БИОХИМИЯ, 2019, том 84, вып. 6, с. 836 - 848
УДК 577.21
ИНДУЦИРОВАННОЕ МИЕЛОПЕРОКСИДАЗОЙ
ОКИСЛЕНИЕ АЛЬБУМИНА И ЦЕРУЛОПЛАЗМИНА:
РОЛЬ ТИРОЗИНА*
© 2019 И.И. Власова1,2**, А.В. Соколов1,3,4, В.А. Костевич1,3,
Е.В. Михальчик1, В.Б. Васильев3,4
1 ФНКЦ физико химической медицины ФМБА России, 119435 Москва, Россия;
электронная почта: iivlasova08@gmail.com
2 Первый МГМУ им.Сеченова, Институт регенеративной медицины,
119998 Москва, Россия
3 ФГБНУ «Институт экспериментальной медицины», 197376 Санкт Петербург, Россия
4 Санкт Петербургский государственный университет,
199034 Санкт Петербург, Россия
Поступила в редакцию 22.02.2019
После доработки 14.03.2019
Принята к публикации 14.03.2019
Миелопероксидаза нейтрофилов (МПО) играет важную роль в защите организма от инфекций. Продукты
МПО - гипогалоидные кислоты и феноксильные радикалы - являются сильными окислителями, которые
могут повреждать не только чужеродные организмы, но и ткани хозяина, в том числе белки плазмы крови.
В данной работе было проведено сравнение МПО$индуцированного окисления двух белков плазмы, обла$
дающих антиоксидантными свойствами, - сывороточного альбумина человека (ЧСА) и церулоплазмина
(ЦП). Инкубация обоих белков с гипохлоритом (NaOCl) или с каталитически активной МПО (MПO +
H2O2), которая в присутствии ионов хлора синтезирует хлорноватистую кислоту (HOCl), приводила к туше$
нию флуоресценции триптофанов белков. Изменения структуры ЧСА и ЦП были различные: высокая ан$
тиоксидантная емкость альбумина способствует нейтрализации окислителей, генерируемых МПО, без об$
разования агрегатов белка, тогда как окисление ЦП приводит к образованию крупных агрегатов, формиру$
емых за счет прочных ковалентных связей между ароматическими аминокислотными остатками. Тирозин
присутствует в плазме крови в свободной форме или в составе аминокислотных последовательностей бел$
ков. Количество аминокислотных остатков тирозина в белке не является определяющим фактором для об$
разования агрегатов. В случае окисления белков HOCl как экзогенной, так и продуцируемой МПО, образо$
вание агрегатов только в случае ЦП обусловлено в первую очередь высоким содержанием триптофанов в его
полипептидной цепи. МПО$зависимое окисление свободной аминокислоты тирозина приводит к образо$
ванию тирозильных радикалов, которые не окисляли остатки ароматических аминокислот в белках благо$
даря высокой скорости рекомбинации с образованием дитирозинов. Показано, что cвободный тирозин мо$
жет модулировать МПО$индуцированное окисление белков благодаря своей способности влиять на синтез
HOCl в активном центре МПО.
КЛЮЧЕВЫЕ СЛОВА: хлорноватистая кислота, феноксильные радикалы, окисление белков, флуоресцен$
ция триптофанов, агрегация белков.
DOI: 10.1134/S0320972519060095
МПО - основной белок нейтрофилов, обла$
модействие Н2О2 с ферри$формой гема МПО
дающий уникальной способностью генериро$
приводит к образованию высокореакционного
вать HOCl, сильный окислитель, необходимый
состояния активного центра - соединения I [3].
для защиты организма от инфекций (редокс по$
Эта форма МПО способна окислять галогениды
тенциал (Eo) пары HOCl/Cl- ~1,3 V) [1, 2]. Взаи$
(Сl-, Br-) c образованием гипогалоидных кислот
(HOCl, HOBr), после чего активный центр фер$
Принятые сокращения: МПО - миелопероксидаза,
мента возвращается в нативную форму, замыкая
ЦП - церулоплазмин, ЧСА - сывороточный альбумин че$
хлорирующий цикл. В то же время, как и любая
ловека.
пероксидаза, МПО может окислять в перокси$
* Первоначально английский вариант рукописи опублико$ дазном цикле ряд веществ (пероксидазных
субстратов) с образованием свободных радика$
msu.ru/biokhimiya, в рубрике «Papers in Press», BM 19$048,
лов. При этом после окисления первой молеку$
13.05.2019.
** Адресат для корреспонденции.
лы субстрата соединение I превращается в сое$
836
ОКИСЛЕНИЕ БЕЛКОВ МПО: РОЛЬ ТИРОЗИНА
837
динение II, а окисление следующей молекулы
станты скорости реакции HOCl с отдельными
пероксидазного субстрата переводит фермент в
аминокислотами. Показано, что в белках HOCl
нативное состояние.
окисляет цистеины, метионины, триптофаны,
Соединение II может быть получено прос$
но хлорирует азот$содержащие аминокислоты,
тым добавлением избытка H2O2 (>100 мкM) к
тирозины, гистидины и концевые аминогруппы
нативному ферменту [4]. Эта форма гема неак$
[16, 20]. Окисление амидов полипептидной це$
тивна в отношении окисления галогенидов. Фе$
пи может приводить к фрагментации белковой
нольные соединения могут влиять на синтез
молекулы, тогда как окисление тиоловых групп
HOCl в активном центре МПО - ускорять обра$
и тирозинов приводит к образованию агрегатов
зование HOCl при высоких концентрациях H2O2
белков за счет формирования дисульфидных
благодаря высокому сродству пероксидазного
связей и дитирозиновых сшивок между белко$
субстрата к соединению II и ингибировать при
выми глобулами. Агрегаты белков, включающие
низких концентрациях пероксида водорода за счет
комплемент C3, аполипопротеин A$1, фибри$
конкуренции с ионами хлора за соединение I [5-7].
ноген и альбумин, были обнаружены в плазме,
В очаге воспаления, для которого характерно
обработанной высокими концентрациями гипо$
закисление среды, МПО катализирует преиму$
хлорита (0,5-5 мM) [21]. Концентрация агрега$
щественно образование НОСl. Из очага воспа$
тов белков, обладающих характерной флуорес$
ления фермент может попадать в плазму, так что
ценцией дитирозинов, выше в плазме больных с
концентрация МПО в плазме при ряде заболе$
тяжелыми формами урологических заболеваний
ваний может доходить до нескольких нМ [8, 9].
по сравнению со здоровыми донорами [22].
При нейтральных значениях рН, характерных
С другой стороны, роль субстратов перокси$
для плазмы, хлорирующая активность фермента
дазного цикла МПО в модификации макромо$
снижена, в то же время возрастает скорость
лекул в этих исследованиях обсуждается крайне
окисления пероксидазных субстратов [10]. Эн$
редко [15, 23]. Ранее было показано, что окисле$
догенными пероксидазными субстратами, при$
ние нитрита МПО приводит к образованию ди$
сутствующими в плазме в микромолярных кон$
оксида азота, способного нитрировать или нит$
центрациях, являются: антиоксиданты (аскор$
розилировать аминокислотные остатки белков
бат, урат), фенольные соединения (тирозин и
[24, 25].
ксенобиотики фенольной природы), а также
Для изучения МПО$индуцированного окис$
нитрит, триптофан, серотонин, β$кетоны, кате$
ления белков плазмы мы выбрали два анионных
холамины и др. [7].
белка - церулоплазмин (ЦП, pI ~4,4) и сыворо$
Высокий окислительный потенциал соедине$
точный альбумин человека (ЧСА, pI ~4,7), кото$
ния I МПО мог бы приводить к тотальным пов$
рые известны как белки, обладающие антиокси$
реждениям макромолекул в плазме. Однако уни$
дантными свойствами, следовательно, их моди$
кальное строение активного центра фермента, в
фикации в условиях окислительного стресса
котором гем расположен на дне узкого кармана,
можно ожидать в первую очередь. Кроме того,
ограничивает его доступность для молекул, раз$
эти белки представлены в плазме в высоких кон$
мер которых существенно больше дипептида [11,
центрациях (~600 мкМ альбумина и 0,5-4 мкМ
12]. Для окисления макромолекул нужны
ЦП), и они могут связываться с положительно
субстраты$посредники, окисленные формы ко$
заряженной МПО (pI ~10,7).
торых являются сильными окислителями [13,
Aльбумин - самый распространенный белок
14]. Наряду с HOCl, макромолекулы могут взаи$
плазмы, для которого показана модификация
модействовать с феноксильными радикалами,
при ряде патологий [26-28]. Единственный сво$
образующимися при окислении в активном
бодный цистеин ЧСА (Cys$34) обеспечивает
центре МПО некоторых фенольных соединений,
~50% всех восстановленных тиолов плазмы [29].
например, аминокислоты тирозина (Eo(Tyr•/Tyr) =
Тем не менее лишь несколько работ посвящены
0,93 V) [15]. Свободный тирозин присутствует в
изучению связывания ЧСА с МПО и его окисле$
плазме в концентрации 80-200 мкM.
нию генерируемыми МПО окислителями. По$
Модификация белков и липидов гипогало$
казано связывание альбумина с
«тяжелой»
идными кислотами изучена подробно [16, 17].
цепью МПО, и измерена константа диссоциации
Много внимания было уделено окислению
комплекса, которая составила (20 ± 1,5) мкМ
апоВ$100, апоА$I и липидов липопротеинов
[30]. Salavej et al. (2006) изучали модификацию
продуктами реакции, катализируемой МПО.
аминокислотных остатков альбумина гипогало$
Показана значимость МПО$индуцированной
идными кислотами и активными формами азо$
модификации липопротеинов в патогенезе ате$
та, продуцируемыми МПО [24]. Авторы наблю$
росклероза [18, 19]. Изучено окисление ряда
дали окисление Met147, Met353 и Met572, а так$
белков в модельных системах, получены кон$
же Trp214.
БИОХИМИЯ том 84 вып. 6 2019
838
ВЛАСОВА и др.
ЦП, как и альбумин, является эффективным
центрации реагентов указаны в подписях к ри$
перехватчиком свободных радикалов [31]. ЦП
сункам.
связывается вблизи активного центра МПО, об$
Флуоресценцию измеряли в области 300-500 нм
разуя очень прочный комплекс со стехиометри$
при длине волны возбуждения 290 нм. Интен$
ей 2 : 1 (Кд ~0,13 мкМ) [32-34]. Связывание ЦП
сивность белковой флуоресценции измеряли
с МПО имеет важное физиологическое значе$
при 340 нм, интенсивность флуоресценции ди$
ние, так как приводит к ингибированию как
тирозинов определяли при 410 нм. Флуоресцен$
хлорирующей, так и пероксидазной активности
цию измеряли с помощью спектрофлуориметра
МПО, но в то же время не влияет на феррокси$
«Hitachi F$4000» (Япония).
дазную и оксидазную активность ЦП в отноше$
SDS$ПААГ$электрофорез проводили в при$
нии большинства субстратов [33, 35-37].
сутствии 2$меркаптоэтанола, используя 5%$ный
В настоящей работе проведено сравнитель$
концентрирующий гель, 7,5%$ный разделяю$
ное исследование модификации ЦП и ЧСА под
щий гель. Гели окрашивали Кумасси R$250
действием HOCl и феноксильных радикалов в
Brilliant Blue. Интенсивность окраски гелей из$
условиях, моделирующих локальный окислитель$
меряли в определенных участках с помощью
ный стресс.
программы Paint.NET. Область измерений со$
ставляла 51 × 51 px в средней части верхней об$
ласти разделяющего геля для каждой дорожки.
МЕТОДЫ ИССЛЕДОВАНИЯ
Все экспериментальные данные представле$
ны как среднее для трех повторных измерений
Все реактивы, использованные для приготов$
(± SD). Различия измеряемых параметров для
ления буферов, а также тирозин, альбумин, ка$
разных проб анализировали с помощью t$крите$
талаза, метионин, пероксид водорода, гипохло$
рия Стьюдента и считали достоверными, если
рит были получены у фирмы «Sigma Aldrich»
p < 0,05. Приведенные в работе рисунки, пред$
(США). Реактивы для проведения электрофоре$
ставляющие результаты измерения флуоресцен$
за были производства «VWR Life Science Am$
ции белков или SDS$ПААГ$электрофореза, яв$
resco» (США).
ляются результатами одного типичного экспе$
МПО была выделена из лейкоцитарной мас$
римента из серии не менее чем трех аналогич$
сы здоровых доноров с использованием аффин$
ных экспериментов.
ной хроматографии на гепарин$сефарозе, гид$
рофобной хроматографии на фенил$сефарозе и
гель$фильтрации. Индекс чистоты МПО (A430/A280)
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
составил 0,85, активность при 22 °C в 50 мМ Na$
фосфатном буфере, рН 7,4, в отношении гвая$
Характеристика МПО)индуцированного окис)
кола была ~1100 ед/мг (ед. Sigma) [38]. Гомоген$
ления белков с помощью метода флуоресценции.
ный непротеолизированный ЦП был получен из
Известно, что уменьшение флуоресценции бел$
плазмы крови здоровых доноров с помощью ионо$
ков вызвано в первую очередь окислением ос$
обменной хроматографии на UNOsphere Q и аф$
татков триптофанов, входящих в полипептид$
финной хроматографии на неомицин$агарозе [39].
ную цепь. С помощью метода флуоресценции
Очищенный ЦП характеризовался A610/A280 = 0,049
проведено сравнительное исследование окисле$
и ~50% препарата составлял нефрагментирован$
ния триптофанов ЧСА и ЦП под действием
ный белок. Вследствие этого при электрофорезе
HOCl и феноксильных радикалов, образующих$
в полиакриламидном геле с додецилсульфатом
ся в катализируемых МПО реакциях.
натрия (SDS$ПААГ$электрофорез) с восстанов$
Флуоресценция альбумина обусловлена в
лением 2$меркаптоэтанолом белок представлял
большей степени единственным триптофаном
собой зоны, соответствующие 132 и 116 кДа и
(Trp214). Характерный спектр белковой флуо$
имеющие примерно равную интенсивность.
ресценции с максимумом в области 340 нм
Окисление белков проводили в 50 мМ Na$фос$
(Ex 290 нм) приведен на рис. 1, a. Инкубация
фатном буфере при рН 7,4 или 6,8 в присутствии
ЧСА с системой МПО/Cl-/Н2О2 привела к ту$
МПО и Н2О2 или NaOCl. В качестве субстратов
шению белковой флуоресценции, и через 2 мин
МПО к раствору добавляли 140 мМ NaCl, фенол
амплитуда спектра уменьшилась более чем в два
или тирозин, или одновременно тирозин и
раза при выбранных условия эксперимента.
NaCl. После добавления Н2О2 (в пробах с МПО)
В состав ЦП входит 18 триптофанов, концент$
или NaOCl регистрировали спектры флуорес$
рация этого белка в наших экспериментах была
ценции растворов или инкубировали пробы в
в 16-18 раз ниже, чем концентрация альбумина.
течение какого$то времени с последующим при$
На рис. 1, б приведена кинетика тушения белко$
готовлением образцов для электрофореза. Кон$
вой флуоресценции ЦП и альбумина HOCl,
БИОХИМИЯ том 84 вып. 6 2019
ОКИСЛЕНИЕ БЕЛКОВ МПО: РОЛЬ ТИРОЗИНА
839
Рис. 1. Уменьшение белковой флуоресценции при МПО$индуцированном окислении белков в присутствии ионов хлора.
а - 20 нМ МПО и 100 мкM H2O2 были добавлены к раствору 4 мкМ альбумина в 50 мМ Na$фосфатном буфере (рН 7,4),
содержащем 140 мМ NaCl. Спектры были записаны в разные промежутки времени после добавления H2O2; б - зависи$
мость от времени МПО$индуцированного окисления ЧСА и ЦП. Экспериментальные условия такие же, как для а), но
концентрация альбумина была 5 мкМ, концентрация ЦП 280 нМ
продуцируемой МПО. Кинетика окисления
были похожи. Феноксильные радикалы, образу$
триптофанов ЦП нелинейная. В первую очередь
ющиеся при катализируемом МПО окислении
окисляются триптофаны, экспонированные на
фенола, вызвали тушение флуоресценции трип$
поверхности белка, тогда как аминокислотные
тофанов в белках, а появление спектра в облас$
остатки внутри белковой глобулы менее доступ$
ти 410 нм свидетельствовало об образовании ди$
ны для окислителей. Поскольку концентрация
фенолов в растворе (рис. 2, б). Быстрое форми$
ЧСА и ЦП в экспериментах различалась, а кон$
рование дифенолов (увеличение флуоресцен$
центрация МПО и Н2О2 была одинаковая, коли$
ции 410 нм в течение 0,5 мин) сопровождалось
чество синтезируемого окислителя на одну мо$
по$следующим их исчезновением одновремен$
лекулу ЧСА было меньше. Тем не менее кинети$
но с уменьшением амплитуды белковой флуо$
ка изменения флуоресценции триптофанов бел$
ресценции. Следовательно, свободные радика$
ков была одинаковой в течение 10 мин инкуба$
лы фенола могут окислять белки, а также обра$
ции, и это свидетельствует о высокой окисляе$
зовывать дифенолы, которые окисляются в ак$
мости единственного триптофана альбумина.
тивном центре МПО. Напротив, инкубация ЦП
Образующиеся в пероксидазном цикле МПО
или ЧСА с МПО/Tyr/H2O2 сопровождалась нез$
феноксильные радикалы являются сильными
начительными изменениями белковой флуорес$
окислителями, они могут модифицировать ами$
ценции, что может быть вызвано изменениями
нокислотные остатки белков. Кроме того, фе$
конформации белка в результате окисления ти$
ноксильные радикалы способны рекомбиниро$
розильными радикалами ряда аминокислот, и в
вать с образованием дифенолов, обладающих ха$
первую очередь метионинов и цистеинов (таб$
рактерной флуоресценцией с максимумом 410 нм.
лица). В то же время в растворе наблюдалось
Обычно для возбуждения флуоресценции дифе$
быстрое и интенсивное формирование дитиро$
нолов используют длину волны 325 нм [40], но
зинов, что хорошо видно по появлению нарас$
мы регистрировали спектры дифенолов при
тающей флуоресценции при 410 нм (рис. 2, в).
длине волны возбуждения 290 нм. При этом ин$
Эти эксперименты показали, что тирозиль$
тенсивность регистрируемого излучения умень$
ные радикалы не способны окислять аромати$
шается на 10-15%, однако такой подход дает
ческие аминокислоты белков. В частности, это
возможность одновременно характеризовать из$
можно объяснить высокой скоростью образова$
менения флуоресценции белков и следить за об$
ния дитирозинов (k ~108 М-1 с-1) [41].
разованием дифенолов в растворе (рис. 2, a).
Электрофорез белков, инкубированных с ка)
Изменения спектров, наблюдаемые при ин$
талитически активной МПО. Окисление белков
кубации ЦП или ЧСА с каталитически активной
может приводить к образованию белковых агре$
МПО в присутствии фенольных соединений,
гатов или фрагментированию полипептидных
БИОХИМИЯ том 84 вып. 6 2019
840
ВЛАСОВА и др.
цепей. Такие изменения мол. массы белковых
глобул могут быть зарегистрированы с помощью
электрофореза. Результаты SDS$ПААГ$элект$
рофореза в присутствии 2$меркаптоэтанола для
ЧСА (мол. масса ~67 кДa с учетом лигандов) и
ЦП (мол. масса ~132 кДа с учетом углеводных
цепей и ионов меди) представлены на рис. 3 и 4
соответственно. Мы сравнивали изменения бел$
ков, вызванные добавлением NaOCl, с измене$
ниями, наблюдаемыми в результате их инкуба$
ции в системе МПО/Cl-/Н2О2. Результаты SDS$
ПААГ$электрофореза показали, что первичная
структура альбумина остается интактной после
его инкубации с каталитически активной МПО
при рН 6,8 или рН 7,0 или c экзогенным гипо$
хлоритом - не наблюдалось формирования агре$
гатов и низкомолекулярных фрагментов белка
(рис. 3, дорожки 1, 2, 4, 7-9).
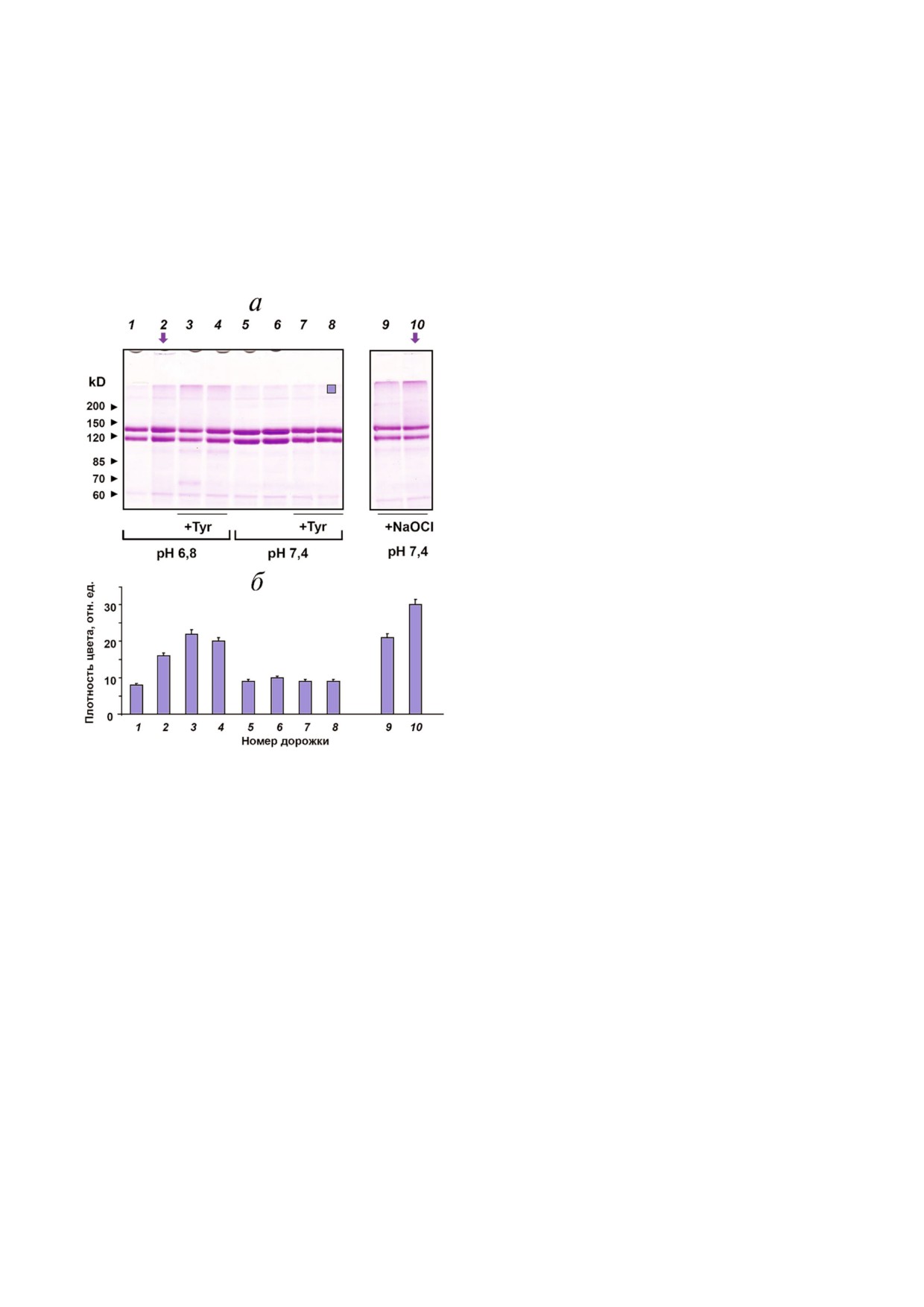
Индуцированное МПО окисление ЦП не
наблюдалось при рН 7,4, что может быть обус$
ловлено формированием прочного комплекса
белков и ингибированием активности МПО
(сравнивать дорожки 5 и 6, рис. 4, a) [33]. ЦП
может быть окислен каталитически активной
МПО при рН 6,8 или при добавлении экзоген$
ного гипохлорита (сравнить дорожки 1 и 2, 9, 10,
рис. 4, a) [42]. Результаты SDS$ПААГ$электро$
фореза демонстрируют появление агрегатов
ЦП, в том числе и крупных агломератов, не вхо$
дящих в концентрирующий гель (указаны верти$
кальными стрелками, рис. 4, a, дорожки 2 и 10).
Поскольку электрофорез проводили в присут$
ствии 2$меркаптоэтанола, можно сделать вы$
вод, что наблюдаемые агрегаты формировались
за счет образования прочных сшивок между
белковыми молекулами. Модификация белко$
вой глобулы ЦП происходила одинаково, как в
случае инкубации белка с (МПО/Cl-/Н2О2), так
и при обработке ЦП гипохлоритом, но в послед$
нем случае окисление ЦП было выражено силь$
нее при равных концентрациях окислителей
(рис. 4, б). При добавлении экзогенного гипо$
хлорита также более ярко выражены молекуляр$
ные фрагменты с массой ~100 кДa, что говорит о
фрагментации белка и, следовательно, об окис$
лении амидов полипептидной цепи.
Рис. 2. Окисление белков продуцируемыми МПО фенок$
Ни для ЦП, ни для ЧСА не было зарегистри$
сильными радикалами, зарегистрированное с помощью
ровано появление фрагментов полипeптидной
флуоресценции. a - Спектры флуоресценции белков (мак$
цепи в результате их инкубации с системой
симум эмиссии 340 нм) и спектры дитирозинов (максимум
МПО/Tyr/H2O2 в отсутствие ионов хлора (дан$
эмиссии 410 нм), зарегистрированные при длине возбуж$
ные не представлены).
дения 290 нм; б - 100 мкМ фенола было добавлено в раст$
вор 4 мкМ альбумина в 50 мМ Na$фосфатном буфере, рН 7,4,
Влияние тирозина на МПО)индуцированное
после чего добавили 25 нМ МПО. Спектры записывали
окисление ЧСА. Исследовано влияние тирозина
; в - 100 мкМ
после добавления к раствору 100 мкМ H2O2
на флуоресценцию альбумина, инкубированно$
тирозина было добавлено к раствору 270 нМ ЦП 50 мМ
го с системой MПO/Cl-/Н2О2, для разных экс$
Na$фосфатном буфере, рН 7,4, после чего добавили 25 нМ
периментальных условий: 1) однократная до$
МПО. Спектры записывали после добавления к раствору
100 мкМ H2O2
бавка высоких концентрации пероксида водо$
БИОХИМИЯ том 84 вып. 6 2019
ОКИСЛЕНИЕ БЕЛКОВ МПО: РОЛЬ ТИРОЗИНА
841
Характеристики аминокислотного состава ЧСА и ЦП и константы скорости реакции второго порядка HOCl c некоторыми
аминокислотами [50]
Mол. масса, кДа
AA
Cys
Met
Trp
Tyr
Lys
His
ЧСА
66,5
585
35 (1 свободный)
6
1
18
59
16
ЦП
132
1046
14 (6 свободных)
24
18
64
65
41
k, M-1 s-1
3,0 × 107
3,8 × 107
1,1 × 104
44
5,0 × 103
1,0 × 105
Примечание. AA - общее число аминокислотных остатков.
рода (100 мкМ Н2О2), как модель «окислитель$
при однократной добавке 100 мкМ Н2О2 (кри$
ного взрыва» при активации фагоцитов в очаге
вые 1 на рис. 5, a, б). При выбранных нами усло$
воспаления (рис. 5, а, в); 2) многократные до$
виях эксперимента скорость синтеза HOCl была
бавки малых концентраций Н2О2 (10 мкМ до$
одинакова в двух системах: при высоких концент$
бавляли 10 раз с интервалом 3 мин), как модель
рациях Н2О2 большинство молекул фермента
окислительного стресса в плазме крови (рис. 5, б, г).
находится в состоянии соединение II, которое
Скорость изменений флуоресценции альбу$
неактивно в отношении синтеза HOCl, поэтому
мина при однократной добавке 100 мкМ Н2О2
скорость синтеза HOCl в растворе не велика,
медленная, что может быть обусловлено мед$
тогда как при дискретных добавках малых доз
ленной наработкой HOCl при этих условиях, так
Н2О2 скорость окисления альбумина определя$
как активный центр МПО переходит в соедине$
ется частотой добавок. В последнем случае до$
ние II, которое неактивно в отношении синтеза
бавление тирозина в раствор инкубации инги$
HOCl (рис. 5, a, кривая 1). В случае, если раст$
бирует окисление белка (рис. 5, б).
вор содержал тирозин, добавление пероксида
водорода приводило к быстрому падению флуо$
ресценции ЧСА (кривая 2), что можно объяс$
нить ускорением синтеза HOCl [7]. Как было
показано ранее, в этих условиях тирозин взаи$
модействует с соединением II и увеличивает
скорость оборота фермента. Соответственно,
одномоментно синтезируется больше HOCl, что
привело к быстрому окислению аминокислот
альбумина, включая триптофан (первые две ми$
нуты инкубации), пока не заканчивается Н2О2
в растворе (линейный участок кривой 2). В слу$
чае более длительной инкубации присутствие
тирозина в растворе все же снизило модифика$
цию альбумина - после 15 мин инкубации флуо$
ресценция ЧСА была выше в растворе, содержа$
щем тирозин (рис. 5, а). Похожий эффект уско$
рения МПО$индуцированного тушения флуо$
ресценции в присутствии тирозина и 100 мкМ
Рис. 3. SDS$ПААГ$электрофорез альбумина, окисленного
синтезированными МПО оксидантами или NaOCl. МПО
Н2О2 был обнаружен для ЦП, IgG и фибриноге$
(25 нМ) была добавлена к раствору 4 мкМ альбумина в 50 мМ
на (данные не представлены). Однако в случае
Na$фосфатном буфере, содержащем 140 мМ NaCl, рН 7,4
этих белков эффект был менее выражен, так как
или 6,8. Тирозин был добавлен в некоторые пробы, как
не все остатки триптофанов в белках доступны
указано. H2O2 или NaOCl были добавлены дважды с интер$
валом 12 мин. Через 12 мин после второй добавки реакцию
для окисления HOCl, продуцируемой МПО
останавливали добавлением каталазы (25 мкг/мл), после
(максимальная разница в амплитуде спектров
чего добавляли 2,5 мМ метионин. Образцы при рН 6,8:
без тирозина и с добавлением тирозина не пре$
(1) + МПО , (2) + МПО + (100 мкM) × 2 H2O2, (3) + МПО +
вышала 17%).
+ 100 мкM тирозин + (100 мкM) × 2 H2O2; образцы при pH 7,4:
(4) + МПО + (100 мкM) × 2 H2O2, (5) + МПО + 100 мкM
В случае титрования раствора, содержащего
тирозин + (100 мкM) × 2 H2O2, (6) + МПО + 200 мкM
ЧСА и МПО, малыми концентрациями Н2О2
тирозин + (100 мкM) × 2 H2O2, (7) Контроль (без МПО),
((10 мкМ) × 10 раз) кинетика тушения флуорес$
(8) + 100 мкM NaOCl, (9) + (100 мкM) × 2 NaOCl. Указана
ценции альбумина мало отличается от кинетики
полоса, соответствующая субъединице каталазы (cat)
7 БИОХИМИЯ том 84 вып. 6 2019
842
ВЛАСОВА и др.
В то же время никаких изменений мол. мас$
(рис. 4, a). Поскольку тирозин является не$
сы ЧСА после инкубации c системой МПО/Cl-/
большой молекулой, связывание ЦП с МПО не
Tyr/Н2О2 зарегистрировать не удалось (рис. 3, a,
препятствует окислению этого пероксидазного
дорожки 3, 5 и 6).
субстрата в активном центре МПО [43]. При
Влияние тирозина на МПО)индуцированное
выбранных нами условиях эксперимента
окисление ЦП. Окисление ЦП каталитически
100 мкМ тирозина усиливали исчезновение по$
активной МПО сравнивали в отсутствие тиро$
лосы нативного ЦП и формирование высоко$
зина и при его концентрациях 100 и 200 мкМ
молекулярных агрегатов белка при рН 6,8, в то
же время добавление тирозина полностью уст$
раняло формирование крупных агломератов
белка, не входящих в разделяющий гель (рис. 4,
a, дорожка 3). Добавление тирозина к инкуба$
ционной смеси усилило фрагментацию ЦП:
усилилась интенсивность полосы низкомоле$
кулярного ЦП в области 100 кДа (аналогично
тому, как это наблюдалось для случая NaOCl,
дорожки 9, 10), и появилась дополнительная
полоса низкомолекулярных фрагментов белка
в области 65 кДа. В присутствии 200 мкМ тиро$
зина (дорожка 4) ЦП окислялся интенсивнее
по сравнению с реакционной смесью без тиро$
зина (дорожка 2), и количество высокомолеку$
лярных агрегатов было сравнимо с тем, что
наблюдали при 100 мкМ тирозина (рис. 4, б).
Дальнейшее увеличение концентрации тирози$
на не имеет смысла, так как в этом случае его
концентрация будет превышать физиологичес$
ки значимые величины.
Тирозин не повлиял значимо на стабиль$
ность ЦП при МПО$индуцированном окисле$
нии при рН 7,4 (рис. 4, дорожки 7, 8).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Окисление белков сопровождается измене$
Рис. 4. SDS$ПААГ$электрофорез церулоплазмина, окислен$
ниями их структуры и физико$химических
ного синтезированными МПО оксидантами или NaOCl.
МПО (25 нМ) была добавлена к раствору 2 мкМ ЦП в 50 мМ
свойств, в том числе и спектральных характе$
Na$фосфатном буфере, содержащем 140 мМ NaCl, рН 7,4
ристик. Окисление цистеинов и тирозинов, вхо$
или 6,8. Тирозин был добавлен в некоторые пробы, как
дящих в состав полипептидных цепей, приводит
или NaOCl были добавлены дважды с интер$
указано. H2O2
к образованию дисульфидных связей и дитиро$
валом 12 мин. Через 12 мин после второй добавки реакцию
зиновых мостиков между молекулами, что вы$
останавливали добавлением каталазы (25 мкг/мл), после
чего добавляли 2,5 мМ метионин. a - ПААГ$электрофо$
зывает агрегацию белков. Формирование агре$
рез нативного и окисленного ЦП. Образцы при рН 6,8:
гатов окисленных белков лежит в основе иници$
, (3) + МПО +
(1) + МПО, (2) + МПО + (100 мкM) × 2 H2O2
ации и развития некоторых патологий. Участие
+ 100 мкM тирозин + (100 мкM) × 2 H2O2, (4) + МПО +
МПО в формировании белковых агрегатов по$
+ 200 мкМ тирозин + (100 мкM) × 2 H2O2; образцы при pH 7,4:
(5) + МПО, (6) +МПО + (100 мкM) × 2 H2O2, (7) + МПО +
казано для заболеваний сердечно$сосудистой
+ 100 мкM тирозин + (100 мкM) × 2 H2O2, (8) + МПО +
системы [2, 18], болезни Альцгеймера [44], забо$
+ 200 мкМ тирозин + (100 мкM) × 2 H2O2, (9) + 100 мкM
леваний почек [45] и других социально$значи$
NaOCl, (10) + (100 мкM) × 2 NaOCl. Стрелки указывают на
мых патологий.
агломераты белков на верхнем уровне концентрирующего
В настоящей работе было проведено сравни$
геля. Линия белка в области 60 кДа соответствует субъеди$
нице каталазы (cat). Синий квадрат (дорожка 8) обознача$
тельное исследование индуцированного МПО
ет область, в которой измеряли плотность цвета; б - плот$
окисления двух белков, обладающих антиокси$
ность цвета в верхней области разделяющего геля для каж$
дантными свойствами: ЦП и ЧСА. Как было об$
дой дорожки.
наружено ранее, эти белки могут образовывать
С цветным вариантом рис. 4 можно ознакомиться в элект$
комплексы с МПО in vivo [30, 33, 36]. Исследова$
journal/biokhsm/
ния показали, что оба белка подвергаются окис$
БИОХИМИЯ том 84 вып. 6 2019
ОКИСЛЕНИЕ БЕЛКОВ МПО: РОЛЬ ТИРОЗИНА
843
лительной модификации при инкубации с ги$
зарегистрировать МПО$индуцированной моди$
похлоритом или с каталитически активной МПО
фикации ЦП в нейтральной среде. При рН 7,4
в присутствии ионов Cl-, но последствия моди$
белок может быть окислен в результате его ин$
фикации различны для двух белков.
кубации c экзогенным NaOCl, в то время как в
Связывание ЦП вблизи активного центра
системе (МПО/Cl-/Н2О2) белок может быть
МПО приводит к уменьшению хлорирующей
модифицирован только при понижении рН
активности фермента [33, 35]. Нам не удалось
(рН
7,0) [42]. Это может быть вызвано деста$
Рис. 5. Влияние тирозина на вызванную МПО окислительную модификацию альбумина. Состав реакционной среды:
5 мкМ альбумина и 20 нМ МПО в 50 мМ Na$фосфатном буфере (рН 7,4), содержащем 140 мМ NaCl (черный ромб) или
(140 мM NaCl + 100 мкМ тирозина) (черный кружок). Спектры флуоресценции ЧСА регистрировали перед добавлением
Н2О2 и далее каждые 5 мин после однократной добавки 100 мкМ Н2О2 (а, в ) или после каждой добавки 10 мкМ Н2О2, ко$
торые делали каждые 3 мин (б, г); (a, б) - амплитуда флуоресценции, измеренная при 340 нм; (в, г) - спектры флуорес$
ценции раствора альбумина
БИОХИМИЯ том 84 вып. 6 2019
7*
844
ВЛАСОВА и др.
билизацией комплекса ЦП$МПО в связи с из$
вероятность образования межмолекулярных ди$
менением заряда белков при понижении рН.
сульфидных связей невелика с учетом существо$
Как и в случае большинства белков, окисле$
вания стерических препятствий для таких взаи$
ние ЦП приводит к образованию высокомоле$
модействий [29]. С другой стороны, белок имеет
кулярных продуктов - агрегатов белка и/или
18 остатков тирозина, но тем не менее не обра$
при определенных условиях к фрагментации
зовывал агрегаты при окислении. Дело в том,
белковой глобулы. В обоих случаях такие изме$
что тирозины при реакции с HOCl хлорируются
нения сопровождаются уменьшением количест$
с образованием хлортирозинов, которые явля$
ва нативного белка. Наши эксперименты пока$
ются стабильными маркерами активной МПО.
зали, что образование агрегатов ЦП в случае ин$
Вклад хлорирования тирозина в общую картину
кубации белка с каталитически активной МПО
окисления белков в наших экспериментах не
(100 + 100 мкМ Н2О2) сопоставимо с изменени$
был существенным, так как константа скорости
ями белка после его обработки экзогенным ги$
реакции HOCl с тирозином на несколько поряд$
похлоритом (100 мкМ NaOCl) (дорожки 3 и 9,
ков меньше, чем для большинства других ами$
рис. 4, a). В растворе образуются крупные агре$
нокислот (k ~44 M-1 s-1) [50] (таблица).
гаты с M ~200-300 кДа, а также агломераты бел$
В то же время окисление триптофана хлорно$
ка, не входящие в концентрирующий гель. Об$
ватистой кислотой характеризуется относительно
разование агрегатов ЦП происходит благодаря
высокой скоростью реакции (k ~1,1 × 104 M-1 s-1)
большому количеству SH$групп и тирозиновых
[50]. Cреди продуктов реакции зарегистрирова$
остатков в молекуле белка (таблица). Дитирози$
ны как производные триптофана, полученные в
новые сшивки, в отличие от дисульфидных свя$
результате ионного окисления аминокислоты,
зей, не восстанавливаются и могут служить ос$
так и радикалы триптофана, образующиеся в ре$
новой образования больших сшитых ковалент$
зультате свободно$радикального окисления его
но агрегатов белков in vivo. Aouffen et al. показа$
индольного кольца [51, 52]. В результате окисле$
ли образование агрегатов окисленного ЦП пос$
ния триптофана могут образовываться продук$
ле обработки белка высокими концентрациями
ты, обладающие антиоксидантными свойствами
Н2О2 [46].
[53]. Радикалы триптофана долгоживущие (вре$
Ранее нами было показано, что зона контак$
мя жизни до нескольких минут), и могут реком$
та ЦП и МПО включает петли между 4 и 5 доме$
бинировать с образованием ковалентных сши$
нами (699-710 а.о.), 5 и 6 доменами (883-892 а.о.)
вок между белками (k ~6 × 108 M-1 s-1) [54]. Кро$
ЦП [47]. Можно предположить, что появление
ме того, редокс$потенциал триптофанильного
низкомолекулярных фрагментов ЦП после его
радикала относительно высок и зависит от pH и
инкубации с функционирующей МПО (рис. 4, а,
от окружения аминокислотного остатка в соста$
дорожки 2, 3, 4) связано с разрывом пептидных
ве белков (E0 может достигать 1,0 V) [15]. Ми$
связей именно в этих участках ЦП, экспониро$
грация «свободнорадикального состояния» c
ванных на поверхности глобулы белка.
триптофана на другие окисляемые аминокис$
Окисление ЦП приводит к образованию аг$
лотные остатки полипептидной цепи внутри
регатов белка, с которыми может быть связана и
белковой глобулы может приводить к окисле$
МПО. Аналогичное взаимодействие белков бы$
нию тирозинов и, соответственно, к образова$
ло показано ранее в случае формирования агре$
нию дитирозиновых сшивок между белками.
гатов гемоглобина и гаптоглобина, причем эти
Единственный триптофан альбумина быстро
агрегаты лучше поглощались макрофагами, чем
окисляется генерируемыми МПО оксидантами
комплексы (гемоглобин + гаптоглобин) [48].
(рис. 1, рис. 2, б), в то же время полипептидная
Можно предположить, что формирование агре$
цепь белка стабильна при окислении - ЧСА
гатов ЦП, содержащих МПО, может способ$
сохранял первичную структуру при его инкуба$
ствовать удалению этой потенциально опасной
ции с каталитически активной МПО (рис. 3).
пероксидазы из плазмы крови.
Относительно высокое содержание лизинов и
Напротив, инкубация альбумина с NaOCl или
гистидинов в ЧСА также может способствовать
с каталитически активной МПО не приводила к
уменьшению HOCl$индуцированного повреж$
формированию агрегатов ЧСА (рис. 3). Альбу$
дения белка (таблица).
мин - основной антиоксидантный белок плазмы,
Результаты исследований формирования аг$
который может нейтрализовать окислители -
регатов ЧСА при окислении противоречивы.
продукты реакции МПО. Ранее была показана
Формирование дисульфидных связей между мо$
высокая окислительная емкость альбумина при
лекулами альбумина было обнаружено в плазме
сохранении им глобулярной формы и функций
крови после ее обработки гидропероксидами и в
некоторых активных центров [49]. У ЧСА толь$
плазме пациентов после гемодиализа [55]. Обра$
ко одна свободная SH$группа (Cys 34), поэтому
зование дитирозиновых связей между глобула$
БИОХИМИЯ том 84 вып. 6 2019
ОКИСЛЕНИЕ БЕЛКОВ МПО: РОЛЬ ТИРОЗИНА
845
ми белка показано для делипидированного аль$
курирует с ионами хлора за соединение I фермен$
бумина при его окислении в буфере в присут$
та даже при том, что его концентрация в плазме
ствии 10$кратного (и выше) избытка HOCl [56].
на три порядка ниже, чем концентрация NaCl;
Colombo et al. не обнаружили существенного
2) при высоких концентрациях Н2О2, которые мо$
формирования дитирозинов при обработке ЧСА
гут переводить МПО в соединение II, тирозин,
гипохлоритом (в отличие от фибриногена) [57].
взаимодействуя с этой стабильной формой фер$
Ранее мы показали, что фенольные вещества
мента, может увеличивать оборот фермента и та$
являются предпочтительными пероксидазными
ким образом ускорять синтез HOCl.
субстратами МПО при нейтральных значениях
В данной работе показано, что тирозин мо$
рН как в модельной системе, так и в суспензии
жет влиять на индуцированное МПО окисление
лизированных нейтрофилов [10]. Активный
белков за счет модуляции хлорирующей актив$
центр МПО недоступен для крупных молекул,
ности фермента: ускорять при высоких концент$
но при окислении небольших фенольных соеди$
рациях Н2О2, благодаря ускорению синтеза
нений могут образоваться высокореакционные
HOCl ферментом, но ингибировать при низких
свободные радикалы, которые служат посред$
концентрациях пероксида водорода или высо$
никами для окисления макромолекул. Тирозин -
ких концентрациях тирозина за счет прямой
важная эндогенная молекула, специфический
конкуренции пероксидазного субстрата с хло$
пероксидазный субстрат МПО. Его окисление
ридом за соединение I (рис. 5). Кроме того, сво$
приводит к образованию тирозильных радика$
бодный тирозин ингибирует формирование
лов (Е0 = 0,93V) [15], которые могут окислять
больших агрегатов ЦП (рис. 4). В отличие от
белки и липиды, а также образовывать дитиро$
действия антиоксидантов, такие эффекты тиро$
зины, обладающие характерной флуоресценцией
зина высокоспецифичны и касаются только ре$
c максимумом 410 нм. Благодаря высокой ско$
гулирования активности МПО. Можно предпо$
рости образования дитирозинов (k ~108 М-1 s-1)
ложить, что тирозин или другие фенольные сое$
окисление свободного тирозина миелоперокси$
динения могут быть использованы для регуля$
дазой не привело к окислению аминокислотных
ции индуцированного МПО окисления белков,
остатков триптофанов в белках (рис. 2, в), тогда
и, в первую очередь, для уменьшения формиро$
как свободные радикалы фенола реагировали с
вания агрегатов сшитых ковалентно белков в
триптофанами (рис. 1, в). Это может быть связа$
плазме в условиях воспаления.
но с более высоким редокс$потенциалом пос$
ледних и с их меньшей способностью к реком$
бинации по сравнению с тирозильными радика$
Финансирование. Исследование выполнено
лами (рис. 2). Возможность окисления белков
при финансовой поддержке Российского фонда
феноксильными радикалами указывает на опас$
фундаментальных исследований в рамках науч$
ность попадания в организм ксенобиотиков фе$
ного проекта 16$14$00873 и программы 5$100.
нольной природы, которые могут быть окисле$
Соблюдение этических норм. Настоящая
ны МПО в условиях воспаления.
статья не содержит описания каких$либо иссле$
Наше предыдущее исследование влияния ти$
дований с использованием людей или животных
розина на катализируемое МПО$окисление хло$
в качестве объектов.
рида при нейтральных значениях рН выявило
Конфликт интересов. Авторы заявляют об от$
следующие закономерности [7]: 1) тирозин кон$
сутствии конфликта интересов.
СПИСОК ЛИТЕРАТУРЫ
1.
Arnhold, J. (2004) Free radicals - friends or foes?
myeloperoxidase, FEBS Lett., 484, 139-143, doi: 10.1016/
Properties, functions, and secretion of human myelopero$
S0014$5793(00)02143$8.
xidase, Biochemistry (Moscow), 69, 4-9, doi: 10.1023/
5.
Kirchner, T., Flemmig, J., Furtmuller, P.G., Obinger, C.,
B:BIRY.0000016344.59411.ee.
and Arnhold, J. (2010) (-)$Epicatechin enhances the chlo$
2.
Davies, M.J., Hawkins, C.L., Pattison, D.I., and Rees, M.D.
rinating activity of human myeloperoxidase, Arch. Bio
(2008) Mammalian heme peroxidases: from molecular
chem. Biophys., 495, 21-27, doi: 10.1016/j.abb.2009.
mechanisms to health implications, Antioxid. Redox
12.013.
Signal., 10, 1199-1234, doi: 10.1089/ars.2007.1927.
6.
Flemmig, J., Remmler, J., Rohring, F., and Arnhold, J.
3.
Arnhold, J., Furtmuller, P.G., and Obinger, C. (2003)
(2014) (-)$Epicatechin regenerates the chlorinating activity
Redox properties of myeloperoxidase, Redox Rep., 8,
of myeloperoxidase in vitro and in neutrophil granulocytes,
179-186, doi: 10.1179/135100003225002664.
J. Inorg. Biochem., 130, 84-91, doi: 10.1016/j.jinorg$
4.
Furtmuller, P.G., Burner, U., Jantschko, W., Regelsberger, G.,
bio.2013.10.002.
and Obinger, C. (2000) Two$electron reduction and one$
7.
Vlasova, I.I., Sokolov, A.V., and Arnhold, J. (2012) The
electron oxidation of organic hydroperoxides by human
free amino acid tyrosine enhances the chlorinating activity
БИОХИМИЯ том 84 вып. 6 2019
846
ВЛАСОВА и др.
of human myeloperoxidase, J. Inorg. Biochem., 106,
Dalle$Donne, I., and Milzani, A. (2017) Thiol oxidation
76-83, doi: 10.1016/j.jinorgbio.2011.09.018.
and di$tyrosine formation in human plasma proteins
8.
Tzikas, S., Schlak, D., Sopova, K., Gatsiou, A., Stakos, D.,
induced by inflammatory concentrations of hypochlorous
Stamatelopoulos, K., Stellos, K., and Laske, C. (2014)
acid, J. Proteomics, 152, 22-32, doi: 10.1016/j.jprot.2016.
Increased myeloperoxidase plasma levels in patients with
10.008.
Alzheimer’s disease, J. Alzheimer’s Dis., 39, 557-564, doi: 10.
22.
Colombo, G., Reggiani, F., Cucchiari, D., Portinaro, N.M.,
3233/JAD$131469.
Giustarini, D., Rossi, R., Garavaglia, M.L., Saino, N.,
9.
Baldus, S., Heeschen, C., Meinertz, T., Zeiher, A.M.,
Milzani, A., Badalamenti, S., and Dalle$Donne, I. (2017)
Eiserich, J.P., Munzel, T., Simoons, M.L., and Hamm,
Plasma protein$bound di$tyrosines as biomarkers of oxida$
C.W. (2003) Myeloperoxidase serum levels predict risk in
tive stress in end stage renal disease patients on mainte$
patients with acute coronary syndromes, Circulation,
nance haemodialysis, BBA Clin., 7, 55-63, doi: 10.1016/
108,
1440-1445, doi:
10.1161/01.CIR.0000090690.
j.bbacli.2016.12.004.
67322.51.
23.
Meotti, F.C., Jameson, G.N.L., Turner, R., Harwood, D.T.,
10.
Vlasova, I.I., Arnhold, J., Osipov, A.N., and Panasenko, O.M.
Stockwell, S., Rees, M.D., Thomas, S.R., and Kettle, A.J.
(2006) pH$Dependent regulation of myeloperoxidase
(2011) Urate as a physiological substrate for myeloperoxi$
activity, Biochemistry (Moscow), 71, 667$677, doi: 10.1134/
dase: Implications for hyperuricemia and inflammation,
S0006297906060113.
J. Biol. Chem., 286, 12901-12911 doi: 10.1074/jbc.
11.
Furtmuller, P.G., Zederbauer, M., Jantschko, W., Helm, J.,
M110.172460.
Bogner, M., Jakopitsch, C., and Obinger, C. (2006) Active
24.
Salavej, P., Spalteholz, H., and Arnhold, J.
(2006)
site structure and catalytic mechanisms of human peroxi$
Modification of amino acid residues in human serum albu$
dases, Arch. Biochem. Biophys., 445, 199-213, doi: 10.1016/
min by myeloperoxidase, Free Radic. Biol. Med., 40,
j.abb.2005.09.017.
516-525, doi: 10.1016/j.freeradbiomed.2005.09.007.
12.
Ramos, D.R., Garcia, M.V., Canle L.M., Santaballa, J.A.,
25.
Carr, A.C., McCall, M.R., and Frei, B. (2000) Oxidation
Furtmuller, P.G., and Obinger, C. (2008) Myeloperoxi$
of LDL by myeloperoxidase and reactive nitrogen species:
dase$catalyzed chlorination: the quest for the active
reaction pathways and antioxidant protection, Arterioscler.
species, J. Inorg. Biochem., 102, 1300-1311, doi: 10.1016/
Thromb. Vasc. Biol., 20, 1716-1723, doi: 0.1161/01.ATV.
j.jinorgbio.2008.01.003.
20.7.1716.
13.
Zhang, R., Brennan, M.L., Shen, Z., MacPherson, J.C.,
26.
Dobretsov, G.E., Syrejshchikova, T.I., Smolina, N.V., and
Schmitt, D., Molenda, C.E., and Hazen, S.L. (2002)
Uzbekov M.V. (2015) CAPIDAN, a fluorescent reporter
Myeloperoxidase functions as a major enzymatic catalyst
for detection of albumin drug$binding site changes, in
for initiation of lipid peroxidation at sites of inflammation,
Human serum albumin (HSA) (Stokes, T., ed.), Nova
J. Biol. Chem., 277, 46116-46122, doi: 10.1074/jbc.
Science Publisher Inc., 129-171.
M209124200.
27.
Colombo, G., Clerici, M., Giustarini, D., Rossi, R.,
14.
Vlasova, I.I., Feng, W.$H., Goff, J.P., Giorgianni, A., Do, D.,
Milzani, A., and Dalle$Donne, I. (2012) Redox albu$
Gollin, S.M., Lewis, D.W., Kagan, V.E., and Yalowich, J.C.
minomics: oxidized albumin in human diseases, Antioxid.
(2011) Myeloperoxidase$dependent oxidation of etoposide
Redox Signal., 17, 1515-1527, doi: 10.1089/ars.2012.4702.
in human myeloid progenitor CD34+ cells, Mol. Phar
28.
Созарукова М.М., Проскурнина Е.В., Владимиров Ю.А.
macol., 79, 479-487, doi: 10.1124/mol.110.068718.
(2016) Сывороточный альбумин как источник и ми$
15.
Jantschko, W., Furtmuller, P.G., Zederbauer, M.,
шень свободных радикалов в патологии 56-61, Бюлле
Neugschwandtner, K., Lehner, I., Jakopitsch, C., Arnhold, J.,
тень РГМУ, 1, 56-60.
and Obinger, C. (2005) Exploitation of the unusual ther$
29.
Torres, M.J., Turell, L., Botti, H., Antmann, L., and
modynamic properties of human myeloperoxidase in
Carballal, S. (2012) Modulation of the reactivity of the
inhibitor design, Biochem. Pharmacol., 69, 1149-1157,
thiol of human serum albumin and its sulfenic derivative by
doi: 10.1016/j.bcp.2005.02.006.
fatty acids, Arch. Biochem. Biophys., 521, 102-110, doi: 10.
16.
Pattison, D.I., and Davies, M.J. (2006) Reactions of
1016/j.abb.2012.03.011.
myeloperoxidase$derived oxidants with biological sub$
30.
Tiruppathi, C., Naqvi, T., Wu, Y., Vogel, S.M., Minshall, R.D.,
strates: gaining chemical insight into human inflammatory
and Malik, A.B. (2004) Albumin mediates the transcytosis
diseases, Curr. Med. Chem., 13, 3271-3290, doi: 10.2174/
of myeloperoxidase by means of caveolae in endothelial
092986706778773095.
cells, Proc. Natl. Acad. Sci., 101, 7699-7704, doi: 10.1073/
17.
Senthilmohan, R., and Kettle, A.J. (2006) Bromination
pnas.0401712101.
and chlorination reactions of myeloperoxidase at physio$
31.
Atanasiu, R.L., Stea, D., Mateescu, M.A, Vergely, C.,
logical concentrations of bromide and chloride, Arch.
Dalloz, F., Briot, F., Maupoil, V., Nadeau, R., and
Biochem. Biophys., 445, 235-244, doi: 10.1016/j.abb.
Rochette, L. (1998) Direct evidence of caeruloplasmin
2005.07.005.
antioxidant properties, Mol. Cell. Biochem., 189, 127-135,
18.
Brennan, M.L., and Hazen, S.L. (2003) Amino acid and
doi: 10.1023/A:1006945713860.
protein oxidation in cardiovascular disease, Amino Acids,
32.
Barinov, N.A., Vlasova, I.I., Sokolov, A.V., Kostevich, V.A.,
25, 365-374, doi: 10.1007/s00726$003$0023$y.
Dubrovin, E.V., and Klinov, D.V. (2018) High$resolution
19.
Shao, B., Tang, C., Sinha, A., Mayer, P.S., Davenport, G.D.,
atomic force microscopy visualization of metalloproteins
Brot, N., Oda, M.N., Zhao, X.Q., and Heinecke, J.W.
and their complexes, Biochim. Biophys. Acta, 1862,
(2014) Humans with atherosclerosis have impaired ABCA1
2862-2868, doi: 10.1016/j.bbagen.2018.09.008.
cholesterol efflux and enhanced high$density lipoprotein
33.
Sokolov, A., Ageeva, K., Pulina, M., Cherkalina, O.,
oxidation by myeloperoxidase, Circ. Res., 114, 1733-1742,
Samygina, V., Vlasova, I.I., Panasenko, O., Zakharova, E.,
doi: 10.1161/circresaha.114.303454.
and Vasilyev, V. (2008) Ceruloplasmin and myeloperoxi$
20.
Arnhold, J., Hammerschmidt, S., Wagner, M., Mueller, S.,
dase in complex affect the enzymatic properties of each
Arnold, K., and Grimm, E. (1990) On the action of
other, Free Radic. Res., 42, 989-998, doi: 10.1080/
hypochlorite on human serum albumin, Biomed. Biochim.
10715760802566574.
Acta, 49, 991-997.
34.
Griffin, S.V., Chapman, P.T., Lianos, E.A., and Lock$
21.
Colombo, G., Clerici, M., Altomare, A., Rusconi, F.,
wood, C.M. (1999) The inhibition of myeloperoxidase by
Giustarini, D., Portinaro, N., Garavaglia, M.L., Rossi, R.,
ceruloplasmin can be reversed by anti$myeloperoxidase
БИОХИМИЯ том 84 вып. 6 2019
ОКИСЛЕНИЕ БЕЛКОВ МПО: РОЛЬ ТИРОЗИНА
847
antibodies, Kidney Int., 55, 917-925, doi: 10.1046/j.1523$
plasmin induced by hydrogen peroxide is prevented by
1755.1999.055003917.x.
pyruvate, Free Radic. Res., 38, 19-26, doi: 10.1080/
35.
Park, Y.S., Suzuki, K., Mumby, S., Taniguchi, N., and
10715760310001624079.
Gutteridge, J.M. (2000) Antioxidant binding of caerulo$
47.
Samygina, V.R., Sokolov, A.V., Bourenkov, G., Petou$
plasmin to myeloperoxidase: myeloperoxidase is inhibited,
khov, M.V., Pulina, M.O., Zakharova, E.T., Vasilyev, V.B.,
but oxidase, peroxidase and immunoreactive properties of
Bartunik, H., and Svergun, D.I. (2013) Ceruloplasmin:
caeruloplasmin remain intact, Free Radic. Res., 33,
macromolecular assemblies with iron$containing acute
phase proteins, PLoS One, 8, e67145, doi: 10.1371/journal.
1421.
pone.0067145.
36.
Chapman, A.L.P., Mocatta, T.J., Shiva, S., Seidel, A.,
48.
Kapralov, A., Vlasova, I.I., Feng, W., Maeda, A., Walson, K.,
Chen, B., Khalilova, I., Paumann$Page, M.E., Jame$
Tyurin, V.A., Huang, Z., Aneja, R.K., Carcillo, J., Bayir, H.,
son, G.N.L., Winterbourn, C.C., and Kettle, A.J. (2013)
and Kagan, V.E. (2009) Peroxidase activity of hemoglo$
Ceruloplasmin is an endogenous inhibitor of myeloperoxi$
bin-haptoglobin complexes. Covalent aggreation and
dase, J. Biol. Chem., 288, 6465-6477, doi: 10.1074/
oxidative stress in plasma and macrophages, J. Biol. Chem.,
jbc.M112.418970.
284, 30395-30407, doi: 10.1074/jbc.M109.045567.
37.
Segelmark, M., Persson, B., Hellmark, T., and Wieslander, J.
49.
Anraku, M., Yamasaki, K., Maruyama, T., Kragh$Hansen, U.,
(1997) Binding and inhibition of myeloperoxidase (MPO):
and Otagiri, M. (2001) Effect of oxidative stress on the
a major function of ceruloplasmin? Clin. Exp. Immunol.,
structure and function of human serum albumin, Pharm.
108, 167-174, doi: 10.1046/j.1365$2249.1997.d01$992.x.
Res., 18, 632-639, doi: 10.1023/A:1011029226072.
38.
Sokolov, A.V., Pulina, M.O., Ageeva, K.V., Ayrapetov, M.I.,
50.
Hawkins, C.L., Pattison, D.I., and Davies, M.J. (2003)
Berlov, M.N., Volgin, G.N., Markov, A.G., Yablonsky, P.K.,
Hypochlorite$induced oxidation of amino acids, peptides
Kolodkin, N.I., Zakharova, E.T., and Vasilyev, V.B. (2007)
and proteins, Amino Acids, 25, 259-274, doi: 10.1007/
Interaction of ceruloplasmin, lactoferrin, and myeloper$
s00726$003$0016$x.
oxidase, Biochemistry (Moscow), 72, 409-415, doi: 10.
51.
Potsch, S., Lendzian, F., Ingemarson, R., Hornberg, A.,
1134/S0006297907040074.
Thelander, L., Lubitz, W., Lassmann, G., and Graslund, A.
39.
Sokolov, A.V., Kostevich, V.A., Romanico, D.N.,
(1999) The iron$oxygen reconstitution reaction in protein
Zakharova, E.T., and Vasilyev, V.B. (2012) Two$stage
R2$Tyr$177 mutants of mouse ribonucleotide reductase:
method for purification of ceruloplasmin based on its inter$
EPR and electron nuclear double resonance studies on a
action with neomycin, Biochemistry (Moscow),
77,
new transient tryptophan radical, J. Biol. Chem., 274,
631-638, doi: 10.1134/S0006297912060107.
17696-17704, doi: 10.1074/jbc.274.25.17696.
40.
Marquez, L.A., and Dunford, H.B. (1995) Kinetics of oxi$
52.
Carvalho, L.C., Estevao, M.S., Ferreira, L.M., Fernandes, E.,
dation of tyrosine and dityrosine by myeloperoxidase com$
and Marques, M.M.B. (2010) A new insight on the
pounds I and II, J. Biol. Chem., 270, 30434-30440, doi: 10.
hypochlorous acid scavenging mechanism of tryptamine
1074/jbc.270.51.30434.
and tryptophan derivatives, Bioorg. Med. Chem. Lett., 20,
41.
Pfeiffer, S., Schmidt, K., and Mayer, B. (2000) Dityrosine
6475-6478, doi: 10.1016/j.bmcl.2010.09.067.
formation outcompetes tyrosine nitration at low steady$
53.
Polimova, A.M., Vladimirova, G.A., Proskurnina, E.V.,
state concentrations of peroxynitrite: implications for tyro$
and Vladimirov, Y.A. (2011) Aromatic amino acid oxida$
sine modification by nitric oxide/superoxide in vivo, J. Biol.
tion products as antioxidants, Biophysics, 56, 585-589,
Chem., 275, 6346-6352, doi: 10.1074/jbc.275.9.6346.
doi: 10.1134/S000635091104021X.
42.
Sokolov, A.V., Kostevich, V.A., Varfolomeeva, E.Y., Gri$
54.
Carroll, L., Pattison, D.I., Davies, J.B., Anderson, R.F.,
gorieva, D.V., Gorudko, I.V., Kozlov, S.O., Kudryavtsev, I.V.,
Lopez$Alarcon, C., and Davies, M.J. (2018) Superoxide
Mikhalchik, E.V., Filatov, M.V., Cherenkevich, S.N.,
radicals react with peptide$derived tryptophan radicals
Panasenko, O.M., Arnhold, J., and Vasilyev, V.B. (2018)
with very high rate constants to give hydroperoxides as
Capacity of ceruloplasmin to scavenge products of the res$
major products, Free Radic. Biol. Med., 118, 126-136,
piratory burst of neutrophils is not altered by the products
doi: 10.1016/j.freeradbiomed.2018.02.033.
of reactions catalyzed by myeloperoxidase, Biochem. Cell
55.
Ogasawara, Y., Namai, T., Togawa, T., and Ishii, K. (2006)
Biol., 96, 457-467, doi: 10.1139/bcb$2017$0277.
Formation of albumin dimers induced by exposure to per$
43.
Panasenko, O.M., Chekanov, A.V., Vlasova, I.I., Sokolov, A.V.,
oxides in human plasma: a possible biomarker for oxidative
Ageeva, K.V., Pulina, M.O., Cherkalina, O.S., and Vasil’ev, V.B.
stress, Biochem. Biophys. Res. Commun., 340, 353-358,
(2008) Influence of ceruloplasmin and lactoferrin on the
doi: 10.1016/j.bbrc.2005.11.183.
chlorination activity of leukocyte myeloperoxidase assayed
56.
Annibal, A., Colombo, G., Milzani, A., Dalle$Donne, I.,
by chemiluminescence, Biophysics, 53, 268-272, doi: 10.
Fedorova, M., and Hoffmann, R. (2016) Identification of
1134/S0006350908040052.
dityrosine cross$linked sites in oxidized human serum
44.
Green, P.S., Mendez, A.J., Jacob, J.S., Crowley, J.R.,
albumin, J. Chromatogr. B Anal. Technol. Biomed. Life Sci.,
Growdon, W., Hyman, B.T., and Heinecke, J.W. (2004)
1019, 147-155, doi: 10.1016/j.jchromb.2015.12.022.
Neuronal expression of myeloperoxidase is increased in
57.
Colombo, G., Clerici, M., Giustarini, D., Portinaro, N.,
Alzheimer’s disease, J. Neurochem., 90, 724-733, doi: 10.
Badalamenti, S., Rossi, R., Milzani, A., and Dalle$Donne, I.
1111/j.1471$4159.2004.02527.x.
(2015) A central role for intermolecular dityrosine cross$
45.
Malle, E., Buch, T., and Grone, H.$J.
(2003)
linking of fibrinogen in high molecular weight advanced
Myeloperoxidase in kidney disease, Kidney Int., 64,
oxidation protein product (AOPP) formation, Biochim.
1956-67, doi: 10.1046/j.1523$1755.2003.00336.x.
Biophys. Acta, 1850, 1-12, doi: 10.1016/j.bbagen.2014.
46.
Aouffen, M., Paquin, J., Furtos, A., Waldron, K.C., and
09.024.
Mateescu, M.$A. (2004) Oxidative aggregation of cerulo$
БИОХИМИЯ том 84 вып. 6 2019
848
ВЛАСОВА и др.
MYELOPEROXIDASE)INDUCED OXIDATION
OF ALBUMIN AND CERULOPLASMIN:
ROLE OF TYROSINES
I. I. Vlasova1,2*, A. V. Sokolov1,3,4, V. A. Kostevich1,3,
E. V. Mikhalchik1, and V. B. Vasilyev3,4
1 Federal Research and Clinical Center of Physical Chemical Medicine,
119435 Moscow, Russia; E mail: iivlasova08@gmail.com
2 Sechenov First Moscow State Medical University, Institute
for Regenerative Medicine, 119991 Moscow, Russia
3 Institute of Experimental Medicine, 197376 St. Petersburg, Russia
4 St. Petersburg State University, 199034 St. Petersburg, Russia
Received February 22, 2019
Revised March 14, 2019
Accepted March 14, 2019
Neutrophil myeloperoxidase (MPO) plays an important role in protecting the body against infections. MPO products -
hypohalous acids and phenoxyl radicals - are strong oxidants, which can damage not only foreign intruders but also
host tissues including blood plasma proteins. Here, we compared the MPO$induced oxidation of two plasma proteins
with antioxidant properties - human serum albumin (HSA) and ceruloplasmin (CP). Incubation of both proteins
with hypochlorite (NaOCl) or with catalytically active MPO (MPO + H2O2), which in the presence of chloride ions
synthesizes hypochlorous acid (HOCl), resulted in quenching of tryptophan fluorescence of the proteins. Oxidation$
induced changes in the structures of HSA and CP were different: HSA due to its high antioxidant capacity efficiently
neutralized the MPO$generated oxidants without formation of protein aggregates, while oxidation of CP resulted in
formation of large aggregates stabilized by strong covalent bonds between aromatic amino acid residues of tyrosine
(which is present in plasma as free amino acid and also as an amino acid residue of polypeptide chains) and trypto$
phan. The number of tyrosine residues in a protein is not a determining factor for the formation of aggregates. In the
case of CP only, the formation of aggregates is primarily due to the high content of tryptophan residues in its polypep$
tide chain. MPO$dependent oxidation of free amino acid tyrosine results in formation of tyrosyl radicals, which do
not oxidize aromatic amino acid residues in proteins because of their high propensity to recombine with formation of
dityrosines. At the same time, free tyrosine can modulate MPO$induced protein oxidation due to its ability to modu$
late the HOCl synthesis in the active center of MPO.
Keywords: hypochlorous acid, phenoxyl radicals, protein oxidation, tryptophan fluorescence, protein aggregation
БИОХИМИЯ том 84 вып. 6 2019