БИОХИМИЯ, 2019, том 84, вып. 6, с. 859 - 873
УДК 577.152.112
ТЕЛЬЦА ВКЛЮЧЕНИЯ РЕКОМБИНАНТНОГО
ПОРИНА OmpF Yersinia pseudotuberculosis:
ИХ СВОЙСТВА И СТРУКТУРНАЯ
ХАРАКТЕРИСТИКА
© 2019
В.А. Хоменко, Е.В. Сидорин, С.И. Бахолдина,
Н.Ю. Ким, Г.А. Набережных, А.М. Стенкова,
Н.Ю. Чернышева, М.П. Исаева, Т.Ф. Соловьева*
Тихоокеанский институт биоорганической химии
им. Г.Б. Елякова ДВО РАН, 690022 Владивосток, Россия;
электронная почта: soltaf@mail.ru
Поступила в редакцию 14.12.2018
После доработки 27.03.2019
Принята к публикации 27.03.2019
Зрелый порообразующий белок OmpF из наружной мембраны Yersinia pseudotuberculosis экспрессировали в
форме телец включения (ТВ) в Escherichia coli при разных условиях культивирования. С помощью электрон%
ной микроскопии, динамического светорассеяния, оптической спектроскопии и специфических гидро%
фобных красителей исследовали свойства и структурную организацию ТВ, а также структуру рекомбинант%
ного порина (rOmpF), растворенного из них. Для ТВ определены размер, форма и стабильность в присут%
ствии денатурантов. Показано, что ТВ хорошо растворимы в Ds%Na и более устойчивы, по сравнению с де%
тергентом, к действию мочевины. Растворение ТВ в обоих денатурантах приводило к образованию гетеро%
генной по размеру популяции олигомерных частиц. Установлено, что ТВ содержат интермедиат rOmpF c
выраженной вторичной структурой, близкой к нативной, и с элементами третичной структуры, который
способен встраиваться в липидный бислой, приобретая функционально активную конформацию. Исследо%
ванные ТВ, которые образуются при разной концентрации индуктора (ИПТГ), заметно не различаются
между собой по свойствам и структуре. Однако следует отметить, что с увеличением концентрации индук%
тора в ТВ возрастает содержание амилоидных структур, что может рассматриваться как неблагоприятный
фактор, снижающий выход рекомбинантного белка. Полученные результаты вносят вклад в развитие новых
подходов для получения активных белков из ТВ, а также ТВ, обладающих биологической и функциональ%
ной активностью.
КЛЮЧЕВЫЕ СЛОВА: Yersinia pseudotuberculosis, тельца включения, рекомбинантный порин OmpF, динами%
ческое рассеяние света, электронная микроскопия, оптическая спектроскопия.
DOI: 10.1134/S0320972519060113
Многие биологически активные белки, ко%
вого белка, легко извлекаются из клеток и очи%
торые находят применение в медицине, а также
щаются от примесей, образование их рассмат%
используются в научных исследованиях, полу%
ривается, как неблагоприятный результат био%
чают с помощью современных методов биотех%
синтеза рекомбинантного белка. Это связано с
нологии. Рекомбинантные белки экспрессиру%
тем, что рекомбинантные белки в ТВ, как при%
ются в генно%инженерных штаммах Escherichia
нято считать, находятся в частично или непра%
сoli и накапливаются в цитоплазме бактерий в
вильно свернутом состоянии, и получение их в
растворимой форме или в виде нерастворимых
нативной конформации включает стадии дена%
агрегатов, т.н. телец включения (ТВ). Несмотря
турации и ренатурации, которые являются тру%
на то, что ТВ состоят преимущественно из целе%
доемкими и часто малоэффективными. Однако
в настоящее время показано, что ТВ могут со%
держать корректно свернутый белок, доля кото%
Принятые сокращения: rOmpF - рекомбинантный
белок OmpF; RH
- гидродинамический радиус; ИПТГ - изо% рого может быть различна [1]. Кроме того, для
пропил%β%D%1%тиогалактопиранозид; PMSF - фенилме%
целого ряда белков (ферменты, колониестиму%
тилсульфонилфторид; ДРС - динамическое рассеяние
света; КФ - карбоксифлуоресцеин; АНС - 8%анилино%1%
лирующий фактор, интерлейкин%1β) были по%
нафталинсульфоновая кислота.
лучены биологически активные ТВ, содержа%
* Адресат для корреспонденции.
щие рекомбинантный белок в конформации,
859
8*
860
ХОМЕНКО и др.
которая подобна нативной [2, 3]. Такие «неклас%
за агрегации. В то же время присутствие в ТВ
сические» ТВ весьма привлекательны как для
правильно свернутого белка дает возможность
получения активного целевого белка, так и ис%
мягкой его солюбилизации в конформации, ко%
пользования их в качестве наноматериалов в био%
торая способна превращаться в функционально
технологии. Образование подобных ТВ зависит
активную в присутствии добавок, имитирующих
как от природы белка, которая определяется его
мембранное окружение. В связи с этим приоб%
аминокислотной последовательностью, так и
ретает большое значение информация о струк%
целого ряда факторов, влияющих на биосинтез
турной организации ТВ, образованных реком%
рекомбинантного белка в клетках штамма%про%
бинантными поринами, и условиях получения
дуцента, включая условия роста клеток [4]. Это
ТВ с высоким содержанием корректно сверну%
открывает возможности контроля за конформа%
того рекомбинантного белка.
цией белка в ТВ.
Цель данной работы заключалась в том, что%
Порообразующие белки наружных мембран
бы изучить свойства и структурные характерис%
бактерий, митохондрий и хлоропластов отно%
тики ТВ, полученных при экспрессии порооб%
сятся к семейству интегральных мембранных
разующего белка OmpF Yersinia pseudotuberculosis
белков. Молекула неспецифического порина
в E. coli при температуре 37 °С, разных концент%
представляет собой β%складчатый лист, образо%
рациях индуктора и в течение разного времени
ванный 16β%тяжами, соединенными между со%
культивирования, влияние этих параметров на
бой длинными и короткими петлями, и сверну%
уровень экспрессии и структуру рекомбинант%
тый в виде цилиндра [5]. В нативном состоянии
ного порина, а также оценить принципиальную
порины существуют как гомотримеры, которые
возможность получить функционально актив%
являются высокостабильными, главным обра%
ный белок из ТВ, минуя стадию денатурации.
зом, за счет гидрофобных взаимодействий меж%
ду мономерами. В бактериальной мембране они
образуют водонаполненные каналы, проницае%
МЕТОДЫ ИССЛЕДОВАНИЯ
мые для низкомолекулярных (<600 Da) гидро%
фильных соединений, через которые клетка по%
Бактериальные штаммы и реактивы. В работе
лучает питательные вещества и удаляет продук%
использовали клетки E. coli штамма BL21(DE3)%
ты метаболизма. Участки молекулы поринов,
pLysS («Invitrogen», США); пептон BD Bacto™ и
экспонированные на поверхности клетки, слу%
дрожжевой экстракт BD Bacto™ («BD Biosciences»,
жат рецепторами для фагов и колицинов. Пори%
США); целлюлозные мембранные фильтры
ны играют фундаментальную роль во взаимо%
0,45 мкм («Agilent», США); акриламид, ДНКаза
действии хозяин-патоген, вызывая провоспа%
(«Serva», Германия); Ds%Na («Bio%Rad», США);
лительный и иммунный ответы [6]. Они влияют
PMSF - фенилметилсульфонилфторид («Merck»,
на устойчивость патогенных бактерий к антиби%
Германия); 8%анилино%1% нафталинсульфоновая
отикам и представляют важную мишень для те%
кислота (АНС), Nonidet P 40 (NP%40), дезокси%
рапевтического воздействия.
холат натрия, полиэтиленгликоль октиловый
В последнее время растет интерес к порооб%
эфир (Octyl%POE), Кумасси R%250, Конго крас%
разующим белкам и пептидам со стороны нано%
ный, карбоксифлуоресцеин («Sigma», США); ка%
биотехнологии (т.н. «биологические поры»):
намицин («Amresco», США); Triton X%100 («Cal%
идет активная разработка подходов к их приме%
Biochem», США); изопропил%β%D%1%тиогалак%
нению в «наномедицине», наноэлектронике и
топиранозид (ИПТГ), набор окрашенных бел%
для создания биосенсоров [7].
ков%маркеров («Fermentas», Литва); N%додецил%N,
Практическое использование поринов пред%
N%диметил%3%аммоний%1%пропансульфонат
полагает разработку достаточно эффективных
(SB3-12), лауроил саркозинат натрия («Sigma%
методов их получения. Биосинтез зрелых белков
Aldrich», США); фосфатно%солевой буфер (PBS),
наружной мембраны, включая порины в форме
рН 7,4 («Helicon», Россия). Все остальные реак%
ТВ в E. coli, давно используется для получения
тивы имели квалификацию х.ч. («Реахим», Рос%
функционально активных белков для научных
сия) и использовались без дополнительной
исследований [8]. Стандартная процедура вклю%
очистки.
чает растворение ТВ в 8 М мочевине с последу%
Разработка генно7инженерных конструкций.
ющим удалением денатуранта и переводом ре%
Создание генетической конструкции проведено
комбинантного белка в раствор, содержащий
как это описано ранее [9]. Полученная плазмида
мицеллы детергента, и предполагает сначала
pET%mOmpF была введена в экспрессионный
полное разворачивание молекул белка, а затем
штамм E. coli BL21(DE3)pLysS.
их сворачивание в нативную конформацию, что
Для изучения влияния концентрации индук%
сопровождается большими потерями белка из%
тора (0,1; 0,2; 0,4; 0,5; 1 мM) и времени индук%
БИОХИМИЯ том 84 вып. 6 2019
ТВ РЕКОМБИНАНТНОГО ПОРИНА OmpF
861
ции (1-5 ч) клетки наращивали в среде 2 × YT с
высушивали, напыляли углеродом. Анализиро%
канамицином (100 мкг/мл) при 37 °C и аэрации
вали образцы на сканирующем электронном
(180 об/мин) до оптической плотности А600, рав%
микроскопе Sigma 300 VP (Великобритания).
ной 0,5, после чего добавляли соответствующее
Связывание Конго красного. Наличие амило%
количество ИПТГ. Накопление биомассы опре%
идных структур в ТВ оценивали с помощью кра%
деляли по поглощению света бактериальными
сителя Конго красный [12]. ТВ суспендировали
суспензиями при 600 нм на спектрофотометре
в 10 мМ фосфатном буфере, рН 7,4 содержащем
Genesys™ 6 («Thermo Scientific», США).
150 мМ NaCl, 10 мкМ красителя до конечной
Выделение и очистка телец включения. Влаж%
концентрации белка 25 мкг/мл. Образцы инку%
ную бактериальную массу суспендировали в ли%
бировали 10 мин при комнатной температуре.
зирующем буфере (50 мM Tris%НCl, pH 8,0, 100 мМ
Спектры поглощения Конго красного в отсут%
NaCl, 1 мM EDTA), затем добавляли ингибитор
ствии и в присутствии ТВ регистрировали с по%
протеаз (PMSF, 1 мМ) и лизоцим (1 мг/мл).
мощью UV%Visible спектрофотометра UV%1601PC
После инкубации суспензии в течение 1,5 ч при
(«Shimadzu», Япония) в кварцевых кюветах с дли%
37 °С добавляли Triton X%100 (0,5%) и выдержи%
ной оптического пути 1 см в области 350-700 нм.
вали 1 ч при перемешивании при комнатной тем%
Растворимость ТВ в мочевине и Ds7Na. ТВ
пературе. Затем суспензию обрабатывали ульт%
суспендировали в 50 мМ Tris%НCl%буферe, рН 8,0,
развуком (УЗО Н%2Т, Россия) (44 кГц, 30 с × 6) на
содержащем от 0,02 до 0,1%%ного Ds%Na, или в
ледяной бане с перерывами в 1 мин, добавляли
водных растворах мочевины с концентрацией от
Nonidet P 40 (NP%40) до концентрации 1%, вы%
1 до 8 М и выдерживали в течение заданного
держивали при 8 °С в течение 1 ч и обрабатыва%
времени (от 10 мин до 24 ч). Мутность образцов
ли ДНКазой (1 мг/мл) в присутствии MgCl2 (1 M)
измеряли при 350 нм на спектрофотометре
1 ч при 37 °С. Полученную смесь центрифугиро%
μQuant («Bio%TEK Instruments, INC.», США).
вали при 15 000 × g 20 мин при 4 °С. Осадок, со%
Динамическое рассеяние света. Размер частиц
держащий ТВ, промывали два раза лизирующим
ТВ и рекомбинантного белка определяли мето%
буфером с Triton X%100 (0,5%) при 4 °С и не%
дом динамического светорассеяния на приборе
сколько раз деионизованной водой для удале%
ZetaSizer Nano ZS («Malvern», Великобритания),
ния солей и детергента. Для дальнейшей очист%
оснащенном He%Ne%лазером (λ 633 нм, 4 мВт)
ки ТВ последовательно обрабатывали раствора%
при угле 173°. Гидродинамический радиус (RH)
ми детергентов: 1%%ным Triton X%100, 0,2%%ным
белковых частиц рассчитывали с помощью
саркозилом, 1%%ным дезоксихолатом натрия в
программного обеспечения к прибору. Образцы
1-2 М мочевине и 1%%ным неионным детерген%
ТВ (0,1-0, 6 мг/мл) cуспендировали в воде или
том octyl%POE. Чистоту ТВ оценивали с по%
50 мМ Tris%НCl%буфере, рН 8,0, и в этих же раст%
мощью Ds%Na%ПААГ электрофореза. ТВ храни%
ворителях с добавлением мочевины или Ds%Na
ли при -70 °С.
до концентраций (1-8 М) и (0,02-0,1%) соответ%
Ds7Na7ПААГ7электрофорез. Белки разделяли
ственно, путем пропускания 10 раз через микро%
электрофорезом в градиентном (12-25%%ном)
иглу шприца и инкубацией при комнатной тем%
геле в денатурирующих условиях по методу Люг%
пературе в течение заданного времени при пере%
тенберга [10]. В качестве маркеров использовали
мешивании. Накопление данных осуществляли
набор окрашенных белков с мол. массами 10, 17,
в течение 5-60 мин. Измерения проводили в
26, 34, 43, 55, 72, 92, 130 и 180 кДа. Белки, разде%
кювете 10 × 10 мм. Время накопления данных
ленные в геле, окрашивали раствором Кумасси
корреляционной функции выбирали автомати%
R%250 в 10%%ной уксусной кислоте и 30%%ном
чески с помощью программного обеспечения к
метаноле. Визуализацию проводили с помощью
прибору, и оно составляло 5-30 мин. Измерения
гель%документирующей системы VersaDoc 4000
были выполнены в 2-3%х повторах.
(«Bio%Rad», США). Синтез рекомбинантного
Спектры КД и флуоресценции. Структуру ре%
белка оценивали денситометрически (програм%
комбинантного белка устанавливали с помощью
мное обеспечение Quantity One, «Bio%Rad»). От%
оптической спектроскопии. Регистрацию спект%
носительное количество белка в образце опреде%
ров КД проводили на спектрометре Chirascan%
лено, как интенсивность полосы этого белка, вы%
plus CD («Applied Photophysics», Великобрита%
раженная в процентах от общей интенсивности
ния) в кварцевых кюветах с длиной оптического
всех полос на фореграмме данного образца.
пути 0,1 и 1 см для съемки спектров в пептидной
Электронная микроскопия. Для исследования
и ароматической областях соответственно. В пеп%
методом сканирующей электронной микроско%
тидной области спектра КД (190-240 нм) рас%
пии образцы готовили по методике, описанной
считывали эллиптичность [θ] среднего остатка,
ранее [11]. ТВ фиксировали в 2,5%%ном глутаро%
принимая мол. массу последнего равной 110 Да.
вом альдегиде, обезвоживали в спирте и ацетоне,
В ароматической области спектра КД (240-320 нм)
БИОХИМИЯ том 84 вып. 6 2019
862
ХОМЕНКО и др.
рассчитывали молярную эллиптичность [θ]М,
Интенсивность флуоресценции растворов
принимая мол. массу белка равной 37,1 кДа. Со%
определяли на спектрофлуориметре FL%600 («Bio%
держание элементов вторичной структуры в
TEK Instruments», США) при длине волны воз%
белке было рассчитано по Провенчеру [13].
буждения 495 нм, эмиссии 530 нм.
Растворы белка в мочевине и детергенте перед
снятием спектров центрифугировали 15 000 g в
течение 20 мин.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Спектры флуоресценции измеряли на спект%
рофлуориметре Hitachi 850 (Япония) при 25 °С в
Экспрессия рекомбинантного порина OmpF.
кварцевой кювете с толщиной слоя 1 см. Воз%
Зависимость роста культуры от концентрации
буждение флуоресценции проводили при 280 и
индуктора и времени индукции изучали на
296 нм. Ширина щели на монохроматорах воз%
трансформированных клетках E. coli в присут%
буждения и излучения 5 нм.
ствии 0,1; 0,2; 0,4; 0,5 и 1 мМ ИПТГ и культиви%
В экспериментах по связыванию АНС спект%
ровании в течение 1, 2, 3, 4 и 5 ч. Анализ опти%
ры были записаны в области 400-600 нм при
ческой плотности культуры клеток свидетель%
возбуждении 375 нм. Образцы ТВ инкубировали
ствует о том, что культуры с ИПТГ до 0,5 мМ ха%
с 50%кратным молярным избытком АНС в тече%
рактеризуются практически одинаковыми ско%
ние 10 мин при комнатной температуре в темно%
ростями роста (5 ч, А600нм 1,61-1,70). Значитель%
те. Основной раствор АНС готовили в 10 мМ
ное отставание роста, в полтора раза, начиная со
фосфатном буфере (рН 7,4) и молярную концент%
2%го часа индукции, наблюдается для культуры
рацию измеряли, используя коэффициент экс%
клеток с 1 мМ ИПТГ (табл. 1).
тинкции 7800 М-1 см-1 при 372 нм [14].
По данным Ds%Na%ПААГ%электрофореза, бе%
Концентрацию белка в растворах мочевины
лок с ожидаемой мол. массой (37,4 кДа) синтези%
и Ds%Na определяли (после центрифугирования
руется в индуцированных клетках и не синтези%
при 15 000 g в течение 20 мин) по УФ%спектрам
руется в клетках без добавления ИПТГ (рис. 1, а).
в максимуме поглощения при 280 нм, принимая
Количество рекомбинантного OmpF (rOmpF)
величину А0,1%1 см, равной 1,27 [9]. УФ%спектры ре%
зависело от концентрации индуктора и времени
гистрировали при 25 °С в кварцевых кюветах (1 см)
роста культуры (табл. 2). Повышение концент%
на спектрофотометре Cesil CE 7200 («Aquarius»,
рации ИПТГ сопровождалось ростом относитель%
United Kingdom).
ного содержания rOmpF в лизате клеток. С уве%
Получение моноламелярных липосом, загружен7
личением времени экспрессии содержание rOmpF
ных карбоксифлуоресцеином (КФ). Липосомы, со%
вначале, от 2 до 3 ч, увеличивается, а затем, в
держащие КФ, получали методом обращения фаз,
последующие 4-5 ч, уменьшается. Максималь%
который описан в [15]. Контроль над размерами
ное количество целевого белка обнаружено в
липосом осуществляли методом ДРС, как опи%
клетках, культивируемых в течение 3 ч после ин%
сано выше.
дукции.
Порообразующая активность. Активность
На основании полученных результатов для
rOmpF определяли по изменению проницаемос%
сравнительного изучения ТВ были взяты следу%
ти липосомальной мембраны для КФ. К 180 мкл
ющие условия экспрессии порина: 37 °С, 3 ч,
суспензии КФ%липосом добавляли 20 мкл раст%
концентрация ИПТГ 0,4 и 1 мМ (ТВ%0,4 и ТВ%1
вора rOmpF (150 мкг/мл) в 0,04 или 0,06%%ном
соответственно). Также в ряде экспериментов
Ds%Na и фиксировали изменение флуоресцен%
использовали ТВ, образованные в клетках при
ции в течение 30 мин. Фоновую флуоресценцию
37 °С в течение 16 ч в присутствии 0,1 мМ ИПТГ
определяли, добавляя 20 мкл 0,04 или 0,06%%ного
(ТВ%0,1).
Ds%Na к 180 мкл суспензии КФ%липосом. Мак%
Выделение и очистка ТВ. Для того чтобы
симальную флуоресценцию при полном лизисе
обеспечить максимальный выход продукта, что
липосом определяли, добавляя 100 мкл 10%%ного
связано во многом с эффективным разрушени%
раствора Ds%Na. Процент специфического ос%
ем микробных клеток и минимальной денатура%
вобождения маркера (СОМ) рассчитывали по
цией рекомбинантного белка, были опробованы
формуле:
четыре метода дезинтеграции: ферментативный
лизис (обработка лизоцимом), осмотический
% СОМ = (Fэксп - Fфон)/(Fмакс - Fфон) × 100 %,
шок, гомогенизация в жидкой среде (Френч%
пресс) и обработка ультразвуком. Сравнение
где Fэксп - флуоресценция после добавления
этих методов проводили, определяя выход и сте%
белка, Fмакс - флуоресценция после полного ли%
пень чистоты ТВ rOmpF визуально с помощью
зиса липосом, Fфон - флуоресценция без добав%
Ds%Na%ПААГ%электрофореза. Анализ получен%
ления белка.
ных данных показал, что оптимальным является
БИОХИМИЯ том 84 вып. 6 2019
ТВ РЕКОМБИНАНТНОГО ПОРИНА OmpF
863
Таблица 1. Влияние концентрации индуктора (ИПТГ) и времени роста на оптическую плотность культуры клеток
Время роста культуры, ч
Концентрация
ИПТГ, мМ
0 ч
1 ч
2 ч
3 ч
4 ч
5 ч
Оптическая плотность клеток, А600 нм
0,1
0,40
0,91
1,25
1,45
1,54
1,62
0,2
0,40
0,84
1,22
1,42
1,52
1,61
0,4
0,40
0,88
1,30
1,51
1,63
1,70
0,5
0,40
0,80
1,27
1,48
1,60
1,66
1,0
0,40
0,77
0,91
1,00
1,03
-
Таблица 2. Относительное количество рекомбинантого порина в лизате клеток в зависимости от концентрации индуктора
и времени роста клеток, %
Время
Концентрация индуктора, мМ
экспрессии, ч
0,1
0,2
0,4
0,5
1
2
10,9
12,8
16,9
17,4
23
3
10,8
15,0
22,4
24,5
24,9
4
9,0
12,6
21,9
20,6
24,4
5
8,4
11,9
21,1
21,5
-
использование лизоцима в комплексе с ультра%
С целью очистки ТВ последовательно обрабаты%
звуком. Лизис клеток проводили в присутствии
вали растворами детергентов: 1%%ным Triton X%100,
ЭДТА, ингибитора протеаз PMSF (фенилметил%
0,2%%ным саркозилом, а также 1%%ным дезокси%
сульфонилфторид) и ДНКазы.
холатом натрия в 1-2 М мочевине. Эти детер%
По данным Ds%Na%ПААГ%электрофореза,
генты эффективно экстрагировали из ТВ сопут%
все полученные ТВ, наряду с целевым белком
ствующие белки, не затрагивая rOmpF. По%
rOmpF, содержали в виде примесей белки клетки%
скольку клетки E. coli содержат собственный по%
хозяина с разной молекулярной массой (рис. 1, а).
рин OmpF, уровень экспрессии которого в клет%
Рис. 1. Характеристика ТВ rOmpF. а - Ds%Na%ПААГ%электрофорез: 1 - лизат неиндуцированных клеток, 2 - лизат инду%
цированных клеток, 3 - ТВ, 4 - ТВ после очистки; б - сканирующая электронная микроскопия
БИОХИМИЯ том 84 вып. 6 2019
864
ХОМЕНКО и др.
ке, синтезирующей рекомбинантный белок, мо%
дельными гидрофобными остатками) на белке,
жет возрастать [16], особое внимание было уде%
что сопровождается значительным увеличением
лено избирательной экстракции его из ТВ. На%
интенсивности флуоресценции красителя и час%
ми было показано, что OmpF E. coli переходит в
то сдвигом максимума излучения в сторону бо%
раствор при обработке ТВ неионным детерген%
лее коротких длин волн [17]. В присутствии ТВ
том 1%%ным octyl%POE, в то время как rOmpF
происходил рост флуоресценции красителя и
Y. pseudotuberculosis остается в составе ТВ.
смещение максимума его излучения от 509 до
С помощью предложенной схемы были по%
487 и 494 нм для ТВ%0,4 и ТВ%1 соответственно
лучены ТВ, которые, по данным Ds%Na%ПААГ%
(рис. 2, а).
электрофореза, содержали достаточно чистый
Полученные данные показывают наличие в
целевой белок и могли быть прямо использова%
агрегатах молекул порина свободных (прямо не
ны в биофизических и биохимических экспери%
включенных в молекулярную агрегацию) клас%
ментах.
теров гидрофобных остатков, доступных для
Размер и форма ТВ. Размеры ТВ были опре%
связывания с зондом. Эти кластеры могут быть
делены методом динамического рассеяния света
образованы либо внутри индивидуальных моле%
(ДРС). ТВ, полученные в разных условиях куль%
кул, либо между соседними молекулами, что
тивирования клеток%продуцентов, представля%
предполагает наличие организованной структу%
ли собой популяции частиц с симметричным
ры у rOmpF в ТВ. Этот вывод поддерживается
мономодальным распределением по размерам и
данными, согласно которым АНС практически
близкими значениями средних гидродинами%
не связывается с неупорядоченными полипеп%
ческих радиусов (RH). ТВ%1, полученные в раз%
тидными цепями (такими, как полностью раз%
личных временных точках после индукции, 1, 2,
вернутые белки), несмотря на присутствие гид%
3 и 4 ч, имели RH 411, 462, 442 и 391 нм соответ%
рофобных боковых цепей [18]. Кроме того, бел%
ственно. Средние радиусы ТВ%0,2; ТВ%0,4; ТВ%0,5
ки порины в полностью развернутой конформа%
и ТВ%1 (время экспрессии 3 ч) были равны 382,
ции имеют низкую гидрофобность благодаря
390, 412, 442 нм соответственно. Анализ полу%
тому, что в их последовательности в областях
ченных данных позволил сделать заключение,
трансмембранных β%тяжей имеет место чередо%
что время экспрессии и концентрация индукто%
вание гидрофобных и гидрофильных остатков.
ра не оказывают существенного влияния на раз%
Взаимодействие амилоид специфичного кра
мер ТВ. Однако можно отметить тенденцию к
сителя с ТВ. Известно, что рекомбинантный бе%
небольшому росту размеров ТВ с увеличением
лок в составе ТВ может образовывать амилоидо%
концентрации индуктора.
подобные структуры. Существует представление,
Сканирующая электронная микроскопия по%
что амилоидные фибриллы, построенные из ре%
казала, что ТВ имеют близкую к сферической фор%
комбинантного белка, создают каркас ТВ, в ко%
му, шероховатую поверхность и размер, сравни%
торый встроены остальные молекулы белка в
мый с таковым, определенным ДРС (рис. 1, б).
частично свернутом состоянии и/или в конфор%
Структурная характеристика ТВ. Связывание
мации близкой к нативной [19]. Для обнаруже%
гидрофобного зонда с ТВ. Информация о струк%
ния амилоидных фибрилл в исследованных ТВ
турной организации белка в ТВ была получена с
был использован специфический краситель
помощью флуоресцентного красителя АНС, ко%
Конго красный (CR) [12]. В присутствии ТВ
торый способен связыватьcя с гидрофобными
наблюдали сдвиг максимума спектра поглоще%
поверхностями (но не с индивидуальными от%
ния CR в сторону более длинных волн, что ука%
Рис. 2. Взаимодействие ТВ с гидрофобными красителями. а - Спектры флуоресценции: 1 - АНС в присутствии ТВ%0,4,
2 - АНС в присутствии ТВ%1, 3 - АНС; б - спектр поглощения 1 - CR и разностные спектры поглощения CR в присут%
ствии 2 - ТВ%0,1, 3 - ТВ%0,4 и 4 - ТВ%1. Концентрация красителя - 10 мкМ, концентрация ТВ - 25 мкг/мл
БИОХИМИЯ том 84 вып. 6 2019
ТВ РЕКОМБИНАНТНОГО ПОРИНА OmpF
865
зывает на связывание красителя с ТВ и предпо%
ных ТВ, где белок, как правило, находится в ви%
лагает наличие в них амилоидоподобных струк%
де частично или неправильно свернутых интер%
тур. Разностные спектры, полученные в резуль%
медиатов. «Неклассические» ТВ растворимы в
тате вычитания спектра самого CR из спектра
мягких детергентах и растворах хаотропных
красителя после инкубации с ТВ%0,1, ТВ%0,4 и
агентов с низкой молярной концентрацией [22].
ТВ%1, имели максимумы при 556, 591, и 563 нм
Сравнительное изучение стабильности исследу%
соответственно (рис. 2, б). Наблюдаемые разли%
емых ТВ в растворах денатурантов позволяет
чия в положении максимумов спектров, воз%
косвенно судить о влиянии условий экспрессии
можно, отражают некоторые различия в органи%
на конформацию rOmpF в ТВ. Эти исследова%
зации фибрилл в ТВ, полученных при разных
ния также дают нам информацию о надмолеку%
концентрациях индуктора.
лярном состоянии в этих растворах солюбили%
Увеличение концентрации ТВ от 25 до 100 мкг/мл
зированного из ТВ rOmpF (размер частиц, сте%
сопровождалось ростом интенсивности погло%
пень полидисперсности). Процесс растворения
щения красителя, а в области 25-75 мкг/мл су%
ТВ%0,1; ТВ%0,4 и ТВ%1,0 в мочевине (1-8 М) и
ществовала прямая пропорциональная зависи%
Ds%Na (0,02-0,1%) изучали с помощью методов
мость между этими параметрами. Интенсив%
турбидиметрии и ДРС.
ность поглощения CR, инкубированного с ТВ%1
Растворение ТВ, за которым следили, изме%
(25 мкг/мл) было выше, чем с ТВ%0,4 и ТВ%0,5
ряя мутность их растворов в мочевине при 350 нм,
(в той же концентрации). Это позволяет считать,
начинается в 1 М мочевине и нарастает по мере
что ТВ, синтезированные при высокой концент%
увеличения ее концентрации (рис. 4, а). Наибо%
рации индуктора, содержат большее амилоидов
лее резкое падение мутности растворов ТВ про%
(если аффинность связывания амилоидов с кра%
исходит при увеличении концентрации мочеви%
сителем в исследованных ТВ одинакова).
ны от 3 до 5 М. Выдержка ТВ в мочевине в ин%
Растворимость ТВ в воде, мочевине и детер
тервале 5-24 ч не оказывает видимого влияния
генте. ТВ достаточно стабильны, при повыше%
на мутность растворов ТВ (данные приведены
нии ионной силы раствора (вода-физ. раствор)
для ТВ%0,1) (рис. 4, а). В то же время метод ДРС
не происходит значимых изменений в распреде%
показывает, что продолжительность инкубации
лении ТВ по размерам. Однако многократное
в мочевине влияет на процесс растворения ТВ.
продавливание достаточно разбавленной сус%
Так, увеличение времени инкубации ТВ%0,1 уве%
пензии ТВ (0,04 мг/мл) через иглу (d = 0,4 мм)
личивает их растворимость: происходит сдвиг
шприца приводит, по данным ДРС, к появле%
кривой концентрационной зависимости сред%
нию популяции мелких частиц (RH 45-65 нм)
него RH частиц в сторону меньших концентра%
(рис. 3, а). Этот результат может объясняться тем,
ций мочевины и уменьшение гетерогенности
что возможен динамический переход между ТВ и
популяции частиц (рис. 4, г, д).
растворимыми формами рекомбинантного белка,
По результатам турбидиметрических измере%
как это имеет место in vivo [20] и/или известным
ний (рис. 4, а), ТВ%1 имеют меньшую устойчи%
фактом, согласно которому гидростатическое
вость к действию мочевины, чем ТВ%0,1 и ТВ%0,4.
давление может вызывать дезагрегацию ТВ [21].
Однако данные ДРС не поддерживают этот вывод
Как известно, ТВ с высоким содержанием
и свидетельствуют в пользу того, что раствори%
белка в нативной или близкой к нативной кон%
мость ТВ падает в ряду ТВ%1 ТВ%0,4 > ТВ%0,1
формации («неклассические») являются более
(рис. 4, в).
рыхлыми и непрочными, в отличие от «класси%
На растворимость ТВ в мочевине влияет так%
ческих» более плотно упакованных и стабиль%
же их концентрация в растворе: чем больше кон%
Рис. 3. Числовое распределение ТВ по размеру. а - ТВ%0,4 в воде: инкубировали 1 ч при 25 °С (сплошная линия) и
продавливали через иглу (10 раз) (пунктирная линия); б, в - ТВ%1 с концентрацией 0,1 (пунктирные линии) и 0,6 мкг/мл
(сплошные линии) в б - 5 М и в - 6 М мочевине
БИОХИМИЯ том 84 вып. 6 2019
866
ХОМЕНКО и др.
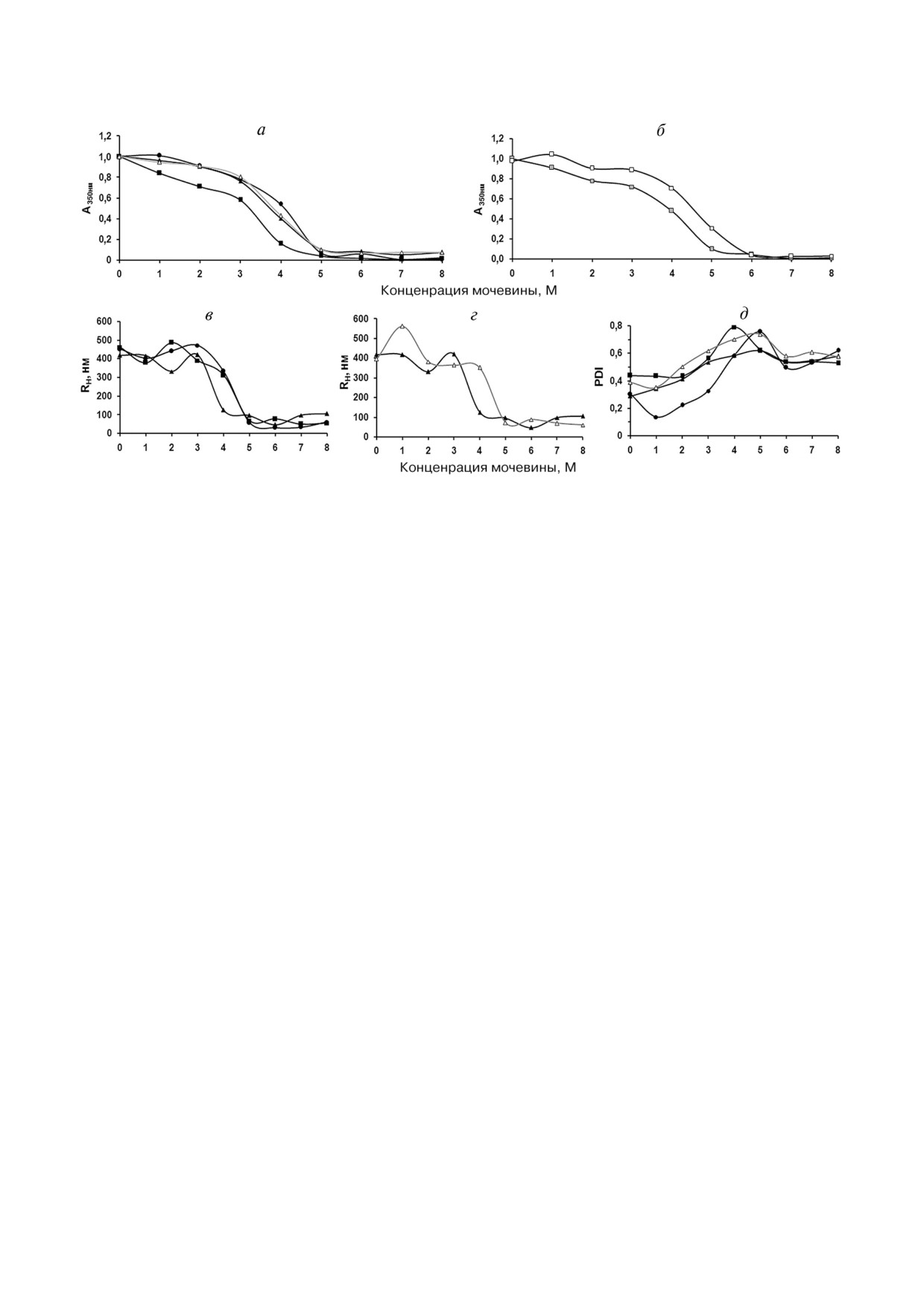
Рис. 4. Растворимость ТВ в мочевине. Графики зависимости: а - мутности растворов ТВ в мочевине, инкубированных 24
и 5 ч (ТВ%0,1), б - мутности растворов ТВ%1 с концентрацией 0,6 и 0,1 мг/мл в мочевине, инкубированных 1 ч; в, г - сред%
него гидродинамического радиуса (числового), в - ТВ, инкубированных в мочевине 24 ч и г - ТВ%0,1, инкубированных 5
и 24 ч, д - индекса полидисперсности ТВ, инкубированных 24 и 5 ч (ТВ%0,1), от концентрации мочевины. ТВ%0,1: 5 ч (бе%
лый треугольник), 24 ч (черный треугольник); ТВ%0,4: 24 ч (черный кружок); ТВ%1: 0,1 мг/мл, 1 ч (серый квадрат), 0,6 мг/мл,
1ч (белый квадрат) и 24 ч (черный квадрат). Концентрация ТВ во всех экспериментах равна 0,6 мг/мл (исключение - 4, б)
центрация, тем выше их устойчивость к действию
социацией агрегатов происходит самоассоциа%
мочевины (рис. 4, б). Более наглядно это обна%
ция образующихся частиц. Этот процесс осо%
руживается при сравнении кривых числового
бенно выражен в растворах с высокой концент%
распределения по размеру частиц ТВ%1 с разной
рацией мочевины (7-8 М) и определяет некото%
концентрацией (0,1 и 0,6 мкг/мл) в растворах 5 и
рый рост среднего размера частиц в этих раство%
6 М мочевины (рис. 3, б, в).
рах. Следует отметить, что при концентрации
Сравнительный анализ кривых распределе%
2-3 М мочевины наблюдается некоторое увели%
ния ТВ%0,1; ТВ%0,4 и ТВ%1,0 по размеру показал,
чение размеров частиц, возможно, за счет свя%
что в растворах мочевины с концентрацией до
зывания мочевины с ТВ, которое предшествует
3 М присутствуют только крупные частицы, ко%
их растворению.
торые имеют мономодальное распределение и
Поскольку светорассеяние от больших час%
размеры, близкие к таковым в воде. В 4 М мо%
тиц может маскировать относительно мелкие
чевине максимум пика на кривой распределе%
частицы, для более точной оценки размеров пос%
ния сдвигается в сторону более мелких частиц
ледних крупные частицы удаляли, фильтруя раст%
(RH ~350 нм). Дальнейшее увеличение концент%
воры через мембрану с размерами пор 0,45 мкм.
рации мочевины до 5 М приводит к образова%
Средние числовые радиусы частиц в растворах
нию частиц с размером менее 100 нм и росту ге%
мочевины разной концентрации находились в
терогенности популяции. Это находит отраже%
диапазоне 17-55 нм с преобладанием частиц с
ние в уменьшении среднего RH и увеличении
размером ~30 нм. Частиц с размерами менее 10 нм
значения индекса полидисперсности (PdI), ко%
обнаружено не было. Таким образом, рекомби%
торый определяется шириной распределения по%
нантный белок присутствует в растворе, в основ%
пуляции частиц по размерам (рис. 4, в, д). В раст%
ном, в олигомерной форме (RН развернутой мо%
ворах ТВ в 6-8 М мочевине появляются более
лекулы rOmpF равен 8,2 нм по данным ДРС [23]).
мелкие частицы, при этом популяция остается
ТВ%0,4 и ТВ%1 достаточно хорошо растворя%
полидисперсной, но ширина распределения
ются в Ds%Na: мутность растворов резко падает
частиц по размеру уменьшается: величина PdI
при увеличении концентрации детергента от
падает, но при этом остается довольно высокой.
0,02 (0,04) до 0,06% и практически не изменяет%
В этих растворах наряду с мелкими присутству%
ся при дальнейшем ее росте (рис. 5, а). Эффек%
ет небольшая фракция довольно крупных час%
тивность растворения ТВ увеличивается с уве%
тиц с RH 100 нм и выше, видимо, наряду с дис%
личением времени выдержки ТВ в детергенте.
БИОХИМИЯ том 84 вып. 6 2019
ТВ РЕКОМБИНАНТНОГО ПОРИНА OmpF
867
Как видно из рис. 5, а, ТВ%0,4 растворяются в
максимальное значение PdI сдвигается в об%
детергенте лучше, чем ТВ%1,0.
ласть более низких концентраций Ds%Na, ука%
Методом ДРС было показано, что растворе%
зывая на то, что интенсивное растворение ТВ,
ние ТВ в детергенте сопровождается образова%
которое сопровождается увеличением гетеро%
нием популяции частиц, размеры которых умень%
генности образующейся популяции частиц, в
шаются по мере увеличения концентрации де%
этом случае происходит при более низких кон%
тергента (числовое распределение частиц по
центрациях детергента.
размерам сдвигается в сторону меньших значе%
Как видно из рис. 5, б, размер ТВ, по сравне%
ний RH). Значение среднего (числового) RH рез%
нию с исходным, увеличивается при концентра%
ко падает с увеличением концентрации детер%
ции детергента, выше которой начинается ин%
гента 0,04 (0,02) до 0,08 (0,06)% (в зависимости
тенсивное растворение ТВ. Можно предполо%
от времени выдержки в детергенте) и сохраняет%
жить, что растворению ТВ предшествует стадия
ся относительно постоянным при дальнейшем
набухания в результате связывания их с молеку%
повышении концентрации Ds%Na (рис. 5, б). Уве%
лами детергента.
личение времени инкубации в детергенте повы%
Чтобы более точно оценить размеры мелких
шает эффективность растворения ТВ, на что
частиц в растворах ТВ в детергенте, крупные
указывает сдвиг кривых зависимости RH от кон%
частицы были отделены фильтрованием. Самые
центрации Ds%Na в сторону меньших концент%
мелкие частицы были обнаружены в растворах
раций детергента (рис. 5, б). При этом средний
0,08%%ного Ds%Na, средний размер 11-20 нм,
радиус популяции частиц, которая образуется
среди них в небольшом количестве присутство%
после инкубации ТВ в течение 24 ч в 0,04%%ном
вали частицы с RН 10 нм. Следовательно, в раст%
Ds%Na, для ТВ%0,4 был меньше, чем для ТВ%1, а
воре детергента rOmpF существует преимущест%
в 0,06 и 0,1%%ном Ds%Na для обоих ТВ он был
венно в олигомерной форме.
практически одинаковый, ~50 и 40 нм соответ%
Структура рекомбинантного белка, солюбили7
ственно.
зированного из ТВ. Для растворения белков из
Популяция частиц, образующаяся при раст%
ТВ использовали мочевину и Ds%Na. Условия
ворении ТВ в детергенте, достаточно гетероген%
солюбилизации были выбраны на основе дан%
на по размерам. Степень ее полидисперсности с
ных турбидиметрии и ДРС. Пространственную
увеличением концентрации детергента вначале
структуру rOmpF определяли с помощью опти%
растет (в интервале концентраций Ds%Na, в ко%
ческой спектроскопии.
тором происходит быстрое уменьшение средне%
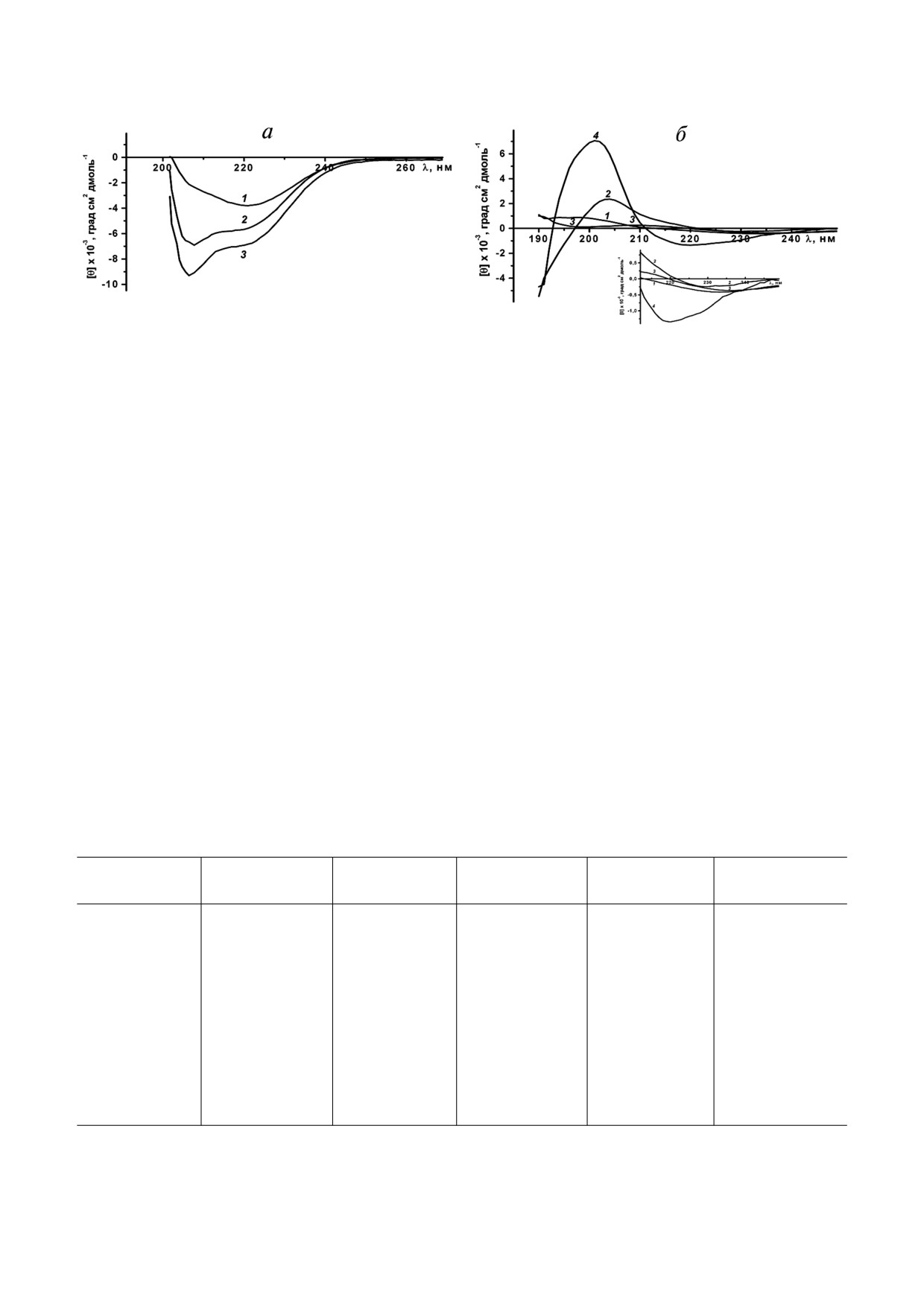
Спектры КД порина из ТВ%0,4 и ТВ%1, раст%
го размера частиц, т.е. идет интенсивное раство%
воренного в 0,04%%ном Ds%Na, в дальней УФ%об%
рение ТВ), а затем падает (при концентрациях
ласти имеют одинаковую форму с минимумом
детергента, где не наблюдается существенного
при 221 нм и разную интенсивность сигнала и
изменения размера частиц), оставаясь довольно
определяют, что в белке преобладает β%структу%
высокой: в 0,1%%ном Ds%Na величина PdI ~0,6
ра (рис. 6, а). В то же время в белке присутству%
(рис. 5, в). С увеличением выдержки ТВ в раст%
ет некоторое количество α%спирали, о чем гово%
воре детергента форма кривой зависимости PdI
рит наличие в спектре плеча при 208-210 нм.
от концентрации денатуранта сохраняется, но
Увеличение концентрации Ds%Na до 0,06% соп%
Рис. 5. Растворимость ТВ в Ds%Na. Изменение: а - мутности растворов ТВ, инкубированных в детергенте 10 мин, 5 ч, 24 ч
(ТВ%0,4) и 24 ч (ТВ%1); б - среднего гидродинамического радиуса (числового) ТВ, инкубированных 10 мин, 5 ч, 24 ч (ТВ%0,4)
и 2 ч, 24 ч (ТВ%1); в - индекса полидисперсности растворов ТВ, инкубированных 10 мин, 5 ч, 24 ч (ТВ%0,4) и 24 ч (ТВ%1)
как функции концентрации Ds%Na. ТВ%0,4: 10 мин (белый кружок), 5 ч (серый кружок), 24 ч (черный кружок); ТВ%1: 2 ч
(серый квадрат), 24 ч (черный квадрат)
БИОХИМИЯ том 84 вып. 6 2019
868
ХОМЕНКО и др.
Рис. 6. КД%спектры в дальней УФ%области rOmpF из ТВ в: a - Ds%Na (1 - 0,04%, 2 - 0,06%, 3 - 0,08%) и б - мочевине
(1 и 2 - ТВ%0,4, 4 М и 5 М мочевина, 3 и 4 - ТВ%1, 4 М и 5 М мочевина)
ровождается увеличением интенсивности полос
структуру с высоким содержанием β%структуры.
и изменением формы спектров: появляется чет%
В то же время белок из ТВ, синтезированных
ко выраженный минимум при 208 нм и плечо при
при меньшей концентрации индуктора, содер%
217 нм, характерные для конформаций α%спира%
жит больше β%структуры и меньше неупорядо%
ли и β%листа соответственно. Дальнейший рост
ченной структуры. Увеличение концентрации
концентрации детергента (до 0,08%) приводит к
детергента от 0,04 до 0,08% приводит к увеличе%
увеличению интенсивности отрицательной по%
нию доли α%спирали и падению относительного
лосы с максимумом при 207 нм, что определяет
содержания β% и неупорядоченной структуры.
увеличение относительного содержания α%струк%
Накопление α%спирали происходит, в значи%
туры. Поскольку наблюдаемые интермедиаты
тельной степени (особенно в случае ТВ%0,4), за
имеют в спектре полосу при 208 нм c большей
счет убывания β%структуры. Это позволяет
величиной эллиптичности и более выраженную,
предполагать, что этот детергент не только раст%
чем при 222 нм, можно предположить, что они
воряет белок из ТВ, но и денатурирует его. Спо%
относятся к α + β белкам [24]. В таком случае
собность Ds%Na в определенных условиях инду%
они имеют вторичную структуру, состоящую из
цировать образование α%спирали в белке была
α%спиралей и антипараллельных β%листов, ко%
показана ранее [25]. Наибольшие изменения во
торые располагаются в разных сегментах поли%
вторичной структуре белка происходят при уве%
пептидной цепи. Из спектров КД было рассчи%
личении концентрации Ds%Na от 0,04 до 0,06%.
тано содержание элементов вторичной структу%
Дальнейший рост концентрации детергента (до
ры в рекомбинантном порине (табл. 3).
0,08%) сопровождается заметно меньшим уве%
Анализ полученных данных показал, что
личением доли α%спирали в белке. Таким обра%
rOmpF из ТВ, полученных при разной концент%
зом, интермедиат порина в составе ТВ, который
рации индуктора, имеет выраженную вторичную
имеет вторичную структуру близкую к натив%
Таблица 3. Содержание элементов вторичной структуры (%) в rOmpF, растворенном в Ds%Na
Концентрация
Образец*
α%cпираль,
β%структура,
β%изгиб,
Неупорядоченная
Ds%Na, %
%
%
%
структура, %
0,04
ТВ%0,4
7,0
39,7
22,8
30,5
ТВ%0,4 (24 ч)
14,9
32,1
21,8
31,2
ТВ%1
5,6
31,3
25,9
37,2
0,06
ТВ%0,4
19,5
30,0
21,3
29,2
ТВ%0,4 (24 ч)
21.0
29.2
20.8
29,0
ТВ%1
20,3
28,6
21,2
29,9
0,08
ТВ%0,4
25,5
25,5
21,7
27,3
ТВ%1
25,0
22,9
21,6
30,5
0,06 + SB3%12
ТВ%0,4
16,6
31,1
22,3
30,0
ТВ%1
18,9
28,7
23,2
29,0
Примечание. * Время инкубации образцов в детергенте 3 ч, за исключением образцов, для которых время инкубации ука%
зано в таблице.
БИОХИМИЯ том 84 вып. 6 2019
ТВ РЕКОМБИНАНТНОГО ПОРИНА OmpF
869
ной, не стабилен и в присутствии Ds%Na денату%
мочевиной, возможно, имеет структуру нена%
рирует, приобретая конформацию более устой%
тивного β%листа.
чивую к действию детергента. В пользу этого
Низкая амплитуда спектров КД rOmpF в мо%
свидетельствует также влияние времени инкуба%
чевине и возможные искажения в положении
ции белка в растворе детергента на его конфор%
полос могут определяться присутствием в раст%
мацию. Увеличение времени выдержки от 3 до
воре белковых агрегатов, не определяемых
24 ч в 0,06%%ном Ds%Na мало влияет на структуру
КД%спектроскопией, или неравномерным расп%
белка, тогда как в тех же условиях в 0,04%%ном
ределением молекул белка в олигомерах, в виде
детергенте в порине происходят существенные
которых порин (по данным ДРС) присутствует в
конформационные изменения (табл. 3).
мочевине [27, 28]. Следует отметить, что rOmpF
Была изучена также вторичная структура
в растворах Ds%Na также образует олигомеры.
rOmpF, растворенного из ТВ%0,4 и ТВ%1 с по%
Однако спектры порина в детергенте, в отличие
мощью мочевины. Рекомбинантный порин в 4 и
от таковых в мочевине, не имеют такой низкой
5 М мочевине, имеет необычные КД%спектры в
амплитуды и сильного смещения положения от%
дальней УФ%области, которые характеризуются
рицательной полосы в длинноволновую область.
максимумом при 200 нм и выше, отрицательной
Возможно, молекулярная организация частиц
полосой при 220-235 нм и очень низкой эллип%
белка в мочевине и детергенте различна. В моче%
тичностью (рис. 6, б). Повышение концентра%
вине, вероятно, в составе олигомера могут при%
ции мочевины от 4 до 5 М сопровождается уве%
сутствовать очень плотные кластеры молекул
личением интенсивности полос (особенно в
белка, образованные за счет гидрофобных кон%
спектре rOmpF из ТВ%1) и сдвигом минимума в
тактов, которые являются причиной неравно%
сторону меньших длин волн в спектрах. Инте%
мерного распределения молекул белка в объеме
ресно отметить, что спектры, подобные спект%
частицы. При более высокой концентрации мо%
рам rOmpF в мочевине, имеют склонные к агре%
чевины содержание таких кластеров может
гации интермедиаты сывороточных альбуми%
уменьшаться, и характеристики спектров могут
нов, образованные в присутствии метилциани%
улучшаться. В детергенте, как можно предполо%
да, структуру которых авторы определили, как
жить, подобные кластеры не образуются, и оли%
ненативный β%лист [26]. Согласно данным, по%
гомерные частицы являются однородными.
лученным при расчете спектров КД, рекомбинант%
Спектры собственной суммарной и трипто%
ный порин в растворах 4-5 М мочевины отлича%
фановой флуоресценции rOmpF, растворенного
ется высоким содержанием β%структуры и по
из ТВ с помощью Ds%Na разной концентрации,
соотношению элементов вторичной структуры
отличались от спектров таковых как нативного
приближается к нативному порину, rOmpF
порина дикого типа, так и полностью разверну%
(OmpF)%: α%спираль 3,2-4,0 (4)%; β%структура
того рекомбинантного порина (табл. 4).
40,1-44,5 (48)%; β%изгиб 21-21,4 (23)%; неупо%
Максимумы спектров суммарной флуорес%
рядоченная структура 30,5-35,5 (25)%. Таким
ценции исследованных образцов рекомбинант%
образом, rOmpF, солюбилизированный из ТВ
ного порина (327-335 нм) сдвинуты в сторону
Таблица 4. Параметры спектров флуоресценции rOmpF, солюбилизированного из ТВ с помощью Ds%Na в течение 24 ч
Суммарная флуоресценция,
Триптофановая
Концентрация
Образец
(λвозб 280 нм)
флуоресценция, (λвозб 296 нм)
Ds%Na, %
λmax, нм
λmax, нм
0,04
ТВ%0,4
310, 334
332, 346
ТВ%1
311, 330
330, 341
0,06
ТВ%0,4
335
332, 343
ТВ%1
329
330, 340
0,08
ТВ%0,4
327
337
ТВ%1
327
340
0,25
OmpF порин Y. pseudotuberculosis,
322
332
нативный тример [29]
0,0
OmpF порин Y. pseudotuberculosis,
307, 348
350
развернутый мономер [23]
БИОХИМИЯ том 84 вып. 6 2019
870
ХОМЕНКО и др.
больших длин волн по сравнению с таковым на%
экспрессированных при разных концентрациях
тивного белка (322 нм), но не достигают значе%
индуктора.
ния максимума спектра развернутого белка
Как известно, КД%спектр белка в ближнем
(348 нм). При концентрации детергента 0,04% в
УФ, где доминируют ароматические остатки,
спектре rOmpF наблюдается второй максимум
чувствителен к третичной структуре. Для того,
(или плечо) при 311-312 нм, связанный с излу%
чтобы подтвердить наличие элементов третич%
чением остатков тирозина, количество которых
ной структуры в рекомбинантном белке, были
в молекуле существенно превышает число трип%
получены КД%спектры в ближней УФ%области
тофановых остатков (зрелый OmpF содержит
rOmpF (из ТВ%0,4) в 0,04%%ном Ds%Na, инкуби%
21Tyr и 3Trp). Высокая интенсивность тирози%
рованного в течение 3 и 24 ч. Для этих же образ%
новой флуоресценции, вероятно, объясняется
цов были сняты спектры КД в дальней УФ%об%
большим расстоянием между остатками тирози%
ласти и спектры флуоресценции (рис. 7).
на и близлежащими группами тушителями,
Как видно из рис. 7, б, rOmpF, выдержанный
включая остатки триптофана, на которые в на%
в 0,04%%ном Ds%Na 3 ч, имеет спектр КД в ближ%
тивном белке передается энергия от тирозина.
ней УФ%области c низкой эллиптичностью и по%
Максимумы спектров триптофановой флуо%
ложительной полосой при 283 нм, которая отно%
ресценции rOmpF по сравнению с таковым раз%
сится к остаткам тирозина. Более длительная ин%
вернутого белка были сдвинуты в сторону ко%
кубация в растворе детергента приводит к изме%
ротких длин волн. При концентрации Ds%Na 0,04
нению во вторичной структуре белка: в спектре
и 0,06% спектры порина имеют основой макси%
КД в дальней УФ%области наблюдается сдвиг ми%
мум (330-332 нм), практически совпадающий с
нимума от 220 до 206 нм (рис. 7, а). В то же время
таковым нативного белка (332 ± 1 нм), который
происходят изменения в спектре КД в ближней
принадлежит триптофанам, спрятанным внутри
УФ%области (рис. 7, б): изменяется знак спектра,
белка, и дополнительный максимум (плечо) в
происходит его сглаживание, уменьшается амп%
области более длинных волн (340-343 нм), со%
литуда сигнала, что указывает на увеличении
ответствующих излучению флуорофоров более
симметрии в окружении ароматических остатков
доступных растворителю, но не экспонирован%
в белке. Эти изменения коррелируют с измене%
ных на поверхности белка. Максимум спектра
ниями в спектрах собственной флуоресценции
rOmpF в 0,08% Ds%Na сдвинут в более длинно%
белка, которые заключаются в значительном па%
волновую область (337 и 340 нм для ТВ%0,4 и
дении интенсивности и появлении дополнитель%
ТВ%1,0 соответственно), что указывает на боль%
ных максимумов при 310 нм (суммарная флуо%
шую доступность растворителю остатков трип%
ресценция) и при 347 нм (триптофановая флуо%
тофана в молекулах и, следовательно, на умень%
ресценция) (рис. 7, в). Это свидетельствует об
шение компактности структуры белка. Спектры
увеличении расстояния между остатками тиро%
собственной флуоресценции свидетельствуют в
зина и других аминокислот в молекуле белка и
пользу того, что rOmpF, растворенный с по%
доступности остатков триптофана растворителю.
мощью Ds%Na из ТВ, имеет третичную структу%
Полученные спектральные данные указывают на
ру, но она более «рыхлая», чем нативная. Флуо%
уменьшение/потерю третичных взаимодействий
ресцентная спектроскопия не обнаруживает за%
в белке. Таким образом, в рекомбинантном по%
метных различий в третичной структуре пори%
рине, извлеченном из ТВ детергентом, присут%
нов, полученных с помощью Ds%Na из ТВ,
ствуют элементы третичной структуры.
Рис. 7. Влияние времени инкубации в 0,04%%ном Ds%Na на структуру rOmpF. а и б - Спектры КД в дальней и ближней
УФ%области; время инкубации: 1 - 3 ч, 2 - 24 ч; в - спектры собственной флуоресценции: 1 и 3 - спектры суммарной флуо%
ресценции, 2 и 4 - спектры триптофановой флуоресценции, время инкубации: 1 и 2 - 3 ч, 3 и 4 - 24 ч
БИОХИМИЯ том 84 вып. 6 2019
ТВ РЕКОМБИНАНТНОГО ПОРИНА OmpF
871
Рефолдинг rOmpF. Для формирования на%
ронние вещества [31]. Исследованные ТВ имели
тивной конформации мембранным белкам, ка%
форму близкую к сферической, шероховатую по%
ковым является порин, требуется мембранное
верхность и пористую структуру. В них присут%
окружение, которое может быть имитировано
ствовали доступные растворителю кластеры гид%
мицеллами детергента или липидными бислоя%
рофобных остатков. ТВ были хорошо раствори%
ми (липосомы, смешанные липид/детергент ли%
мы в присутствии низких концентраций Ds%Na
посомы). В связи с этим было исследовано вли%
(0,04-0,08%) и более устойчивыми к действию
яние детергента SB3%12 в концентрации выше
мочевины, по сравнению с детергентом. Их эф%
критической мицеллярной (10 мМ) и фосфоли%
фективное растворение наблюдается при высо%
пидных липосом на конформацию рекомбинант%
ких концентрациях мочевины (5 М и выше), что
ного порина, растворенного из ТВ детергентом.
сопровождается денатурацией рекомбинантно%
В присутствии мицелл цвиттерионного де%
го порина и неблагоприятно сказывается на по%
тергента SB3%12 не происходит заметных изме%
лучении функционально активного белка. Мень%
нений во вторичной структуре rOmpF из ТВ%0,4
шая стабильность ТВ в детергенте позволяет
и ТВ%1 (табл. 3).
предполагать, что гидрофобные контакты игра%
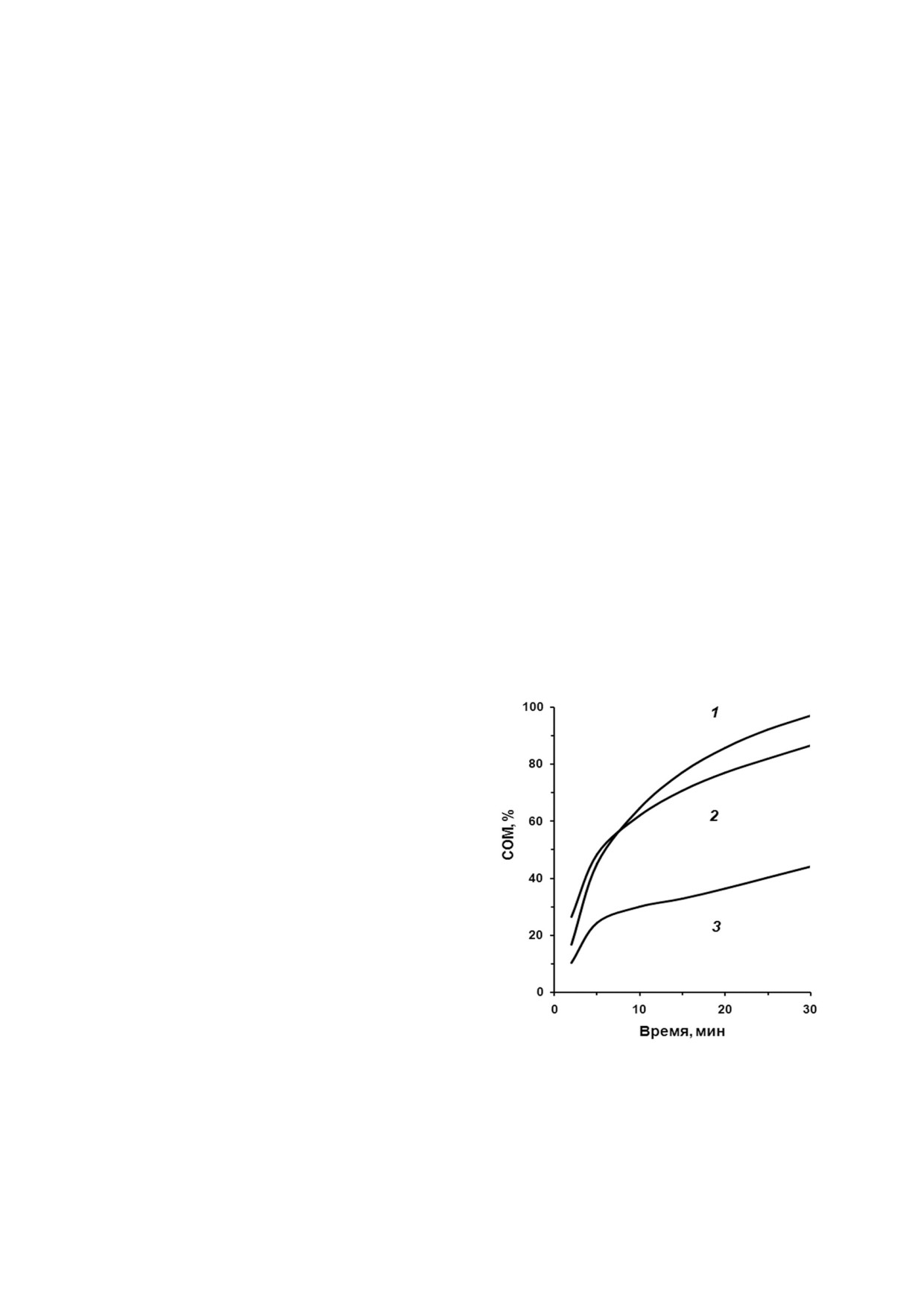
За образованием нативной структуры пори%
ют важную роль во взаимодействии между моле%
на при его взаимодействии с липосомами суди%
кулами rOmpF в составе агрегата. Растворение
ли по его функциональной активности. Для оп%
ТВ в обоих денатуратах приводит к образованию
ределения поровой активности рекомбинант%
гетерогенной по размеру популяции олигомер%
ного порина использовали метод вытекания
ных частиц. ТВ содержат интермедиат rOmpF c
флуоресцентной метки из отрицательно заря%
хорошо выраженной вторичной структурой,
женных липосом. Добавление rOmpF из ТВ%0,4,
близкой к нативной, и с элементами третичной
растворенного в 0,04 и 0,06%%ном Ds%Na, к ли%
структуры, который способен встраиваться в
посомам сопровождалось заметным увеличени%
липидный бислой, приобретая при этом функ%
ем интенсивности флуоресценции, что указы%
ционально активную конформацию. Таким об%
вало на наличие у белка порообразующей ак%
разом, ренатурация порина происходит без
тивности (рис. 8). При этом rOmpF, солюбили%
предварительного полного разворачивания мо%
зированный при более низкой концентрации
лекулы под действием хаотропных агентов, как
детергента, имел заметно более высокую актив%
того требуют действующие на сегодняшний день
ность, сравнимую с таковой нативного порина.
протоколы. Однако этот интермедиат порина со
Наблюдаемые различия в активности, очевид%
структурой β%листа не стабилен и легко денату%
но, связаны с тем, что rOmpF в более концент%
рированных растворах детергента имеет струк%
туру более денатурированную (часть молекул
порина может имеет необратимо денатуриро%
ванную структуру) и поэтому хуже поддающую%
ся ренатурации.
ТВ часто образуются при экспрессии гетеро%
логичных мембранных белков в бактериальных
штаммах%продуцентах. В случае rOmpF образо%
вание ТВ, помимо природы белка, определяется
отсутствием сигнальной последовательности,
обеспечивающей перенос белка через цитоплаз%
матическую мембрану E. coli. Агрегация белка в
ТВ представляет собой высоко специфичный
процесс: молекулы белка могут агрегировать
только с другими молекулами того же самого
или высоко родственного белка [30]. Это объяс%
няет тот факт, что ТВ, образованные rOmpF,
удалось освободить от сопутствующих примесей
простой обработкой ферментами и мягкими де%
тергентами, и тем самым избежать дополнитель%
ных процедур очистки на стадии изолированно%
Рис. 8. Кинетика освобождения КФ из липосом: 1 - OmpF
Y. pseudotuberculosis, 2 - и 3 - rOmpF, растворенный из ТВ%0,4
го рекомбинантного белка. Получению высоко%
с помощью 0,04%%ного и 0,06%%ного Ds%Na соответственно.
очищенных ТВ порина также способствовал
Порины были выдержаны с суспензией липосом при 25 °С.
большой размер ТВ, что уменьшает площадь по%
Ось ординат: СОМ, % - процент специфического осво%
верхности, на которой абсорбируются посто%
бождения КФ
БИОХИМИЯ том 84 вып. 6 2019
872
ХОМЕНКО и др.
рирует в присутствии детергента. В результате
жание амилоидных структур и увеличивается
он приобретает новую конформацию, которая
содержание α%спирали в рекомбинантном по%
отличается более высоким содержанием α%спи%
рине.
рали и менее эффективно способна перестраи%
Результаты, полученные в ходе выполнения
ваться в нативную при встраивании в мембрану.
данной работы, вносят вклад в понимание
В связи с этим защита интермедиатов с близкой
структурной организации и механизма образо%
к нативной структурой от денатурации при их
вания ТВ и в развитие новых подходов для полу%
выделении из ТВ является одной из ключевых
чения активных белков из ТВ, а также ТВ, обла%
задач при разработке новых эффективных мето%
дающих биологической и функциональной ак%
дов подходов для получения функционально ак%
тивностью.
тивных поринов. Не менее важной задачей на
этом пути является увеличение содержания в ТВ
корректно свернутого рекомбинантного белка и
Финансирование. Работа выполнена при фи%
связанного с этим увеличения растворимости
нансовой поддержке Российского фонда фунда%
ТВ в присутствии хаотропных веществ и детер%
ментальных исследований (16%08%00679 и 19%03%
гентов.
00318).
Исследованные ТВ, которые образуются при
Конфликт интересов. Авторы заявляют об от%
разной концентрации индуктора и температуре
сутствии конфликта интересов.
роста клеток 37 °С, существенно не различаются
Соблюдение этических норм. Настоящая
между собой по свойствам и структуре. Однако
статья не содержит описания каких%либо иссле%
следует отметить, что с увеличением концентра%
дований с использованием людей или животных
ции индуктора в ТВ несколько возрастает содер%
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Gonzalez%Montalban, N., Natalello, A., Garcia%Fruitos, E.,
9. Хоменко В.А., Портнягина О.Ю., Новикова О.Д.,
Villaverde, A., and Doglia, S.M. (2008) In situ protein
Исаева М.П., Ким Н.Ю., Лихацкая Г.Н., Вострикова О.П.,
folding and activation in bacterial inclusion bodies,
Соловьева Т.Ф. (2008) Выделение и характеристика
Biotechnol. Bioeng., 100, 797-802, doi: 10.1002/bit.2179.
рекомбинантного OmpF%подобного порина из наруж%
2.
Gatti%Lafranconi, P., Natalello, A., Ami, D., Doglia, S.M.,
ной мембраны Yersinia pseudotuberculosis, Биоорган. хи*
and Lotti, M. (2011) Concepts and tools to exploit the
мия, 34, 177-184.
potential of bacterial inclusion bodies in protein science and
10. Lugtenberg, B., Meijers, J., Peters, R., van der Hoek, P.,
biotechnology, FEBS J., 278, 2408-2418, doi: 10.1111/j.
and van Alphen, L. (1975) Electrophoretic resolution of
1742%4658.2011.08163.x.
the «major outer membrane protein» of E. coli K12 into
3.
Jevsevar, S., Gaberc%Porekar, V., Fonda, I., Podobnik, B.,
four bands, FEBS Lett., 58, 254-258, doi: 10.1016/0014%
Grdadolnik, J., and Menart, V. (2005) Production of non%
5793(75)80272%9.
classical inclusion bodies from which correctly folded pro%
11. Бахолдина С.И., Сидорин Е.В., Хоменко В.А., Иса%
tein can be extracted, Biotechnol. Prog., 21, 632-639, doi: 10.
ева М.П., Ким Н.Ю., Быстрицкая Е.П., Пименова Е.А.,
1021/bp0497839.
Соловьева Т.Ф. (2018) Влияние условий экспрессии
4.
Peternel, S., Grdadolnik, J., Gaberc%Porekar, V., and
рекомбинантной фосфолипазы А1 из наружной мемб%
Komel, R. (2008) Engineering inclusion bodies for non%
раны Yersinia pseudotuberculosis на структуру и свойства
denaturing extraction of functional proteins, Microb. Cell
телец включения, Биоорган. химия, 44, 163-174, doi: 10.
Fact., 7, 34, doi: 10.1186/1475%2859%7%34.
7868/S0132342318020070.
5.
Новикова О.Д., Соловьева Т.Ф. (2009) Неспецифичес%
12. Klunk, W.E., Pettegrew, J.W., and Abraham, D.J. (1989)
кие порины наружной мембраны грамотрицательных
Quantitative evaluation of Congo Red binding to amyloid%
бактерий: структура и свойства, Биол. Мем., 26, 1, 6-20.
like proteins with a beta%pleated sheet conformation, J. His*
6.
Galdiero, S., Falanga, A., Cantisani, M., Tarallo, R., Della
tochem. Cytochem., 37, 1273-1281, doi: 10.1177/37.8.2666510.
Pepa, M.E., D’Oriano, V., and Galdiero, M. (2012)
13. Provencher, S.W., and Glockner, J. (1981) Estimation of
Microbe%host interactions: structure and role of gram%nega%
globular protein secondary structure from circular dichro%
tive bacterial porins, Curr. Protein. Pept. Sci., 13, 843-854,
ism, Biochemistry, 20, 34-37, doi: 10.1021/bi00504a006.
doi: 10.2174/138920312804871120.
14. Diwu, Z., Lu, Y., Zhang, C., Klaubert, D.H., and
7.
Majd, S., Yusko, E.C., Billeh, Y.N., Macrae, M.X., Yang, J.,
Haugland, R.P. (1997) Fluorescent molecular probes. II.
and Mayer, M. (2010) Applications of biological pores in
The synthesis, spectral properties and use of fluorescent
nanomedicine, sensing, and nanoelectronics, Curr. Opin.
solvatochromic dapoxylm dyes, Photochem. and Photobiol.,
Biotechnol., 21, 439-447, doi: 10.1016/j.copbio.2010.
66, 424-431, doi: 10.1111/j.1751%1097.1997.tb03168.x.
05.002.
15. Faudry, E., Perdu, C., and Attree, I. (2013) in Bacterial cell
8.
Gupta, A., Ramasubramanian Iyer, B., Chaturvedi, D.,
surfaces: methods and protocols (Delcour A.H. ed.), Humana
Maurya, S.R., and Mahalakshmi, R. (2015) Thermody%
Press, N.Y., pp. 173-185.
namic, structural and functional properties of membrane
16. Villa, R., Lotti, M., and Gatti%Lafranconi, P.
(2009)
protein inclusion bodies are analogous to purified counter%
Components of the E. coli envelope are affected by and
parts: case study from bacteria and humans, RSC Adv., 5,
react to protein over%production in the cytoplasm, Microb.
1227-1234, doi: 10.1039/C4RA11207E.
Cell Fact., 8, 32, doi: 10.1186/1475%2859%8%32.
БИОХИМИЯ том 84 вып. 6 2019
ТВ РЕКОМБИНАНТНОГО ПОРИНА OmpF
873
17. Hawe, A., Sutter, M., and Jiskoot, W. (2008) Extrinsic fluores%
25. Montserret, R., McLeish, M.J., Bockmann, A., Geourjon, C.,
cent dyes as tools for protein characterization, Pharmaceuti*
and Penin, F. (2000) Involvement of electrostatic interac%
cal Res., 25, 7, 1487-1499, doi: 10.1007/s11095%007%9516%9.
tions in the mechanism of peptide folding induced by sodi%
18. Semisotnov, G.V., Rodionova, N.A., Razgulyaev, O.I.,
um dodecyl sulfate binding, Biochemistry, 39, 8362-8373,
Uversky, V.N., Gripas, A.F., and Gilmanshin, R.I. (1991)
doi: 10.1021/bi000208x.
Study of the «molten globule» intermediate state in protein
26. Sen, P., Fatima, S., Khan, J.M., and Khan, R.H. (2009)
folding by a hydrophobic fluorescent probe, Biopolymers,
How methyl cyanide induces aggregation in all%alpha pro%
31,119%128, doi: 10.1002/bip.360310111.
teins a case study in four albumins, Intern. J. Biol. Macro*
19. Cano%Garrido, O., Rodriguez%Carmona, E., Diez%Gil, C.,
mol., 44, 163-169, doi: 10.1016/j.ijbiomac.2008.11.008.
Vazquez, E., Elizondo, E., Cubarsi, R., Seras%Franzoso, J.,
27. Ioannou, J.C., Donald, A.M., and Tromp, R.H. (2015)
Corchero, J.L., Rinas, U., Rater, I., Ventosa, N., Veciana, J.,
Characterizing the secondary structure changes occurring
Villaverde, A., and Garcia%Fruitos, E. (2013) Supramole%
in high density systems of BLG dissolved in aqueous pH 3
cular organization of protein%releasing functional amyloids
buffer, Food Hydrocolloids, 46, 216-225, doi: 10.1016/j.
solved in bacterial inclusion bodies, Acta Biomater., 9, 4,
foodhyd.2014.12.027.
6134-6142, doi: 10.1016/j.actbio.2012.11.033.
28. Miles, A.J., and Wallace, B.A. (2016) Circular dichroism
20. Carrio, М.М., and Villaverde, A. (2001) Protein aggrega%
spectroscopy of membrane proteins, Chem. Soc. Rev., 45,
tion as bacterial inclusion bodies is reversible, FEBS Lett.,
4859-4872, doi: 10.1039/c5cs00084j.
489, 1, 29-33, doi: 10.1016/S0014%5793(01)02073%7.
29. Ким Н.Ю., Новикова О.Д., Хоменко В.А., Лихацкая Г.Н.,
21. Randolph, T.W., Seefeldt, M., and Carpenter, J.F. (2002)
Вострикова О.П., Емельяненко В.И., Кузнецова С.М.,
High hydrostatic pressure as tool to study protein aggrega%
Соловьева Т.Ф. (2007) Влияние рН на структуру и
tion and amyloidosis, Biochim. Biophys. Acta, 1595,
функциональную активность порина из наружной
224-234, doi: 10.1016/S0167%4838(01)00346%6.
мембраны Yersinia pseudotuberculosis. 1. Функционально
22. Peternel, S., Jevsevar, S., Bele, M., Gaberc%Porekar, V.,
значимые конформационные переходы иерсинина,
and Menart, V. (2008) New properties of inclusion bodies
Биол. мембраны, 24, 150-158.
with implications for biotechnology, Biotechnol. Appl.
30. Speed, M.A., Wang, D.I., and King, J. (1996) Specific
Biochem., 49, 239-246, doi: 10.1042/BA20070140.
aggregation of partially folded polypeptide chains: the mole%
23. Sidorin, E.V., Khomenko, V.A., Kim, N.Y., Dmitrenok, P.S.,
cular basis of inclusion body composition, Nat. Biotechnol.,
Stenkova, A.M., Novikova, O.D., and Solov’eva, T.F.
14, 1283-1287, doi: 10.1038/nbt1096%1283.
(2017) Self%organization of recombinant membrane porin
31. Wurm, D.J., Quehenberger, J., Mildner, J., Eggenreich, B.,
OmpF from Yersinia pseudotuberculosis in aqueous envi%
Slouka, C., Schwaighofer, A., Wieland, K., Lendl, B.,
ronments, Biochemistry (Moscow), 82, 1304-1313, doi: 10.
Rajamanickam, V., Herwig, C., and Spadiut, O. (2018)
1134/S0006297917110086.
Teaching an old pET new tricks: tuning of inclusion body
24. Manavalan, P., and Johnson, W.C. (1983) Sensitivity of
formation and properties by a mixed feed system in E. coli,
circular dichroism to protein tertiary structure class,
Appl. Microbiol. Biotechnol., 102, 667-676, doi: 10.1007/
Nature, 305, 831-832, doi: 10.1038/305831a0.
s00253%017%8641%6.
INCLUSION BODIES OF RECOMBINANT PORIN OmpF
OF Yersinia pseudotuberculosis: THEIR PROPERTIES
AND STRUCTURAL CHARACTERIZATION
V. A. Khomenko, E. V. Sidorin, S. I. Bakholdina, G. A. Naberezhnykh, N. U. Kim,
A. M. Stenkova, N. U. Chernysheva, M. P. Isaeva, and T. F. Solov’eva*
Elyakov Pacific Institute of Bioorganic Chemistry, Far*Eastern Branch
of the Russian Academy of Sciences, 690022 Vladivostok, Russia; E*mail: soltaf@mail.ru
Received December 14, 2018
Revised March 27, 2019
Accepted March 27, 2019
Mature pore%forming protein OmpF from the outer membrane of Yersinia pseudotuberculosis was expressed in
Escherichia coli as inclusion bodies (IBs) under different culture conditions. Using electron microscopy, dynamic light
scattering, optical spectroscopy, and specific hydrophobic dyes, the properties and structural organization of IBs as
well as the structure of the recombinant porin (rOmpF) solubilized from IBs were investigated. The IB sizes, shape
and stability in denaturant solutions have been determined. It was shown that IBs were well soluble in SDS and more
resistant to urea. The dissolution of IBs in both denaturants led to the formation of a heterogeneous in size popula%
tion of oligomeric particles. It was found that IBs contained the intermediate of rOmpF with native%like secondary
structure and elements of the tertiary structure, which was able to penetrate the lipid bilayer and adopt the functionally
active conformation. There were no significant differences in properties and structure between studied IBs formed at
different concentrations of the inducer IPTG. Noteworthy, the increase in concentration of the inducer was accom%
panied by the increase in content of amyloids in IBs, thus decreasing the yield of the recombinant protein. The results
obtained contribute to the development of new approaches for the production of active proteins from IBs, as well as
of biologically and functionally active IBs.
Keywords: Yersinia pseudotuberculosis, inclusion bodies, recombinant OmpF porin, dynamic light scattering, electron
microscopy, CD spectroscopy, fluorescence spectroscopy
9 БИОХИМИЯ том 84 вып. 6 2019