БИОХИМИЯ, 2019, том 84, вып. 7, с. 912 - 922
УДК 57.085.23
ТЕСТ СИСТЕМА ДЛЯ ОЦЕНКИ ФУНКЦИОНАЛЬНОЙ
АКТИВНОСТИ АНТИТЕЛ ПРОТИВ PD 1 И PD L1,
ОСНОВАННАЯ НА ИСПОЛЬЗОВАНИИ БИСПЕЦИФИЧЕСКИХ
АНТИ CD3/АНТИ TAA АНТИТЕЛ
© 2019 А.Н. Доронин1,2, А.А. Гордеев1,2, А.Е. Козлов1, Я.А. Смирнова1,
М.Ю. Пучкова1,2, В.М. Екимова1, Ю.И. Басовский1,2, В.В. Соловьев1,2*
1 BIOCAD, 142380 Любучаны, Россия;
электронная почта: solovyevvv@biocad.ru
2 Пущинский государственный естественно'научный институт,
142290 Пущино, Россия
Поступила в редакцию 22.02.2019
После доработки 17.04.2019
Принята к публикации 18.04.2019
Использование ингибиторов взаимодействия PD 1/PD L1 называют революцией в терапии онкологичес
ких заболеваний. На 2018 год более 100 антител против PD 1 и PD L1 находятся на различных этапах раз
работки, зарегистрированы более 2000 клинических исследований с их применением. Характеризация та
ких антител требует использования тест системы, позволяющей определять их биологическую активность.
Работа посвящена созданию клеточного теста для анализа активности антител против PD 1 и PD L1. Мы
рассмотрели и сравнили несколько подходов для создания репортерной системы на основе двух клеточных
линий с использованием суперантигенов, растворимых анти CD3 антител, трансмембранных анти CD3
антител, химерных антигенных рецепторов (CAR) и биспецифических анти CD3/анти TAA антител. По ре
зультатам экспериментов было предложено использовать систему на основе биспецифических анти
CD3/анти TAA антител, имеющую преимущества перед другими исследованными подходами. Тест систе
ма была охарактеризована, а также показана возможность ее использования для тестирования препаратов
антител против PD 1 и PD L1. Предложенная система может быть полезной при разработке новых терапев
тических агентов и способов их тестирования.
КЛЮЧЕВЫЕ СЛОВА: функциональный клеточный тест, PD 1, PD L1, анти CD3/анти TAA.
DOI: 10.1134/S0320972519070030
Рецептор запрограммированной клеточной
сигнальные каскады, на которые он влияет, но
смерти 1 (PD 1) - белок, присутствующий пре
последовательность молекулярных взаимодей
имущественно на активированных T лимфоци
ствий, определяющих его активность, четко не
тах. Взаимодействие PD 1+ лимфоцитов с клет
определена [4, 5]. Такой механизм ингибирова
ками, несущими его природные лиганды PD L1
ния иммунного ответа служит защитой от чрез
или PD L2 (лиганды рецептора запрограммиро
мерной активации Т лимфоцитов и развития
ванной клеточной смерти 1 и 2), блокирует ак
аутоиммунных реакций, но в то же время может
тивацию лимфоцитов [1, 2]. Это происходит
препятствовать развитию иммунного ответа на
вследствие образования комплекса PD 1 со сво
опухолевые клетки [6].
им лигандом, что вызывает ингибирование
Блокирование взаимодействия PD 1/PD L1,
CD3 зависимой активации Т клетки [3]. Извест
но не PD 1/PD L2 с целью отмены негативной
ны белки, с которыми взаимодействует PD 1, и
иммунной регуляции является одной из наибо
Принятые сокращения: PD 1 - рецептор запрограммированной клеточной смерти 1; PD L1 и PD L2 - лиганды
рецептора запрограммированной клеточной смерти 1; TCR - T клеточный рецептор; FLuc - люцифераза светлячка;
IL 2 - интерлейкин 2; NFAT - ядерный фактор активированных T лимфоцитов; scFv - одноцепочечный вариабельный
фрагмент; GFP - зеленый флуоресцентный белок; tmaCD3 - трансмембранные антитела против CD3; CTLA4 - цитоток
сический Т лимфоцит ассоциированный белок 4; HER2 - рецептор эпидермального фактора роста человека 2; NF κB -
ядерный фактор энхансера легкой цепи активированных B лимфоцитов; MHC - главный комплекс гистосовместимос
ти; CAR - химерный антигенный рецептор; CAR T - Т клетки, презентирующие химерные антигенные рецепторы;
TAA - опухоль ассоциированный антиген человека 1; SEB - стафилококковый энтеротоксин Б; NFAT TRE - тран
скрипционный регуляторный элемент NFAT; EC50 - полуэффективная концентрация.
* Адресат для корреспонденции.
912
АНАЛИЗ АКТИВНОСТИ ИНГИБИТОРОВ PD 1/PD L1
913
лее успешных стратегий борьбы с рядом онко
контаминации микоплазмами набором VenorTM
логических заболеваний [6-9]. За открытие и
GeM Mycoplasma Detection Kit, PCR based
исследование рецептора PD 1 в
2018 году
(«Sigma Aldrich», США).
японский ученый T. Honjo стал лауреатом Нобе
Создание генетических конструкций. Плазмид
левском премии по физиологии или медицине
ный вектор pOGI_NFAT FLuc создан на основе
за «открытие терапии онкологических заболева
вектора pOGI («BIOCAD», Россия), он содержит
ний путем ингибирования негативной иммун
ген, кодирующий люциферазу светляка Photinus
ной регуляции» [1, 8, 10]. В 2014 году были заре
pyralis (FLuc), под контролем минимального
гистрированы первые терапевтические антитела
промотора интерлейкина 2 (IL 2), содержащего
против PD 1, в 2016 - против PD L1 [11]. К кон
3 копии последовательностей, связывающих
цу 2018 года зарегистрировано >2000 клиничес
ядерный фактор активированных T лимфоци
ких исследований препаратов, блокирующих
тов (NFAT), а также экспрессионную кассету с
взаимодействие PD 1/PD L1 [12].
геном устойчивости к гигромицину [14, 15].
Для характеризации терапевтических препа
Плазмидные вектора pSX_tmaCD3, pSX_PD 1
ратов необходим метод определения их биоло
и pSX_PD L1 созданы на основе вектора pSX
гической активности. Такой метод, в идеале,
(«BIOCAD», Россия). pSX_tmaCD3 содержит
должен отражать механизм действия и позво
ген, кодирующий антитело OKT3 в формате од
лять количественно сравнивать препараты меж
ноцепочечного вариабельного фрагмента (scFv),
ду собой [13]. Известные на сегодня подходы
слитое с трансмембранным доменом рецептора
либо ограничены патентами, либо основаны на
тромбоцитарного фактора роста, под контролем
использовании первичных клеток человека, что
цитомегаловирусного (CMV) промотора, а так
делает их неудобными и плохо воспроизводи
же экспрессионную кассету с геном устойчивос
мыми. Поэтому целью данной работы стала раз
ти к пуромицину. pSX_PD 1 содержит ген, ко
работка оригинальной системы тестирования
дирующий PD 1 человека, под контролем CMV
антител к PD 1 и PD L1, лишенной указанных
промотора, а также экспрессионную кассету с
недостатков.
геном устойчивости к генетицину (неомицину).
pSX_PD L1 содержит ген, кодирующий PD L1
человека, под контролем CMV промотора, а так
МЕТОДЫ ИССЛЕДОВАНИЯ
же экспрессионную кассету с геном устойчивос
ти к генетицину (неомицину).
Материалы. В работе использовали реакти
Создание стабильных клеточных линий. Кле
вы: среды DMEM/F12 и RPMI 1640 («ПанЭко»,
точную линию Jurkat NFAT FLuc создали путем
Россия); инактивированная эмбриональная
электропорации клеток Jurkat вектором pOGI_
бычья сыворотка («Gibco», США); классиче
NFAT FLuc с последующей селекцией клеток на
ские моноклональные антитела против PD 1 че
гигромицине Б. Из них отобрали резистентные
ловека (aPD 1), PD L1 человека (aPD L1), ци
клоны, показавшие максимальное увеличение
тотоксического Т лимфоцит ассоциированного
экспрессии люциферазы при добавлении aCD3.
белка 4 (CTLA4) человека (aCTLA4), рецептора
Клеточную линию Jurkat NFAT FLuc PD 1
эпидермального фактора роста человека 2 (HER2)
создали электропорацией клеток Jurkat NFAT FLuc
(aHER2), биспецифические моноклональные
вектором pSX_PD 1 с последующей селекцией
антитела против CD3 человека и опухоль ассо
на генетицине. Целевые клоны отбирали по
циированного антигена человека 1 (aCD3/aTAA1)
максимальному содержанию PD 1 на поверх
и 2 (aCD3/aTAA2) («BIOCAD», Россия); мыши
ности клеток, которое определяли с помощью
ные моноклональные антитела против CD3 че
проточного цитофлуориметра Guava
12HT
ловека, клон HIT3a («BD», США); набор для де
(«Millipore», США) после окрашивания клеток
текции активности люциферазы ONE Glo
aPD 1.
(«Promega», США); стафилококковый энтеро
Клеточную линию Raji PD L1 создали элект
токсин Б (SEB) («Toxin Technology», США).
ропорацией клеток Raji вектором pSX_PD L1 с
Клеточные линии. Клетки Jurkat, Raji и CHO K1
последующей селекцией на генетицине. Целе
культивировали при 37 °С в атмосфере с 5% CO2
вые клоны отбирали по максимальному содер
в соответствующей питательной среде с добав
жанию PD L1 на поверхности клеток, которое
лением 10% эмбриональной бычьей сыворотки,
определяли методом проточной цитофлуори
в случае клеток Jurkat, Raji - в среде RPMI 1640,
метрии после окрашивания клеток aPD L1.
в случае CHO K1 - в среде DMEM/F12. Все
Клеточную линию Jurkat NFAT FLuc PD 1
клеточные линии, использованные для инжене
CAR создали трансдукцией клеток Jurkat NFAT
рии, а также полученные на их основе репортер
FLuc PD 1 лентивирусными частицами, коди
ные линии, были протестированы на отсутствие
рующими химерный антигенный рецептор
БИОХИМИЯ том 84 вып. 7 2019
914
ДОРОНИН и др.
(CAR), соединенный пептидным линкером T2A
Аппроксимацию и построение графиков
с зеленым флуоресцентным белком (GFP)
проводили в программном пакете SigmaPlot,
(«BIOCAD», Россия). Пул клеток анализирова
(SYSTAT Software). Из аппроксимирующего
ли на наличие GFP позитивных клеток методом
уравнения кривой определяли параметр полу
проточной цитофлуориметрии.
эффективной концентрации (EC50). Измерения
Клеточную линию CHO PD L1 tmaCD3 соз
всех экспериментальных точек проводили как
дали трансфекцией клеток CHO K1 вектором
минимум в двух повторах. Точки, приведенные
pSX_PD L1 и pSX_tmaCD3 с последующей се
на рисунках, соответствуют среднему значению
лекцией на генетицине и пуромицине. Клоны
по всем повторам, планки погрешностей, при
скринировали с помощью флуоресцентно ме
веденные на рисунках, - значениям стандарт
ченных антител против PD L1 и Fc фрагмента
ного отклонения для соответствующих повто
антител человека методом проточной цитофлуо
ров.
риметрии. Целевые клоны отбирали по макси
Исследование стабильности образцов aPD 1 и
мальному содержанию PD L1 и трансмембран
aPD L1. По 50 мкл исходных растворов aPD 1 и
ных aCD3 (tmaCD3) на поверхности клеток, ко
aPD L1 (c концентрацией 25 мг/мл) инкубиро
торое определяли методом проточной цитофлуо
вали в микропробирках объемом 200 мкл в
риметрии окрашиванием клеток aPD L1 и анти
ПЦР амплификаторе («Bio Rad», США) в тече
телами против Fc фрагмента антител человека.
ние 1 ч при указанных температурах. Исследова
Функциональные тесты. Тесты проводили в
ние проводили как описано в разделе «Функцио
белых культуральных 96 луночных планшетах
нальные тесты».
для работы с люминесценцией («SPL Life Scien
Исследование линейного диапазона тест сис
ces», Республика Корея). Если не указано дру
темы. Для сравнения ожидаемой и эксперимен
гое, суспензия содержала 50 000 клеток Jurkat
тально определенной активности aPD 1 и
NFAT FLuc PD 1 и 25 000 клеток Raji PDL1 на
aPD L1 готовили разведения данных препара
лунку и aCD3/aTAA1 в концентрации 1 нг/мл.
тов в концентрациях 200, 140, 70 и 50% относи
В случае замены клеток Jurkat NFAT FLuc PD 1
тельно концентрации стандартного образца,
клетками Jurkat NFAT FLuc PD 1 CAR их коли
максимальная конечная концентрация которо
чество также составляло 50 000 клеток на лунку.
го в тесте составляла 100 мкг/мл, его активность
В случае замены клеток Raji PD L1 клетками
принимали за 100%. Исследование проводили,
Raji, либо CHO PD L1 tmaCD3, их количество
как описано в разделе «Функциональные тес
также составляло 25 000 клеток на лунку. Конеч
ты». Экспериментально определенную актив
ный объем клеточной суспензии в лунке состав
ность рассчитывали, как отношение экспери
лял 100 мкл, все компоненты суспензии готови
ментально определенной EC50 стандарта к экс
ли в среде RPMI 1640, содержащей 10% эмбрио
периментально определенной EC50 для данной
нальной бычьей сыворотки. После добавления
концентрации, умноженное на 100%.
всех компонентов планшеты инкубировали в те
чение 16 ч при 37 °С в атмосфере с 5% CO2, да
лее измеряли интенсивность люминесценции в
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
лунках с использованием набора ONE Glo и
планшетного ридера SPARK 20M («Tecan»,
Создание клеточных линий. Для функцио
Швейцария).
нальных клеточных тестов предпочтительно ис
Обработка данных. Для построения кривых
пользование иммортализованных клеточных
зависимости величины активации клеток от
линий, позволяющих избежать проблем с точ
концентрации указанного в эксперименте анти
ностью и воспроизводимостью результатов,
тела использовали 4 х параметрическую логис
присущих методам анализа c использованием
тическую аппроксимирующую функцию. Урав
первичных клеток [16]. Также это позволяет при
нение функции выглядит следующим образом:
помощи методов генной и клеточной инжене
рии создавать клетки с необходимым феноти
пом.
Система для анализа биологической актив
ности aPD 1 или aPD L1 должна состоять из
эффекторных PD 1+ клеток и PD L1. Функция
PD 1 опосредованного ингибирования CD3 за
где x - концентрация антитела, в нг/мл; max -
висимой активации подразумевает, что эффек
верхняя асимптота; min - нижняя асимптота;
торная клеточная линия должна иметь функцио
Hillslope - параметр кривизны; EC50 - значение
нальный CD3 комплекс на поверхности. Для
полуэффективной концентрации, в нг/мл.
оценки уровня CD3 зависимой активации и
БИОХИМИЯ том 84 вып. 7 2019
АНАЛИЗ АКТИВНОСТИ ИНГИБИТОРОВ PD 1/PD L1
915
степени ее ингибирования удобно использовать
Были созданы также две PD L1+ клеточные
репортерную систему, например, на основе ис
линии - Raji PD L1 и CHO PD L1 tmaCD3.
пользования фермента люциферазы. PD 1 при
Выбор способа активации эффекторных клеток.
взаимодействии с PD L1 способен подавлять
Помимо эффекторных клеток тест система долж
NFAT и NF κB (ядерный фактор энхансера лег
на включать в себя PD L1 и активатор CD3. На
кой цепи активированных B лимфоцитов) сиг
иболее физиологичным является использование
нальные каскады, активируемые CD3 [17]. Ис
PD L1+ клеток в качестве носителя PD L1.
пользование NFAT сигнального пути предпоч
Мы рассмотрели несколько вариантов акти
тительнее, т.к. NF κB сигнальный путь имеет
вации CD3, которые могут быть использованы в
множество других способов активации, т.е. яв
тест системе (рис. 1):
ляется менее специфичным маркером CD3 за
1. Взаимодействие T клеточного рецептора
висимой активации [18-20].
(TCR) со специфичным ему комплексом пептида и
Предъявленным требованиям удовлетворяет
главного комплекса гистосовместимости (MHC)
человеческая клеточная линия Т клеточного
является способом активации, наиболее близким к
происхождения Jurkat, которая более 30 лет ус
природному механизму действия (рис. 1, а) [23].
пешно используется в исследовании процессов
2. Суперантигены способны одновременно свя
CD3 зависимой активации [21, 22]. На ее осно
зывать β цепь TCR с MHC класса 2 (MHC II),
ве в рамках данной работы создали стабильную
что имитирует узнавание TCR комплекса MHC/
клеточную линию Jurkat NFAT FLuc PD 1,
пептид (рис. 1, б) [24]. В качестве примера супер
экспрессирующую ген, кодирующий PD 1, и со
антигена в работе использовали SEB.
держащую в геноме репортерный ген, кодирую
3. Растворимые активирующие антитела
щий люциферазу светляка под контролем
против CD3ε наиболее часто используют для ак
NFAT чувствительного промотора.
тивации CD3 (рис. 1, в) [25].
Рис. 1. Способы активации CD3 для системы тестирования ингибиторов взаимодействия PD 1/PD L1. а - Эффекторная
клетка имеет TCR, специфичный к комплексу пептид/MHC клетки мишени. Их взаимодействие приводит к CD3 зави
симой активации эффекторной клетки. б - Суперантиген связывает TCR эффекторной клетки и MHC II антигенпрезен
тирующей клетки, имитируя взаимодействие TCR/MHC. в - Растворимые aCD3ε при взаимодействии с CD3 эффектор
ной клетки вызывают ее CD3 зависимую активацию. г - Трансмембранные aCD3ε, представленные на клетке активато
ре, при контакте с эффекторной клеткой взаимодействуют с CD3 эффекторных клеток и вызывают в их CD3 зависимую
активацию. д - В эффекторной клетке, имеющей CAR против TAA, содержащий сигнальный домен CD3ζ, при контакте
с TAA+ клеткой мишенью активируются CD3 зависимые сигнальные каскады. е - При контакте клетки мишени с эф
фекторной клеткой связанное с TAA биспецифическое антитело против CD3 и TAA связывается с CD3 эффекторной
клетки, что приводит к ее CD3 зависимой активации.
biokhsm/
БИОХИМИЯ том 84 вып. 7 2019
916
ДОРОНИН и др.
4. Трансмембранные антитела против CD3ε,
пают биспецифическим антителам по абсолют
представленные на клетках мишенях, обычно
ной и относительной активации и не рассматри
используют в описанных тест системах для
вались в дальнейших исследованиях. Также су
aPD 1 и aPD L1 (рис. 1, г) [17, 26-28].
перантигены являются токсинами, что делает их
5. CAR+ эффекторные клетки могут оказать
использование нежелательным, если есть аль
ся интересной альтернативой для тестирования
тернативные варианты [34].
aPD 1 и aPD L1. Внутриклеточная часть CAR
Интересно, что добавление клеток Raji в
обычно включает в себя сигнальный домен
систему, включающую в себя только эффектор
CD3ζ, который обеспечивает активацию сиг
ные клетки и растворимые aCD3, повышает
нальных каскадов, аналогично полноразмерно
уровень экспрессии гена люциферазы в эффек
му CD3 комплексу (рис. 1, д) [29, 30]. Есть сооб
торных клетках. Это может быть связано с по
щения об усилении эффекта CAR T терапии
вышением активации с помощью aCD3 за счет
при ее совмещении с блокаторами PD 1/PD L1
их взаимодействия с Fc рецепторами клеток
[31].
Raji [35].
6. Биспецифические aCD3/aTAA являются
Преимущество растворимых активаторов
еще одним вариантом активации CD3 (рис. 1, е)
CD3 по сравнению с трансмембранными акти
[32].
вирующими молекулами заключается в возмож
Активация, опосредованная взаимодействи
ности подбора их оптимальной концентрации,
ем TCR с комплексом MHC/пептид, сложна с
что делает систему более гибкой (рис. 3). Мак
точки зрения практической реализации относи
симальную кратность увеличения интенсивнос
тельно других подходов и далее рассматриваться
ти люминесценции при добавлении aPD 1 на
в данной работе не будет [33].
блюдали в диапазоне 0,1-1 нг/мл для обоих
Для определения оптимального варианта ак
aCD3/aTAA. Для экспериментов использовали
тивации CD3 при разработке тест системы сна
концентрацию aCD3/aTAA 1 нг/мл, при кото
чала мы сравнили только растворимые актива
рой сохраняется максимальный уровень отно
торы: aCD3, aCD3/aTAA1, aCD3/aTAA2 и SEB
сительной активации и наблюдаются более вы
(рис. 2). Активаторы CD3 оценивали по двум
сокие абсолютные значения интенсивности лю
параметрам: абсолютная активация (интенсив
минесценции.
ность люминесценции образца в системе, содер
Далее мы сравнили 4 тест системы, основан
жащей эффекторные клетки, клетки мишени,
ные на одном из следующих вариантов активации:
активатор и aPD 1) и относительная активация
(отношение интенсивности люминесценции
образцов, содержащих эффекторные клетки,
клетки мишени, активатор и aPD 1, к интен
сивности люминесценции аналогичных образ
цов, не содержащих aPD 1). Абсолютная акти
вация тест системы на основе aCD3/aTAA1 и
aCD3/aTAA2 примерно в 2-3 раза больше, чем
на основе aCD3 и SEB. При этом стоит отме
тить, что концентрации aCD3 и SEB, использу
емые в исследовании, превышают концентра
цию биспецифических антител 1000× и 100× со
ответственно. Растворимые aCD3, в отличие от
других описанных выше активаторов CD3, вы
зывают активацию всех эффекторных клеток, а
не только тех, которые непосредственно взаи
модействуют с клетками мишенями. При ис
пользовании PD L1+ клеток мишеней опосре
дованное PD 1 подавление CD3 зависимой ак
Рис. 2. Сравнение эффективности CD3 зависимой стиму
тивации происходит не во всех эффекторных
ляции NFAT сигнального каскада растворимыми активи
клетках. Это приводит к повышению фонового
рующими агентами. Суспензию, состоявшую из указанной
уровня сигнала в системе и, как следствие, низ
комбинации клеток Jurkat NFAT FLuc PD 1 (J PD 1), Raji
кому значению относительной активации. От
(R), Raji PD L1 (R PD L1), инкубировали в присутствии
одного из активирующих агентов в указанной концентра
носительная активация для тест системы с ис
ции, а также в присутствии (+aPD 1), либо в отсутствии
пользованием aCD3/aTAA1 и aCD3/aTAA2 сос
(-aPD 1) aPD 1 в концентрации 50 мкг/мл. Эффектив
тавляет примерно 5-6 раз, aCD3 - 1,5 раза,
ность активации оценивали по уровню синтеза люцифера
SEB - 2 раза. Таким образом, aCD3 и SEB усту
зы путем измерения люминесценции
БИОХИМИЯ том 84 вып. 7 2019
АНАЛИЗ АКТИВНОСТИ ИНГИБИТОРОВ PD 1/PD L1
917
Рис. 3. Зависимость активации репортерной системы от концентрации aCD3/aTAA. В клеточном тесте использовали сус
пензию клеток Jurkat NFAT FLuc PD 1 (Jurkat PD 1), содержавшую (кривые 2 и 3), либо не содержавшую (кривая 1)
клетки Raji PD L1 (Raji PD 1). В случае кривой 3 - к клеткам добавляли aPD 1 в концентрации 50 мкг/мл. В качестве ак
тивирующего агента использовали aCD3/aTTA1 (а), либо aCD3/aTАA2 (б). Относительная активация (кривая 4) - отно
шение интенсивности люминесценции кривой 3 к кривой 2 для соответствующих концентраций aCD3/aTAA.
biokhsm/
двух вариантов aCD3/aTAA, клеток мишеней с
использованием трансмембранных молекул в 2-3
трансмембранным aCD3 или CAR+ эффекторных
раза. При этом по относительной активации тест
клеток (рис. 4). По значениям абсолютной актива
система с использованием aCD3/aTAA1 превосхо
ции вариант с использованием CAR+ эффектор
дит систему на основе aCD3/aTAA2. На основании
ных клеток ~ 5× превосходит варианты, основан
этих данных aCD3/aTAA1 были выбраны в качест
ные на aCD3/aTAA и клетках мишенях с транс
ве способа активации CD3.
мембранным aCD3. Относительная активация в
Характеризация тест системы. Для доказа
вариантах с aCD3/aTAA превосходит варианты с тельства специфичности выбранной тест систе
Рис. 4. Зависимость активации репортерной системы от концентрации aPD 1 в присутствии различных активирующих
агентов. В клеточном тесте использовали суспензию клеток Jurkat NFAT FLuc PD 1 (кривые 1-3), либо Jurkat NFAT
FLuc PD 1 CAR (кривая 4) с добавлением клеток Raji PD L1 (кривые 1, 2 и 4), либо CHO PDL1 tmaCD3 (кривая 3). В слу
чае кривых 1 и 2 суспензия клеток содержала, соответственно, aCD3/aTAA1 и aCD3/aTAA2 в концентрации 1 нг/мл. Ре
зультаты приведены в значениях интенсивности люминесценции (а) и единицах относительной активации (б). Относи
тельную активацию определяли как отношение интенсивности люминесценции при данной концентрации aPD 1 к ин
тенсивности люминесценции в варианте без добавления aPD 1 для каждого активатора.
biokhsm/
БИОХИМИЯ том 84 вып. 7 2019
918
ДОРОНИН и др.
мы мы использовали ее для тестирования aPD 1,
aPD L1, aCTLA4 и aHER2 (рис. 5). В выбранной
тест системе подавление CD3 зависимой акти
вации обеспечивается наличием PD 1 на эффек
торных клетках и PD L1 на клетках мишенях.
Реактивация NFAT зависимой экспрессии гена,
кодирующего FLuc, происходит при добавлении
aPD 1 или aPD L1, но не aCTLA4 или aHER2,
используемых в качестве отрицательного конт
роля. Кривые зависимости интенсивности лю
минесценции образцов от концентрации антител
могут быть описаны 4 х параметрическим логис
тическим уравнением, что позволяет сравнивать
исследуемые препараты по значениям EC50.
Для определения способности тест системы
различать препараты ингибиторов PD 1/PD L1
Рис. 5. Исследование специфичности репортерной систе
с различной активностью мы использовали пре
мы. В клеточном тесте использовали aPD 1 (1), либо aPD
параты aPD 1 и aPD L1, которые были подверг
L1 (2), либо aCTLA4 (3), либо aHER2 (4) в указанных кон
центрациях. Исследование проводили согласно методике,
нуты термическому стрессу (рис. 6). Наблюдает
описанной в разделе «функциональные тесты».
ся прямая зависимость между значениями EC50
С цветным вариантом рис. 5 можно ознакомиться в элект
и температуры, при которой были проинкуби
рованы препараты. Таким образом система спо
journal/biokhsm/
собна различать препараты aPD 1 и aPD L1 с
различным уровнем активности и может быть
успешно использована для определения их ста
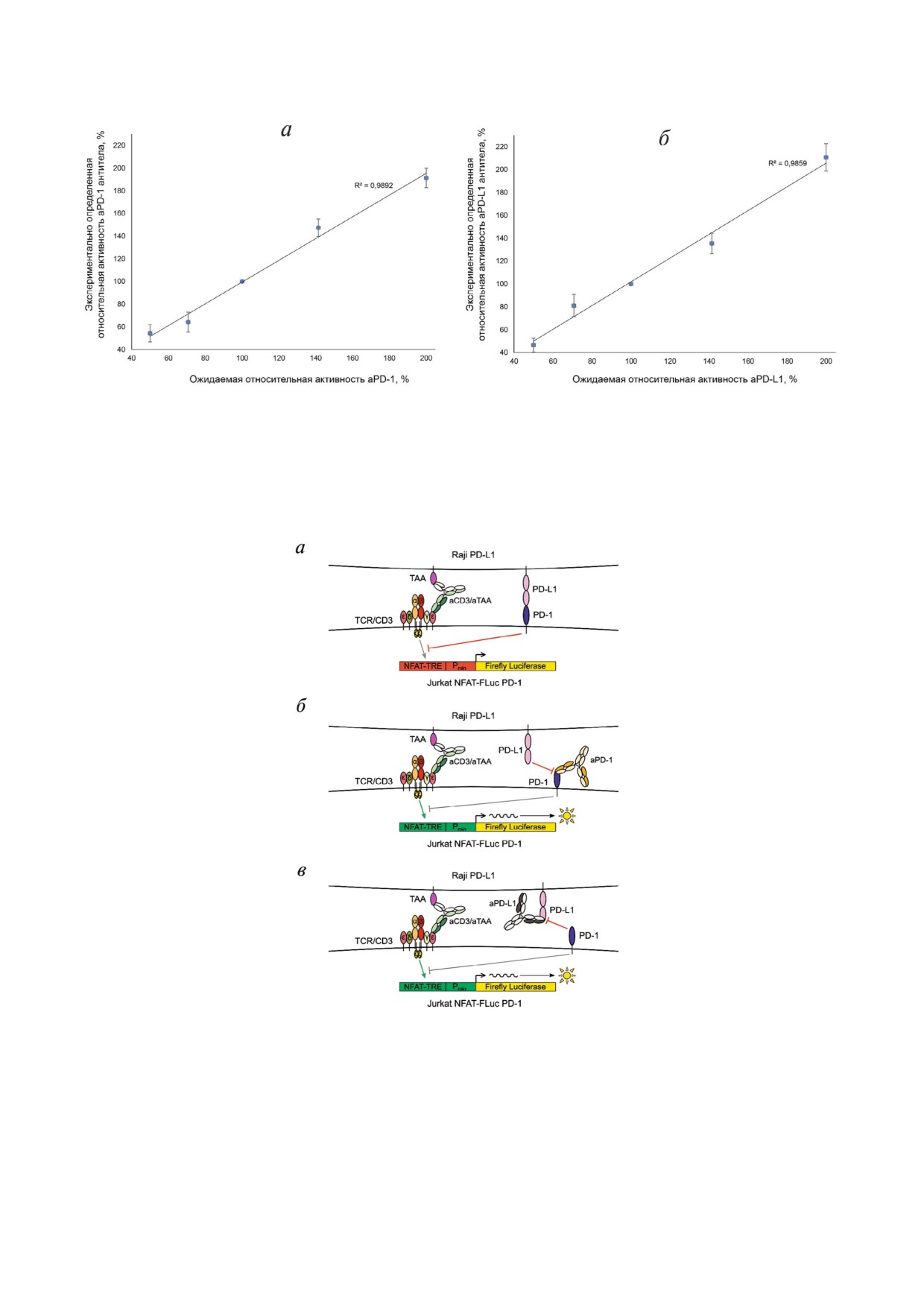
200% относительно стандарта, активность кото
бильности.
рого принимали за 100% (рис. 7). Показано, что
Тест система может быть использована, если
их активность в эксперименте схожа с ожидае
активность исследуемого образца совпадает с
мой. Система является линейной в диапазоне
диапазоном, в котором система сохраняет ли
50-200% относительно активности стандарта
нейную зависимость [13]. Для определения ли
для aPD 1 и aPD L1.
нейности тест системы в диапазоне 50-200%
были использованы препараты aPD 1 и aPD L1
В ходе данной работы разработана тест сис
с ожидаемой активностью 50, 70, 100, 140 и тема для определения биологической активнос
Рис. 6. Использование разработанного клеточного теста для оценки специфической активности aPD 1 и aPD L1. В кле
точном тесте использовали aPD 1 (а), либо aPD L1 (б), исходные (1), либо проинкубированные в течении 1 ч при темпе
ратуре 50 °С (2), 70 °С (3), либо 90 °С (4). Для вариантов (1-3) указаны соответствующие значения EC50. Исследование
проводили согласно методике, описанной в разделе «функциональные тесты».
biokhsm/
БИОХИМИЯ том 84 вып. 7 2019
АНАЛИЗ АКТИВНОСТИ ИНГИБИТОРОВ PD 1/PD L1
919
Рис. 7. Исследование линейного диапазона тест системы. Сравнение ожидаемой и экспериментально определенной ак
тивности aPD 1 (а) и aPD L1 (б). Измеряли EC50 заранее подготовленных разведений (в диапазоне концентраций
50-200% относительно стандарта, активность которого принимали за 100%) антител. Экспериментально определенную
активность рассчитывали, как отношение экспериментально определенной EC50 стандарта к EC50 для данной концент
рации, умноженное на 100%.
biokhsm/
Рис. 8. Схема работы тест системы для оценки функциональной активности aPD 1 и aPD L1, основанная на использова
нии бисфецифических aCD3/aTAA. а - Система без добавления ингибиторов взаимодействия PD 1/PD L1. При контак
те эффекторной клетки и клетки мишени aCD3/aTAA, связавшиеся с TAA клетки мишени, взаимодействуют с CD3 эф
фекторной клетки, что активирует ее CD3 зависимый NFAT сигнальный каскад. При этом происходит взаимодействие
PD 1 эффекторной клетки с PD L1 клетки мишени, что ингибирует активацию CD3 зависимого NFAT сигнального кас
када. б - Добавленные в систему aPD 1 или aPD L1 (в) связываются со своей мишенью, что блокирует взаимодействие
PD 1/PD L1 и реактивирует CD3 зависимый NFAT сигнальный каскад.
biokhsm/
БИОХИМИЯ том 84 вып. 7 2019
920
ДОРОНИН и др.
ти aPD 1 и aPD L1. Система состоит из 3 ком
на основе трансмембранных aCD3 [28]. Но та
понентов (рис. 8):
кой подход был ранее запатентован и имеет ог
- Эффекторная репортерная линия имеет на
раничения для применения [27].
своей поверхности рецептор PD 1 и содержит в
Разработанная нами тест система может
геноме репортерный ген, кодирующий люцифе
быть использована на стадии разработки aPD 1
разу светляка, под контролем NFAT чувстви
и aPD L1 для сравнения кандидатов, оценки их
тельного промотора.
стабильности, а также характеризации серий те
- Клеточная линия, презентирующая на по
рапевтического препарата для подтверждения
верхности PD L1.
их эквивалентности, требующей в большинстве
- Биспецифические aCD3/aTAA, задача ко
случаев соответствия 80-125% активности от
торых - активация CD3 зависимого NFAT сиг
носительно стандартного образца [36].
нального каскада в репортерной клетке, а также
Возможно дополнительное улучшение пара
связывание ее с лиганд презентирующей клет
метров данной тест системы, например, за счет
кой.
снижения фонового сигнала путем использова
В ходе работы сравнили различные способы
ния дестабилизированной версии репортерного
активации CD3. Экспериментально показали,
белка люциферазы [37].
что из всех проверенных вариантов максималь
Представленные сравнительные данные об
ная относительная активация при добавлении
активации CD3 под действием различных акти
aPD 1 наблюдается при использовании биспе
ваторов могут быть полезными при разработке
цифических aCD3/aTAA в качестве активаторов
новых терапевтических агентов и способов их
CD3 (рис. 2, рис. 4). Кроме того, к преимущест
тестирования.
вам их использования можно отнести низкий
С помощью данной тест системы были успеш
фоновый сигнал (в отличие от aCD3), исключе
но отобраны и охарактеризованы кандидаты те
ние дополнительных генно инженерных работ
рапевтических aPD 1 и aPD L1, которые в на
(в отличие от CAR и tmaCD3), нетоксичность
стоящее время проходят клинические исследо
(в отличие от суперантигенов).
вания.
Следует отметить, что два из рассмотренных
вариантов активации CD3 в Т клетке являются
оригинальными для решения подобного рода
Конфликт интересов. Авторы заявляют об от
задач и ранее не были описаны. Это использова
сутствии конфликта интересов.
ние биспецифических aCD3/aTAA и CAR.
Соблюдение этических норм. Настоящая
В литературе описана система, позволяющая
статья не содержит описания каких либо ис
определять активность aPD 1 или aPD L1. В ней
следований с участием людей в качестве объек
в качестве активатора CD3 использован подход
тов.
СПИСОК ЛИТЕРАТУРЫ
1.
Freeman, G.J., Long, A.J., Iwai, Y., Bourque, K.,
signalosome and downstream signaling to PKCtheta, FEBS
Chernova, T., Nishimura, H., Fitz, L.J., Malenkovich, N.,
Lett., 547, 37-41, doi: 10.1016/j.febslet.2004.07.083.
Okazaki, T., Byrne, M.C., Horton, H.F., Fouser, L.,
4.
Bardhan, K., Anagnostou, T., Boussiotis, V.A. (2016) The
Carter, L., Ling, V., Bowman, M.R., Carreno, B.M.,
PD1 : PD L1/2 Pathway from Discovery to Clinical Imple
Collins, M., Wood, C.R., Honjo, T. (2000) Engagement of
mentation,
Front.
Immunol.,
7,
550,
doi:
the PD 1 immunoinhibitory receptor by a novel B7 family
10.3389/fimmu.2016.00550.
member leads to negative regulation of lymphocyte activa
5.
Arasanz, H., Gato Canas, M., Zuazo, M., Ibanez Vea,
tion, J. Exp. Med., 192, 1027-1034, doi: 10.1084/jem.
M., Breckpot, K., Kochan, G., Escors, D. (2017) PD1 sig
192.7.1027.
nal transduction pathways in T cells, Oncotarget, 8,
2.
Latchman, Y., Wood, C.R., Chernova, T., Chaudhary, D.,
51936-51945, doi: 10.18632/oncotarget.17232.
Borde, M., Chernova, I., Iwai, Y., Long, A.J., Brown, J.A.,
6.
Alsaab, H.O., Sau, S., Alzhrani, R., Tatiparti, K., Bhise,
Nunes, R., Greenfield, E.A., Bourque, K., Boussiotis, V.A.,
K., Kashaw, S.K., Iyer, A.K. (2017) PD 1 and PD L1
Carter, L.L., Carreno, B.M., Malenkovich, N.,
Checkpoint Signaling Inhibition for Cancer Immuno
Nishimura, H., Okazaki, T., Honjo, T., Sharpe, A.H.,
therapy: Mechanism, Combinations, and Clinical Out
Freeman, G.J. (2001) PD L2 is a second ligand for PD 1
come, Front. Pharmacol., 8, 561, doi: 10.3389/fphar.2017.
and inhibits T cell activation, Nat. Immunol., 2, 261-268,
00561.
doi: 10.1038/85330.
7.
Chen, L., Han, X. (2015) Anti PD 1/PD L1 therapy of
3.
Sheppard, K.A., Fitz, L.J., Lee, J.M., Benander, C.,
human cancer: past, present, and future, J. Clin. Invest.,
George, J.A., Wooters, J., Qiu, Y., Jussif, J.M., Carter, L.L.,
125, 3384-3391, doi: 10.1172/JCI80011.
Wood, C.R., Chaudhary, D. (2004) PD 1 inhibits T cell
8.
Iwai, Y., Ishida, M., Tanaka, Y., Okazaki, T., Honjo, T.,
receptor induced phosphorylation of the ZAP70/CD3zeta
Minato, N. (2002) Involvement of PD L1 on tumor cells
БИОХИМИЯ том 84 вып. 7 2019
АНАЛИЗ АКТИВНОСТИ ИНГИБИТОРОВ PD 1/PD L1
921
in the escape from host immune system and tumor
antigens, Annu. Rev. Immunol., 17, 435-466, doi: 10.1146/
immunotherapy by PD L1 blockade, Proc. Natl. Acad. Sci.
annurev.immunol.17.1.435.
U S A, 99, 12293 12297, doi: 10.1073/pnas.192461099.
25.
Tsoukas, C.D., Landgraf, B., Bentin, J., Valentine, M.,
9.
Rozali, E.N., Hato, S.V., Robinson, B.W., Lake, R.A.,
Lotz, M., Vaughan, J.H., and Carson, D.A.
(1985)
Lesterhuis, W.J. (2012) Programmed Death Ligand 2 in
Activation of resting T lymphocytes by anti CD3 (T3)
Cancer Induced Immune Suppression, Clin. Dev.
antibodies in the absence of monocytes, J. Immunol., 135,
Immunol., 2012, 656340, doi: 10.1155/2012/656340.
1719-1723.
10.
Ishida, Y., Agata, Y., Shibahara, K., Honjo, T. (1992)
26.
Leitner, J., Kuschei, W., Grabmeier Pfistershammer, K.,
Induced expression of PD 1, a novel member of the
Woitek, R., Kriehuber, E., Majdic, O., Zlabinger, G.,
immunoglobulin gene superfamily, upon programmed cell
Pickl, W.F., and Steinberger, P. (2010) T cell stimulator
death, EMBO J., 11, 3887-3895, doi: 10.1002/j.1460
cells, an efficient and versatile cellular system to assess the
2075.1992.tb05481.x.
role of costimulatory ligands in the activation of human T
11.
Gong. J., Chehrazi Raffle, A., Reddi, S., Salgia, R. (2018)
cells, J. Immunol. Methods, 362, 131-141, doi: 10.1016/
Development of PD 1 and PD L1 inhibitors as a form of
j.jim.2010.09.020.
cancer immunotherapy: a comprehensive review of regis
27.
Cong, M., Cheng Z.J., Karassina, N., Grailer, J., and Fan,
tration trials and future considerations, J. Immunother.
F. (2015) Systems and methods for assessing modulators of
Cancer, 6, 8, doi: 10.1186/s40425 018 0316 z.
immune checkpoints, patent WIPO, WO2016081854.
12.
Tang, J., Yu, J.X., Hubbard Lucey, V.M., Neftelinov, S.T.,
28.
Wang, L., Yu, C., Yang, Y., Gao, K., and Wang, J. (2017)
Hodge, J.P., Lin, Y. (2018) Trial watch: The clinical trial land
Development of a robust reporter gene assay to measure the
scape for PD1/PDL1 immune checkpoint inhibitors, Nat.
bioactivity of anti PD 1/anti PD L1 therapeutic antibo
Rev. Drug Discov., 17, 854-855, doi: 10.1038/nrd.2018.210.
dies, J. Pharm. Biomed. Anal., 145, 447-453, doi: 10.1016/
13.
Rockville, M.D. (2012) United States Pharmacopeia and
j.jpba.2017.05.011.
National Formulary (USP 35 NF 30), United States
29.
Sadelain, M., Brentjens, R., and Riviere, I. (2013) The
Pharmacopeial Convention, 1032, 5160-5174.
basic principles of chimeric antigen receptor design, Cancer
14.
Skerka, C., Decker, E.L., and Zipfel, P.F. (1995) A regula
Discov., 3, 388-398, doi: 10.1158/2159 8290.CD 12 0548.
tory element in the human interleukin 2 gene promoter is a
30.
Irving, B.A., and Weiss, A. (1991) The cytoplasmic domain
binding site for the zinc finger proteins Sp1 and EGR 1,
of the T cell receptor zeta chain is sufficient to couple to
J. Biol. Chem., 270, 22500-22506, doi: 10.1074/jbc.
receptor associated signal transduction pathways, Cell, 64,
270.38.22500.
891-901, doi: 10.1016/0092 8674(91)90314 O.
15.
Park, J., Takeuchi, A., and Sharma, S. (1996) Characte
31.
John, L.B., Devaud, C., Duong, C.P., Yong, C.S., Beavis, P.A.,
rization of a new isoform of the NFAT (nuclear factor of
Haynes, N.M., Chow, M.T., Smyth, M.J., Kershaw, M.H.,
activated T cells) gene family member NFATc, J. Biol.
and Darcy, P.K. (2013) Anti PD 1 antibody therapy
Chem., 271, 33705-33716, doi: 10.1074/jbc.271.34.20914.
potently enhances the eradication of established tumors by
16.
Hsieh, Y.T., Aggarwal, P., Cirelli, D., Gu, L., Surowy, T.,
gene modified T cells, Clin. Cancer Res., 19, 5636-5646,
and Mozier, N.M. (2017) Characterization of FcγRIIIA
doi: 10.1158/1078 0432.CCR 13 0458.
effector cells used in in vitro ADCC bioassay: comparison
32.
Nazarian, A.A., Archibeque, I.L., Nguyen, Y.H., Wang, P.,
of primary NK cells with engineered NK 92 and Jurkat T
Sinclair, A.M., and Powers, D.A. (2015) Characterization
cells, J. Immunol. Methods, 441, 56-66, doi: 10.1016/j.jim.
of bispecific T cell Engager (BiTE) antibodies with a high
2016.12.002.
capacity T cell dependent cellular cytotoxicity (TDCC)
17.
Jutz, S., Leitner, J., Schmetterer, K., Doel Perez, I.,
assay, J. Biomol. Screen., 20, 519-527, doi: 10.1177/
Majdic, O., Grabmeier Pfistershammer, K., Paster, W.,
1087057114561405.
Huppa, J.B., and Steinberger, P. (2016) Assessment of cos
33.
Versteven, M., Van den Bergh, J.M.J., Broos, K., Fujiki, F.,
timulation and coinhibition in a triple parameter T cell
Campillo Davo, D., De Reu, H., Morimoto, S., Lecocq, Q.,
reporter line: simultaneous measurement of NF кB,
Keyaerts, M., Berneman, Z., Sugiyama, H., Van Tendeloo,
NFAT and AP 1, J. Immunol. Methods, 430, 10-20,
V.F.I., Breckpot, K., and Lion, E. (2018) A versatile T cell
doi: 10.1016/j.jim.2016.01.007.
based assay to assess therapeutic antigen specific PD 1
18.
Pahl, H.L. (1999) Activators and target genes of Rel/NF
targeted approaches, Oncotarget, 9, 27797-808, doi: 10.
kappaB transcription factors, Oncogene, 18, 6853-6866,
18632/oncotarget.25591.
doi: 10.1038/sj.onc.1203239.
34.
Miethke, T., Wahl, C., Heeg, K., Echtenacher, B.,
19.
Rao, A., Luo, C, and Hogan, P.G. (1997) Transcription
Krammer, P.H., and Wagner, H. (1992) T cell mediated
factors of the NFAT family: regulation and function, Annu.
lethal shock triggered in mice by the superantigen staphy
Rev. Immunol., 15, 707-747, doi: 10.1146/annurev.immu
lococcal enterotoxin B: critical role of tumor necrosis fac
nol.15.1.707.
tor, J. Exp. Med., 175, 91-98, doi: 10.1084/jem.175.1.91.
20.
Vaeth, M., and Feske, S. (2018) NFAT control of immune
35
Krutmann, J., Kirnbauer, R., Kock, A., Schwarz, T.,
function: New Frontiers for an Abiding Trooper,
Schopf, E., May, L.T., Sehgal, P.B., and Luger, T.A. (1990)
F1000Res., 7, 260, doi: 10.12688/f1000research.13426.1.
Cross linking Fc receptors on monocytes triggers IL 6
21.
Abraham, R.T., and Weiss, A. (2004) Jurkat T cells and
production. Role in anti CD3 induced T cell activation,
development of the T cell receptor signalling paradigm,
J. Immunol., 145, 1337-1342.
Nat. Rev. Immunol., 4, 301-308, doi: 10.1038/nri1330.
36.
Kaushal, N., Singh, S.K., Gulati, M., Vaidya, Y., and
22.
Mege, D., Di, Bartolo, V., Germain, V., Tuosto, L.,
Kaushik, M. (2016) Study of regulatory requirements for
Michel, F., and Acuto, O. (1996) Mutation of tyrosines
the conduct of bioequivalence studies in US, Europe,
492/493 in the kinase domain of ZAP 70 affects multiple
Canada, India, ASEAN and SADC countries: Impact on
T cell receptor signaling pathways, J. Biol. Chem., 271,
generic drug substitution, JAPS, 6, 206-222, doi: 10.7324/
32644-32652, doi: 10.1074/jbc.271.51.32644.
JAPS.2016.60430.
23.
Davis, M.M., and Bjorkman, P.J. (1988) T cell antigen
37.
Voon, D.C., Subrata, L.S., Baltic, S., Leu, M.P., Whiteway, J.M.,
receptor genes and T cell recognition, Nature, 334,
Wong, A., Knight, S.A., Christiansen, F.T., and Daly, J.M.
395-402, doi: 10.1038/334395a0.
(2005) Use of mRNA and protein destabilizing elements
24.
Li, H., Llera, A., Malchiodi, E.L., and Mariuzza, R.A.
to develop a highly responsive reporter system, Nucleic
(1999) The structural basis of T cell activation by super
Acids Res., 33, e27, doi: 10.1093/nar/gni030.
3 БИОХИМИЯ том 84 вып. 7 2019
922
ДОРОНИН и др.
T CELL REDIRECTING BISPECIFIC ANTIBODIES BASED
BIOASSAY FOR EVALUATION OF PD 1/PD L1
INHIBITORS ACTIVITY
A. N. Doronin1,2, A. A. Gordeev1,2, A. E. Kozlov1, I. A. Smirnova1,
M. Yu. Puchkova1,2, V. M. Ekimova1, Y. I. Basovskiy1,2, and V. V. Solovyev1,2*
1 BIOCAD, 142380 Lyubuchany, Russia; E'mail: solovyevvv@biocad.ru
2 Pushchino State Institute of Natural Sciences, 142290 Pushchino, Russia
Received February 22, 2019
Revised April 17, 2019
Accepted April 18, 2019
PD 1/PD L1 inhibitor based therapy was called a revolution in cancer therapy. By the end of 2018, more than 100
anti PD 1 and anti PD L1 antibodies are at various phases of development, and more than 2000 clinical trials with
their use have been registered. Characterization of such antibodies requires bioassay to determine their activity. This
article is devoted to the development of a cell based assay for analyzing the activity of anti PD 1 and anti PD L1
antibodies. We have compared several approaches for development of a reporter system using two cell lines. Effector
cells activation in these approaches was based on superantigens, soluble anti CD3 antibodies, transmembrane anti
CD3 antibodies, chimeric antigen receptors (CARs) or bispecific anti CD3/anti TAA antibodies. Based on the
results, it was proposed to use a system involving bispecific anti CD3/anti TAA antibodies, which has advantages over
other approaches. The assay was characterized, and the possibility of its use for testing activity of anti PD 1 and anti
PD L1 antibodies was shown. The proposed system may be useful for development of new therapeutic agents and
methods for their testing.
Keywords: bioassay, PD 1, PD L1, T cell redirecting bispecific antibodies
БИОХИМИЯ том 84 вып. 7 2019