БИОХИМИЯ, 2019, том 84, вып. 7, с. 934 - 952
УДК 576.311; 571.27
ПЕРСПЕКТИВЫ ИСПОЛЬЗОВАНИЯ НАНОЧАСТИЦ ДЛЯ
РЕПРОГРАММИРОВАНИЯ ОПУХОЛЕВЫХ МАКРОФАГОВ
В ИММУНОТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Обзор
© 2019
К.С. Капитанова1, В.А. Науменко2*, А.С. Гаранина2,
П.А. Мельников3, М.А. Абакумов2,4, И.Б. Алиева5*
1 Московский государственный университет им. М.В. Ломоносова, факультет
биоинженерии и биоинформатики, 119234 Москва, Россия
2 Национальный исследовательский технологический университет
«МИСиС», 119049 Москва, Россия; электронная почта: naumenko.vict@gmail.com
3 Национальный медицинский исследовательский центр психиатрии и наркологии
им. В.П. Сербского Минздрава России, 119034 Москва, Россия
4 Российский национальный исследовательский медицинский университет
им. Н.И. Пирогова Минздрава России, 117997 Москва, Россия
5 Московский государственный университет им. М.В. Ломоносова,
Научно<исследовательский институт физико<химической биологии
им. А.Н. Белозерского, 119992 Москва, Россия;
электронная почта: irina_alieva@mail.ru
Поступила в редакцию 08.11.2019
После доработки 12.02.2019
Принята к публикации 13.02.2019
Несмотря на прогресс современной медицины, онкологические заболевания являются одной из наиболее
распространенных причин смертности взрослого населения в развитых странах. Современные методы тера
пии несовершенны; высокая летальность при лечении онкологических больных, отсутствие персонализи
рованных подходов, осложнения, развивающиеся в результате лечения, заставляют искать новые подходы к
лечению злокачественных новообразований. В последнее десятилетие активно развивается иммунотерапия
опухолей - концепция, предполагающая борьбу с опухолью путем активации иммунного ответа организма.
Иммунотерапия опухолей - наиболее перспективное направление современной фундаментальной и прак
тической онкологии, одной из ключевых задач которой является восстановление патологически изменен
ного опухолевого микроокружения, в частности репрограммирование опухолевых макрофагов из иммуно
супрессивного М2 фенотипа в провоспалительный М1 фенотип. В настоящей работе представлен обзор
современных исследований, посвященных классификации макрофагов, механизмам их поляризации, изу
чению их роли в формировании опухолевого микроокружения и стратегий изменения функциональной ак
тивности М2 макрофагов, а также вопросам специфической доставки иммуностимуляторных сигналов к
опухолевым макрофагам с использованием наночастиц.
КЛЮЧЕВЫЕ СЛОВА: опухолевое микроокружение, М1/М2 макрофаги, иммунотерапия опухолей,
наночастицы, интравитальная микроскопия.
DOI: 10.1134/S0320972519070054
Онкологические заболевания в развитых
пациентов и сопряженных с этим экономичес
странах продолжают занимать лидирующие по
ких потерь. Ограниченная эффективность клас
зиции в структуре причин смертности, потери
сического арсенала терапевтических методов
трудоспособности, снижения качества жизни (радикальная операция, химио и лучевая тера
Принятые сокращения: ЛПС - липополисахарид, НЧ - наночастицы, ИВМ - интравитальная микроскопия, IL -
интерлейкин (interleukin), CD - кластер дифференциации (cluster of differentiation), STAT - преобразователь сигнала и
активатор транскрипции (signal transducer and activator of transcription), VEGF - фактор роста эндотелия сосудов (vascular
endothelial growth factor), TNFα - фактор некроза опухолей альфа (tumor necrosis factor alpha), IFN γ - интерферон гамма
(interferon gamma), TGFβ - трансформирующий фактор роста бета (transforming growth factor beta), TLR - Toll-подобный
рецептор (Toll like receptor), IRF
- регуляторный фактор интерферона (interferon regulatory factor), CSF
-
колониестимулирующий фактор (colony stimulating factor), iNOS - индуцируемая синтаза оксида азота (inducible nitric
oxide synthase), PD - программируемая клеточная гибель (programmed cell death).
* Адресат для корреспонденции.
934
НАНОЧАСТИЦЫ ДЛЯ РЕПРОГРАММИРОВАНИЯ ОПУХОЛЕВЫХ МАКРОФАГОВ
935
пия) диктует необходимость поиска новых под
Обе субпопуляции берут начало из первич
ходов для лечения злокачественных новообра
ных М0 макрофагов, но при этом сохраняют
зований. В последнее десятилетие большие на
пластичность, т.е. способность к обратимому
дежды связывают с развитием иммунотерапии -
М1/М2 переходу (репрограммированию) под
концепции, направленной на борьбу с опухолью
действием внешних стимулов [9].
путем активации иммунитета [1, 2]. Ингибито
М1 и М2 макрофаги отличаются по спектру
ры контрольных точек иммунного ответа, воз
секретируемых цитокинов и хемокинов, а также
действующие на рецепторы PD1/PDL1 или
мембранных рецепторов и ферментов [10]. Эти
CTLA4, успешно зарекомендовали себя при ле
отличия определяют разные функциональные
чении различных опухолей [3]. К другим попу
особенности клеток, а также могут быть исполь
лярным направлениям иммунотерапии отно
зованы как маркеры М1 и М2 макрофагов. Так,
сится использование Т клеток с химерным ре
для M1 макрофагов характерен высокий уро
цептором [4] и онколитических вирусов [5].
вень синтеза Th1 провоспалительных цитоки
Эффективность иммунотерапии солидных
нов - IL 1β, IL 6, IL 12, IL 18, TNFα, в то вре
опухолей напрямую связана со способностью
мя как М2 макрофаги секретируют преимуще
Т лимфоцитов проникать в опухолевые ткани,
ственно противовоспалительные цитокины -
при этом сохраняя противоопухолевую цитоток
IL 4 и IL 10. М1 макрофаги экспрессируют
сическую активность. Известно, что один из меха
CD86 и TLR4, а М2 макрофаги - CD163 и
низмов ускользания опухоли от иммунного надзо
CD206. Хемокины CCL2 и CCL5 характерны для
ра состоит в создании иммуносупрессивного опу
М1 фенотипа, CCL17 и CCL22 - для М2 макро
холевого микроокружения за счет секреции цито
фагов. Ферменты iNOS и аргиназа 1 (Arg 1) ас
кинов, привлечения Т регуляторных лимфоцитов
социированы с М1 и М2 макрофагами соответ
и супрессорных клеток миелоидного ряда, а также
ственно. М2 макрофаги мыши дополнительно
репрограммирования опухолевых макрофагов. В
характеризуются наличием фермента Ym 1 [10].
связи с этим особую актуальность приобретают
Cуществует также более детальная класси
подходы, связанные с воздействием не только на
фикация субпопуляций макрофагов, основан
опухолевые клетки, но и на строму опухоли [6].
ная на их специфической реакции в ответ на
Присутствие в очаге опухоли человека лейко
воздействие комплекса биологически активных
цитов наряду с трансформированными клетками
молекул (так называемых цитокиновых коктей
впервые было показано в 1863 г. В настоящее
лей), применяемых in vitrо для индукции их
время достоверно установлено, что макрофаги
дифференцировки. Согласно этой классифика
являются одним из ключевых компонентов мик
ции, M1 макрофаги образуются после воздей
роокружения опухоли, а в некоторых случаях их
ствия IFN γ/LPS (ЛПС); M2a макрофаги - пос
содержание в инфильтрате достигает 50% от мас
ле воздействия IL 4/IL 13; M2b макрофаги -
сы всех клеток опухоли [7]. Происхождение опу
после воздействия LPS/IL 1β; M2c макрофа
холевых макрофагов связывают с моноцитами
ги - после воздействия TGFβ/IL 10 [11].
периферической крови, мигрирующими в очаг
Подробно изучены механизмы поляризации
из кровеносного русла [7]. В 2006 г. впервые бы
макрофагов под действием различных внешних
ла сформулирована гипотеза о том, что популя
стимулов. Так, липополисахарид, связываясь с
ция опухолевых макрофагов неоднородна по
TLR4 посредством активации NF κB и IRF3,
своим функциям [8], что и дало начало активно
приводит к М1 поляризации макрофагов. Ана
му изучению субпопуляций макрофагов.
логичный эффект возникает при взаимодей
ствии IFN γ со своим мембранным рецептором с
последующей активацией и фосфорилировани
КЛАССИФИКАЦИЯ МАКРОФАГОВ
ем STAT1 [12]. М2 поляризация под воздействи
ем IL 10 опосредована взаимодействием с ре
Описаны две основные субпопуляции мак
цептором IL 10R, который индуцирует STAT3.
рофагов, отличающиеся по своим функциям в
IL 4 и IL 13 связываются с мембранным рецеп
иммунном ответе, воспалении и ремоделирова
тором IL 4Ra и через активацию STAT3, STAT6
нии тканей: провоспалительные (классические)
или PPAR γ вызывают М2 поляризацию [13].
М1 макрофаги и противовоспалительные (аль
тернативные) М2 макрофаги (рис. 1). В норме
М1 макрофаги являются ключевым звеном
РОЛЬ МАКРОФАГОВ В ФОРМИРОВАНИИ
противомикробной защиты и острого воспали
ОПУХОЛЕВОГО МИКРООКРУЖЕНИЯ
тельного ответа, а М2 макрофаги участвуют в
разрешении воспалительного инфильтрата и за
Прогрессия опухоли сопровождается моди
живлении ран.
фикацией ее микроокружения с помощью при
БИОХИМИЯ том 84 вып. 7 2019
936
КАПИТАНОВА и др.
Рис. 1. Фенотипические различия активированных М1 и М2 популяций макрофагов. Для М1 популяции характерен вы
сокий уровень экспрессии поверхностных маркеров CD40, CD80, CD86, CD14, CD16, CD32, CD64, TLR2, TLR4, CCR7,
MHCII и IFNγR. Поверхностные маркеры М2 популяции макрофагов представлены такими молекулами, как CD206 и
CD163, а также TGFβR, CCR2, MCSF, CSF1R, CXCR1 и CXCR2. Для дифференцировки макрофагов по М1 пути харак
терен высокий уровень экспрессии транскрипционного фактора STAT1, а для М2 фенотипа - факторов STAT3 и STAT6.
В макрофагах М1 фенотипа определяется экспрессия IRF3, IRF5 и IRF7, тогда так в М2 макрофагах - экспрессия IRF4.
Связывание специфических лигандов с поверхностными рецепторами макрофагов приводит к активации сигнальных
каскадов в клетке и запуску той или иной транскрипционной программы, которая реализуется через секрецию функцио
нально различных репертуаров цитокинов
влечения клеток из кровеносного русла за счет
для опухолевой прогрессии [15] благодаря сек
продукции цитокинов и хемокинов трансфор
реции ими протеолитических ферментов и фак
мированными клетками. Так, направленная
торов роста (EGF, PDGF, HGF, bFGF), индуци
миграция моноцитов в ткань опухоли и их по
рующих, соответственно, инвазию края опухоли
следующая макрофагальная дифференцировка
в окружающие ткани и пролиферацию злокаче
определяется локально синтезируемыми раство
ственных клеток [16]
римыми молекулами - хемокинами CCL2 и
Доказана также ключевая роль М2 макрофа
CCL5 и цитокинами CSF 1 и VEGF соответ
гов в васкуляризации опухоли: макрофаги мигри
ственно. Показано, что М2 поляризация макро
руют в зоны гипоксии, где вырабатывают проан
фагов происходит преимущественно в областях
гиогенные цитокины и факторы роста эндотели
с пониженным содержанием кислорода [14].
оцитов и перицитов (VEGF, TNFα, IL 8, bFGF,
Предположительно, ключевыми медиаторами,
CSF 1/M CSF). Более того, существует прямая
определяющими хемотаксис макрофагов в оча
корреляция между количеством М2 макрофагов
ги гипоксии опухоли и изменение их фенотипа,
и гематогенным метастазированием [8], которая
могут являться эотаксин и онкостатин М [14].
осуществляется посредством двух механизмов.
Согласно другим гипотезам, сигналами, вызы
С одной стороны, М2 макрофаги в первичном
вающими направленную миграцию макрофагов
очаге вызывают эндотелиально мезенхималь
в области гипоксии опухоли, могут служить
ную трансформацию опухолевых клеток, необ
EMAP II и эндотелины, в частности ET 2,
ходимую для приобретения ими подвижности и
CXCL8 и VEGF [7].
способности к интравазации. С другой стороны,
Формирование микроокружения с превали
макрофаги создают преметастатические ниши -
рующим содержанием М2 макрофагов способ
экспрессия VEGF рецептора на поверхности
ствует поддержанию благоприятных условий
этих клеток способствует экстравазации цирку
БИОХИМИЯ том 84 вып. 7 2019
НАНОЧАСТИЦЫ ДЛЯ РЕПРОГРАММИРОВАНИЯ ОПУХОЛЕВЫХ МАКРОФАГОВ
937
лирующих опухолевых клеток и формирует бла
Первый терапевтический подход связан с
гоприятное микроокружение для развития вто
деплецией опухолевых макрофагов путем введе
ричного очага злокачественного новообразова
ния цитотоксических препаратов (например,
ния [17].
клодроната [23] или метотрексата [24]) или ис
Присутствие М1 макрофагов характерно для
пользования природного соединения трабедек
областей опухоли с высокой плотностью сосу
тина [25]. В нескольких моделях показано, что
дов [18]. При этом преобладание М1 макрофа
деплеция опухолевых макрофагов предотвраща
гов в опухоли коррелирует с благоприятным
ет васкуляризацию и рост опухолей [24, 26, 27].
прогнозом. Эти клетки являются продуцентами
Однако недостаток указанных подходов состоит
активных форм кислорода и азота, а также про
в том, что деплеция макрофагов происходит не
воспалительных цитокинов, способствующих
только в опухоли, но и во всем организме, что
формированию противоопухолевого Т клеточ
ставит вопрос о безопасности терапии. Для пре
ного ответа [16].
одоления этого ограничения предложены спе
В отличие от классических М1 макрофагов,
цифические мишени на поверхности М2 мак
активно участвующих в иммунном ответе в
рофагов, которые могут быть использованы для
качестве антиген презентирующих клеток, М2
адресной доставки препаратов, например, ман
макрофаги лишены этой функции и, напротив,
нозный рецептор CD206 [28], CD52 [29] или ле
подавляют противоопухолевый иммунитет.
гумаин [30].
Описано множество механизмов супрессии
Второй принципиальный подход связан с
CD8 и НК клеток опухолевыми макрофагами:
предотвращением инфильтрации опухолей мо
экспрессия аргиназы 1, индоламин 2,3 диок
ноцитами - предшественниками макрофагов -
сигеназы 1, PD лигандов (PDL1 и PDL2), ли
путем воздействия на сигнальный путь CCL2-
ганда к рецептору B7 H4 [19], HLA лигандов
CCR2. Терапевтическая эффективность антаго
(HLA C, E/G) [20]. Наконец, М2 макрофаги
ниста CCR2, установленная для эксперимен
ответственны за рецидивы после химиотера
тальных животных и человека, достигается бла
пии [21].
годаря подавлению миграции моноцитов в очаг
Опухолевые макрофаги обладают пластич
[32, 33]. Снижение популяции миелоидных кле
ным фенотипом, они способны одновременно
ток в опухоли и сопутствующее улучшение отве
проявлять и провоспалительные, и иммуносуп
та на лучевую терапию у мышей наблюдали при
рессивные свойства. Эта особенность была об
использовании нейтрализующих антител CD11b
наружена как у макрофагов в эксперименталь
[31]. Вещество, получившее название карлумаб
ных животных моделях (на примере коэкспрес
(Carlumab), ингибитор CCL2, показал свою те
сии iNOS и аргиназы 1), так и у макрофагов,
рапевтическую эффективность на нескольких
присутствующих в злокачественных опухолях
животных моделях [34], транзиторное подавле
(например, при раке желудка человека в образ
ние экспрессии CCL2 также было выявлено в
цах опухоли был выявлен высокий уровень про
клинических испытаниях [35]. К сожалению,
воспалительного цитокина IL 12 и противовос
недостатком этого подхода является быстрое во
палительного IL 10 [18]). Контролируемое пе
зобновление миграции моноцитов в опухоль
реключение функционального состояния мак
при прекращении терапии и, как следствие, ак
рофагов с М2 на М1 фенотип на данный мо
тивация метастазирования. И действительно, в
мент является одной из ключевых задач в тера
двух других клинических испытаниях, где ис
пии опухолей.
пользовался карлумаб, не было выявлено ни
блокировки CCL2-CCR2, ни противоопухоле
вой активности [34, 36].
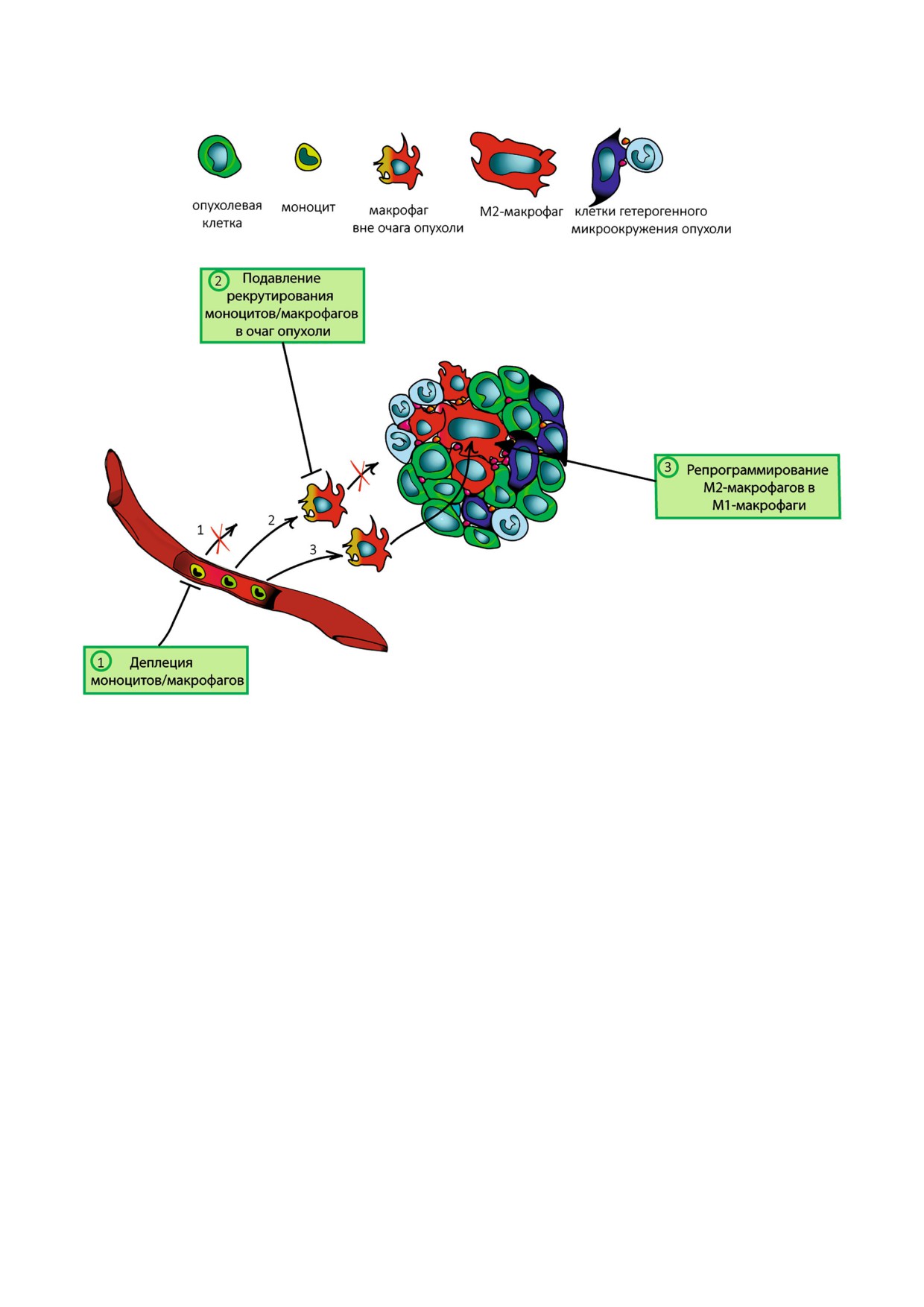
СТРАТЕГИИ ИЗМЕНЕНИЯ
Интересно, что инфильтрация макрофагами
ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ
опухолей головы и шеи, молочной, поджелудоч
М28МАКРОФАГОВ
ной и щитовидной желез, печени, почек, моче
вого пузыря, яичников, шейки и тела матки
Значительные усилия исследователей во
коррелирует с плохим прогнозом течения забо
всем мире направлены на подавление или изме
левания. Инфильтрация мезотелиом, глиом, ме
нение функциональной активности М2 макро
ланом, неходжкинских лимфом имеет анало
фагов. На сегодняшний день описаны три ос
гичный неблагоприятный прогноз. Напротив,
новные стратегии воздействия на М2 макрофа
при раке толстого кишечника высокая плот
ги: 1) деплеция макрофагов/моноцитов, 2) пред
ность макрофагов в опухоли является благопри
отвращение инфильтрации опухоли моноцита
ятным прогностическим признаком [20], что
ми, 3) репрограммирование М2 макрофагов в
косвенно свидетельствует о преобладании
М1 фенотип [22] (рис. 2).
М1 фенотипа при данной патологии. В случае с
4 БИОХИМИЯ том 84 вып. 7 2019
938
КАПИТАНОВА и др.
Рис. 2. Стратегии изменения функциональной активности М2 макрофагов. Вследствие продукции опухолевыми клетка
ми хемотаксических факторов моноциты периферической крови рекрутируются в очаг опухоли, где наблюдается их диф
ференцировка с образованием преимущественно макрофагов М2 фенотипа
опухолями костей, пищевода, простаты и легких
рапевтическая эффективность была показана
данные о корреляции между присутствием мак
для препарата, блокирующего сигнальный путь
рофагов и прогнозом заболевания противоречи
CSF 1/CSF 1R [27, 37, 38]. Интересно, что ин
вы [20]. Приведенные данные свидетельствует о
гибирование рецептора CSF 1R снижало уро
том, что снижение моноцитов/макрофагов в
вень экспрессии М2 маркеров, но не приводило
опухоли не может являться универсальной стра
к полной деплеции макрофагов.
тегией, однако указывает на принципиальную
Агонист рецептора CD40 способен активи
возможность использования макрофагов для
ровать противоопухолевую активность макро
борьбы с опухолью.
фагов, а в сочетании с гемцитабином может
В связи с этим наиболее привлекательной
приводить к регрессии опухоли у пациентов с
является альтернативная возможность - ре
неоперабельным раком поджелудочной железы
программирование опухолевых макрофагов.
[39]. Поляризацию макрофагов и увеличение
Для этой цели было предложено множество пре
выживаемости животных с опухолью наблюдали
паратов, различающихся по химическому соста
также при блокировке рецептора IL 10R [40] и
ву и механизму действия.
использовании IFN γ и кальциневрина В [41].
Одним из подходов к репрограммированию
Маннозо чувствительный гемагглютинин также
опухолевых макрофагов является ингибирова
показал свою эффективность в М2/М1 репро
ние сигнальных путей, направляющих поляри
граммировании CD163+ макрофагов in vitro и in
зацию макрофагов по М2 пути. В частности, те
vivo [42]. Использование низкомолекулярного
БИОХИМИЯ том 84 вып. 7 2019
НАНОЧАСТИЦЫ ДЛЯ РЕПРОГРАММИРОВАНИЯ ОПУХОЛЕВЫХ МАКРОФАГОВ
939
ингибитора STAT3 избирательно повышало
Ключевая роль в терапии, основанной на ан
экспрессию молекул CD80 и CD86 на поверх
титело опосредованной цитотоксичности/фа
ности опухолевых макрофагов, а также продук
гоцитозе, также отводится макрофагам [56].
цию ими IL 12, что способствовало преодоле
В основе данного подхода лежит разрушение
нию иммунорезистентности у пациентов с глио
трансформированных клеток за счет распозна
мой [43].
вания связанных с их поверхностью антител
Poly I:C - аналог вирусной двухцепочечной
FcγRIIIa (CD16a) рецепторами макрофагов.
РНК - обладает способностью к М2/М1 кон
В частности, противоопухолевый эффект таких
версии за счет связывания с TLR3 на поверхнос
препаратов, как цетуксимаб (cetuximab) и трас
ти М2 макрофагов и последующей активации
тузумаб (trastuzumab), достигается благодаря
NF κB каскада [44]. Другой олигонуклеотид -
частичной реализации этого механизма. Успеш
CpG - связывается с TLR9, что также вызывает
ность такой терапии возрастает при одновре
активацию противоопухолевой активности мак
менном использовании антагониста CD47.
рофагов [45, 46]. Аналогичный TLR зависимый
Экспрессия на поверхности клеток молекулы
механизм воздействия на опухолевые макрофа
CD47 позволяет им избегать фагоцитоза макро
ги характерен для бактериофага М13 [47]. Также
фагами, что часто используется опухолевыми
показан синергический эффект в поляризации
клетками в качестве стратегии избегания им
макрофагов in vitro при использовании агониста
мунного надзора. Применение биспецифичных
рецептора CD40 и CpG [48].
антител к CD47 и антигену опухоли может стать
Известно, что липополисахарид (ЛПС) -
перспективным подходом в борьбе со злокаче
компонент бактериальной клеточной стенки -
ственными новообразованиями [57].
является классическим TLR4 опосредованным
Репрограммирование М2 макрофагов в
индуктором М1 макрофагов. ЛПС широко при
М1 макрофаги способно оказывать терапевти
меняется для поляризации макрофагов in vitro,
ческий эффект само по себе [58] и (особенно) в
однако он оказался неэффективен для М2/М1
сочетании с другими видами терапии - с ис
репрограммирования опухолевых макрофагов
пользованием ингибиторов контрольных точек
[49]. В то же время другой полисахарид, β глю
иммунного ответа [55], онколитических вирусов
кан, получаемый из дрожжей, показал выражен
[23], химиотерапии [39] и лучевой терапии [31].
ные противоопухолевые свойства за счет акти
вации М1 макрофагов [50].
Катионные полимеры также обладают спо
НАНОЧАСТИЦЫ КАК ИНСТРУМЕНТ
собностью переключать фенотип опухолевых
АДРЕСНОЙ ДОСТАВКИ ПРЕПАРАТОВ
макрофагов с М2 на М1 за счет взаимодействия
К ОПУХОЛЕВЫМ МАКРОФАГАМ
с TLR4 и могут приводить к повышению уровня
экспрессии IL 12 in vitro. Более того, in vivo ка
Несмотря на некоторые успехи М2/М1 ре
тионные полимеры индуцируют инфильтрацию
программирования, остается актуальным воп
опухоли Th1 и НК клетками, блокируют опу
рос специфической доставки иммуностимули
холевый ангиогенез, что приводит к увеличе
рующих сигналов к опухолевым макрофагам,
нию продолжительности жизни животных [51].
которая, с одной стороны, позволила бы про
Часть веществ, показавших свою высокую
лонгировать эффект от воздействия препарата в
эффективность в переключении фенотипа опу
клетке мишени, с другой - по возможности ни
холевых макрофагов с М2 на М1 in vitro, уже
велировала бы побочные эффекты препарата на
проходит испытания в клинике. Упомянутый
здоровые ткани.
выше β глюкан в настоящее время находится на
Для адресной доставки различных молекул
I-II стадиях клинических испытаний [52, 53].
(в т.ч. противоопухолевых препаратов, генов,
Одной из перспективных молекул с доказан
вакцин) широко применяются наночастицы
ной на пациентах с меланомой и раком легкого
(НЧ). Выделяют два основных типа НЧ: органи
терапевтической эффективностью является ти
ческие (липиды, полимеры, липосомы, поли
мозин α, эффект которого достигается благода
мерные мицеллы, дендримеры, инженерные
ря дифференцировке макрофагов в дендритные
пептидные конструкции и нуклеиновые кисло
клетки, продуцирующие цитокины IL 1 и TNFα
ты) и неорганические (НЧ углерода, кремния,
в высоких концентрациях [54]. Другим механиз
металлов, в т.ч. магнитные НЧ) [59]. Преимуще
мом действия обладает противоопухолевый пре
ство магнитных НЧ перед другими наноносите
парат LCL161 из группы миметиков вторичных
лями состоит в том, что их магнитные свойства
митохондриальных активаторов каспаз [23, 55],
позволяют визуализировать и контролировать
вызывающий поляризацию М2 макрофагов в
эффективность доставки и высвобождения пре
М1 фенотип.
парата за счет экспозиции постоянного/пере
БИОХИМИЯ том 84 вып. 7 2019
4*
940
КАПИТАНОВА и др.
менного магнитного поля [60]. Наконец, на пе
Вопрос о причине преимущественного на
ресечении диагностического и терапевтическо
копления НЧ в макрофагах опухолевого микро
го потенциала магнитных НЧ возникает воз
окружения до конца не решен. По одной из ги
можность их использования для предсказания
потез, это может быть связано с количественны
эффективности лечения у отдельных пациентов
ми различиями в популяционном составе мак
[61, 62].
рофагов в очаге опухоли: превалирующие в опу
Различают активное и пассивное накопле
холевом микроокружении М2 макрофаги обла
ние НЧ в опухоли. Считается, что пассивная ак
дают более выраженной способностью к захвату
кумуляция НЧ обусловлена так называемым
частиц по сравнению с М1 фенотипом, что бы
EPR эффектом
- повышенной проницае
ло показано in vitro на примере кремниевых час
мостью кровеносных сосудов и сниженным
тиц размером 26 и 41 нм [72]. Однако в отноше
лимфатическим дренажом. Механизм экстрава
нии полистироловых НЧ (30, 50, 100 нм) эта ги
зации, предположительно, связан с неплотны
потеза не подтвердилась - in vitro М1 макрофа
ми клеточными контактами между эндотелио
ги демонстрировали более выраженный захват
цитами в опухолевых сосудах [63]. Активная
по сравнению с М2 фенотипом [73]. Также ока
доставка обеспечивается прикреплением к час
залось, что способность макрофагов к захвату
тице лиганда, специфического для опухоли,
НЧ неодинакова в различных животных моде
например, для эндотелия неопластических со
лях, что необходимо учитывать при интерпрета
судов, межклеточного матрикса в опухоли, по
ции результатов. Так, в экспериментах in vitro на
верхностного или внутриклеточного рецепторов
смешанной популяции макрофагов костного
трансформированных клеток [64]. Примеча
мозга мышей пород C57BL/6 и BALB/c был об
тельно, что, хотя метаанализ 224 работ показал
наружен более выраженный захват НЧ разме
преимущество активной доставки частиц в опу
ром 300 нм макрофагами мышей линии BALB/c
холь перед пассивной доставкой (0,9 и 0,6% от
по сравнению с мышами линии C57BL/6. Авто
вводимой дозы соответственно), прямое сравне
ры отмечают, что для мышей линии C57BL/6 со
ние двух стратегий доставки не выявило разли
отношение М1/М2 макрофагов в организме бы
чий между ними [65]. Следует отметить, что на
ло смещено в сторону образования М1 макро
копление НЧ в опухолевых тканях еще не озна
фагов, тогда как для мышей линии BALB/с -
чает их доставку к опухолевым клеткам. После
в сторону М2 макрофагов. Кроме того, существу
преодоления сосудистого барьера НЧ контакти
ют различия и на уровне рецепторов - у мышей
руют в первую очередь с клетками стромы (пе
BALB/c, в отличие от мышей C57BL/6, выявлена
рицитами, фибробластами), лейкоцитами (мак
экспрессия маннозного рецептора MMR [74].
рофагами, нейтрофилами) и компонентами
Еще одним фактором, потенциально опре
межклеточного матрикса [60]. Адсорбция НЧ в
деляющим аффинность НЧ к М1/М2 клеткам,
строме опухоли существенно снижает долю НЧ,
является формирование белковой «короны» на
взаимодействующих с опухолевыми клетками, и
поверхности НЧ. В частности, в бессывороточ
активная доставка не решает эту проблему.
ной среде НЧ кремния размером 50-1000 нм
Действительно, в последние годы накаплива
захватываются преимущественно M1 , но не
ются данные о том, что НЧ доставляют препара
M2 макрофагами. По одной из гипотез, это
ты не к опухолевым, а к стромальным клеткам
обусловлено морфологией М1 макрофагов. По
опухолевого микроокружения. Так, с использо
сравнению с М2 фенотипом, эти клетки отли
ванием интравитальной микроскопии было по
чаются более крупными размерами и уплощен
казано, что при внутривенном введении НЧ на
ной формой, что способствует образованию
капливаются преимущественно в опухолевых
неспецифических контактов с НЧ. В то же вре
макрофагах [66]. Те же авторы показали, что за
мя добавление сыворотки подавляет фагоцитар
хват НЧ опухолевыми макрофагами является
ную активность макрофагов в отношении НЧ
важным механизмом накопления доставляемого
малого размера (≤ 200 нм), но стимулирует по
препарата в опухоли, а деплеция этих клеток де
глощение крупных частиц М2 макрофагами.
лает лечение неэффективным [67]. О накопле
В отношении малых НЧ показано, что их размер
нии НЧ в макрофагах сообщают и другие авторы
способствует образованию белковой «короны» с
[68]. Методом магнитно резонансной томогра
преимущественным содержанием в ней фибри
фии (МРТ) также было продемонстрировано на
ногена, кининогена и обогащенных гистидином
копление применяемого в клинической практи
гликопротеинов, что является лимитирующим
ке ферумокситола в опухолевых макрофагах [69].
фактором для их захвата макрофагами. Разли
Примечательно, что онколитические вирусы,
чия же в захвате крупных частиц могут объяс
попадая в опухоль, тоже контактируют преиму
няться способностью М2 макрофагов к рецеп
щественно с неопухолевыми клетками [70, 71].
торно опосредованному эндоцитозу НЧ, по
БИОХИМИЯ том 84 вып. 7 2019
НАНОЧАСТИЦЫ ДЛЯ РЕПРОГРАММИРОВАНИЯ ОПУХОЛЕВЫХ МАКРОФАГОВ
941
крытых белковой «короной» [75]. Действитель
более выраженное воздействие на дифференци
но, согласно данным литературы, набор
ровку макрофагов (J774.A1) в М1 фенотип, что
экспрессируемых M1 и M2 макрофагами ре
может быть обусловлено различиями в механиз
цепторов не идентичен, что обусловливает раз
мах захвата этих частиц [80]. Согласно другим
личие в эффективности процессов эндоцитоза.
данным, в отличие от золотых частиц, именно
Полагают, что процесс захвата НЧ, осуществля
НЧ серебра вызывали М1 поляризацию макро
емый тем или иным фенотипом макрофагов,
фагов линии RAW264.7 [81]. И в том, и в другом
определяется мишенью: М1 макрофаги склон
случае эффективность поляризации оценивали
ны к эндоцитозу золотистого стафилококка
по уровню секреции цитокинов IL 1, IL 6,
(Staphylococcus aureus), тогда как M2 макрофаги
TNFα и TNFα, IL 6, NF κB соответственно. Об
- к эндоцитозу миелина, апоптотических кле
отсутствии иммуностимуляторного эффекта
ток и частиц латекса [74]. Показано, что в отли
частиц золота на макрофаги свидетельствуют и
чие от М1 фенотипа, M2 макрофаги экспресси
другие работы [82-84]. Существует мнение, что
руют рецептор к IgG (FCGR2B [CD32]), окис
разнородность имеющихся в литературе данных
ленным липидам (CD36 и COLEC12) и факто
вызвана различиями экспериментальных усло
рам комплемента (ITGAM или CR3) [75].
вий, и ее можно преодолеть путем более деталь
Захват НЧ опухолевыми макрофагами тра
ного фенотипирования субпопуляций макрофа
диционно рассматривают как биологический
гов [11]. Так, согласно данным MacParland et al.,
барьер для их доставки к опухолевым клеткам, а
in vitro захват НЧ золота размером 100 нм макро
значит, как препятствие для терапии. С другой
фагами, поляризованными цитокинами IL 4/
стороны, приведенные выше результаты иссле
IL 10 (М2) и TGFβ/IL 10 (M2с), протекает на
дований указывают на принципиальную воз
40% эффективнее и быстрее по сравнению с те
можность использования наноносителей для
ми, чья поляризация проходила под действием
доставки стимулирующих сигналов в макрофаги
IFN γ/LPS (M1). Было показано, что в целом
и активации противоопухолевого иммунного
эффективность захвата НЧ определяется следу
ответа.
ющей тенденцией: M2c > M2 > M2b > M2a >
MCSF > M1 > моноциты. Аналогичные данные
были получены для НЧ кремния [11].
ВЛИЯНИЕ ФИЗИКО8ХИМИЧЕСКИХ
При сопоставлении уровня цитокинов (IL 6
СВОЙСТВ НАНОЧАСТИЦ
и IL 1β), продуцируемых макрофагами линии
НА ЭФФЕКТИВНОСТЬ ПОЛЯРИЗАЦИИ
RAW264.7 под воздействием НЧ оксида титана,
МАКРОФАГОВ
оксида цинка и серебра, был выявлен дозозави
симый провоспалительный эффект, наиболее
Хорошо известно, что НЧ сами по себе спо
ярко выраженный для НЧ серебра [85]. Сущест
собны модулировать иммунный ответ. Одним из
венный сдвиг в сторону М1 фенотипа (130 и
пусковых механизмов активации неспецифи
30 кратное повышение экспрессии IL 1β и
ческого иммунитета является распознавание
TNFα соответственно) наблюдали при инкуба
клетками молекулярных паттернов, ассоцииро
ции макрофагов человека с НЧ оксида кремния
ванных с патогенами за счет специальных ре
[86]. В этом же исследовании отмечали умерен
цепторов, в т.ч. TLR. В результате дальнейшего
ный провоспалительный эффект НЧ кобальта
каскада событий происходит секреция цитоки
(50-200 нм), тогда как НЧ оксидов титана
нов и активация макрофагов и нейтрофилов
(70 нм) и циркония (5-30 нм) не оказывали вли
[76]. Так, некоторые НЧ способны запускать ак
яния на макрофаги. Механизм выраженного
тивацию иммунной системы за счет взаимодей
провоспалительного эффекта НЧ оксида крем
ствия с TLR2 (катионные липосомы, [77]) и
ния предположительно связан с повышением
TLR7 (вирусоподобные частицы), что может
экспрессии CD14 - корецептора TLR4, в ре
быть использовано при создании бактериаль
зультате чего макрофаг реагирует на частицы
ных [78] и вирусных вакцин [79].
как на ЛПС [86].
К настоящему моменту накоплены данные,
НЧ оксида железа (ферумокситол) вызывают
позволяющие оценить вклад различных пара
провоспалительный ответ макрофагов и их по
метров - размера, формы и материала наноно
ляризацию в противоопухолевое состояние. Это
сителя - на эффективность поляризации мак
сопровождается усилением экспрессии CD80 и
рофагов. Однако подавляющее большинство
снижением экспрессии CD206 на макрофагах
исследований в данной области выполнено на
опухоли, а также повышением активности кас
моделях in vitro.
пазы 3 в клетках опухоли, сокультивируемых с
Было показано, что НЧ золота, по сравне
макрофагами [87]. Важно отметить, что in vivo
нию с НЧ серебра того же размера, оказывают
ферумокситол ингибирует рост первичного опу
БИОХИМИЯ том 84 вып. 7 2019
942
КАПИТАНОВА и др.
холевого очага на ранних стадиях канцерогенеза
ностержни золота при покрытии GLF пепти
и предотвращает развитие метастазов в печени
дом индуцируют М1 поляризацию макрофагов
[88]. Механизм активации макрофагов НЧ ок
печени, тогда как покрытие RGD пептидом вы
сида железа связывают с изменением внутри
зывает М2 поляризацию [93]. Гликокаликсопо
клеточной концентрации железа, повышением
добные НЧ также способны повышать уровень
активности ферритина и катепсина [89].
экспрессии CD86 и IL 12 и подавлять экспрес
В настоящее время нет единого мнения о ро
сию CD206, CD23 и IL 10 в перитонеальных
ли размера НЧ в активации макрофагов. Есть
макрофагах in vitro. Способность данных частиц
данные о том, что крупные частицы графена
к репрограммированию макрофагов была также
(750-1300 нм) вызывают наиболее выраженную
подтверждена in vivo [94]. Аналогичным эффек
экспрессию мРНК iNOS и продукцию цитоки
том обладают полистироловые НЧ с карбокси
нов (TNFα, IL 6, IL 1β) в макрофагах по срав
и аминогруппами на поверхности, однако меха
нению с частицами среднего (350-750 нм) и ма
низм их действия остается неизученным [95].
лого (50-350 нм) размеров [90]. Последние луч
Интересно, что использование полистироловых
ше проникают в клетки, но не активируют TLR4
НЧ с нефункционализированной поверхностью
и NF κB. Однако для большинства других час
не оказывает влияния на поляризацию макро
тиц (золота, серебра, алюминия) эффектив
фагов in vitro [73].
ность М1 активации и степень захвата НЧ эти
Наряду со свойствами НЧ, их взаимодей
ми клетками повышались с уменьшением раз
ствие с макрофагами зависит также от биологи
мера НЧ [80, 81].
ческих факторов. Так, для мышей линии
Существует мнение, что интенсивность за
C57BL/6 поляризация макрофагов в M1 состоя
хвата НЧ макрофагами зависит не столько от
ние не повлияла на интенсивность захвата НЧ,
размера, сколько от площади поверхности час
тогда как для мышей линии BALB/c было отме
тиц, доступной для контакта с клетками. Со
чено снижение этого параметра; при поляриза
гласно гипотезе Doshi et al., НЧ распознаются
ции макрофагов мышей линии C57BL/6 в
макрофагами по принципу, сходному с таковым
М2 состояние интенсивность захвата ими частиц
у микроорганизмов, - и в том, и в другом случае
возрастала, а в случае мышей линии BALB/c - не
форма и размер распознаваемой структуры иг
изменялась [74].
рают важную роль. Морфологические особен
ности плазматической мембраны макрофагов
(в частности, ее способность к быстрому фор
НАНОВЕКТОРЫ ДЛЯ ДОСТАВКИ
мированию многочисленных выростов, называ
ИММУНОПРЕПАРАТОВ
емых раффлами) оказывают влияние на эффек
К ОПУХОЛЕВЫМ МАКРОФАГАМ
тивность захвата. Таким образом, ориентация
частицы относительно раффлов определяет ко
Результаты экспериментальных исследова
личество контактов, образуемых с мембраной
ний, опубликованных к настоящему времени,
макрофага [91].
позволяют сделать вывод о существовании сти
Исследование вопроса об эффективности
мулирующего влияния наноносителей на акти
захвата НЧ макрофагами опухоли в зависимости
вацию макрофагов. Гораздо меньшее количест
от поверхностного заряда частиц показало, что
во работ посвящено исследованию нановекто
НЧ с положительным зарядом в большей степе
ров для доставки иммунопрепаратов к опухоле
ни подвержены фагоцитозу по сравнению с от
вым макрофагам. Способность самих наноно
рицательно заряженными НЧ. При этом захват
сителей активировать макрофаги дает основа
макрофагами нейтральных носителей является
ния предвидеть их адъювантные свойства при
наиболее редким событием. Однако примене
доставке иммуноактивных соединений. Так, по
ние частиц как с высоким положительным, так
казано, что упаковка CpG олигонуклеотидов
и с высоким отрицательным зарядом также не
(агонист TLR9) в НЧ приводит к более эффек
эффективно, о чем свидетельствует преимуще
тивному захвату препарата клетками [96, 97], его
ственное накопление таких НЧ в печени, но не
аккумуляции в лимфатических узлах [98] и вы
в тканях опухоли [92].
раженному терапевтическому эффекту [99]. НЧ,
Кроме того, влияние на захват наноносите
загруженные агонистом TLR3 (Poly I:C), были
лей макрофагами оказывают их механические
успешно использованы для доставки противо
свойства: твердые частицы поглощаются за счет
опухолевой вакцины [100] и активации проти
клатрин опосредованного эндоцитоза, а мяг
воопухолевого иммунитета [101]. НЧ также мо
кие - за счет пиноцитоза [92]. На захват НЧ
гут применяться для сочетанной активации не
макрофагами и активацию последних может
скольких TLR [102]. Помимо этого, НЧ влияют
также влиять покрытие частиц. Например, на
на активность дендритных клеток [103, 104], что
БИОХИМИЯ том 84 вып. 7 2019
НАНОЧАСТИЦЫ ДЛЯ РЕПРОГРАММИРОВАНИЯ ОПУХОЛЕВЫХ МАКРОФАГОВ
943
может быть использовано для активации СD8+
внутривенном, так и при внутриопухолевом
Т лимфоцитов [78, 105].
введении [58]. Следует отметить, что на фоне те
Повышение эффективности наноформули
рапии количество макрофагов в опухоли увели
рованных иммунопрепаратов по сравнению с их
чивалось, но при этом наблюдался их сдвиг в
применением в свободной форме достигается
сторону провоспалительного фенотипа. Ранее
благодаря накоплению частиц в фагоцитах од
было показано, что IL 12, инкапсулированный
новременно со снижением побочных систем
в микрочастицы, также способен стимулировать
ных эффектов. Так, например, внутриклеточная
иммунный ответ и тормозить рост опухоли [110].
локализация TLR9 резко уменьшает эффектив
В другой работе исследовали иммунотера
ность CpG in vivo [106], что может быть преодо
певтический потенциал частиц марганца
лено путем доставки олигонуклеотида на НЧ.
(180 нм), покрытых гиалуроновой кислотой и
Действительно, частицы золота показали свою
маннатом [111]. Функционализация поверх
эффективность при доставке CpG к макрофагам
ности частиц была обусловлена тем, что на по
in vitro, при этом мелкие частицы (15 нм) оказы
верхности М2 макрофагов в большом количе
вали более выраженный иммуностимуляторный
стве экспрессируется маннозный рецептор, а
эффект, чем крупные частицы (30, 80 нм). Внут
гиалуроновая кислота является агентом, спосо
риопухолевая инъекция молекул CpG в составе
бствующим активации макрофагов за счет про
полимерных нанокомплексов приводила к вы
дукции активных форм кислорода [112]. Было
раженной инфильтрации опухоли макрофагами
показано, что системное введение НЧ приво
и дендритными клетками (CD11b+, CD11c+) и
дило к репрограммированию макрофагов и
обеспечивала более существенный терапевти
снижению внутриопухолевой гипоксии. Ука
ческий эффект по сравнению со свободным
занные изменения в опухолевом микроокруже
CpG [107]. Применение НЧ железа, конъюгиро
нии приводили к торможению опухолевого
ванных с CpG, также оказалось эффективным
роста, особенно в сочетании с терапией доксо
для активации противоопухолевого иммунного
рубицином.
ответа: авторы отмечали инфильтрацию опухо
Совсем недавно была исследована роль на
ли активированными НК, CD4+ T , CD8+ T
ноформулированного метотрексата в терапии
клетками и повышение уровня продукции IFN γ
рака яичника ID8 [24]. Авторы загружали препа
спленоцитами [108]. Кроме того, исследовате
рат на дендримерные НЧ и вводили внутрибрю
лями было отмечено снижение скорости роста
шинно. Действие препарата было направлено на
опухолей рака прямой кишки мыши С26 и рака
деплецию, а не на репрограммирование опухо
молочной железы мыши 4Т1. При этом в случае
левых макрофагов. Применение наноформули
4Т1 было также зафиксировано снижение коли
рованной формы позволило добиться снижения
чества метастатических очагов в легких [108].
количества опухолевых стволовых клеток и мак
Несмотря на то, что в указанной работе непо
рофагов, а также подавления VEGF опосредо
средственно опухолевые макрофаги не изучали,
ванного ангиогенеза, что привело к повышению
результаты аналогичного исследования [107]
выживаемости экспериментальных животных
позволяют предположить, что противоопухоле
по сравнению с группой, получавшей свобод
вый эффект CpG в составе полимерных наноком
ную форму препарата [24].
плексов может быть опосредован поляризацией
макрофагов.
Привлекательной стратегией является дос
ПРОБЛЕМЫ И ПЕРСПЕКТИВЫ МЕТОДА
тавка в опухоль цитокинов для модуляции про
РЕПРОГРАММИРОВАНИЯ ОПУХОЛЕВЫХ
тивоопухолевого иммунного ответа. Так, приме
МАКРОФАГОВ ПРИ ПОМОЩИ
нение НЧ магнетита для доставки IFN γ под
ПРЕПАРАТОВ, ДОСТАВЛЯЕМЫХ
действием внешнего магнитного поля приводит
НА НАНОЧАСТИЦАХ
к почти полной элиминации аденокарциномы
Pan02. При этом в инфильтрате опухоли опреде
Несмотря на то, что проблеме поляризации
ляется увеличение количества макрофагов
макрофагов с использованием НЧ посвящено
(LAMP 2+), Т лимфоцитов (CD3+) и НК клеток
значительное количество исследований, остает
(Ly49G2+), а интенсивность васкуляризации
ся открытым вопрос о том, какие свойства нано
опухоли сильно снижается. Сходные данные
носителя определяют его преимущественное на
были получены при индукции опухоли хими
копление в макрофагах. Одним из серьезных ог
ческим агентом 3 метилхолантреном [109]. По
раничений исследований, связанных с воздей
лимерные НЧ, несущие IL 12 - ключевой регу
ствием на опухолевые М1/М2 макрофаги, явля
лятор активности макрофагов, - успешно пока
ется то, что подавляющее большинство работ
зали себя при лечения меланомы B16 как при
проведено в модельных системах in vitro, кото
БИОХИМИЯ том 84 вып. 7 2019
944
КАПИТАНОВА и др.
рые не отражают многокомпонентность и слож
щи разработки алгоритма тестирования имму
ность связей опухолевого микроокружения. При
нопрепаратов в составе нанокомплексов. На
системном введении НЧ необходимо учитывать
первом этапе необходимо выбрать оптимальный
биологические факторы, среди которых: взаимо
вектор доставки препаратов путем оценки на
действие НЧ с внутрисосудистыми лейкоцита
копления НЧ различной физико химической
ми, механизмы выхода НЧ из сосудов, диффузия
структуры в опухоли методом ИВМ. На втором
НЧ в опухолевых тканях и, наконец, степень их
этапе нужно оценить in vitro эффективность
накопления в опухолевых и стромальных клет
кандидатных иммунопрепаратов при их загруз
ках опухоли в зависимости от гистологической
ке на выбранный наноноситель. Наконец, на
структуры новообразования. До недавнего вре
третьем этапе тестирование наноформулиро
мени изучение указанных процессов было за
ванных иммунопрепаратов, показавших наи
труднено в связи с отсутствием адекватных мето
лучшие результаты in vitro, должно проводиться
дов оценки динамических процессов in vivo. Си
на животных моделях. Предложенный алгоритм
туация изменилась с появлением метода интра
позволит оптимизировать стратегию поляриза
витальной микроскопии (ИВМ), позволяющего
ции макрофагов для иммунотерапии опухолей.
прижизненно наблюдать взаимодействие клеток
и частиц в интактных тканях лабораторных жи
Поскольку современные методы терапии
вотных в режиме реального времени. Использо
онкологических заболеваний далеки от совер
вание ИВМ позволяет оценить время циркуля
шенства, исследователи ведут поиск принципи
ции НЧ в сосудах, идентифицировать клетки
ально новых подходов. Один из таких подхо
мишени в опухолевом микроокружении, изу
дов - иммунотерапия опухолей - предполагает
чить локусы утечки в различных опухолевых мо
борьбу с опухолью путем активации иммунного
делях. В существующих на сегодняшний день
ответа организма. Ключевой задачей иммуноте
исследованиях отсутствует этап выбора опти
рапии опухолей является восстановление пато
мального наноносителя для специфической дос
логически измененного опухолевого микроок
тавки стимулирующих сигналов к опухолевым
ружения, в частности репрограммирование опу
макрофагам. Этот пробел может быть восполнен
холевых макрофагов из иммуносупрессивного
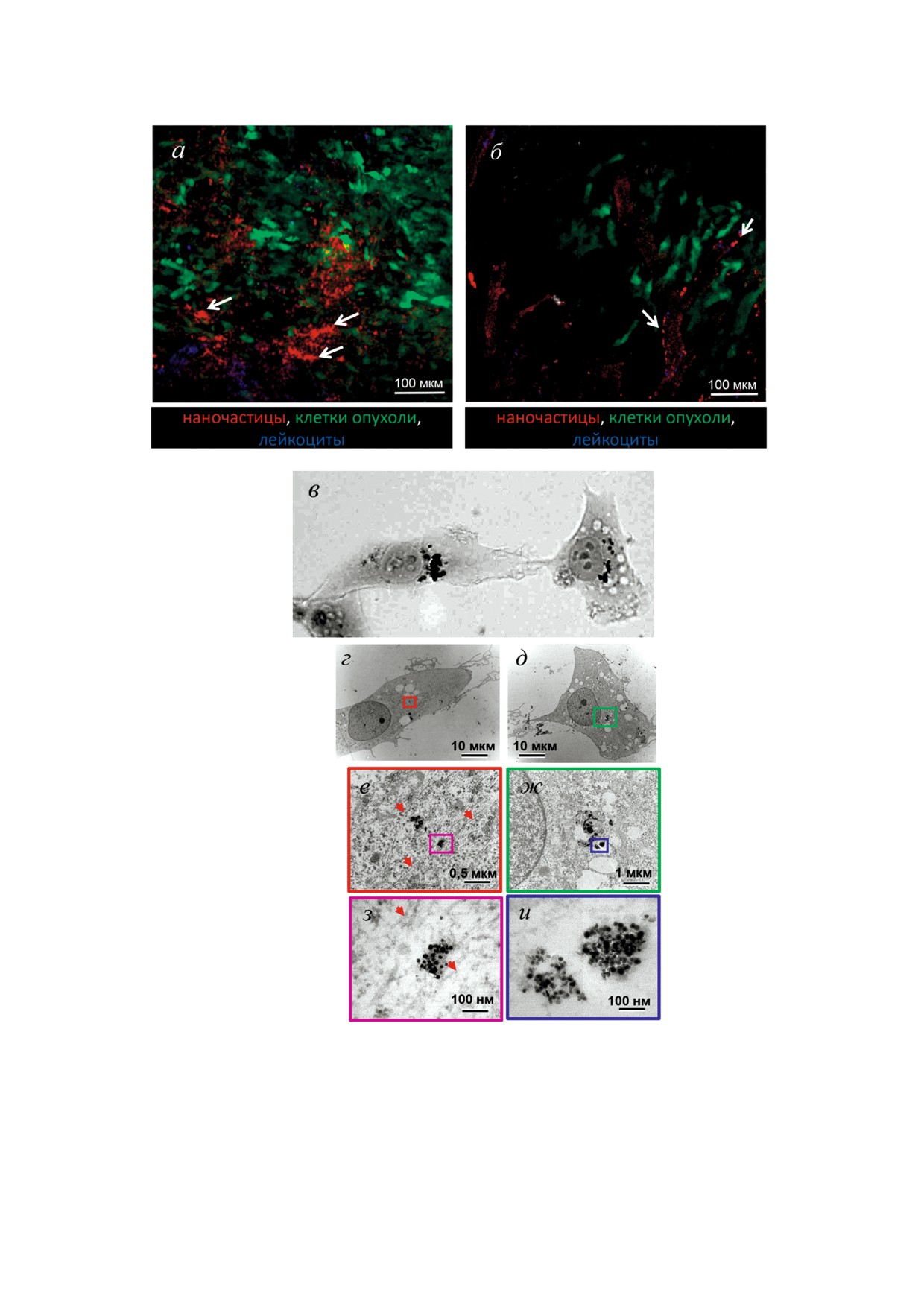
с использованием ИВМ. Так, предварительные
М2 фенотипа в провоспалительный М1 фено
данные, полученные в нашей лаборатории, ука
тип. Для решения этой нетривиальной задачи
зывают на то, что магнитные НЧ преимущест
используются различные методики, и одним из
венно накапливаются в стромальных клетках,
наиболее перспективных представляется метод
морфологически схожих с макрофагами, в то
репрограммирования опухолевых макрофагов
время как липосомы адсорбируются на стенках
при помощи препаратов, доставляемых к мак
опухолевых сосудов (рис. 3, а, б).
рофагам посредством нановекторов.
Наряду с идентификацией клеток мишеней
Несмотря на обнадеживающие перспективы
для НЧ необходимо определить их субклеточ
концепции репрограммирования опухолевых
ную локализацию, поскольку агонисты внут
макрофагов, ее применение в клинической
риклеточных и поверхностных рецепторов эф
практике требует более детального исследова
фективны при их доставке к соответствующим
ния как морфофункциональных свойств самих
клеточным структурам. Для решения указанной
макрофагов в очаге опухоли, так и тщательной
задачи необходимо изучение интернализации
отработки методов доставки лекарств на нано
НЧ на ультраструктурном уровне (рис. 3, г-и).
частицах, в т.ч. обеспечение стабильности заяв
Также представляется перспективным метод
ленных свойств синтезируемых наноносителей.
корреляционной интравитальной/электронной
Одной из главных проблем, стоящих на пути
микроскопии, в котором прижизненное иссле
применения противоопухолевой терапии, наце
дование накопления НЧ в опухолевом микроок
ленной на модификацию микроокружения опу
ружении дополняется ультраструктурным ана
холи, является невысокая эффективность дос
лизом выбранных участков опухоли.
тавки нанокомплексов к макрофагам опухоли.
Другой важной задачей является выбор им
Недостаточность знаний о специфичности фе
мунопрепаратов, наиболее эффективных для
нотипа этих клеток затрудняет их выявление и
поляризации макрофагов при их доставке на
повышает риск негативного воздействия на
НЧ. Большинство существующих данных полу
макрофаги нецелевых органов (печени, легких и
чено в исследованиях, проведенных с использо
селезенки). Кроме того, наличие одноименных
ванием различных клеточных линий, НЧ и им
рецепторов на клетках, отличных от макрофа
мунопрепаратов, что не позволяет напрямую
гов, может вызывать кросс реактивность. Ре
сравнить эффективность описанных подходов.
зультатом такого воздействия становится не
Решение указанной задачи возможно при помо
контролируемый выброс провоспалительных
БИОХИМИЯ том 84 вып. 7 2019
НАНОЧАСТИЦЫ ДЛЯ РЕПРОГРАММИРОВАНИЯ ОПУХОЛЕВЫХ МАКРОФАГОВ
945
Рис. 3. Использование интравитальной и электронной микроскопии при выборе оптимального наноносителя для достав
ки препаратов. а, б - Накопление магнитных наночастиц (а, стрелки) и липосом (б, стрелки) в опухоли 4Т1 GFP, интра
витальная микроскопия (микрофотография Науменко В.А.); в - фазово контрастное изображение клеток фибросаркомы
человека HT1080; г-и - изображения тех же клеток, полученные с помощью трансмиссионной электронной микроско
пии (корреляционная световая электронная микроскопия) при разных увеличениях: магнитные наночастицы свободно
лежат в цитоплазме клеток, часть агрегатов наночастиц контактирует с микротрубочками (е, з - микротрубочки отмече
ны красными стрелками); в-и - микрофотографии из работы Alieva et al. [113], с изменениями
БИОХИМИЯ том 84 вып. 7 2019
946
КАПИТАНОВА и др.
цитокинов, оказывающий отрицательное влия
денцией исследований в области наномедици
ние на общее состояние пациента, что было по
ны в настоящее время является сокращение эта
казано на примере применения инкапсулиро
пов синтеза наночастиц и синтез более простых
ванной в липосомы золедроновой кислоты [114,
носителей [122].
115]. В настоящее время большое внимание уде
Обобщая существующие проблемы развития
ляется поиску специфичных для опухолевых
иммунотерапии опухолей, основанной на вос
макрофагов молекул, которые смогут служить
становлении патологически измененного опу
мишенями для противоопухолевой терапии, т.к.
холевого микроокружения, следует отметить,
специфичность молекул VEGF, MMPs, TGFβ и
что главной задачей на пути ее применения в
CXCL 12 подвергается сомнению [116]. Другой
клинической практике является обеспечение
перспективной стратегией решения этой проб
возможности успешного перепрограммирова
лемы является разработка подходов модифика
ния (или деплеции) опухолеассоциированных
ции поверхности наноносителей лигандами, что
М2 макрофагов при одновременном сохране
позволяет предотвратить поглощение наночас
нии в интактном состоянии макрофагов в неце
тиц клетками нецелевых органов. В частности,
левых органах и противоопухолевых М1 макро
модификация наноносителей лигандами,
фагов в очаге опухоли.
чувствительными к гипоксии или другим фак
Несмотря на имеющиеся в настоящий мо
торам микроокружения опухоли, позволяет ин
мент сложности и нерешенные проблемы, дан
капсулированному препарату активироваться
ная концепция лечения онкологических заболе
непосредственно в очаге опухоли [117]. Кроме
ваний имеет ряд неоспоримых преимуществ по
того, проблема эффективности адресной дос
сравнению с доминирующими в современной
тавки может быть решена с помощью ремодели
клинической практике методами воздействия
рования внеклеточного матрикса, имеющего
непосредственно на опухолевые клетки. В част
аномальную структуру в опухоли, а также ре
ности, ее успешность продиктована относитель
программирования иммуносупрессивных кле
ной стабильностью фенотипа макрофагов опу
ток опухолевого микроокружения [118].
холевого микроокружения в процессе лечения,
Второй важной проблемой на пути примене
в то время как антигены на поверхности транс
ния данной терапии является иммуносупрес
формированных клеток постоянно изменяются
сивное микроокружение опухоли, что налагает
в ходе опухолевой прогрессии, что делает прак
определенные ограничения на интенсивность и
тически невозможным их эффективную достав
длительность противоопухолевого воздействия,
ку на протяжении длительного времени, необ
способного активировать и репрограммировать
ходимого для терапии.
иммунную систему пациента. К сопутствующим
Таким образом, модуляция опухолевого
проблемам относится недостаточная эффектив
микроокружения является актуальной задачей
ность и продолжительность функционального
иммунотерапии опухолей, поскольку позволяет
перепрограммирования М2 макрофагов опухо
принципиально по иному подойти к терапии
ли.
онкологических заболеваний. Преимуществен
Для оценки трансляционного потенциала
ное накопление наночастиц в опухолевых мак
препарата критически важно учитывать особен
рофагах дает возможность специфической дос
ности макрофагов человека, что хорошо иллю
тавки иммуностимуляторных сигналов именно
стрирует пример исследования 5,6 диметил
в эти клетки, и данное обстоятельство позволя
ксантенон 4 уксусной кислоты (DMXAA,
ет говорить о рациональности использования
Vadimezan). Этот препарат показал высокую те
наночастиц для репрограммирования опухоле
рапевтическую эффективность на животных
вых макрофагов. Учитывая способность нано
опухолевых моделях за счет поляризации мак
носителей стимулировать макрофаги in vitro и in
рофагов и сосудистого коллапса [119, 120]. Пре
vivo, а также возможное наличие у них адъювант
парат успешно прошел I-II фазы клинических
ных свойств, доставка иммунопрепаратов к мак
испытаний, однако оказался неэффективным
рофагам в составе нанокомплексов - новая
на пациентах из за различий в интерферон сти
перспективная задача, требующая разработки
мулирующих генах (STING) человека и мыши
адекватных исследовательских моделей in vitro и
[121]. Указанный пример демонстрирует необ
in vivo.
ходимость тестирования макрофагов человека
на этапе выбора кандидатных препаратов.
Поддержание стабильности параметров син
Финансирование. Работа выполнена при под
тезируемых наночастиц и исследование вопроса
держке Российского фонда фундаментальных
их токсичности также является важной задачей
исследований (гранты № 18 29 09061 и 18 29
на пути развития терапии, поэтому главной тен
09082) и Программы развития Московского го
БИОХИМИЯ том 84 вып. 7 2019
НАНОЧАСТИЦЫ ДЛЯ РЕПРОГРАММИРОВАНИЯ ОПУХОЛЕВЫХ МАКРОФАГОВ
947
сударственного университета им. М.В. Ломоно
Соблюдение этических норм. Настоящая
сова (MSU Development Program PNR 5).
статья не содержит описания выполненных ав
Конфликт интересов. Авторы заявляют об от
торами исследований с участием людей или ис
сутствии конфликта интересов.
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Mellman, I., Coukos, G., and Dranoff, G. (2011) Cancer
cytokines oncostatin M and eotaxin, Oncotarget, 5,
immunotherapy comes of age, Nature, 480, 480-489, doi:
5350-5368, doi: 10.18632/oncotarget.2110.
10.1038/nature10673.
15.
Noy, R., and Pollard, J.W. (2014) Tumor associated
2.
Mahoney, K.M., Rennert, P.D., and Freeman, G.J. (2015)
macrophages: from mechanisms to therapy, Immunity, 41,
Combination cancer immunotherapy and new
49-61, doi: 10.1016/j.immuni.2014.06.010.
immunomodulatory targets, Nat. Rev. Drug Discov., 14,
16.
Caux, C., Ramos, R.N., Prendergast, G.C., Bendriss
561-584, doi: 10.1038/nrd4591.
Vermare, N., and Menetrier Caux, C. (2016) A milestone
3.
Pardoll, D.M. (2012) The blockade of immune check
review on how macrophages affect tumor growth, Cancer
points in cancer immunotherapy, Nat. Rev. Cancer, 12,
Res., 76, 6439-6442, doi: 10.1158/0008 5472.can 16 2631.
252-264, doi: 10.1038/nrc3239.
17.
Colegio, O.R., Chu, N. Q., Szabo, A.L., Chu, T.,
4.
Neelapu, S.S., Tummala, S., Kebriaei, P., Wierda, W.,
Rhebergen, A.M., Jairam, V., Cyrus, N., Brokowski, C.E.,
Gutierrez, C., Locke, F.L., Komanduri, K.V., Lin, Y., Jain,
Eisenbarth, S.C., Phillips, G.M., Cline, G.W., Phillips,
N., Daver, N., Westin, J., Gulbis, A.M., Loghin, M.E., de
A.J., and Medzhitov, R. (2014) Functional polarization of
Groot, J.F., Adkins, S., Davis, S.E., Rezvani, K., Hwu, P.,
tumour associated macrophages by tumour derived lactic
and Shpall, E.J. (2018) Chimeric antigen receptor T cell
acid, Nature, 513, 559-563, doi: 10.1038/nature13490.
therapy - assessment and management of toxicities, Nat.
18.
Biswas, S.K., Sica, A., and Lewis, C.E. (2008) Plasticity of
Rev. Clin. Oncol., 15, 47-62, doi: 10.1038/nrclinonc.
macrophage function during tumor progression: regulation
2017.148.
by distinct molecular mechanisms, J. Immunol., 180,
5.
Romero, D. (2018) Immunotherapy: oncolytic viruses
2011-2017.
prime antitumour immunity, Nat. Rev. Clin. Oncol., 15,
19.
MacGregor, H.L., and Ohashi, P.S. (2017) Molecular
135, doi: 10.1038/nrclinonc.2018.15.
pathways: evaluating the potential for B7 H4 as an
6.
Valkenburg, K.C., de Groot, A.E., and Pienta, K.J. (2018)
immunoregulatory target, Clin. Cancer Res., 23, 2934-
Targeting the tumour stroma to improve cancer therapy,
2941, doi: 10.1158/1078 0432.ccr 15 2440.
Nat. Rev. Clin. Oncol., 15, 366-381, doi: 10.1038/s41571
20.
Ruffell, B., and Coussens, L.M. (2015) Macrophages and
018 0007 1.
therapeutic resistance in cancer, Cancer Cell, 27, 462-472,
7.
Murdoch, C., Giannoudis, A., and Lewis, C.E. (2004)
doi: 10.1016/j.ccell.2015.02.015.
Mechanisms regulating the recruitment of macrophages
21.
Hughes, R., Qian, B. Z., Rowan, C., Muthana, M.,
into hypoxic areas of tumors and other ischemic tissues,
Keklikoglou, I., Olson, O.C., Tazzyman, S., Danson, S.,
Blood, 104, 2224-2234, doi: 10.1182/blood 2004 03 1109.
Addison, C., Clemons, M., Gonzalez Angulo, A.M.,
8.
Lewis, C.E., and Pollard, J.W. (2006) Distinct role of
Joyce, J.A., De Palma, M., Pollard, J.W., and Lewis, C.E.
macrophages in different tumor microenvironments,
(2015) Perivascular M2 macrophages stimulate tumor
Cancer Res., 66, 605-612, doi:10.1158/0008 5472.can 05
relapse after chemotherapy, Cancer Res., 75, 3479-3491,
4005.
doi: 10.1158/0008 5472.can 14 3587.
9.
Martinez, F.O. (2011) Regulators of macrophage activa
22.
Yang, L., and Zhang, Y.
(2017) Tumor associated
tion, Eur. J. Immunol., 41, 1531-1534, doi: 10.1002/eji.
macrophages: from basic research to clinical application,
201141670.
J. Hematol. Oncol., 10, 58, doi: 10.1186/s13045 017 0430 2.
10.
Miao, X., Leng, X., and Zhang, Q. (2017) The current
23.
Kim, D. S., Dastidar, H., Zhang, C., Zemp, F.J., Lau, K.,
state of nanoparticle induced macrophage polarization
Ernst, M., Rakic, A., Sikdar, S., Rajwani, J., Naumenko,
and reprogramming research, Int. J. Mol. Sci., 18, 336, doi:
V., Balce, D.R., Ewanchuk, B.W., Tailor, P., Yates, R.M.,
10.3390/ijms18020336.
Jenne, C., Gafuik, C., and Mahoney, D.J. (2018) Author
11.
MacParland, S.A., Tsoi, K.M., Ouyang, B., Ma, X. Z.,
correction: Smac mimetics and oncolytic viruses synergize
Manuel, J., Fawaz, A., Ostrowski, M.A., Alman, B.A.,
in driving anticancer T cell responses through comple
Zilman, A., Chan, W.C.W., and McGilvray, I.D. (2017)
mentary mechanisms, Nat. Commun., 9, 2109, doi:
Phenotype determines nanoparticle uptake by human
10.1038/s41467 018 04597 8.
macrophages from liver and blood, ACS Nano, 11,
24.
Penn, C.A., Yang, K., Zong, H., Lim, J. Y., Cole, A.,
2428-2443, doi: 10.1021/acsnano.6b06245.
Yang, D., Baker, J., Goonewardena, S.N., and
12.
Mills, C.D., and Ley, K. (2014) M1 and M2 macrophages:
Buckanovich, R.J. (2018) Therapeutic impact of nanopar
the chicken and the egg of immunity, J. Innate Immun., 6,
ticle therapy targeting tumor associated macrophages,
716-726, doi: 10.1159/000364945.
Mol. Cancer Ther., 17, 96-106, doi: 10.1158/1535
13.
Zhou, D., Huang, C., Lin, Z., Zhan, S., Kong, L., Fang,
7163.mct 17 0688.
C., and Li, J. (2014) Macrophage polarization and func
25.
Germano, G., Frapolli, R., Belgiovine, C., Anselmo, A.,
tion with emphasis on the evolving roles of coordinated
Pesce, S., Liguori, M., Erba, E., Uboldi, S., Zucchetti, M.,
regulation of cellular signaling pathways, Cell. Signal., 26,
Pasqualini, F., Nebuloni, M., van Rooijen, N., Mortarini,
192-197, doi: 10.1016/j.cellsig.2013.11.004.
R., Beltrame, L., Marchini, S., Fuso Nerini, I., Sanfilippo,
14.
Tripathi, C., Tewari, B.N., Kanchan, R.K., Baghel, K.S.,
R., Casali, P.G., Pilotti, S., Galmarini, C.M., Anichini, A.,
Nautiyal, N., Shrivastava, R., Kaur, H., Bhatt, M.L.B.,
Mantovani, A., D’Incalci, M., and Allavena, P. (2013)
and Bhadauria, S. (2014) Macrophages are recruited to
Role of macrophage targeting in the antitumor activity of
hypoxic tumor areas and acquire a pro angiogenic
trabectedin, Cancer Cell, 23, 249-262, doi: 10.1016/j.ccr.
M2 polarized phenotype via hypoxic cancer cell derived
2013.01.008.
БИОХИМИЯ том 84 вып. 7 2019
948
КАПИТАНОВА и др.
26.
De Palma, M., Venneri, M.A., Galli, R., Sergi, L.S., Politi,
35.
Sandhu, S.K., Papadopoulos, K., Fong, P.C., Patnaik, A.,
L.S., Sampaolesi, M., and Naldini, L. (2005) Tie2 identi
Messiou, C., Olmos, D., Wang, G., Tromp, B.J., Puchalski,
fies a hematopoietic lineage of proangiogenic monocytes
T.A., Balkwill, F., Berns, B., Seetharam, S., de Bono, J.S.,
required for tumor vessel formation and a mesenchymal
and Tolcher, A.W. (2013) A first in human, first in class,
population of pericyte progenitors, Cancer Cell,
8,
phase I study of carlumab (CNTO 888), a human mono
211-226, doi: 10.1016/j.ccr.2005.08.002.
clonal antibody against CC chemokine ligand 2 in patients
27.
Cassier, P.A., Italiano, A., Gomez Roca, C.A., Le
with solid tumors, Cancer Chemother. Pharmacol., 71,
Tourneau, C., Toulmonde, M., Cannarile, M.A., Ries, C.,
1041-1050, doi: 10.1007/s00280 013 2099 8.
Brillouet, A., Muller, C., Jegg, A. M., Broske, A. M.,
36.
Brana, I., Calles, A., LoRusso, P.M., Yee, L.K., Puchalski,
Dembowski, M., Bray French, K., Freilinger, C.,
T.A., Seetharam, S., Zhong, B., de Boer, C.J., Tabernero,
Meneses Lorente, G., Baehner, M., Harding, R.,
J., and Calvo, E.
(2015) Carlumab, an anti C C
Ratnayake, J., Abiraj, K., Gass, N., Noh, K., Christen,
chemokine ligand 2 monoclonal antibody, in combination
R.D., Ukarma, L., Bompas, E., Delord, J. P., Blay, J. Y.,
with four chemotherapy regimens for the treatment of
and Ruttinger, D. (2015) Csf1r inhibition with emac
patients with solid tumors: an open label, multicenter
tuzumab in locally advanced diffuse type tenosynovial
phase
1b study, Target. Oncol.,
10,
111-123, doi:
giant cell tumours of the soft tissue: a dose escalation and
10.1007/s11523 014 0320 2.
dose expansion phase 1 study, Lancet Oncol., 16, 949-956,
37.
Pyonteck, S.M., Akkari, L., Schuhmacher, A.J., Bowman,
doi: 10.1016/s1470 2045(15)00132 1.
R.L., Sevenich, L., Quail, D.F., Olson, O.C., Quick, M.L.,
28.
Movahedi, K., Schoonooghe, S., Laoui, D., Houbracken,
Huse, J.T., Teijeiro, V., Setty, M., Leslie, C.S., Oei, Y.,
I., Waelput, W., Breckpot, K., Bouwens, L., Lahoutte, T.,
Pedraza, A., Zhang, J., Brennan, C.W., Sutton, J.C.,
De Baetselier, P., Raes, G., Devoogdt, N., and Van
Holland, E.C., Daniel, D., and Joyce, J.A. (2013) CSF 1R
Ginderachter, J. A. (2012) Nanobody based targeting of
inhibition alters macrophage polarization and blocks
the macrophage mannose receptor for effective in vivo
glioma progression, Nat. Med., 19, 1264-1272, doi:
imaging of tumor associated macrophages, Cancer Res.,
10.1038/nm.3337.
72, 4165-4177, doi: 10.1158/0008 5472.can 11 2994.
38.
Pyonteck, S.M., Gadea, B.B., Wang, H. W., Gocheva, V.,
29.
Pulaski, H.L., Spahlinger, G., Silva, I.A., McLean, K.,
Hunter, K.E., Tang, L.H., and Joyce, J.A.
(2012)
Kueck, A.S., Reynolds, R.K., Coukos, G., Conejo
Deficiency of the macrophage growth factor CSF 1 dis
Garcia, J.R., and Buckanovich, R.J. (2009) Identifying
rupts pancreatic neuroendocrine tumor development,
alemtuzumab as an anti myeloid cell antiangiogenic thera
Oncogene, 31, 1459-1467, doi: 10.1038/onc.2011.337.
py for the treatment of ovarian cancer, J. Transl. Med., 7,
39.
Beatty, G.L., Chiorean, E.G., Fishman, M.P., Saboury, B.,
49, doi: 10.1186/1479 5876 7 49.
Teitelbaum, U.R., Sun, W., Huhn, R.D., Song, W., Li, D.,
30.
Smahel, M., Duskova, M., Polakova, I., and Musil, J.
Sharp, L.L., Torigian, D.A., O’Dwyer, P.J., and
(2014) Enhancement of DNA vaccine potency against
Vonderheide, R.H. (2011) CD40 agonists alter tumor stro
legumain, J. Immunother., 37, 293-303, doi: 10.1097/cji.
ma and show efficacy against pancreatic carcinoma in mice
0000000000000040.
and humans, Science, 331, 1612-1616, doi: 10.1126/sci
31.
Ahn, G. O., Tseng, D., Liao, C. H., Dorie, M.J.,
ence.1198443.
Czechowicz, A., and Brown, J.M. (2010) Inhibition of
40.
Ruffell, B., Chang Strachan, D., Chan, V., Rosenbusch,
Mac 1 (CD11b/CD18) enhances tumor response to radia
A., Ho, C.M.T., Pryer, N., Daniel, D., Hwang, E.S., Rugo,
tion by reducing myeloid cell recruitment, Proc. Natl.
H.S., and Coussens, L.M. (2014) Macrophage IL 10
Acad. Sci. USA, 107, 8363-8368, doi: 10.1073/pnas.
blocks CD8+ T cell dependent responses to chemotherapy
0911378107.
by suppressing IL 12 expression in intratumoral dendritic
32.
Sanford, D.E., Belt, B.A., Panni, R.Z., Mayer, A.,
cells, Cancer Cell, 26, 623-637, doi: 10.1016/j.ccell.
Deshpande, A.D., Carpenter, D., Mitchem, J.B.,
2014.09.006.
Plambeck Suess, S.M., Worley, L.A., Goetz, B.D., Wang
41.
Su, Z., Yang, R., Zhang, W., Xu, L., Zhong, Y., Yin, Y.,
Gillam, A., Eberlein, T.J., Denardo, D.G., Goedegebuure,
Cen, J., DeWitt, J.P., and Wei, Q. (2015) The synergistic
S.P., and Linehan, D.C. (2013) Inflammatory monocyte
interaction between the calcineurin B subunit and IFN γ
mobilization decreases patient survival in pancreatic can
enhances macrophage antitumor activity, Cell Death Dis.,
cer: a role for targeting the CCL2/CCR2 axis, Clin. Cancer
6, e1740-e1740, doi: 10.1038/cddis.2015.92.
Res., 19, 3404-3415, doi: 10.1158/1078 0432.ccr 13 0525.
42.
Yang, L., Wang, F., Wang, L., Huang, L., Wang, J., Zhang,
33.
Nywening, T.M., Wang Gillam, A., Sanford, D.E., Belt,
B., and Zhang, Y. (2015) CD163+ tumor associated
B.A., Panni, R.Z., Cusworth, B.M., Toriola, A.T.,
macrophage is a prognostic biomarker and is associated
Nieman, R.K., Worley, L.A., Yano, M., Fowler, K.J.,
with therapeutic effect on malignant pleural effusion of
Lockhart, A.C., Suresh, R., Tan, B.R., Lim, K. H., Fields,
lung cancer patients, Oncotarget, 6, 10592-10603, doi:
R.C., Strasberg, S.M., Hawkins, W.G., DeNardo, D.G.,
10.18632/oncotarget.3547.
Goedegebuure, S.P., and Linehan, D.C. (2016) Targeting
43.
Hussain, S.F., Kong, L. Y., Jordan, J., Conrad, C.,
tumor associated macrophages with CCR2 inhibition in
Madden, T., Fokt, I., Priebe, W., and Heimberger, A.B.
combination with FOLFIRINOX in patients with border
(2007) A novel small molecule inhibitor of signal transduc
line resectable and locally advanced pancreatic cancer:
ers and activators of transcription 3 reverses immune tole
a single centre, open label, dose finding, non ran
rance in malignant glioma patients, Cancer Res., 67,
domised, phase 1b trial, Lancet Oncol., 17, 651-662, doi:
9630-9636, doi: 10.1158/0008 5472.can 07 1243.
10.1016/ S1470 2045(16)00078 4.
44.
Seya, T., Shime, H., and Matsumoto, M. (2012) TAMable
34.
Pienta, K.J., Machiels, J. P., Schrijvers, D., Alekseev, B.,
tumor associated macrophages in response to innate RNA
Shkolnik, M., Crabb, S.J., Li, S., Seetharam, S.,
sensing, Oncoimmunology, 1, 1000-1001, doi: 10.4161/
Puchalski, T.A., Takimoto, C., Elsayed, Y., Dawkins, F.,
onci.19894.
and de Bono, J.S. (2013) Phase 2 study of carlumab
45.
Guiducci, C., Vicari, A.P., Sangaletti, S., Trinchieri, G.,
(CNTO 888), a human monoclonal antibody against CC
and Colombo, M.P. (2005) Redirecting in vivo elicited
chemokine ligand 2 (CCL2), in metastatic castration
tumor infiltrating macrophages and dendritic cells towards
resistant prostate cancer, Invest. New Drug., 31, 760-768,
tumor rejection, Cancer Res.,
65,
3437-3446, doi:
doi: 10.1007/s10637 012 9869 8.
10.1158/0008 5472.can 04 4262.
БИОХИМИЯ том 84 вып. 7 2019
НАНОЧАСТИЦЫ ДЛЯ РЕПРОГРАММИРОВАНИЯ ОПУХОЛЕВЫХ МАКРОФАГОВ
949
46.
Sato, T., Shimosato, T., Ueda, A., Ishigatsubo, Y., and
Polymeric nanoparticles promote macrophage reversal
Klinman, D.M. (2015) Intrapulmonary delivery of CpG
from M2 to M1 phenotypes in the tumor microenviron
microparticles eliminates lung tumors, Mol. Cancer Ther.,
ment, Biomaterials, 112, 153-163, doi: 10.1016/j.biomate
14, 2198-2205, doi: 10.1158/1535 7163.mct 15 0401.
rials.2016.09.034.
47.
Eriksson, F., Tsagozis, P., Lundberg, K., Parsa, R.,
59.
Zhu, L., Zhou, Z., Mao, H., and Yang, L. (2017) Magnetic
Mangsbo, S.M., Persson, M.A.A., Harris, R.A., and Pisa,
nanoparticles for precision oncology: theranostic magnetic
P. (2009) Tumor specific bacteriophages induce tumor
iron oxide nanoparticles for image guided and targeted
destruction through activation of tumor associated
cancer therapy, Nanomedicine, 12, 73-87, doi: 10.2217/
macrophages, J. Immunol., 182, 3105-3111, doi: 10.4049/
nnm 2016 0316.
jimmunol.0800224.
60.
Shi, J., Kantoff, P.W., Wooster, R., and Farokhzad, O.C.
48.
Shi, Y., Felder, M.A.R., Sondel, P.M., and Rakhmilevich,
(2017) Cancer nanomedicine: progress, challenges and
A.L. (2015) Synergy of anti CD40, CpG and MPL in acti
opportunities, Nat. Rev. Cancer, 17, 20-37, doi: 10.1038/
vation of mouse macrophages, Mol. Immunol.,
66,
nrc.2016.108.
208-215, doi: 10.1016/j.molimm.2015.03.008.
61.
Lee, H., Shields, A.F., Siegel, B.A., Miller, K.D., Krop, I.,
49.
Sica, A., Saccani, A., Bottazzi, B., Polentarutti, N.,
Ma, C.X., LoRusso, P.M., Munster, P.N., Campbell, K.,
Vecchi, A., van Damme, J., and Mantovani, A. (2000)
Gaddy, D.F., Leonard, S.C., Geretti, E., Blocker, S.J.,
Autocrine production of IL 10 mediates defective IL 12
Kirpotin, D. B., Moyo, V., Wickham, T.J., and Hendriks,
production and NF κB activation in tumor associated
B.S. (2017) 64Cu MM 302 positron emission tomography
macrophages, J. Immunol., 164, 762-767, doi: 10.4049/
quantifies variability of enhanced permeability and reten
jimmunol.164.2.762.
tion of nanoparticles in relation to treatment response in
50.
Chan, G., Chan, W., and Sze, D. (2009) The effects of
patients with metastatic breast cancer, Clin. Cancer Res.,
β glucan on human immune and cancer cells, J. Hematol.
23, 4190-4202, doi: 10.1158/1078 0432.ccr 16 3193.
Oncol., 2, 25, doi: 10.1186/1756 8722 2 25.
62.
Ramanathan, R.K., Korn, R.L., Raghunand, N., Sachdev,
51.
Huang, Z., Yang, Y., Jiang, Y., Shao, J., Sun, X., Chen, J.,
J.C., Newbold, R.G., Jameson, G., Fetterly, G.J., Prey, J.,
Dong, L., and Zhang, J. (2013) Anti tumor immune
Klinz, S.G., Kim, J., Cain, J., Hendriks, B.S.,
responses of tumor associated macrophages via toll like
Drummond, D.C., Bayever, E., and Fitzgerald, J.B. (2017)
receptor 4 triggered by cationic polymers, Biomaterials, 34,
Correlation between ferumoxytol uptake in tumor lesions
746-755, doi: 10.1016/j.biomaterials.2012.09.062.
by MRI and response to nanoliposomal irinotecan in
52.
Kushner, B.H., Cheung, I.Y., Modak, S., Kramer, K.,
patients with advanced solid tumors: a pilot study, Clin.
Ragupathi, G., and Cheung, N.K.V. (2014) Phase I trial of
Cancer Res., 23, 3638-3648, doi: 10.1158/1078 0432.ccr
a bivalent gangliosides vaccine in combination with β glu
16 1990.
can for high risk neuroblastoma in second or later remis
63.
Nakamura, Y., Mochida, A., Choyke, P.L., and Kobayashi,
sion, Clin. Cancer Res., 20, 1375-1382, doi: 10.1158/1078
H. (2016) Nanodrug delivery: is the enhanced permeabili
0432.ccr 13 1012.
ty and retention effect sufficient for curing cancer?
53.
Segal, N.H., Gada, P., Senzer, N., Gargano, M.A.,
Bioconjug. Chem., 27, 2225-2238, doi: 10.1021/acs.bio
Patchen, M.L., and Saltz, L.B. (2016) A phase 2 efficacy
conjchem.6b00437.
and safety, open label, multicenter study of imprime PGG
64.
Lazarovits, J., Chen, Y.Y., Sykes, E.A., and Chan, W.C.W.
injection in combination with cetuximab in patients with
(2015) Nanoparticle-blood interactions: the implications
stage IV KRAS mutant colorectal cancer, Clin. Colorectal
on solid tumour targeting, Chem. Commun.,
51,
Cancer, 15, 222-227, doi: 10.1016/j.clcc.2016.02.013.
2756-2767, doi: 10.1039/c4cc07644c.
54.
Garaci, E., Pica, F., Serafino, A., Balestrieri, E.,
65.
Wilhelm, S., Tavares, A.J., Dai, Q., Ohta, S., Audet, J.,
Matteucci, C., Moroni, G., Sorrentino, R., Zonfrillo, M.,
Dvorak, H.F., and Chan, W.C.W. (2016) Analysis of
Pierimarchi, P., and Sinibaldi Vallebona, P.
(2012)
nanoparticle delivery to tumours, Nat. Rev. Mater., 1,
Thymosin α1 and cancer: action on immune effector and
16014, doi: 10.1038/natrevmats.2016.14.
tumor target cells, Ann. N. Y. Acad. Sci., 1269, 26-33, doi:
66.
Miller, M.A., Gadde, S., Pfirschke, C., Engblom, C.,
10.1111/j.1749 6632.2012.06697.x.
Sprachman, M.M., Kohler, R.H., Yang, K.S., Laughney,
55.
Beug, S.T., Beauregard, C.E., Healy, C., Sanda, T., St
A.M., Wojtkiewicz, G., Kamaly, N., Bhonagiri, S., Pittet,
Jean, M., Chabot, J., Walker, D.E., Mohan, A., Earl, N.,
M.J., Farokhzad, O.C., and Weissleder, R.
(2015)
Lun, X., Senger, D.L., Robbins, S.M., Staeheli, P.,
Predicting therapeutic nanomedicine efficacy using a com
Forsyth, P.A., Alain, T., LaCasse, E.C., and Korneluk,
panion magnetic resonance imaging nanoparticle, Sci.
R.G. (2018) Publisher correction: Smac mimetics syner
Transl. Med., 7, 314ra183, doi: 10.1126/scitranslmed.
gize with immune checkpoint inhibitors to promote
aac6522.
tumour immunity against glioblastoma, Nat. Commun., 9,
67.
Miller, M.A., Zheng, Y. R., Gadde, S., Pfirschke, C.,
16231, doi: 10.1038/ncomms16231.
Zope, H., Engblom, C., Kohler, R.H., Iwamoto, Y., Yang,
56.
Gul, N., and van Egmond, M. (2015) Antibody dependent
K.S., Askevold, B., Kolishetti, N., Pittet, M., Lippard,
phagocytosis of tumor cells by macrophages: a potent
S.J., Farokhzad, O.C., and Weissleder, R. (2015) Tumour
effector mechanism of monoclonal antibody therapy of
associated macrophages act as a slow release reservoir of
cancer, Cancer Res., 75, 5008-5013, doi: 10.1158/0008
nano therapeutic Pt(IV) pro drug, Nat. Commun., 6, 8692,
5472.can 15 1330.
doi: 10.1038/ncomms9692.
57.
Zhao, X.W., van Beek, E.M., Schornagel, K., Van der
68.
Mikhaylov, G., Mikac, U., Magaeva, A.A., Itin, V.I.,
Maaden, H., Van Houdt, M., Otten, M.A., Finetti, P., Van
Naiden, E.P., Psakhye, I., Babes, L., Reinheckel, T.,
Egmond, M., Matozaki, T., Kraal, G., Birnbaum, D., van
Peters, C., Zeiser, R., Bogyo, M., Turk, V., Psakhye, S.G.,
Elsas, A., Kuijpers, T.W., Bertucci, F., and van den Berg,
Turk, B., and Vasiljeva, O. (2011) Ferri liposomes as an
T.K. (2011) CD47 signal regulatory protein α (SIRP α)
MRI visible drug delivery system for targeting tumours
interactions form a barrier for antibody mediated tumor
and their microenvironment, Nat. Nanotechnol.,
6,
cell destruction, Proc. Natl. Acad. Sci. USA,
108,
594-602, doi: 10.1038/nnano.2011.112.
18342-18347, doi: 10.1073/pnas.1106550108.
69.
Daldrup Link, H.E., Golovko, D., Ruffell, B., DeNardo,
58.
Wang, Y., Lin, Y. X., Qiao, S. L., An, H. W., Ma, Y.,
D.G., Castaneda, R., Ansari, C., Rao, J., Tikhomirov,
Qiao, Z. Y., Rajapaksha, R.P., and Wang, H. (2017)
G.A., Wendland, M.F., Corot, C., and Coussens, L.M.
БИОХИМИЯ том 84 вып. 7 2019
950
КАПИТАНОВА и др.
(2011) MRI of tumor associated macrophages with clini
81.
Nishanth, R.P., Jyotsna, R.G., Schlager, J.J., Hussain,
cally applicable iron oxide nanoparticles, Clin. Cancer Res.,
S.M., and Reddanna, P. (2011) Inflammatory responses of
17, 5695-5704, doi: 10.1158/1078 0432.ccr 10 3420.
RAW 264.7 macrophages upon exposure to nanoparticles:
70.
Ilkow, C.S., Marguerie, M., Batenchuk, C., Mayer, J., Ben
role of ROS NFкB signaling pathway, Nanotoxicology, 5,
Neriah, D., Cousineau, S., Falls, T., Jennings, V.A., Boileau,
502-516, doi: 10.3109/17435390.2010.541604.
M., Bellamy, D., Bastin, D., de Souza, C.T., Alkayyal, A.,
82.
Hashimoto, M., Toshima, H., Yonezawa, T., Kawai, K.,
Zhang, J., Le Boeuf, F., Arulanandam, R., Stubbert, L.,
Narushima, T., Kaga, M., and Endo, K. (2014) Responses
Sampath, P., Thorne, S.H., Paramanthan, P., Chatterjee, A.,
of RAW264.7 macrophages to water dispersible gold and
Strieter, R.M., Burdick, M., Addison, C.L., Stojdl, D.F.,
silver nanoparticles stabilized by metal carbon σ bonds,
Atkins, H.L., Auer, R.C., Diallo, J. S., Lichty, B.D., and
J. Biomed. Mater. Res. A, 102, 1838-1849, doi: 10.1002/
Bell, J.C. (2015) Reciprocal cellular cross talk within the
jbm.a.34854.
tumor microenvironment promotes oncolytic virus activity,
83.
Bancos, S., Stevens, D.L., and Tyner, K.M. (2014) Effect
Nat. Med., 21, 530-536, doi: 10.1038/nm.3848.
of silica and gold nanoparticles on macrophage prolifera
71.
Arulanandam, R., Batenchuk, C., Angarita, F.A.,
tion, activation markers, cytokine production, and phago
Ottolino Perry, K., Cousineau, S., Mottashed, A., Burgess,
cytosis in vitro, Int. J. Nanomedicine, 10, 183-206, doi:
E., Falls, T.J., De Silva, N., Tsang, J., Howe, G.A.,
10.2147/ijn.s72580.
Bourgeois Daigneault,
M. C., Conrad,
D.P.,
84.
Zhang, Q., Hitchins, V.M., Schrand, A.M., Hussain,
Daneshmand, M., Breitbach, C.J., Kirn, D.H., Raptis, L.,
S.M., and Goering, P.L. (2011) Uptake of gold nanoparti
Sad, S., Atkins, H., Huh, M.S., Diallo, J. S., Lichty, B.D.,
cles in murine macrophage cells without cytotoxicity or
Ilkow, C.S., Le Boeuf, F., Addison, C.L., McCart, J.A.,
production
of
pro inflammatory
mediators,
and Bell, J.C. (2015) VEGF mediated induction of PRD1
Nanotoxicology, 5, 284-295, doi: 10.3109/17435390.
BF1/Blimp1 expression sensitizes tumor vasculature to
2010.512401.
oncolytic virus infection, Cancer Cell, 28, 210-224, doi:
85.
Giovanni, M., Yue, J., Zhang, L., Xie, J., Ong, C.N., and
10.1016/j.ccell.2015.06.009.
Leong, D.T.
(2015) Pro inflammatory responses of
72.
Hoppstadter, J., Seif, M., Dembek, A., Cavelius, C.,
RAW264.7 macrophages when treated with ultralow con
Huwer, H., Kraegeloh, A., and Kiemer, A.K. (2015) M2
centrations of silver, titanium dioxide, and zinc oxide
polarization enhances silica nanoparticle uptake by
nanoparticles, J. Hazard. Mater., 297, 146-152, doi:
macrophages, Front. Pharmacol., 6, 55, doi: 10.3389/
10.1016/j.jhazmat.2015.04.081.
fphar.2015.00055.
86.
Lucarelli, M., Gatti, A.M., Savarino, G., Quattroni, P.,
73.
Qie, Y., Yuan, H., von Roemeling, C.A., Chen, Y., Liu, X.,
Martinelli, L., Monari, E., and Boraschi, D. (2004) Innate
Shih, K.D., Knight, J.A., Tun, H.W., Wharen, R.E., Jiang,
defence functions of macrophages can be biased by nano
W., and Kim, B.Y.S. (2016) Erratum: corrigendum: surface
sized ceramic and metallic particles, Eur. Cytokine Netw.,
modification of nanoparticles enables selective evasion of
15, 339-346.
phagocytic clearance by distinct macrophage phenotypes,
87.
Yang, R., Sarkar, S., Yong, V.W., and Dunn, J.F. (2018) In
Sci. Rep., 6, 26269, doi: 10.1038/srep30663.
vivo MR imaging of tumor associated macrophages: the
74.
Jones, S.W., Roberts, R.A., Robbins, G.R., Perry, J.L.,
next frontier in cancer imaging, Magn. Reson. Insights, 11,
Kai, M.P., Chen, K., Bo, T., Napier, M.E., Ting, J.P.Y,
1178623X1877197, doi: 10.1177/1178623x18771974.
DeSimone, J.M., and Bear, J.E. (2013) Nanoparticle
88.
Zanganeh, S., Hutter, G., Spitler, R., Lenkov, O.,
clearance is governed by Th1/Th2 immunity and strain
Mahmoudi, M., Shaw, A., Pajarinen, J.S., Nejadnik, H.,
background, J. Clin. Invest.,
123,
3061-3073, doi:
Goodman, S., Moseley, M., Coussens, L.M., and
10.1172/jci66895.
Daldrup Link, H.E. (2016) Iron oxide nanoparticles
75.
Binnemars Postma, K.A., ten Hoopen, H.W., Storm, G.,
inhibit tumour growth by inducing pro inflammatory
and Prakash, J. (2016) Differential uptake of nanoparticles
macrophage polarization in tumour tissues, Nat.
by human M1 and M2 polarized macrophages: protein
Nanotechnol., 11, 986-994, doi: 10.1038/nnano.2016.168.
corona as a critical determinant, Nanomedicine, 11,
89.
Laskar, A., Eilertsen, J., Li, W., and Yuan, X. M. (2013)
2889-2902, doi: 10.2217/nnm 2016 0233.
SPION primes THP1 derived M2 macrophages towards
76.
Thaiss, C.A., Zmora, N., Levy, M., and Elinav, E. (2016)
M1 like macrophages, Biochem. Biophys. Res. Commun.,
The microbiome and innate immunity, Nature, 535,
441, 737-742, doi: 10.1016/j.bbrc.2013.10.115.
65-74, doi: 10.1038/nature18847.
90.
Ma, J., Liu, R., Wang, X., Liu, Q., Chen, Y., Valle, R.P., Zuo,
77.
Lonez, C., Bessodes, M., Scherman, D., Vandenbranden,
Y.Y., Xia, T., and Liu, S. (2015) Crucial role of lateral size for
M., Escriou, V., and Ruysschaert, J. M. (2014) Cationic
graphene oxide in activating macrophages and stimulating
lipid nanocarriers activate Toll like receptor 2 and NLRP3
pro inflammatory responses in cells and animals, ACS Nano,
inflammasome pathways, Nanomedicine, 10, 775-782, doi:
9, 10498-10515, doi: 10.1021/acsnano. 5b04751.
10.1016/j.nano.2013.12.003.
91.
Doshi, N., and Mitragotri, S. (2010) Macrophages recog
78.
Lebel, M. E., Daudelin, J. F., Chartrand, K., Tarrab, E.,
nize size and shape of their targets, PLoS One, 5, e10051,
Kalinke, U., Savard, P., Labrecque, N., Leclerc, D., and
doi: 10.1371/journal.pone.0010051.
Lamarre, A. (2014) Nanoparticle adjuvant sensing by
92.
Vinogradov, S., Warren, G., and Wei, X.
(2014)
TLR7 enhances CD8+ T cell mediated protection from
Macrophages associated with tumors as potential targets
Listeria monocytogenes infection, J. Immunol.,
192,
and therapeutic intermediates, Nanomedicine, 9, 695-707,
1071-1078, doi: 10.4049/jimmunol.1302030.
doi: 10.2217/nnm.14.13.
79.
Rioux, G., Carignan, D., Russell, A., Bolduc, M., Gagne,
93.
Bartneck, M., Ritz, T., Keul, H.A., Wambach, M.,
M. E.L., Savard, P., and Leclerc, D. (2016) Influence of
Bornemann, J., Gbureck, U., Ehling, J., Lammers, T.,
PapMV nanoparticles on the kinetics of the antibody
Heymann, F., Gassler, N., Ludde, T., Trautwein, C., Groll,
response to flu vaccine, J. Nanobiotechnol., 14, 43, doi:
J., and Tacke, F. (2012) Peptide functionalized gold
10.1186/s12951 016 0200 2.
nanorods increase liver injury in hepatitis, ACS Nano, 6,
80.
Yen, H. J., Hsu, S., and Tsai, C. L. (2009) Cytotoxicity
8767-8777, doi: 10.1021/nn302502u.
and immunological response of gold and silver nanoparti
94.
Su, L., Zhang, W., Wu, X., Zhang, Y., Chen, X., Liu, G.,
cles of different sizes, Small,
5,
1553-1561, doi:
Chen, G., and Jiang, M. (2015) Glycocalyx mimicking
10.1002/smll.200900126.
nanoparticles for stimulation and polarization of
БИОХИМИЯ том 84 вып. 7 2019
НАНОЧАСТИЦЫ ДЛЯ РЕПРОГРАММИРОВАНИЯ ОПУХОЛЕВЫХ МАКРОФАГОВ
951
macrophages via specific interactions, Small,
11,
107. Lin, A.Y., Almeida, J.P., Bear, A., Liu, N., Luo, L., Foster,
4191-4200, doi: 10.1002/smll.201403838.
A.E., and Drezek, R.A. (2013) Gold nanoparticle delivery
95. Fuchs, A. K., Syrovets, T., Haas, K.A., Loos, C.,
of modified CpG stimulates macrophages and inhibits
Musyanovych, A., Mailander, V., Landfester, K., and
tumor growth for enhanced immunotherapy, PLoS One, 8,
Simmet, T. (2016) Carboxyl and amino functionalized
e63550, doi: 10.1371/journal.pone.0063550.
polystyrene nanoparticles differentially affect the polariza
108. Zhang, X., Wu, F., Men, K., Huang, R., Zhou, B., Zhang,
tion profile of M1 and M2 macrophage subsets,
R., Zou, R., and Yang, L. (2018) Modified Fe3O4 magne
Biomaterials, 85, 78-87, doi: 10.1016/j.biomaterials.
tic nanoparticle delivery of CpG inhibits tumor growth and
2016.01.064.
spontaneous pulmonary metastases to enhance
96. Wei, M., Chen, N., Li, J., Yin, M., Liang, L., He, Y., Song,
immunotherapy, Nanoscale Res. Lett., 13, 240, doi:
H., Fan, C., and Huang, Q. (2012) Polyvalent immuno
10.1186/s11671 018 2661 8.
stimulatory nanoagents with self assembled CpG oligonu
109. Mejias, R., Perez Yague, S., Gutierrez, L., Cabrera, L.I.,
cleotide conjugated gold nanoparticles, Angew. Chem. Int.
Spada, R., Acedo, P., Serna, C.J., Lazaro, F.J., Villanueva,
Ed. Engl., 51, 1202-1206, doi: 10.1002/anie.201105187.
A., Morales Mdel, P., and Barber, D.F.
(2011)
97. Kim, J.H., Noh, Y. W., Heo, M.B., Cho, M.Y., and Lim,
Dimercaptosuccinic acid coated magnetite nanoparticles
Y.T. (2012) Multifunctional hybrid nanoconjugates for effi
for magnetically guided in vivo delivery of interferon
cient in vivo delivery of immunomodulating oligonu
gamma for cancer immunotherapy, Biomaterials, 32,
cleotides and enhanced antitumor immunity, Angew. Chem.
2938-2952, doi: 10.1016/j.biomaterials.2011.01.008.
Int. Ed. Engl.,
51,
9670-9673, doi:
10.1002/anie.
110. Egilmez, N.K., Jong, Y.S., Sabel, M.S., Jacob, J.S.,
201204989.
Mathiowitz, E., and Bankert, R.B. (2000) In situ tumor
98. Ruiz de Angulo, A., Zabaleta, A., Gomez Vallejo, V.,
vaccination with interleukin 12 encapsulated biodegrad
Llop, J., and Mareque Rivas, J.C. (2016) Microdosed
able microspheres: induction of tumor regression and
lipid coated 67Ga magnetite enhances antigen specific
potent antitumor immunity, Cancer Res., 60, 3832-3837.
immunity by image tracked delivery of antigen and CpG to
111.
Song, M., Liu, T., Shi, C., Zhang, X., and Chen, X. (2016)
lymph nodes, ACS Nano, 10, 1602-1618, doi: 10.1021/
Correction to bioconjugated manganese dioxide nanopar
acsnano.5b07253.
ticles enhance chemotherapy response by priming tumor
99. Kim, S. Y., Heo, M.B., Hwang, G. S., Jung, Y., Choi,
associated macrophages toward M1 like phenotype and
D.Y., Park, Y. M., and Lim, Y.T. (2015) Multivalent poly
attenuating tumor hypoxia, ACS Nano, 10, 3872, doi:
mer nanocomplex targeting endosomal receptor of
10.1021/acsnano.5b06779.
immune cells for enhanced antitumor and systemic memo
112. Rayahin, J.E., Buhrman, J.S., Zhang, Y., Koh, T.J., and
ry response, Angew. Chem. Int. Ed. Engl., 54, 8139-8143,
Gemeinhart, R.A. (2015) High and low molecular weight
doi: 10.1002/anie.201501380.
hyaluronic acid differentially influence macrophage activa
100. Li, A.V., Moon, J.J., Abraham, W., Suh, H., Elkhader, J.,
tion, ACS Biomater. Sci. Eng.,
1,
481-493, doi:
Seidman, M.A., Yen, M., Im, E. J., Foley, M.H.,
10.1021/acsbiomaterials.5b00181.
Barouch, D.H., and Irvine, D.J. (2013) Generation of
113. Alieva, I.B., Kireev, I.I, Garanina, A.S., Alyabyeva, N.,
effector memory T cell based mucosal and systemic
Ruyter, A., Strelkova, O.S., Zhironkina, O.A.,
immunity with pulmonary nanoparticle vaccination, Sci.
Cherepaninets, V.D., Majouga, A.G., Davydov, V.A.,
Transl. Med., 5, 204ra130, doi: 10.1126/scitranslmed.
Khabashesku, V.N., Agafonov, V., and Uzbekov, R.E.
3006516.
(2016) Magnetocontrollability of Fe7C3@C superparamag
101. Ultimo, A., Gimenez, C., Bartovsky, P., Aznar, E.,
netic nanoparticles in living cells, J. Nanobiotechnology, 14,
Sancenon, F., Marcos, M.D., Amoros, P., Bernardo, A.R.,
67-79, doi: 10.1186/s12951 016 0219 4.
Martinez Manez, R., Jimenez Lara, A.M., and Murguia,
114. Hattori, Y., Yamashita, J., Sakaida, C., Kawano, K., and
J.R. (2016) Targeting innate immunity with dsRNA conju
Yonemochi, E. (2015) Evaluation of antitumor effect of
gated mesoporous silica nanoparticles promotes antitumor
zoledronic acid entrapped in folate linked liposome for
effects on breast cancer cells, Chem.<Eur. J.,
22,
targeting to tumor associated macrophages, J. Liposome
1582-1586, doi: 10.1002/chem.201504629.
Res., 25, 131-140, doi: 10.3109/08982104.2014.954128.
102. Fox, C.B., Sivananthan, S.J., Duthie, M.S., Vergara, J.,
115. Shmeeda, H., Amitay, Y., Tzemach, D., Gorin, J., and
Guderian, J.A., Moon, E., Coblentz, D., Reed, S.G., and
Gabizon, A. (2013) Liposome encapsulation of zoledronic
Carter, D. (2014) A nanoliposome delivery system to syner
acid results in major changes in tissue distribution and
gistically trigger TLR4 and TLR7, J. Nanobiotechnology,
increase in toxicity, J. Control. Release, 167, 265-275, doi:
12, 17, doi: 10.1186/1477 3155 12 17.
10.1016/j.jconrel.2013.02.003.
103. Ghoneum, M., Ghoneum, A., and Gimzewski, J. (2010)
116. Tang, X., Mo, C., Wang, Y., Wei, D., and Xiao, H. (2013)
Nanodiamond and nanoplatinum liquid, DPV576, acti
Anti tumour strategies aiming to target tumour associated
vates human monocyte derived dendritic cells in vitro,
macrophages, Immunology, 138, 93-104, doi: 10.1111/
Anticancer Res., 30, 4075-4079.
imm.12023.
104. Zheng, D. W., Chen, J. L., Zhu, J. Y., Rong, L., Li, B.,
117. Zeng, Y., Ma, J., Zhan, Y., Xu, X., Zeng, Q., Liang, J., and
Lei, Q., Fan, J. X., Zou, M. Z., Li, C., Cheng, S. X., Xu,
Chen, X. (2018) Hypoxia activated prodrugs and redox
Z., and Zhang, X. Z. (2016) Highly integrated nano plat
responsive nanocarriers, Int. J. Nanomedicine,
13,
form for breaking the barrier between chemotherapy and
6551-6574, doi: 10.2147/ijn.s173431.
immunotherapy, Nano Lett., 16, 4341-4347, doi: 10.1021/
118. Andon, F.T., Digifico, E., Maeda, A., Erreni, M.,
acs.nanolett.6b01432.
Mantovani, A., Alonso, M.J., and Allavena, P. (2017)
105. Manish, M., Rahi, A., Kaur, M., Bhatnagar, R., and Singh,
Targeting tumor associated macrophages: the new chal
S. (2013) A single dose PLGA encapsulated protective
lenge for nanomedicine, Semin. Immunol., 34, 103-113,
antigen domain 4 nanoformulation protects mice against
doi: 10.1016/j.smim.2017.09.004.
Bacillus anthracis spore challenge, PLoS One, 8, e61885,
119. Downey, C.M., Aghaei, M., Schwendener, R.A., and Jirik,
doi: 10.1371/journal.pone.0061885.
F.R. (2014) DMXAA causes tumor site specific vascular
106. Guha, M. (2012) Anticancer TLR agonists on the ropes,
disruption in murine non small cell lung cancer, and like
Nat. Rev. Drug Discov., 11, 503-505, doi: 10.1038/
the endogenous non canonical cyclic dinucleotide STING
nrd3775.
agonist, 2’3’ cgamp, induces M2 macrophage repolariza
БИОХИМИЯ том 84 вып. 7 2019
952
КАПИТАНОВА и др.
tion, PLoS One, 9, e99988, doi: 10.1371/journal.pone.
121. Conlon, J., Burdette, D.L., Sharma, S., Bhat, N.,
0099988.
Thompson, M., Jiang, Z., Rathinam, V.A.K., Monks, B.,
120. Jassar, A.S., Suzuki, E., Kapoor, V., Sun, J., Silverberg,
Jin, T., Xiao, T.S., Vogel, S.N., Vance, R.E., and
M.B., Cheung, L., Burdick, M.D., Strieter, R.M., Ching,
Fitzgerald, K.A. (2013) Mouse, but not human STING,
L. M., Kaiser, L.R., and Albelda, S.M. (2005) Activation
binds and signals in response to the vascular disrupting
of tumor associated macrophages by the vascular disrupt
agent 5,6 dimethylxanthenone 4 acetic acid, J. Immunol.,
ing agent 5,6 dimethylxanthenone 4 acetic acid induces
190, 5216-5225, doi: 10.4049/jimmunol.1300097.
an effective CD8+ T cell mediated antitumor immune
122. Binnemars Postma, K., Storm, G., and Prakash, J. (2017)
response in murine models of lung cancer and mesothe
Nanomedicine strategies to target tumor associated
lioma, Cancer Res., 65, 11752-11761, doi: 10.1158/0008
macrophages, Int. J. Mol. Sci.,
18,
979, doi:
5472.can 05 1658.
10.3390/ijms18050979.
ADVANCES AND CHALLENGES OF NANOPARTICLE8BASED
MACROPHAGE REPROGRAMMING FOR CANCER IMMUNOTHERAPY
K. S. Kapitanova1, V. A. Naumenko2*, A. S. Garanina2,
P. A. Melnikov3, M. A. Abakumov2,4, and I. B. Alieva5*
1 Lomonosov Moscow State University, Faculty of Bioengineering and Bioinformatics, 119991 Moscow, Russia
2 National University of Science and Technology «MISIS», 119049 Moscow, Russia
3 Serbsky Federal Medical Research Centre of Psychiatry and Narcology,
Ministry of Health of the Russian Federation, 119034 Moscow, Russia
4 Pirogov Russian National Research Medical University, 117997 Moscow, Russia
5 Belozersky Institute of Physico<Chemical Biology, Lomonosov Moscow State University, 119991 Moscow, Russia
Received November 8, 2018
Revised February 12, 2019
Accepted February 13, 2019
Despite the progress of modern medicine, oncological diseases are still among the most common causes of death in
adult populations of developed countries. Severe side effects of the current therapeutic approaches, the lack of per
sonalized strategies, and the high mortality of oncological patients force seeking new approaches to therapy of malig
nant tumors. During the last decade, immunotherapy of tumors, an approach that relies on activation of the host anti
tumor immune response, has been actively developing. One of the key tasks of immunotherapy of tumors is the
restoration of the pathologically altered tumor microenvironment, in particular, the reprogramming of tumor
macrophages from the immunosuppressive M2 phenotype into the proinflammatory M1 phenotype is pivotal for
eliciting antitumor response. This review describes the current knowledge about macrophage classification, mecha
nisms of their polarization, their role in formation of the tumor microenvironment, and strategies for changing the
functional activity of M2 macrophages, as well as problems of targeted delivery of immunostimulatory signals to
tumor macrophages using nanoparticles.
Keywords: tumor microenvironment, M1/M2 macrophages, cancer immunotherapy, nanoparticles, intravital imaging
БИОХИМИЯ том 84 вып. 7 2019