БИОХИМИЯ, 2019, том 84, вып. 7, с. 953 - 971
УДК 615.2
ЦИСТЕИНОВЫЕ КАТЕПСИНЫ:
ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ В ДИАГНОСТИКЕ
И ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ*
Обзор
© 2019
А.И. Петушкова1, Л.В. Савватеева1,
Д.О. Королев2, А.А. Замятнин мл.1,3**
1 Институт молекулярной медицины, Первый Московский государственный
медицинский университет им. И.М. Сеченова Минздрава России,
119991 Москва, Россия; электронная почта: zamyat@belozersky.msu.ru
2 Институт урологии и репродуктивного здоровья человека, Первый Московский
государственный медицинский университет им. И.М. Сеченова
Минздрава России, 119991 Москва, Россия
3 НИИ физико)химической биологии им. А.Н. Белозерского,
Московский государственный университет
им. М.В. Ломоносова, 119992 Москва, Россия
Поступила в редакцию 28.03.2019
После доработки 18.04.2019
Принята к публикации 19.04.2019
Цистеиновые катепсины являются протеолитическими ферментами, обеспечивающими функцию деграда
ции белков в лизосомах и эндосомах. При онкогенезе цистеиновые катепсины выявляют в микроокруже
нии опухолей, где эти ферменты участвуют в процессах пролиферации, инвазии и метастазирования, обес
печивая деградацию внеклеточного матрикса, разрушение межклеточных взаимодействий и стимулируя ан
гиогенез. В связи с этим катепсины имеют диагностическую значимость и являются перспективными ми
шенями при разработке противоопухолевых препаратов, направленных на ингибирование этих ферментов.
Цистеиновые катепсины также могут быть использованы в качестве активаторов новых противоопухолевых
препаратов направленного действия. В данном обзоре собраны современные данные о роли цистеиновых
катепсинов в онкогенезе, а также отмечены основные направления развития работ в области диагностики и
терапии онкологических заболеваний, использующих цистеиновые катепсины в качестве маркеров, мише
ней или активаторов.
КЛЮЧЕВЫЕ СЛОВА: цистеиновые катепсины, онкогенез, противоопухолевая терапия, направленная дос
тавка, протеолиз, диагностика.
DOI: 10.1134/S0320972519070066
Цистеиновые катепсины являются гомоло
и X(Z). Представители цистеиновых катепсинов
гичными протеиназами клана CA цистеиновых
проявляют разнообразную каталитическую ак
пептидаз, экспрессирующимися в различных
тивность: катепсины F, O, S, K, V, L и W пред
клетках и тканях многих видов организмов [1].
ставляют собой эндопептидазы с широкой
Методами биоинформатического анализа в ге
субстратной специфичностью, катепсины H и B
номе человека было идентифицировано 11 цис
обладают как эндо , так и экзопептидазной ак
теиновых катепсинов: B, C, F, H, K, L, O, S, V, W
тивностью, тогда как катепсины C и X являются
Принятые сокращения: APC -антиген презентирующие клетки; DC -дендритные клетки; MHC -главный комп
лекс гистосовместимости; ECM - внеклеточный матрикс; NK - етественные киллеры; VEGF - фактор роста эндотелия
сосудов; TAM - макрофаги, ассоциированные с опухолью; MMP - матриксные металлопротеиназы; PGA - поли γ глу
таминовая кислота; ADC - конъюгаты антител с лекарственным средством; MMAE - монометилауристатин Е; ICG - ин
доцианин зеленый; FRET - ферстеровский перенос энергии.
* Приложение к статье на английском языке опубликовано на сайте журнала «Biochemistry» (Moscow) и на сайте
издательства Springer (Link.springer.com), том 84, вып. 7, 2019.
** Адресат для корреспонденции.
5
953
954
ПЕТУШКОВА и др.
исключительно амино и карбоксипептидазой
деградацию катепсинами белков цитоплазмы и
соответственно. Наибольшую активность цис
межклеточного матрикса. Однако повышение
теиновые катепсины проявляют в средах с по
уровня экспрессии и активности катепсинов
ниженными значениями pH, вследствие чего
часто связано с развитием различных патологи
изначально считалось, что функционирование
ческих состояний, таких как неврологические
этих ферментов ограничивается лизосомами и
расстройства, сердечно сосудистые заболева
эндосомами. Однако появляется все больше
ния, ожирение, ревматоидный артрит и рак.
данных о высокоспецифичной и направленной
Исследования механизмов экспрессии, а
протеолитической активности катепсинов в
также функций цистеиновых катепсинов в про
других компартментах клеток, таких как секре
цессах онкогенеза позволяют открывать новые
торные везикулы, цитозоль и ядро, а также вне
перспективы в терапии и диагностике рака. Он
клеток [2].
когенез является комплексным процессом, в хо
Основной функцией катепсинов является
де которого опухолевые клетки обеспечивают
низкоспецифичная деградация белков в лизосо
передачу сигналов пролиферации, уклоняются
ме, однако некоторые представители этой груп
от действия супрессоров роста и активаторов
пы ферментов выполняют и другие функции.
клеточной смерти, обладают непрерывным реп
Так, при пермеабилизации лизосомальной
ликативным потенциалом, индуцируют ангио
мембраны катепсины B, H, L, S и K активируют
генез, инвазию и метастазирование, проявляют
проапоптотический белок семейства Bcl 2 Bid.
нестабильность генома и подвергаются мутаге
Получаемый в результате этого процесса усечен
незу, вызывают воспалительный ответ, пере
ный t Bid способствует олигомеризации белков
страивают энергетический обмен в клетке и по
Bax и Bak [3], запуская процесс апоптоза. Также
давляют иммунный ответ [9]. Для реализации
цистеиновые катепсины могут индуцировать
многих из этих функций опухолевые клетки
апоптоз, разрушая связанный с Х хромосомой
поддерживают определенное микроокружение,
ингибитор апоптоза и антиапоптотические бел
состоящее из внеклеточного матрикса (ECM) и
ки, такие как Bcl 2 и Bcl xL. Кроме того, пока
стромальных клеток. Динамическая трехмерная
зано, что цистеиновые катепсины способны ак
структура ECM образована коллагенами, лами
тивировать каспазу 3, каспазу 7 и каспазу 9 [4].
нинами, фибронектинами, протеогликанами и
Катепсин К, ген которого преимущественно
гиалуронанами. В ECM также содержатся цито
экспрессируется в остеокластах, большинстве
кины, факторы роста, гормоны и ферменты,
эпителиальных клеток и в синовиальных фиб
секретируемые раковыми клетками и клетками,
робластах суставов при ревматоидном артрите,
ассоциированными с опухолью. Стромальные
играет существенную роль в резорбции костной
клетки представлены фибробластами и мио
ткани [5]. Каталитически активные варианты
фибробластами, нейроэндокринными клетка
катепсина L, локализованные в ядре, играют
ми, жировыми клетками, иммунными клетка
роль в регуляции клеточного цикла и протеоли
ми, а также клетками кровеносных и лимфати
тической обработке N конца гистона H3 [6]. Ка
ческих сосудов [10].
тепсин S преимущественно экспрессируется в
В нормальных условиях микроокружение
антиген презентирующих клетках (APC), таких
способно подавлять рост злокачественных кле
как дендритные клетки (DC) и B клетки, где он
ток, однако в случае успешного развития опухо
совместно с катепсинами F, L и V расщепляет
ли микроокружение начинает работать как
инвариантную цепь с образованием пептидов,
аберрантная ткань и играть критическую роль в
необходимых для презентации антигена глав
развитии злокачественного новообразования.
ным комплексом гистосовместимости (MHC)
Так, ассоциированные с опухолью фибробласты
класса II, который распознается CD4+ Т клет
способствуют росту опухоли и опосредуют тера
ками [7]. Ген катепсина W в основном экспрес
певтическую устойчивость, секретируя провос
сируется в CD8+ лимфоцитах и естественных
палительные цитокины, ангиогенные факторы,
киллерах [8]. Таким образом, цистеиновые ка
которые рекрутируют макрофаги и участвуют в
тепсины выполняют различные функции в
ремоделировании ECM [11]. Эндотелиальные
клетках и тканях, однако их активность строго
клетки, ассоциированные с опухолью, секрети
регулируется. Преимущественная локализация
руют ангиокринные факторы, способствуя про
катепсинов в лизосомах ограничивает область
лиферации и метастазированию опухоли [12].
их действия, экспрессия эндогенных ингибито
Среди иммунных клеток в опухоли различают
ров предотвращает избыточную активность, а
макрофаги, DC, естественные киллеры, супрес
низкие уровни pH необходимы для оптималь
сорные клетки миелоидного происхождения и
ной работы катепсинов. Совокупность этих
регуляторные Т клетки. Они характеризуются
факторов позволяет организму предотвращать
нарушенным иммунным ответом. Также было
БИОХИМИЯ том 84 вып. 7 2019
ЦИСТЕИНОВЫЕ КАТЕПСИНЫ В ДИАГНОСТИКЕ И ТЕРАПИИ РАКА
955
показано, что NK и T клетки опухоли секрети
первоисточники). Считается, что при онкогене
руют фактор роста эндотелия сосудов (VEGF),
зе к секреции катепсинов во внеклеточное
способствуя ангиогенезу [13].
пространство может приводить перенос лизо
Ассоциированные с опухолью макрофаги
сом из перинуклеарного пространства к пери
(TAM) являются наиболее распространенными
ферии клетки [21], а подкисленная внеклеточ
лейкоцитами в опухолевой строме и выполняют
ная среда опухоли способствует поддержанию
важные функции в разнообразных процессах,
активности ферментов. Еще одной вероятной
имеющих решающее значение для пролифера
причиной наличия катепсинов в ECM может
ции и метастазирования опухоли. Повышенное
являться нарушение молекулярных взаимодей
количество TAM в опухоли коррелирует с не
ствий рецептора инсулиноподобного фактора
благоприятным прогнозом заболевания, поэто
роста 2 (рецептор маннозо 6 фосфата), который
му в последние годы появляется все больше ис
ответственен за перенос белков в лизосомы. По
следований, посвященных поиску терапевти
ниженный уровень экспрессии этого рецептора
ческих препаратов, нацеленных на TAM [14].
в злокачественных клетках также может способ
ТАМ относят к M2 поляризованным макрофа
ствовать секреции катепсинов [22].
гам, также известным как альтернативно акти
Эндогенные ингибиторы катепсинов, при
вированные макрофаги. M2 поляризации под
сутствующие в ЕСМ, могут подвергаться гидро
вергаются резидентные макрофаги и моноциты,
лизу протеолитическими ферментами. Так, бы
рекрутированные в микроокружение опухоли
ло показано, что наиболее мощный эндогенный
[15] под действием цитокинов Th2, таких как
ингибитор цистеиновых катепсинов цистатин C
IL 4, IL 10 и IL 13 [16], колониестимулирую
расщепляется аспартатной протеиназой прока
щих факторов 1 и 2 [17], хемокинов CCL 2, 3, 14
тепсином D и матриксной металлопротеиназой
и 20 [18] и других активных веществ, экспресси
MMP2. Имеются данные, что ММР могут рас
руемых опухолевыми и стромальными клетка
щеплять цистатины E и M, увеличивая актив
ми, ассоциированными с опухолью. M2 поля
ность катепсинов [23], а прокатепсин D может
ризация макрофагов в микроокружении опухо
активировать прокатепсин B, превращая его в
ли характеризуется повышенной экспрессией
зрелый фермент [24].
матриксных металлопротеиназ (MMP) и цисте
Активные катепсины способствуют ангиоге
иновых катепсинов, последние из которых мо
незу, пролиферации и метастазированию опухо
гут функционировать как в лизосоме, так и в ка
ли. Считается, что наиболее важный вклад в он
честве секретируемых ферментов для деграда
когенез человека вносят цистеиновые катепси
ции внеклеточного матрикса [19].
ны B, S, L и X [25]. Сверхэкспрессия в опухолях
В настоящем обзоре приведены данные о
и, как следствие, повышенное содержание в сы
вовлеченности цистеиновых катепсинов в такие
воротке крови этих ферментов, как правило,
онкогенные процессы, как пролиферация, ан
связаны с неблагоприятными прогнозами при
гиогенез, инвазия, метастазирование и химио
многих онкологических заболеваниях. При
резистентность. Кроме того, рассмотрены при
этом значимость отдельных катепсинов может
меры использования этих ферментов в качестве
варьироваться в зависимости от типа опухоли и
маркеров, мишеней и активаторов при создании
ее локализации.
новых диагностических и терапевтических под
Роль катепсинов в инвазии и метастазирова5
ходов для эффективного лечения онкологичес
нии. Катепсины способны расщеплять молеку
ких заболеваний.
лы клеточной адгезии, такие как интегрины и
E кадгерины, нарушая межклеточные контакты
и способствуя отсоединению клеток опухоли
ЦИСТЕИНОВЫЕ КАТЕПСИНЫ
[25]. E кадгерины гидролизуются преимущест
В ПРОЦЕССАХ ОНКОГЕНЕЗА
венно катепсинами B, L и S, приводя к получе
нию различных продуктов расщепления [20].
В микроокружении опухоли наблюдается из
Деградация матриксных белков также нарушает
быточная экспрессия и высокая активность оп
взаимодействие между опухолевыми клетками.
ределенных катепсинов, имеющих нехарактер
Было показано, что катепсины B и S гидролизу
ную локализацию. Помимо непосредственно
ют коллаген, ламинин, фибронектин и тенас
опухолевых клеток, катепсины секретируются
цин C [26]. Кроме того, катепсин B играет важ
ассоциированными с опухолью Т клетками,
ную роль в продвижении и высвобождении со
фибробластами, остеокластами, нейтрофилами,
держимого опухолевых экзосом [27]. Катепсины
тучными клетками, миоэпителиальными клет
также способны расщеплять базальную мембра
ками и эндотелиальными клетками [20] (табл. 1;
ну, способствуя инвазии клеток опухоли в кро
в табл. S1 Приложения представлены ссылки на
веносные и лимфатические сосуды, приводя к
БИОХИМИЯ том 84 вып. 7 2019
5*
956
ПЕТУШКОВА и др.
Таблица 1. Экспрессия катепсинов в различных типах опухолей
Ассоциированные с опухолью клетки
Катепсин
Опухолевые клетки
макрофаги
фибробласты
эндотелиальные
остеокласты
клетки
Катепсин B
опухоль головного мозга, рак ко
опухоль головного
рак кожи, рак
опухоль голов
рак молочной
жи, рак молочной железы, рак
мозга, рак молоч
молочной желе
ного мозга, рак
железы, рак
легкого, рак желудка, рак моче
ной железы, рак
зы, колорек
молочной же
щитовидной
вого пузыря, рак шейки матки,
поджелудочной
тальный рак, ге
лезы, рак же
железы
рак яичника, колоректальный
железы
патоцеллюляр
лудка
рак, гепатоцеллюлярная карци
ная карцинома,
нома, рак поджелудочной желе
рак поджелу
зы, рак щитовидной железы
дочной железы
Катепсин C
рак кожи
н.д.
рак кожи
н.д.
н.д.
Катепсин F
рак шейки матки
н.д.
н.д.
н.д.
н.д.
Катепсин H
опухоль головного мозга, рак ко
н.д.
н.д.
н.д.
н.д.
жи, рак предстательной железы,
колоректальный рак
Катепсин K
рак кожи, рак молочной железы,
рак легкого
рак кожи, рак
н.д.
опухоль кости,
рак легкого, рак желудка, рак
молочной желе
рак молочной
предстательной железы
зы
железы, рак
предстатель
ной железы,
рак почки
Катепсин L
опухоль головного мозга, рак ко
рак поджелудоч
рак кожи, рак
н.д.
н.д.
жи, рак молочной железы, рак
ной железы
поджелудочной
легкого, рак желудка, рак яични
железы
ка, колоректальный рак, рак
поджелудочной железы
Катепсин S
опухоль головного мозга, рак
рак молочной же
н.д.
гепатоцеллю
н.д.
молочной железы, рак желудка,
лезы, рак предста
лярная карци
рак предстательной железы, ко
тельной железы,
нома
лоректальный рак, гепатоцеллю
колоректальный
лярная карцинома, рак поджелу
рак, гепатоцеллю
дочной железы
лярная карцинома
Катепсин V
рак щитовидной железы
н.д.
н.д.
н.д.
н.д.
Катепсин X
рак желудка, рак предстательной
рак желудка, ко
н.д.
н.д.
н.д.
железы, колоректальный рак, ге
лоректальный рак
патоцеллюлярная карцинома,
рак поджелудочной железы
Примечание. Н.д. - нет данных.
метастазированию и опухолеобразованию в дру
как было показано, играет решающую роль при
гих частях организма [28]. Катепсин Н способ
метастазах рака молочной железы в мозг. Он
ствует миграции опухолевых клеток через рас
способен расщеплять адгезивные молекулы се
щепление талина, который регулирует актива
мейства JAM, в частности JAM B, что приводит
цию интегрина и адгезию [29]. Существуют дан
к нарушению гематоэнцефалического барьера.
ные, что катепсин K расщепляет коллаген I и
Этому способствует проявление активности ка
остеонектин в костях и потому ответственен за
тепсина S при нейтральных уровнях pH в сосу
остеолиз при метастазировании в кости. При
дах головного мозга [31].
этом катепсин K гидролизует белки матрикса
Катепсин X способствует адгезии, миграции
после фагоцитоза, а не в ECM [30]. Катепсин S, и инвазивности опухолевых клеток через инак
БИОХИМИЯ том 84 вып. 7 2019
ЦИСТЕИНОВЫЕ КАТЕПСИНЫ В ДИАГНОСТИКЕ И ТЕРАПИИ РАКА
957
тивацию опухолевого супрессора профилина 1 в
правлено на супрессорные клетки миелоидного
перинуклеарном пространстве и на плазмати
происхождения, которые подавляют активацию
ческой мембране [32]. В случае гепатоцеллю
T клеток. Однако в процессе гибели иммуно
лярной карциномы было показано, что катеп
супрессорных клеток происходит высвобожде
син X участвует в онкогенезе путем активации
ние катепсина B из лизосом, что запускает це
белков, связанных с ремоделированием ECM
лый каскад воспалительных реакций через акти
(MMP2, MMP3 и MMP9). Катепсин X также
вацию NLRP3 инфламмасомы, способствуя, в
может способствовать эпителиально мезенхи
конечном итоге, ангиогенезу и привлечению
мальному переходу через активацию мезенхи
новых супрессорных клеток [42]. В связи с тем,
мальных маркеров (фибронектин и виментин) и
что активность катепсина B связана с транспор
подавление эпителиальных маркеров (E кадге
том везикул, содержащих TNF α, к поверхности
рин и α катенин) [33]. Кроме того, зимоген ка
макрофагов, резистентность к химиотерапии
тепсина X задействован в онкогенезе за счет
может быть опосредована также через актива
связывания с интегринами как внутриклеточно,
цию NF κB или через экспрессию IL 6 в нео
так и в ECM. Это приводит к активации
пластических клетках с последующей активаци
FAK/Src пути пролиферации и к ремоделирова
ей STAT3 [43]. С другой стороны, было показа
нию актинового цитоскелета и инвазивности
но, что пермеабилизация лизосомальной мем
раковых клеток [34].
браны, вызванная химиотерапией тимохино
При деградации белков ЕСМ катепсинами
ном, индуцирует независимый от каспаз путь
могут образовываться проангиогенные фраг
апоптоза раковых клеток. Высвобождение ка
менты, что, в частности, показано для катепси
тепсинов B и D из лизосом и подкисление цито
на S в отношении ламинина 5 [35]. Кроме того,
золя, вызванные пермеабилизацией, индуциру
катепсины могут активировать другие фермен
ют передачу сигнала медиаторам гибели клеток
ты, запуская сигнальные пути, которые приво
[14]. Тем не менее было показано, что ингибито
дят к активации факторов роста и цитокинов.
ры катепсинов B и D способны вызывать гибель
Так, катепсин L способен активировать гепара
клеток нейробластомы, индуцированную акти
назу, которая регулирует ангиогенез и лимфоан
вацией зависимого от каспаз пути. Поскольку
гиогенез через высвобождение факторов роста
катепсины необходимы для аутофагии, апоптоз,
[36]. Было отмечено, что деградация эндоген
по всей видимости, является результатом инги
ных тканевых ингибиторов металлопротеиназ
бирования этого цитопротекторного пути [44].
катепсином B усиливает проангиогенные функ
В случае использования терапии ионизиру
ции MMP [37]. Катепсин S способен расщеп
ющим излучением повреждается ДНК, что при
лять некоторые антиангиогенные факторы, та
водит к индукции интерферона γ. Через регуля
кие как канстатин и аррестин [38]. Напротив,
торный фактор 1 интерферона он увеличивает
катепсины L и S способны генерировать анти
экспрессию катепсина S. Катепсин S, в свою
ангиогенный пептид эндостатин из коллагена
очередь, способствует устойчивости опухоли к
XVIII
[39]. При этом было показано, что
ионизирующему излучению [45].
экспрессия катепсина S в опухолевой среде уси
ливается в присутствии VEGF [40].
Роль катепсинов в химиорезистентности. Со
ЦИСТЕИНОВЫЕ КАТЕПСИНЫ
гласно имеющимся данным, катепсины могут
В КАЧЕСТВЕ МИШЕНЕЙ
играть решающую роль в развитии резистент
И АКТИВАТОРОВ
ности опухоли при применении различных ви
дов противоопухолевой терапии. Например,
Ингибирование протеолитической активности
TAM, на которые приходится большая часть
катепсинов. Избыточная активность катепсинов
секретируемых катепсинов [21], способны ин
в опухолевых клетках зачастую вызвана наруше
гибировать гибель раковых клеток, индуциро
нием работы цистатинов - эндогенных ингиби
ванную таксолом, этопозидом и доксорубици
торов цистеиновых протеиназ. Поэтому поиск
ном. Более того, после проведения химиотера
экзогенных ингибиторов катепсинов является
пии отмечалось привлечение новых макрофагов
перспективным направлением в разработке но
в опухолевую ткань. В исследовании Shree et al.
вых противоопухолевых средств. Использова
[41] показано, что ингибирование активности
ние различных ингибиторов цистеиновых про
катепсинов макрофагов оказалось достаточным
теиназ (табл. 2) способствует предотвращению
для инициации гибели опухолевых клеток. При
процессов ангиогенеза, инвазии и метастазиро
этом наиболее значимыми катепсинами в раз
вания опухолевых клеток.
витии резистентности оказались катепсины B и
Низкомолекулярные ингибиторы. Низкомоле
S. Действие гемцитабина и 5 фторурацила на
кулярные ингибиторы, применяемые для бло
БИОХИМИЯ том 84 вып. 7 2019
958
ПЕТУШКОВА и др.
Таблица 2. Примеры экзогенных ингибиторов протеиназной активности цистеиновых катепсинов
Ингибитор
Катепсин
Тип опухоли
Экспериментальная модель
Источник
1
2
3
4
5
Низкомолекулярные ингибиторы
катепсины
рак почки
клеточные линии A498, 786 O
[93]
катепсин B,
рак яичника
линия мышей M5076
[94]
катепсин L
E 64
катепсин B,
рак печени
клеточная линия H 59
[95]
катепсин L
катепсин L
рак молочной железы
клеточная линия MDA MB 231
[96]
рак молочной железы
линия мышей MMTV PyMT
[97]
JPM OEt
катепсины
рак поджелудочной железы
линия мышей RIP1 Tag2
[47]
опухоль шеи
клеточная линия SQ20B
рак молочной железы
клеточная линия BT 20
рак предстательной железы
клеточные линии PC 3, DU145
[48]
глиобластома
клеточная линия U 373
рак шейки матки
клеточная линия HeLa
CATI 1
катепсины
острый лимфобластный лейкоз
клеточные линии ALL 1, RS4;11,
KM3, NALM 6, MOLT 3, JURKAT
острый миелоидный лейкоз
клеточные линии HL 60, U937
[98]
хронический миелоидный лейкоз
клеточная линия K 562
лимфома Беркитта
клеточные линии DAUDI, RAMOS,
RAJI
рак молочной железы
клеточная линия 4T1.2, в т.ч.
[99]
ксенотрансплантат в мышах Balb/c
CA 074
катепсин B
рак молочной железы
клеточная линия MDA MB 231
[100]
меланома
клеточная линия MV3
[101]
рак молочной железы
клеточная линия MCF 10A NeoT
[56]
лейкоз
клеточная линия HL 60
лимфома
клеточные линии Raji, DHL 4
[54]
Нитроксолин и
катепсин B
рак поджелудочной железы
клеточная линия Panc 1
производные
рак яичника
клеточная линия A2780
глиобластома
клеточные линии U 87 MG, U373
[102]
фибросаркома
клеточная линия LPB 1, линия
мышей C57B1/6
БИОХИМИЯ том 84 вып. 7 2019
ЦИСТЕИНОВЫЕ КАТЕПСИНЫ В ДИАГНОСТИКЕ И ТЕРАПИИ РАКА
959
Окончание табл. 2
1
2
3
4
5
рак молочной железы
клеточная линия MCF 10A NeoT
Cq-Ru
катепсин B
[57]
глиобластома
клеточная линия U 87 MG
Оданакатиб
катепсин K
рак молочной железы
клинические исследования
[58]
L 235
катепсин K
рак молочной железы
ксенотрансплантат MDA MB 231
[59]
в крысах rnu/rnu
меланома
клеточная линия A375 в мышах
[61]
CLIK 148
катепсин L
колоректальный рак
клеточная линия 26 PMF 15 в мышах
глиобластома
клеточная линия U87
[62]
Z FF FMK
катепсин L
рак полости рта
клеточные линии 101A, 686Tu
[63]
нейробластома
клеточная линия SKN SH в мышах CD1
iCL
катепсин L
[64]
остеогенная саркома
клеточная линия SaOS2 в мышах CD1
рак предстательной железы
клеточная линия PC 3ML
[65]
рак молочной железы
клеточная линия MDA MB 231
рак предстательной железы
ксенотрансплантат PC 3ML
[66]
KGP94
катепсин L
в мышах NCR nu/nu
рак молочной железы
клеточная линия MDA MB 231, ксено
трансплантат C3H в мышах CDF1
[103]
рак предстательной железы
клеточная линия DU 145
LHVS
катепсин S
глиобластома
клеточные линии U251MG, U87MG
[67]
6n, 6r, 6w
катепсин S
рак легкого
клеточная линия CL1 5
[68]
VBY 999
катепсин S
рак молочной железы
ксенотрансплантат MDA MB 231
[31]
в мышах athymic/nude
Ингибиторы на основе антител
астроцитома
клеточная линия U251MG
рак предстательной железы
клеточная линия PC3
[71]
Fsn0503,
катепсин S
рак молочной железы
клеточная линия MDA MB 231
Fsn0503h
колоректальный рак
клеточная линия HCT116, в т.ч.
ксенотрансплантат в мышах Balb/c
колоректальный рак
клеточная линия LoVo
[72]
2A2
катепсин B
рак молочной железы
клеточная линия MCF 10A NeoT
[74]
БИОХИМИЯ том 84 вып. 7 2019
960
ПЕТУШКОВА и др.
кирования активности цистеиновых катепси
го связывания с гибкой окклюзионной петлей,
нов, можно разделить на синтетические и при
которая перемещается в зависимости от измене
родные, обратимые и необратимые. За счет на
ний рН и определяет субстратную эндопепти
личия реакционноспособной электрофильной
дазную активность или субстратную активность
группы необратимые ингибиторы могут связы
экзопептидазы [53]. Нитроксолин, как было по
ваться с нуклеофильными группами не только
казано in vitro, ингибирует рост раковых клеток и
катепсинов, приводя к неспецифическому свя
обладает антиангиогенными свойствами [54].
зыванию. Поэтому при разработке ингибиторов
По некоторым данным, при использовании нит
цистеиновых катепсинов основное внимание
роксолина можно наблюдать значительное
направлено на создание соединений с повы
уменьшение объема опухоли молочной железы,
шенной селективностью.
а также ингибирование роста раковых клеток
Используемые ингибиторы катепсинов
мочевого пузыря in vivo на ксенотрансплантате у
представляют собой в основном ингибиторы,
мышей. Кроме того, использование этого соеди
взаимодействующие с активным центром фер
нения ингибирует образование эндотелиальной
мента. Такие ингибиторы основаны на структу
трубки в матригеле и уменьшает плотность мик
рах эпоксисукцинила, винилсульфона или нит
рососудов in vivo [55]. Значительное снижение
рила. Например, Е 64 является необратимым
деградации ECM и эффективное ингибирование
ингибитором на основе эпоксисукцинила, обла
инвазии клеток MCF 10A neoT были также от
дающим ингибирующей активностью широкого
мечены при использовании производных нит
спектра действия в отношении катепсинов и
роксолина, ингибирующих катепсин B [56]. Ин
других цистеиновых протеиназ [46]. Сходный
тересные возможности для ингибирования ка
по структуре ингибитор JPM OEt проявляет бо
тепсина В предоставляют комплексы рутения с
лее специфичную активность в отношении ка
клиохинолом и хинолоном. В частности, комп
тепсинов и, как было показано на животной мо
лекс клиохинол-рутений (Cq-Ru) показал себя
дели, усиливает эффективность химиотерапии
как потенциальный противораковый агент за
путем снижения ангиогенеза и инвазии опухо
счет способности ингибировать как эндо , так и
левых клеток по сравнению с контрольной груп
экзопептидазную активность катепсина B. По
пой [47]. Ингибитор цистеиновых катепсинов
казано, что применение Cq-Ru приводит к зна
Z Phe Gly NHO Bz (CATI 1 - cathepsins inhibi
чительному снижению инвазии опухолевых кле
tor I) может вызывать апоптоз при плоскокле
ток при концентрациях, не оказывающих цито
точном раке шеи, аденокарциноме молочной
токсического действия [57].
железы, аденокарциноме предстательной желе
Большинство ингибиторов катепсина K об
зы, глиобластоме и раке шейки матки [48].
ладают реакционноспособными функциональ
Специфические ингибиторы катепсина B,
ными группами, такими как нитрил или альде
CA 074 и CA074Me (производное метилового
гид, которые способны образовывать ковалент
эфира CA 074), были созданы на основе струк
ную связь с цистеином активного центра фер
туры E 64 для улучшения проницаемости в клет
мента. Оданакатиб, ковалентное производное
ки, причем было показано, что CA074Me также
на основе нитрила, является ингибитором ка
хорошо ингибирует катепсин L [49]. Часто инги
тепсина К для лечения костных метастазов. Он
биторы катепсина B представляют собой миме
был исследован в фазе II клинических испыта
тики переходного состояния и содержат элект
ний у пациентов с раком молочной железы. Бы
рофильную карбонильную или нитрильную
ло доказано, что оданакатиб снижает количест
группу. В качестве природных обратимых инги
во маркера резорбции кости (N телопептида) в
биторов катепсина B выступают бифлавоны и их
моче. Однако значительный риск развития ин
производные, проявляя селективность в отно
сульта, связанного с приемом оданакатиба, выз
шении эндопептидазной активности фермента
вал прекращение его исследований [58]. Тем не
[50]. Также показано, что соединение DOFA ([2
менее проводится изучение новых ингибиторов
[2 (2,4 диоксо 1,3 тиазолидин 3 ил)этилами
катепсина K для лечения метастазов в кости.
но] 2 оксоэтил]2 (фуран 2 карбонилами
Так, структурно родственный оданакатибу обра
но)ацетат) в равной степени ингибирует экзо и
тимый ингибитор катепсина K, L 235, как было
эндопептидазную активность катепсина В [51], а
показано, замедляет рост опухоли и снижает ин
6 замещенные
4 бензилтио 1,3,5 триазин
вазию рака молочной железы [59]. В настоящее
2(1H) оны ингибируют его эндопептидазную
время активно изучаются ингибиторы катепси
активность [52]. Интересно, что хинолоновый
на K, которые активируются под воздействием
антибиотик нитроксолин, используемый для ле
света. К такому типу ингибиторов относится
чения инфекций мочевыводящих путей, обрати
Tanshinone IIA сульфонат натрия (T06), кото
мо ингибирует катепсин B за счет нековалентно
рый, как уже показано в исследованиях in vitro и
БИОХИМИЯ том 84 вып. 7 2019
ЦИСТЕИНОВЫЕ КАТЕПСИНЫ В ДИАГНОСТИКЕ И ТЕРАПИИ РАКА
961
in vivo, проявляет активность в остеокластах че
агрессивных опухолей с высоким уровнем
ловека и мыши, ингибируя резорбцию костной
экспрессии катепсина S, моноклональное анти
ткани [60].
тело мыши Fsn0503 связывает катепсин S при
Для катепсина L, как и для катепсина B, был
рН 4,9-7,5 и нарушает протеолиз желатина и
разработан специфический ингибитор на осно
коллагена. Так, снижение инвазивности наблю
ве структуры E 64 - CLIK 148. Показано, что
далось на линии клеток астроцитомы U251MG,
применение этого ингибитора может подавлять
клетках рака предстательной железы PC3 и мо
метастазирование при раке толстой кишки, ме
лочной железы MDA MB 231. Наиболее сущест
ланоме и глиобластоме [61, 62]. К снижению
венные эффекты были получены на клеточной
инвазивности плоскоклеточного рака полости
линии колоректальной карциномы HCT116, в
рта приводит использование селективного ин
которой наблюдалось снижение опухолевой ин
гибитора катепсина L Z FF FMK [63]. Обрати
вазии на 64% [71]. Fsn0503 также ингибирует
мый ингибитор iCL демонстрирует сильное по
процессы ангиогенеза, приводя к уменьшению
давление устойчивости опухолевых клеток к ле
образования сосудов до 70% по сравнению с
карственным средствам in vivo и in vitro. Причем
контролем [71]. Более того, эффективность при
показано, что применение iCL, в т.ч. в комбина
менения Fsn0503 была подтверждена в исследо
ции с доксорубицином, снижает рост опухоли у
ваниях in vivo на ксенотрансплантатах HCT116 у
мышей с ксенотрансплантатами нейробластомы
мышей. Применение Fsn0503 приводит к значи
[64]. Другой ингибитор катепсина L, KGP94, яв
тельному угнетению развития опухоли и сниже
ляясь производным тиосемикарбазона, спосо
нию количества эндотелиального маркера
бен угнетать вызванную гипоксией и ацидозом
CD34, что свидетельствует о нарушении ин
инвазивность клеток рака предстательной и мо
фильтрации эндотелиальных клеток и связан
лочной желез [65], а также ангиогенез и резорб
ной с ней неоваскуляризацией опухоли [71].
цию костной ткани [66].
В дальнейшем, после обнаружения того, что ка
Для необратимого ингибитора катепсина S,
тепсин S локализован не только в лизосомах и
LHVS, была показана способность снижать ин
ЕСМ, но также связан с клеточной мембраной,
вазию и вызывать апоптоз в клетках глиобласто
стала очевидной возможность применения ка
мы [67]. Ингибиторы катепсина S на основе
тепсина S в роли мишени в антителозависимой
α кетоамидных соединений, такие как 6n, 6r и
клеточной цитотоксичности. Примечательно,
6w, продемонстрировали противоопухолевую
что на исследованных клеточных линиях катеп
эффективность на раковых клетках легкого [68].
син S локализуется совместно с актином в огра
Противоопухолевая активность селективного
ниченных областях клеточной поверхности [72].
ингибитора катепсина S была обнаружена для
При создании аналога антитела Fsn0503 для
нитрильного производного, которое иницииро
клинического применения была разработана его
вало апоптоз, значительно снижало пролифера
специальная форма Fsn0503h, в которой участок
цию на моделях рака, а также проявляло анти
связывания антигена был несколько изменен, а
ангиогенный эффект in vitro [69]. Другим мощ
в качестве Fc фрагмента использовался IgG1,
ным противораковым специфическим ингиби
но при этом все гипервариабельные домены бы
тором катепсина S является VBY 999, его ис
ли сохранены. Результаты исследований на ли
пользование приводит к уменьшению метаста
нии LoVo колоректального рака показали, что
зирования в мозг при применении на ранних
использование модифицированного антитела
стадиях в исследованиях in vivo [31].
Fsn0503h, имеющего сходный с Fsn0503 про
Для катепсина X был обнаружен ингибитор
филь связывания, способно вызывать гибель
на основе триазолбензодиоксина. Его действие
> 20% клеток. Кроме того, было показано, что
приводит к снижению миграции опухолевых
действие Fsn0503h связано с привлечением
клеток и увеличению роста аксонов, причем оба
CD16+ клеток, обладающих выраженной цито
процесса находятся под контролем карбокси
токсической активностью [72]. Таким образом,
пептидазной активности катепсина X [70].
Fsn0503h является перспективным кандидатом в
Ингибиторы на основе антител. В настоящее
качестве противоопухолевого терапевтического
время ингибиторы на основе антител были раз
средства.
работаны для катепсина S и катепсина В, как
Катепсин В, как было отмечено выше, про
наиболее активных и распространенных в раз
являет ферментативную активность как эндо и
личных видах опухолей цистеиновых протеиназ
экзопептидаза. Было показано, что деградация
и, следовательно, являющихся перспективными
катепсином B белков ECM, необходимая для
мишенями в противоопухолевой терипии.
инвазии и метастазирования опухолевых кле
Согласно исследованиям in vitro на клеточ
ток, осуществляется за счет эндопептидазной
ных линиях, представляющих основные классы
активности. Моноклональное антитело 2A2
БИОХИМИЯ том 84 вып. 7 2019
962
ПЕТУШКОВА и др.
подкласса IgG2a при связывании катепсина B
клетках оно последовательно активируется гис
значительно снижает инвазию опухолевых кле
тондеацетилазой, которая удаляет ацетильную
ток [73]. Расположение эпитопа 2A2 около гиб
группу, и катепсином L, который отщепляет ли
кой петли протеиназы указывает на то, что свя
зин и высвобождает пуромицин. Активность
зывание 2A2 может изменить конформацию
данного пролекарства была подтверждена in
петли и таким образом стабилизировать кон
vivo на опухолевых ксенотрансплантатах чело
формацию экзопептидазы. Эти данные также
века [75]. Гемцитабин, характеризующийся ко
подтверждает проявление катепсином B экзо
ротким периодом полувыведения и серьезными
пептидазной активности по отношению к орто
побочными эффектами, в составе синтетичес
аминобензойной кислоте и отсутствие эндопеп
кого пролекарства с ковалентно связанной ами
тидазной активности по отношению к казеину и
ногруппой и карбоксильной группой холесте
коллагену IV в присутствии 2A2 [74]. Эффектив
рил гемисукцината (CHSdFdC - cholesteryl
ность 2A2 подтверждена на клетках MCF 10A
hemisuccinate gemcitabine) представляет собой
NeoT, для которых было показано, что при до
амфифильные самособирающиеся в водных
бавлении антитела значительно снижается де
средах наночастицы, которые высвобождают
градация коллагена IV как вне, так и внутри кле
гемцитабин только в кислых средах, характер
ток. Такой специфический механизм регуляции
ных для лизосом, причем высвобождение гем
активности катепсина В может быть применен
цитабина значительно увеличивается с участи
при разработке терапевтичеких средств для ле
ем катепсина В. Кроме того, такие наночастицы
чения заболеваний, ассоциированных с
лучше и быстрее проникают в клетку по сравне
действием катепсина B [74].
нию с гемцитабином [76]. Для флоксуридина,
Направленная доставка. В настоящее время
также характеризующегося существенными по
активно изучается возможность использования
бочными эффектами, были разработаны два
протеолитической активности катепсинов для
успешных пролекарства путем присоедине
повышения специфичности различных химио
ния фенилаланина и тирозина или глицина с
терапевтических средств. Разработка способов
образованием 5′ O L фенилаланил L тирозил
направленной доставки лекарств с участием ка
флоксуридина и 5′ O L фенилаланил L глицил
тепсинов обусловлена присутствием в больших
флоксуридина соответственно. Обе молекулы
количествах активных ферментов в микроокру
активируются катепсинами B и D, поэтому по
жении опухолевых клеток. В то же время невы
тенциально они могут успешно применяться в
сокий уровень экспрессии катепсинов в здоро
терапии опухолей [77]. Кроме того, недавно
вых тканях позволяет снизить системную ток
доклинические испытания прошли пролекар
сичность противоопухолевых препаратов на
ства для направленной доставки доксорубици
правленного действия, активирующихся под
на: конъюгаты лекарств с пептидами, в которых
действием протеолитических ферментов. В нас
проникающий в клетку пептид TAT ковалентно
тоящее время можно выделить три стратегии
связан с молекулами доксорубицина через лин
направленной доставки с участием цистеиновых
кер GFLG, и мПЭГилированный дендрон
катепсинов: 1) катепсин опосредованная акти
GFLG доксорубицин, который способен к са
вация пролекарств; 2) катепсин опосредован
мосборке в компактные наночастицы с отрица
ная активация пролекарств, конъюгированных
тельно заряженной поверхностью. Последова
с антителом; 3) катепсин опосредованная де
тельность GFLG, как было показано, является
градация наночастиц (табл. 3). Такая активация
наиболее стабильным спейсером в плазме, ко
пролекарств осуществляется за счет протеоли
торый при этом эффективно гидролизуется в
тически активных катепсинов, локализованных
присутствии катепсина B, а количество доксо
в опухоли, с последующим превращением в сво
рубицина в конъюгате значительно влияет на
бодные лекарственные средства. За счет созда
его высвобождение и эффективность in vitro
ния пролекарств можно избежать многих недос
[78]. Также показано, что дендримерные нано
татков и побочных эффектов действующих ве
частицы с доксирубицином проявляют повы
ществ.
шенную противоопухолевую эффективность и
Катепсин опосредованная активация проле
пониженную токсичность по сравнению со сво
карств. Известно, что аминонуклеозидный ан
бодным доксорубицином [79]. Примером био
тибиотик пуромицин способен ингибировать
разлагаемого конъюгата может служить конъю
синтез белка, вызывая нарушение работы рибо
гат поли γ глутаминовой кислоты (PGA) и про
сом во время трансляции и приводя к цитоток
тивоопухолевого средства паклитаксел (PPX -
сичности клеток. Однако в составе пролекар
paclitaxel poliglumex; CT 2103) [80], который уже
ства Boc KAc Puro пуромицин связан с ацети
оценен в клинических испытаниях. Конъюга
лированной группой лизина, и в опухолевых
ция паклитаксела через сложноэфирную связь с
БИОХИМИЯ том 84 вып. 7 2019
ЦИСТЕИНОВЫЕ КАТЕПСИНЫ В ДИАГНОСТИКЕ И ТЕРАПИИ РАКА
963
Таблица 3. Примеры терапевтических препаратов, основанных на протеиназной активности катепсинов
Название
Активирующий
Цитотоксический
Тип опухоли
Экспериментальная модель/
Источник
пролекарства
фермент
агент
стадия исследования
Катепсин5опосредованная активация пролекарств
колоректальный
клеточные линии Caco 2,
рак
GOGA 10, HCA 7, HT29, HCT116
рак поджелудоч
клеточные линии MiaPaca 2,
Boc KAc Puro
катепсин L
пуромицин
ной железы
BXPC3
[75]
рак печени
клеточная линия HepG2
рак шейки матки
клеточная линия HeLa
CHSdFdC
катепсин B
гемцитабин
рак поджелудоч
клеточная линия Bxpc 3
[76]
ной железы
5′ O L фенилала
катепсин B
флоксуридин
рак поджелудоч
клеточная линия Capan 2
[77]
нил L тирозил
ной железы
флоксуридин, 5′ O
L фенилаланил L
глицилфлоксуридин
мПЭГилированный
катепсин B
доксорубицин
рак молочной же
клеточная линия 4T1, в т.ч.
[79]
дендрон GFLG
лезы
ксенотрансплантат в мышах
доксорубицин
Balb/c
CT 2103
катепсин B
паклитаксел
рак легкого
клинические исследования
[80]
Катепсин5опосредованная активация пролекарств, конъюгированных с антителом
ADC брентуксимаб
катепсин B
монометилаурис
лимфома Ходжки
клинические исследования
[93]
ведотин
татин Е (ММАЕ,
на
ведотин)
плоскоклеточный
ксенотрансплантат A 431
рак кожи
в мышах Balb/c
монометилаурис
ADC MMAE F16
катепсин B
татин Е (ММАЕ,
рак молочной же
ксенотрансплантат MDA
[82]
ведотин)
лезы
MB 231 в мышах Balb/c
глиобластома
ксенотрансплантат U 87
MG в мышах Balb/c
Катепсин5опосредованная деградация наночастиц
Мезопористые нано
катепсин B
доксорубицин
рак шейки матки
клеточная линия HeLa
[83]
частицы кремнезема
PGA наночастицы/
катепсин B
индоцианин зеле
плоскоклеточный
клеточная линия SCC 9
[85]
индоцианин зеленый
ный (при ИК об
рак языка
лучении)
PLGA наночастицы/
катепсин B
цистатин (инги
рак молочной же
клеточная линия MCF 7
[86]
цистатин с антителом
битор катепси
лезы
на цитокератин 8
нов)
БИОХИМИЯ том 84 вып. 7 2019
964
ПЕТУШКОВА и др.
боковыми цепями PGA обеспечивает большую
экспрессии опухолевых антигенов может способ
загрузку лекарственного средства, причем PPX
ствовать формированию иммунологической то
высвобождается из конъюгата за счет расщепле
лерантности к данным антигенам. В связи с
ния лизосомальным катепсином В основной це
этим разработки в данной области распростра
пи полимера после поглощения клетками в про
нились на компоненты модифицированного
цессе эндоцитоза.
внеклеточного матрикса опухоли, такие как
Катепсин опосредованная активация проле
сплайс изоформы фибронектина и тенасцина С,
карств, конъюгированных с антителом. Для уве
являющиеся привлекательными мишенями для
личения специфичности противоопухолевых
доставки из за их высокой селективной
таргетных лекарственных средств также исполь
экспрессии в месте опухоли, а также стабиль
зуется широко известный подход - связывание
ности. Так, недавно было разработано ADC, в
с моноклональными антителами, которые спе
состав которого входит антитело F16 типа IgG,
цифически распознают клеточные поверхност
специфичное к сплайс изоформе тенасцина С,
ные антигены и доставляют лекарственное сред
и присоединенный через линкер Val Cit MMAE.
ство непосредственно к клетке мишени. Опос
Изоформа тенасцина С, как было показано на
редованная антителами доставка в опухолевые
трех моделях рака человека (U87, A431, MDA
клетки может существенно повышать терапев
MB 231) у мышей, селективно локализуется в
тическую эффективность и уменьшать побоч
субэндотелиальном ECM опухоли. Несмотря на
ные эффекты химиотерапевтического средства.
то, что в ECM пептидные линкеры расщепляют
Конъюгаты антител с лекарственным средством
ся преимущественно сериновыми протеиназа
(ADC - antibody-drug conjugate) часто нацеле
ми, цистеиновый катепсин В при рН 6,5 также
ны на мембранные рецепторы, которые после
способен расщеплять Val Cit. В результате
связывания интернализуются и доставляют
MMAE, высвобожденный в ЕМС опухоли, мо
ADC в кислую, богатую катепсинами эндолизо
жет диффундировать и впоследствии интерна
сомальную систему. При этом линкеры, связы
лизироваться в опухолевые клетки, эндотели
вающие цитотоксическое вещество и антитело,
альные клетки и лейкоциты, где оказывает свое
имеют решающее значение, поскольку они
антимитотическое действие [83].
должны предотвращать высвобождение лекар
Катепсин опосредованная деградация нано
ственного средства в крови, но способствовать
частиц. Полимерные наночастицы являются
данному процессу после поглощения опухоле
многообещающими системами для доставки
вой клеткой. В разработках применительно к
противоопухолевых агентов, поскольку они на
противоопухолевой терапии линкеры зачастую
капливаются в опухолях благодаря эффекту по
нацелены на лизосомальные катепсины. На
вышенной проницаемости и удерживания (EPR -
пример, последовательности Val Cit (цитруллин),
enhanced permeability and retention) и попадают в
Val Ala или Phe Lys являются наиболее часто ис
опухолевые клетки посредством эндоцитоза.
пользуемыми линкерами, расщепляемые катеп
Кроме того, они могут предотвращать преждев
синами. За счет высокой стабильности в плазме
ременную деградацию лекарственного средства
и эффективного расщепления катепсином B
и осуществлять контролируемое высвобождение
линкер Val Cit стал особенно популярен [81].
молекул в необходимом месте, повышая тера
Так, в клинически утвержденном на рынке ADC
певтическую эффективность и уменьшая неже
Adcetris антитело брентуксимаб нацелено на
лательные побочные эффекты. Одним из при
CD30 - маркер лимфомы Ходжкина и систем
меров являются мезопористые наночастицы
ной анапластической крупноклеточной лимфо
кремнезема для внутриклеточного контролируе
мы [82], а лекарственное средство представляет
мого высвобождения сафранина O (S1 P) или
собой монометилауристатин Е (MMAE
-
доксорубицина (S2 P) в клетках, экспрессирую
monomethyl auristatin E, или ведотин), связан
щих катепсин В. Эти наночастицы содержат
ный с антителом через дипептид Val Cit. После
«молекулярные ворота», состоящие из распоз
того как ADC интернализуется опухолевыми
наваемой катепсином B аминокислотной после
клетками посредством эндоцитоза, катепсин B
довательности. После интернализации наночас
высвобождает MMAE
- антимитотическое
тиц специфические последовательности рас
средство, которое ингибирует деление клеток,
щепляются катепсином B, что приводит к вы
блокируя полимеризацию тубулина [82].
свобождению цитотоксического агента [84].
Большинство фармацевтических разработок
В другом исследовании были разработаны и
в области ADC направлены на мишени, распо
охарактеризованы наночастицы из PGA, содер
ложенные на мембране опухолевых клеток, что,
жащие индоцианин зеленый (ICG). Деградация
с одной стороны, улучшает селективность, од
наночастиц катепсином В приводит к поглоще
нако, с другой стороны, низкий уровень
нию ICG клетками. Обладая минимальной ток
БИОХИМИЯ том 84 вып. 7 2019
ЦИСТЕИНОВЫЕ КАТЕПСИНЫ В ДИАГНОСТИКЕ И ТЕРАПИИ РАКА
965
сичностью в темноте, ICG проявлял значитель
щепления гасителя целевым ферментом, изби
ную цитотоксичность при воздействии излуче
рательно локализующимся в пораженной ткани,
ния ближней инфракрасной области. Эти ре
в то время как в интактном препарате флуорес
зультаты показывают, что такой терапевтичес
ценция гасится ферстеровским переносом энер
кий подход может быть полезным при лечении
гии (FRET). Применение зондов в хирургии
поверхностных злокачественных новообразова
опухолей приводит к детекции флуоресценции в
ний, таких как опухоли головы и шеи [85].
пораженных тканях, способствуя наиболее пол
К полимерным наночастицам также присое
ному удалению пораженной ткани [87]. В насто
диняют специфические молекулы распознава
ящее время на ранних этапах клинических ис
ния - лиганды (моноклональные антитела к ас
следований находятся два зонда широкого
социированным опухолевым антигенам, рецеп
спектра: LUM015 и
68Ga BMV101. Зонд
торы, ферменты, гликопротеины), тем самым
LUM015 представляет собой ПЭГилированный
увеличивая сродство к опухолевым клеткам [86].
субстрат катепсинов, флуоресцирующий в
Примером могут служить наночастицы из по
ближнем инфракрасном диапазоне. Зонд 68Ga
ли(молочной со гликолевой) кислоты, содер
BMV101, созданный на основе феноксиметил
жащие ингибитор катепсинов цистатин внутри
кетона для позитронно эмиссионной и компью
и антитела, распознающие эпитоп на внекле
терной томографии, обеспечивает неинвазив
точной части цитокератина 8, на поверхности.
ную визуализацию тканей с глубоким проник
Полимерные наночастицы за счет связывания с
новением лучей [88]. Кроме того, средства, на
цитокератином
8, сверхэкспрессирующимся
целенные на протеолиз катепсинами, могут так
инвазивными клетками опухоли молочной же
же применяться в диагностике методом магнит
лезы, интернализуются опухолевыми клетками
но резонансной томографии.
и затем расщепляются в эндосомальной и лизо
Цистеиновые катепсины часто проявляют
сомальной системе, в т.ч. цистеиновыми катеп
перекрывающуюся субстратную специфич
синами, что приводит к высвобождению инги
ность, поэтому разработка зондов для визуализа
битора. Активность катепсина B почти пол
ции конкретного фермента представляет собой
ностью устраняется цистатином, что предотвра
трудную задачу. Тем не менее на основе данных
щает деградацию интернализованного ECM и
скрининга различных пептидных последова
снижает способность опухолевых клеток к инва
тельностей был разработан высокоселективный
зии и метастазированию, не влияя на протеоли
маркер MP cL3 для катепсина L [89]. Еще один
тические функции в здоровых клетках [86].
специфичный зонд 8h6 на основе сконструиро
Цистеиновые катепсины в диагностике опухо5
ванного белка с анкириновым повтором DARPin
лей. Протеолитическая активность катепсинов
направлен на визуализацию катепсина B [90].
также находит применение в клинической мо
Недавно также был разработан флуоресцентный
лекулярной диагностике. Данный подход за
зонд CyA P CyB, который помимо визуализа
ключается в визуализации опухоли путем ис
ции обладает фототоксичностью. В этом случае
пользования активируемых флуоресцентных
до расщепления катепсином B флуоресценция
зондов (табл. 4). Принцип их работы основан на
CyA гасится CyB посредством FRET. В результа
том, что зонды флуоресцируют только после от
те расщепления образуется CyA, который при
Таблица 4. Примеры зондов для визуализации опухоли, основанных на протеиназной активности катепсинов
Маркер
Целевой
Тип опухоли
Стадия исследования/экспериментальная модель
Источник
фермент
LUM015
катепсин B,
рак молочной железы
клинические исследования
[87]
катепсин K,
катепсин L,
катепсин S
MP cL3
катепсин L
рак молочной железы
клеточная линия MDA MB 231
[89]
DARPin 8h6
катепсин B
рак молочной железы
клеточная линия PyMT, клеточная линия 4T1, ксено
[90]
трансплантанты у мышей
CyA P CyB
катепсин B
рак легкого
ксенотрансплантат у мышей
[91]
CPC@MOF
катепсин B
рак шейки матки
клеточная линия HeLa, ксенотрансплантат у мышей
[92]
БИОХИМИЯ том 84 вып. 7 2019
966
ПЕТУШКОВА и др.
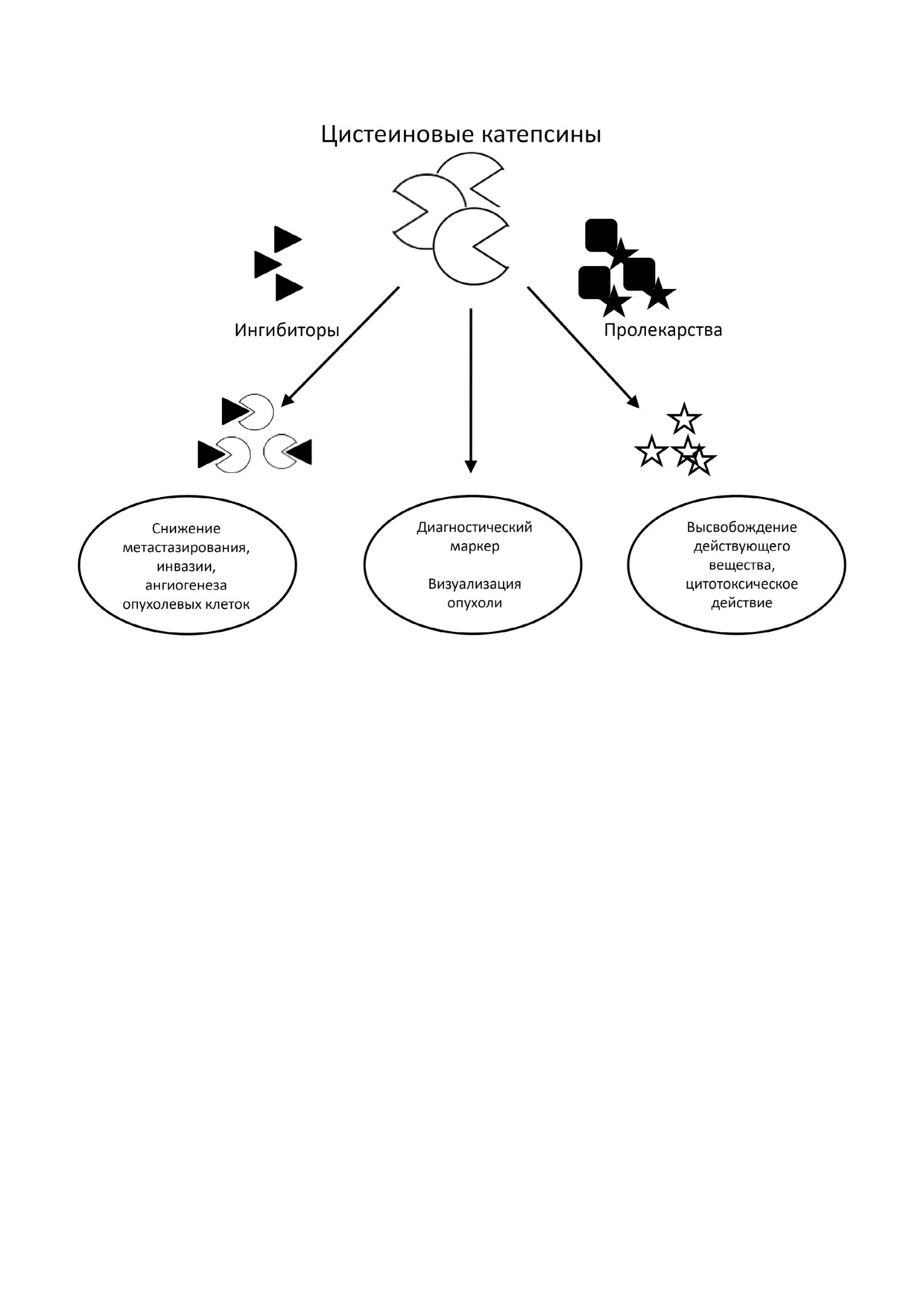
Возможности применения цистеиновых катепсинов в диагностике и терапии онкологических заболеваний
облучении при длине волны 650 нм флуоресци
ми для создания новых эффективных высоко
рует, что позволяет локализовать опухоль. В то
специфичных противоопухолевых средств (ри
же время высвободившийся CyB в результате
сунок). Для блокирования работы катепсинов
химических реакций превращается в Cy S Ph
был разработан ряд ингибиторов, многие из ко
NH2, который при облучении при длине волны
торых активно исследуются в доклинических и
808 нм оказывает фототоксический эффект [91].
клинических испытаниях. При этом ингибиро
Препарат со сходными свойствами CPC@MOF
вание катепсинов не только способствует сни
использует в качестве флуорофора Ce6, кото
жению жизнеспособности опухоли, но также
рый закреплен на металлорганической структу
позволяет более тщательно изучить их роль в ра
ре через линкер, расщепляемый катепсином B.
ковых, а также ассоциированных с опухолью
При высвобождении Ce6 способен флуоресци
клетках. Кроме того, ингибиторы на основе ан
ровать, а применение лазерного излучения при
тител могут приводить к активации цитотоксич
длине волны 660 нм приводит к фотооксигена
ности клеток. Другой подход предлагает исполь
ции [92].
зование протеиназной активности катепсинов
вместо ее ингибирования. Например, химиоте
Во многих опухолях катепсины выполняют
рапевтические средства могут быть инактивиро
важные для онкогенеза функции и обнаружива
ваны при помощи различных модификаций, что
ются в больших количествах. Расщепление ка
приводит к уменьшению побочных эффектов.
тепсинами многочисленных и разнообразных
Однако в микроокружении опухоли эти моди
субстратов как в лизосомах, так и в межклеточ
фикации снимаются катепсинами, что обеспе
ном пространстве обеспечивает инвазивность и
чивает направленную доставку препарата. Так
ангиогенез, что способствует успешному росту и
же для ограничения действия химиотерапевти
метастазированию опухоли. Вследствие этого
ческих средств было предложено упаковывать
катепсины являются перспективными мишеня
их в наночастицы, которые накапливаются в
БИОХИМИЯ том 84 вып. 7 2019
ЦИСТЕИНОВЫЕ КАТЕПСИНЫ В ДИАГНОСТИКЕ И ТЕРАПИИ РАКА
967
опухоли благодаря эффекту повышенной про
подходов к диагностике рака и противоопухоле
ницаемости и удерживания, где деградируют
вой терапии.
под действием катепсинов. Применение проте
иназной активности катепсинов для визуализа
ции опухоли - еще один успешный подход, ко
Финансирование. Работа выполнена при под
торый можно применять для диагностики и при
держке Российского научного фонда (грант
хирургических вмешательствах. Такие направ
№ 16 15 10410).
ления катепсин опосредованной терапии рака
Конфликт интересов. Авторы заявляют об от
отражают многообразие процессов онкогенеза,
сутствии конфликта интересов.
в которые вовлечены эти цистеиновые протеи
Соблюдение этических норм. Настоящая
назы. Дальнейшие исследования локализации и
статья не содержит описания выполненных
специфичности цистеиновых катепсинов долж
авторами исследований с участием людей или
ны способствовать прогрессу в развитии новых
использованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Rawlings, N.D., Barrett, A.J., Thomas, P.D., Huang, X.,
12.
Maishi, N., and Hida, K. (2017) Tumor endothelial cells
Bateman, A., and Finn, R.D. (2018) The MEROPS data
accelerate tumor metastasis, Cancer Sci., 108, 1921-1926,
base of proteolytic enzymes, their substrates and inhibitors
doi: 10.1111/cas.13336.
in 2017 and a comparison with peptidases in the PAN
13.
Bruno, A., Focaccetti, C., Pagani, A., Imperatori, A.S.,
THER database, Nucleic Acids Res., 46, D624-D632, doi:
Spagnoletti, M., Rotolo, N., Cantelmo, A.R., Franzi, F.,
10.1093/nar/gkx1134.
Capella, C., Ferlazzo, G., Mortara, L., Albini, A., and
2.
Spira, D., Stypmann, J., Tobin, D.J., Petermann, I.,
Noonan, D.M. (2013) The proangiogenic phenotype of
Mayer, C., Hagemann, S., Vasiljeva, O., Gunther, T.,
natural killer cells in patients with non small cell lung can
Schule, R., Peters, C., and Reinheckel, T. (2007) Cell type
cer, Neoplasia, 15, 133-142, doi: 10.1593/neo.121758.
specific functions of the lysosomal protease cathepsin L in
14.
Mitchem, J.B., Brennan, D.J., Knolhoff, B.L., Belt, B.A.,
the heart, J. Biol. Chem., 282, 37045-37052, doi: 10.1074/
Zhu, Y., Sanford, D.E., Belaygorod, L., Carpenter, D.,
jbc.M703447200.
Collins, L., Piwnica Worms, D., Hewitt, S., Udupi, G.M.,
3.
Boya, P., and Kroemer, G. (2008) Lysosomal membrane
Gallagher, W.M., Wegner, C., West, B.L., Wang Gillam,
permeabilization in cell death, Oncogene, 27, 6434-6451,
A., Goedegebuure, P., Linehan, D.C., and DeNardo,
doi: 10.1038/onc.2008.310.
D.G. (2013) Targeting tumor infiltrating macrophages
4.
Repnik, U., Cesen, M.H., and Turk, B. (2013) The
decreases tumor initiating cells, relieves immunosuppres
endolysosomal system in cell death and survival, Cold
sion, and improves chemotherapeutic responses, Cancer
Spring Harb. Perspect. Biol., 5, a008755, doi: 10.1101/csh
Res., 73, 1128-1141, doi: 10.1158/0008 5472.CAN 12
perspect.a008755.
2731.
5.
Salminen Mankonen, H., Morko, J., and Vuorio, E.
15.
Franklin, R.A., Liao, W., Sarkar, A., Kim, M.V., Bivona,
(2007) Role of cathepsin K in normal joints and in the
M.R., Liu, K., Pamer, E.G., and Li, M.O. (2014) The cel
development of arthritis, Curr. Drug Targets, 8, 315-323,
lular and molecular origin of tumor associated
doi: 10.2174/138945007779940188.
macrophages, Science, 344, 921-925, doi: 10.1126/sci
6.
Duncan, E.M., Muratore Schroeder, T.L., Cook, R.G.,
ence.1252510.
Garcia, B.A., Shabanowitz, J., Hunt, D.F., and Allis, C.D.
16.
Linde, N., Lederle, W., Depner, S., van Rooijen, N.,
(2008) Cathepsin L proteolytically processes histone H3
Gutschalk, C.M., and Mueller, M.M. (2012) Vascular
during mouse embryonic stem cell differentiation, Cell,
endothelial growth factor induced skin carcinogenesis
135, 284-294, doi: 10.1016/j.cell.2008.09.055.
depends on recruitment and alternative activation of
7.
Sadegh Nasseri, S., and Kim, A. (2015) MHC class II
macrophages, J. Pathol., 227, 17-28, doi: 10.1002/
auto antigen presentation is unconventional, Front.
path.3989.
Immunol., 6, 372, doi: 10.3389/fimmu.2015.00372.
17.
Su, S., Liu, Q., Chen, J., Chen, J., Chen, F., He, C.,
8.
Stoeckle, C., Gouttefangeas, C., Hammer, M., Weber, E.,
Huang, D., Wu, W., Lin, L., Huang, W., Zhang, J., Cui,
Melms, A., and Tolosa, E. (2009) Cathepsin W expressed
X., Zheng, F., Li, H., Yao, H., Su, F., and Song, E. (2014)
exclusively in CD8+ T cells and NK cells, is secreted dur
A positive feedback loop between mesenchymal like can
ing target cell killing but is not essential for cytotoxicity in
cer cells and macrophages is essential to breast cancer
human CTLs, Exp. Hematol.,
37,
266-275, doi:
metastasis, Cancer Cell, 25, 605-620, doi: 10.1016/j.ccr.
10.1016/j.exphem.2008.10.011.
2014.03.021.
9.
Hanahan, D., and Weinberg, R. (2011) Hallmarks of can
18.
Li, Y., Zheng, Y., Li, T., Wang, Q., Qian, J., Lu, Y., Zhang,
cer: the next generation, Cell, 144, 646-674, doi:
M., Bi, E., Yang, M., Reu, F., Yi, Q., and Cai, Z. (2015)
10.1016/j.cell.2011.02.013.
Chemokines CCL2, 3, 14 stimulate macrophage bone
10.
Chen, F., Zhuang, X., Lin, L., Yu, P., Wang, Y., Shi, Y.,
marrow homing, proliferation, and polarization in multiple
Hu, G., and Sun, Y. (2015) New horizons in tumor
myeloma, Oncotarget, 6, 24218-24229, doi: 10.18632/
microenvironment biology: challenges and opportunities,
oncotarget.4523.
BMC Med., 13, 45, doi: 10.1186/s12916 015 0278 7.
19.
Olson, O.C., and Joyce, J.A. (2015) Cysteine cathepsin
11.
Shiga, K., Hara, M., Nagasaki, T., Sato, T., Takahashi, H.,
proteases: regulators of cancer progression and therapeutic
and Takeyama, H. (2015) Cancer associated fibroblasts:
response, Nat. Rev. Cancer, 15, 712-729, doi: 10.1038/
their characteristics and their roles in tumor growth,
nrc4027.
Cancers (Basel),
7,
2443-2458, doi:
10.3390/can
20.
Gocheva, V., Wang, H.W., Gadea, B.B., Shree, T., Hunter,
cers7040902.
K.E., Garfall, A.L., Berman, T., and Joyce, J.A. (2010)
БИОХИМИЯ том 84 вып. 7 2019
968
ПЕТУШКОВА и др.
IL 4 induces cathepsin protease activity in tumor associat
33.
Wang, J., Chen, L., Li, Y., and Guan, X. Y. (2011)
ed macrophages to promote cancer growth and invasion,
Overexpression of cathepsin Z contributes to tumor metas
Genes Dev., 24, 241-255, doi: 10.1101/gad.1874010.
tasis by inducing epithelial mesenchymal transition in
21.
Fehrenbacher, N., Bastholm, L., Kirkegaard Sorensen, T.,
hepatocellular carcinoma, PLoS One, 6, e24967, doi:
Rafn, B., Bottzauw, T., Nielsen, C., Weber, E., Shirasawa,
10.1371/journal.pone.0024967.
S., Kallunki, T., and Jaattela, M. (2008) Sensitization to
34.
Akkari, L., Gocheva, V., Kester, J.C., Hunter, K.E., Quick,
the lysosomal cell death pathway by oncogene induced
M.L., Sevenich, L., Wang, H. W., Peters, C., Tang, L.H.,
down regulation of lysosome associated membrane pro
Klimstra, D.S., Reinheckel, T., and Joyce, J.A. (2014)
teins 1 and 2, Cancer Res., 68, 6623-6633, doi: 10.1158/
Distinct functions of macrophage derived and cancer cell
0008 5472.CAN 08 0463.
derived cathepsin Z combine to promote tumor malignan
22.
Bannoud, N., Carvelli, F.L., Troncoso, M., Sartor, T.,
cy via interactions with the extracellular matrix, Genes
Vargas Roig, L.M., and Sosa, M. (2018) Cation dependent
Dev., 28, 2134-2150, doi: 10.1101/gad.249599.114.
mannose 6 phosphate receptor expression and distribution
35.
Small, D.M., Burden, R.E., Jaworski, J., Hegarty, S.M.,
are influenced by estradiol in MCF 7 breast cancer cells,
Spence, S., Burrows, J.F., McFarlane, C., Kissenpfennig,
PLoS One, 13, 1-17, doi: 10.1371/journal.pone. 0201844.
A., McCarthy, H.O., Johnston, J.A., Walker, B., and Scott,
23.
Dean, R.A., and Overall, C.M. (2007) Proteomics disco
C.J. (2013) Cathepsin S from both tumor and tumor asso
very of metalloproteinase substrates in the cellular context
ciated cells promote cancer growth and neovascularization,
by iTRAQTM labeling reveals a diverse MMP 2 substrate
Int. J. Cancer, 133, 2102-2112, doi: 10.1002/ijc.28238.
degradome, Mol. Cell. Proteomics, 6, 611-623, doi:
36.
Abboud Jarrous, G., Atzmon, R., Peretz, T., Palermo, C.,
10.1074/mcp.M600341 MCP200.
Gadea, B.B., Joyce, J.A., and Vlodavsky, I.
(2008)
24.
Laurent Matha, V., Huesgen, P.F., Masson, O., Derocq,
Cathepsin L is responsible for processing and activation of
D., Prebois, C., Gary Bobo, M., Lecaille, F., Rebiere, B.,
proheparanase through multiple cleavages of a linker seg
Meurice, G., Orear, C., Hollingsworth, R.E.,
ment, J. Biol. Chem., 283, 18167-18176, doi: 10.1074/jbc.
Abrahamson, M., Lalmanach, G., Overall, C.M., and
M801327200.
Liaudet Coopman, E. (2012) Proteolysis of cystatin C by
37.
Kostoulas, G., Lang, A., Nagase, H., and Baici, A. (1999)
cathepsin D in the breast cancer microenvironment,
Stimulation of angiogenesis through cathepsin B inactiva
FASEB J., 26, 5172-5181, doi: 10.1096/fj.12 205229.
tion of the tissue inhibitors of matrix metalloproteinases,
25.
Gocheva, V., Zeng, W., Ke, D., Klimstra, D., Reinheckel,
FEBS Lett., 455, 286-290, doi: S0014 5793(99)00897 2.
T., Peters, C., Hanahan, D., and Joyce, J.A.
(2006)
38.
Wang, B., Sun, J., Kitamoto, S., Yang, M., Grubb, A.,
Distinct roles for cysteine cathepsin genes in multistage
Chapman, H.A., Kalluri, R., and Shi, G.P.
(2006)
tumorigenesis, Genes Dev., 20, 543-556, doi: 10.1101/gad.
Cathepsin S controls angiogenesis and tumor growth via
1407406.
matrix derived angiogenic factors, J. Biol. Chem., 281,
26.
Guinec, N., Dalet Fumeron, V., and Pagano, M. (1993)
6020-6029, doi: 10.1074/jbc.M509134200.
«In vitro» study of basement membrane degradation by the
39.
Veillard, F., Saidi, A., Burden, R.E., Scott, C.J., Gillet, L.,
cysteine proteinases, cathepsins B, B like and L, Biol.
Lecaille, F., and Lalmanach, G. (2011) Cysteine cathep
Chem., 374, 1135-1146, doi: 10.1515/bchm3.1993.374.7
sins S and L modulate anti angiogenic activities of human
12.1135.
endostatin, J. Biol. Chem., 286, 37158-37167, doi:
27.
Giusti, I., D’Ascenzo, S., Millimaggi, D., Taraboletti, G.,
10.1074/jbc.M111.284869.
Carta, G., Franceschini, N., Pavan, A., and Dolo, V.
40.
Ryschich, E., Lizdenis, P., Ittrich, C., Benner, A., Stahl,
(2008) Cathepsin B mediates the pH dependent proinva
S., Hamann, A., Schmidt, J., Knolle, P., Arnold, B.,
sive activity of tumor shed microvesicles, Neoplasia, 10,
Hammerling, G.J., and Ganss, R. (2006) Molecular fin
481-488, doi: 10.1593/neo.08178.
gerprinting and autocrine growth regulation of endothelial
28.
Chang, S., Kanasaki, K., Gocheva, V., Blum, G., Harper,
cells in a murine model of hepatocellular carcinoma,
J., Moses, A., Shih, S., Nagy, J.A., Joyce, J., Bogyo, M.,
Cancer Res., 66, 198-211, doi: 10.1158/0008 5472.CAN
and Dvorak, H.F. (2009) VEGF A induces angiogenesis by
05 1636.
perturbing the cathepsin cysteine protease inhibitor ba
41.
Shree, T., Olson, O.C., Elie, B.T., Kester, J.C., Garfall,
lance in venules, causing basement membrane degradation
A.L., Simpson, K., Bell Mcguinn, K.M., Zabor, E.C.,
and mother vessel formation, Cancer Res., 69, 4537-4544,
Brogi, E., and Joyce, J.A. (2011) Macrophages and cathep
doi: 10.1158/0008 5472.CAN 08 4539.VEGF A.
sin proteases blunt chemotherapeutic response in breast
29.
Jevnikar, Z., Rojnik, M., Jamnik, P., Doljak, B., Fonovic,
cancer, Genes Dev.,
25,
2465-2479, doi:
10.1101/
U.P., and Kos, J. (2013) Cathepsin H mediates the pro
gad.180331.111.
cessing of talin and regulates migration of prostate cancer
42.
Bruchard, M., Mignot, G., Derangere, V., Chalmin, F.,
cells, J. Biol. Chem., 288, 2201-2209, doi: 10.1074/
Chevriaux, A., Vegran, F., Boireau, W., Simon, B., Ryffel,
jbc.M112.436394.
B., Connat, J.L., Kanellopoulos, J., Martin, F., Rebe, C.,
30.
Quintanilla Dieck, M.J., Codriansky, K., Keady, M.,
Apetoh, L., and Ghiringhelli, F. (2013) Chemotherapy
Bhawan, J., and Runger, T.M. (2008) Cathepsin K in
triggered cathepsin B release in myeloid derived suppressor
melanoma invasion, J. Invest. Dermatol., 128, 2281-2288,
cells activates the Nlrp3 inflammasome and promotes
doi: 10.1038/jid.2008.63.
tumor growth, Nat. Med., 19, 57-64, doi: 10.1038/
31.
Sevenich, L., Bowman, R.L., Mason, S.D., Quail, D.F.,
nm.2999.
Elie, B.T., Brogi, E., Brastianos, P.K., Hahn, W.C.,
43.
Mori, T., Miyamoto, T., Yoshida, H., Asakawa, M.,
Holsinger, L.J., Massague, J., Leslie, C.S., and Joyce, J.A.
Kawasumi, M., Kobayashi, T., Morioka, H., Chiba, K.,
(2014) Analysis of tumor and stroma supplied proteolytic
Toyama, Y., and Yoshimura, A. (2011) IL 1β and TNFα
networks reveals a brain metastasis promoting role for
initiated IL 6 STAT3 pathway is critical in mediating
cathepsin S, Nat. Cell Biol., 16, 876-888, doi: 10.1038/
inflammatory cytokines and RANKL expression in inflam
ncb3011.Analysis.
matory arthritis, Int. Immunol., 23, 701-712, doi: 10.1093/
32.
Pecar Fonovic, U., Jevnikar, Z., Rojnik, M., Doljak, B.,
intimm/dxr077.
Fonovic, M., Jamnik, P., and Kos, J. (2013) Profilin 1 as a
44.
Castino, R., Pace, D., Demoz, M., Gargiulo, M., Ariatta,
target for cathepsin X activity in tumor cells, PLoS One, 8,
C., Raiteri, E., and Isidoro, C. (2002) Lysosomal proteases
e53918, doi: 10.1371/journal.pone.0053918.
as potential targets for the induction of apoptotic cell death
БИОХИМИЯ том 84 вып. 7 2019
ЦИСТЕИНОВЫЕ КАТЕПСИНЫ В ДИАГНОСТИКЕ И ТЕРАПИИ РАКА
969
in human neuroblastomas, Int. J. Cancer, 97, 775-779,
The cathepsin K inhibitor odanacatib suppresses bone
doi: 10.1002/ijc.10139.
resorption in women with breast cancer and established
45.
Storm van’s Gravesande, K., Layne, M.D., Ye, Q., Le, L.,
bone metastases: results of a 4 week, double blind, ran
Baron, R.M., Perrella, M.A., Santambrogio, L.,
domized, controlled trial, Clin. Breast Cancer,
10,
Silverman, E.S., and Riese, R.J. (2002) IFN regulatory
452-458, doi: 10.3816/CBC.2010.n.059.
factor 1 regulates IFN γ dependent cathepsin S expres
59.
Duong, L.T., Wesolowski, G.A., Leung, P., Oballa, R., and
sion, J. Immunol., 168, 4488-4494, doi: 10.4049/jim
Pickarski, M. (2014) Efficacy of a cathepsin K inhibitor in
munol.168.9.4488.
a preclinical model for prevention and treatment of breast
46.
Matsumoto, K., Mizoue, K., Kitamura, K., Tse, W.C.,
cancer bone metastasis, Mol. Cancer Ther., 13, 2898-2909,
Huber, C.P., and Ishida, T. (1999) Structural basis of inhi
doi: 10.1158/1535 7163.MCT 14 0253.
bition of cysteine proteases by E 64 and its derivatives,
60.
Panwar, P., Xue, L., Soe, K., Srivastava, K., Law, S.,
Biopolymers,
51,
99-107, doi:
10.1002/(SICI)1097
Delaisse, J. M., and Bromme, D. (2017) An ectosteric
0282(1999)51:1<99::AID BIP11>3.0.CO;2 R.
inhibitor of cathepsin K inhibits bone resorption in
47.
Bell McGuinn, K.M., Garfall, A.L., Bogyo, M.,
ovariectomized mice, J. Bone Miner. Res., 32, 2415-2430,
Hanahan, D., and Joyce, J.A. (2007) Inhibition of cysteine
doi: 10.1002/jbmr.3227.
cathepsin protease activity enhances chemotherapy regi
61.
Katunuma, N., Tsuge, H., Nukatsuka, M., Asao, T., and
mens by decreasing tumor growth and invasiveness in a
Fukushima, M. (2002) Structure based design of specific
mouse model of multistage cancer, Cancer Res., 67,
cathepsin inhibitors and their application to protection of
7378-7385, doi: 10.1158/0008 5472.CAN 07 0602.
bone metastases of cancer cells, Arch. Biochem. Biophys.,
48.
Zhu, D.M., and Uckun, F.M. (2000) Z Phe Gly NHO
397, 305-311, doi: 10.1006/abbi.2001.2709.
Bz, an inhibitor of cysteine cathepsins, induces apoptosis
62.
Zajc, I., Hreljac, I., and Lah, T. (2006) Cathepsin L affects
in human cancer cells, Clin. Cancer Res., 6, 2064-2069.
apoptosis of glioblastoma cells: a potential implication in
49.
Mihalik, R., Imre, G., Petak, I., Szende, B., and Kopper,
the design of cancer therapeutics, Anticancer Res., 26,
L. (2004) Cathepsin B independent abrogation of cell
3357-3364.
death by CA 074 OMe upstream of lysosomal breakdown,
63.
Nagaraj, N.S., and Zacharias, W. (2007) Cigarette smoke
Cell Death Differ., 11, 1357-1360, doi: 10.1038/sj.cdd.
condensate increases cathepsin mediated invasiveness of
4401493.
oral carcinoma cells, Toxicol. Lett., 170, 134-145, doi:
50.
Zeng, G. Z., Pan, X. L., Tan, N. H., Xiong, J., and
10.1016/j.toxlet.2007.02.014.
Zhang, Y. M. (2006) Natural biflavones as novel inhibitors
64.
Zheng, X., Chu, F., Chou, P.M., Gallati, C., Dier, U.,
of cathepsin B and K, Eur. J. Med. Chem., 41, 1247-1252,
Mirkin, B.L., Mousa, S.A., and Rebbaa, A.
(2009)
doi: 10.1016/j.ejmech.2006.06.002.
Cathepsin L inhibition suppresses drug resistance in vitro
51.
Schenker, P., Alfarano, P., Kolb, P., Caflisch, A., and Baici,
and in vivo: a putative mechanism, Am. J. Physiol. Physiol.,
A. (2008) A double headed cathepsin B inhibitor devoid of
296, C65-C74, doi: 10.1152/ajpcell.00082.2008.
warhead, Protein Sci., 17, 2145-2155, doi: 10.1110/ps.
65.
Sudhan, D.R., and Siemann, D.W. (2013) Cathepsin L
037341.108.
inhibition by the small molecule KGP94 suppresses tumor
52.
Sosic, I., Mirkovic, B., Turk, S., Stefane, B., Kos, J., and
microenvironment enhanced metastasis associated cell
Gobec, S. (2011) Discovery and kinetic evaluation of
functions of prostate and breast cancer cells, Clin. Exp.
6 substituted 4 benzylthio 1,3,5 triazin 2(1H) ones as
Metastasis, 30, 891-902, doi: 10.1007/s10585 013 9590 9.
inhibitors of cathepsin B, Eur. J. Med. Chem., 46,
66.
Sudhan, D.R., Pampo, C., Rice, L., and Siemann, D.W.
4648-4656, doi: 10.1016/j.ejmech.2011.08.005.
(2016) Cathepsin L inactivation leads to multimodal inhi
53.
Mirkovic, B., Renko, M., Turk, S., Sosic, I., Jevnikar, Z.,
bition of prostate cancer cell dissemination in a preclinical
Obermajer, N., Turk, D., Gobec, S., and Kos, J. (2011)
bone metastasis model, Int. J. Cancer, 138, 2665-2677,
Novel mechanism of cathepsin B inhibition by antibiotic
doi: 10.1002/ijc.29992.
nitroxoline and related compounds, ChemMedChem, 6,
67.
Zhang, L., Wang, H., Xu, J., Zhu, J., and Ding, K. (2014)
1351-1356, doi: 10.1002/cmdc.201100098.
Inhibition of cathepsin S induces autophagy and apoptosis
54.
Jiang, H., Taggart, J.E., Zhang, X., Benbrook, D.M.,
in human glioblastoma cell lines through ROS mediated
Lind, S.E., and Ding, W. Q. (2011) Nitroxoline
(8
PI3K/AKT/mTOR/p70S6K and JNK signaling pathways,
hydroxy 5 nitroquinoline) is more a potent anti cancer
Toxicol. Lett., 228, 248-259, doi: 10.1016/j.toxlet.2014.
agent than clioquinol (5 chloro 7 iodo 8 quinoline),
05.015.
Cancer Lett., 312, 11-17, doi: 10.1016/j.canlet.2011.
68.
Chen, J. C., Uang, B. J., Lyu, P. C., Chang, J. Y., Liu,
06.032.
K. J., Kuo, C. C., Hsieh, H. P., Wang, H. C., Cheng, C. S.,
55.
Shim, J.S., Matsui, Y., Bhat, S., Nacev, B.A., Xu, J.,
Chang, Y. H., Chang, M.D. T., Chang, W. S.W., and Lin,
Bhang, H.C., Dhara, S., Han, K.C., Chong, C.R.,
C. C. (2010) Design and synthesis of α ketoamides as
Pomper, M.G., So, A., and Liu, J.O. (2010) Effect of
cathepsin S inhibitors with potential applications against
nitroxoline on angiogenesis and growth of human bladder
tumor invasion and angiogenesis, J. Med. Chem., 53,
cancer, J. Natl. Cancer Inst., 102, 1855-1873, doi:
4545-4549, doi: 10.1021/jm100089e.
10.1093/jnci/djq457.
69.
Wilkinson, R.D.A., Young, A., Burden, R.E., Williams, R.,
56.
Sosic, I., Mirkovic, B., Arenz, K., Stefane, B., Kos, J., and
and Scott, C.J. (2016) A bioavailable cathepsin S nitrile
Gobec, S. (2013) Development of new cathepsin B
inhibitor abrogates tumor development, Mol. Cancer, 15,
inhibitors: combining bioisosteric replacements and struc
29, doi: 10.1186/s12943 016 0513 7.
ture based design to explore the structure-activity rela
70.
Fonovic, U.P., Mitrovic, A., Knez, D., Jakos, T., Pislar, A.,
tionships of nitroxoline derivatives, J. Med. Chem., 56,
Brus, B., Doljak, B., Stojan, J., Zakelj, S., Trontelj, J., Gobec,
521-533, doi: 10.1021/jm301544x.
S., and Kos, J. (2017) Identification and characterization of
57.
Mitrovic, A., Kljun, J., Sosic, I., Gobec, S., Turel, I., and
the novel reversible and selective cathepsin X inhibitors, Sci.
Kos, J. (2016) Clioquinol-ruthenium complex impairs
Rep., 7, 11459, doi: 10.1038/s41598 017 11935 1.
tumour cell invasion by inhibiting cathepsin B activity, Dalt.
71.
Burden, R.E., Gormley, J.A., Jaquin, T.J., Small, D.M.,
Trans., 45, 16913-16921, doi: 10.1039/C6DT02369J.
Quinn, D.J., Hegarty, S.M., Ward, C., Walker, B.,
58.
Jensen, A.B., Wynne, C., Ramirez, G., He, W., Song, Y.,
Johnston, J.A., Olwill, S.A., and Scott, C.J.
(2009)
Berd, Y., Wang, H., Mehta, A., and Lombardi, A. (2010)
Antibody mediated inhibition of cathepsin S blocks colo
6 БИОХИМИЯ том 84 вып. 7 2019
970
ПЕТУШКОВА и др.
rectal tumor invasion and angiogenesis, Clin. Cancer Res.,
nanoparticles, Chemistry, 20, 15309-15314, doi: 10.1002/
15, 6042-6051, doi: 10.1158/1078 0432.CCR 09 1262.
chem.201404382.
72.
Kwok, H.F., Buick, R.J., Kuehn, D., Gormley, J.A.,
85.
Tarassoli, S.P., de Pinillos Bayona, A.M., Pye, H., Mosse,
Doherty, D., Jaquin, T.J., McClurg, A., Ward, C., Byrne, T.,
C.A., Callan, J.F., MacRobert, A., McHale, A.P., and
Jaworski, J., Leung, K.L., Snoddy, P., McAnally, C.,
Nomikou, N. (2017) Cathepsin B degradable, NIR
Burden, R.E., Gray, B., Lowry, J., Sermadiras, I., Gruszka,
responsive nanoparticulate platform for target specific
N., Courtenay Luck, N., Kissenpfennig, A., Scott, C.J.,
cancer therapy, Nanotechnology, 28, 055101, doi: 10.1088/
Johnston, J.A., and Olwill, S.A. (2011) Antibody targeting of
1361 6528/28/5/055101.
cathepsin S induces antibody dependent cellular cytotoxic
86.
Kos, J., Obermajer, N., Doljak, B., Kocbek, P., and Kristl,
ity, Mol. Cancer, 10, 147, doi: 10.1186/1476 4598 10 147.
J. (2009) Inactivation of harmful tumour associated proteo
73.
Premzl, A., Zavaљnik Bergant, V., Turk, V., and Kos, J.
lysis by nanoparticulate system, Int. J. Pharm., 381,
(2003) Intracellular and extracellular cathepsin B facilitate
106-112, doi: 10.1016/j.ijpharm.2009.04.037.
invasion of MCF 10A neo T cells through reconstituted
87.
Whitley, M.J., Cardona, D.M., Lazarides, A.L.,
extracellular matrix in vitro, Exp. Cell Res., 283, 206-214,
Spasojevic, I., Ferrer, J.M., Cahill, J., Lee, C. L., Snuderl,
doi: 10.1016/S0014 4827(02)00055 1.
M., Blazer, D.G., Hwang, E.S., Greenup, R.A., Mosca,
74.
Mirkovic, B., Premzl, A., Hodnik, V., Doljak, B., Jevnikar,
P.J., Mito, J.K., Cuneo, K.C., Larrier, N.A., O’Reilly,
Z., Anderluh, G., and Kos, J. (2009) Regulation of cathep
E.K., Riedel, R.F., Eward, W.C., Strasfeld, D.B.,
sin B activity by 2A2 monoclonal antibody, FEBS J., 276,
Fukumura, D., Jain, R.K., Lee, W.D., Griffith, L.G.,
4739-4751, doi: 10.1111/j.1742 4658.2009.07171.x.
Bawendi, M.G., Kirsch, D.G., and Brigman, B.E. (2016)
75.
Ueki, N., Lee, S., Sampson, N.S., and Hayman, M.J.
A mouse human phase 1 co clinical trial of a protease
(2013) Selective cancer targeting with prodrugs activated
activated fluorescent probe for imaging cancer, Sci. Transl.
by histone deacetylases and a tumour associated protease,
Med., 8, 320ra4, doi: 10.1126/scitranslmed.aad0293.
Nat. Commun., 4, 2735, doi: 10.1038/ncomms3735.
88.
Withana, N.P., Ma, X., McGuire, H.M., Verdoes, M., van
76.
Xu, Y., Geng, J., An, P., Xu, Y., Huang, J., Lu, W., Liu, S.,
der Linden, W.A., Ofori, L.O., Zhang, R., Li, H., Sanman,
and Yu, J. (2015) Cathepsin B sensitive cholesteryl
L.E., Wei, K., Yao, S., Wu, P., Li, F., Huang, H., Xu, Z.,
hemisuccinate-gemcitabine prodrug nanoparticles:
Wolters, P.J., Rosen, G.D., Collard, H.R., Zhu, Z.,
enhanced cellular uptake and intracellular drug controlled
Cheng, Z., and Bogyo, M. (2016) Non invasive imaging of
release, RSC Adv.,
5,
6985-6992, doi:
10.1039/
idiopathic pulmonary fibrosis using cathepsin protease
C4RA13870H.
probes, Sci. Rep., 6, 19755, doi: 10.1038/srep19755.
77.
Tsume, Y., and Amidon, G.L. (2012) The feasibility of
89.
Poreba, M., Rut, W., Vizovisek, M., Groborz, K.,
enzyme targeted activation for amino acid/dipeptide
Kasperkiewicz, P., Finlay, D., Vuori, K., Turk, D., Turk,
monoester prodrugs of floxuridine; cathepsin D as a poten
B., Salvesen, G., and Drag, M. (2018) Selective imaging of
tial targeted enzyme, Molecules, 17, 3672-3689, doi:
cathepsin L in breast cancer by fluorescent activity based
10.3390/molecules17043672.
probes, Chem. Sci.,
9,
2113-2129, doi:
10.1039/
78.
Chen, Z., Zhang, P., Cheetham, A.G., Moon, J.H.,
c7sc04303a.
Moxley, J.W., Lin, Y., and Cui, H. (2014) Controlled
90.
Kramer, L., Renko, M., Zavrsnik, J., Turk, D., Seeger, M.,
release of free doxorubicin from peptide-drug conjugates
Vasiljeva, O., Grutter, M., Turk, V., and Turk, B. (2017)
by drug loading, J. Control. Release, 191, 123-130, doi:
Non invasive in vivo imaging of tumour associated
10.1016/j.jconrel.2014.05.051.
cathepsin B by a highly selective inhibitory DARPin,
79.
Li, N., Li, N., Yi, Q., Luo, K., Guo, C., Pan, D., and Gu,
Theranostics, 7, 2806-2821, doi: 10.7150/thno.19081.
Z. (2014) Amphiphilic peptide dendritic copolymer doxo
91.
Chen, X., Lee, D., Yu, S., Kim, G., Lee, S., Cho, Y.,
rubicin nanoscale conjugate self assembled to enzyme
Jeong, H., Nam, K.T., and Yoon, J. (2017) In vivo near
responsive anti cancer agent, Biomaterials, 35, 9529-
infrared imaging and phototherapy of tumors using a
9545, doi: 10.1016/j.biomaterials.2014.07.059.
cathepsin B activated fluorescent probe, Biomaterials, 122,
80.
Chipman, S.D., Oldham, F.B., Pezzoni, G., and Singer,
130-140, doi: 10.1016/j.biomaterials.2017.01.020.
J.W. (2006) Biological and clinical characterization of
92.
Liu, J., Zhang, L., Lei, J., Shen, H., and Ju, H. (2016)
paclitaxel poliglumex (PPX, CT 2103), a macromolecular
Multifunctional metal organic framework nanoprobe for
polymer drug conjugate, Int. J. Nanomedicine,
1,
cathepsin B activated cancer cell imaging and chemo pho
375-383, 10.2147/nano.2006.1.4.375.
todynamic therapy multifunctional cathepsin metal - orga
81.
Kern, J.C., Dooney, D., Zhang, R., Liang, L., Brandish,
nic framework cell nanoprobe imaging for and B activated
P.E., Cheng, M., Feng, G., Beck, A., Bresson, D., Firdos,
cancer chemo photodynamic therapy, ACS Appl. Mater.
J., Gately, D., Knudsen, N., Manibusan, A., Sun, Y., and
Interfaces, 9, 2150-2158, doi: 10.1021/acsami.6b14446.
Garbaccio, R.M. (2016) Novel phosphate modified
93.
Yin, P., Jia, J., Li, J., Song, Y., Zhang, Y., and Chen, F.
cathepsin B linkers: improving aqueous solubility and
(2016) ABT 737, a Bcl 2 selective inhibitor, and chloro
enhancing payload scope of ADCs, Bioconjug. Chem., 27,
quine synergistically kill renal cancer cells, Oncol. Res., 24,
2081-2088, doi: 10.1021/acs.bioconjchem.6b00337.
65-72, doi: 10.3727/096504016X14587366983838.
82.
Scott, L.J. (2017) Brentuximab vedotin: a review in CD30
94.
Leto, G., Pizzolanti, G., Tumminello, F.M., and Gebbia,
positive Hodgkin lymphoma, Drugs, 77, 435-445, doi:
N. (1994) Effects of E 64 (cysteine proteinase inhibitor)
10.1007/s40265 017 0705 5.
and pepstatin (aspartyl proteinase inhibitor) on metastasis
83.
Gebleux, R., Stringhini, M., Casanova, R., Soltermann,
formation in mice with mammary and ovarian tumors, In
A., and Neri, D. (2017) Non internalizing antibody drug
Vivo, 8, 231-236.
conjugates display potent anti cancer activity upon prote
95.
Navab, R., Mort, J., and Brodt, P. (1997) Inhibition of car
olytic release of monomethyl auristatin E in the suben
cinoma cell invasion and liver metastases formation by the
dothelial extracellular matrix, Int. J. Cancer,
140,
cysteine proteinase inhibitor E 64, Clin. Exp. Metastasis,
1670-1679, doi: 10.1002/ijc.30569.
15, 121-129, doi: 10.1023/A:1018496625936.
84.
de la Torre, C., Mondragon, L., Coll, C., Sancenon, F.,
96.
Wilder, C.L., Walton, C., Watson, V., Stewart, F.A.A.,
Marcos, M.D., Martinez Manez, R., Amoros, P., Perez
Johnson, J., Peyton, S.R., Payne, C.K., Odero Marah, V.,
Paya, E., and Orzaez, M. (2014) Cathepsin B induced
and Platt, M.O. (2016) Differential cathepsin responses to
controlled release from peptide capped mesoporous silica
inhibitor induced feedback: E 64 and cystatin C elevate
БИОХИМИЯ том 84 вып. 7 2019
ЦИСТЕИНОВЫЕ КАТЕПСИНЫ В ДИАГНОСТИКЕ И ТЕРАПИИ РАКА
971
active cathepsin S and suppress active cathepsin L in breast
(2009) Voltage gated sodium channel activity promotes
cancer cells, Int. J. Biochem. Cell Biol., 79, 199-208, doi:
cysteine cathepsin dependent invasiveness and colony
10.1016/j.biocel.2016.08.030.
growth of human cancer cells, J. Biol. Chem., 284,
97. Schurigt, U., Sevenich, L., Vannier, C., Gajda, M.,
8680-8691, doi: 10.1074/jbc.M806891200.
Schwinde, A., Werner, F., Stahl, A., von Elverfeldt, D.,
101. Klose, A., Zigrino, P., Dennhofer, R., Mauch, C., and
Becker, A. K., Bogyo, M., Peters, C., and Reinheckel, T.
Hunzelmann, N. (2006) Identification and discrimination
(2008) Trial of the cysteine cathepsin inhibitor JPM OEt
of extracellularly active cathepsins B and L in high invasive
on early and advanced mammary cancer stages in the
melanoma cells, Anal. Biochem.,
353,
57-62, doi:
MMTV PyMT transgenic mouse model, Biol. Chem., 389,
10.1016/j.ab.2006.01.037.
1067-1074, doi: 10.1515/BC.2008.115.
102. Mitrovic, A., Sosic, I., Kos, S., Tratar, U.L., Breznik, B.,
98. Zhu, D. M., and Uckun, F.M. (2000) Cathepsin inhibition
Kranjc, S., Mirkovic, B., Gobec, S., Lah, T., Sersa, G.,
induces apoptotic death in human leukemia and lym
and Kos, J. (2017) Addition of 2 (ethylamino)acetonitrile
phoma cells, Leuk. Lymphoma, 39, 343-354, doi: 10.3109/
group to nitroxoline results in significantly improved anti
10428190009065834.
tumor activity in vitro and in vivo, Oncotarget,
8,
99. Withana, N.P., Blum, G., Sameni, M., Slaney, C.,
59136-59147, doi: 10.18632/oncotarget.19296.
Anbalagan, A., Olive, M.B., Bidwell, B.N., Edgington, L.,
103. Chavarria, G.E., Horsman, M.R., Arispe, W.M., Kumar,
Wang, L., Moin, K., Sloane, B.F., Anderson, R.L., Bogyo,
G.D.K., Chen, S. E., Strecker, T.E., Parker, E.N.,
M.S., and Parker, B.S. (2012) Cathepsin B inhibition
Chaplin, D.J., Pinney, K.G., and Trawick, M.L. (2012)
limits bone metastasis in breast cancer, Cancer Res., 72,
Initial evaluation of the antitumour activity of KGP94, a
1199-1209, doi: 10.1158/0008 5472.CAN 11 2759.
functionalized benzophenone thiosemicarbazone inhibitor
100. Gillet, L., Roger, S., Besson, P., Lecaille, F., Gore, J.,
of cathepsin L, Eur. J. Med. Chem., 58, 568-572, doi:
Bougnoux, P., Lalmanach, G., and Le Guennec, J. Y.
10.1016/j.ejmech.2012.10.039.
CYSTEINE CATHEPSINS: PROSPECTS FOR THEIR USE IN DIAGNOSTICS
AND THERAPY OF MALIGNANT TUMORS
A. I. Petushkova1, L. V. Savvateeva1, D. O. Korolev2, and A. A. Zamyatnin, Jr.1,3*
1 Sechenov First Moscow State Medical University, Institute of Molecular Medicine,
119991 Moscow, Russia; E)mail: zamyat@belozersky.msu.ru
2 Sechenov First Moscow State Medical University, Institute of Uronephrology
and Human Reproductive Health, 119991 Moscow, Russia
3 Belozersky Institute of Physico)Chemical Biology, Lomonosov Moscow State University, 119992 Moscow, Russia
Received March 28, 2019
Revised April 18, 2019
Accepted April 19, 2019
Cysteine cathepsins represent proteolytic enzymes executing protein degradation in lysosomes and endosomes.
Cysteine cathepsins are also detected in tumor microenvironment during carcinogenesis. These enzymes are impli
cated in proliferation, invasion and metastasis through the degradation of extracellular matrix and of intercellular
interactions, thus promoting angiogenesis. Therefore, the cathepsins have a diagnostic value and represent promising
targets for antitumor drugs inhibiting these enzymes. Moreover, cysteine cathepsins can be used as activators in tar
geted therapy assays. This review summarizes the recent data on the role of cysteine cathepsins in carcinogenesis and
the recent trends in cancer therapy and diagnostics utilizing cysteine cathepsins as markers, targets or activators.
Keywords: cysteine cathepsins, carcinogenesis, antitumor therapy, targeted drug delivery, proteolysis, diagnostics
БИОХИМИЯ том 84 вып. 7 2019
6*