БИОХИМИЯ, 2019, том 84, вып. 7, с. 1036 - 1048
УДК 577.29
ИМПОРТ ДНК В МИТОХОНДРИИ РАСТЕНИЙ:
КОМПЛЕКСНЫЙ ПОДХОД ДЛЯ ИЗУЧЕНИЯ in organello И in vivo*
© 2019
Т.А. Тарасенко#, В.И. Тарасенко#, М.В. Кулинченко**,
Е.С. Клименко, Ю.М. Константинов
Сибирский институт физиологии и биохимии растений СО РАН,
664033 Иркутск, Россия; электронная почта: mk100171@yahoo.com
Поступила в редакцию 06.03.2019
После доработки 02.04.2019
Принята к публикации 10.04.2019
Природная компетентность митохондрий к поглощению ДНК - феномен, известный на протяжении по#
следних 20 лет. Все исследования этого процесса до настоящего времени проводили исключительно на
уровне изолированных митохондрий, поскольку отсутствовала система, позволяющая изучать перенос
ДНК в эти органеллы в целых клетках. Нами проведена работа по усовершенствованию и стандартизации
существующих подходов к изучению импорта ДНК в митохондрии растений в системе in organello. Разрабо#
тан метод детекции импорта флуоресцентно меченых субстратов ДНК. С учетом выявленных особенностей
процесса импорта ДНК, предложен эффективный метод оценки его интенсивности с помощью количест#
венной ПЦР. Нами разработана и детально охарактеризована также система in vivo, позволяющая исследо#
вать процесс переноса молекул ДНК из цитоплазмы в митохондриальный матрикс в протопластах
Arabidopsis thaliana. Предлагаемый комплексный подход для изучения природной компетентности митохо#
ндрий растений к поглощению ДНК позволит установить, сохраняются ли in vivo закономерности митохо#
ндриального импорта ДНК, показанные in organello.
КЛЮЧЕВЫЕ СЛОВА: импорт ДНК, митохондрии растений, флуоресцентное мечение, трансформация
протопластов, Arabidopsis thaliana.
DOI: 10.1134/S032097251907011X
Как известно, большинство митохондриаль#
какая#либо гомология с имеющимися в базах
ных белков кодируются ядерными генами и
данных последовательностями [4].
после биосинтеза в цитоплазме импортируются
Известно, что для митохондриального гено#
в митохондрию. Тем не менее митохондрии име#
ма растений характерна удивительно высокая, в
ют собственную генетическую систему, которая
сравнении с другими геномами, частота собы#
обеспечивает органеллу набором белков, необ#
тий горизонтального и внутриклеточного пере#
ходимых для формирования структуры комп#
носов [5]. Более 5% нуклеотидных последова#
лексов окислительного фосфорилирования или
тельностей митохондриального генома имеют
их биогенеза. Компактно организованный ге#
хлоропластное, ядерное или вирусное проис#
ном митохондрий млекопитающих размером
хождение [4, 6]. Высока вероятность того, что на
16,5 т.п.н. кодирует 13 полипептидных компо#
структуру и динамику митохондриального гено#
нентов электрон#транспортной цепи, 22 тРНК и
ма растений значительное влияние может ока#
2 рРНК [1]. По сравнению с геномом млекопи#
зывать наличие у митохондрий природной ком#
тающих, мт#геном растений обладает огромным
петентности - способности поглощать ДНК из
размером, который может превышать 1500 т.п.н.
окружающей среды. Этот феномен был перво#
[2, 3]. При этом мтДНК растений содержит толь#
начально продемонстрирован для растений [7,
ко 60 генов, кодирующих 3 рРНК, 15-20 тРНК и
8], но в дальнейшем был описан также для мито#
30-35 известных белков. Тем не менее для более
хондрий млекопитающих [9] и дрожжей [10].
чем половины последовательностей мт#генома
Митохондрии также импортируют РНК, глав#
растений функции не известны, и отсутствует
ным образом тРНК. Установлено, что митохон#
дриальный порин (VDAC) является основным
* Первоначально английский вариант рукописи опубликован участником этого процесса, кроме того, показа#
но, что компоненты аппарата импорта белков
biokhimiya, в рубрике «Papers in Press», BM 19#066, 1.07.2019.
** Адресат для корреспонденции.
также вовлечены в процесс импорта РНК [11,
# Авторы внесли равный вклад в работу.
12].
1036
ИМПОРТ ДНК В МИТОХОНДРИИ РАСТЕНИЙ in organello И in vivo
1037
В отличие от импорта белков и тРНК, био#
осуществлялись на уровне изолированных ми#
логическая роль и молекулярный механизм им#
тохондрий. До настоящего момента остается не#
порта ДНК в митохондрии до сих пор остаются
ясным происходит ли импорт на уровне целых
недостаточно изученными. Накопленные дан#
клеток и сохраняются ли in vivo закономерности
ные свидетельствуют о том, что VDAC, как и в
этого процесса, продемонстрированные ранее in
случае импорта РНК, является основным кана#
organello. Разработка системы, позволяющей
лом импорта ДНК [7, 13, 10]. Недавние исследо#
изучать механизмы переноса молекул ДНК из
вания выявили другие белки, которые могут
цитоплазмы в митохондриальный матрикс в це#
быть вовлечены в этот процесс [14]. Одним из
лых клетках, помимо фундаментальной значи#
этих белков может быть предшественник
мости, может послужить отправной точкой для
β#субъединицы АТФ#синтазы, связанный с
осуществления трансформации мт#генома выс#
внешней мембраной, где он может взаимодей#
ших растений, чрезвычайно важной и, на насто#
ствовать с VDAC в процессе связывания ДНК.
ящий момент, нерешенной задачи.
Кроме того было показано, что CuBPp, субъеди#
Таким образом, очевидна необходимость оп#
ница комплекса I, действующая как рецептор в
тимизации и стандартизации условий и подхо#
межмембранном пространстве, играет роль в
дов в исследовании импорта ДНК in organello и,
импорте длинных фрагментов ДНК [14]. Пере#
что особенно важно, создания системы, позво#
нос ДНК через внутреннюю мембрану в мат#
ляющей изучать транспорт ДНК в митохондрии
рикс остается малоизученным и может происхо#
in vivo. В данной работе мы представляем комп#
дить в растениях и у млекопитающих с участием
лексный подход для изучения импорта ДНК в
различных механизмов: ингибиторы белка#пе#
митохондрии с использованием двух систем - in
реносчика внутренней мембраны адениннукле#
organello и in vivo.
отид#транслоказы блокируют импорт ДНК в
растениях, но не в митохондриях млекопитаю#
щих [9].
МЕТОДЫ ИССЛЕДОВАНИЯ
Ранее при изучении процесса импорта ДНК
в митохондрии использовали преимущественно
Растительный материал и условия выращива3
радиоактивно меченые субстраты ДНК [7]. Ана#
ния. Растения Arabidopsis thaliana (L.) Heynh.
лиз с помощью радиоавтографии позволяет ви#
экотип Columbia (Col(0) после стратификации в
зуализировать полноразмерные молекулы им#
течение 3 суток при 4 °C выращивали при 22 °C
портированной ДНК, оценить влияние тех или
в ростовой камере KBW#720 («Binder», Герма#
иных эффекторов на интенсивность переноса
ния), в горшках, наполненных смесью почво#
ДНК. Тем не менее, введение радиоактивной
грунта для комнатных растений/торфа/верми#
метки имеет ряд недостатков - радиоактивность
кулита (2 : 1 : 3) при освещенности 150 мкмоль ×
может быть опасна для здоровья, требует для ра#
м-2 × с-1 и длине светового дня 16 ч. Этиолиро#
боты с ней специальных, лицензируемых усло#
ванные проростки кукурузы Zea mays (сорт «Ку#
вий, время полураспада 32P составляет всего 14
банский 250 МВ») выращивали при 29 °С в тече#
суток.
ние 4 суток в темноте. В работе были использо#
Помимо радиоактивного метода при изуче#
ваны также клубни картофеля Solanum tuberosum
нии процесса импорта были получены доказа#
(сорт «Адретта») и корнеплоды репы Brassica
тельства попадания ДНК в митохондриальный
rapa (сорт «Внучка»). Семена кукурузы приобре#
матрикс с помощью методов транскрипции [7] и
тены в НПО «КОС#МАИС», Краснодар; карто#
гомологичной рекомбинации in organello [15].
фель выращен на территории СИФИБР СО
Импорт генетических конструкций с последую#
РАН, Иркутск; семена репы приобретены в тор#
щим анализом их транскрипции с помощью
говой сети.
ОТ#ПЦР или проведение гомологичной реком#
Получение субстратов импорта ДНК. Для
бинации in organello оптимальны для изучения
амплификации ДНК использовали Taq#полиме#
процессов, связанных с экспрессией экзоген#
разу («Thermo Scientific», США) в соответствии
ной ДНК и ее сохранением в составе мт#генома.
с рекомендациями изготовителя. Для получения
Однако эти методы не подходят для оценки ин#
флуоресцентного ДНК#субстрата использовали
тенсивности процесса импорта ДНК в митохон#
олигонуклеотиды, содержащие на 5’#конце флуо#
дрии. Таким образом, все подходы, использо#
ресцирующую группу Cy3 («Евроген», Россия),
ванные ранее для изучения импорта, имеют ряд
и позволяющие получить фрагменты ДНК раз#
недостатков.
мером 269 п.н., 852 п.н. и 2,7 т.п.н. (табл. 1). Ре#
Важно отметить, что все исследования им#
жим амплификации для фрагментов размером
порта ДНК в митохондрии животных и расте#
269 п.н. и 852 п.н.: 94 °С - 3 мин (1 цикл);
ний, проводившиеся до настоящего времени,
94 °С - 30 с, 58 °С - 45 с, 72 °С - 45 с, (30 цик#
БИОХИМИЯ том 84 вып. 7 2019
1038
ТАРАСЕНКО и др.
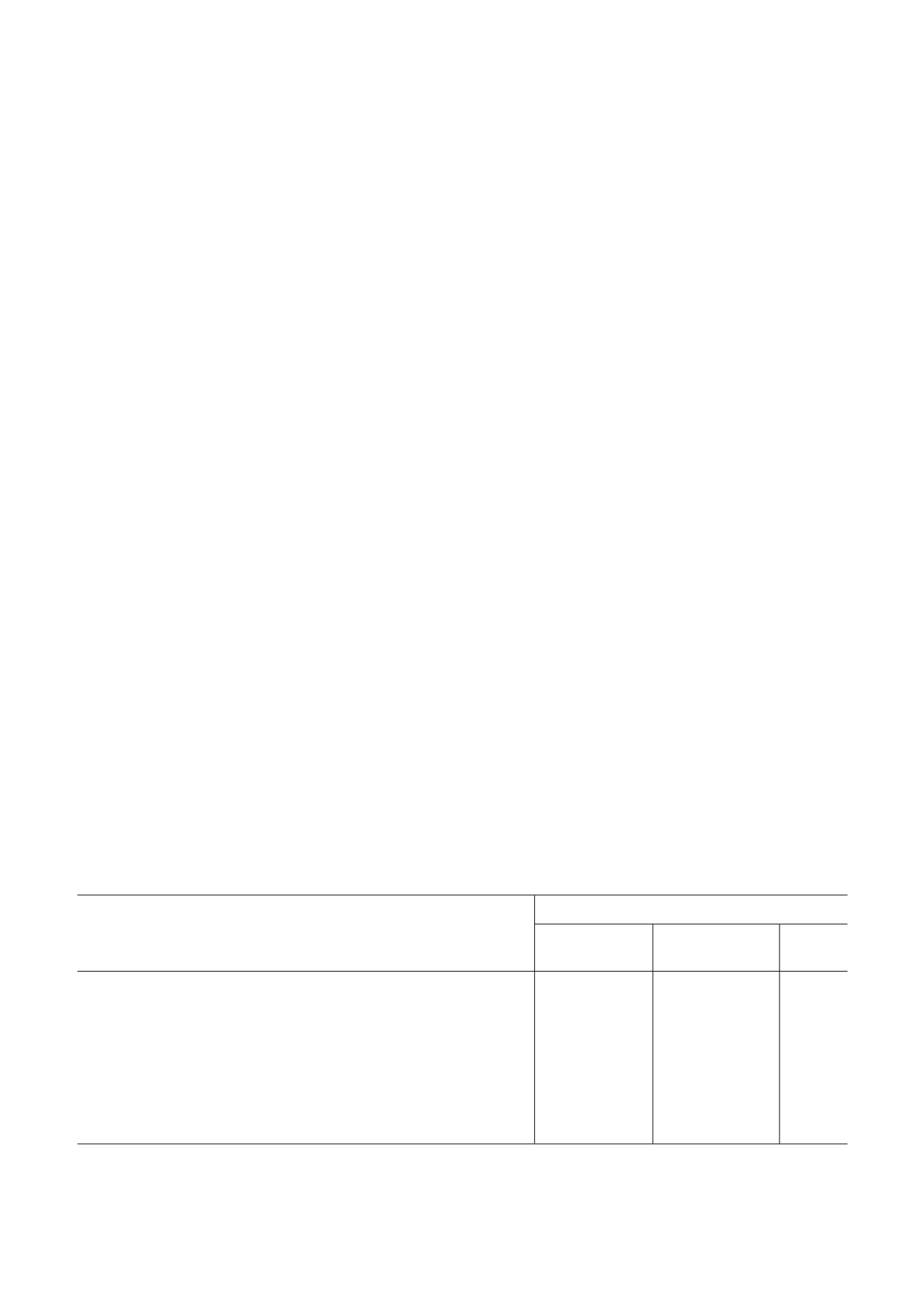
Таблица 1. Последовательности праймеров, использован#
затем осаждали и промывали в буфере, содержа#
ных для получения флуоресцентного ДНК#субстрата
щем 0,3 М сахарозу, 10 мМ фосфат калия, 1 мМ
ЭДТА, рН 7,2.
Название
5'-3' последовательность праймеров
Определение дыхательного контроля и интакт3
праймера
ности митохондрий. Анализ функциональной ак#
тивности изолированных митохондрий (100 мкг
269bp#F
Cy3#ATGAGTAAAGGAGAAGAACTTTTCACT
белка) проводили полярографическим методом
269bp#R
Cy3#CGGGGCATGGCACTCTTGA
с использованием платинового кислородного
852bp#F
Cy3#CTGTTCCTTGGCCACACT
электрода и ячейки Oxytherm system
852bp#R
Cy3#ACGCTCTGTAGGATTTGAACC
(«Hansatech», Великобритания). Коэффициент
2.7kb#F
Cy3#CCAACCACCACATACCGAAA
дыхательного контроля митохондрий определя#
ли согласно описанному ранее протоколу [21].
2.7kb#R
Cy3#ACGCTCTGTAGGATTTGAACC
Интактность внешней мембраны митохондрий
рассчитывали, как описано ранее [22].
Получение протопластов и их трансфекция
лов); 72 °С - 1 мин. Для фрагмента размером
ДНК. Протопласты получали из листьев
2,7 т.п.н. использовали следующий режим амп#
A. thaliana в возрасте 35 суток, согласно описан#
лификации: 94 °С - 3 мин (1 цикл); 94 °С - 30 с,
ному ранее протоколу [23] с модификациями.
60 °С - 45 с, 72 °С - 180 с (30 циклов); 72 °С -
Верхний слой эпидермиса удаляли с помощью
5 мин. ДНК очищали на колонках GeneJETTMPCR
липкой ленты. Куски липкой ленты с приклеив#
Purification Kit («Thermo Scientific», США) сог#
шимся нижним эпидермисом и клетками мезо#
ласно инструкции производителя. Качество
филла помещали на поверхность среды выделе#
ПЦР#продуктов оценивали электрофоретичес#
ния протопластов (0,4 M маннитол, 10 мМ
ки с использованием Gel Doc XR System («Bio#
CaCl2, 20 мМ KCl, 20 мМ MES, pH 5,7, 0,1% БСА),
Rad», США), количество ДНК определяли с по#
содержащей 1% целлюлазу и 0,25% пектолиазу
мощью спектрофотометра NanoPhotometer
(«MP Biomedicals», США) и инкубировали при
NP80 («IMPLEN», Германия). Генетическая
легком покачивании при 23 °С на свету в тече#
конструкция pCK/GFP/PRmt [7], содержащая
ние 2 ч. К отобранной суспензии протопластов
последовательность гена GFP, служила матри#
добавляли 15 мл среды промывания (СП), со#
цей для амплификации.
держащей 154 мМ NaCl, 125 мМ CaCl2, 5 мМ
Выделение митохондрий. Митохондрии полу#
KCl, 5 мМ глюкозу, 2 мМ MES, pH 5,7 и центри#
чали согласно описанным ранее протоколам из
фугировали в течение 3 мин при 100 g, исполь#
Arabidopsis thaliana [16], этиолированных пророст#
зуя Allegra 64R («Beckman Coulter», США), при
ков Zea mays [17], клубней Solanum tuberosum и
20 °С. Супернатант удаляли, осадок протоплас#
корнеплодов Brassica rapa [18]. Количество бел#
тов ресуспендировали в 15 мл среды СП и пов#
ка в суспензии митохондрий оценивали по ме#
торяли центрифугирование. Осадок ресуспен#
тоду Бредфорда [19]. Очищенную фракцию ми#
дировали в среде, содержащей 0,4 M маннитол,
тохондрий исследовали в трансмиссионном
15 мМ MgCl2, 4 мМ MES, pH 5,7 из расчета 300 мкл
электронном микроскопе Leo 906Е («Zeiss», Гер#
на один образец. К суспензии протопластов до#
мания). [20].
бавляли раствор ДНК#субстрата (5 мкг), после
Импорт ДНК в изолированные митохондрии.
чего к пробам добавляли 300 мкл раствора, со#
Импорт ДНК проводили в буфере импорта, со#
держащего 20% (w/v) PEG (MW 2000), 0,2 M
держащем 0,4 М сахарозы, 40 мМ фосфата ка#
маннитол, 100 мМ CaCl2, и инкубировали в те#
лия, рН 7,0, при температуре 25 °С и постоян#
чение 5 мин. Суспензию протопластов подвер#
ном покачивании (350 rpm) на термошейкере
гали трем циклам центрифугирования в 1,5 мл
для микропробирок и ПЦР планшетов TS#100
СП в течение 1 мин при 100 g и 20 °С. Прото#
(«BioSan», Латвия) в течение 30 мин [7], объем
пласты ресуспендировали в СП и инкубировали
реакции составлял 100-200 мкл. Обработку ми#
в 48#луночном планшете (200 мкл на лунку) при
тохондрий ДНКазой проводили в буфере им#
22 °С и слабом освещении в течение 20 ч.
порта (100 мкл) в присутствии ДНКазы I (500 мкг/
Выделение митохондрий из протопластов
мл) («Sigma», США) и 10 мM MgCl2 в течение 20
A. thaliana. Целостность протопластов оценива#
мин при 25 °С. Дальнейшую отмывку проводили
ли методом световой микроскопии. Суспензию
как описано ранее [7]. Для получения митоплас#
протопластов центрифугировали в течение 1 мин
тов внешнюю мембрану митохондрий разруша#
при 100 g и 20 °С. К осадку добавляли 400 мкл
ли с помощью осмотического шока: осадок ми#
среды выделения митохондрий (СВ) (0,4 М са#
тохондрий ресуспендировали в 1 мл 5 мM фос#
хароза, 50 мМ Tris#HCl, рН 7,5, 5 мМ MgCl2,
фата калия, pH 7,5, инкубировали на льду 5 мин,
0,2% БСА, 2 мМ DTT). Непосредственно перед
БИОХИМИЯ том 84 вып. 7 2019
ИМПОРТ ДНК В МИТОХОНДРИИ РАСТЕНИЙ in organello И in vivo
1039
использованием в CB добавляли ДНКазу I из
проводили на CFX96 («Bio#Rad», США) в следу#
расчета 1 ед.акт. фермента на 50 мкл СВ. Про#
ющем режиме: 50 °С - 2 мин, 95 °С - 3 мин,
топласты разрушали с помощью гомогенизатора
1 цикл; 95 °С - 20 с, 60 °С - 30 с, 72 °С - 30 с,
Поттера. К каждому образцу добавляли СВ до
40 циклов. Данные анализировали при помощи
объема 1 мл и подвергали двум циклам последо#
программного обеспечения CFX Manager («Bio#
вательных низко# и высокоскоростных центри#
Rad», США). Все процедуры проводили как ми#
фугирований: в течение 5 мин при 3000 g и 4 °С
нимум в трех независимых экспериментах.
и в течение 7 мин при 15 000 g и 4 °С, используя
Allegra 64R («Beckman Coulter», США). Осадок
митохондрий ресуспендировали в 100 мкл среды
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
обработки ДНКазой (0,4 М сахароза, 40 мМ
KH2PO4, рН 7,0), содержащей 0,2% БСА, 10 мМ
Импорт ДНК в растительные митохондрии в
MgCl2 и ДНКазу I из расчета 1 ед.акт. фермента
системе in organello. Нами был разработан аль#
на 50 мкл среды и инкубировали 20 мин при
тернативный способ анализа импорта ДНК в
25 °С. После инкубации митохондрии подверга#
изолированные митохондрии растений с ис#
ли двум циклам центрифугирования в среде
пользованием флуоресцентно меченой ДНК.
промывания, содержащей 0,2% БСА, 10 мМ
Мы предположили, что введение в молекулы
EDTA и 10 мМ EGTA в течение 7 мин при 15 000 g
ДНК нерадиоактивной флуоресцентной метки
и 4 °С.
позволит преодолеть недостатки радиоактивно#
Экстракция нуклеиновых кислот. Экстрак#
го мечения, сохраняя при этом основные преи#
цию ДНК из осадка митохондрий проводили с
мущества использования для импорта меченых
использованием буфера, содержащего 10 мM
субстратов ДНК - такие, как возможность тес#
Tris#HCl, 1 мM ЭДТА, 1% (w/v) SDS, pH 7,5, и
тирования после экстракции полноразмерных
равного объема фенола. Нуклеиновые кислоты,
импортированных молекул, высокая чувстви#
содержавшиеся после центрифугирования в
тельность и специфичность.
водной фазе, осаждали этанолом в присутствии
Флуоресцентную метку в состав субстрата
200 мМ NaCl. Элюцию ДНК из геля проводили
импорта вводили амплификацией молекул ДНК
с помощью набора GeneJET Gel Extraction Kit
с помощью праймеров, несущих на 5'#концах
(«Thermo Scientific», США). Для анализа эффек#
цианин 3 (Cy3) (рис. 1, а). Пользуясь данным
тивности импорта флуоресцентно меченого
подходом, мы получили флуоресцентно мече#
ДНК#субстрата пробы подвергали электрофоре#
ные субстраты ДНК (рис. 1, б) и оценили воз#
тическому разделению в 1 %#ном агарозном ге#
можность их использования в зависимости от
ле и сканировали при помощи Ettan™ DIGE
времени хранения. Пробы не теряли своей спо#
Imager («GE Healthcare», Швеция).
собности к флуоресценции в течение месяца:
Количественная ПЦР. кПЦР проводили с ис#
количество детектируемой ДНК (не менее
пользованием набора SYBR Select Master Mix
0,5 нг) оставалось на одном уровне (рис. 1, в).
(«Applied Biosystems», США) согласно инструк#
Мы провели анализ импорта флуоресцентно
ции производителя. Список использованных
меченых субстратов ДНК разной длины в мито#
праймеров приведен в табл. 2. Амплификацию
хондрии, выделенные из разных растительных
источников (Z. mays, B. rapa и A. thaliana) (рис. 2).
Оценка функциональной активности получен#
Таблица 2. Последовательности праймеров, использован#
ных митохондриальных препаратов показала,
ных для оценки количества импортированных ДНК#
что митохондрии всех тестированных растений
субстратов
обладали высокой степенью сопряжения окис#
Название
5'-3' последовательность праймеров
ления и фосфорилирования (величина дыха#
праймера
тельного контроля ~4 при окислении сукцина#
та), а их интактность составляла 85-90%. Со#
gfp#F
GATGTGGAAAACAAGACAGGGGTTT
гласно данным электронной микроскопии, по#
gfp#R
TGGTGAACCGGGCGTACTATTT
лученные фракции митохондрий характеризо#
nad4#F
GCATTTCAGTGGGTTGGTCTGGT
вались высокой степенью очистки (рис. 2, а и б).
Сканирование флуоресценции препаратов
nad4#R
AGGGATTGGCACGCTTTCGG
мтДНК, выделенной из всех трех тестирован#
rbcL#F
TGCCGTAGCCAACCGAGT
ных нами растений, позволило детектировать
rbcL#R
TCTTTCCATACTTCACAAGCAGCA
полноразмерные молекулы ДНК, импортиро#
yls8#F
GAGGTGCTTGCGTCTGTTGCT
ванные в митохондриальный матрикс (рис. 2, в).
Таким образом, очевидно, что флуоресцентно
yls8#R
TGTCCTTGAGAGCCCAGTTGAT
меченую ДНК можно использовать в исследова#
БИОХИМИЯ том 84 вып. 7 2019
1040
ТАРАСЕНКО и др.
а
б
в
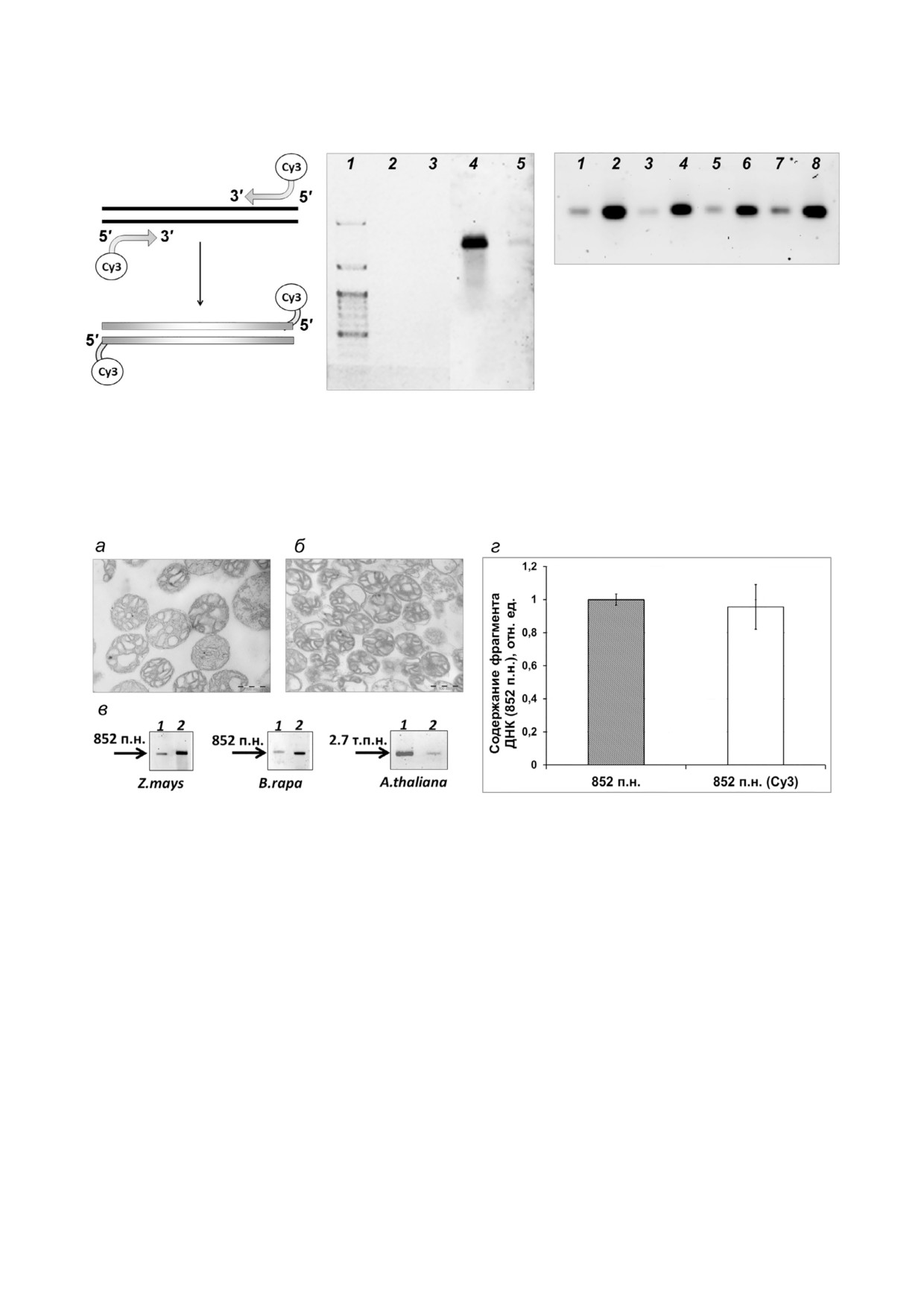
Рис. 1. Флуоресцентно меченые субстраты ДНК для импорта в митохондрии. а - Схема способа введения флуорофора Cy3
в молекулы ДНК; б и в - флуоресцентно меченые фрагменты ДНК 852 п.н. б - На гель нанесены 5 нг (2, 4) и 0,5 нг (3, 5)
ДНК; (1-3) - визуализация ДНК после окрашивания бромистым этидием, (1) - маркер молекулярного веса ДНК;
(4 и 5) - визуализация ДНК в сканере флуоресценции; в - визуализация флуоресцентно меченых проб ДНК; (1 и 2) - 4х#,
(3 и 4) - 3х#, (5 и 6) - 2х#, (7 и 8) - 1#недельные пробы; (1, 3, 5 и 7) - 1 нг, (2, 4, 6 и 8) - 5 нг нанесенной на гель ДНК
фрагмента 852 п.н
Рис. 2. Импорт меченой (Cy3) ДНК в растительные митохондрии. Митохондрии B. rapa (а) и Z. mays (б), изображения по#
лучены с помощью электронной микроскопии (масштаб 500 нм). в - Флуоресцентно меченая ДНК (0,5 мкг) размером
852 п.н. и 2,7 т.п.н. была импортирована в изолированные митохондрии Z. mays, B. rapa и A. thaliana. После инкубации с
митохондриями мтДНК была экстрагирована и разделена электрофоретически в агарозном геле. Дорожки: 1 - флуорес#
центно меченый ДНК#субстрат до импорта, 3 нг; 2 - экстрагированный после импорта в митохондрии. г - Влияние на#
личия Cy3 на 5'#концах фрагмента ДНК размером 852 п.н. на его импорт в митохондрии
ниях по изучению эффективности митохондри#
делять значительно меньшие количества импор#
ального импорта in organello.
тируемой ДНК. Очевидным недостатком данно#
Однако, анализ импорта ДНК в митохон#
го подхода является то, что в реакции кПЦР де#
дрии с применением флуоресцентно меченых
тектируются не полноразмерные молекулы
субстратов обладает недостаточной чувстви#
ДНК, а лишь ее фрагменты.
тельностью для решения ряда принципиальных
Впервые анализ импорта немеченых
задач, в частности, для изучения митохондри#
субстратов ДНК in organello с помощью кПЦР с
ального импорта ДНК in vivo. Этого недостатка
использованием TaqMan#зондов был применен
практически лишен метод анализа импорта
в работе Клименко с соавт. [24]. В данном иссле#
ДНК с помощью количественной ПЦР в режи#
довании мы разработали стандартизированную
ме реального времени (кПЦР), позволяя опре#
систему анализа импорта ДНК в кПЦР с ис#
БИОХИМИЯ том 84 вып. 7 2019
ИМПОРТ ДНК В МИТОХОНДРИИ РАСТЕНИЙ in organello И in vivo
1041
пользованием интеркалирующего красителя
молекул остается связанной с внешней мембра#
SYBR Green, которая отличается удобством при#
ной митохондрий или в межмебранном простран#
менения и относительной быстротой. Для ана#
стве и экстрагируется вместе с мтДНК. Присут#
лиза количества импортированной ДНК прово#
ствие этого «фона» может негативно влиять на
дили амплификацию нуклеотидной последова#
количественную оценку импорта. Удаление
тельности размером 185 п.н., являющейся фраг#
внешней митохондриальной мембраны с по#
ментом импортированного субстрата. Парал#
мощью осмотического шока (этап получения
лельно, в каждой экспериментальной пробе про#
митопластов), проведенное после импорта ДНК
водили анализ количества эндогенного митохон#
в митохондрии, позволяет существенно снизить
дриального гена nad4, по которому затем норми#
содержание низкомолекулярных фрагментов
ровали количество импортированной ДНК.
(рис. 3, б, дорожка 2). Эта процедура приводит в
Анализ активности импорта флуоресцентно
то же время и к довольно значительному сниже#
меченого субстрата с помощью кПЦР подтвер#
нию количества импортированной в митохон#
дил, что присутствие флуорофоров на концах
дрии ДНК, выявляемого в кПЦР (рис. 3, в). Для
молекул ДНК не препятствует ее переносу в ми#
того чтобы выяснить, насколько существенна
тохондриальный матрикс: меченая Cy3 и неме#
доля низкомолекулярных фрагментов в получае#
ченая ДНК фрагмента 852 п.н. импортировалась
мом количественном результате импорта целе#
в митохондрии A. thaliana с равной эффектив#
вых фрагментов ДНК, мы провели электрофоре#
ностью (рис. 2, г).
тическое разделение ДНК, экстрагированной
Исходя из накопленных экспериментальных
после импорта в митохондрии и получения ми#
данных, следует отметить, что корректность ре#
топластов. Элюированные из агарозного геля
зультатов, полученных с помощью кПЦР, зави#
мтДНК и участок, соответствующий полнораз#
сит от условий постановки реакции импорта
мерному импортируемому фрагменту, проанали#
ДНК в митохондрии. Использовавшиеся на
зировали с помощью кПЦР (рис. 3, г). Как ока#
настоящий момент подходы при постановке ре#
залось, эффективность импорта ДНК, как в слу#
акции импорта имели существенные различия в
чае использования в качестве матрицы экстраги#
отношении наличия или отсутствия стадии по#
рованной ДНК непосредственно после импорта,
лучения митопластов, объема реакции импорта,
так и при использовании элюата, содержащего
способа экстракции мтДНК [7, 9, 14, 24] и др.
полноразмерные импортированную и мтДНК,
В данной работе мы провели определение объе#
практически не различалась (рис. 3, г).
ма реакции импорта, оптимального для эффек#
Полученные результаты позволяют заклю#
тивного поглощения ДНК митохондриями. На#
чить, что анализ при помощи кПЦР, несмотря на
ми была проанализирована интенсивность им#
лежащую в основе подхода детекцию небольшо#
порта ДНК в серии образцов, различающихся
го амплифицируемого фрагмента ДНК, при ана#
объемом реакции, но с постоянными количест#
лизе препарата выделенной из митопластов ДНК
вом митохондриального белка (200 мкг) и до#
дает результаты, совпадающие с результатами
бавленного ДНК#субстрата (500 нг) (рис. 3, а).
анализа препарата, содержащего только полно#
Низкой эффективностью импорта ДНК отлича#
размерный фрагмент импортированной ДНК.
лись образцы, объем реакции которых составил
Импорт ДНК в растительные митохондрии в
20 и 50 мкл. В небольших объемах реакции ми#
системе in vivo. Исследования импорта ДНК в
тохондрии, скорее всего, агрегируют, что может
клетках животных и растений до настоящего
являться причиной блокирования транспорт#
времени оставались ограниченными системой
ных каналов, необходимых для процесса пере#
изолированных митохондрий. Нами впервые
носа макромолекул. Объем реакции 100-300 мкл
разработан подход, позволяющий детектиро#
оказался наиболее оптимальным для транспорта
вать транспорт ДНК из цитоплазмы в митохонд#
ДНК в митохондрии (рис. 3, а).
рии, происходящий в протопластах A. thaliana.
Анализ флуоресцентно меченой ДНК,
Данный подход включает: (a) трансформацию
экстрагированной после импорта в митохон#
протопластов ДНК#субстратом; (б) инкубацию
дрии и подвергшейся электрофоретическому
клеток в оптимальных физиологических усло#
разделению в агарозном геле, выявил, помимо
виях (температура, освещенность) в течение
полноразмерного импортированного фрагмента
20 ч; (в) разрушение протопластов и выделение
размером 852 п.н., наличие «фона» низкомоле#
митохондрий из протопластов микрометодом;
кулярных фрагментов (рис. 3, б, дорожка 1). По#
(г) обработку изолированных митохондрий
явление этих низкомолекулярных фрагментов
ДНКазой с целью избавления от возможного
обусловлено, скорее всего тем, что после обра#
загрязнения фракцией ДНК, связавшейся с на#
ботки ДНКазой и отмывок некоторая часть не
ружной мембраной; (д) лизис митохондрий и
импортированных и частично деградированных
выделение мтДНК; (е) оценку количества им#
БИОХИМИЯ том 84 вып. 7 2019
1042
ТАРАСЕНКО и др.
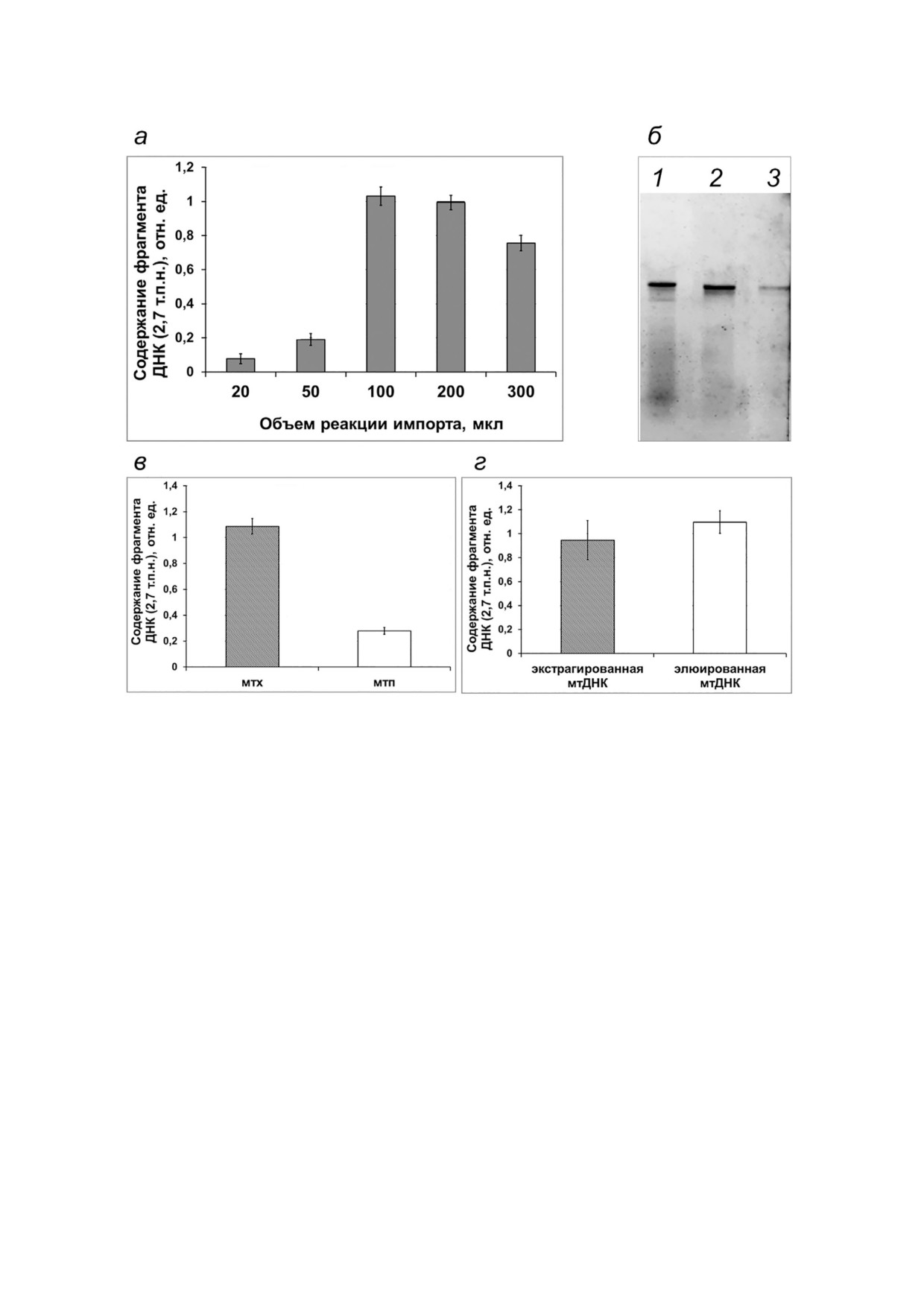
Рис. 3. Анализ параметров, влияющих на эффективность импорта ДНК в митохондрии. Импорт немеченого или флуорес#
центно меченого фрагмента ДНК размером 2,7 т.п.н. проводили в митохондрии S. tuberosum (а), A.thaliana (б и в) и B. rapa (г).
а - Относительное количество ДНК фрагмента размером 2,7 т.п.н., нормированное к содержанию фрагмента гена nad4,
выявленное при анализе проб после импорта в изолированные митохондрии в условиях вариации объема реакции.
б и в - анализ импорта ДНК после экстракции из митохондрий (дорожка 1, мтх) или митопластов (дорожка 2, мтп).
г - кПЦР#анализ ДНК, экстрагированной после импорта в изолированные митохондрии (экстрагированная мтДНК) и
подвергшейся элюции после разделения в агарозном геле (элюированная мтДНК)
портированной в митохондрии ДНК с помощью
ций в цитоплазме [23]. Мы показали, что полу#
кПЦР. Использование флуоресцентного мече#
ченный препарат протопластов свободен от заг#
ния ДНК#субстратов с помощью Cy3#содержа#
рязнений, а протопласты сохраняют целост#
щих праймеров не позволило достичь эффек#
ность в течение как минимум 20 ч после выделе#
тивности включения, достаточной для выявле#
ния и трансфекции их ДНК (рис. 4, а).
ния флуоресценции в препаратах ДНК митохон#
Митохондрии были выделены на основе мето#
дрий, выделенных из трансформированных
да, разработанного для получения органелл из про#
протопластов (данные не приведены). Поэтому
топластов суспензионной культуры A. thaliana [25],
нами был выбран подход, включающий кПЦР#
адаптированного нами для небольших количеств
анализ, преимуществом которого является бо#
материала. С целью исключения возможности
лее высокая чувствительность.
поглощения митохондриями фрагментов экзо#
Для получения протопластов из листьев
генной ДНК в процессе выделения, в состав сре#
A. thaliana и трансформации их ДНК был ис#
ды выделения митохондрий были включены
пользован протокол, применявшийся ранее
MgCl2 и ДНКаза I. Нами была произведена оцен#
преимущественно в экспериментах, требующих
ка степени загрязнения препарата ДНК, выде#
временной экспрессии генетических конструк#
ленного из протопластов митохондрий, последо#
БИОХИМИЯ том 84 вып. 7 2019
ИМПОРТ ДНК В МИТОХОНДРИИ РАСТЕНИЙ in organello И in vivo
1043
вательностями ДНК немитохондриального про#
Параллельно было проанализировано содержа#
исхождения. С этой целью был проведен кПЦР#
ние того же ДНК#субстрата, импортированного
анализ, в котором оценивалось содержание фраг#
в изолированные митохондрии A. thaliana. В ре#
ментов хлоропластного гена rbcL и ядерного гена
зультате показано, что содержание импортиро#
yls8. Установлено, что содержание как хлоропла#
ванного в митохондрии ДНК#субстрата было
стной, так и ядерной ДНК в полученном препа#
существенно выше в условиях импорта in vivo по
рате митохондрий снижено приблизительно в
сравнению с условиями in organello (рис. 4, г).
500 раз по сравнению с ее содержанием в тоталь#
Для доказательства внутримитохондриаль#
ной ДНК протопластов (рис. 4, б и в). Таким об#
ной локализации детектируемой ДНК митохон#
разом, митохондрии, выделенные примененным
дрии, выделенные из протопластов A. thaliana,
нами методом, имеют достаточно высокую сте#
были обработаны неионным детергентом Три#
пень очистки от чужеродных примесей.
тон Х#100, нарушающим целостность митохон#
В предварительных экспериментах прото#
дриальных мембран. Перед обработкой ДНКазой
пласты были трансформированы ДНК#субстра#
выделенные митохондрии инкубировали в среде,
том размером 2,7 т.п.н. После инкубации про#
содержащей 0,5% (v/v) Тритон Х#100, в течение
топластов в течение 20 ч, выделения митохон#
10 мин. Данная обработка приводила к практи#
дрий и экстракции мтДНК, детекция с по#
чески полному отсутствию импортированного
мощью кПЦР показала достаточно высокое со#
фрагмента ДНК (рис. 5, а), это служит важным
держание импортированного фрагмента ДНК.
аргументом в пользу того, что детектируемый
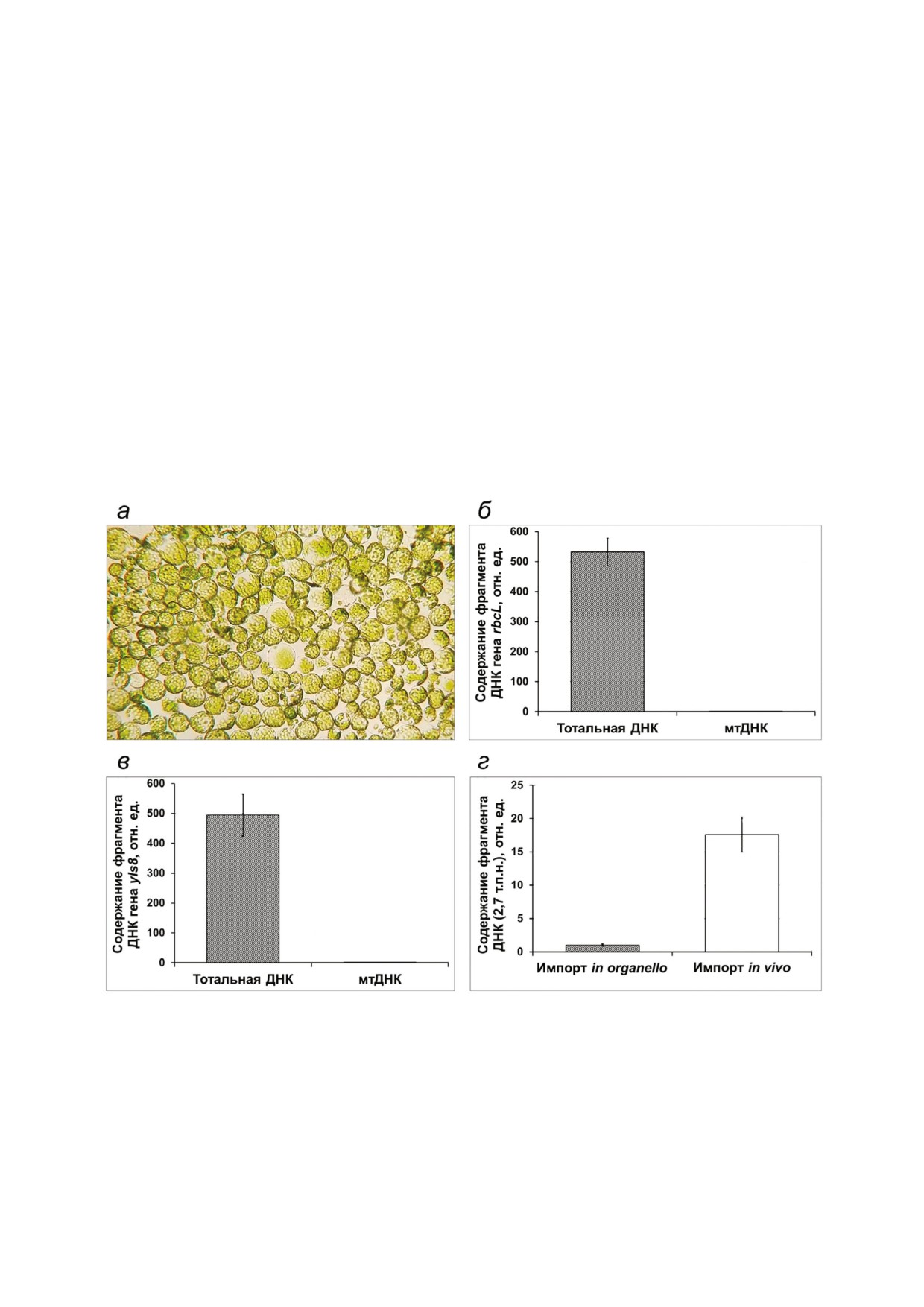
Рис. 4. Импорт ДНК в митохондрии протопластов A. thaliana. а - Внешний облик протопластов арабидопсиса после
трансформации фрагментом ДНК и инкубации в течение 20 ч; б - анализ степени очистки митохондрий, выделенных из
протопластов, от хлоропластного загрязнения; в - анализ степени очистки митохондрий, выделенных из протопластов,
от загрязнения ядерной ДНК. Показано относительное количество фрагментов генов rbcL (хлДНК) и yls8 (ядДНК), нор#
мированное к содержанию фрагмента гена nad4 (мтДНК), выявленное при анализе проб ДНК, выделенной из тотально#
го экстракта протопластов и из препарата изолированных митохондрий; г - анализ импорта ДНК в изолированных орга#
неллах (in organello) и в протопластах (in vivo) A. thaliana.
biokhsm/
БИОХИМИЯ том 84 вып. 7 2019
1044
ТАРАСЕНКО и др.
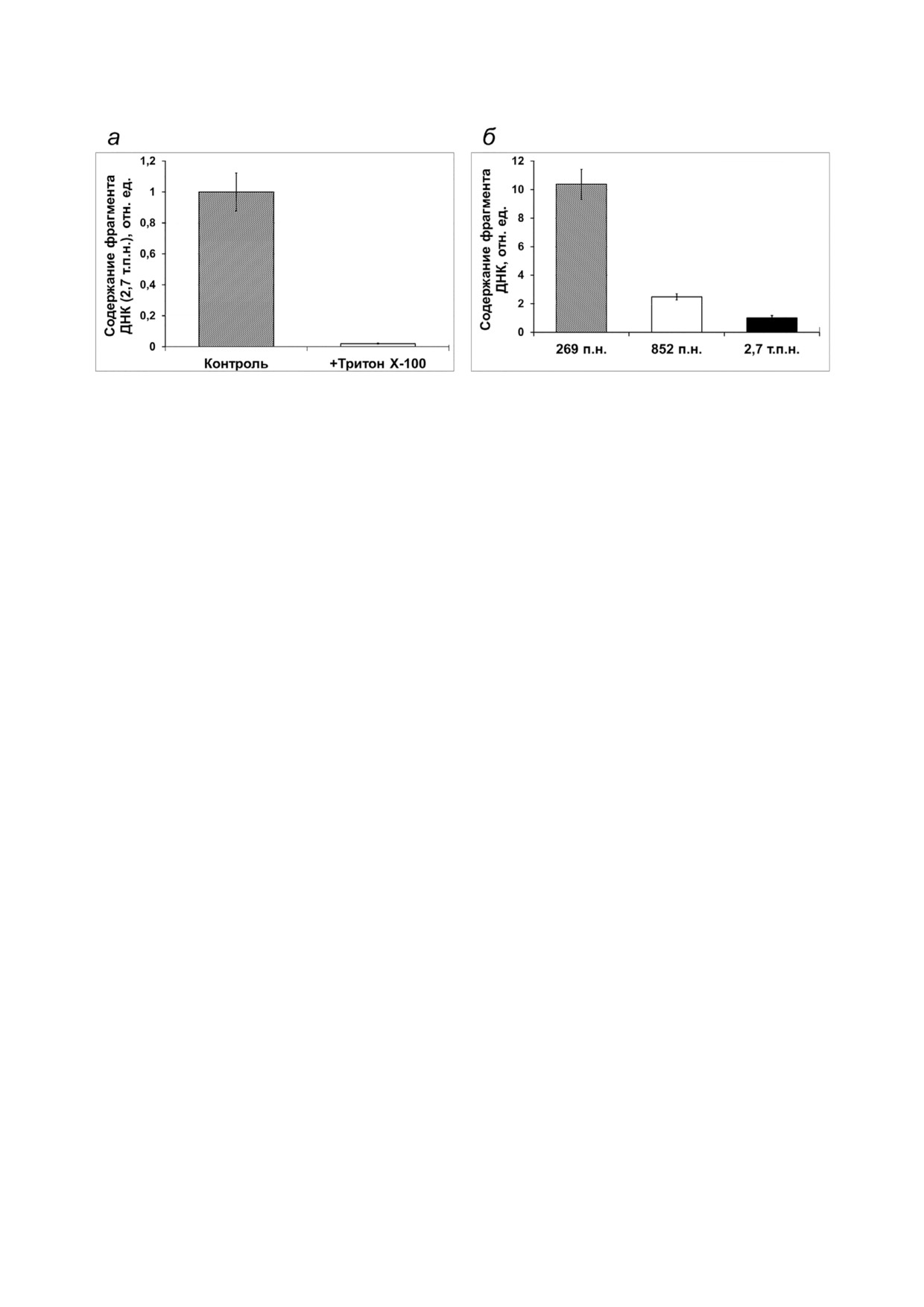
Рис. 5. Митохондриальный импорт ДНК, детектируемый (а) в условиях обработки митохондрий, выделенных из прото#
пластов, детергентом Тритон Х#100, и (б) в протопластах арабидопсиса c использованием ДНК различного размера. По#
казано относительное количество фрагмента гена GFP (содержащегося в импортированной ДНК), нормированное к со#
держанию фрагмента гена nad4
фрагмент локализован в матриксе митохондрий,
vivo нами показано существование феномена
а не ассоциирован с внешней мембраной.
импорта ДНК в митохондрии высших растений.
На следующем этапе работы было проведено
На настоящем этапе исследований сложно од#
сравнение интенсивности импорта ДНК#суб#
нозначно оценить значимость этого процесса
стратов трех размеров - 269 п.н., 852 п.н. и
для функций митохондрий в клетке. Не исклю#
2,7 т.п.н. Для трансфекции протопластов ис#
чено, что это явление может быть следствием
пользовалось равное количество ДНК каждого
механизма, оставшегося от бактериального
из трех субстратов (5 мкг). Из рис. 5, б видно, что
предка митохондрий: как известно, способность
количество молекул ДНК, импортировавшихся
бактериальных клеток к захвату чужеродного ге#
в митохондрии в условиях in vivo, уменьшается с
нетического материала играет огромную роль в
увеличением размера импортируемого субстра#
их эволюции [26, 27]. Наряду с этим, возможно
та. Схожая зависимость была отмечена ранее для
участие митохондриальных транспортных кана#
импорта фрагментов ДНК разного размера в
лов в поглощении молекул ДНК, имеющих ви#
изолированные митохондрии [7], это свидетель#
русное происхождение, с целью запуска защит#
ствует в пользу того, что обнаруженные нами за#
ных механизмов клетки, связанных с митохон#
кономерности импорта ДНК in organello отража#
дриями.
ют процессы, протекающие in vivo. Таким обра#
Достаточно хорошо известны пути транс#
зом, нами впервые показано, что ДНК, находя#
порта ДНК в ядра растительных и животных
щаяся в цитоплазме целой растительной клетки,
клеток. Используя механизмы импорта клеточ#
активно поступает в митохондрии.
ных белков ядерной адресации, через ядерную
мембрану может транспортироваться ДНК ви#
русного происхождения [28]. Для двудольных
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
растений характерен специфический перенос в
ядро плазмидной ДНК при инфицировании аг#
Исходя из особенностей структурной орга#
робактерией, опосредованный бактериальными
низации митохондриального генома растений,
белками VirD2 и VirE2. Кроме того, при исполь#
для которой характерны (i) больший размер в
зовании микроинъекции фрагментов ДНК в ци#
сравнении с мт#геномами других эукариотичес#
топлазму [29] и пермеабилизации клеток диги#
ких организмов, (ii) наличие большого количе#
тонином [30] показано существование неспеци#
ства последовательностей чужеродного проис#
фического импорта фрагментов ДНК размером
хождения, (iii) наличие автономных реплико#
до нескольких т.п.н. в ядра клеток млекопитаю#
нов, (iv) способность к рекомбинации, пред#
щих. На эволюционном уровне множество ге#
ставляется весьма вероятным, что растительные
нов эубактериального происхождения мигриро#
митохондрии обладают выраженной способ#
вали в ядро из клеточных органелл посредством
ностью к захвату и интегрированию в геном чу#
внутриклеточного переноса генов [31]. В ядре
жеродных последовательностей. Действитель#
растительных клеток присутствует практически
но, с использованием подходов in organello и in
полная копия хлоропластного генома [32, 33],
БИОХИМИЯ том 84 вып. 7 2019
ИМПОРТ ДНК В МИТОХОНДРИИ РАСТЕНИЙ in organello И in vivo
1045
копии многих митохондриальных генов, коди#
кальной микроскопии. Было показано, что мече#
рующих полипептиды [34] и тРНК [35]. Ядер#
ная ДНК сохраняется после обработки ДНКазой,
ные мобильные генетические элементы были
т.е. находится в матриксе органеллы. Однако дан#
приобретены во множестве случаев благодаря
ный метод не включал удаления внешней мито#
горизонтальному переносу генов [36]. Интерес#
хондриальной мембраны и не гарантировал из#
но, что события переноса генетического мате#
бавления от ассоциированной с ней ДНК, а так#
риала в геном хлоропластов чрезвычайно редки
же не позволял различить флуоресценцию про#
[37], при этом для хлоропластов, по#видимому,
никших в митохондрию полноразмерных фраг#
характерно отсутствие способности к активному
ментов ДНК и продуктов их деградации.
поглощению ДНК [38]. Таким образом, наблю#
Используя флуоресцентно меченые cубстра#
дается очевидная корреляция между способ#
ты ДНК разной длины, мы изучили возмож#
ностью клеточной органеллы к транспорту ДНК
ность их импорта в митохондрии трех видов рас#
и направлениями внутриклеточного переноса
тений (A. thaliana, B. rapa и Z. mays) и убедились,
генетического материала в процессе эволюции.
что наличие флуорофора не препятствует пере#
Мы предполагаем, что природная компетент#
носу полноразмерных молекул в митохондри#
ность митохондрий к поглощению ДНК может
альный матрикс. Однако, данный метод не дает
являться одним из механизмов, посредством ко#
количественную оценку импорта, которая необ#
торых происходит миграция генетического ма#
ходима в экспериментах по изучению механиз#
териала внутри клетки. В данной работе пред#
мов транспорта ДНК и его кинетических харак#
ставлены современные подходы к исследова#
теристик. Перечисленные недостатки могут
нию феномена импорта ДНК в растительные
быть устранены при использовании для анализа
митохондрии.
кПЦР. Мы оптимизировали этот подход, прове#
Ранее в работах по изучению импорта ДНК в
дя подбор условий импорта в системе in organel(
митохондрии использовали преимущественно
lo и способа выделения ДНК для кПЦР#анали#
радиоактивно меченые субстраты [7, 9, 10, 14].
за. Наиболее оптимальными объемами для по#
Применение радиоактивно меченой ДНК имеет
становки реакции импорта являются 100-300 мкл.
ряд существенных недостатков (табл. 3), поэто#
Использование элюированной после импорта
му для продолжения исследований этого явле#
ДНК в качестве матрицы при проведении кПЦР
ния необходимо было искать альтернативные
подтвердило, что амплификация стандартных
подходы к детекции и анализу импортирован#
для кПЦР ампликонов небольшого размера в
ной ДНК.
составе импортированного субстрата позволяет
Нами был разработан способ детекции ДНК,
получить надежный результат. Удаление внеш#
импортированной в митохондрии растений, с
ней митохондриальной мембраны позволяет из#
помощью флуоресцентного мечения. Ранее
бавиться от связанной с ней ДНК, не проник#
единственное исследование импорта ДНК с ис#
шей в матрикс.
пользованием флуоресцентно меченых фрагмен#
Оптимизированный нами подход in organello
тов [39] было проведено на изолированных мито#
позволяет использовать интактные митохон#
хондриях человека. Импортированную в митохо#
дрии для изучения механизмов импорта ДНК и
ндрии ДНК визуализировали с помощью конфо#
роли белков#переносчиков митохондриальной
Таблица 3. Сопоставление преимуществ и недостатков методов анализа импорта ДНК
Метод анализа импорта
Критерий выбора метода
Радиоактивный
Флуоресцентный
кПЦР
метод анализа
метод анализа
Детекция полноразмерного фрагмента
+
+
-
Количественная оценка эффективности импорта
-
-
+
Сохранение качества ДНК#субстрата импорта при длительном хранении
-
+
+
Удобство и быстрота метода
-
+
+
Безопасность для здоровья
-
+
+
Применение в системе in organello
+
+
+
Применение в системе in vivo
-
-
+
БИОХИМИЯ том 84 вып. 7 2019
1046
ТАРАСЕНКО и др.
Рис. 6. Схема, иллюстрирующая комплексный подход, основанный на использовании систем in organello и in vivo, для ис#
следований импорта ДНК в растительные митохондрии
мембраны, однако, такая система не учитывает
[43]. Также трансформация протопластов посред#
многочисленные клеточные факторы, способ#
ством электропорации была использована при
ные влиять на процесс переноса.
попытке изучения in vivo импорта тРНК в мито#
Ранее природную компетентность митохон#
хондрии S. tuberosum [44]. Однако трансформа#
дрий, как животных, так и растений, к поглоще#
ция протопластов никогда ранее не применя#
нию ДНК не исследовали in vivo. При этом на
лась для изучения механизмов импорта ДНК.
протяжении многих лет не прекращался поиск
На основе метода PEG#опосредованной
методических подходов для осуществления
трансформации протопластов A. thaliana [23] мы
трансформации митохондриального генома
разработали подход к изучению импорта ДНК in
млекопитающих. Были предприняты попытки
vivo. В результате установлено, что фрагменты
трансформации митохондрий посредством свя#
ДНК размером 270-2700 п.н., трансфицирован#
зывания ДНК с митохондриальным транзитным
ные в протопласты, импортируются из цито#
пептидом или с рекомбинантным митохондри#
плазмы в митохондрии с достаточно высокой
альным белком TFAM, бактериальной конъюга#
интенсивностью. Разработанный подход позво#
ции, доставки с помощью липофильных кати#
лит в дальнейшем выявить, сохраняются ли за#
онных соединений, переноса генов, опосредо#
кономерности импорта ДНК, показанные ранее
ванного аденовирусами и других способов [40,
с использованием изолированных митохон#
41]. Тем не менее, ни один из этих методов не
дрий, такие как зависимость от размера и струк#
позволил достичь стабильной трансформации.
турных особенностей молекулы ДНК, влияние
Отсутствуют также сообщения и об успешной
на интенсивность импорта инактивации опре#
трансформации митохондрий высших растений
деленных белков митохондриальной мембраны,
[12, 40]. Между тем, подобная работа представ#
на уровне целой растительной клетки. Помимо
ляет существенный интерес, поскольку, в част#
изучения механизмов переноса ДНК in vivo,
ности, позволит получить трансгенные расте#
данный подход может быть использован при
ния с контролируемым по материнской линии
разработке системы трансформации митохон#
наследованием чужеродного генетического ма#
дриального генома растений. Подобная система
териала.
может включать трансфекцию протопластов
Трансформация протопластов широко при#
конструкциями, содержащими последователь#
меняется, в частности, для внедрения в клетку
ности, обеспечивающие встраивание в мт#геном
временно экспрессируемых конструкций с
[15] и транскрипцию целевых последователь#
целью изучения внутриклеточной адресации
ностей [7], регенерацию клеточной стенки, се#
белков [42], либо промоторной активности тех
лективный отбор трансформированных клеток
или иных регуляторных последовательностей
и получение из них целых растений.
БИОХИМИЯ том 84 вып. 7 2019
ИМПОРТ ДНК В МИТОХОНДРИИ РАСТЕНИЙ in organello И in vivo
1047
В заключение, нами был разработан комплекс#
Благодарности. Авторы выражают благодар#
ный подход для изучения импорта ДНК в расти#
ность Клименкову Игорю Викторовичу за про#
тельные митохондрии, включающий анализ в
ведение микроскопии и Коротаевой Наталье
системах in organello и in vivo (рис. 6). Примене#
Евгеньевне за помощь в проведении флуоресцент#
ние этой системы позволит установить, сохра#
ного анализа. В работе использовано оборудова#
няются ли in vivo закономерности импорта
ние ЦКП «Биоаналитика» СИФИБР СО РАН
ДНК, показанные in organello.
(г. Иркутск).
Конфликт интересов. Авторы заявляют об от#
сутствии конфликта интересов.
Финансирование. Работа выполнена при фи#
Соблюдение этических норм. Настоящая
нансовой поддержке Российского фонда фунда#
статья не содержит описания каких#либо иссле#
ментальных исследований (грант № 18#04#
дований с использованием животных или людей
00603).
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Saccone, C., De Giorgi, C, Gissi C., Pesole, G., and
acids into mitochondria, Biochemistry (Moscow), 83,
Reyes, A. (1999) Evolutionary genomics in Metazoa: the
643-661, doi: 10.1134/S0006297918060032.
mitochondrial DNA as a model system, Gene, 238,
13.
Delage, L., Duchene, A. M., Zaepfel, M., and Marechal#
195-209, doi: 10.1016/S0378#1119(99)00270#X.
Drouard, L. (2003) The anticodon and the D#domain
2.
Alverson, A.J., Rice, D.W., Dickinson, S., Barry, K., and
sequences are essential determinants for plant cytosolic
Palmer, J.D. (2011) Origins and recombination of the bacteri#
tRNAVal import into mitochondria, Plant J., 34, 623-633,
al#sized multichromosomal mitochondrial genome of cucum#
doi: 10.1046/j.1365#313X.2003.01752.x.
ber, Plant Cell, 23, 2499-2513, doi: 10.1105/tpc.111.087189.
14.
Weber#Lotfi, F., Koulintchenko, M.V., Ibrahim, N.,
3.
Kubo, T., and Newton, K.J. (2008) Angiosperm mitochon#
Hammann, P., Mileshina, D.V., Konstantinov, Y.M., and
drial genomes and mutations Mitochondrion, 8, 5-14, doi:
Dietrich, A. (2015) Nucleic acid import into mitochon#
10.1016/j.mito.2007.10.006.
dria: New insights into the translocation pathways,
4.
Unseld, M., Marienfeld, J.R., Brandt, P., and Brennicke, A.
Biochim. Biophys. Acta, 1853, 3165-3181, doi: 10.1016/
(1997) The mitochondrial genome of Arabidopsis thaliana
j.bbamcr.2015.09.011.
contains 57 genes in 366,924 nucleotides, Nat. Genet., 15,
15.
Mileshina, D., Koulintchenko, M., Konstantinov, Yu., and
57-61, doi: 10.1038/ng0197#57.
Dietrich, A. (2011) Transfection of plant mitochondria and
5.
Sanchez#Puerta, M.V. (2014) Involvement of plastid,
in organello gene integration, Nucleic Acids Res., 39, e115,
mitochondrial and nuclear genomes in plant#to#plant hor#
doi: 10.1093/nar/gkr517.
izontal gene transfer, Acta Soc. Bot. Pol., 83, 317-323, doi:
16.
Sweetlove, L.J., Taylor, N.L., and Leaver, C.J.
(2007)
10.5586/asbp.2014.041.
Isolation of intact, functional mitochondria from the
6.
Kubo, T., Nishizawa, S., Sugawara, A., Itchoda, N., Estiati, A.,
model plant Arabidopsis thaliana, Methods Mol. Biol., 372,
and Mikami, T. (2000) The complete nucleo#tide sequence
125-136, doi: 10.1007/978#1#59745#365#3_9.
of the mitochondrial genome of sugar beet (Beta vulgaris L.)
17.
Newton, K.J., and Walbot, V. (1985) Maize mitochondria
reveals a novel gene for tRNAcys(GCA), Nucleic Acids Res.,
synthesize organ#specific polypeptides, Proc. Natl. Acad.
28, 2571-2576, doi: 10.1093/nar/28.13.2571.
Sci. USA, 82, 6879-6883, doi: 10.1073/pnas.82.20.6879.
7.
Koulintchenko, M., Konstantinov, Y., and Dietrich, A.
18.
Neuburger, M., Journet, E.P., Bligny, R., Carde J.#P., and
(2003) Plant mitochondria actively import DNA via the
Douce, R. (1982) Purification of plant mitochondria by
permeability transition pore complex, EMBO J., 22,
isopycnic centrifugation in density gradients of Percoll,
1245-1254, doi: 10.1093/emboj/cdg128.
Arch. Biochem. Biophys., 217, 312-323, doi: 10.1016/
8.
Konstantinov, Y.M., Dietrich, A., Weber#Lotfi, F.,
0003#9861(82)90507#0.
Ibrahim, N., Klimenko, E.S., Tarasenko, V.I., Bolotova, T.A.,
19.
Bradford, M.M. (1976) A rapid and sensitive method for
and Koulintchenko, M.V. (2016) DNA import into mito#
the quantitation of microgram quantities of protein utiliz#
chondria, Biochemistry (Moscow), 81, 1044-1056, doi:
ing the principle of protein#dye binding, Anal. Biochem.,
10.1134/S0006297916100035.
72, 248-254, doi: 10.1016/0003#2697(76)90527#3.
9.
Koulintchenko, M., Temperley, R.J., Mason, P.A.,
20.
Layton, B.E., Sastry, A.M., Lastoskie, C.M., Philbert, M.A.,
Dietrich, A., and Lightowlers, R.N. (2006) Natural com#
Miller, T.J., Sullivan, K.A., Feldman, E.L., and Wang, C.#W.
petence of mammalian mitochondria allows the molecular
(2004) In situ imaging of mitochondrial outer membrane
investigation of mitochondrial gene expression, Hum. Mol.
pores using atomic force microscopy, Biotechniques, 37,
Genet., 15, 143-154, doi: 10.1093/hmg/ddi435.
564-573, doi: 10.2144/04374BI01.
10.
Weber#Lotfi, F., Ibrahim, N., Boesch P., Cosset, A.,
21.
Douce, R., and Neuburger, M. (1989) The uniqueness of
Konstantinov, Y., Lightowlers, R.N., and Dietrich, A. (2009)
plant mitochondria, Annu. Rev. Plant Physiol. Plant Mol.
Developing a genetic approach to investigate the mechanism of
Biol., 40, 371-414, doi: 10.1146/annurev.pp.40.060189.
mitochondrial competence for DNA import, Biochim. Biophys.
002103.
Acta, 1787, 320-327, doi: 10.1016/j.bbabio.2008.11.001.
22.
Грабельных О.И., Кириченко К.А., Побежимова Т.П.,
11.
Campo, M.L., Peixoto, P.M., and Martinez#Caballero, S.
Боровик О.А., Павловская Н.С., Любушкина И.В., Ко#
(2017) Revisiting trends on mitochondrial mega#channels
ролева Н.А., Войников В.К. (2014) Влияние холодового
for the import of proteins and nucleic acids, J. Bioenerg.
шока на жирнокислотный состав и функциональное
Biomembr., 49, 75-99, doi: 10.1007/s10863#016#9662#z.
состояние митохондрий закаленных и незакаленных
12.
Verechshagina, N.A., Konstantinov, Y.M., Kamenski, P.A.,
проростков озимой пшеницы, Биологические мембраны,
and Mazunin, I.O. (2018) Import of proteins and nucleic
31, 204-217, doi: 10.7868/S0233475514020029.
БИОХИМИЯ том 84 вып. 7 2019
1048
ТАРАСЕНКО и др.
23.
Wu, F.#H., Shen, S.#C., Lee L.#Y., Chan M.#T., and Lin, C.#S.
34.
Mower, J.P., Jain, K., and Hepburn, N.J. (2012) The role
(2009) Tape#Arabidopsis sandwich - a simpler Arabidopsis
of horizontal transfer in shaping the plant mitochondrial
protoplast isolation method, Plant Methods, 5, 1-10, doi:
genome, Adv. Botan. Res., 63, 41-69, doi: 10.1016/B978#
10.1186/1746#4811#5#16.
0#12#394279#1.00003#X.
24.
Клименко Е.С., Милейко В.А., Морозкин Е.С., Лак#
35.
Marechal#Drouard, L., Small, I., Weil, J.H., and Dietrich, A.
тионов П.П., Константинов Ю.М. (2011) Характерис#
(1995) Transfer RNA import into plant mitochondria,
тика импорта и экспорта ДНК в митохондриях карто#
Methods Enzymol., 260, 310-327, doi: 10.1016/0076#
феля (Solanum tuberosum) с использованием метода ко#
6879(95)60148#1.
личественной ПЦР, Биологические мембраны,
28,
36.
Diao, X.M., Freeling, M., and Lisch, D. (2006) Horizontal
199-205, doi: 10.1134/S1990747811030044.
transfer of a plant transposon, PLoS Biol.,
4, e5,
25.
Meyer, E.H., and Millar, A.H. (2008) Isolation of mito#
doi: 10.1371/journal.pbio.0040005.
chondria from plant cell culture, Methods Mol. Biol., 425,
37.
Rice, D.W., and Palmer, J.D. (2006) An exceptional hori#
163-169, doi: 10.1007/978#1#60327#210#0_15.
zontal gene transfer in plastids: gene replacement by a dis#
26.
Doolittle, W.F., Boucher, Y., Nesbo, C.L., Douady, C.J.,
tant bacterial paralog and evidence that haptophyte and
Andersson, J.O., and Roger, A.J. (2003) How big is the ice#
cryptophyte plastids are sisters, BMC Biol.,
4,
berg of which organellar genes in nuclear genomes are but
doi: 10.1186/1741#7007#4#31.
the tip? Philos. Trans. R. Soc. Lond. B Biol. Sci., 358,
38.
Richardson, A.O., and Palmer, J.D. (2007) Horizontal gene
39-57, doi: 10.1098/rstb.2002.1185.
transfer in plants, J. Exp. Bot., 58, 1-9, doi: 10.1093/jxb/erl148.
27.
Nakamura, Y., Itoh, T., Matsuda, H., and Gojobori, T.
39.
Jackson, C.B., Zbindena, C., Gallati, S., and Schaller, A.
(2004) Biased biological functions of horizontally trans#
(2014) Heterologous expression from the human D#Loop
ferred genes in prokaryotic genomes, Nat. Genet., 36,
in organello, Mitochondrion, 17, 67-75, doi: 10.1016/
760-766, doi: 10.1038/ng1381.
j.mito.2014.05.011.
28.
Bai, H., Schiralli Lester, G.M., Petishnok, L.C., and
40.
Remacle, C., Larosa, V., Salinas, T., Hamel, P.,
Dean, D.A. (2017) Cytoplasmic transport and nuclear
Subrahmanian, N., Bonnefoy, N., and Kempken, F. (2012)
import of plasmid DNA, Biosci. Rep., 37, BSR20160616,
In Genomics of chloroplasts and mitochondria, Advances in
doi: 10.1042/BSR20160616.
photosynthesis and respiration (Bock, R., and Knoop V.,
29.
Dowty, M.E., Williams, P., Zhang, G., Hagstrom, J.E., and
eds), Springer Science, Belgium, pp.
443-458,
Wolff, J.A. (1995) Plasmid DNA entry into postmitotic
doi: 10.1007/978#94#007#2920#9.
nuclei of primary rat myotubes, Proc. Natl. Acad. Sci. USA,
41.
Niazi, A.K., Mileshina, D., Cosset, A., Val, R., Weber#
92, 4572-4576, doi: 10.1073/pnas.92.10.4572.
Lotfi, F., and Dietrich, A. (2013) Targeting nucleic acids
30.
Hagstrom, J. E., Ludtke, J.J., Bassik, M.C., Sebestyén, M.G.,
into mitochondria: progress and prospects, Mitochondrion,
Adam, S.A. and Wolff, J.A. (1997) Nuclear import of DNA in
13, 548-558, doi: 10.1016/j.mito.2012.05.004.
digitonin#permeabilized cells, J. Cell Sci., 110, 2323-2331.
42.
Bhushan, S., Pavlov, P.F., Rudhe, C., and Glaser, E. (2007)
31.
Johnston, I.G., and Williams, B.P. (2016) Evolutionary
In vitro and in vivo methods to study protein import into
inference across eukaryotes identifies specific pressures
plant mitochondria, Methods Mol. Biol., 390, 131-150,
favoring mitochondrial gene retention, Cell Systems, 2,
doi: 10.1007/978#1#59745#466#7_9.
101-111, doi: 10.1016/j.cels.2016.01.013.
43.
Wehner, N., Hartmann, L., Ehlert, A., Bottner, S., Onate#
32.
Pichersky, E., Logsdon, J.M. Jr., McGrath, J.M., and
Sanchez, L., and Droge#Laser, W. (2011) High#throughput
Stasys, R.A. (1991) Fragments of plastid DNA in the
protoplast transactivation (PTA) system for the analysis of
nuclear genome of tomato: prevalence, chromosomal loca#
Arabidopsis transcription factor function, Plant J., 68,
tion, and possible mechanism of integration, Mol. Gen.
560-569, doi: 10.1111/j.1365#313X.2011.04704.x.
Genet., 225, 453-458, doi: 10.1007/BF00261687.
44.
Wintz, H., and Dietrich, A. (1996) Electroporation of
33.
Ayliffe, M.A., and Timmis, J.N. (1992) Plastid DNA
small RNAs into plant protoplasts: mitochondrial uptake
sequence homologies in the tobacco nuclear genome, Mol.
of transfer RNAs, Biochem. Biophys. Res. Commun., 223,
Gen. Genet., 236, 105-112, doi: 10.1007/BF00279648.
204-210, doi: 10.1006/bbrc.1996.0870.
DNA IMPORT INTO PLANT MITOCHONDRIA:
AN in organello AND in vivo COMPLEX APPROACH
T. A. Tarasenko, V. I. Tarasenko, M. V. Koulintchenko*, E. S. Klimenko, and Yu. M. Konstantinov
Siberian Institute of Plant Physiology and Biochemistry, Siberian Branch of the Russian Academy of Sciences,
664033 Irkutsk, Russia; E(mail: mk100171@yahoo.com
Received March 6, 2019
Revised April 2, 2019
Accepted April 10, 2019
Natural competence of mitochondria to uptake DNA is a phenomenon known for the last 20 years. To date, all stu#
dies of this process have been carried out with isolated mitochondria, because a system for studying DNA transport
into mitochondria in whole cells was not available. We have contributed to the upgrade and standardization of the
existing approaches to study DNA import into plant mitochondria in the in organello system. A method for detecting
the import of fluorescently labeled DNA substrates involving an effective assessment of its intensity using quantitative
PCR has been developed. We have also developed an in vivo system to investigate the translocation of DNA molecules
from cytoplasm to mitochondrial matrix using Arabidopsis thaliana protoplasts. The proposed combined approach will
be useful to determine whether the regularities of mitochondrial DNA import shown in organello remain in vivo.
Keywords: DNA import, plant mitochondria, fluorescent labeling, protoplasts transformation, Arabidopsis thaliana
БИОХИМИЯ том 84 вып. 7 2019