БИОХИМИЯ, 2019, том 84, вып. 8, с. 1051 - 1075
УДК 577.1
МЕХАНИЗМЫ НЕКОФЕРМЕНТНОГО ДЕЙСТВИЯ ТИАМИНА:
БЕЛКОВЫЕ МИШЕНИ И МЕДИЦИНСКОЕ ЗНАЧЕНИЕ
Обзор
© 2019
В.А. Алешин1,2, Г.В. Мкртчян1, В.И. Буник1,2*
1 Московский государственный университет им. М.В. Ломоносова,
факультет биоинженерии и биоинформатики, 119991 Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова,
НИИ физико(химической биологии им. А.Н. Белозерского, 119991 Москва, Россия;
электронная почта: bunik@belozersky.msu.ru
Поступила в редакцию 27.12.2018
После доработки 21.03.2019
Принята к публикации 07.04.2019
Тиамин (витамин В1) является предшественником известного кофермента тиаминдифосфата (ТДФ). Высо
чайшая интенсивность ТДФ зависимой выработки энергии при окислении глюкозы в мозге определяет
критическое значение тиамина для деятельности нейронов. Однако существуют и некоферментные меха
низмы действия тиамина. Давно известное усиление ацетилхолинового сигнала при совместном выбросе
тиамина и ацетилхолина в синаптическую щель на настоящий момент подтверждено такими молекулярны
ми процессами, как фосфорилирование взаимодействующего с ацетилхолиновым рецептором белка рапси
на за счет тиаминтрифосфата (ТТФ) и взаимодействие тиамина с рецептором TAS2R1, усиливающее синап
тические потоки ионов. Некоферментное взаимодействие с тиаминовыми соединениями показано и для
транскрипционного фактора р53, поли(ADP рибозо) полимеразы, прионного белка PRNP и ряда ключе
вых ферментов центрального метаболизма, не использующих ТДФ в качестве кофермента. Таким образом,
анализ полученных результатов указывает на значительно большее, чем обычно полагают, разнообразие ме
ханизмов нейротропного действия тиамина. С этими механизмами тесно связан метаболизм тиаминовых
соединений в клетках животных, современные представления о котором также суммированы в обзоре. Ак
туальность тематики продемонстрирована на примере недавно установленной конкуренции тиамина и ши
роко применяемого антидиабетического препарата метформина за общие внутриклеточные транспортеры.
Конкурентный транспорт вызывает дефицит тиамина, лежащий в основе ряда побочных эффектов метфор
мина. В обзоре рассмотрены и такие медицинские аспекты фундаментальных исследований тиамина, как
роль тиаминаз в реутилизации тиамина и биосинтезе его антагонистов, механизмы действия природных и
синтетических антагонистов тиамина, биотрансформация используемых в медицине фармакологических
форм тиамина. Широкая практика лекарственного применения тиамина и его синтетических форм опреде
ляет актуальность представленных в обзоре исследований для медицины и фармакологии, включая лечение
нейродегенеративных заболеваний.
КЛЮЧЕВЫЕ СЛОВА: витамин В1, метформин, p53, серпины, тиамин, тиаминаза, транспорт тиамина.
DOI: 10.1134/S0320972519080013
Тиамин (витамин В1) является незамени
бактерий, архей, протист и грибов - синтезиру
мым водорастворимым витамином, широко ис
ется de novo. Молекула тиамина образуется за
пользуемым при лечении неврологических
счет объединения двух гетероциклов - шести
расстройств. В организм млекопитающих тиа
членного аминопиримидинового и пятичленно
мин попадает экзогенным путем, а у растений,
го тиазолового. В результате их соединения ме
тиленовым мостиком с участием атома азота ти
азолового кольца последнее переходит в форму
Принятые сокращения: АТДФ - аденилированный
тиаминдифосфат; АТТФ - аденилированный тиаминтри
тиазолия, несущего положительный заряд
фосфат; ОГДГК - 2 оксоглутаратдегидрогеназный комп
(рис. 1). Гидроксиэтильная группа тиазолиевого
лекс; ПАРП - поли(ADP рибозо) полимераза; ПДГК - кольца тиамина подвергается фосфорилирова
пируватдегидрогеназный комплекс; ТДФ - тиаминдифос
нию in vivo при синтезе различных природных
фат; ТДФаза - тиаминдифосфатаза; ТМФ - тиаминмоно
производных тиамина (рис. 1).
фосфат; ТМФаза - тиаминмонофосфатаза; ТТФ - тиамин
трифосфат; ТТФаза - тиаминтрифосфатаза; ЭПР - эндоп
Молекула тиамина имеет много потенци
лазматический ретикулум.
альных центров окисления, которое может за
* Адресат для корреспонденции.
трагивать как аминопиримидиновую, так и тиа
1051
1052
АЛЕШИН и др.
Рис. 1. Тиамин, его природные производные и их взаимные превращения в клетках животных. Номерами обозначены ре
акции, катализируемые следующими ферментами: 1 - тиаминдифосфокиназа, 2 - ТДФаза, 3 - фермент фосфорилиро
вания тиамина, 4 - ТМФаза, 5 - аденилаткиназа, 6 - ТТФ синтаза, 7 - ТТФаза, 8 - ТДФ аденилилтрансфераза,
9 - АТТФ гидролаза, 10 - ТМФ аденилилтрансфераза
золиевую части тиамина. В зависимости от ус
ция реакции тиамина и производных с актив
ловий можно наблюдать окисление тиамина до
ными формами кислорода и азота при сильном
тиохрома, тиаминдисульфида (рис. 2) и других
окислительном стрессе (например, в условиях
окисленных форм, таких как рассмотренные
радиационного поражения) может приводить к
ниже антагонисты тиамина 4' окситиамин или
уменьшению общего пула тиамина в организме
2 оксотиамин. Окисление феррицианидом в
человека и животных [2].
щелочных условиях (рН > 12) способствует ко
Нейротропное действие тиамина в организ
личественному превращению тиамина во флуо
ме человека и млекопитающих известно с 80 x гг.
ресцирующий тиохром (рис. 2) и служит одним
XIX века, когда началось систематическое ис
из методов определения тиамина и его произ
следование болезни «бери бери». В результате в
водных. Окисление при реакции тиамина с ак
1926 г. тиамин стал первым из структурно иден
тивными формами кислорода и азота [1] может
тифицированных витаминов, хотя механизм его
обеспечивать антиоксидантные свойства высо
каталитического действия в качестве кофермен
ких доз тиамина. С другой стороны, стимуля
та (ТДФ) был расшифрован гораздо позднее.
Рис. 2. Окисление тиамина до тиаминдисульфида и тиохрома
БИОХИМИЯ том 84 вып. 8 2019
МЕХАНИЗМЫ НЕКОФЕРМЕНТНОГО ДЕЙСТВИЯ ТИАМИНА
1053
У млекопитающих наиболее важными ТДФ
заболеваниями, в т.ч. болезнями Альцгеймера,
зависимыми ферментами являются транскето
Паркинсона и Хантингтона [7, 10, 11]. Показа
лаза,
пируватдегидрогеназный комплекс
ны значительное снижение активностей ТДФ
(ПДГК) и
2 оксоглутаратдегидрогеназный
зависимых ферментов центрального метаболиз
комплекс (ОГДГК). Это ферменты центральных
ма у пациентов с нейродегенеративными забо
метаболических путей клетки. Транскетолаза -
леваниями и корреляция между снижением
цитоплазматический фермент пентозофосфат
функции ОГДГК и потерей когнитивных спо
ного пути. В организме человека известны три
собностей [12]. При этом высокие дозы тиамина
паралогичных гена транскетолазы: TKT, TKTL1
в ряде случаев приводят к улучшению когнитив
и TKTL2. Экспрессия TKTL1 повышена при
ных и локомоторных функций у пациентов,
различных типах рака, однако данные о связы
страдающих нейродегенеративными заболева
вании ТДФ и наличии транскетолазной актив
ниями [13, 14]. Длительное введение высоких
ности у белкового продукта TKTL1 противоре
доз тиамина (100 мг внутримышечно 2 раза в не
чивы [3-5]. Функция ПДГК и ОГДГК, ключе
делю) не способствовало появлению побочных
вых полиферментных комплексов окислитель
эффектов [14], хотя описаны случаи смертель
ного метаболизма митохондрий, критична для
ного исхода при внутривенном введении тиами
выживаемости нейронов и подробно рассмотре
на [15]. В экспериментах на животных введение
на в монографии [6] и ряде обзоров [7, 8]. Обна
высоких доз тиамина непосредственно в мозг
руженные у млекопитающих изоформы ТДФ
или спинномозговую жидкость могло вызывать
зависимой 2 оксоглутаратдегидрогеназы (ген
конвульсии, однако для людей такие побочные
OGDH) кодируются генами OGDHL и DHTKD1 и
эффекты тиамина не описаны [15].
являются тканеспецифическими компонентами
Традиционно положительное действие тиа
аналогичных ОГДГК с измененной регуляцией
мина на нервную систему объясняют улучше
и/или субстратной специфичностью [6]. ТДФ
нием энергетического метаболизма мозга за
также используется в качестве кофермента ми
счет коферментной функции тиаминдифосфата
тохондриального комплекса дегидрогеназ раз
(ТДФ). Однако некоторые результаты, в т.ч. ис
ветвленных 2 оксокислот (ключевой фермент
следования действия тиамина или его аналогов
катаболизма разветвленных аминокислот [6]) и
в моделях нейродегенеративных заболеваний
ферментов α окисления жирных кислот - пе
на животных, не укладываются в представление
роксисомальной 2 гидроксифитаноил КоА ли
о том, что ключевая роль тиамина в нервной
азы (ген HACL1) и ее недавно обнаруженного
ткани определяется лишь ролью ТДФ в качест
паралога (ген ILVBL или HACL2).
ве кофермента. Так, положительный нейро
При глубоком дефиците тиамина у живот
тропный эффект тиамина и/или его лекар
ных наблюдается опистотонус - судорожная по
ственных форм часто не сопровождается увели
за с резким выгибанием спины, запрокидыва
чением содержания ТДФ в мозге [11, 16, 17],
нием головы, судорожным напряжением конеч
указывая на существование иных механизмов
ностей. Такой дефицит тиамина может вызы
действия тиамина. Целью настоящего обзора
вать паралич и приводить к гибели в течение
является критическое обобщение существую
нескольких дней. Одной из патологий, вызыва
щих в литературе данных о роли некофермент
емых дефицитом тиамина, является синдром
ного типа связывания тиаминовых соединений
Вернике-Корсакова [9]. Ранее данный синдром
и белковых мишенях такого связывания у мле
в основном наблюдали у алкоголиков, однако в
копитающих.
последнее время его все чаще обнаруживают
при ряде состояний, вызывающих скрытый де
фицит тиамина. Такие состояния могут возни
ПРИРОДНЫЕ ПРОИЗВОДНЫЕ
кать вследствие применения диуретиков и дру
ТИАМИНА И ИХ ВНУТРИКЛЕТОЧНАЯ
гих лекарственных препаратов, в частности мет
ЛОКАЛИЗАЦИЯ
формина, радиотерапии и хирургических вме
шательств.
За исключением коферментной функции
Существенно сложнее, чем выраженный де
ТДФ и некоторых аспектов биологического зна
фицит тиамина, диагностируется гиповитами
чения тиаминмонофосфата (ТМФ), роль при
ноз тиамина. Симптомами гиповитаминоза тиа
родных производных тиамина в клетках живот
мина у человека являются апатия, ухудшение
ных на настоящий момент практически не оха
памяти, отсутствие активности и ипохондрия.
рактеризована. Определение локализации при
Большое количество данных свидетельствует о
родных производных тиамина в клетке и моле
связи гиповитаминоза тиамина и/или наруше
кулярная идентификация взаимодействующих с
ний его метаболизма с нейродегенеративными
ними ферментов способствуют решению дан
БИОХИМИЯ том 84 вып. 8 2019
1054
АЛЕШИН и др.
ной проблемы. Например, преимущественную
дифосфокиназы (синтез ТДФ) и митохондри
локализацию того или иного производного сле
ального транспортера ТДФ, кодируемого геном
дует учитывать при поиске его белковых мише
SLC25A19 [22]. Кроме того, у животных ТДФ ре
ней, а также для оценки клеточных концентра
гулирует активность р53 путем связывания с
ций с учетом компартментализации.
этим транскрипционным фактором, которое
Внутриклеточный тиамин присутствует не
конкурентно по отношению к связыванию р53
только в свободной форме, но и в виде фосфо
с ДНК [23]. Поскольку р53 способен активиро
рилированных производных [18, 19]. Такими
вать экспрессию транспортера тиамина THTR 1
производными тиамина являются ТМФ, ТДФ,
(SLC19A2) [24], он может быть «сенсором» уров
ТТФ, а также недавно идентифицированные
ня ТДФ у млекопитающих, аналогичным ТДФ
аденилированные производные ди и трифос
рибопереключателю организмов, способных к
фата тиамина (АТДФ и АТТФ соответственно)
биосинтезу тиамина. Таким образом, предста
[20] (рис. 1). Относительное содержание раз
вители различных царств живых организмов ре
личных производных тиамина, составляющих
ализуют ряд молекулярных механизмов контро
тиаминовый пул клетки, видо и тканеспеци
ля внутриклеточного уровня ТДФ, основанных
фично. В большинстве случаев пул в основном
на некоферментном типе связывания ТДФ с
(~90%) представлен ТДФ (рис. 1) [19]. В сред
компонентами клетки. В случае клеток живот
нем количество ТДФ в разных тканях варьирует
ных таким сенсором ТДФ может быть белок
в диапазоне 20-150 пмоль на 1 мг белка. Если
р53.
учесть, что в среднем белок составляет ~20%
Несмотря на то что в большинстве клеток ос
массы эукариотической клетки, такое содержа
новной представитель пула тиаминовых соеди
ние соответствует внутриклеточной концентра
нений - ТДФ, в отдельных тканях животных
ции 4-30 мкМ. Свободный тиамин составляет
преимущественным компонентом пула является
не более 5 пмоль на 1 мг белка (1 мкМ) [19].
другое производное тиамина - тиаминтрифос
Следует, однако, понимать условность таких
фат (ТТФ) (рис. 1). Его концентрация превыша
оценок. В частности, внутриклеточное содер
ет концентрацию ТДФ, например, в скелетных
жимое не является гомогенным. Поэтому пре
мышцах свиньи, курицы, в электрическом орга
имущественная локализация тиамина и его
не угря Electrophorus electricus [19]. В тканях чело
природных производных в различных клеточ
века ТТФ содержится в количестве не более
ных компартментах может обусловливать зна
3 пмоль на 1 мг белка (0,6 мкМ), а в мозге млеко
чительные расхождения между усредненной и
питающих ТТФ составляет до 1% от общего пула
локальной концентрациями. Помимо простран
тиамина [19]. По некоторым данным, количест
ственного фактора, существуют и временные
во ТТФ падает в мозге у пациентов с болезнью
изменения концентраций, связанные с регуля
Лея и миелоэнцефалопатией [25, 26].
цией синтеза и транспорта биологически актив
ТТФ обнаружен у живых организмов всех
ных соединений в зависимости от условий ок
царств и рассматривается в качестве сигнальной
ружающей среды.
молекулы, индуцируемой при метаболическом
У бактерий, грибов и растений регуляция
стрессе [27]. У животных известно ТТФ зависи
уровня ТДФ контролируется с участием ТДФ
мое фосфорилирование белка рапсина, участву
рибопереключателя. РНК, считываемые с ге
ющего в организации ацетилхолиновых рецеп
нов, кодирующих белки метаболизма и транс
торов в синапсах [28]. Хотя идентифицировать
порта тиамина, содержат консервативную нук
киназу рапсина, участвующую в таком ТТФ за
леотидную последовательность в 5' нетрансли
висимом фосфорилировании, не удалось, дан
руемой области, способную специфическим об
ный процесс может быть связан с известным с
разом связывать ТДФ. Такое связывание ТДФ с
начала ХХ века усилением ацетилхолинергиче
РНК регулирует экспрессию соответствующих
ской нейротрансмиссии при совместном выб
генов биосинтеза тиамина и ТДФ за счет воз
росе ацетилхолина и тиамина в синаптическую
действия на транскрипцию и трансляцию, а у
щель [29, 30]. В независимых исследованиях бы
представителей эукариот - и на альтернатив
ло обнаружено, что процесс высвобождения тиа
ный сплайсинг [21]. У животных, не способных
мина при электрической стимуляции нервов
к самостоятельному синтезу тиамина, не было
предполагает дефосфорилирование ТДФ и ТТФ
найдено подобного ТДФ рибопереключателя,
[31]. Тем не менее данные о молекулярных меха
однако существуют механизмы контроля мета
низмах некоферментного действия тиамина в
болизма тиамина с участием некодирующих
ацетилхолинергической нейротрансмиссии до
РНК. Так, микроРНК miR 155 регулирует
сих пор остаются фрагментарными.
экспрессию клеточного транспортера тиамина
Аденилированное производное тиаминтри
THTR 1, кодируемого геном SLC19A2, тиамин
фосфата, АТТФ (рис. 1), также идентифициро
БИОХИМИЯ том 84 вып. 8 2019
МЕХАНИЗМЫ НЕКОФЕРМЕНТНОГО ДЕЙСТВИЯ ТИАМИНА
1055
вано у представителей всех царств, в т.ч. в тка
БЕЛКИ, УЧАСТВУЮЩИЕ
нях и культурах клеток животных. Количествен
В МЕТАБОЛИЗМЕ ТИАМИНА
ные исследования показали, что в мозге содер
И ЕГО ПРОИЗВОДНЫХ
жание АТТФ не превышает 0,3 пмоль на 1 мг
белка [19, 20]. В клетках линии глиобластомы
Исследование катализируемых ферментами
человека LN 18 содержание АТТФ достигало
взаимных превращений тиамина и его произ
20 пмоль на 1 мг белка (4 мкМ) [19]. У млекопи
водных необходимо для понимания механизмов
тающих показаны специфичное ингибирование
поддержания требуемых концентраций и внут
поли(ADP рибозо) полимеразы 1 (ПАРП) при
риклеточной локализации тиаминовых соеди
концентрации 1-10 мкМ АТТФ [32] и актива
нений в биосистемах. Регуляторное действие
ция глутаматдегидрогеназы в том же диапазоне
различных производных тиамина может зави
концентраций АТТФ [33].
сеть, в частности, от тканеспецифической
Содержание ТМФ (рис. 1) в мозге колеблет
экспрессии белков метаболизма тиамина.
ся в диапазоне 2-15 пмоль на 1 мг белка (0,4-
Основные типы ферментативных реакций,
3,0 мкМ) [19]. Помимо тиамина, ТМФ является
вовлеченных во взаимные превращения тиами
единственным природным производным тиа
новых соединений у млекопитающих, представ
мина, существенно представленным в плазме
лены на рис. 1. В цитоплазме клетки тиамин
крови [19] и способным проходить через гемато
подвергается ATP зависимому фосфорилирова
энцефалический барьер [34].
нию до ТДФ с помощью фермента тиаминди
Фракционирование тканей для определения
фосфокиназы (EC 2.7.6.2, реакция 1, рис. 1).
внутриклеточной локализации тиамина и его
Цитоплазматический синтез ТДФ способствует
производных показало, что в мозге, почках, пе
транспорту тиамина в клетку за счет увеличения
чени и скелетных мышцах тиамин, ТМФ и ТДФ
градиента концентрации тиамина. Тиаминди
присутствуют как в цитозоле, так и во фракции
фосфокиназа (ген TPK1) представляет собой го
клеточных органелл. ТТФ распределяется при
модимер с молекулярной массой 50-64 кДа.
близительно в равной степени между цитозолем
Описанные мутации данного фермента у чело
и органеллами в печени, а в сердце и мозге лока
века приводят к синдрому Лея и различным эн
лизован преимущественно во фракции клеточ
цефалопатиям вследствие лактатного или 2 ок
ных органелл [35]. Разделение гомогенатов моз
соглутаратного ацидоза, возникающего при на
га крысы методом дифференциального центри
рушении ТДФ зависимого катаболизма пирува
фугирования показало, что в основном тиамин
та и 2 оксоглутарата [38, 39].
и ТМФ определяются в цитозольной фракции, а
Кофермент ТДФ может гидролизоваться
ТДФ - в митохондриях [36]. Внутриклеточная
фосфатазами ТДФ (ТДФазами) с образованием
локализация ТТФ, как и его представленность в
ТМФ (реакция 2, рис. 1). Оказалось, что ТДФазы
общем пуле тиаминовых соединений, сильно
печени и почек проявляют одинаково выражен
зависит от организма и типа ткани. Так, в элект
ный максимум активности при рН 9, тогда как
рическом органе Electrophorus electricus практи
для ТДФаз мозга характерно наличие двух рН
чески весь (96%) ТТФ содержится в свободном
оптимумов - при рН 6 и рН 9. В связи с этим
(не связанном с белком) виде в цитозольной
рассматривают два типа ТДФаз - мозговую (B,
фракции. В мозге крысы основная часть ТТФ
от англ. «brain») и печеночную (L, от англ.
определяется в синаптосомах и митохондриях,
«liver») [40]. Обе эти гидролазы не активны в от
тогда как в цитозоле его количество незначи
ношении ТМФ. Подобная черта характерна для
тельно [36, 37].
белков семейства апираз, гидролизующих нук
Таким образом, клеточная локализация и от
леозидди и трифосфаты, но не способных к
носительное содержание тиаминовых соедине
гидролизу нуклеозидмонофосфатов. Недавно
ний могут значительно варьировать. Усреднен
было показано связывание и гидролиз ТДФ бак
ные концентрации некоферментных производ
териальными апиразами [41]. В геноме человека
ных тиамина в тканях и клетках млекопитаю
имеется не менее восьми паралогичных генов
щих могут достигать 10-5 М, а концентрация
апираз (ENTPD1-8), играющих важную роль в
ТДФ - 10-4 М. Такие концентрации ТДФ на по
регуляции пуринергического сигнала. Анализ
рядок выше необходимых для насыщения фер
данных литературы позволяет предположить,
ментов, использующих ТДФ в качестве кофер
что ранее охарактеризованные, но не идентифи
мента [7]. Вполне возможно, что такой избыток
цированные на молекулярном уровне ТДФазы
связан с реализацией некоферментных функ
млекопитающих [40] могут принадлежать к се
ций тиаминовых соединений при более высо
мейству апираз.
ких, чем требуемые для коферментного действия,
Имеется мало данных о ферментах метабо
концентрациях.
лизма ТМФ у животных (рис. 1). Показано, что
БИОХИМИЯ том 84 вып. 8 2019
1056
АЛЕШИН и др.
ТМФ может образовываться не только путем
ной аденилаткиназой 1 [47]. С другой стороны,
гидролиза ТДФ (реакция 2, рис. 1), но и из тиа
нокаут гена AK1 не изменяет уровень ТТФ in vivo
мина путем энергозависимого переноса фосфа
[48], что согласуется с далеким от физиологи
та с различных доноров (реакция 3, рис. 1), та
ческого (~рН 10) оптимумом рН синтеза ТТФ
ких как β глицерофосфатат или креатинфосфат
этой аденилаткиназой [49] и высокой констан
[42]. Эти реакции катализирует щелочная фос
той Михаэлиса (Кm = 0,83 мМ) по сравнению с
фатаза кишечника (ген ALPI) [42], обеспечиваю
концентрацией свободного ТДФ в цитозоле
щая активный транспорт тиамина из полости
клеток (10-5 М) [36]. Однако с учетом данных
кишки посредством энергозависимого синтеза
современной геномики о существовании у мле
ТМФ. Внеклеточная локализация трансмемб
копитающих девяти генов аденилаткиназ
ранной кислой фосфатазы простаты согласуется
(АК1-9), корреляция между общей аденилатки
с циркуляцией ТМФ в плазме крови. ТМФазная
назной активностью и концентрацией ТТФ в
активность трансмембранной кислой фосфата
мышцах крысы [50] может свидетельствовать о
зы простаты, кодируемой геном ACPP (реакция 4,
синтезе ТТФ одним из изоферментов аденилат
рис.
1), необходима для ноцицептивного
киназ, отличным от кодируемого АК1.
действия монофосфорилированных производ
В митохондриях мозга показан синтез ТТФ
ных тиамина в задних корешках спинного мозга
из ТДФ и неорганического фосфата в присут
[43, 44]. Считается, что гидролиз ТМФ до тиа
ствии субстратов дыхательной цепи [37]. Данная
мина (реакция 4, рис. 1) необходим для образо
реакция ингибируется разобщителями и инги
вания ТДФ в реакции 1 (рис. 1).
биторами FоF1 ATP синтазы. В связи с этим бы
Синтез ТТФ в нервных клетках был впервые
ло высказано предположение, что ТТФ может
охарактеризован в середине ХХ века. С исполь
синтезироваться с помощью хемиосмотическо
зованием [14С]тиамина в экспериментах на жи
го механизма, используемого для синтеза ATP
вотных и клеточных культурах показано, что на
(реакция 6, рис. 1). У Escherichia coli с каталити
копление ТТФ может происходить даже быстрее
чески неактивной ATP синтазой образование
накопления ТДФ [36]. Наиболее очевидным ме
ТТФ не происходит, тогда как синтез ТТФ вос
ханизмом синтеза ТТФ является перенос фос
станавливается при наличии плазмиды, содер
фатной группы с ATP на ТДФ. Фермент, катали
жащей оперон для кодирования субъединиц
зирующий реакцию фосфорилирования ТДФ с
FоF1 ATP синтазы [51]. Тем не менее авторы не
помощью ATP, получил название ТДФ фосфо
смогли продемонстрировать такой синтез in vitro
рилтрансфераза или ТТФ синтаза. Данную ре
с использованием очищенной FоF1 ATP синта
акцию катализировал ферментный препарат
зы, несмотря на функциональную активность
ацетонового порошка экстрактов спинного моз
фермента в реакции синтеза ATP. Таким обра
га свиньи [45], но сам фермент не был охаракте
зом, вопрос о ферменте, катализирующем син
ризован. Позже было показано, что очищенная
тез ТТФ из ТДФ и фосфата в митохондриях моз
из ацетонового порошка митохондриальной
га, остается открытым.
фракции мозга быка ТДФ фосфорилтрансфера
Поддержание низкой стационарной концен
за в присутствии ионов двухвалентных металлов
трации ТТФ (< 10-6 М) осуществляется путем
катализирует реакцию, продукт которой (ТТФ)
его гидролиза с помощью тиаминтрифосфатазы
остается связанным с белком [46]. На молеку
(ТТФазы; реакция 7, рис. 1). Существуют две
лярном уровне продуцирующий ТТФ фермент
формы ТТФазы: растворимая и связанная с
не идентифицирован даже у бактерий, у кото
мембраной, однако на молекулярном уровне
рых ТТФ может накапливаться при стрессе в ка
охарактеризована лишь растворимая ТТФаза
честве сигнальной молекулы [27]. Отсутствие
(EC 3.6.1.28, ген THTPA). Данный белок состоит
молекулярной идентификации значительно за
из одной полипептидной цепи с молекулярной
трудняет исследование физиологической роли
массой 25 кДа. Каталитическая эффективность
ТТФ с использованием генно инженерных под
растворимой ТТФазы достаточно высока,
ходов.
kcat/Km варьирует в диапазоне 106-107 с-1 · моль-1
Аденилаткиназа может катализировать пере
(оптимум рН 8,9), фермент обладает высокой
нос фосфата с ADP на ТДФ с образованием
специфичностью к ТТФ
[52]. Мембранная
AMP и ТТФ in vitro [18] (реакция 5, рис. 1), одна
ТТФаза не была идентифицирована на молеку
ко биологическая роль этой реакции не очевид
лярном уровне [53], но ряд ее биохимических
на. С одной стороны, исследование мутации
свойств отличался от характеристик раствори
Arg128Trp в сайте связывания ATP гена АК1 у па
мого фермента. Данный фермент обладал низ
циента с расстройством функции аденилатки
ким сродством к ТТФ (Km = 1,5 мМ) и ингиби
назы показало увеличение продукции ТТФ та
ровался ATP и ADP (Ki 20 и 75 мкМ соответ
кой мутантной формой по сравнению с натив
ственно) [53].
БИОХИМИЯ том 84 вып. 8 2019
МЕХАНИЗМЫ НЕКОФЕРМЕНТНОГО ДЕЙСТВИЯ ТИАМИНА
1057
В мышечной ткани было показано сущест
реутилизацию тиамина из его поврежденных
вование обратной корреляции между раствори
форм. Биологическая роль тиаминазы II в реу
мой ТТФазной активностью и уровнем ТТФ у
тилизации тиамина подтверждается в 100 раз
различных классов животных [19]. В связи с
большей эффективностью гидролиза одного из
этим можно предположить, что данный фер
продуктов деградации тиамина, 4 амино 5 ами
мент играет ключевую роль в регуляции содер
нометил 2 метилпиримидина, по сравнению с
жания ТТФ в тканях млекопитающих. В мела
гидролизом самого тиамина [56].
номе экспрессия растворимой ТТФазы отрица
На молекулярном уровне тиаминазы иден
тельно коррелирует с экспрессией опухолевого
тифицированы в основном у бактерий, и их су
антигена - меланотрансферрина (р97) [54], что
ществование у млекопитающих не является об
указывает на связь уровня ТТФ со злокачествен
щепризнанным. Однако у мышей, которым вво
ной трансформацией.
дили [35S]тиамин, была показана быстрая дегра
В клетках животных было идентифицирова
дация тиамина до его аминопиримидинового и
но и аденилированное производное тиаминтри
тиазолового гетероциклов [57]. Продукты пре
фосфата, АТТФ [20]. Данное соединение, струк
вращения введенного тиамина зависели от дозы
турно сходное с регулятором трансляции диаде
тиамина и типа исследуемой ткани. Так, в мозге
нозинтетрафосфатом, обладает свойствами сиг
наблюдали 1,5 кратный рост содержания 5 (2
нальной молекулы [27]. Предполагают, что син
гидроксиэтил) 4 метилтиазола и 1,3 кратный -
тез АТТФ осуществляется из основного компо
тиаминфосфатов. В печени такое же увеличение
нента тиаминового пула клетки, ТДФ, фермен
тиаминфосфатов сопровождалось двукратным
том ТДФ аденилтрансферазой [19]. Однако ме
увеличением продукта окисления тиамина -
ханизм реакции (реакция 8, рис. 1) остается не
тиохрома (рис. 2). В независимых исследовани
ясным даже в части того, является ли донором
ях было показано, что в моче после перорально
переносимого на ТДФ фосфатного остатка ADP
го и парентерального введения тиамина крысам
или ATP. Предполагается, что низкая стацио
детектируется другой катаболит тиамина -
нарная концентрация АТТФ, подобно ТТФ,
4 метилтиазол 5 уксусная кислота [57, 58]. Та
поддерживается его ферментативной деграда
ким образом, введение высоких доз тиамина мо
цией с образованием кофермента ТДФ (реак
жет сопровождаться значительным накоплени
ция 9, рис. 1). В мембране E. coli локализован
ем продуктов его деградации. Не исключено,
фермент, катализирующий гидролиз АТТФ до
что они также могут иметь физиологическое
ТДФ и AMP [20]. Показано, что у бактерий
действие. Например, известный седативный
АТТФ синтезируется из ТТФ в ответ на метабо
препарат геминейрин (хлорметиазол, 5 (2 хлор
лический стресс [20]. Наряду с АТТФ идентифи
этил) 4 метилтиазол) - агонист GABAA рецеп
цировано также дифосфорное аденилированное
тора - является структурным аналогом тиазоло
производное тиамина - АТДФ [20], которое мо
вого фрагмента тиамина.
жет быть побочным продуктом синтеза АТТФ
Обладающие тиаминазной активностью бел
(реакция 10, рис. 1). Следует отметить, что иден
ки выделены из насекомых (Anaphe spp.) [59] и
тификация специфических ферментов метабо
рыб [60]. Наличие такой активности может вы
лизма и белков мишеней таких минорных ком
зывать дефицит тиамина при культуре питания,
понентов тиаминового пула помогает разре
связанной с употреблением в пищу сырой рыбы
шить и существующую в литературе дискуссию
[61]. Гомогенный препарат тиаминазы I был по
о том, являются ли такие метаболиты синтези
лучен из печени карпа, для которой была опре
руемыми в ответ на клеточный стресс регулято
делена последовательность 20 N концевых ами
рами (т.е. «алармонами») или их появление в та
нокислот: DKLPSLIKMNNDFAFHLYKR [60].
ких условиях - неспецифический артефакт ме
Хотя при публикации этого исследования в
таболического стресса.
2000 г. не было известно ни одного гена, кодиру
Помимо превращений фосфорилированных
ющего такую последовательность, на данный
производных, представленных на рис. 1, извест
момент этот пробел восполнен. С помощью био
ны ферменты расщепления тиамина - тиамина
информатического поиска в базах данных мы
зы. Тиаминаза I переносит аминопиримидино
обнаружили, что в геномах карпа и Danio rerio
вую часть тиамина на органические соедине
существует до трех дуплицированных генов, ко
ния акцепторы [55]. В частности, тиаминаза I
торые могут кодировать тиаминазу I. В настоя
может катализировать замену поврежденного
щее время эти гены аннотированы как изофор
тиазолиевого кольца на новое. Тиаминаза II
мы серпинов - белков, подобных кортикостеро
(тиаминаза TenA) катализирует расщепление
ид связывающему глобулину (транскортину).
молекулы тиамина на два составляющих его ге
Таким образом, тиаминазу I карпа [60] можно
тероцикла [55, 56]. Оба фермента обеспечивают
считать одним из белков семейства серпинов.
БИОХИМИЯ том 84 вып. 8 2019
1058
АЛЕШИН и др.
Учитывая возможность деградации тиамина в
следнее время симптомы данного заболевания
организме млекопитающих [57, 58], можно
часто наблюдаются у пациентов, подвергшихся
предположить, что тиаминазная активность
бариатрической хирургии, химио и радиотера
присуща одному или нескольким белкам, коди
пии [63]. Однако внутриклеточный дефицит тиа
руемым генами серпинов млекопитающих. Мы
мина может возникать и при нормальном уровне
сравнили опубликованные последовательности
тиамина в крови вследствие дисфункции клеточ
генов тиаминазы I карповых рыб [60] с гомоло
ных транспортеров тиамина. Такие дисфункции
гами из семейства серпинов млекопитающих.
могут возникать при мутациях генов транспорте
Проведенный анализ показал, что N концевой
ров тиамина или за счет конкуренции тиамина с
участок обладающего тиаминазной актив
различными ксенобиотиками.
ностью фермента карпа располагается внутри
Постгеномные технологии позволили иден
последовательностей хорошо охарактеризован
тифицировать ряд новых транспортеров тиами
ных серпинов. Поэтому вполне возможно, что
на и его производных в дополнение к ранее из
тиаминазная активность появляется в результа
вестным из биохимических исследований. На
те посттрансляционного протеолиза, характер
рушение работы этих транспортеров может при
ного для серпинов [62]. Наличие в организме че
водить к дефициту тиамина не только в целом
ловека серпинов, потенциально обладающих
организме, но и в отдельных его тканях и клет
активностью тиаминаз, заслуживает внимания с
ках. Благодаря наличию альтернативных транс
точки зрения нейродегенеративных заболева
портеров тиамина и/или неполной потере
ний, сопряженных с развитием дефицита тиа
функции при мутации негативный эффект та
мина.
ких мутаций зачастую остается не идентифици
Суммируя вышеизложенное, можно заклю
рованным в нормальных условиях, но может
чить, что на настоящий момент на молекуляр
проявиться при патологических и/или терапев
ном уровне идентифицированы далеко не все
тических воздействиях. В этих случаях может
ферменты метаболизма тиамина млекопитаю
потребоваться прием высоких доз тиамина. По
щих. В частности, недостаточно охарактеризо
этому идентификация генов транспорта тиами
ваны ферменты синтеза и функции сигнальных
на является актуальной задачей персонифици
молекул - ТТФ, АТТФ, АТДФ, а также тиами
рованной медицины.
назная активность тканей млекопитающих.
У млекопитающих хорошо охарактеризова
Учитывая значение тиамина и его природных
ны клеточные транспортеры тиамина THTR 1
производных для регуляции метаболизма, фер
(Кm = 2,5 · 10-6 M) и THTR 2 (Кm = 2,7 · 10-8 M),
менты метаболизма тиаминовых соединений
кодируемые генами SLC19A2 и SLC19A3 соответ
могут быть потенциальными мишенями тера
ственно (рис. 3) [64, 65]. При мутациях гена
певтических воздействий, однако для этого тре
SLC19A2 развивается синдром тиамин зависи
буется их дальнейшая идентификация на моле
мой мегалобластной анемии, сопровождаю
кулярном уровне.
щийся диабетом и необратимой потерей слуха
[66]. Транспортер THTR 1 также идентифици
рован как входной рецептор для вируса лейкоза
ТРАНСПОРТ ТИАМИНА
кошачьих (Feline leukemia virus), связывание ко
И ЕГО ПРОИЗВОДНЫХ
торого с транспортером THTR 1 (SLC19A2) на
рушает вход тиамина в клетку [67]. Мутации ге
В водных растворах тиамин заряжен поло
на SLC19A3 приводят к симптомам, схожим с
жительно, а его фосфорные производные - от
синдромом Лея [68, 69]. Полиморфизм в недав
рицательно. Поэтому транспорт всех форм тиа
но аннотированном транспортере тиамина, ко
мина через биологические мембраны требует
дируемом геном SLC35F3, ассоциирован с ги
соответствующих транспортеров и может быть
пертензией у человека и меньшим содержанием
использован для регуляции метаболизма на
тиамина в эритроцитах [70].
уровне экспрессии этих транспортеров [10, 24].
Транспортер ТДФ, кодируемый геном
Детальная характеристика транспорта тиамина
SLC25A19, локализован в митохондриальной
и ТМФ имеет специфическое значение для моз
мембране и предназначен для переноса синте
га, поскольку лишь эти соединения проникают
зируемого лишь в цитоплазме ТДФ в митохонд
в мозг посредством активного транспорта через
рии (рис. 3). Он обладает значительной гомоло
гематоэнцефалический барьер [7, 34].
гией с митохондриальным ADP/ATP антипор
Нарушения транспорта тиамина в кровь из
тером, что соответствует структурному сходству
кишечника можно выявить по пониженному со
тиамина с нуклеотидами. Мутации данного
держанию тиамина в крови, которое приводит к
транспортера приводят к дефициту ТДФ в мито
развитию синдрома Вернике-Корсакова. В по
хондриях и дисфункции митохондриальных
БИОХИМИЯ том 84 вып. 8 2019
МЕХАНИЗМЫ НЕКОФЕРМЕНТНОГО ДЕЙСТВИЯ ТИАМИНА
1059
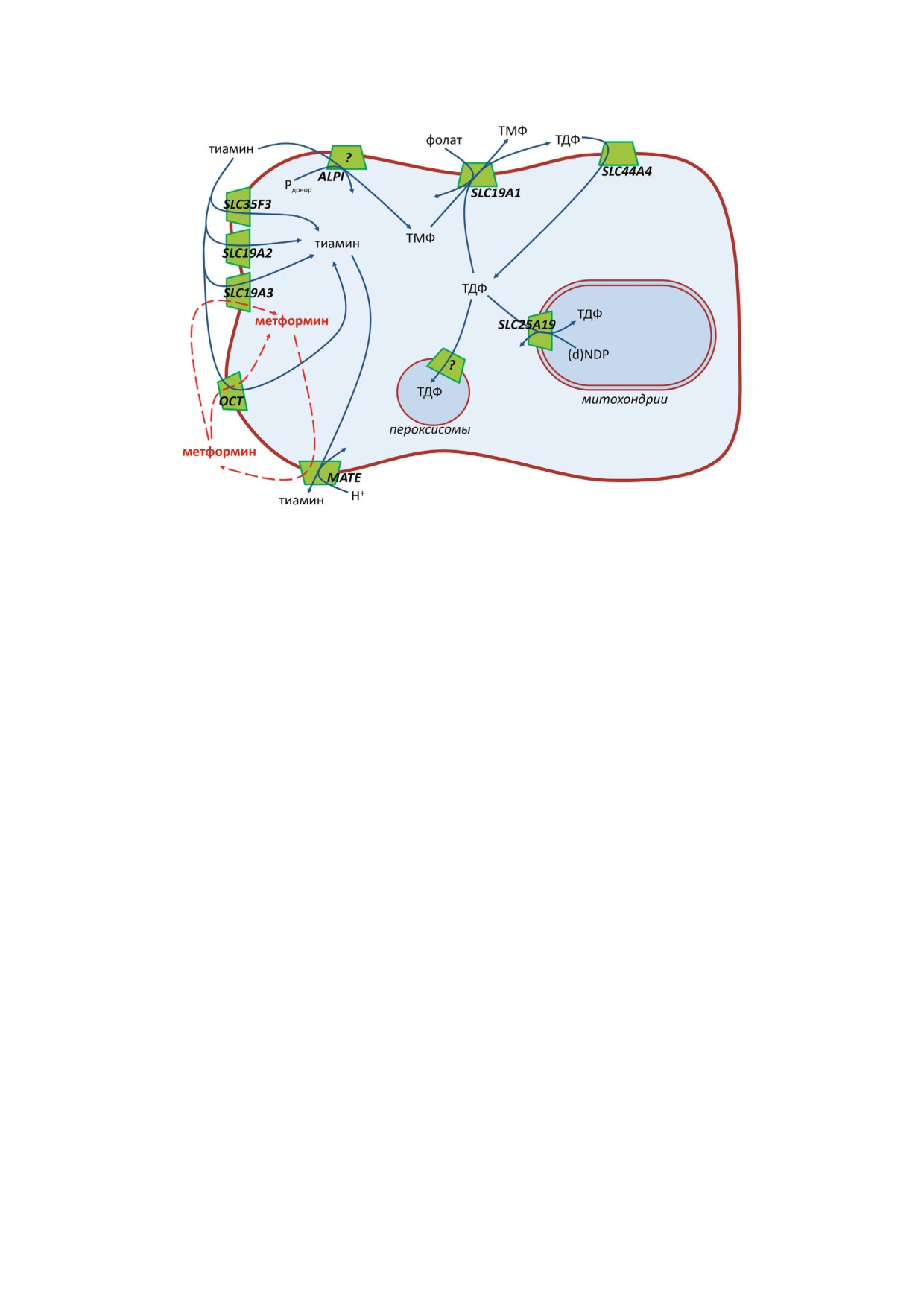
Рис. 3. Клеточный транспорт тиамина и его производных. Транспортеры, идентифицируемые по названиям генов или се
мейства генов, показаны в виде трапеций, транспорт тиамина и производных - сплошными стрелками, транспорт мет
формина - пунктирными стрелками; (d)NDP - (дезокси)нуклеотиддифосфат.
journal/biokhsm/
ТДФ зависимых ферментов. Характерные фе
SLC44A4 (рис. 3). Экспрессия этого транспорте
нотипы данных мутаций - микроцефалия и би
ра относительно высока в клетках кишечного
латеральный некроз [71]. Неоднозначность фи
эпителия, где он, по видимому, используется
зиологических последствий дефицита тиамина
для захвата ТДФ, получаемого с пищей и синте
и/или ТДФ, возникающего при дисфункции
зируемого симбиотическими микроорганизма
специфических транспортеров, свидетельствует
ми [73].
в пользу существования тканеспецифических
Относительно недавно была показана воз
механизмов действия тиаминовых соединений,
можность транспорта тиамина с Km ~ 10-60 мкM
дополняющих универсальную роль ТДФ как ко
через плазматические транспортеры из семей
фермента центрального метаболизма.
ства переносчиков органических катионов
Аналогично митохондриям, пероксисомы не
(OCT), кодируемых генами SLC22A1 (OCT1) и
обладают тиаминдифосфокиназной актив
SLC22A2 (OCT2) (рис. 3) [74-76]. Следует отме
ностью, что указывает на необходимость импор
тить, что величины Km, характерные для реком
та синтезируемого в цитоплазме ТДФ (рис. 3)
бинантных транспортеров человека и мыши
для 2 гидроксифитаноил КоА лиазы, ТДФ за
ОСТ1 и ОСТ2, находятся в субмилимолярном
висимого фермента пероксисом, кодируемого
интервале и составляют 0,5-0,8 мМ [75]. Такие
геном HACL1 [72]. В связи с отсутствием иденти
величины на порядок выше Km, полученных в
фикации пероксисомального транспортера
исследовании клеток со сверхэкспрессией на
ТДФ была высказана гипотеза о совместной
тивного ОСТ2 [76]. Тем не менее высокие значе
транслокации белка HACL1 и ТДФ в виде холо
ния Km рекомбинантных белков ОСТ1 и ОСТ2
фермента [72]. Тем не менее существование не
частично компенсировались значительно более
скольких паралогов гена транспортера ТДФ
высокой величиной максимальной скорости
SLC25A19 в организмах эукариот позволяет
транспорта (Vmax) по сравнению с высокоаф
предположить, что функцией одного из них
финным транспортером тиамина, кодируемым
вполне может быть транспорт ТДФ в пероксисо
геном SLC19A2 [75].
мы (рис. 3).
Выход ТМФ и ТДФ из клетки возможен в
На плазматической мембране клетки также
обмен на фолат через переносчик RFC1, коди
локализован транспортер ТДФ из семейства хо
руемый геном SLC19A1, который известен как
линовых транспортеров, кодируемый геном
внутриклеточный транспортер фолата (рис. 3)
БИОХИМИЯ том 84 вып. 8 2019
1060
АЛЕШИН и др.
[77]. В экспорте тиамина могут участвовать и
КОНКУРЕНЦИЯ ТИАМИНА
белки, транспортирующие различные токсины
И МЕТФОРМИНА ЗА ОБЩИЕ
и лекарства из клеток. К ним относятся белки
ТРАНСПОРТЕРЫ МОЖЕТ ВЫЗЫВАТЬ
семейства MATE: MATE1 (SLC47A1) и MATE2 K
ГИПОВИТАМИНОЗ ТИАМИНА
(SLC47A2) (рис. 3). Величины Km этих транспор
теров для тиамина составляют 3,5 и 3,9 мкM со
Возможность транспорта тиамина и ксено
ответственно [76, 78], подтверждая физиологи
биотиков через одни и те же переносчики может
ческую значимость осуществляемого ими
быть причиной побочных эффектов лекарствен
транспорта тиамина.
ных препаратов. Так, показано, что широко
Изменения транспорта тиамина при злока
применяемый для лечения диабета препарат
чественной трансформации хорошо согласуют
метформин (рис. 4) конкурирует с тиамином за
ся с ключевой ролью тиаминовых соединений в
транспортеры, осуществляющие перенос как
регуляции метаболизма. Так, экспрессия транс
тиамина, так и метформина (рис. 3). По види
портера, кодируемого геном SLC19A3, пониже
мому, это связано с катионной природой обоих
на в клетках и опухолях рака молочной железы
соединений (рис. 1 и 4). Поскольку прием мет
по сравнению с нормальной тканью [79]. Сни
формина обычно продолжается ежедневно в те
жение уровня экспрессии SLC19A3 было обна
чение длительного времени, в долгосрочной
ружено также в клетках и опухолях рака желудка
перспективе такая конкуренция может нару
[80] и в линиях клеток рака прямой кишки [81].
шать нормальное содержание тиамина в тканях
Установлено, что подобное снижение экспрес
и приводить к развитию тиаминового гиповита
сии SLC19A3 при данных типах рака вызвано
миноза вплоть до дефицита. При этом скрытые
эпигенетическими механизмами - деацетили
дисфункции транспортеров тиамина, обуслов
рованием гистонов и гиперметилированием
ленные полиморфизмом или мутациями генов,
ДНК в промоторной области гена [80, 81]. Срав
могут служить отягощающим фактором, приво
нение опухолевых и контрольных тканей мо
дящим к различиям в индивидуальной чувстви
лочной железы также показало увеличение
тельности пациентов к такому побочному эф
экспрессии другого высокоаффинного транс
фекту метформина. Возникающий вследствие
портера тиамина (SLC19A2), митохондриально
приема метформина гиповитаминоз тиамина
го транспортера ТДФ (SLC25А19) и фермента
может усугубить проблемы, вызванные диабе
тиаминдифосфокиназы (TPK1) [82]. Значитель
том, провоцируя развитие других патологий, та
ное увеличение тиаминового пула и уровня
ких как нейродегенеративные заболевания.
экспрессии SLC25А19 наблюдали в клетках ней
Идентификация конкуренции между транспор
робластомы N2A по сравнению с астроцитами
том тиамина и метформина является ярким
[83]. Таким образом, независимые данные, по
примером преимущества фундаментальных ис
лученные на клетках и опухолях разных типов
следований молекулярных механизмов транс
рака, подтверждают изменения внутриклеточ
порта и действия лекарственных препаратов по
ного транспорта тиамина при злокачественной
сравнению со скрининговыми исследованиями.
трансформации. Существенность тиамина для
Скрининг, осуществляемый в фиксированных
пролиферации раковых клеток подтверждена, в
условиях и по ограниченному набору целевых
частности, с использованием препаратов бакте
параметров, выбранных для оценки фармаколо
риальной тиаминазы I, показавших положи
гического действия соединения, не может заме
тельные результаты в борьбе с лейкемией [84].
нить изучение молекулярных механизмов
Следует подчеркнуть, что определяемые тиа
действия препарата. В частности, исследования
мином изменения экспрессии генов при злока
транспорта in vitro позволяют получить парамет
чественной трансформации не обязательно свя
ры, необходимые для предварительной оценки
заны лишь с ТДФ зависимыми ферментами.
и моделирования процессов взаимодействия ле
В частности, сверхэкспрессия транспортера, ко
карственных препаратов с нормальным метабо
дируемого геном SLC19A3, в клетках рака мо
лизмом in vivo.
лочной железы ассоциирована с увеличением
Таким образом, основными клеточными
экспрессии гена цитохрома Р450 CYP4B1 и
транспортерами тиамина считаются высокоаф
уменьшением уровня экспрессии фактора TFF1
финные транспортеры THTR 1 и THTR 2, ко
и ингибитора диссоциации GDP Rho белков,
дируемые генами SLC19A2 и SLC19A3, экспрес
причем депривация тиамина имела обратное
сируемые практически во всех тканях (рис. 3).
действие на экспрессию этих генов [85]. Таким
В то время как существенного транспорта мет
образом, регуляция жизнедеятельности раковых
формина через THTR 1 (SLC19A2) не наблюда
клеток тиамином осуществляется не только за
ется, для транспортера тиамина THTR 2
счет коферментной функции ТДФ.
(SLC19A3) установлена способность переносить
БИОХИМИЯ том 84 вып. 8 2019
МЕХАНИЗМЫ НЕКОФЕРМЕНТНОГО ДЕЙСТВИЯ ТИАМИНА
1061
также и метформин [86]. При этом как конкурент
ный транспорт, так и вызываемое метформином
ингибирование THTR 2 нарушают нормальный
вход тиамина в клетки в присутствии метфор
мина (рис. 3) [86].
С другой стороны, физиологическое значе
ние поступления тиамина в клетку было также
показано для известных переносчиков метфор
мина - транспортеров органических катионов
OCT1 и OCT2 (рис. 3) [74-76, 87]. Для этих
транспортеров характерна узкая тканеспеци
фичность экспрессии: OCT1 экспрессируется в
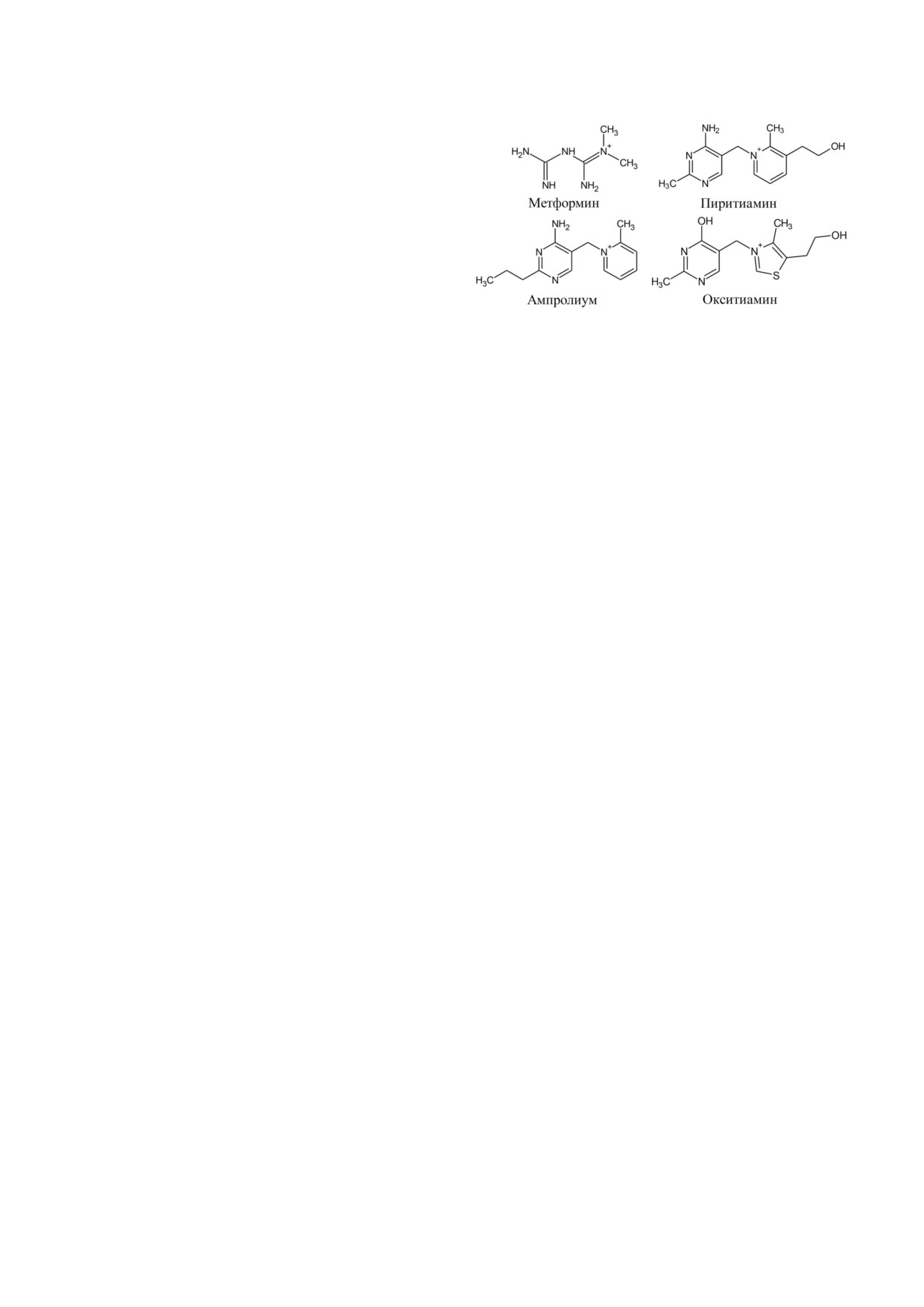
Рис. 4. Структурные формулы метформина и наиболее
печени, а OCT2 - в почках. Таким образом,
известных антагонистов тиамина
OCT1 и OCT2 могут обеспечивать тканеспеци
фическую регуляцию абсорбции тиамина в пе
чени и почках. Действительно, нокаут OCT1
раничено отдельными случаями [91], тогда как
(SLC22A1) у мышей нарушает метаболизм глю
токсическое действие метформина на почки ши
козы и приводит к ингибированию ТДФ зави
роко распространено [92]. Данные результаты
симых ферментов, в частности ПДГК, что сов
хорошо согласуются с приведенными выше ве
падает с фенотипом контрольных мышей при
личинами Ki ОСТ1 и ОСТ2 метформином и тка
диете без тиамина [88].
неспецифичностью экспрессии этих транспор
Сравнение кинетических параметров OCT1
теров. Так, преимущественно почечная экспрес
и OCT2 в отношении метформина позволило
сия ОСТ2, обладающего более низкой по срав
сделать заключение о значительно большей эф
нению с ОСТ1 Ki в отношении метформина,
фективности переноса метформина транспорте
должна приводить к более сильному нарушению
ром OCT2 по сравнению с ОСТ1 in vivo [87].
транспорта тиамина в почках, чем в печени. Со
В сверхэкспрессирующих OCT1 клетках мет
ответственно, в почках может возникать и более
формин полностью ингибировал транспорт тиа
острый тиаминовый дефицит, что хорошо соот
мина через OCT1 [75]. С учетом того, что конс
ветствует клиническим наблюдениям более
танта ингибирования ОСТ1 метформином
распространенного токсического действия мет
(Ki = 1,4 мМ) намного выше таковой для друго
формина на почки по сравнению с печенью.
го бигуанида - фенформина (Ki = 0,07 мМ) [75],
Побочные эффекты метформина в почках и
можно предположить усиление побочного эф
печени, включая развитие лактатного ацидоза,
фекта на транспорт тиамина при использовании
были также ассоциированы с дисфункцией
фенформина. Кроме того, по сравнению с OCT1
MATE1 - еще одного белка, способного транс
ингибирование метформином OCT2 характери
портировать тиамин (рис. 3) [93]. Транспортеры
зуется вдвое меньшей величиной Ki [89]. На ос
семейства MATE, в т.ч. обладающие высоким
новании этих данных и приблизительно одина
(10-6 М) сродством к тиамину MATE1 (SLC47A1)
ковых параметров транспорта тиамина через
и MATE2 K (SLC47A2) [76, 78], участвуют в сек
OCT1 и OCT2 [75] можно предположить, что
реции токсинов и лекарств (включая метфор
метформин будет сильнее ингибировать транс
мин) в печени и почках. Транспорт катионов че
порт тиамина через ОСТ2, чем через OCT1.
рез МАТЕ происходит в обмен на протон, а нап
Конкуренция тиамина и метформина при их
равление транспорта задается за счет рН, поэто
транспорте через ОСТ1 и ОСТ2 должна снижать
му работа данных переносчиков может приво
эффективность насыщения клеток данными со
дить к выведению тиамина с желчью или мочой
единениями при их совместном действии. По
(рис. 3). Поскольку MATE1 обладает более вы
скольку печень является органом, в котором тиа
соким сродством к метформину по сравнению с
мин запасается и расходуется по мере необходи
MATE2 K [78], его дисфункция [93] приводит к
мости [90], ингибирование OCT1 метформи
существенному нарушению выведения метфор
ном, назначаемым при диабете, способно нару
мина из организма, способствуя проявлению
шать запасающую функцию печени в отноше
побочных эффектов.
нии тиамина, способствуя развитию гиповита
В ряде клинических исследований при при
миноза тиамина вплоть до сильного дефицита.
менении метформина и его аналогов у пациентов
Этим могут объясняться побочные эффекты
отмечали возникновение лактатного ацидоза.
метформина на организм в целом. Однако кли
Поскольку лактатный ацидоз является общим
нические исследования также показали, что
индикатором побочного действия метформина
токсическое действие метформина на печень ог
[94] и дефицита тиамина [95], такие исследова
БИОХИМИЯ том 84 вып. 8 2019
1062
АЛЕШИН и др.
ния служат дополнительным подтверждением
метформина. Рассмотренный пример конку
физиологического значения конкуренции бигу
ренции тиамина и лекарств за белки перенос
анидов и тиамина за общие транспортеры. Бо
чики и клинические последствия такой конку
лее того, знание молекулярного механизма воз
ренции указывают на актуальность исследова
никновения побочных эффектов позволяет пред
ний транспорта тиамина in vivo, в который, сог
отвратить такие эффекты. Например, при при
ласно последним исследованиям, могут быть
менении буформина, аналога метформина, наб
вовлечены не только давно известные транспор
людали острый лактатный ацидоз при понижен
теры. Полученные данные также показывают
ном содержании тиамина в плазме крови, а вве
значительный уровень недооценки встречае
дение лекарственной формы тиамина с повы
мости тиаминового дефицита в развитых стра
шенной мембранной проницаемостью - фур
нах и необходимость внедрения в медицинскую
султиамина - способствовало быстрому исчез
практику анализа содержания тиамина у паци
новению лактатного ацидоза и повышению
ентов. Несмотря на то что существующие ана
уровня тиамина в плазме крови [96].
литические методы позволяют эффективно оп
В ряде клинических исследований отмечали
ределять уровень тиамина в плазме крови, в
и другие симптомы дефицита тиамина на фоне
большинстве стран такие анализы обычно не
приема метформина [97, 98] и буформина [96].
включены в оплачиваемый медицинским стра
Так, диета с низким содержанием тиамина, при
хованием набор исследований.
ем пациентом 2 г метформина в день вместо ре
комендованной дозы в 1 г и процедура гемодиа
лиза из за болезни почек вызывали острую эн
СИНТЕТИЧЕСКИЕ И ПРИРОДНЫЕ
цефалопатию и симптомы, свойственные болез
АНТАГОНИСТЫ ТИАМИНА
ни Паркинсона, сопровождавшие развитие тиа
минового дефицита [97]. Отмена метформина
Антагонистами тиамина являются соедине
способствовала исчезновению данных симпто
ния, блокирующие процессы, которые зависят
мов при нормализации уровня тиамина в плазме
от тиамина. Синтетические антагонисты тиами
крови [97]. В другом исследовании, продемон
на были внедрены в исследовательскую практи
стрировавшем положительный эффект высокой
ку в качестве средств изучения физиологиче
дозы тиамина при эссенциальном треморе, па
ской роли ТДФ зависимых ферментов в различ
циент принимал метформин (500 мг 2 раза в
ных тканях и при злокачественной трансформа
день) на протяжении десяти лет [98]. Метфор
ции, а также для изучения метаболизма и транс
мин является широко используемым лекар
порта тиамина и его производных. Широко из
ством при диабете второго типа, и вполне веро
вестными антагонистами тиамина являются
ятно, что ингибирование транспорта тиамина
4' окситиамин, пиритиамин и ампролиум (рис. 4).
метформином может быть одним из факторов,
Все три антагониста блокируют коферментную
обусловливающих распространенность тиами
функцию тиамина (рис. 1), однако молекуляр
нового дефицита среди больных диабетом вто
ные механизмы их действия различаются [7].
рого типа [99]. Разная степень выраженности
Ампролиум, подобно метформину, подавляет
данного побочного эффекта бигуанидов у паци
транспорт тиамина внутрь клеток, вызывая де
ентов может зависеть от уровня тиамина в орга
фицит внутриклеточного тиамина и, как след
низме, который определяется питанием, мик
ствие, образующегося из тиамина ТДФ. В моде
рофлорой и всасыванием в кишечнике, а также
лях тиаминового дефицита на мышах показано,
сопутствующими назначениями диуретиков и
что ампролиум вызывает более медленное раз
гемодиализа. Кроме того, степень тиаминового
витие тиаминового дефицита по сравнению с
гиповитаминоза может зависеть и от генетичес
пиритиамином, широко применяемым для соз
кой вариабельности других компонентов систе
дания тиаминового дефицита [100].
мы метаболизма тиамина, потенциально влияю
Пиритиамин (рис. 4) блокирует фосфорили
щей на насыщение тканей тиамином и его про
рование тиамина до ТДФ (рис. 1), создавая
изводными в условиях конкуренции с бигуани
внутриклеточный дефицит кофермента ТДФ за
дами.
счет сильного ингибирующего действия на тиа
Таким образом, конкуренция бигуанидов,
миндифосфокиназу [7]. При этом транспорт тиа
включая наиболее широко применяемый мет
мина в клетку непосредственно не блокируется,
формин, и тиамина за транспортеры THTR 2,
но может нарушаться из за снижения мембран
OCT1, OCT2, MATE1 и MATE2 K может приво
ного градиента концентрации тиамина при ин
дить к развитию разной степени тиаминового
гибировании его внутриклеточного превраще
гиповитаминоза вплоть до тиаминового дефи
ния в ТДФ. Хотя ингибирование тиаминдифос
цита и лежать в основе ряда побочных эффектов
фокиназы считается основным при создании
БИОХИМИЯ том 84 вып. 8 2019
МЕХАНИЗМЫ НЕКОФЕРМЕНТНОГО ДЕЙСТВИЯ ТИАМИНА
1063
животных моделей тиаминового дефицита, ин
тиамина может быть обусловлен недостатком
дуцируемого пиритиамином, показано также
энергии для обратного захвата ацетилхолина.
использование пиритиамина тиаминдифосфо
Тем не менее специфическое ингибирование
киназой в качестве субстрата [7, 10]. Данная ре
митохондриальных дегидрогеназ 2 оксокислот
акция протекает с низкой эффективностью из за
показало, что первоочередные физиологиче
очень прочного связывания пиритиамина с
ские эффекты такого ингибирования обуслов
ферментом, однако фосфорилирование пири
лены не энергетическим дефицитом, а наруше
тиамина может иметь физиологическое значе
нием гомеостаза метаболитов, связанных с де
ние. Об этом свидетельствует имитирующее
гидрогеназами 2 оксокислот [10, 83, 103]. Дан
ТДФ действие пиритиамина в качестве рибопе
ная особенность может быть обусловлена тем,
реключателя у микроорганизмов, доказываю
что энергетический дефицит при ингибирова
щее продукцию из пиритиамина in vivo аналога
нии одного продуцента NADH может быть эф
ТДФ - дифосфата пиритиамина [7, 10]. Тем не
фективно скомпенсирован другими NADH
менее общепризнанным субстратом тиаминди
продуцирующими реакциями, поскольку био
фосфокиназы является не пиритиамин, а другой
системы настроены на стабилизацию энергети
антагонист тиамина - 4' окситиамин (рис. 4).
ческого обмена. Изменение же клеточных кон
Образование in vivo дифосфорилированной
центраций таких регуляторных метаболитов,
формы 4' окситиамина (4' оксиТДФ), блокирую
как связанные с дегидрогеназами 2 оксокислот
щей ферменты центрального метаболизма, ко
нейромедиаторы и/или их предшественники
торые используют ТДФ в качестве кофермента,
(глутамат, γ аминомасляная кислота, ацетил
является основным механизмом реализации ан
КоА), аналогичной компенсации не поддается,
тиметаболического действия окситиамина.
поскольку биосистемы используют данные из
4' ОксиТДФ также способен имитировать
менения в сигнальных каскадах.
функцию ТДФ как рибопереключателя [101].
4' Окситиамин и/или его фосфорилирован
В силу ключевого положения ТДФ зависи
ные производные обнаруживаются in vivo, при
мых ферментов в центральных метаболических
чем у различных организмов идентифицирова
путях практически любой физиологический эф
ны ферменты, которые детоксифицируют ок
фект антагонистов тиамина может быть объяс
сиТДФ [104, 105]. У микроорганизмов показана
нен нарушением энергетического метаболизма.
регенерация тиамина из 4' окситиамина через
Тем не менее во многих случаях обнаруженные
тиаминосукцинат, однако на молекулярном
эффекты можно интерпретировать и как свиде
уровне ферменты данного пути не были опреде
тельства в пользу некоферментного действия
лены [104]. У бактерий, растений и дрожжей
тиамина и/или производных. Например, при
найдена гидролаза семейства NUDIX, которая
действии 4' окситиамина наблюдали увеличе
обладает в 60 раз большей ферментативной ак
ние кальций зависимого высвобождения си
тивностью с 4' окси и 2 оксоТДФ по сравне
наптического ацетилхолина [102]. Поскольку
нию с ТДФ [105]. Ортологи этого фермента есть
ингибирование пируватдегидрогеназы 4' ок
у рыб, амфибий и некоторых других хордовых.
сиТДФ должно уменьшать содержание ацетил
Хотя биологическая роль ферментов, детокси
холина в связи с уменьшением продуцируемого
фицирующих
«поврежденные» метаболиты,
ПДГК предшественника ацетилхолина - аце
согласуется с детекцией 4' окситиамина, в т.ч. в
тил КоА, результат, полученный Hirsch и Parrott
организме здоровых людей [106], у млекопитаю
[102], указывает на некоферментный характер
щих такие ферменты не охарактеризованы. По
действия
4' окситиамина,
аналогичный
лагают, что биосинтез 4' оксиТДФ из тиамина
действию тиамина по усилению ацетилхолинер
и/или его фосфатов может проходить путем
гической нейротрансмиссии, которое наблюда
спонтанного гидролиза 4' аминогруппы тиами
ли Minz и von Muralt [29, 30]. В рамках рассмот
на либо под действием окислительного стресса
рения исключительно коферментной роли тиа
[104, 105, 107]. Второй путь превращения 4' ами
мин и его антагонист, не имеющий каталитичес
ногруппы тиамина в 4' оксигруппу подтвержда
ки важной 4' аминогруппы, не могут вызывать
ется накоплением в плазме крови и эритроцитах
один и тот же эффект. С учетом же некофермент
4' оксиТДФ при хронической болезни почек,
ного действия тиамина его высокое структурное
ведущей к окислительному стрессу [106].
сходство с 4' окситиамином (рис. 1 и 4) вполне
Таким образом, 4' окситиамин и его произ
может обеспечить сходную регуляцию одних и
водные являются природными антагонистами
тех же мишеней, связывающих тиамин по неко
тиамина. Низкая концентрация данного произ
ферментному типу. С другой стороны, с тради
водного в организме животных может поддер
ционной точки зрения высокий уровень синап
живаться за счет секреции с желчью и мочой
тического ацетилхолина при действии 4' окси
при участии транспортеров MATE (рис. 3), для
БИОХИМИЯ том 84 вып. 8 2019
1064
АЛЕШИН и др.
которых показан транспорт тиамина [76, 78].
ронидазол имитирует тиазолиевый фрагмент
Возможно, что циркуляция секретируемого
тиамина и используется тиаминазой I бактерий
4' окситиамина в кровотоке способствует его
для синтеза соответствующего аминопирими
детоксификации микробиотой кишечника,
дин имидазолиевого аналога тиамина (рис. 5).
превращающей данный антагонист в тиамин за
Такой аналог эффективно ингибирует тиамин
счет рассмотренных выше бактериальных фер
дифосфокиназу [109]. Недавно была показана
ментов.
индуцированная метронидазолом энцефалопа
Известен и другой природный антагонист
тия по причине развития у пациента дефицита
тиамина, предшественником которого является
тиамина при приеме данного антибиотика [110].
недавно идентифицированный у некоторых
По видимому, синтезируемый микробиотой
бактерий антибиотик бациметрин (рис.
5).
аминопиримидин имидазолиевый антагонист
Имитируя аминопиримидиновое кольцо тиами
тиамина (рис. 5) в данном случае накапливался
на, бациметрин используется в качестве
в токсических для человека количествах. Анти
субстрата ферментами биосинтеза тиамина дру
витаминный эффект метронидазола требует за
гих бактерий и дрожжей. В итоге синтезируется
мены антибиотика, однако может быть устранен
антагонист ТДФ, 2' метоксиТДФ, который по
и с помощью приема высоких доз тиамина [110].
давляет жизнеспособность за счет блокирова
Определяемый действием тиаминазы I меха
ния ТДФ зависимых ферментов (рис. 5) [108].
низм развития тиаминового дефицита указыва
Подобным же образом из структурных ана
ет на необходимость контроля уровня тиамина
логов составных частей тиамина могут образо
(или синтезируемого тиаминазой I антагониста
вываться антагонисты тиамина при действии
тиамина) у пациентов, принимающих антибио
тиаминазы I in vivo. Например, антибиотик мет
тики, способные выступать в качестве субстра
Рис. 5. Антагонисты тиамина, синтезируемые ферментами метаболизма тиамина бактерий. а - Механизм действия баци
метрина в качестве антибиотика; б - образование антагониста тиамина при приеме метронидазола
БИОХИМИЯ том 84 вып. 8 2019
МЕХАНИЗМЫ НЕКОФЕРМЕНТНОГО ДЕЙСТВИЯ ТИАМИНА
1065
тов тиаминазы I. Данный пример демонстриру
дуцируемое радиацией связывание р53 с ДНК,
ет актуальность фундаментальных исследова
тестируемое по экспрессии известных мишеней
ний соотношения структуры и функции фер
р53, белков hdm2 (Mdm2) и p21 [23]. С другой
ментов, включающих характеристику детерми
стороны, известна регуляция белком р53 транс
нант субстратной специфичности и регуляции
порта тиамина и его производных. Так, р53 ак
ферментов. Кроме того, не следует недооцени
тивирует экспрессию тиаминового транспорте
вать вариабельность микробиоты как потенци
ра, кодируемого геном SLC19A2 [24], и подавля
альный фактор варьирующего воздействия на
ет экспрессию транспортера RFC1, кодируемого
организм человека ксенобиотиков, способных
геном SLC19A1, обменивающего фолат на ТМФ
подвергаться трансформации в кишечнике.
или ТДФ [111]. Поскольку оба эффекта обеспе
Учитывая существование бактериального син
чивают увеличение содержания тиамина и его
теза антагонистов тиамина, роль микробиоты в
производных в клетке за счет транскрипцион
развитии тиаминового дефицита и сопряжен
ной активности р53, взаимодействие р53 с гене
ных с ним патологий нуждается в дальнейшем
рируемым в цитоплазме ТДФ может быть осно
изучении.
вой механизма обратной связи для регуляции
клеточного уровня ТДФ. Зависимость регуля
торного действия р53 от тиаминового пула клет
БЕЛКИ;МИШЕНИ
ки наблюдали в экспериментах на первичных
НЕКОФЕРМЕНТНОГО ДЕЙСТВИЯ
культурах нейронов, в которых экспрессия p53 и
ТИАМИНОВЫХ СОЕДИНЕНИЙ
Mdm2 увеличивалась в ответ на высокое атмос
ферное давление, а после добавления к клеткам
Структурные детерминанты белковых цент
тиамина уровень p53 и Mdm2 снижался [112].
ров, взаимодействующих с ТДФ как кофермен
В независимых экспериментах с трансформиро
том, охарактеризованы достаточно хорошо бла
ванными клеточными линиями нейронального
годаря идентификации большого количества та
и глиального происхождения инкубация с анта
ких белков. Знания о некоферментном типе
гонистами тиамина 4' окситиамином и пиритиа
связывания тиамина и его производных у жи
мином приводила к опосредованному каспазой
вотных ограничены в основном структурными
апоптозу, индуцируемому р53 [113]. Временные
исследованиями тиаминдифосфокиназы и
зависимости апоптоза в присутствии 4' окситиа
ТТФазы. Это затрудняет поиск и функциональ
мина и пиритиамина различались, что согласу
ную аннотацию белков генома, потенциально
ется с существенной ролью дифосфатной груп
связывающих тиаминовые соединения по неко
пы ТДФ во взаимодействии с р53 и значительно
ферментному типу. Тем не менее некофермент
более высокой эффективностью образования
ный тип связывания установлен в ряде незави
дифосфатного производного в случае 4' окситиа
симых биохимических экспериментов по изме
мина по сравнению с пиритиамином [10].
нениям специфических функций белков, при
Аденилированный
тиаминтрифосфат
чем в некоторых случаях он был дополнен иден
(АТТФ) in vitro ингибировал NAD+ зависимый
тификацией потенциальных структурных детер
фермент поли(ADP рибозо) полимеразу
1
минант образования соответствующих комп
(ПАРП), кодируемую геном PARP1 [32]. Полное
лексов. Фрагментарность этих результатов, сум
ингибирование рекомбинантного фермента
мированных ниже, компенсируется биологи
наблюдали при концентрации АТТФ 10 мкМ
ческой значимостью белков, охарактеризован
[32], сравнимой с концентрацией АТТФ в клет
ных в качестве мишеней тиаминовых соедине
ках глиобластомы [19]. АТДФ, ТТФ, ТДФ и тиа
ний, указывая на необходимость дальнейших
мин при концентрации 20 мкМ не влияли на ак
исследований в данной области.
тивность фермента [32]. Модель комплекса
Показано, что in vitro ТДФ образует комп
АТТФ c ПАРП, полученная на основании разре
лекс с регулятором транскрипции и онкосуп
шенной структуры белка с NAD+ и кинетиче
рессором р53, ингибируя ДНК связывающую
ских данных о связывании АТТФ с этим белком,
активность р53 [23]. Дифосфатная группа ТДФ
предполагает образование стэкинга тиазолиево
является существенной для взаимодействия
го кольца АТТФ с Tyr907, расположенным не
ТДФ с р53, т.к. при прочих равных условиях
посредственно в каталитическом центре [32].
ТМФ и тиамин связываются менее эффективно
Данная модель объясняет механизм селективно
[23]. In vitro р53 также связывает ТДФ лучше,
го ингибирования ПАРП АТТФ и отсутствие
чем нуклеотиды ADP или NAD+. Таким обра
ингибирования ПАРП ТТФ или АТДФ. Модель
зом, некоферментное связывание ТДФ может
структуры комплекса показывает, что для эф
регулировать функции р53. Действительно, до
фективного ингибирования необходимо связы
бавление к клеткам тиамина ингибировало ин
вание одновременно тиаминового и аденозино
2 БИОХИМИЯ том 84 вып. 8 2019
1066
АЛЕШИН и др.
вого фрагментов, но меньшая длина молекулы
и белка биосинтеза тиамина, кодируемого геном
АТДФ не позволяет осуществить такое связыва
ThiD (киназа гидроксиметилпиримидина/фос
ние. Высокая селективность и низкая константа
фометилпиримидина), на уровне их простран
связывания АТТФ ПАРП, а также роль АТТФ в
ственных структур и функциональных остатков
качестве алармона у бактерий [20] позволяют
активного центра [10]. Таким структурным дан
предположить, что АТТФ может быть физиоло
ным хорошо соответствует идентификация ко
гическим регулятором поли ADP рибозилиро
дируемого DJ(1 паркина 7 среди белков мозга
вания («парилирования») - процесса, вовлечен
крысы, связывающихся на носителе, модифи
ного в ответ клеток на повреждения ДНК.
цированном производным тиазолия [33]. В со
Тиамин и его производные взаимодействуют
вокупности с известной ролью паркина в разви
со связанным с мембраной прионным белком
тии болезни Паркинсона данные результаты
PRNP (прионом) [114, 115]. С помощью моде
позволяют предположить, что взаимодействие
лирования охарактеризовали структуру комп
паркина 7 с тиамином и/или производными мо
лекса тиамина и его производных с прионом
жет вносить вклад в положительный эффект вы
[114]. Для рекомбинантного приона Kd комп
соких доз тиамина, наблюдаемый у пациентов с
лекса с тиамином и его моно и дифосфатами
болезнью Паркинсона [14].
варьирует в пределах 0,06-0,07 мМ [115]. В от
Исследование связывания белков мозга на
личие от связывания ТДФ с р53 [23] или АТТФ
модифицированных тиамином или аналогом
c ПАРП [32], связывание с белком PRNP не за
его тиазолиевой части носителях обнаружило,
висит от фосфорилирования тиамина. Высказа
что значительная доля таких белков представле
но предположение, что такое связывание может
на пиридоксалькиназой, глутаматдегидрогена
выполнять биологическую функцию сорбции
зой и малатдегидрогеназой [33]. Кинетический
тиаминовых соединений в примембранном
анализ взаимодействия очищенных препаратов
слое на внешней поверхности клетки для улуч
пиридоксалькиназы, глутаматдегидрогеназы и
шения эффективности дальнейшего транспорта
изоформ малатдегидрогеназы с тиамином и его
витамина В1 и его фосфатов в клетку [10, 114,
производными, а также биоинформатический
115].
поиск структурных элементов этих белков для
Известно связывание тиамина с рецептором,
связывания тиаминовых соединений подтвер
кодируемым геном TAS2R1, принадлежащим к
дили регуляцию указанных ферментов тиами
группе сопряженных с G белками рецепторов
новыми соединениями [33]. Впервые была по
горечи [116]. В независимом исследовании тиа
казана регуляция глутаматдегидрогеназы и глу
мин был охарактеризован как агонист неиден
таминсинтетазы сигнальными формами тиами
тифицированного рецептора из группы TAS2R
на - АТТФ и ТТФ, хорошо согласующаяся с
[117]. Эти данные согласуются с некофермент
синтезом ТТФ в ответ на аминокислотное голо
ным действием тиамина в ацетилхолиновой
дание [33, 119].
нейротрансмиссии [29, 30, 102]. Показанное в
Биоинформатический анализ белков мозга
опытах с 4' окситиамином увеличение кальций
крысы, связывающихся на модифицированных
зависимого высвобождения синаптического
тиамином или тиазолием носителях, идентифи
ацетилхолина [102] может осуществляться за
цировал категорию «ацетилирование» как об
счет активации рецептора, кодируемого одним
щую особенность таких белков [33]. Поскольку
из генов группы TAS2R. Можно предположить,
необходимый для данной посттрансляционной
что такая активация инициирует сигнальный
модификации субстрат, ацетил КоА, в митохонд
каскад, в результате которого открытие кальци
риях синтезируется с помощью ТДФ зависимой
евых каналов в конечном итоге усиливает выб
реакции, катализируемой ПДГК, связь кофер
рос ацетилхолина. Таким образом, изучение
ментной и некоферментной роли тиамина и его
вкусовых рецепторов представляет большой ин
производных через ацетилирование белков соз
терес с точки зрения некоферментной функции
дает дополнительные возможности для регуля
тиамина в ацетилхолинергической нейротранс
ции метаболизма. Ацетил и сукцинил КоА,
миссии.
продуцируемые ТДФ зависимыми комплекса
В бактериальных геномах гены, кодирующие
ми дегидрогеназ 2 оксокислот, участвуют в
ферменты биосинтеза тиамина, соседствуют с
посттрансляционных модификациях ацетили
геном YajL, что позволяет предположить общую
рованием и сукцинилированием. Эти механиз
регуляцию биосинтеза тиамина и YajL [118].
мы могут лежать в основе долговременных
Бактериальный ген YajL является гомологом ге
(8 недель) изменений аминокислотного профи
на DJ(1 (альтернативное название PARK7) чело
ля и ферментативных активностей мозга крыс,
века, кодирующего паркин 7. Проведенный на
которые наблюдали в результате однократного
ми анализ выявил гомологию белков YajL/DJ 1
введения высокой дозы тиамина [119, 120].
БИОХИМИЯ том 84 вып. 8 2019
МЕХАНИЗМЫ НЕКОФЕРМЕНТНОГО ДЕЙСТВИЯ ТИАМИНА
1067
Взаимодействие с ТДФ по некоферментному
ных функций тиаминовых соединений. В этой
типу было также показано для аланинаминотранс
связи значительно большего внимания заслужи
феразы и аспартатаминотрансферазы [121]. Ре
вает известная роль тиамина в стимуляции аце
акции, катализируемые этими аминотрансфера
тилхолинергической нейротрансмиссии
[29,
зами, связывают между собой пируват, оксало
30], поскольку единственными признанными
ацетат, 2 оксоглутарат и глутамат - метаболиты,
средствами для облегчения болезни Альцгейме
уровни которых могут регулироваться ТДФ че
ра являются усиливающие ацетилхолинергиче
рез коферментное взаимодействие с ПДГК и
ский сигнал ингибиторы ацетилхолинэстеразы
ОГДГК и некоферментное (аллостерическое)
[122].
действие тиаминовых соединений на малатде
Хотя долгое время считалось, что экономи
гидрогеназу, глутаматдегидрогеназу, глутамин
чески развитые страны давно победили пробле
синтетазу и пиридоксалькиназу. В результате та
му гиповитаминоза и дефицита тиамина, пред
кого коферментного и некоферментного
ставленные в обзоре данные показывают, что та
действия тиамина и/или производных оказыва
кая проблема может быть вызвана не только
ется возможной метаболическая регуляция
плохим питанием, но и медицинскими вмеша
ТДФ зависимых и сопряженных реакций, обес
тельствами. В результате классический тип али
печивающая оптимальное в данных условиях
ментарного дефицита тиамина сменяется харак
распределение субстратов и продуктов этих ре
терным для развитых стран дефицитом, прово
акций по пересекающимся метаболическим пу
цируемым побочным действием лекарств, хи
тям [33]. In vivo краткосрочная регуляция актив
рургических вмешательств и радиотерапии.
ности этих ферментов при связывании тиами
Причем побочное действие может быть опосре
новых соединений [33] может дополняться дол
довано как различными белками мишенями ор
госрочной регуляцией за счет как посттрансля
ганизма хозяина, так и вариабельностью соста
ционных модификаций, так и на уровне изме
ва кишечной микробиоты. Увеличение продол
нения транскрипции и трансляции генов, во
жительности жизни также вносит вклад в проб
влеченных в метаболизм тиамина [103, 120]. Из
лему гиповитаминоза В1, поскольку известно
вестными на данный момент регуляторами этих
снижение уровня тиамина и его коферментной
процессов являются микроРНК miR 155 [22] и
формы ТДФ в крови и тканях при старении [19].
транскрипционный фактор р53 [23].
Это может быть отягощающим фактором при
Таким образом, независимые данные о су
развитии различных возрастных патологий моз
ществовании белковых центров связывания тиа
га, включая нейродегенеративные заболевания.
мина и производных, отличных от связывания
Результаты независимых исследований показы
ТДФ в качестве кофермента, позволяют заклю
вают, что для больных с нейродегенеративными
чить, что биологическая функция тиамина не
заболеваниями характерны нарушения не толь
ограничивается регуляцией ферментов, исполь
ко уровней тиамина и его производных в крови,
зующих ТДФ в качестве кофермента. Тиамин и
но и нарушения метаболизма тиамина. В этой
его производные вовлечены в более широкий
связи важно, с одной стороны, вовремя диа
спектр механизмов регуляции метаболизма. Та
гностировать наличие и причину дефицита тиа
кие механизмы включают краткосрочную ал
мина, а с другой - быстро устранить его, осно
лостерическую регуляцию белков тиаминовыми
вываясь на установленных молекулярных меха
соединениями, дополненную долгосрочными
низмах возникновения такого дефицита.
механизмами регуляции экспрессии белков и их
Большинство современных подходов к уст
активностей на уровне транскрипции, трансля
ранению дефицита тиамина основано на ис
ции и путем посттрансляционных модифика
пользовании синтетических фармакологиче
ций.
ских форм тиамина (рис. 6) с увеличенными био
доступностью и нейротропностью. Однако ме
ханизмы транспорта и метаболические пути, на
ТИАМИН И ПАТОЛОГИИ
которые действуют эти производные тиамина,
НЕРВНОЙ СИСТЕМЫ
охарактеризованы недостаточно, по крайней
мере в открытой печати. Дисульфидные произ
Работа мозга остро нуждается в активном ка
водные тиамина, такие как фурсултиамин или
таболизме глюкозы, поэтому при гиповитами
сульбутиамин, были синтезированы в качестве
нозе тиамина важную роль в развитии патоло
аналогов природного дисульфида аллитиамина
гий мозга имеет дисфункция ТДФ зависимых
(рис. 6) [123]. Липофильность данных форм тиа
ферментов и роль ТДФ как кофермента. Однако
мина определяет их высокую проницаемость че
развитию нейродегенеративных болезней может
рез мембраны. Такие предшественники тиамина
способствовать также нарушение некофермент
могут превращаться в тиамин после внутрикле
БИОХИМИЯ том 84 вып. 8 2019
2*
1068
АЛЕШИН и др.
точного восстановления дисульфидной связи.
ментов. Однако бенфотиамин уменьшает коли
Другой класс фармакологических форм тиами
чество β амилоида и улучшает когнитивную
на представлен S ацилпроизводными открыто
функцию без увеличения уровня ТДФ в мозге
го тиазолиевого кольца тиамина. Одним из
[17]. Данный результат не согласуется с пред
представителей этого класса является широко
ставлением о том, что эффекты тиамина и ана
используемый бенфотиамин (рис. 6). В большин
логов на мозговую деятельность определяются
стве исследований его действие сравнивают с
исключительно коферментным действием ТДФ.
действием тиамина [124, 125], хотя бенфотиа
В независимых исследованиях было показано,
мин является аналогом ТМФ и потому вполне
что бенфотиамин способствует и уменьшению
может оказывать эффекты, не наблюдаемые при
продукции β амилоида при инкубации с высо
введении тиамина [124]. В частности, мембран
кими концентрациями глюкозы клеток
ная кислая фосфатаза простаты, которая
HEK293, сверхэкспрессирующих предшествен
экспрессируется в нейронах спинальных ганг
ник β амилоида [129]. В обоих экспериментах
лиев, дефосфорилирует и бенфотиамин, и ТМФ
наблюдалось снижение активности киназы гли
[43, 44]. Именно дефосфорилирование бенфо
когенсинтазы, кодируемой геном GSK3B. При
тиамина, аналогичное дефосфорилированию
этом тиамин обладает структурным сходством с
ТМФ, может быть связано с положительным
ингибиторами данной киназы, используемыми
эффектом бенфотиамина при воспалительной и
для борьбы с болезнью Альцгеймера [130]. Более
нейропатической болях, которые зависят от
того, в условиях, когда наблюдается увеличение
действия кислой фосфатазы [43, 44].
уровня киназы, кодируемой геном GSK3B, на
Существование белковых мишеней бенфо
пример, в животной модели физиологического
тиамина, отличных от ТДФ зависимых фермен
стресса с использованием хищника (predator
тов, объясняет и тот факт, что в ряде исследова
stress), введение животным тиамина или бенфо
ний положительные физиологические эффекты
тиамина снижает экспрессию данного фермен
тиамина и бенфотиамина не сопровождаются
та, предотвращает индуцируемое стрессом сни
ростом ТДФ в мозге [17, 126, 127]. Так, накопле
жение нейрогенеза гиппокампа и улучшает ког
ние β амилоида при дефиците тиамина [128]
нитивные способности животных [127, 131].
можно объяснить метаболическими нарушения
Как и в других экспериментах, улучшение
ми за счет дисфункции ТДФ зависимых фер
функций мозга в таких исследованиях сопро
Рис. 6. Структурные формулы наиболее известных фармакологических форм тиамина
БИОХИМИЯ том 84 вып. 8 2019
МЕХАНИЗМЫ НЕКОФЕРМЕНТНОГО ДЕЙСТВИЯ ТИАМИНА
1069
вождается ростом содержания в мозге тиамина,
выше некоферментное действие тиамина и его
но не ТДФ [127]. Таким образом, отсутствие
производных на ферменты метаболизма глута
корреляции между уровнем кофермента ТДФ в
мата - глутаматдегидрогеназу, глутаминсинте
мозге и положительными эффектами бенфотиа
тазу, трансаминазы и синтезирующую кофер
мина свидетельствует в пользу некоферментно
мент трансаминаз пиридоксалькиназу [33, 121].
го характера действия бенфотиамина и/или
Тиаминовая регуляция метаболизма глутамата
продуктов его метаболизма.
может не только снижать нейротоксичность
При болезни Альцгеймера понижены уровни
глутамата, но и способствовать увеличению
тиамина в плазме крови [132], причем измере
синтеза глутатиона из глутамата. С другой сто
ние уровней тиамина и его производных в крови
роны, активация р53 из за травматического
имеет диагностическое значение [133]. При
повреждения может увеличивать экспрессию
этом наблюдают существенное увеличение ак
THTR 1 (SLC19A2), транспортирующего тиа
тивностей ТМФазы и ТДФазы без изменения
мин в клетки, и уменьшать экспрессию RFC1
тиаминдифосфокиназной активности
[134].
(SLC19A1), транспортирующего ТДФ и ТМФ из
Ключевая роль ТМФазы и ТДФазы в наруше
клетки (рис. 3). В таких условиях введение в ор
нии метаболизма тиамина при болезни Альц
ганизм дополнительных количеств тиамина
геймера подтверждается нарушением корреля
усилит повышение уровня ТДФ в травмирован
ции уровней ТМФ и ТДФ в плазме крови боль
ной ткани, необходимого для улучшения мета
ных [134]. В целом, данные о патогенезе болез
болизма. В свою очередь, связывание р53 с на
ни Альцгеймера позволяют полагать, что тиами
копившимся ТДФ будет способствовать ослаб
новый дефицит вследствие нарушения метабо
лению сигнального каскада, индуцированного
лизма тиамина может являться одной из причин
метаболическим стрессом.
болезни, запуская механизмы, способствующие
Таким образом, патологии нервной системы,
окислительному стрессу и стрессу ЭПР, а также
связанные как со старением (болезни Паркин
активации аутофагии [9].
сона и Альцгеймера), так и с травмами мозга,
При болезни Паркинсона также был обнару
могут провоцироваться и/или усиливаться не
жен пониженный уровень тиамина в спинно
достатком витамина В1. Применение высоких
мозговой жидкости [135] и низкий уровень
доз тиамина может иметь положительный эф
ТДФ зависимого ОГДГК в черной субстанции,
фект даже после диагностирования болезни. Ре
причем уменьшение ОГДГК коррелировало со
зультаты, полученные при введении в организм
степенью развития заболевания [136]. Получе
человека и животных тиамина или его фармако
ны свидетельства о роли потребления тиамина
логических форм, не укладываются в представ
за несколько лет до диагностирования болезни
ление об исключительно коферментной роли
Паркинсона в торможении развития данной бо
тиамина. Важную роль в нейропротекторном
лезни [137]. Показано, что в условиях падения
действии тиамина при патологиях нервной тка
активности ОГДГК, лимитирующего поток ме
ни могут иметь как рассмотренные в данном об
таболитов через цикл трикарбоновых кислот,
зоре, так и еще не идентифицированные белки
нейрональные клетки и мозг животных увели
мишени и молекулярные механизмы некофер
чивают внутриклеточный транспорт тиамина
ментного действия тиамина.
[83]. Высокие дозы тиамина, снижающие выра
женность симптомов болезни Паркинсона [14],
Несмотря на хорошо известные механизмы
могут усиливать эффективность такого компен
действия тиамина в качестве предшественника
саторного ответа.
кофермента ТДФ, исследование метаболизма и
При травмах головного и спинного мозга,
функций тиамина у млекопитающих не теряет
для которых характерно развитие воспалитель
своей актуальности. Накопленные сведения о
ных процессов и дисфункция антиоксидантной
действии тиамина, его антагонистов и фарма
системы, показано положительное действие тиа
кологических форм указывают на важную роль
мина на ряд метаболических параметров мозга
не только коферментного, но и некофермент
[138, 139]. Так, введение высокой дозы тиамина
ного связывания тиамина и производных с бел
восстанавливает активности митохондриальных
ками млекопитающих. В этой связи значитель
ферментов и дыхания, которые уменьшаются в
но большего внимания заслуживает тиамино
результате травмы головного мозга [139], и спо
вая регуляция онкосупрессора р53 и поли
собствует нормализации метаболизма глутатио
(АДФ рибозо) полимеразы. Использование
на, содержание которого остается вдвое ниже
постгеномных подходов для идентификации
нормы даже спустя восемь недель реабилитации
белков, взаимодействующих с тиамином и его
после травмы спинного мозга [138]. Важную
производными, необходимо для разработки диа
роль в этих процессах может играть описанное
гностики и лечения ряда патологий, включаю
БИОХИМИЯ том 84 вып. 8 2019
1070
АЛЕШИН и др.
щих и нейродегенеративные болезни. Охарак
сонифицированной медицины и определение
теризованные нарушения метаболизма тиамина
новых мишеней фармакологических воздей
у пациентов с болезнью Альцгеймера, как и
ствий для лечения нейродегенеративных забо
давно известная некоферментная функция тиа
леваний.
мина в ацетилхолинергической нейротранс
миссии, делают очевидной необходимость мо
лекулярной идентификации белковых компо
Финансирование. Работа выполнена при под
нентов биосистем, вовлеченных в данные про
держке Российского фонда фундаментальных
цессы. В частности, это касается белков, ответ
исследований (грант № 18 34 00235).
ственных за метаболизм таких некоферментных
Конфликт интересов. Авторы заявляют об от
производных тиамина, как ТМФ, ТТФ и АТТФ.
сутствии конфликта интересов.
Идентификация этих белков на молекулярном
Соблюдение этических норм. Настоящая
уровне будет ключевым шагом для решения ря
статья не содержит описания не опубликован
да актуальных проблем, в их числе - функцио
ных авторами результатов исследований с учас
нальная аннотация геномов млекопитающих,
тием людей или использованием животных в ка
функциональная диагностика мутаций для пер честве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Stepuro, I.I., Oparin, A.Y., Stsiapura, V.I., Maskevich, S.A.,
the molecular mechanisms of the noncoenzyme action of
and Titov, V.Y. (2012) Oxidation of thiamine on reaction
thiamin (vitamin B1), Studies in Natural Products
with nitrogen dioxide generated by ferric myoglobin and
Chemistry, 53, 375-429, doi: 10.1016/b978 0 444 63930
hemoglobin in the presence of nitrite and hydrogen perox
1.00011 9.
ide, Biochemistry (Moscow), 77, 41-55, doi: 10.1134/
11.
Bunik, V.I. (2014) Benefits of thiamin (vitamin B1) adminis
S0006297912010051.
tration in neurodegenerative diseases may be due to both the
2.
Parkhomenko, Y.M., Donchenko, G.V., Chehovskaya, L.I.,
coenzyme and non coenzyme roles of thiamin, J. Alzheimer’s
Stepanenko, S.P., Mejenskaya, O.A., and Gorban, E.N.
Dis. Parkinsonism, 4, 173, doi: 10.4172/2161 0460.1000173.
(2015) Metovitan prevents accumulation of thiamin diphos
12.
Gibson, G.E., Blass, J.P., Beal, M.F., and Bunik, V. (2005)
phate oxygenized form in rat tissues under irradiation,
The α ketoglutarate-dehydrogenase complex: a mediator
Biotechnologia Acta, 8, 63-70, doi: 10.15407/biotech8.04.063.
between mitochondria and oxidative stress in neurodegen
3.
Coy, J.F., Dressler, D., Wilde, J., and Schubert, P. (2005)
eration, Mol. Neurobiol.,
31,
43-63, doi:
10.1385/
Mutations in the transketolase like gene TKTL1: clinical
MN:31:1 3:043.
implications for neurodegenerative diseases, diabetes and
13.
Costantini, A., Giorgi, R., D’Agostino, S., and Pala, M.I.
cancer, Clin. Lab., 51, 257-273.
(2013) High dose thiamine improves the symptoms of
4.
Langbein, S., Zerilli, M., Zur Hausen, A., Staiger, W.,
Friedreich’s ataxia, BMJ Case Rep., 2013, doi: 10.1136/
Rensch Boschert, K., Lukan, N., Popa, J., Ternullo, M.P.,
bcr 2013 009424.
Steidler, A., Weiss, C., Grobholz, R., Willeke, F., Alken, P.,
14.
Costantini, A., and Fancellu, R. (2016) An open label pilot
Stassi, G., Schubert, P., and Coy, J.F. (2006) Expression of
study with high dose thiamine in Parkinson’s disease,
transketolase TKTL1 predicts colon and urothelial cancer
Neural Regen Res., 11, 406-407, doi: 10.4103/1673 5374.
patient survival: Warburg effect reinterpreted, Br. J. Cancer,
179047.
94, 578-585, doi: 10.1038/sj.bjc.6602962.
15.
Snodgrass, S.R.
(1992) Vitamin neurotoxicity, Mol.
5.
Meshalkina, L.E., Drutsa, V.L., Koroleva, O.N.,
Neurobiol., 6, 41-73, doi: 10.1007/bf02935566.
Solovjeva, O.N., and Kochetov, G.A. (2013) Is transketo
16.
Lonsdale, D. (2006) A review of the biochemistry, metabo
lase like protein, TKTL1, transketolase? Biochim. Biophys.
lism and clinical benefits of thiamin(e) and its derivatives,
Acta, 1832, 387-390, doi: 10.1016/j.bbadis.2012.12.004.
Evid. Based Complement Alternat. Med., 3, 49-59, doi:
6.
Bunik, V. (2017) Vitamin(dependent multienzyme complexes
10.1093/ecam/nek009.
of 2(oxo acid dehydrogenases: structure, function, regulation
17.
Pan, X., Gong, N., Zhao, J., Yu, Z., Gu, F., Chen, J., Sun, X.,
and medical implications, Nova Science Publishers.
Zhao, L., Yu, M., Xu, Z., Dong, W., Qin, Y., Fei, G.,
7.
Bunik, V.I., Tylicki, A., and Lukashev, N.V.
(2013)
Zhong, C., and Xu, T.L. (2010) Powerful beneficial effects
Thiamin diphosphate dependent enzymes: from enzymology
of benfotiamine on cognitive impairment and β amyloid
to metabolic regulation, drug design and disease models,
deposition in amyloid precursor protein/presenilin 1
FEBS J., 280, 6412-6442, doi: 10.1111/febs.12512.
transgenic mice, Brain, 133, 1342-1351, doi: 10.1093/
8.
Bunik, V.I., Denton, T.T., Xu, H., Thompson, C.M.,
brain/awq069.
Cooper, A.J., and Gibson, G.E. (2005) Phosphonate ana
18.
Bettendorff, L., and Wins, P. (1999) Thiamine derivatives
logues of α ketoglutarate inhibit the activity of the
in excitable tissues: metabolism, deficiency and neurode
α ketoglutarate dehydrogenase complex isolated from
generative diseases, Rec. Res. Devel. Neurochem., 2, 37-62.
brain and in cultured cells, Biochemistry, 44, 10552-10561,
19.
Gangolf, M., Czerniecki, J., Radermecker, M., Detry, O.,
doi: 10.1021/bi0503100.
Nisolle, M., Jouan, C., Martin, D., Chantraine, F.,
9.
Liu, D., Ke, Z., and Luo, J. (2017) Thiamine deficiency and
Lakaye, B., Wins, P., Grisar, T., and Bettendorff, L. (2010)
neurodegeneration: the interplay among oxidative stress,
Thiamine status in humans and content of phosphorylated
endoplasmic reticulum stress, and autophagy, Mol.
thiamine derivatives in biopsies and cultured cells, PLoS
Neurobiol., 54, 5440-5448, doi: 10.1007/s12035 016 0079 9.
One, 5, e13616, doi: 10.1371/journal.pone.0013616.
10.
Bunik, V.I., and Aleshin, V.A. (2017) Analysis of the pro
20.
Frederich, M., Delvaux, D., Gigliobianco, T., Gangolf, M.,
tein binding sites for thiamin and its derivatives to elucidate
Dive, G., Mazzucchelli, G., Elias, B., De Pauw, E.,
БИОХИМИЯ том 84 вып. 8 2019
МЕХАНИЗМЫ НЕКОФЕРМЕНТНОГО ДЕЙСТВИЯ ТИАМИНА
1071
Angenot, L., Wins, P., and Bettendorff, L.
(2009)
35.
Matsuda, T., Tonomura, H., Baba, A., and Iwata, H.
Thiaminylated adenine nucleotides. Chemical synthesis,
(1989) Tissue difference in cellular localization of thiamine
structural characterization and natural occurrence, FEBS J.,
phosphate esters, Comp. Biochem. Physiol. B, 94, 405-409,
276, 3256-3268, doi: 10.1111/j.1742 4658.2009. 07040.x.
doi: 10.1016/0305 0491(89)90364 7.
21.
Bocobza, S.E., Malitsky, S., Araujo, W.L., Nunes Nesi, A.,
36.
Bettendorff, L., Wins, P., and Lesourd, M.
(1994)
Meir, S., Shapira, M., Fernie, A.R., and Aharoni, A.
Subcellular localization and compartmentation of thi
(2013) Orchestration of thiamin biosynthesis and central
amine derivatives in rat brain, Biochim. Biophys. Acta,
metabolism by combined action of the thiamin pyrophos
1222, 1-6, doi: 10.1016/0167 4889(94)90018 3.
phate riboswitch and the circadian clock in Arabidopsis,
37.
Gangolf, M., Wins, P., Thiry, M., El Moualij, B., and
Plant Cell, 25, 288-307, doi: 10.1105/tpc.112.106385.
Bettendorff, L. (2010) Thiamine triphosphate synthesis in
22.
Kim, S., Rhee, J.K., Yoo, H.J., Lee, H.J., Lee, E.J., Lee, J.W.,
rat brain occurs in mitochondria and is coupled to the res
Yu, J.H., Son, B.H., Gong, G., Kim, S.B., Singh, S.R.,
piratory chain, J. Biol. Chem., 285, 583-594, doi:
Ahn, S.H., and Chang, S. (2015) Bioinformatic and
10.1074/jbc.M109.054379.
metabolomic analysis reveals miR 155 regulates thiamine
38.
Mayr, J.A., Freisinger, P., Schlachter, K., Rolinski, B.,
level in breast cancer, Cancer Lett., 357, 488-497, doi:
Zimmermann, F.A., Scheffner, T., Haack, T.B., Koch, J.,
10.1016/j.canlet.2014.11.058.
Ahting, U., Prokisch, H., and Sperl, W. (2011) Thiamine
23.
McLure, K.G., Takagi, M., and Kastan, M.B. (2004)
pyrophosphokinase deficiency in encephalopathic children
NAD+ modulates p53 DNA binding specificity and func
with defects in the pyruvate oxidation pathway, Am. J. Hum.
tion, Mol. Cell Biol., 24, 9958-9967, doi: 10.1128/MCB.
Genet., 89, 806-812, doi: 10.1016/j.ajhg.2011.11.007.
24.22.9958 9967.2004.
39.
Banka, S., de Goede, C., Yue, W.W., Morris, A.A., von
24.
Lo, P.K., Chen, J.Y., Tang, P.P., Lin, J., Lin, C.H., Su, L.T.,
Bremen, B., Chandler, K.E., Feichtinger, R.G., Hart, C.,
Wu, C.H., Chen, T.L., Yang, Y., and Wang, F.F. (2001)
Khan, N., Lunzer, V., Matakovic, L., Marquardt, T.,
Identification of a mouse thiamine transporter gene as a
Makowski, C., Prokisch, H., Debus, O., Nosaka, K.,
direct transcriptional target for p53, J. Biol. Chem., 276,
Sonwalkar, H., Zimmermann, F.A., Sperl, W., and Mayr, J.A.
37186-37193, doi: 10.1074/jbc.M104701200.
(2014) Expanding the clinical and molecular spectrum of
25.
Cooper, J.R., Itokawa, Y., and Pincus, J.H.
(1969)
thiamine pyrophosphokinase deficiency: a treatable neuro
Thiamine triphosphate deficiency in subacute necrotizing
logical disorder caused by TPK1 mutations, Mol. Genet.
encephalomyelopathy, Science, 164, 74-75, doi: 10.1126/
Metab.,
113,
301-306, doi:
10.1016/j.ymgme.
science.164.3875.74.
2014.09.010.
26.
Pincus, J.H., Solitare, G.B., and Cooper, J.R.
(1976)
40.
Sano, S., Matsuda, Y., Miyamoto, S., and Nakagawa, H.
Thiamine triphosphate levels and histopathology.
(1984) Thiamine pyrophosphatase and nucleoside diphos
Correlation in Leigh disease, Arch. Neurol., 33, 759-763,
phatase in rat brain, Biochem. Biophys. Res. Commun., 118,
doi: 10.1001/archneur.1976.00500110027005.
292-298, doi: 10.1016/0006 291X(84)91099 4.
27.
Gigliobianco, T., Lakaye, B., Makarchikov, A.F., Wins, P.,
41.
Zebisch, M., Schafer, P., Lauble, P., and Strater, N. (2013)
and Bettendorff, L. (2008) Adenylate kinase independent
New crystal forms of NTPDase1 from the bacterium
thiamine triphosphate accumulation under severe energy
Legionella pneumophila, Acta Crystallogr. Sect. F Struct.
stress in Escherichia coli, BMC Microbiol., 8, 16, doi:
Biol. Cryst. Commun.,
69,
257-262, doi:
10.1107/
10.1186/1471 2180 8 16.
S1744309113001504.
28.
Nghiem, H.O., Bettendorff, L., and Changeux, J.P. (2000)
42.
Rindi, G., Ricci, V., Gastaldi, G., and Patrini, C. (1995)
Specific phosphorylation of Torpedo 43K rapsyn by
Intestinal alkaline phosphatase can transphosphorylate thi
endogenous kinase(s) with thiamine triphosphate as the
amin to thiamin monophosphate during intestinal trans
phosphate donor, FASEB J., 14, 543-554, doi: 10.1096/
port in the rat, Arch. Physiol. Biochem., 103, 33-38, doi:
fasebj.14.3.543.
10.3109/13813459509007560.
29.
Von Muralt, A. (1958) The role of thiamine (vitamin B1) in
43.
Zylka, M.J., Sowa, N.A., Taylor Blake, B., Twomey, M.A.,
nerve excitation, Exp. Cell Res., 14, 72-79.
Herrala, A., Voikar, V., and Vihko, P. (2008) Prostatic acid
30.
Minz, B. (1938) Sur la liberation de la vitamine B1 par le
phosphatase is an ectonucleotidase and suppresses pain by
trone isole de nerf pneumogastrique soumis a l’exitation
generating adenosine, Neuron, 60, 111-122, doi: 10.1016/
electrique, C. R. Soc. Biol., 127, 1251-1253.
j.neuron.2008.08.024.
31.
Itokawa, Y., and Cooper, J.R. (1970) Ion movements and
44.
Hurt, J.K., Coleman, J.L., Fitzpatrick, B.J., Taylor Blake, B.,
thiamine. II. The release of the vitamin from membrane
Bridges, A.S., Vihko, P., and Zylka, M.J. (2012) Prostatic
fragments, Biochim. Biophys. Acta, 196, 274-284, doi:
acid phosphatase is required for the antinociceptive effects
10.1016/0005 2736(70)90015 5.
of thiamine and benfotiamine, PLoS One, 7, e48562, doi:
32.
Tanaka, T., Yamamoto, D., Sato, T., Tanaka, S., Usui, K.,
10.1371/journal.pone.0048562.
Manabe, M., Aoki, Y., Iwashima, Y., Saito, Y., Mino, Y.,
45.
Eckert, T., and Moebus, W. (1964) On the ATP thi
and Deguchi, H. (2011) Adenosine thiamine triphosphate
aminediphosphate phosphotransferase activity in nerve tis
(AThTP) inhibits poly(ADP ribose) polymerase 1 (PARP 1)
sue. A contribution on the mechanism of nerve impulse
activity, J. Nutr. Sci. Vitaminol. (Tokyo), 57, 192-196, doi:
conduction, Hoppe Seylers Z Physiol. Chem.,
338,
10.3177/jnsv.57.192.
286-288.
33.
Mkrtchyan, G., Aleshin, V., Parkhomenko, Y., Kaehne, T.,
46.
Nishino, K., Itokawa, Y., Nishino, N., Piros, K., and
Di Salvo, M.L., Parroni, A., Contestabile, R., Vovk, A.,
Cooper, J.R. (1983) Enzyme system involved in the syn
Bettendorff, L., and Bunik, V. (2015) Molecular mecha
thesis of thiamin triphosphate. I. Purification and charac
nisms of the non coenzyme action of thiamin in brain: bio
terization of protein bound thiamin diphosphate: ATP
chemical, structural and pathway analysis, Sci. Rep., 5,
phosphoryltransferase, J. Biol. Chem., 258, 11871-11878.
12583, doi: 10.1038/srep12583.
47.
Shioda, T., Yasuda, S., Yamada, K., Yamada, M.,
34.
Rindi, G., Patrini, C., Nauti, A., Bellazzi, R., and Magni, P.
Nakazawa, A., and Kawasaki, T. (1993) Thiamin triphos
(2003) Three thiamine analogues differently alter thiamine
phate synthesizing activity of mutant cytosolic adenylate
transport and metabolism in nervous tissue: an in vivo
kinases: significance of Arg 128 for substrate specificity,
kinetic study using rats, Metab. Brain Dis., 18, 245-263,
Biochim. Biophys. Acta,
1161,
230-234, doi:
doi: 10.1023/B:MEBR.0000020187.98238.58.
10.1016/0167 4838(93)90218 G.
БИОХИМИЯ том 84 вып. 8 2019
1072
АЛЕШИН и др.
48.
Makarchikov, A.F., Wins, P., Janssen, E., Wieringa, B.,
64.
Dutta, B., Huang, W., Molero, M., Kekuda, R., Leibach, F.H.,
Grisar, T., and Bettendorff, L. (2002) Adenylate kinase 1
Devoe, L.D., Ganapathy, V., and Prasad, P.D. (1999)
knockout mice have normal thiamine triphosphate levels,
Cloning of the human thiamine transporter, a member of
Biochim. Biophys. Acta, 1592, 117-121, doi: 10.1016/
the folate transporter family, J. Biol. Chem.,
274,
S0167 4889(02)00277 X.
31925-31929, doi: 10.1074/jbc.274.45.31925.
49.
Shikata, H., Koyama, S., Egi, Y., Yamada, K., and
65.
Said, H.M., Balamurugan, K., Subramanian, V.S., and
Kawasaki, T. (1989) Cytosolic adenylate kinase catalyzes
Marchant, J.S. (2004) Expression and functional contribu
the synthesis of thiamin triphosphate from thiamin diphos
tion of hTHTR 2 in thiamin absorption in human intes
phate, Biochem. Int., 18, 933-941.
tine, Am. J. Physiol. Gastrointest. Liver Physiol., 286,
50.
Bettendorff, L., Lakaye, B., Kohn, G., and Wins, P. (2014)
G491-G498, doi: 10.1152/ajpgi.00361.2003.
Thiamine triphosphate: a ubiquitous molecule in search of
66.
Akin, L., Kurtoglu, S., Kendirci, M., Akin, M.A., and
a physiological role, Metab. Brain Dis., 29, 1069-1082,
Karakukcu, M. (2011) Does early treatment prevent deaf
doi: 10.1007/s11011 014 9509 4.
ness in thiamine responsive megaloblastic anaemia syn
51.
Gigliobianco, T., Gangolf, M., Lakaye, B., Pirson, B., von
drome? J. Clin. Res. Pediatr. Endocrinol., 3, 36-39, doi:
Ballmoos, C., Wins, P., and Bettendorff, L. (2013) An
10.4274/jcrpe.v3i1.08.
alternative role of FoF1 ATP synthase in Escherichia coli:
67.
Mendoza, R., Miller, A.D., and Overbaugh, J. (2013)
synthesis of thiamine triphosphate, Sci. Rep., 3, 1071, doi:
Disruption of thiamine uptake and growth of cells by feline
10.1038/srep01071.
leukemia virus subgroup A, J. Virol., 87, 2412-2419, doi:
52.
Makarchikov, A.F., and Chernikevich, I.P.
(1992)
10.1128/JVI.03203 12.
Purification and characterization of thiamine triphos
68.
Ortigoza Escobar, J.D., Molero Luis, M., Arias, A.,
phatase from bovine brain, Biochim. Biophys. Acta, 1117,
Oyarzabal, A., Darin, N., Serrano, M., Garcia Cazorla, A.,
326-332, doi: 10.1016/0304 4165(92)90032 P.
Tondo, M., Hernandez, M., Garcia Villoria, J., Casado, M.,
53.
Bettendorff, L., Michel Cahay, C., Grandfils, C., De
Gort, L., Mayr, J.A., Rodriguez Pombo, P., Ribes, A.,
Rycker, C., and Schoffeniels, E. (1987) Thiamine triphos
Artuch, R., and Perez Duenas, B. (2016) Free thiamine is
phate and membrane associated thiamine phosphatases in
a potential biomarker of thiamine transporter 2 deficiency:
the electric organ of Electrophorus electricus,
a treatable cause of Leigh syndrome, Brain, 139, 31-38,
J. Neurochem., 49, 495-502, doi: 10.1111/j.1471 4159.
doi: 10.1093/brain/awv342.
1987.tb02891.x.
69.
Alfadhel, M. (2017) Early infantile leigh like SLC19A3
54.
Suryo Rahmanto, Y., Dunn, L.L., and Richardson, D.R.
gene defects have a poor prognosis: report and review, J.
(2007) Identification of distinct changes in gene expression
Cent. Nerv. Syst. Dis., 9, 1179573517737521, doi: 10.1177/
after modulation of melanoma tumor antigen p97 (melano
1179573517737521.
transferrin) in multiple models in vitro and in vivo,
70.
Zhang, K., Huentelman, M.J., Rao, F., Sun, E.I.,
Carcinogenesis, 28, 2172-2183, doi: 10.1093/carcin/bgm096.
Corneveaux, J.J., Schork, A.J., Wei, Z., Waalen, J.,
55.
Murata, K. (1982) Actions of two types of thiaminase on
Miramontes Gonzalez, J.P., Hightower, C.M., Maihofer, A.X.,
thiamin and its analogues, Ann. N. Y. Acad. Sci., 378,
Mahata, M., Pastinen, T., Ehret, G.B., International
146-156, doi: 10.1111/j.1749 6632.1982.tb31193.x.
Consortium for Blood Pressure Genome Wide Association
56.
Jenkins, A.H., Schyns, G., Potot, S., Sun, G., and Begley, T.P.
Studies, Schork, N.J., Eskin, E., Nievergelt, C.M., Saier,
(2007) A new thiamin salvage pathway, Nat. Chem. Biol., 3,
M.H., Jr., and O’Connor, D.T. (2014) Genetic implication
492-497, doi: 10.1038/nchembio.2007.13.
of a novel thiamine transporter in human hypertension,
57.
Петров С.А. (1992) Метаболизм тиамина в органах и
J. Am. Coll. Cardiol., 63, 1542-1555, doi: 10.1016/
тканях мыши in vivo и in vitro, Физиологический журнал,
j.jacc.2014.01.007.
38, 79-75.
71.
Subramanian, V.S., Nabokina, S.M., Lin Moshier, Y.,
58.
Matsuo, T., and Suzuoki, Z. (1969) The occurrence of
Marchant, J.S., and Said, H.M. (2013) Mitochondrial
4 methylthiazole 5 acetic acid as a thiamine metabolite in
uptake of thiamin pyrophosphate: physiological and cell
rabbit, dog, man and rat, J. Biochem., 65, 953-960.
biological aspects, PLoS One, 8, e73503, doi: 10.1371/
59.
Nishimune, T., Watanabe, Y., Okazaki, H., and Akai, H.
journal.pone.0073503.
(2000) Thiamin is decomposed due to Anaphe spp. ento
72.
Fraccascia, P., Sniekers, M., Casteels, M., and van
mophagy in seasonal ataxia patients in Nigeria, J. Nutr.,
Veldhoven, P.P. (2007) Presence of thiamine pyrophos
130, 1625-1628, doi: 10.1093/jn/130.6.1625.
phate in mammalian peroxisomes, BMC Biochem., 8, 10,
60.
Bos, M., and Kozik, A. (2000) Some molecular and enzy
doi: 10.1186/1471 2091 8 10.
matic properties of a homogeneous preparation of thiami
73.
Nabokina, S.M., Inoue, K., Subramanian, V.S., Valle, J.E.,
nase I purified from carp liver, J. Protein Chem., 19, 75-84,
Yuasa, H., and Said, H.M. (2014) Molecular identification
doi: 10.1023/A:1007043530616.
and functional characterization of the human colonic thi
61.
Vimokesant, S.L., Hilker, D.M., Nakornchai, S.,
amine pyrophosphate transporter, J. Biol. Chem., 289,
Rungruangsak, K., and Dhanamitta, S. (1975) Effects of
4405-4416, doi: 10.1074/jbc.M113.528257.
betel nut and fermented fish on the thiamin status of north
74.
Lemos, C., Faria, A., Meireles, M., Martel, F., Monteiro, R.,
eastern Thais, Am. J. Clin. Nutr., 28, 1458-1463, doi:
and Calhau, C. (2012) Thiamine is a substrate of organic
10.1093/ajcn/28.12.1458.
cation transporters in Caco 2 cells, Eur. J. Pharmacol.,
62.
Law, R.H., Zhang, Q., McGowan, S., Buckle, A.M.,
682, 37-42, doi: 10.1016/j.ejphar.2012.02.028.
Silverman, G.A., Wong, W., Rosado, C.J., Langendorf, C.G.,
75.
Chen, L., Shu, Y., Liang, X., Chen, E.C., Yee, S.W., Zur, A.A.,
Pike, R.N., Bird, P.I., and Whisstock, J.C. (2006) An
Li, S., Xu, L., Keshari, K.R., Lin, M.J., Chien, H.C.,
overview of the serpin superfamily, Genome Biol., 7, 216,
Zhang, Y., Morrissey, K.M., Liu, J., Ostrem, J., Younger, N.S.,
doi: 10.1186/gb 2006 7 5 216.
Kurhanewicz, J., Shokat, K.M., Ashrafi, K., and
63.
Huertas Gonzalez, N., Hernando Requejo, V., Luciano
Giacomini, K.M. (2014) OCT1 is a high capacity thi
Garcia, Z., and Cervera Rodilla, J.L. (2015) Wernicke’s
amine transporter that regulates hepatic steatosis and is a
encephalopathy, wet beriberi, and polyneuropathy in a
target of metformin, Proc. Natl. Acad. Sci. USA, 111,
patient with folate and thiamine deficiency related to gas
9983-9988, doi: 10.1073/pnas.1314939111.
tric phytobezoar, Case Rep. Neurol. Med., 2015, 624807,
76.
Kato, K., Mori, H., Kito, T., Yokochi, M., Ito, S., Inoue, K.,
doi: 10.1155/2015/624807.
Yonezawa, A., Katsura, T., Kumagai, Y., Yuasa, H.,
БИОХИМИЯ том 84 вып. 8 2019
МЕХАНИЗМЫ НЕКОФЕРМЕНТНОГО ДЕЙСТВИЯ ТИАМИНА
1073
Moriyama, Y., Inui, K., Kusuhara, H., and Sugiyama, Y.
teristics of inhibitory effects exerted by biguanides and H2
(2014) Investigation of endogenous compounds for assess
blockers on human and rat organic cation transporter
ing the drug interactions in the urinary excretion involving
mediated transport: insight into the development of drug
multidrug and toxin extrusion proteins, Pharm. Res., 31,
candidates, Xenobiotica, 37, 618-634, doi: 10.1080/
136-147, doi: 10.1007/s11095 013 1144 y.
00498250701397705.
77.
Zhao, R., Gao, F., Wang, Y., Diaz, G.A., Gelb, B.D., and
90. Osiezagha, K., Ali, S., Freeman, C., Barker, N.C., Jabeen, S.,
Goldman, I.D. (2001) Impact of the reduced folate carrier
Maitra, S., Olagbemiro, Y., Richie, W., and Bailey, R.K.
on the accumulation of active thiamin metabolites in
(2013) Thiamine deficiency and delirium, Innov. Clin.
murine leukemia cells, J. Biol. Chem., 276, 1114-1118,
Neurosci., 10, 26-32.
doi: 10.1074/jbc.M007919200.
91. Miralles Linares, F., Puerta Fernandez, S., Bernal
78.
Tanihara, Y., Masuda, S., Sato, T., Katsura, T., Ogawa, O.,
Lopez, M.R., Tinahones, F.J., Andrade, R.J., and Gomez
and Inui, K. (2007) Substrate specificity of MATE1 and
Huelgas, R. (2012) Metformin induced hepatotoxicity,
MATE2 K, human multidrug and toxin extrusions/H+
Diabetes Care, 35, e21, doi: 10.2337/dc11 2306.
organic cation antiporters, Biochem. Pharmacol., 74,
92. Kalantar Zadeh, K., and Kovesdy, C.P. (2016) Should
359-371, doi: 10.1016/j.bcp.2007.04.010.
restrictions be relaxed for metformin use in chronic kidney
79.
Liu, S., Huang, H., Lu, X., Golinski, M., Comesse, S.,
disease? No, we should never again compromise safety!
Watt, D., Grossman, R.B., and Moscow, J.A. (2003)
Diabetes Care, 39, 1281-1286, doi: 10.2337/dc15 2327.
Down regulation of thiamine transporter THTR2 gene
93. Toyama, K., Yonezawa, A., Masuda, S., Osawa, R.,
expression in breast cancer and its association with resis
Hosokawa, M., Fujimoto, S., Inagaki, N., Inui, K., and
tance to apoptosis, Mol. Cancer Res., 1, 665-673.
Katsura, T. (2012) Loss of multidrug and toxin extrusion 1
80.
Liu, X., Lam, E.K., Wang, X., Zhang, J., Cheng, Y.Y.,
(MATE1) is associated with metformin induced lactic aci
Lam, Y.W., Ng, E.K., Yu, J., Chan, F.K., Jin, H., and
dosis, Br. J. Pharmacol., 166, 1183-1191, doi: 10.1111/
Sung, J.J. (2009) Promoter hypermethylation mediates
j.1476 5381.2012.01853.x.
downregulation of thiamine receptor SLC19A3 in gastric
94. Vecchio, S., and Protti, A. (2011) Metformin induced lac
cancer, Tumour Biol.,
30,
242-248, doi:
10.1159/
tic acidosis: no one left behind, Crit. Care, 15, 107, doi:
000243767.
10.1186/cc9404.
81.
Ikehata, M., Ueda, K., and Iwakawa, S. (2012) Different
95. Amrein, K., Ribitsch, W., Otto, R., Worm, H.C., and
involvement of DNA methylation and histone deacetyla
Stauber, R.E. (2011) Severe lactic acidosis reversed by thi
tion in the expression of solute carrier transporters in
amine within
24 hours, Crit. Care,
15,
457, doi:
4 colon cancer cell lines, Biol. Pharm. Bull., 35, 301-307,
10.1186/cc10495.
doi: 10.1248/bpb.35.301.
96. Godo, S., Yoshida, Y., Fujita, M., Kudo, D., Nomura, R.,
82.
Zastre, J.A., Sweet, R.L., Hanberry, B.S., and Ye, S. (2013)
Shimokawa, H., and Kushimoto, S. (2017) The dramatic
Linking vitamin B1 with cancer cell metabolism, Cancer
recovery of a patient with biguanide associated severe lactic
Metab., 1, 16, doi: 10.1186/2049 3002 1 16.
acidosis following thiamine supplementation, Intern. Med.,
83.
Mkrtchyan, G., Graf, A., Bettendorff, L., and Bunik, V.
56, 455-459, doi: 10.2169/internalmedicine.56.7754.
(2016) Cellular thiamine status is coupled to function of
97. McGarvey, C., Franconi, C., Prentice, D., and Bynevelt, M.
mitochondrial 2 oxoglutarate dehydrogenase, Neurochem.
(2018) Metformin induced encephalopathy: the role of
Int., 101, 66-75, doi: 10.1016/j.neuint.2016.10.009.
thiamine, Intern. Med. J., 48, 194-197, doi: 10.1111/
84.
Daily, A., Liu, S., Bae, Y., Bhatnagar, S., and Moscow, J.A.
imj.13693.
(2011) Linear chain PEGylated recombinant Bacillus thi(
98. Costantini, A. (2018) High dose thiamine and essential
aminolyticus thiaminase I enzyme has growth inhibitory
tremor, BMJ Case Rep., 2018, doi: 10.1136/bcr 2017
activity against lymphoid leukemia cell lines, Mol. Cancer
223945.
Ther., 10, 1563-1570, doi: 10.1158/1535 7163.MCT 11
99. Page, G.L., Laight, D., and Cummings, M.H. (2011)
0003.
Thiamine deficiency in diabetes mellitus and the impact of
85.
Liu, S., Stromberg, A., Tai, H.H., and Moscow, J.A. (2004)
thiamine replacement on glucose metabolism and vascular
Thiamine transporter gene expression and exogenous thi
disease, Int. J. Clin. Pract., 65, 684-690, doi: 10.1111/
amine modulate the expression of genes involved in drug
j.1742 1241.2011.02680.x.
and prostaglandin metabolism in breast cancer cells, Mol.
100. Moraes, J.O., Rodrigues, S.D.C., Pereira, L.M., Medeiros,
Cancer Res., 2, 477-487.
R.d.C.N., de Cordova, C.A.S., and de Cordova, F.M.
86.
Liang, X., Chien, H.C., Yee, S.W., Giacomini, M.M.,
(2018) Amprolium exposure alters mice behavior and
Chen, E.C., Piao, M., Hao, J., Twelves, J., Lepist, E.I.,
metabolism in vivo, Animal Model Exp. Med., 1, 272-281,
Ray, A.S., and Giacomini, K.M. (2015) Metformin is a
doi: 10.1002/ame2.12040.
substrate and inhibitor of the human thiamine transporter,
101. Singh, V., Peng, C.S., Li, D., Mitra, K., Silvestre, K.J.,
THTR 2 (SLC19A3), Mol. Pharm., 12, 4301-4310, doi:
Tokmakoff, A., and Essigmann, J.M. (2014) Direct obser
10.1021/acs.molpharmaceut.5b00501.
vation of multiple tautomers of oxythiamine and their
87.
Kimura, N., Masuda, S., Tanihara, Y., Ueo, H., Okuda, M.,
recognition by the thiamine pyrophosphate riboswitch,
Katsura, T., and Inui, K. (2005) Metformin is a superior
ACS Chem. Biol., 9, 227-236, doi: 10.1021/cb400581f.
substrate for renal organic cation transporter OCT2 rather
102. Hirsch, J.A., and Parrott, J. (2012) New considerations on
than hepatic OCT1, Drug Metab. Pharmacokinet., 20,
the neuromodulatory role of thiamine, Pharmacology, 89,
379-386, doi: 10.2133/dmpk.20.379.
111-116, doi: 10.1159/000336339.
88.
Liang, X., Yee, S.W., Chien, H.C., Chen, E.C., Luo, Q.,
103. Aleshin, V.A., Artiukhov, A.V., Oppermann, H., Kazantsev, A.V.,
Zou, L., Piao, M., Mifune, A., Chen, L., Calvert, M.E.,
Lukashev, N.V., and Bunik, V.I. (2015) Mitochondrial
King, S., Norheim, F., Abad, J., Krauss, R.M., and
impairment may increase cellular NAD(P)H: resazurin
Giacomini, K.M. (2018) Organic cation transporter 1
oxidoreductase activity, perturbing the NAD(P)H based
(OCT1) modulates multiple cardiometabolic traits through
viability assays, Cells,
4,
427-451, doi:
10.3390/
effects on hepatic thiamine content, PLoS Biol., 16,
cells4030427.
e2002907, doi: 10.1371/journal.pbio.2002907.
104. Fukui, S., Ohishi, N., Kishimotostakamizaw, A., and
89.
Umehara, K.I., Iwatsubo, T., Noguchi, K., and
Hamazima, Y. (1965) Formation of «thiaminosuccinic
Kamimura, H. (2007) Comparison of the kinetic charac
acid» as an intermediate in the transformation of oxythi
БИОХИМИЯ том 84 вып. 8 2019
1074
АЛЕШИН и др.
amine to thiamine by a thiamineless mutant of Escherichia
119. Мкртчян Г. (2017) Молекулярные механизмы действия
coli, J. Biol. Chem., 240, 1315-1321.
тиамина (витамина В1) в нервной ткани, МГУ
105. Goyer, A., Hasnain, G., Frelin, O., Ralat, M.A.,
им. М.В. Ломоносова, Москва.
Gregory, J.F., 3rd, and Hanson, A.D. (2013) A cross king
120. Tsepkova, P.M., Artiukhov, A.V., Boyko, A.I., Aleshin, V.A.,
dom Nudix enzyme that pre empts damage in thiamin
Mkrtchyan, G.V., Zvyagintseva, M.A., Ryabov, S.I.,
metabolism, Biochem. J., 454, 533-542, doi: 10.1042/
Ksenofontov, A.L., Baratova, L.A., Graf, A.V., and Bunik, V.I.
BJ20130516.
(2017) Thiamine induces long term changes in amino acid
106. Zhang, F., Masania, J., Anwar, A., Xue, M., Zehnder, D.,
profiles and activities of 2 oxoglutarate and 2 oxoadipate
Kanji, H., Rabbani, N., and Thornalley, P.J. (2016) The
dehydrogenases in rat brain, Biochemistry (Moscow), 82,
uremic toxin oxythiamine causes functional thiamine defi
723-736, doi: 10.1134/S0006297917060098.
ciency in end stage renal disease by inhibiting transketo
121. Петров С.А., Донеско Е.В. (1989) Эффект тиамина и
lase activity, Kidney Int., 90, 396-403, doi: 10.1016/j.kint.
его метаболитов на активность аминотрансфераз ас
2016.03.010.
партата и аланина в организме белых крыс и в крови
107. Linster, C.L., van Schaftingen, E., and Hanson, A.D.
доноров, Физиологический журнал, 35, 94-96.
(2013) Metabolite damage and its repair or pre emption,
122. Singh, M., Kaur, M., Kukreja, H., Chugh, R., Silakari, O., and
Nat. Chem. Biol., 9, 72-80, doi: 10.1038/nchembio.1141.
Singh, D. (2013) Acetylcholinesterase inhibitors as Alzheimer
108. Nemeria, N.S., Shome, B., DeColli, A.A., Heflin, K.,
therapy: from nerve toxins to neuroprotection, Eur. J. Med.
Begley, T.P., Meyers, C.F., and Jordan, F.
(2016)
Chem., 70, 165-188, doi: 10.1016/j.ejmech.2013.09.050.
Competence of thiamin diphosphate dependent enzymes
123. Lonsdale, D. (2004) Thiamine tetrahydrofurfuryl disulfide:
with
2’ methoxythiamin diphosphate derived from
a little known therapeutic agent, Med. Sci. Monit., 10,
bacimethrin, a naturally occurring thiamin anti vitamin,
RA199-RA203.
Biochemistry, 55, 1135-1148, doi: 10.1021/acs.biochem.
124. Tapias, V., Jainuddin, S., Ahuja, M., Stack, C., Elipenahli, C.,
5b01300.
Vignisse, J., Gerges, M., Starkova, N., Xu, H., Starkov, A.A.,
109. Agyei Owusu, K., and Leeper, F.J. (2009) Thiamin diphos
Bettendorff, L., Hushpulian, D.M., Smirnova, N.A.,
phate in biological chemistry: analogues of thiamin diphos
Gazaryan, I.G., Kaidery, N.A., Wakade, S., Calingasan, N.Y.,
phate in studies of enzymes and riboswitches, FEBS J.,
Thomas, B., Gibson, G.E., Dumont, M., and Beal, M.F.
276, 2905-2916, doi: 10.1111/j.1742 4658.2009.07018.x.
(2018) Benfotiamine treatment activates the Nrf2/ARE
110. Iwadate, D., Sato, K., Kanzaki, M., Komiyama, C.,
pathway and is neuroprotective in a transgenic mouse
Watanabe, C., Eguchi, T., and Uesaka, Y. (2017) Thiamine
model of tauopathy, Hum. Mol. Genet., 27, 2874-2892,
deficiency in metronidazole induced encephalopathy: a
doi: 10.1093/hmg/ddy201.
metabolic correlation? J .Neurol. Sci., 379, 324-326, doi:
125. Gibson, G.E., Hirsch, J.A., Fonzetti, P., Jordan, B.D.,
10.1016/j.jns.2017.06.042.
Cirio, R.T., and Elder, J. (2016) Vitamin B1 (thiamine) and
111.
Ding, B.C., Whetstine, J.R., Witt, T.L., Schuetz, J.D., and
dementia, Ann. N. Y. Acad. Sci., 1367, 21-30, doi:
Matherly, L.H. (2001) Repression of human reduced folate
10.1111/nyas.13031.
carrier gene expression by wild type p53, J. Biol. Chem.,
126. Volvert, M.L., Seyen, S., Piette, M., Evrard, B., Gangolf, M.,
276, 8713-8719, doi: 10.1074/jbc.M005248200.
Plumier, J.C., and Bettendorff, L. (2008) Benfotiamine, a
112. Yang, Z., Ge, J., Yin, W., Shen, H., Liu, H., and Guo, Y.
synthetic S acyl thiamine derivative, has different mecha
(2004) The expression of p53, MDM2 and Ref1 gene in
nisms of action and a different pharmacological profile
cultured retina neurons of SD rats treated with vitamin B1
than lipid soluble thiamine disulfide derivatives, BMC
and/or elevated pressure, Yan Ke Xue Bao, 20, 259-263.
Pharmacol., 8, 10, doi: 10.1186/1471 2210 8 10.
113. Chornyy, S., Parkhomenko, Y., and Chorna, N. (2017)
127. Vignisse, J., Sambon, M., Gorlova, A., Pavlov, D., Caron, N.,
Thiamine antagonists trigger p53 dependent apoptosis in
Malgrange, B., Shevtsova, E., Svistunov, A., Anthony, D.C.,
differentiated SH SY5Y cells, Sci. Rep., 7, 10632, doi:
Markova, N., Bazhenova, N., Coumans, B., Lakaye, B.,
10.1038/s41598 017 10878 x.
Wins, P., Strekalova, T., and Bettendorff, L.
(2017)
114. Pagadala, N.S., Bjorndahl, T.C., Blinov, N., Kovalenko, A.,
Thiamine and benfotiamine prevent stress induced sup
and Wishart, D.S. (2013) Molecular docking of thiamine
pression of hippocampal neurogenesis in mice exposed to
reveals similarity in binding properties between the prion
predation without affecting brain thiamine diphosphate
protein and other thiamine binding proteins, J. Mol.
levels, Mol. Cell Neurosci., 82, 126-136, doi: 10.1016/
Model., 19, 5225-5235, doi: 10.1007/s00894 013 1979 5.
j.mcn.2017.05.005.
115. Perez Pineiro, R., Bjorndahl, T.C., Berjanskii, M.V., Hau, D.,
128. Mouton Liger, F., Rebillat, A.S., Gourmaud, S., Paquet, C.,
Li, L., Huang, A., Lee, R., Gibbs, E., Ladner, C., Dong, Y.W.,
Leguen, A., Dumurgier, J., Bernadelli, P., Taupin, V.,
Abera, A., Cashman, N.R., and Wishart, D.S. (2011) The
Pradier, L., Rooney, T., and Hugon, J. (2015) PKR down
prion protein binds thiamine, FEBS J., 278, 4002-4014,
regulation prevents neurodegeneration and β amyloid pro
doi: 10.1111/j.1742 4658.2011.08304.x.
duction in a thiamine deficient model, Cell Death Dis., 6,
116. Pulkkinen, V., Manson, M.L., Safholm, J., Adner, M., and
e1594, doi: 10.1038/cddis.2014.552.
Dahlen, S.E. (2012) The bitter taste receptor (TAS2R)
129. Sun, X.J., Zhao, L., Zhao, N., Pan, X.L., Fei, G.Q., Jin, L.R.,
agonists denatonium and chloroquine display distinct pat
and Zhong, C.J. (2012) Benfotiamine prevents increased
terns of relaxation of the guinea pig trachea, Am. J. Physiol.
β amyloid production in HEK cells induced by high glu
Lung Cell Mol. Physiol., 303, L956-L966, doi: 10.1152/
cose, Neurosci. Bull., 28, 561-566, doi: 10.1007/ s12264
ajplung.00205.2012.
012 1264 0.
117. Lossow, K., Hubner, S., Roudnitzky, N., Slack, J.P.,
130. Zhang, X., Hernandez, I., Rei, D., Mair, W., Laha, J.K.,
Pollastro, F., Behrens, M., and Meyerhof, W.
(2016)
Cornwell, M.E., Cuny, G.D., Tsai, L.H., Steen, J.A., and
Comprehensive analysis of mouse bitter taste receptors
Kosik, K.S. (2013) Diaminothiazoles modify Tau phospho
reveals different molecular receptive ranges for orthologous
rylation and improve the tauopathy in mouse models, J. Biol.
receptors in mice and humans, J. Biol. Chem., 291,
Chem., 288, 22042-22056, doi: 10.1074/jbc.M112. 436402.
15358-15377, doi: 10.1074/jbc.M116.718544.
131. Markova, N., Bazhenova, N., Anthony, D.C., Vignisse, J.,
118. Lucas, J.I., and Marin, I. (2007) A new evolutionary para
Svistunov, A., Lesch, K.P., Bettendorff, L., and Strekalova, T.
digm for the Parkinson disease gene DJ(1, Mol. Biol. Evol.,
(2017) Thiamine and benfotiamine improve cognition and
24, 551-561, doi: 10.1093/molbev/msl186.
ameliorate GSK 3β associated stress induced behaviours
БИОХИМИЯ том 84 вып. 8 2019
МЕХАНИЗМЫ НЕКОФЕРМЕНТНОГО ДЕЙСТВИЯ ТИАМИНА
1075
in mice, Prog. Neuropsychopharmacol. Biol. Psychiatry, 75,
136. Mizuno, Y., Matuda, S., Yoshino, H., Mori, H., Hattori, N.,
148-156, doi: 10.1016/j.pnpbp.2016.11. 001.
and Ikebe, S. (1994) An immunohistochemical study on
132. Gold, M., Hauser, R.A., and Chen, M.F. (1998) Plasma
α ketoglutarate dehydrogenase complex in Parkinson’s
thiamine deficiency associated with Alzheimer’s disease
disease, Ann. Neurol., 35, 204-210, doi: 10.1002/ana.
but not Parkinson’s disease, Metab. Brain Dis., 13, 43-53,
410350212.
doi: 10.1023/A:1020678912330.
137. Haglin, L., Johansson, I., Forsgren, L., and Backman, L.
133. Pan, X., Fei, G., Lu, J., Jin, L., Pan, S., Chen, Z., Wang, C.,
(2017) Intake of vitamin B before onset of Parkinson’s dis
Sang, S., Liu, H., Hu, W., Zhang, H., Wang, H., Wang, Z.,
ease and atypical parkinsonism and olfactory function at
Tan, Q., Qin, Y., Zhang, Q., Xie, X., Ji, Y., Cui, D., Gu, X.,
the time of diagnosis, Eur. J. Clin. Nutr., 71, 97-102, doi:
Xu, J., Yu, Y., and Zhong, C. (2016) Measurement of blood
10.1038/ejcn.2016.181.
thiamine metabolites for Alzheimer’s disease diagnosis,
138. Boyko, A., Ksenofontov, A., Ryabov, S., Baratova, L.,
EBioMedicine,
3,
155-162,
doi:
10.1016/
Graf, A., and Bunik, V. (2017) Delayed influence of spinal
j.ebiom.2015.11.039.
cord injury on the amino acids of NO· metabolism in rat
134. Pan, X., Sang, S., Fei, G., Jin, L., Liu, H., Wang, Z.,
cerebral cortex is attenuated by thiamine, Front. Med.
Wang, H., and Zhong, C. (2017) Enhanced activities of
(Lausanne), 4, 249, doi: 10.3389/fmed.2017.00249.
blood thiamine diphosphatase and monophosphatase in
139. Mkrtchyan, G.V., Ucal, M., Mullebner, A., Dumitrescu, S.,
Alzheimer’s disease, PLoS One, 12, e0167273, doi:
Kames, M., Moldzio, R., Molcanyi, M., Schaefer, S.,
10.1371/journal.pone.0167273.
Weidinger, A., Schaefer, U., Hescheler, J., Duvigneau, J.C.,
135. Jimenez Jimenez, F.J., Molina, J.A., Hernanz, A.,
Redl, H., Bunik, V.I., and Kozlov, A.V. (2018) Thiamine
Fernandez Vivancos, E., de Bustos, F., Barcenilla, B.,
preserves mitochondrial function in a rat model of trau
Gomez Escalonilla, C., Zurdo, M., Berbel, A., and
matic brain injury, preventing inactivation of the 2 oxoglu
Villanueva, C. (1999) Cerebrospinal fluid levels of thiamine
tarate dehydrogenase complex, Biochim. Biophys. Acta
in patients with Parkinson’s disease, Neurosci. Lett., 271,
Bioenerg.,
1859,
925-931, doi:
10.1016/j.bbabio.
33-36, doi: 10.1016/S0304 3940(99)00515 7.
2018.05.005.
MECHANISMS OF THE NON;COENZYME ACTION OF THIAMINE:
PROTEIN TARGETS AND MEDICAL SIGNIFICANCE
V. A. Aleshin1,2, G. V. Mkrtchyan1, and V. I. Bunik1,2*
1 Lomonosov Moscow State University, Faculty of Bioengineering and Bioinformatics, 119991 Moscow, Russia
2 Belozersky Institute of Physico(Chemical Biology, Lomonosov Moscow State University,
199991 Moscow, Russia; E(mail: bunik@belozersky.msu.ru
Received December 27, 2018
Revised April 7, 2019
Accepted April 7, 2019
Thiamine (vitamin B1) is a precursor of a well known coenzyme of central metabolism, thiamine diphosphate
(ThDP). A very high intensity of ThDP dependent energy production from glucose in brain determines critical sig
nificance of thiamine for neuronal functions. However, non coenzyme mechanisms of thiamine action have been
characterized as well. The long known facilitation of acetylcholinergic neurotransmission upon the co release of thi
amine and acetylcholine into synaptic cleft is currently supported at molecular level by the thiamine triphosphate
(ThTP) dependent phosphorylation of the acetylcholine receptor binding protein rapsin and by the thiamine inter
action with receptor TAS2R1, activating synaptic ion currents. Non coenzyme type of regulatory binding of thiamine
compounds is also established for transcriptional regulator p53, poly(ADP ribose) polymerase, prion protein PRNP
and a number of key metabolic enzymes which do not use ThDP as a coenzyme. The reviewed results indicate that
molecular mechanisms of the neurotropic action of thiamine are much more diverse than usually considered. These
mechanisms are intimately linked to metabolism of thiamine and its derivatives in animals that is also summarized in
the review. Newly acquired significance of this topic is demonstrated by the recently established competition of thi
amine and antidiabetic drug metformin for their common transporters. The competition may cause thiamine defi
ciency underlying known side effects of metformin. Medical implications of basic research on thiamine are high
lighted, regarding the role of thiaminases in the thiamine reutilization and biosynthesis of thiamine antagonists; mo
lecular mechanisms of action of natural and synthetic thiamine antagonists; biotransformation of pharmacological
forms of thiamine. Given the wide pharmacological application of thiamine and its synthetic forms, the reviewed data
are of high importance for medicine and pharmacology, including therapy of neurodegenerative diseases.
Keywords: metformin, p53, serpin, thiamine, thiamine transport, thiaminase, vitamin B1
БИОХИМИЯ том 84 вып. 8 2019