БИОХИМИЯ, 2019, том 84, вып. 8, с. 1076 - 1098
УДК 577.112.7
РНК (ЦИТОЗИН С5) МЕТИЛТРАНСФЕРАЗЫ
Обзор
© 2019
С.А. Кузнецова1*#, К.С. Петрюков2*#, Ф.И. Плетнев2,3,4,
П.В. Сергиев1,2,3,5, О.А. Донцова2,3,4
1 Институт функциональной геномики, Московский государственный
университет им. М.В. Ломоносова, 119991 Москва, Россия;
электронная почта: svetlana@belozersky.msu.ru
2 Московский государственный университет им. М.В. Ломоносова,
химический факультет, 119991 Москва, Россия;
электронная почта: kirill(petriukov@mail.ru
3 Сколковский институт науки и технологий,
121205 Московская область, Сколково
4 Институт биоорганической химии, 117997 Москва, Россия
5 НМИЦ онкологии им. И.И. Петрова, 197758 Санкт(Петербург, Россия
Поступила в редакцию 05.03.2019
После доработки 16.04.2019
Принята к публикации 16.04.2019
Обобщены сведения о результатах и достижениях в области исследований про и эукариотических РНК
(цитозин С5) метилтрансфераз. Описываются их структуры, внутриклеточная локализация, РНК мишени
и механизмы каталитического действия, а также функциональная роль метилированных остатков цитозина
в РНК и функции РНК (цитозин С5) метилтрансфераз в клетке, не связанные с метилированием. Особое
внимание уделено анализу сходства и различий в структуре и механизме действия РНК и ДНК метилтранс
фераз. Приводятся данные о связи мутаций в генах РНК (цитозин С5) метилтрансфераз с заболеваниями
человека.
КЛЮЧЕВЫЕ СЛОВА: посттранскрипционная модификация РНК, РНК (цитозин С5) метилтрансферазы,
5 метилцитозин, метилирование РНК.
DOI: 10.1134/S0320972519080025
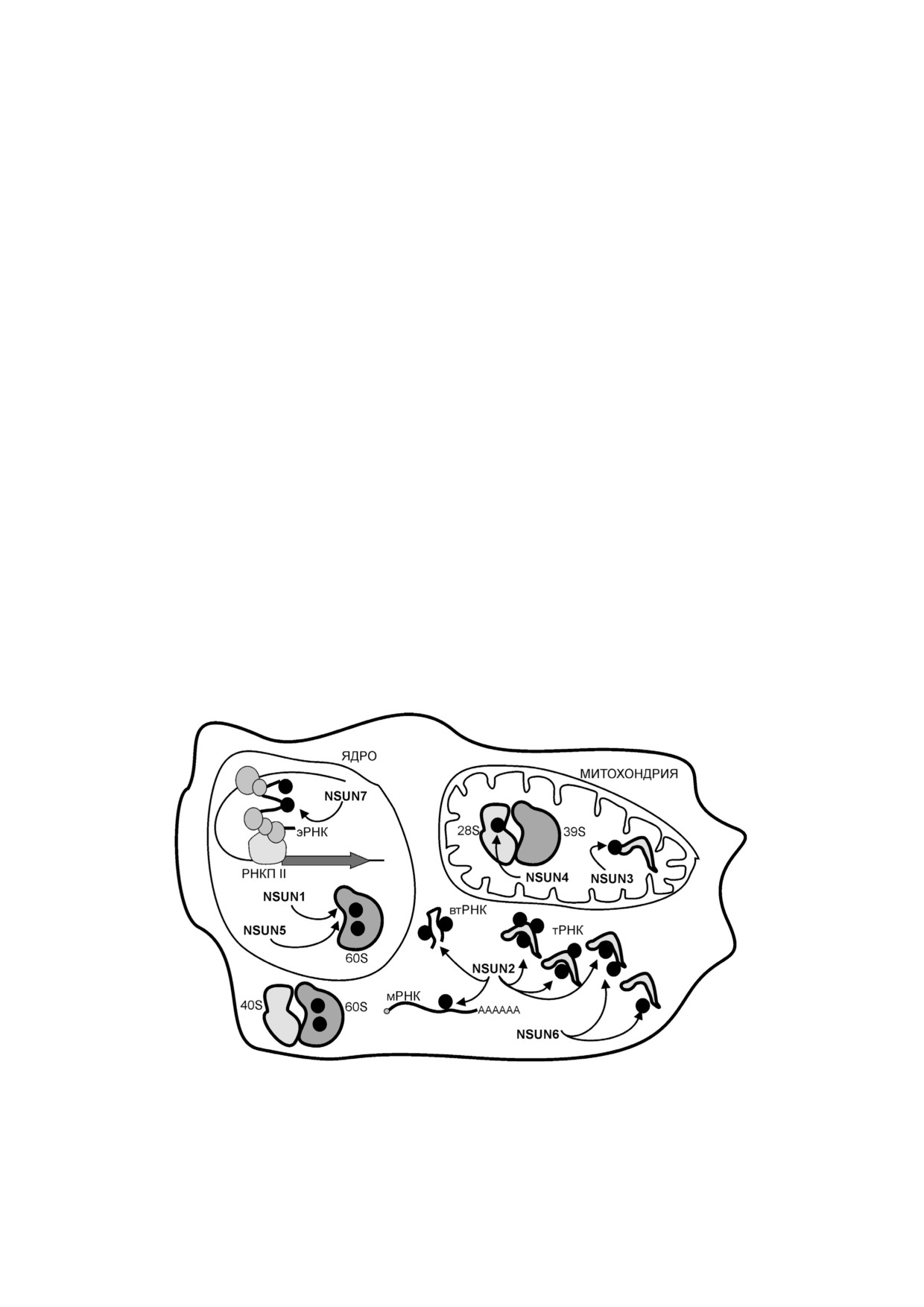
Посттранскрипционная модификация РНК
изучающей влияние различных модификаций
является фундаментальным клеточным процес
РНК на регуляцию различных функций орга
сом, занимающим важнейшее место в жизнеде
низма, был введен специальный термин «эпи
ятельности живых организмов. К настоящему
транскриптомика».
времени описано более 160 модификаций РНК,
Модификации в РНК затрагивают как остат
и их количество постоянно увеличивается [1].
ки рибозы, так и гетероциклические основания.
Они присутствуют во всех типах РНК, но наибо
Одним из распространенных модифицирован
лее часто встречаются в молекулах тРНК и
ных оснований РНК является 5 метилцитозин
рРНК. В последние годы значительное внима
(m5C). В то время как в ДНК функциональная
ние уделяется изучению модификаций и их
роль m5C детально изучена, его роль в РНК ясна
функциональной роли в мРНК, поскольку они,
не до конца. В бактериях 5 метилцитозин со
подобно модификациям гистонов и ДНК, опре
держится исключительно в рРНК, в археях и эу
деляющим структуру хроматина, обуславливают
кариотах он встречается также в тРНК, мРНК и
еще один уровень регуляции экспрессии генов.
различных некодирующих РНК. Несмотря на
Посттранскрипционная модификация РНК, не
небольшой размер и гидрофобную природу, ме
изменяя последовательности транскрипта, мо
тильная группа в 5 ом положении цитозина мо
жет принципиальным образом изменять его
жет кардинальным образом изменять конфор
свойства и функциональную роль. Для соответ
мацию всей молекулы [2].
ствующей области молекулярной биологии,
Образование 5 метилцитозина в РНК про
исходит в результате метилирования цитозина
# Авторы внесли равный вклад в работу.
особой группой ферментов, названных РНК
* Адресат для корреспонденции.
(цитозин C5) метилтрансферазами (РНК C5
1076
РНК С5 МЕТИЛТРАНСФЕРАЗЫ
1077
метилтрансферазами). Аналогичные ферменты,
го относится бисульфитное секвенирование
метилирующие цитозин в молекулах ДНК
РНК [6], основанное на различной реакцион
(ДНК (цитозин C5) метилтрансферазы), в нас
ной способности метилированной и неметили
тоящее время достаточно хорошо изучены. Ус
рованной форм цитозина в реакции дезамини
тановлена ключевая роль метилирования ДНК в
рования, а также иммунопреципитация РНК с
обеспечении стабильности и целостности гено
использованием антител на m5C [7]. Кроме того,
ма, регуляции онтогенеза и клеточной диффе
ряд подходов позволяет идентифицировать ми
ренцировки, а также в подавлении экспрессии
шени РНК (цитозин С5) метилтрансфераз, ин
чужеродных последовательностей и мобильных
дуцируя образование ковалентных комплексов
элементов. Показано, что нарушение профиля
соответствующих метилтрансфераз с их РНК
метилирования ДНК приводит к хромосомным
мишенями с последующим выделением ковалент
аномалиям, являющимся основными причина
ного соединения и секвенированием совыде
ми старения и различных патологий, включая
лившихся РНК [8, 9].
комплексные заболевания, болезни геномного
В бактериях 5 метилцитозин содержится
импринтинга, нейродегенеративные расстрой
исключительно в рРНК, в то время как в археях
ства и онкологические заболевания [3].
и эукариотах данная модификация встречается
В отличие от ДНК (цитозин C5) метилтранс
также в тРНК, мРНК и различных некодирую
фераз, ферменты РНК (цитозин С5) метилтранс
щих РНК. В рРНК и тРНК 5 метилцитозин, по
феразы гораздо менее изучены [4]. Известно,
добно другим модификациям, участвует в фор
что РНК C5 метилтрансферазы являются кон
мировании третичной структуры РНК, необхо
сервативными как среди про , так и эукариоти
димой для точного протекания процесса транс
ческих организмов и проявляют сходство с
ляции. Следует отметить, что, несмотря на не
РНК (урацил С5) и ДНК (цитозин C5) метил
большой размер и гидрофобную природу, ме
трансферазами. Сведения об эукариотических
тильная группа в 5 положении цитозина может
РНК (цитозин С5) метилтрансферазах, меха
кардинальным образом изменять конформацию
низме их действия и функциях в клетке приво
всей молекулы, как это было продемонстриро
дятся в недавно опубликованой обзорной статье
вано на примере тРНК [2].
Bohnsack et al. [5].
Наличие 5 метилцитозина в эукариотиче
В данном обзоре обобщены результаты и
ских мРНК было установлено только с развити
достижения в области исследования как прока
ем широкомасштабных методов определения
риотических, так и эукариотических РНК (ци
данной модификации. Согласно последним
тозин С5) метилтрансфераз. Описаны их струк
данным, в транскриптоме клетки до 10 000 ос
туры, функции, внутриклеточная локализация,
нований цитозина в составе мРНК подвергают
РНК мишени и механизмы каталитического
ся метилированию по 5 положению [10]. Лока
действия. Особое внимание уделено анализу
лизация m5C в транскрипте чаще всего не явля
сходства и различий в структуре и механизме
ется случайной: наиболее часто он расположен в
действия РНК и ДНК метилтрансфераз. При
области стартового кодона. Эксперименты in
водятся данные о связи мутаций в генах РНК
vitro показали, что наличие m5C вблизи старто
(цитозин С5) метилтрансфераз с заболевания
вого кодона приводит к уменьшению эффектив
ми человека.
ности трансляции, в то время как наличие m1A
ассоциируют с увеличением эффективности
трансляции соответствующих мРНК [11, 12].
5 МЕТИЛЦИТОЗИН В РНК.
Интересно отметить, что существует большое
РАСПРОСТРАНЕННОСТЬ, ФУНКЦИИ
количество мРНК, которые в различных тканях
И МЕХАНИЗМЫ ОБРАЗОВАНИЯ
имеют близкий уровень экспрессии, но различ
ную картину метилирования. Так, это было про
Одной из распространенных модификаций
демонстрировано для ряда транскриптов из
гетероциклических оснований в РНК является
культуры эмбриональных стволовых клеток и
5 метилцитозин (m5C). В то время как в ДНК
ткани мозга, как образцов плюрипотентных и
функциональная роль m5C детально изучена,
высокодифференцированных клеток соответ
его роль в РНК ясна не до конца. Существенный
ственно [13]. При этом тканеспецифичному ме
прогресс в понимании распределения и функ
тилированию подвергаются транскрипты генов,
ций 5 метилцитозина в РНК произошел после
имеющих отношение к регуляции клеточного
разработки ряда широкомасштабных методов
цикла, биогенезу мРНК и структуре хроматина в
сайт специфического определения локализа
эмбриональных стволовых клетках, а также к
ции данного минорного основания в тран
внутриклеточному транспорту и развитию нерв
скриптоме клетки. К таким методам прежде все
ной системы в мозге. Это свидетельствует в
БИОХИМИЯ том 84 вып. 8 2019
1078
КУЗНЕЦОВА и др.
пользу специфической регуляторной роли ме
Первой детально охарактеризованной РНК
тилирования мРНК, точное определение кото
C5 метилтрансферазой, для которой был изучен
рой остается пока неизвестным.
механизм каталитического действия и получена
Кроме того, 5 метилцитозин встречается и в
кристаллическая структура, была бактериальная
некодирующих РНК. Так, его присутствие опи
метилтрансфераза RsmB из E. coli. Впослед
сано для широко известных некодирующих
ствии ее первичная и пространственная струк
РНК HOTAIR и XIST, причем в последней нали
тура стали основой для отнесения более 55 ее го
чие m5C изменяет ее способность связываться с
мологов к гипотетическим РНК C5 метилтранс
комплексом PRC2, основная функция которого
феразам, для многих из которых такая актив
заключается в репрессии транскрипции путем
ность была впоследствии доказана. Общей чер
метилирования гистонов [14]. Для обеих упомя
той данных метилтрансфераз является наличие
нутых некодирующих РНК взаимодействие с
метилтрансферазного домена, в то время как N
комплексом PRC2 является основным способом
и C концевые участки могут быть различными
их функционирования в процессе регуляции
[16].
структуры хроматина. Новым шагом в понима
Каталитический механизм действия РНК
нии биологической функции 5 метилцитозина
C5 метилтрансфераз приведен на рис. 1. В про
стало открытие белка регулятора ядерно ци
цессе реакции метилирования фермент образует
топлазматического транспорта ALYREF, специ
ковалентный коньюгат с РНК, в котором оста
фически узнающего m5C в составе молекул РНК
ток цистеина каталитического центра связан с
и способствующего их транспорту в цитоплазму
атомом С6 цитозина мишени. В составе такого
[15]. Таким образом, ядерно цитоплазматиче
коньюгата нуклеофильность пятого атома угле
ский транспорт становится еще одним процес
рода гетероциклического основания существен
сом, на регуляцию которого оказывает влияние
но повышается и как следствие происходит его
метилирование цитозина в составе РНК.
взаимодействие с метильной группой S адено
Образование 5 метилцитозина в РНК проис
зил L метионина (SAM), выступающего в каче
ходит в результате метилирования цитозина осо
стве кофактора, донора метильной группы, с об
бой группой ферментов, названных РНК (цито
разованием переходного интермедиата (рис. 1,
зин C5) метилтрансферазами (РНК C5 метил
структуры 2 и 3). На следующем этапе метили
трансферазами). РНК C5 метилтрансферазы
рования в результате реакции β элиминирова
являются консервативными как среди прокарио
ния происходит депротонирование пятого ато
тических, так и среди эукариотических организ
ма углерода интермедиата и восстановление
мов и часто проявляют сходство с РНК (урацил
двойной связи С5 С6 (образование 5 метилци
С5) и ДНК (цитозин C5) метилтрансферазами.
тозина) с регенерацией остатка каталитического
а
1
2
3
4
б
1
2
3
4
Рис. 1. Каталитический механизм РНК (цитозин С5) метилтрансфераз. а - Двухцистеиновый механизм, характерный
для белков семейства NOL1/Nop2/Sun; б - одноцистеиновый механизм, характерный для ДНК (цитозин С5) метилтранс
фераз и РНК (цитозин С5) метилтрансферазы DNMT2. Обозначены аминокислоты мотивов IV и VI, участвующие в ка
тализе. 1 - Нуклеофильная атака каталитического цистеина на С6 атом цитозина, 2 - перенос метильной группы кофак
тора на атом С5 цитозина, 3 - реакция β элиминирования, 4 - образование 5 метилцитозина
БИОХИМИЯ том 84 вып. 8 2019
РНК С5 МЕТИЛТРАНСФЕРАЗЫ
1079
цистеина (рис. 1, структуры 3 и 4). В пользу та
роциклического основания и каталитического
кого механизма свидетельствует то, что в случае
остатка цистеина. Таким образом, РНК (цито
замены в РНК остатка цитозина на 5 фторцито
зин C5) метилтрансферазы занимают промежу
зин процесс метилирования завершается на ста
точное положение между РНК (урацил С5) и
дии образования стабильного ковалентного
ДНК (цитозин C5) метилтрансферазами. Сог
коньюгата РНК с белком [17].
ласно одной из теорий, РНК (цитозин C5) ме
Общей чертой РНК и ДНК (цитозин С5)
тилтрансферазы произошли от РНК (урацил
метилтрансфераз является наличие в их струк
С5) метилтрансфераз, при этом цистеин в мо
туре до десяти эволюционно консервативных
тиве VI сохранил свою роль каталитического
участков (мотивов) (I-X), которые могут распо
нуклеофила, а в мотиве IV появился цистеин,
лагаться в различном порядке [18]. Так, мотивы
выполняющий функции основания на заверша
I-III и V отвечают за связывание кофактора
ющей стадии катализа. Последний, в свою оче
S аденозил L метионина с помощью гидрофоб
редь, стал нуклеофилом в ДНК (цитозин C5)
ных и отрицательно заряженных аминокислот
метилтрансферазах, а цистеин в мотиве VI поте
ных остатков, мотив VIII способствует экспони
рял свою каталитическую функцию [18].
рованию метилируемого нуклеотида. Мотивы
IV и VI белков семейства NOL1/Nop2/Sun со
держат остатки цистеина, участвующие в ката
БАКТЕРИАЛЬНЫЕ
лизе, вследствие чего механизм их действия час
РНК (ЦИТОЗИН С5)
то называют двухцистеиновым (рис. 1, а). Так, в
МЕТИЛТРАНСФЕРАЗЫ
мотиве VI находится цистеин, участвующий в
образовании коньюгата с цитозином мишенью
Как уже упоминалось ранее, у бактерий
на первой стадии катализа, а последняя стадия
5 метилцитозин встречается только в рРНК.
катализа осуществляется при непосредственном
Ниже будут рассмотрены некоторые структур
участии цистеина из IV мотива. Участие в ката
ные и функциональные особенности РНК (ци
лизе остатков цистеинов из двух структурных
тозин C5) метилтрансфераз из Escherichia coli
мотивов РНК метилтрансфераз было неодно
как наиболее изученного модельного организма.
кратно подтверждено сайт направленным мута
RsmB. Метилтрансфераза RsmB/Fmu - пер
генезом. Так, замена цистеина в мотиве VI на
вая детально охарактеризованная РНК C5 ме
аланин приводила к потере ферментом катали
тилтрансфераза, отвечающая за образование
тической активности, в то время как мутации
5 метилцитозина m5C967 в 16S рРНК E. coli [20].
цистеина в мотиве IV приводили к тому, что
Непосредственно рядом с m5C967 в 16S рРНК
процесс метилирования останавливался на ста
располагается метилированный по 2 положе
дии образования стабильного ковалентного
нию гуанин m2G966, за образование которого
коньюгата белка с РНК мишенью [18].
отвечает метилтрансфераза RsmD [21]. Инте
Основное различие между РНК и ДНК ме
ресно отметить, что метилирование C967 прохо
тилтрансферазами состоит в том, что в ДНК ме
дит исключительно в 16S рРНК, находящейся в
тилтрансферазах роль VI мотива играет после
свободном состоянии в отсутствии связанных с
довательность Glu Asn Val, не содержащая цис
ней рибосомных белков, в то время как метили
теина (рис. 1, б). В этом случае основанием, за
рование соседнего гуанина идет только в том
пускающим процесс β элиминирования, явля
случае, когда 16S рРНК находится в составе 30S
ется остаток аспарагиновой кислоты либо моле
субчастиц рибосомы [22]. Такая особенность яв
кула воды, определенным образом ориентиро
ляется примером конформационного контроля
ванная в активном центре фермента [19]. Инте
процесса метилирования РНК, поскольку извест
ресно отметить, что в случае метилтрансферазы
но, что в процессе сборки малой субчастицы
DNMT3A образование ковалентного коньюгата
связывание 16S рРНК с рибосомными белками
не является необходимым для метилирования.
S7 и S19 приводит к изменению ее простран
Так, замена цистеина в мотиве IV на аланин
ственной структуры, а именно к образованию
приводит к снижению, но не исчезновению ка
шпильки, включающей в себя 960-975 нуклео
талитической активности, однако механизм та
тиды 16S рРНК [23].
кой реакции пока не установлен.
RsmB - первая РНК C5 метилтрансфераза,
РНК (урацил С5) метилтрансферазы, так
для которой была получена кристаллическая
же, как и РНК (цитозин C5) метилтрансфера
структура в высоком разрешении как в присут
зы, используют в качестве каталитического ос
ствии, так и в отсутствии связанного кофакто
татка цистеин в мотиве VI, однако они лишены
ра - S аденозил L метионина [24]. По данным
остатка цистеина в мотиве IV, используемого
РСА, в RsmB можно выделить РНК связываю
для расщепления ковалентного конъюгата гете
щий NusB подобный домен и каталитический
БИОХИМИЯ том 84 вып. 8 2019
1080
КУЗНЕЦОВА и др.
С концевой, принадлежащий семейству доме
m5C967, не являясь жизненно необходимой для
нов NOL1/Nop2/Sun (рис. 2, рис. 3, а). В струк
E. coli, по крайней мере, в лабораторных услови
туре присутствуют все характерные мотивы C5
ях влияет на регуляцию скорости инициации
метилтрансфераз. Так, мотив I представляет со
трансляции, что наиболее явно проявляется в
бой жесткую шпильку, координирующую с по
процессе аттенюации. Возможно, что в условиях
мощью амидных связей полипептидной цепи
нехватки других метаболитов или конкуренции
карбоксильную группу S аденозил L метиони
с другими штаммами или видами бактерий не
на, мотив II координирует его 2’ и 3’ гидрок
оправданный расход ресурсов на дорогостоя
сильные группы, а мотив III задает правильную
щий биосинтез триптофана может иметь крити
ориентацию аденозина благодаря образованию
ческое значение.
водородных связей с атомами N1 и N6 пурино
RsmF. Метилтрансфераза RsmF была иден
вого кольца. Пространственное расположение
тифицирована как РНК C5 метилтрансфераза
цистеинов Cys325 и Cys375 из IV и VI мотивов в
на основании ее гомологии с RsmB (27% иден
каталитическом кармане RsmB (рис. 3, а) согла
тичности). RsmF катализирует in vivo метилиро
суется с предложенным двухцистеиновым меха
вание цитозина С1407 16S рРНК малой субча
низмом образования 5 метилцитозина [23]. Хотя
стицы рибосомы [27]. Поскольку С1407 нахо
кристаллическая структура комплекса RsmB с
дится в области межсубчастичного контакта
РНК до настоящего времени не получена, мето
вблизи от Р сайта, то его метилирование может
дом молекулярной динамики было показано, что
потенциально влиять на ассоциацию субчастиц
С967 в составе РНК шпильки способен эффек
рибосомы, связывание тРНК или процесс
тивно связываться с RsmB [24]. При этом проис
транслокации. В отличие от метилтрансферазы
ходит экспонирование C967 и его координация
RsmB, проявляющей свою каталитическую ак
остатком аспарагиновой кислоты из мотива VI.
тивность, когда 16S рРНК находится в свобод
Известно, что в рРНК минорные основания
сгруппированы в функционально значимых об
ластях рибосомы. Для изучения функциональ
ной роли m5C967 был детально изучен штамм
ΔrsmB/ΔrsmD, в котором отсутствует не только
m5C967, но и m2G966. Оказалось, что данные
модификации выполняют свою функцию на
стадии инициации трансляции: они стабилизи
руют связывание инициаторной аминокислоты
с 30S пре инициаторным комплексом перед
процессом узнавания старт кодона [25]. В рабо
те [26] было показано, что in vivo это может при
водить к повышенной экспрессии триптофано
вого оперона даже при наличии триптофана.
Экспрессия данного оперона в норме зависит от
концентрации триптофана и определяется про
цессом аттенюации: в зависимости от соотно
шения скоростей транскрипции и трансляции
соответствующая мРНК может образовывать
различные типы вторичной структуры. При
низкой концентрации триптофана происходит
замедление рибосомы на триптофановых кодо
нах, в результате чего увеличивается расстояние
между РНК полимеразой и рибосомой и обра
зуется вторичная структура мРНК, способству
ющая продолжению трансляции. При высоких
концентрациях триптофана происходит форми
рование терминаторной шпильки, и наблюдает
ся противоположный эффект. В штамме
ΔrsmB/ΔrsmD задержка в инициации трансля
ции приводит к увеличению расстояния между
Рис. 2. Доменная организация РНК (цитозин С5) метил
РНК полимеразой и рибосомой, и ситуация
трансфераз бактерий (RsmB, RsmF, RlmI) и эукариот
оказывается аналогичной условиям недостатка
(NSUN1 7, DNMT2). Показаны метилтрансферазные и
триптофана. Таким образом, модификация
другие домены, принадлежащие к известным семействам
БИОХИМИЯ том 84 вып. 8 2019
РНК С5 МЕТИЛТРАНСФЕРАЗЫ
1081
а
б
в
г
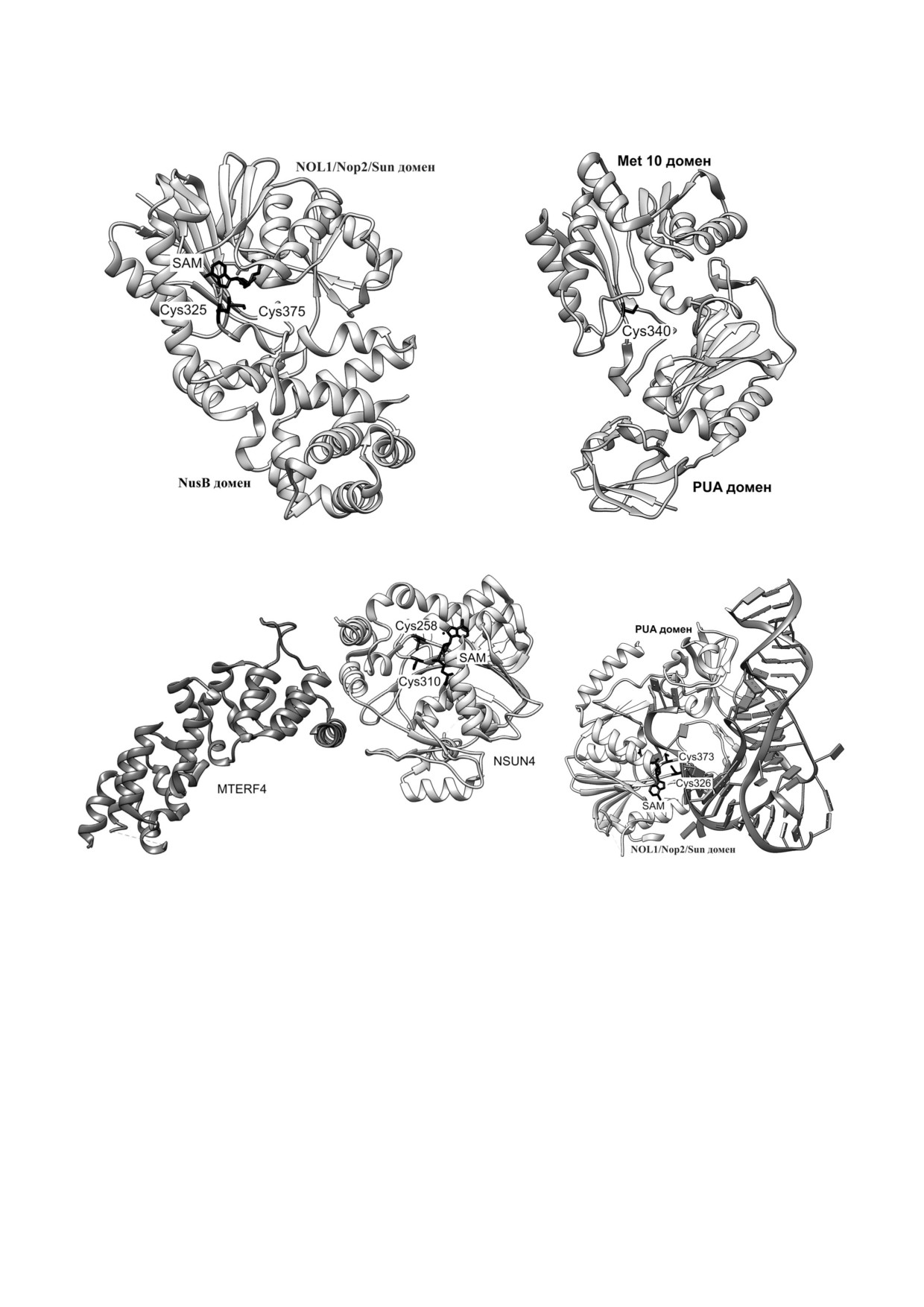
Рис. 3. Структуры представителей РНК (цитозин С5) метилтрансфераз. а - Кристаллическая структура метилтрансфера
зы RsmB E. coli (код Brookhaven PDB 1SQF) [24]. Отмечены положение каталитически активных цистеиновых остатков,
находящихся в мотивах VI и IV, соответственно, и S аденозил L метионина. Обозначены домены NusB и
NOL1/Nop2/Sun; б - кристаллическая структура метилтрансферазы RlmI E. coli (код Brookhaven PDB 3C0K) [28]. Указа
ны компоненты комплекса и каталитический остаток цистеина. Обозначены домены PUA и Met 10. в - Кристаллическая
структура комплекса NSUN4 MTERF4 SAM (код Brookhaven PDB 4FZV) [80]. Указаны компоненты комплекса и катали
тические остатки цистеина. г - Кристаллическая структура комплекса РНК (цитозин С5) метилтрансферазы NSUN6 c
тРНК по данным рентгеноструктурного анализа (код Brookhaven PDB 5WWR) [87]. Показано принципиальное участие
как акцепторного стебля, так и D петли тРНК в образовании комплекса. Обозначены домены PUA и NOL1/Nop2/Sun, а
также остатки цистеина, участвующие в катализе
ном состоянии в отсутствии связанных с ней ри
сомы, не подвергаются метилированию RsmF.
босомных белков, RsmF метилирует 16S рРНК
Взаимодействие 16S рРНК с рибосомными бел
исключительно в составе 30S субчастиц. Как
ками в процессе сборки малой субчастицы, как
свободная 16S рРНК, так и собранные 70S рибо
уже отмечалось ранее, сопряжено с ее значи
3 БИОХИМИЯ том 84 вып. 8 2019
1082
КУЗНЕЦОВА и др.
тельными конформационными изменениями,
что на основании первичной структуры ее дол
что может служить причиной специфичности
гое время считали РНК (урацил С5) метилтранс
RsmF. В свою очередь, ассоциация субчастиц
феразой. RlmI метилирует цитозин C1962 23S
приводит к экранированию C1407.
рРНК, расположенный, подобно m5С1407, в об
Cогласно данным рентгеноструктурного
ласти межсубчастичного контакта, в участке 23S
анализа, в структуре RsmF можно выделить
рРНК, содержащем большое число минорных
N концевой каталитический и C концевой
оснований [29]. Как и в случае RsmB, мишенью
PUA подобный домены (рис. 2) [28]. Последний
для RlmI является свободная 23S рРНК до ее
напоминает PUA домены псевдоуридинсинтаз
включения в состав 50S субчастиц рибосомы.
и трансгликозилаз, отвечающие за связывание
Интересно, что ближайшим к остатку цитозина
участков РНК со сложной пространственной
С1962 минорным основанием является псевдо
структурой. PUA домен в RsmF жестко связан с
уридин Ψ1917, и соответствующая псевдоури
метилтрансферазным доменом пролин богатой
динсинтаза RluD модифицирует 23S рРНК уже
последовательностью. Непосредственно на
после ее связывания с рибосомными белками.
N конце RsmF находится еще одна РНК связы
Для RlmI, как и для двух описанных ранее
вающая последовательность. Следует отметить,
РНК C5 метилтрансфераз из E. coli, была полу
что наличие двух пространственно разделенных
чена кристаллическая структура (рис. 3, б) [30].
участков узнавания РНК нехарактерно для
Следует отметить, что не только аминокислот
большинства известных бактериальных фер
ная последовательность, но и пространственная
ментов.
структура RlmI резко отличаются от ранее изу
На основании кристаллической структуры
ченных РНК C5 метилтрансфераз. Так, для нее
RsmF методом компьютерного моделирования
не характерен двухцистеиновый механизм ката
была построена модель его связывания с рРНК.
литического действия, поскольку в мотиве IV
Согласно полученным данным, метилтрансфе
цистеин отсутствует, а Cys340, который, возмож
разный домен взаимодействует не только с
но, ответственен за образование ковалентного
С1407, но и с двумя β листами рибосомного
соединения с метилируемым остатком, располо
белка S12, входящего в состав 30S субчастицы.
жен в мотиве VI. На вопрос о том, каким обра
Такая модель объясняет специфичность RsmF в
зом осуществляется процесс β элиминирова
отношении 30S субчастиц, а также еще раз под
ния, однозначного ответа нет. С одной стороны,
черкивает важность координации различных
согласно кристаллической структуре RlmI,
процессов при сборке рибосомы для обеспече
функцию основания в данном процессе может
ния эффективной модификации рРНК. Моде
выполнять аспарагиновая кислота Asp300, но
лирование структуры активного центра RsmF в
также нельзя исключать и возможность генера
присутствии связанной 16S рРНК находится в
ции основания путем депротонирования связан
согласии с предложенным механизмом катали
ной в активном центре воды, как это было про
тической активности РНК C5 метилтрансфе
демонстрировано методом компьютерного мо
раз: атомы С5 и С6 метилируемого цитозина
делирования для ДНК метилтрансферазы HhaI
С1407 располагаются в непосредственной бли
[19]. Архитектура центрального домена RlmI
зости как от метильной группы S аденозил L
близка к архитектуре РНК (урацил С5) метил
метионина, так и от входящих в состав IV и VI
трансферазы RlmD и архейного белка PH0793.
мотивов цистеинов Cys197 и Cys247.
Ортолог последнего в H. sapiens TYW2 участвует
Функциональная роль m5C1407, как и мно
в образовании вайбутозина в тРНК и является
гих других минорных оснований бактериальной
SAM зависимым белком, однако переносу под
рибосомы, до конца не изучена. Ортологи RsmF
вергается не метильная, а α амино α карбок
присутствуют во многих грамположительных и
сипропильная группа S аденозил L метионина
грамотрицательных бактериях, свидетельствуя о
[31]. Общим структурным мотивом в каталити
возможных преимуществах, которые в опреде
ческих доменах данных трансфераз является так
ленных условиях дает бактериям данная моди
называемый ЕЕНЕЕ домен, составленный из
фикация. Действительно, удаление гена данной
четырех β листов и одной α спирали и имею
метилтрансферазы сопряжено с небольшим, но
щий высокое сродство к РНК. N конец RlmI
устойчивым снижением скорости роста, и в
также предположительно участвует во взаимо
стрессовых условиях наблюдается усиление дан
действии с РНК за счет наличия PUA домена.
ного эффекта.
На основании кристаллической структуры
RlmI. Идентификация РНК (цитозин С5)
RlmI, а также структуры комплекса RlmD c РНК
метилтрансферазы RlmI была сопряжена с ря
была построена модель связывания RlmI с 23S
дом сложностей, связанных в первую очередь с
рРНК [30]. В рамках данной модели положитель
отсутствием гомологии с RsmB, а также с тем,
но заряженная бороздка на поверхности димера
БИОХИМИЯ том 84 вып. 8 2019
РНК С5 МЕТИЛТРАНСФЕРАЗЫ
1083
RlmI предпочтительно связывает одноцепочеч
цитозина ДНК метилтрансферазами (одноцис
ную РНК. Так как в отсутствии рибосомных бел
теиновый механизм, рис. 1, б), и таким образом,
ков рРНК легче подвергается разрушению вто
DNMT2 в настоящее время является единствен
ричной структуры с образованием одноцепочеч
ной из известных РНК метилтрансфераз, рабо
ных участков, данный факт согласуется со спе
тающих по типу ДНК метилтрансфераз.
цифичностью RlmI к свободной 23S рРНК.
Практически во всех исследованных орга
Гомологи RlmI распространены как среди
низмах, таких как H. sapiens, M. musculus,
бактерий, так и в археях. Отсутствие m5C1962 в
D. melanogaster, D. discoideum, E. histolytica,
23S рРНК, так же, как и отсутствие m5C1407 в
S. pombe, мишенью метилтрансферазы DNMT2
16S рРНК E. coli, сопряжено с небольшим, но
является тРНКАsp(GUC), в которой метилирует
достоверным снижением скорости роста, одна
ся цитозин С38, находящийся в составе антико
ко конкретная функциональная роль этого ме
доновой петли [33]. В некоторых организмах
тилированного цитозина до конца не изучена.
мишенью DNMT2 являются тРНКGly и тРНКVal.
Интересно отметить, что гомолог DNMT2 - бе
лок GsDnmt2 был обнаружен в протеобактериях
ЭУКАРИОТИЧЕСКИЕ
Geobacter sulfurreducens. Основной мишенью
РНК (ЦИТОЗИН С5)
GsDnmt2 in vivo является тРНКGlu, в то время
МЕТИЛТРАНСФЕРАЗЫ
как метилирование тРНКАsp протекает с низкой
эффективностью и только в условиях in vitro
По сравнению с бактериями, в эукариотах
[34]. Детальный анализ субстратной специфич
5 метилцитозин гораздо более распространен и
ности GsDnmt2, основанный на мутагенезе
встречается, помимо рРНК, также в тРНК,
тРНК с последующей оценкой уровня их мети
мРНК и ряде некодирующих РНК. Ниже будут
лирования, подчеркивает значительную роль
рассмотрены восемь известных в настоящее
вариабельной петли тРНК в процессе узнава
время эукариотических РНК (цитозин С5) ме
ния, в частности, она не должна содержать в
тилтрансфераз. Одна из них - DNMT2 - по
своем составе динуклеотид GG.
структуре и свойствам напоминает ДНК метил
В настоящее время установлено, что m5C38 в
трансферазы, а семь других содержат общий
тРНКАsp выполняет в клетке, как минимум, две
консервативный мотив NOL1/Nop2/Sun.
различные функции, связанные со стабиль
DNMT2 - единственная эукариотическая
ностью самой тРНК и ее участием в реакции
РНК C5 метилтрансфераза, структура и ката
аминоацилирования. Так, наличие m5C38 пре
литический механизм которой схожи с извест
дотвращает разрезание тРНК ангиогенином -
ными про и эукариотическими ДНК метилтранс
рибонуклеазой, активирующейся при различ
феразами. Филогенетический анализ аминокис
ных видах стресса [35]. Ангиогенин разрезает
лотных последовательностей более чем 2300
молекулы тРНК в области антикодоновой петли
РНК и ДНК (цитозин С5) метилтрансфераз
на фрагменты, обладающие регуляторными
показал, что эволюция DMNT2 и известных эу
функциями и действущие подобно малым ин
кариотических ДНК метилтрансфераз, таких
терферирующим РНК [36]. Другая функция
как DNMT1, DNMT3A и DNMT3B, протекала
m5C38 в тРНКАsp состоит в увеличении сродства
независимо, и что у описанных ферментов есть
метилированной тРНК к аспартил тРНК син
общий предшественник из семейства прокарио
тетазе более чем в четыре раза по сравнению с ее
тических ДНК метилтрансфераз [32]. В то же
неметилированным аналогом. Таким образом,
время, DNMT2 имеет гораздо меньшее сходство
метилированная форма тРНК эффективнее
с известными РНК метилтрансферазами, поэ
вступает в реакцию аминоацилирования. В от
тому можно полагать, что эволюционным пред
сутствии m5C38 количество аминоацилирован
шественником DNMT2 была ДНК (цитозин
ной тРНК снижается, что, в свою очередь, при
С5) метилтрансфераза, изменившая свою
водит к снижению эффективности трансляции,
субстратную специфичность с ДНК на РНК.
в первую очередь белков, содержащих участки
Как уже упоминалось ранее, ключевым от
олигоаспартата. Установлено, что белки, содер
личием между РНК и ДНК метилтрансфераза
жащие четыре и более остатков аспарагиновой
ми является различная функциональная роль их
кислоты подряд, имеют преимущественно ядер
структурных мотивов в процессе образования
ную локализацию и участвуют в регуляции
ковалентного комплекса с цитозин содержащей
экспрессии различных генов, а также в струк
мишенью и его последующего разрушения в ре
турной организации хромосом [37].
зультате β элиминирования. Механизм метили
Интересно отметить, что наличие в антико
рования цитозина РНК метилтрансферазой
доне тРНКАsp кьюозина, производного 7 деаза
DNMT2 аналогичен механизму метилирования
гуанозина, присутствие которого в антикодоне
БИОХИМИЯ том 84 вып. 8 2019
3*
1084
КУЗНЕЦОВА и др.
ассоциируют с увеличением точности трансля
NSUN1. Эукариотическая РНК (цитозин
ции [38], приводит к увеличению процента ме
С5) метилтрансфераза NSUN1 (p120, NOL1,
тилирования цитозина С38 с 14% до 100% в ус
Nop2) является представителем семейства
ловиях in vivo. Данный факт был впервые обна
NOL1/Nop2/Sun РНК метилтрансфераз. Парт
ружен в дрожжах S. pombe и впоследствии также
нером Nop2 дрожжей является белок Trm112,
подтвержден для D. discoideum и E. histolytica
партнером NSUN1 млекопитающих - гомоло
[39]. Таким образом, наличие кьюозина в
гичный белок TRMT112. Белки семейства
тРНКАsp влияет на степень метилирования С38
Trm112 служат адаптором для ряда РНК метил
и, следовательно, на ее стабильность. Учитывая,
трансфераз, модифицирующих как РНК, так и
что эукариотические организмы не способны
белки, компоненты аппарата трансляции [44,
синтезировать кьюозин, а получают его исклю
45]. NSUN1 высококонсервативна и имеет го
чительно от бактерий, данный процесс пред
мологов как в одно , так и в многоклеточных эу
ставляет собой один из многочисленных аспек
кариотических организмах. Для дрожжевого го
тов взаимодействия эукариотических организ
молога NSUN1 - метилтрансферазы Nop2 -
мов с микробиотой.
была построена модель трехмерной структуры,
Экспрессия, внутриклеточная локализация
основанная на его гомологии с бактериальной
и каталитическая активность DNMT2 сильно
РНК C5 метилтрансферазой RsmB с известной
зависят от стадии развития организма, стадии
кристаллической структурой [46]. На N конце
клеточного цикла, а также наличия стрессовых
Nop2 расположен РНК связывающий домен
условий. Стабильно высокая экспрессия наблю
[47], в состав которого также входит аминокис
дается в часто делящихся и метаболически ак
лотная последовательность, отвечающая за ло
тивных клетках. Внутриклеточная локализация
кализацию в ядрышке [48], а на С конце - метил
DNMT2 динамична на протяжении клеточного
трансферазный домен (рис. 2). Nop2 метилирует
цикла и является преимущественно цитоплаз
цитозин С2870 25S рРНК дрожжей, располо
матической, но этот белок также обнаруживает
женный в пептидилтрансферазном центре боль
ся и в ядерном матриксе, а его распределение в
шой субчастицы рибосомы.
профазе митоза соответствует расположению
Как и в случае других известных РНК C5
формирующегося веретена деления [40]. Таким
метилтрансфераз, метилирование РНК метил
образом, DNMT2 может иметь еще не изучен
трансферазой Nop2 протекает с участием двух
ные функции в процессе митоза, и не исключе
цистеинов: Сys424 из мотива VI и Cys478 из мо
но, что они могут быть не связаны с метилтранс
тива IV (рис. 1, а). Эксперименты с заменой ка
феразной активностью.
талитически активных цистеинов на аланин
В отсутствии DNMT2 организмы остаются
продемонстрировали одну интересную особен
жизнеспособными и фертильными. Возможно,
ность: замена Cys424, а также одновременно
наличие данной метилтрансферазы благоприят
Cys424 и Cys478 не являлись летальными и ожи
но сказывается на выживании организмов в ус
даемо приводили к ингибированию метилиро
ловиях, далеких от лабораторных. Действитель
вания, в то время как замена Cys478 на аланин
но, инактивация DNMT2 у ряда организмов по
при сохранении Cys424 оказалась летальной для
нижает продолжительность их жизни и устойчи
клетки. Причина такого эффекта, вероятно,
вость к различным видам стресса, в том числе к
заключается в том, что в отсутствии каталити
окислительному и нитрозному, в то время как
ческого цистеина в мотиве VI не происходит об
суперэкспрессия DNMT2 имеет противополож
разования ковалентного коньюгата Nop2 с
ный эффект [41].
РНК мишенью, что является необходимой ста
Согласно базе данных соматических мута
дией процесса метилирования, а при замене ка
ций, связанных с различными видами рака
талитического цистеина в мотиве IV такой конь
(COSMIC), более 120 мутаций в гене DNMT2 че
югат образуется, но дальнейшего β элиминиро
ловека выявляются в образцах опухолевых тка
вания не происходит. В результате 25S рРНК
ней различного происхождения [42]. Однако од
оказывается ковалентно связанной с Nop2 и, со
нозначного вывода о том, являются ли эти мута
ответственно, не может принимать участие в био
ции причиной опухолевой трансформации, сде
генезе рибосом, что приводит к катастрофичес
лать пока нельзя.
ким последствиям для клетки.
Кроме того, имеются данные о влиянии
У высших эукариот метилтрансфераза
DNMT2 на процесс эпигенетического наследо
NSUN1 метилирует цитозин С4447 спирали Н89
вания. Непосредственную роль в данном про
пептидилтрансферазного центра 28S рРНК по
цессе играют малые фрагменты тРНК, однако в
аналогии с Nop2, которая метилирует цитозин
настоящее время механизм этого процесса на
С2870 25S рРНК S. сerevisiae [46]. Известно, что
ходится в стадии изучения [43].
NSUN1 человека, содержащая Arg богатый
БИОХИМИЯ том 84 вып. 8 2019
РНК С5 МЕТИЛТРАНСФЕРАЗЫ
1085
участок, образует in vitro комплекс с 28S рРНК
ства STAT в фосфорилированном состоянии.
[47]. В подтверждение теории о гомологии Nop2
В клетках костного мозга сигнальный путь, за
и NSUN1 можно привести тот факт, что NSUN1
пускаемый гранулоцит колониестимулирую
H. sapiens при экспрессии в штамме Δnop2
щим фактором G CSF и приводящий к актива
S. cerevisiae метилирует С2870 в 25S рРНК. К та
ции JAK/STAT каскада, является основным пу
кому же результату приводит экспрессия гиб
тем активации экспрессии NSUN1. Результатом
ридного белка, составленного из дрожжевого N
такого процесса является пролиферация и диф
и человеческого С доменов [49].
ференцировка предшественников гранулоцитов
Метилтрансфераза Nop2 S. cerevisiae являет
[54]. Мутации STAT связывающего участка гена
ся необходимым фактором для процессинга 27S
NSUN1 приводят к исчезновению стимулирую
пре рРНК и, соответственно, образования зре
щего действия G CSF на экспрессию NSUN1.
лых форм 25S и 5,8S рРНК. Отсутствие Nop2
Следует отметить, что относительно высокая
приводит к замедлению процессинга 27S пре
экспрессия NSUN1 в стволовых клетках умень
рРНК и уменьшению уровня метилирования ее
шается по мере их дифференцировки и в боль
консервативного участка UmGmΨUC2922 [50].
шинстве тканей взрослого организма осущест
Наблюдается уменьшение количества 60S суб
вляется на очень низком уровне. Однако из этой
частиц рибосом и компенсаторное увеличение
закономерности есть одно интересное исключе
уровня 40S субчастиц и 43S преинициаторных
ние: в клетках мозга высокая экспрессия
комплексов. Для нокаутных клеток также харак
NSUN1 отмечена не только в нейрональных
терно значительное снижение скорости роста.
стволовых клетках, но и в зрелых дифференци
Интересно, что данные эффекты нивелируются
рованных нейронах в определенных областях
не только при экспрессии в нокуатном штамме
мозга, прежде всего в супрагранулярных и инф
функционального Nop2, но и при экспрессии
рагранулярных слоях соматосенсорной коры
его каталитически неактивного аналога с заме
[55]. При этом тип нейронов также имеет значе
нами каталитических цистеинов на аланины
ние - высокий уровень экспрессии характерен
[49]. Таким образом, есть основания полагать,
прежде всего для гигантских пирамидных ней
что описанные выше эффекты действительно
ронов, в то время как в олигодендроцитах и
связаны с Nop2, но не зависят от его метилтранс
клетках микроглии высокого уровня экспрессии
феразной активности. Функциональная роль
NSUN1 не отмечено. В настоящее время нет ос
самого метилирования 28S рРНК остается пока
нований полагать, что такая экспрессия NSUN1
неизвестной.
напрямую обусловлена ее метилтрансферазной
В клетках млекопитающих наблюдается ло
активностью в отношении рРНК, так как для
кализация NSUN1 в плотном фибриллярном
многих типов клеток, активно синтезирующих
компоненте ядрышка и сильная зависимость
рибосомы, в частности гепатоцитов, экспрессия
экспрессии от стадии клеточного цикла: макси
NSUN1 практически не наблюдается.
мальная экспрессия достигается в поздней G1 и
NSUN2. Эукариотическая РНК (цитозин
S фазе [51]. Полное удаление гена NSUN1 явля
C5) метилтрансфераза NSUN2 (MISU, MRT5,
ется летальным, что говорит о значимости вы
SAKI, TRM4), принадлежащая семейству
полняемых им функций. Экспрессия NSUN1
NOL1/NOP2/Sun РНК метилтрансфераз, пред
сопряжена с ростом и пролиферацией клеток, а
ставлена как в одноклеточных, так и в много
ее чрезмерно высокий уровень наблюдается в
клеточных эукариотических организмах и мети
злокачественных опухолях. Так, суперэкспрес
лирует удивительно большой набор РНК мише
сия NSUN1 в фибробластах мыши NIH3T3 при
ней. Согласно результатам широкомасштабного
водит к их злокачественному перерождению, а
секвенирования с бисульфитной конверсией,
количество NSUN1 в данном случае напрямую
основными мишенями NSUN2 являются тРНК,
коррелирует со способностью клеток к проли
но мРНК и некодирующие РНК также могут
ферации и метастазированию в иммунодефи
метилироваться этим белком [56].
цитных мышах и, следовательно, с тяжестью
Метилирование тРНК NSUN2 является вы
прогноза заболевания [52]. Для ряда видов рака,
сококонсервативным и встречается в 80% всех
таких как карцинома молочной железы и лег
тРНК в клетке. Метилируемые основания в ос
ких, NSUN1 служит диагностическим марке
новном располагаются в двух структурных об
ром, позволяющим оценить состояние опухоли
ластях тРНК: в области антикодоновой петли
и адекватно выбрать тактику лечения [53]. Акти
(С34, С38) и в области вариабельной петли в
вация синтеза NSUN1 также происходит при за
месте ее соединения с ТΨС петлей (С48, С49,
пуске ряда сигнальных каскадов. Так, например,
С51). Как уже упоминалось выше, цитозин С38
первый интрон гена NSUN1 содержит последо
может метилироваться также метилтрансфера
вательность, способную связывать белки семей
зой DNMT2. Необходимым условием метилиро
БИОХИМИЯ том 84 вып. 8 2019
1086
КУЗНЕЦОВА и др.
вания цитозина С34 тРНКLeu(САА) метилтранс
чае такая модификация способствует репрессии
феразой NSUN2 является наличие интрона в
трансляции, а во втором - ее активации. В ре
области вариабельной петли, и, таким образом,
зультате данные эффекты согласованно приво
реакция протекает исключительно на стадии
дят к замедлению репликативного старения
пре тРНК [57]. Метилирование ряда цитозинов
[61]. В научной литературе описано, что метил
вариабельной петли (С48 51) играет важную
трансфераза NSUN2 может метилировать экзо
роль в развитии ответа на окислительный и дру
циклическую аминогруппу аденина А988 мРНК
гие виды стресса, опосредованного рибонуклеа
гена супрессора опухолей р16. Наличие m6A988
зой ангиогенином. В ответ на стресс ангиогенин
препятствует образованию шпильки в данной
разрезает молекулы тРНК в области антикодо
мРНК и способствует увеличению ее стабиль
нового участка, генерируя, соответственно 5’ и
ности в клетке. В отсутствии NSUN2 образова
3’ фрагменты тРНК
[58]. В то время как
ние вторичной структуры в мРНК приводит к ее
3’ фрагменты тРНК подвергаются деградации,
ассоциации с факторами HuR, AUF1 и комп
5’ фрагменты, получившие название tsRNA,
лексом AGO2/RISC с последующей деградаци
имеют тенденцию к накоплению в клетке. На
ей [62]. Следует отметить, что такая специфич
капливающиеся
5’ фрагменты тРНКAla и
ность NSUN2 достаточно неординарна: пос
тРНКCys ингибируют трансляцию на стадии ее
кольку каталитические механизмы цитозин и
инициации за счет связывания с инициаторны
аденин метилтрансфераз различны, протекание
ми факторами eIF4G и eIF4A, препятствующего
обеих реакций в одном активном центре мало
их взаимодействию с мРНК. Метилирование
вероятно.
цитозинов вариабельной петли тРНК значи
Некодирующие РНК мишени метилтранс
тельно снижает их аффинность к ангиогенину,
феразы NSUN2 крайне разнообразны, однако в
уменьшая накопление 5’ фрагментов тРНК
их функциях можно проследить общую законо
[58]. Такая роль NSUN2 подтверждается тем,
мерность. Для многих из них характерно участие
что в клетках с инактивированным NSUN2 наб
в регуляции процессинга, фолдинга и модифи
людается накопление 5’ фрагментов тРНК и,
кации других некодирующих РНК - к ним от
соответственно, подавление трансляции даже в
носятся РНК компонент рибонуклеазы Р
отсутствии внешних стрессовых факторов.
RPPH1, Y РНК и малая РНК SCARNA2, участ
Другим классом РНК мишеней NSUN2 яв
вующая в процессинге малых ядерных РНК в
ляются мРНК, при этом метилируемые основа
тельцах Кахаля. Кроме того, к мишеням NSUN2
ния могут располагаться как непосредственно в
относятся также 5S рРНК и 7S L РНК, необхо
кодирующей последовательности, так и в 5’ и
димые для синтеза белков и их транспорта в эн
3’ нетранслируемых областях мРНК. Наличие
доплазматический ретикулум соответственно
5 метилцитозина в мРНК может иметь различ
[63]. Метилированию NSUN2 подвергаются
ные последствия для ее стабильности и эффек
также РНК компоненты комплекса Vault - са
тивности трансляции. Так, в Т лимфоцитах
мого крупного из известных рибонуклеопротеи
NSUN2 метилирует цитозин С466 в кодирую
новых комплексов, размер которого приблизи
щей области мРНК интерлейкина 17 - ключе
тельно в три раза превышает размер рибосомы.
вого регулятора развития иммунного ответа, от
К настоящему времени известно, что комплекс
ветственного также за развитие аутоиммунных
Vault принимает участие во множестве сигналь
заболеваний [59]. Такая модификация, не изме
ных каскадов в клетке и участвует в приобрете
няя стабильности самой мРНК, непосредствен
нии устойчивости некоторых видов рака к хи
но влияет на процесс ее трансляции, усиливая
миотерапии [64]. РНК, входящие в комплекс
экспрессию интерлейкина 17. NSUN2 также
Vault и подвергающиеся метилированию
метилирует еще одну мРНК, необходимую для
NSUN2, способны процессироваться белками
работы иммунной системы, кодирующую белок
семейства Argonaute и выполнять функции мик
межклеточной адгезии ICAM 1 [60]. По резуль
роРНК, причем этот процесс напрямую зависит
татам изучения метилирования in vitro, в мРНК
от наличия 5 метилцитозина [65]. Более деталь
ICAM 1 содержится не менее семи сайтов мети
но данный механизм, а также роль модифика
лирования NSUN2. Модификация мРНК
ций РНК в составе Vault комплекса пока не изу
ICAM 1 вызывает активацию ее трансляции и,
чены.
следовательно, усиление экспрессии ICAM 1 и
Интересной особенностью РНК метилтранс
увеличение адгезии лейкоцитов к клеткам сосу
феразы NSUN2, отличающей ее от всех других
дистого эндотелия. Кроме того, мишенями
известных на настоящий момент метилтрансфе
NSUN2 могут служить мРНК белков регулято
раз, является ее различная внутриклеточная ло
ров клеточного цикла. Например, NSUN2 мети
кализация на разных стадиях клеточного цикла.
лирует мРНК p27 и CDK1, причем в первом слу
В G1 фазе NSUN2 преимущественно сосредото
БИОХИМИЯ том 84 вып. 8 2019
РНК С5 МЕТИЛТРАНСФЕРАЗЫ
1087
чена в ядрышке, в S фазе - в нуклеоплазме, при
NSUN2 ассоциируется с развитием онкологи
чем именно в S фазе экспрессия NSUN2 в клет
ческих заболеваний, и для рака молочной желе
ке максимальна. При движении далее по кле
зы была установлена корреляция между уровнем
точному циклу NSUN2 переходит в цитоплазму
экспрессии NSUN2 и клинической стадией за
и в G2 фазе обнаруживается преимущественно в
болевания [71]. Удаление гена NSUN2 у мышей
цитоплазматических везикулах. При переходе к
не является летальным, однако для них харак
митозу наблюдается ассоциация комплекса
терна значительная задержка в росте, в то же
NSUN2 и 18S рРНК с микротрубочками верете
время для плодовой мушки D. melanogaster по
на деления. Таким образом, при движении по
мимо задержки в росте были отмечены наруше
клеточному циклу локализация NSUN2 карди
ния кратковременной памяти [72].
нально изменяется, что допускает возможность
У человека мутации в гене NSUN2 ассоци
тесного взаимодействия NSUN2 с белками ре
ированы с умственной отсталостью, а также вы
гуляторами клеточного цикла [66].
зывают синдром Дубовица - редкое генетиче
Идея о том, что РНК метилтрансфераза
ское расстройство, при котором наблюдаются
NSUN2 играет роль в контроле клеточного цик
мутации в сайте сплайсинга экзона 6 гена
ла, подтверждается также тем, что она является
NSUN2 [73]. Помимо задержки в умственном
непосредственной мишенью для фактора тран
развитии, у подобных пациентов наблюдаются
скрипции Myc и центральной митотической ки
серьезные неврологические аномалии - микро
назы Aurora B [67, 68]. Myc является фактором
цефалия, заторможенность речи, а также мор
транскрипции для множества генов, отвечаю
фологические изменения, такие как задержка
щих за процессинг рРНК и белков, а также за
роста и дефекты кожных покровов. В настоящее
контроль клеточного цикла. Активация Myc вы
время нет единой картины, каким образом на
зывает увеличение размера ядрышка и усиление
рушения активности NSUN2 могут приводить к
пролиферации клеток, а инактивация NSUN2
подобным проявлениям. Возможно, одной из
ингибирует эти эффекты. Таким образом,
причин является нарушение трансляции, выз
NSUN2 является важным посредником в инду
ванное ангиогенин опосредованным накопле
цированном Myc функциональном каскаде.
нием 5’ фрагментов тРНК, следствием чего мо
Митотическая киназа Aurora B, напротив, фос
гут быть уменьшение размера нейронов и ошиб
форилируя серин Ser139, ингибирует метилтранс
ки в формировании синаптических контактов.
феразную активность NSUN2. Таким образом,
Подобная теория подтверждается тем, что по
во время митоза метилтрансфераза NSUN2 на
давление трансляции и уменьшение размера
ходится в каталитически неактивном состоя
мозга мышей с инактивированным геном
нии. Эксперименты с заменой каталитически
NSUN2 могут быть нивелированы при примене
активного цистеина на аланин подтверждают,
нии ингибиторов ангиогенина или окислитель
что для стабилизации веретена деления метил
ного стресса [56].
трансферазная активность NSUN2 не является
NSUN3. Метилтрансфераза NSUN3, в отли
необходимой. Интересно, что на веретене деле
чие от большинства РНК С5 метилтрансфераз
ния NSUN2 находится в комплексе не только с
семейства NOL1/NOP2/Sun, имеет близких го
18S рРНК, но и c ядрышковым белком NuSAP,
мологов, за редким исключением, только у хор
являющимся важным фактором сборки верете
довых животных. NSUN3 локализуется в мат
на деления. NuSAP, в свою очередь, является
риксе митохондрий и метилирует С34 митохонд
мишенью Myc, что демонстрирует пересечение
риальной тРНКМet (мт тРНКМet), что соответ
глобальных функциональных каскадов для регу
ствует первому, «wobble» положению антикодо
ляции процесса клеточной пролиферации [66].
на. Важно отметить, что в данном случае 5 ме
Многообразие функций, выполняемых в
тилцитозин не является конечным продуктом
клетке метилтрансферазой NSUN2, сопряжено
реакции, идет его дальнейшее окисление Fe(II)
с таким же многообразием фенотипов, ассоци
зависимой диоксигеназой ALKBH1/ABH1 до
ированных с ее отсутствием или мутациями. На
5 гидроксиметилцитозина, а затем и до 5 фор
клеточном уровне удаление гена NSUN2 имеет
милцитозина (рис. 4) [74].
множество последствий для митоза, таких как
Следует отметить, что в клетке присутствуют
построение мультиполярных веретен деления,
мт тРНКМet со всеми указанными вариантами
анеуплоидия и клеточная смерть [66].
модификаций цитозина С34, каждая из которых
У высших эукариот экспрессия NSUN2 наб
изменяет способность тРНК узнавать различ
людается на низком уровне во всех здоровых
ные кодоны в процессе трансляции.
тканях и обеспечивает протекание процесса
Так, 5 формилцитозин благодаря наличию
дифференцировки и пролиферации клеток [69,
формильной группы, способен образовывать
70]. В то же время, повышение экспрессии
Уотсон-Криковские пары не только с гуани
БИОХИМИЯ том 84 вып. 8 2019
1088
КУЗНЕЦОВА и др.
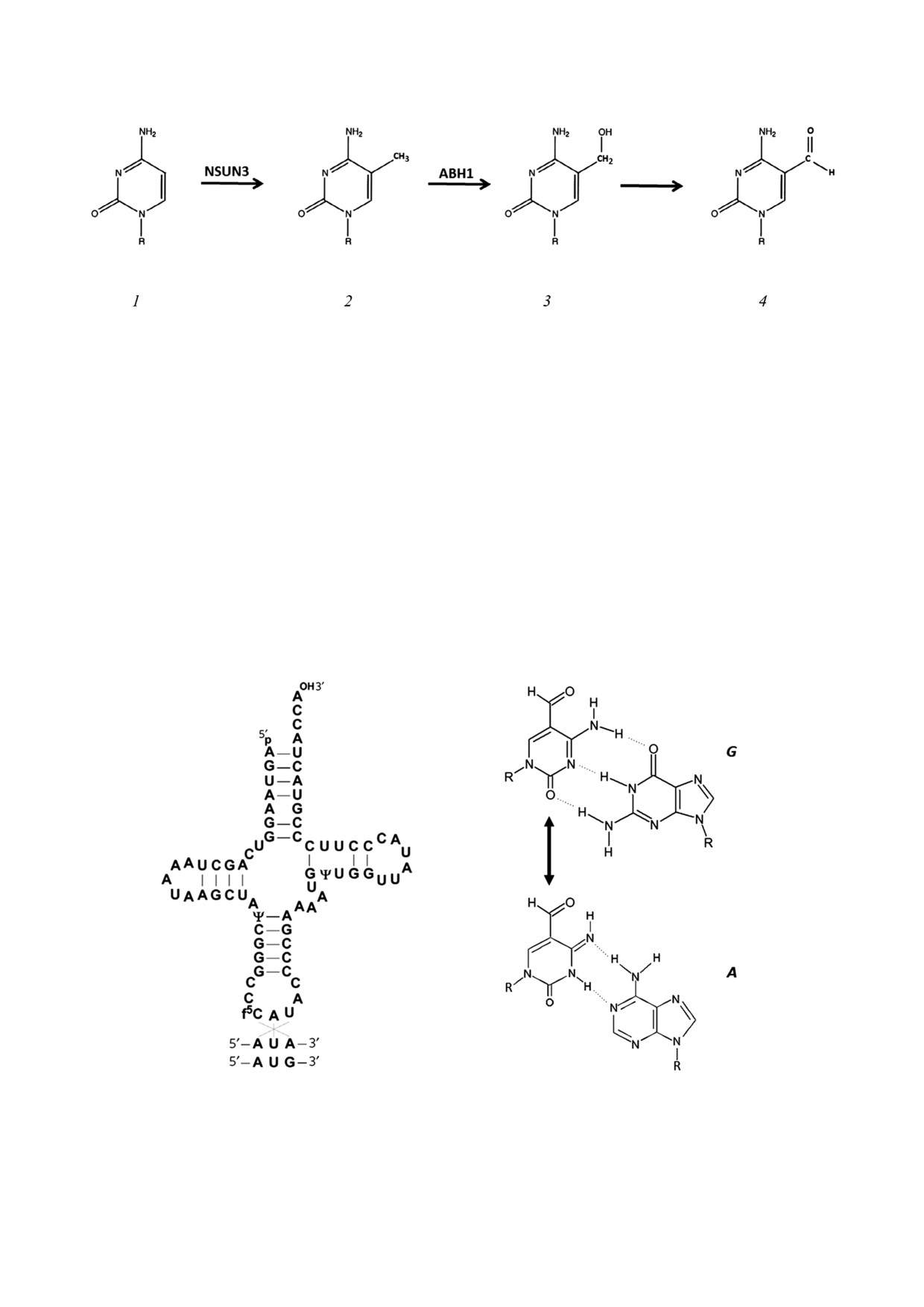
Рис. 4. Последовательность биохимических реакций, катализируемых ферментами NSUN3 и ABH1 в тРНКМet; R - оста
ток молекулы РНК; 1-4 - остатки цитозина, 5 метил , 5 гидроксиметил и 5 формилцитозина соответственно
ном, но и аденином, поскольку формильная
ти как инициации, так и элонгации трансляции
группа, не оказывая влияния на стабильность
[76].
самой тРНК, способствует сдвигу равновесия в
Эксперименты на клеточных линиях показа
сторону образования имино таутомера цитози
ли снижение общего уровня трансляции в мито
на [75]. Таким образом, мт тРНКMet может узна
хондриях, а также уменьшение интенсивности
вать не только AUG, но и AUA кодоны (рис. 5).
дыхания в клетках с каталитически неактивной
Кроме того, описано узнавание мт тРНКMet
мутантной формой NSUN3. При этом в таких
инициаторного кодона AUU мРНК ND2. Так
клетках наблюдается усиленный биогенез мито
как в митохондриях человека закодировано 13
хондрий, что вероятно, является механизмом
белков, и в соответствующих мРНК присутству
компенсации нарушенной митохондриальной
ют 167 кодонов AUA и 40 кодонов AUG, подоб
трансляции. Кроме того, NSUN3 принимает не
ное изменение специфичности антикодона
посредственное участие в процессе дифферен
ключевым образом отражается на эффективнос
цировки эмбриональных стволовых клеток [77].
Рис. 5. Узнавание AUG и AUA кодонов митохондриальной тРНКMet. Слева - положение 5 формилцитозина в мт тРНКMet,
справа - комплементарные пары оснований, образующиеся с участием амино (сверху) и имино (снизу) таутомерных
форм 5 формилцитозина соответственно
БИОХИМИЯ том 84 вып. 8 2019
РНК С5 МЕТИЛТРАНСФЕРАЗЫ
1089
Об этом свидетельствует скачкообразное увели
MTERF4 принимают активное участие в регуля
чение уровня экспрессии NSUN3 при запуске
ции терминации транскрипции в митохондри
дифференцировки, а также существенные изме
ях, в то время как для MTERF4 подобная актив
нения в экспрессии ряда маркеров дифферен
ность на настоящий момент неизвестна. Комп
цировки в клетках с мутантной формой NSUN3,
лекс NSUN4 MTERF4 необходим для ассоциа
причем наиболее ярко этот эффект проявлялся
ции рибосомных субчастиц в зрелые рибосомы,
для клеток нейроэктодермы.
и нарушения в его структуре приводят к увели
При анализе функций метилтрансферазы
чению эффективности синтеза рибосомных
NSUN3 на уровне целого организма следует
субчастиц без соответствующего увеличения ко
учитывать, что уровень ее экспрессии и место
личества зрелых рибосом.
локализации (митохондриальный матрикс) не
Особенностью метилтрансферазы NSUN4
зависят от типа ткани, в то время как для диок
является отсутствие РНК связывающего доме
сигеназы ABH1 характерны как широкий диа
на, функцию которого выполняет MTERF4.
пазон экспрессии, так и различная внутрикле
Интересно, что в клетке белок MTERF4 преи
точная локализация. Таким образом, для раз
мущественно связывает 16S рРНК и в значи
личных тканей можно ожидать различную сте
тельно меньшей степени, 12S рРНК и 7S РНК.
пень модификации цитозина С34 в мт тРНКМet
Последний факт указывает на то, что MTERF4
и, следовательно, различную степень выражен
находится в клетке не только в виде комплексов
ности эффекта. У человека описан ряд мутаций,
с рРНК, но также может располагаться в непо
приводящих к сбою рамки считывания и преж
средственной близости от промотора L цепи
девременным стоп кодонам в области катали
мтДНК и выполнять на настоящий момент еще
тического домена NSUN3 [78]. Такие мутации
не известные функции в регуляции митохонд
вызывают у их носителей симптомы, характер
риальной транскрипции. Для комплекса
ные для нарушений функционирования мито
NSUN4 MTERF4 показана способность мети
хондриальной дыхательной цепи и окислитель
лировать 16S рРНК in vitro, при этом положение
ного фосфорилирования в клетках скелетной
модификации пока не определено.
мускулатуры. А именно, у таких пациентов
Известно, что сборка рибосом является
встречаются микроцефалия, умственная отста
крайне сложным процессом, в ходе которого
лость, лактозный ацидоз, потеря слуха и патоло
рибосомная РНК претерпевает множество кон
гическая мышечная слабость. В фибробластах
формационных изменений, некоторые из кото
пациентов с мутантными формами NSUN3 наб
рых стабилизируются исключительно за счет
людаются дефекты митохондриальной трансля
взаимодействия с рибосомными белками или
ции, которые нивелируются экзогенной
факторами сборки рибосом. Предложенная ав
экспрессией каталитически активной NSUN3.
торами [79] модель предполагает, что на опреде
К описанному выше фенотипу приводят
ленном этапе биогенеза большой субчастицы
также мутации в области антикодоновой петли
рибосомы происходит связывание 16S рРНК c
мт тРНКМet, нарушающие формирование двой
комплексом NSUN4 MTERF4, что препятству
ной спирали РНК и, следовательно, препятству
ет ассоциации субчастиц. При дальнейшем со
ющие узнаванию NSUN3 антикодонового стеб
зревании большой субчастицы вновь происхо
ля и протеканию метилтрансферазной реакции.
дит конформационная перестройка, на этот раз
Таким образом, мутации как в NSUN3, так и в
с диссоциацией комплекса и активацией боль
его мишени приводят к сходным эффектам, что
шой субчастицы рибосомы. Таким образом, свя
свидетельствует о ключевой роли катализируе
зываясь с 16S рРНК во время ее созревания,
мого NSUN3 метилирования мт тРНКМet в про
NSUN4 MTERF4 участвует в «контроле качест
цессе трансляции в митохондриях.
ва» рибосом, допуская к процессу трансляции
NSUN4. Эукариотическая метилтрансфераза
только зрелые формы большой субчастицы.
NSUN4 представлена в многоклеточных эука
Другой важной функцией NSUN4 является
риотах и играет важную роль в биогенезе мито
метилирование цитозина С841 в составе 12S
хондриальных рибосом. Подобно метилтранс
рРНК малой субчастицы рибосомы. В отличие
феразе NSUN3, белок NSUN4 локализуется в
от аналогичной ситуации с 16S рРНК большой
митохондриальном матриксе, и в настоящее
субчастицы, для протекания данной реакции
время для него известны две функции в процес
NSUN4 не требуется партнер MTERF4, и удале
се созревания рибосом [79]. Так, интересной
ние гена MTERF4 не сказывается на статусе ме
особенностью NSUN4 является образование
тилирования С841. Функция цитозина m5C841,
прочного (Кд = 13,3 нМ) комплекса с белком из
как и многих других минорных оснований в со
семейства факторов терминации митохондри
ставе рРНК, сейчас еще недостаточно изучена,
альной транскрипции MTERF4. Гомологи
однако считается, что он, наряду с m6A936 и
БИОХИМИЯ том 84 вып. 8 2019
1090
КУЗНЕЦОВА и др.
m6A937, принимает участие в стабилизации
структуры малой субчастицы рибосомы. На
рис. 6 схематично представлены оба описанных
пути, по которым NSUN4 регулирует процесс
биогенеза рибосом.
Структура комплекса NSUN4 MTERF4 как
в присутствии, так и в отсутствии S аденозил L
метионина была определена методом рентгено
структурного анализа независимо двумя группа
ми (рис. 3, в) [80, 81]. В результате анализа дан
ных РСА был подтвержден двухцистеиновый
механизм метилирования цитозина. Согласно
этим данным, карбоксильная группа S адено
зил L метионина расположена в кармане, обра
зованном четырьмя атомами азота, что обеспе
чивает его жесткую фиксацию в активном цент
ре и корректное расположение метильной груп
пы. Каталитически активные цистеины С258 и
С310, находящиеся в пространственно сближе
ных петлях, расположены в непосредственной
близости от донорной метильной группы. Белки
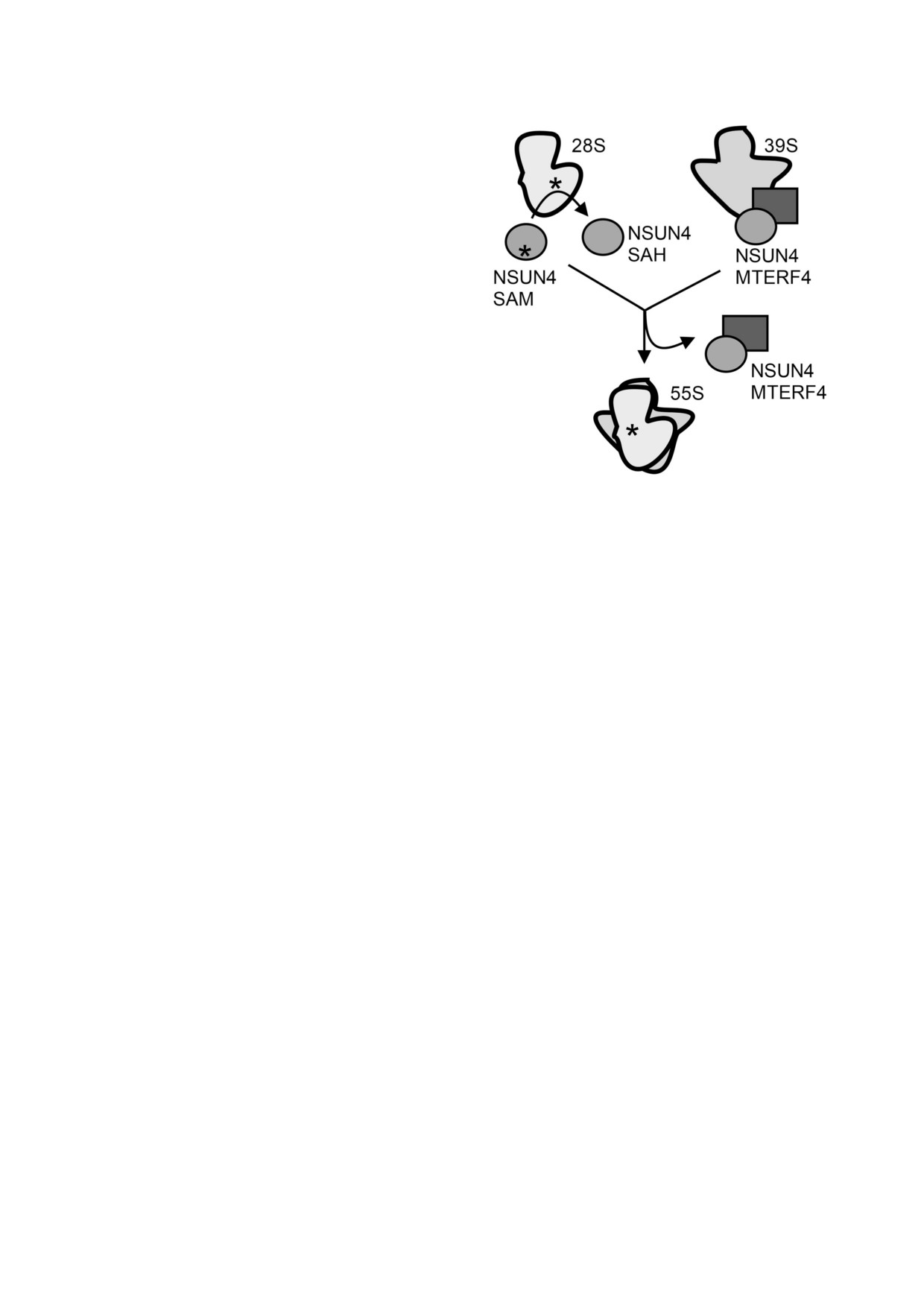
Рис.
6. Роль РНК (цитозин С5) метилтрансферазы
NSUN4 и MTERF4 связаны в комплексе как по
NSUN4 в созревании митохондриальных рибосом. Сле
лярными, так и гидрофобными взаимодействи
ва - NSUN4 независимо от MTERF4 проводит метилиро
ями. Водородные связи между ними ограничи
вание C841 12S рРНК; справа - ассоциация комплекса
вают своеобразную треугольную площадь, внут
NSUN4 MTERF4 с 16S рРНК препятствует ассоциации
ри которой сосредоточено большинство гидро
субчастиц до их полного созревания, внизу - на последнем
этапе биогенеза происходит диссоциация комплексов
фобных контактов. Значительная часть амино
NSUN4 MTERF4 и ассоциация зрелых субчастиц в функ
кислотных остатков, формирующих область
ционально активные рибосомы
взаимодействия белков, являются высококон
сервативными, а случаи замен - компенсатор
ными, то есть происходят одновременно на двух
ного развития [82]. В то же время, инактивация
белках без серьезного изменения результирую
данного гена во взрослых особях в кардиомио
щего взаимодействия. В результате анализа
цитах и клетках скелетных мышц приводила к
структуры комплекса NSUN4 MTERF4 [80]
резкому снижению продолжительности жизни,
был предложен механизм связывания и метили
которая не превышла 25 недель. Кроме того, у
рования РНК. Так, на поверхности белка
таких мышей развивается прогрессирующая
NSUN4, выполняющего функцию связывания
кардиомиопатия, что ассоциируется с феноти
РНК, имеется желоб, образованный положи
пом, обусловленным нарушениями экспрессии
тельно заряженными аминокислотами, который
генов, ответственных за протекание окисли
ведет в активный центр фермента. Этот желоб
тельного фосфорилирования. В митохондриях
может представлять собой путь, по которому
резко уменьшалось количество белков, закоди
движется РНК при связывании с комплексом
рованных митохондриальной ДНК, в то время
NSUN4 MTERF4. В пользу этого предположе
как уровень экспрессии комлекса II дыхатель
ния свидетельствует тот факт, что белки семей
ной цепи, кодируемого только ядерной ДНК, не
ства MTERF являются высококонсервативны
менялся, что свидетельствует об угнетении иск
ми, и для MTERF1 доказано сродство к двуце
лючительно митохондриальной трансляции.
почечной РНК. Возможно, именно в составе
Таким образом, эукариотическая РНК (ци
двойной спирали происходит связывание доста
тозин С5) метилтрансфераза NSUN4, подобно
точно сложно пространственно организованной
метилтрансферазе NSUN3, является важным
рРНК с положительно заряженным желобом на
регулятором процесса митохондриальной
поверхности комплекса NSUN4 MTERF4.
трансляции. Принимая независимое участие в
К тому же, ширина этого желоба достаточна для
процессах созревания обеих рибосомных суб
связывания двуцепочечной РНК.
частиц, NSUN4 регулирует их скоординирован
Нарушения в описанных выше процессах с
ную сборку в функциональные рибосомы.
участием NSUN4 могут иметь негативные по
NSUN5. Метилтрансфераза NSUN5 встреча
следствия. Так, инактивация гена NSUN4 в мы
ется как в одно , так и в многоклеточных эука
шах является летальной на стадии эмбриональ
риотических организмах и проявляет высокую
БИОХИМИЯ том 84 вып. 8 2019
РНК С5 МЕТИЛТРАНСФЕРАЗЫ
1091
консервативность первичной структуры. Ее
гомологов NSUN5. При этом размер особей и их
дрожжевой гомолог Rcm1 локализуется в яд
фертильность остаются неизменными.
рышке и принимает участие в образовании
Учитывая высокое сходство Rcm1 S. cerevisiae
5 метилцитозина m5C2278 в 25S рРНК [46]. По
и NSUN5 H. sapiens, а также соответствующих
результатам анализа первичной структуры ката
участков рРНК, предположительной функцией
литически активными являются Cys404 и Cys330
NSUN5 у человека является образование
из VI и IV мотивов соответственно. Установле
m5C3782 в 28S рРНК, что, несомненно, требует
но, что замена цистеина Cys404 на аланин не
подтверждения. Дополнительным указанием на
имеет критических последствий для жизнедея
подобную функцию NSUN5 является его коим
тельности клеток, в то время как замена Cys330
мунопреципитация с рРНК [84]. Интересно от
является летальной, что связано, как уже упо
метить, что NSUN5 является одним из группы
миналось ранее, с образованием непродуктив
генов, делеция которых у человека ассоцииро
ного ковалентного комплекса РНК белок с по
вана с возникновением синдрома Вильям
следующим исключением РНК из дальнейшего
са-Бойрена - редкого генетического заболева
биогенеза (рис. 1, а). Аналогичный результат
ния, характеризующегося задержкой умствен
был получен при замене каталитического цисте
ного развития, а также рядом других системных
ина из IV мотива дрожжевой метилтрансферазы
нарушений. Вероятная роль гена NSUN5 в воз
Nop2, также метилирующей 25S рРНК. Резуль
никновении данного синдрома послужила при
таты in silico моделирования 3D структуры Rcm1
чиной его альтернативного названия
-
подтвердили наличие РНК связывающего и ме
WBSCR20 (WBSCR - Williams-Beuren syndrome
тилтрансферазного доменов, а также располо
critical region - участок хромосомы, делеция ко
жение каталитических цистеинов в активном
торого ассоциирована с синдромом Вильям
центре.
са-Бойрена). Также у человека существуют еще
5 Метилцитозин m5C2278 25S рРНК распо
две копии данного гена, возникшие, вероятно, в
лагается вблизи пептидилтрансферазного цент
результате дупликации гена NSUN5
-
ра большой субчастицы рибосомы. Результаты
WBSCR20B (nsun5P1) и WBSCR20C (nsun5P2).
химического зондирования (пробинга) указыва
Последние кодируют укороченные формы бел
ют на его влияние на укладку 25S рРНК в усло
ка NSUN5 (который по аналогии также называ
виях окислительного стресса. Отсутствие мети
ют WBSCR20A), и, в отличие от полноразмер
лирования C2278 не влияет на скорость роста
ной формы, не имеют гомологов в других живых
S. cerevisiae, однако вызывает гиперчувствитель
организмах.
ность к антибиотику анизомицину. Кроме того,
Таким образом, для гомологов NSUN5 пока
установлено, что наличие m5C2278 непосред
зано участие в образовании 5 метилцитозина в
ственно влияет на возникновение рибосомного
рРНК большой субчастицы рибосомы. Данная
ответа на окислительный стресс. Удаление гена
модификация влияет на регуляцию ответа на
Rcm1 приводит к усиленной трансляции ряда
различные виды стресса и является одним из
мРНК стрессового ответа, таких как мРНК фак
крайне малочисленных примеров, когда моди
торов регуляции клеточного цикла и компонен
фикация единственного нуклеотида рРНК име
тов системы репарации ДНК, даже в условиях
ет конкретные фенотипические проявления.
отсутствия стресса. Таким образом, согласно
Для ряда модельных организмов показана связь
данным некоторых авторов [83], метилтрансфе
активности гомологов NSUN5 с продолжитель
раза Rcm1 подавляет индукцию стрессовых ге
ностью жизни, однако функциональная роль
нов. В клетке присутствуют две субпопуляции
NSUN5 у человека и его взаимосвязь с возник
рибосом - имеющие и не имеющие минорного
новением синдрома Вильямса-Бойрена явля
цитозина m5C2278 [83]. При хроническом стрес
ются предметом дальнейших исследований.
се увеличивается доля субпопуляции немоди
NSUN6. Метилтрансфераза NSUN6 пред
фицированных рибосом, эффективно трансли
ставлена в большинстве многоклеточных эука
рующих мРНК компонентов стрессового отве
риот. В результате анализа аминокислотной
та. Для ряда модельных организмов, таких как
последовательности, в NSUN6 можно выделить
C. elegans и D. melanogaster, для которых также
метилтрансферазный домен, а также непосред
было показано участие NSUN5 в образовании
ственно связанный с ним PUA домен, отвечаю
5 метилцитозина в рРНК, удаление NSUN5 при
щий у многих РНК метилтрансфераз за связы
водит к увеличению продолжительности жизни
вание РНК (рис. 2). Доказанными мишенями
до двух раз, в то время как его суперэкспрессия
для NSUN6 являются тРНКCys и тРНКТhr (как
сокращает продолжительность жизни [83], пред
UGU, так и AGU) [85]. Метилтрансфераза
положительно из за большей устойчивости к
NSUN6 метилирует цитозин С72, находящийся
окислительному стрессу организмов, лишенных
в акцепторном стебле тРНК. Известно, что
БИОХИМИЯ том 84 вып. 8 2019
1092
КУЗНЕЦОВА и др.
тРНК, будучи одними из наиболее модифици
происходило упорядочивание нескольких ранее
рованных молекул РНК в клетке, проходят
неструктурированных участков полипептидной
сложный путь биогенеза от момента транскрип
цепи. Наиболее интересными оказались те из
ции до зрелой формы. После транскрипции
менения, которые при связывании претерпева
РНК полимеразой III пре тРНК подвергаются
ла сама молекула тРНК. На первом этапе ее вза
процессингу 5’ и 3’ концов, сплайсингу, моди
имодействия с NSUN6 происходит расплетание
фикации оснований, нуклеотидилтрансфераз
терминального участка акцепторного стебля,
ной реакции с образованием ССА тринуклеоти
ведущее к разрушению комплементарных пар
да на 3’ конце и только после этого экспорту в
1:72 и 2:71. При этом образующийся одноцепо
цитоплазму. Таким образом, подавляющее боль
чечный фрагмент РНК (U71 A76) приобретает
шинство модификаций тРНК происходят в ядре
структуру U поворота, который взаимодейству
и ответственные за них ферменты имеют преи
ет с местом соединения PUA и каталитического
мущественно ядерную локализацию. Однако
доменов в NSUN6 и способствует сближению
для NSUN6 данная закономерность не харак
C72 с активным центром. Такой механизм объ
терна. Этот белок локализуется в цитоплазме,
ясняет, почему для успешного каталитического
причем значительная его доля сосредоточена в
процесса необходимо наличие двух водородных
аппарате Гольджи и перицентриолярном прост
связей в паре 2:71 и трех водородных связей в
ранстве. Таким образом, имеются основания
3:70. Действительно, разрушение пары 2:71 в та
полагать, что мишенями NSUN6 являются экс
ком случае произойдет с меньшими энергети
портированные в цитоплазму молекулы тРНК,
ческими затратами, а прочная связь в паре 3:70
уже имеющие большинство необходимых моди
препятствует дальнейшему расплетанию акцеп
фикаций и правильно сформированную третич
торного участка, которое может привести к зна
ную структуру.
чительным конформационным изменениям в
Метилтрансфераза NSUN6, в отличие от
молекуле тРНК. Кроме того, данные рентгено
NSUN2, имеет узкую субстратную специфич
структурного анализа свидетельствуют о двой
ность, метилируя лишь тРНКCys и тРНКТhr. Это
ственной роли PUA домена в процессе образо
может свидетельствовать о том, что данные
вания комплекса. Во первых, PUA домен отве
тРНК имеют ряд структурных особенностей,
чает за связывание мотива CCA 3’ конца тРНК
которые отличают их от остальных тРНК. Путем
с помощью сложной системы взаимодействий,
мутагенеза различных тРНК и анализа способ
где узнавание каждого нуклеотида обеспечива
ности их метилирования метилтрансферазой
ется одновременно несколькими аминокисло
NSUN6 in vitro и in vivo, был определен ряд
тами. Во вторых, происходит специфическое
свойств, которыми должна обладать тРНК для
связывание участка D петли тРНК бороздкой
успешного протекания каталитической реакции
PUA домена, сформированной положительно
[86]. Так, было установлено, что метилированию
заряженными аминокислотными остатками
подвергаются исключительно полноразмерные
(рис. 3, г).
и правильно свернутые тРНК, что подтверждает
Детальное изучение активного центра
действие NSUN6 на позднем этапе биогенеза
NSUN6 позволило установить важную роль в
тРНК. Обязательным условием является нали
катализе высококонсервативных аминокислот
чие ССА тринуклеотида на 3’ конце и уридина в
ных остатков Lys248, Asp323, Cys326 и Cys373 и
положении 73. Кроме того, вторая комплемен
подтвердить роль Сys373 как нуклеофила на
тарная пара акцепторного стебля (2:71) должна
первой стадии катализа, а Сys326 - как основа
формироваться двумя водородными связями, а
ния в последующей реакции β элиминирова
третья комплементарная пара (3:70) - тремя во
ния. Кроме того, ряд экспериментальных дан
дородными связями. Также в непосредственное
ных указывает на возможность существования
взаимодействие с NSUN6 вовлечены пары 11:24
дисульфидной связи Сys373 Сys326, что требует
и 12:23, находящиеся в области D петли тРНК.
дальнейшего подтверждения.
Авторами [86] была предложена модель связы
К настоящему времени нет данных о том,
вания NSUN6 с тРНКCys(GCA). В дальнейшем с
как отсутствие или функциональные наруше
помощью РСА была определена структура апо
ния в структуре NSUN6 могут влиять на жизне
фермента NSUN6 и его комплекса с тРНКCys и
деятельность организмов, однако существуют
S аденозил L метионином (рис. 3, г), в значи
данные о его участии в развитии метастазов в
тельной степени улучшено понимание как про
костях при раке молочной железы [88]. Также
цесса узнавания тРНК, так и катализа [87]. Так,
известно, что NSUN6 в составе рибонуклеопро
при связывании NSUN6 с молекулой тРНКCys
теидного комплекса LLGL2 MAYA РНК
отсутствовали принципиальные изменения
NSUN6 принимает участие в метилировании
структуры фермента, за исключением того, что
лизина Lys59 киназы MST1, подавляющего ак
БИОХИМИЯ том 84 вып. 8 2019
РНК С5 МЕТИЛТРАНСФЕРАЗЫ
1093
тивность этой киназы и таким образом влияю
графии заметна аномалия структуры спирали
щего на активность фактора транскрипции YAP
митохондрий. Подобная взаимосвязь мутаций в
и экспрессию генов, ответственных за развитие
гене NSUN7 и структуры сперматозоидов описа
опухоли. Таким образом, NSUN6 может иметь в
на и для человека. Так, с астеноспермией ассо
клетке функции, отличные от РНК метилтранс
циированы делеция A11337 в экзоне 4, а также
феразной активности и делающие его перспек
замена T26248G в экзоне 7 [91, 92].
тивным кандидатом для разработки противо
В клетках гепатомы Hepa 1 6 белок NSUN7
опухолевых препаратов.
был охарактеризован как компонент комплекса
NSUN7. РНК (цитозин С5) метилтрансфе
с коактиватором транскрипции PGC 1α [93].
раза NSUN7 является седьмым и последним
Последний является ключевым регулятором
представителем семейства NOL1/Nop2/Sun
различных метаболических путей в клетке,
РНК метилтрансфераз у млекопитающих.
включая биогенез митохондрий. Для ряда ге
К настоящему времени мишени и функцио
нов мишеней PGC 1α, таких как ген 6 фос
нальная роль этого белка плохо изучены. Со
фофруктокиназы PFKL, сиртуина SIRT5, изо
гласно данным транскриптомного анализа тка
цитратдегидрогеназы IDH3b и гемоксигеназы
ней M. musculus и H. sapiens, мРНК NSUN7 нахо
HMOX2 была показана ассоциация PGC 1α не
дится в семенниках. В пределах семенников она
только с сайтами инициации транскрипции, но
ограничена сперматоцитами и сперматидами и
и с энхансерными последовательностями соот
практически отсутствует в сперматогониях и
ветствующих генов. В последнем случае PGC
клетках Сертоли [89]. У мышей описана мута
1α способствует транскрипции энхансерных
ция Ste5Jcs1, индуцированная воздействием
участков, результатом которой являются корот
N нитрозоэтилмочевины и приводящая к воз
кие некодирующие энхансерные РНК, участву
никновению преждевременного стоп кодона
ющие в in cis активации транскрипции соответ
перед метилтрансферазным доменом [90]. Осо
ствующих генов. В составе энхансерных РНК
би, обладающие подобной мутацией, являются
упомянутых выше генов были обнаружены ос
стерильными либо субфертильными. Спермато
татки 5 метилцитозина, а нокдаун NSUN7 с по
зоиды таких мышей имеют характерный фено
мощью РНК интерференции приводил к сниже
тип: вследствие повышенной жесткости средне
нию степени их метилирования. Кроме того,
го сегмента они двигаются по круговой траекто
наблюдалось резкое снижение количества мети
рии. Кроме того, на электронной микрофото
лирумых энхансерных РНК и мРНК соответ
Рис. 7. РНК мишени и внутриклеточная локализация эукариотических РНК (цитозин С5) метилтрансфераз. 40S и 60S -
обозначение малой и большой субъединиц рибосомы соответственно; 28S и 39S - обозначение малой и большой субъ
единиц митохондриальной рибосомы, эРНК - энхансерная РНК, втРНК - РНК компонент рибонуклеопротеиновой
частицы Vault, РНКП II - РНК полимераза II. Черным кружком обозначены остатки 5 метилцитозина
БИОХИМИЯ том 84 вып. 8 2019
1094
КУЗНЕЦОВА и др.
ствующих им генов, что может свидетельство
лостью, а также вызывают синдром Дубовица
вать о положительном влиянии 5 метилцитози
[73]. Делецию гена NSUN5 ассоциируют с воз
на на их стабильность.
никновением синдрома Вильямса-Бойрена -
редкого генетического заболевания, характери
Несмотря на широкую распространенность
зующегося задержкой умственного развития, а
5 метилцитозина в РНК эукариотических орга
также рядом других системных нарушений. Ус
низмов, к настоящему времени известно только
тановлено, что мутации в области каталитичес
восемь эукариотических РНК С5 метилтранс
кого домена NSUN3 вызывают микроцефалию,
фераз. Они функционируют в ядре, цитоплазме
умственную отсталость, лактозный ацидоз, по
и митохондриях клетки, поддерживая профиль
терю слуха и патологическую мышечную сла
метилирования РНК и обеспечивая (наряду с
бость [78]. Делецию A11337 в экзоне 4 и замену
другими ферментами нуклеинового обмена)
T26248G в экзоне 7 гена NSUN7 ассоциируют с
формирование фенотипа клеток и организма в
астеноспермией [91, 92]. Все эти данные подтве
целом (рис. 7). В подавляющем большинстве их
рждают исключительную важность РНК (цито
РНК мишенями являются компоненты транс
зин С5) метилтрансфераз для обеспечения нор
ляционного аппарата (рРНК и тРНК), в том чис
мальной жизнедеятельности организмов.
ле митохондриального (NSUN3, NSUN4) (рис. 7).
Таким образом, достижения структурной и
Значительная часть метилированных остатков
молекулярной биологии последнего десятиле
цитозина находится в непосредственной близос
тия существенно расширили наши знания об
ти от функционально значимых центров рибосо
РНК (цитозин С5) метилтрансферазах - фер
мы, что влияет на эффективность и точность
ментах, участвующих в посттранскрипционной
прохождения различных этапов трансляции и
модификации РНК. Стало возможным получать
тем самым на регуляцию клеточных механизмов,
детальную информацию об этих сложно органи
основанных на трансляции.
зованных биологических объектах, что является
Помимо функций, связанных непосред
важным шагом на пути к пониманию их молеку
ственно с метилированием цитозина в РНК,
лярной функции и роли в эволюции и развитии
РНК (цитозин С5) метилтрансферазы выпол
болезней человека. Эти достижения совместно с
няют многочисленные функции, не связанные с
достижениями биоорганической химии, экспе
метилированием. Так, DNMT2 оказывает влия
риментальной и клинической медицины позво
ние на продолжительность жизни ряда организ
ляют надеяться, что со временем появятся но
мов и устойчивость к различным видам стресса
вые эффективные и доступные методы диагнос
[41], а также на процесс эпигенетического нас
тики и терапии ассоциированных с нарушения
ледования [43]. Метилтрансферазы NSUN1,
ми работы РНК (цитозин С5) метилтрансфераз
NSUN2 и NSUN3 участвуют в дифференциров
заболеваний, что приведет к увеличению про
ке и пролиферации клеток [52-54, 69, 70, 77],
должительности и улучшению качества жизни
NSUN3 - в регуляции работы митохондриаль
человека.
ной дыхательной цепи и окислительного фос
форилирования в клетках скелетной мускулату
ры [78], NSUN4 - в биогенезе митохондриаль
Финансирование. Обзор подготовлен при
ных рибосом [79], гомологи NSUN5 в C. elegans
финансовой поддержке Российского научного
и D. melanogaster - в модуляции продолжитель
фонда (проект 17 75 30027) и Российского фон
ности жизни организма [83].
да фундаментальных исследований (проект 17
Нарушение функций РНК (цитозин С5)
00 00366).
метилтрансфераз у человека сопряжено с раз
Конфликт интересов. Авторы заявляют об от
личными заболеваниями. Так, NSUN6 участвует
сутствии конфликта интересов.
в развитии метастазов в костях при раке молоч
Соблюдение этических норм. Настоящая
ной железы [88] и в экспрессии генов, ответ
статья не содержит описания каких либо иссле
ственных за развитие опухоли. Мутации в гене
дований с использованием людей или животных
NSUN2 ассоциированы с умственной отста
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Boccaletto, P., Machnicka, M.A., Purta, E., Piatkowski, P.,
pathways. 2017 update, Nucleic Acids Res., 46, 303-307,
Baginski, B., Wirecki, T.K., de Crécy Lagard, V., Ross, R.,
doi: 10.1093/nar/gkx1030.
Limbach, P.A., Kotter, A., Helm, M., and Bujnicki, J.M.
2.
Chen, Y., Sierzputowska Gracz, H., Guenther, R.,
(2018) MODOMICS: a database of RNA modification
Everett, K., and Agris, P.
(1993)
5 Methylcytidine is
БИОХИМИЯ том 84 вып. 8 2019
РНК С5 МЕТИЛТРАНСФЕРАЗЫ
1095
required for cooperative binding of Mg2+ and a conforma
genomic and proteomic sequences, Nucleic Acids Res., 27,
tional transition at the anticodon stem loop of yeast
3138-3145, PMID: 10454610.
phenylalanine tRNA, Biochemistry, 32, 10249-10253,
17.
Walbott, H., Husson, C., Auxilien, S., and Golinelli
PMID: 8399153.
Pimpaneau, B. (2007) Cysteine of sequence motif VI is
3.
Gowher, H., and Jeltsch, A. (2018) Mammalian DNA
essential for nucleophilic catalysis by yeast tRNA m5C
methyltransferases: new discoveries and open questions,
methyltransferase, RNA, 13, 967-973, doi: 10.1261/
Biochem. Soc. Trans., 46, 1191-1202, doi: 10.1042/
rna.515707.
BST20170574.
18.
Liu, Y., and Santi, D. (2000) m5C RNA and m5C DNA
4.
Trixl, L., and Lusser, A. (2019) The dynamic RNA modifi
methyltransferases use different cysteine residues as cata
cation 5 methylcytosine and its emerging role as an epi
lysts, Proc. Natl. Acad. Sci. USA, 97, 8263-8265, PMID:
transcriptomic mark, Wiley Interdiscip. Rev. RNA, 10,
10899996.
e1510, doi: 10.1002/wrna.1510.
19.
Zhang, X., and Bruice, T. (2006) The mechanism of
5.
Bohnsack, K.E., Höbartner, K., and Bohnsack, M.T.
M.HhaI DNA C5 cytosine methyltransferase enzyme: a
(2019) Eucaryotic 5 methylcytosine (m5C) RNA methyl
quantum mechanics/molecular mechanics approach,
transferases: mechanisms, cellular functions, and links to
Proc. Natl. Acad. Sci. USA, 103, 6148-6153, doi: 10.1073/
disease, Genes, 10, 102, doi: 10.3390/genes10020102.
pnas.0601587103.
6.
Schaefer, M., Pollex, T., Hanna, and K., and Lyko, F.
20.
Gu, X., Gustafsson, C., Ku, J., Yu, M., and Santi, D.
(2009) RNA cytosine methylation analysis by bisulfite
(1999) Identification of the 16S rRNA m5C967 methyl
sequencing, Nucleic Acids Res., 37, e12, doi: 10.1093/
transferase from Escherichia coli, Biochemistry,
38,
nar/gkn954.
4053-4057, doi: 10.1021/bi982364y.
7.
Edelheit, S., Schwartz, S., Mumbach, M., Wurtzel, O.,
21.
Lesnyak, D.V., Osipiuk, J., Skarina, T., Sergiev, P.V.,
and Sorek, R. (2013) Transcriptome wide mapping of
Bogdanov, A.A., Edwards, A., Savchenko, A., Joachimiak, A.,
5 methylcytidine RNA modifications in bacteria, archaea,
and Dontsova, O.A. (2007) Methyltransferase that modi
and yeast reveals m(5)C within archaeal mRNAs, PLoS
fies guanine 966 of the 16 S rRNA: functional identifica
Genet., 9, e1003602, doi: 10.1371/journal.pgen.1003602.
tion and tertiary structure, J. Biol. Chem., 282, 5880-5887,
8.
Khoddami, V., and Cairns, B. (2013) Identification of direct
doi: 10.1074/jbc.M608214200.
targets and modified bases of RNA cytosine methyltrans
22.
Tscherne, J., Nurse, K., Popienick, P., Michel, H.,
ferases, Nat Biotechnol., 31, 458-464, doi: 10.1038/nbt.2566.
Sochacki, M., and Ofengand, J. (1999) Purification,
9.
George, H., Ule, J., and Hussain, S. (2017) Illustrating the
cloning, and characterization of the 16S RNA m5C967
Epitranscriptome at Nucleotide Resolution Using
methyltransferase from Escherichia coli, Biochemistry, 38,
Methylation iCLIP (miCLIP), Methods Mol. Biol., 1562,
1884-1892, doi: 10.1021/bi981880l.
91-106, doi: 10.1007/978 1 4939 6807 7_7.
23.
Weitzmann, C., Tumminia, S., Boublik, M., and
10.
Squires, J., Patel, H., Nousch, M., Sibbritt, T.,
Ofengand, J. (1991) A paradigm for local conformational
Humphreys, D., Parker, B.J., Suter, C.M., and Preiss, T.
control of function in the ribosome: binding of ribosomal
(2012) Widespread occurrence of 5 methylcytosine in
protein S19 to Escherichia coli 16S rRNA in the presence of
human coding and non coding RNA, Nucleic Acids Res.,
S7 is required for methylation of m2G966 and blocks
40, 5023-2033, doi: 10.1093/nar/gks144.
methylation of m5C967 by their respective methyltrans
11.
Hoernes, T., Clementi, N., Faserl, K., Glasner, H.,
ferases, Nucleic Acids Res., 19, 7089-7095, PMID:
Breuker, K., and Lindner, H. (2016) Nucleotide modifica
1766869.
tions within bacterial messenger RNAs regulate their trans
24.
Foster, P., Nunes, C., Greene, P., Moustakas, D., and
lation and are able to rewire the genetic code, Nucleic Acids
Stroud, R. (2003) The first structure of an RNA m5C
Res., 44, 852-862, doi: 10.1093/nar/gkv1182.
methyltransferase, Fmu, provides insight into catalytic
12.
Dominissini, D., Nachtergaele, S., Moshitch Moshkovitz, S.,
mechanism and specific binding of RNA substrate,
Peer, E., Kol, N., Ben Haim, M.S., Dai, Q., Di Segni, A.,
Structure, 11, 1609-1620, doi: 10.1016/j.str.2003.10.014.
Salmon Divon, M., Clark, W.C., Guanqun Zheng, G.,
25.
Burakovsky, D., Prokhorova, I., Sergiev, P., and Milуn, P.
Pan, T., Solomon, O., Eran Eyal, E., Hershkovitz, V., Han,
(2012) Impact of methylations of m2G966/m5C967 in 16S
D., Doré, L.C., Amariglio, N., Rechavi, G., and He, C.
rRNA on bacterial fitness and translation initiation,
(2016) The dynamic N1 methyladenosine methylome in
Nucleic Acids Res., 40, 7885- 7895, doi: 10.1093/nar/
eukaryotic messenger RNA, Nature, 530, 441-446,
gks508.
doi: 10.1038/nature16998.
26.
Prokhorova, I., Osterman, I., Burakovsky, D., and
13.
Amort, T., Rieder, D., Wille, A., Khokhlova Cubberley, D.,
Serebryakova, M.
(2013)
Modified nucleotides
Riml, C., Trixl, L., Jia, X.Y., Micura, R., and Lusser, A.
m2G966/m5C967 of Escherichia coli 16S rRNA are
(2017) Distinct 5 methylcytosine profiles in poly(A) RNA
required for attenuation of tryptophan operon, Sci. Rep., 3,
from mouse embryonic stem cells and brain, Genome Biol.,
3236, doi: 10.1038/srep03236.
18, 1, doi: 10.1186/s13059 016 1139 1.
27.
Andersen, N., and Douthwaite, S. (2006) YebU is a m5C
14.
Amort, T., Souliиre, M., Wille, A., Jia, X., Fiegl, H.,
methyltransferase specific for 16 S rRNA nucleotide 1407,
Wörle, H., Micura, R., and Lusser, A. (2013) Long non
J. Mol. Biol., 359, 777-786, doi: 10.1016/j.jmb.2006.04.007.
coding RNAs as targets for cytosine methylation, RNA
28.
Hallberg, B., Ericsson, U., Johnson, K., Andersen,
Biol., 10, 1003-1008, doi: 10.4161/rna.24454.
N., Douthwaite, S., Nordlund, P., Beuscher A.E., and
15.
Yang, X., Yang, Y., Sun, B., Chen, Y., Xu, J., Lai, W., Li, A.,
Erlandsen, H. (2006) The structure of the RNA m5C
Wang, X., Bhattarai, D.P., Xiao, W., Sun, H. Y., Zhu, Q.,
methyltransferase YebU from Escherichia coli reveals a
Hai Li Ma, H. L., Adhikari, S., Sun, M., Hao, Y. J., Bing
C terminal RNA recruiting PUA domain, J. Mol. Biol.,
Zhang, B., Chun Min Huang, C. M., Huang, N., Jiang, G. B.,
360, 774-787, doi: 10.1016/j.jmb.2006.05.047.
Zhao, Y. L., Wang, H. L., Sun, Y. P., and Yang, Y. G.
29.
Purta, E., O’Connor, M., Bujnicki, J., and Douthwaite, S.
(2017)
5 Methylcytosine promotes mRNA export -
(2008) YccW is the m5C methyltransferase specific for 23S
NSUN2 as the methyltransferase and ALYREF as an m5C
rRNA nucleotide 1962, J. Mol. Biol., 383, 641-651,
reader, Cell Res., 27, 606-625, doi: 10.1038/ cr.2017.55.
doi: 10.1016/j.jmb.2008.08.061.
16.
Reid, R., Greene, P., and Santi, D. (1999) Exposition of a
30.
Sunita, S., Tkaczuk, K., Purta, E., Kasprzak, J.,
family of RNA m(5)C methyltransferases from searching
Douthwaite, S., Bujnicki, and J., Sivaraman, J. (2008)
БИОХИМИЯ том 84 вып. 8 2019
1096
КУЗНЕЦОВА и др.
Crystal structure of the Escherichia coli 23S rRNA:m5C
Zhai, Q., and Zhou, Q. (2016) Sperm tsRNAs contribute
methyltransferase RlmI (YccW) reveals evolutionary links
to intergenerational inheritance of an acquired metabolic
between RNA modification enzymes, J. Mol. Biol., 383,
disorder, Science,
351,
397-400, doi:
10.1126/
652-666, doi: 10.1016/j.jmb.2008.08.062.
science.aad7977.
31.
Rodriguez, V., Vasudevan, S., Noma, A., Carlson, B., Green,
44.
Sardana, R., and Johnson, A. (2012) The methyltrans
J., Suzuki, T, and Chandrasekharappa, S.C.
(2012)
ferase adaptor protein Trm112 is involved in biogenesis of
Structure function analysis of human TYW2 enzyme
both ribosomal subunits, Mol. Biol. Cell., 23, 4313-4322,
required for the biosynthesis of a highly modified
doi: 10.1091/mbc.E12 05 0370.
Wybutosine (yW) base in phenylalanine tRNA, PLoS One,
45.
Vasilieva, E.N., Laptev, I.G., Sergiev, P.V., and Dontsova, O.A.
7, e39297, doi: 10.1371/journal.pone.0039297.
(2018) The common partners of several methyltransferases
32.
Jurkowski, T., and Jeltsch, A. (2011) On the evolutionary
modifying components of the eukaryotic translation appa
origin of eukaryotic DNA methyltransferases and Dnmt2,
ratus, Mol. Biol. (Mosk.), 52, 975-983, doi: 10.1134/
PLoS One, 6, e28104, doi: 10.1371/journal.pone.0028104.
S0026898418060174.
33.
Goll, M., Kirpekar, F., Maggert, K., Yoder, J., Hsieh, C.,
46.
Sharma, S., Yang, J., Watzinger, P., Kцtter, P., and Entian, K.
Zhang, X., Golic, K., Jacobsen, S., and Bestor, T. (2006)
(2013) Yeast Nop2 and Rcm1 methylate C2870 and C2278
Methylation of tRNAAsp by the DNA methyltransferase
of the 25S rRNA, respectively, Nucleic Acids Res., 41,
homolog Dnmt2, Science, 311, 395-398, doi: 10.1371/
9062-9076, doi: 10.1093/nar/gkt679.
journal.pone.0028104.
47.
Gustafson, W., Taylor, C., Valdez, B., Henning, D.,
34.
Shanmugam, R., Aklujkar, M., Schдfer, M., Reinhardt, R.,
Phippard, A., Ren, Y., Busch, H., and Durban E. (1998)
Nickel, O., Reuter, G., Lovley, D.R., Ehrenhofer Murray, A.,
Nucleolar protein p120 contains an arginine rich domain
Nellen, W., Ankri, S., Helm, M., Jurkowski, T.P., and
that binds to ribosomal RNA, Biochem. J., 331, 387-393,
Jeltsch, A. (2014) The Dnmt2 RNA methyltransferase
PMID: 9531475.
homolog of Geobacter sulfurreducens specifically methy
48.
Valdez, B.C., Perlaky, L., Henning, D., Saijo, Y., Chan. P.K.,
lates tRNA Glu, Nucleic Acids Res., 42, 6487-6496,
and Busch, H. (1994) Identification of the nuclear and
doi: 10.1093/nar/gku256.
nucleolar localization signals of the protein p120 interac
35.
Schaefer, M., Pollex, T., Hanna, K., Tuorto, F.,
tion with translocation protein B23, J. Biol. Chem., 269,
Meusburger, M., Helm, M., and Lyko, F. (2010) RNA
23776-23783, PMID: 8089149.
methylation by Dnmt2 protects transfer RNAs against
49.
Bourgeois, G., Ney, M., Gaspar, I., Aigueperse, C.,
stress induced cleavage, Genes Dev., 24, 1590-1595,
Schaefer, M., Kellner, S., Helm, M., and Motorin, Y.
doi: 10.1101/gad.586710.
(2015) Eukaryotic rRNA modification by yeast 5 methyl
36.
Haussecker, D., Huang, Y., Lau, A., Parameswaran, P.,
cytosine methyltransferases and human proliferation
Fire, A., and Kay, M. (2010) Human tRNA derived small
associated antigen p120, PLoS One, 10, e0133321,
RNAs in the global regulation of RNA silencing, RNA, 16,
doi: 10.1371/journal.pone.0133321.
673-695, doi: 10.1261/rna.2000810.
50.
Hong, B., Brockenbrough, J., Wu, P., and Aris, P. (1997)
37.
Shanmugam, R., Fierer, J., Kaiser, S., Helm, M.,
Nop2p is required for pre rRNA processing and 60S ribo
Jurkowski, T., and Jeltsch, A. (2015) Cytosine methylation
some subunit synthesis in yeast, Mol. Cell. Biol., 17,
of tRNA Asp by DNMT2 has a role in translation of pro
378-388, PMID: 8972218.
teins containing poly Asp sequences, Cell Discov., 1,
51.
Fonagy, A., Swiderski, C., Wilson, A., Bolton, W.,
15010, doi: 10.1038/celldisc.2015.10.
Kenyon, N., and Freeman, J. (1993) Cell cycle regulated
38.
Zaborske, J., Vanessa, L., DuMont, B., Wallace, E., Pan, T.,
expression of nucleolar antigen P120 in normal and trans
Aquadro, C., and Drummond, A. (2014) A nutrient driven
formed human fibroblasts, J. Cell. Physiol., 154, 16-27,
tRNA modification alters translational fidelity and
PMID: 8419402.
genome wide protein coding across an animal genus, PLoS
52.
Perlaky, L., Valdez, B., Busch, R., Larson, R.,
Biol., 12, e1002015, doi: 10.1371/journal.pbio.1002015.
Jhiang, S., Zhang, W., Brattain, M., and Busch, H. (1992)
39.
Muller, M., Hartmann, M., Schuster, I., Bender, S.,
Increased growth of NIH/3T3 cells by transfection with
Thuring, K., Helm, M., Katze, J., Nellen, W., Lyko, F.,
human p120 complementary DNA and inhibition by a
and Ehrenhofer Murray, A. (2015) Dynamic modulation
p120 antisense construct, Cancer Res., 52, 428-436,
of Dnmt2 dependent tRNA methylation by the micronu
PMID: 1728415.
trient queuine, Nucleic Acids Res., 43, 10952-10962,
53.
Fonagy, A., Swiderski, C., Ostrovsky, A., Bolton, W., and
doi: 10.1093/nar/gkv980.
Freeman, J. (1994) Effect of nucleolar P120 expression
40.
Schaefer, M., Steringer, J., and Lyko, F. (2008) The
level on the proliferation capacity of breast cancer cells,
Drosophila cytosine 5 methyltransferase Dnmt2 is associ
Cancer Res., 54, 1859-1864, PMID: 8137301.
ated with the nuclear matrix and can access DNA during
54.
Khanna Gupta, A., Sun, H., Zibello, T., Lozovatsky, L.,
mitosis, PLoS One, 3, e1414, doi: 10.1371/journal.pone.
Ghosh, P., Link, D., McLemore, M., and Berliner, N.
0001414.
(2006) p120 Nucleolar proliferating antigen is a direct tar
41.
Lin, M., Tang, L., Reddy, M., and Shen C. (2005) DNA
get of G CSF signaling during myeloid differentiation,
methyltransferase gene dDnmt2 and longevity of
J. Leukoc. Biol., 79, 1011-1021, doi: 10.1189/jlb.0205066.
Drosophila, J. Biol. Chem., 280, 861-864, doi: 10.1074/jbc.
55.
Kosi, N., Alić, I., Kolačević, M., Vrsaljko, N., Jovanov,
C400477200.
Milošević, N., Sobol, M., and Mitreči, D. (2015) Nop2 is
42.
Forbes, S., Beare, D., Gunasekaran, P., Leung, K.,
expressed during proliferation of neural stem cells and in
Bindal, N., Boutselakis, H., Ding, M., Bamford, S., Cole, C.,
adult mouse and human brain, Brain Res., 1597, 65-76,
Ward, S., Kok, C.Y., Jia, M., De, T., Teague, J.W.,
doi: 10.1016/j.brainres.
Stratton, M.R., McDermott, U., and Campbell, P.J.
56.
Blanco, S., Dietmann, S., Flores, J. V., Hussain, S.,
(2015) COSMIC: exploring the world’s knowledge of
Kutter, C., Humphreys, P., Lukk, M., Lombard, P.,
somatic mutations in human cancer, Nucleic Acids Res.,
Treps, L., Popis, M., Kellner, S., Hölter, S. M., Garrett, L.,
43, 805-811, doi: 10.1093/nar/gku1075. Epub
2014
Wurst, W., Becker, L., Klopstock, T., Fuchs, H., Gailus
Oct 29.
Durner, V., Hrabě de Angelis, M., Káradуttir, R.T., Helm, M.,
43.
Chen, Q., Yan, M., Cao, Z., Li, X., Zhang, Y., Shi, J.,
Ule, J., Gleeson, J.G., Odom, D.T., and Frye, M. (2014).
Feng, G., Peng, H., Zhang, X., Zhang, Y., Qian, J., Duan, E.,
Aberrant methylation of tRNAs links cellular stress to
БИОХИМИЯ том 84 вып. 8 2019
РНК С5 МЕТИЛТРАНСФЕРАЗЫ
1097
neuro developmental disorders, EMBO J., 33, 2020-2039,
71.
Yi, J., Gao, R., Chen, Y., Yang, Z., Han, P., Zhang, H.,
doi: 10.15252/embj.201489282.
Dou, Y., Liu, W., Wang, W., Du, G., Xu, Y., and Wang, J.
57.
Brzezicha, B., Schmidt, M., Makalowska, I., Jarmolowski, A.,
(2017) Overexpression of NSUN2 by DNA hypomethyla
Pienkowska, J., and Szweykowska Kulinska, Z. (2006)
tion is associated with metastatic progression in human
Identification of human tRNA:m5C methyltransferase
breast cancer, Oncotarget, 8, 20751-20765, doi: 10.18632/
catalysing intron dependent m5C formation in the first
oncotarget.10612.
position of the anticodon of the pre tRNALeu(CAA),
72.
Abbasi Moheb, L., Mertel, S., Gonsior, M., Nouri Vahid, L.,
Nucleic Acids Res., 34, 6034-6043, doi: 10.1093/nar/
Kahrizi, K., Cirak, S., Wieczorek, D., Motazacker, M.,
gkl765.
Esmaeeli Nieh, S., Cremer, K., WeiЯmann, R., Tzschach, A.,
58.
Ivanov, P., Emara, M., Villen, J., Steven, P., Gygi, S., and
Garshasbi, M., Abedini, S., Najmabadi, H., Ropers, H.,
Paul Anderson, P. (2011) Angiogenin induced tRNA frag
Sigrist, S., and Kuss, A. (2012) Mutations in NSUN2
ments inhibit translation initiation, Mol. Cell.,
43,
cause autosomal recessive intellectual disability, Am. J.
613-623, doi: 10.1016/j.molcel.2011.06.022.
Hum. Genet., 90, 847-855, doi: 10.1016/j.ajhg.2012.03.
59.
Wang, N., Tang, H., Wang, X., Wang, W., and Feng, J.
021.
(2017) Homocysteine upregulates interleukin 17A expres
73.
Martinez, F., Lee, J., Lee, J., Blanco, S., Nickerson, E.,
sion via NSun2 mediated RNA methylation in T lympho
Gabriel, S., Frye, M., Al Gazali, L., and Gleeson, J.
cytes, Biochem. Biophys. Res. Commun., 493, 94-99,
(2012) Whole exome sequencing identifies a splicing muta
doi: 10.1016/j.bbrc.2017.09.069.
tion in NSUN2 as a cause of a Dubowitz like syndrome,
60.
Luo, Y., Feng, J., Xu, Q., Wang, W., and Wang, X. (2016)
J. Med. Genet., 49, 380-385, doi: 10.1136/jmedgenet
NSun2 deficiency protects endothelium from inflamma
2011 100686.
tion via mRNA methylation of ICAM 1, Circ. Res., 118,
74.
Nakano, S., Suzuki, T., Kawarada, L., Iwata, H., Asano, K.,
944-956, doi: 10.1161/CIRCRESAHA.115.307674.
and Suzuki, T.
(2016) NSUN3 methylase initiates
61.
Tang, H., Fan, X., Xing, J., Liu, Z., Jiang, B., Dou, Y.,
5 formylcytidine biogenesis in human mitochondrial
Gorospe, M., and Wang, W. (2015) NSun2 delays replica
tRNAMet, Nat. Chem. Biol., 12, 546-551, doi: 10.1038/
tive senescence by repressing p27 (KIP1) translation and
nchembio.
elevating CDK1 translation, Aging,
7,
1143-1155,
75.
Cantara, W., Murphy, V., Demirci, H., and Agris, P. (2013)
doi: 10.18632/aging.100860.
Expanded use of sense codons is regulated by modified
62.
Zhang, X., Liu, Z., Yi, J., Tang, H., Xing, J, Yu, M., Tong, T.,
cytidines in tRNA, Proc. Natl. Acad. Sci. USA, 110,
Shang, Y., Gorospe, M., and Wang, W. (2012) The tRNA
10964-10969, doi: 10.1073/pnas.1222641110.
methyltransferase NSun2 stabilizes p16INK4 mRNA by
76.
Haag, S., Sloan, K., Ranjan, N., Warda, A., Kretschmer, J.,
methylating the 3′ untranslated region of p16, Nat.
Blessing, C., Hübner, B., Seikowski, J., Dennerlein, S.,
Commun., 3, 712, doi: 10.1038/ncomms1692.
Rehling, P., Rodnina, M., Hцbartner, C., and Bohnsack, M.
63.
Khoddami, V., and Cairns, B. (2013) Identification of
(2016) NSUN3 and ABH1 modify the wobble position of
direct targets and modified bases of RNA cytosine methyl
mt tRNAMet to expand codon recognition in mitochon
transferases, Nat. Biotechnol., 31, 458-464, doi: 10.1038/
drial translation, EMBO J., 35, 2104-2119, doi: 10.15252/
nbt.2566.
embj.201694885.
64.
Berger, W., Steiner, E., Grusch, M., Elbling, L., and
77.
Trixl, L., Amort, T., Wille, A., Zinni, M., Ebner, S.,
Micksche, M. (2009) Vaults and the major vault protein:
Hechenberger, C., Eichin, F., Gabriel, H., Schoberleitner, I.,
novel roles in signal pathway regulation and immunity, Cell.
Huang, A., Piatti, P., Nat, R., Troppmair, J., and Lusser, A.
Mol. Life Sci., 66, 43-61, doi: 10.1007/s00018 008 8364 z.
(2018) RNA cytosine methyltransferase Nsun3 regulates
65.
Hussain, S., Sajini, A., Blanco, S., Dietmann, S.,
embryonic stem cell differentiation by promoting mito
Lombard, P., Sugimoto, Y., Paramor, M., Gleeson, J.,
chondrial activity, Cell. Mol. Life Sci., 75, 1483-1497,
Odom, D., Ule, J., and Frye, M. (2013) NSun2 mediated
doi: 10.1007/s00018 017 2700 0.
cytosine 5 methylation of vault noncoding RNA deter
78.
Van Haute, L., Dietmann, S., Kremer, L., Hussain, S.,
mines its processing into regulatory small RNAs, Cell Rep.,
Pearce, S., Powell, C., Rorbach, J., Lantaff, R., Blanco, S.,
4, 255-261, doi: 10.1016/j.celrep.2013.06.029.
Sauer, S., Kotzaeridou, U., Hoffmann, G., Memari, Y.,
66.
Hussain, S., Benavente, S.B., Nascimento, E., Dragoni, I.,
Kolb Kokocinski, A., Durbin, R., Mayr, J., Frye, M.,
Kurowski, A., Gillich, A., Humphreys, P., and Frye, M.
Prokisch, H., and Minczuka, M. (2016) Deficient methy
(2009) The nucleolar RNA methyltransferase Misu
lation and formylation of mt tRNAMet wobble cytosine in a
(NSun2) is required for mitotic spindle stability, J. Cell.
patient carrying mutations in NSUN3, Nat. Commun., 7,
Biol., 186, 27-40, doi: 10.1083/jcb.200810180.
12039, doi: 10.1038/ncomms12039.
67.
Frye, M., and Watt, F. (2006) The RNA methyltransferase
79.
Metodiev, M.D., Spеhr, H., Loguercio Polosa, P., Meharg, C.,
Misu (NSun2) mediates Myc induced proliferation and is
Becker, C., Altmueller, J., Habermann, B., Larsson, N.G.,
upregulated in tumors, Curr. Biol.,
16,
971-981,
and Ruzzenente, B. (2014) NSUN4 is a dual function
doi: 101016/j.cub.2006.04.027.
mitochondrial protein required for both methylation of
68.
Sakita Suto, S., Kanda, A., Suzuki, F., Sato, S., Takata, T.,
12S rRNA and coordination of mitoribosomal assembly,
and Tatsuka, M. (2007) Aurora B regulates RNA methyl
PLoS Genetics, 10, e1004110, doi: 10.1371/journal.pgen.
transferase NSun2, Mol. Biol. Cell., 18, 1107-1117,
1004110.
doi: 10.1091/mbc.E06 11 1021.
80.
Yakubovskaya, E., Guja, K.E., Mejia, E., Castano, S.,
69.
Blanco, S., Kurowski, A., Nichols, J., Watt, F., Benitah, S.,
Hambardjieva, E., Choi, W.S., and Garcia Diaz, M.
and Frye, M. (2011) The RNA methyltransferase Misu
(2012) Structure of the essential MTERF4:NSUN4 pro
(NSun2) poises epidermal stem cells to differentiate, PLoS
tein complex reveals how an MTERF protein collaborates
Genet., 7, e1002403, doi: 10.1371/journal.pgen.1002403.
to facilitate rRNA modification, Structure, 20, 1940-1947,
70.
Hussain, S., Tuorto, F., Menon, S., Blanco, S., Cox, C.,
doi: 10.1016/j.str.2012.08.027.
Flores, J., Watt, S., Kudo, N., Lyko, F., and Frye, M.
81.
Spеhr, H., Habermann, B., Gustafsson, C., Larsson, N., and
(2013) The mouse cytosine 5 RNA methyltransferase
Hallberg, B. (2012) Structure of the human MTERF4
NSun2 is a component of the chromatoid body and
NSUN4 protein complex that regulates mitochondrial
required for testis differentiation, Mol. Cell. Biol., 33,
ribosome biogenesis, Proc. Natl. Acad. Sci. USA, 109,
1561-1570, doi: 10.1128/MCB.01523 12.
15253-15258, doi: 10.1073/pnas.1210688109.
4 БИОХИМИЯ том 84 вып. 8 2019
1098
КУЗНЕЦОВА и др.
82. Cámara, Y., Asin Cayuela, J., Park, C., Metodiev, M., Shi, Y.,
88. Li, C., Wang, S., Xing, Z., Lin, A., Liang, K., Song, J., Hu, Q.,
Ruzzenente, B., Kukat, C., Habermann, B., Wibom, R.,
Yao, J., Chen, Z., Park, P.K., Hawke, D.H., Zhou, J.,
Hultenby, K., Franz, T., Erdjument Bromage, H., Tempst, P.,
Zhou, Y., Zhang, S., Liang, H., Hung, M.C., Gallick, G.E.,
Hallberg, M., Gustafsson, C.M., and Larsson, N. G.
Han, L., Lin, C., and Yang, L. (2017) A ROR1 HER3
(2011) MTERF4 regulates translation by targeting the
LncRNA signaling axis modulates the Hippo YAP pathway
methyltransferase NSUN4 to the mammalian mitochon
to regulate bone metastasis, Nat. Cell Biol., 19, 106-119,
drial ribosome, Cell. Metab., 13, 527-539, doi: 10.1016/
doi: 10.1038/ncb3464.
j.cmet.2011.04.002.
89. Chalmel, F., Rolland, A.D., Niederhauser Wiederkehr, C.,
83. Schosserer, M., Minois, N., Angerer, T.B., Amring, M.,
Chung, S.S., Demougin, P., Gattiker, A., Moore, J.,
Dellago, H., Harreither, E., Calle Perez, A., Pircher, A.,
Patard, J.J., Wolgemuth, D.J., Jйgou, B., and Primig, M.
Gerstl, M. P., Pfeifenberger, S., Brandl, C., Sonntagbauer, M.,
(2007) The conserved transcriptome in human and rodent
Kriegner, A., Linder, A., Weinhдusel, A., Mohr, T., Steiger, M.,
male gametogenesis, Proc. Nat. Acad. Sci. USA, 104,
Mattanovich, D., Rinnerthaler, M., Karl, T., Sharma, S.,
8346-8351, doi: 10.1073/pnas.0701883104.
Entian, K.D., Kos, M., Breitenbach, M., Wilson, I.B.,
90. Harris, T., Marquez, B., Suarez, S., and Schimenti, J.
Polacek, N., Grillari Voglauer, R., Breitenbach Koller, L.,
(2007) Sperm motility defects and infertility in male mice
and Grillari, J. (2015) Methylation of ribosomal RNA by
with a mutation in Nsun7, a member of the Sun domain
NSUN5 is a conserved mechanism modulating organismal
containing family of putative RNA methyltransferases,
lifespan, Nat. Commun.,
6,
6158. doi:
10.1038/
Biol. Reprod., 77, 376-382, doi: 10.1095/biolreprod.106.
ncomms7158.
058669.
84. Ramani, A K., Li, Z., Hart, G.T., Carlson, M.W., Boutz, D.R.,
91. Khosronezhad, N., Colagar, A., and Mortazavi, S. (2015)
and Marcotte, E.M. (2008) A map of human protein inter
The Nsun7 (A11337) deletion mutation, causes reduction
actions derived from co expression of human mRNAs and
of its protein rate and associated with sperm motility defect
their orthologs, Mol. Systems Biol., 4, 180, doi: 10.1038/
in infertile men, J. Assist. Reprod. Genet., 32, 807-815,
msb.2008.19.
doi: 10.1007/s10815 015 0443 0.
85. Haag, S., Warda, A., Kretschmer, J., Gьnnigmann, M.,
92. Khosronejad, N., Colagar, A., and Jorsarayi, S. (2015)
Höbartner, C., and Bohnsack, M. (2015) NSUN6 is a
T26248G transversion mutation in exon7 of the putative
human RNA methyltransferase that catalyzes formation of
methyltransferase Nsun7 gene causes a change in protein
m5C72 in specific tRNAs, RNA,
21,
1532-1543,
folding associated with reduced sperm motility in
doi: 10.1261/rna.051524.115.
asthenospermic men, Reprod. Fertil. Dev., 27, 471-480,
86. Long, T., Li, J., Li, H., Zhou, M., Zhou, X., Liu, R., and
doi: 10.1071/RD13371.
Wang, E. (2016) Sequence specific and shape selective
93. Aguilo, F., Li, S., Balasubramaniyan, N., Sancho, A.,
RNA recognition by the human RNA 5 methylcytosine
Benko, S., Zhang, F., Vashisht, A., Rengasamy, M.,
methyltransferase NSun6, J. Biol. Chem., 291, 24293-
Andino, B., Chen, C.H., Zhou, F., Qian, C., Zhou, M.M.,
24303, doi: 10.1074/jbc.M116.742569.
Wohlschlegel, J.A., Zhang, W., Suchy, F.J., and
87. Liu, R., Long, T., Li, J., Li, H., and Wang, E. (2017)
Walsh, M.J. (2016) Deposition of 5 methylcytosine on
Structural basis for substrate binding and catalytic mecha
enhancer RNAs enables the coactivator function of PGC
nism of a human RNA:m5C methyltransferase NSun6,
1α, Cell Rep.,
14,
479-492, doi:
10.1016/j.celrep.
Nucleic Acids Res., 45, 6684 6697, doi: 10.1093/nar/gkx473.
2015.12.043.
RNA (CYTOSINE C5) METHYLTRANSFERASES
S. A. Kuznetsova1*#, K. S. Petrukov2*#, F. I. Pletnev2,3,4,
P. V. Sergiev1,2,3,5, and O. A. Dontsova2,3,4
1 Lomonosov Moscow State University, Institute of Functional Genomics,
119234 Moscow, Russia; E(mail: svetlana@belozersky.msu.ru
2 Lomonosov Moscow State University, Faculty of Chemistry, 119991 Moscow, Russia
3 Skolkovo Institute of Science and Technology, 121205 Skolkovo, Moscow Region, Russia
4 Institute of Bioorganic Chemistry, 117997 Moscow, Russia
5 Petrov National Medical Research Center of Oncology, 197758 St. Petersburg, Russia
Received March 5, 2019
Revised April 16, 2019
Accepted April 16, 2019
The review summarizes published results of studies of pro and eukaryotic RNA (cytosine C5) methyltransferases.
Their structures, intracellular localization, RNA targets and catalytic mechanisms, as well as the functional role of
methylated cytosine residues in RNA and the RNA (cytosine C5) methyltransferases’ functions not related to
methylation are discussed. Special attention is given to the analysis of similarities and differences in the structure and
mechanism of action of RNA and DNA methyltransferases. Finally, data on the relationship of mutations in the
genes of RNA (cytosine C5) methyltransferases with human diseases are presented.
Keywords: posttranscriptional modification of RNA, RNA (cytosine С5) methyltransferases, 5 methylcytosine,
RNA methylation
БИОХИМИЯ том 84 вып. 8 2019