БИОХИМИЯ, 2019, том 84, вып. 8, с. 1129 - 1138
УДК 577.2
РЕДАКТИРОВАНИЕ РНК АДЕНОЗИНДЕЗАМИНАЗАМИ ADAR:
ОТ МОЛЕКУЛЯРНОЙ ПЛАСТИЧНОСТИ БЕЛКОВ
НЕРВНОЙ СИСТЕМЫ ДО ПАТОГЕНЕЗА
ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ЧЕЛОВЕКА
Обзор
© 2019
А.О. Гончаров1, А.А. Ключникова1,2,
Ш.Ш. Насаев2, С.А. Мошковский1,2*
1 НИИ биомедицинской химии имени В.Н. Ореховича, 119121 Москва, Россия;
электронная почта: smosh@mail.ru
2 Российский национальный исследовательский медицинский университет
им. Н.И. Пирогова Минздрава России, 117997 Москва, Россия
Поступила в редакцию 04.04.2019
После доработки 30.04.2019
Принята к публикации 01.05.2019
Редактирование РНК аденозиндезаминазами семейства ADAR привлекает нарастающий интерес исследо
вателей от зоологов, изучающих экологическую и эволюционную пластичность беспозвоночных, до меди
цинских биохимиков, чья работа сфокусирована на патогенезе злокачественных опухолей и других заболе
ваний человека. Изоформы этого фермента дезаминируют остатки аденозина в двухцепочечных участках
РНК с образованием инозина. В итоге, некоторые РНК меняют свою пространственную структуру и функ
ции. Так, замена аденозина на инозин в кодирующей части мРНК может вызывать аминокислотные заме
ны в соответствующих белках. В обзоре мы сформулировали современные представления о функциях двух
активных изоформ ADAR у млекопитающих, в том числе у человека. Белок ADAR1, неспецифически воз
действующий на протяженные участки двухцепочечной РНК, способен оказывать иммуносупрессорное
действие. Это происходит за счет инактивации взаимодействия двухцепочечной РНК с особыми сенсорами
этой конформации, индуцирующими клеточный иммунитет. При этом экспрессия особого сплайс вариан
та ADAR1 происходит под воздействием интерферонов I типа по принципу отрицательной обратной связи.
Как оказалось, иммуносупрессорные функции ADAR1 положительно воздействуют на рост некоторых зло
качественных опухолей. С другой стороны, изменения в аминокислотной последовательности отредактиро
ванных мРНК под воздействием ферментов ADAR могут образовывать неоантигены, активирующие проти
воопухолевый иммунитет. Изоформа ADAR2 действует на РНК более селективно, и с ее функцией связыва
ют редактирование кодирующих белок участков мРНК. В результате этого зачастую образуются аминокис
лотные замены, в частности, необходимые для правильного функционирования некоторых нейромедиатор
ных рецепторов в центральной нервной системе.
КЛЮЧЕВЫЕ СЛОВА: аденозиндезаминаза, редактирование РНК, ADAR, злокачественная опухоль, имму
нитет, неоантиген.
DOI: 10.1134/S0320972519080050
В омиксных исследованиях зачастую анали
РНК аденозиндезаминазами ADAR, которое в
зируют пластичность протеома за счет функцио
некоторых случаях ведет к перекодированию
нально значимых аминокислотных замен, на
мРНК и их белковых продуктов. В одной из пер
пример, вследствие точечных мутаций при злока
вых работ по анализу редактирования РНК в
чественных опухолях [1]. Существует другой ис
масштабе протеома мы идентифицировали из
точник образования точечных аминокислотных
менения, которые ферменты ADAR вызывали в
замен в белках, которому до недавнего времени
протеоме головного мозга плодовой мушки [2].
уделяли меньше внимания. Это редактирование
Так, анализ протеомов вызвал у нас дальнейший
интерес к функции ферментов ADAR, в том
числе, в организме человека. В последнее время,
Принятые сокращения: ADAR - аденозиндезами
наза, РНК зависимая; дцРНК - двухцепочечная РНК;
эти аденозиндезаминазы стали объектом биоме
PKR - протеинкиназа R.
дицинских исследований самого высокого уров
* Адресат для корреспонденции.
ня [3, 4]. В этом обзоре предполагается объеди
6
1129
1130
ГОНЧАРОВ и др.
нить разрозненные сведения о роли ADAR в
томой показано, что ADAR3 конкурирует с
функционировании человеческого организма в
ADAR2 за связывание с транскриптом GRIA2,
норме и при различных заболеваниях.
ингибируя редактирование РНК [10]. Второй
ADAR подобный ген позвоночных, ADAD,
экспрессируется в мужской зародышевой линии.
АДЕНОЗИНДЕЗАМИНАЗЫ ADAR -
Продукт этого гена TENR локализован в сперма
ПРОИСХОЖДЕНИЕ И СВОЙСТВА
тидных клетках. Предполагается, что он может
участвовать в специфичных для тестикул пост
Редактирование РНК представляет собой
транскрипционных процессах, таких как альтер
молекулярный процесс, при котором последо
нативный сплайсинг, упаковка гетерогенной
вательность РНК после транскрипции изменя
ядерной РНК или транспорт мРНК [11]. TENR
ется путем модификации, вставок или делеции
связывается с субстратами и выступает в процес
оснований. Среди различных видов этого изме
се редактирования в качестве ингибитора [12].
нения молекулы РНК наиболее универсальным
Все ферменты ADAR имеют сходную мо
является распространенное у животных преоб
дульную организацию и содержат один или не
разование аденозина в инозин [5]. Такое редак
сколько
дцРНК связывающих доменов
тирование осуществляют ферменты семейства
(dsRBD) и каталитический дезаминазный домен
ADAR (РНК зависимая аденозиндезаминаза;
[5]. Помимо этого, ADAR1 также включает два
Adenosine DeAminase, RNA dependent; КФ
Z ДНК связывающих домена, названных Zα и
3.5.4.37). Эти ферменты катализируют гидроли
Zβ. Одна из возможных ролей Zα домена состо
тическое дезаминирование аденозина и для
ит в том, чтобы направлять ADAR1 к активно
осуществления реакции нуждаются в двухцепо
транскрибируемой ДНК, чтобы обеспечить эф
чечных структурах. Преобразование оснований
фективное редактирование РНК перед сплай
в двуцепочечной РНК (дцРНК) приводит к де
сингом. Zβ домен не способен аффинно связы
стабилизации дуплекса из за некомплементар
вать ДНК, и его функция остается неясной [13].
ности инозина и урацила. Действительно,
Ферменты ADAR действуют на РНК, кото
ADAR были впервые обнаружены у шпорцевой
рая полностью или в значительной степени яв
лягушки Xenopus leavis как ферменты, расплета
ляется двухцепочечной. Любая двухцепочечная
ющие дуплекс РНК [6].
область, состоящая как минимум из 15-20 пар
Ферменты семейства ADAR обнаружены
оснований, является потенциальным субстра
только у многоклеточных животных и отсут
том для ADAR [14]. Длинные области дцРНК
ствуют у дрожжей и растений. Следовательно,
могут редактироваться неспецифически [5]. Бо
впервые подобный фермент мог появиться пос
лее короткие участки несовершенно спаренной
ле расхождения филогенетического дерева на
дцРНК могут быть точно отредактированы в
простейших и многоклеточных [7].
конкретном аденозине среди сотен.
Известные сегодня изоформы ADAR1 и
Дезаминирование остатков аденозина в ко
ADAR2 возникли из родительского гена путем
дирующих областях - это значимое событие,
дупликации в ходе ранней эволюции многокле
поскольку в отличие от него остаток инозина
точных, по оценкам, ~700 миллионов лет назад
образует более прочные водородные связи с ци
[7]. У многих первичноротых, например, у насе
тидином, по сути, с точки зрения генетического
комых, присутствует только одна активная изо
кода имитируя гуанозин [15]. Это означает, что,
форма фермента [8], в то время как хордовым
если редактирование происходит в соответству
присущи оба гена. Как станет ясно из дальней
ющем кодоне, оно вызывает аминокислотную
шего, у ADAR1 (ген ADAR человека) и ADAR2
замену. Недавно в системах трансляции in vitro
(ADARB1) позвоночных в процессе эволюции
было показано, что инозин в кодирующих об
дивергировали и функции, хотя последние час
ластях может имитировать не только гуанозин,
тично перекрываются.
но также исходный аденозин и даже цитидин
Кроме двух изоформ с ферментативной ак
[16]. Правда, последние два исхода представля
тивностью, млекопитающим присущи по край
ют собой относительно редкое явление.
ней мере два ADAR подобных гена, продукты
В той же работе было показано, что скопле
которых неактивны. Функция последних связана
ние в кодирующей части инозиновых остатков
преимущественно с ингибированием процесса
способно вызывать затормаживание рибосомы в
редактирования. Белок ADAR3 (кодируемый ге
отредактированном участке мРНК, отчего обна
ном ADARB2), также называемый Red2, более
руживаются укороченные формы белков. Таким
тесно связан с ADAR2 [9]. Он сохраняется у всех
образом, в некоторых случаях ADAR способны
позвоночных и возник, вероятно, из ADAR2 пу
снижать экспрессию соответствующих мише
тем дупликации генов. На пациентах с глиоблас
ней [16].
БИОХИМИЯ том 84 вып. 8 2019
РЕДАКТИРОВАНИЕ РНК АДЕНОЗИНДЕЗАМИНАЗАМИ ADAR
1131
Редактирование при участии ферментов
отсутствии вирусных РНК, когда сенсоры
класса ADAR часто встречается в транскриптах
дцРНК, например, PKR или MDA5, могут реа
генов приматов. У человека выявлено большое
гировать на эндогенные молекулы [26-28].
количество сайтов редактирования приблизи
Именно поэтому некоторые герминальные
тельно в 1600 разных генах [17-20]. Чем обус
инактивирующие мутации в человеческом гене
ловлен такой уровень редактирования? Большин
ADAR, кодирующем ADAR1, вызывают орфан
ство сайтов находятся в расположенных рядом
ное заболевание - одну из форм синдрома Ай
Alu повторах, вставленных в обратной ориента
карди-Гутьерес (аутосомно рецессивная форма
ции, что после транскрипции приводит к обра
синдрома 6, инвентарный номер в базе знаний
зованию структур дцРНК [17-20]. Таким обра
OMIM 615010 [29]), при котором наблюдается
зом, высокий уровень редактирования РНК
интерферонопатия и детский энцефалит [30].
достигается за счет наличия в геноме данных
Так проявляется усиленный интерфероновый
элементов, когда они транскрибируются [21].
ответ в отсутствии уравновешивающей его амп
У человека насчитывается свыше миллиона Alu
литуду аденозиндезаминазы. Следует отметить,
повторов длиной 300 п.н., что составляет ~10%
что другие мутации в гене ADAR вызывают менее
всего генома [22]. Таким образом, это свойство
фатальное, аутосомно доминантное заболева
генома человека делает его РНК продукты осо
ние - симметричный наследственный дисхро
бенно подверженными действию ADAR.
матоз или акропигментацию (номер OMIM
127400) [31]. При этом синдроме без существен
ного вреда для организма в целом возникают
ADAR1 И УПРАВЛЕНИЕ
очаги гипер и гипопигментации кожи. Предпо
ИММУНИТЕТОМ
лагается, что ADAR1 каким то образом участву
ет в миграции и дифференцировке кератиноци
У всех позвоночных ферменты ADAR, как
тов [31], но механизмы этого явления еще
предполагается, дезаминируют дцРНК, насы
предстоит выяснить.
щенную аденозиновыми остатками. Например,
Возникает вопрос: а как воздействует деза
эту функцию у человека выполняет фермент
минирование аденозина в вирусной РНК на
ADAR1, кодируемый геном ADAR. Двухцепочеч
судьбу самого вируса? Оказывается, что в одних
ные участки РНК, особенно протяженные, вы
случаях активность ADAR обладает провирус
зывают у клеточных механизмов насторожен
ным действием, а в других - наоборот. Это зави
ность, поскольку часто такая РНК характеризу
сит от природы вируса и активации различных
ет геномы вирусов. Так, у млекопитающих на
молекулярных каскадов в клетке.
копление дцРНК посредством действия на осо
Действительно, редактирование вирусной
бые сенсоры, а именно, RIG I подобные (на
РНК увеличивает разнообразие ее последова
пример, MDA5) и Toлл подобные рецепторы (в
тельностей. Показано, что отредактированная
частности, TLR3), и вызывает выброс интерфе
форма РНК может обладать как провирусными,
рона I типа, после чего реализуется противови
так и противовирусными свойствами [32], хотя
русный ответ. Например, в клетке посредством
механизмы этого явления все еще не до конца
активации протеинкиназы R (PKR), в том числе
изучены. Так, ADAR1 может редактировать
за счет взаимодействия с двухцепочечной РНК,
РНК вирусов гепатита С и лимфоцитарного хо
быстро ингибируется трансляция, что может по
риоменингита, препятствуя их репликации
мешать размножению вируса [23]. Показано,
[33,34], а редактирование вируса гриппа А спо
что интерфероновый ответ в клетке индуцирует
собствует его деградации посредством рибонук
соответствующий сплайс вариант ADAR1, p150
леаз, распознающих инозиновые сигналы [35].
[24]. Последний начинает активнее дезамини
В то же время ADAR1 играет роль в усилении
ровать вирусную или другую дцРНК, что приво
репликации вирусов Эпштейна-Барр и герпеса 8
дит к ее разворачиванию. Это, как полагают,
типа за счет редактирования вирусных мик
противодействует интерфероновому ответу по
роРНК [36, 37]. Также этот фермент редактиру
принципу отрицательной обратной связи [5].
ет вирус кори и может способствовать провирус
Кроме того, сообщается о неферментативном
ной активности путем подавления активации
взаимодействии этой изоформы с PKR, в ре
протеинкиназы R в ответ на двухцепочечную
зультате чего активность последней ингибирует
РНК [38], а в случае гиперредактирования виру
ся [25]. Таким образом, можно сказать, что ак
са функция может стать противовирусной [39].
тивность ADAR1 защищает клетки от избыточ
Особым образом активность ADAR1 участ
ных воспалительных реакций, опосредованных
вует в жизненном цикле вируса гепатита D
интерферонами I типа (рис. 1). В частности,
(HDV) [40]. Геном вируса кодирует единствен
ADAR1 не дает развиваться этим процессам в
ный белок, называемый просто антигеном гепа
БИОХИМИЯ том 84 вып. 8 2019
6*
1132
ГОНЧАРОВ и др.
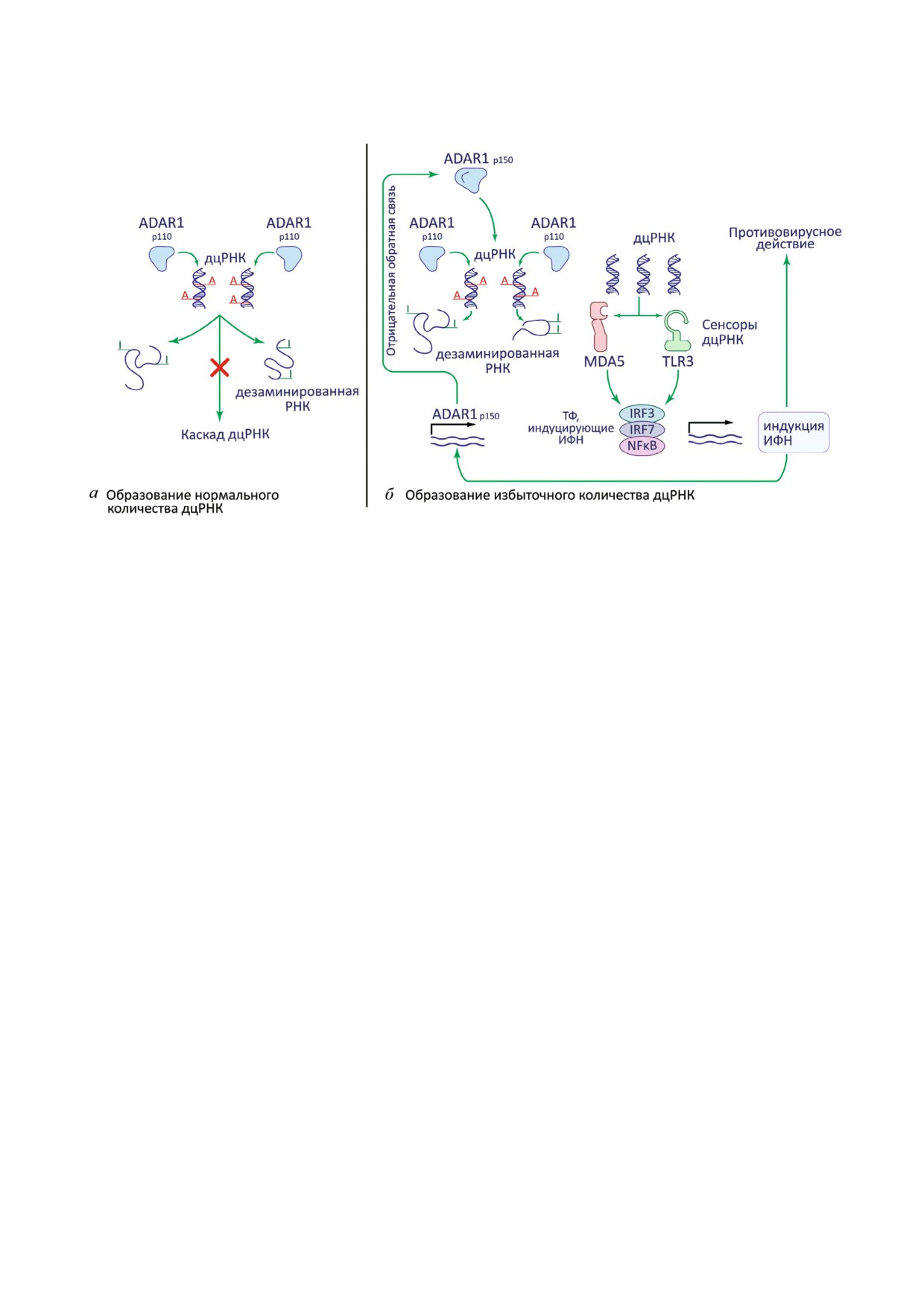
Рис. 1. Иммуносупрессорное действие ADAR1 (ген ADAR) в клетках млекопитающих. В обычной ситуации (а) при неболь
шом количестве двухцепочечной РНК фермент в конститутивной форме p110 дезаминирует остатки аденозина, образуя
инозин. В итоге двухцепочечная структура нарушается, а каскад сенсоров дцРНК не активируется. При повышенной кон
центрации дцРНК (б), например, в результате вирусной инфекции или транскрипции транспозонов, активности консти
тутивной формы ADAR1 p110 не хватает. Сенсоры дцРНК нескольких видов запускают реакцию экспрессии ответа ин
терферонов I типа для активации механизмов клеточного иммунитета. Интерфероновый ответ индуцирует продукцию
особой сплайс изоформы ADAR1 p150, которая по принципу отрицательной обратной связи снижает концентрацию
дцРНК. ТФ, транскрипционные факторы; ИФН, интерферон I типа.
biokhsm/
тита D (HDAg). В своей неотредактированной
рования механизму. С этим соотносятся новые
форме он способствует репликации вируса.
данные о том, что активация транскрипции
Кольцевой РНК антигеном HDV подвергается
LINE1 вовлечена в процесс старения и способ
редактированию, в результате чего амбер кодон
ствует в стареющих клетках развитию интерфе
итоговой мРНК меняется на кодон триптофана.
рон зависимого возрастного воспаления [41].
Новый белок HDAg L оказывается на 19-20
Таким образом, следует выдвинуть обоснован
аминокислотных остатков длиннее, и, в отличие
ную гипотезу о том, что сниженная активность
от исходного HDAg S, он ингибирует реплика
фермента ADAR1 может также вносить вклад в
цию вируса и способствует упаковке вируса в
механизмы старения.
капсид. По мере нарастания редактирования
вирусных геномов реализуется жизненный цикл
HDL, который приспособил для этого ADAR1 в
ADAR1 И ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
клетке хозяина [40].
Иммунная функция ADAR1, в основном, не
Метаболические и другие молекулярные
приводит к перекодированию белковых после
процессы, связанные со старением и развитием
довательностей. Этот изофермент требует для
злокачественных опухолей, зачастую противо
работы протяженных участков двухцепочечной
направлены. Образно выражаясь, развитие опу
РНК и, в частности, взаимодействует с тран
холей можно назвать избыточным омоложени
скриптами различных повторов, изобилующих в
ем. В соответствии с этой логикой, было обна
геномах млекопитающих. Так, у человека работа
ружено, что некоторые клеточные линии рака
ADAR1 ограничивает активность ретротранспо
легкого оказались зависимыми от ADAR1 [42].
зонов LINE1 [4], причем, по видимому, по от
Блокировка этого фермента различными спосо
дельному, не связанному с реакцией дезамини
бами замедляла рост опухолевых клеток в куль
БИОХИМИЯ том 84 вып. 8 2019
РЕДАКТИРОВАНИЕ РНК АДЕНОЗИНДЕЗАМИНАЗАМИ ADAR
1133
туре. Поскольку в этих условиях об иммунных
в отношении отредактированных пептидов цик
функциях говорить не приходится, зависимость
лина I, присутствуют в опухолях человека и ата
от ADAR1 объясняется его способностью подав
куют злокачественные клетки, на которых
лять протеинкиназу R. Последняя индуцируется
представлен этот эпитоп [44]. Так, активность
не только выбросом двухцепочечной ДНК, но и
ADAR1 не только помогает опухолям уклонять
другими стрессовыми факторами, обычными в
ся от иммунного надзора, но, вместе с тем, мо
раковых клетках. Как было указано выше, PKR
жет и формировать опасные для них неоантиге
способна ингибировать трансляцию белка в це
ны.
лом, что для некоторых раковых клеточных ли
ний оказалось губительным.
Более того, выяснилось, что на уровне цело
ADAR2 И РЕДАКТИРОВАНИЕ ПРОТЕОМА
го организма функция ADAR1 препятствует от
вету злокачественных опухолей на лечение ин
Фермент ADAR2, кодируемый в человече
гибиторами иммунных контрольных точек, на
ском гене ADARB1, также свойственный для всех
пример, лекарственным антителом против PD
позвоночных, функционально отличается от
L1 [3]. Сниженная активность фермента оказа
ADAR1 по выбору мишеней. Также склонный к
лась прогностическим фактором клинического
редактированию двухцепочечной РНК за счет
ответа на терапию, а ее ингибирование у мо
наличия соответствующего связывающего до
дельных животных также приводило к этому от
мена, он более тяготеет к редактированию коди
вету. Выяснилось, что для Т клеточного ответа
рующих последовательностей [45]. В последних
на опухоль, пробуждаемого терапией, необхо
двухцепочечные участки отличаются большим
дим также интерфероновый воспалительный
количеством неспаренных оснований по срав
ответ. Подавление этой реакции активностью
нению с таковыми, находящимися в повторах
ADAR1 в опухолевых клетках делает опухоль ус
SINE и LINE [46], которые предпочитает
тойчивой к лечению. Предлагаются адресные
ADAR1. Есть предположение, что эта изоформа,
методы доставки ингибиторов экспрессии
несмотря на порядковый номер, эволюционно
ADAR1, например, с помощью РНК интерфе
является более молодой [47]. Действительно, у
ренции для того, чтобы способствовать воспале
предковых представителей Metazoa, например,
нию в опухоли и сделать ее чувствительной к
губок и гребневиков, имеется всего одна форма
иммунотерапии [43].
ADAR, и она по составу доменов напоминает
Повышение экспрессии ADAR1 и увеличе
ADAR2, будучи лишенной особого, связываю
ние редактирования его субстратов обнаружено
щего Z форму нуклеиновой кислоты домена
при различных видах злокачественных опухо
[13]. В подтверждение этого предположения, у
лей, что было подробно описано в недавнем об
беспозвоночных все ферменты семейства напо
зоре [43]. Из 504 типов злокачественных опухо
минают ADAR2. Например, у дрозофилы ADAR
лей только в 7% наблюдается повышенное ре
представлен единственным геном [8]. У голово
дактирование. Наибольшее количество событий
ногих моллюсков их два, но, вероятно, один из
редактирования найдено при раке яичника, ме
них возник в ходе дупликации исходного гена
ланоме и раке молочной железы [44]. Это объяс
[48]. У беспозвоночных нет системы интерферо
нимо в свете того, что ADAR1 помогает опухо
новой сигнализации, в которой задействован
лям бороться с иммунитетом. С другой стороны,
ADAR1, и борьбу с вирусными инфекциями
редактирование ферментами ADAR способству
они, как предполагается, осуществляют при по
ет формированию «неоэпитопов», или «неоан
мощи РНК интерференции [49]. Поэтому сис
тигенов», распознаваемых молекулами гисто
тема противовеса интерфероновому ответу, ко
совместимости I класса. Действительно, иммун
торую осуществляет ADAR1 у человека, у бес
ная система «обучается» и вырабатывает резис
позвоночных, вероятнее всего, не образовалась.
тентность к собственным антигенам в тимусе на
Какую же функцию выполняет ADAR2? Как
ранних стадиях развития организма. В процесс
отмечалось выше, он способен перекодировать
обучения могут быть не включены отредактиро
белки, поскольку инозин в кодонах обладает
ванные фрагменты белка, например, в связи с
большим сродством к цитозину, чем к урацилу,
низкой активностью ADAR в тот момент. Таким
таким образом, имитируя в генетическом коде
образом, отредактированные участки белка мо
гуанозин, а не исходный аденозин [15]. Описано
гут позднее быть признаны чужеродными.
значительное количество замен в различных
Недавно было показано, что неоэпитоп бел
мРНК мишенях, обеспечивающих функцио
ка клеточного цикла циклина I образуется за
нальную гибкость кодируемых белков. Это про
счет активности ADAR1. Кроме того, выяснено,
исходит в условиях разных стадий развития ор
что эффекторные CD8+ Т клетки, специфичные
ганизма или в разных органах и тканях, в допол
БИОХИМИЯ том 84 вып. 8 2019
1134
ГОНЧАРОВ и др.
Функции воздействующих на двухцепочечную РНК аденозиндезаминаз (ADAR) человека и их связь с заболеваниями
Характеристика
ADAR1 (ген ADAR)
ADAR2 (ген ADARB1)
Субстратная специ
протяженные участки дцРНК [5]
особые участки дцРНК, принципы избира
фичность
тельности неясны
Воздействие на кле
подавляет за счет снижения концентрации
не воздействует
точный иммунитет
дцРНК [28]
Редактирование ко
известно, предполагается, что выражено в
преимущественно редактирует кодирующие
дирующих белки
меньшей степени, чем для ADAR2
участки; классический пример - редактирова
участков
ние субъединицы глутаматных рецепторов
gria2 с изменением их электрофизиологичес
ких характеристик [60]
Индукция интерфе
происходит за счет экспрессии дополнитель
не происходит
ронами I типа
ного сплайс варианта (p150) с альтернативно
го промотора [61]
Роль при злокачест
способствует опухолевой прогрессии за счет
предположительно участвует в образовании
венных опухолях
подавления клеточного иммунитета [42];
опухолевых неоантигенов
установлено участие в образовании опухоле
вых неоантигенов [44]
Роль при клеточном
препятствует за счет ингибирования актив
не установлена
старении
ности транспозонов LINE1 [4]
Генные дефекты
синдром Айкарди-Гутиерреса: выраженные
не известны, то есть, приводят к гибели эмб
аутоиммунные и воспалительные реакции [30];
риона; необходимый для организма фермент:
симметричный врожденный дисхроматоз, или
редактирует транскрипты белков, важных для
акропигментация [31] - нефатальное наруше
нормального развития нервной системы [62]
ние пигментации кожи
нение к генетической изменчивости [50]. Осо
Несмотря на то, что млекопитающим не
бенно широко процесс перекодирования проте
нужно интенсивно отвечать на изменения окру
ома представлен у беспозвоночных, где это, по
жающих температур, их протеом также переко
сути, является главнейшей функцией ADAR.
дируется за счет редактирования РНК фермен
В нашей работе на уровне протеома головного
тами ADAR. Наиболее интенсивно этот процесс
мозга дрозофилы было идентифицировано ~70
выражен в центральной нервной системе, где
участков редактирования. Количественный ана
его связывают с активностью ADAR2 [20]. Веро
лиз методом таргетной протеомики показал, что
ятно, это система реагирования на изменяющи
у взрослых насекомых некоторые белки голов
еся под воздействием внешних факторов по
ного мозга в значительной степени находятся в
требности нервных клеток в тех случаях, когда
отредактированном состоянии [2]. У калифор
результата нельзя достичь за счет альтернатив
нийского осьминога в панорамном протеоме
ного сплайсинга или посттрансляционных мо
обнаружено несколько сотен кодирующих
дификаций.
участков редактирования, причем ~50 - в одном
Воздействие ADAR2 на развитие и нормаль
из калиевых каналов [51]. Показано, что изме
ное функционирование центральной нервной
нение последовательности в одном из них меня
системы путем редактирования белковых после
ет кинетику инактивации канала. Это считается
довательностей исследовано на конкретных при
адаптацией к различным температурам воды,
мерах. Активность фермента приводит к измене
также, по термодинамическим принципам, воз
нию аминокислотной последовательности в бел
действующим на работу ионных каналов. Для
ках серотонинового рецептора 2C (ген HTR2C),
одинаковой работы своих молекулярных машин
потенциал управляемых ионных каналов и глу
в изменяющихся условиях пойкилотермное жи
таматных рецепторов групп GluK и GluA [53, 54].
вотное, к которым относится головоногий мол
Так, замена глутамина на аргинин в субъединице
люск, прибегает к редактированию РНК, по
GluA2 глутаматного рецептора (ген gria2) ослаб
скольку геномные адаптации в этой ситуации
ляет поток кальция в канал, что является обяза
недоступны [52].
тельным событием нейронального развития мле
БИОХИМИЯ том 84 вып. 8 2019
РЕДАКТИРОВАНИЕ РНК АДЕНОЗИНДЕЗАМИНАЗАМИ ADAR
1135
копитающих. Неудивительно, что неправильное
млекопитающих. Так, у насекомых и головоно
функционирование фермента, связанного с си
гих моллюсков ADAR преимущественно пере
наптической передачей и тонкой регуляцией
кодирует аминокислотные последовательности,
когнитивных и психических функций, приводит
обеспечивая эволюционную и экологическую
к значительным последствиям [55]. При нокауте
пластичность, например, адаптацию пойкило
гена ADAR2 у мышей в течение двух-трех недель
термных организмов к изменениям окружаю
после рождения развиваются судороги, несов
щей температуры.
местимые с жизнью [56]. Снижение эффектив
Функциональные различия двух активных
ности редактирования субъединицы GluA2 при
изоформ ADAR, существующих у млекопитаю
водит к гибели мотонейронов, характерной для
щих, представлены в таблице. У млекопитаю
пациентов с боковым амиотрофическим склеро
щих одна из изоформ фермента ADAR1 дезами
зом [57, 58]. Пониженная экспрессия ADAR2, и
нирует мишени из протяженных участков двух
как следствие, измененный уровень редактиро
цепочечной РНК, обеспечивая защиту клетки
вания мРНК серотонинового рецептора 5HT2C,
от активируемого такими РНК неспецифичес
выявлены у пациентов с депрессивными рас
кого противовирусного иммунитета. Интерес
стройствами и шизофренией [59].
но, что каскад интерферонов I типа - основной
фактор этого вида иммунитета - индуцирует
Благодаря интенсивным исследованиям
особый сплайс вариант ADAR1, который по
последних лет, в том числе с привлечением
давляет действие каскада по принципу отрица
омиксных технологий, стали понятны функцио
тельной обратной связи. Многие клеточные ме
нальные характеристики изоформ ADAR, суще
ханизмы, способные подавлять клеточный им
ствующих у животных - от беспозвоночных до
мунитет, как показано, помогают злокачествен
Рис. 2. Участие ферментов семейства ADAR человека в прогрессии злокачественных опухолей и клеточном старении.
ADAR1 (ген ADAR) может оказывать двойственный эффект на прогрессию опухолей, участвуя в иммуносупрессии, но с
тем же - в образовании неоантигенов. В целом, имеющиеся сведения указывают на то, что активность этого гена скорее
благоприятна для опухолевого роста. Точечные эффекты ADAR2 (ADARB1) модулируют работу белков нервной системы;
роль этой изоформы в патогенезе опухолей, если она есть, мало изучена. Способность ADAR1 инактивировать тран
скрипты повторов LINE1 могут препятствовать их вкладу в клеточное старение.
biokhsm/
БИОХИМИЯ том 84 вып. 8 2019
1136
ГОНЧАРОВ и др.
ным опухолям избегать его атак. ADAR1 не стал
ние жизни млекопитающего, в том числе, чело
исключением, и его активность может служить
века, обеспечивает пластичность работы клеток
предиктором уклонения опухолей от терапии
центральной нервной системы. Редактирование
ингибиторами иммунных контрольных точек.
матричных РНК ферментом ADAR2 обеспечи
При том, что ADAR1 способствует росту зло
вает управляемую пластичность протеома наря
качественных опухолей, этот фермент может
ду с геномным полиморфизмом и альтернатив
инактивировать транскрипты повторов LINE1,
ным сплайсингом.
которые за счет обратной транскрипции спо
собны оказывать неблагоприятные эффекты,
вызывая клеточное старение (рис. 2).
Финансирование. Работа выполнена при под
В то время как ADAR1 дезаминирует боль
держке Российского научного фонда (грант
шое количество мишеней с двухцепочечными
№ 17 15 01229).
участками, ADAR2 у млекопитающих работает
Конфликт интересов. Авторы заявляют об от
избирательно, по функциям приближаясь к
сутствии конфликта интересов.
сходному ферменту беспозвоночных. Известно
Соблюдение этических норм. Настоящая
некоторое количество белковых мишеней, тран
статья не содержит описания каких либо иссле
скрипты которых претерпевают перекодирова
дований с использованием животных и людей в
ние. Перекодирование некоторых белков в тече качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Lobas, A.A., Pyatnitskiy, M.A., Chernobrovkin, A.L.,
8. Palladino, M.J., Keegan, L.P., O’Connell, M.A., and
Ilina, I.Y., Karpov, D.S., Solovyeva, E.M., Kuznetsova, K.G.,
Reenan, R.A. (2000) dADAR, a Drosophila double
Ivanov, M. V, Lyssuk, E.Y., Kliuchnikova, A.A., Voronko, O.E.,
stranded RNA specific adenosine deaminase is highly
Larin, S.S., Zubarev, R.A., Gorshkov, M.V, and
developmentally regulated and is itself a target for RNA
Moshkovskii, S.A. (2018) Proteogenomics of malignant
editing, RNA, 6, 1004-1018.
melanoma cell lines: the effect of stringency of exome data
9. Melcher, T., Maas, S., Herb, A., Sprengel, R., Higuchi, M.,
filtering on variant peptide identification in shotgun pro
and Seeburg, P.H. (1996) RED2, a brain specific member
teomics, J. Proteome Res., 17, 1801-1811, doi: 10.1021/
of the RNA specific adenosine deaminase family, J. Biol.
acs.jproteome.7b00841.
Chem., 271, 31795-31798.
2.
Kuznetsova, K.G., Kliuchnikova, A.A., Ilina, I.U.,
10. Oakes, E., Anderson, A., Cohen Gadol, A., and Hundley, H.A.
Chernobrovkin, A.L., Novikova, S.E., Farafonova, T.E.,
(2017) Adenosine deaminase that acts on RNA 3 (ADAR3)
Karpov, D.S., Ivanov, M.V, Goncharov, A.O., Ilgisonis, E.V.,
Binding to glutamate receptor subunit B pre mRNA
Voronko, O.E., Nasaev, S.S., Zgoda, V.G., Zubarev, R.A.,
inhibits RNA editing in glioblastoma, J. Biol. Chem., 292,
Gorshkov, M.V, and Moshkovskii, S.A.
(2018)
4326-4335, doi: 10.1074/jbc.M117.779868.
Proteogenomics of adenosine to inosine RNA editing in
11. Schumacher, J.M., Lee, K., Edelhoff, S., and Braun, R.E.
the fruit fly, J. Proteome Res., 17, 3889-3903, doi: 10.1021/
(1995) Distribution of Tenr, an RNA binding protein, in a
acs.jproteome.8b00553.
lattice like network within the spermatid nucleus in the
3.
Ishizuka, J.J., Manguso, R.T., Cheruiyot, C.K., Bi, K.,
mouse, Biol. Reprod., 52, 1274-1283.
Panda, A., Iracheta Vellve, A., Miller, B.C., Du, P.P.,
12. Saunders, L.R., and Barber, G.N. (2003) The dsRNA
Yates, K.B., Dubrot, J., Buchumenski, I., Comstock, D.E.,
binding protein family: critical roles, diverse cellular func
Brown, F.D., Ayer, A., Kohnle, I.C., Pope, H.W.,
tions, FASEB J., 17, 961-983, doi: 10.1096/fj.02 0958rev.
Zimmer, M.D., Sen, D.R., Lane Reticker, S.K.,
13. Herbert, A., Alfken, J., Kim, Y.G., Mian, I.S., Nishikura, K.,
Robitschek, E.J., Griffin, G.K., Collins, N.B., Long, A.H.,
and Rich, A. (1997) A Z DNA binding domain present in
Doench, J.G., Kozono, D., Levanon, E.Y., and Haining, W.N.
the human editing enzyme, double stranded RNA adeno
(2019) Loss of ADAR1 in tumours overcomes resistance
sine deaminase, Proc. Natl. Acad. Sci. USA,
94,
to immune checkpoint blockade, Nature, 565, 43-48,
8421-8426.
doi: 10.1038/s41586 018 0768 9.
14. Nishikura, K., Yoo, C., Kim, U., Murray, J.M., Estes, P.A.,
4.
Orecchini, E., Doria, M., Antonioni, A., Galardi, S.,
Cash, F.E., and Liebhaber, S.A. (1991) Substrate specifici
Ciafre, S.A., Frassinelli, L., Mancone, C., Montaldo, C.,
ty of the dsRNA unwinding/modifying activity, EMBO J.,
Tripodi, M., and Michienzi, A. (2017) ADAR1 restricts
10, 3523-3532.
LINE 1 retrotransposition, Nucleic Acids Res.,
45,
15. Bass, B.L., and Weintraub, H. (1988) An unwinding activ
155-168, doi: 10.1093/nar/gkw834.
ity that covalently modifies its double stranded RNA sub
5.
Bass, B.L. (2002) RNA editing by adenosine deaminases
strate, Cell, 55, 1089-1098.
that act on RNA, Annu. Rev. Biochem., 71, 817-846,
16. Licht, K., Janisiw, M.P., Jantsch, M.F., Anrather, D.,
doi: 10.1146/annurev.biochem.71.110601.135501.
Hartl, M., and Amman, F. (2018) Inosine induces context
6.
Hough, R.F., and Bass, B.L. (1994) Purification of the
dependent recoding and translational stalling, Nucleic
Xenopus laevis double stranded RNA adenosine deami
Acids Res., 47, 3-14, doi: 10.1093/nar/gky1163.
nase, J. Biol. Chem., 269, 9933-9939.
17. Levanon, E.Y., Eisenberg, E., Yelin, R., Nemzer, S.,
7.
Jin, Y., Zhang, W., and Li, Q. (2009) Origins and evolution
Hallegger, M., Shemesh, R., Fligelman, Z.Y., Shoshan, A.,
of ADAR mediated RNA editing, IUBMB Life, 61,
Pollock, S.R., Sztybel, D., Olshansky, M., Rechavi, G.,
572-578, doi: 10.1002/iub.207.
and Jantsch, M.F. (2004) Systematic identification of
БИОХИМИЯ том 84 вып. 8 2019
РЕДАКТИРОВАНИЕ РНК АДЕНОЗИНДЕЗАМИНАЗАМИ ADAR
1137
abundant A to I editing sites in the human transcriptome,
32.
Samuel, C.E. (2011) Adenosine deaminases acting on
Nat. Biotechnol., 22, 1001-1005, doi: 10.1038/nbt996.
RNA (ADARs) are both antiviral and proviral, Virology,
18.
Kim, D.D.Y., Kim, T.T.Y., Walsh, T., Kobayashi, Y.,
411, 180-193, doi: 10.1016/j.virol.2010.12.004.
Matise, T.C., Buyske, S., and Gabriel, A.
(2004)
33.
Taylor, D.R., Puig, M., Darnell, M.E.R., Mihalik, K., and
Widespread RNA editing of embedded alu elements in the
Feinstone, S.M. (2005) New antiviral pathway that medi
human transcriptome, Genome Res., 14, 1719-1725,
ates hepatitis C virus replicon interferon sensitivity through
doi: 10.1101/gr.2855504.
ADAR1, J. Virol., 79, 6291-6298, doi: 10.1128/JVI.79.10.
19.
Athanasiadis, A., Rich, A., and Maas, S.
(2004)
6291 6298.2005.
Widespread A to I RNA editing of Alu containing
34.
Zahn, R.C., Schelp, I., Utermohlen, O., and von Laer, D.
mRNAs in the human transcriptome, PLoS Biol., 2, e391,
(2007) A to G hypermutation in the genome of lympho
doi: 10.1371/journal.pbio.0020391.
cytic choriomeningitis virus, J. Virol., 81, 457-464,
20.
Blow, M., Futreal, P.A., Wooster, R., and Stratton, M.R.
doi: 10.1128/JVI.00067 06.
(2004) A survey of RNA editing in human brain, Genome
35.
Suspene, R., Petit, V., Puyraimond Zemmour, D.,
Res., 14, 2379-2387, doi: 10.1101/gr.2951204.
Aynaud, M. M., Henry, M., Guetard, D., Rusniok, C.,
21.
Eisenberg, E., Nemzer, S., Kinar, Y., Sorek, R., Rechavi, G.,
Wain Hobson, S., and Vartanian, J. P. (2011) Double
and Levanon, E.Y. (2005) Is abundant A to I RNA editing
stranded RNA adenosine deaminase ADAR 1 induced
primate specific? Trends Genet., 21, 77-81, doi: 10.1016/
hypermutated genomes among inactivated seasonal
j.tig.2004.12.005.
influenza and live attenuated measles virus vaccines,
22.
Shen, M.R., Batzer, M.A., and Deininger, P.L. (1991)
J. Virol., 85, 2458-2462, doi: 10.1128/JVI.02138 10.
Evolution of the master Alu gene(s), J. Mol. Evol., 33,
36.
Gandy, S.Z., Linnstaedt, S.D., Muralidhar, S., Cashman, K.A.,
311-320.
Rosenthal, L.J., and Casey, J.L. (2007) RNA editing of the
23.
Garcia, M.A., Gil, J., Ventoso, I., Guerra, S., Domingo, E.,
human herpesvirus 8 kaposin transcript eliminates its trans
Rivas, C., and Esteban, M. (2006) Impact of protein kinase
forming activity and is induced during lytic replication,
PKR in cell biology: from antiviral to antiproliferative
J. Virol., 81, 13544-13551, doi: 10.1128/JVI.01521 07.
action, Microbiol. Mol. Biol. Rev.,
70,
1032-1060,
37.
Iizasa, H., Wulff, B. E., Alla, N.R., Maragkakis, M.,
doi: 10.1128/MMBR.00027 06.
Megraw, M., Hatzigeorgiou, A., Iwakiri, D., Takada, K.,
24.
Yang, J. H., Nie, Y., Zhao, Q., Su, Y., Pypaert, M., Su, H.,
Wiedmer, A., Showe, L., Lieberman, P., and Nishikura, K.
and Rabinovici, R. (2003) Intracellular localization of dif
(2010) Editing of Epstein-Barr virus encoded BART6
ferentially regulated RNA specific adenosine deaminase
microRNAs controls their dicer targeting and consequent
isoforms in inflammation, J. Biol. Chem., 278, 45833-
ly affects viral latency, J. Biol. Chem., 285, 33358-33370,
45842, doi: 10.1074/jbc.M308612200.
doi: 10.1074/jbc.M110.138362.
25.
Clerzius, G., Gelinas, J. F., Daher, A., Bonnet, M.,
38.
Toth, A.M., Li, Z., Cattaneo, R., and Samuel, C.E. (2009)
Meurs, E.F., and Gatignol, A. (2009) ADAR1 interacts
RNA specific adenosine deaminase ADAR1 suppresses
with PKR during Human Immunodeficiency Virus infec
measles virus induced apoptosis and activation of protein
tion of lymphocytes and contributes to viral replication,
kinase PKR, J. Biol. Chem.,
284,
29350-29356,
J. Virol., 83, 10119- 10128, doi: 10.1128/JVI.02457 08.
doi: 10.1074/jbc.M109.045146.
26.
Porath, H.T., Knisbacher, B.A., Eisenberg, E., and
39.
Gelinas, J. F., Clerzius, G., Shaw, E., and Gatignol, A.
Levanon, E.Y. (2017) Massive A to I RNA editing is com
(2011) Enhancement of replication of RNA viruses by
mon across the Metazoa and correlates with dsRNA abun
ADAR1 via RNA editing and inhibition of RNA activated
dance, Genome Biol., 18, 185, doi: 10.1186/s13059 017
protein kinase, J. Virol., 85, 8460-8466, doi: 10.1128/
1315 y.
JVI.00240 11.
27.
Pestal, K., Funk, C.C., Snyder, J.M., Price, N.D.,
40.
Casey, J.L. (2011) Control of ADAR1 Editing of Hepatitis
Treuting, P.M., and Stetson, D.B. (2015) Isoforms of
Delta Virus RNAs, in Current topics in microbiology and
RNA editing enzyme ADAR1 independently control
immunology, vol.
353, pp.
123-143, doi:
10.1007/
nucleic acid sensor MDA5 driven autoimmunity and
82_2011_146.
multi organ development, Immunity,
43,
933-944,
41.
De Cecco, M., Ito, T., Petrashen, A.P., Elias, A.E., Skvir, N.J.,
doi: 10.1016/j.immuni.2015.11.001.
Criscione, S.W., Caligiana, A., Brocculi, G., Adney, E.M.,
28.
Mannion, N.M., Greenwood, S.M., Young, R., Cox, S.,
Boeke, J.D., Le, O., Beausejour, C., Ambati, J., Ambati, K.,
Brindle, J., Read, D., Nellеker, C., Vesely, C., Ponting, C.P.,
Simon, M., Seluanov, A., Gorbunova, V., Slagboom, P.E.,
McLaughlin, P.J., Jantsch, M.F., Dorin, J., Adams, I.R.,
Helfand, S.L., Neretti, N., and Sedivy, J.M. (2019) L1 dri
Scadden, A.D.J., Ohman, M., Keegan, L.P., and
ves IFN in senescent cells and promotes age associated
O’Connell, M.A.
(2014) The RNA editing enzyme
inflammation, Nature, 566, 73-78, doi: 10.1038/s41586
ADAR1 controls innate immune responses to RNA, Cell
018 0784 9.
Rep., 9, 1482-1494, doi: 10.1016/j.celrep.2014.10.041.
42.
Gannon, H.S., Zou, T., Kiessling, M.K., Gao, G.F., Cai, D.,
29.
Amberger, J.S., Bocchini, C.A., Schiettecatte, F., Scott, A.F.,
Choi, P.S., Ivan, A.P., Buchumenski, I., Berger, A.C.,
and Hamosh, A. (2015) OMIM.org: Online Mendelian
Goldstein, J.T., Cherniack, A.D., Vazquez, F., Tsherniak, A.,
Inheritance in Man (OMIM®), an online catalog of
Levanon, E.Y., Hahn, W.C., and Meyerson, M. (2018)
human genes and genetic disorders, Nucleic Acids Res., 43,
Identification of ADAR1 adenosine deaminase dependen
D789-D798, doi: 10.1093/nar/gku1205.
cy in a subset of cancer cells, Nat. Commun., 9, 5450,
30.
Rice, G.I., Kasher, P.R., Forte, G.M.A., Mannion, N.M.,
doi: 10.1038/s41467 018 07824 4.
Greenwood, S.M., et al. (2012) Mutations in ADAR1
43.
Xu, L. D., and Ohman, M. (2018) ADAR1 editing and its
cause Aicardi Goutieres syndrome associated with a type I
role in cancer, Genes (Basel)., 10, 12, doi: 10.3390/
interferon signature, Nat. Genet.,
44,
1243-1248,
genes10010012.
doi: 10.1038/ng.2414.
44.
Zhang, M., Fritsche, J., Roszik, J., Williams, L.J., Peng, X.,
31.
Miyamura, Y., Suzuki, T., Kono, M., Inagaki, K., Ito, S.,
Chiu, Y., Tsou, C. C., Hoffgaard, F., Goldfinger, V.,
Suzuki, N., and Tomita, Y. (2003) Mutations of the RNA
Schoor, O., Talukder, A., Forget, M.A., Haymaker, C.,
specific adenosine deaminase gene (DSRAD) are involved
Bernatchez, C., Han, L., Tsang, Y. H., Kong, K., Xu, X.,
in dyschromatosis symmetrica hereditaria, Am. J. Hum.
Scott, K.L., Singh Jasuja, H., Lizee, G., Liang, H.,
Genet., 73, 693-699, doi: 10.1086/378209.
Weinschenk, T., Mills, G.B., and Hwu, P. (2018) RNA
БИОХИМИЯ том 84 вып. 8 2019
1138
ГОНЧАРОВ и др.
editing derived epitopes function as cancer antigens to elic
and RNA editing studies, RNA Biol., 6, 248-253,
it immune responses, Nat. Commun., 9, 3919, doi: 10.1038/
doi: 10.4161/rna.6.3.8370.
s41467 018 06405 9.
54. Barbon, A., and Barlati, S. (2011) Glutamate receptor
45.
Higuchi, M., Single, F.N., Kohler, M., Sommer, B.,
RNA editing in health and disease, Biochemistry (Moscow),
Sprengel, R., and Seeburg, P.H. (1993) RNA editing of
76, 882, doi: 10.1134/S0006297911080037.
AMPA receptor subunit GluR B: a base paired intron
55. Gallo, A., Vukic, D., Michalik, D., O’Connell, M.A., and
exon structure determines position and efficiency, Cell, 75,
Keegan, L.P. (2017) ADAR RNA editing in human dis
1361-1370. DOI:10.1016/0092 8674(93)90622 W.
ease; more to it than meets the I, Hum. Genet., 136,
46.
Egebjerg, J., Kukekov, V., and Heinemann, S.F. (1994)
1265-1278, doi: 10.1007/s00439 017 1837 0.
Intron sequence directs RNA editing of the glutamate recep
56. Higuchi, M., Maas, S., Single, F.N., Hartner, J., Rozov, A.,
tor subunit GluR2 coding sequence, Proc. Natl. Acad. Sci.,
Burnashev, N., Feldmeyer, D., Sprengel, R., and Seeburg, P.H.
91, 10270 LP - 10274, doi: 10.1073/pnas.91.22.10270.
(2000) Point mutation in an AMPA receptor gene rescues
47.
Grice, L.F., and Degnan, B.M. (2015) The origin of the
lethality in mice deficient in the RNA editing enzyme
ADAR gene family and animal RNA editing, BMC Evol.
ADAR2, Nature, 406, 78-81, doi: 10.1038/35017558.
Biol., 15, 4, doi: 10.1186/s12862 015 0279 3.
57. Kawahara, Y., Ito, K., Sun, H., Aizawa, H., Kanazawa, I.,
48.
Yablonovitch, A.L., Deng, P., Jacobson, D., and Li, J.B.
and Kwak, S. (2004) RNA editing and death of motor neu
(2017) The evolution and adaptation of A to I RNA edit
rons, Nature, 427, 801, doi: 10.1038/427801a.
ing, PLoS Genet., 13, e1007064, doi: 10.1371/journal.pgen.
58. Kwak, S., and Kawahara, Y. (2005) Deficient RNA editing
1007064.
of GluR2 and neuronal death in amyotropic lateral sclero
49.
Fire, A., Xu, S., Montgomery, M.K., Kostas, S.A., Driver, S.E.,
sis, J. Mol. Med., 83, 110-120, doi: 10.1007/s00109 004
and Mello, C.C. (1998) Potent and specific genetic inter
0599 z.
ference by double stranded RNA in Caenorhabditis ele-
59. Lyddon, R., Dwork, A.J., Keddache, M., Siever, L.J., and
gans, Nature, 391, 806-811, doi: 10.1038/35888.
Dracheva, S. (2013) Serotonin 2c receptor RNA editing in
50.
Walkley, C.R., and Li, J.B. (2017) Rewriting the transcrip
major depression and suicide, World J. Biol. Psychiatry, 14,
tome: adenosine to inosine RNA editing by ADARs,
590-601, doi: 10.3109/15622975.2011.630406.
Genome Biol., 18, 205, doi: 10.1186/s13059 017 1347 3.
60. Sommer, B., Kohler, M., Sprengel, R., and Seeburg, P.H.
51.
Liscovitch Brauer, N., Alon, S., Porath, H.T., Elstein, B.,
(1991) RNA editing in brain controls a determinant of ion
Unger, R., Ziv, T., Admon, A., Levanon, E.Y., Rosenthal, J.J.C.,
flow in glutamate gated channels, Cell, 67, 11-19,
and Eisenberg, E. (2017) Trade off between transcriptome
doi: 10.1016/0092 8674(91)90568 J.
plasticity and genome evolution in cephalopods, Cell, 169,
61. Patterson, J.B., and Samuel, C.E. (1995) Expression and
191 202.e11, doi: 10.1016/j.cell.2017.03.025.
regulation by interferon of a double stranded RNA specif
52.
Garrett, S., and Rosenthal, J.J.C. (2012) RNA editing
ic adenosine deaminase from human cells: evidence for two
underlies temperature adaptation in K+ channels from
forms of the deaminase, Mol. Cell. Biol., 15, 5376-5388.
polar octopuses, Science, 335, 848-851, doi: 10.1126/sci
62. Wright, A., and Vissel, B. (2012) The essential role of
ence.1212795.
AMPA receptor GluR2 subunit RNA editing in the normal
53.
Iwamoto, K., Bundo, M., and Kato, T. (2009) Serotonin
and diseased brain, Front. Mol. Neurosci.,
5,
34,
receptor 2C and mental disorders: Genetic, expression,
doi: 10.3389/fnmol.2012.00034.
RNA EDITING BY ADAR ADENOSINE DEAMINASES:
FROM THE MOLECULAR PLACTICITY OF NEURAL PROTEINS
TO THE MECHANISMS OF HUMAN CANCER
A. O. Goncharov1, A. A. Kliuchnikova1,2, S. S. Nasaev2, and S. A. Moshkovskii1,2*
1 Institute of Biomedical Chemistry, 119121 Moscow, Russia; E-mail: smosh@mail.ru
2 Pirogov Russian National Research Medical University, 117997 Moscow, Russia
Received April 4, 2019
Revised April 30, 2019
Accepted May 1, 2019
RNA editing by adenosine deaminases of ADAR family attracts growing interest of researchers, both zoologists who
study ecological and evolutionary plasticity of invertebrates and medical biochemists who are focused on mechanisms
of cancers and other human diseases. Isoforms of this enzyme deaminate adenosine residues in double strand (ds)
regions of RNA with inosine formation. As a result, some RNAs change their dimensional structure and functions.
Thus, adenosine to inosine editing in coding parts of mRNAs may cause amino acid substitutions in corresponding
proteins. In the review, we compose the state of the art on functions of two active ADAR isoforms in mammals includ
ing human. ADAR1 protein, which acts non specifically on extended stretches of dsRNA, is capable of immunosup
pressing effects via inactivation of the dsRNA interaction with its specific sensors which induce the cell immunity.
Notably, the expression of a specific ADAR1 splice variant is regulated by type I interferons based on the negative
feedback. It was shown that immunosuppressing effects of ADAR1 facilitate the progression of some cancer types. On
the other hand, amino acid sequence changes through editing of mRNAs by ADAR enzymes can result in formation
of neoantigens that activate antitumor immunity. ADAR2 isoform acts on RNA more selectively, and its function is
associated with the editing of protein coding regions of mRNA. As a result, amino acid substitutions are introduced,
which are essential for proper functioning of some neurotransmitter receptors in the central nervous system.
Keywords: adenosine deaminase, RNA editing, ADAR, cancer, immunity, neoantigen
БИОХИМИЯ том 84 вып. 8 2019