БИОХИМИЯ, 2019, том 84, вып. 9, с. 1226 - 1243
УДК 571.27
МЕХАНИЗМЫ ИНДУКЦИИ АНТИФОСФОЛИПИДНОГО
СИНДРОМА. РОЛЬ NKT КЛЕТОК
Обзор
© 2019
С.В. Ширшев
Институт экологии и генетики микроорганизмов УрО РАН -
филиал Пермского федерального исследовательского центра УрО РАН,
614081 Пермь, Россия; электронная почта: shirshev@iegm.ru
Поступила в редакцию 04.03.2019
После доработки 03.06.2019
Принята к публикации 03.06.2019
В данном обзоре рассматриваются механизмы потенциального участия натуральных киллерных Т клеток
(NKT) в индукции антифосфолипидных антител, играющих основную патогенетическую роль в формиро
вании антифосфолипидного синдрома. На основании литературных данных рассматриваются патогенез ан
тифосфолипидного синдрома и современные аспекты формирования антител с участием фолликулярных
хелперных NKT клеток II типа. Представлено несколько потенциальных механизмов участия NKT клеток
в индукции антифосфолипидных антител.
КЛЮЧЕВЫЕ СЛОВА: антифосфолипидный синдром, антифосфолипидные антитела, NKT клетки,
В лимфоциты, гуморальный иммунный ответ.
DOI: 10.1134/S0320972519090021
Антифосфолипидный синдром (АФС), так
боза, синдромом потери плода (повторные вы
же известный как синдром Хьюза, представляет
кидыши), иммунной тромбоцитопенией и нев
собой системное аутоиммунное заболевание,
рологическими расстройствами [1, 2]. Этиоло
которое характеризуется возникновением тром
гическим фактором АФС считается появление
антифосфолипидных антител (АФА), включая
Принятые сокращения: АКА - антикардиолипино
волчаночный антикоагулянт (ВА), антикардио
вые антитела; АФА - антифосфолипидные антитела;
липиновые антитела (АКА) и антитела против
АФС - антифосфолипидный синдром; ВА - волчаночный β2 гликопротеина I (β2GPI) [3, 4]. Установлена
антикоагулянт; КАФС - катастрофический АФС; ТФ - тесная взаимосвязь между АФА, тромбозами со
тканевой фактор; AP 1 - активаторный белок 1; APC - ан
судов и множеством акушерских осложнений
тиген презентирующая клетка; ApoER2- аполипопротеин
Е2; APRIL - лиганд, индуцирующий пролиферацию;
[1]. Практически все АФА являются аутореак
BAFF - фактор активации В клеток; Bcl 6 - транскрип
тивными по отношению не только к фосфоли
ционный фактор B клеточной лимфомы 6; BCR - B кле
пидам, но и к фосфолипидсвязывающим бел
точный рецептор; Blimp 1 - белок 1, индуцирующий соз
кам, таким как β2GPI и протромбин [5]. Боль
ревание B лимфоцита; CD - лейкоцитарный антиген;
шинство исследований показало, что β2GPI яв
DC - дендритная клетка; EC - эндотелиальная клетка;
FDC - фолликулярная дендритная клетка; FRC - фолли
ляется основной антигенной мишенью [6], а
кулярная ретикулярная клетка; GC - герминативный
анти β2GPI аутоантитела преимущественно от
центр; β2GPI - β2
гликопротеин I; HLA DR - антиген вечают за клинические проявления АФС [7].
лейкоцитов человека DR; ICOS - индуцибельный кости
АФА, как правило, связываются с анионными
мулятор; ICOS L - ICOS лиганд; IFN γ - интерферон γ;
Ig - иммуноглобулин; IL - интерлейкин; LDL R - рецеп
фосфолипидами и белковыми комплексами сы
тор липопротеина низкой и очень низкой плотности; mB -
воротки [6]. Взаимодействие между антителами
B клетка памяти; MHC - главный комплекс гистосовмес
и сосудистыми эндотелиальными клетками
тимости; NF κВ - фактор транскрипции κB; NKT - нату
(EC), как полагают, играет важную роль в пато
ральная киллерная Т клетка; p38MAPK - митогенактиви
генезе АФС [8]. β2GPI является основной фос
рованная протеинкиназа p38; PC - плазматическая клет
ка; PD 1 - молекула программы смерти 1; PT - протром
фолипидсвязывающей молекулой, распознавае
бин; SAP - адапторный белок рецепторов семейства моле
мой АФА. Данный белок продуцируется пре
кул CD150 и PD 1; TCR - Т клеточный рецептор; TD - имущественно гепатоцитами, хотя некоторые
тимусзависимый иммунный ответ; TFH - фолликулярный
EC кровеносных сосудов и трофобласт также
Т хелпер; TFPI - ингибитор ТФ; Th - Т хелпер; TI - ти
муснезависимый иммунный ответ; TLR - Toll подобные
экспрессируют этот гликопротеин [9]. Когда
рецепторы; TNF α - фактор некроза опухоли α.
β2GPI связывается с анионными фосфолипида
1226
РОЛЬ NKT КЛЕТОК В ИНДУКЦИИ АНТИФОСФОЛИПИДНЫХ АНТИТЕЛ
1227
ми, такими как кардиолипин, круговая структу
Появление анти β2GPI антител приводит к
ра плазматического β2GPI преобразуется в ли
возникновению протромботического статуса.
нейную форму, что приводит к экспонированию
Патогенез АФС связан с нарушением микро
основного эпитопа для АФА [10]. Однако ауто
циркуляции, гемостаза и деструктивными изме
антитела против β2GPI, связанные с фосфоли
нениями в сосудистой стенке [1, 2]. Ведущим
пидами, обнаруживаются менее чем у половины
патогенетическим фактором АФС является
пациентов с клиническими проявлениями АФС
тромбоз, определяющий клинику синдрома, ко
[11], что предполагает наличие дополнительных
торый может возникнуть в любом органе [13].
мишеней для АФА.
Формирование протромботического состояния
В 2006 г. в Сиднее на XI Международном
при АФС связано с генерацией тканевого фак
конгрессе были представлены новые диагности
тора (ТФ) [14], активацией EC и системы комп
ческие критерии АФС [4]. Был достигнут кон
лемента [15]. Важную роль в патогенезе АФС иг
сенсус, что диагноз АФС ставится, если у паци
рает воспаление, которое считается основным
ента выявлен хотя бы один из двух клинических
механизмом, лежащим в основе протромботи
критериев (сосудистый тромбоз или осложне
ческой и прокоагулянтной активности эндоте
ния беременности) и один из двух лабораторных
лия [16]. В сыворотке больных с АФС присут
критериев, включая наличие ВА, АКА или анти
ствуют высокие уровни IL 1β, IL 6, IL 8 и TNF α
β2GPI антител (Ig) изотипов G или M в диаг
[17]. Кроме того, АФА индуцируют у моноцитов
ностическом титре [4]. Ранее АФС подразделяли
и EC экспрессию молекул адгезии (VCAM 1,
на первичный и вторичный, однако пересмот
ICAM 1 и Е селектина) и ТФ, что определяется
ренные в Сиднее критерии классификации не
как провоспалительный фенотип [17]. Все это
рекомендуют использовать термин «вторич
приводит к усилению агрегантных свойств EC
ный». В последнее десятилетие получены новые
[7]. Связывание АФА с β2GPI уменьшает его ре
данные о роли воспаления в патогенезе АФС,
гуляторную функцию в отношении системы
что позволяет рассматривать его также как вос
комплемента с последующим нарушением кли
палительное протромботическое расстройство
ренса апоптотических клеток [18]. Показано, что
[1]. Наиболее тяжелой формой АФС является
активация комплемента АФА провоцирует тром
так называемый катастрофический АФС
боз при АФС [19]. Активация коагуляционного
(КАФС). Этот синдром также иначе именуется
каскада осуществляется через молекулы мембра
как синдром Ашерсона, который в 1992 г. впер
ноатакующего комплекса, формирующегося
вые ввел в клиническую практику термин
после взаимодействия АФА с антигеном, или
КАФС. Под влиянием АФА происходит форми
опосредованно через взаимодействие C5a с его
рование прокоагулянтного и провоспалитель
рецептором (C5aR), что также приводит к повы
ного состояния, на фоне которого под действи
шению уровня экспрессии ТФ и, таким образом,
ем дополнительных провоцирующих факторов
к активации коагуляционного процесса [20]. До
развивается КАФС, т.е. реализуется декомпен
полнительно АФА ингибируют антикоагулянт
сация системы гемостаза, запускается систем
ные свойства активированного белка C [21], что
ный воспалительный ответ и формируется по
угнетает фибринолиз [22], снижает активность
лиорганная недостаточность вследствие разви
ингибитора ТФ (TFPI) [23] и нарушает антикоа
тия синдрома диссеминированного внутрисосу
гулянтную активность аннексина A5 [24].
дистого свертывания [12].
В основе перечисленных выше механизмов
АФС лежит способность АФА связываться с
мембраноассоциированными молекулами и ре
ПАТОГЕНЕЗ АФС
цепторами на клетках мишенях, вызывая их ак
тивацию и приводя к тромбозу различных сосу
Этиологическим фактором АФС является
дов [25]. Такими молекулами/рецепторами мо
появление АФА, чаще всего направленных про
гут быть аннексин А2 [26], рецептор аполипо
тив кардиолипина (дифосфатидилглицерола) -
протеина Е2 (ApoER2) [27], рецептор липопро
эндогенного фосфолипида клеточных мембран,
теина низкой (LDL R) и очень низкой плотнос
поэтому данное заболевание относят к аутоим
ти [28], Toll подобные рецепторы TLR 2 [29] и
мунным патологиям. В обычных условиях кар
TLR 4 [30], а также адгезивный рецептор тром
диолипин (анион) может взаимодействовать с
боцитов GPIbα [31] и фактор тромбоцитов 4
лизинбогатыми белками (катион), такими как
(PF4) [8]. Кроме того, в качестве мишени могут
β2GPI. В этом случае закольцованная молекула
выступать молекулы β2GPI, связанные с HLA
β2GPI приобретает развернутую конформацию
DR7 и HLA DR4 [32]. Известно, что пациенты,
и также становится доступной в качестве ауто
в клетках которых экспрессируются аллели
антигена [10].
MHC II - HLA DR7 и DR4, наиболее часто
БИОХИМИЯ том 84 вып. 9 2019
2*
1228
ШИРШЕВ
страдают от аутоиммунных заболеваний, в част
зии и провоспалительных цитокинов в данных
ности от АФС [33]. Помимо клеток иммунной
клетках [42]. Таким образом, активации NF κB
системы, экспрессия MHC II индуцируется на
и/или AP 1 приводит к взаимодействию лейко
ЕС благодаря провоспалительным цитокинам,
цитов и тромбоцитов с эндотелием in vivo, ини
таким как IFN γ и TNF α [34]. Установлено, что
циируя воспалительный ответ и усиление коагу
83,3% пациентов с АФС обладают аутоантитела
ляцинной активности [17]. Также было показа
ми против комплекса β2GPI/HLA DR. Кроме
но, что АФА, взаимодействуя с ЕС, активируют
того, эти аутоантитела способны реализовывать
сигнальный путь фосфатидилинозитол 3 кина
комплементзависимую цитотоксичность [32],
зы (PI3K)/AKT (протеинкиназы В). Активация
что приводит к повреждению ЕС и, как след
этого сигнального каскада задействует mTOR
ствие, к тромбозу [8]. Поэтому цитокины, про
(мишень для рапамицина млекопитающих), что
дуцируемые в ответ на провоспалительные сти
приводит к пролиферации клеток и повышает
мулы, например, вызванные вирусной инфек
их выживаемость. В конечном счете это запус
цией, могут индуцировать образование комп
кает процессы гиперплазии интимы и хроничес
лексов β2GPI/HLA DR на поверхности ЕС, в
кой васкулопатии, наблюдаемой при АФС [43].
частности, на децидуальных ЕС у женщин с
Завершая краткое рассмотрение патогенеза
АФС, приводя к активации комплемента и
АФС, можно с уверенностью сказать, что АФА
тромбозу во время беременности [35]. Круговая
влияют на все механизмы регуляции свертыва
структура β2GPI в плазме сменяется линейной
ния крови, полностью смещая баланс в пользу
при взаимодействии белка с отрицательно заря
прокоагулянтного потенциала, включая функ
женными фосфолипидами, что приводит к экс
цию естественных антикоагулянтов, регуляцию
понированию эпитопа, распознаваемого АФА
фибринолиза, первичный и вторичный гемо
[10]. По видимому, β2GPI, связанные с молеку
стаз, защитные свойства эндотелия. При этом
лами HLA DR, имеют сходную конформацию и
АФА активируют процессы воспаления, вклю
распознаются аутоантителами пациентов с
чая синтез провоспалительных цитокинов и мо
АФС. Кроме того, комплексы β2GPI/HLA DR7
лекул адгезии, и запускают эффекторные и регу
также обладают уникальными эпитопами для
ляторные механизмы системы комплемента,
аутоантител при АФС, которые отсутствуют у
формируя «порочный круг», усиливающий па
β2GPI, связанного с фосфолипидом. Показано,
тогенное воздействие АФА (рис. 1). В то же вре
что домены IV (DIV) и V (DV) β2GPI являются
мя практически ничего не известно о механиз
мишенями для АФА [36], так же как и домен I
мах, инициирующих синтез данных антител им
(DI) комплексов β2GPI/HLA DR [32]. Взаимо
мунной системой. Прежде чем рассмотреть ме
действия АФА с β2GPI, связанным с моноцита
ханизм индукции АФА, необходимо кратко ос
ми и ЕС, приводят к активации транскрипцион
тановиться на характеристике АФА и механиз
ного фактора NF κВ и митогенактивированной
мах генерации этих антител.
протеинкиназы p38 (p38MAPK). Последняя
приводит к стимуляции активаторного белка 1
(AP 1), который, как и NF κB, инициирует
АНТИФОСФОЛИПИДНЫЕ
экспрессию ТФ [37], т.к. промотор гена ТФ со
АНТИТЕЛА (АФА)
держит два AP 1 сайта и сайт NF κB [38].
Экспрессия ТФ циркулирующими моноцитами
Практически все научные работы по пробле
крови и клетками сосудистого эндотелия приво
ме АФС ограничиваются констатацией того, что
дит к повышенной свертываемости крови [39].
этиологическим фактором является появление
Взаимодействие АФА с тромбоцитами через
АФА, которые реализуют патогенное действие
ApoER2 активирует p38MAPK, которая фосфо
на разные клетки и системы организма. При
рилирует фосфолипазу А2 (PLA2), высвобожда
этом учитываются только несколько наиболее
ющую арахидоновую кислоту - субстрат для
информативных с точки зрения клиники и диаг
синтеза тромбоксана В2 (TXB2), способного уси
ностики разновидностей АФА. В качестве диаг
ливать агрегацию тромбоцитов [40]. Взаимодей
ностических принимаются три теста для доку
ствие АФА с молекулами TLR 4 также активи
ментирования наличия этих антител в крови па
рует NF κB путь, который участвует в реализа
циентов: появление ВА, анти β2GPI антител и
ции патогенных эффектов анти β2GPI антител
АКА [3, 4]. Однако аутоантитела против β2GPI,
на уровне ЕС и моноцитов [41]. Как правило,
связанного с фосфолипидом, обнаруживаются
трансдукция сигнала осуществляется через
менее чем у половины пациентов с клинически
мультибелковый комплекс, включающий не
ми проявлениями АФС [11], что предполагает
только TLR 4, но и аннексин A2 [7, 42]. В ре
наличие дополнительных мишеней для АФА.
зультате усиливается экспрессия молекул адге
Так, у больных АФС выявляются антитела дру
БИОХИМИЯ том 84 вып. 9 2019
РОЛЬ NKT КЛЕТОК В ИНДУКЦИИ АНТИФОСФОЛИПИДНЫХ АНТИТЕЛ
1229
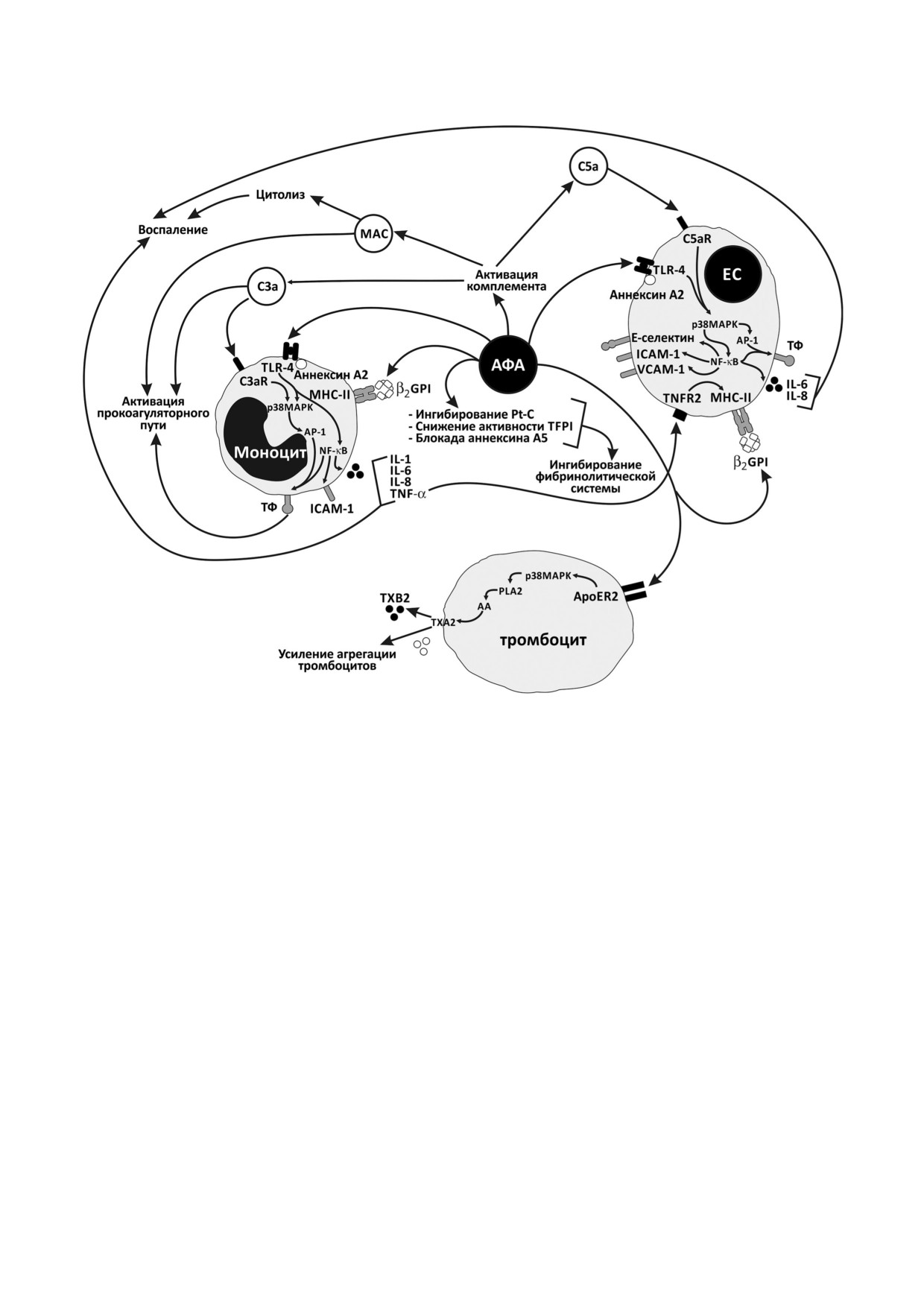
Рис. 1. Основные патогенетические механизмы развития антифосфолипидного синдрома. AA - арахидоновая кислота;
C3a, C5a - анафилатоксины; C3aR, C5aR - рецепторы для анафилатоксинов; ICAM - молекула межклеточной адгезии;
MAC - мембраноатакующий комплекс; PLA2 - фосфолипаза A2; Pt C - протеин C; ТХА2 - тромбоксан А2; ТХВ2 -
тромбоксан В2; VCAM - молекула адгезии ЕС
гого изотипа и специфичности, например, IgA к
гуляционных факторов XII и X, а также аннек
карлиолипину, IgA анти β2GPI, антифосфати
синов A5 и A2 [2].
дилсерин, антифосфатидилэтаноламин, анти
Считается, что антитела против β2GPI могут
фосфатидилсерин/протромбин и пр. [1]. Таким
быть результатом молекулярной мимикрии
образом, АФА представляют собой гетероген
между β2GPI человека и аналогичными молеку
ную группу аутоантител, определяющих поли
лами патогенных бактерий [45]. Мыши, имму
морфизм клинической картины. С точки зрения
низированные некоторыми бактериями, проду
патогенеза АФС, АФА можно подразделить на
цировали анти β2GPI антитела, которые при
два типа: патогенные (критичные) и малопато
переносе беременным мышам приводили к по
генные (некритичные). К патогенным АФА от
тере эмбриона [46]. Гетерогенность АФА корре
носятся ВА, IgG и IgM против кардиолипина и
лирует с различными механизмами патогенного
β2GPI. Их первичными мишенями являются
действия: активацией тромбоцитов, ЕС и моно
фосфолипидсвязывающие белки и сами фосфо
цитов, ингибированием фибринолитической
липиды [2]. К некритичным относятся антитела,
системы, активацией коагуляционного каскада
направленные против протромбина (PT), комп
и системы комплемента [1]. Наиболее важными
лекса фосфатидилсерин/протромбин (PS/PT)
с точки зрения патогенеза АФС являются анти
[44], фосфатидной кислоты, комплекса вимен
тела, направленные против гликопротеина
тин/кардиолипин, белков C/S, и множество
β2GPI. Данный белок был идентифицирован как
других аутоантител, направленных против коа
главная мишень аутоантител против кардио
БИОХИМИЯ том 84 вып. 9 2019
1230
ШИРШЕВ
липина у пациентов с АФС [6]. β2GPI представ
зависимый гуморальный иммунный ответ не
ляет собой одноцепочечный белок, содержащий
требует помощи Т клеток и подразделяется на
пять доменов. DV необходим для связывания с
TI 1 (активация В лимфоцитов через TLR) и
анионными фосфолипидными мембранами,
TI 2 при перекрестной сшифке B клеточных
тогда как DI служит мишенью для аутоанти
рецепторов (BCR), а также на TI 3 ответ, при
тел [47]. Создание рекомбинантных молекул
котором помощь В лимфоцитам оказывают мие
β2GPI позволило Iverson et al. оценить значение
лоидные клетки: нейтрофил В хелпер (NВН),
аутоантител к каждому из пяти доменов β2GPI
моноцит ВН (MBH), мастоцит BH (MasВН) и
[48]. Установлено, что наличие антител против
базофил ВН (BasBH) [55].
DI напрямую коррелирует с клиническими
TD 1 ответы инициируются, как правило,
симптомами АФС [49], в частности показано,
белково пептидными антигенами, поступаю
что введение анти DI антител приводит к гибе
щими в зону вторичных лимфоидных органов
ли плода у беременных мышей [50]. В то же вре
(лимфатические узлы, селезенка, лимфоидные
мя рекомбинантный DI человека ингибирует
образования слизистой), в которых выделяют
способность поликлональных АФА вызывать
В и Т зависимые зоны. В Зависимая зона со
тромбоз или повышать активность ТФ [51].
держит наивные (n) В лимфоциты и фоллику
Итак, АФС вызывают три типа антител:
лярные дендритные клетки (FDC), которые
1) антитела, специфически связывающие эндо
продуцируют хемокины CXCL13, определяю
генные фосфолипиды; 2) антитела, нейтрализу
щие присутствие nB лимфоцитов, экспрессиру
ющие белки, связавшие фосфолипиды; 3) анти
ющих рецептор для данного хемокина - CXCR5
тела, взаимодействующие с белками, принима
[56]. Т Зависимая зона содержит nT лимфоци
ющими участие в гемокоагуляции. В настоящее
ты и ретикулярные фолликулярные клетки
время превалирует мнение о том, что АФА на
(FRC). Выделяемые FRC хемокины CCL19 и
правлены против фосфолипидсвязывающих
CCL21 привлекают в Т зависимую зону
белков, а не фосфолипидов как таковых [1]. Од
nT лимфоциты, экспрессирующие на своей по
нако первые тест системы, определяющие АФА
верхности специфические хемокиновые рецеп
[52] в качестве антигена, использовали именно
торы CCR7 [57]. nB клетки сталкиваются с
кардиолипин или другие фосфолипиды [53, 54],
растворимым антигеном в своем компартменте,
что и послужило основанием называть антитела
и, если произошло специфическое взаимодей
антифосфолипидными. По видимому, распоз
ствие BCR с молекулами антигена, B лимфоцит
наваемая антигенная детерминанта включает
активируется, и комплекс BCR-антиген
как часть β2GPI, так и фрагменты кардиолипина
(pBCR) интернализируется. После этого анти
или, возможно, DV молекулы β2GPI, и имеет пе
ген процессируется и экспрессируется на поверх
рекрестные антигенные детерминанты с фосфо
ности В лимфоцитов в комплексе с молекулами
липидами, поскольку антитела распознают кон
MHC II класса - pMHC II [58]. Одновременно,
формацию антигена, а не его химическую при
благодаря активации, повышается экспрессия
роду. Так или иначе, антитела к эндогенным
костимулирующих молекул и CCR7 при нали
фосфолипидам играют существенную роль в па
чии CXCR5, что позволяет активированной
тогенезе АФС.
антигеном B клетке переместиться к границе
T зависимой зоны [59]. В свою очередь, антиген
захватывается дендритными клетками (DC) и
МЕХАНИЗМЫ ФОРМИРОВАНИЯ
презентируется в виде pMHC II. Это приводит к
ГУМОРАЛЬНОГО ИММУННОГО ОТВЕТА
созреванию DC и их миграции в Т зависимую
зону. В ходе миграции DC продуцирут хемоки
Гуморальный иммунный ответ может быть
ны CCL19 и CCL21, благодаря чему nT клетки
инициирован несколькими популяциями и суб
контактируют с антиген презентирующей клет
популяциями клеток иммунной системы, каж
кой. Непосредственное (когнатное) взаимодей
дая из которых распознает антиген определен
ствие CD4+ nT лимфоцитов с DC обусловлено
ной физико химической структуры. В связи с
T клеточным рецептором (TCR), специфически
этим гуморальный иммунный ответ подразделя
распознающим процессированный антиген в
ют на тимусзависимый (TD) и тимуснезависи
комплексе с молекулами MHC (pMHC II) [60].
мый (TI). Тимусзависимый гуморальный им
Как и в случае с B лимфоцитом, CD4+ nT клет
мунный ответ инициируется фолликулярными
ка активируется, трансформируясь в пре
Т хелперами (TFH) - тип TD 1, а также нату
T фолликулярный хелпер (преTFH), что также
ральными киллерными Т клетками (NKT) FH,
приводит к миграции преTFH в B зону [61, 62].
которые генерируются в тимусе, но относятся к
На границе T и B зон происходит непосред
врожденному иммунитету - тип TD 2. Тимусне
ственное взаимодействие активированного
БИОХИМИЯ том 84 вып. 9 2019
РОЛЬ NKT КЛЕТОК В ИНДУКЦИИ АНТИФОСФОЛИПИДНЫХ АНТИТЕЛ
1231
антигеном B лимфоцита с преTFH, что приво
сит от активности транскрипционных факторов
дит к образованию клеточных пар, которые пе
Bcl 6 или Blimp 1 (B lymphocyte induced matu
ремещаются в первичный фолликул [63]. Дан
ration protein 1) [67, 73]. Данные факторы со
ное взаимодействие способствует выживанию и
ставляют антагонистическую пару, они не толь
дифференцировке этих клеток [64, 65].
ко оказывают разнонаправленное действие на
Межклеточное взаимодействие приводит к
функции лимфоцитов, но и подавляют экспрес
подавлению экспрессии CCR7 и EBI2 (орфано
сию друг друга [74]. Экспрессия Bcl 6 необходи
вый G протеин связанный рецептор) [66], од
ма для пролиферации В лимфоцитов, формиро
новременно в обоих типах клеток появляется
вания GC и индукции процессов переключения
фактор Bcl 6 (B cell leukemia/lymphoma 6), что
классов антител и повышения их аффинности
усиливает миграцию клеток внутри фолликула,
[67]. Blimp 1, напротив, стимулирует дифферен
их пролиферацию и формирование GC [67]. Та
цировку PC, связанную с развитием секретор
кие В клетки, находящиеся в темной зоне фол
ного аппарата для продукции антител, и блоки
ликула, получили название центробласты [68].
рует процессы пролиферации В клеток [73, 75].
Центробласты, экспрессирующие молекулы
Кроме того, Bcl 6 необходим для дифференци
CXCR4, локализуются рядом с CXCL12
ровки CD4+ T клетки в TFH, а появление
экспрессирующими FRC в темной зоне GC,
Blimp 1, напротив, препятствует этой диффе
пролиферируют и подвергаются соматическим
ренцировке, подавляя экспрессию Bcl 6 [65].
гипермутациям, что приводит к образованию
Наиболее эффективным путем развития акти
центроцитов, локализованных в светлой зоне,
вированной антигеном В клетки является фор
экспрессирующих антигенспецифичные BCR с
мирование GC фолликула, в который устремля
вариабельной аффинностью
[69]. Селекция
ются как В клетки, так и преTFH лимфоциты -
центроцитов осуществляется FDC, которые от
«моногамные пары» [61]. Этот путь приводит к
бирают B лимфоциты с высокоаффинными
формированию долгоживущих PC или mB кле
BCR [64]. В отличие от центробластов, центро
ток. Спектр цитокинов TFHCG в этой паре оп
циты являются непролиферующими клетками,
ределяет, какой изотип специфических антител
склонными к апоптозу, и в случае отсутствия
будет синтезировать PC [76].
контакта с TFHGC клетками они подвергаются
TFH характеризуются высокой экспрессией
апоптозу [64].
молекулы программы смерти 1 (PD 1) и рецеп
Непосредственный контакт TFHGC лим
тора хемокинов CXCR5. С одной стороны, низ
фоцитов с pMHC II+ B лимфоцитами светлой
кая (low) экспрессия CCR7 и высокая (high)
зоны (центроциты) с помощью TCR дополни
CXCR5 позволяет этим клеткам локализоваться
тельно осуществляется посредством костимули
в области лимфоидных фолликулов [77]. С дру
рующих молекул и их рецепторов. В результате
гой стороны, экспрессия молекул PD 1 не дает
этого контакта образуются молекулярные пары,
пролиферировать TFH клеткам, которые пос
такие как CD86/CD28, PD L1/PD 1, CD40/
тоянно контактируют с В лимфоцитами и DC
CD40L и ICOS лиганд (ICOS L)/ICOS (inducible
[78]. Помимо этого, TFH клетки также на вы
costimulator) [61, 70]. Данное взаимодействие
соком уровне экспрессируют молекулы ICOS,
приводит к дополнительной активации B кле
которые взаимодействуют с ICOSL В лимфо
ток и запуску программы выживания с последу
цитов, в результате чего поддерживается диф
ющей индукцией переключения классов Ig
ференцировка TFH клетки и синтез ею IL 21
центроцитами [71]. Затем В клетки покидают
[70]. Главной функцией TFH клетки является
фолликулы и дифференцируются либо в цирку
обеспечение развития В клеток посредством
лирующие B клетки памяти (mB), либо в долго
секреции IL 4, IFN γ, IL 21 и фактора актива
живущие PC, секретирующие высокоаффинные
ции В клеток (BAFF) [70]. IL 21 играет основ
антитела [72]. TFH клетки GC также покидают
ную роль в регуляции реакций GC и дифферен
фолликулы и становятся циркулирующими
цировки В клеток [79]. С помощью высокоак
клетками (рис. 2).
тивированных TFH клеток (CXC5Rhigh, PD1high,
При отсутствии GC pMHC II B клетка мо
ICOShigh, Bcl 6high) формируются высокоаффин
жет после первичного контакта с преTFH диф
ные PC с различными изотипами Ig и mB клет
ференцироваться в короткоживущие PC
-
ки [70].
экстрафолликулярный путь развития. Образую
Таким образом, TFH клетки контролируют
щиеся в этом случае PC будут секретировать
первичное распознавание антигена, дифферен
низкоаффинные антитела четырех классов:
цировку В лимфоцитов как в экстрафоллику
IgM, IgG, IgA и IgE [64].
лярные, короткоживущие PC, так и в долгожи
На молекулярном уровне процесс выбора
вущие PC GC, продуцирующие специфические
пути дифференцировки В или Т клеток зави
антитела.
БИОХИМИЯ том 84 вып. 9 2019
1232
ШИРШЕВ
Рис. 2. Схематическое изображение основных этапов формирования гуморального иммунного ответа во вторичных лим
фоидных органах. Аг - антиген; актВ кл. - активированная В клетка; ИК - иммунный комплекс; Цб - центробласт; Цц -
центроцит; DC - дендритная клетка; FDC - фолликулярная дендритная клетка; mB кл. - В клетки памяти; nB кл. -
наивная В клетка; nТ кл. - наивная Т клетка; PC - плазматическая клетка; preTFH - предшественник TFH клетки
НАТУРАЛЬНЫЕ КИЛЛЕРНЫЕ
ных лигандов для CD1d была идентифицирова
T КЛЕТКИ (NKT) И ИХ РОЛЬ
на как гликосфинголипидные соединения, аге
В ФОРМИРОВАНИИ ГУМОРАЛЬНОГО
ласфины, полученные из морской губки Agelas
ИММУННОГО ОТВЕТА (АФА)
mauritianus. Структура этого соединения пред
ставляет собой разветвленный α галактозилце
Липидные и липидсодержащие молекулы
рамид (αGalCer) [81]. Несмотря на то что
экзогенного и/или эндогенного происхождения
αGalCer активирует CD1d рестриктированные
могут выступать в качестве антигенов. Их пре
Т лимфоциты, он не обнаружен у позвоночных
зентация осуществляется в комплексе с MHC I
и микроорганизмов [82].
подобной β2 микроглобулин ассоциированной
Все CD1 белки подразделяются на три груп
молекулой CD1d [80]. Первая группа прототип пы: 1) CD1a, CD1b и CD1c; 2) CD1d; 3) CD1e [83].
БИОХИМИЯ том 84 вып. 9 2019
РОЛЬ NKT КЛЕТОК В ИНДУКЦИИ АНТИФОСФОЛИПИДНЫХ АНТИТЕЛ
1233
У человека и большинства млекопитающих
У человека все CD1d рестриктированные
экспрессируются все изоформы CD1 (CD1a-e),
Т лимфоциты могут быть разделены на четыре
тогда как у мышей - только изоформа CD1d
основных типа по структуре TCR и способности
[84], которая, в отличие от остальных, является
распознавать два маркерных антигена - либо
высококонсервативной молекулой [85]. CD1e
α GalCer, либо сульфатид (таблица). Говоря о
принимает участие во внутриклеточном липид
патогенезе АФС, следует рассматривать данный
ном трафике и не экспонирована на клеточной
синдром как проявление специфического гумо
мембране [86]. Необходимо отметить, что моле
рального иммунного ответа, направленного
кулы CD1а, CD1b и CD1c презентируют только
против собственных фосфолипидов и, прежде
микробные липидные антигены обычным
всего, кардиолипина, который также обознача
Т лимфоцитам, в то время как CD1d презенти
ют как дифосфатидилглицерол (DPG). Данный
руют липиды, гликолипиды и липопротеины
фосфолипид является наиболее важной ми
как микробного (экзогенного), так и эндогенно
шенью для АФА и может распознаваться в комп
го происхождения. В свою очередь, молекулы
лексе с молекулами CD1d тремя типами CD1d
CD1d, связанные с антигеном, распознаются
рестриктивированных Т лимфоцитов. Это
только NKT клетками и особой группой CD1d
NKT клетки I и II типов, а также CD1d зависи
рестриктированных Т лимфоцитов, которые
мые γδ или δ/αβ TCR Т клетки. Однако только
используют γδ или δ/αβ TCR [87]. Молекулы
NKT клетки I и II типов способны дифференци
CD1d экспрессируются на DC, макрофагах
роваться в фолликулярные клетки хелперы
(включая резидентные клетки Купфера в пече
(NKTFH), и, следовательно, CD1d зависимыми
ни), В клетках, тимоцитах, гепатоцитах [80],
γδ или δ/αβ TCR Т клетками, как индуктора
эпителиальных [88] и раковых клетках [89].
ми АФА, можно пренебречь (таблица). Таким об
Кроме того, CD1d присутствует на ворсинчатых
разом, основными претендентами на роль пол
и экстраворсинчатых трофобластах, экспрессия
ноценных индукторов антикардиолипиновых
которых возрастает в ходе беременности [90].
TFH клеток можно считать NKT лимфоциты
Характеристика CD1d рестриктированных Т лимфоцитов человека (суммировано по данным работы Macho Fernandez и
Brigl [87])
Тип CD1d рестриктиро
Репертуар молекул
Распознаваемые антигены
Функциональный тип
ванных Т клеток
TCR
NKT клетки I типа, распознающие молекулы αGalCer (но не сульфатид)
Инвариантные (i) NKT
инвариантная α цепь
микробные гликолипиды: α GSL, α GDAG
Th1 подобный, Th2 подоб
клетки
(Vα24, Jα18)
эндогенные глико и фосфолипиды:
ный, Th17 подобный, TFH
β GSL, фосфолипид, лизофосфолипиды,
подобный, цитотоксический
плазмалогены
Vα24- iNKT клетки
расширенный
микробный α GSL
Th1 подобный, Th2 подоб
репертуар TCR
эндогенные гликолипиды:
ный, Th17 подобный
(Vα10, Vα2,
β GSL, β GlcSph
Vα3, Vβ11)
NKT клетки II типа, распознающие сульфатид (но не αGalCer)
Разнообразные (d) или
вариантный тип
микробные и эндогенные фосфолипиды:
Th1 подобный, Th2 подоб
вариантные (v) NKT
αβTCR
PG, DPG (кардиолипин), PI
ный, Th17 подобный, TFH
клетки
лизофосфолипиды: LPC, LSM, LPE,
подобный, цитотоксический
β GlcSph
γδ и δ/αβ Т клетки, распознающие сульфатид и αGalCer
γδ T клетки,
γδ TCR, δ/αβ TCR
гликолипиды пыльцы
Th1 подобный, Th2 подоб
δ/αβ Т клетки
(Vδ1, Vδ3)
эндогенные фосфолипиды: PE, PC, DPG
ный
Примечание. DPG - дифосфатидилглицерол (кардиолипин); α GDAG - α глико(Gal/Glc)диацилглицерол; β GlcSph -
β гликозилсфингозин; α GSL - α гликосфинголипид; LPC - лизофосфатидилхолин; LPE - лизофосфатидилэтанол
амин; LSM - лизосфингомиелин; PC - фосфатидилхолин; PE - фосфатидилэтаноламин; PG - фосфатидилглицерол;
PI - фосфоинозитол.
БИОХИМИЯ том 84 вып. 9 2019
1234
ШИРШЕВ
I и II типов. Данные клетки являются основны
[98]. Под воздействием iNKT клеток DC акти
ми лимфоцитами иммунной системы, распозна
вируют наивные CD4+ Т клетки, которые под
ющими аутофосфолипидные детерминанты
вергаются клональной экспансии, дифферен
[82], обладающие способностью усиливать про
цируются в TFH клетки и оказывают помощь
лиферацию и продукцию антител В клетками
В лимфоцитам, что приводит к формированию
[91, 92] благодаря фенотипическим и функцио
GC, специфических PC и образованию mB кле
нальным качествам TFH клеток [93, 94].
ток [96].
Для детального рассмотрения роли NKT
В дальнейшем были получены доказатель
клеток в качестве индукторов АФА необходимо
ства того, что и NKT клетки II типа способны
последовательно охарактеризовать молекуляр
оказывать помощь В лимфоцитам в продукции
ные механизмы хелперной функции NKT кле
PC специфических антител против эндогенных
ток I и II типов у человека.
липидных детерминант [99]. Показано, что гли
NKT клетки I типа, которые помогают
козилсфингозинспецифические NKTFH клет
В клеткам трансформироваться в PC, получили
ки II типа (в т.ч. у пациентов c болезнью Гоше)
название фолликулярные хелперные iNKT
также приводят к формированию GC и B кле
клетки (iNKTFH) [95]. Они локализуются внут
точной активации с выработкой специфических
ри GC после иммунизации как одним гликоли
антител [100]. В отличие от NKT клеток I типа,
пидом αGalCer, так и в комплексе с пептидом
гликолипидспецифические NKT клетки II типа
[70, 95]. Как и классические TFH клетки,
конститутивно экспрессируют TFH фенотип, в
iNKTFH клетки экспрессируют поверхностные
то время как NKT клетки I типа имеют слабый
молекулы PD 1, CD40L и CXCR5, содержат
TFH фенотип [101] и дифференцируются в
транскрипционный фактор Bcl 6, секретируют
TFH клетки только после активации αGalCer,
такие цитокины, как IL 4, IFN γ, IL 21 и BAFF
который, как известно, не встречается у позво
[95, 96]. Другими молекулами, необходимыми
ночных и микроорганизмов [99]. Кроме того, в
для формирования GC и конечной дифферен
организме человека CD1d зависимые NKT
цировки TFH клеток, являются PD 1 и SAP -
клетки II типа встречаются чаще, чем NKT
адапторный белок рецепторов семейства SLAM
клетки I типа. В костном мозге человека ~25%
(CD150) [70]. Известно, что экспрессия SAP не
CD3+ Т клеток экспрессируют CD161 (маркер
обходима не только для обеспечения непосред
NKT клеток) и половина CD161+CD3+ клеток
ственной помощи В клеткам, но и для развития
распознает CD1d [102].
NKT клеток в тимусе [70, 95].
Многие NKT клетки II типа схожи по фено
Выделяют два основных механизма помощи
типу и функциям с NKT клетками I типа. Так,
B лимфоцитам: контактный (когнатный, врож
им, как и NKT клеткам I типа, присуща высо
денный) и опосредованный или неконтактный
кая аутореактивность [103], зависимость разви
(некогнатный, адаптивный) [93, 94]. Первона
тия клеток в тимусе от транскрипционного
чально эти две формы помощи были установле
фактора PLZF и адаптерного белка SAP, конс
ны только для NKT клеток I типа. In vivo и in
титутивная экспрессия мРНК IL 4, а также
vitro было показано, что иммунизация комплекс
способность секретировать широкий спектр
ными антигенами, состоящими из белков,
цитокинов сразу после стимуляции антигеном
конъюгированных с гликолипидами, такими
[104, 105]. Конститутивная аутореактивность
как αGalCer [91, 92], или бактериальными гли
NKT клеток позволяет им контролировать по
колипидами [97] приводит к формированию
явление
«нефизиологических» липидных
специфических противобелковых антител бла
структур [106], инициируя, по видимому, и гу
годаря контактной помощи iNKT клеток [93,
моральный иммунный ответ в виде АФА при
94]. Кроме того, при контактном взаимодей
АФС. У человека субпопуляции NKT клеток
ствии B лимфоцитов с NKTFH клетками I типа
II типа экспрессируют Vα24-/Vβ11- TCR с ва
формируются экстрафолликулярные PC, кото
риабельными цепями Vβ и имеют фенотип
рые продуцируют антитела только против гли
CD45RA+CD45RO-CD62highCD69-/low. Большин
колипидных детерминант [92, 95, 96].
ство этих клеток экспрессируют устойчивый
При использовании αGalCer в качестве адъ
TFH подобный фенотип - CXCR5+PD 1high
юванта белковых антигенов iNKT клетки при
ICOShighBcl 6highFoxP3-IL 21+. Данные клетки
влекают αGalCer презентирующие DC и ини
после CD1d рестриктированной активации
циируют рекрутирование ими пептидспецифич
способны к индукции GC для В клеток и липид
ных CD4+ Т клеток. Такое действие iNKT кле
специфических антител in vivo [99].
ток относится к некогнатной или неконтактной
Таким образом, у человека основными по
или адаптивной помощи, поскольку в качестве
мощниками в формировании PC из В лимфо
TFH клеток используются CD4+ T лимфоциты
цитов являются NKT клетки II типа [102].
БИОХИМИЯ том 84 вып. 9 2019
РОЛЬ NKT КЛЕТОК В ИНДУКЦИИ АНТИФОСФОЛИПИДНЫХ АНТИТЕЛ
1235
Принципиально важно то, что кардиолипин,
Таким образом, в зависимости от активаци
как эндогенный липид, может распознаваться
онного сигнала В клетки могут получать по
только NKTFH клетками II типа. Поэтому наи
мощь от NKTFH клеток либо для формирова
более эффективным и вероятным индуктором
ния PC, секретирующих антитела против одно
АФА при АФС являются NKT клетки II типа.
го уникального гликолипида/липида или белко
Эти лимфоциты могут оказывать контактную
вого носителя, либо адаптивную форму помощи
или непосредственную (когнатную) антиген
от NKTFH клеток благодаря гликолипид акти
специфическую помощь В лимфоцитам для
вированным DC и адаптивным CD4+ TFH клет
продукции АКА, поскольку NKT клетки I типа
кам [107]. В этом случае NKT клетки будут уси
не распознают молекулы кардиолипина [87].
ливать эффект TFH лимфоцитов для трансфор
Кроме того, важную роль здесь играет способ
мации В клеток в PC с последующим синтезом
ность β2GPI связываться с кардиолипином и
антител только к белковым антигенам [93, 94].
возможность данного комплекса презентиро
ваться молекулами МНС II [32]. Все это позво
ляет NKTFH клеткам II типа инициировать
МЕХАНИЗМЫ ИНДУКЦИИ
анти β2GPI ответ наподобие αGalCer/белок
РАЗВИТИЯ ГУМОРАЛЬНЫХ
контактным способом. Кроме того, vNKT клет
ИММУННЫХ РЕАКЦИЙ ПРИ АФС
ки, как и iNKT, оказывают и неконтактную (не
когнатную) помощь В лимфоцитам, выступая
Учитывая все вышесказанное, можно с высо
усилителями TFH клеток, реагирующими на
кой долей вероятности утверждать, что АФА при
комплексную фосфолипид белковую конструк
АФС индуцируются NKT клетками II типа. В то
цию или только белковый фрагмент молекулы
же время нельзя исключать, что индукторами
β2GPI - DI, появляющийся при взаимодей
могут быть и NKT клетки I типа, особенно ког
ствии с кардиолипином [2].
да речь идет об индукции «некритичных» анти
Принципиальная разница в механизмах
тел. Можно предложить три основных механиз
контактной и неконтактной помощи, которую
ма индукции АФА NKTFH клетками II типа:
оказывают NKTFH клетки B лимфоцитам, за
1) контактная помощь NKTFH клеток II ти
ключается в том, что в первом случае презента
па, реализующих специфический иммунный от
ция структуры CD1d/липид осуществляется
вет на эндогенные фосфолипиды, такие как
В клеткой. При этом NKTFH клетка вступает в
кардиолипин (DPG), фосфатидилсерин (PS),
контакт с В лимфоцитом, формируя своеобраз
фосфатидилэтаноламин (PE), появление анти
ный иммунный синапс при помощи корецепто
тел к которым приводит к развитию АФС [1].
ров - CD40L и CD28, что приводит к секреции
Фосфолипиды могут взаимодействовать как с
IL 21 и IFN γ, усиливающих дифференцировку
молекулами BCR B лимфоцитов [94], так и с ре
B клетки в PC [92]. В ряде случаев предвари
цептором липопротеинов низкой плотности
тельно NKT клетка может быть активирована
(LDL R) [108]. В том и другом случае это приво
аналогичным контактом с DC [93]. Важно, что
дит к поглощению В клеткой фосфолипида и
другой помощи от классических TFH клеток
последующей его презентации с помощью
B лимфоцит не получает. Во втором случае
CD1d молекулы NKTFH клетке для их конта
NKTFH клетка является усилителем обычной
ктной активации [91, 92]. В лимфоцит, распоз
(классической) реакции помощи B клетке со
навший фосфолипид через BCR, получает по
стороны pMHC II рестриктированного TFH
мощь для продукции АФА. Так, у больных АФС
лимфоцита
[93,
107]. При этом активация
выявляются и антитела другого изотипа и спе
NKTFH клетки осуществляется, как правило,
цифичности, например, антифосфатидилсери
только DC по CD1d рестриктированному меха
новые и антифосфатидилэтаноламиновые [1].
низму [93, 94].
В этом случае преимущественно будут генери
В первом случае будут развиваться экстра
роваться экстрафолликулярные PC, продуциру
фолликулярные быстрые и недолговременные
ющие патогенные низкоаффинные антикардио
иммунные ответы без формирования mB кле
липиновые иммуноглобулины разного изотипа
ток (TD2 ответы) [95, 96], во втором - класси
и низкопатогенные Ig, связывающие PS и PE
ческие фолликулярные иммунные реакции с
без формирования mB клеток (рис. 3);
формированием клеток памяти, поскольку ос
2) контакная помощь NKTFH клеток II ти
новными дирижерами будут выступать TFH
па, реализующих специфический ответ на эндо
клетки (TD1 ответы) [55]. Необходимо отме
генные белки, конъюгированные с патогенети
тить, что созревание аффинности антител после
чески значимыми молекулами - критическими
контактной помощи существенно ниже, чем
(β2GPI/кардиолипин) [2] и/или некритически
при неконтактной помощи [95].
ми белковыми и/или липидными молекулами
БИОХИМИЯ том 84 вып. 9 2019
1236
ШИРШЕВ
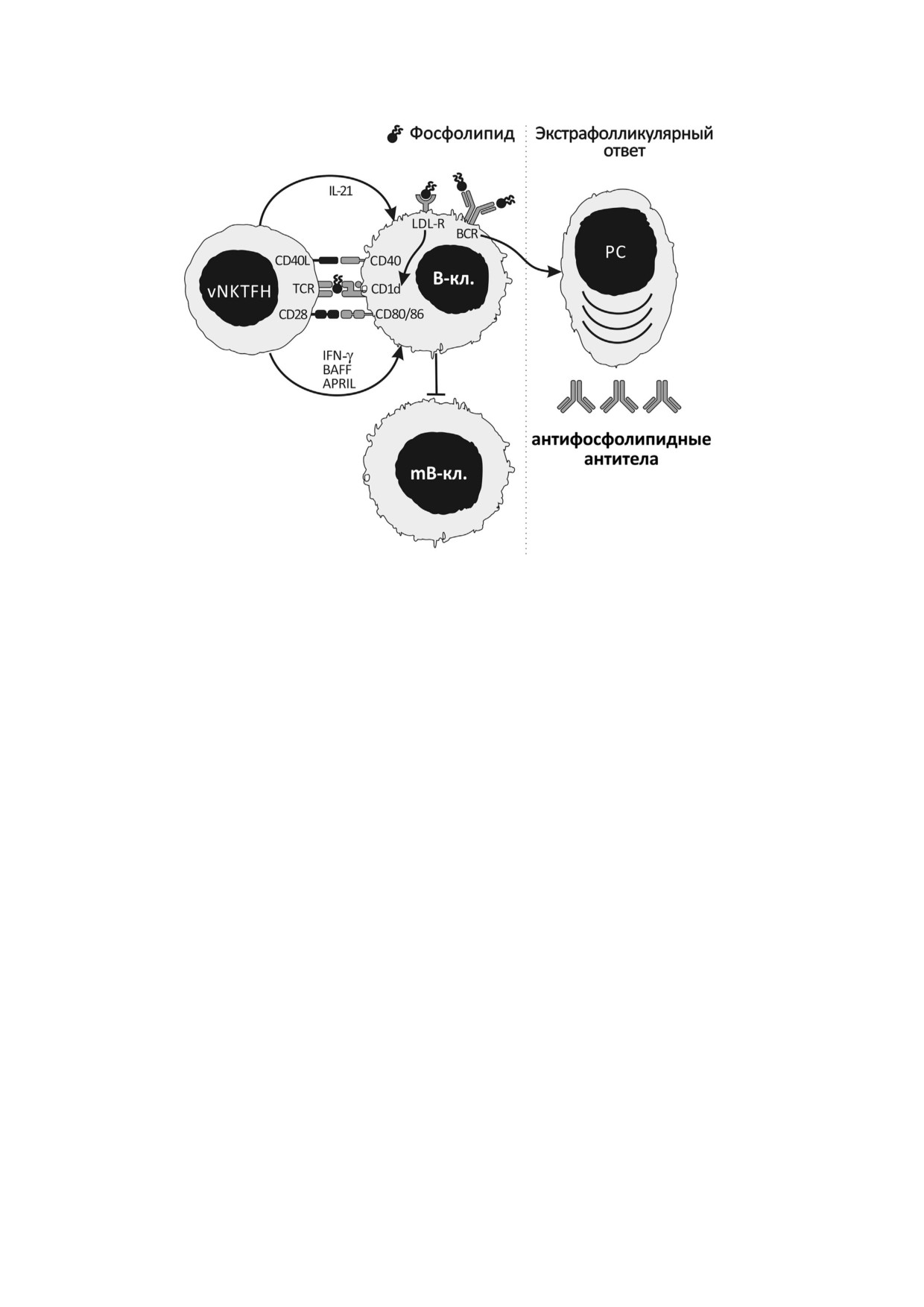
Рис. 3. Вероятный механизм индукции специфического антифосфолипидного (антикардиолипинового) гуморального
иммунного ответа с участием NKTFH клеток II типа (vNKTFH), реализующих контактный механизм помощи В лимфо
цитам. Кардиолипин или другой фосфолипид специфически связывается с BCR B клетки (B кл.) и/или LDL R, что при
водит к селекции и последующей активации В лимфоцита, одновременно фосфолипид (кардиолипин) презентируется
vNKTFH клетке с помощью молекулы CD1d. Иммунный синапс, включающий пары рецептор-лиганд (TCR/фосфоли
пид CD1d; CD28/CD80 или CD86; CD40L/CD40), активирует vNKTFH клетку, что приводит к секреции ею IFN γ, BAFF,
APRIL и IL 21, которые наряду с когнатным взаимодействием способствуют трансформации В лимфоцита в плазмати
ческую клетку (PC) экстрафолликулярной зоны. В результате PC продуцирует и секретирует специфические антифосфо
липидные антитела. Клетки памяти (mB кл.) при этом не образуются
(PS/протромбин (PS/PT), виментин/кардиоли
осуществляется дистанционно без непосред
пин) [44]. В данном случае важную роль будет
ственного взаимодействия с В лимфоцитом,
играть физическая связь между белковыми мо
когда, в силу условий поступления антигена,
лекулами и фосфолипидами, которая необходи
В лимфоцит не презентирует фосфолипидный
ма для эффективного контакта между NKTFH
антиген CD1d молекулой. Однако помощь
клеткой и В лимфоцитом. Специфические
NKT клеток реализуется благодаря коэкспрес
BCR, связавшие белковый фрагмент комплекса,
сии CD1d и MHC II на DC [109]. В этом случае,
например, DI, при условии эффективной сшив
при поступлении во вторичные лимфоидные
ки рецептора [91] будут поглощаться вместе со
органы смеси белковых и фосфолипидных мо
связанными фосфолипидами. Затем интернали
лекул, они неселективно поглощаются CD8α+
зованный фосфолипид будет презентироваться
DC, которые затем активируют NKT и/или
В лимфоцитами в комплексе с CD1d молекула
NKTFH клетки II типа, представляя комплексы
ми для контактной активации NKTFH клеток
фосфолипид/CD1d. Таким образом, DC будут
[91, 92]. В этом случае также формируются
играть ключевую роль в запуске первичной ак
экстрафолликулярные PC, секретирующие ан
тивации NKT клеток [110]. Взаимодействие DC
титела против белковых антигенов (рис. 4);
с NKT клетками осуществляется при непосред
3) неконтактная помощь NKTFH клеток
ственном контакте и приводит к костимуляции
II типа, реализующих специфический ответ на
NKT лимфоцита благодаря взаимодействию
эндогенные белки, прежде всего β2GPI, в присут
CD40L/ CD40 и антиген презентирующей
ствии фосфолипидов и их лизоформ. В этом ме
функции DC, что приводит к усилению актива
ханизме, как было сказано выше, NKT клетки
ции CD4+ Th клеток, которые специфичны к
выступают в качестве усилителей адаптивной
конкретному белковому антигену [109]. При
реакции. Неконтактная помощь NKT клетками
этом DC продуцируют IL 12, дополнительно ак
БИОХИМИЯ том 84 вып. 9 2019
РОЛЬ NKT КЛЕТОК В ИНДУКЦИИ АНТИФОСФОЛИПИДНЫХ АНТИТЕЛ
1237
тивирующий как NKTFH клетки, так и CD4+
Эндогенные липиды, которые могут распоз
T лимфоциты, запуская полноценный гумо
навать NKT клетки I типа, не принимают учас
ральный ответ и формируя иммунную память
тия в патогенезе АФА. Однако если будет иметь
[94]. Активированные таким образом Th клетки
место индукция экзогенными гликолипидами
приобретают функции TFH клеток и мигриру
бактериальной природы, iNKT клетки смогут
ют к границе зоны T/B клеток, где они обеспе
выступать как в механизме когнатной, так и не
чивают эффективную помощь селекциониро
когнатной помощи, но только для индукции про
ванным В лимфоцитам. Это происходит неза
тивобелковых антител, например, β2GPI. Осталь
висимо от экспрессии CD1d на В клетках.
ные CD1d рестриктированные Т лимфоциты не
TFH/В клеточные взаимодействия индуцируют
могут быть индукторами, поскольку для них уста
типичный TD 1 ответ с образованием GC, соз
новлена только функциональная активность Th2,
реванием аффинности Ig и переключением изо
т.е. они могут лишь создавать цитокиновый фон
типов иммуноглобулинов, а также генерацией
для дифференцировки В лимфоцитов.
долгоживущих PC и mB клеток [109]. Дополни
тельно NKT клетки способствуют формирова
Индукция АФА приводит к множественным
нию mT клеток благодаря секреции IL 2, IL 4,
патологическим реакциям, формирующим кли
BAFF и лиганда, индуцирующего пролифера
ническую картину АФС. Основными антитела
цию (APRIL) [111]. Таким образом, неконтакт
ми, запускающими патологический процесс,
ная помощь NKT клеток реализует адъювант
являются два патогенетически значимых типа
ную функцию, которая поддерживает адаптив
иммуноглобулинов: критические и некритичес
ные иммунные реакции (рис. 5).
кие. К критическим антителам относят ВА,
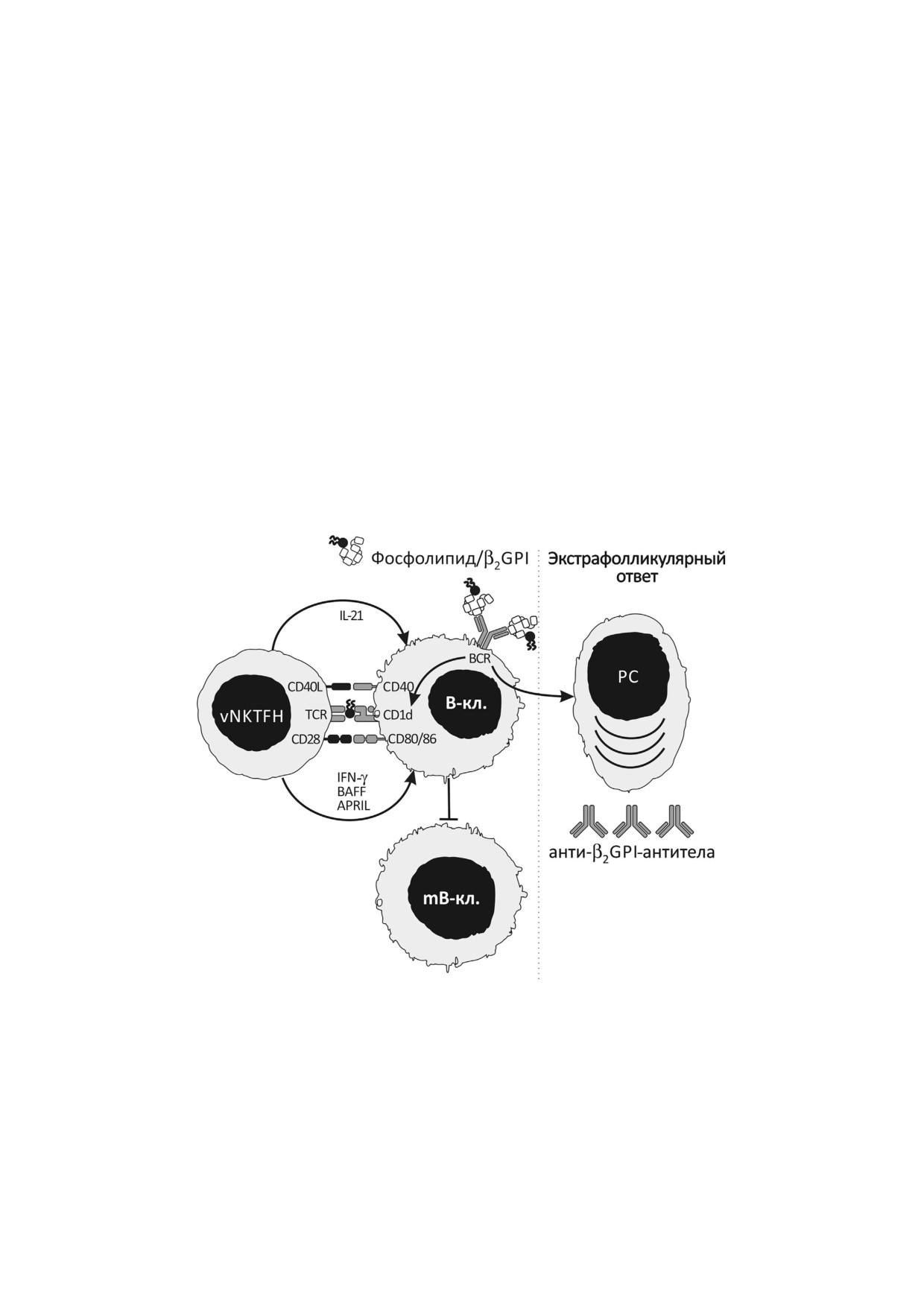
Рис. 4. Вероятный механизм индукции специфических анти β2GPI антител с участием NKTFH клеток II типа
(vNKTFH), реализующих контактный механизм помощи В лимфоцитам. Взаимодействие кардиолипина с молекулой
β2GPI приводит к изменению конформации гликопротеина, делая доступным к распознаванию молекулами BCR один из
его доменов. Специфически связываясь с B клеткой (B кл.), молекула β2GPI, с одной стороны, запускает каскад актива
ции В лимфоцита, с другой - приводит к процессингу и презентации кардиолипина vNKTFH клетке в комплексе с мо
лекулой CD1d. Иммунный синапс, включающий пары рецептор-лиганд (TCR/фосфолипид CD1d; CD28/CD80 или
CD86; CD40L/CD40), активирует vNKTFH клетку, что приводит к секреции ею IFN γ, BAFF, APRIL и IL 21, которые на
ряду с когнатным взаимодействием способствуют трансформации В лимфоцита в плазматическую клетку (PC) экстра
фолликулярной зоны. В результате PC продуцирует и секретирует специфические анти β2GPI антитела. Клетки памяти
(mB кл.) при этом не образуются
БИОХИМИЯ том 84 вып. 9 2019
1238
ШИРШЕВ
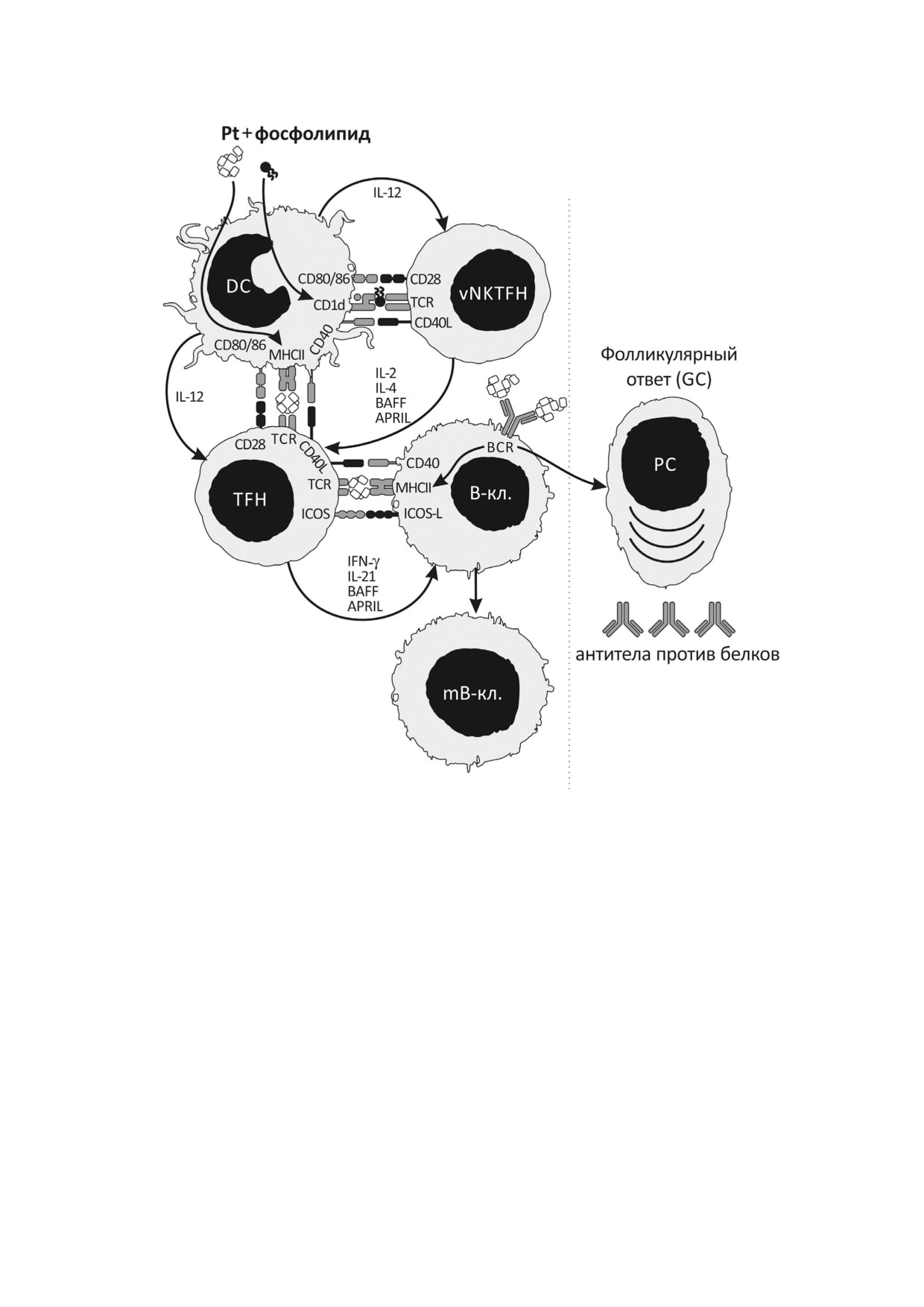
Рис. 5. Вероятный механизм индукции специфических антител к белкам мишеням при АФС с участием NKTFH клеток
II типа (vNKTFH), реализующих неконтактный механизм помощи В лимфоцитам. Одновременное поглощение DC бел
ковой (Pt) и фосфолипидной молекул приводит к презентации белкового антигена при помощи молекул MHC II и фос
фолипида в комплексе с молекулой CD1d, что активирует DC (секреция IL 12). При этом vNKTFH клетка распознает
фосфолипид совместно с молекулой CD1d, а TFH клетка распознает секвенциальную белковую антигенную детерминан
ту в комплексе с молекулой MHC II. Это приводит к активации обоих хелперов. Активированный антигеном (Pt) В лим
фоцит выступает в качестве дополнительной APC, с которой взаимодействует классический TFH. vNKTFH клетка вы
ступает в качестве усилителя, продуцируя цитокины, повышающие активацию адаптивного хелпера, который и оказыва
ет помощь B лимфоциту, переводя его в PC. Данный процесс осуществляется в GC, что создает условия для развития дол
говременного гуморального иммунного ответа и формирования В клеток памяти (mB кл.)
анти β2GPI и антикардиолипиновые антитела,
дельные фосфолипиды, либо комплексы фос
которые запускают каскад патологических реак
фолипид/белок или непосредственно запускают
ций, формирующих симптомокомплекс АФС.
коагуляцию при контакте с аннексинами или
К некритическим антителам относят анти
факторами коагуляционного гемостаза. Чем
PS/протромбин, антивиментин/кардиолипин,
больше антител, тем больше мишеней и, следо
анти PT, анти PS/PT [44], анти C/S белки и
вательно, активнее и быстрее протекает клини
множество других аутоантител, направленных
ка АФС, вплоть до КАФС. В силу физико хими
против коагуляционных факторов и аннексинов
ческих особенностей TCR NKT клеток, именно
[2]. Таким образом, все АФА связывают либо от
их функциональные субтипы способны как рас
БИОХИМИЯ том 84 вып. 9 2019
РОЛЬ NKT КЛЕТОК В ИНДУКЦИИ АНТИФОСФОЛИПИДНЫХ АНТИТЕЛ
1239
познавать эндогенные фосфолипиды, так и ока
некритическим молекулам мишеням. По види
зывать непосредственную или опосредованную
мому, индукция АФА может осуществляться с
помощь в индукции АФА В лимфоцитами,
использованием всех приведенных механизмов
трансформируясь в NKTFH клетки. Физиоло
или их некоторых сочетаний, что и будет опре
гия NKT клеток II типа позволяет им реагиро
делять тяжесть клинических проявлений АФС.
вать на фосфолипиды клеточных мембран при
стрессорных воздействиях (нефизиологические
фосфолипиды) и быстро формировать цитоки
Финансирование. Работа выполнена в рамках
новую сеть, активирующую гуморальные им
госзадания № 01201353248 «Механизмы регуля
мунные реакции, что определяет их аутоиммун
ции иммунной системы».
ный потенциал. Учитывая патогенез АФС, наи
Конфликт интересов. Конфликт интересов в
более значимыми механизмами индукции АФА
финансовой или какой либо иной сфере отсут
являются те, в которых принимают участие
ствует.
NKT клетки II типа. Другие CD1d рестрикти
Соблюдение этических норм. Настоящая
рованные Т лимфоциты могут помогать созда
статья не содержит описания выполненных ав
вать полиморфизм клинической картины и от
тором исследований с участием людей или ис
вечать за индукцию поливалентных антител к
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Mehdi, A.A., Uthman, I., and Khamashta, M. (2010)
antiphospholipid syndrome, Blood, 116, 1336-1343,
Antiphospholipid syndrome: pathogenesis and a window of
doi: 10.1182/blood 2009 12 260976.
treatment opportunities in the future, Eur. J. Clin. Invest.,
11.
Gardiner, C., Hills, J., Machin, S.J., and Cohen, H. (2013)
40, 451-464, doi: 10.1111/j.1365 2362.2010.02281.x.
Diagnosis of antiphospholipid syndrome in routine clinical
2.
Arachchillage, D.R.J., and Laffan, M. (2017) Pathogenesis
practice, Lupus, 22, 18-25, doi: 10.1177/0961203312460722.
and management of antiphospholipid syndrome, Br.
12.
Vora, S.K., Asherson, R.A., and Erkan, D.
(2006)
J. Haematol., 178, 1-15, doi: 10.1111/bjh 14632.
Catastrophic antiphospholipid syndrome, J. Intensive Care
3.
Ruiz Irastorza, G., Crowther, M., Branch, W., and
Med., 21, 144-159, doi: 10.1007/s11420 008 9103 6.
Khamashta, M.A. (2010) Antiphospholipid syndrome, Lancet,
13.
Cervera, R., Serrano, R., Pons Estel, G.J., Ceberio
376, 1498-1509, doi: 10.1016/S0140 6736(10)60709 X.
Hualde, L., Shoenfeld, Y., de Ramon, E., Buonaiuto, V.,
4.
Miyakis, S., Lockshin, M.D., Atsumi, T., Branch, D.W.,
Jacobsen, S., Zeher, M.M., Tarr, T., Tincani, A., Taglietti, M.,
Brey, R.L., Cervera, R., Derksen, R.H., de Groot, P.G.,
Theodossiades, G., Nomikou, E., Galeazzi, M., Bellisai, F.,
Koike, T., Meroni, P.L., Reber, G., Shoenfeld, Y., Tincani, A.,
Meroni, P.L., Derksen, R.H., de Groot, P.G., Baleva, M.,
Vlachoyiannopoulos, P.G., and Krilis, S.A.
(2006)
Mosca, M., Bombardieri, S., Houssiau, F., Gris, J.C.,
International consensus statement on an update of the
Quere, I., Hachulla, E., Vasconcelos, C., Fernandez
classification criteria for definite antiphospholipid syn
Nebro, A., Haro, M., Amoura, Z., Miyara, M.,
drome (APS), J. Thromb. Haemost., 4, 295-306, doi:
Tektonidou, M., Espinosa, G., Bertolaccini, M.L., and
10.1111/j.1538 7836.2006.01753.x.
Khamashta, M.A. (2015) Euro Phospholipid Project,
5.
Willis, R., and Pierangeli, S.S. (2013) Anti β2 glycopro
morbidity and mortality in the antiphospholipid syndrome
tein I antibodies, Ann. N. Y. Acad. Sci., 1285, 44-58, doi:
during a 10 year period: a multicentre prospective study of
10.1111/nyas.12080.
1000 patients, Ann. Rheum. Dis., 74, 1011-1018, doi: 10.1136/
6.
Bas de Laat, H., Derksen, R.H., and de Groot, P.G. (2004)
annrheumdis 2013 204838.
β2 glycoprotein I, the playmaker of the antiphospholipid
14.
Cuadrado, M.J., Lopez Pedrera, C., Khamashta, M.A.,
syndrome, Clin. Immunol., 112, 161-168, doi: 10.1016/
Camps, M.T., Tinahones, F., Torres, A., Hughes, G.R.,
j.clim.2004.02.012.
and Velasco, F. (1997) Thrombosis in primary antiphos
7.
Allen, K.L., Fonseca, F.V., Betapudi, V., Willard, B.,
pholipid syndrome: a pivotal role for monocyte tissue fac
Zhang, J., and McCrae, K.R. (2012) A novel pathway for
tor expression, Arthritis Rheum.,
40,
834-841,
human endothelial cell activation by antiphospholipid/
doi:10.1002/1529 0131(199705)40:5<834::AID ART8>3.0.CO;2 #.
anti β2 glycoprotein I antibodies, Blood, 119, 884-893,
15.
Breen, K.A., Seed, P., Parmar, K., Moore, G.W., Stuart
doi: 10.1182/blood 2011 03 344671.
Smith, S.E., and Hunt, B.J. (2012) Complement activation
8.
Sikara, M.P., Routsias, J.G., Samiotaki, M., Panayotou, G.,
in patients with isolated antiphospholipid antibodies or pri
Moutsopoulos, H.M., and Vlachoyiannopoulos, P.G.
mary antiphospholipid syndrome, Thromb. Haemost., 107,
(2010) β2 Glycoprotein I (β2GPI) binds platelet factor 4
423-429, doi: 10.1160/TH11 08 0554.
(PF4): implications for the pathogenesis of antiphospho
16.
Colosanti, T., Alessandri, C., Capozzi, A., Sorice, M.,
lipid syndrome, Blood, 115, 713-723, doi: 10.1182/blood
Delunardo, F., Longo, A., Pierdominici, M., Conti, F.,
2009 03 206367.
Truglia, S., Siracusano, A., Valesini, G., Ortona, E., and
9.
Chamley, L.W., Allen, J.L., and Johnson, P.M. (1997)
Margutti, P. (2012) Autoantibodies specific to a peptide of
Synthesis of β2 glycoprotein 1 by the human placenta,
β2 glycoprotein I cross react with TLR4, inducing a proin
Placenta, 18, 403-410, doi: 10.1016/S0143 4004(97)80040 9.
flammatory phenotype in endothelial cells and monocytes,
10.
Agar, C., van Os, G.M., Morgelin, M., Sprenger, R.R.,
Blood, 120, 3360-3370, doi: 10.1182/blood 2011 09
Marquart, J.A., Urbanus, R.T., Derksen, R.H., Meijers, J.C.,
378851.
and de Groot, P.G. (2010) β2 glycoprotein I can exist in 2
17.
Xia, L., Xie, H., Yu, Y., Zhou, H., Wang, T., and Yan, J.
conformations: implications for our understanding of the
(2016) The effects of NF kB and c Jun/AP 1 on the
БИОХИМИЯ том 84 вып. 9 2019
1240
ШИРШЕВ
expression of prothrombotic and proinflammatory mole
Moerloose, P. (2011) Toll like receptor 2 mediates the acti
cules induced by anti β2GPI in mouse, PLoS One, 11,
vation of human monocytes and endothelial cells by
1-17, doi: 10.1371/journal.pone.0147958.
antiphospholipid antibodies, Blood, 117, 5523-5531,
18.
Gropp, K., Weber, N., Reuter, M., Micklisch, S., Kopka, I.,
doi: 10.1182/blood 2010 11 316158.
Hallstrom, T., and Skerka, C. (2011) β2 glycoprotein I, the
30.
Pierangeli, S.S., Vega Ostertag, M.E., Raschi, E., Liu, X.,
major target inantiphospholipid syndrome, is a special
Romay Penabad, Z., De Micheli, V., Galli, M., Moia, M.,
human complement regulator, Blood, 118, 2774-2783,
Tincani, A., Borghi, M.O., Nguyen Oghalai, T., and
doi: 10.1182/blood 2011 02 339564.
Meroni, P.L. (2007) Toll like receptor and antipholipid
19.
Fischetti, F., Durigutto, P., Pellis, V., Debeus, A., Macor, P.,
mediated thrombosis: in vivo studies, Ann. Rheum. Dis., 66,
Bulla, R., Bossi, F., Ziller, F., Sblattero, D., Meroni, P.,
1327-1333, doi: 10.1136/ard.2006.065037.
and Tedesco, F. (2005) Thrombus formation induced by
31.
Urbanus, R.T., Pennings, M.T., Derksen, R.H., and de
antibodies to β2 glycoprotein I is complement dependent
Groot, P.G. (2008) Platelet activation by dimeric β2 glyco
and requires a priming factor, Blood, 106, 2340-2346,
protein I requires signaling via both glycoprotein Ibα and
doi: 10.1182/blood 2005 03 1319.
apolipoprotein E receptor 2’, J. Thromb. Haemost., 6,
20.
Redecha, P., Tilley, R., Tencati, M., Salmon, J.E.,
1405-1412, doi: 10.1111/j.1538 7836.2008.03021.x.
Kirchhofer, D., Mackman, N., and Girardi, G. (2007)
32.
Tanimura, K., Jin, H., Suenaga, T., Morikami, S., Arase, N.,
Tissue factor: a link between C5a and neutrophil activation
Kishida, K., Hirayasu, K., Kohyama, M., Ebina, Y.,
in antiphospholipid antibody induced fetal injury, Blood,
Yasuda, S., Horita, T., Takasugi, K., Ohmura, K.,
110, 2423-2431, doi: 10.1182/blood 2007 01 070631.
Yamamoto, K., Katayama, I., Sasazuki, T., Lanier, L.L.,
21.
Galli, M., Willems, G.M., Rosing, J., Janssen, R.M.,
Atsumi, T., Yamada, H., and Arase, H.
(2015)
Govers Riemslag, J.W., Comfurius, P., Barbui, T., Zwaal, R.F.,
β2 Glycoprotein I/HLA class II complexes are novel
and Bevers, E.M. (2005) Anti prothrombin IgG from
autoantigens in antiphospholipid syndrome, Blood, 125,
patients with anti phospholipid antibodies inhibits the inac
2835-2844, doi: 10.1182/blood 2014 08 593624.
tivation of factor Va by activated protein C, Br. J. Haematol.,
33.
Domenico Sebastiani, G., Minisola, G., and Galeazzi, M.
129, 240-247, doi: 10.1111/j.1365 2141.2005.05438.x.
(2003) HLA class II alleles and genetic predisposition to
22.
Ieko, M., Yoshida, M., Naito, S., Nakabayashi, T.,
the antiphospholipid syndrome, Autoimmun. Rev., 2,
Kanazawa, K., Mizukami, K., Mukai, M., Atsumi, T., and
387-394, doi: 10.1016/S1568 9972(03)00068 5.
Koike, T. (2010) Increase in plasma thrombin activatable
34.
Collins, T., Krman, A.J., Wake, C.T., Boss, J.M., Kappes, D.J.,
fibrinolysis inhibitor may not contribute to thrombotic ten
Fiers, W., Ault, K.A., Gimbrone, M.A., Jr., Strominger, J.L.,
dency in antiphospholipid syndrome because of inhibitory
and Pober, J.S. (1984) Immune interferon activates multi
potential of antiphospolipid antibodies toward TAFI acti
ple class II major histocompatibility complex genes and the
vation, Int. J. Hematol., 91, 776-783, doi: 10.1007/
associated invariant chain gene in human endothelial cells
s12185 010 0590 0.
and dermal fibroblasts, Proc. Natl. Acad. Sci. USA, 81,
23.
Lean, S.Y., Ellery, P., Ivey, L., Thom, J., Oostryck, R.,
4917-4921, doi: 10.1073/pnas.81.15.4917.
Leahy, M., Baker, R.I., and Adams, M.J. (2006) The
35.
Girardi, G., Berman, J., Redecha, P., Spruce, L.,
effects of tissue factor pathway inhibitor and anti β2 glyco
Thurman, J.M., Kraus, D., Hollmann, T.J., Casali, P.,
protein I IgG on thrombin generation, Haematologica, 91,
Caroll, M.C., Wetsel, R.A., Lambris, J.D., Holers, V.M.,
1360-1366.
and Salmon, J.E. (2003) Complement C5a receptors and
24.
Yunt, B.J., Wu, X.X., de Laat, B., Arslan, A.A., Stuart
neutrophils mediate fetal injury in the antiphospolipid syn
Smith, S., and Rand, J.H. (2011) Resistance to annexin A5
drome, J. Clin. Invest., 112, 1644-1654, doi: 10.1172/
anticoagulant activity in women with histories for obstetric
JCI18817.
antiphospholipid syndrome, Am. J. Obstet. Gynecol., 205,
36.
Kasahara, H., Matsuura, E., Kaihara, K., Yamamoto, D.,
485.e17-485.e23, doi: 10.1016/j.ajog.2011.06.019.
Kobayashi, K., Inagaki, J., Ichikawa, K., Tsutsumi, A.,
25.
Du, V.X., Kelchtermans, H., de Groot, P.G., and de Laat, B.
Yasuda, S., Atsumi, T., Yasuda, T., and Koike, T. (2005)
(2013) From antibody to clinical phenotype, the black box
Antigenic structures recognized by anti β2 glycoprotein I
of the antiphospholipid syndrome: pathogenic mechanisms
auto antibodies, Int. Immunol.,
17,
1533-1542,
of the antiphospholipid syndrome, Thromb. Res., 132,
doi: 10.1093/intimm/dxh330.
319-326, doi: 10.1016/j.thromres.2013.07.023.
37.
Xia, L., Zhou, H., Hu, L., Xie, H., Wang, T., Xu, Y., Liu, J.,
26.
Romay Penabad, Z., Montiel Manzano, M.G., Shilagard, T.,
Zhang, X., and Yan, J. (2013) Both NF κB and c Jun/AP 1
Papalardo, E., Vargas, G., Deora, A.B., Wang, M.,
involved in anti β2GPI/β2GPI induced tissue factor
Jacovina, A.T., Garcia Latorre, E., Reyes Maldonado, E.,
expression in monocytes, Thromb. Haemost.,
109,
Hajjar, K.A., and Pierangeli, S.S. (2009) Annexin A2 is
643-651, doi: 10.1160/TH12 09 0655.
involved in antiphospholipid antibody mediated patho
38.
Mackman, N. (1995) Regulation of the tissue factor gene,
genic effects in vitro and in vivo, Blood, 114, 3074-3083,
FASEB J., 9, 883-889, doi: 10.1096/fasebj.9.10.7615158.
doi: 10.1182/blood 2008 11 188698.
39.
Boles, J., and Mackman, N. (2010) Role of tissue factor in
27.
Ulrich, V., Gelber, S.E., Vukelic, M., Sacharidou, A.,
thrombosis in antiphospholipid antibody syndrome, Lupus,
Herz, J., Urbanus, R.T., de Groot, P.G., Natale, D.R.,
19, 370-378, doi: 10.1177/0961203309360810.
Harihara, A., Redecha, P., Abrahams, V.M., Shaul, P.W.,
40.
Vega Ostertag, M., Harris, E.N., and Puerangeli, S.S.
Salmon, J.E., and Mineo, C. (2016) ApoE receptor 2
(2004) Intercellular events in platelet activation induced by
mediation of trophoblast dysfunction and pregnancy com
antiphospholipid antibodies in the presence of low doses of
plications induced by antiphospholipid antibodies in mice,
thrombin, Arthritis Rheum., 50, 2911-2919, doi: 10.1002/
Arthritis Rheumatol., 68, 730-739, doi: 10.1002/art.39453.
art.20434.
28.
Pennings, M.T., van Lummel, M., Derksen, R.H.,
41.
Vega Ostertag, M., Casper, K., Swerlick, R., Ferrara, D.,
Urbanus, R.T., Romijn, R.A., Lenting, P.J., and de Groot, P.G.
Harris, E.N., and Pierangeli, S.S. (2005) Involvement of
(2006) Interaction of β2 glycoprotein I wth members of the
p38 MAPK in the up regulation of tissue factor on
low density lipoprotein receptor family, J. Thromb. Haemost.,
endothelial cells by antiphospholipid antibodies, Arthritis
4, 1680-1690, doi: 10.1111/j.1538 7836.2006.02036.x.
Rheum., 52, 1545-1554, doi: 10.1002/art.21009.
29.
Satta, N., Kruithof, E.R., Fickentscher, C., Dunoyer
42.
Zhou, H., Sheng, L., Wang, H., Xie, H., Mu, Y., Wang, T.,
Geindre, S., Boehlen, F., Reber, G., Burger, D., and de
and Yan, J. (2013) Anti β2GPI/β2GPI stimulates activa
БИОХИМИЯ том 84 вып. 9 2019
РОЛЬ NKT КЛЕТОК В ИНДУКЦИИ АНТИФОСФОЛИПИДНЫХ АНТИТЕЛ
1241
tion of THP 1 cells through TLR4/MD 2/MyD88 and
56.
Ansel, K.M., Ngo, V.N., Hyman, P.L., Luther, S.A.,
NF κB signaling pathways, Thromb. Res., 132, 742-749,
Forster, R., Sedgwick, J.D., Browning, J.L., Lipp, M., and
doi: 10.1016/j.thromres.2013.09.039.
Cyster, J.G. (2000) A chemokine driven positive feedback
43.
Canaud, G., Bienaime, F., Tabarin, F., Bataillon, G.,
loop organizes lymphoid follicles, Nature, 406, 309-314,
Seilhean, D., Noel, L.H., Dragon Durey, M.A.,
doi: 10.1038/35018581.
Snanoudj, R., Friedlander, G., Halbwachs Mecarelli, L.,
57.
Gunn, M.D., Tangemann, K., Tam, C., Cyster, J.G.,
Legendre, C., and Terzi, F. (2014) Inhibition of the mTORC
Rosen, S.D., and Williams, L.T. (1998) A chemokine
pathway in the antiphospholipid syndrome, N. Engl. J. Med.,
expressed in lymphoid high endothelial venules promotes
371, 303-312, doi: 10.1056/NEJMoa1312890.
the adhesion and chemotaxis of naive T lymphocytes, Proc.
44.
Sciascia, S., Sanna, G., Murru, V., Roccatello, D.,
Natl. Acad. Sci. USA,
95,
258-263, doi:
10.1073/
Khamashta, M.A., and Bertolaccini, M.L. (2014) Anti
pnas.95.1.258.
prothrombin (aPT) and antiphosphatidylserine/protrom
58.
Batista, F.D., and Harwood, N.E. (2009) The who, how
bin (aPS/PT) antibodies and the risk of thrombosis in the
and where of antigen presentation to B cells, Nat. Rev.
antiphospholipid syndrome. A systematic review, Thromb.
Immunol., 9, 15-27, doi: 10.1038/nri2454.
Haemost., 111, 354-364, doi: 10.1160/TH13 06 0509.
59.
Ebert, L.M., Horn, M.P., Lang, A.B., and Moser, B.
45.
Gharavi, A.E., Wilson, W., and Pierangeli, S. (2003) The
(2004) B cells alter the phenotype and function of follicu
molecular basis of antiphospolipid syndrome, Lupus, 12,
lar homing CXCR5+ T cells, Eur. J. Immunol., 34,
579-583, doi: 10.1191/0961203303lu448rr.
3562-3571, doi: 10.1002/eji.200425478.
46.
Blank, M., Krause, I., Fridkin, M., Keller, N., Kopolovic, J.,
60.
Celli, S., Lemaitre, F., and Bousso, P. (2007) Real time
Goldberg, I., Tobar, A., and Shoenfeld, Y. (2002) Bacterial
manipulation of T cell dendritic cell interactions in vivo
induction of autoantibodies to β2 glycoprotein I accounts
reveals the importance of prolonged contacts for CD4+ T
for the infectious etiology of antiphospholipid syndrome,
cell activation, Immunity, 27, 625-634, doi: 10.1016/
J. Clin. Invest., 109, 797-804, doi: 10.1172/JCI12337.
j.immuni.2007.08.018.
47.
Miyakis, S., Giannakopoulos, B., and Krilis, S.A. (2004) Beta 2
61.
Fazilleau, N., McHeyzer Williams, L.J., Rosen, H., and
glycoprotein I - function in health and disease, Thromb. Res.,
McHeyzer Williams, M.G. (2009) The function of follicu
114, 335-346, doi: 10.1016/j.thromres.2004.07.017.
lar helper T cells is regulated by the strength of T cell anti
48.
Iverson, G.M., Victoria, E.J., and Marquis, D.M. (1998)
gen receptor binding, Nat. Immunol., 10, 375-384,
Anti β2 glycoprotein I (β2GPI) autoantibodies recognize
doi: 10.1038/ni.1704.
an epitope on the first domain of β2GPI, Proc. Natl. Acad.
62.
Walker, L.S., Gulbranson Judge, A., Flynn, S., Brocker, T.,
Sci. USA, 95, 15542-15546.
Raykundalia, C., Goodall, M., Forster, R., Lipp, M., and
49.
Andreoli, L., Chighizola, C.B., Nalli, C., Gerosa, M.,
Lane, P. (1999) Compromised OX40 function in CD28
Borghi, M.O., Pregnolato, F., Grossi, C., Zanola, A.,
deficient mice is linked with failure to develop CXC
Allegri, F., Norman, G.L., Mahler, M., Meroni, P.L., and
chemokine receptor 5 positive CD4 cells and germinal
Tincani, A. (2015) Clinical characterization of antiphos
centers, J. Exp. Med., 190, 1115-1122, doi: 10.1084/
pholipid syndrome by detection of IgG antibodies against
jem.190.8.1115.
β2 glycoprotein I domain 1 and domain 4/5: ratio of anti
63.
Okada, T., Miller, M.J., Parker, I., Krummel, M.F.,
domain 1 to anti domain 4/5 as a useful new biomarker for
Neighbors, M., Hartley, S.B., O’Garra, A., Cahalan, M.D.,
antiphospholipid syndrome, Arthritis Rheumatol., 67,
and Cyster, J.G. (2005) Antigen engaged B cells undergo
2196-2204, doi: 10.1002/art.39187.
chemotaxis toward the T zone and form motile conjugates
50.
Agostinis, C., Durigutto, P., Sblattero, D., Borghi, M.O.,
with helper T cells, PLoS Biol., 3, e150, doi: 10.1371/jour
Grossi, C., Guida, F., Bulla, R., Macor, P., Pregnolato, F.,
nal.pbio.0030150.
Meroni, P.L., and Tedesco, F. (2014) A non complement
64.
McHeyzer Williams, L.J., Pelletier, N., Mark, L.,
fixing antibody to β2 glycoprotein I as a novel therapy for
Fazilleau, N., and McHeyzer Williams, M.G. (2009)
antiphospholipid syndrome, Blood, 123, 3478-3487,
Follicular helper T cells as cognate regulators of cell immu
doi: 10.1182/blood 2013 11 537704.
nity, Curr. Opin. Immunol., 21, 266-273, doi: 10.1016/
51.
Iannou, Y., Romay Penabad, Z., Pericleous, C., Giles, I.,
j.coi.2009.05.010.
Papalardo, E., Vargas, G., Shilagard, T., Latchman, D.S.,
65.
Johnston, R.J., Poholek, A.C., DiToro, D., Yusuf, I., Eto, D.,
Isenberg, D.A., Rahman, A., and Pierangeli S. (2009) In
Barnett, B., Dent, A.L., Craft, J., and Crotty, S. (2009)
vivo inhibition of antiphospholipid antibody induced patho
Bcl6 and Blimp 1 are reciprocal and antagonistic regula
genicity utilizing the antigenic target peptide domain I of
tors of T follicular helper cell differentiation, Science, 325,
β2 glycoprotein I: proof of concept, J. Thromb. Haemost.,
1006-1010, doi: 10.1126/science.1175870.
7, 833-842, doi: 10.1111/j.1538 7836.2009.03316.x.
66.
Suan, D., Nguyen, A., Moran,I., Bourne, K., Hermes, J.R.,
52.
Harris, E.N., Gharavi, A.E., Patel, S.P., and Hughes, G.R.V.
Arshi, M., Hampton, H.R., Tomura, M., Miwa, Y.,
(1987) Evaluation of the anti cardiolipin antibody test:
Kelleher, A.D., Kaplan, W., Deenick, E.K., Tangye, S.G.,
report of an international workshop held 4 April 1986, Clin.
Brink, R., Chtanova, T., and Phan, T.G. (2015) T follicular
Exp. Immunol., 68, 215-222.
helper cells have distinct modes of migration and molecu
53.
Gharavi, A.E., Harris, E.N., Asherson, R.A., and
lar signatures in naive and memory immune responses,
Hughes, G.R.V. (1987) Anticardiolipin antibodies: isotype
Immunity, 42, 704-718, doi: 10.1016/j.immuni.2015.
distribution and phospholipid specificity, Ann. Rheum. Dis.,
03.002.
46, 1-6, doi: 10.1136/ard.46.1.1.
67.
Klein, U., and Dalla Favera, R. (2008) Germinal centers:
54.
Loizou, S., Mackworth Young, C.G., Cofiner, C., and
role in B cell physiology and malignancy, Nat. Rev.
Walport, M.J. (1990) Heterogeneity of binding reactivity to
Immunol., 8, 22-33, doi: 10.1038/nri2217.
different phospholipids of antibodies from patients with
68.
Victora, G.D., and Nussenzweig, M.C. (2012) Germinal
systemic lupus erythematosus (SLE) and with syphilis,
centers, Annu. Rev. Immunol., 30, 429-457, doi: 10.1146/
Clin. Exp. Immunol., 80, 171-176, doi: 10.1111/j.1365
annurev.iy.12.040194.001001.
2249.1990.tb05228.x.
69.
Gitlin, A.D., Shulman, Z., and Nussenzweig, M.C. (2014)
55.
Vinuesa, C.G., and Chang, P.P. (2013) Innate B cell
Clonal selection in the germinal centre by regulated pro
helpers reveal novel types of antibody responses, Nat.
liferation and hypermutation, Nature, 509, 637-640,
Immunol., 14, 119-126, doi: 10.1038/ni.2511.
doi: 10.1038/nature13300.
3 БИОХИМИЯ том 84 вып. 9 2019
1242
ШИРШЕВ
70.
Crotty, S. (2011) Follicular helper CD4 T cells (TFH),
86.
De Libero, G., and Mori, L. (2006) Mechanisms of lipid
Annu. Rev. Immunol., 29, 621-663, doi: 10.1146/annurev
antigen generation and presentation to T cells, Trends
immunol 031210 101400.
Immunol., 27, 485-492, doi: 10.1016/j.it.2006.08.001.
71.
Dufaud, C.R., McHeyzer Williams, L.J., and McHeyzer
87.
Macho Fernandez, E., and Brigl, M. (2015) The extended
Williams, M.G. (2017) Deconstructing the germinal cen
family of CD1d restricted NKT cells: sifting through a
ter, one cell at a time, Curr. Opin. Immunol., 45, 112-118,
mixed bag of TCRs, antigens, and functions, Front.
doi: 10.1016/j.coi.2017.03.007.
Immunol., 6, 1-19, doi: 10.3389/fimmu.2015.00362.
72.
Allen, C.D.C., Okada, T., Tang, H.L., and Cyster, J.G.
88.
Kronenberg, M. (2005) Toward an understanding of NKT cell
(2007) Imaging of germinal center selection events during
biology: progress and paradoxes, Annu. Rev. Immunol., 23,
affinity maturation, Science, 315, 528-531, doi: 10.1126/
877-900, doi: 10.1146/annurev.immunol.23.021704.115742.
science.1136736.
89.
Fais, F., Morabito, F., Stelitano, C., Callea, V., Zanardi, S.,
73.
Shapiro Shelef, M., and Calame, K. (2005) Regulation of
Scudeletti, M., Varese, P., Ciccone, E., and Grossi, C.E.
plasma cell development, Nat. Rev. Immunol., 5, 230-242,
(2004) CD1d is expressed on B chronic lymphocytic
doi: 10.1038/nri1572.
leukemia cells and mediates α galactosylceramide presen
74.
Mendez, L.M., Polo, J.M., Yu, J.J., Krupski, M., Ding, B.B.,
tation to natural killer T lymphocytes, Int. J. Cancer, 109,
Melnick, A., and Ye, B.H. (2008) CtBP is an essential
402-411, doi: 10.1002/ijc.11723.
corepressor for BCL6 autoregulation, Mol. Cell. Biol., 28,
90.
Boyson, J.E., Rybalov, B., Koopman, L.A., Exley, M.,
2175-2186, doi: 10.1128/MCB.01400 07.
Balk, S.P., Racke, F.K., Schatz, F., Masch, R., Wilson, S.B.,
75.
Shapiro Shelef, M., Lin, K.I., McHeyzer Williams, L.J.,
and Strominger, J.L. (2002) CD1d and invariant NKT cells
Liao, J., McHeyzer Williams, M.G., and Calame, K. (2003)
at the human maternal fetal interface, Proc. Natl. Acad.
Blimp 1 is required for the formation of immunoglobulin
Sci. USA, 99, 13741-13746, doi: 10.1073/pnas.162491699.
secreting plasma cells and pre plasma memory B cells,
91.
Barral, P., Exkl Dorna, J., Harwood, N.E., De Santo, C.,
Immunity, 19, 607-620, doi: 10.1016/S1074 7613(03)00267 X.
Salio, M., Illarionov, P., Besra, G.S., Cerundolo, V., and
76.
Reinhardt, R., Liang, H., and Locksley, R. (2009) Cytokine
Batista, F.D. (2008) B cell receptor mediated uptake of
secreting follicular T cells shape the antibody repertoire,
CD1d restricted antigen augments antibody responses by
Nat. Immunol., 10, 385-393, doi: 10.1038/ni.1715.
recruiting invariant NKT cell help in vivo, Proc. Natl. Acad.
77.
Scaerli, P., Willimann, K., Lang, A.B., Lipp, M.,
Sci. USA, 105, 8345-8350, doi: 10.1073/pnas.0802968105.
Loetscher, P., and Moser, B. (2000) CXC chemokine
92.
Leadbetter, E.A., Brigl, M., Illarionov, P., Cohen, N.,
receptor 5 expression defines follicular homing T cells with
Luteran, M.C., Pillai, S., Besra, G.S., and Brenner, M.B.
B cell helper function, J. Exp. Med., 192, 553-562, doi:
(2008) NK T cells provide lipid antigen specific cognate
10.1084/jem.192.11.1553.
help for B cells, Proc. Natl. Acad. Sci. USA, 105,
78.
Good Jacobson, K.L., Szumilas, C.G., Chen, L.,
8339-8344, doi: 10.1073/pnas.0801375105.
Sharpe, A.H., Tomayko, M.M., and Shlomchik, M.J.
93.
Dellabona, P., Abrignani, S., and Casorati, G. (2014)
(2010) PD 1 regulates germinal center B cell survival and
iNKT cell help to B cells: a cooperative job between innate
the formation and affinity of long lived plasma cells, Nat.
and adaptive immune responses, Eur. J. Immunol., 44,
Immunol., 11, 535-542, doi: 10.1038/ni.1877.
2230- 2237, doi: 10.1002/eji.201344399.
79.
Linterman, M.A., Beaton, L., Yu, D., Ramiscal, R.R.,
94.
Vomhof DeKrey, E.E., Yates, J., and Leadbetter, E.A.
Srivastava, M., Hogan, J.J., Verma, N.K., Smyth, M.J.,
(2014) Invariant NKT cells provide innate and adaptive help
Rigby, R.J., and Vinuesa, C.G. (2010) IL 21 acts directly
for B cells, Curr. Opin. Immunol., 28, 12-17, doi: 10.1016/
on B cells to regulate Bcl 6 expression and germinal center
j.coi.2014.01.007.
responses, J. Exp. Med., 207, 353-363, doi: 10.1084/
95.
Chang, P.P., Barral, P., Fitch, J., Pratama, A., Ma, C.S.,
jem.20091738.
Kallies, A., Hogan, J.J., Cerundolo, V., Tangye, S.G.,
80.
Bendelac, A., Savage, P.B., and Teyton, L. (2007) The
Bittman, R., Nutt, S.L., Brink, R., Godfrey, D.I., Batista, F.D.,
biology of NKT cells, Annu. Rev. Immunol., 25, 297-336,
and Vinuesa, C.G. (2012) Identification of Bcl 6 depen
doi: 10.1146/annurev.immunol.25.022106.141711.
dent follicular helper NKT cells that provide cognate help
81.
Morita, M., Natori, T., Sakai, T., Sawa, E., Yamaji, K.,
for B cell responses, Nat. Immunol., 13, 35-43, doi: 10.1038/
Koezuka, Y., Kobayashi, E., and Fukushima, H. (1995)
ni.2166.
Structure activity relationship of α galactosylceramides
96.
King, I.L., Fortier, A., Tighe, M., Dibble, J., Watts, G.F.,
against B16 bearing mice, J. Med. Chem., 38, 2176-2187,
Veerapen, N., Haberman, A.M., Besra, G.S., Mohrs, M.,
doi: 10.1021/jm00012a018.
Brenner, M.B., and Leadbetter, E.A. (2012) Invariant nat
82.
Kawano, T., Cui, J., Koezuka, Y., Toura, I., Kaneko, Y.,
ural killer T cells direct B cell responses to cognate lipid
Motoki, K., Ueno, H., Nakagawa, R., Sato, H., Kondo, E.,
antigen in an IL 21 dependent manner, Nat. Immunol., 13,
Koseki, H., and Taniguchi, M. (1997) CD1d restricted
44-50, doi: 10.1038/ni.2172.
and TCR mediated activation of Vα14 NKT cells by gly
97.
Mattner, J., Savage, P.B., Leung, P., Oertelt, S.S., Wang, V.,
cosylceramides, Science, 278, 1626-1629, doi: 10.1126/
Trivedi, O., Scanlon, S.T., Pendem, K., Teyton, L., Hart, J.,
science.278.5343.1626.
Ridgway, W.M., Wicker, L.S., Gershwin, M.E., and
83.
Barral, D.C., and Brenner, M.B. (2007) CD1 antigen pre
Bendelac, A. (2008) Liver autoimmunity triggered by
sentation: how it works, Nat. Rev. Immunol., 7, 929-941,
microbial activation of natural killer T cells, Cell Host
doi: 10.1038/nri2191.
Microbe, 3, 304-315, doi: 10.1016/j.chom.2008.03.009.
84.
Godfrey, D.I., Rossjohn, J., and McCluskey, J. (2008) The
98.
Fujii, S., Shimizu, K., Smith, C., Bonifaz, L., and
fidelity, occasional promiscuity, and versatility of T cell
Steinman, R.M. (2003) Activation of natural killer T cells
receptor recognition, Immunity, 28, 304-314, doi: 10.1016/
by α galactosylceramide rapidly induces the full matura
j.immuni.2008.02.004.
tion of dendritic cells in vivo and thereby acts as an adju
85.
Brossay, L., Chioda, M., Burdin, N., Koezuka, Y.,
vant for combined CD4 and CD8 T cell immunity to a
Casorati, G., Dellabona, P., and Kronenberg, M. (1998)
coadministreted protein, J. Exp. Med., 198, 267-279,
CD1d mediated recognition of an α galactosylceramide
doi: 10.1084/jem.20030324.
by natural killer T cells highly conserved through mam
99.
Nair, S., Boddupalli, C.S., Verma, R., Liu, J., Yang, R.,
malian evolution, J. Exp. Med.,
188,
1521-1528,
Pastores, G.M., Mistry, P.K., and Dhodapkar, M.V. (2015)
doi: 10.1084/jem.188.8.1521.
Type II NKT TFH cells against Gaucher lipids regulate
БИОХИМИЯ том 84 вып. 9 2019
РОЛЬ NKT КЛЕТОК В ИНДУКЦИИ АНТИФОСФОЛИПИДНЫХ АНТИТЕЛ
1243
B cell immunity and inflammation, Blood,
125,
cytotoxicity against lymphoma, Eur. J. Immunol., 44,
1256-1271, doi: 10.1182/blood 2014 09 600270.
3634-3657, doi: 10.1002/eji.201444848.
100. Mistry, P.K., Taddei, T., von Dahl, S., and Rosenblom, B.E.
106. Sallo, M., Silk, J.D., Jones, E.Y., and Cerundolo, V. (2014)
(2013) Gaucher disease and malignancy: a model for can
Bilogy of CD1 and MR1 restricted T cells, Annu. Rev.
cer pathogenesis in an inbom error of metabolism, Crit.
Immunol., 32, 323-366, doi: 10.1146/annurev immunol
Rev. Oncol., 18, 235-246, doi: 10.1615/CritRevOncog.
032713 120243.
2013006145.
107. Liu, K., Idoyaga, J., Charalambous, A., Fujii, S., Bonito, A.,
101. Zeng, S.G., Ghnewa, Y.G., O’Reilly, V.P., Lyons, V.G.,
Mordoh, J., Wainstok, R., Bai, X.F., Liu, Y., and
Atzberger, A., Hogan, A.E., Exley, M.A., and Doherty, D.G.
Steinman, R.M. (2005) Innate NKT lymphocytes confer
(2013) Human invariant NKT cell subsets differentiation,
superior adaptive immunity via tumor capturing dendritic
antibody production, and T cell stimulation by B cells in
cells, J. Exp. Med., 202, 1507-1516, doi: 10.1084/
vitro, J. Immunol.,
191,
1666-1676, doi:
10.4049/
jem.20050956.
jimmunol.1202223.
108. Allan, L.L., Hoefl, K., Zheng, D.J., Chung, B.K., Kozak, F.K.,
102. Exley, M.A., Tahir, S.M., Cheng, O., Shaulov, A., Joyce, R.,
Tan, R., and van den Elzen, P. (2009) Apolipoprotein
Avigan, D., Sackstein, R., and Balk, S.P. (2001) A major
mediated lipid antigen presentation in B cells provides a
fraction of human bone marrow lymphocytes are Th2 like
pathway for innate help by NKT cells, Blood, 114,
CD1d reactive T cells that can suppress mixed lymphocyte
2411-2416, doi: 10.1182/blood 2009 04 211417.
responses, J. Immunol., 167, 5531-5534, doi: 10.4049/
109. Tonti, E., Galli, G., Malzone, C., Abrignani, S., Casorati, G.,
jimmunol.167.10.5531.
and Dellabona, P. (2009) NKT cell help to B lymphocytes
103. Gumperz, J.E., Roy, C., Makowska, A., Lum, D., Sugita, M.,
can occur independently of cognate interaction, Blood,
Podrebarac, T., Koezukan, Y., Porcelli, S.A., Cardell, S.,
113, 370-376, doi: 10.1182/blood 2008 06 166249.
Brenner, M.B., and Behar, S.M. (2000) Murine CD1d
110. King, I.L., Amiel, E., Tighe, M., Mohrs, K., Veerapen, N.,
restricted T cell recognition of cellular lipids, Immunity,
Besra, G., Mohrs, M., and Leadbetter, E.A. (2013) The
12, 211-221, doi: 10.1016/S1074 7613(00)80174 0.
mechanism of splenic invariant NKT cell activation dic
104. Zhao, J., Weng, X., Bagchi, S., and Wang, C.R. (2014)
tates localization in vivo, J. Immunol., 191, 572-582,
Policlonal type II natural killer T cells require PLZF and
doi: 10.4049/jimmunol.1300299.
SAP for their development and contribute to CpG mediat
111. Shah, H.B., Joshi, S.K., Rampuria, P., Devera, T.S., Lang, G.A.,
ed antitumor response, Proc. Natl. Acad. Sci. USA, 111,
Stohl, W., and Lang, M.L. (2013) BAFF and APRIL
2674-2679, doi: 10.1073/pnas.1323845111.
dependent maintenance of antibody titers after immuniza
105. Weng, X., Liao, C.M., Bagchi, S., Cardell, S.L., Stein, P.L.,
tion with T dependent antigen and CD1d binding ligand,
and Weng, C.R. (2014) The adaptor protein SAP regulates
J. Immunol., 191, 1154-1163, doi: 10.4049/jimmunol.
type II NKT cell development, cytokine production and
1300263.
MECHANISMS OF THE INDUCTION
OF ANTIPHOSPHOLIPID SYNDROME.
ROLE OF NKT CELLS
S. V. Shirshev
Perm Federal Research Center, Institute of Ecology and Genetics of Microorganisms,
Ural Branch of the Russian Academy of Sciences,
614081 Perm, Russia; E(mail: shirshev@iegm.ru
Received March 4, 2019
Revised June 3, 2019
Accepted June 3, 2019
The mechanisms of the potential participation of natural killer T cells (NKT) in the induction of antiphospholipid
antibodies, which play a major pathogenetic role in the formation of antiphospholipid syndrome, are reviewed. Based
on the literature data, the pathogenesis of antiphospholipid syndrome and modern aspects of antibody formation
involving follicular helper NKT cells of type II are considered. Several potential mechanisms underlying participation
of NKT cells in the induction of antiphospholipid antibodies are presented.
Keywords: antiphospholipid syndrome, antiphospholipid antibodies, NKT cells, B lymphocytes, humoral immune
response
БИОХИМИЯ том 84 вып. 9 2019
3*