БИОХИМИЯ, 2019, том 84, вып. 9, с. 1267 - 1280
УДК 577.29
РАКОВЫЙ СТВОЛОВОЙ КОМПЛЕКС,
НЕ РАКОВАЯ СТВОЛОВАЯ КЛЕТКА,
ОСНОВА ЭВОЛЮЦИИ РАКОВОЙ ОПУХОЛИ
Обзор
© 2019
Е.Д. Свердлов1,2, И.П. Чернов2*
1 Институт молекулярной генетики РАН, 123182 Москва, Россия
2 Институт биоорганической химии им. акад. М.М. Шемякина
и Ю.А. Овчинникова РАН, 117997 Москва, Россия;
электронная почта: igor.palich@gmail.com
Поступила в редакцию 29.04.2019
После доработки 30.05.2019
Принята к публикации 01.06.2019
Выдвигается гипотеза о механизме функционирования раковых стволовых клеток при условии, что они су
ществуют. В основе гипотезы лежат следующие постулаты: 1. Паракринный обмен между раковыми и стро
мальными клетками эффективен только при условии, что они находятся в прочном контакте и образуют си
напсоподобное межклеточное пространство, через которое происходит межклеточный обмен информаци
ей и в котором концентрация паракринных сигнальных молекул высока благодаря малому объему синапти
ческой щели. 2. Раковых стволовых клеток, как таковых, не существует, существуют раковые стволовые
комплексы, формируемые раковой клеткой прочно связанной со стромальной клеткой(ами) (портативная
ниша) и паракринно обменивающейся с нею (ними). 3. Раковый стволовой комплекс представляет собой
сложную систему, с вновь возникающими свойствами: стволовостью и повышенной резистентностью к воз
действиям, в т.ч. терапевтическим. 4. Стволовость заключается в способности раковой клетки в составе
комплекса делиться асимметрично: одна клетка остается в составе комплекса и образует обновленный ство
ловый комплекс, а другая отделяется от него, давая дифференцируемую не стволовую клетку. 5. Повышен
ная резистентность ракового стволового комплекса связана с объединением путем паракринного обмена за
щитных систем, входящих в него компонентов. Это микрорезистентность на клеточном уровне. 6. Стволо
вой комплекс способен стохастически разрушаться, образуя не стволовую раковую клетку; частично диф
ференцированные не стволовые раковые клетки способны стохастически связываться со стромальным ком
понентом, дедифференцироваться за счет паракринных сигналов и образовывать новый раковый стволовой
комплекс. Таким образом, опухоль является пластичной системой, находящейся в псевдоравновесном со
стоянии. В таких системах осуществляется принцип Ле Шателье (гомеостаз): система, находящаяся в рав
новесии, при воздействии извне, активирует процессы, противодействующие изменениям. Это обеспечива
ет повышенную резистентность опухоли на уровне популяции клеток - макрорезистентность. 7. Портатив
ная ниша путешествует с раковой клеткой в процессе метастазирования. Предлагается общая терапевтичес
кая стратегия, мишенью которой являются контакты между раковыми и стромальными клетками. Их раз
рушение должно приводить к исчезновению раковых стволовых комплексов и разрушению опухоли.
КЛЮЧЕВЫЕ СЛОВА: канцерогенез, метастазирование, дифференцировка и дедифференцировка, стволо
вость, ниша стволовых клеток, самообновление, синапс, паракринный обмен.
DOI: 10.1134/S0320972519090057
С 2016 по март 2019 г. в Pubmed 2523 статьи,
из генетически, эпигенетически и фенотипи
включая 534 обзора, содержат слова «cancer stem
чески гетерогенных клонов. Две основные кон
cells» в заголовке. Это свидетельствует, с одной
цепции пытаются объяснить эту гетерогенность:
стороны, о важности проблемы, с другой - дает
гипотеза раковых стволовых клеток (РСК) и мо
понять, что она далека от разрешения. Большин
дель клональной (стохастической) эволюции
ство опухолей к моменту обнаружения состоит
[1-3]. Хотя эти две концепции имеют некото
рые общие положения, они принципиально
Принятые сокращения: СК - стволовая клетка,
различаются и с практической точки зрения
РСК - раковая стволовая клетка, РСКом - раковый ство
ловой комплекс, ОАФ - опухоль ассоциированный фиб
диктуют разные подходы к терапии. В послед
робласт.
ние годы разрабатываются теории, объединяю
* Адресат для корреспонденции.
щие эти две концепции [4]. В этом коротком об
1267
1268
СВЕРДЛОВ, ЧЕРНОВ
зоре мы остановимся на анализе и развитии
РСК должна постоянно давать новые клетки:
концепции РСК.
раковую стволовую и более дифференцирован
Успехи в идентификации и расшифровке ме
ное потомство, которое способно только к огра
ханизмов регуляции взрослых стволовых клеток
ниченному числу делений. Она должна обладать
привели к идее, что стволовые клетки могут
свойством стволовости (stemness), комбинирую
оперировать и в опухолях, являясь «двигателя
щим способность клетки увековечивать свою
ми» их развития, начиная с начальной стадии и
родословную, давать начало дифференцирован
завершая метастазированием. Такие клетки по
ным клеткам и взаимодействовать с окружаю
лучили название раковых стволовых клеток
щей средой для поддержания баланса между по
(РСК). Иногда РСК называют опухоль иниции
коем, пролиферацией и регенерацией. В то вре
рующими клетками (tumor initiating cells, TIC)
мя как взрослые стволовые клетки проявляют
или опухоль генерирующими клетками (tumor
эти свойства при участии в гомеостазе тканей,
propagating cells, TPC) [5]. Постепенно термин
РСК, как предполагали, должны быть их злока
РСК и их реальное существование стали вос
чественными эквивалентами. Стволовые клетки
приниматься как само собой разумеющееся,
и РСК не могут выживать ни вне их микроокру
иногда даже как «не подлежащая дискуссии дог
жения, ни в отсутствии специфических факто
ма» [6]. Однако несмотря на громадное количе
ров и цитокинов. При этом клетки сохраняют
ство публикаций, само существование РСК,
способность дедифференцироваться и возвра
критерии, отличающие их от других раковых
щаться к стволовому состоянию [20]. Сегодня в
клеток, насколько их существование является
основном принимается, что клеткой происхож
пререквизитом эволюции злокачественной опу
дения рака является нормальная стволовая
холи, их происхождение [7] и, наконец, на
клетка, хотя в процессе развития опухоли РСК
сколько отчетлива граница между РСК и други
могут образовываться из разных клеток опухо
ми раковыми клетками продолжает оставаться
ли, в том числе и дифференцированных за счет
проблемой весьма далекой от решения [8, 9].
их дедифференцировки (см. ниже).
Далека от решения и проблема возможности ис
В 2011 г. рабочая конференция по раковым
пользования РСК в качестве мишеней для тера
стволовым клеткам (Working Conference on
пии. Знаменателен в этом отношении заголовок
CSCs) выработала основные рекомендации по
одной из недавних статей [10]: «Pancreatic cancer
определениям, сформулированным в обзоре
stem cells: A state or an entity?».
Valent et al. [5]. Согласно этим рекомендациям,
Мы высказываем гипотезу о том, как могли
под РСК подразумеваются неопластические
бы возникать, выглядеть и функционировать
клетки, которые имеют потенциал в течение не
РСК, если предположить, что они вообще суще
ограниченного или продолжительного периода
ствуют. При этом мы рассчитываем на широкий
времени поддерживать инвазивную твердую
круг читателей «Биохимии» и даем максимально
опухоль или лейкемию. Согласно определению
обобщенную картину описываемых процессов
2019 года (журнал Nature, nature.com/subjects/
развития раковой опухоли, отсылая читателя,
cancer stem cells), раковые стволовые клетки -
заинтересованного в более детальной информа
это редкие бессмертные клетки в опухоли, кото
ции, к недавним компетентным обзорам для
рые могут самообновляться путем деления и да
знакомства с последними веяниями и с литера
вать начало множеству типов клеток, которые
турой, которая лежит в их основе [7, 10-18].
составляют опухоль, и, следовательно, могут об
Другие, более ранние сведения и определения,
разовывать новые опухоли. Такие клетки были
читатель найдет в открытом доступе в нашем об
обнаружены в различных типах опухолей чело
зоре [19].
века и могут быть привлекательными мишеня
ми для лечения рака.
Большинство моделей дифференцировки
ПРОБЛЕМА СУЩЕСТВОВАНИЯ РСК
раковых клеток принимают бимодальный прин
цип при рассмотрении РСК: РСК и все другие
Концепция РСК берет за основу сценарий,
опухолевые клетки [12].
по которому движется нормальная стволовая
Согласно существующей концепции, попу
клетка (СК) в процессе дифференцировки. Ис
ляция РСК имеет следующие свойства:
ходно считали, что мутации, ведущие к раку,
1. Образует отдельный пул клеток, иденти
происходят в нормальной СК, в результате чего
фицируемый биологическими и физико хими
она превращается в раковую стволовую клетку.
ческими методами. Должно существовать по
Способность нормальной СК к самообновле
меньшей мере два пула клеток в опухоли: РСК и
нию и к дифференцировке автоматически при
ее производные - дифференцированные в раз
писали и предполагаемой РСК. В таком случае
ной степени клетки [20].
БИОХИМИЯ том 84 вып. 9 2019
РАКОВЫЙ СТВОЛОВОЙ КОМПЛЕКС
1269
2. Проявляет способность, подобно нор
ванное состояние, не доказаны и кажутся мало
мальным стволовым клеткам, к неограниченно
вероятными [6], а необратимость перехода оп
му самообновлению и дифференцировке по
ровергнута недавними экспериментами (см. ни
многим направлениям [21].
же). К утверждению, что РСК составляют отно
3. Поддерживает рост гетерогенной раковой
сительно небольшую фракцию в общей популя
массы, содержащей полный репертуар частично
ции раковых клеток, также следует относиться с
или полностью дифференцированных раковых
осторожностью, поскольку показано, что фрак
клеток, способных к нескольким дифференци
ция РСК может сильно варьировать (0,1-30%) в
ровкам или находящихся на стадии окончатель
зависимости от типа опухоли и дизайна экспе
ной дифференцировки [6].
римента [22].
4. Составляет незначительную долю общей
В последние годы начинает приобретать
популяции клеток опухоли, отличающихся от
влияние идея о пластичности РСК, когда РСК
основной массы клеток опухоли способностью
могут терять «стволовость», тогда как диффе
к формированию новой опухоли при импланта
ренцированные раковые клетки могут дедиффе
ции и самообновлению.
ренцироваться, превращаясь в РСК [23, 24].
5. Экспрессирует специфический набор по
Различные виды и, возможно, даже один и
верхностных маркеров, которые позволяют
тот же вид рака у разных пациентов могут разви
дифференцировать ее и выделять из массы дру
ваться и по РСК, и по эволюционно стохасти
гих клеток.
ческой моделям. Имея дело с такими лабильны
6. Проявляет высокую устойчивость к стан
ми системами, как стволовые, раковые или РСК
дартной терапии [14, 21].
клетки, всегда нужно учитывать возможность их
В целом, концепция РСК представляет со
фенотипической перестройки вследствие эпи
бой иерархическую модель с РСК во главе иерар
генетических процессов. В 2011 г. было описано
хии. Она совершенно подобна иерархии, наб
[3, 25] приобретение способности к самообнов
людаемой для взрослых стволовых клеток, кото
лению у не РСК популяций. Эти данные проде
рые при дифференцировке дают цепочку все бо
монстрировали высокую пластичность стволо
лее дифференцированных клеток. Потому мо
вых клеток вообще, и РСК в особенности, а так
дель РСК иногда называют иерархической. РСК
же легкость взаимопревращений стволовых кле
образуют в опухоли субклоны, внутри которых,
ток в не стволовые и наоборот, особенно в рако
тем не менее, каждая клетка отличается от дру
вых опухолях.
гой по структуре генома, по характеру тран
Выявляемая пластичность раковых клеток и
скриптома, протеома и т.п. Субклоны имеют
возможность переходов между стволовыми и не
разные злокачественные (malignant) потенциа
стволовыми клетками вносит дополнительные
лы, поскольку РСК, движущие их размножение,
сложности в исследование роли РСК в канцеро
различаются и поскольку они могут оказываться
генезе. Эта пластичность может зависеть от
в разном микроокружении внутри опухоли и по
многих факторов, среди которых важную роль
разному с ним взаимодействовать.
играют сигналы от микроокружения и межкле
Из этого следует, что каждый существующий
точные взаимодействия в «нише» [26]. РСК мо
и размножающийся субклон должен содержать
гут превращаться в не РСК и наоборот, сущест
свой компартмент РСК, обладающий уникаль
вуя при этом в динамическом равновесии [27].
ными геномными и эпигеномными характерис
Таким образом, один из существенных эле
тиками, и каждый субклон может производить
ментов концепции РСК - существование в опу
новые субклоны, которые будут обладать изме
холевой массе необратимо отделенной фракции
ненными, по сравнению с исходным, свойства
РСК, оказывается в общем виде несостоятель
ми.
ным. Дифференцированные раковые клетки и
Однако в большинстве случаев найти уни
РСК находятся в состоянии постоянного взаи
кальный для РСК маркер не удается, поэтому
мопревращения [28, 29]. Наша гипотеза просто
фенотипические данные сами по себе не дают
объясняет такие переходы.
достаточных доказательств присутствия отдель
ной популяции РСК. Предполагают, что меха
низмы, обеспечивающие особые свойства РСК,
НИША РСК - ОПРЕДЕЛЕНИЯ
не стабильны, поскольку могут быть связаны с
И ПРОБЛЕМЫ
изменениями эпигенома, часто происходящими
в опухолевых популяциях [5].
Процесс перехода РСК в не РСК может мо
Некоторые упомянутые характеристики
дулироваться специфическими сигналами мик
РСК, в частности, асимметричное деление и не
роокружения и клеточными взаимодействиями,
обратимый процесс перехода в дифференциро
возникающими в нише опухоли [7, 11, 26]. Су
БИОХИМИЯ том 84 вып. 9 2019
1270
СВЕРДЛОВ, ЧЕРНОВ
ществование так называемых ниш - физиоло
При этом мы отмечали, что не РСК или
гического микроокружения, состоящего из спе
стромальные клетки ниши, но скорее их взаи
циализированных клеток, которые участвуют в
модействия приводят к эволюции опухоли, как
регуляции функционирования стволовых кле
органоподобного образования [57]. Эти взаимо
ток через обмен различного рода сигналами, для
действия включают: (i) непосредственные би
нормальных стволовых клеток признано. В этом
нарные контакты между лигандами и рецепто
случае определение ниши, в которой они суще
рами, экспонированными на поверхности рако
ствуют, не вызывает принципиальных проблем
вых и стромальных клеток, и (ii) паракринные
[20, 30]. Это достаточно четко определенная об
коммуникации между раковыми (обычно эпи
ласть, окружающая дискретно локализованные
телиальными) клетками и различными клетка
функционирующие стволовые клетки в ткани,
ми опухолевого микроокружения [58, 59]. Неко
хотя не для всех нормальных тканей доказано
торые авторы для опухоль стромального взаи
существование стволовых клеток и, соответ
модействия используют термин «симбиотичес
ственно, их ниш [31].
кое» [60]: «Связь между опухолью и стромой яв
По аналогии со взрослыми стволовыми клет
ляется симбиотической. Стромальные клетки,
ками было предположено, что ниши существу
измененные под действием злокачественного
ют также и в случае РСК, и что взаимодействие
эпителия, образуют потенцирующее (permissive)
РСК с нишами может регулировать самообнов
микроокружение, которое управляет прогресси
ление, пролиферацию и дифференцировку РСК
ей рака».
[32-35]. Естественно, если ниша существует, то
Однако в случае ниши РСК возникает боль
она должна находиться где то в микроокруже
ше вопросов, чем ответов (см. недавние обзоры
нии опухоли.
[35, 61, 62]).
Американский Национальный институт рака
Существует большое число статей, посвя
определяет опухолевое микроокружение (Tumor
щенных взаимодействию стромальных элемен
Microenvironment TME) как «нормальные клет
тов опухоли с предполагаемыми РСК [13, 49].
ки, молекулы и кровеносные сосуды, окружаю
По данным Valent et al. [5], в нише содержатся
щие и питающие опухоль. Опухоль может ме
некоторые важные компоненты регуляции
нять свое микроокружение, а микроокружение
РСК. Двусторонние взаимодействия между ра
может влиять на рост и распространение опухо
ковыми клетками и стромой широко обсужда
ли» [36]. В случае солидных опухолей микроок
ются с точки зрения роли последней в развитии
ружение состоит из двух основных компонентов,
опухоли и, в частности, в приобретении таких
клеточного и неклеточного, соотношение и со
важнейших качеств, как инвазия и метастазиро
став которых могут варьировать в зависимости от
вание [63]. Предполагается, что не только стро
расположения и стадии опухоли. Неклеточные
мальная ниша действует на раковые клетки, но
компоненты в основном содержат внеклеточ
и наоборот: раковые клетки (в основном имеют
ный матрикс, состоящий из белков, гликопроте
ся в виду РСК) способны влиять на строму, ис
идов и протеогликанов, которые образуют кар
пользуя ее для своего развития [64-68].
кас архитектуры опухолей [37-39]. Клеточные
При этом, как мы упоминали выше, каждый
компоненты включают фибробласты, такие как
существующий и размножающийся субклон
опухоль ассоциированные фибробласты (ОАФ),
РСК должен содержать свою нишу, и непонятно
мезенхимальные стволовые клетки, адипоциты,
как это реализуется. Наша гипотеза объясняет
перициты, эндотелиальные клетки, сети лимфа
все эти особенности.
тических сосудов и опухоль инфильтрирующие
клетки иммунной системы [40-46]. Микроокру
жение рака влияет на эволюцию раковых клеток
ПРОБЛЕМА ВЗАИМОДЕЙСТВИЙ
и вносит значительный вклад в сложность рака,
РСК С НИШЕЙ. ПАРАКРИННЫЕ
что было подчеркнуто в недавних обзорах [47,
СИГНАЛЫ ЭФФЕКТИВНЫ ТОЛЬКО
48]. Микроокружение определяет судьбу опухо
НА НЕБОЛЬШИХ РАССТОЯНИЯХ,
ли, служит барьером для терапевтических воз
И КЛЕТКИ, ОБМЕНИВАЮЩИЕСЯ ИМИ,
действий и может влиять на пластичность опухо
ДОЛЖНЫ НАХОДИТЬСЯ В БЛИЗКОМ
левых клеток, например, на переходы от РСК к
КОНТАКТЕ, ВОЗМОЖНО, ОБРАЗУЯ
не РСК состояниям [15, 26, 42, 49-51]. Микро
СИНАПСОПОДОБНЫЕ ЩЕЛИ
окружение опухоли формирует ее экологиче
скую нишу, которая играет важнейшую роль как
Несмотря на широко обсуждаемую важность
в развитии первичной опухоли, так и в ее мета
стромальной ниши в жизни опухоли, только
стазировании [37, 38, 52-56]. Мы рассматривали
очень немногие данные надежно подтверждают
эти проблемы в недавнем обзоре [57].
ее функции на молекулярном уровне, а также на
БИОХИМИЯ том 84 вып. 9 2019
РАКОВЫЙ СТВОЛОВОЙ КОМПЛЕКС
1271
уровне транспорта информации, например, осу
ремоделирования стромы» [71] или «архитекто
ществляется ли этот транспорт паракринно,
рами патогенеза рака» [72]. Было показано, что
аутокринно, или каким либо иным способом [5,
ОАФ по разному влияют на прогрессию опухо
13, 32, 33]. Более детальная информация помо
ли. В частности, они могут вызывать деграда
жет лучше оценить реальную роль ниши в раз
цию внеклеточного матрикса и высвобождение
витии опухолей и выработать рациональные те
множества растворимых факторов, регулиро
рапевтические стратегии с учетом этой инфор
вать метаболизм опухоли, а также способство
мации.
вать пролиферации, миграции и метастазирова
Паракринные сигналы могут передаваться
нию раковых клеток. Последние данные на эту
на расстоянии десятков диаметров клетки [58],
тему представлены в соответствующих обзорах
формируя при этом градиентный профиль сиг
[43, 45, 46, 71, 73, 74].
налов, который в зависимости от концентрации
ОАФ являются гетерогенным «семейством»
может приводить к разным последствиям, вмес
или «группой» клеток, проявляющих мезенхи
то простого «да или нет» бинарного ответа. В то
мально подобные свойства. Считается, что
же время логично предположить, что паракрин
процесс превращения нормальных фиброблас
ный контакт более эффективен, когда он скон
тов в ОАФ проходит в три стадии. На первой
центрирован в ограниченном пространстве, как
стадии удаленные клетки рекрутируются злока
это имеет место, в частности, в иммунном си
чественными или пред злокачественными
напсе, т.е. в узком промежутке между тесно взаи
клетками посредством паракринных или эн
модействующими клетками иммунной системы
докринных сигналов. На второй стадии рекру
[69, 70].
тированные клетки превращаются в ОАФ. По
В высказываемой здесь гипотезе мы предпо
следняя стадия - это поддержание, экспансия и
лагаем, что синапсоподобные образования мо
эволюция популяций ОАФ в микроокружении
гут использоваться для контактов между РСК и
благодаря постоянным сигналам от злокачест
другими компонентами стромы. В частности,
венных клеток [75, 76]. В ответ популяции ОАФ
широко признано, что паракринное взаимовлия
производят паракринные сигналы, влияющие
ние раковых клеток и клеток стромы опухоли
на прогрессию рака. Главной причиной образо
приводит к превращению стромальных фибро
вания злокачественного ракового фенотипа
бластов в ОАФ. Для более надежного взаимовлия
ОАФ предположительно является двунаправ
ния взаимодействующим клеткам, возможно,
ленное взаимовлияние раковых клеток и фиб
нужно образовывать синапсоподобные контак
робластов [77, 78]. Отмечалась возможная важ
ты, обеспечивающие эффективный обмен па
ная роль ОАФ в поддержании стволовости РСК
ракринными сигналами. В этих структурах взаи
[79]. Недавние исследования показали, что
модействующие клетки находятся на расстоя
предшественниками ОАФ могут быть не только
нии ~10-15 нм, что точно организует множест
резидентные фибробласты ткани, но и окружаю
во молекул в области межклеточных контактов.
щие ткань адипоциты, мезенхимальные клетки
Мы выдвигаем гипотезу, что в большинстве
и другие клетки [73, 74]. Рекрутированная из
случаев образование синапсоподобных структур
разных мест группа таких предшественников
связано с прямыми межклеточными контакта
приобретает фенотип ОАФ с участием пока
ми. Мы продемонстрируем сущность выдвигае
плохо исследованных сложных процессов акти
мой гипотезы, используя опухоль ассоцииро
вации. Большинство исследователей согласно с
ванные фибробласты, как парадигму ниши
тем, что, независимо от предшественников,
РСК. Современные сведения о ОАФ даны в двух
ОАФ экспрессируют похожие наборы марке
последующих разделах.
ров, таких как альфа актин гладких мышц
(α SMA), белок активации фибробластов
(FAP), а также рецепторы α и β типа фактора
БЕГЛЫЙ ОБЗОР ОПУХОЛЬ-
роста тромбоцитов (PDGFR) [73].
АССОЦИИРОВАННЫХ
Приобретение фенотипа ОАФ часто связы
ФИБРОБЛАСТОВ
вают с изменениями экспрессии некодирующих
РНК и аномальной активацией некоторых сиг
В ряде карцином ОАФ являются одними из
нальных путей. Эти изменения влияют на
наиболее представленных стромальных клеток,
экспрессию многих генов, кодирующих факто
в том числе при раке груди, простаты, пищевода
ры роста, цитокины и другие продукты, что ин
и кишечника [43, 64]. В других карциномах,
тенсифицирует пролиферацию, стимулирует
включая рак яичника, меланомы и почечные
секрецию белков внеклеточного матрикса и раз
опухоли, ОАФ встречаются менее часто [37]. Не
личных факторов роста и вызывает ремоделиро
которые авторы называют их «архитекторами
вание цитоскелета [37, 38, 43, 73, 74, 80].
БИОХИМИЯ том 84 вып. 9 2019
1272
СВЕРДЛОВ, ЧЕРНОВ
ОАФ МОГУТ НАПРЯМУЮ
Также известно, что ОАФ могут циркулиро
ВЗАИМОДЕЙСТВОВАТЬ С РАКОВЫМИ
вать в крови вместе с клетками метастазирую
КЛЕТКАМИ И УСИЛИВАТЬ ИХ
щей карциномы легких мышей, что может спо
ИНВАЗИЮ И МЕТАСТАЗИРОВАНИЕ
собствовать выживаемости и преимущественно
му росту в месте расположения метастаз [71].
ОАФ часто обнаруживаются вблизи или в
Авторы предположили, что раковые и стромаль
прямом контакте с опухолевыми клетками [37,
ные клетки в инвазивных опухолях находятся в
43, 45, 81]. В то же время лишь в немногих
прямом контакте и в процессе развития опухоли
статьях есть экспериментальные свидетельства
устанавливают сложное взаимовлияние.
прямого взаимодействия ОАФ и раковых клеток
В очень важной работе Labernadie et al. [87]
и данные по его функциональным последстви
показали, что ОАФ вызывали совместную инва
ям. Наиболее очевидное и важное последствие
зию посредством гетерофильной адгезии с учас
такого прямого взаимодействия - участие ОАФ
тием N кадгерина на мембранах ОАФ и E кад
в стимуляции эпителиально мезенхимальных
герина на мембранах раковых клеток. Ослабле
переходов (ЭМП) раковых клеток, а также в их
ние этой адгезии лишало ОАФ способности
инвазии и метастазировании [71, 82-87]. Это
направлять совместную миграцию клеток и бло
согласуется с данными, согласно которым со
кировало инвазию раковых клеток. Одновре
вместная миграция клеток типична для много
менно организаторы межклеточных соединений
клеточных организмов и, как считается, физи
нектины и афадин рекрутировались к интер
ческое взаимодействие клеток с участием хими
фейсу раковая клетка/ОАФ. Эти данные пока
ческих сигналов играет основную роль в про
зывают, что механически активная гетерофиль
цессе ЭМП [88]. Gaggioli et al. [82] показали, что
ная адгезия между ОАФ и раковыми клетками
ОАФ направляли инвазию клеток плоскокле
делает возможной кооперативную инвазию опу
точной карциномы (squamous cell carcinoma -
холи.
SCCs), образуя пути во внеклеточном матриксе
Контакты между ОАФ и раковыми клетками
в системе сокультивирования. При совместной
могут образовываться при взаимодействии Eph
инвазии лидировали клетки ОАФ, за которыми
рецептора и соответствующих эфриновых ли
следовали ассоциированные клетки SCC. Из
гандов [89]. Можно предполагать, что эти пря
этого следует, что для инвазии клеток SCC необ
мые контакты образуют синапсоподобные
ходимо либо близкое расположение, либо пря
структуры, усиливающие паракринный обмен
мой контакт с ОАФ. Ряд дополнительных дово
информацией.
дов в пользу этого содержится в обзоре
Yamaguchi и Sakai [86]. Для исследования вкла
дов прямых межклеточных контактов и парак
ОБОБЩАЮЩАЯ ГИПОТЕЗА
ринных сигнальных факторов в метастазирова
ние клеток немелкоклеточного рака легких
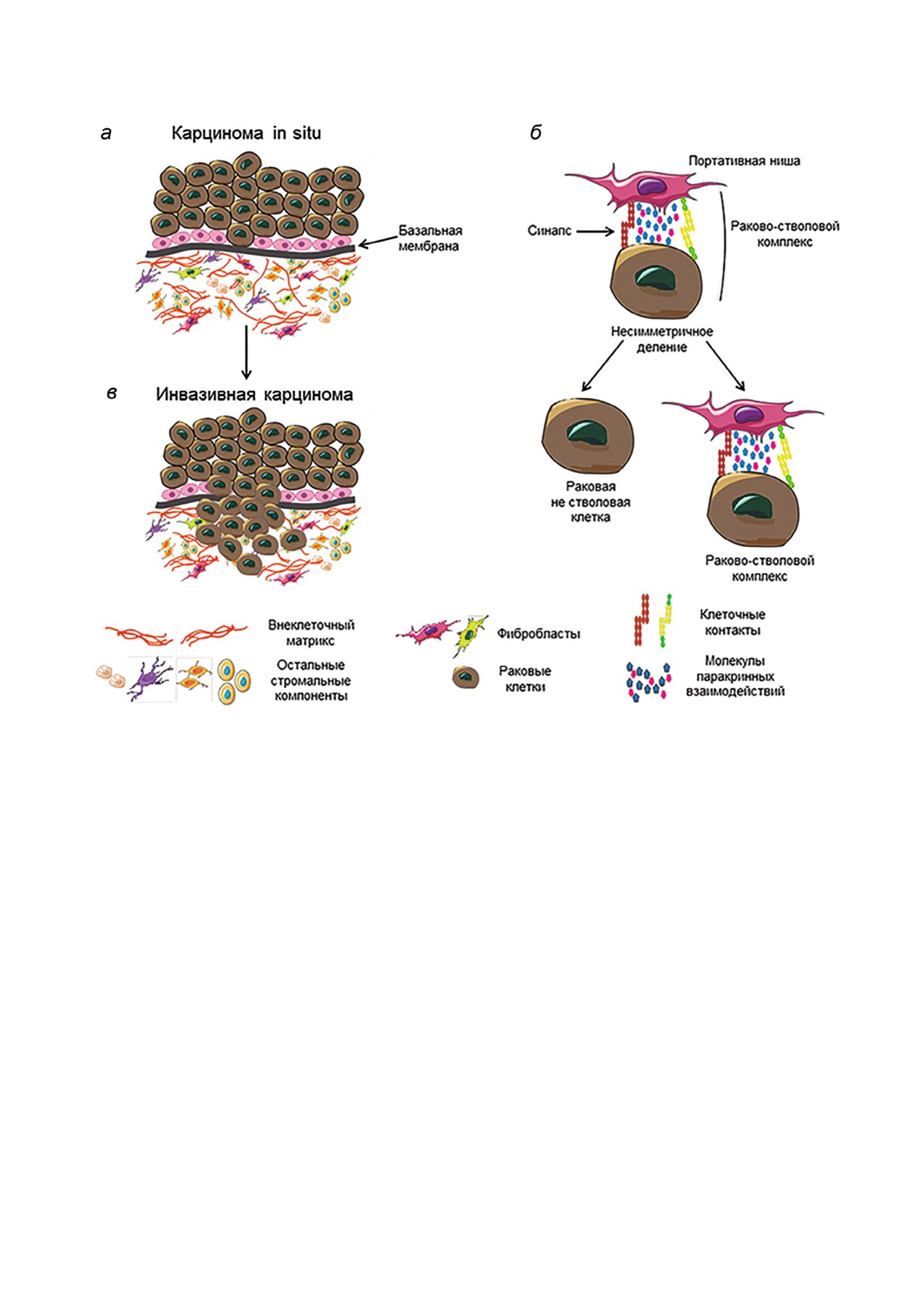
1. В карциноме in situ раковые клетки проли
(non small cell lung carcinoma - NSCLC) Choe et
ферируют и приобретают гетерогенность в соот
al. [84] использовали два варианта сокультиви
ветствии со стохастической (клональной) мо
рования: прямое сокультивирование клеточной
делью эволюции. РСК еще не сформировались
линии NSCLC с первичными культурами ОАФ
[71] (рис. 1, а).
от пациентов с резецированной NSCLC и не
2. При прогрессии рака, после нарушения
прямое сокультивирование с проницаемой
базальной мембраны, раковые клетки достига
мембраной. В этих опытах ОАФ более активно
ют стромы опухоли, сталкиваясь со стромаль
индуцировали ЭМП при прямом сокультивиро
ными компонентами, включая ОАФ, и внекле
вании, указывая на то, что физические контак
точным матриксом (рис. 1, б) [74, 90, 91].
ты между клетками NSCLC и ОАФ могут конт
3. Среди множества стохастических собы
ролировать метастатический потенциал NSCLC.
тий, происходящих при этой судьбоносной
Это не исключает возможности участия парак
встрече, образуются прочные связи между неко
ринного взаимовлияния, усиленного физичес
торыми раковыми и стромальными клетками
ким взаимодействием между клетками, анало
(рис. 1, в). Это приводит к революционному пе
гично иммунным синапсам. В недавнем обзоре
релому в судьбе раковой опухоли: между прочно
Santi et al. [71] есть данные в пользу того, что
связанными клетками образуются синапсопо
прилегающие к раковым областям ОАФ способ
добные контакты. Начинается интенсивный па
ны повышать инвазивность раковых клеток за
ракринный обмен между соединенными рако
счет взаимодействий клетка-клетка и различ
выми и стромальными клетками. Образуется
ных проинвазивных молекул, таких как цитоки
комплекс с возникающим новым свойством -
ны, хемокины и воспалительные медиаторы.
стволовостью. Мы будем называть его раковым
БИОХИМИЯ том 84 вып. 9 2019
РАКОВЫЙ СТВОЛОВОЙ КОМПЛЕКС
1273
Рис. 1. Формирование раково стволового комплекса (РСКом) и его асимметричное деление. а - Карцинома in situ. Рако
вые клетки отделены от стромальных базальной мембраной. Раковых стволовых клеток нет. б - Инвазивная карцинома.
Раковые клетки прорывают базальную мембрану и встречаются со стромальными клетками. Внеклеточный матрикс де
градирует. в - В ряде случаев раковые клетки образуют прочные межклеточные связи и формируют синапсоподобный
контакт, через который начинается интенсивный паракринный обмен между раковыми и стромальными клетками. Обра
зуется РСКом, способный к асимметричному делению, в результате которого одна раковая клетка остается связанной со
стромальным элементом и продолжает паракринный обмен с ним, тогда как другая отщепляется и становится дифферен
цируемой раковой клеткой. РСКом образует новую сложную систему со вновь возникающими свойствами, в частности,
стволовостью и повышенной резистентностью к внешним, в частности терапевтическим, воздействиям. Последнее воз
никает, вероятно, за счет объединения защитных систем входящих в комплекс компонентов. В состав РСКом могут вхо
дить несколько стромальных клеток. В РСКом раково ассоциированный фибробласт(ы) играет роль портативной (пере
носной) ниши для раковой клетки. Ниша передвигается с РСК на всем протяжении существования, включая метастази
рование
стволовым комплексом - РСКом. Стромальная
собность клеток, прочно связанных с другими
часть в этом комплексе играет роль портативной
клетками, делиться, сохраняя прочные связи,
ниши. Предполагаем, что комплекс способен к
демонстрируют эпителиальные клетки [92]. Ра
асимметричному делению (рис. 1, в). При этом,
ковые клетки чаще всего имеют эпителиальное
когда раковая клетка, входящая в состав ком
происхождение. Первоначальные контакты мо
плекса, делится, то одна из дочерних клеток
гут осуществляться с различными клеточными
сохраняет контакт с фибробластной частью
компонентами стромы, но вследствие пара
комплекса и остается стволовой, тогда как дру
кринного обмена может происходить трансдиф
гая отделяется от нее, становясь не стволовой
ференцировка, в результате которой различные
клеткой способной к дифференцировке. Спо
компоненты превращаются в ОАФ [74] (рис. 2).
5 БИОХИМИЯ том 84 вып. 9 2019
1274
СВЕРДЛОВ, ЧЕРНОВ
Рис. 2. Вероятная трансдифференцировка различных стромальных клеточных компонентов в раково ассоциированные
фибробласты, происходящая в результате интенсивного паракринного обмена между связанными раковыми и стромаль
ными клетками в РСКом
В состав комплекса может входить большее чис
обмена химическими сигналами на больших
ло компонентов.
расстояниях. Такие сигнальные отростки позво
4. Существует множество способов образо
ляют доставлять сигналы в двух направлениях,
вания прочных связей между клетками [93, 94].
от отправителя к получателю и наоборот. Эти
В 1977 г. был идентифицирован первый белок
новые открытия позволяют расширить понима
клеточной адгезии позвоночных, N CAM, и в
ние контакт зависимых клеточных коммуника
1981 г. - кадгерины. С тех пор список игроков,
ций [97-101].
вовлеченных в распознавание и адгезию клеток,
5. Клетки РСКом образуют единую систему с
пополнился суперсемейством кадгеринов,
усиленным межклеточным обменом информа
включающем классические, атипичные и про
цией, который придает гибкость, обусловлен
токадгерины, нектины, молекулы клеточной ад
ную как регуляторным аппаратом РСК, так и
гезии (cellular adhesion molecule - САМ) кон
аппаратом фибробластов. Это типичная слож
нексины, лектины, сигнальные комплексы
ная система [47]. Вследствие взаимодействия
Notch/Delta и eph/Ephrin [89, 93]. К этому мож
появляются свойственные сложным системам
но еще добавить десмосомы [95]. Возможно, что
неожиданно возникающие особенности «emer
эти прямые контакты образуют синапсоподоб
gent properties». Создается сверхчувствительная
ные структуры, усиливающие межклеточный
устойчивая система, каждый компонент кото
паракринный обмен информацией. Эта богатая
рой сохраняет определенную степень автоном
палитра белков адгезии может использоваться
ности, например, способность к эпителиально
для создания радикально различных эффектов
мезенхимальному переходу. Адгезивные ком
при контакте клеток, от отталкивания до адге
плексы функционально интегрируют внеклеточ
зии и всех промежуточных состояний. В допол
ное микроокружение с внутренней частью клет
нение к этому в последние годы появилось мно
ки. Сигнальный механизм, связанный с адге
жество публикаций, посвященных новым типам
зивными комплексами, регулирует разнообраз
межклеточных контактов. Один из них исполь
ные клеточные функции, которые влияют почти
зует туннельные нанотрубки (ТНТ). Как следует
на все биологические процессы [102]. РСКом
из названия, ТНТ представляют собой крошеч
обладает повышенной резистентностью, свя
ные туннели, которые связывают две (или бо
занной с объединением защитных систем, вхо
лее) клетки и позволяют транспортировать ши
дящих в него компонентов путем паракринного
рокий спектр продуктов между ними, включая
обмена. Это микрорезистентность на клеточном
ионы, вирусы и целые органеллы [96]. Другой
уровне.
способ контактирования осуществляется через
6. Стволовая клетка в составе комплекса со
клеточные выросты, филоподии (filopodia,
храняет способность к асимметричному самооб
cytonemes), которые используются клетками для
новлению. При ее делении одна клетка остается
БИОХИМИЯ том 84 вып. 9 2019
РАКОВЫЙ СТВОЛОВОЙ КОМПЛЕКС
1275
связанной с портативной нишей, стволовость
равновесию система, в которой может работать
комплекса сохраняется. От связанной клетки
принцип Ле Шателье-Брауна - «если на систе
отщепляется несвязанная, способная к диффе
му, находящуюся в равновесии, воздействовать
ренцировке.
извне, изменяя какое либо из условий равнове
7. Несмотря на прочность, связи между клет
сия, то в системе усиливаются процессы, на
ками нековалентны и подвержены стохастиче
правленные в сторону противодействия измене
ской диссоциации (рис. 3). При этом РСКом
ниям». В биологии принцип Ле Шателье ис
распадается, образуя не стволовую дифферен
пользуют под термином гомеостаз [29]. Это
цируемую раковую клетку. Независимо от этого,
обеспечивает повышенную резистентность опу
другая дифференцированная раковая клетка так
холи на уровне популяции клеток - макроре
же стохастически может образовать комплекс с
зистентность, что, в частности, относится и к
другой стромальной клеткой, начать интенсив
терапевтическим агентам. Вышесказанное объ
ный паракринный обмен информацией и обра
ясняет широко обсуждаемую пластичность
зовать новый стволовой комплекс. Процесс раз
РСК.
рушения образования стволовых комплексов
8. Портативная ниша путешествует с рако
постоянно идет в популяции раковых и стро
вой клеткой в процессе метастазирования в со
мальных клеток. Создается приближенная к
ставе РСКом.
Рис 3. Пластичность РСКом. РСКом с определенной частотой стохастически разрушается, образуя дифференцируемую
раковую клетку и фибробласт. Паракринный обмен прекращается. В тоже время частично дифференцированная раковая
клетка способна образовать прочный комплекс с другим стромальным элементом, начать интенсивный паракринный об
мен, трансдифференцировать стромальный элемент в раково ассоциированный фибробласт и образовать РСКом. В опу
холи образуется подобие равновесия и действует принцип Ле Шателье
БИОХИМИЯ том 84 вып. 9 2019
5*
1276
СВЕРДЛОВ, ЧЕРНОВ
Некоторым подтверждением высказанной
нированными на поверхности раковых и стро
гипотезы может служить недавняя статья Su et
мальных клеток, и (ii) паракринные коммуника
al. [103], авторы показали, что фракция ОАФ,
ции между раковыми (обычно эпителиальны
характеризуемая наличием маркеров клеточной
ми) клетками и различными стромальными
поверхности CD10 и GPR77, способствует обра
клетками [57].
зованию опухоли и химиорезистентности, пред
Иммунотерапия контрольных точек пока
положительно предоставляя нишу для РСК. В
зывает, что наиболее эффективный способ раз
их экспериментах обработка антителами против
рушения раковой системы - это прямое воз
GPR77 уменьшала образование опухолей и вос
действие на бинарные контакты между лиган
станавливала чувствительность к химиотерапии
дами и их рецепторами, экспонированными на
на клеточных и животных моделях рака легкого
поверхности антигенпредставляющих клеток
и молочной железы.
(АПК), а также раковых и стромальных иммун
ных клеток. Благодаря своей доступности и
участию в важных сигнальных путях, часто на
РАКОВЫЙ СТВОЛОВОЙ КОМПЛЕКС,
рушенных при раке [105], поверхностные белки
КАК ПОТЕНЦИАЛЬНАЯ
клеток являются привлекательной мишенью
ТЕРАПЕВТИЧЕСКАЯ МИШЕНЬ
для терапии. Взаимодействие рецептора с ли
гандом относительно несложно, и его можно
Статья Kaiser [104], опубликованная в начале
описать простыми кинетическими уравнения
2015 г. в журнале «Science», посвящена проблеме
ми. Рецепторы и лиганды могут иметь разные
существования и значимости раковых стволо
формы, но их пары всегда хорошо согласованы,
вых клеток для эволюции и терапии рака. Автор
так что рецептор узнает всего один или не
ссылается на авторитет Robert A. Weinberg, круп
сколько специфических лигандов, а лиганд из
нейшего ученого в области онкологии. Weinberg
бирательно связывается всего с одним или не
и другие исследователи настаивают, что раковые
сколькими рецепторами. Именно это позволяет
опухоли содержат небольшой процент раковых
парам рецептор-лиганд поддаваться лечению
стволовых клеток, которые лежат в основе само
лекарственными средствами, а также делает их
обновления тканей. Они верят, что эти клетки
особенно полезными клиническими мишенями
играют роль семян рака, подпитывающих и вос
[106]. Помимо этого, клетки, взаимодействую
станавливающих опухоль, что они устойчивы к
щие в межклеточных контактах, сближены до
химиотерапии и после лечения возникают снова
расстояний, сравнимых с длиной комплексов
через месяцы или годы. Если бы можно было
рецептор-лиганд, обычно составляющей 15-
специфически воздействовать на эти клетки, то
40 нм [107]. Поэтому ингибирование рецепто
болезнь можно было бы если не победить, то
ров может также приводить к ингибированию
взять под контроль.
паракринного взаимовлияния.
Но проблемы сложны. В отличие от тради
Эти рассуждения выливаются в концепцию
ционной химиотерапии, лекарства, направлен
терапевтически перспективного множества
ные против раковых стволовых клеток, которые
прямых межклеточных взаимодействий - анти
составляют небольшой процент от общей массы
тезис молекулярной таргетной терапии, мише
опухоли, не будут быстро уменьшать размеры
нями которой служат сложные внутриклеточ
опухоли, а в химиотерапии это один из критери
ные интерактомы. Как и в любой сложной си
ев успешности. Но строгого анализа, позволяю
стеме [47], фенотипические последствия такого
щего оценивать количество РСК, не существует,
молекулярного таргетирования непредсказуе
и, следовательно, определение эффективности
мы. Иммунная терапия контрольных точек -
терапевтического воздействия весьма пробле
яркий пример успеха концепции использова
матично. Клинические испытания, которые
ния прямых межклеточных взаимодействий
проводятся с агентами против РСК, находятся
[108].
на слишком ранних стадиях, чтобы судить об ус
С целью разрушения прямых контактов
пехе.
ОАФ с раковыми клетками Yamaguchi et al. [86] в
Наша концепция позволяет подойти к про
попытке найти ингибиторы прямого взаимо
блеме такой терапии с другой точки зрения. Не
действия между ОАФ и раковыми клетками об
раковые или стромальные клетки как таковые,
наружили, что ингибитор Src тирозинкиназ да
но скорее их взаимодействия с образованием
затиниб эффективно блокирует физическую
РСКом приводят к эволюции опухоли как орга
связь между ОАФ и клетками скиррозной кар
ноподобного образования. Эти взаимодействия
циномы желудка (Scirrhous gastric cancer - SGC)
включают: (i) непосредственные бинарные кон
с очень небольшим цитотоксическим эффек
такты между лигандами и рецепторами, экспо
том. Дазатиниб также эффективно действовал
БИОХИМИЯ том 84 вып. 9 2019
РАКОВЫЙ СТВОЛОВОЙ КОМПЛЕКС
1277
против перитонеальной диссеминации SGC на
образование РСКом в качестве перспективной
мышиной модели. Важно отметить, что соглас
мишени разрушения рака [86].
но гистологическому анализу метастазирующих
опухолей, ассоциированных с фибробластами
стромы, было меньше в мышах, обработанных
Финансирование. Исследование выполнено
дазатинибом, чем в контроле. Эти результаты
при поддержке Российского научного фонда
впервые показали, что прямое взаимодействие
(проект № 19 15 00317).
между раковыми клетками и ассоциированны
Конфликт интересов. Авторы заявляют, что у
ми фибробластами, вероятно образующими
них нет конфликта интересов.
РСКом, может быть мишенью для антиметаста
Соблюдение этических норм. Настоящая
тической терапии [86]. Мы надеемся, что буду
статья не содержит описания выполненных ав
щие исследования подтвердят правильность вы
торами исследований с участием людей или ис
бора компонентов контактов, отвечающих за
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Greaves, M., and Maley, C.C. (2012) Clonal evolution in
14.
Kusoglu, A., and Biray Avci, C. (2019) Cancer stem cells:
cancer, Nature, 481, 306-313, doi: 10.1038/nature10762.
a brief review of the current status, Gene, 681, 80-85,
2.
Marusyk, A., and Polyak, K. (2013) Cancer cell pheno
doi: 10.1016/j.gene.2018.09.052.
types, in fifty shades of grey, Science, 339, 528-529,
15.
Bocci, F., Gearhart Serna, L., Boareto, M., Ribeiro, M.,
doi: 10.1126/science.1234415.
Ben Jacob, E., Devi, G.R., Levine, H., Onuchic, J.N.,
3.
O’Connor, M.L., Xiang, D., Shigdar, S., Macdonald, J.,
and Jolly, M.K. (2019) Toward understanding cancer stem
Li, Y., Wang, T., Pu, C., Wang, Z., Qiao, L., and Duan, W.
cell heterogeneity in the tumor microenvironment, Proc.
(2014) Cancer stem cells: a contentious hypothesis now
Natl. Acad. Sci. USA, 116, 148-157, doi: 10.1073/
moving forward, Cancer Lett., 344, 180-187, doi: 10.1016/
pnas.1815345116.
j.canlet.2013.11.012.
16.
Ayob, A.Z., and Ramasamy, T.S. (2018) Cancer stem cells
4.
Kreso, A., and Dick, J.E. (2014) Evolution of the cancer
as key drivers of tumour progression, J. Biomed. Sci., 25,
stem cell model, Cell Stem Cell,
14,
275-291,
20, doi: 10.1186/s12929 018 0426 4.
doi: 10.1016/j.stem.2014.02.006.
17.
Alguacil Nunez, C., Ferrer Ortiz, I., Garcia Verdu, E.,
5.
Valent, P., Bonnet, D., De Maria, R., Lapidot, T.,
Lopez Pirez, P., Llorente Cortijo, I.M., and Sainz, B.Jr.
Copland, M., Melo, J.V., Chomienne, C., Ishikawa, F.,
(2018) Current perspectives on the crosstalk between lung
Schuringa, J.J., Stassi, G., Huntly, B., Herrmann, H.,
cancer stem cells and cancer associated fibroblasts, Crit.
Soulier, J., Roesch, A., Schuurhuis, G.J., Wohrer, S.,
Rev. Oncol. Hematol., 125, 102-110, doi: 10.1016/
Arock, M., Zuber, J., Cerny Reiterer, S., Johnsen, H.E.,
j.critrevonc.2018.02.015.
Andreeff M, and Eaves C. (2012) Cancer stem cell defini
18.
Peitzsch, C., Tyutyunnykova, A., Pantel, K., and
tions and terminology: the devil is in the details, Nat. Rev.
Dubrovska, A. (2017) Cancer stem cells: The root of tumor
Cancer, 12, 767-775, doi: 10.1038/nrc3368.
recurrence and metastases, Semin. Cancer Biol., 44, 10-24,
6.
Maenhaut, C., Dumont, J.E., Roger, P.P., and van
doi: 10.1016/j.semcancer.2017.02.011.
Staveren, W.C. (2010) Cancer stem cells: a reality, a myth,
19.
Vinogradova, T.V., Chernov, I.P., Monastyrskaya, G.S.,
a fuzzy concept or a misnomer? An analysis,
Kondratyeva, L.G., and Sverdlov, E.D. (2015) Cancer stem
Carcinogenesis, 31, 149-158, doi: 10.1093/carcin/bgp259.
sells: plasticity works against therapy, Acta Naturae, 7, 46-55.
7.
Afify, S.M., and Seno, M. (2019) Conversion of stem cells
20.
Aponte, P.M., and Caicedo, A. (2017) Stemness in cancer:
to cancer stem cells: undercurrent of cancer initiation,
stem cells, cancer stem cells, and their microenvironment,
Cancers (Basel), 11, 345, doi: 10.3390/cancers11030345.
Stem Cells Int., 2017, 5619472, doi: 10.1155/2017/5619472.
8.
Teng, Y.D., Wang, L., Kabatas, S., Ulrich, H., and
21.
Luo, J., Zhou, X., and Yakisich, J.S. (2014) Stemness and
Zafonte, R.D. (2018) Cancer stem cells or tumor survival
plasticity of lung cancer cells: paving the road for better
cells? Stem Cells Dev., 27, 1466-1478, doi: 10.1089/
therapy, Onco. Targets Ther.,
7,
1129-1134,
scd.2018.0129.
doi: 10.2147/OTT.S62345.
9.
Laplane, L., and Solary, E. (2019) Towards a classification
22.
Shackleton, M., Quintana, E., Fearon, E.R., and
of stem cells, Elife, 8, e46563, doi: 10.7554/eLife.46563.
Morrison, S.J. (2009) Heterogeneity in cancer: cancer
10.
Hermann, P.C., and Sainz, B.Jr. (2018) Pancreatic cancer
stem cells versus clonal evolution, Cell, 138, 822-829,
stem cells: a state or an entity? Semin. Cancer Biol., 53,
doi: 10.1016/j.cell.2009.08.017.
223-231, doi: 10.1016/j.semcancer.2018.08.007.
23.
La Porta, C.A.M., and Zapperi, S. (2017) Complexity in
11.
Najafi, M., Farhood, B., and Mortezaee, K. (2019) Cancer
cancer stem cells and tumor evolution: toward precision
stem cells (CSCs) in cancer progression and therapy,
medicine, Semin. Cancer Biol., 44, 3-9, doi: 10.1016/
J. Cell. Physiol., 234, 8381-8395, doi: 10.1002/jcp.27740.
j.semcancer.2017.02.007.
12.
Prager, B.C., Xie, Q., Bao, S., and Rich, J.N. (2019)
24.
Batlle, E., and Clevers, H. (2017) Cancer stem cells revis
Cancer stem cells: the architects of the tumor eco
ited, Nat. Med., 23, 1124-1134, doi: 10.1038/nm.4409.
system, Cell Stem Cell, 24, 41-53, doi: 10.1016/j.stem.
25.
Xie, X., Teknos, T.N., and Pan, Q. (2014) Are all cancer
2018.12.009.
stem cells created equal? Stem Cells Transl. Med., 3,
13.
Melzer, C., von der Ohe, J., Lehnert, H., Ungefroren, H.,
1111-1115, doi: 10.5966/sctm.2014 0085.
and Hass, R. (2017) Cancer stem cell niche models and
26.
Cabrera, M.C., Hollingsworth, R.E., and Hurt, E.M.
contribution by mesenchymal stroma/stem cells, Mol.
(2015) Cancer stem cell plasticity and tumor hierarchy,
Cancer, 16, 28, doi: 10.1186/s12943 017 0595 x.
World J. Stem Cells, 7, 27-36, doi: 10.4252/wjsc.v7.i1.27.
БИОХИМИЯ том 84 вып. 9 2019
1278
СВЕРДЛОВ, ЧЕРНОВ
27.
Li, Y., and Laterra, J. (2012) Cancer stem cells: distinct
46.
Valkenburg, K.C., de Groot, A.E., and Pienta, K.J. (2018)
entities or dynamically regulated phenotypes? Cancer Res.,
Targeting the tumour stroma to improve cancer therapy,
72, 576-580, doi: 10.1158/0008 5472.CAN 11 3070.
Nat. Rev. Clin. Oncol., 15, 366-381, doi: 10.1038/s41571
28.
Chaffer, C.L., and Weinberg, R.A. (2015) How does multi
018 0007 1.
step tumorigenesis really proceed? Cancer Discov., 5,
47.
Sverdlov, E.D. (2016) Multidimensional complexity of can
22-24, doi: 10.1158/2159 8290.CD 14 0788.
cer. Simple solutions are needed, Biochemistry (Moscow),
29.
Vermeulen, L., and Snippert, H.J. (2014) Stem cell
81, 731-738, doi: 10.1134/S0006297916070099.
dynamics in homeostasis and cancer of the intestine, Nat.
48.
Ramamonjisoa, N., and Ackerstaff, E. (2017) Characteri
Rev. Cancer, 14, 468-480, doi: 10.1038/nrc3744.
zation of the tumor microenvironment and tumor stroma
30.
Pennings, S., Liu, K.J., and Qian, H. (2018) The stem cell
interaction by non invasive preclinical imaging, Front.
niche: interactions between stem cells and their environ
Oncol., 7, 3, doi: 10.3389/fonc.2017.00003.
ment, Stem Cells Int., 2018, 4879379, doi: 10.1155/2018/
49.
Melzer, C., von der Ohe, J., and Hass, R. (2018) Concise
4879379.
review: crosstalk of mesenchymal stroma/stem like cells
31.
White, A.C., and Lowry, W.E. (2015) Refining the role for
with cancer cells provides therapeutic potential, Stem Cells,
adult stem cells as cancer cells of origin, Trends Cell Biol.,
36, 951-968, doi: 10.1002/stem.2829.
25, 11-20, doi: 10.1016/j.tcb.2014.08.008.
50.
Lou, E., Zhai, E., Sarkari, A., Desir, S., Wong, P., Iizuka, Y.,
32.
Plaks, V., Kong, N., and Werb, Z. (2015) The cancer stem
Yang, J., Subramanian, S., McCarthy, J., Bazzaro, M., and
cell niche: how essential is the niche in regulating stemness
Steer, C.J. (2018) Cellular and molecular networking with
of tumor cells? Cell Stem Cell,
16,
225-238,
in the ecosystem of cancer cell communication via tunnel
doi: 10.1016/j.stem.2015.02.015.
ing nanotubes, Front. Cell Dev. Biol., 6, 95, doi: 10.3389/
33.
Ye, J., Wu, D., Wu, P., Chen, Z., and Huang, J. (2014) The
fcell.2018.00095.
cancer stem cell niche: cross talk between cancer stem cells
51.
Wu, J.S., Sheng, S.R., Liang, X.H., and Tang, Y.L. (2017)
and their microenvironment, Tumour Biol.,
35,
The role of tumor microenvironment in collective tumor
3945-3951, doi: 10.1007/s13277 013 1561 x.
cell invasion, Future Oncol., 13, 991-1002, doi: 10.2217/
34.
Scadden, D.T. (2014) Nice neighborhood: emerging con
fon 2016 0501.
cepts of the stem cell niche, Cell,
157,
41-50,
52.
Chen, F., Zhuang, X., Lin, L., Yu, P., Wang, Y., Shi, Y.,
doi: 10.1016/j.cell.2014.02.013.
Hu, G., and Sun, Y. (2015) New horizons in tumor
35.
Borovski, T., De Sousa, E.M.F., Vermeulen, L., and
microenvironment biology: challenges and opportunities,
Medema, J.P. (2011) Cancer stem cell niche: the place to
BMC Med., 13, 45, doi: 10.1186/s12916 015 0278 7.
be, Cancer Res.,
71,
634-639, doi:
10.1158/0008
53.
Gandellini, P., Andriani, F., Merlino, G., D’Aiuto, F.,
5472.CAN 10 3220.
Roz, L., and Callari, M. (2015) Complexity in the tumour
36.
microenvironment: cancer associated fibroblast gene
publications/dictionaries/cancer terms/def/tumor
expression patterns identify both common and unique fea
microenvironment?redirect=true).
tures of tumour stroma crosstalk across cancer types,
37.
Gascard, P., and Tlsty, T.D. (2016) Carcinoma associated
Semin. Cancer Biol.,
35,
96-106, doi:
10.1016/
fibroblasts: orchestrating the composition of malignancy,
j.semcancer.2015.08.008.
Genes Dev., 30, 1002-1019, doi: 10.1101/gad.279737.116.
54.
Stadler, M., Walter, S., Walzl, A., Kramer, N., Unger, C.,
38.
Hanahan, D., and Coussens, L.M. (2012) Accessories to
Scherzer, M., Unterleuthner, D., Hengstschlager, M.,
the crime: functions of cells recruited to the tumor
Krupitza, G., and Dolznig, H. (2015) Increased complexity in
microenvironment, Cancer Cell, 21, 309-322, doi: 10.1016/
carcinomas: analyzing and modeling the interaction of human
j.ccr.2012.02.022.
cancer cells with their microenvironment, Semin. Cancer
39.
Reina Campos, M., Moscat, J., and Diaz Meco, M.
Biol., 35, 107-124, doi: 10.1016/j.semcancer.2015.08.007.
(2017) Metabolism shapes the tumor microenvironment,
55.
Zi, F., He, J., He, D., Li, Y., Yang, L., and Cai, Z. (2015)
Curr. Opin. Cell Biol., 48, 47-53, doi: 10.1016j.ceb.
Fibroblast activation protein alpha in tumor microenviron
2017.05.006.
ment: recent progression and implications (review), Mol.
40.
Bhome, R., Al Saihati, H.A., Goh, R.W., Bullock, M.D.,
Med. Rep., 11, 3203-3211, doi: 10.3892/mmr.2015.3197.
Primrose, J.N., Thomas, G.J., Sayan, A.E., and
56.
Raffaghello, L., and Dazzi, F. (2015) Classification and
Mirnezami, A.H. (2016) Translational aspects in targeting
biology of tumour associated stromal cells, Immunol. Lett.,
the stromal tumour microenvironment: from bench to bed
168, 175-182, doi: 10.1016/j.imlet.2015.06.016.
side, New Horiz. Transl. Med., 3, 9-21, doi: 10.1016/
57.
Sverdlov, E. (2018) Missed druggable cancer hallmark:
j.nhtm.2016.03.001.
cancer-stroma symbiotic crosstalk as paradigm and
41.
Bhome, R., Bullock, M.D., Al Saihati, H.A., Goh, R.W.,
hypothesis for cancer therapy, Bioessays, 40, e1800079,
Primrose, J.N., Sayan, A.E., and Mirnezami, A.H. (2015)
doi: 10.1002/bies.201800079.
A top down view of the tumor microenvironment: struc
58.
Perrimon, N., Pitsouli, C., and Shilo, B.Z.
(2012)
ture, cells and signaling, Front. Cell Dev. Biol., 3, 33,
Signaling mechanisms controlling cell fate and embryonic
doi: 10.3389/fcell.2015.00033.
patterning, Cold Spring Harb. Perspect. Biol., 4, a005975,
42.
Bhome, R., Mellone, M., Emo, K., Thomas, G.J., Sayan, A.E.,
doi: 10.1101/cshperspect.a005975.
and Mirnezami, A.H. (2018) The colorectal cancer
59.
Bizzarri, M., and Cucina, A. (2014) Tumor and the
microenvironment: strategies for studying the role of can
microenvironment: a chance to reframe the paradigm of
cer associated fibroblasts, Methods Mol. Biol., 1765,
carcinogenesis? Biomed Res. Int.,
2014,
934038,
87-98, doi: 10.1007/978 1 4939 7765 9_6.
doi: 10.1155/2014/934038.
43.
Kalluri, R. (2016) The biology and function of fibroblasts
60.
Guo, F., Wang, Y., Liu, J., Mok, S.C., Xue, F., and Zhang, W.
in cancer, Nat. Rev. Cancer, 16, 582-598, doi: 10.1038/
(2016) CXCL12/CXCR4: a symbiotic bridge linking can
nrc.2016.73.
cer cells and their stromal neighbors in oncogenic commu
44.
Kalluri, R., and Zeisberg, M. (2006) Fibroblasts in cancer,
nication
networks,
Oncogene,
35,
816-826,
Nat. Rev. Cancer, 6, 392-401, doi: 10.1038/nrc1877.
doi: 10.1038/onc.2015.139.
45.
LeBleu, V.S., and Kalluri, R. (2018) A peek into cancer associ
61.
Takakura, N. (2012) Formation and regulation of the can
ated fibroblasts: origins, functions and translational impact, Dis.
cer stem cell niche, Cancer Sci.,
103
1177-1181,
Model. Mech., 11, dmm029447, doi: 10.1242/dmm.029447.
doi: 10.1111/j.1349 7006.2012.02270.x.
БИОХИМИЯ том 84 вып. 9 2019
РАКОВЫЙ СТВОЛОВОЙ КОМПЛЕКС
1279
62.
Kise, K., Kinugasa Katayama, Y., and Takakura, N. (2016)
78.
Tao, L., Huang, G., Song, H., Chen, Y., and Chen, L.
Tumor microenvironment for cancer stem cells, Adv. Drug
(2017) Cancer associated fibroblasts: an essential role in
Deliv. Rev., 99, 197-205, doi: 10.1016/j.addr.2015.08.005.
the tumor microenvironment, Oncol. Lett., 14, 2611-2620,
63.
Park, T.S., Donnenberg, V.S., Donnenberg, A.D.,
doi: 10.3892/ol.2017.6497.
Zambidis, E.T., and Zimmerlin, L. (2014) Dynamic inter
79.
Bu, L., Baba, H., Yoshida, N., Miyake, K., Yasuda, T.,
actions between cancer stem cells and their stromal part
Uchihara, T., Tan, P., and Ishimoto, T. (2019) Biological
ners, Curr. Pathobiol. Rep., 2, 41-52, doi: 10.1007/s40139
heterogeneity and versatility of cancer associated fibro
013 0036 5.
blasts in the tumor microenvironment, Oncogene,
64.
Alvarez Teijeiro, S., Garcia Inclan, C., Villaronga, M.A.,
doi: 10.1038/s41388 019 0765 y.
Casado, P., Hermida Prado, F., Granda Diaz, R.,
80.
Du, H., and Che, G. (2017) Genetic alterations and epige
Rodrigo, J.P., Calvo, F., Del Rio Ibisate, N., Gandarillas, A.,
netic alterations of cancer associated fibroblasts, Oncol.
Moris, F., Hermsen, M., Cutillas, P., and Garcia Pedrero, J.M.
Lett., 13, 3-12, doi: 10.3892/ol.2016.5451.
(2018) Factors secreted by cancer associated fibroblasts
81.
Belli, C., Trapani, D., Viale, G., D’Amico, P., Duso, B.A.,
that sustain cancer stem properties in head and neck squa
Della Vigna, P., Orsi, F., and Curigliano, G.
(2018)
mous carcinoma cells as potential therapeutic targets,
Targeting the microenvironment in solid tumors, Cancer
Cancers (Basel), 10, 334, doi: 10.3390/cancers10090334.
Treat. Rev., 65, 22-32, doi: 10.1016/j.ctrv.2018.02.004.
65.
Xiong, S., Wang, R., Chen, Q., Luo, J., Wang, J., Zhao, Z.,
82.
Gaggioli, C., Hooper, S., Hidalgo Carcedo, C., Grosse, R.,
Li, Y., Wang, Y., Wang, X., and Cheng, B. (2018) Cancer
Marshall, J.F., Harrington, K., and Sahai, E.
(2007)
associated fibroblasts promote stem cell like properties of
Fibroblast led collective invasion of carcinoma cells with
hepatocellular carcinoma cells through IL 6/STAT3/
differing roles for RhoGTPases in leading and following
Notch signaling, Am. J. Cancer Res., 8, 302-316.
cells, Nat. Cell Biol., 9, 1392-1400, doi: 10.1038/ncb1658.
66.
Ghiabi, P., Jiang, J., Pasquier, J., Maleki, M., Abu Kaoud, N.,
83.
Semba, S., Kodama, Y., Ohnuma, K., Mizuuchi, E.,
Rafii, S., and Rafii, A. (2014) Endothelial cells provide a
Masuda, R., Yashiro, M., Hirakawa, K., and Yokozaki, H.
notch dependent pro tumoral niche for enhancing breast
(2009) Direct cancer stromal interaction increases fibro
cancer survival, stemness and pro metastatic properties,
blast proliferation and enhances invasive properties of scir
PLoS One,
9, e112424, doi:
10.1371/journal.pone.
rhous type gastric carcinoma cells, Br. J. Cancer, 101,
0112424.
1365-1373, doi: 10.1038/sj.bjc.6605309.
67.
Saltarella, I., Lamanuzzi, A., Reale, A., Vacca, A., and
84.
Choe, C., Shin, Y.S., Kim, S.H., Jeon, M.J., Choi, S.J.,
Ria, R. (2015) Identify multiple myeloma stem cells:
Lee, J., and Kim, J. (2013) Tumor stromal interactions
utopia? World J. Stem Cells, 7, 84-95, doi: 10.4252/
with direct cell contacts enhance motility of non small cell
wjsc.v7.i1.84.
lung cancer cells through the hedgehog signaling pathway,
68.
Weiland, A., Roswall, P., Hatzihristidis, T.C., Pietras, K.,
Anticancer Res., 33, 3715-3723.
Ostman, A., and Strell, C. (2012) Fibroblast dependent
85.
He, X.J., Tao, H.Q., Hu, Z.M., Ma, Y.Y., Xu, J., Wang, H.J.,
regulation of the stem cell properties of cancer cells,
Xia, Y.J., Li, L., Fei, B.Y., Li, Y.Q., and Chen, J.Z. (2014)
Neoplasma, 59, 719-727, doi: 10.4149/neo_2012_091.
Expression of galectin 1 in carcinoma associated fibro
69.
Xie, J., Tato, C.M., and Davis, M.M. (2013) How the
blasts promotes gastric cancer cell invasion through upreg
immune system talks to itself: the varied role of synapses,
ulation of integrin beta1, Cancer Sci., 105, 1402-1410,
Immunol. Rev., 251, 65-79, doi: 10.1111/imr.12017.
doi: 10.1111/cas.12539.
70.
Terry, S., Savagner, P., Ortiz Cuaran, S., Mahjoubi, L.,
86.
Yamaguchi, H., and Sakai, R. (2015) Direct interaction
Saintigny, P., Thiery, J.P., and Chouaib, S. (2017) New
between carcinoma cells and cancer associated fibroblasts
insights into the role of EMT in tumor immune escape,
for the regulation of cancer invasion, Cancers (Basel), 7,
Mol. Oncol., 11, 824-846, doi: 10.1002/1878 0261.12093.
2054-2062, doi: 10.3390/cancers7040876.
71.
Santi, A., Kugeratski, F. G., and Zanivan, S.
(2018)
87.
Labernadie, A., Kato, T., Brugues, A., Serra Picamal, X.,
Cancer associated fibroblasts: the architects of stroma
Derzsi, S., Arwert, E., Weston, A., Gonzalez Tarrago, V.,
remodeling, Proteomics, 18, e1700167, doi: 10.1002/pmic.
Elosegui Artola, A., Albertazzi, L., Alcaraz, J., Roca
201700167.
Cusachs, P., Sahai, E., and Trepat, X. (2017) A mechani
72.
Marsh, T., Pietras, K., and McAllister, S.S.
(2013)
cally active heterotypic E cadherin/N cadherin adhesion
Fibroblasts as architects of cancer pathogenesis, Biochim.
enables fibroblasts to drive cancer cell invasion, Nat. Cell
Biophys. Acta, 1832, 1070-1078, doi: 10.1016/j.bbadis.
Biol., 19, 224-237, doi: 10.1038/ncb3478.
2012.10.013.
88.
Theveneau, E., and Linker, C. (2017) Leaders in collective
73.
Liao, Z., Tan, Z. W., Zhu, P., and Tan, N.S. (2018)
migration: are front cells really endowed with a particular
Cancer associated fibroblasts in tumor microenvironment -
set of skills? F1000Res,
6,
1899, doi:
10.12688/
accomplices in tumor malignancy, Cell. Immunol.,
f1000research.11889.1.
30222-30228, doi: 10.1016/j.cellimm.2017.12.003.
89.
Wang, B. (2011) Cancer cells exploit the Eph-ephrin sys
74.
Ziani, L., Chouaib, S., and Thiery, J. (2018) Alteration of
tem to promote invasion and metastasis: tales of unwitting
the antitumor immune response by cancer associated
partners, Sci. Signaling, 4, pe28, doi: 10.1126/scisignal.
fibroblasts, Front. Immunol., 9, 414, doi: 10.3389/fimmu.
2002153.
2018.00414.
90.
Attieh, Y., Clark, A.G., Grass, C., Richon, S., Pocard, M.,
75.
De Wever, O., Van Bockstal, M., Mareel, M., Hendrix, A.,
Mariani, P., Elkhatib, N., Betz, T., Gurchenkov, B., and
and Bracke, M. (2014) Carcinoma associated fibroblasts
Vignjevic, D.M. (2017) Cancer associated fibroblasts lead
provide operational flexibility in metastasis, Semin. Cancer
tumor invasion through integrin beta3 dependent
Biol., 25, 33-46, doi: 10.1016/j.semcancer.2013.12.009.
fibronectin assembly, J. Cell Biol., 216, 3509-3520,
76.
Heneberg, P. (2016) Paracrine tumor signaling induces
doi: 10.1083/jcb.201702033.
transdifferentiation of surrounding fibroblasts, Crit. Rev.
91.
Karagiannis, G.S., Poutahidis, T., Erdman, S.E., Kirsch, R.,
Oncol. Hematol., 97, 303-311, doi: 10.1016/j.critrevonc.
Riddell, R.H., and Diamandis, E.P. (2012) Cancer associ
2015.09.008.
ated fibroblasts drive the progression of metastasis through
77.
Augsten, M. (2014) Cancer associated fibroblasts as
both paracrine and mechanical pressure on cancer tissue,
another polarized cell type of the tumor microenviron
Mol. Cancer Res., 10, 1403-1418, doi: 10.1158/1541
ment, Front. Oncol., 4, 62, doi: 10.3389/fonc.2014.00062.
7786.MCR 12 0307.
БИОХИМИЯ том 84 вып. 9 2019
1280
СВЕРДЛОВ, ЧЕРНОВ
92. Le Bras, S., and Le Borgne, R. (2014) Epithelial cell divi
101. Caviglia, S., and Ober, E.A. (2018) Non conventional pro
sion - multiplying without losing touch, J. Cell Sci., 127,
trusions: the diversity of cell interactions at short and long
5127-5137, doi: 10.1242/jcs.151472.
distance, Curr. Opin. Cell Biol.,
54,
106-113,
93. Cohen, D.J., and Nelson, W.J. (2018) Secret handshakes:
doi: 10.1016/j.ceb.2018.05.013.
cell-cell interactions and cellular mimics, Curr. Opin. Cell
102. Humphries, J.D., Paul, N.R., Humphries, M.J., and
Biol., 50, 14-19, doi: 10.1016/j.ceb.2018.01.001.
Morgan, M.R. (2015) Emerging properties of adhesion
94. Serge, A. (2016) The molecular architecture of cell adhe
complexes: what are they and what do they do? Trends Cell
sion: dynamic remodeling revealed by videonanoscopy,
Biol., 25, 388-397, doi: 10.1016/j.tcb.2015.02.008.
Front. Cell Dev. Biol., 4, 36, doi: 10.3389/fcell.2016.00036.
103. Su, S., Chen, J., Yao, H., Liu, J., Yu, S., Lao, L., Wang, M.,
95. Price, A.J., Cost, A.L., Ungewiss, H., Waschke, J.,
Luo, M., Xing, Y., Chen, F., Huang, D., Zhao, J., Yang, L.,
Dunn, A.R., and Grashoff, C. (2018) Mechanical loading
Liao, D., Su, F., Li, M., Liu, Q., and Song, E. (2018)
of desmosomes depends on the magnitude and orientation
CD10(+)GPR77(+) Cancer associated fibroblasts pro
of external stress, Nat. Commun., 9, 5284, doi: 10.1038/
mote cancer formation and chemoresistance by sustaining
s41467 018 07523 0.
cancer stemness, Cell, 172, 841-856 e816, doi: 10.1016/
96. Sahu, P., Jena, S.R., and Samanta, L. (2018) Tunneling
j.cell.2018.01.009.
nanotubes: a versatile target for cancer therapy, Curr.
104. Kaiser, J. (2015) The cancer stem cell gamble, Science,
Cancer Drug Targets,
18,
514-521, doi:
10.2174/
347, 226-229, doi: 10.1126/science.347.6219.226.
1568009618666171129222637.
105. Kuhlmann, L., Cummins, E., Samudio, I., and Kislinger, T.
97. Jacquemet, G., Hamidi, H., and Ivaska, J.
(2015)
(2018) Cell surface proteomics for the identification of
Filopodia in cell adhesion, 3D migration and cancer cell
novel therapeutic targets in cancer, Expert Rev. Proteomics,
invasion, Curr. Opin. Cell Biol., 36, 23-31, doi: 10.1016/
15, 259-275, doi: 10.1080/14789450.2018.1429924.
j.ceb.2015.06.007.
106. Kim, J.W., and Cochran, J.R. (2017) Targeting ligand
98. Kornberg, T.B. (2017) Distributing signaling proteins in
receptor interactions for development of cancer therapeu
space and time: the province of cytonemes, Curr. Opin.
tics, Curr. Opin. Chem. Biol., 38, 62-69, doi: 10.1016/
Genet. Dev., 45, 22-27, doi: 10.1016/j.gde.2017.02.010.
j.cbpa.2017.03.010.
99. Mattes, B., and Scholpp, S. (2018) Emerging role of con
107. Weikl, T., Asfaw, M., Krobath, H., Rozycki, B., and
tact mediated cell communication in tissue development
Lipowsky, R. (2009) Adhesion of membranes via recep
and diseases, Histochem. Cell Biol.,
150,
431-442,
tor-ligand complexes: domain formation, binding cooper
doi: 10.1007/s00418 018 1732 3.
ativity, and active processes, Soft Matter, 5, 3213-3224,
100. Fairchild, C.L., and Barna, M. (2014) Specialized filopo
doi: 10.1039/b902017A.
dia: at the “tip” of morphogen transport and vertebrate tis
108. Cogdill, A.P., Andrews, M.C., and Wargo, J.A. (2017)
sue patterning, Curr. Opin. Genet. Dev., 27, 67-73,
Hallmarks of response to immune checkpoint blockade,
doi: 10.1016/j.gde.2014.03.013.
Br. J. Cancer, 117, 1-7, doi: 10.1038/bjc.2017.136.
CANCER STEM COMPLEX, NOT A CANCER STEM CELL,
IS THE DRIVER OF CANCER EVOLUTION
E. D. Sverdlov1,2 and I. P. Chernov2*
1 Institute of Molecular Genetics, Russian Academy of Sciences, 123182 Moscow, Russia
2 Shemyakin-Ovchinnikov Institute of Bioorganic Chemistry, Russian Academy of Sciences,
117997 Moscow, Russia; E*mail: igor.palich@gmail.com
Received April 29, 2019
Revised May 30, 2019
Accepted June 1, 2019
A hypothesis is put forward on the mechanism of cancer stem cells functioning providing that they exist. The hypoth
esis is based on the following postulates: 1. Paracrine exchange between cancer and stromal cells is efficient only pro
vided that they are in close contact and form a synapse like intercellular space for intercellular crosstalk, where the
concentration of paracrine signal molecules is high due to a small volume of the synaptic cleft. 2. Cancer stem cells per
se do not exist. Instead, there are cancer stem complexes formed by cancer cells which are strongly bound to stromal
cells (portable niches) and are in paracrine exchange with them. 3. A cancer stem complex is a complex system with
newly arising properties, such as stemness and resistance to external impacts, including therapeutic interventions.
4. Stemness reveals itself in the ability of the cancer cell within the complex to divide asymmetrically: one cell remains
in the complex forming a renewed stem complex, whereas the other cell gets detached from the complex forming a dif
ferentiating non stem cell. 5. Enhanced resistance of cancer stem complexes is due to the integration of its intrinsic
defense systems through a paracrine exchange. This is microresistance at the cell level. 6. A stem complex can stochas
tically decay forming a non stem cancer cell. Partly differentiated non stem cancer cells are able to stochastically bind
to a stromal component, dedifferentiate due to paracrine signals and form new cancer stem complexes. Thus, a tumor
is a flexible system in a near equilibrium state. Such systems comply with Le Chatelier’s principle (homeostasis): an
equilibrium system under external impacts activates the processes antagonistic to changes. This provides an enhanced
resistance of the tumor at the level of cell population, i.e., macroresistance. 7. A portable niche travels with a cancer
cell in metastasis. We propose a general therapeutic strategy directed at the contacts between cancer and stromal cells.
The disruption of these contacts should lead to the destruction of cancer stem complexes and elimination of tumors.
Keywords: tumorigenesis, metastasis, differentiation and dedifferentiation, stemness, stem cell niche, self renewal,
synapse, paracrine crosstalk
БИОХИМИЯ том 84 вып. 9 2019