БИОХИМИЯ, 2019, том 84, вып. 9, с. 1359 - 1368
УДК 577.355.2
СПЕКТРАЛЬНЫЕ И ФОТОХИМИЧЕСКИЕ СВОЙСТВА ПЛЕНОК
РЕАКЦИОННОГО ЦЕНТРА Rhodobacter sphaeroides R 26
В УСЛОВИЯХ ВАКУУМА
© 2019
А.А. Забелин*, В.А. Шкуропатова, В.А. Шувалов, А.Я. Шкуропатов
Институт фундаментальных проблем биологии РАН,
ФИЦ «Пущинский научный центр биологических исследований» РАН,
142290 Пущино, Московская обл., Россия; электронная почта: zabelin.bio@gmail.com
Поступила в редакцию 03.04.2019
После доработки 05.06.2019
Принята к публикации 05.06.2019
Методами абсорбционной спектроскопии в видимой/ближней ИК и средней ИК областях исследованы
спектральные и фотохимические свойства изолированных реакционных центров (РЦ) из Rhodobacter
sphaeroides R 26 в сухих пленках на поверхности неорганических подложек (кварц или CaF2) в условиях ва
куумной дегидратации (10-2 или 7⋅10-5 мм. рт. ст.). Три детергента, N,N диметилдодециламино N оксид
(ЛДАО), Triton Х 100 (ТХ100) и n додецил β D мальтозид (ДМ) тестировались в отношении их способнос
ти стабилизировать РЦ-детергент комплексы в вакуум сухом состоянии. Показано, что в присутствии
ЛДАО РЦ-комплексы подвергаются разрушению в вакууме. Напротив, ДМ обеспечивает среду, позволяю
щую минимизировать необратимые деструктивные изменения в РЦ в условиях вакуума. Эффекты вакуум
ной дегидратации пленок РЦ-ДМ включали в себя небольшое увеличение содержания α спиралей в белке
РЦ, коротковолновый обратимый сдвиг оптических переходов пигментов и минорные изменения в элект
ронной структуре димера P+. Пленки сохраняли фотохимическую активность при возбуждении светом вы
сокой интенсивности (200 мВт/см2). ТХ100 также способствует поддержанию спектральных и функцио
нальных свойств РЦ в вакууме, однако, в этом случае стабилизирующий эффект выражен в меньшей степе
ни, чем в присутствии ДМ, особенно при высоких концентрациях детергента. Результаты обсуждаются в
рамках модели, предполагающей, что при вакуумной дегидратации РЦ-комплексов взаимодействие детер
гент-белок и свойства мицелл детергента играют доминирующую роль в поддержании структуры РЦ. По
лученные данные могут быть полезными при разработке гибридных фотопреобразующих систем, содержа
щих бактериальные РЦ.
КЛЮЧЕВЫЕ СЛОВА: реакционный центр, абсорбционная спектроскопия, вакуумная дегидратация, де
тергент, мицеллы, Rhodobacter sphaeroides R 26.
DOI: 10.1134/S0320972519090136
Фотохимические реакционные центры (РЦ)
реноса электрона [1]. РЦ пурпурной бактерии
фотосинтезирующих бактерий - интегральные
Rhodobacter (Rba.) sphaeroides содержат три бел
мембранные пигмент-белковые комплексы,
ковые субъединицы (L, M и H), две из которых
осуществляющие в природных условиях функ
(L и M) связывают кофакторы, образующие две
цию преобразования энергии световых квантов
квази симметричные ветви переноса электрона
в электрохимическую энергию разделенных за
[2, 3] (часто обозначаемые A и B). Кофакторные
рядов посредством серии быстрых реакций пе
ветви делят между собой димер экситонно
сопряженных молекул бактериохлорофилла
(БХл), служащий первичным донором электро
Принятые сокращения: ΔA - изменение поглоще
ния; БХл - бактериохлорофилл; BA и BB
- мономерные на (P), и далее каждая из них включает в себя
молекулы БХл в A и B ветвях соответственно; БФео - бак
молекулу мономерного БХл (BA или BB), моле
териофеофитин; HA и HB - молекулы БФео в A и B ветвях
соответственно; ДМ - n додецил β D мальтозид; ИК
кулу бактериофеофитина (БФео) (HA или HB) и
Фурье спектроскопия - инфракрасная спектроскопия с
молекулу убихинона (QA или QB). Только ветвь А
Фурье преобразованием; ЛДАО - N,N диметилдодецил
активна в первичном разделении зарядов [1].
амино N оксид; P - первичный донор электрона, димер Рентгенографические исследования выявили,
молекул БХл; PA и PB - молекулы БХл, составляющие P;
что кристаллы РЦ содержат также большое ко
РЦ - реакционный центр; ТХ100 - Triton Х 100; QA - пер
вичный хинонный акцептор; QB - вторичный хинонный
личество связанных молекул воды, некоторые
акцептор; Rba. - Rhodobacter.
из которых играют функциональную роль [3, 4].
* Адресат для корреспонденции.
Бактериальные РЦ, как природные наноразмер
1359
1360
ЗАБЕЛИН и др.
ные энергопреобразующие структуры, характе
бране с отсекаемой массой 30 кДа («Millipore»,
ризуются предельно высоким (практически
США) в ячейке для ультраконцентрирования
100%) квантовым выходом разделения зарядов,
под давлением газообразного аргона. При необ
достигаемым в результате быстрого (~200 пс)
ходимости образцы концентрировали, исполь
«каскадного» переноса электрона от синглетно
зуя ячейки для ультрафильтрации Ultrafree MC
возбужденного первичного донора электрона P*
с отсекаемой массой 50 кДа («Millipore», США).
к первичному хинонному акцептору QA (через
Получение твердых сухих пленок. В качестве
промежуточные короткоживущие ионные пары
объектов исследования использовали твердые
P+B– и P+H–) с образованием относительно дол
сухие пленки РЦ на поверхности подложек из
гоживущего (~0,1 с) состояния P+Q–. Этот факт
кварца или фторида кальция. Аликвоту суспен
стимулирует разнообразные попытки использо
зии РЦ объемом 3-3,5 мкл (A867 = 45 в кювете с
вания РЦ в качестве фоточувствительного эле
длиной оптического пути 1 см) в 10 мМ Tris HCl
мента в искусственных фотопреобразующих
(pH
8,0), буферном растворе, содержащем
системах [5], включая интегрирование их в твер
0,025% (v/v) ЛДАО или 0,05% (v/v) TX100 или
дотельные фотоэлектронные устройства [6]. Од
0,03% (v/v) ДМ, помещали на кварцевую плас
ной из необходимых предпосылок для создания
тинку (1 × 5 см) для измерения электронных
гибридных устройств такого рода является ста
спектров поглощения в видимой/ближней ИК
билизация структуры РЦ в иммобилизованном
областях или на пластинку из CaF2 (19 мм в ди
состоянии [6-8]. В частности, при изготовле
аметре) для ИК Фурье измерений. Суспензию
нии твердотельных устройств на основе РЦ важ
высушивали в токе аргона до образования твер
ной задачей является максимальное сохранение
дого состояния («воздушно сухая» пленка). Мо
структуры и функциональной активности РЦ
лярное отношение (детергент/РЦ), n, рассчиты
при помещении их в вакуум, который представ
вали по формуле (C0⋅CРЦ + Cdet.)/CРЦ, где C0 - мо
ляет собой неприродную, эффективно гидро
лярная связывающая способность детергента
фобную среду, потенциально склонную к нару
(моль/моль); CРЦ - концентрация РЦ (моль/л);
шению нативной структуры белков [9-11].
Cdet. - концентрация добавленного детергента
В настоящее время один из распространен
(моль/л). Значения C0 для комплексов РЦ Rba.
ных подходов к стабилизации изолированных
sphaeroides с ЛДАО, TX100 и ДМ были получены
мембранных белков [12, 13], включая их пере
ранее [15]. Для того чтобы получить воздушно
нос из раствора в вакуум при масс спектромет
сухие пленки с более высокими значениями n,
рическом анализе [10, 11], основан на использо
небольшое количество 10 мМ Tris-HCl (pH 8,0)
вании подходящего детергента. Однако, резуль
буферного раствора, содержащего
3% (v/v)
таты систематических исследований влияния
ЛДАО, 3% (w/v) TX100 или 3% (w/v) ДМ добав
детергентов на стабильность РЦ в агрегирован
ляли к суспензии РЦ перед ее высушиванием на
ном состоянии в вакууме в литературе, по види
подложке. Вакуум сухие пленки получали вы
мому, отсутствуют.
держиванием воздушно сухих пленок в вакууме
Цель данной работы - исследование метода
(10-2 или 7⋅10-5 мм. рт. ст.) в течение 2-3 ч перед
ми оптической спектроскопии роли детергентов
оптическими измерениями и далее в течение
в поддержании структуры и функциональной
всего эксперимента. Гидратированные пленки
активности изолированных РЦ пурпурной бак
(только для ИК Фурье измерений) получали
терии Rba. sphaeroides R 26 в дегидратированных
аналогично тому, как описано выше для воздуш
пленках на поверхности твердых неорганичес
но сухих пленок, однако, суспензия РЦ-детер
ких подложек в условиях вакуума.
гент на пластинке из CaF2 лишь слегка подсу
шивалась в токе аргона, и полученный пастооб
разный образец накрывался другой пластинкой
МЕТОДЫ ИССЛЕДОВАНИЯ
из CaF2, образуя вакуум плотную ячейку.
Электронные спектры поглощения. Электрон
Выделение бактериальных РЦ. РЦ Rhodobacter
ные спектры поглощения в видимом и ближ
sphaeroides R 26 были выделены при обработке
нем ИК диапазонах (450-1000 нм) записывали
мембран детергентом N,N диметилдодецилами
на спектрофотометрах Shimadzu UV1800
но N оксидом (ЛДАО) с последующей очист
(«Shimadzu», Япония) или Agilent
8530
кой методом ионообменной хроматографии на
(«Agilent», США). Кварцевую пластину с нане
колонках с ДЭАЭ целлюлозой [14]. Очищенные
сенной пленкой РЦ помещали под углом 45° от
препараты содержали ~50% функционально ак
носительно измерительного и возбуждающего
тивного вторичного хинона QB. Замену ЛДАО
света в кварцевую кювету, которая являлась
на детергенты Triton Х 100 (TХ100) или n доде
частью герметичной ячейки, подключенной к
цил β D мальтозид (ДМ) проводили на мем
вакуумной линии (10-2 или 7·10-5 мм. рт. ст.).
БИОХИМИЯ том 84 вып. 9 2019
РЕАКЦИОННЫЕ ЦЕНТРЫ В ВАКУУМНЫХ УСЛОВИЯХ
1361
Фотоиндуцированные дифференциальные (свет
минус темнота) электронные спектры P+Q-/PQ
в области 650-1000 нм были получены с исполь
зованием спектрофотометра Agilent 8530 путем
вычитания спектров поглощения, измеренных в
темноте, из спектров, измеренных при освеще
нии образцов в течение 7 с постоянным действу
ющим светом (340-600 нм; 200 мВт/см2).
ИК Фурье спектроскопия. ИК Фурье спект
ры поглощения и фотоиндуцированные диффе
ренциальные ИК Фурье спектры записывали
на инфракрасном Фурье спектрометре IFS66v/s
(«Bruker», Германия) с детектором MCT
(D313/6) и светоделителем из KBr. Спектраль
ное разрешение составляло 2 или 4 см-1. Образ
цы помещались в держателе оптического крио
стата («Specac», Великобритания), который мог
быть подсоединен к вакуумной линии (10-2 мм.
рт. ст.). В случае воздушно сухих пленок предва
рительно записанный ИК спектр поглощения
водяного пара в криостате вычитали из ИК
спектра поглощения РЦ для минимизации
вклада узких колебательно вращательных пи
ков воды в области 1700-1600 см-1 в полосу
амид I белка. Фотоиндуцированные дифферен
циальные (свет минус темнота) ИК Фурье
спектры P+Q-/PQ измеряли при освещении об
разцов постоянным действующим светом
(720-1100 нм; ~2 мВт/см2) [16]. Циклы освеще
ния повторяли многократно для достижения
приемлемого соотношения сигнал/шум.
Все измерения были выполнены при ком
натной температуре.
Рис.
1.
Электронные спектры поглощения РЦ
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Rba. sphaeroides R 26, измеренные в воздушно сухих (кри
вые 1) и вакуум сухих (102 мм. рт. ст.) пленках (кривые 2),
и в водных буферных растворах (кривые 3), содержащих
Три детергента, ЛДАО, ТХ100 и ДМ, широко
детергенты ЛДАО (а), ТХ100 (б) и ДM (в). Спектры в рас
используемые при выделении и очистке фото
творах нормированы к соответствующим спектрам в воз
синтетических комплексов, тестировали опти
душно сухих пленках в полосе БФео при 760 нм; спектры
ческими методами в отношении их способности
поглощения в вакуум сухих пленках приведены без нор
мировки. Значения на оси ординат на панелях а, б и в от
стабилизировать РЦ-комплексы в вакуум су
носятся к спектрам поглощения РЦ в пленках
хих пленках. Для сравнения измерения были
выполнены также на воздушно сухих и гидрати
рованных пленках.
их критическим концентрациям мицеллообразо
Влияние вакуумной дегидратации на электрон
вания (ККМ): 0,025% для ЛДАО, 0,05% для
ные спектры поглощения РЦ-детергент комплек
ТХ100 и 0,03% для ДМ, что соответствовало ве
сов. Рис. 1 показывает электронные спектры пог
личинам молярного отношения (детергент/РЦ)
лощения РЦ Rba. sphaeroides R 26, измеренные в
n, равным 291, 106 и 150 соответственно.
области 450-1000 нм, в воздушно сухих (кривые 1)
Из рис. 1 видно, что электронные спектры
и в полученных из них вакуум сухих (кривые 2)
поглощения РЦ в растворах c различными де
пленках, содержащих детергенты ЛДАО (а),
тергентами (кривые 3) практически не отлича
ТХ100 (б) и ДМ (в). Для сравнения кривые 3
лись друг от друга, хорошо соответствуя спект
представляют аналогичные спектры поглощения
рам известным в литературе. Однако высушива
РЦ в буферных детергентных растворах, из кото
ние тех же образцов РЦ на воздухе и затем в ва
рых были приготовлены пленки. Детергенты бы
кууме приводило к заметным изменениям
ли использованы при концентрациях, близких к
спектров.
БИОХИМИЯ том 84 вып. 9 2019
1362
ЗАБЕЛИН и др.
Абсорбционные изменения, сопровождаю
гом Qy полосы P (до 847 нм) в спектрах вакуум
щие образование воздушно сухих пленок (кри
сухих пленок РЦ-ДM наблюдали также обрати
вые 1), были близки, хотя и не идентичны, для
мые коротковолновые сдвиги всех остальных Qx
трех использованных детергентов. Удаление в
и Qy полос РЦ на 2-4 нм, а Qy полоса поглоще
этом случае жидкой и, вероятно, слабосвязан
ния молекул BA/B, локализованная в вакуум су
ной воды сопровождалось спектральными эф
хих пленках при 798 нм, показывала увеличение
фектами, связанными, в основном, с димером P,
интенсивности по отношению к воздушно су
наиболее отчетливыми из которых являлись не
хим пленкам (рис. 1 в, кривые 2) [17]. Все опи
большое уменьшение интенсивности и корот
санные спектральные эффекты наблюдали так
коволновый сдвиг длинноволновой Qy полосы
же для пленок РЦ-ДМ, дегидратированных в
P от 866 нм в растворе до 851, 853 и 861 нм в
вакууме 7⋅10-5 мм. рт. ст. (данные не показаны).
пленках с ЛДАО, TX100 и ДМ соответственно.
Таким образом, удаление прочносвязанных мо
Ранее коротковолновый сдвиг полосы поглоще
лекул воды, ожидаемое в условиях вакуума, со
ния Р от ~865 до ~850 нм наблюдали для изоли
провождалось обратимыми изменениями абсо
рованных РЦ из Rba. sphaeroides в различных
рбционных свойств всего гексахромофорного
экспериментальных условиях, включая дегидра
пигментного комплекса РЦ. Аналогичные дан
тацию РЦ в пленках [17, 18]. Высушивание РЦ
ные были получены для вакуум сухой пленки
на воздухе (рис. 1, кривые 1) сопровождалось
РЦ-ТХ100 (рис. 1, б, кривая 2), однако, экспе
также небольшим уменьшением интенсивности
римент с перерастворением пленки выявил не
Qy полосы поглощения мономерных молекул
большие изменения спектров поглощения,
БХл BA/B при 802 нм. Значительно менее выра
близкие по характеру к изменениям, описан
женное влияние высушивание оказывало на Qy
ным выше для пленок РЦ-ЛДАО, и указываю
и Qx переходы молекул БФео (при ~760 и ~540
щие на разрушение небольшой доли (~5%)
нм соответственно), а также на Qx переходы всех
РЦ-ТХ100 комплексов (не показано).
четырех молекул БХл (~600 нм).
Различие в стабилизирующем действии ДМ
Более интенсивная последующая дегидрата
и ТХ100 на РЦ в вакууме (10-2 мм. рт. ст.) более
ция воздушно сухих пленок РЦ в вакууме
отчетливо проявлялось при увеличении концен
(10-2 мм. рт. ст.; кривые 2) приводила к дальней
трации детергентов в образцах выше ККМ и, со
шим изменениям спектров поглощения в види
ответственно, при возрастании молярного отно
мой и ближней ИК областях, причем конеч
шения детергент/РЦ (n). Увеличение n (от 150
ный результат зависел от использованного де
до 220) в пленках РЦ-ДМ сопровождалось за
тергента. В спектре вакуум сухой пленки
метным уменьшением вакуум индуцированно
РЦ-ЛДАО практически не разрешалась длин
го синего сдвига максимума полосы поглоще
новолновая Qy полоса P, наблюдались сильное
ния P (847 нм при n = 150 (рис. 1, в, кривая 2) и
уменьшение поглощения в Qy полосах молекул
852 нм при n = 220 (не показано)). Дальнейшее
BA/B при ~800 нм и увеличение поглощения в об
увеличение n не оказывало существенного влия
ласти 740-780 нм (рис. 1, а, кривая 2), что в со
ния на положение максимума полосы P, кото
вокупности указывает на нарушение структур
рый локализовался при 852-854 нм в диапазоне
ной целостности РЦ и высвобождение значи
значений n от 220-600. Напротив, увеличение n
тельной части молекул БХл и БФео из их натив
(106-470) в пленках РЦ-TX100 приводило к не
ного окружения [19]. Последующий смыв пле
большому дополнительному коротковолновому
нок РЦ-ЛДАО в буферный раствор подтвердил,
сдвигу полосы P (842 нм при n = 106 (рис. 1, б,
что основная часть РЦ необратимо разрушена
кривая 2) и 841 нм при n = 300-470 (не показа
при высушивании в вакууме (не показано).
но)). Более того, при высоких концентрациях
Вакуум индуцированные изменения в
TX100 в спектре поглощения вакуум сухих пле
спектрах поглощения пленок РЦ-ДM были су
нок РЦ-TX100 проявлялись изменения, сход
щественно менее критичными (рис. 1, в, кривая 2)
ные с теми, которые наблюдали в присутствии
и, очевидно, не связаны с необратимыми на
ЛДАО (рис. 1, а, кривая 2), то есть имело место
рушениями структуры РЦ. В подтверждение
значительное (>50%) разрушение структуры РЦ.
этого вывода было найдено, что возвращение
Таким образом, ни один из тестируемых де
вакуум сухих пленок РЦ-ДM в атмосферные
тергентов не позволил получить вакуум сухие
условия восстанавливало спектр поглощения,
пленки РЦ со спектрами поглощения идентич
наблюдаемый для воздушно сухих пленок, а их
ными спектру в растворе, что, очевидно, отра
последующее перерастворение в буферном раст
жает появление локальных изменений в натив
воре давало спектр, характерный для спектра
ных пигмент-пигментных и/или пигмент-бел
исходной суспензии РЦ (не показано). Приме
ковых взаимодействиях в РЦ в твердом состоя
чательно, что наряду с дальнейшим синим сдви
нии. Это может указывать на то, что связанные
БИОХИМИЯ том 84 вып. 9 2019
РЕАКЦИОННЫЕ ЦЕНТРЫ В ВАКУУМНЫХ УСЛОВИЯХ
1363
молекулы воды, присутствующие в РЦ-комп
чение содержания регулярных (преимуществен
лексах [3, 4], играют некоторую структурную
но α спиральных) элементов вторичной струк
роль, и их удаление влияет на свойства РЦ.
туры было обнаружено при дегидратации внут
Вместе с тем для минимизации необратимых
ренне неупорядоченных белков [23, 24]. Пред
деструктивных изменений, вызываемых в РЦ
полагается, что в этом случае дегидратация бел
дегидратацией в вакууме, существенное значе
ка приводит к замене межмолекулярных водо
ние имеет присутствие подходящего детергента.
родных связей между пептидными группами и
Очевидно ДМ представляет среду, наиболее бла
молекулами воды новыми внутрибелковыми во
гоприятную в этом отношении.
дородными связями [24]. Возможно, индуциро
Изменения вторичной структуры белка при ва
ванное дегидратацией образование α спиралей
куумной дегидратации РЦ. Для того чтобы полу
в вакуум сухих пленках РЦ-ДМ могло происхо
чить информацию о влиянии вакуумной дегид
дить внутри H субъединицы белка, которая со
ратации на вторичную структуру белка в плен
держит значительный нерегулярный домен [2]
ках РЦ-ДМ и РЦ-TX100, была использована
со связанными молекулами воды [3].
ИК Фурье спектроскопия в частотной области
В целом, вакуумная дегидратация оказывает,
полосы амид I [20].
по видимому, минорное влияние на вторичную
На примере воздушно сухой пленки
структуру белка в комплексах РЦ-ДМ и
РЦ-ДМ рис. 2, а демонстрирует типичный ИК
РЦ-TX100, однако, небольшое увеличение со
Фурье спектр поглощения РЦ, измеренный в
держания α спирального компонента может
области 1800-1480 см-1, в которой преобладает
вносить дополнительный вклад в способность
полоса амид I с максимумом при 1657 см-1
ДМ стабилизировать белок РЦ в вакуум сухом
(в спектре присутствует также полоса амид II с
максимумом при 1547 см-1). Поскольку полоса
амид I включает в себя несколько перекрываю
щихся пиков, представляющих α спирали,
β листы, повороты и агрегированные и нерегу
лярные структуры [21], для выявления качест
венной картины изменений вторичной структу
ры при вакуумной дегидратации РЦ были полу
чены разностные спектры «вакуум сухая минус
воздушно сухая пленка» (рис. 2, б) для пленок
РЦ, содержащих TX100 (кривая 1) и ДМ (кри
вая 2). Видно, что оба разностных спектра со
держат отрицательную полосу в области
~1630 см-1, что свидетельствует о структурных
изменениях и/или уменьшении количества
β структуры. Положительные сигналы при 1692
и 1674 см-1, по видимому, отражают увеличение
количества поворотов и/или антипараллельных
β структур [21]. Согласно рентгеноструктурным
данным [2, 3], β структурные компоненты рас
положены преимущественно в цитоплазмати
ческой и периплазматической областях РЦ, ко
торые находятся в контакте с молекулами воды.
Возможно, эффект, который вакуумная дегид
ратация оказывает на β структуры (рис. 2, б),
связан с частичным удалением этих молекул
воды.
Наиболее интересное отличие между разно
стными спектрами на рис. 2, б состоит в том, что
Рис. 2. а - ИК Фурье спектр поглощения воздушно сухой
вакуумная дегидратация пленок РЦ-ДМ приво
пленки РЦ-ДМ в области полос амид I и амид II. б - Раз
дила к заметному увеличению поглощения при
ностные ИК Фурье спектры «вакуум сухая минус воздуш
1657 см-1 (кривая 2), что свидетельствует об уве
но сухая пленка», полученные для пленок, содержащих
TX100 (n = 106) (1) и ДМ (n = 220) (2). Вакуум сухие плен
личении количества α спиральных структур [21,
ки получены при остаточном давлении 10-2 мм. рт. ст. Для
22]. В случае пленок РЦ-TX100 наблюдался
удобства сравнения разностные спектры нормированы по
лишь слабый отрицательный сигнал в этой об
амплитуде дифференциального сигнала при 1555-1557/
ласти спектра (рис. 2, б, кривая 1). Ранее увели
1507-1509 см-1
БИОХИМИЯ том 84 вып. 9 2019
1364
ЗАБЕЛИН и др.
состоянии, в то время как подобный стабилизи
связанной воды значительно затрудняется [27,
рующий фактор отсутствует в пленках с TX100.
28]. На рис. 3 показаны дифференциальные
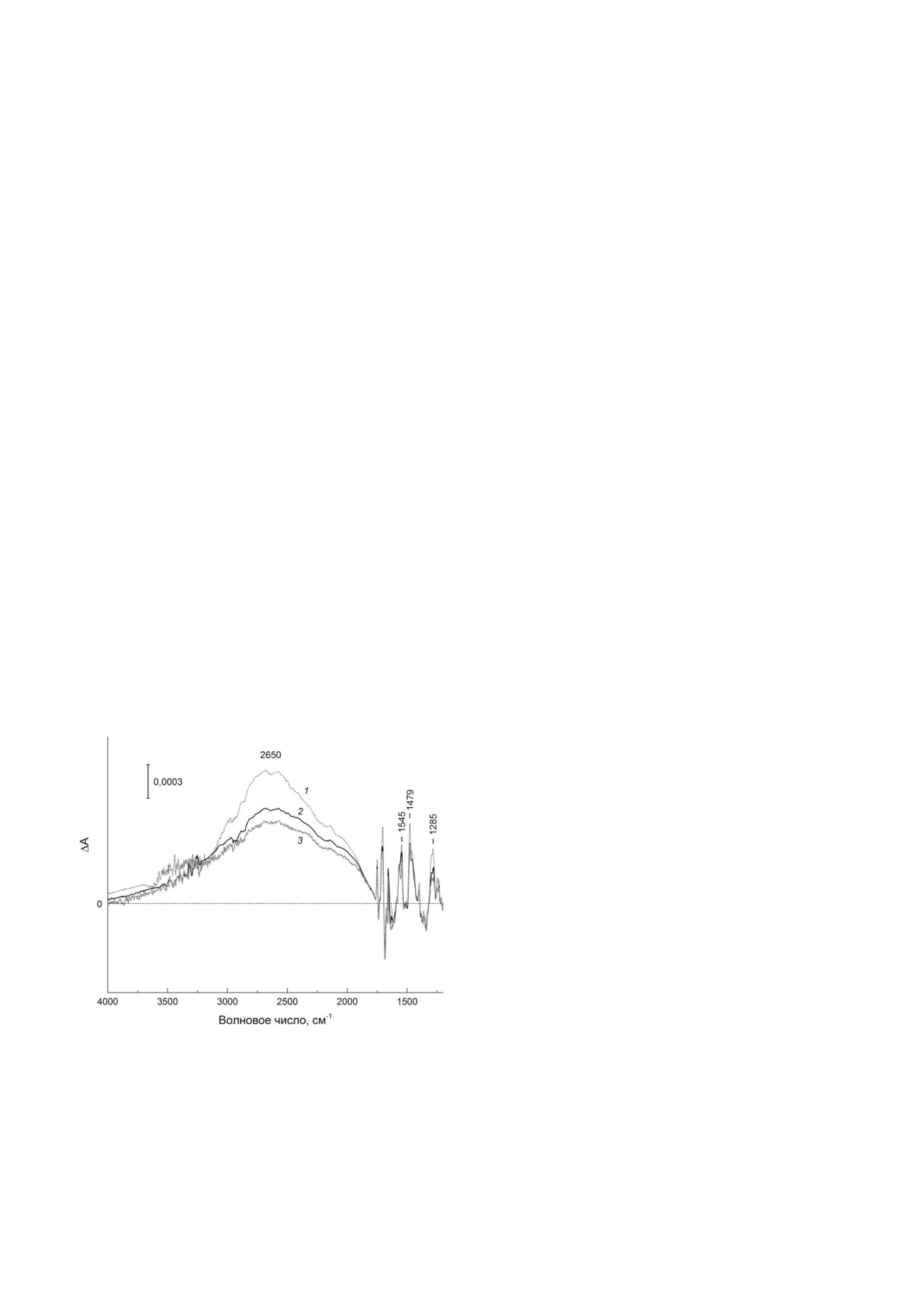
Вакуумная дегидратация РЦ и электронная
«свет минус темнота» ИК Фурье спектры
структура первичного донора электронов. С целью
P+Q–/PQA для вакуум сухих (10-2 мм. рт. ст.)
выяснения влияния вакуумной дегидратации на
пленок РЦ Rba. sphaeroides R 26 в присутствии
электронную структуру окисленного димера P+
TX100 (n = 106) (кривая 3) и ДМ (n = 220) (кри
в составе функционального состояния P+Q- ис
вая 2). Для сравнения показан также ИК спектр
пользовали фотоиндуцированную дифференци
P+Q-/PQ (Q- - смесь анионов Q– и QB-) для
альную ИК Фурье спектроскопию, позволяю
гидратированной пленки РЦ-ДМ (кривая 1).
щую выявлять тонкие изменения, происходя
Все спектры нормированы друг к другу [17] на
щие в структуре и молекулярных взаимодей
количество фотогенерированного P+ по ампли
ствиях кофакторов переноса электрона в ответ
туде дифференциального сигнала 1750/1738 см-1,
на разделение зарядов в РЦ [25].
отнесенного к высокочастотному сдвигу валент
В соответствии с изменениями в электрон
ных колебаний 133 эфирных C=O групп моле
ных спектрах поглощения (рис. 1, а, кривая 3),
кул БХл [29]. Отрицательные и положительные
которые указывают на почти полное разруше
пики в ИК Фурье спектрах соответствуют ис
ние РЦ в вакууме в присутствии ЛДАО, лишь
чезновению нейтральных форм P и Q и появле
остаточный фотоиндуцированный ИК Фурье
нию ион радикальных форм P+ и Q- соответ
сигнал P+Q-/PQ был различим для вакуум су
ственно. Отметим, что спектры на рис. 3 отра
хой пленки РЦ-ЛДАО (не показано). Ранее
жают, главным образом, переход P → P+, пос
Morita et al. [26] сообщили об отсутствии фото
кольку интенсивность ИК полос, связанных с
индуцированных ИК изменений в вакуум су
восстановлением хинонных акцепторов, отно
хих
(<10-3
мм. рт. ст.) пленках РЦ
сительно мала [29].
Rba. sphaeroides дикого типа, полученных в отсу
ИК Фурье спектр P+Q-/PQ гидратирован
тствии детергента.
ных пленок РЦ-ДМ (рис. 3, кривая 1) содержит
Напротив, РЦ в пленках с ДМ и TX100 со
широкую полосу низкоэнергетического элект
храняли способность к разделению зарядов в ус
ронного перехода при ~2650 см-1, связанного с
ловиях вакуума, показывая интенсивные фото
переносом положительного заряда (дырки)
индуцированные сигналы в средней ИК облас
внутри димерного катион радикала P+ [30], и
ти спектра, отражающие преимущественно об
три интенсивные полосы при 1545, 1479 и
разование состояния P+QA , поскольку перенос
~1285 см-1, отнесенные колебательным фазо
электрона с Q– на QB в РЦ при удалении прочно
во фононным модам P+ [31]. Нормированный
ИК спектр P+Q-/PQ для гидратированной
пленки РЦ-TX100 был сравним по форме и
амплитуде со спектром, представленным кри
вой 1 (не показано). Полоса переноса дырки и
фазово фононные полосы являются индикато
рами гомодимерной природы катион радикала
P+, и их интенсивность зависит от степени
электронного сопряжения между молекулами
РA и PB в P+ [30, 31]. Сравнение спектров 2 и 3
со спектром 1 (рис. 3) показывает, что высуши
вание пленок РЦ в вакууме не влияет на поло
жение максимумов полосы переноса дырки
при ~2650 см-1 и фазово фононных полос, но
приводит к заметному уменьшению их интен
сивности по сравнению с гидратированной
пленкой, особенно в случае РЦ-TX100 комп
лексов. Это свидетельствует [30, 31] об ослабле
нии электронного сопряжения между молеку
лами БХл в катион радикале Р+ в вакуум сухих
Рис. 3. Сравнение фотоиндуцированных дифференциаль
пленках РЦ, вероятно, более выраженное в
ных «свет минус темнота» ИК Фурье спектров P+Q-/PQ ре
пленках РЦ-TX100.
акционных центров в гидратированной РЦ-ДМ пленке (1)
В частотной области 1760-1620 см-1 ИК
и вакуум сухих (10-2 мм. рт. ст.) пленках, содержащих ДМ
Фурье спектр P+Q-/PQ гидратированной плен
(n = 220) (2) и TX100 (n = 106) (3) в области 4000-1200 см-1.
Спектры нормированы по амплитуде дифференциального
ки РЦ (рис. 4) показывает сигналы, преимуще
сигнала (+)1750/(-)1738 см-1
ственно связанные с высокочастотными сдвига
БИОХИМИЯ том 84 вып. 9 2019
РЕАКЦИОННЫЕ ЦЕНТРЫ В ВАКУУМНЫХ УСЛОВИЯХ
1365
ми карбонильных мод молекул PA и PB при фо
тоокислении P [29]. В спектре вакуум сухой
пленки РЦ-TX100 (кривая 3) наблюдается от
носительное увеличение интенсивности полосы
валентных колебаний 131 кето группы PA+ при
1713 см-1 по сравнению с аналогичной полосой
131 кето группы PB+ при 1704 см-1. Соотноше
ние интенсивностей полос при 1713 и 1704 см-1
в спектре вакуум сухой пленки РЦ-ДМ (кри
вая 2) является промежуточным между соотно
шениями, наблюдаемыми для гидратированной
пленки и вакуум сухой пленки РЦ-TX100.
Недавно Malferrari et al. [18], анализируя
качественно сходные изменения ИК Фурье
спектров P+Q–/PQA, наблюдавшиеся при дегид
ратации пленок РЦ-ЛДАО из Rba. sphaeroides ди
кого типа (штамм 2.4.1.), уравновешенных при
различной относительной влажности, пришли к
выводу, что дегидратация РЦ индуцирует перера
спределение заряда в катион радикале P+ в поль
зу PA+. В рамках этой интерпретации наблюдае
мые нами изменения в ИК спектрах (рис. 3 и 4)
согласуются с предположением о том, что ваку
умное высушивание приводит к более значитель
ным изменениям в электронной структуре диме
ра P+ в пленках РЦ-TX100, чем в пленках
Рис.
4. Область валентных колебаний C=O групп
РЦ-ДМ, вызывая более сильную локализацию
(1800-1600 см-1) дифференциальных ИК Фурье спектров
заряда на одной из половин P+ в случае TX100.
P+Q-/PQ, представленных на рис. 3. Для удобства сравне
Фотохимическая активность РЦ-ДМ комп
ния спектры смещены друг относительно друга по оси ор
лексов в вакуум сухом состоянии. Для того, что
динат
бы качественно сопоставить протекторный эф
фект ДМ с фотохимической активностью РЦ в
уровнем фотохимической активности в вакууме
вакууме, на рис. 5 представлены результаты из
и способны выдерживать возбуждение светом
мерений кинетики абсорбционных изменений
высокой интенсивности (200 мВт/см2) без за
при 850 нм, связанных с фотоокислением P в ва
метных изменений в амплитуде и кинетике фо
куум сухих (7⋅10-5 мм. рт. ст.) пленках РЦ-ДМ
тосигнала.
при стационарном освещении светом видимого
На примере трех различных детергентов мы
диапазона при комнатной температуре. На
показали, что устойчивость изолированных РЦ
вставке (а) показан спектр фотоиндуцирован
из Rba. sphaeroides R 26 к деструктивным эф
ных абсорбционных изменений, измеренный
фектам вакуумного высушивания в большой
для РЦ-ДМ пленок в области Qy переходов пиг
степени зависит от типа и концентрации детер
ментов. Спектр отражает образование состоя
гента, используемого для солюбилизации белка
ния P+Q– [32], включая выцветание длинновол
РЦ и получения пленок. Причины различного
новой полосы поглощения P с максимумом при
поведения в этом отношении ДМ, TX100 и
850 нм и электрохромные сдвиги полос погло
ЛДАО следует, по видимому, искать в особен
щения мономерных молекул БХл и молекул
ностях их взаимодействий с белком РЦ. Соглас
БФео. Световая зависимость фотоиндуцирован
но данным, полученным методом дифракции
ных изменений поглощения вакуум сухой
нейтронов на кристаллах РЦ из пурпурных бак
пленки РЦ при 850 нм, представленная на
терий [33, 34], молекулы детергента образуют
вставке (б), показывает, что насыщение фото
непрерывный мицеллярный пояс вокруг гидро
сигнала наблюдалось при ~200 мВт/см2. Не ме
фобных трансмембранных спиралей белка РЦ.
нее 60% РЦ в пленке сохраняли фотохимичес
Было отмечено, что кристаллы РЦ представля
кую активность в вакууме, исходя из степени
ют собой трехфазную систему, в которой взаи
выцветания полосы P при 850 нм в условиях на
модействия между фазами детергент-белок, де
сыщающего освещения (данные не показаны).
тергент-растворитель, белок-растворитель
Из рис. 5 можно заключить, что пленки
вносят важный вклад в энергию системы [33]. В
РЦ-ДМ характеризуются достаточно высоким
условиях вакуума, когда растворитель (вода) ин
БИОХИМИЯ том 84 вып. 9 2019
1366
ЗАБЕЛИН и др.
Рис. 5. Кинетика фотоиндуцированных изменений поглощения в полосе P при 850 нм. Вставка (а): разностный спектр
«свет минус темнота» в области
700-1000 нм, полученный при стационарном освещении
(340-600 нм;
200 мВт/см2) вакуум сухой (7⋅10-5 мм. рт. ст.) пленки РЦ ДМ (n = 220). Вставка (б): кривая насыщения фотосигнала, по
лученная при стационарном освещении (340-600 нм) в диапазоне интенсивностей 2-300 мВт/см2. Стрелки ↓ и ↑ указы
вают моменты включения и выключения возбуждающего света соответственно
тенсивно удаляется из пленки РЦ, взаимодей
тичной структуры белка [35]. ЛДАО содержит
ствие детергент-белок и свойства мицелл де
сильно полярную аминоксидную группу и по
тергента играют, по видимому, доминирующую
свойствам ближе к алкил ионным, чем к не
роль в поддержании структуры РЦ. Исследова
ионным детергентам [36]. Возможно, необрати
ния влияния детергентов на мембранные белки
мые изменения структуры РЦ в вакууме, наб
в сухих пленках в вакууме в литературе, по ви
людаемые в присутствии ЛДАО, связаны с на
димому, не представлены. Имеются, однако,
рушением структуры мицелл и возникновением
обширные данные, полученные для комплек
ненативных электростатических контактов
сов мембранных белков с различными детер
между молекулами ЛДАО и белком.
гентами в вакууме методами масс спектромет
Как и в случае ДМ, умеренный стабилизиру
рии [10, 11] и молекулярной динамики [35]. Бы
ющий эффект в вакууме при низкой концентра
ло найдено, что мицеллы ДМ обладают хорошо
ции ТХ100, возможно, обусловлен неионной
выраженной способностью поддерживать цело
природой этого детергента. Однако причины
стность мембранных белков в процессе их пере
дестабилизирующего действия ТХ100 при высо
носа из раствора в вакуум масс спектрометра
ких концентрациях остаются неясными. Воз
[10]. Недавние молекулярно динамические
можно, это связано с особенностями мицелло
расчеты показали, что стабилизирующий эф
образования этого детергента. Интересно, что в
фект ДМ на структуру α спирального мембран
отсутствии воды при комнатной температуре
ного белка в вакууме, по видимому, связан с
ТХ100, в отличие от ДМ, не склонен к сегрега
сохранением структуры мицеллы ДМ, харак
ции неполярных и полярных групп и представ
терной для раствора, за счет образования до
ляет собой изотропную жидкость [37].
полнительных водородных связей между остат
Потенциально способность мицелл ДМ
ками мальтозы [35]. В то же время дегидратация
обеспечивать достаточно высокий уровень ста
в вакууме комплексов цвиттерионных детерген
билизации структуры и функциональных
тов с α спиральным мембранным белком при
свойств РЦ, даже в жестких условиях вакуумно
водила к инверсии мицеллы и оголению части
го высушивания, может оказаться полезной при
поверхности белка в вакууме, что сопровожда
разработке искусственных гибридных фотопре
лось заметными изменениями вторичной и тре
образующих систем, содержащих бактериаль
БИОХИМИЯ том 84 вып. 9 2019
РЕАКЦИОННЫЕ ЦЕНТРЫ В ВАКУУМНЫХ УСЛОВИЯХ
1367
ные РЦ. Примечательной в этом отношении
тичной финансовой поддержке Российского
особенностью вакуум сухих пленок РЦ-ДМ яв
фонда фундаментальных исследований (грант
ляется их достаточно высокий уровень фотохи
№ 16 34 00829).
мической активности при освещении постоян
Конфликт интересов. Авторы заявляют об от
ным светом высокой интенсивности (рис. 5).
сутствии конфликта интересов.
Соблюдение этических норм. Настоящая
статья не содержит описания каких либо иссле
Финансирование. Работа выполнена в рамках
дований с использованием людей или животных
госзадания № АААА А17030110140 5 и при час в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Blankenship, R.E. (2014) Molecular mechanisms of photo<
13.
Gall, B., and Scheer, H. (1998) Stabilization of photosys
synthesis, Wiley Blackwell, Chichester.
tem II reaction centers: influence of bile salt detergents and
2.
Allen, J.P., Feher, G., Yeates, T.O., Komiya, H., and Rees, D.C.
low pH, FEBS Lett., 431, 161-166, doi: 10.1016/S0014
(1987) Structure of the reaction center from Rhodobacter
5793(98)00739 X.
sphaeroides R 26: the protein subunits, Proc. Natl. Acad.
14.
Zabelin, A.A., Shkuropatova, V.A., Shuvalov, V.A., and
Sci. USA, 84, 6162-6166, doi: 10.1073/pnas.84.17.6162.
Shkuropatov, A.Ya. (2011) FTIR spectroscopy of the reac
3.
Koepke, J., Krammer, E. M., Klingen, A.R., Sebban, P.,
tion center of Chloroflexus aurantiacus: photoreduction of
Ullmann, G.M., and Fritzsch, G. (2007) pH modulates
the bacteriopheophytin electron acceptor, Biochim.
the quinone position in the photosynthetic reaction center
Biophys. Acta,
1807,
1013-1021, doi:
10.1016/
from Rhodobacter sphaeroides in the neutral and charge
j.bbabio.2011.05.018.
separated states, J. Mol. Biol.,
371,
396-409,
15.
Moller, J.V., and le Maire, M. (1993) Detergent binding as
doi: 10.1016/j.jmb.2007.04.082.
a measure of hydrophobic surface area of integral mem
4.
Jones, M. (2009) In The purple phototrophic bacteria
brane proteins, J. Biol. Chem., 268, 18659-18672.
(Hunter, C.N., Daldal, F., Thurnauer, M.C., and Beatty, J.T.,
16.
Zabelin, A.A., Shkuropatova, V.A., Shuvalov, V.A., and
eds.), Springer, Dordrecht, The Netherlands, pp. 295-321.
Shkuropatov, A.Ya. (2012) FTIR spectroscopy of the reac
5.
Lu, Y., Xu, J., Liu, B., and Kong, J. (2007) Photosynthetic
tion center of Chloroflexus aurantiacus: photooxidation of
reaction center functionalized nano composite films:
the primary electron donor, Biochemistry (Moscow), 77,
effective strategies for probing and exploiting the photo
157-164, doi: 10.1134/S000629791202006X.
induced electron transfer of photosensitive membrane pro
17.
Clayton, R. (1978) Effects of dehydration on reaction cen
tein, Biosens. Bioelectron., 22, 1173-1185, doi: 10.1016/
ters from Rhodopseudomonas sphaeroides, Biochim.
j.bios.2006.05.026.
Biophys. Acta,
504,
255-264, doi:
10.1016/0005
6.
Das, R., Kiley, P.J., Segal, M., Norville, J., Yu A.A., Wang, L.,
2728(78)90174 3.
Trammell, S.A., Reddick, L.E., Kumar, R., Stellacci, F.,
18.
Malferrari, M., Turina, P., Francia, F., Mezzetti, A., Leibl, W.,
Lebedev, N., Schnur, J., Bruce, B.D., Zhang, S., and
and Venturoli, G. (2015) Dehydration affects the electron
Baldo, M. (2004) Integration of photosynthetic protein
ic structure of the primary electron donor in bacterial pho
molecular complexes in solid state electronic devices,
tosynthetic reaction centers: evidence from visible NIR
Nano Lett., 4, 1079-1083, doi: 10.1021/nl049579f.
and light induced difference FTIR spectroscopy,
7.
Kiley, P., Zhao, X., Vaughn, M., Baldo, M.A., Bruce, B.D.,
Photochem. Photobiol. Sci., 14, 238-251, doi: 10.1039/
and Zhang, S. (2005) Self assembling peptide detergents
c4pp00245h.
stabilize isolated photosystem I on a dry surface for an
19.
Hughes, A.V., Rees, P., Heathcote, P., and Jones, M.R.
extended time, PLoS Biol., 3, e230, doi: 10.1371/journal.
(2006) Kinetic analysis of the thermal stability of the pho
pbio.0030230.
tosynthetic reaction center from Rhodobacter sphaeroides,
8.
Lukashev, E.P., Knox, P.P., Oleinikov, I.P., Seifullina, N.Kh.,
Biophys. J.,
90,
4155-4166, doi:
10.1529/biophysj.
and Grishanova, N.P. (2016) Investigation of stability of
105.070029.
photosynthetic reaction center and quantum dot hybrid
20.
Barth, A. (2007) Infrared spectroscopy of proteins,
films, Biochemistry (Moscow), 81, 58-63, doi: 10.1134/
Biochim. Biophys. Acta, 1767, 1073-1101, doi: 10.1016/
S0006297916010065.
j.bbabio.2007.06.004.
9.
Xia, N., May, C.J., McArthur, S.L., and Castner, D.G.
21.
Arrondo, J.L.R., Muga, A., Castresana, J., and Goni, F.M.
(2002) Time of flight secondary ion mass spectrometry
(1993) Quantitative studies of the structure of proteins in
analysis of conformational changes in adsorbed protein
solution by Fourier transform infrared spectroscopy, Progr.
films, Langmuir, 18, 4090-4097, doi: 10.1021/la020022u.
Biophys. Mol. Biol., 59, 26-56, doi: 10.1016/0079
10.
Barrera, N.P., Di Bartolo, N., Booth P.J., and Robinson, C.V.
6107(93)90006 6.
(2008) Micelles protect membrane complexes from solu
22.
Nabedryk, E., Mantele, W., and Breton, J. (1989) In
tion to vacuum, Science, 321, 243-246, doi: 10.1126/science.
Techniques and new developments in photosynthesis research
1159292.
(Barber. J., Malkin, R., eds.), NATO ASI Ser, Vol. 168,
11.
Reading, E., Liko, I., Allison, T.M., Benesch, J.L.P.,
Plenum Press, New York, pp. 17-34.
Laganowsky, A., and Robinson, C.V. (2015) The role of the
23.
Popova, A.V., Hundertmark, M., Seckler, R., and Hinch, D.K.
detergent micelle in preserving the structure of membrane
(2011) Structural transitions in the intrinsically disordered
proteins in the gas phase, Angew. Chem. Int. Ed., 54,
plant dehydration stress protein LEA7 upon drying are
4577-4581, doi: 10.1002/anie.201411622.
modulated by the presence of membranes, Biochim.
12.
Seibert, M., Picorel, R., Rubin, A.B., and Connolly, J.S.
Biophys. Acta, 1808, 1879-1887, doi: 10.1016/j.bbamem.
(1988) Spectral, photophysical, and stability properties of
2011.03.009.
isolated photosystem II reaction center, Plant Physiol., 87,
24.
Yoneda, J.S., Miles, A.J., Araujo, A.P., and Wallace, B.A.
303-306, doi: 10.1104/pp.87.2.303.
(2017) Differential dehydration effects on globular proteins
БИОХИМИЯ том 84 вып. 9 2019
1368
ЗАБЕЛИН и др.
and intrinsically disordered proteins during film formation,
31. Reimers, J.R., and Hush, N.S. (2003) Modeling the bacte
Protein Sci., 26, 718-726, doi: 10.1002/pro.3118.
rial photosynthetic reaction center. VII. Full simulation of
25. Lutz, M., and Mantele, W. (1991) In Chlorophylls (Scheer, H.,
the intervalence hole transfer absorption spectrum of the
ed.), CRC Press, Boca Raton, FL, pp. 855-902.
special pair radical cation, J. Chem. Phys.,
119,
26. Morita, E.H., Hayashi, H., and Tasumi, M.
(1993)
3262-3277, doi: 10.1063/1.1589742.
Temperature dependence of the light induced infrared dif
32. Shuvalov, V.A., Shkuropatov, A.Ya., Kulakova, S.M.,
ference spectra of chromatophores and reaction centers
Ismailov, M.A., and Shkuropatova, V.A.
(1986)
from photosynthetic bacteria, Biochim. Biophys. Acta,
Photoreactions of bacteriopheophytins and bacterio
1142, 146-154, doi: 10.1016/0005 2728(93)90096 X.
chlorophylls in reaction centers of Rhodopseudomonas
27. Nikolaev, G.M., Knox, P.P., Kononenko, A.A.,
sphaeroides and Chloroflexus aurantiacus, Biochim. Biophys.
Grishanova, N.P., and Rubin, A.B. (1980) Photo induced
Acta, 849, 337-346, doi: 10.1016/0005 2728(86)90145 3.
electron transport and water state in Rhodospirillum
33. Roth, M., Lewit Bentley, A., Michel, H., Deisenhofer, J.,
Rubrum chromatophores, Biochim. Biophys. Acta, 590,
Huber, R., and Oesterhelt, D. (1989) Detergent structure
194-201, doi: 10.1016/0005 2728(80)90024 9.
in crystals of a bacterial photosynthetic reaction centre,
28. Francia, F., Palazzo, G., Mallardi, A., Cordone, L., and
Nature, 340, 659-662, doi: 10.1038/340659a0.
Venturoli, G. (2003) Residual water modulates Q– to QB
34. Roth, M., Arnoux, B., Ducruix, A., and Reiss Husson F.
electron transfer in bacterial reaction centers embedded in
(1991) Structure of the detergent phase and protein-deter
trehalose amorphous matrices, Biophys. J., 85, 2760-2775,
gent interactions in crystals of the wild type (strain Y)
doi: 10.1016/S0006 3495(03)74698 0.
Rhodobacter sphaeroides photochemical reaction center,
29. Naberdyk, E., Allen, J.P., Taguchi, A.K.W., Williams, J.C.,
Biochemistry, 30, 9403-9413, doi: 10.1021/bi00103a003.
Woodbury, N.W., and Breton, J. (1993) Fourier transform
35. Rouse, S.L., Marcoux, J., Robinson, C.V., and
infrared study of the primary electron donor in chro
Sansom, M.S.P. (2013) Dodecyl maltoside protects mem
matophores of Rhodobacter sphaeroides with reaction cen
brane proteins in vacuo, Biophys. J., 105, 648-656,
ters genetically modified at residues M160 and L131,
doi: 10.1016/j.bpj.2013.06.025.
Biochemistry,
32,
13879-13885, doi:
10.1021/
36. Helenius, A., McCaslin, D.R., Fries, E., and Tanford, C.
bi00213a017.
(1979) Properties of detergents, Methods Enzymol., 56,
30. Breton, J., Nabedryk, E., and Parson, W.W. (1992) A new
734-749, doi: 10.1016/0076 6879(79)56066 2.
infrared electronic transition of the oxidized primary elec
37. Giorgio, G., Colafemmina, G., Mavelli, F., Murgiac, S.,
tron donor in bacterial reaction centers: a way to assess res
and Palazzo, G. (2016) The impact of alkanes on the struc
onance interactions between the bacteriochlorophylls,
ture of Triton X100 micelles, RSC Adv., 6, 825-836,
Biochemistry, 31, 7503-7510, doi: 10.1021/bi00148a010.
doi: 10.1039/c5ra21691e.
SPECTRAL AND PHOTOCHEMICAL PROPERTIES OF Rhodobacter
sphaeroides R 26 REACTION CENTER FILMS
UNDER VACUUM CONDITIONS
A. A. Zabelin*, V. A. Shkuropatova, V. A. Shuvalov, and A. Ya. Shkuropatov
Institute of Basic Biological Problems, Pushchino Scientific Center for Biological Research,
Russian Academy of Sciences, 142290 Pushchino, Moscow Region, Russia; E<mail: zabelin.bio@gmail.com
Received April 3, 2019
Revised June 5, 2019
Accepted June 5, 2019
Using absorption spectroscopy in visible/near IR and mid IR regions, the spectral and photochemical properties of
isolated reaction centers (RCs) from Rhodobacter sphaeroides R 26 are studied in dried films on the surface of inor
ganic supports (quartz or CaF2 plates) under vacuum dehydration conditions (10-2 or 7⋅10-5 mm Hg). Three deter
gents, i.e., N,N dimethyldodecylamino N oxide (LDAO), Triton X 100 (TX100), and n dodecyl β D maltoside
(DM), were tested for their ability to stabilize RC-detergent complexes in the vacuum dried state. It is shown that in
the presence of LDAO, RC complexes undergo destruction in vacuum. In contrast, DM provides an environment
that minimizes irreversible disruptive changes in RC under vacuum conditions. Vacuum dehydration of RC-DM
films caused a small increase in the content of α helices in the RC protein, a short wavelength reversible shift in the
optical transitions of pigments, and minor changes in the electronic structure of the P+ dimer. The films retained pho
tochemical activity upon excitation with high intensity light (200 mW/cm2). TX100 also helps to maintain the spec
tral and functional properties of RC in vacuum, however, in this case the stabilizing effect is less pronounced than in
the presence of DM, especially at high concentrations of the detergent. The results are discussed within the frame
work of a model suggesting that upon vacuum dehydration of RC complexes, the detergent-protein interactions and
the properties of detergent micelles play a dominant role in maintaining the RC structure. The data obtained can be
useful in the development of hybrid photoconverting systems containing bacterial RCs.
Keywords: reaction center, absorption spectroscopy, vacuum dehydration, detergent, micelles, Rhodobacter
sphaeroides R 26
БИОХИМИЯ том 84 вып. 9 2019