БИОХИМИЯ, 2020, том 85, вып. 1, с. 3 - 14
УДК 579.61
ОСОБЕННОСТИ МИКРОБИОМА РЕСПИРАТОРНОГО ТРАКТА
БОЛЬНЫХ МУКОВИСЦИДОЗОМ*
© 2020
О.Л. Воронина1**,***, Н.Н. Рыжова1, М.С. Кунда1, Э.В. Лосева1,
Е.И. Аксенова1, Е.Л. Амелина2, Г.Л. Шумкова2, О.И. Симонова3, А.Л. Гинцбург1
1 Национальный исследовательский центр им. Н.Ф. Гамалеи Минздрава России,
123098 Москва, Россия; электронная почта: olv550@gmail.com
2 Научно'исследовательский институт пульмонологии ФМБА России, 115682 Москва, Россия
3 Национальный медицинский исследовательский центр здоровья детей Минздрава России,
119296 Москва, Россия
Поступила в редакцию 04.06.2019
После доработки 29.07.2019
Принята к публикации 10.09.2019
Микробиота - неотъемлемая часть организма человека, которую активно исследуют, в т.ч. методами массо
вого параллельного секвенирования. Однако микробиомы легких и пазух носа стали объектами присталь
ного внимания лишь в последнем десятилетии. Для пациентов с муковисцидозом контроль состояния мик
роорганизмов дыхательных путей важен для сохранения функции легких. Выяснение роли пазух носа и на
личия полипов в формировании микробиома дыхательных путей стало целью нашего исследования. Мы
показали, что уже в детском возрасте в пазухах носа присутствуют протеобактерии, обнаруженные также в
образцах из нижних дыхательных путей. В ряде случаев им сопутствуют потенциально опасные базидиоми
цеты. Однако наличие полипов не влияет на формирование микробиома пазух носа. Протеобактерии явля
ются определяющими в снижении биоразнообразия микробиомов легких и пазух носа, что коррелирует с
ухудшением показателей функции легких. Мягкие мутации в гене CFTR даже в гетерозиготном состоянии в
сочетании с мутацией I класса способствуют формированию более благополучного микробиома.
КЛЮЧЕВЫЕ СЛОВА: микробиом, муковисцидоз, респираторный тракт, хронический риносинусит,
Proteobacteria.
DOI: 10.31857/S0320972520010017
Микробиоту - совокупность микроорганиз
лекулярных часов для филогенетики [1]. Осо
мов - в настоящее время рассматривают как не
бое внимание Stackebrandt и Woese уделяли ро
отъемлемую составную часть организма челове
ли рРНК в филогении и таксономии прокариот
ка, оказывающую влияние на пищеваритель
[2]. В 1970 е гг. началось накопление данных о
ную, иммунную, нервную и др. системы. XXI век
последовательностях генов рРНК, чему содей
привнес новый термин - микробиом, определя
ствовали работы Sanger, предложившего в 1977 г.
ющий суммарный геном микроорганизмов эко
метод расшифровки первичной структуры
логической ниши или конкретного образца. Од
ДНК. Накопленные данные нуждались в систе
нако в большинстве исследований под микро
матизации, и в 1982 г. GenBank NCBI начал ра
биомом понимают совокупность генов рибосо
боту в качестве базы данных последовательнос
мальной РНК (рРНК) микробиоты.
тей нуклеиновых кислот [3]. В 1990 е гг. Woese et al.
Woese et al. доказали универсальность этих
выполнили проекты по формированию базы
генов и возможность рассмотрения их как мо данных последовательностей рРНК [4]. Пере
Принятые сокращения: МВ - муковисцидоз; CFTR - трансмембранный регулятор проводимости (cystic fibrosis
transmembrane regulator); MLST - мультилокусное секвенирование (MultiLocus Sequence Typing); ST - генотип в контекс
те генов MLST (Sequence Type); ITS - внутренний транскрибируемый спейсер (internal transcribed spacer); OTU - опера
ционная таксономическая единица (Operational Taxonomic Unit); SRA - Архив секвенированных прочтений (Sequence
Read Archive); PCoA - анализ главных координат (Principal Coordinate Analysis); ОФВ1 - объем форсированного выдоха
в первую секунду; PERMANOVA - пермутационный многомерный анализ дисперсии (PERmutational Multivariate
ANalysis Of Variance); FDR - доля ложных отклонений (false discovery rate).
* Статья посвящается 80 летию кафедры биохимии биологического факультета МГУ им. М.В. Ломоносова (см. том 84,
вып. 11, 2019).
** Автор является выпускником кафедры биохимии биологического факультета МГУ им. М.В. Ломоносова.
*** Адресат для корреспонденции.
3
4
ВОРОНИНА и др.
численные события содействовали тому, что
формируется сбалансированное сообщество,
дальнейшая автоматизация процесса секвени
находящееся под контролем клеток иммунной
рования нуклеиновых кислот, разработка сек
системы, способных уничтожить патогенные
венаторов нового поколения, обеспечивших
микробы, благодаря работе фаголизосомы.
получение большого массива данных, не при
При моногенном заболевании муковисцидоз
вели к хаосу, а позволили пополнить созданные
(МВ) мутации в гене трансмембранного регуля
базы новой информацией. Поскольку биология
тора проводимости (cystic fibrosis transmembrane
в ХХ веке, по меткому выражению Woese, стала
regulator, CFTR) приводят к нарушению транс
инженерной наукой [1], процессы компьюте
порта ионов хлора, последствиями которого яв
ризации затронули ее в полной мере. Разрабо
ляются мультиорганные поражения. В центре
танное и постоянно совершенствуемое программ
внимания врачей, прежде всего, находится сос
ное обеспечение, развитие компьютерной тех
тояние нижних дыхательных путей пациентов с
ники позволяют анализировать результаты сек
МВ, поскольку снижение функции легких ска
венирования и сопоставлять их с базами дан
зывается на качестве жизни пациентов и опре
ных.
деляет продолжительность жизни.
Подготовленная информационная среда и
Следует отметить, что при повреждении
опыт секвенирования, полученный в процессе
хлорного канала нарушается мукоцилиарный
выполнения проекта «Геном человека», позво
клиренс не только в легких, бронхах, трахее, но
лили в 2008 г. запустить новый проект «Микро
и в полостях носа, в т.ч. в пазухах. Секрет ста
биом человека» (The Human Microbiome
новится все более плотным, создавая препят
Project, HMP) [5]. В процессе оптимизации ис
ствие для работы реснитчатого эпителия. На
следования основной мишенью для секвениро
капливаются микроорганизмы, их атакуют
вания был выбран ген 16S rDNA, а в дальней
клетки иммунной системы, но не могут уничто
шем - его фрагмент, включающий несколько
жить, поскольку нарушение работы хлорного
вариабельных областей (как правило, V1-V4
канала не позволяет должным образом закис
или меньше, в зависимости от возможностей
лить полость фаголизосомы. В ответ на сигна
платформы, применяемой для секвенирова
лы макрофагов приходят нейтрофилы, у кото
ния). Таким образом, исследование микробио
рых также не работает хлорный канал. Некроз
ма в контексте фрагментов генов 16S rDNA,
клеток иммунной системы способствует фор
строго говоря, позволяет получить представле
мированию дезинтегрированного воспалитель
ние о бактериоме, т.е. о филогенетическом раз
ного процесса при хронической инфекции,
нообразии бактерий.
обусловленной размножающимися микроорга
Метагеномные исследования, предоставля
низмами [7].
ющие возможность изучить метаболизм мик
Изменения в составе микробиома у больных
робного сообщества, пока дороги и могут быть
МВ начинаются с ранних лет [8], выявить триг
выполнены только в рамках отдельных высоко
гер этих изменений позволят последовательные
финансируемых проектов.
исследования микробиома пациентов в течение
Следует отметить, что первый проект «Мик
всей их жизни. Накопленные в настоящий мо
робиом человека» был нацелен на исследование
мент знания сформировали представление о так
бактерий кишечника, кожи, урогенитального
называемом «здоровом микробиоме» нижних
тракта и, исходя из господствовавших представ
дыхательных путей, в который входят предста
лений о стерильности легких, не включал эту
вители трех основных филумов: Actinobacteria,
область в поле зрения своих интересов [5, 6].
Bacteroidetes и Firmicutes [9]. Несмотря на то что
Только к следующему проекту «Интегративный
протеобактерии присутствуют в сбалансирован
геном человека» (The Integrative Human
ном микробиоме здоровых людей [10], их появ
Microbiome Project, iHMP), начавшемуся в 2014 г.,
ление в микробном сообществе легких больных
это предубеждение удалось преодолеть [5]. Та
МВ является настораживающим фактором, по
ким образом, активное изучение микробиома
этому протеобактерии, прежде всего, подлежат
легких и ряда отделов верхних дыхательных пу
регулярному контролю в нижних дыхательных
тей в норме и при патологиях с применением
путях пациентов с МВ. Данные о пациентах с
методов массового параллельного секвенирова
хронической инфекцией легких отражаются в
ния началось только в 10 е гг. ХХI века.
национальном и международных регистрах
В норме формирование микробиома легких
больных МВ [11, 12].
определяют два основных процесса: аспирация
При сопоставлении микробиомов легких
микроорганизмов ротовой полости и мукоцили
здоровых добровольцев и пациентов с МВ в пер
арный клиренс, удаляющий большинство «при
вую очередь необходимо обратить внимание на
шельцев» из нижних дыхательных путей. Так
такой параметр, как бактериальная нагрузка.
БИОХИМИЯ том 85 вып. 1 2020
ОСОБЕННОСТИ МИКРОБИОМА
5
Она низка у здоровых людей в течение всей жиз
МЕТОДЫ ИССЛЕДОВАНИЯ
ни и у детей с МВ в раннем возрасте. Начало из
менений в микробиоме пациентов с МВ, выра
Материал. В анализе были 53 образца от 21
жающееся в увеличении бактериальной нагруз
пациента c МВ (15 взрослых, медиана возраста
ки, росте количества протеобактерий и сниже
27,3 года; 6 детей, медиана возраста 8,7 лет): 22
нии разнообразия микробного сообщества, за
образца мокроты, 14 образцов лаважа верхнече
висит от многих параметров, ключевой из кото
люстных пазух носа, 2 назофарингеальных смы
рых пока не определен [13].
ва, 8 трахеальных аспиратов и 7 фрагментов по
Протеобактерии, попадающие в организм
липов, полученных во время полипэктомии. По
человека из окружающей среды, заслуживают
состоянию верхних дыхательных путей отола
особого внимания в отношении больных МВ.
ринголог всем пациентам поставил диагноз хро
За годы наблюдений с 1950 х гг. доказано, что
нический риносинусит преимущественно тяже
Pseudomonas aeruginosa, Burkholderia spp.,
лого течения с полипами или без них.
Achromobacter spp. и Stenotrophomonas maltophilia,
Забор образцов осуществляли специалисты
относящиеся к условно патогенным микроор
лечебных учреждений, в которых наблюдались
ганизмам, являются патогенами при муковис
пациенты. Информированные согласия на ис
цидозе [14]. При инфицировании этими мик
следование образцов были получены врачами
роорганизмами нижних дыхательных путей
от взрослых больных МВ, пациентов старше 15
снижается функция легких, сокращается 5 лет
лет, а также от родителей и опекунов несовер
няя выживаемость [15], возникает опасность
шеннолетних пациентов младше 15 лет. Цикл
заселения этими бактериями трансплантата
исследований биологических образцов паци
легких [16].
ентов, больных МВ и врожденным пороком
Обострения заболевания легких, антибиоти
развития легких, был одобрен комитетом по
котерапия, класс мутаций в гене CFTR и другие
биомедицинской этике НИИЭМ им. Н.Ф. Га
факторы влияют на состояние микробиоты,
малеи Минздрава России (протокол № 1 от
сдерживание патогенных микроорганизмов и
17.05.2012).
снижение функции легких [17-19].
Методы. ДНК из образцов мокроты выделя
Однако даже после успешной антибиотико
ли согласно инструкции к набору реактивов
терапии протеобактерии появляются в легких
Maxwell 16 Tissue DNA Purification Kit на прибо
вновь, причем бактерии того же генотипа, что и
ре Maxwell MDX Instrument («Promega», США).
колонизировавшие ранее нижние дыхательные
Основной микроорганизм биологического
пути. Наблюдения за пациентами, инфициро
образца определяли с помощью амплификации
ванными Burkholderia и перенесшими транс
и секвенирования фрагмента гена 16S rDNA, как
плантацию легких, показали, что в зависимости
описано ранее Voronina et. al. [22]. Экспресс ди
от состояния пациента и патогенных свойств
агностику бактерий порядка Burkholderiales, по
бактерии Burkholderia прежнего генотипа засе
ражающих дыхательные пути больных муковис
ляла новые легкие сразу после пересадки, через
цидозом, выполняли согласно схеме для моле
3 месяца, через год и более, но через 2,5 года
кулярно генетического типирования, предло
после операции Burkholderia была выявлена у
женной Ворониной с соавт. [23]. Для выявления
всех исследованных пациентов [20].
Pseudomonas aeruginosa использовали наиболее
Эти факты заставили обратить внимание на
вариабельную мишень схемы мультилокусного
верхние дыхательные пути, а именно пазухи но
секвенирования (MLST, MultiLocus Sequence
са, как возможный резервуар инфекции. В пи
Typing) trpE, следуя методике Curran et al. [24] с
лотном исследовании мы показали, что у всех
нашими модификациями.
пациентов, для которых были одновременно
Идентификацию гена mecA в составе стафи
взяты образцы лаважа пазух носа и мокроты,
лококковой хромосомной кассеты (staphylococ
совпали генотипы патогенных микроорганиз
cal cassette chromosome mec, SCCmec), опреде
мов в обоих образцах [21].
ляющей устойчивость к метициллину, проводи
Поскольку хронический риносинусит, нару
ли с праймерами Мес_10 11_For 5′ ATGTAT
шение мукоцилиарного клиренса пазух носа
GCTTTGGTCTTTCT 3′ и Мес_10 11_Rev
наблюдаются у всех пациентов с МВ, но только
5′ TACACATATCGTGAGCAATGA 3′, разрабо
у доли больных разрастаются полипы назальных
танными нами. Для амплификации фрагмента
пазух и средней раковины, мы предприняли
гена mecA использовали следующую программу:
следующий этап исследования для выяснения
95 °С - 10 мин; (95 °С - 30 с, 52 °С - 1 мин,
роли морфологических образований носа в фор
72 °С - 1 мин) × 35; 72 °С - 5 мин. В положи
мировании микробиома верхних дыхательных
тельных образцах размер продукта амплифика
путей и его влиянии на микробиом легких.
ции составлял 584 п.н.
БИОХИМИЯ том 85 вып. 1 2020
6
ВОРОНИНА и др.
Выявление возбудителей микозов проводи
верными признавали только различия для групп
ли на основе амплификации и секвенирования
с p < 0,05.
региона ITS1_5.8S_ITS2 согласно протоколу,
опубликованному Ворониной с соавт. [25].
Для определения состава микробиома раз
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
личных отделов респираторного тракта прово
дили массовое параллельное секвенирование
Сравнение микроорганизмов верхних и нижних
ампликонов гена 16S rDNA на платформе MiSeq
дыхательных путей в группе детей с МВ. Иссле
Illumina, как описано Рыжовой с соавт. [19].
дования последнего десятилетия доказали необ
Полученные данные анализировали с по
ходимость контроля микроорганизмов верхних
мощью модуля Microbial Genomics программы
дыхательных путей у больных МВ. Однако неяс
CLC Genomic Workbench v.11 - 12. Для опреде
но, в каком возрасте пациента опасные для
ления OTU (Operational Taxonomic Unit) ис
функции легких микроорганизмы колонизиру
пользовали базу данных Greengenes v.13_8 с
ют верхние дыхательные пути, особенно пазухи,
уровнем сходства 97%.
среднюю и верхнюю раковины носа. Получение
Данные секвенирования депонировали в
образцов такого рода у детей затруднено болез
SRA (Sequence Read Archive) NCBI: BioProject
ненностью процедуры. Источником материала
accession number PRJNA544655 для микробио
могут служить фрагменты полипов, удаленных
мов взрослых, PRJNA544933 - для микробио
при полипэктомии.
мов детей.
При анализе материала от пяти пациентов с
Для оценки альфа разнообразия (таксоно
МВ было показано, что у четырех детей полипы
мическое разнообразие микробиоты в конкрет
содержали Staphylococcus aureus, являющийся
ном образце) использовали коэффициент фило
аутохтонным микроорганизмом для носовой
генетического разнообразия, а также Simpson’s
полости. Отсутствие генов mecA в образцах
index, показатели Shannon entropy и Chao 1 bias
подтвердило чувствительность S. aureus к мети
corrected. Бета разнообразие (степень попарно
циллину, что также свидетельствовало в пользу
го сходства таксономического состава микроби
аутохтонного происхождения выявленных бак
оты разных проб) было оценено с помощью ин
терий. Пациент 3 CHP, у которого в полипах
дексов Jaccard, Bray Curtis, Euclidean distance, а
был выявлен только S. aureus, при дальнейшем
также различных метрик UniFrac (Unweighted
наблюдении демонстрировал нормальную
UniFrac, Weighted UniFrac, Weighted UniFrac not
функцию легких и отсутствие протеобактерий в
normalized, D_0 UniFrac, D_0.5 UniFrac), учи
трахеальном аспирате при преобладании
тывающих филогенетическую структуру сооб
Streptococcus spp.
щества [26].
У четырех пациентов и в полипах, и в трахе
Для подробного анализа сходства между об
альном аспирате выявили P. aeruginosa. Геноти
разцами использовали Principal Coordinate
пы бактерий в нижних и верхних дыхательных
Analysis (PCoA), основанный на многомерном
путях совпали у всех пациентов. Следует отме
рассмотрении данных [27]. Подгруппы взрос
тить, что у ребенка 2 CHP с 9 до 12 лет в трахе
лых пациентов формировали с учетом следую
альном аспирате из протеобактерий обнаружи
щих параметров: 1) возраст: 18-25, 26-30 лет;
вали только Achromobacter xylosoxidans ST251, од
2) значение ОФВ1 (объем форсированного вы
нако после его эрадикации в образцах из ниж
доха в первую секунду): 70-115%, 40-69%,
них дыхательных путей детектировали P. aerugi'
<40%; 3) тип образца: из верхних или нижних
nosa того же генотипа, что ранее был выявлен в
дыхательных путей; 4) степень тяжести болезни
полипах носа.
легких: легкое течение, средней тяжести, тяже
У близнецов 4 CHP и 5 CHP помимо одина
лое течение; 5) основной микроорганизм, выяв
ковых P. aeruginosa в полипах были обнаружены
ленный в микробиоме (восемь групп); 6) класс
грибы Auriculariopsis ampla (Fungi; Dikarya;
мутации в гене CFTR (Cystic Fibrosis Transport
Basidiomycota; Agaricomycotina; Agaricomycetes;
Regulator). Для определения класса мутаций ис
Agaricomycetidae; Agaricales; Schizophyllaceae),
пользовали базу данных МГНЦ LOVD v.0.1 [28].
тогда как в трахеальном аспирате обоих пациен
Анализ статистической значимости разли
тов присутствовали дрожжеподобные грибы
чий между группами образцов производили с
Candida albicans. В то же время даже у близнецов
помощью метода PERMANOVA (PERmutational
наблюдали отличия в микробиомах: если основ
Multivariate ANalysis Of Variance) [29]. Для каж
ным микробом полипов пациента 4 CHP был
дой пары групп рассчитывали псевдо'f статис
S. aureus, то в полипах 5 CHP преобладал
тику, величину уровня значимости p и скоррек
Haemophilus influenzae, ранее обнаруженный в
тированные по Бонферрони p'значения. Досто
образцах трахеального аспирата.
БИОХИМИЯ том 85 вып. 1 2020
ОСОБЕННОСТИ МИКРОБИОМА
7
Таким образом, полученные данные подтвер
тов с МВ, что снижает способность здоровой
ждают, что уже в детском возрасте у пациентов с
части микробиома противостоять патогенным
МВ верхние дыхательные пути могут служить
микроорганизмам.
резервуаром бактерий, инфицирующих легкие.
Сопоставление микробиомов пазух носа и
Сравнение альфа?разнообразия бактерий в
нижних дыхательных путей у взрослых пациентов
микробиомах ребенка и взрослых с диагнозом МВ.
с МВ. Взрослых пациентов, вошедших в анализ
Протеобактерии порядка Burkholderiales опасны
микробиома респираторного тракта, можно раз
для больных МВ способностью формировать
делить на три группы по тяжести заболевания
эпидемические штаммы, распространяемые воз
легких: легкая форма, средняя и тяжелая. Толь
душно капельным путем. Для российских паци
ко у одного пациента первой группы - 61 CF -
ентов наиболее значимыми являются B. ceno'
отсутствовали протеобактерии в мокроте в пе
cepacia ST709 (Sequence Type) и A. ruhlandii ST36
риод наблюдения. У всех остальных пациентов
[21]. При хронизации инфекции не отмечено
вне зависимости от тяжести заболевания легких
эрадикации этих бактерий из дыхательных пу
в мокроте были выявлены представители родов
тей. Поэтому когда у ребенка 82 CF в возрасте
Burkholderia, Achromobacter и Pseudomonas.
4 г. 9 мес. была выявлена B. cenocepacia ST709, вра
В лаваже пазух носа бактерии и грибы отсут
чами стационара была применена интенсивная
ствовали у пациента
61 CF. Лишь следы
терапия, а также проведена операция по промы
Burkholderia обнаружены у пациента 74 CF в об
ванию пазух носа. Анализ лаважа пазух показал,
разце лаважа пазух носа, полученного в процес
что даже после очистки легких от буркхолдерии
се полипотомии и полисинусотомии носа
в пазухах носа сохранялись различные предста
(рис. 2). В образце преобладал S. aureus, тогда
вители порядка Burkholderiales, а также другие
как в легких 90% всего микробиома составляла
протеобактерии. Несмотря на то что антибиоти
B. cenocepacia ST709. Объяснение такого исклю
котерапия оказала влияние на фирмикутов, ин
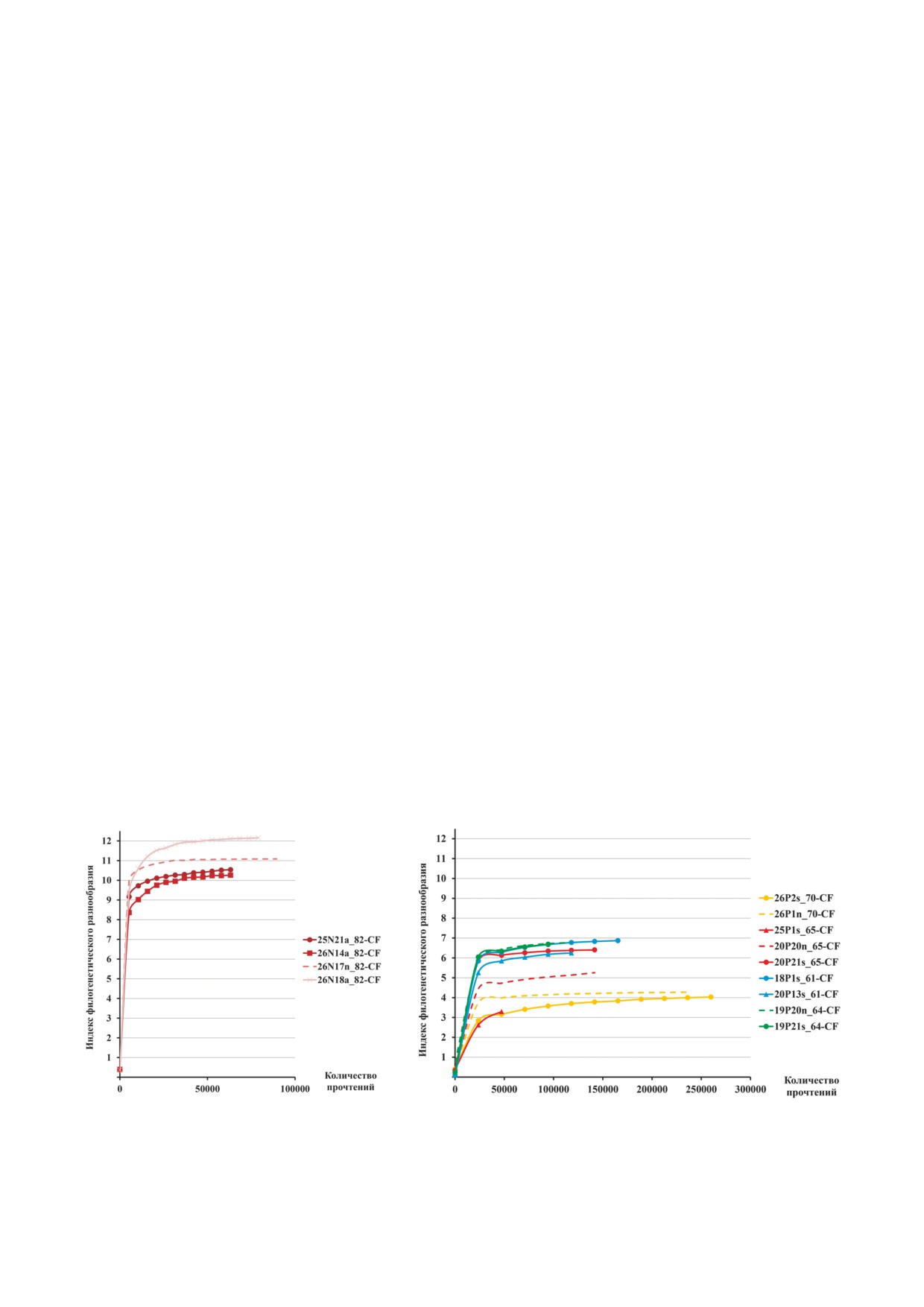
чения врачи видят в чрезвычайно затрудненном
декс альфа разнообразия (max 12) для образцов
носовом дыхании из за разрастания полипов.
трахеального аспирата и пазух носа пациента
У пациентов 70 CF и 71 CF преобладание
82 CF был достаточно высоким (рис. 1) и значи
фирмикутов в образцах из верхних дыхательных
тельно превышал соответствующий показатель
путей («n») определили проблемы взятия мате
(max 7) для образцов взрослых даже у самого
риала. У пациентов в силу тяжести состояния
благополучного пациента 61 CF c сохранной
был выполнен только прокол пазух, и смыв
функцией легких и чистыми пазухами носа при
включал не только вытекший гной, но и бакте
легкой форме хронического риносинусита.
рии носоглотки, поэтому эти два образца следу
Эти данные подтверждают, что регулярные
ет считать назофарингеальными смывами, обо
обострения и курсы антибиотикотерапии сокра
гащенными содержимым пазух. Как видно из
щают разнообразие микробиома легких пациен
рис. 2, в образцах «n» этих пациентов 80-90%
а
б
Рис. 1. Альфа разнообразие микробиомов в образцах пациентов с муковисцидозом. а - Образцы ребенка 82 CF: a - тра
хеальный аспират, n - лаваж пазух носа; б - образцы взрослых пациентов: s - мокрота, n - лаваж пазух носа
БИОХИМИЯ том 85 вып. 1 2020
8
ВОРОНИНА и др.
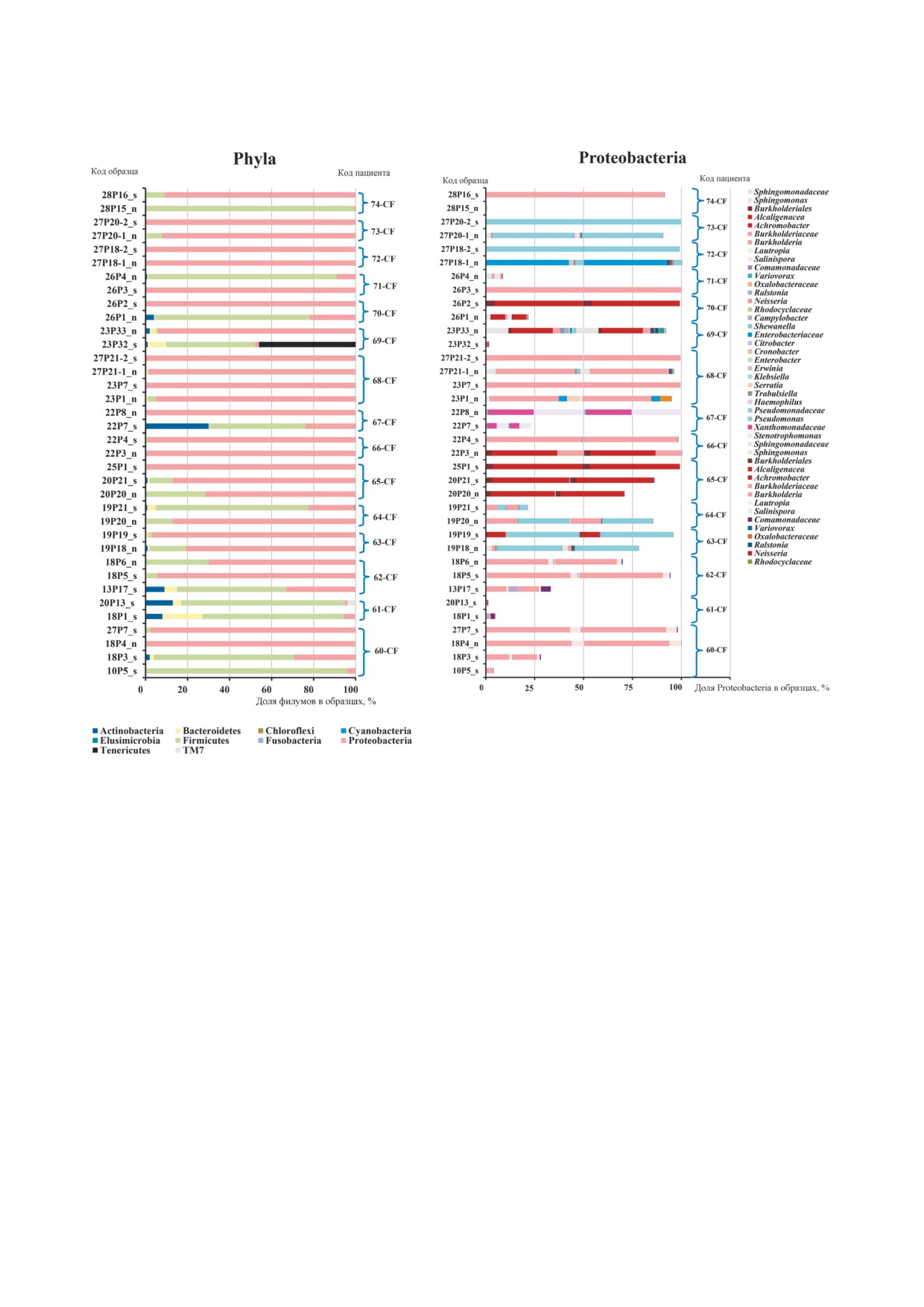
а
б
Рис. 2. Представленность филумов бактерий (а) и таксонов Proteobacteria (б) в образцах респираторного тракта взрослых
пациентов с муковисцидозом: n - лаваж верхнечелюстных пазух (для пациентов 70 CF и 71 CF - назофарингеальные
смывы, обогащенные содержимым пазух), s - мокрота. Фигурными скобками объединены образцы одного пациента
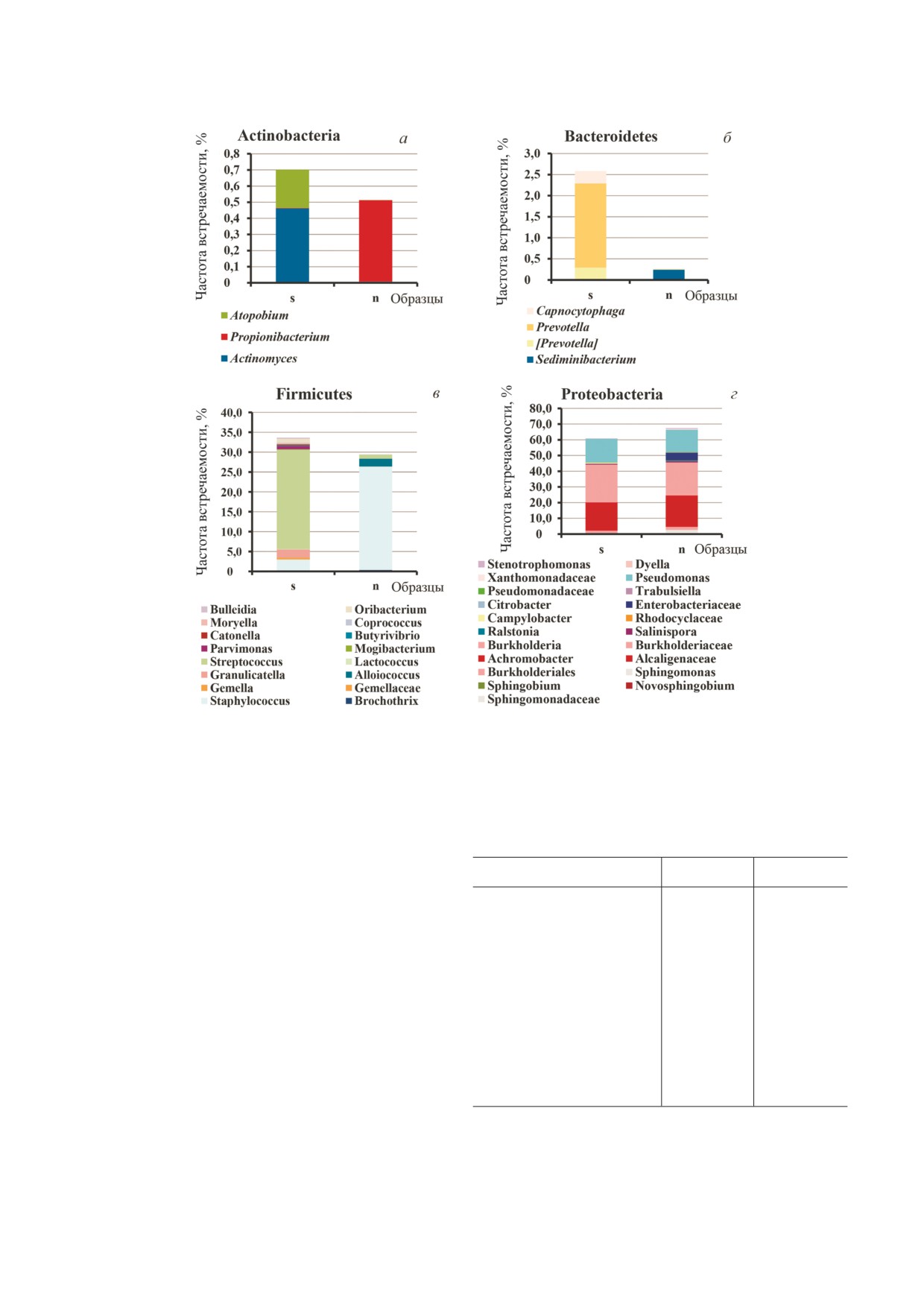
всех бактерий составляли фирмикуты, однако
це). Среди фирмикутов пазух носа ожидаемо ли
обнаруженные протеобактерии соответствовали
дировали Staphylococcus, а в мокроте - Streptococ'
по генотипу выявленным в мокроте.
cus. Бактероиды Prevotella и Capnocytophaga,
У остальных пациентов протеобактерии пре
представленные в микробиоме мокроты, практи
валировали в микробиоме пазух носа даже в пе
чески отсутствовали в пазухах носа. Для филума
риод благополучного состояния микробиома
актинобактерий в образцах мокроты были харак
легких, например, у пациентов 60 CF и 64 CF.
терны Actinomyces и Atopobium, а в пазухах носа
При сравнении всех образцов мокроты со
был выявлен Propionibacterium. В то же время про
всеми образцами лаважа пазух носа достоверное
теобактерии, преобладавшие как в микробиоме
отличие было получено по индексам Unweighted
пазух, так и в микробиоме легких, практически
UniFrac (p = 0,00118) и D_0 UniFrac (p = 0,0001)
не отличались по составу. Дополнительный так
(рис. 3). Фракции фирмикутов, а также минор
сон в пазухах носа представляли энтеробактерии.
ных актинобактерий и бактероидов отличались
Таким образом, мы получили еще одно подтвер
по составу между микробиомами пазух носа и
ждение характеристики пазух носа как резервуа
мокроты (параметры достоверности для отме
ра протеобактерий, способных поддерживать ин
ченных на рис. 3 таксонов представлены в табли
фекцию в легких у пациентов с МВ.
БИОХИМИЯ том 85 вып. 1 2020
ОСОБЕННОСТИ МИКРОБИОМА
9
Рис. 3. Сопоставление состава филумов Actinobacteria (а), Bacteroidetes (б), Firmicutes (в) и Proteobacteria (г) в мокроте и
образцах из верхних дыхательных путей взрослых пациентов с муковисцидозом: s - 21 образец мокроты, n - 13 образцов
лаважа верхнечелюстных пазух носа и 2 назофарингеальных смыва, обогащенных содержимым пазух
Сравнение микробиомов пазух носа взрослых
Достоверность отличий по содержанию таксонов актино
бактерий, бактероидов и фирмикутов в образцах мокроты
пациентов с МВ с полипами и без полипов. У всех
и лаважа пазух носа
взрослых пациентов, взятых в исследование,
отоларингологом диагностирован хронический
Род, OTU
p
FDR p
риносинусит. Только у пациента 61 CF отмече
но легкое течение, остальные 14 пациентов ха
Prevotella, 530206
8,84E 09
2,43E 07
рактеризовались тяжелым течением риносину
сита. У восьми пациентов полипы отсутствова
Actinomyces, 875735
4,28E 11
2,44E 09
ли, у шести обнаружены полипы второй степени
с обеих сторон. У пациента 68 CF были проана
Atopobium, 4451251
4,04E 11
2,41E 09
лизированы два образца из пазух носа: один об
разец был взят до, а второй - после полипо и
Capnocytophaga, 1106150
1,88E 12
2,07E 10
полисинусотомии. У пациента 72 CF лаваж па
Staphylococcus, 1084906
2,93E 11
1,99E 09
зух носа был получен через два месяца после
третьей за последние 16 лет операции полипо и
Streptococcus, 561636
7,14E 11
3,71E 09
полисинусотомии.
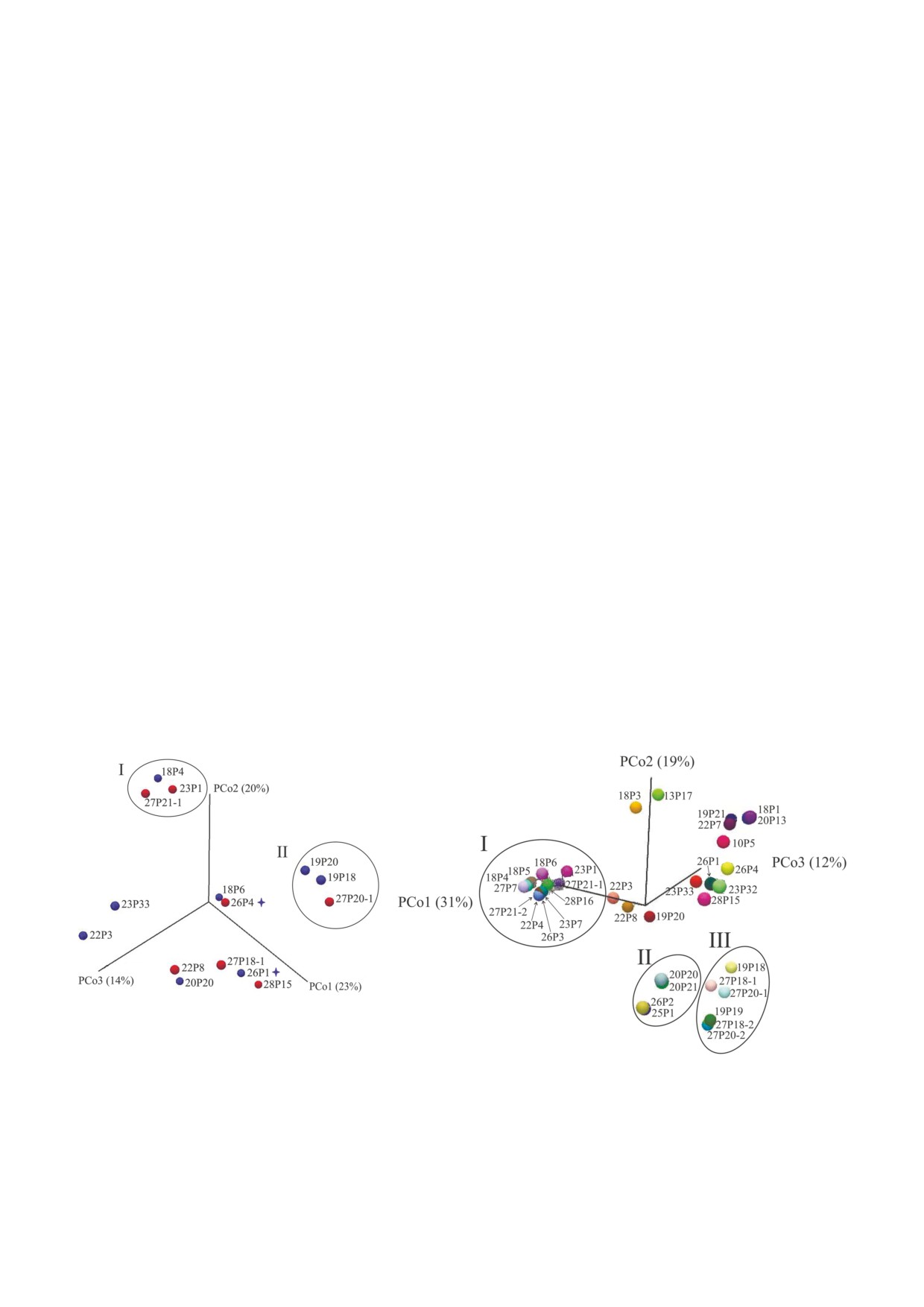
Результаты PCoA микробиомов образцов па
зух носа представлены на рис. 4, а. Как видно на
Примечание. FDR - false discovery rate (доля ложных
рисунке, группировка образцов по признаку на
отклонений).
БИОХИМИЯ том 85 вып. 1 2020
10
ВОРОНИНА и др.
личия/отсутствия полипов не наблюдается.
кращение доли протеобактерий до 30% в образ
Достоверно различаются микробиомы двух
цах мокроты пациентов 60 CF и 62 CF в благо
групп: I - с доминирующей Burkholderia и II -
получный период приводит к смещению образ
с превалирующим Pseudomonas. Причем в груп
цов вверх по оси PCo2 19%.
пу I входят оба образца пациента 68 CF. У па
В то же время образцы лаважа пазух носа со
циента 72 CF даже после третьей операции
сложным сочетанием нескольких протеобакте
протеобактерии составляли 100% микробиома,
рий выстроились вдоль оси PCo1 31%: 22P3,
среди которых лидировала E. coli, а P. aerugi'
22P8, 19P20, а образцы мокроты с комбинацией
nosa, превалировавший в микробиоме легких,
протеобактерий сместились по оси PCo2 19%:
составлял < 10% (рис. 2). Таким образом, для
19P21 и 22P7.
эрадикации протеобактерий недостаточно
При сравнении микробиомов в подгруппах
только оперативного вмешательства, необхо
по ОФВ1 было получено достоверное отличие
дима длительная антибиотикотерапия посред
подгруппы 1 с ОФВ1 70-115% от подгруппы 3 с
ством ингаляций и приверженность пациентов
ОФВ1 < 40% (Bray-Curtis p = 0,00899).
к лечению.
Сравнение подгрупп по классам мутаций по
Сопоставление микробиомов респираторного
казало, что достоверные отличия наблюдаются
тракта в подгруппах сравнения взрослых пациен?
между подгруппами Class II/Class I и Class V/
тов. Результаты PCoA всех образцов респира
Class I (Bray-Curtis p = 0,02857), а также между
торного тракта (рис. 4, б) выявили три достовер
Class II/Class II и Class V/Class I (Euclidean p =
но отличающиеся группы по доминирующему
= 0,02573). Эти данные подчеркивают вклад
микроорганизму. Наиболее многочисленная
мягких мутаций (Class V) даже в гетерозиготном
группа I Burkholderia отличалась от группы II
состоянии в сочетании с мутацией I класса.
Achromobacter по всем восьми использованным
индексам (Bray-Curtis p = 0,00016), от группы III
Pseudomonas
- по всем, кроме Euclidean
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
(Bray-Curtis p = 0,000116). Отличие группы II от
группы III подкреплено восемью индексами
Персонализированная медицина, учитыва
(Bray-Curtis p = 0,00433).
ющая влияние генетических особенностей и ок
Обращает на себя внимание положение об
ружающей среды на состояние здоровья челове
разцов пациента 61 CF с самым здоровым мик
ка [30], не может не принимать во внимание еще
робиомом (наиболее удаленные точки по оси
один «весомый» комплекс генов - микробиом.
PCo3 12%). Увеличение доли фирмикутов и со
Поскольку муковисцидоз - заболевание, затра
а
б
Рис. 4. Результаты PCoA микробного разнообразия образцов взрослых пациентов с муковисцидозом. а - Образцы лаважа
верхнечелюстных пазух (13 образцов) и назофарингеальных смывов (2 образца). Красные круги - образцы пациентов с
полипами, синие круги - образцы пациентов без полипов. Подгруппа I - образцы с Burkholderia, подгруппа II - образцы
с Pseudomonas. Звездочкой отмечены образцы назофарингеальных смывов; б - все образцы от взрослых пациентов. Под
группа I - образцы с Burkholderia, подгруппа II - образцы с Achromobacter, подгруппа III - образцы с Pseudomonas
БИОХИМИЯ том 85 вып. 1 2020
ОСОБЕННОСТИ МИКРОБИОМА
11
гивающее многие органы и ткани, системный
микроорганизмов преобладающие флавобакте
подход к его лечению сложился и в детских, и во
рии отличались: у 4 CHP выявлен Capnocytophaga
взрослых Центрах муковисцидоза. Один из ком
spp., а у 5 CHP - Chryseobacterium spp.
понентов этого подхода - микробиологическая
В группе взрослых пациентов полипы отме
диагностика. Обоснованный забор образцов,
чены у 40% больных. Сопоставление филогене
выполненный под наблюдением пульмонологов
тического разнообразия микробиомов пазух но
и отоларингологов, пролонгированное наблю
са двух групп не выявило отличий между ними.
дение, учитывающее применяемую антибиоти
Полипо и полисинусотомия не оказала крат
ко и физиотерапию, питание, географию пере
косрочного влияния на состав микробиома па
мещений пациента и др. факторы, помогают в
зух носа двух прооперированных пациентов,
трактовке изменений микробиома дыхательных
возможно, длительная антибиотикотерапия при
путей пациента, что обеспечивает своевремен
соблюдении пациентом рекомендаций врача бу
ную корректировку терапии и стабилизацию
дет более эффективно воздействовать на микро
состояния больного.
бы пазух носа. В настоящее время мы можем
Включение в наблюдение верхних дыхатель
констатировать, что нарушение мукоцилиарно
ных путей способствовало выявлению еще од
го клиренса является определяющим в развитии
ного резервуара инфекции, а также содейство
инфекций пазух носа.
вало обоснованию и активному внедрению ин
Заметим, что у пациентов с хроническим ри
галяционной терапии. Морфологические изме
носинуситом, но без диагноза МВ, Biswas et al.
нения в носовой полости - полипы, снижаю
не выявили отличий между группами с полипа
щие в т.ч. эффективность ингаляций, оказались
ми и без полипов ни по филогенетическому раз
в поле зрения отоларингологов и микробиоло
нообразию микробиомов, ни по маркерам вос
гов.
паления [32].
По данным Pletcher et al., полипы носа и па
Протеобактерии, как наиболее опасные па
зух носа выявляют более чем у 40% детей с МВ
тогенные микроорганизмы, у 13 из 15 взрослых
[18]. Полипотомия в детском возрасте приводит
пациентов были обнаружены в двух отделах ды
к улучшению синоназального кровотока, что
хательных путей и совпали по генотипу. У деся
опосредованно улучшает качество жизни паци
ти пациентов протеобактерии в пазухах носа
ента, но не гарантирует от повторного появле
составили 70-100% микробиома. У троих паци
ния полипов. Пациенту 72 CF, включенному в
ентов такое изобилие протеобактерий в пазухах
наше исследование, полипотомию проводили
носа отмечено даже в период сравнительного
трижды.
благополучия в микробиоме легких. В нашей
Исследование микробного состава смывов с
выборке были выявлены Burkholderia, Pseudo'
полипов, удаленных при операции, показало,
monas и Achromobacter, их комбинации, а также
что уже в возрасте семи лет пазухи пациента с
Stenotrophomonas и E. coli в сочетании с
МВ инфицированы P. aeruginosa. В нашей не
Pseudomonas. В работе Biswas et al. снижение био
большой выборке образцов детей этот патоген
разнообразия микробиома пазух отмечали в об
ный микроорганизм встречался чаще всего.
разцах с такими протеобактериями, как Pseudo'
Настораживает также выявление грибов Auri'
monas, Haemophilus и Achromobacter [32].
culariopsis ampla в образцах близнецов. Это бази
Сопоставляя микробиомы пазух носа и лег
диомицеты семейства Schizophyllaceae. Пред
ких, отметим, что у восьми из 14 взрослых па
ставитель другого рода этого семейства,
циентов мы наблюдали существенно перекры
Schizophyllum commune, известен как возбудитель
вающиеся по составу микробиомы. Однако у
инфекций человека с 1950 г. В большинстве слу
шести пациентов в пазухах носа были выявле
чаев S. commune поражал органы дыхания: в 63%
ны отдельные микроорганизмы, отсутствую
регистрировали бронхолегочное заболевание, в
щие в легких, например, E. coli у пациента
31% - синусит [31].
72 CF. По мнению одних исследователей,
Следует отметить, что у близнецов были вы
Lucas et al., наличие патогенной бактерии в па
явлены индивидуальные отличия в микробиомах
зухах носа не является предиктором появления
дыхательных путей. Наблюдение за нижними
ее в легких [33]; по мнению других, Fothergill et al.,
дыхательными путями пациентов в течение трех
в пазухах носа Pseudomonas приобретает адап
лет позволило детектировать эти отличия еще до
тивные признаки, которые обеспечивают эф
появления в микробиоме P. aeruginosa, тогда мар
фективную колонизацию нижних дыхательных
кером микробиома одного из близнецов был
путей [34].
H. influenzae, обнаруженный теперь в пазухах. В
Таким образом, дальнейшая колонизация
последних образцах трахеальных аспиратов при
легких микроорганизмами из пазух носа являет
сходстве большинства идентифицированных
ся лишь вопросом времени, однако правильно
БИОХИМИЯ том 85 вып. 1 2020
12
ВОРОНИНА и др.
выбранная стратегия лечения может стать сдер
явлением, связанным с антибиотикорезистент
живающим фактором.
ностью патогена и примененной стратегией ле
В настоящее время с появлением таргетных
чения.
препаратов, позволяющих частично восстано
вить функцию хлорного канала, стратегию ле
Проведенное исследование показало необ
чения определяет мутация в гене CFTR. В на
ходимость контроля микробиома пазух носа па
шем исследовании показана корреляция между
циентов наряду с микробиомом легких, бóль
классом мутации и разнообразием микробного
шую информативность молекулярно генетичес
сообщества отделов респираторного тракта.
ких методов исследования по сравнению с куль
Мягкая мутация (Class V) даже в сочетании с
туральными. Подробный пролонгированный
мутацией I класса улучшала состояние микро
анализ микробиомов, в т.ч. их минорных компо
биома. Самые необычные микробиомы мы
нентов, приблизит нас к пониманию триггеров
наблюдали у пациента 67 CF с мутациями
развития инфекции.
[delta]F508/P205S (Class II/Class V). В легких у
этого пациента были обнаружены Actinobacte
ria (Rothia - 29%), Firmicutes (Lactobacillus -
Финансирование. Работа выполнена в рамках
6%, Lactococcus - 2%, Streptococcus - 37%),
Государственного задания № 056 00108 18 00 на
Proteobacteria (Pseudomonas - 1%, Xanthomona
2018 г. и на плановый период 2019 и 2020 гг. и Го
daceae - 10, Stenotrophomonas - 12%), в то время
сударственного задания № 056 00078 19 00 на
как в пазухах носа выявлены Proteobacteria
2019 г. и на плановый период 2020 и 2021 гг. для
(Pseudomonas - 2%, Xanthomonadaceae - 47%,
НИЦЭМ им. Н.Ф. Гамалеи Минздрава России.
Stenotrophomonas - 51%).
Конфликт интересов. Авторы статьи подтвер
Таким образом, наши данные поддержива
ждают отсутствие конфликта интересов в науч
ют концепцию микробной транслокации в ды
ной и финансовой сферах.
хательных путях у пациентов с МВ, однако от
Соблюдение этических норм. Информиро
вергают роль полипов в формировании состава
ванные согласия на исследование образцов бы
и разнообразия микробных сообществ респи
ли получены врачами от взрослых больных МВ,
раторного тракта. По всей видимости, опреде
пациентов старше 15 лет, а также от родителей и
ляющую роль играют индивидуальное состоя
опекунов несовершеннолетних пациентов
ние слизистого слоя и мукоцилиарного кли
младше 15 лет. Цикл исследований биологичес
ренса, а также анатомические особенности па
ких образцов пациентов, больных МВ и врож
зух носа пациентов. Отсутствие патогенных
денным пороком развития легких, был одобрен
микроорганизмов в одном из сайтов респира
комитетом по биомедицинской этике НИИЭМ
торного тракта при их наличии в другом сайте,
им. Н.Ф. Гамалеи Минздрава России (протокол
по всей видимости, можно считать временным
№ 1 от 17.05.2012).
СПИСОК ЛИТЕРАТУРЫ
1.
Woese, C.R. (2004) A new biology for a new century,
8. Salsgiver, E.L., Fink, A.K., Knapp, E.A., LiPuma, J.J.,
Microbiol. Mol. Biol. Rev., 68, 173-186, doi: 10.1128/
Olivier, K.N., Marshall, B.C., and Saiman, L. (2016)
MMBR.68.2.173 186.2004.
Changing epidemiology of the respiratory bacteriology of
2.
Stackebrandt, E., and Woese, C.R. (1984) The phylogeny
patients with cystic fibrosis, Chest,
149,
390-400,
of prokaryotes, Microbiol. Sci., 1, 117-122.
doi: 10.1378/chest.15 0676.
3.
Land, M., Hauser, L., Jun, S.R., Nookaew, I., Leuze, M.R.,
9. Dickson, R.P., Erb Downward, J.R., Martinez, F.J., and
Ahn, T.H., Karpinets, T., Lund, O., Kora, G., Wassenaar, T.,
Huffnagle, G.B. (2016) The microbiome and the respirato
Poudel, S., and Ussery, D.W. (2015) Insights from 20 years
ry tract, Annu. Rev. Physiol., 78, 481-504, doi: 10.1146/
of bacterial genome sequencing, Funct. Integr. Genomics,
annurev physiol 021115 105238.
15, 141-161, doi: 10.1007/s10142 015 0433 4.
10. Zakharkina, T., Heinzel, E., Koczulla, R.A., Greulich, T.,
4.
Olsen, G.J., Larsen, N., and Woese, C.R. (1991) The ribo
Rentz, K., Pauling, J.K., Baumbach, J., Herrmann, M.,
somal RNA database project, Nucleic Acids Res., 19 Suppl.,
Grunewald, C., Dienemann, H., von Muller, L., and
2017-2021, doi: 10.1093/nar/19.suppl.2017.
Bals, R. (2013) Analysis of the airway microbiota of
5.
healthy individuals and patients with chronic obstructive
6.
Proctor, L.M. (2011) The Human Microbiome Project in
pulmonary disease by T RFLP and clone sequencing,
2011 and beyond, Cell Host Microbe, 10, 287-291,
PLoS One,
8, e68302, doi:
10.1371/journal.pone.
doi: 10.1016/j.chom.2011.10.001.
0068302.
7.
Nichols, D.P., and Chmiel, J.F. (2015) Inflammation and
11. Воронкова А.Ю., Амелина Е.Л., Каширская Н.Ю.,
its genesis in cystic fibrosis, Pediatr. Pulmonol., 50 (Suppl.
Кондратьева Е.И., Красовский С.А., Старинова Н.И.,
40), S39-S56, doi: 10.1002/ppul.23242.
Капранов Н.И. (2019) В кн. Регистр больных муковис'
БИОХИМИЯ том 85 вып. 1 2020
ОСОБЕННОСТИ МИКРОБИОМА
13
цидозом в Российской Федерации. 2017 год (под ред. Во
the order Burkholderiales representatives in the healthcare
ронковой А.Ю.), Медпрактика М, Москва, 68 с.
units, BioMed Res. Int., 2015, 680210, doi: 10.1155/
12.
European Cystic Fibrosis Society Patient Registry. Annual
2015/680210.
23.
Воронина О.Л., Кунда М.С., Аксенова E.И., Орлова А.А.,
sites/default/files/general content images/working groups/
Чернуха М.Ю., Лунин В.Г., Амелина Е.Л., Чучалин А.Г.,
ecfs patient registry/ECFSPR_Report2016_06062018.pdf).
Гинцбург А.Л. (2013) Экспресс диагностика микроор
13.
Einarsson, G.G., Zhao, J., LiPuma, J.J., Downey, D.G.,
ганизмов, поражающих дыхательные пути больных
Tunney, M.M., and Elborn, J.S. (2019) Community analy
муковисцидозом, Клиническая лабораторная диагнос'
sis and co occurrence patterns in airway microbial com
тика, 11, 53-57.
munities during health and disease, ERJ Open Res., 5,
24.
Curran, B., Jonas, D., Grundmann, H., Pitt, T., and
00128 2017, doi: 10.1183/23120541.00128 2017.
Dowson, C.G. (2004) Development of a multilocus
14.
Caverly, L.J., and LiPuma, J.J. (2018) Cystic fibrosis respi
sequence typing scheme for the opportunistic pathogen
ratory microbiota: unraveling complexity to inform clinical
Pseudomonas aeruginosa, J. Clin. Microbiol.,
42,
practice, Exp. Rev. Respir. Med.,
12,
857-865,
5644-5649, doi: 10.1128/JCM.42.12.5644 5649.2004.
doi: 10.1080/17476348.2018.1513331.
25.
Воронина О.Л., Рыжова Н.Н., Кунда М.С., Аксенова Е.И.,
15.
Isles, A., Maclusky, I., Corey, M., Gold, R., Prober, C.,
Овчинников Р.С., Федосова Н.Ф., Амелина Е.Л., Лу
Fleming, P., and Levison, H. (1984) Pseudomonas cepacia
нин В.Г., Чучалин А.Г., Гинцбург А.Л. (2015) Разработ
infection in cystic fibrosis: an emerging problem,
ка подходов к идентификации возбудителей микозов
J. Pediatr.,
104,
206-210, doi:
10.1016/s0022
легких у больных муковисцидозом непосредственно в
3476(84)80993 2.
клинических образцах из респираторного тракта, Ла'
16.
Lobo, L.J., Tulu, Z., Aris, R.M., and Noone, P.G. (2015)
бораторная служба, 4, 11-17.
Pan resistant Achromobacter xylosoxidans and Stenotro'
26.
Chen, J., Bittinger, K., Charlson, E.S., Hoffmann, C.,
phomonas maltophilia infection in cystic fibrosis does not
Lewis, J., Wu, G.D., Collman, R.G., Bushman, F.D., and
reduce survival after lung transplantation, Transplantation,
Li, H. (2012) Associating microbiome composition with
99, 2196-2202, doi: 10.1097/TP.0000000000000709.
environmental covariates using generalized UniFrac dis
17.
Voronina, O., Ryzhova, N., Kunda, M., Sharapova, N.,
tances, Bioinformatics, 28, 2106-2113, doi: 10.1093/bioin
Aksenova, E., Amelina, E., Shumkova, G., Simonova, O.,
formatics/bts342.
Egorov, M., Kondratyeva, E., Chuchalin, A., and
27.
Консенсус по клиническим эффектам генетических
Gintsburg, A. (2018) Changes in airways bacterial commu
вариантов МГНЦ, Leiden Open Variation Database, v.3.0
nity with cystic fibrosis patients’ age and lung function
decline. 41st European Cystic Fibrosis Conference,
28.
Clustering and classification methods for biologists.
J. Cystic Fibrosis, 17 (Suppl. 3), S78, doi: 10.1016/S1569
Manchester
Metropolitan
University
(URL:
1993(18)30366 7.
18.
Pletcher, S.D., Goldberg, A.N., and Cope, E.K. (2019)
29.
Anderson, M.J. (2001) A new method for non parametric
Loss of microbial niche specificity between the upper and
multivariate analysis of variance, Austral. Ecology, 26,
lower airways in patients with cystic fibrosis, Laryngoscope,
32-46, doi: 10.1111/j.1442 9993.2001.01070.pp.x.
129, 544-550, doi: 10.1002/lary.27454.
30.
Ginsburg, G.S., and Willard, H.F. (2009) Genomic and
19.
Рыжова Н.Н., Воронина О.Л., Лосева Э.В., Аксенова Е.И.,
personalized medicine: foundations and applications,
Кунда М.С., Шарапова Н.Е., Шерман В.Д., Гинцбург А.Л.
Transl. Res., 154, 277-287, doi: 10.1016/j.trsl.2009.09.005.
(2019) Микробиом респираторного тракта детей с му
31.
Chowdhary, A., Randhawa, H.S., Gaur, S.N., Agarwal, K.,
ковисцидозом, Сибирское медицинское обозрение, 2,
Kathuria, S., Roy, P., Klaassen, C.H., and Meis, J.F.
19-28, doi: 10.20333/2500136 2019 2 19 28.
(2013) Schizophyllum commune as an emerging fungal
20.
Воронина О.Л., Рыжова Н.Н., Кунда М.С., Аксенова Е.И.,
pathogen: a review and report of two cases, Mycoses, 56,
Шарапова Н.Е., Амелина Е.Л., Лазарева А.В., Черне
1-10, doi: 10.1111/j.1439 0507.2012.02190.x.
вич В.П., Симонова О.И., Жуховицкий В.Г., Жилина С.В.,
32.
Biswas, K., Cavubati, R., Gunaratna, S., Hoggard, M.,
Семыкин С.Ю., Поликарпова С.В., Ашерова И.К.,
Waldvogel Thurlow, S., Hong, J., Chang, K., Wagner
Орлов А.В., Кондратенко О.В. (2019) Основные тен
Mackenzie, B., Taylor, M.W., and Douglas, R.G. (2019)
денции в изменении разнообразия буркхолдерий, ин
Comparison of subtyping approaches and the underlying
фицирующих российских больных муковисцидозом,
drivers of microbial signatures for chronic rhinosinusitis,
Сибирское медицинское обозрение, 2, 80-88, doi: 10.20333/
mSphere, 4, e00679 18, doi: 10.1128/mSphere.00679 18.
2500136 2019 2 80 88.
33.
Lucas, S.K., Yang, R., Dunitz, J.M., Boyer, H.C., and
21.
Voronina, O.L., Kunda, M.S., Ryzhova, N.N., Aksenova, E.I.,
Hunter, R.C. (2018) 16S rRNA gene sequencing reveals
Sharapova, N.E., Semenov, A.N., Amelina, E.L.,
site specific signatures of the upper and lower airways of
Chuchalin, A.G., and Gintsburg, A.L.
(2018) On
cystic fibrosis patients, J. Cyst. Fibros., 17, 204-212,
Burkholderiales order microorganisms and cystic fibrosis
doi: 10.1016/j.jcf.2017.08.007.
in Russia, BMC Genomics, 19 (Suppl. 3), 74, doi: 10.1186/
34.
Fothergill, J.L., Neill, D.R., Loman, N., Winstanley, C.,
s12864 018 4472 9.
and Kadioglu, A. (2014) Pseudomonas aeruginosa adapta
22.
Voronina, O.L., Kunda, M.S., Ryzhova, N.N., Aksenova, E.I.,
tion in the nasopharyngeal reservoir leads to migration and
Semenov, A.N., Lasareva, A.V., Amelina, E.L., Chuchalin, A.G.,
persistence in the lungs, Nat. Commun.,
5,
4780,
Lunin, V.G., and Gintsburg. A.L. (2015) The variability of
doi: 10.1038/ncomms5780.
БИОХИМИЯ том 85 вып. 1 2020
14
ВОРОНИНА и др.
CHARACTERISTICS OF THE AIRWAY MICROBIOME
OF CYSTIC FIBROSIS PATIENTS*
O. L. Voronina1**,***, N. N. Ryzhova1, M. S. Kunda1, E. V. Loseva1, E. I. Aksenova1,
E. L. Amelina2, G. L. Shumkova2, O. I. Simonova3, and A. L. Gintsburg1
1 Gamaleya National Research Center for Epidemiology and Microbiology,
Ministry of Health of Russia, 123098 Moscow, Russia; E'mail: olv550@gmail.com
2 Pulmonology Research Institute, Federal Medical'Biological Agency, 115682 Moscow, Russia
3 National Medical Research Center for Children’s Health, Ministry of Health of Russia, 119296 Moscow, Russia
Received June 4, 2019
Revised July 29, 2019
Accepted September 10, 2019
Microbiota as an integral component of human body is actively investigated, including by massively parallel sequenc
ing. However, microbiomes of lungs and sinuses have become the object of scientific attention only in the last decade.
For patients with cystic fibrosis, monitoring the state of respiratory tract microorganisms is essential for maintaining
lung function. Here, we studied the role of sinuses and polyps in the formation of respiratory tract microbiome. We
identified Proteobacteria in the sinuses and samples from the lower respiratory tract (even in childhood). In some
cases, they were accompanied by potentially dangerous basidiomycetes. The presence of polyps did not affect forma
tion of the sinus microbiome. Proteobacteria are decisive in reducing the biodiversity of lung and sinus microbiomes,
which correlated with the worsening of the lung function indicators. Soft mutations in the CFTR gene contribute to
the formation of safer microbiome even in heterozygotes with class I mutations.
Keywords: microbiome, cystic fibrosis, airway, chronic rhinosinusitis, Proteobacteria
БИОХИМИЯ том 85 вып. 1 2020