БИОХИМИЯ, 2020, том 85, вып. 1, с. 15 - 33
УДК 611.018.2
БИОХИМИЧЕСКАЯ РЕГУЛЯЦИЯ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ
ФАКТОРАМИ РОСТА И ЦИТОКИНАМИ:
ОСНОВНЫЕ МЕХАНИЗМЫ И ЗНАЧИМОСТЬ
ДЛЯ РЕГЕНЕРАТИВНОЙ МЕДИЦИНЫ*
Обзор
© 2020
П.И. Макаревич1,2**, А.Ю. Ефименко1,2, В.А. Ткачук1,2,3***
1 Московский государственный университет им. М.В. Ломоносова, Институт регенеративной медицины,
Медицинский научно!образовательный центр, 119991 Москва, Россия;
электронная почта: pmakarevich@mc.msu.ru
2 Московский государственный университет им. М.В. Ломоносова,
факультет фундаментальной медицины, 119991 Москва, Россия
3 Институт экспериментальной кардиологии,
НМИЦ кардиологии Минздрава России, 121552 Москва, Россия
Поступила в редакцию 15.06.2019
После доработки 30.09.2019
Принята к публикации 16.10.2019
Сформировавшаяся в конце ХХ века регенеративная медицина использует культивированные клетки или
тканеинженерные конструкции для трансплантации в организм человека с целью восстановления утрачен!
ных или поврежденных органов. Однако достигнутые в этом направлении практические успехи оказались да!
леки от многообещающих результатов, полученных в экспериментах. В поисках новых путей развития этой
области стало очевидно, что успешное решение практических задач невозможно в отрыве от изучения фун!
даментальных принципов регуляции развития, обновления и восстановления тканей человека. Эти процес!
сы успешно исследовались клеточными биологами, физиологами и биохимиками в рамках смежного на!
правления, которое часто называют «регенеративной биологией». Было показано, что в ходе регенерации
факторы роста, цитокины и гормоны регулируют не отдельные функции клеток, а, действуя через специфи!
ческие системы рецепции, регулируют важные для восстановления ткани процессы - пролиферацию и диф!
ференцировку клеток. Эти события требуют скоординированных стимулов и поэтому практически невосп!
роизводимы с помощью одиночных белков или низкомолекулярных соединений, т.е. плохо управляемы с
помощью подходов классической фармакологии. Данный обзор суммирует актуальные представления о би!
охимических и клеточных механизмах регуляции обновления и регенерации тканей человека, обращая вни!
мание на некоторые общебиологические и эволюционные аспекты в этой области. Особое внимание в нем
уделяется биохимическим механизмам регуляции, в частности, роли факторов роста и цитокинов, а также
механизмам рецепции этих молекул. В отдельном разделе затронуты перспективные практические подходы
для активации регенерации с помощью малых молекул или секретома стволовых клеток, который содержит
широкий репертуар факторов роста, цитокинов, пептидов, а также внеклеточные везикулы.
КЛЮЧЕВЫЕ СЛОВА: регенеративная медицина, стволовая клетка, фактор роста, цитокин, внутриклеточ!
ная сигнализация, рецепторная тирозиновая киназа.
DOI: 10.31857/S0320972520010029
В живых системах регенерация идет на всех
клетки [1]. Постоянная регенерация обеспечи!
уровнях - синтезируются и разрушаются моле!
вает физиологическое обновление, поддерживаю!
кулы, обновляются и восстанавливаются после
щее соответствие организма структуре, вырабо!
повреждения ткани, гибнут и появляются новые
танной в ходе эволюции, а обновление на моле!
Принятые сокращения: ГТ - генная терапия; МСК - мезенхимные стромальные клетки; РТК - рецепторные ти!
розиновые киназы; СК - стволовые клетки; PDGF - тромбоцитарный фактор роста; ФР - факторы роста; FGF - фак!
тор роста фибробластов; PDGF, VEGF, EGF, IGF!1 - тромбоцитарный, эндотелиальный, эпидермальный и инсулинопо!
добный факторы роста соответственно; HGF - фактор роста гепатоцитов.
* Статья посвящается 80!летию кафедры биохимии биологического факультета МГУ им. М.В. Ломоносова (см. том 84,
вып. 11, 2019).
** Адресат для корреспонденции.
*** Автор является выпускником кафедры биохимии биологического факультета МГУ им. М.В. Ломоносова.
15
16
МАКАРЕВИЧ и др.
кулярном уровне необходимо для устойчивых
дили с середины XIX века. Идея о том, что рас!
взаимодействий внутри ткани и регуляции иду!
шифровка механизмов регенерации у видов, ко!
щих в ней процессов.
торые к ней способны, поможет понять, как за!
Человек по своей способности к репаратив!
пустить аналогичный процесс у человека, вы!
ной регенерации (т.е. регенерации после повреж!
глядела совершенно логичной [7] и позволила,
дения) значительно уступает другим многокле!
используя удачные объекты из животного мира,
точным организмам, однако процессы идущего в
установить клеточные, молекулярные и, позд!
течение жизни обновления тканей имеют впечат!
нее, генетические основы этого феномена. При
ляющие масштабы. Практически все клетки су!
этом исследование позвоночных с выдающими!
ществуют определенный отрезок времени, по ис!
ся регенеративными возможностями позволило
течении которого происходит их программируе!
хорошо ответить на вопрос «как?», но не давало
мая гибель, после чего погибшая клетка ограни!
ответа на второй важный вопрос: «Почему неко!
ченное количество раз замещается вновь образо!
торые виды лишены этих способностей?» [8].
ванной клеткой такого же типа. Этот цикл явля!
Ответ на него может быть найден в сравни!
ется основой тканевого гомеостаза, т.е. постоян!
тельных исследованиях двух близкородствен!
ства клеточного состава ткани [2, 3]. Ежедневно у
ных видов, один из которых способен регенери!
взрослого человека обновляется ~1% зрелых
ровать конечность или орган (вид А), а второй
эритроцитов, т.е. за сутки разрушается 1011 крас!
залечивает ранение с образованием культи или
ных клеток крови и столько же появляется за счет
рубца (вид Б). Их сравнение позволило бы не
того, что из костного мозга каждую секунду вы!
только понять, что движет регенерацией вида А,
ходит 2-3 млн новых эритроцитов [4]. Постоян!
но и разобраться в том, что блокирует ее у вида
ное обновление с разной скоростью идет в коже,
Б, например, какая регуляторная система или
жировой ткани, во всех паренхиматозных и по!
сигнальная ось была утрачена или кардинально
лых органах, сердечно!сосудистой и нервной
изменилась в ходе расхождения этих таксонов.
системах. Можно сказать, что гибель и появле!
Эта идея была частично реализована в рабо!
ние новых клеток формируют подобие прямой и
тах по изучению заживления ран у млекопитаю!
обратной реакций с константами, меняющимися
щих на этапе эмбриона, которому присуща пол!
в разные периоды жизни организма, а также при
ная регенерация, притом что для взрослой осо!
его повреждении или болезни [5].
би этого же вида характерно рубцевание в зоне
В этом отношении читателю может оказать!
повреждения [9, 10]. Эти исследования внесли
ся интересен классический труд Richard J. Goss
большой вклад в понимание возможностей ре!
«Principles of regeneration» («Принципы регене!
генерации у млекопитающих, однако их объеди!
рации»), в котором он удачно заметил: «Если бы
няет и общий изъян. На стадии эмбриона или
не было регенерации, то не стало бы живого. Но
плода организм характеризуется неполным раз!
если бы все живое регенерировало, то не было
витием тканей и органов, специфическим гемо!
бы смерти. Все многоклеточные организмы по!
поэзом и незрелой иммунной системой, а также
стоянно “живут” и “умирают”, совмещая в себе
находится в водной среде в гипоксическом со!
эти две крайности» [1].
стоянии [11, 12].
Не менее удачной является еще одна анало!
В утробе клетки и ДНК плода защищены от
гия, приведенная David L. Stocum: «Регенерация
повреждающего действия активных форм кис!
позволяет живой системе ограниченное время
лорода и излучения, а рождение на свет по
противостоять разрушительному воздействию
масштабам перестройки организма в какой!то
второго закона термодинамики, сохраняя свою
степени можно сравнить с выходом первых жи!
целостность. В этой борьбе индивидуум обречен
вотных из воды на сушу. С той разницей, что на
на поражение, но за время жизни он позволяет
адаптацию у новорожденного уходят не милли!
виду выйти из нее победителем, дав начало по!
оны лет, а несколько первых дней жизни. В этот
томству» [6].
момент организм из!за контакта с атмосферным
Выше мы упомянули, что млекопитающие
уровнем кислорода испытывает колоссальный
по своим способностям к репаративной регене!
стресс, адаптируясь к новому уровню оксигена!
рации уступают другим позвоночным, например
ции тканей [13, 14]. В первую неделю жизни это
хвостатым амфибиям или рыбам, способным к
приводит к шквалу эпигенетических модифика!
многократному «отращиванию» конечностей и
ций, влияющих на экспрессию сотен генов, ко!
даже внутренних органов.
дирующих белки и регуляторные малые РНК
Глядя на эти примеры, исторически первым
[15, 16]. У человека и других сухопутных млеко!
возникал вопрос: «Как они это делают?». Ответ
питающих это считается одной из предпосылок
на него дали фундаментальные работы по изуче!
резкого падения регенеративных способностей
нию регенерации у животных, которые прово!
в первые несколько дней жизни [16]. По этим
БИОХИМИЯ том 85 вып. 1 2020
БИОХИМИЧЕСКАЯ РЕГУЛЯЦИЯ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ
17
причинам в настоящее время высказывают
У человека репаративная регенерация воз!
обоснованные сомнения в том, что сравнение
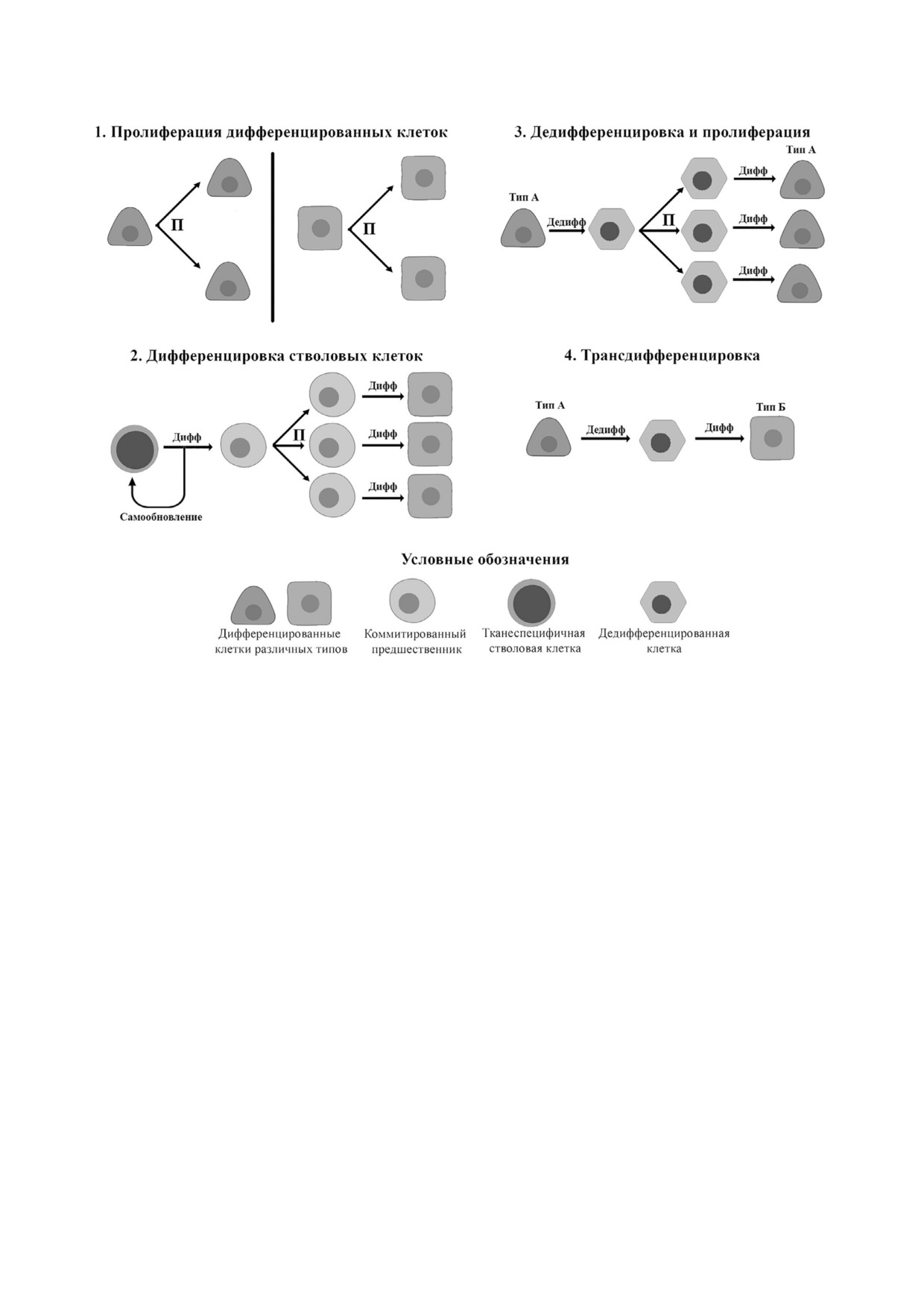
можна за счет нескольких механизмов (рис. 1).
регенерации эмбриона и взрослой особи релевант!
Дифференцировка постнатальных стволовых
но и позволит достичь прорывных результатов в
клеток (СК). После рождения в большинстве
этой области.
тканей сохраняется и поддерживается пул тка!
неспецифичных (резидентных) СК. Они спо!
собны к самообновлению (делению без потери
РЕПАРАТИВНАЯ РЕГЕНЕРАЦИЯ
недифференцированного состояния), а также к
У ЧЕЛОВЕКА, ЕЕ ПРИРОДА
дифференцировке в определенные типы клеток
И ОСНОВНЫЕ КЛЕТОЧНЫЕ МЕХАНИЗМЫ
[20]. При физиологическом обновлении тканей
они вместе с мезенхимными стромальными
Происхождение регенеративных способнос!
клетками (МСК) обеспечивают тканевой гоме!
тей у вида всегда рассматривалось с двух эволю!
остаз, а в случае повреждения становятся клю!
ционных позиций. Первая предполагает, что ре!
чевым участником процесса регенерации [21].
генерация конечностей и органов носит при!
Упомянутым выше МСК отводят роль клеток,
способительный характер, и отдельные виды
которые отвечают за поддержание СК [22],
выработали эту способность. Для закрепления
участвуя в формировании микроокружения, на!
способности к регенерации необходимо соответ!
зываемого «нишей» [21].
ствующее давление отбора - атаки естествен!
Пролиферация дифференцированных клеток.
ных врагов и повреждения, в которых в природе
Деление клеток организма считалось основным
нет недостатка. Однако в дикой природе особь,
механизмом регенерации со времен формули!
потерявшая часть тела, выживает с очень низ!
ровки положений классической клеточной тео!
кой вероятностью. Даже если принять, что спо!
рии [23]. Позднее выяснилось, что пролифера!
собности отращивать плавники у рыб или хвост
тивный потенциал активно обновляющихся
у ящерицы сформировались как приспособле!
тканей (слизистых оболочек, печени, кожи) мо!
ние после нападений естественных врагов, то
жет быть недостаточен для поддержания посто!
сложнее будет таким же образом утверждать о
янства структуры из!за предела Хейфлика и
приспособительном происхождении регенера!
снижения пролиферативной способности кле!
ции сердца, поджелудочной железы или печени.
ток с возрастом [24, 25]. Более того, многократ!
Травма этих органов почти всегда фатальна для
ная пролиферация сопровождается накоплени!
особи, что едва ли позволит закрепиться любо!
ем «поломок» и сдвигами дифференцировочно!
му новому признаку [17]. Более реалистичной и
го состояния, которые лежат в основе развития
принятой в настоящее время представляется
дегенеративных заболеваний и опухолей [26].
точка зрения на регенерацию как на «остаточ!
Таким образом, пролиферация играет важную
ную» характеристику, т.е. своеобразную рефлек!
роль в регенерации, однако ее возможности на
сию внутриутробного развития, способность к
длительном промежутке времени выглядят ог!
которой в ходе эволюции была, например, утра!
раниченными.
чена млекопитающими, однако сохранилась у
Транзиторная дедифференцировка. В тканях с
амфибий и пресмыкающихся [18].
низкой пластичностью при регенерации часть
В конце ХХ века многие открытия, сделан!
новых клеток появляется по механизму транзи!
ные в регенеративной биологии, заложили базу
торной дедифференцировки. В ходе этого про!
для формирования нового направления - реге!
цесса зрелая материнская клетка дает начало до!
неративной медицины. Однако затем ее форми!
черним клеткам с такими же фенотипом и
рование происходило в отрыве от классических
функцией, проходя через стадию дедифферен!
направлений биологии, из!за чего произошел
цированной формы, обладающей пластич!
определенный сдвиг в сторону ускорения транс!
ностью. При повреждении клетка подвергается
ляционных исследований без достаточного вни!
эпигенетическим модификациям, в результате
мания к фундаментальным основам регенера!
которых возможен ее временный возврат в ме!
ции и развития организма. Большая часть ис!
нее специализированное состояние, в котором
пользуемых методов запуска регенерации у че!
она способна к делению с последующей редиф!
ловека основана на трансплантации культиви!
ференцировкой для замещения утраченных кле!
рованных клеток или тканеинженерных
ток [27]. В организме человека так идет регене!
конструкций [19]. При этом акцент в последние
рация некоторых экзокринных желез, напри!
десятилетия был сделан на прикладных и техно!
мер, слюнной и поджелудочной [28, 29].
логических решениях без должного внимания к
Прямая трансдифференцировка. Данный ме!
базовым принципам функционирования сис!
ханизм заключается в конверсии зрелой клетки
тем, контролирующих регенерацию у человека.
одного типа в другой без возвращения в низко!
2 БИОХИМИЯ том 85 вып. 1 2020
18
МАКАРЕВИЧ и др.
Рис. 1. Основные механизмы репаративной регенерации у человека. Пояснения к рисунку даны в тексте. Условные
обозначения: П - пролиферация; Дедифф - дедифференцировка; Дифф - дифференцировка
дифференцированные состояния, сопровождаю!
РЕГУЛЯЦИЯ ОБНОВЛЕНИЯ
щиеся сильными изменениями потентности.
И РЕГЕНЕРАЦИИ У ЧЕЛОВЕКА
Перепрограммирование осуществляется при ак!
тивации специфических факторов транскрип!
Нейроэндокринная регуляция обновления и
ции, как правило, экспрессирующихся в ходе
регенерации. Управление функциями всех клеток
эмбриогенеза (Oct!4, Klf!4, Nanog и др.), а так!
организма осуществляется интегральной нейро!
же под контролем регуляторных (микро! и
эндокринной системой, объединяющей регуля!
длинных некодирующих) РНК [30]. Это позво!
цию за счет нейромедиаторов и гормонов, кото!
ляет клетке миновать опасное с точки зрения
рые различаются скоростью ответа на стимулы и
канцерогенеза состояние плюрипотентности и
его продолжительностью. Нервная система ха!
превратиться в другую специализированную
рактеризуется быстрым, почти молниеносным,
клетку [31]. Показано, что в организме человека
ответом, следующим за выбросом в синаптичес!
регенерация с прямой трансдифференцировкой
кую щель нейромедиаторов (ацетилхолина, серо!
идет после повреждения островков Лангерганса
тонина, норадреналина и др.). Их рецепторы по!
[32, 33] и желчных протоков печени [34, 35].
лучили название ионотропных и представляют
Процессы регенерации и репарации идут
собой лиганд!зависимые трансмембранные ион!
длительно и регулируются гормонами, фактора!
ные каналы [39, 40]. Активация таких каналов
ми роста (ФР), цитокинами, РНК различных
приводит к изменению поляризации мембраны,
классов и др. [36-38]. Рассмотрим подробнее
а эффекты запускаются и гасятся за доли секун!
регуляторные системы, влияющие на процессы
ды, что создает оперативный способ регуляции,
регенерации и обновления ткани, а также ряд их
лежащий в основе многих рефлекторных реак!
особенностей важных с точки зрения биохимии
ций (в том числе необходимых для выживания в
и медицины.
критических ситуациях) [41].
БИОХИМИЯ том 85 вып. 1 2020
БИОХИМИЧЕСКАЯ РЕГУЛЯЦИЯ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ
19
Более длительными отрезками времени (ми!
ром, в комплексе с которым транслоцируются в
нуты, часы) измеряются эффекты гормонов. Их
ядро. Там комплекс «гормон-рецептор» спосо!
рецепторами являются белки, расположенные
бен связываться с хроматином и регулировать
как на мембране клетки, так и внутриклеточно:
экспрессию генов, приводя к масштабным из!
в цитоплазме, на мембранах органелл и в ядре.
менениям фенотипа клетки, которые сохраня!
Гормональная регуляция не является системой
ются длительное время [47, 48].
«включения/выключения»: ее принцип работы
При изучении механизмов гормональной ре!
скорее напоминает реостат. Регуляция обеспе!
гуляции на уровне одиночных клеток нами было
чивается наличием на мембране клетки не!
показано, что гормональные сигналы критичес!
скольких типов рецептора к одному и тому же
ки важны для функционирования МСК, кон!
гормону (рис. 2, а). Примером является адре!
тролирующих тканевой гомеостаз и регенера!
нергическая рецепция, когда на одной клетке
цию при повреждении [49-51]. Мы обнаружи!
одновременно имеются трансмембранные β! и
ли, что большинство МСК экспрессируют ши!
α!адренорецепторы, сопряженные с Gs! и Gi!
рокий репертуар рецепторов к гормонам и ней!
белками, разнонаправленно регулирующими
ромедиаторам. При этом среди общей популя!
активность аденилатциклазы и содержание
ции только небольшая доля клеток (~5-7%)
внутриклеточного Ca2+ [42].
способна отвечать на тот или иной гормон акти!
Известно, что процессы миграции, синтез и
вацией Са2+ сигнализации, т.е. содержит необ!
распад жирных кислот, полисахаридов и др. яв!
ходимые компоненты внутриклеточной систе!
ляются Ca2+!зависимыми. Эти процессы не мо!
мы проведения сигнала. Более того, как стало
гут идти по принципу «все или ничего», и меха!
известно, однократное воздействие гормона
низм их регуляции зависит не от перепада кон!
приводит к резкому росту доли клеток, способ!
центрации Ca2+ в цитоплазме, который имеет
ных к ответу на него же при повторном действии
достаточно узкий интервал, а от частоты осцил!
[51]. Это послужило основанием для предполо!
ляции Ca2+, которая варьирует в широком диа!
жения о «триггерной роли» популяции МСК,
пазоне. Такая система обеспечивает плавную,
имеющих функционирующую систему рецеп!
ступенчатую регуляцию Ca2+!зависимых про!
ции гормона. Вероятно, в ответ на действие гор!
цессов в клетке [43].
мона чувствительные к нему клетки продуциру!
Таким образом, гормоны, в отличие от ней!
ют факторы, действующие на окружающие
ромедиаторов, действуют не на поляризацию
МСК и увеличивающие их чувствительность к
мембраны, а через свои рецепторы активируют
этому агонисту. В клетках!мишенях это может
систему внутриклеточных вторичных посредни!
обеспечиваться как увеличением плотности ре!
ков (цАМФ, цГМФ, ДАГ, Ca2+ и др.). Вторичные
цептора на мембране, так и ростом экспрессии
посредники передают сигнал внутрь клетки, за!
генов, кодирующих белки внутриклеточной
пуская каскад химических модификаций белков
сигнальной системы.
(фосфорилирование, рибозилирование, ацети!
Мы также обнаружили, что однократная
лирование и др.) [44], и управляют метаболичес!
стимуляция β!адренорецепторов вызывает в
кими процессами, что служит поводом отнести
МСК переключение с цАМФ!зависимого на
сами рецепторы гормонов к метаботропным.
Ca2+!зависимый путь передачи сигнала, т.е. про!
Особенностью такой рецепции является фе!
исходит не десенситизация из!за избыточной
номен десенситизации, направленный на защи!
активации рецептора, а отложенное во времени
ту клетки от слишком продолжительного
переключение сигнализации на каскад, исходно
действия гормона. Если гормон находится на
связанный с активацией α1!адренорецептора.
рецепторе длительное время (более 8-10 мин),
Это явление представляет собой т.н. гетерологи!
то происходит фосфорилирование рецептора
ческую сенситизацию - уникальный механизм
лиганд!зависимой протеинкиназой, что приво!
регуляции гормональной чувствительности,
дит к снижению сродства рецептора к гормону
присущий МСК [50, 52].
[45]. При очень длительной (часами) стимуля!
Наконец, мы установили, что чувствитель!
ции рецептора запускается процесс эндоцитоза,
ность стволовых клеток к некоторым гормонам
приводящий к даунрегуляции, вплоть до дегра!
сопряжена с гетерогенностью их дифференциро!
дации рецептора в лизосоме [46]. Это ограничи!
вочного потенциала. В частности, у МСК из жи!
вает период влияния гормонов на клетку мину!
ровой ткани была обнаружена экспрессия всех
тами, реже часами.
компонентов ренин!ангиотензин!альдостероно!
Более продолжительными могут быть эф!
вой системы (РААС), причем экспрессия рецеп!
фекты липофильных стероидных и тиреоидных
торов 2!го типа (АТ2) к ангиотензину!II характе!
гормонов, которые проникают в цитоплазму и
ризовала субпопуляцию МСК с повышенной
взаимодействуют с внутриклеточным рецепто!
способностью к дифференцировке в адипоциты.
БИОХИМИЯ том 85 вып. 1 2020
2*
20
МАКАРЕВИЧ и др.
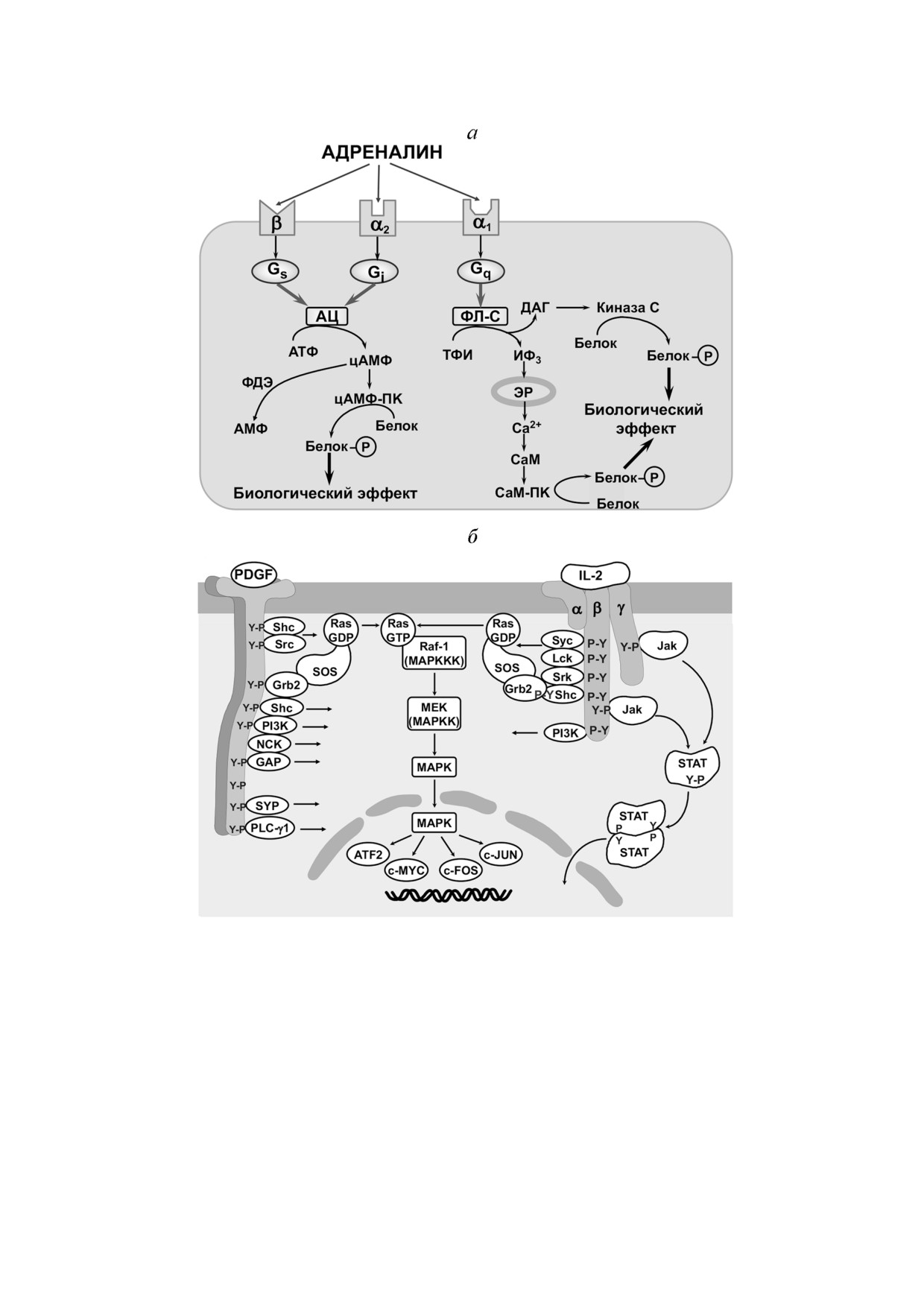
Рис. 2. Примеры сигнальных каскадов, запускаемых при активации рецепторов гормонов, факторов роста и интерлейки!
нов. а - Гормон может активировать различные сигнальные системы в зависимости от типа рецептора. Агонист (адрена!
лин) может активировать один из трех типов рецепторов и передавать сигнал внутрь клетки с помощью разных G!белков,
аденилатциклазной системы и фосфоинозитидного обмена. Условные обозначения: АЦ - аденилатциклаза; ФЛ!С - фос!
фолипаза С; ТФИ - трифосфоинозитид; цАМФ - циклический анденозинмонофосфат; ИФ3 - инозитол!1,4,5!трифос!
фат; ЭР - эндоплазматический ретикулум; ДАГ - диацилглицерин; СаМ - кальмодулин; ПК - протеинкиназа; ФДЭ -
фосфодиэстераза. б - Активация рецепторов факторов роста и цитокинов приводит к лиганд!зависимой олигомеризации
и аутофосфорилированию по остаткам тирозина. Фосфотирозины являются сайтами связывания адаптерных белков и
сигнальных молекул, в результате чего собирается сигнальный комплекс, осуществляющий передачу сигнала без участия
вторичных посредников. Условные обозначения: Y!P - фосфотирозин; АТF!2, C!MYC, c!FOS, c!JUN - факторы тран!
скрипции; MAPK - митоген!активируемая протеинкиназа; STAT - активатор транскрипции челночного типа; Jak -
Янус!киназа; α, β, γ - субъединицы рецептора цитокина; IL!2 - интерлейкин!2; PDGF - тромбоцитарный фактор рос!
та. Адаптировано из учебника В.А. Ткачука и соавт. «Основы молекулярной эндокринологии: рецепция и внутриклеточ!
ная сигнализация» [41]
БИОХИМИЯ том 85 вып. 1 2020
БИОХИМИЧЕСКАЯ РЕГУЛЯЦИЯ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ
21
Эти же клетки способны продуцировать ангио!
[56, 57], которое дает начало сигнальному каска!
тензин!II, который действует, вероятно, по ауто!
ду (рис. 2, б).
кринному механизму, что приводит к мобилиза!
Следует отметить, что некоторые РТК спо!
ции внутриклеточного Сa2+. При этом мы наблю!
собны к спонтанной димеризации в отсутствие
дали рост экспрессии мастер!генов адипогене!
связывания с ФР. Например, IR и IGF!1R
за - PPAR!γ и адипонектина [49] с последующей
экспрессируются на поверхность клетки уже в
адипогенной дифференцировкой МСК.
виде (αβ)2 димеров, связанных дисульфидными
Приведенные примеры иллюстрируют меха!
связями, однако тирозинкиназную активность
низмы участия нейроэндокринной системы и
они проявляют только после активации своими
убедительно показывают ее важность для опера!
лигандами. Аналогично ведут себя EGFR, Tie!2
тивной регуляции миграции и чувствительности
(рецептор ангиопоэтинов) и ряд рецепторов эф!
одиночной клетки в момент времени. Однако
ринов, причем для них описано формирование
продолжительность эффектов нейромедиаторов
очень крупных олигомеров из нескольких де!
и гормонов намного короче периода, необходи!
сятков РТК [58]. Некоторые авторы предполага!
мого для воссоздания структуры при репаратив!
ют, что такая олигомеризация необходима для
ной регенерации, занимающей несколько суток
регуляции передачи сигнала после связывания с
или недель. Еще одним фактором, ограничиваю!
соответствующим лигандом [59].
щим роль гормональной регуляции на всем про!
При активации РТК ответ отличается специ!
тяжении регенеративного процесса, является
фичностью в зависимости от фосфорилируемо!
динамичное изменение чувствительности кле!
го остатка тирозина, а также многочисленными
ток: это касается как десенситизации под влия!
точками амплификации сигнала, обеспечиваю!
нием агонистов рецепторов, так и упомянутых
щими кооперативность действия нескольких
выше переключений сигнализации.
ФР и цитокинов или «перехват» сигнала [56, 60].
Факторы роста и цитокины - регуляторы обC
Специфичность эффектов, вызываемых фосфо!
новления и регенерации с уникальным механизмом
рилированием конкретного остатка тирозина,
рецепции. Еще в 70!х годах ХХ века было показа!
обеспечивает плеотропный характер рецепции,
но, что после воздействия ФР и цитокинов их
т.е. возможность запуска разных сигнальных пу!
эффекты на миграцию и дифференцировку кле!
тей от одного рецептора (рис. 2, б). Остаток ти!
ток сохраняются очень долгое время - часы и да!
розина, фосфорилируемого в составе внутри!
же дни. Это позволило предположить, что после
клеточной части рецептора, определяет связы!
однократной стимуляции этими белками клетки
вание с конкретной сигнальной молекулой и ак!
секретируют другие аутокринные факторы, сти!
тивацию сигнального пути. При этом РТК мо!
мулирующие подвижность и дифференцировку
жет как напрямую запускать определенный кас!
[53, 54]. Также для ФР и цитокинов был описан
кад, так и выступать в роли адаптерного белка,
мощный митогенный эффект, которым не обла!
необходимого для сборки сигнальных комплек!
дали известные гормоны и который не блокиро!
сов. Сигнал через каскад внутриклеточных ки!
вали существующие антагонисты метаботроп!
наз достигает ядра, где активирует факторы
ных рецепторов, что позволило предположить
транскрипции и контролирует экспрессию ге!
наличие иных сигнальных путей, активируемых
нов, клеточный цикл, выживаемость и диффе!
этими лигандами [55].
ренцировку клетки [61].
Чувствительность клетки к ФР и цитокинам
Длительное действие ФР обеспечивается
обеспечивается особой группой трансмембран!
возможностью многократного запуска сигнали!
ных белков, одновременно обладающих функ!
зации при повторной лиганд!зависимой сборке
циями рецептора и фермента. Всего известно
олигомерного комплекса РТК. Существующие
~60 таких белков, получивших название рецеп!
механизмы эндоцитоза РТК могут уменьшать
торных тирозиновых киназ (РТК). Среди них
чувствительность клетки к ФР и цитокинам
выделяют несколько семейств: рецепторы фак!
[62], однако здесь на первый план выходят упо!
торов роста фибробластов (FGFR), рецепторы
мянутые точки амплификации сигнала, на кото!
тромбоцитарного (PDGFR), эндотелиального
рых сходятся несколько путей, активируемых
(VEGFR) и эпидермального факторов роста
разными рецепторами.
(EGFR), а также инсулина и инсулиноподобно!
Например, митоген!активируемая протеин!
го ФР (IR и IGF!1R) [56].
киназа (МАР!киназа) ERK является посредни!
Несмотря на некоторые различия в структу!
ком сигнальных путей рецепторов EGF, PDGF и
ре для большинства из них характерен общий
FGF [63]. По этой причине даунрегуляция одно!
принцип лиганд!зависимой димеризации с по!
го из этих рецепторов не приведет к выключению
следующим аутофосфорилированием остатков
пролиферации клетки, регулируемой ERK!зави!
тирозина в составе внутриклеточной части РТК
симыми ядерными факторами Jun, Fos и Myc.
БИОХИМИЯ том 85 вып. 1 2020
22
МАКАРЕВИЧ и др.
Таким образом, в отличие от гормонов и
ленно регулируют в эндотелиоцитах активацию
нейромедиаторов ФР и цитокины являются вы!
транскрипционного фактора NFκB (VEGF его
сокоспецифичными регуляторами клеточной
активирует, а HGF подавляет, см рис. 3). Одной
программы. Они влияют на решение клетки о
из мишеней NFκB является хемокин MCP!1 -
входе в клеточный цикл, подталкивают ее к миг!
эффективный хемоаттрактант моноцитов, являю!
рации и дифференцировке в ходе развития или
щихся ключевыми участниками ангио! и арте!
регенерации, т.е. к масштабным в плане струк!
риогенеза в сердце. Таким образом, несмотря на
туры ткани событиям. Именно по этой причине
кооперативное действие VEGF и HGF на про!
логичным становится «дублирование» сигналь!
лиферацию эндотелия, эти факторы разнонап!
ных путей от различных РТК и наличие точек
равленно влияли на инвазию моноцитов, без
амплификации, на которых сходятся сигналь!
которых затрудняется стабилизация вновь обра!
ные каскады от рецепторов разных ФР и цито!
зованных в ткани сосудов [69].
кинов. Дифференцировка клетки, ее выжива!
Роль факторов роста и цитокинов в межклеC
ние, пролиферация, а главное - формирование
точной коммуникации, развитии и регенерации.
новых тканевых структур, должны быть защи!
В чем же уникальность ФР и цитокинов и поче!
щены от случайных воздействий, поэтому их за!
му механизмы их рецепции являются важными
пуск требует скоординированных сигналов от
для понимания регуляции регенеративного про!
нескольких рецепторов и, соответственно, кок!
цесса? Эволюционно система РТК - одна из са!
тейля лигандов. Организованная таким образом
мых поздних, и долгое время считалось, что она
система рецепции работает подобно фильтру,
является уникальной особенностью многокле!
исключающему сигнальный «шум»: неспецифи!
точных организмов. За 1,5 миллиарда лет эво!
ческие или случайные воздействия [64].
люции, разделивших одноклеточные эукариоты
Аналогично можно отметить дублирование
и первые многоклеточные организмы, именно
функций и у самих ФР и цитокинов. Данная осо!
появление тирозинкиназной системы рецепции
бенность является защитой от временных ло!
считают ключевым шагом для перехода к мно!
кальных условий, которые могут разрушать мо!
гоклеточному строению организмов. Ее роль
лекулы или менять их сродство к рецептору [65].
заключается в установлении высшего уровня
Например, при сопровождающем тяжелую ги!
организации - межклеточных коммуникаций и
поксию ацидозе некоторые ФР (IGF, bFGF) те!
организации клеток в ткани и органы [70]. На!
ряют способность связываться с рецептором из!
личие выстроенной системы межклеточных взаи!
за снижения рН в ткани [66]. Однако другие ФР
модействий отличает организмы с облигатно
(VEGF165, TGF!β1) устойчивы к ацидозу и про!
многоклеточным строением от колоний одно!
должают выполнять свои функции в этой облас!
клеточных, формируемых по принципу времен!
ти, стимулируя пролиферацию фибробластов и
ных сообществ. Вне такой колонии каждый от!
ангиогенез, сопровождающие заживление ран.
дельный организм в отсутствие партнеров до!
Еще одним примером может быть потеря ак!
вольствуется собственной системой рецепции
тивности фактором роста гепатоцитов (HGF),
внешних стимулов и может поддерживать вид за
который нуждается в протеолитической актива!
счет регулярного удвоения, что невозможно для
ции для перехода в двухцепочечную форму, спо!
многоклеточного организма.
собную связываться с его рецептором - с!met
РТК были обнаружены у Choanoflagellatea -
[67]. При повреждении почек экспрессия про!
жгутиковых простейших, способных к формиро!
HGF увеличивается в несколько раз, однако
ванию колоний и представляющих собой сохра!
снижение продукции его активаторов (HGF!A,
нившееся переходное звено от одноклеточных к
матриптаз, урокиназы и др.) делает этот ответ
многоклеточным организмам [71]. В 2001 году
неэффективным из!за снижения активации
Kind и Carroll впервые показали наличие у
HGF. Компенсаторным в этой ситуации являет!
Monosiga brevicollis мембранного белка MBRTK1,
ся рост продукции IL!10, обладающего, как и
обладающего тирозинкиназной активностью
HGF, противовоспалительным и противофиб!
[72]. Далее было показано, что первые гены РТК
ротическим действием, защищающим жизнен!
появились у M. brevicollis ~600 млн лет назад,
но важный орган.
причем в удивительно большом количестве. Все!
Чтобы проиллюстрировать важность плеот!
го у этого вида было идентифицировано 128 (!)
ропии ФР в регуляции регенеративных процес!
генов, кодирующих РТК, что отражает первич!
сов, приведем еще один пример. При восстанов!
ную избыточность, возникшую в ходе приспосо!
лении ткани VEGF и HGF обладают коопера!
бительной реакции, движущая сила которой ос!
тивным действием на пролиферацию и мигра!
тается нам неизвестной [73, 74].
цию эндотелия за счет усиления фосфорилиро!
Существующая за счет ФР, цитокинов и РТК
вания ERK1/2 [68], однако эти ФР разнонаправ!
система коммуникации критична для всех эта!
БИОХИМИЯ том 85 вып. 1 2020
БИОХИМИЧЕСКАЯ РЕГУЛЯЦИЯ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ
23
Рис. 3. При активации рецепторов VEGFR и c!met усиление митогенного сигнала и разнонаправленное действие на диф!
ференцировку и выживаемость клетки обусловлено сигнализацией от тирозинкиназных рецепторов факторов роста. Уси!
ление сигнала, активирующего пролиферацию и миграцию, происходит за счет кооперативного фосфорилирования RAF!
киназы и активации сигнального пути киназы ERK1/2. При этом разнонаправленное влияние активации VEGFR2 и
c!met на дифференцировку, продукцию воспалительных белков и выживаемость клеток также обусловлено активацией
специфических сигнальных путей, регулирующих транскрипционные факторы и сигнальные комплексы, которые перек!
лючают экспрессию генов. Таким образом, тирозинкиназный путь рецепции может обеспечивать как усиление, так и раз!
личную направленность влияния ФР на одни и те же процессы в клетке
пов, требующих взаимодействия между клетка!
но уже неоднородной системе. В опытах с разде!
ми - от развития до обновления и регенерации в
лением клеток из состава 4!х и 8!клеточных ста!
постнатальном периоде. Важную роль, начиная
дий развития мыши было показано, что одиноч!
с ранних этапов эмбриогенеза, играют IGF,
ные бластомеры различаются по экспрессии β!
TGF!β1 и !β3, HGF, PDGF!А и !B и появление
катенина - важного участника канонического
спектра РТК, опосредующих чувствительность к
пути Wnt!сигналинга - каскада, задействован!
перечисленным ФР [75]. Репертуар экспресси!
ного в регуляции дифференцировочного статуса
руемых ФР формирует сеть взаимных влияний
СК [77, 78]. Дальнейшие стадии эмбриогенеза
между элементами, определяющими судьбу каж!
характеризуются расширением репертуара про!
дого из них и ход развития организма [56, 76].
дуцируемых ФР и чувствительности к ним. В ре!
Например, после первых дроблений зиготы
зультате этого начинается процесс специализа!
между четырьмя бластомерами имеются сущест!
ции клеточных типов, зависящий от миграцион!
венные различия, хотя визуально они обладают
ной активности и дифференцировки плюри!, а
совершенно неотличимой сферической формой.
затем мультипотентных СК в составе зародыше!
Каждый бластомер обладает уникальными приз!
вых листков [79].
наками, а также спектром ФР и цитокинов,
С точки зрения организации ткани регенера!
действующих ауто! и паракринно в крошечной, тивный процесс также характеризуется делени!
БИОХИМИЯ том 85 вып. 1 2020
24
МАКАРЕВИЧ и др.
ем, специализацией клеток и усложнением
выполняет свою функцию и формирует набор
структуры под контролем ФР и цитокинов.
стимулов, необходимых для запуска и регуляции
После повреждения на месте разрушенной тка!
следующего этапа [83].
ни формируется временная структура, основой
Хорошей иллюстрацией жестко закреплен!
которой, как правило, является сгусток крови
ной стадийности регуляции, осуществляемой
[80]. В зависимости от вида этой структурой мо!
ФР, является опыт с эктопическим отрастанием
жет быть васкуляризованная, но не специализи!
конечности или хвоста у аксолотля. Оба этих
рованная грануляционная ткань или бластема,
процесса требуют последовательного переклю!
состоящая из дедифференцированных сомати!
чения стимулов и кооперативного действия бел!
ческих клеток. В дальнейшем для полноценной
ков из семейств костных морфогенетических
регенерации она должна быть в состоянии обес!
белков (BMP) и FGF [84]. Ни FGF2, ни FGF8,
печить условия для дифференцировки, пра!
ни пара BMP2/BMP7 по одиночке не способны
вильной организации ткани и функционирова!
запустить полную регенерацию конечности [85].
ния клеток, т.е. усложнения структуры [27]. Этот
Действие любого из перечисленных факторов
процесс зачастую подчиняется закономернос!
вызывает появление на раневой поверхности
тям, аналогичным тем, которые действовали на
временных структур, напоминающих бласте!
этапе эмбрионального развития затронутой час!
му - группу дедифференцированных клеток,
ти тела [81].
дающих начало отрастающей конечности. Од!
Стадийность и своевременное переключение
нако только их кооперативное действие в опре!
стимулов необходимы для регенерации ткани. Все
деленной последовательности (во многом сов!
фазы репаративной регенерации - от гемостаза
падающей с переключениями экспрессии генов
после повреждения до регенерации или фибро!
в процессе эмбрионального развития) [68] поз!
за - характеризуются активностью специализи!
воляет добиться отрастания дополнительной
рованных типов клеток, обладающих особен!
части тела [86].
ностями регуляции и, следовательно, требую!
В недавно опубликованной работе Yu et al.
щих специфического набора стимулирующих и
[87] именно последовательным воздействием
ингибирующих молекул [41, 82].
BMP2 и BMP9 удалось добиться регенерации
Самые ранние стадии (образование тромба и
ампутированной дистальной фаланги у млеко!
воспаление) высоко консервативны у позвоноч!
питающего (мыши), что, несомненно, стало вы!
ных и обладают критическим значением для вы!
дающимся результатом. Однако следует отме!
живания особи и борьбы с инфекцией, которая
тить, что в ходе эволюции базовый принцип ре!
попадает в зону повреждения. Активация тром!
генерации - последовательное образование и
боцитов, помимо остановки кровотечения, со!
усложнение структуры - не изменился, что
провождается их дегрануляцией и выбросом хе!
всегда будет требовать определенных стимулов в
моаттрактантов (IL!8, IL!6, IFN!γ и др.), при!
определенной последовательности. Отступле!
влекающих в зону повреждения нейтрофилы.
ние от этого принципа объясняет результаты
Их защитная функция реализуется за счет вы!
клинических исследований, в которых не пока!
броса токсических молекул и активной продук!
зала эффективности ни одна из молекул, акти!
ции свободных радикалов, уничтожающих в
вирующих СК. Предпринимались попытки
зоне повреждения как микробы, так и клетки
применения ФР (VEGF, bFGF, HGF, PDGF и
макроорганизма. Массовая гибель нейтрофилов
др.) и колониестимулирующих факторов (G!CSF),
очищает рану и создает новый градиент цитоки!
однако результаты их использования были
нов (MCP!1, MIP!1, TNF!α), привлекающих
очень скромными, несмотря на попытки подо!
моноциты и запускающих их дифференцировку
брать приемлемые показания - начиная от ле!
в макрофаги. Фагоцитирующие макрофаги по!
чения ожогов до сахарного диабета I типа [88].
глощают клеточный дебрис, оставшийся после
Таким образом, регенеративный процесс не
погибших нейтрофилов, и активно вырабатыва!
является функцией отдельно взятой клетки или
ют цитокины и ФР (IL!6, SDF!1α, FGF, PDGF,
результатом воздействия одиночных молекул на
VEGF), которые привлекают в рану ключевых
идущие в ней процессы. Он требует последова!
участников дальнейших событий - МСК, фи!
тельной активации и регуляции различных ти!
бробласты и миофибробласты [21, 41]. Этими
пов клеток, участвующих в восстановлении
же ФР стимулируется пролиферация и диффе!
структуры. Именно поэтому попытки стимули!
ренцировка клеток, их организация в упорядо!
ровать регенерацию лучше основывать не на ак!
ченные структуры, необходимые для регенера!
тивности важных для регенерации лигандов и
ции. Уже на примере первых этапов репаратив!
рецепторов, а на воспроизведении стадийности с
ной регенерации видно, что каждый тип клеток,
учетом особенностей процессов, происходящих
активируемый специфическими стимулами,
при органогенезе или восстановлении ткани.
БИОХИМИЯ том 85 вып. 1 2020
БИОХИМИЧЕСКАЯ РЕГУЛЯЦИЯ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ
25
МЕТОДОЛОГИЯ РЕГЕНЕРАТИВНОЙ
полняющими друг друга эффектами. Примером
МЕДИЦИНЫ С ТОЧКИ ЗРЕНИЯ
такой физиологически обоснованной комбина!
РЕГУЛЯЦИИ ПРОЦЕССОВ
ции может служить сочетание VEGF165 и ангио!
ОБНОВЛЕНИЯ И РЕГЕНЕРАЦИИ
поэтина!1. В этой паре VEGF165 играет роль ак!
тиватора ангиогенеза, а ангиопоэтин!1 - ат!
Генная терапия в регенеративной медицине.
трактанта перицитов и гладкомышечных кле!
Под генной терапией (ГТ) понимают группу ме!
ток. Под влиянием VEGF165 происходит актив!
тодов, направленных на модификацию последо!
ный капиллярогенез, однако многие сформиро!
вательности генов или управление их экспрес!
ванные сосуды обладают повышенной проницае!
сией, а также изменение биологических свойств
мостью или быстро разрушаются. Ангиопоэтин!
живых клеток для их терапевтического исполь!
1, сам по себе обладая очень скромным ангио!
зования. Концепция гена как фармакологичес!
генным потенциалом, в комбинации с VEGF165
кой мишени не нова - многие низкомолекуляр!
сыграл роль стабилизатора сосудов и оказался
ные препараты и гормоны способны действо!
способен уменьшать побочные эффекты моно!
вать на ДНК напрямую или опосредованно,
терапии VEGF. Более того, комбинирование
влияя на метаболизм и жизнеспособность клет!
этих генов значительно усилило васкуляриза!
ки. Однако концепция гена как активного нача!
цию регенерирующей ткани по сравнению с
ла лекарства впервые была сформулирована в
каждым из них по отдельности [95]. Однако для
начале 70!х годов ХХ века, дав начало этому
запуска полноценной регенерации ткани или
направлению [89].
органа ГТ имеет ограниченный потенциал [90,
С точки зрения регуляции процессов регене!
92, 96].
рации ГТ позволила решить задачу продолжи!
Следует отметить, что «моногенная» терапия
тельной экспрессии ФР и цитокинов, активирую!
оказалась эффективной для терапии наслед!
щих процессы формирования новых структур,
ственных заболеваний. Метод доставки «здоро!
которые идут длительно - сутками и даже неде!
вой» копии гена стал примером этиотропной ГТ,
лями. Добиться продолжительного действия
направленной на устранение единственной
этих белков локальным введением в ткань ока!
причины заболевания, не корректируемой ины!
залось невозможно, так как время их жизни
ми способами. Благодаря этому в настоящее
после локальной или системной инъекции было
время мы приблизились к возможности излече!
мизерным из!за деградации под влиянием про!
ния ряда наследственных иммунодефицитов,
теаз и большого объема распределения. При
энзимопатий, гемофилии А [97-99].
этом их концентрация быстро снижалась ниже
Стимуляция регенеративных процессов с поC
порога связывания с рецептором и, следова!
мощью секретома стволовых клеток. Клеточную
тельно, прекращалось влияние на клетки!ми!
терапию длительное время рассматривали как
шени. Генная терапия позволила превратить
способ получения «лекарства на основе стволо!
часть клеток органа в клетки!продуценты, кото!
вых клеток», причем в последние годы для этого
рые нарабатывают белок, запускающий проли!
активно использовали МСК из различных ис!
ферацию, миграцию и активирующий резидент!
точников. Являясь удобным объектом и источ!
ные СК [90]. С помощью плазмидных и вирус!
ником материала для клеточной терапии, они
ных векторов в ткани были доставлены гены ФР
долгие годы считались одним из наиболее пер!
(VEGF, HGF, ангиопоэтина!1, PDGF и др.), ре!
спективных и безопасных инструментов для
гулирующие регенерацию и ее отдельные
клеточной терапии. В пользу этого говорят по!
звенья: рост нервов и кровеносных сосудов,
ложительные результаты применения МСК, од!
миграцию эпителия, защиту от фиброза и др.
нако в начале 2000!х годов все чаще стали появ!
[69, 91-94].
ляться данные о невозможности интеграции
В клинических исследованиях ГТ с по!
клеток, введенных в ткань [100]. Ряд исследова!
мощью одного гена ФР (VEGF, HGF, FGF и др.)
телей с разочарованием констатировали, что
оказалась малоэффективной для стимуляции
МСК оказались неспособны к включению в
регенеративных процессов [92]. Биологических
состав ткани, а их эффекты связаны с актив!
эффектов одного ФР или цитокина было доста!
ностью продуцируемого ими секретома [100].
точно для того, чтобы индуцировать рост от!
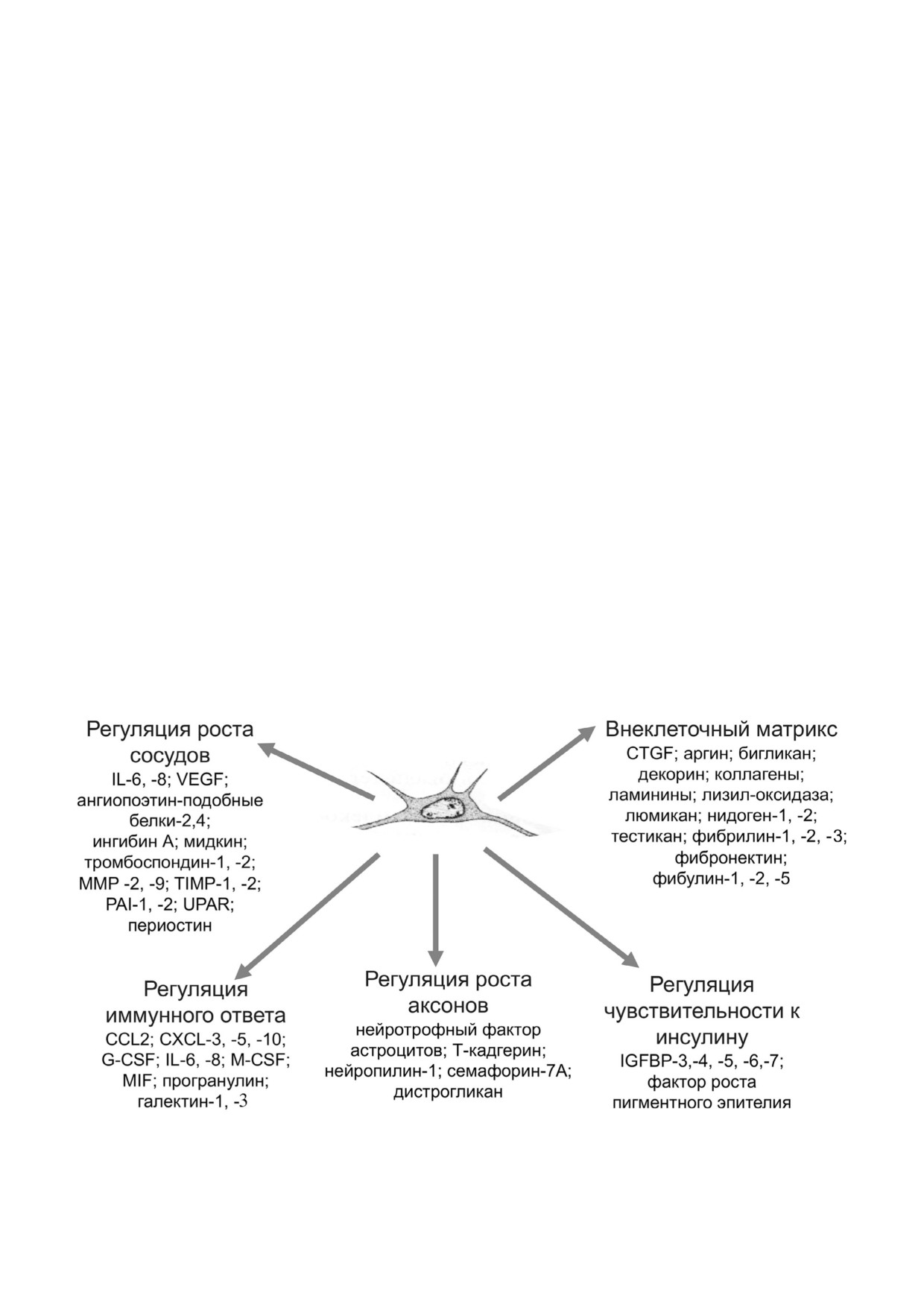
Протеомные исследования секретома МСК,
дельных структур (сосудов, аксонов), но не фор!
в том числе проведенные нами [101], показали,
мирование ткани, которое требует каскада по!
что он содержит большое количество пептид!
следовательно переключающихся стимулов. В
ных и белковых компонентов, многие из кото!
этой области, как стало известно, возможны оп!
рых были идентифицированы как ФР, регулято!
ределенные улучшения с помощью комбиниро!
ры метаболизма, компоненты внеклеточного
ванной генной терапии несколькими ФР с до!
матрикса и др. (рис. 4) [102, 103]. Все это состав!
БИОХИМИЯ том 85 вып. 1 2020
26
МАКАРЕВИЧ и др.
ляет комплекс стимулов, упомянутый во ввод!
данные in vivo говорят о том, что секретом МСК
ной части, который, как оказалось, невозможно
обладает мощным ангиогенным и нейротроф!
воспроизвести с помощью фармакологических
ным действием, стимулирует заживление после
препаратов или методов ГТ. Эти данные стали
ожогов кожи, способен восстанавливать спер!
отражением биологической роли МСК - регу!
матогенез [101, 104].
ляторных клеток, имеющих базальный уровень
Среди разрабатываемых в мире препаратов
секреторной активности, обеспечивающий тка!
такого класса заслуживает упоминания Thero!
невой гомеостаз, и при этом способных много!
101 (ранее известный, как NeuroFX) - инфузи!
кратно ее повышать при повреждении для обес!
онный препарат для лечения последствий ише!
печения регенерации. В пользу этого говорит их
мического инсульта, основой которого является
преимущественно периваскулярная локализа!
очищенная белковая фракция секретома МСК
ция, где МСК одновременно экспонированы к
человека. В настоящее время разрабатывающая
воздействию системных стимулов (уровня глю!
его компания готовится к первым клиническим
козы, кислорода, инсулина, гормонов крови) и
исследованиям, которые позволят оценить эф!
локальных сигналов, возникающих в ткани. Та!
фективность этого подхода.
кое положение обеспечивает рецепцию ими
В отношении секретома МСК следует также
сигналов от организма в целом и от клеток in situ
отметить, что многие фармакологические эф!
[102, 103]. Продуцируемый МСК секретом ока!
фекты основаны на продукции не только белков
зался очень удачным объектом для создания
и пептидов, но и фракции внеклеточных вези!
«регенеративного лекарства», которое отвечает
кул, включающей микровезикулы и экзосомы
ключевым требованиям с точки зрения регуля!
[105]. Долгое время их рассматривали как ре!
ции регенерации. При этом комбинированное
зультат удаления из клеток отживших органелл,
действие ФР приводит к усилению сигнала в
неправильно уложенных белков и др., однако
точках амплификации, общих для сигнальных
сейчас мы можем с уверенностью говорить о
каскадов молекулах, воссоздавая картину ко!
том, что внеклеточные везикулы являются спо!
оперативной регуляции клетки суммой стиму!
собом передачи информации между клетками.
лов, а не одиночными молекулами.
Более того, за счет присутствия в их составе нук!
Это стало основой для создания регенера!
леиновых кислот (мРНК, микроРНК и др.),
тивных препаратов, содержащих продуцируе!
данный вид транспорта может являться спосо!
мые МСК белки и предназначенных для стиму!
бом горизонтального переноса генетической
ляции восстановления ткани. Полученные нами
информации в организме человека, в т.ч. и при
Рис. 4. Секретом МСК человека и основные функциональные группы идентифицированных в его составе молекул
БИОХИМИЯ том 85 вып. 1 2020
БИОХИМИЧЕСКАЯ РЕГУЛЯЦИЯ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ
27
стимуляции дедифференцировки и трансдиф!
развития и участвующих в обновлении и регене!
ференцировки клеток в организме [106].
рации ткани [111].
Таким образом, с точки зрения регенератив!
Однако раз за разом исследователи обнару!
ного процесса вводимые МСК действительно не
живали, что выделенные из тканей тканеспеци!
способны интегрироваться в ткань, однако их
фичные СК не были способны дать начало тка!
секреторная активность позволяет влиять на
ни или сформировать ее эквивалент с полно!
большинство стадий восстановления после пов!
ценной функцией. В ряде случаев ситуацию уда!
реждения [104].
валось частично улучшить с помощью тканевой
Введенные в поврежденную ткань МСК спо!
инженерии и использования скаффолдов (син!
собны к рецепции условий микроокружения.
тетических матриксных каркасов или децеллю!
При гипоксии или наличии высокого содержа!
ляризованных органов) [112]. Более того, неко!
ния воспалительных цитокинов IL!8 или TNF!α
торые тканеспецифичные СК по!прежнему не
они способны в определенном диапазоне ме!
удается запустить даже в ранние стадии органо!
нять состав секретома, т.е. обладают адаптив!
генеза вне организма. Например, известные
ностью [107, 108]. За счет этого МСК могут ус!
несколько десятилетий сателлитные клетки ске!
корять разрешение воспаления в его острой и
летных мышц хорошо активируются in vitro,
острейшей фазах, а на более поздних этапах -
экспрессируя транскрипционные факторы, от!
способствовать росту капилляров и нервных
вечающие за миогенез и формируя структуры,
окончаний, необходимых для регенерации и
аналогичные миофибриллам [113]. При этом
восстановления ткани. Следует отметить, что
добиться от них полноценной и регулируемой
МСК также могут под влиянием тканевого ок!
сократительной активности с возможностью
ружения приобретать фенотип миофиброблас!
интеграции в ткань не удалось [114].
тов, способных усиливать фиброз в зоне пов!
Эти результаты можно объяснить двумя при!
реждения и рубцевание ткани [109, 110].
чинами: 1) СК, утрачивая контакт со своим спе!
Таким образом, секреторная активность
цифическим окружением, теряет свою способ!
МСК может быть использована для создания
ность к полноценной дифференцировке; 2) за!
препаратов на основе секретома, однако они
пущенная в дифференцировку СК, дойдя по
представляют собой коктейль факторов, полу!
стадии коммитированных клеток!предшествен!
ченных в культуре и, соответственно, не могут
ников, требует полноценного окружения, чтобы
воспроизвести стадийность регенерации, о
созреть до терминально дифференцированного
важности которой было сказано выше. Вводи!
состояния и встроиться в ткань морфологичес!
мые в ткань МСК способны адаптивно менять
ки и функционально [21, 22].
свою секреторную активность в зависимости от
В итоге мы приходим к выводу о том, что
условий окружения, однако есть данные об их
функциональной единицей регенерации явля!
участии в фиброзировании поврежденных ор!
ется не сама по себе СК с ее внутренними свой!
ганов. Оба этих пути имеют свои перспективы
ствами, а комплекс, состоящий из СК и ее спе!
и, вероятно, найдут свои показания. В настоя!
цифического окружения, играющего регулятор!
щее время существуют возможности для управ!
ную роль. Это окружение получило название
ления состоянием МСК и других типов клеток
«ниша», и в современном представлении о регу!
in vitro. Имитация напряжения сдвига, внесе!
ляции регенеративного процесса именно ему
ние различных активирующих молекул или ги!
отводится роль в рецепции активирующих сти!
поксия позволяют эффективно менять состав
мулов и контроле «судьбы» СК на ранних этапах
секретома. Эти приемы могут быть использова!
дифференцировки [115]. Вопросам анатомии
ны для получения эффективных бесклеточных
ниш различных типов и механизмам их регуля!
препаратов различной «модальности», пригод!
ции посвящено множество замечательных об!
ных для использования при широком спектре
зорных публикаций, поэтому мы лишь позво!
заболеваний.
лим себе уточнить, что в состав ниши, помимо
Тканеспецифичные стволовые клетки и их ниC
самой СК, входят растворимые факторы, белки
ша как терапевтическая мишень. Длительное вре!
матрикса и поддерживающие клетки. При этом
мя одними из самых перспективных объектов с
в отношении других типов клеток мы вновь об!
точки зрения регенеративной медицины явля!
ращаем внимание на МСК, которые во многих
лись тканеспецифичные СК. Они были обнару!
нишах играют роль как в поддержании покоя!
жены во всех паренхиматозных органах челове!
щегося состояния СК, так и в ее активации. На!
ка, в легких, коже, криптах кишки и др. Эти
конец, свой ключевой вклад МСК вносят при
постнатальные СК существуют в виде ограни!
завершении регенерации на этапе формирова!
ченной популяции недифференцированных
ния специфичного для ткани матриксного, со!
клеток, сохраняющихся в ходе эмбрионального
судистого и нейрального компонентов [116].
БИОХИМИЯ том 85 вып. 1 2020
28
МАКАРЕВИЧ и др.
Возвращаясь к предмету обзора, мы можем
ройств. При локальном введении в среднее ухо
предположить, что в регенеративной медицине
FX!322 активирует Lgr5+ прогениторные клет!
будущего на первый план выйдет понимание
ки, вызывая восстановление сенсорного эпите!
механизмов функционирования ниши СК и
лия и слуховой чувствительности. Аналогичным
разработка способов ее контролируемой актива!
образом данный «коктейль» ингибиторов может
ции или восстановления после повреждения.
быть эффективным в нише крипты кишки, ре!
Многие подходы, вероятно, будут основаны на
генерация эпителия которой тоже зависит от
описанных в первой части принципах регуля!
Lgr5+ клеток. Наконец, Lgr5+ клетки содержатся
ции, базирующихся на последовательном пе!
в волосяной луковице, поэтому одним из перс!
реключении факторов и стимулов, вначале ак!
пективных показаний для FX!322 является и
тивирующих СК, а затем поддерживающих соз!
алопеция различного генеза.
ревание СК в ходе регенерации.
Таким образом, на этом примере мы видим,
Таким образом, в дальнейшем мы сможем
что удачно подобранная комбинация фармако!
уйти от этапа культивирования СК ex vivo, так
логических ингибиторов оказывается эффектив!
как это несет в себе риски (контаминация мик!
ным стимулятором регенерации за счет действия
робами, хромосомные аберрации и генетические
на тканеспецифичные СК и позволяет избежать
перестройки) и приводит к потере СК их регене!
этапа их культивирования. К слову, возвращаясь
ративных свойств, определяемых условиями ни!
к самой первой части обзора, следует отметить,
ши. Конечно, в ряде случаев СК и клетки их ок!
что и здесь механизмом действия препарата яв!
ружения исходно имеют сниженный регенера!
ляется ингибирование мишеней, а не их актива!
тивный потенциал: существует понятие об исто!
ция, как это происходит под действием, напри!
щении пула СК по мере старения, а также пока!
мер, секретома МСК или белка, продуцирующе!
заны неблагоприятные эффекты метаболичес!
гося после доставки гена в ткань.
ких и сердечно!сосудистых заболеваний на их
Ограничением описанной стратегии может
основные физиологические функции [117]. В
стать истощение пула тканеспецифичных СК,
данной ситуации перед нами встает задача более
однако в такой ситуации могут быть использо!
глубокого понимания процессов, которые про!
ваны методы, направленные на активацию про!
текают в нише и как именно действуют на нее
лиферации с помощью вирусной доставки ге!
повреждающие факторы. В перспективе это соз!
нов, кодирующих положительные регуляторы
даст основы для управления нишей СК, а в даль!
клеточного цикла или регуляторные РНК, вы!
нейшем и подходы к блокировке или подавле!
зывающие ограниченную дедифференцировку
нию формирования патологических ниш, нап!
зрелых клеток и их пролиферацию с последую!
ример, ниш опухолевых СК [118].
щей редифференцировкой. Более того, данный
Использование «малых молекул» для регенеC
подход может быть совмещен с описанной выше
ративной медицины. В ходе изложения мы по!
стратегией, как, например, это было сделано в
дошли к важному направлению в регенератив!
опыте по активации пролиферации зрелых кар!
ной медицине - регуляции обновления и реге!
диомиоцитов мыши [119]. В этом эксперименте
нерации ткани in situ. В этом плане было бы
было установлено, что введение в миокард генов
несправедливо обделить вниманием ряд «малых
4!х регуляторов клеточного цикла (CDK1, цик!
молекул», например, специфических ингибито!
лина B, CDK4 и CCND) вызывает пролифера!
ров белков и регуляторных каскадов, контроли!
цию кардиомиоцитов. При этом оказалось, что
рующих статус СК. В США сейчас готовится к
использование двух низкомолекулярных инги!
клиническим исследованиям комбинирован!
биторов, подавляющих активность TGF!β1 и
ный препарат FX!322, включающий два низко!
киназы Wee!1, позволяет добиться того же эф!
молекулярных ингибитора. Мишень первого
фекта введением только двух факторов (CDK4 и
ингибитора - киназа!3 гликогенсинтазы (GSK!3),
CCND).
ингибирование которой приводит к активации
Еще одним перспективным подходом явля!
пути Wnt - ключевого регулятора многих проге!
ется трансдифференцировка клеток in situ путем
ниторных клеток. Второй ингибитор блокирует
доставки факторов транскрипции или регуля!
активность гистоновой деацетилазы (HDAC1),
торных РНК с помощью вирусов или экзосом.
уменьшая ее скручивающее действие на цепочку
В ряде экспериментов было показано прямое
ДНК. Суммой этих эффектов оказалась актива!
перепрограммирование фибробластов в гепато!
ция Lgr5+ прогениторных клеток, которые явля!
циты, кардиомиоциты и клетки дермы, минуя
ются предшественниками волоскового сенсор!
стадию плюрипотентности [34, 35, 120].
ного эпителия, чье отмирание в раннем возрас!
Таким образом, в настоящее время мы
те стало встречаться все чаще из!за распростра!
вплотную приблизились к созданию подходов,
ненности наушников и персональных аудиоуст!
основанных на комбинации генной терапии и
БИОХИМИЯ том 85 вып. 1 2020
БИОХИМИЧЕСКАЯ РЕГУЛЯЦИЯ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ
29
фармакологической регуляции дифференци!
зрелых клеток и дифференцировки СК, идут
ровки, которые можно использовать для актива!
процессы дедифференцировки и прямой кон!
ции обновления и регенерации ткани после
версии одного типа клеток в другой в ответ на
повреждения.
повреждение. Таким образом, в регенеративной
биологии и медицине ближайших десятилетий
Изучение регуляции регенеративных про!
станет важным изучение регенерирующей ткани
цессов, сколь ни сложным может показаться
как созревающей (по аналогии с эмбриогене!
этот предмет, все чаще дает прорывные резуль!
зом) системы межклеточных взаимодействий,
таты. В XXI веке за неполные 20 лет удалось до!
опосредованных ФР и цитокинами. Реализация
биться регенерации сердца и частей конечности
корректной программы этого процесса долгое
у млекопитающих, установить закономерности,
время ассоциировалась с активацией резидент!
описывающие падение способности к репара!
ных СК, однако сейчас все большее внимание
тивной регенерации после рождения и, нако!
уделяется нише - ее специфическому регуля!
нец, установить ~20 новых мишеней, отвечаю!
торному окружению. Результатами этих иссле!
щих за функционирование СК в постнатальном
дований уже стали практические успехи - соз!
периоде. Расширившаяся методическая база -
данные методы запуска регенерации без культи!
от релевантных животных моделей до РНК!сек!
вирования клеток вне организма, т.е. in situ, с
венирования одиночных клеток - дала уникаль!
помощью малых молекул, методов ГТ и секре!
ные возможности для фундаментальных иссле!
тома постнатальных СК.
дований в области регенеративной биологии и
Несомненно, важным с точки зрения биохи!
медицины.
мической регуляции этих процессов останется
В данном обзоре мы постарались дать чита!
изучение метаболической регуляции регенера!
телю представление о расшифрованных регуля!
ции и сигнальных механизмов, отвечающих за
торных системах, которые являются объектами
передачу стимула, и контроль судьбы клетки.
для регенеративной медицины настоящего.
Обнаружение новых мишеней в ближайшем бу!
Это направление, пройдя солидную историю
дущем останется за классическими подходами
развития, сейчас подошло к точке, когда кон!
клеточной биологии и биохимии, однако рас!
вергенция с регенеративной биологией (от ко!
пространяющееся применение методов генной
торой она заимствовала многие базовые поня!
инженерии и биоинформатики значительно
тия и частично методологию) является наиболее
увеличит эффективность их поиска с быстрой
разумным путем развития. Изучение молеку!
проверкой на релевантных модельных объектах.
лярных механизмов регуляции СК долгое время
было флагманским направлением в этой науке и
дало множество перспективных технологий.
Финансирование. Работа выполнена при фи!
Однако сейчас на первый план выходят задачи,
нансовой поддержке Российского научного
связанные с пониманием того, как после пов!
фонда (грант № 19!75!30007) (подготовка руко!
реждения в постнатальном периоде клетки мо!
писи и обеспечение доступа к первоисточни!
гут воспроизвести процессы организации тка!
кам) и гранта Президента РФ для государствен!
ни, которые шли в эмбриогенезе.
ной поддержки молодых российских ученых
Оптимизм исследователям внушает тот факт,
№ МК!1068.2019.7 (подготовка иллюстраций).
что в организме человека не оказалось эволюци!
Конфликт интересов. Авторы заявляют об от!
онно выработанной блокировки регенерации,
сутствии конфликта интересов.
все клеточные механизмы, присущие живот!
Соблюдение этических норм. Настоящая
ным, эффективно восстанавливающим свои
статья не содержит описания выполненных ав!
части тела, могут в ответ на повреждение идти в
торами исследований с участием людей или ис!
тканях Homo sapiens. Помимо пролиферации
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Goss, R.J. (1969) Principles of regeneration, Academic
5.
Iismaa, S.E., Kaidonis, X., Nicks, A.M., Bogush, N.,
Press, New York.
Kikuchi, K., Naqvi, N., Harvey, R.P., Husain, A., and
2.
Wyllie, A.H. (1987) Apoptosis: cell death in tissue regula!
Graham, R.M. (2018) Comparative regenerative mechanisms
tion, J. Pathol., 153, 313-316.
across different mammalian tissues, NPJ Regen. Med., 3, 6.
3.
Guillot, C., and Lecuit, T. (2013) Mechanics of epithelial tissue
6.
Stocum, D.L. (2012) An Overview of Regenerative
homeostasis and morphogenesis, Science, 340, 1185-1189.
Biology, in Regenerative Biology and Medicine (Second
4.
Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K.,
Edition), Academic Press, San Diego. pp 3-20.
and Walter, P. (2002) Molecular Biology of the Cell, 4th
7.
Goss, R.J. (1980) Prospects of regeneration in man, Clin.
Edition, Garland Science, New York, pp. 1616.
Orthop. Relat. Res., 270-282.
БИОХИМИЯ том 85 вып. 1 2020
30
МАКАРЕВИЧ и др.
8.
Seifert, A.W., and Muneoka, K. (2018) The blastema and
28.
Wang, W.E., Li, L., Xia, X., Fu, W., Liao, Q., Lan, C.,
epimorphic regeneration in mammals, Dev. Biol., 433,
Yang, D., Chen, H., Yue, R., Zeng, C., Zhou, L., Zhou, B.,
190-199.
Duan, D.D., Chen, X., Houser, S.R., and Zeng, C. (2017)
9.
Bleacher, J.C., Adolph, V.R., Dillon, P.W., and Krummel, T.M.
Dedifferentiation, proliferation, and redifferentiation of
(1993) Fetal tissue repair and wound healing, Dermatol.
adult mammalian cardiomyocytes after ischemic injury,
Clin., 11, 677-683.
Circulation, 136, 834-848.
10.
Dostal, G.H., and Gamelli, R.L. (1993) Fetal wound heal!
29.
Jopling, C., Sleep, E., Raya, M., Marti, M., Raya, A., and
ing, Surg. Gynecol. Obstet., 176, 299-306.
Izpisua Belmonte, J.C. (2010) Zebrafish heart regeneration
11.
Burrington, J.D. (1971) Wound healing in the fetal lamb, J.
occurs by cardiomyocyte dedifferentiation and prolifera!
Pediatr. Surg., 6, 523-528.
tion, Nature, 464, 606-609.
12.
Frantz, F.W., Diegelmann, R.F., Mast, B.A., and Cohen, I.K.
30.
Takahashi, K. (2014) Cellular reprogramming, Cold Spring
(1992) Biology of fetal wound healing: collagen biosynthe!
Harb. Perspect. Biol., 6, pii: a018606, doi: 10.1101/
sis during dermal repair, J. Pediatr. Surg., 27, 945-948; dis!
cshperspect.a018606.
cussion 949.
31.
Kelaini, S., Cochrane, A., and Margariti, A. (2014) Direct
13.
Buonocore, G., Perrone, S., and Tataranno, M.L. (2017)
reprogramming of adult cells: avoiding the pluripotent
Oxidative stress in the newborn, Oxid. Med. Cell. Longev.,
state, Stem Cells Cloning, 7, 19-29.
2017, 1094247.
32.
Criscimanna, A., Speicher, J.A., Houshmand, G., Shiota, C.,
14.
Torres!Cuevas, I., Parra!Llorca, A., Sanchez!Illana, A.,
Prasadan, K., Ji, B., Logsdon, C.D., Gittes, G.K., and
Nunez!Ramiro, A., Kuligowski, J., Chafer!Pericas, C.,
Esni, F. (2011) Duct cells contribute to regeneration of
Cernada, M., Escobar, J., and Vento, M. (2017) Oxygen
endocrine and acinar cells following pancreatic damage in
and oxidative stress in the perinatal period, Redox. Biol.,
adult mice, Gastroenterology, 141, 1451-1462, doi: 10.1053/
12, 674-681.
j.gastro.2011.07.003.
15.
Yun, M.H. (2015) Changes in regenerative capacity
33.
Beer, R.L., Parsons, M.J., and Rovira, M.
(2016)
through lifespan, Int. J. Mol. Sci., 16, 25392-25432.
Centroacinar cells: at the center of pancreas regeneration,
16.
Nakada, Y., Canseco, D.C., Thet, S., Abdisalaam, S.,
Dev. Biol., 413, 8-15.
Asaithamby, A., Santos, C.X., Shah, A.M., Zhang, H.,
34.
Raven, A., Lu, W.Y., Man, T.Y., Ferreira!Gonzalez, S.,
Faber, J.E., Kinter, M.T., Szweda, L.I., Xing, C., Hu, Z.,
O’Duibhir, E., Dwyer, B.J., Thomson, J.P., Meehan, R.R.,
Deberardinis, R.J., Schiattarella, G., Hill, J.A., Oz, O.,
Bogorad, R., Koteliansky, V., Kotelevtsev, Y., Ffrench!
Lu, Z., Zhang, C.C., Kimura, W., and Sadek, H.A. (2017)
Constant, C., Boulter, L., and Forbes, S.J.
(2017)
Hypoxia induces heart regeneration in adult mice, Nature,
Cholangiocytes act as facultative liver stem cells during
541, 222-227.
impaired hepatocyte regeneration, Nature, 547, 350-354.
17.
Simkin, J., and Seifert, A.W. (2018) Concise review: trans!
35.
Malato, Y., Naqvi, S., Schurmann, N., Ng, R., Wang, B.,
lating regenerative biology into clinically relevant thera!
Zape, J., Kay, M.A., Grimm, D., and Willenbring, H.
pies: are we on the right path? Stem Cells Transl. Med., 7,
(2011) Fate tracing of mature hepatocytes in mouse liver
220-231.
homeostasis and regeneration, J. Clin. Invest., 121,
18.
Gawriluk, T.R., Simkin, J., Thompson, K.L., Biswas, S.K.,
4850-4860.
Clare!Salzler, Z., Kimani, J.M., Kiama, S.G., Smith, J.J.,
36.
Discher, D.E., Mooney, D.J., and Zandstra, P.W. (2009)
Ezenwa, V.O., and Seifert, A.W. (2016) Comparative analy!
Growth factors, matrices, and forces combine and control
sis of ear!hole closure identifies epimorphic regeneration as
stem cells, Science, 324, 1673-1677.
a discrete trait in mammals, Nat. Commun., 7, 11164.
37.
Michalopoulos, G.K. (1990) Liver regeneration: molecular
19.
Christ, G.J., Saul, J.M., Furth, M.E., and Andersson, K.E.
mechanisms of growth control, FASEB J., 4, 176-187.
(2013) The pharmacology of regenerative medicine,
38.
Michalopoulos, G.K., and DeFrances, M.C. (1997) Liver
Pharmacol. Rev., 65, 1091-1133.
regeneration, Science, 276, 60-66.
20.
Tanaka, E.M., and Reddien, P.W. (2011) The cellular basis
39.
Ткачук В.А. (1994) Физиология эндокринной систе!
for animal regeneration, Dev. Cell, 21, 172-185.
мы, Успехи физиологических наук, 25, 47-54.
21.
Nimiritsky, P.P., Eremichev, R.Y., Alexandrushkina, N.A.,
40.
Ткачук В.А. (1987) Роль и место циклических нуклео!
Efimenko, A.Y., Tkachuk, V.A., and Makarevich, P.I.
тидов в нейронэдокринной регуляции клеток и тка!
(2019) Unveiling mesenchymal stromal cells’ organizing
ней, Научные доклады высшей школы. Биологические
function in regeneration, Int. J. Mol. Sci., 20, pii: E823,
науки, 5-17.
doi: 10.3390/ijms20040823.
41.
Ткачук В.А., Воротников А.В., Тюрин!Кузьмин П.А.
22.
Nimiritsky, P.P., Sagaradze, G.D., Efimenko, A.Y.,
(2017) Основы молекулярной эндокринологии: рецепция и
Makarevich, P.I., and Tkachuk, V.A. (2018) The stem cell
внутриклеточная сигнализация, ГЭОТАР!Медиа, Москва.
niche, Tsitologiya, 60, 575-586.
42.
Grigorian, G.Y., Mirzapoyazova, T.Y., Resink, T.J.,
23.
Mazzarello, P. (1999) A unifying concept: the history of
Danilov, S.M., and Tkachuk, V.A. (1989) Regulation of
cell theory, Nat. Cell Biol., 1, E13-E15.
phosphoinositide turnover in endothelium from human
24.
Shay, J.W., and Wright, W.E. (2000) Hayflick, his limit, and
pulmonary artery, aorta and umbilical vein. Antagonistic
cellular ageing, Nat. Rev. Mol. Cell Biol., 1, 72-76.
action on the beta!adrenoceptor coupled adenylate cyclase
25.
Munoz!Espin, D., and Serrano, M. (2014) Cellular senes!
system, J. Mol. Cell. Cardiol., 21, Suppl. 1, 119-123.
cence: from physiology to pathology, Nat. Rev. Mol. Cell
43.
Tkachuk, V.A. (2000) Membrane receptors and intracellu!
Biol., 15, 482-496.
lar calcium, Membr. Cell Biol., 13, 263-285.
26.
Klochendler, A., Weinberg!Corem, N., Moran, M., Swisa, A.,
44.
Ткачук В.А., Авакян А.Е. (2003) Молекулярные меха!
Pochet, N., Savova, V., Vikesa, J., Van de Peer, Y.,
низмы сопряжения G!белков с мембранными рецеп!
Brandeis, M., Regev, A., Nielsen, F.C., Dor, Y., and Eden, A.
торами и системами вторичных посредников, Рос!
(2012) A transgenic mouse marking live replicating cells
сийский физиологический журнал им. И.М. Сеченова, 89,
reveals in vivo transcriptional program of proliferation,
1478-1490.
Dev. Cell, 23, 681-690.
45.
Tkachuk, V.A. (1982) Regulation of adenylate cyclase by
27.
Brockes, J.P., and Kumar, A. (2008) Comparative aspects
hormones and guanine nucleotides in normal, desensi!
of animal regeneration, Annu. Rev. Cell Dev. Biol., 24,
tized, and resensitized rabbit heart, Adv. Myocardiol., 3,
525-549.
305-316.
БИОХИМИЯ том 85 вып. 1 2020
БИОХИМИЧЕСКАЯ РЕГУЛЯЦИЯ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ
31
46.
Ткачук В.А. (1989) Развитие десенситизации и гипер!
(2000) Acidosis inhibits endothelial cell apoptosis and
чувствительности аденилатциклазной системы сердца
function and induces basic fibroblast growth factor and
под влиянием гормонов, Кардиология, 29, 122-125.
vascular endothelial growth factor expression, Circ. Res.,
47.
Ткачук В.А., Рыбин В.О., Никашин А.В. (1994) Стеро!
86, 312-318.
идные и тиреоидные гормоны в регуляции G!белков,
66.
Green, J., and Maor, G. (2000) Effect of metabolic acido!
связывающих мембранные рецпторы с системами
sis on the growth hormone/IGF!I endocrine axis in skele!
вторичных посредников, Доклады Российской акаде!
tal growth centers, Kidney Int., 57, 2258-2267.
мии медицинских наук, 7-12.
67.
Conway, K., Price, P., Harding, K.G., and Jiang, W.G.
48.
Evans, R.M., and Mangelsdorf, D.J. (2014) Nuclear
(2006) The molecular and clinical impact of hepatocyte
receptors, RXR, and the big bang, Cell, 157, 255-266.
growth factor, its receptor, activators, and inhibitors in
49.
Sysoeva, V.Y., Ageeva, L.V., Tyurin!Kuzmin, P.A.,
wound healing, Wound Repair Regen., 14, 2-10.
Sharonov, G.V., Dyikanov, D.T., Kalinina, N.I., and
68.
Satoh, A., and Makanae, A. (2014) Conservation of posi!
Tkachuk, V.A. (2017) Local angiotensin II promotes adi!
tion!specific gene expression in axolotl limb skin, Zool.
pogenic differentiation of human adipose tissue mesenchy!
Sci., 31, 6-13.
mal stem cells through type 2 angiotensin receptor, Stem
69.
Makarevich, P.I., Dergilev, K.V., Tsokolaeva, Z.I.,
Cell Res., 25, 115-122.
Boldyreva, M.A., Shevchenko, E.K., Gluhanyuk, E.V.,
50.
Tyurin!Kuzmin, P.A., Chechekhin, V.I., Ivanova, A.M.,
Gallinger, J.O., Menshikov, M.Y., and Parfyonova, Y.V.
Dyikanov, D.T., Sysoeva, V.Y., Kalinina, N.I., and
(2018) Angiogenic and pleiotropic effects of VEGF165 and
Tkachuk, V.A. (2018) Noradrenaline sensitivity is severely
HGF combined gene therapy in a rat model of myocardial
impaired in immortalized adipose!derived mesenchymal
infarction, PLoS One, 13, e0197566.
stem cell line, Int. J. Mol. Sci.,
19, pii: E3712,
70.
Rokas, A. (2008) The molecular origins of multicellular
doi: 10.3390/ijms19123712.
transitions, Curr. Opin. Genet. Dev., 18, 472-478.
51.
Tyurin!Kuzmin, P.A., Fadeeva, J.I., Kanareikina, M.A.,
71.
King, N. (2004) The unicellular ancestry of animal devel!
Kalinina, N.I., Sysoeva, V.Y., Dyikanov, D.T., Stambolsky, D.V.,
opment, Dev. Cell, 7, 313-325.
and Tkachuk, V.A. (2016) Activation of beta!adrenergic
72.
King, N., and Carroll, S.B. (2001) A receptor tyrosine
receptors is required for elevated alpha1A!adrenoreceptors
kinase from choanoflagellates: molecular insights into early
expression and signaling in mesenchymal stromal cells, Sci.
animal evolution, Proc. Natl. Acad. Sci. USA,
98,
Rep., 6, 32835.
15032-15037.
52.
Tyurin!Kuzmin, P.A., Dyikanov, D.T., Fadeeva, J.I.,
73.
Pincus, D., Letunic, I., Bork, P., and Lim, W.A. (2008)
Sysoeva, V.Y., and Kalinina, N.I. (2018) Flow cytometry
Evolution of the phospho!tyrosine signaling machinery in
analysis of adrenoceptors expression in human adipose!
premetazoan lineages, Proc. Natl. Acad. Sci. USA, 105,
derived mesenchymal stem/stromal cells, Sci. Data, 5, 180196.
9680-9684.
53.
Levi!Montalcini, R., and Booker, B. (1960) Excessive
74.
Manning, G., Young, S.L., Miller, W.T., and Zhai, Y.
growth of the sympathetic ganglia evoked by a protein iso!
(2008) The protist, Monosiga brevicollis, has a tyrosine
lated from mouse salivary glands, Proc. Natl. Acad. Sci.
kinase signaling network more elaborate and diverse than
USA, 46, 373-384.
found in any known metazoan, Proc. Natl. Acad. Sci. USA,
54.
Cohen, S. (1962) Isolation of a mouse submaxillary gland
105, 9674-9679.
protein accelerating incisor eruption and eyelid opening in
75.
Mummery, C.L., van den Eijnden!van Raaij, A.J., Feijen, A.,
the new!born animal, J. Biol. Chem., 237, 1555-1562.
Freund, E., Hulskotte, E., Schoorlemmer, J., and Kruijer, W.
55.
Cohen, S. (2008) Origins of growth factors: NGF and
(1990) Expression of growth factors during the differentia!
EGF, J. Biol. Chem., 283, 33793-33797.
tion of embryonic stem cells in monolayer, Dev. Biol., 142,
56.
Lemmon, M.A., and Schlessinger, J. (2010) Cell signaling
406-413.
by receptor tyrosine kinases, Cell, 141, 1117-1134.
76.
Shilo, B.Z. (2005) Regulating the dynamics of EGF recep!
57.
Hunter, T. (2015) Discovering the first tyrosine kinase,
tor signaling in space and time, Development, 132,
Proc. Natl. Acad. Sci. USA, 112, 7877-7882.
4017-4027.
58.
Clayton, A.H., Walker, F., Orchard, S.G., Henderson, C.,
77.
Piotrowska!Nitsche, K., Perea!Gomez, A., Haraguchi, S.,
Fuchs, D., Rothacker, J., Nice, E.C., and Burgess, A.W.
and Zernicka!Goetz, M. (2005) Four!cell stage mouse
(2005) Ligand!induced dimer!tetramer transition during
blastomeres have different developmental properties,
the activation of the cell surface epidermal growth factor
Development, 132, 479-490.
receptor!A multidimensional microscopy analysis, J. Biol.
78.
Zdravkovic, T., Nazor, K.L., Larocque, N., Gormley, M.,
Chem., 280, 30392-30399.
Donne, M., Hunkapillar, N., Giritharan, G., Bernstein, H.S.,
59.
Himanen, J.P., and Nikolov, D.B. (2003) Eph signaling: a
Wei, G., Hebrok, M., Zeng, X., Genbacev, O., Mattis, A.,
structural view, Trends Neurosci., 26, 46-51.
McMaster, M.T., Krtolica, A., Valbuena, D., Simon, C.,
60.
Fambrough, D., McClure, K., Kazlauskas, A., and Lander, E.S.
Laurent, L.C., Loring, J.F., and Fisher, S.J. (2015) Human
(1999) Diverse signaling pathways activated by growth fac!
stem cells from single blastomeres reveal pathways of
tor receptors induce broadly overlapping, rather than inde!
embryonic or trophoblast fate specification, Development,
pendent, sets of genes, Cell, 97, 727-741.
142, 4010-4025.
61.
Katz, M., Amit, I., and Yarden, Y. (2007) Regulation of
79.
Manca, A., Capsoni, S., Di Luzio, A., Vignone, D.,
MAPKs by growth factors and receptor tyrosine kinases,
Malerba, F., Paoletti, F., Brandi, R., Arisi, I., Cattaneo, A.,
Biochim. Biophys. Acta, 1773, 1161-1176.
and Levi!Montalcini, R. (2012) Nerve growth factor regu!
62.
Goh, L.K., and Sorkin, A. (2013) Endocytosis of receptor
lates axial rotation during early stages of chick embryo
tyrosine kinases, Cold Spring Harb. Perspect. Biol., 5,
development, Proc. Natl. Acad. Sci. USA, 109, 2009-2014.
a017459.
80.
Ud!Din, S., Volk, S.W., and Bayat, A. (2014) Regenerative
63.
Roskoski, R., Jr. (2012) ERK1/2 MAP kinases: structure,
healing, scar!free healing and scar formation across the
function, and regulation, Pharmacol. Res., 66, 105-143.
species: current concepts and future perspectives, Exp.
64.
Ihle, J.N. (1995) Cytokine receptor signalling, Nature,
Dermatol., 23, 615-619.
377, 591-594.
81.
Bielefeld, K.A., Amini!Nik, S., and Alman, B.A. (2013)
65.
D’Arcangelo, D., Facchiano, F., Barlucchi, L.M., Melillo, G.,
Cutaneous wound healing: recruiting developmental path!
Illi, B., Testolin, L., Gaetano, C., and Capogrossi, M.C.
ways for regeneration, Cell. Mol. Life Sci., 70, 2059-2081.
БИОХИМИЯ том 85 вып. 1 2020
32
МАКАРЕВИЧ и др.
82.
Kalinina, N.I., Sysoeva, V.Y., Rubina, K.A., Parfenova, Y.V.,
99. Dunbar, C.E., High, K.A., Joung, J.K., Kohn, D.B.,
and Tkachuk, V.A. (2011) Mesenchymal stem cells in tis!
Ozawa, K., and Sadelain, M. (2018) Gene therapy comes of
sue growth and repair, Acta Naturae, 3, 30-37.
age, Science, 359, pii: eaan4672, doi: 10.1126/science.aan4672.
83.
Takeo, M., Lee, W., and Ito, M. (2015) Wound healing and
100. Savukinas, U.B., Enes, S.R., Sjoland, A.A., and
skin regeneration, Cold Spring Harb. Perspect. Med., 5,
Westergren!Thorsson, G. (2016) Concise review: the
a023267.
bystander effect: mesenchymal stem cell!mediated lung
84.
Makanae, A., Mitogawa, K., and Satoh, A.
(2016)
repair, Stem Cells, 34, 1437-1444.
Cooperative inputs of Bmp and Fgf signaling induce tail
101. Kalinina, N., Kharlampieva, D., Loguinova, M., Butenko, I.,
regeneration in urodele amphibians, Dev. Biol., 410,
Pobeguts, O., Efimenko, A., Ageeva, L., Sharonov, G.,
45-55.
Ischenko, D., Alekseev, D., Grigorieva, O., Sysoeva, V.,
85.
Makanae, A., Hirata, A., Honjo, Y., Mitogawa, K., and
Rubina, K., Lazarev, V., and Govorun, V.
(2015)
Satoh, A. (2013) Nerve independent limb induction in
Characterization of secretomes provides evidence for adi!
axolotls, Dev. Biol., 381, 213-226.
pose!derived mesenchymal stromal cells subtypes, Stem
86.
Makanae, A., Mitogawa, K., and Satoh, A.
(2014)
Cell Res. Ther., 6, 221.
Implication of two different regeneration systems in limb
102. Rolandsson Enes, S., Ahrman, E., Palani, A., Hallgren, O.,
regeneration, Regeneration (Oxf), 1, 1-9.
Bjermer, L., Malmstrom, A., Scheding, S., Malmstrom, J.,
87.
Yu, L., Dawson, L.A., Yan, M., Zimmel, K., Lin, Y.L.,
and Westergren!Thorsson, G. (2017) Quantitative pro!
Dolan, C.P., Han, M., and Muneoka, K. (2019) BMP9
teomic characterization of lung!MSC and bone marrow!
stimulates joint regeneration at digit amputation wounds in
MSC using DIA!mass spectrometry, Sci. Rep., 7, 9316.
mice, Nat. Commun., 10, 424.
103. Kim, H.S., Choi, D.Y., Yun, S.J., Choi, S.M., Kang, J.W.,
88.
Barrientos, S., Brem, H., Stojadinovic, O., and Tomic!
Jung, J.W., Hwang, D., Kim, K.P., and Kim, D.W. (2012)
Canic, M. (2014) Clinical application of growth factors
Proteomic analysis of microvesicles derived from human
and cytokines in wound healing, Wound Repair Regen., 22,
mesenchymal stem cells, J. Proteome Res., 11, 839-849.
569-578.
104. Sagaradze, G., Grigorieva, O., Nimiritsky, P., Basalova, N.,
89.
Friedmann, T., and Roblin, R. (1972) Gene therapy for
Kalinina, N., Akopyan, Z., and Efimenko, A. (2019)
human genetic disease? Science, 175, 949-955.
Conditioned medium from human mesenchymal stromal
90.
Makarevich, P.I., and Parfyonova, Ye.V.
(2017)
cells: towards the clinical translation, Int. J. Mol. Sci., 20,
Therapeutic angiogenesis: foundations and practical appli!
pii: E1656, doi: 10.3390/ijms20071656.
cation, in Physiologic and Pathologic Angiogenesis -
105. Phinney, D.G., and Pittenger, M.F. (2017) Concise review:
Signaling Mechanisms and Targeted Therapy, Intech Open,
MSC!derived exosomes for cell!free therapy, Stem Cells,
London, pp. 343-364.
35, 851-858.
91.
Boldyreva, M.A., Bondar, I.V., Stafeev, I.S., Makarevich, P.I.,
106. Bang, O.Y., and Kim, E.H. (2019) Mesenchymal stem
Beloglazova, I.B., Zubkova, E.S., Shevchenko, E.K.,
cell!derived extracellular vesicle therapy for stroke: chal!
Molokotina, Y.D., Karagyaur, M.N., Ratner, E.I., and
lenges and progress, Front. Neurol., 10, 211.
Parfyonova, Y.V. (2018) Plasmid!based gene therapy with
107. Zubkova, E.S., Beloglazova, I.B., Makarevich, P.I.,
hepatocyte growth factor stimulates peripheral nerve
Boldyreva, M.A., Sukhareva, O.Y., Shestakova, M.V.,
regeneration after traumatic injury, Biomed. Pharmacother.,
Dergilev, K.V., Parfyonova, Y.V., and Menshikov, M.Y.
101, 682-690.
(2016) Regulation of adipose tissue stem cells angiogenic
92.
Макаревич П.И., Рубкина К.А., Дыйканов Д.Т., Тка!
potential by tumor necrosis factor!Alpha, J. Cell. Biochem.,
чук В.А., Парфенова Е.В. (2015) Терапевтический ан!
117, 180-196.
гиогенез с применением факторов роста: современное
108. Efimenko, A., Starostina, E., Kalinina, N., and Stolzing, A.
состояние и перспективы развития, Кардиология, 55,
(2011) Angiogenic properties of aged adipose derived mes!
59-71.
enchymal stem cells after hypoxic conditioning, J. Transl.
93.
Karagyaur, M., Dyikanov, D., Makarevich, P., Semina, E.,
Med., 9, 10.
Stambolsky, D., Plekhanova, O., Kalinina, N., and
109. Aleksandrushkina, N.A., Danilova, N.V., Grigorieva, O.A.,
Tkachuk, V. (2015) Non!viral transfer of BDNF and uPA
Mal’kov, P.G., Popov, V.S., Efimenko, A.Y., and
stimulates peripheral nerve regeneration, Biomed.
Makarevich, P.I. (2019) Cell sheets of mesenchymal stro!
Pharmacother., 74, 63-70.
mal cells effectively stimulate healing of deep soft tissue
94.
Makarevich, P., Tsokolaeva, Z., Shevelev, A., Rybalkin, I.,
defects, Bull. Exp. Biol. Med., 167, 159-163.
Shevchenko, E., Beloglazova, I., Vlasik, T., Tkachuk, V.,
110. Baertschiger, R.M., Serre!Beinier, V., Morel, P., Bosco, D.,
and Parfyonova, Y. (2012) Combined transfer of human
Peyrou, M., Clement, S., Sgroi, A., Kaelin, A., Buhler, L.H.,
VEGF165 and HGF genes renders potent angiogenic
and Gonelle!Gispert, C. (2009) Fibrogenic potential of
effect in ischemic skeletal muscle, PLoS One, 7, e38776.
human multipotent mesenchymal stromal cells in injured
95.
Shyu, K.G., Chang, H., and Isner, J.M. (2003) Synergistic
liver, PLoS One, 4, e6657.
effect of angiopoietin!1 and vascular endothelial growth
111.
Shi, S., and Gronthos, S. (2003) Perivascular niche of
factor on neoangiogenesis in hypercholesterolemic rabbit
postnatal mesenchymal stem cells in human bone marrow
model with acute hindlimb ischemia, Life Sci., 73,
and dental pulp, J. Bone Miner. Res., 18, 696-704.
563-579.
112. Murphy, A.R., Laslett, A., O’Brien, C.M., and Cameron, N.R.
96.
Слободкина Е.А., Макаревич П.И., Долинкин А.О.
(2017) Scaffolds for 3D in vitro culture of neural lineage
(2018) Разработка генотерапевтических лекарствен!
cells, Acta Biomater., 54, 1-20.
ных препаратов, Биофармацевтический журнал, 10,
113. Pourquie, O., Al Tanoury, Z., and Chal, J. (2018) The long road
3-14.
to making muscle in vitro, Curr. Top. Dev. Biol., 129, 123-142.
97.
Badat, M., and Davies, J. (2017) Gene therapy in a patient
114. Syverud, B.C., VanDusen, K.W., and Larkin, L.M. (2016)
with sickle cell disease, N. Engl. J. Med., 376, 2093-2094.
Growth factors for skeletal muscle tissue engineering, Cells
98.
Rangarajan, S., Walsh, L., Lester, W., Perry, D.,
Tissues Organs, 202, 169-179.
Madan, B., Laffan, M., Yu, H., Vettermann, C., Pierce,
115. Cosson, S., Otte, E.A., Hezaveh, H., and Cooper!White, J.J.
G.F., Wong, W.Y., and Pasi, K.J. (2017) AAV5!Factor VIII
(2015) Concise review: tailoring bioengineered scaffolds
gene transfer in severe hemophilia A, N. Engl. J. Med., 377,
for stem cell applications in tissue engineering and regen!
2519-2530.
erative medicine, Stem Cells Transl. Med., 4, 156-164.
БИОХИМИЯ том 85 вып. 1 2020
БИОХИМИЧЕСКАЯ РЕГУЛЯЦИЯ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ
33
116. Lane, S.W., Williams, D.A., and Watt, F.M.
(2014)
119. Mohamed, T.M.A., Ang, Y.S., Radzinsky, E., Zhou, P.,
Modulating the stem cell niche for tissue regeneration,
Huang, Y., Elfenbein, A., Foley, A., Magnitsky, S., and
Nat. Biotechnol., 32, 795-803.
Srivastava, D. (2018) Regulation of cell cycle to stimulate
117. Efimenko, A.Y., Kochegura, T.N., Akopyan, Z.A., and
adult cardiomyocyte proliferation and cardiac regenera!
Parfyonova, Y.V. (2015) Autologous stem cell therapy: how
tion, Cell, 173, 104-116, e112.
aging and chronic diseases affect stem and progenitor cells,
120. Huang, P., Zhang, L., Gao, Y., He, Z., Yao, D., Wu, Z.,
Biores. Open Access, 4, 26-38.
Cen, J., Chen, X., Liu, C., Hu, Y., Lai, D., Hu, Z., Chen, L.,
118. Chacon!Martinez, C.A., Koester, J., and Wickstrom, S.A.
Zhang, Y., Cheng, X., Ma, X., Pan, G., Wang, X., and Hui, L.
(2018) Signaling in the stem cell niche: regulating cell fate,
(2014) Direct reprogramming of human fibroblasts to function!
function and plasticity, Development, 145.
al and expandable hepatocytes, Cell Stem Cell, 14, 370-384.
BIOCHEMICAL REGULATION OF REGENERATIVE PROCESSES
BY GROWTH FACTORS AND CYTOKINES: BASIC MECHANISMS
AND RELEVANCE FOR REGENERATIVE MEDICINE*
Review
P. I. Makarevich1,2**, A. Yu. Efimenko1,2, and V. A. Tkachuk1,2,3***
1 Lomonosov Moscow State University, Institute for Regenerative Medicine, Medical Research
and Education Center, 119991 Moscow, Russia; E!mail: pmakarevich@mc.msu.ru
2 Lomonosov Moscow State University, Faculty of Fundamental Medicine, 119991 Moscow, Russia
3 Institute of Experimental Cardiology, National Medical Research Center of Cardiology, 121552 Moscow, Russia
Received June 15, 2019
Revised September 30, 2019
Accepted October 16, 2019
At the end of the 20th century regenerative medicine still uses cultured cells or tissue!engineered structures for trans!
plantation into human body to restore lost or damaged organs. However, at the turn of the century, practical achieve!
ments in this field were far from the promising experimental results. It became apparent that successful resolution of
practical problems is impossible without understanding fundamental regulation mechanisms of development, renew!
al and restoration of human tissues. These aspects have been successfully investigated by cell biologists, physiologists,
and biochemists working in the field of “regenerative biology”. Their studies revealed that during regeneration, growth
factors, cytokines and hormones act beyond regulation of cell individual functions, but activating specific receptor
systems, they control key tissue repair processes including cell proliferation and differentiation. These events require
numerous coordinated stimuli and therefore are practically irreproducible using single proteins or low molecular
weight compounds, i.e., poorly managed using classical pharmacological approaches. This review summarizes current
views on regulatory mechanisms of renewal and regeneration in human tissues with emphasis on certain general bio!
logical and evolutionary aspects in this area. A special attention is focused on biochemical mechanisms of regulation,
in particular, the role of growth factors and cytokines, as well as on mechanisms of their reception. Promising practi!
cal approaches for activating regeneration using small molecules or stem cell secretome, which contains a wide reper!
toire of growth factors, cytokines, peptides, as well as extracellular vesicles, are discussed in a separate section.
Keywords: regenerative medicine, stem cell, growth factor, cytokine, intracellular signaling, receptor tyrosine kinase
3 БИОХИМИЯ том 85 вып. 1 2020