БИОХИМИЯ, 2020, том 85, вып. 1, с. 34 - 48
УДК 577.1
РЕГУЛЯЦИЯ МАЛАТДЕГИДРОГЕНАЗ
И ГЛУТАМАТДЕГИДРОГЕНАЗЫ МОЗГА
ЖИВОТНЫХ ТИАМИНОМ in vitro И in vivo*
© 2020
О.А. Меженская1, В.А. Алешин2,3, Т. Кэне4,
А.В. Артюхов2,3, В.И. Буник2,3**,***
1 Институт биохимии им. А.В. Палладина НАНУ, 01601 Киев, Украина
2 Московский государственный университет им. М.В. Ломоносова, факультет биоинженерии
и биоинформатики, 119991 Москва, Россия; электронная почта: bunik@belozersky.msu.ru
3 НИИ физико/химической биологии им. А.Н. Белозерского,
Московский государственный университет им. М.В. Ломоносова, 119991 Москва, Россия
4 Институт экспериментальной медицины
Университета им. Отто фон Гюрике, 39120 Магдебург, Германия
Поступила в редакцию 05.08.2019
После доработки 24.09.2019
Принята к публикации 24.09.2019
Для исследования механизмов некоферментного взаимодействия тиамина и его дифосфата (ТДФ) с белка
ми мозга ацетоновый экстракт синаптосом мозга быка или гомогенат коры мозга крысы подвергали аффин
ной хроматографии на модифицированной тиамином сефарозе (тиамин сефарозе). В последовательных
элюатах тиамином (при рН 7,4 или 5,6), хлоридом натрия и мочевиной характеризовали представленность
глутаматдегидрогеназы (ГДГ) и изоферментов малатдегидрогеназ (МДГ) методом масс спектрометрии, а
также изменение активностей данных ферментов в присутствии тиамина и/или ТДФ. Активация малатде
гидрогеназной реакции тиамином максимальна после элюции белков синаптосомальной фракции кислым
раствором тиамина, не приводящей к высвобождению МДГ1. Влияние экзогенного тиамина или ТДФ на
активность ГДГ зависит от присутствия эндогенных регуляторов фермента. Так, тиамин и/или ТДФ акти
вируют ГДГ мозга в элюатах с тиамин сефарозы, но ингибируют фермент в наносимых на тиамин сефаро
зу препаратах. Установлено, что ТДФ ингибирует ГДГ, активированную ADP. Активация ГДГ тиамином (но
не ТДФ) снижена при ее элюции NaCl и мочевиной после применения кислого раствора тиамина по срав
нению с аналогичными фракциями после элюции слабощелочным раствором тиамина. Одновременное по
вышение содержания МДГ2 и общей активности ГДГ в данных фракциях свидетельствует о роли известно
го взаимодействия ГДГ с МДГ2 в стабилизации активности ГДГ и регуляции ГДГ тиамином. Биологичес
кий потенциал регуляции ГДГ мозга тиамином подтвержден в экспериментах in vivo, установивших измене
ние регуляторных свойств ГДГ мозга после введения крысам высокой дозы тиамина. Биоинформатический
анализ наборов элюируемых тиамином с тиамин сефарозы белков показал специфическое обогащение их
аннотации терминами «фосфобелок», «ацетилирование» и «метилирование». Связь тиамина с посттрансля
ционными модификациями в мозге может вносить вклад в механизмы нейропротекторного действия высо
ких доз тиамина, включающие регуляцию окисления основного возбуждающего нейромедиатора мозга -
глутамата.
КЛЮЧЕВЫЕ СЛОВА: тиамин, малатдегидрогеназа, глутаматдегидрогеназа, тиамин сефароза, фосфобе
лок, ацетилирование, метилирование.
DOI: 10.31857/S0320972520010030
Тиамин (витамин В1) является одним из ос
влияния на центральный метаболизм глюкозы
новных витаминов группы В, широко применя
[1-3]. В основном такое действие приписывают
емых в медицинской практике в силу своего
дифосфорилированному производному тиами
нейротропного эффекта и стимулирующего
на - тиаминдифосфату (ТДФ), который являет
Принятые сокращения: ГДГ - глутаматдегидрогеназа; МДГ - малатдегидрогеназа; ОПИ - общий поток ионов;
ТДФ - тиаминдифосфат; тиамин сефароза - сефароза, модифицированная тиамином.
* Статья посвящается 80 летию кафедры биохимии биологического факультета МГУ им. М.В. Ломоносова (см. том 84,
вып. 11, 2019).
** Автор является выпускником кафедры биохимии биологического факультета МГУ им. М.В. Ломоносова.
*** Адресат для корреспонденции.
34
РЕГУЛЯЦИЯ ДЕГИДРОГЕНАЗ МАЛАТА И ГЛУТАМАТА ТИАМИНОМ
35
ся необходимым коферментом таких фермен
новые данные о путях и молекулярных механиз
тов центрального метаболизма, как транскето
мах некоферментного действия тиамина и его
лаза и дегидрогеназы 2 оксокислот. Однако в
природных производных.
последнее время, в т.ч. в связи с угрожающими
темпами роста нейродегенеративных заболева
ний, все большее внимание привлекают и дру
МЕТОДЫ ИССЛЕДОВАНИЯ
гие, так называемые некоферментные, меха
низмы действия тиамина и его природных про
Материалы. Использованы реактивы следу
изводных [4-7]. В качестве эффекторов не
ющих производителей: ТДФ, 2 оксоглутарат
только ТДФ зависимых, но и сопряженных с
(динатриевая соль), NADH (динатриевая соль),
ними ферментов тиаминовые соединения могут
ADP, GTP, CHAPS, ингибиторы протеаз AEBSF,
обеспечить системную регуляцию метаболизма
апротинин, бестатин, E 64, лейпептин, пепста
за счет воздействия на множественные белки
тин А - «Sigma», США; тиамин, полиэтилен
мишени. Такое плейотропное действие тиами
гликоль 6000, глюкоза, Tris HCl - «Serva», Гер
новых соединений лучше объясняет ряд экспе
мания; глицерол - «Biomedicals, LLC», США;
риментальных результатов по регуляции дан
NAD+ - «Gerbu», Германия. В части экспери
ными соединениями продукции ацетилхолина,
ментов применяли бикарбонатный физиологи
которые плохо согласуются с чисто кофермент
ческий раствор Кребса-Рингера, содержавший
ным действием ТДФ [5, 6]. Следует отметить,
118 мМ NaCl, 2,34 мМ KH2PO4, 4,6 мМ KCl,
что плейотропный характер действия генов [8]
1,19 мМ MgSO4,
2,42 мМ CaCl2,
24,9 мМ
и белковых регуляторов метаболизма (напри
NaHCO3 и 10 мМ глюкозы, pH 7,4. Растворы го
мер, таких белков, как транскрипционные регу
товили на деионизированной воде стандарта
ляторы р53 или Nrf 2 [9]) хорошо известен, од
Milli Q, использованные в работе соли были наи
нако для низкомолекулярных регуляторов та
высшей степени чистоты.
кая множественность мишеней действия тради
Эксперименты с животными. Для получения
ционно рассматривается лишь как источник
белков из мозга крыс использовали белых крыс
побочных эффектов [10]. Тем не менее в пос
линии Wistar, содержавшихся на стандартном
леднее время возрастает внимание к возмож
рационе в виварии МГУ им. М.В. Ломоносова с
ности повышения эффективности терапии при
постоянным доступом к воде и пище при свето
использовании лекарств, эффекты которых
вом цикле 12/12 ч (световая фаза с 9:00 до 21:00
опосредованы множественным действием на
по местному времени), температуре (21 ± 2) °C и
несколько мишеней [11]. В этой связи изучение
относительной влажности воздуха (53 ± 5)%.
молекулярных механизмов аналогичной регу
Крыс умерщвляли методом декапитации с по
ляции природными низкомолекулярными сое
мощью гильотины. Мозги быков возрастом
динениями, включая витамины, вызывает осо
1,5-3 года были получены на бойне (г. Киев).
бый интерес [6, 12].
Аффинной хроматографии подвергали гомо
Данная работа развивает описанный ранее
генаты коры мозга самок крыс линии Wistar
подход для исследования множественных ми
массой 250-300 г; действие высоких доз тиами
шеней действия тиамина, использующий аф
на исследовали на самцах линии Wistar массой
финную хроматографию фракций мозга на но
300-350 г (возраст 3-4 мес.). Эксперименталь
сителе, содержащем ковалентно связанный тиа
ным животным вводили тиамин из расчета
мин, с последующей масс спектрометрической
400 мг/кг веса (водный раствор 200 мг/мл тиа
идентификацией белков в элюате [6]. По срав
мина гидрохлорида, рН после добавления
нению с предыдущим исследованием, в котором
NaOH составлял 6,7-6,9) внутрибрюшинно в
связанные с модифицированной тиамином се
вечернее время (17:00-19:00). Крысам кон
фарозой (тиамин сефарозой) белки мозга кры
трольной группы вводили аналогичный объем
сы (так называемый тиаминовый протеом) элю
0,9% ного раствора NaCl. Для инъекций ис
ировались неспецифическими агентами, в нас
пользовали инсулиновые шприцы в соответ
тоящей работе охарактеризована аффинная рН
ствии с опубликованными рекомендациями
зависимая элюция белков с тиамин сефарозы
[13]. Через 24 ч после инъекций проводили де
тиамином, использован иной способ модифи
капитацию животных.
кации носителя тиамином, исключающий мно
Аффинная хроматография. Ацетоновый по
жественную ориентацию «наживки» на носите
рошок из частично очищенной фракции мито
ле, и проведено сравнительное исследование
хондрий мозга быка получали согласно ранее
профилей элюции с тиамин сефарозы белков
описанной методике [14] и хранили сухим при
синаптосомальной фракции и полного гомоге
-70 °C. Экстракцию белков ацетонового порош
ната мозга быка и крысы. В результате получены
ка проводили буфером Кребса-Рингера соглас
БИОХИМИЯ том 85 вып. 1 2020
3*
36
МЕЖЕНСКАЯ и др.
но ранее описанному протоколу [6]. Гомогенат
Для кинетической характеристики исполь
коры мозга крыс получали в соответствии с ра
зовали ГДГ и МДГ в составе объединенных го
нее опубликованным протоколом [15].
могенатов мозга исследуемой группы крыс в
В хроматографии использовали аффинный
рамках одной экспериментальной серии (по три
сорбент тиамин N 4 азобензоил ε гидразидсе
животных в контрольной группе и группе крыс,
фарозу 4В (тиамин сефароза), синтезированный
которым вводили тиамин). Эксперименты на
по методу Клящицкого с соавт. [16]. Экстракт
животных повторяли в трех независимых сери
ацетонового порошка мозга или полный гомоге
ях - общее число животных составило 18 крыс.
нат коры мозга наносили на колонку с тиамин
Гомогенаты мозга готовили согласно ранее опи
сефарозой, предварительно уравновешенную бу
санному протоколу [15], нерастворимую фрак
фером Кребса-Рингера. Скорость потока в ходе
цию осаждали центрифугированием (30 мин,
нанесения образцов и последующего промыва
20 000 g, 4 °C). Для удаления содержащихся в го
ния носителя составляла 0,2 мл/мин. Удаление
могенатах мозга низкомолекулярных соедине
несвязавшихся или слабосвязавшихся белков
ний - регуляторов исследуемых ферментов -
контролировали по снижению оптической плот
супернатант подвергали быстрой гель фильтра
ности элюата при 280 нм до базовой линии.
ции на колонке HiTrapTM Desalting, 5 мл («GE
Связавшиеся с тиамин сефарозой белки
Healthcare», Швеция) согласно протоколу про
элюировали в несколько стадий. Первая стадия -
изводителя. Белки элюировали 100 мМ Tris
элюция 5 или 10 мМ тиамином, рН 7,4 или 5,6.
HCl, pH 7,5. Данные кинетических эксперимен
Для дальнейшей ступенчатой элюции использо
тов (n = 3) объединяли и аппроксимировали в
вали 10 мМ Tris HCl, рН 7,4, содержавший 1 М
программе GraphPad Prism v. 8.0 c использова
NaCl или 2 M мочевину, как описано ранее [6].
нием встроенных моделей. Для аппроксимации
Замену буфера на 10 мМ Tris HCl, рН 7,4, про
насыщения
2 оксоглутаратом и глутаматом
водили одновременно с концентрированием
применяли модель полного субстратного инги
элюатов с помощью центрифужных фильтров
бирования: v = Vmax · [S]/(Km + [S](1 + [S]/Ki)),
Amicon Ultra 15 с мембраной, непроницаемой
где v - скорость реакции при данной концент
для белков массой свыше 30 кДа. Сорбент реге
рации субстрата [S], Vmax - максимальная ско
нерировали промыванием 8 М мочевиной и де
рость реакции, Km - константа Михаэлиса, Ki -
ионизированной водой и хранили в 0,02% ном
константа субстратного ингибирования. Насы
растворе азида натрия.
щение ГДГ ингибитором (GTP) или активатора
Измерение ферментативных активностей. Ак
ми (ADP и лейцин) характеризуется коопера
тивность NADH зависимых дегидрогеназ - ма
тивными взаимодействиями субъединиц. По
латдегидрогеназы (МДГ) и глутаматдегидроге
этому данные зависимости аппроксимировали с
назы (ГДГ) - измеряли по поглощению NADH
помощью модели логистической регрессии с че
при 340 нм. Характеристику профилей элюции
тырьмя параметрами («four parameter logistic
проводили путем измерения активностей фер
regression», 4PL), учитывающей отличие коэф
ментов при насыщающих концентрациях
фициента Хилла от единицы.
субстратов. Для исследования влияния тиамина
Измерение концентрации белка в образцах.
или ТДФ на активности ферментов использова
Концентрацию белка определяли по методу
ли специфические для каждого фермента усло
Лоури с соавт. [17].
вия максимизации эффектов [6]. Детали ис
Характеристика тиамин@зависимых протеомов
пользованных условий приведены в подписях к
исследуемых образцов. Элюированные с тиамин
рисункам и таблицам.
сефарозы белки, составляющие так называемый
Частичную очистку ГДГ мозга крысы для ис
тиамин зависимый протеом наносимых на аф
следования совместных эффектов ТДФ и ADP
финную колонку биологических образцов, раз
проводили следующим образом. Экстракцию
деляли с помощью электрофореза в денатуриру
белков осажденной из гомогената мозга мемб
ющих условиях с последующей идентификаци
ранной фракции осуществляли путем обработки
ей методом масс спектрометрии (LC MS/MS)
ультразвуком и добавления детергента CHAPS
после трипсинолиза, как описано ранее [6]. Для
(1%). Из полученного в результате центрифуги
идентификации полученных пептидов исполь
рования (40 мин, 11 000 g, 4 °C) супернатанта
зовали базы данных NCBI. Ввиду отсутствия ан
удаляли фракцию полиферментных комплексов
нотаций для части белков быка, для более пол
добавлением 0,16 объема 35% ного полиэтилен
ной идентификации этих белков проводили по
гликоля при рН 6,15 с последующим центрифу
иск по последовательностям базы данных
гированием (15 мин, 18 500 g, 4 °C). Полученный
SwissProt для всех организмов. Белки крысы
супернатант содержал частично очищенную из
идентифицировали с использованием последо
мозга крысы ГДГ.
вательностей базы данных SwissProt для крысы.
БИОХИМИЯ том 85 вып. 1 2020
РЕГУЛЯЦИЯ ДЕГИДРОГЕНАЗ МАЛАТА И ГЛУТАМАТА ТИАМИНОМ
37
Биоинформатический анализ элюированных с
ной хроматографии в зависимости от значения
тиамин сефарозы протеомов проводили с по
pH (7,4 или 5,6) на первой, аффинной, стадии
мощью программы DAVID v. 6.8, как описано
элюции. По данным масс спектрометрии вид
ранее [6].
но, что в обоих случаях ГДГ хорошо элюируется
Определение относительного содержания пеп@
мочевиной: в данном элюате обнаруживается
тидов ГДГ и МДГ в образцах. Содержание иссле
значительное число пептидов ГДГ даже в том
дуемых белков в частично очищенных препара
случае, когда фермент плохо элюируется на пре
тах оценивали с помощью полуколичественного
дыдущих стадиях (табл. 1). Однако при элюции
метода, основанного на пропорциональности
мочевиной после первичной элюции кислым
количества белка в препарате числу идентифи
(pH 5,6) раствором тиамина удельная и общая
цированных при масс спектрометрии пептидов
активности ГДГ на порядок и более превышают
[18]. Для сравнения разных образцов в геле ис
таковые в элюате мочевиной после первичной
пользовали отношение числа идентифициро
элюции слабощелочным (pH 7,4) раствором ти
ванных пептидов исследуемого фермента к об
амина. Кроме того, при первичной элюции кис
щему потоку ионов (ОПИ) при масс спектро
лым раствором тиамина распределение общей
метрическом анализе соответствующей пробы,
активности ГДГ, элюируемой на трех стадиях,
поскольку ОПИ пропорционален общему уров
хорошо согласуется с представленностью фер
ню определяемых в пробе пептидов. Значения
мента в элюатах по данным масс спектромет
ОПИ получали с помощью аналитической плат
рии, т.е. более высокая общая активность соот
формы Skyline [19]. Для удобства представления
ветствует большему числу уникальных пептидов
нормализованных данных использовали пара
ГДГ во фракции. Напротив, при первичной
метр ОПИ с коэффициентом 10-10 (ОПИ · 10-10).
элюции ГДГ слабощелочным раствором тиами
на (рН 7,4) ее активность, измеряемая в получа
емом на этой стадии элюате, составляет основ
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ную долю общей активности ГДГ, элюируемой с
тиамин сефарозы. При этом удельная актив
Аффинная хроматография на тиамин@сефаро@
ность ГДГ на стадии элюции слабощелочным
зе синаптосомальной фракции мозга быка. В
раствором тиамина вдвое превышает таковую
табл. 1 представлено сравнение активности и
при первичной элюции кислым раствором тиа
числа пептидов ГДГ из синаптосомальной
мина. Однако по данным масс спектрометрии
фракции мозга быка на разных стадиях аффин
фракция, полученная при элюции слабощелоч
Таблица 1. Активность глутаматдегидрогеназы (ГДГ) и уникальные для ГДГ пептиды в элюатах с тиамин сефарозы при
аффинной хроматографии ацетонового экстракта синаптосом мозга быка
Удельная активность ГДГ
Общая активность ГДГ
Белковая фракция
Число пептидов ГДГ
нмоль/мин
%
нмоль/мин
%
на 1 мг белка
Первая стадия элюции: 10 мМ тиамин, рН 7,4
Ацетоновый экстракт
19 ± 2
100
780 ± 60
100
8
10 мМ тиамин
12 ± 2
64
300 ± 50
39
1
1 M NaCl
14 ± 4
75
36 ± 2
5
1
2 М мочевина
2 ± 1
11
5 ± 1
2
4
Первая стадия элюции: 10 мМ тиамин, рН 5,6
Ацетоновый экстракт
14 ± 1
100
600 ± 50
100
8
10 мМ тиамин
6 ± 2
43
150 ± 50
25
6
1 M NaCl
16 ± 5
114
80 ± 30
14
4
2 М мочевина
21 ± 6
150
230 ± 70
39
6
Примечание. Активность ГДГ определяли после замены элюирующего раствора на 10 мМ Tris НCl (pH 7,4) при насыще
нии субстратами в среде следующего состава: 100 мМ Tris НСl, рН 7,5, 2,5 мМ 2 оксоглутарат, 0,2 мМ NАDH, 50 мМ
NH4Cl. Относительные активности указаны в процентах от уровней в исходных препаратах.
БИОХИМИЯ том 85 вып. 1 2020
38
МЕЖЕНСКАЯ и др.
ным раствором тиамина, содержит значительно
элюция тиамином не была эффективной, т.е.
меньшее количество ГДГ (обнаруживается лишь
при рН 5,6. Напротив, МДГ2 элюируется NaCl и
один характерный пептид ГДГ), чем аналогич
мочевиной после аффинной элюции тиамином
ная фракция, полученная в ходе элюции кис
при обоих значениях рН. Таким образом, при
лым раствором тиамина (шесть пептидов ГДГ)
рН 7,4 раствор тиамина элюирует с тиамин се
(табл. 1). Таким образом, аффинная элюция
фарозы практически всю МДГ1, тогда как при
белка ГДГ с тиамин сефарозы значительно эф
рН 5,6 элюция раствором тиамина эффективна
фективнее происходит при рН 5,6, чем при
лишь в отношении МДГ2 (табл. 2). Зависимость
рН 7,4, однако удельная и общая активности
профилей элюции изоферментов МДГ с тиа
ГДГ, элюируемой тиамином с тиамин сефаро
мин сефарозы от рН аффинной элюции тиами
зы, выше после элюции при рН 7,4, чем при
ном согласуется с разной чувствительностью
рН 5,6 (табл. 1).
структуры и функции данных изоферментов к
В табл. 2 представлено аналогичное сравне
изменениям рН [20, 21]. Повышение концент
ние активности и числа пептидов изоферментов
рации тиамина при аффинной элюции приво
МДГ при аффинной хроматографии с тиамин
дит к увеличению активности МДГ в получен
сефарозы. Следует учесть, что малатдегидроге
ной на этой стадии фракции и, как следствие, к
назная реакция катализируется цитоплазмати
снижению активности МДГ при последующей
ческим (МДГ1) и митохондриальным (МДГ2)
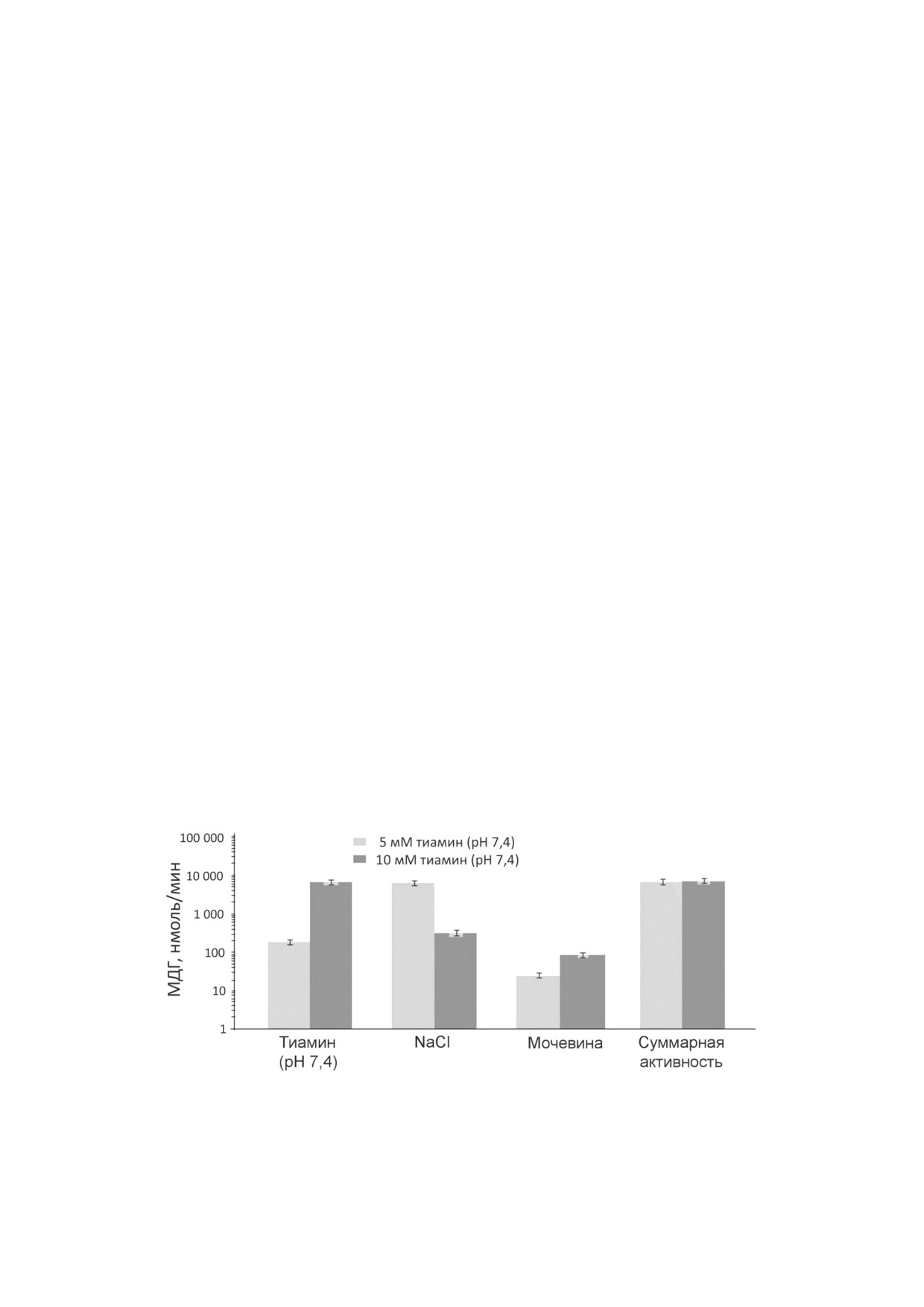
элюции раствором NaCl (рис. 1). Данный ре
изоферментами, на которые тиамин влияет по
зультат свидетельствует о специфичности тиа
разному [6]. Элюция кислым (рН 5,6) раствором
мина, а не только кислого значения рН, в каче
тиамина в значительной степени снижает ско
стве элюирующего фактора. Однако суммарная
рость малатдегидрогеназной реакции. В этих ус
активность МДГ во фракции, элюируемой мо
ловиях активность МДГ во фракции, получен
чевиной, не зависит от концентрации тиамина
ной в ходе аффинной элюции тиамином, сос
на первой стадии элюции (рис. 1). Это свиде
тавляет < 10% от общей активности МДГ, нане
тельствует об ином типе связывания с тиамин
сенной на тиамин сефарозу, тогда как при элю
сефарозой изоферментов МДГ, элюируемых мо
ции слабощелочным раствором тиамина наблю
чевиной (преимущественно МДГ2, табл. 2), по
дается существенное (1,5-2,5 кратное) повы
сравнению с изоферментами МДГ, элюируемы
шение как удельной, так и общей активности
ми тиамином и NaCl.
МДГ в элюате по сравнению с исходными зна
Известно, что ГДГ и МДГ2 взаимодействуют
чениями. Тем не менее данные масс спектро
с образованием комплекса, имеющего сущест
метрии элюированных тиамином фракций по
венное функциональное значение, в т.ч. для
казывают, что кислый раствор тиамина преиму
действия низкомолекулярных регуляторов на
щественно элюирует с тиамин сефарозы МДГ2,
активность обоих ферментов [22-24]. Получен
а слабощелочной раствор - МДГ1 (табл. 2). Со
ные результаты свидетельствуют о том, что об
ответственно, МДГ1 элюируется NaCl и моче
разование такого комплекса может стабилизи
виной только в том случае, когда ее аффинная
ровать активность ГДГ при элюции с тиамин
Рис. 1. Зависимость общей активности малатдегидрогеназы (МДГ) во фракциях, получаемых при аффинной хроматогра
фии синаптосомальной фракции мозга быка на тиамин сефарозе, от концентрации тиамина в элюирующем растворе
(рН 7,4) на первой стадии элюции. Усреднены результаты не менее двух независимых хроматографий при элюции 5 и
10 мМ тиамином
БИОХИМИЯ том 85 вып. 1 2020
РЕГУЛЯЦИЯ ДЕГИДРОГЕНАЗ МАЛАТА И ГЛУТАМАТА ТИАМИНОМ
39
Таблица 2. Активность малатдегидрогеназы (МДГ) и уникальные для цитоплазматического (МДГ1) и митохондриального
(МДГ2) изоферментов пептиды в элюатах с тиамин сефарозы при аффинной хроматографии ацетонового экстракта
синаптосом мозга быка
Удельная активность МДГ
Общая активность МДГ
Число пептидов МДГ
Белковая фракция
нмоль/мин
%
нмоль/мин
%
МДГ1
МДГ2
на 1 мг белка
Первая стадия элюции: 10 мМ тиамин, рН 7,4
Ацетоновый экстракт
190 ± 10
100
8000 ± 400
100
2
3
10 мМ тиамин
460 ± 5
280
11 900 ± 100
150
2
1
1 M NaCl
350 ± 130
210
890 ± 340
11
0
2
2 М мочевина
60 ± 20
36
150 ± 50
2
0
2
Первая стадия элюции: 10 мМ тиамин, рН 5,6
Ацетоновый экстракт
160 ± 3
100
6600 ± 300
100
2
3
10 мМ тиамин
16 ± 1
10
390 ± 20
6
0
4
1 M NaCl
30 ± 6
20
170 ± 30
3
3
5
2 М мочевина
30 ± 5
18
30 ± 5
1
1
5
Примечание. Активность МДГ определяли после замены элюирующего раствора на 10 мМ Tris НCl (pH 7,4) при насыще
нии субстратами в среде следующего состава: 20 мМ калий фосфатный буфер (рН 7,2), 0,3 мМ оксалоацетат,
0,14 мМ NADH. Относительные активности указаны в процентах от уровней в исходных препаратах.
сефарозы NaCl и мочевиной. Так, общая и
ГДГ и МДГ2 при хроматографии гомогенатов
удельная активность ГДГ в данных фракциях
мозга наблюдалась под действием NaCl (9 пеп
выше при повышенном содержании МДГ2, ко
тидов ГДГ и 3 пептида МДГ2), причем именно в
торое наблюдается после проведения первой
данной фракции удельные активности этих взаи
стадии элюции при рН 5,6 (табл. 1 и 2). Опосре
модействующих между собой ферментов были
дованное ГДГ взаимодействие МДГ2 с тиамин
наиболее высокими (табл. 3). Данные особен
сефарозой может определять коэлюцию данных
ности элюции зависели от типа наносимой на
ферментов мочевиной и иной характер взаимо
тиамин сефарозу белковой фракции. Так, при
действия с носителем МДГ2, элюируемой с тиа
аффинной хроматографии синаптосомальной
мин сефарозы мочевиной (рис. 1).
фракции мозга быка в аналогичных условиях,
Аффинная хроматография на тиамин@сефаро@
т.е. после аффинной элюции тиамином при
зе гомогенатов коры мозга крысы. О зависимости
рН 7,4, ГДГ лучше всего элюировалась мочеви
элюируемых с тиамин сефарозы активностей
ной (табл. 1), а МДГ2 хорошо отделялась от
ГДГ и МДГ от белкового состава анализируемой
МДГ1 (табл. 2). Таким образом, как взаимодей
фракции свидетельствует и разница профилей
ствие ГДГ и/или изоферментов МДГ с тиамин
элюции этих активностей при нанесении на ти
сефарозой, так и коэлюция ГДГ с МДГ2 могут
амин сефарозу разных препаратов белков мозга.
существенно зависеть от состава образца, под
Так, по сравнению с активностями ГДГ и МДГ в
вергаемого аффинной хроматографии, отлича
синаптосомальной фракции белков мозга, в
ющегося наборами белков и их низкомолеку
элюате раствором тиамина (рН 7,4) данной
лярных лигандов.
фракции с тиамин сефарозы удельная актив
Регуляция активности ГДГ и МДГ тиамино@
ность ГДГ падала (табл. 1), а МДГ - возрастала
выми соединениями in vitro. Влияние тиамино
более чем в 2 раза (табл. 2). Напротив, по срав
вых соединений на ГДГ и МДГ исследовали с
нению с активностями ГДГ и МДГ в гомогенате
учетом полученных ранее данных о действую
мозга, аффинная элюция данного препарата с
щих концентрациях и условиях максимизации
тиамин сефарозы слабощелочным раствором
влияния этих соединений на исследуемые фер
тиамина приводила к значительному (в 3 раза)
менты [6]. В сравнительных экспериментах ис
увеличению удельной активности ГДГ при не
пользовали фиксированные концентрации тиа
большом росте малатдегидрогеназной актив
мина (0,05 мМ) и ТДФ (1 мМ), соотношение ко
ности (с 8 до 11 нмоль/мин на 1 мг белка)
торых имитирует таковое in vivo. На рис. 2 пока
(табл. 3). Кроме того, максимальная элюция
зано влияние тиамина и/или ТДФ на актив
БИОХИМИЯ том 85 вып. 1 2020
40
МЕЖЕНСКАЯ и др.
ность ГДГ мозга в исходных препаратах и в элю
руженное в данной работе при аффинной хро
атах с тиамин сефарозы. Видно, что в исходных
матографии препаратов мозга (рис. 2), свиде
препаратах тиамин и ТДФ ингибируют актив
тельствует о роли концентрации белка и/или со
ность ГДГ, тогда как после хроматографии наб
держащихся в исходных препаратах ГДГ мозга
людается активация фермента данными соеди
эндогенных факторов, удаляемых в ходе аффин
нениями. Аналогичную разницу в воздействии
ной хроматографии, в регуляции активности
ТДФ на ГДГ наблюдали ранее в условиях насы
фермента под действием ТДФ. Например, мож
щения субстратами очищенного фермента (1,2
но ожидать, что содержание ADP - активатора
кратная активация ТДФ) и фермента в составе
ГДГ - существенно выше в гомогенате мозга,
митохондриального экстракта (1,3 кратное ин
чем в ацетоновом экстракте синаптосомальной
гибирование ТДФ) [6]. Значительно более выра
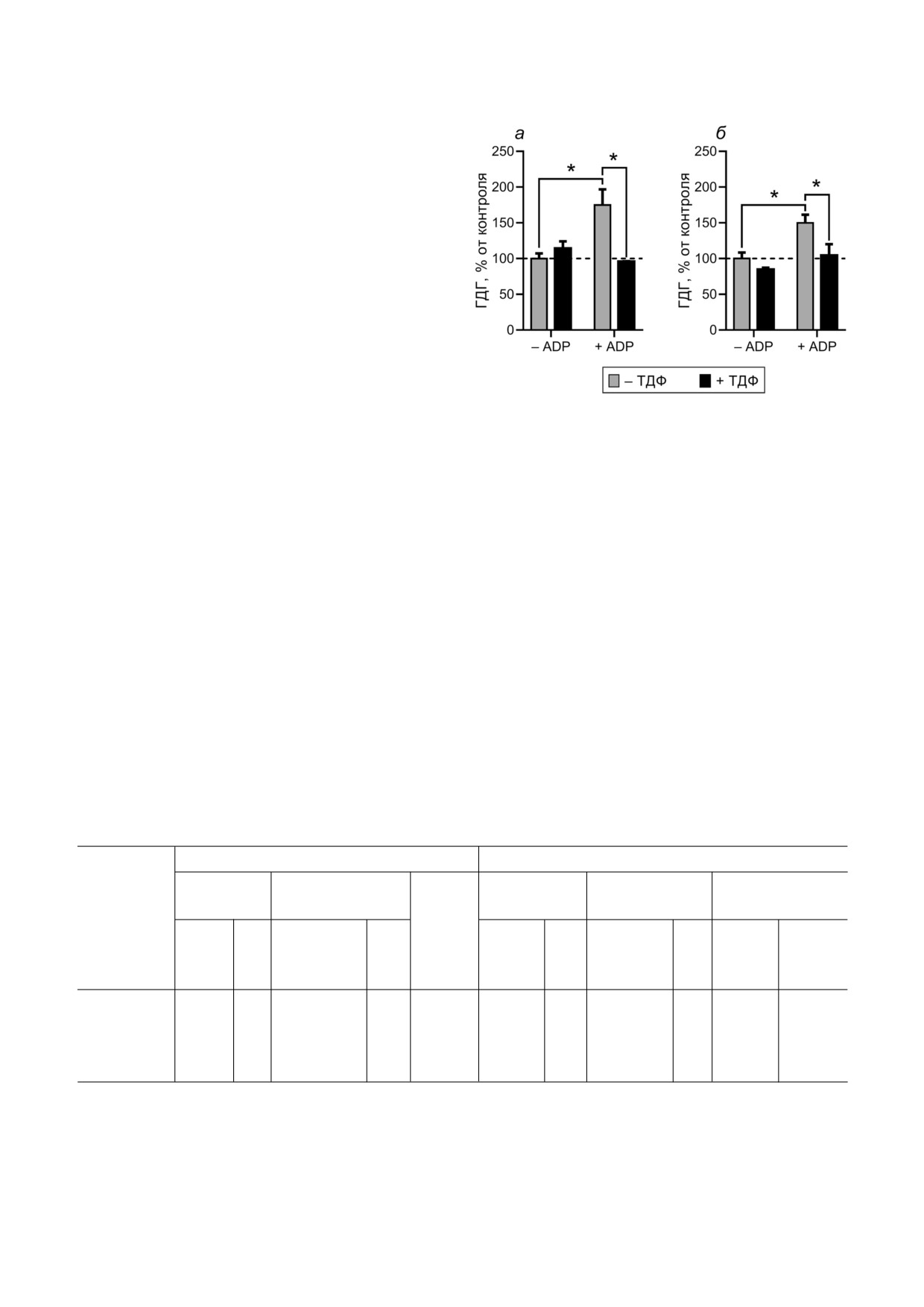
фракции мозга. Как видно из рис. 3, ТДФ пре
женное влияние ТДФ на активность ГДГ, обна
пятствует активации ГДГ под действием ADP.
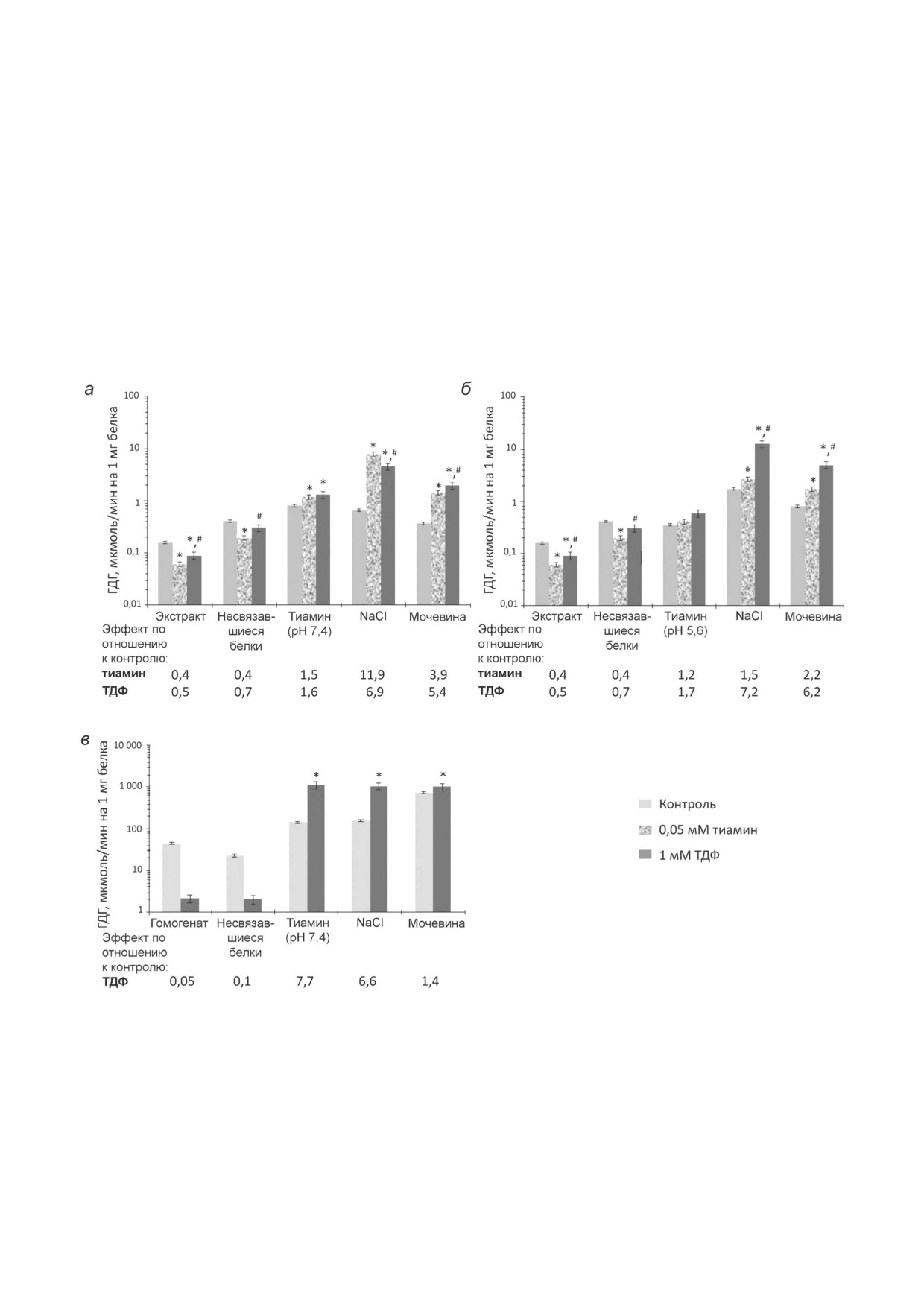
Рис. 2. Влияние тиамина и/или тиаминдифосфата (ТДФ) на активность глутаматдегидрогеназы (ГДГ) из мозга быка или
крысы в элюатах с тиамин сефарозы. При аффинной хроматографии ацетонового экстракта синаптосом мозга быка на
первой стадии элюции применяли 10 мМ раствор тиамина, рН 7,4 (а) или рН 5,6 (б); в - при аффинной хроматографии
гомогената коры мозга крысы на первой стадии элюции применяли 10 мМ раствор тиамина, рН 7,4. Во всех случаях элю
ированные белки переводили в 10 мМ Tris HCl (рН 7,4) с помощью ультрафильтрации. Эффекты тиамина и ТДФ измеря
ли при ненасыщающей концентрации NАDH в среде следующего состава: 100 мМ Tris НСl (рН 7,5), 2,5 мМ 2 оксоглута
рат, 0,02 мМ NАDH, 50 мМ NH4Cl. Приведены усредненные результаты по 2-4 независимым экспериментам; *, # р < 0,05
(достоверные отличия от контрольной активности и от активности в присутствии 0,05 мМ тиамина соответственно, со
гласно t тесту Стьюдента)
БИОХИМИЯ том 85 вып. 1 2020
РЕГУЛЯЦИЯ ДЕГИДРОГЕНАЗ МАЛАТА И ГЛУТАМАТА ТИАМИНОМ
41
Таким образом, ингибирующее действие ТДФ в
подвергаемых аффинной хроматографии препа
ратах может быть связано с выраженностью ак
тивирующего влияния ADP на ГДГ. Меньшее
ингибирование фермента в составе синаптосо
мальной фракции мозга ТДФ (рис. 2, а) соответ
ствует ожидаемому снижению содержания ADP
в данном препарате по сравнению с полным го
могенатом мозга, в котором влияние ТДФ на ак
тивность ГДГ существенно более выражено
(рис. 2, в). С другой стороны, активация ТДФ
после аффинной хроматографии могла бы быть
связана с облегченной диссоциацией GTP - вы
сокоэффективного ингибитора ГДГ. Однако в
модельных экспериментах с очищенной ГДГ на
ми не было выявлено снижение ингибирования
фермента GTP под действием ТДФ или тиамина
Рис. 3. Взаимозависимость влияния тиаминдифосфата
в использованном интервале условий (до 1 мМ
(ТДФ) и ADP на активность глутаматдегидрогеназы (ГДГ).
Активность измеряли в буфере Кребса-Рингера (рН 7,4) в
ТДФ или тиамина при 1 мкМ GTP и варьирова
условиях насыщения субстратами (2,5 мМ 2 оксоглутарат,
нии концентрации 2 оксоглутарата в интервале
0,2 мМ NADH, 50 мМ NH4Cl). ADP и ТДФ использовали в
0,1-10,0 мМ). Помимо влияния эндогенных ре
концентрациях 1,7 и 1 мМ соответственно. Эксперименты
гуляторов, при интерпретации результатов раз
проводили с коммерческим препаратом фермента, очи
щенного из печени быка (а), и частично очищенным фер
ных воздействий ТДФ на активность ГДГ си
ментом из мозга крысы (б). * р < 0,05 (достоверные отличия
наптосом и гомогената мозга (рис. 2) нельзя
согласно двухфакторному дисперсионному анализу с post
исключить и разницу регуляции синаптосо
hoc тестом Сидака)
мальной и общей ГДГ мозга тиаминовыми сое
динениями - например, за счет специфических
для синаптосом посттрансляционных модифи
быка наблюдается 2 кратное ингибирование
каций или альтернативного сплайсинга фер
ГДГ под действием ТДФ, которое сменяется 1,5
мента.
кратной активацией в элюате раствором тиами
Следует отметить, что при меньшем ингиби
на, рН 7,4 (рис. 2, а). В то же время в гомогенате
рующем эффекте ТДФ в исходном препарате
коры мозга крысы добавление ТДФ приводит к
ГДГ меньшей оказалась и активация ТДФ ГДГ,
20 кратному ингибированию ГДГ, а при аффин
элюируемой раствором тиамина, рН 7,4 (рис. 2).
ной элюции белков данного препарата тиами
Так, в частично очищенном препарате из мозга
ном (рН 7,4) наблюдается 8 кратная активация
Таблица 3. Активность и уникальные пептиды глутаматдегидрогеназы (ГДГ), цитоплазматического (МДГ1) и митохонд
риального (МДГ2) изоферментов малатдегидрогеназы (МДГ) в элюатах с тиамин сефарозы при аффинной хроматогра
фии гомогената коры мозга крысы
ГДГ
МДГ
удельная
общая
удельная
общая
число
Белковая
активность
активность
активность
активность
пептидов
фракция
число
нмоль/
пептидов
нмоль/
мин
%
нмоль/мин
%
мин на
%
нмоль/мин
%
МДГ1
МДГ2
на 1 мг
1 мг
белка
белка
Гомогенат
5 ± 0
100
4600 ± 400
100
н.о.
8 ± 0
100
7100 ± 350
100
н.о.
н.о.
10 мМ тиамин
17 ± 3
340
2900 ± 500
64
7
11 ± 1
138
1900 ± 100
26
1
1
1 M NaCl
19 ± 1
356
1600 ± 60
34
9
26 ± 5
325
2200 ± 400
31
1
3
2 М мочевина
19 ± 5
370
1300 ± 260
28
4
15 ± 5
188
1100 ± 400
15
1
1
Примечание. Активности ферментов определяли после замены элюирующего раствора на 10 мМ Tris НCl (pH 7,4) в сре
дах следующего состава: для ГДГ - 100 мМ Tris НСl (рН 7,5), 2,5 мМ 2 оксоглутарат, 0,2 мМ NАDH, 50 мМ NH4Cl; для
МДГ - 20 мМ калий фосфатный буфер (рН 7,2), 0,3 мМ оксалоацетат, 0,14 мМ NАDH. Относительные активности ука
заны в процентах от уровней в исходных препаратах; н.о. - не определяли.
БИОХИМИЯ том 85 вып. 1 2020
42
МЕЖЕНСКАЯ и др.
ГДГ под действием ТДФ (рис. 2, в, гомогенат и
ствие ТДФ уровень активности ГДГ, аффинно
тиамин, рН 7,4). Полученные результаты свиде
элюируемой тиамином, ниже уровня активиро
тельствуют о том, что аллостерические эффекты
ванной ТДФ ГДГ (рис. 2). Таким образом, низ
ТДФ, как ингибирующий, так и активирующий,
кая активация данной фракции ГДГ ТДФ не
сильнее выражены в отношении ГДГ полного
может быть обусловлена активированным сос
гомогената мозга крысы, чем в отношении ГДГ
тоянием элюированной тиамином ГДГ за счет
после ацетоновой экстракции синаптосомаль
прочного связывания тиамина ферментом.
ной фракции мозга быка (рис. 2).
Аналогичный (1,2 кратный) уровень активации
Из рис. 2 также видно, что при хроматогра
фермента ТДФ в условиях насыщения ГДГ
фии ацетонового экстракта активирующий эф
2 оксоглутаратом и аммонием при низкой кон
фект ТДФ на ГДГ значительно выше после элю
центрации NADH наблюдали и ранее [6] при
ции NaCl и мочевиной (5-7 кратная актива
исследовании очищенного фермента или ГДГ в
ция) по сравнению с эффектом, наблюдаю
составе митохондриального экстракта. В отли
щимся на стадии аффинной элюции тиамином
чие от аффинной хроматографии синаптосо
(1,5-1,7 кратная активация). При этом в отсут
мальной фракции мозга, при хроматографии
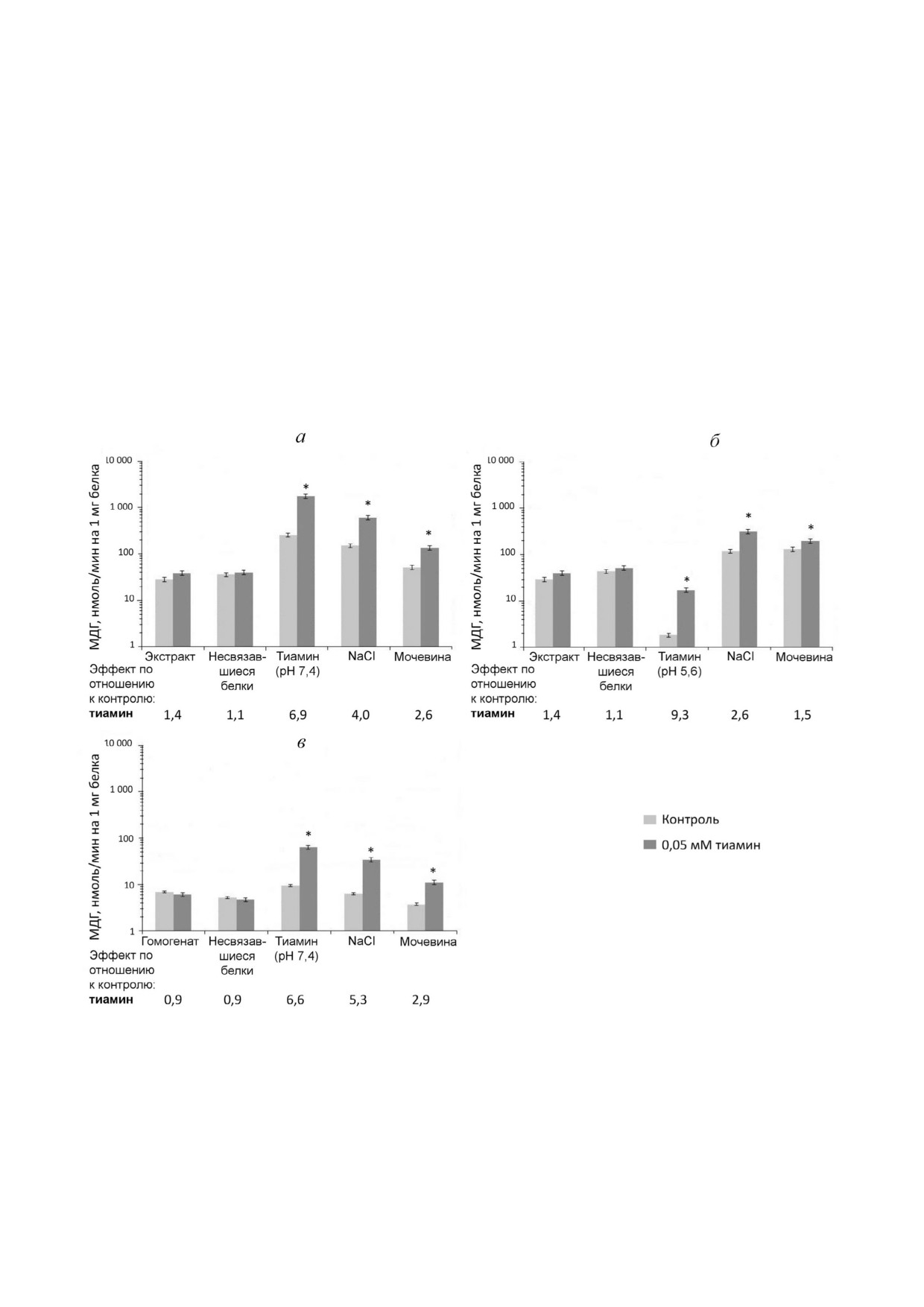
Рис. 4. Влияние тиамина (0,05 мМ) на малатдегидрогеназную активность (МДГ) мозга быка и крысы в элюатах с тиамин
сефарозы. При аффинной хроматографии ацетонового экстракта синаптосом мозга быка на первой стадии элюции при
меняли 10 мМ раствор тиамина, рН 7,4 (а) или рН 5,6 (б); в - при аффинной хроматографии гомогената коры мозга кры
сы на первой стадии элюции применяли 10 мМ раствор тиамина, рН 7,4. Во всех случаях элюированные белки переводи
ли в 10 мМ Tris HCl (рН 7,4) с помощью ультрафильтрации. Эффект тиамина измеряли при ненасыщающей концентра
ции оксалоацетата в среде следующего состава: буфер Кребса-Рингера (рН 7,4), 0,01 мМ оксалоацетат, 0,14 мМ NАDH.
Приведены усредненные результаты по 2-5 независимым экспериментам; * р < 0,05 (достоверные отличия активности в
присутствии тиамина от контрольной активности согласно t тесту Стьюдента)
БИОХИМИЯ том 85 вып. 1 2020
РЕГУЛЯЦИЯ ДЕГИДРОГЕНАЗ МАЛАТА И ГЛУТАМАТА ТИАМИНОМ
43
гомогената мозга максимальная (8 кратная) ак
дующей элюции NaCl и особенно мочевиной
тивация ТДФ ГДГ наблюдается именно во
данный эффект тиамина значительно снижает
фракции, элюируемой тиамином (рис. 2, в).
ся (рис. 4). Очевидно, неспецифическая элюция
Поскольку в этом случае тиамин элюирует по
растворами NaCl или мочевины приводит к час
давляющую часть ГДГ (64% от общей активнос
тичной потере аллостерической регуляции МДГ
ти в исходном препарате, табл. 1), можно за
под действием тиамина.
ключить, что выраженный активирующий эф
Отсутствие влияния тиамина на активность
фект ТДФ определяется концентрацией ГДГ
исходных препаратов МДГ может быть связано
и/или ее гетерологических комплексов. Иссле
с ранее охарактеризованной разнонаправлен
дование действия тиамина на ГДГ синаптосо
ностью действия тиамина (ингибирование
мальной фракции, элюируемую NaCl и мочеви
МДГ1 и активация МДГ2) на данные изофер
ной (рис. 2, а, б), подтверждает данное предпо
менты [6]. Действительно, из рис. 4, а и табл. 2
ложение. В отличие от действия ТДФ, которое
видно, что повышение активности МДГ тиами
не зависит от значения рН при предшествую
ном максимально (9 кратное) во фракциях с
щей аффинной элюции тиамином, активация
преимущественным содержанием МДГ2 (после
ГДГ тиамином в элюатах NaCl и мочевиной
аффинной элюции кислым раствором тиамина,
значительна (до 12 кратной) лишь после прове
табл. 2), а коэлюция МДГ1 и МДГ2 (при элюции
дения элюции тиамином при рН 7,4 (рис. 2, а).
слабощелочным раствором тиамина, табл. 2)
В этих же условиях активность ГДГ, элюируе
несколько снижает активацию МДГ тиамином
мой NaCl и мочевиной, составляет значительно
(до 7 кратной). Таким образом, во фракции, со
меньшую часть ее общей активности, чем после
держащей обе изоформы фермента, активация
проведения аффинной элюции тиамином при
тиамином МДГ2 может уменьшаться за счет ин
рН 5,6. В последнем случае, как показано выше,
гибирования тиамином МДГ1 [6]. Однако сле
в элюатах содержится больше МДГ2 (табл. 2).
дует также учесть, что, согласно измерению
Одновременное присутствие в элюате ГДГ и
ферментативной активности, существенная
МДГ2 создает лучшие условия для образования
часть МДГ не связывается с тиамин сефарозой
комплекса ГДГ и МДГ2. Тем не менее удельная
даже при нанесении на колонку значительно
и общая активности МДГ, а также активация
меньшего количества белка, содержащегося в
МДГ тиамином в этом случае существенно ни
ацетоновом экстракте синаптосом, по сравне
же по сравнению с теми, что наблюдаются в
нию с полным гомогенатом мозга (рис. 4). По
элюатах NaCl и мочевиной после аффинной
этому можно предположить, что с тиамин сефа
элюции тиамином при рН 7,4 (табл. 2). Полу
розой взаимодействуют лишь определенные
ченные результаты свидетельствуют о том, что
изоформы МДГ1 и МДГ2 - например, отличаю
после хроматографии на тиамин сефарозе ак
щиеся уровнем посттрансляционных модифи
тивация ГДГ тиамином не выражена в услови
каций.
ях, способствующих образованию комплекса
Исследование влияния высоких доз вводимого
ГДГ с МДГ2, т.е. после аффинной элюции при
крысам тиамина на регуляторные свойства ГДГ и
рН 5,6. Напротив, активация ГДГ тиамином
МДГ в составе гомогенатов мозга. Как показано
максимальна в условиях низкой общей актив
выше, регуляция активности ферментов тиами
ности ГДГ и пониженного содержания МДГ2
ном и его производными может отличаться в за
при элюции растворами NaCl и мочевины, т.е.
висимости от препарата фермента (рис. 2 и 4)
после аффинной элюции при рН 7,4 (табл. 1 и 2).
[6]. Так, в гомогенатах или синаптосомальной
В связи с этим можно предположить, что тиа
фракции мозга ГДГ ингибируется тиамином, а
мин, аналогично МДГ2, стабилизирует ГДГ в
на МДГ тиамин не оказывает влияния. Однако
последующих элюатах с помощью NaCl и моче
после аффинной хроматографии наблюдается
вины, способных вызывать частичную диссо
активация ГДГ и МДГ (рис. 2 и 4), причем ско
циацию и/или денатурацию ГДГ.
рость катализируемой МДГ реакции растет даже
Стимулирующее влияние тиамина на актив
в тех случаях, когда в препарате присутствуют
ность МДГ исследованных препаратов белков
оба изофермента МДГ (табл. 1 и 3), один из ко
мозга характеризуется менее сложными законо
торых (МДГ1) ингибируется тиамином [6]. Вви
мерностями, чем действие тиамина на актив
ду такой неоднозначности регуляции тиамино
ность ГДГ. Тиамин не влияет на активность
выми соединениями in vitro мы оценили ее био
МДГ исходных препаратов. При хроматографии
логическое значение путем исследования регу
как синаптосомальной фракции мозга, так и го
ляторных свойств ферментов мозга крысы после
могената мозга максимальное влияние тиамина
введения животным высокой дозы тиамина. Для
на активность МДГ наблюдается во фракции,
этого содержащие ГДГ и МДГ гомогенаты коры
аффинно элюированной тиамином. При после
мозга экспериментальных и контрольных крыс
БИОХИМИЯ том 85 вып. 1 2020
44
МЕЖЕНСКАЯ и др.
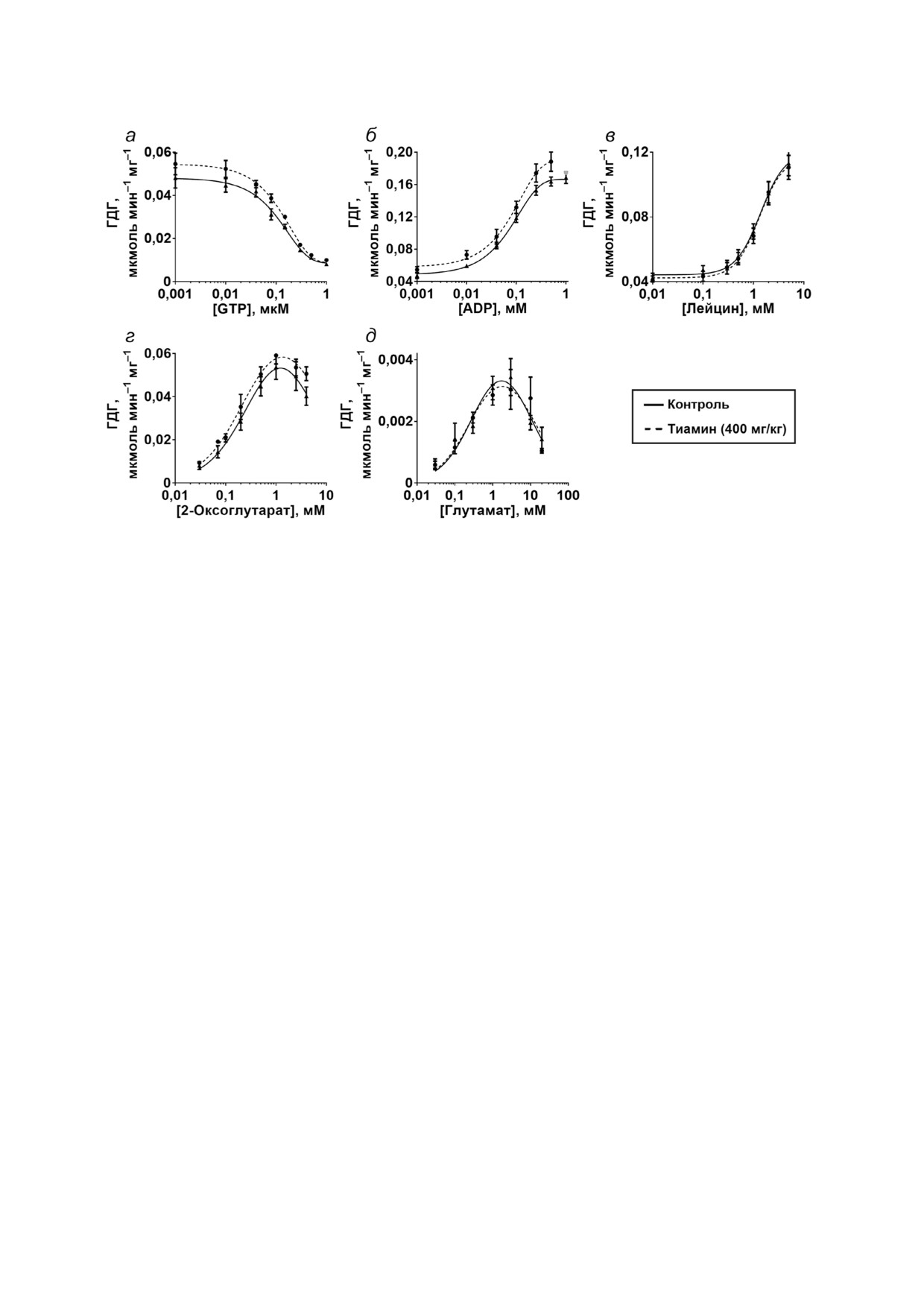
Рис. 5. Влияние введения животным тиамина (400 мг/кг) на регуляторные свойства глутаматдегидрогеназы (ГДГ) мозга
крысы. Исследована зависимость активности фермента от аллостерических регуляторов: GTP (а), ADP (б), лейцина (в) и
субстратов 2 оксоглутарата (г) и глутамата (д). Для построения кинетических зависимостей усреднены данные трех неза
висимых экспериментов. Аппроксимации проводили в программе GraphPad Prism v. 8.0 с использованием встроенных мо
делей (см. разд. «Методы исследования»). Параметры аппроксимаций приведены в табл. 4
были освобождены от низкомолекулярных ли
действием GTP показало статистическую досто
гандов путем быстрой гель фильтрации, не при
верность (табл. 4). По видимому, это связано со
водящей к существенному разведению гомоге
сложностью дифференциации приведенных за
ната.
висимостей в случаях, когда активация сменяет
Кинетические зависимости активности ГДГ
ся ингибированием при высоких концентраци
от ее основных низкомолекулярных регулято
ях ADP (после введения тиамина) и 2 оксоглу
ров: аллостерических эффекторов, GTP, ADP и
тарата. Тем не менее характерные для насыще
ОГ
лейцина, а также субстратов разных направле
ния 2 оксоглутаратом значения КmОГ
и Кi
ний реакции, 2 оксоглутарата или глутамата, -
(табл. 4) хорошо согласуются с наблюдаемым на
представлены на рис. 5. Сравнение кинетичес
рис. 5, г снижением субстратного ингибирова
ких кривых показывает, что введенный живот
ния, а сопряженный характер данных измене
ным тиамин увеличивает амплитуду ингибиро
ний соответствует известной связи механизмов
вания GTP (рис. 5, а) и максимум эффективной
регуляции ГДГ с помощью GTP и ADP с
скорости катализируемой ГДГ реакции, дости
субстратным ингибированием фермента [25].
гаемой в фазе активации фермента под действи
Поскольку ряд остатков регуляторных центров
ем ADP (рис. 5, б) и 2 оксоглатурата (рис. 5, г).
ГДГ, включая остаток лизина в центре связыва
При этом введение тиамина in vivo не меняет ре
ния GTP, подвергаются посттрансляционному
гуляцию ГДГ мозга лейцином (рис. 5, в) и глута
ацилированию [25], можно предположить, что
матом (рис. 5, д). Поэтому увеличение наблюда
введение животным тиамина приводит к изме
емой амплитуды ответа ГДГ на GTP, ADP и
нению регуляторных свойств ГДГ (рис.
5,
2 оксоглутарат не связано с ростом экспрессии
табл. 4) за счет изменения уровня таких пост
фермента, что подтверждает и количественный
трансляционных модификаций. Например,
анализ пептидов ГДГ, детектируемых в исследо
конформационные изменения при связывании
ванных гомогенатах с помощью масс спектро
тиамина и/или его производных с ГДГ in vivo
метрии. Следует отметить, что из указанных вы
могут менять доступность тех или иных остатков
ше сопряженных изменений регуляции ГДГ
фермента ацилированию или деацилированию.
после введения животным тиамина лишь изме
Аналогичный анализ влияния высокой дозы
нение амплитуды ингибирования фермента под тиамина на регуляторные свойства МДГ в со
БИОХИМИЯ том 85 вып. 1 2020
РЕГУЛЯЦИЯ ДЕГИДРОГЕНАЗ МАЛАТА И ГЛУТАМАТА ТИАМИНОМ
45
ставе гомогенатов мозга после гель фильтрации
ный гомогенат мозга крысы. Биоинформатичес
не выявил существенных изменений в зависи
кий анализ идентифицированных в данной ра
мостях скорости малатдегидрогеназной реак
боте совокупностей белков, элюируемых при
ции от насыщения субстратами: оксалоацетатом
хроматографии синаптосомальной фракции
(0,01-1,00 мМ) и малатом (0,1-10,0 мМ). Таким
мозга быка или гомогената мозга крысы, пред
образом, если тиамин активирует лишь неболь
ставлен в табл. 5. Сравнение с предыдущими ре
шую часть взаимодействующих с тиамин сефа
зультатами аналогичного анализа тиамин зави
розой изоформ МДГ, то введение животным ти
симых протеомов синаптосомальной фракции
амина значительно не меняет представленность
мозга крысы [6] показало, что введение аффин
данных изоформ в гомогенате мозга.
ной элюции тиамином меняет относительную
Сравнительный анализ элюируемых с тиамин@
представленность терминов аннотации «фосфо
сефарозы протеомов. По сравнению с предыду
белки» и «ацетилирование» в характеристике
щим использованием аффинной хроматогра
элюируемых с тиамин сефарозы белков. В на
фии на носителях, модифицированных тиами
шем предыдущем исследовании [6], в котором
ном или аналогом его функциональной (тиазо
элюция тиамином белков синаптосомальной
лиевой) части, в данной работе применялась мо
фракции мозга крысы не использовалась, тер
дификация носителя тиамином, исключающая
мин «ацетилирование» имел существенно боль
разную конформацию и/или количество присо
шую степень обогащения (P = 10-17, согласно
единенных к линкеру молекул «наживки». Для
результатам анализа тиамин связывающего
возможного повышения специфичности элю
протеома программой DAVID), чем термин
ции с тиамин содержащего носителя мы также
«фосфобелки» (P = 10-6). При аффинной же
использовали раствор тиамина в качестве аф
элюции тиамином белков синаптосомальной
финного элюента. Наконец, для определения
фракции мозга быка оба термина характеризу
дополнительных путей некоферментного
ются сходной степенью обогащения (P
=
действия тиамина, мишени которого могли те
= 10-35-10-36), а в случае аффинной хроматогра
ряться при очистке проанализированной ранее
фии полных гомогенатов мозга крысы термин
синаптосомальной фракции мозга крысы [6],
«фосфобелки» даже приобретает большую зна
мы подвергли аффинной хроматографии пол
чимость (P = 10-76), чем термин «ацетилирова
Таблица 4. Кинетические параметры регуляции ГДГ мозга контрольных крыс и крыс после введения высокой дозы тиамина
Параметры
Контроль
Тиамин
ICG0TP, мкМ
0,13 ± 0,01
0,14 ± 0,01
Амплитуда ингибирования GTP, мкмоль/мин на мг
0,042 ± 0,003
0,048 ± 0,003
Коэффициент Хилла (GTP)
-1,4 ± 0,3
-1,3 ± 0,2
ECA0DP, мМ
0,09 ± 0,01
0,11 ± 0,07
Амплитуда активации ADP, мкмоль/мин на мг
0,12 ± 0,01
0,17 ± 0,04
Коэффициент Хилла (ADP)
1,3 ± 0,3
1,1 ± 0,4
ECL0eu, мМ
1,4 ± 0,2
1,3 ± 0,1
Амплитуда активации лейцином, мкмоль/мин на мг
0,08 ± 0,01
0,07 ± 0,01
Коэффициент Хилла (лейцин)
1,8 ± 0,6
1,8 ± 0,6
VОГmax, мкмоль/мин на мг
0,08 ± 0,02
0,08 ± 0,01
KmОГ, мМ
0,36 ± 0,16
0,25 ± 0,07
KiОГ, мМ
4,2 ± 2,4
7,1 ± 3,1
V
Glu, мкмоль/мин на мг
0,005 ± 0,001
0,004 ± 0,001
KmGlu, мМ
0,33 ± 0,16
0,26 ± 0,13
KiGlu, мМ
9,0 ± 4,5
12,7 ± 6,8
Примечание. Представлены результаты нелинейной регрессии в программе GraphPad Prism v. 8.0 (см. «Методы исследо
вания») кинетических зависимостей, приведенных на рис. 5. Верхние индексы параметров насыщения ГДГ указывают ли
ганд, в случае 2 оксоглутарата - ОГ. Жирным шрифтом выделены определенные с помощью F критерия достоверные от
личия между кинетическими параметрами аппроксимированных зависимостей ГДГ из мозга крыс контрольной группы и
крыс, которым вводили тиамин.
БИОХИМИЯ том 85 вып. 1 2020
46
МЕЖЕНСКАЯ и др.
Таблица 5. Главные термины аннотации протеомов, элюируемых с тиамин сефарозы тиамином или неспецифическими
агентами (NaCl и мочевиной)
Элюция тиамином
Элюция NaCl + мочевиной
термин аннотации
число белков
Р обогащения
термин аннотации
число белков
Р обогащения
Бык (n = 115)
Бык (n = 136)
1) Фосфобелки
83
2,0E 39
1) Фосфобелки
96
1,3E 46
2) Ацетилирование
68
3,6E 38
2) Кератин
25
1,4E 36
3) Кератин
23
6,5E 34
3) Промежуточные филаменты
26
4,5E 35
4) Цитоплазма
56
1,1E 23
4) Ацетилирование
69
1,3E 34
5) Метилирование
25
5,2E 17
5) Цитоплазма
62
2,3E 25
6) Метилирование
23
1,8E 13
Крыса (n = 183)
Крыса (n = 202)
1) Фосфобелки
153
6,5E 76
1) Фосфобелки
173
1,0E 82
2) Ацетилирование
105
3,4E 61
2) Ацетилирование
120
2,9E 69
3) Метилирование
48
7,2E 34
3) Метилирование
58
1,9E 42
4) Цитоплазма
84
3,9E 29
4) Цитоплазма
95
5,9E 32
Примечание. Показаны репрезентативные результаты биоинформатического анализа с помощью программы DAVID
(v. 6.8) наборов белков, элюируемых при аффинной хроматографии ацетонового экстракта синаптосом мозга быка (два
независимых определения) и полных гомогенатов коры мозга крысы (три независимых определения); n - общее количе
ство белков в анализируемых протеомах; Р обогащения - значение Р, характеризующее вероятность встречаемости соот
ветствующего термина аннотации в анализируемой выборке из n белков по сравнению со случайной встречаемостью дан
ного термина в соответствующем геноме.
ние» (P = 10-61) (табл. 5). Тем не менее о специ
га) (табл. 5) [6]. Биоинформатический анализ с
фичности термина «ацетилирование» в качестве
помощью программы DAVID v. 6.8 (табл. 5) так
характеристики тиамин зависимого протеома
же показал, что удерживаемые на тиамин сефа
синаптосом мозга быка говорит сравнение
розе белки ацетонового экстракта синаптосом
представленности основных терминов белковой
мозга быка значительно реже аннотируются
аннотации на аффинной и неспецифических
термином «метилирование» (позиции 5 и 6), чем
стадиях элюции. В элюате синаптосомальной
аналогичные белки полного гомогената коры
фракции мозга быка раствором тиамина терми
мозга крысы (позиция 3). С учетом того, что
ны «фосфобелки» и «ацетилирование» обогаще
термин «метилирование» не был значительно
ны одинаково (P = 10-35-10-36), тогда как в элю
представлен и при предыдущем анализе тиа
атах неспецифическими агентами (NaCl и моче
мин зависимых протеомов синаптосомальной
вина) относительное обогащение термина «аце
фракции мозга крысы [6], можно заключить,
тилирование» снижается со второй до четвертой
что обогащение данного термина связано не с
позиции при росте обогащения термина «фос
видоспецифическими эффектами, а с удалени
фобелки» (P = 10-46). Таким образом, по сравне
ем при очистке синаптосомальной фракции
нию с элюцией неспецифическими агентами,
группы взаимодействующих с тиамином белков,
аффинная элюция тиамином связавшихся с ти
характеризующихся функциональным терми
амин сефарозой синаптосомальных белков уве
ном «метилирование».
личила относительную представленность бел
Представленное сравнение взаимодействия
ков, аннотируемых как «фосфобелки», подтвер
с тиамин сефарозой как различных фракций
див специфичность термина «ацетилирование»
белков мозга (полный гомогенат и ацетоновый
в качестве характеристики данного протеома.
экстракт синаптосом), так и различных видов
Оба термина характеризуют тиамин зависимые
животных (бык и крыса) указывает на универ
протеомы мозга независимо от вида использо
сальность регуляции тиаминовыми соединени
ванного животного (бык или крыса) или препа
ями таких ферментов центрального метаболиз
рата, подвергаемого аффинной хроматографии
ма мозга животных, как дегидрогеназы малата и
(синаптосомальная фракция или гомогенат моз
глутамата. Биологическое значение регулятор
БИОХИМИЯ том 85 вып. 1 2020
РЕГУЛЯЦИЯ ДЕГИДРОГЕНАЗ МАЛАТА И ГЛУТАМАТА ТИАМИНОМ
47
ного действия тиамина и/или ТДФ подтвержде
(в т.ч. биоинформатический) результатов аф
но изменением регуляторных свойств ГДГ мозга
финной хроматографии в сочетании с данными
крыс после введения животным высоких доз ти
масс спектрометрии и подготовка публикации к
амина. Биоинформатический анализ наборов
печати проведены в рамках выполнения проек
белков, элюируемых с тиамин сефарозы в раз
та, финансируемого Российским научным фон
ных условиях, указывает на специфичность их
дом (грант № 18 14 00116).
обогащения термином «ацетилирование» и во
Благодарности. Авторы выражают благодар
влеченность таких белков в процессы метилиро
ность к.б.н. А.В. Граф и к.б.н. М.В. Масловой
вания.
(МГУ им. М.В. Ломоносова) за предоставление
образцов мозга крыс, использованных в данном
исследовании.
Финансирование. Работа О.А. Меженской,
Конфликт интересов. Авторы заявляют об от
аспирантки Института биохимии им. А.В. Пал
сутствии конфликта интересов.
ладина НАНУ (Киев, Украина) (эксперимен
Соблюдение этических норм. Все примени
тальные результаты, представленные на рис. 1,
мые международные, национальные и/или ин
2, 4 и в табл. 1-3 за исключением данных масс
ституциональные принципы ухода и использо
спектрометрии), по данному проекту, выполня
вания животных были соблюдены. В частности,
емому в МГУ им. М. В. Ломоносова, была под
все эксперименты с животными проводили с
держана Российским фондом фундаментальных
соблюдением этических норм согласно «Прави
исследований (грант № 15 34 50124) в числе ра
лам проведения работ с использованием экспе
бот, проводимых молодыми учеными под руко
риментальных животных», утвержденным ди
водством кандидатов и докторов наук в научных
рективой Евросоюза 2010/63/EU. Эксперимен
организациях Российской Федерации. Экспе
ты были одобрены Комиссией по биоэтике МГУ
рименты, представленные на рис. 3 и 5, анализ
им. М.В. Ломоносова.
СПИСОК ЛИТЕРАТУРЫ
1.
Frank, L.L. (2015) Thiamin in clinical practice, JPEN J.
9. Morales Gonzalez, J.A., Madrigal Santillan, E., Morales
Parenter. Enteral. Nutr., 39, 503-520, doi: 10.1177/
Gonzalez, A., Bautista, M., Gayosso Islas, E., and
0148607114565245.
Sanchez Moreno, C. (2015) What is known regarding the
2.
Tylicki, A., Lotowski, Z., Siemieniuk, M., and Ratkiewicz, A.
participation of factor Nrf 2 in liver regeneration? Cells, 4,
(2018) Thiamine and selected thiamine antivitamins -
169-177, doi: 10.3390/cells4020169.
biological activity and methods of synthesis, Biosci. Rep.,
10. Muller, S. (2017) DNA damage inducing compounds:
38, BSR20171148, doi: 10.1042/BSR20171148.
unraveling their pleiotropic effects using high throughput
3.
Pavlovic, D.M. (2019) Thiamine deficiency and benfoti
sequencing, Curr. Med. Chem.,
24,
1558-1585,
amine therapy in brain diseases, Am. J. Biomed. Sci. Res., 3,
doi: 10.2174/0929867324666170124143710.
1-5, doi: 10.34297/AJBSR.2019.03.000621.
11. Leeuw, E.P.H., Lee, S.H., Kim, W.H., Kwasny, S.M.,
4.
Bunik, V.I., and Aleshin, V.A. (2017) Analysis of the pro
Opperman, T.J., and Lillehoj, H.S. (2018) Pleiotropic anti
tein binding sites for thiamin and its derivatives to elucidate
infective effects of defensin derived antimicrobial com
molecular mechanisms of the non coenzyme action of thi
pounds, Avian Dis., 62, 381-387, doi: 10.1637/11912
amin (vitamin B1), Studies in Natural Products Chemistry,
061118 Reg.1.
53, 375-429, doi: 10.1016/B978 0 444 63930 1.00011 9.
12. Gomes, M.B., and Negrato, C.A. (2014) Alpha lipoic acid
5.
Aleshin, V.A., Mkrtchyan, G.V., and Bunik, V.I. (2019)
as a pleiotropic compound with potential therapeutic use in
Mechanisms of the non coenzyme action of thiamine: pro
diabetes and other chronic diseases, Diabetol. Metab.
tein targets and medical implications, Biochemistry (Moscow),
Syndr., 6, 80, doi: 10.1186/1758 5996 6 80.
84, 1051-1075, doi: 10.1134/S0006297919080017.
13. Turner, P.V., Pekow, C., Vasbinder, M.A., and Brabb, T.
6.
Mkrtchyan, G., Aleshin, V., Parkhomenko, Y., Kaehne, T.,
(2011) Administration of substances to laboratory animals:
Luigi Di Salvo, M., Parroni, A., Contestabile, R., Vovk, A.,
equipment considerations, vehicle selection, and solute
Bettendorff, L., and Bunik, V. (2015) Molecular mecha
preparation, J. Am. Assoc. Lab. Anim. Sci., 50, 614-627.
nisms of the non coenzyme action of thiamin in brain: bio
14. Postoyenko, V.A., Parkhomenko, Y.M., Vovk, A.I.,
chemical, structural and pathway analysis, Sci. Rep., 5,
Khalmuradov, A.G., and Donchenko, G.V. (1987) Isolation
12583, doi: 10.1038/srep12583.
and some properties of thiamine binding protein from the
7.
Tsepkova, P.M., Artiukhov, A.V., Boyko, A.I., Aleshin, V.A.,
rat brain synaptosomes, Biokhimiia, 52, 1792-1797.
Mkrtchyan, G.V., Zvyagintseva, M.A., Ryabov, S.I.,
15. Graf, A., Kabysheva, M., Klimuk, E., Trofimova, L.,
Ksenofontov, A.L., Baratova, L.A., Graf, A.V., and Bunik, V.I.
Dunaeva, T., Zundorf, G., Kahlert, S., Reiser, G.,
(2017) Thiamine induces long term changes in amino acid
Storozhevykh, T., Pinelis, V., Sokolova, N., and Bunik, V.
profiles and activities of 2 oxoglutarate and 2 oxoadipate
(2009) Role of 2 oxoglutarate dehydrogenase in brain
dehydrogenases in rat brain, Biochemistry (Moscow), 82,
pathologies involving glutamate neurotoxicity, J. Mol. Catal.
723-736, doi: 10.1134/S0006297917060098.
B Enzym., 61, 80-87, doi: 10.1016/j.molcatb.2009.02.016.
8.
He, X., and Zhang, J. (2006) Toward a molecular under
16. Klyashchitsky, B.A., Pozdnev, V.F., Mitina, V.K.,
standing of pleiotropy, Genetics,
173,
1885-1891,
Voskoboev, A.I., and Chernikevich, I.P. (1980) Isolation
doi: 10.1534/genetics.106.060269.
and purification of biopolymers by biospecific affinity
БИОХИМИЯ том 85 вып. 1 2020
48
МЕЖЕНСКАЯ и др.
chromatography. V. Affinity chromatography of pyruvate
21. Bleile, D.M., Schulz, R.A., Harrison, J.H., and Gregory, E.M.
decarboxylase from brewer’s yeast, Russ. J. Bioorg. Chem.,
(1977) Investigation of the subunit interactions in malate
6, 1572-1579.
dehydrogenase, J. Biol. Chem., 252, 755-758.
17. Lowry, O.H., Rosebrough, N.J., Farr, A.L., and Randall, R.J.
22. Fahien, L.A., Kmiotek, E., and Smith, L.
(1979)
(1951) Protein measurement with the Folin phenol
Glutamate dehydrogenase-malate dehydrogenase com
reagent, J. Biol. Chem., 193, 265-275.
plex, Arch. Biochem. Biophys., 192, 33-46, doi: 10.1016/
18. Bunik, V., Kaehne, T., Degtyarev, D., Shcherbakova, T., and
0003 9861(79)90069 9.
Reiser, G. (2008) Novel isoenzyme of 2 oxoglutarate dehy
23. Fahien, L.A., Kmiotek, E.H., MacDonald, M.J., Fibich, B.,
drogenase is identified in brain, but not in heart, FEBS J.,
and Mandic, M. (1988) Regulation of malate dehydrogenase
275, 4990-5006, doi: 10.1111/j.1742 4658.2008.06632.x.
activity by glutamate, citrate, alpha ketoglutarate, and mul
19. MacLean, B., Tomazela, D.M., Shulman, N., Chambers, M.,
tienzyme interaction, J. Biol. Chem., 263, 10687-10697.
Finney, G.L., Frewen, B., Kern, R., Tabb, D.L., Liebler, D.C.,
24. Fahien, L.A., MacDonald, M.J., Teller, J.K., Fibich, B.,
and MacCoss, M.J. (2010) Skyline: an open source docu
and Fahien, C.M. (1989) Kinetic advantages of hetero
ment editor for creating and analyzing targeted proteomics
enzyme complexes with glutamate dehydrogenase and the
experiments, Bioinformatics, 26, 966-968, doi: 10.1093/
alpha ketoglutarate dehydrogenase complex, J. Biol.
bioinformatics/btq054.
Chem., 264, 12303-12312.
20. Wood, D.C., Jurgensen, S.R., Geesin, J.C., and Harrison, J.H.
25. Bunik, V., Artiukhov, A., Aleshin, V., and Mkrtchyan, G.
(1981) Subunit interactions in mitochondrial malate dehy
(2016) Multiple forms of glutamate dehydrogenase in ani
drogenase. Kinetics and mechanism of reassociation, J.
mals: structural determinants and physiological implica
Biol. Chem., 256, 2377-2382.
tions, Biology (Basel), 5, 53, doi: 10.3390/biology5040053.
REGULATION OF MALATE DEHYDROGENASES
AND GLUTAMATE DEHYDROGENASE OF MAMMALIAN
BRAIN BY THIAMINE in vitro AND in vivo*
O. A. Mezhenska1, V. A. Aleshin2,3, T. Kaehne4, A. V. Artiukhov2,3, and V. I. Bunik2,3**,***
1 Department of Vitamin and Coenzyme Biochemistry, Palladin Institute of Biochemistry,
NAS of Ukraine, 01601 Kyiv, Ukraine
2 Lomonosov Moscow State University, Faculty of Bioengineering and Bioinformatics,
119991 Moscow, Russia; E/mail: bunik@belozersky.msu.ru
3 Belozersky Institute of Physico/Chemical Biology, Lomonosov Moscow State University, 19991 Moscow, Russia
4 Institute of Experimental Internal Medicine, Otto/von/Guericke University, 39120 Magdeburg, Germany
Received August 5, 2019
Revised September 24, 2019
Accepted September 24, 2019
To study the mechanisms of the non coenzyme action of thiamine and its diphosphate (ThDP) on brain proteins, an
acetone extract of bovine brain synaptosomes or homogenate of rat brain cortex are subjected to affinity chromatog
raphy on thiamine modified Sepharose. Relative content of glutamate dehydrogenase (GDH) and isoenzymes of
malate dehydrogenase (MDH) in step wise eluates by thiamine (at pH 7.4 or 5.6), NaCl and urea is determined by
mass spectrometry. Influence of thiamine and/or ThDP on GDH and MDH activities in these eluates is studied as
well. Activation of malate dehydrogenase reaction by thiamine is maximal after elution of proteins with an acidic thi
amine solution that does not elute an MDH1 isoenzyme. Effects of exogenous thiamine or ThDP on GDH activity
probably depend on the presence of endogenous regulators of the enzyme. In fact, thiamine and/or ThDP activate the
brain GDH in eluates but inhibits the enzyme in crude preparations applied to the sorbent. ThDP inhibits the ADP
activated GDH. Activation of GDH by thiamine (but not ThDP) decreases in case when the acidic thiamine solution
(pH 5.6) is used as eluent compared to the procedure employing slightly alkaline thiamine solution (pH 7.4).
Simultaneous increase in the MDH2 content and in total GDH activity after the affinity elution at pH 5.6 compared
to the elution at pH 7.4 indicates the role of the known GDH-MDH2 interaction in stabilizing the GDH activity and
in GDH regulation by thiamine. The biological potential of thiamine dependent regulation of the brain GDH is con
firmed in vivo by demonstration of changes in regulatory properties of GDH after administration of a high dose of thi
amine to rats. Bioinformatics analysis of the thiamine eluted brain proteins shows specific enrichment of their anno
tation with terms «phosphoprotein», «acetylation» and «methylation». Relationship between thiamine and these post
translational modifications in brain may contribute to neuroprotective effects of high doses of thiamine, including the
regulation of oxidation of the major excitatory neurotransmitter in brain - glutamate.
Keywords: thiamine, malate dehydrogenase, glutamate dehydrogenase, thiamine Sepharose, phosphoprotein, acety
lation, methylation
БИОХИМИЯ том 85 вып. 1 2020