БИОХИМИЯ, 2020, том 85, вып. 1, с. 49 - 63
УДК 577.121.7
ВНУТРИКЛЕТОЧНЫЕ МЕХАНИЗМЫ
ЧУВСТВИТЕЛЬНОСТИ К КИСЛОРОДУ
Обзор
© 2020
А.Н. Вётош1,2,3
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН,
194223 Санкт(Петербург, Россия; электронная почта: vjotnn@yahoo.com
2 НГУ физической культуры, спорта и здоровья им. П.Ф. Лесгафта,
190121 Санкт(Петербург, Россия
3 СЗГМУ им. И.И. Мечникова Минздрава России, 195067 Санкт(Петербург, Россия
Поступила в редакцию 09.05.2019
После доработки 29.09.2019
Принята к публикации 20.10.2019
На основании анализа данных литературы описаны молекулярные механизмы рецепции уровня кислорода
в различных компартментах клеток животных. Показано, что внутриклеточная сенсорная трансдукция кис
лорода может осуществляться несколькими способами. Рассмотрены детали функционирования околомем
бранного и цитоплазматического пулов молекулярных конструктов клеток в условиях гипоксии. Обсужда
ются сведения о роли митохондрий в процессах клеточной чувствительности к уменьшению содержания
кислорода. Выявлены подробности взаимного влияния оперативных и хронических внутриклеточных ме
ханизмов восприятия отрицательных градиентов концентрации молекулярного кислорода и их связи с ре
акциями клеточного метаболизма на оксидативный стресс.
КЛЮЧЕВЫЕ СЛОВА: митохондрии, калиевые мембранные каналы, HIF.
DOI: 10.31857/S0320972520010042
Кислород - главный детерминант клеточно
условиях перехода от нормоксии к гипоксии
го метаболизма аэробов. Отдельные клетки и их
in vitro.
небольшие группы, инкубируемые в естествен
За последние 30 лет были намечены контуры
ных или искусственных условиях, получают
описания физиологического кислородного го
жизненно важные ингредиенты путем диффу
меостаза клетки. Молекулярную платформу для
зии. В многоклеточных организмах в распреде
исследований в этой области обеспечили рабо
лении атмосферного кислорода участвуют спе
ты Lopez Barneo et al. [1] и Semenza et al. [2, 3].
циализированные респираторные и циркуля
Дальнейшие исследования данной проблемы
торные транспортные системы.
позволят узнать закономерности простран
Качество распределения кислорода не мо
ственной динамики концентрации кислорода
жет не контролироваться на системном, регио
внутри клетки, предпочтительные «ворота вхо
нарном и клеточном уровне. В последнем слу
да», «воронки утилизации» и возможные «сайты
чае можно ожидать наличие специальных кис
депонирования» О2.
лородных клеточных сенсоров или цитоцентри
ческих механизмов, участвующих в управлении
клеточным гомеостазом. Наибольшее количе
МИТОХОНДРИИ
ство данных о чувствительности клеток к вариа
циям содержания кислорода получено для кле
Молекулярный кислород является терми
точных элементов тахитрофных тканей в нальным акцептором электронов в процессах
продукции АТР в митохондриях [4-6]. Эти кле
точные органеллы потребляют до 90% кислоро
Принятые сокращения: АФК - активные формы
кислорода; BKCa
- кальций зависимые калиевые каналы да, поступающего к клеткам за счет диффузион
высокой проводимости; CSE - цистатионин гамма лиаза;
ного и конвективного массопереноса [5, 7, 8].
FIH - фактор, ингибирующий HIF; НО 2 - гемоксигена
за 2; HIF - фактор, индуцированный гипоксией; PHD -
Названные обстоятельства многие годы сохра
пролилгидроксилаза.
няли за митохондриями статус главной мишени
4
49
50
ВЁТОШ
в «охоте» исследователей за внутриклеточным
обзоров по этой теме считают, что кислородная
кислородным сенсором [6, 9, 10].
чувствительность этапов взаимодействия Н2О2 и
Большинство авторов, ставивших себе
тиолсодержащих молекул, в частности глутатио
целью обосновать исходную точку в цепи регу
на, глутаредоксинов, тиоредоксинов и перокси
лирования внутриклеточного кислородного го
редоксинов является скорее свидетельством оп
меостаза, по умолчанию искали гипоксический
тимизации хрупкого баланса этого альянса, чем
сенсор О2. В качестве такового предполагалось
кислородной внутриклеточной сенсорной
обнаружить молекулярный агрегат или процесс,
трансдукции [14-16].
изменяющий свое состояние при уменьшении
Еще один вариант участия митохондрий в
концентрации молекул кислорода. При этом из
формировании «гипоксического ответа» клетки
менение состояния «предполагаемого сенсора»
может быть основан на сигнальной роли актив
должно было иметь значимые для функциони
ных форм кислорода (АФК), продуцируемых
рования и судьбы клетки последствия.
группой ферментов цепи окислительного фос
Ожидаемый на первый взгляд механизм
форилирования [4, 5, 17-19]. Давно известно,
кислородной рецепции предполагали найти в
что при поступлении избытка кислорода в клет
конечных точках поступления кислорода в
ки продукция АФК увеличивается [20, 21]. В ис
клетки. Надеялись, что он будет основан на уче
следованиях прошлых лет отмечалось уменьше
те запаса АТР. Если объем этого запаса прибли
ние продукции прооксидантов на фоне гипок
зится к минимально допустимому значению,
сических воздействий [22, 23]. Однако с некото
должен включиться режим «тревоги», и клетка
рых пор в работах группы авторов появились
запустит «гипоксический ответ». Вдохновляла
данные об увеличении продукции одного из ви
умозрительная модель Atkinson [11] и предло
дов АФК - перекиси водорода - митохондрия
женная им формула расчета энергетического
ми кардиомиоцитов и гладкомышечных клеток
заряда клетки. Однако до настоящего времени
легочной артерии в условиях гипоксии [24-26].
вышеизложенный механизм обнаружен не был,
Их выводы основывались на результатах не
и в недавнем обзоре Waypa et al. [6] данный ва
скольких лабораторий, где различными метода
риант сохранения нормального кислородного
ми изучали процессы внутриклеточного распре
статуса клетки назван «слишком бедным инже
деления АФК при пониженном содержании
нерным решением».
кислорода [27-29].
В качестве критики АТР зависимого меха
Экспериментально обосновано, что АФК по
низма кислородной рецепции можно привести
мимо прооксидантных обладают и регуляторны
следующие доводы. Во первых, кроме кислоро
ми функциями в широком диапазоне клеточных
да для синтеза АТР требуются различные орга
ответов, включая пролиферацию, дифференци
нические субстраты. Следовательно, количество
ровку, старение клеток, регуляцию транскрип
АТР отражает не только адекватную доставку
ционных факторов и воспалительную реакцию
кислорода. Во вторых, совершенно не ясно как
[19, 30, 31]. Было сделано предположение о воз
отдельная митохондрия и весь митохондриаль
можном участии прооксидантов, в частности
ный пул клетки в целом могут повлиять на диф
Н2О2, в механизмах регулирования внутрикле
фузионный массоперенос кислорода в экстра
точного кислородного гомеостаза [32, 33]. В ос
целлюлярной и цитозольной зонах? В третьих,
нову доказательной базы легли результаты пря
по данным прямых измерений содержания кис
мого измерения динамики концентрации АФК с
лорода в клетках, продукция АТР сохраняется
помощью тиолового редокс сенсора roGFP в
вплоть до достижения аноксического порога
гладкомышечных клетках легочной артерии [34].
(2 торр, т.е. 2 мм рт. ст.) [12, 13]. Следовательно,
В условиях нормоксии roGFP был активирован
ориентация на измерение запаса АТР не обеспе
присутствием молекул перекиси водорода в ци
чит детектирование поступления кислорода в
тозоле только на 20%, в межмембранном прост
диапазоне физиологической гипоксии [6].
ранстве митохондрий - на 45% и в матриксе тех
Отсутствие положительных ответов на эти
же органелл - на 70%. При гипоксии активация
вопросы, а также безуспешные 40 летние поиски
roGFP в цитозоле повышалась до 35%, в межмем
АТР зависимого механизма кислородной внут
бранном пространстве - до 65%, а в матриксе
риклеточной рецепции приводят к выводу о том,
митохондрий она заметно снижалась. Сходные
что митохондрии, если они и вовлечены в про
изменения наблюдали [32] на изолированных
цессы регулирования клеточного кислородного
артериальных гладкомышечных клетках. Это
гомеостаза, делают это каким то иным способом.
прямое подтверждение увеличения концентра
Определенный интерес в связи с этим вызы
ции Н2О2 в цитозоле при гипоксии. Полученные
вают процессы окисления тиолов перекисью во
Waypa et al. [6] результаты нашли подтверждение
дорода. Однако осторожные в суждениях авторы
в работах других авторов [8, 35-37].
БИОХИМИЯ том 85 вып. 1 2020
ВНУТРИКЛЕТОЧНАЯ КИСЛОРОДНАЯ ЧУВСТВИТЕЛЬНОСТЬ
51
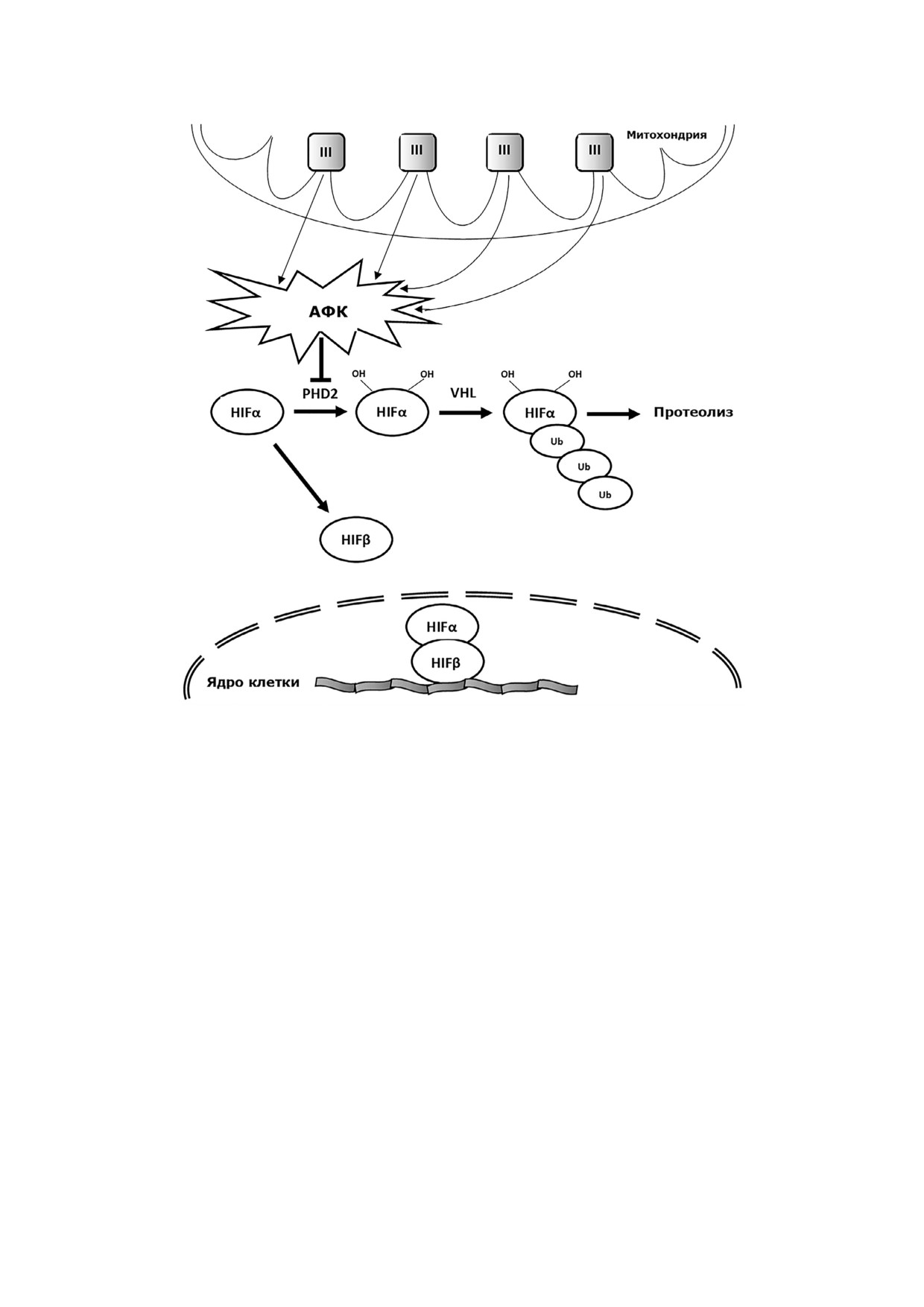
Рис. 1. Ингибирование в цитозоле метаболизма субъединицы HIF α активными формами кислорода митохондриального
генеза, возникающими под влиянием гипоксии: III - митохондриальный комплекс III; АФК - активные формы кисло
рода; PHD - пролилгидроксилаза; VHL - фактор фон Хиппел-Линдау; HIF - фактор, индуцированный гипоксией; Ub -
убиквитин
Недавно были получены доказательства то
Семейству ферментов пролилгидроксилаз
го, что основным источником АФК, оказываю
(PHD) требуется молекулярный кислород как
щим решающее влияние на кислородный гомео
субстрат для деградации фактора, индуцирован
стазис клетки, является комплекс III в цепи
ного гипоксией (HIF), в частности его изофор
ферментов окислительного фосфорилирования
мы HIF α. Это происходит перманентно в нор
[4, 38, 39]. Последовательность событий по во
моксических условиях. Под влиянием гипоксии,
влечению митохондриальных АФК в организа
т.е. при уменьшении концентрации молекул
цию клеточного ответа на гипоксию представле
кислорода в цитозольном окружении PHD2 ак
на на рис. 1. Под влиянием гипоксии комплек
тивность этого фермента снижается, и деграда
сы III дыхательных цепей митохондрий выделя
ция HIF прекращается. В этом случае молекулы
ют часть супероксид анион радикалов в межмем
индуцированного гипоксией фактора переме
бранное пространство [10, 40]. В этом митохон
щаются в ядро клетки, испытывающей недо
дриальном компартменте при участии суперок
статок кислорода, запускается транскрипция се
сиддисмутазы названный радикал превращается
мейства «гипоксических» генов и формируется
в Н2О2 [41, 42]. Далее молекулы перекиси водо
клеточный гипоксический ответ [43].
рода выходят в цитозоль, где оказывают модули
Каким же образом увеличение концентра
рующее влияние на активность фермента про
ции АФК в цитозоле при гипоксии может при
лилгидроксилаза 2 [4, 9, 10].
водить к ингибированию активности PHD2 и
БИОХИМИЯ том 85 вып. 1 2020
4*
52
ВЁТОШ
стабилизации HIF? По мнению Waypa et al. [6] и
Авторы обзора констатировали, что выключение
их единомышленников [44, 45], АФК успевают
BKCa при уменьшении парциального давления
частично денатурировать молекулы ферментов,
кислорода в инкубационном растворе до значе
что ведет к уменьшению их активности.
ний >20 торр не вызывает сомнений. Это оказа
Митохондрии эукариотических клеток до
лось справедливо для широкого класса цито
недавнего времени оставались наиболее вероят
морфных моделей (гладкомышечных клеток ар
ными кандидатами на роль места для кислород
териальных сосудов, нейронов коры, гиппокам
ных сенсоров [4, 6, 10]. На сегодняшний день
па и черной субстанции, клеток 1 го типа каро
собрано достаточное количество доказательств
тидных тел, клеток нейроэпителиальных тел в
того, что побочные продукты биоэнергетичес
бифуркациях бронхов). Важно отметить, что
кой активности митохондрий - АФК - могут
BKCa реагировали на гипоксию как в составе не
принимать модулирующее участие в цитозоль
поврежденной клеточной мембраны целых кле
ных процессах формирования клеточного отве
ток, так и при регистрации в режиме patch clamp.
та на гипоксию [6, 8, 39]. Прооксиданты пред
В обзоре было высказано предположение о том,
стают в этом случае не в качестве О2 сенсоров, а
что и другие типы ионных каналов, возможно,
скорее в роли О2 маркеров. В современных тер
испытывают модулирующее влияние со стороны
минах АФК митохондриального генеза являют
молекул кислорода.
ся участниками сигнальных путей, обеспечиваю
На втором этапе исследований кислородной
щих сохранение кислородного гомеостаза клет
чувствительности К+ каналов специалисты за
ки в условиях недостатка кислорода [4, 10].
интересовались конструкцией этих молекуляр
Можно ожидать, что у этой сигнальной сети бо
ных агрегатов. Искали домены, непосредствен
лее чем один вход.
но отвечающие за сенсорную трансдукцию кон
центрации молекул кислорода в околоканаль
ном пространстве в процессе исполнительного
КИСЛОРОД ЧУСТВИТЕЛЬНЫЕ ИОННЫЕ
акта закрытия селективных переносчиков ионов
КАНАЛЫ КЛЕТОЧНЫХ МЕМБРАН
К+ [49]. Группа кислород чувствительных калие
вых каналов, исследованных авторами, включа
Плазматическая мембрана клетки является
ла три семейства, содержащие более 14 видов
первым барьером на пути молекулярного кисло
[50, 51]. Однако ни в α , ни в β субъединицах
рода к сайтам его внутриклеточного использо
различных типов калиевых каналов такие кис
вания. По мнению Бенджамина Льюина [46],
лород чувствительные домены найдены не бы
очень маленькие нейтральные молекулы кисло
ли [49, 51].
рода легко преодолевают бислойную липидную
На третьем этапе появились зачатки так на
основу клеточных мембран. Общим свойством
зываемой «мембранной гипотезы» [47, 49, 52].
всех живых клеток является наличие регулируе
Эта гипотеза формировалась, как попытка от
мого ионного градиента на плазматических
ветить на сформулированные к началу XXI века
мембранах. Отражением динамики этого ла
вопросы. Почему только калиевые каналы
бильного процесса является мембранный по
чувствительны к изменениям концентрации
тенциал, который создается многочисленными
О2? Как они могут длительное время работать
классами встроенных в билипидный слой ион
без митохондриальной поддержки при регист
ных каналов. При формировании мембранного
рации в режиме patch clamp? Являются ли BKCa
потенциала в клетках животных главным обра
каналы кислородными сенсорами или только
зом участвуют ионы К+, Na+ и Cl-. Перенося
эффекторным звеном в реакции на гипоксию?
щие их каналы испытывают влияние многих
Почему реакция калиевых каналов на уменьше
факторов (напряженность электрического поля,
ние концентрации кислорода происходит очень
концентрация ионов Ca2+, H+, молекул АТР и
быстро?
т.д.) [47].
Различные группы исследователей предпо
После 1988 года в перечень влияний, модули
ложили существование неизвестных белковых
рующих активность мембранных ионных кана
ансамблей, прямо или дистантно связанных с
лов, переносящих К+, попал молекулярный кис
кислород чувствительными калиевыми ионны
лород. Информация, опубликованная Lopez
ми каналами [47, 49]. Кандидатами в члены
Barneo et al. [1], была неожиданной и в последую
этих ансамблей называли глутатион, активиро
щие годы тщательно проверялась. Уже спустя 9
ванную протеинкиназу, гемоксигеназу 2,
лет появился первый обзор о влиянии недостат
NADP(H) оксидазу и другие белки [47, 53, 54].
ка кислорода на кальций зависимые калиевые
Было показано, что BKCa тесно связаны с ге
каналы высокой проводимости (BKCa), который
моксигеназой 2. В экспериментах, проводимых
насчитывал 73 публикации по данной теме [48].
на клетках I го типа каротидных тел крыс, ис
БИОХИМИЯ том 85 вып. 1 2020
ВНУТРИКЛЕТОЧНАЯ КИСЛОРОДНАЯ ЧУВСТВИТЕЛЬНОСТЬ
53
пользуя масс спектрометрический анализ и ко
Взаимодействие мембранных калиевых ка
иммунопреципитацию, установили тесную ассо
налов различных семейств с ассоциированными
циацию молекулярной конструкции кальций за
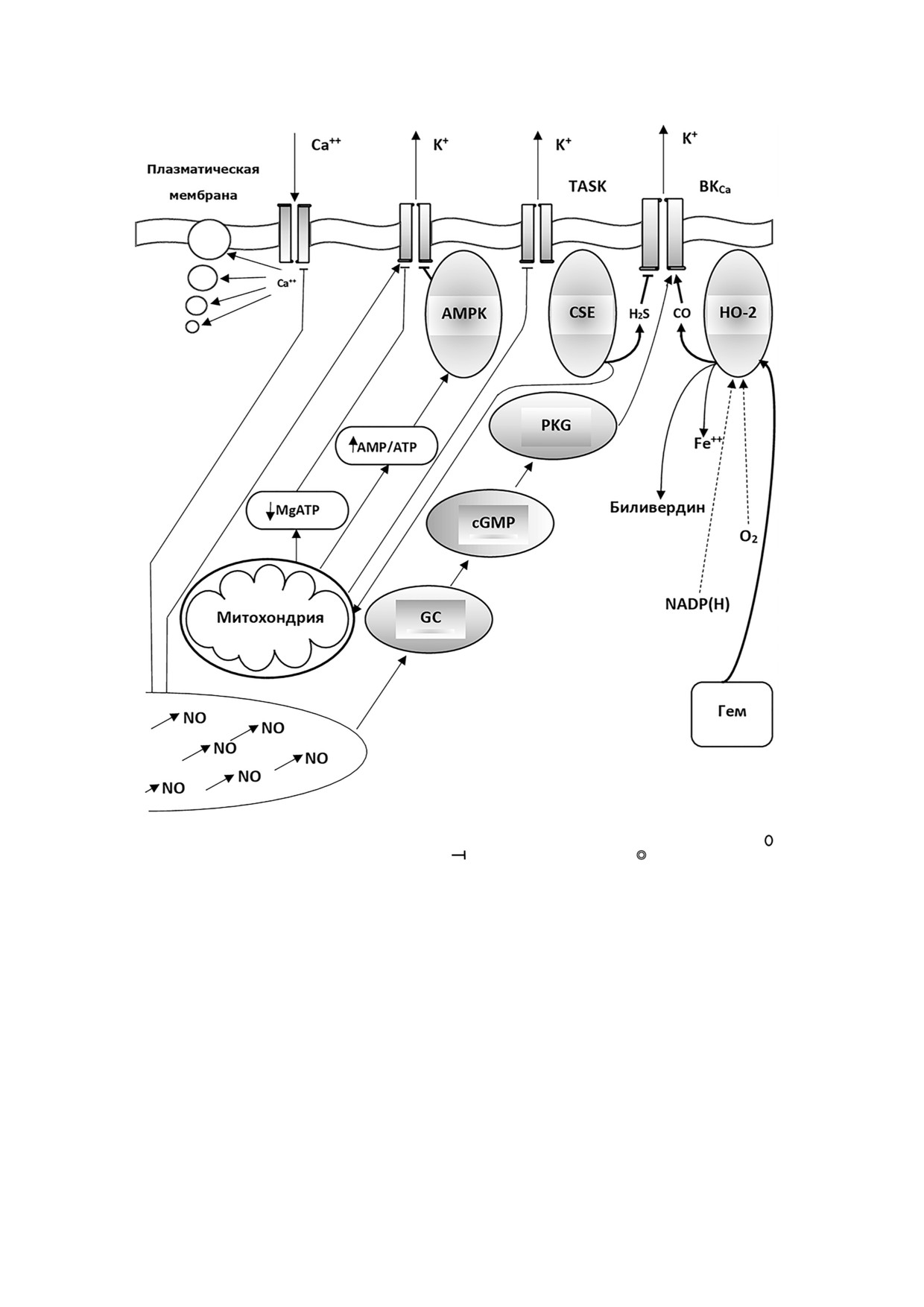
белками представлено на рис. 2. Гемоксигеназа 2
висимых калиевых каналов высокой проводи
осуществляет деградацию гема, превращая его в
мости с HO 2 [55]. Катаболизируя геминовые мо
биливердин, ион двухвалентного железа и мо
лекулы, гемоксигеназа 2 продуцирует монооксид
нооксид углерода. Кофакторами деградации ге
углерода, биливердин и Fe2+. При нормоксии в
ма при нормоксии выступают NADP(H) и моле
качестве кофакторов участвуют NADP(H) и мо
кулярный кислород [61]. Вышеназванные про
лекулярный кислород. Показано, что монооксид
цессы происходят в том числе и в гломусных
углерода при этом выступает как активатор BKCa
клетках каротидных тел [56, 62].
каналов [56]. При гипоксии, когда кислородный
Молекулы CO оказывают активирующее
кофактор становится дефицитным, тоническое
действие на кальций зависимые калиевые кана
укрепляющее влияние монооксида углерода на
лы высокой проводимости [57, 63, 64]. Гипоксия
BKCa ослабевает, и их проводимость для ионов
уменьшает продукцию молекул монооксида уг
калия снижается. Молекулы гемоксигеназы 2
лерода в каротидных телах. Такое же действие
выступают, таким образом, в качестве кислород
производит блокатор НО 2 цинкпротопорфи
ного сенсора при кальций зависимых калиевых
рин 9 [62]. Эти СО дефицитные состояния ве
каналах высокой проводимости. Другие группы
дут к закрытию BKCa [51].
авторов сумели показать ингибирующее участие
Таким образом, уменьшение концентрации
H2S в управлении BKCa на фоне гипоксии в клет
молекулярного кислорода в цитоплазматичес
ках I го типа каротидных тел мышей, крыс и че
ком окружении конститутивной НО 2, ассоции
ловека [57, 58]. Это заставило включить в объяс
рованной с BKCa, понижает ее каталитическую
нительную модель кислородной чувствительнос
активность. Это приводит к ограничению син
ти калиевых каналов два внутриклеточных газо
теза внутриклеточного газотрансмиттера - мо
трансмиттера: СО и H2S [52].
нооксида углерода, который является активато
Позднее мембранная гипотеза приобрела
ром BKCa. Дефицит СО в ходе развития гипок
черты необходимого оформления, если не за
сического состояния клетки ведет к закрытию
вершения [51, 59]. Ионные каналы плазмати
калиевых каналов.
ческих мембран играют значительную роль в
Это нарушает динамику формирования
процессах сенсорной трансдукции различной
мембранного потенциала гломусных клеток ка
модальности: либо как первичные сенсорные
ротидных тел и некоторых других кислород
элементы, либо как последующие звенья эф
чувствительных клеточных конструктов.
фекторной сети [60]. Калиевые каналы клеток
Следовательно, гемоксигеназа 2 клеток I го
I го типа каротидных тел позвоночных являют
типа каротидных тел позвоночных является тем
ся примером каналов с эффекторной специали
молекулярным внутриклеточным объектом, в
зацией. Среди них семейства Kv3, Kv4, BKCa и
котором происходит сенсорная трансдукция
TASK [50, 52]. Доказано, что проводимость ка
концентрации внутриклеточного кислорода в
лиевых каналов этих типов зависит от концен
управляющий сигнал для эффекторов - BKCa.
трации молекулярного кислорода на поверхнос
Свою версию мембранной гипотезы авторы
ти плазматических мембран содержащих их кле
считают доказанной [51]. Ее эвристическая сила
ток [1, 51]. Открытым оставался вопрос: «Какая
нашла подтверждение в исследовании на сис
часть молекулярного конструкта ионного кана
темном уровне. У молодых здоровых испытуе
ла или ассоциированных с функционированием
мых была отмечена редукция вентиляторного
канала сателлитных молекул является кисло
ответа на гипоксию после кратковременной ин
родным сенсором?».
галяции избытка монооксида углерода [65].
Авторы мембранной гипотезы Chris Peers и
В дополнение к CO зависимому механизму
Nanduri Prabhakar считают, что калиевые кана
модуляции активности калиевых каналов гло
лы являются эффекторной частью сигнальной
мусных клеток каротидных тел существует вто
сети в чувствительных к кислороду цитосисте
рая интрацеллюлярная сигнальная цепь. Цент
мах [49, 51, 52]. Восприимчивыми же к недо
ральным звеном этой цепи является цистатио
статку кислорода следует считать процессы
нин гамма лиаза [66, 67]. Данный фермент син
функционирования ассоциированных с калие
тезирует внутриклеточный газотрансмиттер
выми каналами макромолекул [47, 53, 54]. Сре
H2S, который экспрессируется в гломусных
ди них НО 2, NADP(H), цистатионин гамма
клетках каротидных тел позвоночных [51, 57,
лиаза (CSE), гуанилатциклаза (GC), цикличес
68]. В условиях нормоксии синтез молекул серо
кий гуанозинмонофосфат (cGMP) и протеин
водорода минимален, но при гипоксии генера
киназа G (PKG).
ция H2S увеличивается пропорционально на
БИОХИМИЯ том 85 вып. 1 2020
54
ВЁТОШ
Рис. 2. Взаимодействие мембранных калиевых каналов различных семейств с ассоциированными белками:
- ассоции
рованные с каналами белки; → - активирующее действие;
- блокирующее действие;
- везикулы с медиатором, про
дуцируемым гломусными клетками каротидных тел; AMPK - АМФ активируемая протеинкиназа; CSE - цистатионин
гамма лиаза; HO 2 - гемоксигеназа 2; PKG - протеинкиназа g; MgATP - активируемая магнием АТРаза; cGMP - цик
лический гуанилатмонофосфат; GC - гуанилат циклаза
растанию дефицита кислорода [57, 69]. У нокау
Совокупность накопленных эксперименталь
тированных по CSE мышей отсутствует увели
ных данных позволяет считать продукт деятель
чение синтеза H2S в ответ на гипоксию. Блока
ности цистатионин гамма лиазы (H2S) обяза
тор CSE - пропаргил L глицин также нивели
тельным участником процесса формирования
рует продукцию внутриклеточного сероводоро
клеточного ответа каротидных тел на гипокси
да [59]. Сегодня принято считать, что CSE явля
ческий стимул.
ется главным продуцентом внутриклеточного
В 2010 году Li et al. [58] первыми выявили
H2S в ответ на гипоксию [51]. Искусственное
влияние избытка внутриклеточного сероводоро
увеличение количества молекул сероводорода в
да на ионные каналы гломусных клеток каротид
клетках каротидных тел активирует этот орган
ных тел. Позднее было уточнено, что мишенью
пропорционально степени воздействия [57, 70].
для H2S являются BKCa, но влияние сероводоро
БИОХИМИЯ том 85 вып. 1 2020
ВНУТРИКЛЕТОЧНАЯ КИСЛОРОДНАЯ ЧУВСТВИТЕЛЬНОСТЬ
55
да на них отличается от влияния монооксида уг
условиях [76]. Установлено, что стимулирующее
лерода [59]. Внутриклеточный сероводород про
влияние NO на BKCa передается от монооксидов
воцирует вход в гломусные клетки ионов каль
азота, проникающих в гломусные клетки через
ция [70]. Этот же газотрансмиттер оказывает ин
гуанилатциклазу, циклический гуанозинмоно
гибирующее влияние на калиевые каналы се
фосфат и далее через протеинкиназу g [77, 78].
мейства TASK через угнетение процессов окис
Давно известно, что самый оперативный
лительного фосфорилирования в митохондриях
(быстрый) клеточный ответ на острую гипоксию
гломусных клеток [70, 71]. Однако главной ми
свойственен гломусным клеткам каротидных
шенью для продукта каталитической деятель
тел. Сегодня не вызывает сомнения тот факт,
ности CSE - сероводорода - в клетках I го типа
что в этом ответе участвуют мембранные калие
каротидных тел являются каналы BKCa [59, 72].
вые каналы нескольких семейств. BKCa фигури
Таким образом, в условиях нормоксии фер
рует сразу в нескольких сигнальных цепях ги
мент CSE малоактивен. На фоне нарастающей
поксического клеточного метаболизма в качест
внутриклеточной гипоксии его активность рас
ве эффекторного звена. Кислородным сенсором
тет пропорционально дефициту кислорода, что
при BKCa является гемоксигеназа 2. Наряду с
сопровождается повышением интенсивности
этим хорошо известны молекулярные механиз
генерации H2S. Этот газотрансмиттер ингибиру
мы цитоплазматического ответа на хроническое
ет активность BKCa и косвенно через митохон
гипоксическое воздействие.
дрии уменьшает проводимость калиевых кана
лов иных семейств, в частности TASK. Следова
тельно, цистатионин гамма лиаза клеток I го
ЦИТОПЛАЗМАТИЧЕСКИЕ МЕХАНИЗМЫ
типа каротидных тел позвоночных является еще
ЧУВСТВИТЕЛЬНОСТИ К КИСЛОРОДУ
одним молекулярным внутриклеточным объек
том, в котором происходит сенсорная трансдук
Каротидные тела являются примером сис
ция концентрации интрацеллюлярного кисло
темного «сенсора на кислород» [79, 80]. В свою
рода в управляющий сигнал для эффекторов -
очередь, гемоксигеназа 2 имеет статус ассоции
BKCa. Можно констатировать, что в клетках I го
рованного с плазматической мембраной «кис
типа каротидных тел позвоночных имеется бо
лородного сенсора» для гломусных клеток I го
лее чем один механизм сенсорной трансдукции
типа каротидных тел [51]. Наряду с этим в ци
интрацеллюлярной концентрации молекуляр
топлазме всех клеток Metazoa имеется сигналь
ного кислорода в изменении активности калие
ный пул, центральным звеном которого являет
вых каналов. СО и H2S газотрансмиттеры
ся HIF - фактор, индуцированный гипоксией
действуют на эффекторную часть кислород
[81]. В этом пуле следует искать еще один кле
чувствительной сигнальной цепи по ходу нарас
точный сенсор на кислород.
тания гипоксического стимула противополож
История открытия и исследования HIF пула
ным образом. При этом концентрация молекул
кратко изложена в работе Szewczak [82]. Много
СО уменьшается, и BKCa лишаются поддержи
летнее изучение регуляторной роли эритропоэ
вающего влияния, а концентрация H2S растет,
тина (Epo) привело к открытию кодирующего
что стимулирует закрытие калиевых каналов.
его гена [83], а вслед за этим активируемого ги
Клетка при гипоксии оказывается под надеж
поксией фактора HIF цитоплазматической ло
ным двойным контролем.
кализации, запускающего транскрипцию этого
По мнению авторов последней версии
гена [2]. Последующий анализ показал, что HIF
«мембранной гипотезы», третий внутриклеточ
запускает массивный транскрипционный кас
ный газотрансмиттер - NO - также участвует в
кад генов в клетках млекопитающих в ответ на
регулировании внутриклеточного кислородного
уменьшение доставки кислорода [3, 84].
гомеостазиса. Давно известно, что гипоксия
Состав, структура и функционирование
уменьшает активность NO синтазы (NOS), в
HIFs обсуждаются в многочисленных обзорах
том числе ее нейрональной изоформы nNOS в
[85-87]. Схематически эти данные представле
гломусных клетках каротидных тел [73]. По
ны на рис. 3.
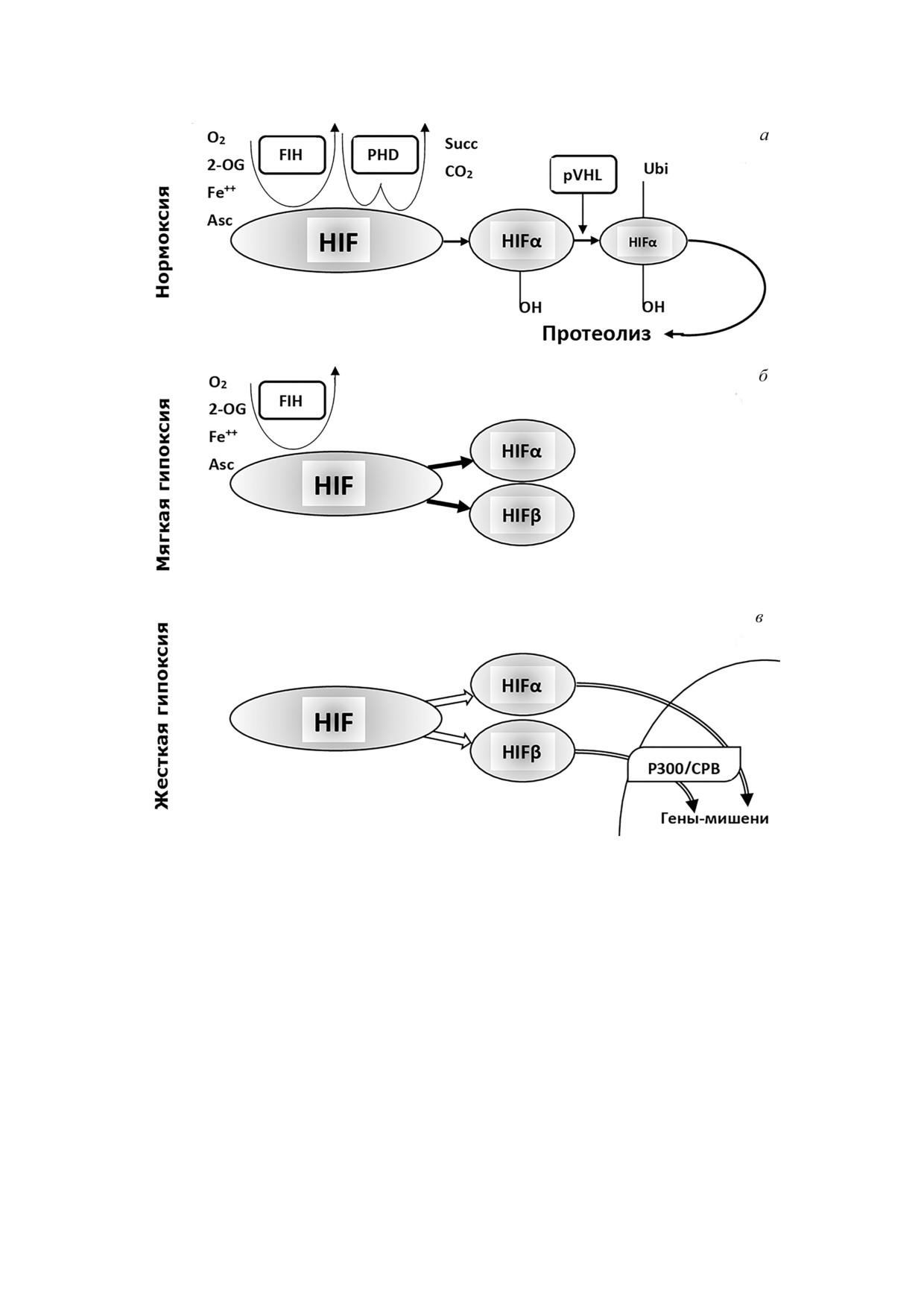
следняя не экспрессируется в клетках I го типа
При нормоксии напряжение кислорода в
и, по замыслу авторов, попадает в них из окру
цитоплазме клетки находится в пределах 20-
жающих эти клетки эфферентных отростков
7 торр (рис. 3, а). В таких условиях резидентно
глоссофаренгиального нерва [51, 73, 74]. Есть
присутствующие в клетках молекулы HIF под
данные о том, что искусственное увеличение ко
вергаются протеосомальной деградации. На
личества молекул NO в клетках каротидных тел
первом этапе катаболизма HIF на него, в свою
активирует BKCa [75]. Однако эти результаты не
очередь, действует молекулярный фактор FIH
были подтверждены в иных экспериментальных
(фактор ингибирования HIF). Он отщепляет от
БИОХИМИЯ том 85 вып. 1 2020
56
ВЁТОШ
Рис. 3. Схема цитоплазматического кислород чувствительного пула метаболитов с участием HIF: нормоксия (а), мягкая
гипоксия (б) и жесткая гипоксия (в); 2 OG - 2 оксиглутарат; Asc - аскорбиновая кислота; FIH - фактор, ингибирующий
HIF; PHD - домен пролилгидроксилазы; Succ - янтарная кислота; pVHL - белок супрессии опухоли фон Хиппел-Лин
дау; Ubi - убиквитин; P300/CBP - коактиватор транскрипции
HIF аспарагиновый фрагмент. Реакция идет в
холи фон Хиппел-Линдау и при участи убикви
присутствии достаточного количества кислоро
тина попадает в протеасомы, где подвергается
да, 2 оксоглутарата, ионов двухвалентного же
окончательной фрагментации [80, 84].
леза и аскорбиновой кислоты [87].
На исходном этапе развития внутриклеточ
Наряду с этим на начальном этапе протеоли
ной мягкой гипоксии при умеренном снижении
за молекул HIF вступает в действие пролилгид
напряжения кислорода в цитоплазме катабо
роксилаза, которая присоединяет к двум моле
лизм HIF изменяется (рис. 3, б). Выпадает звено
кулам пролина в α субъединице ОН группы. В
с участием пролилгидроксилазы. Полученные
результате образуется диоксид углерода и янтар
промежуточные продукты HIF α и HIF β не до
ная кислота [88]. На следующем этапе деграда
ходят до протеасом, и окончательный цикл про
ции HIF α под влиянием белка супрессии опу
теолиза не получает завершения [84, 87].
БИОХИМИЯ том 85 вып. 1 2020
ВНУТРИКЛЕТОЧНАЯ КИСЛОРОДНАЯ ЧУВСТВИТЕЛЬНОСТЬ
57
Метаболизм с участием HIF на фоне тяжелой
клетках млекопитающих, а HIF 2α и HIF 3α
гипоксии представлен на рис. 3, в. В условиях не
присутствуют в некоторых видах эндотелия и со
достатка кислорода начальные этапы протеолиза
единительной ткани [80, 85, 97]. Кроме кислоро
с участием FIH и PHD становятся невозможны
да на метаболиты HIF пула действуют АФК, ок
ми. Более жесткая гипоксия ингибирует гидрок
сид азота, HSP90 и другие молекулы, обладаю
силирование аспарагинового фрагмента HIF.
щие сигнальным потенциалом [6, 10]. Рассмот
HIF α и HIF β в этом случае способны совмест
рим детали этих регуляторных процессов.
но с коактиватором транскрипции P300/CBP
включать процессы транскрипции генов мише
ней, чья компетенция относится к участию в пре
ВЗАИМОДЕЙСТВИЕ ОСНОВНЫХ
одолении кислородного дефицита [80, 84, 85].
МЕХАНИЗМОВ КИСЛОРОДНОЙ
По последним оценкам массивный тран
ЧУВСТВИТЕЛЬНОСТИ КЛЕТКИ
скрипционный каскад, инициируемый HIF, мо
жет затрагивать до 1500 генов [84, 89, 90]. Ско
Митохондриальные, мембранные и цито
рость реагирования клеток на гипоксию с во
плазматические механизмы обеспечения кисло
влечением метаболического HIF пула не высо
родного гомеостаза клетки, являясь активными
ка. Самые ранние результаты активирования ге
участниками целлюлярного метаболизма, не
нома в ответ на внутриклеточный недостаток
могут быть свободными от взаимного влияния
кислорода проявляются через час [91]. Пик
друг на друга [49, 54]. К 2008 году Ward [54] раз
экспрессии генов в условиях хронической внут
личал три возможных механизма влияния кис
риклеточной гипоксии наступает через 24 ч [80].
лород чувствительных процессов в митохон
Нокаутированные по HIF мыши погибают на
дриях на пластический и энергетический кле
10 й день эмбрионального развития, что свиде
точный метаболизм. За прошедшие годы сложи
тельствует о востребованности этого механизма
лось мнение, что основное влияние митохон
регулирования кислородного гомеостаза клеток
дрий на цитоплазматические и мембранные ме
уже на пренатальном этапе [92].
ханизмы кислородной чувствительности клетки
Анализ изменений метаболизма клеток
осуществляется главным образом через актив
Metazoa в ответ на уменьшение концентрации
ные формы кислорода [4, 6, 8, 39].
кислорода показывает наличие кластера из двух
Метаболический пул цитоплазматических
сотен кислород чувствительных белков, запускаю
процессов, в которых мастером регулятором яв
щих каскады посттрансляционной модификации
ляется HIF, представлен на рис. 1 и 3. Активные
других белков. Гидроксилазы - один из важней
формы кислорода (Н2О2) выходят из митохон
ших элементов этого кластера. Среди них выде
дрий (комплекс III), диффундируют в цитозоле
ляют пролилгидроксилазы, которые гидроксили
и оказывают супрессирующее влияние на актив
руют пролин в белковых молекулах [81, 93].
ность фермента пролилгидроксилаза 2 [41, 42].
Домен PHD, ассоциированный с трансляци
На фоне развивающейся гипоксии этот процесс
ей молекул HIF в цитоплазме клеток, в условиях
усиливается. Как следствие, прекращается де
клеточной нормоксии постоянно гидроксилиру
градация HIF. В этом случае разновидности мо
ет пролин α субъединицы этой гетеродимерной
лекул индуцированного гипоксией фактора пе
молекулы. Гидроксилирование осуществляется
ремещаются в ядро клетки, испытывающей не
сначала в позиции Р564, а затем в Р402, что при
достаток кислорода. Запускается транскрипция
водит к кислород зависимой деградации HIF 1α
семейства «гипоксических» генов и формирует
[91, 94]. Таким образом, PHD является ближай
ся клеточный гипоксический ответ [43]. Такого
шим (проксимальным) регулятором активности
рода механизм не может быть быстрым. Следо
HIF [9]. Это заставляет нас считать цитоплазма
вательно, реакция на гипоксию при участии
тическим сенсором на кислород не HIF, а HIF
HIF пула оказывается эффективной в случае
гидроксилазы, в том числе PHD [93, 95].
хронического недостатка кислорода.
Центральным звеном сигнального пула с
Наряду с этим имеет место влияние HIF пу
участием HIF является семейство индуцирован
ла на процессы окислительного фосфорилиро
ных гипоксией транскрипционных факторов
вания в митохондриях [80, 98]. Транскрипция
(HIFs). Этот фактор представляет собой гетероди
гена, кодирующего киназу пируватдегидрогена
мерный молекулярный конструкт, состоящий из
зы, запускается под влиянием HIF. Эта киназа
кислород чувствительных субъединиц HIF α и
фосфорилирует субъединицу пируватдегидроге
конститутивных субъединиц HIF β [4, 96]. У выс
назы Е1α, тем самым инактивируя этот фермент
ших многоклеточных встречаются три вариации
ный комплекс, который конвертирует пируват в
HIF α субъединиц: HIF 1α, HIF 2α и HIF 3α.
ацетил коэнзим А. Под влиянием HIF это про
Первый экспрессируется во многих, если не всех
исходит как за счет депривации по глюкозе, так
БИОХИМИЯ том 85 вып. 1 2020
58
ВЁТОШ
и путем ограничения использования жирных
Детальные изменения в мембранно связан
кислот. В последнем случае HIF 1 индуцирует
ных микродоменах, объединяющих каналы и
транскрипцию микроРНК miR210, которая, в
митохондрии, интенсивно исследуются в насто
свою очередь, уменьшает экспрессию железо
ящее время. Не меньший интерес специалистов
серосодержащих каркасных белков ISCU1/2.
вызывают взаимодействия чувствительных к не
Как следствие, происходит ингибирование ак
достатку кислорода мембранных механизмов и
тивности цикла трикарбоновых кислот, сниже
HIF пула цитоплазмы клетки.
ние интенсивности окислительного фосфори
Количество экспериментальных исследова
лирования и редукция потребления кислорода
ний взаимного обмена сигналами между кисло
митохондриями [99, 100]. Таким образом, HIF
род чувствительными каналами плазматичес
на фоне развития гипоксии в соответствии с
кой мембраны клетки и HIF пулом невелико.
принципом обратной связи оказывает влияние
Нам не удалось найти ни одного обзора на эту
на источник внутриклеточных АФК.
тему. В 2006 году Tajima et al. [104] привели дока
Антиоксидантный потенциал клеток также
зательства влияния HIF пула клеток культуры
находится под влиянием HIF пула. В условиях
меланомы человека в ходе длительной гипоксии
гипоксии HIF 1 и HIF 2 активируют тран
на увеличение проводимости кальций зависи
скрипцию соответствующих генов, что ведет к
мых калиевых каналов (KCa). Это происходило
запуску в митохондриях процессов дополни
под действием избыточной экспрессии HIF 1α
тельного синтеза глутатиона - базового компо
в ответ на недостаток кислорода в среде культи
нента антиоксидантной системы [101].
вирования. Позднее аналогичный эффект был
Следовательно, HIF пул и митохондриаль
получен на культурах гладкомышечных клеток
ный метаболизм клетки сопряжены системой
легочной артерии крыс для семейства потенци
обратных связей, обеспечивающих сохранение в
ал зависимых калиевых каналов (Кv) [105] и
определенных пределах ее кислородного гомео
WEHI 231B клеток мыши для TASK 2 калиевых
стазиса. На сегодняшний день известны два
каналов [106].
контура обратной связи (прооксидантный и ан
Имеются отдельные сведения о том, что в ус
тиоксидантный) между митохондриальными и
ловиях продолжительной гипоксии молекулы
HIF пулами клетки, которые балансируют их
HIF 2α осуществляют репрессию генов, ответ
взаимное влияние. Схематически это представ
ственных за синтез β1 субъединицы BKCa [107].
лено на рис. 4.
В последние годы появились данные о пря
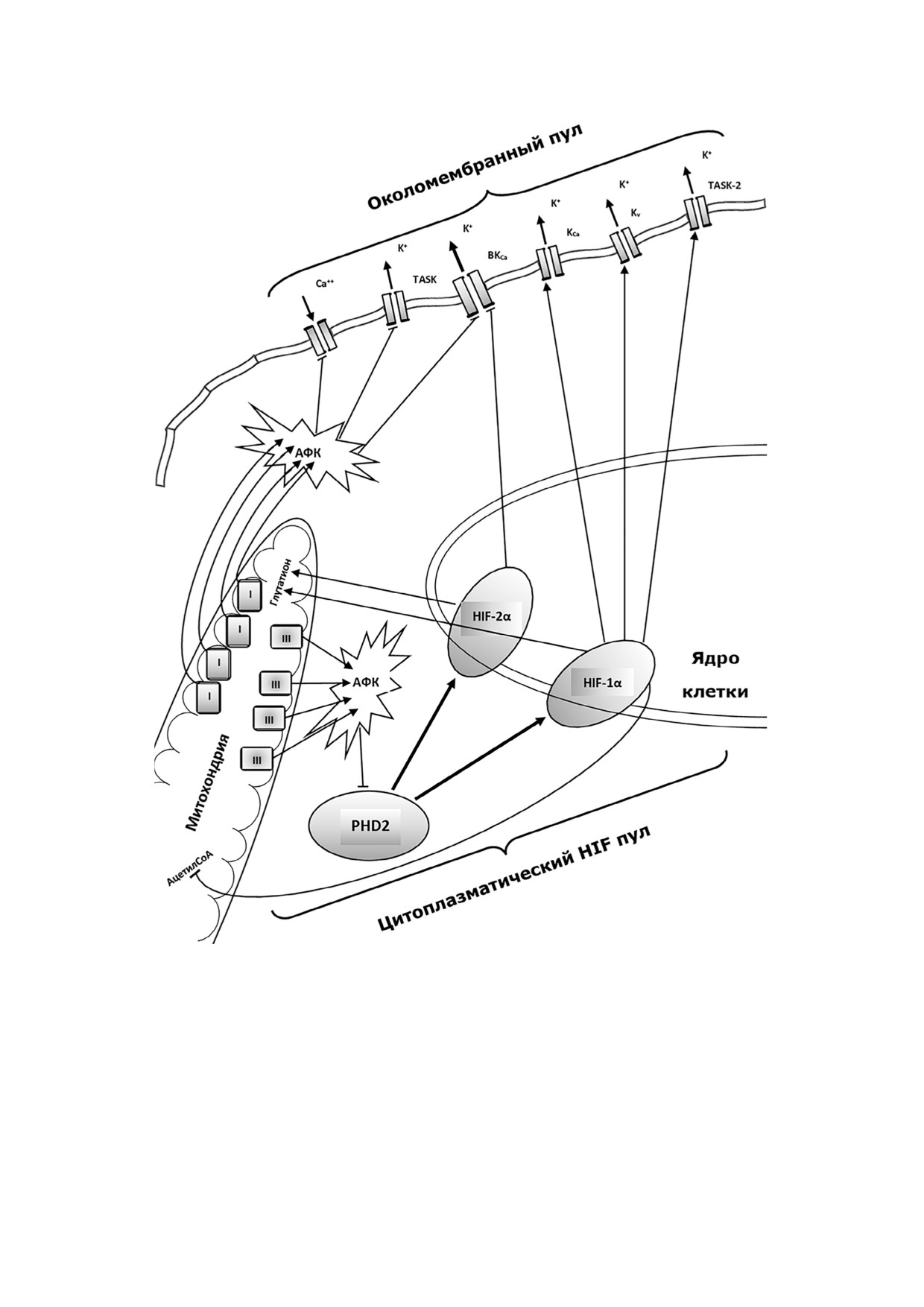
Взаимодействия митохондриального мета
мом влиянии пролилгидроксилаз из HIF пула
болического пула и мембранно агрегированных
на катионные каналы семейства TRP (TRPA1 и
механизмов кислородного гомеостаза клетки
TRPV3). В условиях нормоксии пролилгидрок
исследованы в меньшей степени [4, 52, 102]. В
силазы не только направляют HIF на путь про
условиях быстро развивающейся гипоксии
теосомальной деградации, но и ингибируют ак
комплекс I в цепи ферментов окислительного
тивность TRPA1. При снижении напряжения
фосфорилирования увеличивает продукцию
кислорода в цитоплазме это ингибирование ос
АФК (О2·-) [4, 103]. Активные формы кислоро
лабевает, и в условиях гипоксии происходит его
да, в свою очередь, ингибируют проводимость
отмена [108, 109].
кальциевых каналов, расположенных на плаз
Полученные данные свидетельствуют о про
матической мембране клетки [4]. Повышение
тивоположных тенденциях (активирующих и
концентрации АФК вблизи внутренней поверх
тормозящих) влияния HIF пула клетки на
ности плазматической мембраны блокирует
мембранно связанные механизмы регулирова
проводимость ионов калия через TASK каналы
ния клеточного кислородного гомеостаза. Для
[54]. Эта же причина ведет к закрытию кальций
прояснения приоритетов данного механизма
зависимых калиевых каналов высокой проводи
регуляции требуются дальнейшие исследова
мости [6]. Таким образом, можно считать дока
ния [110].
занным, что АФК в условиях быстро развиваю
Данных об ответном влиянии кислород
щейся гипоксии оказывают тормозное влияние
чувствительных калиевых каналов плазматичес
на проводимость кальциевых и калиевых кана
кой мембраны клеток на HIF пул найти не уда
лов, расположенных поблизости от ассоцииро
лось. Отсутствие таких данных можно объяс
ванных с этими каналами митохондрий [102,
нить колоссальной разницей в скорости реаги
103]. Следовательно, побочные прооксидант
рования ионных каналов (несколько секунд) и
ные продукты метаболизма митохондрий на фо
метаболизма HIF пула (десятки минут) на ги
не гипоксии способствуют деполяризации клет
поксический стимул. В этом случае медленные
ки за счет ингибирования нескольких семейств
процессы могут оказывать эффективное влия
калиевых каналов (рис. 4).
ние на быстрые, но не наоборот.
БИОХИМИЯ том 85 вып. 1 2020
ВНУТРИКЛЕТОЧНАЯ КИСЛОРОДНАЯ ЧУВСТВИТЕЛЬНОСТЬ
59
Рис. 4. Сигнальные отношения между метаболическим пулом митохондрий, цитоплазматическим HIF пулом и около
мембранными механизмами кислородной чувствительности клетки: АФК - активные формы кислорода; I - комплекс I
в цепи ферментов окислительного фосфорилирования; III - комплекс III в цепи ферментов окислительного фосфорили
рования; PHD2 - домен пролилгидроксилазы 2
Таким образом, оба основных механизма ре
стимулов различной модальности тесно взаи
гулирования кислородного гомеостазиса клетки
мосвязаны и дополняют друг друга.
(цитоплазматический и мембранный) в купе с
Приведенные в обзоре данные позволяют
модулирующим влиянием митохондриального
сделать вывод, что клетки Metazoa обладают
метаболизма на фоне действия гипоксических
несколькими способами определения содержа
БИОХИМИЯ том 85 вып. 1 2020
60
ВЁТОШ
ния кислорода в клеточном объеме. На фоне
же встречаться внутри клеток при экспонирова
быстроразвивающейся гипоксии детекцию не
нии организма в условиях гипероксии, но их
достатка кислорода осуществляет околомем
влияние реализуется пока еще недостаточно
бранный пул калиевых каналов с ассоциирован
изученными способами [111-113].
ными белками. В условиях хронической гипоксии
клеточным ответом на уменьшение концентра
ции кислорода управляет метаболический пул,
Благодарности. Автор выражает благодар
мастером регулятором в котором является HIF.
ность Л.Б. Буравковой за полезные и конструк
Влияние митохондриального метаболизма на
тивные обсуждения в ходе выполнения работы.
эти два полюса кислородно сенсорной актив
Конфликт интересов. Автор заявляет об отсут
ности ограничиваются модуляцией через АФК.
ствии конфликта интересов в финансовой или
Следует особо отметить, что вышеперечислен
какой либо иной сфере.
ные внутриклеточные механизмы вполне ус
Соблюдение этических норм. Настоящий об
пешно реализуют реакции клеток на недостаток
зор не содержит описания выполненных авто
кислорода. Избыточные по отношению к норме
ром исследований с участием людей или ис
концентрации окислителя, очевидно, могут так пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Lopez Barneo, J., Lopez Lopez, J., Urena, J., and
sured by delayed fluorescence of endogenous protoporphyrin
Gonzalez, C. (1988) Chemotransduction in the carotid
IX, Nat. Methods, 3, 939-945, doi: 10.1038/nmeth940.
body: K+ current modulated by PO2 in type I chemorecep
14.
Быстрова М.Ф., Буданова Е.Н. (2007) Перекись водо
tor cells, Science, 241, 580-582.
рода и пероксиредоксины в редокс регуляции внут
2.
Semenza, G., and Wang, G. (1992) A nuclear factor induced
риклеточной сигнализации, Биологические мембраны,
by hypoxia via de novo protein synthesis binds to the human
24, 115-125.
erythropoietin gene enhancer at a site required for transcrip
15.
Октябрьский О.Н., Смирнова Г.В. (2007) Редокс регу
tional activation, Mol. Cell. Biol., 12, 5447-5454.
ляция клеточных функций, Биохимия, 72, 158-174.
3.
Semenza, G., Roth, P., Fang, H., and Wang, G. (1994)
16.
Hopkins, B.L., and Neumann, C.A. (2019) Redoxins as
Transcriptional regulation of genes encoding glycolytic
gatekeepers of the transcriptional oxidative stress response,
enzymes by hypoxia inducible factor 1, J. Biol. Chem., 269,
Redox Biol., 21, 101-104, doi: 10.1016/j.redox.2019.101104.
23757-23763.
17.
Quinlan, C., Perevoshchikova, I., Hey Mogensen, M.,
4.
McElroy, G., and Chandel, N. (2017) Mitochondria con
Orr, A., and Brand, M. (2013) Sites of reactive oxygen species
trol acute and chronic responses to hypoxia, Exp. Cell Res.,
generation by mitochondria oxidizing different substrates,
356, 217-222, doi: 10.1016/j.yexcr.2017.03.034.
Redox. Biol., 23, 304-312, doi: 10.1016/j.redox.2013.04.005.
5.
Скулачев В.П., Богачев А.В., Каспаринский Ф.О. (2010)
18.
Goncalves, R., Bunik, V., and Brand, M.
(2016)
Мембранная биоэнергетика, Изд во МГУ, Москва.
Production of superoxide/hydrogen peroxide by the mito
6.
Waypa, G., Smith, K., and Schumacher, P. (2016) O2 sensing,
chondrial 2 oxoadipate dehydrogenase complex, Free
mitochondria and ROS signaling: the fog is lifting, Mol. Aspects
Radic. Biol. Med., 91, 247-255, doi: 10.1016/j.freeradbiomed.
Med., 47-48, 76-89, doi: 10.1016/j.mam.2016.01.002.
2015.12.020.
7.
Santore, M., McClintock, D., Lee, V., Budinger, G., and
19.
Sena, L., and Chandel, N. (2012) Physiological roles of
Chandel, N. (2002) Anoxia induced apoptosis occurs
mitochondrial reactive oxygen species, Mol. Cell, 48,
through a mitochondria dependent pathway in lung
158-167, doi: 10.1016/j.molcel.2012.09.025.
epithelial cells, Am. J. Physiol. Lung Cell. Mol. Physiol.,
20.
McCord, J. (1985) Oxygen derived free radicals in postis
282, L727-L734, doi: 10.1152/ajplung.00281.2001.
chemic tissue injury, New Engl. J. Med., 312, 159-163,
8.
Solaini, G., Baracca, A., Lenaz, G., and Sgarbi, G. (2010)
doi: 10.1056/NEJM198501173120305.
Hypoxia and mitochondrial oxidative metabolism,
21.
Cross, C., Halliwell, B., Borish, E., Pryor, W., Ames, B.,
Biochim. Biophys. Acta., 1797, 1171-1177, doi: 10.1016/
Saul, R., McCord, J., and Harman, D. (1987) Oxygen rad
j.bbabio.2010.02.011.
icals and human disease, Ann. Intern. Med., 107, 526-545.
9.
Bell, E., and Chandel, N. (2007) Mitochondrial oxygen
22.
Archer, S., Peterson, D., Nelson, D., DeMaster, E., Kelly, B.,
sensing: regulation of hypoxia inducible factor by mito
Eaton, J., and Weir, E. (1989) Oxygen radicals and antioxidant
chondrial generated reactive oxygen species, Essays
enzymes alter pulmonary vascular reactivity in the rat lung, J.
Biochem., 43, 17-27, doi: 10.1042/BSE0430017.
Appl. Physiol., 66, 102-111, doi: 10.1152/jappl.1989.66.1.102.
10.
Hamanaka, R., and Chandel, N. (2009) Mitochondrial reac
23.
Michelakis, E., Archer, S., and Weir, E. (1995) Acute
tive oxygen species regulate hypoxic signaling, Curr. Opin.
hypoxic pulmonary vasoconstriction: a model of oxygen
Cell Biol., 21, 894-899, doi: 10.1016/j.ceb.2009.08.005.
sensing, Physiol. Res., 44, 361-367.
11.
Atkinson, D. (1968) The energy charge of the adenylate
24.
Chandel, N., McClintock, D., Feliciano, C., Wood, T.,
pool as a regulatory parameter. Interaction with feedback
Melendez, J., Rodriguez, A., and Schumacker, P. (2000)
modifiers, Biochemistry, 7, 4030-4034.
Reactive oxygen species generated at mitochondrial com
12.
Koo, Y., Cao, Y., Kopelman, R., Koo, S., Brasuel, M., and
plex III stabilize hypoxia inducible factor 1alpha during
Philbert, M. (2004) Real time measurements of dissolved
hypoxia: a mechanism of O2 sensing, J. Biol. Chem., 275,
oxygen inside live cells by organically modified silicate
25130-25138, doi: 10.1074/jbc.M001914200.
fluorescent nanosensors, Anal. Chem., 76, 2498-2505,
25.
Waypa, G., Marks, J., Mack, M., Boriboun, C., Mungai, P.,
doi: 10.1021/ac035493f.
and Schumacker, P. (2000) Mitochondrial reactive oxygen
13.
Mik, E., Stap, J., Sinaasappel, M., Beek, J., Aten, J., van
species trigger calcium increases during hypoxia in pul
Leeuwen, T., and Ince, C. (2006) Mitochondrial PO2 mea
monary arterial myocytes, Circ. Res., 91, 719-726.
БИОХИМИЯ том 85 вып. 1 2020
ВНУТРИКЛЕТОЧНАЯ КИСЛОРОДНАЯ ЧУВСТВИТЕЛЬНОСТЬ
61
26.
Guzy, R., Hoyos, B., Robin, E., Chen, H., Liu, L.,
42.
Murphy, M., Holmgren, A., Larsson, N., Halliwell, B.,
Mansfield, K., Simon, M., Hammerling, U., and
Chang, C., Kalyanaraman, B., Rhee, S., Thornalley, P.,
Schumacker, P. (2005) Mitochondrial complex III is
Partridge, L., Gems, D., Nyström, T., Belousov, V.,
required for hypoxia induced ROS production and cellular
Schumacker, P., and Winterbourn, C. (2011) Unraveling
oxygen sensing, Cell Metab., 1, 401-408, doi: 10.1016/
the biological roles of reactive oxygen species, Cell Metab.,
j.cmet.2005.05.001.
13, 361-366, doi: 10.1016/j.cmet.2011.03.010.
27.
Mansfield, K., Guzy, R., Pan, Y., Young, R., Cash, T.,
43.
Semenza, G. (2012) Hypoxia inducible factors in physiol
Schumacker, P., and Simon, M. (2005) Mitochondrial dys
ogy and medicine, Cell, 148, 399-408, doi: 10.1016/j.cell.
function resulting from loss of cytochrome c impairs cellu
2012.01.021.
lar oxygen sensing and hypoxic HIF alpha activation, Cell
44.
Rhee, S., Woo, H., Kil, I., and Bae, S. (2012) Peroxi
Metab., 1, 393-399, doi: 10.1016/j.cmet.2005.05.003.
redoxin functions as a peroxidase and a regulator and sen
28.
Lebuffe, G., Schumacker, P., Shao, Z., Anderson, T.,
sor of local peroxides, J. Biol. Chem., 287, 4403-4410,
Iwase, H., and Vanden Hoek, T.L. (2003) ROS and NO
doi: 10.1074/jbc.R111.283432.
trigger early preconditioning: relationship to mitochondri
45.
Chowdhury, R., Flashman, E., Mecinović, J., Kramer, H.,
al KATP channel, Am. J. Physiol. Heart Circ. Physiol., 284,
Kessler, B., Frapart, Y., Boucher, J., Clifton, I.,
H299-H308, doi: 10.1152/ajpheart.00706.2002.
McDonough, M., and Schofield, C. (2011) Studies on the
29.
Guzy, R., Mack, M., and Schumacker, P.
(2007)
reaction of nitric oxide with the hypoxia inducible factor
Mitochondrial complex III is required for hypoxia
prolyl hydroxylase domain 2 (EGLN1), J. Mol. Biol., 410,
induced ROS production and gene transcription in yeast,
268-279, doi: 10.1016/j.jmb.2011.04.075.
Antioxid. Redox Signal., 9, 1317-1328, doi: 10.1089/
46.
Льюин Б. (2016) В кн. Клетки по Льюину (под ред. Кас
ars.2007.1708.
симерис Л., Лингаппа В., Плоппер Д.), Лаборатория
30.
Boveris, A., and Cadenas, E. (2000) Mitochondrial pro
знаний, Москва, с. 26-27.
duction of hydrogen peroxide regulation by nitric oxide
47.
Hoshi, T., and Lahiri, S. (2004) Cell biology. Oxygen sens
and the role of ubisemiquinone, IUBMB Life, 50,
ing: it’s a gas! Cell Biol., 306, 2050-2051, doi: 10.1126/
245-250, doi: 10.1080/713803732.
science.1107069.
31.
Sabharwal, S., and Schumacker, P. (2014) Mitochondrial
48.
Haddad, G., and Jiang, C. (1997) O2 sensing mechanisms
ROS in cancer: initiators, amplifiers or an Achilles’ heel?
in excitable cells: role of plasma membrane K+ channels,
Nat. Rev. Cancer, 14, 709-721, doi: 10.1038/nrc3803.
Annual Rev. Physiol., 59, 23-42, doi: 10.1146/annurev.
32.
Waypa, G., Marks, J., Guzy, R., Mungai, P., Schriewer, J.,
physiol.59.1.23.
Dokic, D., and Schumacher P. (2010) Hypoxia triggers
49.
Kemp, P., and Peers. C (2007) Oxygen sensing by ion
subcellular compartmental redox signaling in vascular
channels, Essays Biochem., 43, 77-90, doi: 10.1042/
smooth muscle cells, Circ. Res.,
106,
526-535,
BSE0430077.
doi: 10.1161/CIRCRESAHA.109.206334.
50.
Platoshyn, O., Brevnova, E., Burg, E., Yu, Y., Remillard, C.,
33.
Brand, M. (2016) Mitochondrial generation of superoxide
and Yuan, J. (2006) Acute hypoxia selectively inhibits
and hydrogen peroxide as the source of mitochondrial
KCNA5 channels in pulmonary artery smooth muscle
redox signaling, Free Radic. Biol. Med., 100, 14-31,
cells, Am. J. Physiol. Cell Physiol., 290, C907-C916,
doi: 10.1016/j.freeradbiomed.2016.04.001.
doi: 10.1152/ajpcell.00028.2005.
34.
Remington, S. (2006) Fluorescent proteins: maturation,
51.
Prabhakar, N.R., and Peers, C. (2014) Gasotransmitter
photochemistry and photophysics, Curr. Opin. Struct. Biol.,
regulation of ion channels: a key step in O2 sensing by the
16, 714-721, doi: 10.1016/j.sbi.2006.10.001.
carotid body, Physiology (Bethesda),
29,
49-57,
35.
Liu, H., Colavitti, R., Rovira, I., and Finkel, T. (2005)
doi: 10.1152/physiol.00034.2013.
Redox dependent transcriptional regulation, Circ. Res.,
52.
Peers, C., Wyatt, C., and Evans, A. (2010) Mechanisms for
97, 967-974, doi: 10.1161/01.RES.0000188210.72062.10.
acute oxygen sensing in the carotid body, Respir. Physiol.
36.
Pan, Y., Mansfield, K., Bertozzi, C., Rudenko, V., Chan, D.,
Neurobiol., 174, 292-298, doi: 10.1016/j.resp.2010.08.010.
Giaccia, A., and Simon, M. (2007) Multiple factors affect
53.
Kemp, P. (2006) Detecting acute changes in oxygen: will
ing cellular redox status and energy metabolism modulate
the real sensor please stand up? Exp. Physiol., 91, 829-834,
hypoxia inducible factor prolyl hydroxylase activity in vivo
doi: 10.1113/expphysiol.2006.034587.
and in vitro, Mol. Cell. Biol., 27, 912-925, doi: 10.1128/
54.
Ward, J. (2008) Oxygen sensors in context, Biochim.
MCB.01223 06.
Biophys. Acta, 1777, 1-14, doi: 10.1016/j.bbabio.2007.
37.
Finkel, T. (2012) Signal transduction by mitochondrial
10.010.
oxidants, J. Biol. Chem., 287, 4434-4440, doi: 10.1074/
55.
Williams, S., Wootton, P., Mason, H., Bould, J., Iles, D.,
jbc.R111.271999.
Riccardi, D., Peers, C., and Kemp, P. (2004) Hemoxy
38.
Bell, E., and Chandel, N. (2007) Genetics of mitochon
genase 2 is an oxygen sensor for a calcium sensitive potas
drial electron transport chain in regulating oxygen sensing,
sium channel, Science, 306, 2093-2097, doi: 10.1126/
Methods Enzymol., 435, 447-461, doi: 10.1016/S0076
science.1105010.
6879(07)35023 4.
56.
Hou, S., Heinemann, S., and Hoshi, T. (2009) Modulation
39.
Orr, A., Vargas, L., Turk, C., Baaten, J., Matzen, J.,
of BKCa channel gating by endogenous signaling mole
Dardov, V., Attle, S., Li, J., Quackenbush, D., Goncalves, R.,
cules, Physiology (Bethesda), 24, 26-35, doi: 10.1152/
Perevoshchikova, I., Petrassi, H., Meeusen, S., Ainscow,
physiol.00032.2008.
E., and Brand, M. (2015) Suppressors of superoxide pro
57.
Peng, Y., Nanduri, J., Raghuraman, G., Souvannakitti, D.,
duction from mitochondrial complex III, Nat. Chem. Biol.,
Gadalla, M., Kumar, G., Snyder, S., and Prabhakar, N.
11, 834-836, doi: 10.1038/nchembio.1910.
(2010) H2S mediates O2 sensing in the carotid body, Proc.
40.
Sabharwal, S., Waypa, G., Marks, J., and Schumacker, P.
Natl. Acad. Sci. USA, 107, 10719-10724, doi: 10.1073/
(2013) Peroxiredoxin 5 targeted to the mitochondrial
pnas.1005866107.
intermembrane space attenuates hypoxia induced reactive
58.
Li, Q., Sun, B., Wang, X., Jin, Z., Zhou, Y., Dong, L.,
oxygen species signaling, Biochem. J., 456, 337-346,
Jiang, L., and Rong, W. (2010) A crucial role for hydrogen
doi: 10.1042/BJ20130740.
sulfide in oxygen sensing via modulating large conductance
41.
Murphy, M. (2009) How mitochondria produce reactive oxy
calcium activated potassium channels, Antioxid. Redox
gen species, Biochem. J., 417, 1-13, doi: 10.1042/BJ20081386.
Signal., 12, 1179-1189, doi: 10.1089/ars.2009.2926.
БИОХИМИЯ том 85 вып. 1 2020
62
ВЁТОШ
59.
Peers, C. (2015) Acute oxygen sensing inching ever closer
77.
Li, Y., Zheng, H., Ding, Y., and Schultz, H.
(2010)
to an elusive mechanism, Cell Metab., 22, 753-754,
Expression of neuronal nitric oxide synthase in rabbit
doi: 10.1016/j.cmet.2015.10.011.
carotid body glomus cells regulates large conductance
60.
Julius, D., and Nathans, J. (2012) Signaling by sensory
Ca2+ activated potassium currents, J. Neurophysiol., 103,
receptors, Cold Spring Harb. Perspect. Biol., 4, a005991,
3027-3033, doi: 10.1152/jn.01138.2009.
doi: 10.1101/cshperspect.a005991.
78.
Campanucci, V., Zhang, M., Vollmer, C., and Nurse, C.
61.
Maines, M. (1997) The heme oxygenase system: a regula
(2006) Expression of multiple P2X receptors by glossopha
tor of second messenger gases, Annu. Rev. Pharmacol.
ryngeal neurons projecting to rat carotid body O2
Toxicol., 37, 517-554.
chemoreceptors: role in nitric oxide mediated efferent
62.
Prabhakar, N., Dinerman, J., Agani, F., and Snyder, S.
inhibition, J. Neurosci., 26, 9482-9493, doi: 10.1523/
(1995) Carbon monoxide: a role in carotid body chemore
JNEUROSCI.1672 06.2006.
ception, Proc. Natl. Acad. Sci. USA, 92, 1994-1997.
79.
Колесникова Е.Э. (2004) Молекулярные механизмы
63.
Prabhakar, N. (2012) Carbon monoxide (CO) and hydro
рецепции уровня кислорода, Нейрофизиология, 36,
gen sulfide (H2S) in hypoxic sensing by the carotid body,
330-347.
Respir. Physiol. Neurobiol., 184, 165-169, doi: 10.1016/
80.
Samanta, D., Prabhakar, N., and Semenza, G. (2017)
j.resp.2012.05.022.
Systems biology of oxygen homeostasis, Wiley Interdiscip.
64.
Barbé, C., Al Hashem, F., Conway, A., Dubuis, E.,
Rev. Syst. Biol. Med., 9, e1382, doi: 10.1002/wsbm.1382.
Vandier, C., and Kumar, P. (2002) A possible dual site of
81.
Semenza, G.
(2010) Oxygen homeostasis, Wiley
action for carbon monoxide mediated chemoexcitation in
Interdiscip. Rev. Syst. Biol. Med.,
2,
336-361,
the rat carotid body, J. Physiol.,
543,
933-945,
doi: 10.1002/wsbm.69.
doi: 10.1113/jphysiol.2001.015750.
82.
Szewczak, L. (2016) Timeline: cellular oxygen sensing,
65.
Lloyd, B., Cunningham, D., and Goode, R. (2013) in
Cell, 167, 286, doi: 10.1016/j.cell.2016.08.065.
Arterial Chemoreceptors (Torrance, R., ed.), Blackwell,
83.
Lin, F., Suggs, S., Lin, C., Browne, J., Smalling, R., Egrie, J.,
Oxford, pp. 145-150.
Chen, K., Fox, G., Martin, F., and Stabinsky, Z. (1985)
66.
Gadalla, M., and Snyder, S. (2010) Hydrogen sulfide as a
Cloning and expression of the human erythropoietin gene,
gasotransmitter, J. Neurochem., 113, 14-26, doi: 10.1111/
Proc. Natl. Acad. Sci. USA, 82, 7580-7584.
j.1471 4159.2010.06580.x.
84.
Bishop, T., and Ratcliffe, P. (2014) Signaling hypoxia by
67.
Wang, R. (2012) Physiological implications of hydrogen
hypoxia inducible factor protein hydroxylases: a historical
sulfide: a whiff exploration that blossomed, Physiol. Rev.,
overview and future perspectives, Hypoxia (Auckl), 2,
92, 791-896, doi: 10.1152/physrev.00017.2011.
197-213, doi: 10.2147/HP.S47598.
68.
Mkrtchian, S., Kåhlin, J., Ebberyd, A., Gonzalez, C.,
85.
Gleadle, J. (2009) Review article: How cells sense oxygen:
Sanchez, D., Balbir, A., Kostuk, E., Shirahata, M.,
lessons from and for the kidney, Nephrology (Carlton), 1,
Fagerlund, M., and Eriksson, L. (2012) The human carotid
86-93, doi: 10.1111/j.1440 1797.2008.01064.x.
body transcriptome with focus on oxygen sensing and
86.
Анохина Е.Б., Буравкова Л.Б. (2010) Механизмы регу
inflammation - a comparative analysis, J. Physiol., 590,
ляции транскрипционного фактора при гипоксии,
3807-3819, doi: 10.1113/jphysiol.2012.231084.
Биохимия, 75, 185-195.
69.
Makarenko, V., Nanduri, J., Raghuraman, G., Fox, A.,
87.
Masson, N., Willam, C., Maxwell, P., and Pugh, C. (2001)
Gadalla, M., Kumar, G., Snyder, S., and Prabhakarn, N.
Ratcliffe, P. Independent function of two destruction
(2012) Endogenous H2S is required for hypoxic sensing by
domains in hypoxia inducible factor alpha chains activat
carotid body glomus cells, Am. J. Physiol. Cell Physiol., 303,
ed by prolyl hydroxylation, EMBO J., 20, 5197-5206,
C916-C923, doi: 10.1152/ajpcell.00100.2012.
doi: 10.1093/emboj/20.18.5197.
70.
Buckler, K. (2012) Effects of exogenous hydrogen sulphide
88.
Maxwell, P., Wiesener, M., Chang, G., Clifford, S., Vaux, E.,
on calcium signalling, background (TASK) K channel
Cockman, M., Wykoff, C., Pugh, C., Maher, E., and
activity and mitochondrial function in chemoreceptor
Ratcliffe, P. (1999) The tumour suppressor protein VHL
cells, Pflug. Arch., 463, 743-754, doi: 10.1007/s00424
targets hypoxia inducible factors for oxygen dependent
012 1089 8.
proteolysis, Nature, 399, 271-275, doi: 10.1038/20459.
71.
Haouzi, P., Bell, H., and Van de Louw, A. (2011) Hypoxia
89.
Semenza, G. (2016) Dynamic regulation of stem cell specifica
induced arterial chemoreceptor stimulation and hydrogen
tion and maintenance by hypoxia inducible factors, Mol.
sulfide: too much or too little? Respir. Physiol. Neurobiol.,
Aspects Med., 47-48, 15-23, doi: 10.1016/j.mam.2015.09.004.
179, 97-102, doi: 10.1016/j.resp.2011.09.009.
90.
Prabhakar, N., and Semenza, G. (2016) Regulation of
72.
Olson, K., and Whitfield, N. (2010) Hydrogen sulfide and
carotid body oxygen sensing by hypoxia inducible factors,
oxygen sensing in the cardiovascular system, Antioxid.
Pflug. Arch., 468, 71-75, doi: 10.1007/s00424 015 1719 z.
Redox Signal., 12, 1219-1234, doi: 10.1089/ars.2009.2921.
91.
Hirsilä, M., Koivunen, P., Günzler, V., Kivirikko, K., and
73.
Campanucci, V., and Nurse, C. (2007) Autonomic inner
Myllyharju, J. (2003) Characterization of the human prolyl
vation of the carotid body: role in efferent inhibition,
4 hydroxylases that modify the hypoxia inducible factor, J.
Respir. Physiol. Neurobiol., 157, 83-92, doi: 10.1016/
Biol. Chem.,
278,
30772-30780, doi:
10.1074/jbc.
j.resp.2007.01.020.
M304982200.
74.
Prabhakar, N., Kumar, G., Chang, C., Agani, F., and
92.
Maltepe, E., Schmidt, J., Baunoch, D., Bradfield, C., and
Haxhiu, M. (1993) Nitric oxide in the sensory function of
Simon, M. (1997) Abnormal Angiogenesis and responses
the carotid body, Brain Res., 625, 16-22.
to glucose and oxygen deprivation in mice lacking the pro
75.
Silva, J., and Lewis, D. (2002) Nitric oxide enhances
tein ARNT, Nature, 386, 403-407, doi: 10.1038/386403a0.
Ca(2+) dependent K(+) channel activity in rat carotid
93.
Townley Tilson, W., Pi, X., and Xie, L. (2015) The role of
body cells, Pflugers Arch., 443, 671-675, doi: 10.1007/
oxygen sensors, hydroxylases, and HIF in cardiac function
s00424 001 0745 1.
and disease, Oxid. Med. Cell. Longev., 2015, 676893,
76.
Summers, B., Overholt, J., and Prabhakar, N. (1999)
doi: 10.1155/2015/676893.
Nitric oxide inhibits L type Ca2+ current in glomus cells of
94.
Epstein, A., Gleadle, J., McNeill, L., Hewitson, K.,
the rabbit carotid body via a cGMP independent mecha
O’Rourke, J., Mole, D., Mukherji, M., Metzen, E.,
nism, J. Neurophysiol., 81, 1449-1457, doi: 10.1152/
Wilson, M., Dhanda, A., Tian, Y., Masson, N., Hamilton, D.,
jn.1999.81.4.1449.
Jaakkola, P., Barstead, R., Hodgkin, J., Maxwell, P., Pugh, C.,
БИОХИМИЯ том 85 вып. 1 2020
ВНУТРИКЛЕТОЧНАЯ КИСЛОРОДНАЯ ЧУВСТВИТЕЛЬНОСТЬ
63
Schofield, C., and Ratcliffe, P. (2001) C. elegans EGL 9
Ca2+ activated K+ channels in human melanoma cells are
and mammalian homologs define a family of dioxygenases
up regulated by hypoxia involving hypoxia inducible fac
that regulate HIF by prolyl hydroxylation, Cell, 107, 43-54.
tor 1alpha and the von Hippel Lindau protein, J. Physiol.,
95. Coleman, M.L., and Ratcliffe, P.J. (2007) in Essays in
571, 349-359, doi: 10.1113/jphysiol.2005.096818.
Biochemistry. Oxygen Sensing and Hypoxia(Induced Responses,
105. Dong, Q., Zhao, N., Xia, C., Du, L., Fu, X., and Du, Y.
(Peers. C., ed.), Portland Press, London, pp. 1-15.
(2012) Hypoxia induces voltage gated K+ (Kv) channel
96. Тренделева Т.А., Аливердиева Д.А., Звягильская Р.А.
expression in pulmonary arterial smooth muscle cells
(2014) Механизмы определения низкого уровня кис
through hypoxia inducible factor 1 (HIF 1), Bosn. J. Basic
лорода у млекопитающих и дрожжей и их адаптацион
Med. Sci., 12, 158-163, doi: 10.17305/bjbms.2012.2463.
ные ответы, Биохимия, 79, 944-956.
106. Shin, D., Lin, H., Zheng, H., Kim, K., Kim, J., Chun, Y.,
97. Погодина М.В., Буравкова Л.Б. (2015) Особенности
Park, J., Nam, J., Kim, W., Zhang, Y., and Kim, S. (2014)
экспрессии HIF 1α в мультипотентных мезенхимных
HIF 1α mediated upregulation of TASK 2 K+ channels aug
стромальных клетках при гипоксии, Бюлл. эксп. биол.
ments Ca2+ signaling in mouse B cells under hypoxia, J.
мед., 159, 333-335.
Immunol., 193, 4924-4933, doi: 10.4049/jimmunol.1301829.
98. Ivan, M., and Kaelin, W.G. Jr., (2017) The EGLN HIF
107. Bautista, L., Castro, M., López Barneo, J., and
O2 sensing system: multiple inputs and feedbacks, Mol.
Castellano, A. (2009) Hypoxia inducible factor 2alpha stabi
Cell, 66, 772-779, doi: 10.1016/j.molcel.2017.06.002.
lization and maxi K+ channel beta1 subunit gene repression
99. Kim, J., Tchernyshyov, I., Semenza, G., and Dang, C.
by hypoxia in cardiac myocytes: role in preconditioning, Circ.
(2006) HIF 1 mediated expression of pyruvate dehydroge
Res.,
104,
1364-1372, doi:
10.1161/CIRCRESAHA.
nase kinase: a metabolic switch required for cellular adap
108.190645.
tation to hypoxia, Cell Metab., 3, 177-1785, doi: 10.1016/
108. Takahashi, N., Kuwaki, T., Kiyonaka, S., Numata, T., Kozai, D.,
j.cmet.2006.02.002.
Mizuno, Y., Yamomoto, S., Naito, S., Knevels, E., Carmeliet, P.,
100. Goda N., and Kanai M. (2012) Hypoxia inducible factors
Oqa, T., Kaneko, S., Suqa, S., Nokami, T., Yoshida, J., and
and their roles in energy metabolism, Int. J. Hematol., 95,
Mori, Y. (2011) TRPA1 underlies a sensing mechanism for O2,
457-463, doi: 10.1007/s12185 012 1069 y.
Nat. Chem. Biol., 7, 701-711, doi: 10.1038/nchembio.640.
101. Lu, H., Samanta, D., Xiang, L., Zhang, H., Hu, H., Chen, I.,
109. Nagarajan, Y., Rychkov, G., and Peet, D.
(2017)
Bullen, J., and Semenza, G. (2015) Chemotherapy triggers
Modulation of TRP channel activity by hydroxylation and
HIF 1 dependent glutathione synthesis and copper chela
its therapeutic potential, Pharmaceuticals (Basel), 10, 1-8,
tion that induces the breast cancer stem cell phenotype,
doi: 10.3390/ph10020035.
Proc. Natl. Acad. Sci. USA,
112, E4600-E4609,
110. Semenza, G., and Prabhakar, N. (2018) The role of hypox
doi: 10.1073/pnas.1513433112.
ia inducible factors in carotid body (patho) physiology, J.
102. Gao, L., González Rodr guez, P., Ortega Sáenz, P., and
Physiol., 596, 2977-2983, doi: 10.1113/JP275696.
López Barneo, J. (2017) Redox signaling in acute oxygen
111.
Macdonald, A., and Vjotosh, A. (1999) Patch clamp
sensing, Redox Biol.,
12,
908-915, doi:
10.1016/
recording of BKCa channels in hyperbaric oxygen, J.
j.redox.2017.04.033.
Physiol., 518, 111P-112P.
103. Fernández Agüera, M., Gao, L., González Rodr guez, P.,
112. Pokorski, M., Takeda, K., and Okada, Y. (2016) Oxygen
Pintado, C., Arias Mayenco, I., Garc a Flores, P., Garc a
sensing mechanisms: a physiological penumbra, Adv. Exp.
Pergañeda, A., Pascual, A., Ortega Sáenz, P., and López
Med. Biol., 952, 1-8, doi: 10.1007/5584_2016_67.
Barneo, J. (2015) Oxygen sensing by arterial chemorecep
113. Mori, Y., Takahashi, N., Kurokawa, T., and Kiyonaka, S.
tors depends on mitochondrial complex I signaling, Cell
(2017) TRP channels in oxygen physiology: distinctive
Metab., 22, 825-837, doi: 10.1016/j.cmet.2015.09.004.
functional properties and roles of TRPA1 in O2 sensing,
104. Tajima, N., Schönherr, K., Niedling, S., Kaatz, M.,
Proc. Jpn. Acad. Ser. B Phys. Biol. Sci., 93, 464-482,
Kanno, H., Schönherr, R., and Heinemann, S. (2006)
doi: 10.2183/pjab.93.028.
INTRACELLULAR MECHANISMS OF OXYGEN SENSING
Review
A. N. Vjotosh1,2,3
1 Sechenov Institute of Evolutionary Physiology and Biochemistry,
194223 St. Petersburg, Russia; E(mail: vjotnn@yahoo.com
2 Lesgaft National State University of Physical Education, Sport and Health, 190121 St. Petersburg, Russia
3 Mechnikov North(Western State Medical University, 195067 St. Petersburg, Russia
Received May 9, 2019
Revised September 29, 2019
Accepted October 20, 2019
Based on the analysis of literature data, molecular mechanisms for oxygen sensing in various compartments of animal
cells are postulated. Several ways for intracellular sensory oxygen transduction are suggested. Functioning of the near
membrane and cytoplasmic pools of molecular constructs of cells under hypoxia is considered. Role of mitochondria
in cell sensitivity toward a decrease in oxygen content is discussed. Interrelationship of the operational and chronic
intracellular mechanisms of perception of negative gradients of molecular oxygen concentration, as well as their rela
tionship with cell response to oxidative stress, is revealed.
Keywords: mitochondria, potassium membrane channels, HIF
БИОХИМИЯ том 85 вып. 1 2020