БИОХИМИЯ, 2020, том 85, вып. 1, с. 64 - 79
УДК 577.218
ТРАНСКРИПЦИОННЫЙ ФАКТОР KLF2 И ЕГО РОЛЬ
В РЕГУЛЯЦИИ ВОСПАЛИТЕЛЬНЫХ ПРОЦЕССОВ
Обзор
© 2020
К.Т. Турпаев
Центр теоретических проблем физико химической фармакологии РАН,
119991 Москва, Россия; электронная почта: kyril.turpaev@yahoo.com
Поступила в редакцию 11.05.2019
После доработки 02.08.2019
Принята к публикации 07.10.2019
KLF2 входит в семейство Krüppel подобных факторов транскрипции из обширной группы ДНК связываю
щих белков с консервативными доменами, известными как цинковые пальцы. KLF2 участвует в дифферен
цировке и регуляции функциональной активности моноцитов и T лимфоцитов, адипоцитов и клеток сосу
дистого эндотелия. Активность KLF2 контролирует несколько регуляторных систем: MAP киназный кас
кад MEKK2,3/MEK5/ERK5/MEF2, G белки семейства Rho, гистонацетилтрансферазы CBP и p300 и гис
тондеацетилазы HDAC 4 и HDAC 5. Активация KLF2 в эндотелиальных клетках вызывает индукцию eNOS
и имеет вазодилатационный эффект. Действие многих зависимых от KLF2 генов направлено на подавление
коагуляции крови, агрегации T клеток и макрофагов с сосудистым эндотелием, что препятствует развитию
атеросклероза. Активация KLF2 оказывает двоякое воздействие на спектр экспрессируемых генов. KLF2
индуцирует значительное число генов и подавляет транскрипцию генов зависимых от NF κB. Транскрип
ционные факторы KLF2 и NF κB проявляют себя как взаимные антагонисты. KLF2 снижает активность
NF κB, тогда как NF κB подавляет транскрипцию гена KLF2. Зависимое от KLF2 подавление экспрессии
контролируемых NF κB генов ослабляет ответ клеток на про воспалительные цитокины IL 1β и TNFα и
развитие воспалительных процессов.
КЛЮЧЕВЫЕ СЛОВА: KLF2, цинковые пальцы, регуляция транскрипции, про воспалительные цитокины,
эндотелий.
DOI: 10.31857/S0320972520010054
ОБЩАЯ ХАРАКТЕРИСТИКА ФАКТОРОВ
на Krüppel, который контролирует сегментацию
СЕМЕЙСТВА KLF
эмбриона, и мутации по этому гену вызывают
значительные морфологические нарушения и
Транскрипционные факторы KLF (Krüppel
летальны (нем. Krüppel, калека) [1]. Факторы
like factors) названы так по структурной близос
семейства KLF имеются у всех многоклеточных
ти ДНК связывающих доменов с аналогичным
животных и контролируют широкий спектр
доменом обнаруженного ранее у дрозофилы ге
внутриклеточных процессов. Первый из этих
факторов, обозначенный как EKLF (впослед
ствии KLF1), был обнаружен в эритроидных
Принятые сокращения: AMPK - AMP зависимая
протеинкиназа; CaMK - кальций кальмодулин зависимая клетках в 1993 г. К настоящему времени установ
протеинкиназа; eNOS - эндотелиальная синтаза оксида лено 17 членов семейства KLF. Для факторов
азота; ERK5 - активируемая внеклеточными сигналами
KLF характерно наличие консервативных
протеинкиназа 5 (extracellular signal regulated kinase 5);
HDAC - гистондеацетилаза; HO 1 - гемоксигеназа 1;
C концевых доменов (~80 аминокислот), изве
ICAM 1 - молекула межклеточной адгезии 1 типа (inter cel
стных как цинковые пальцы. Подобные струк
lular adhesion molecule 1); KLF - Krüppel подобный тран
туры содержат транскрипционные факторы
скрипционный фактор (Krüppel like factor); MAP - активи
родственных KLF семейств Sp (1-9) (Specificity
руемый митогенами белок (mitogen activated protein);
Proteins) и EGR (1-4) (Early Growth Response),
MEF2 - миоцитарный энхансерный фактор 2 (myocyte
enhancer factor 2); MEK5 - киназа MAP киназ 5 (MAP kinase
WT1 (Wilms Tumor Protein 1), YY1 (yin yang 1),
kinase 5); MEKK - киназа киназ MAP киназ (MAP kinase
CTCF и ряд других белков [2, 3]. Факторы KLF
kinase kinase); PECAM 1 - молекула адгезии тромбоцитов и и Sp распознают близкие или одинаковые по
эндотелиальных клеток 1 (platelet/endothelial cell adhesion
структуре GC богатые нуклеотидные последо
molecule 1); VCAM 1 - молекула адгезии клеток эндотелия
сосудов 1 (vascular cell adhesion molecule 1); VEGF - фактор
вательности и, по видимому, могут конкуриро
роста эндотелия сосудов; VEGFR - рецептор VEGF.
вать за связывание с промоторами зависимых
64
ФАКТОР ТРАНСКРИПЦИИ KLF2
65
генов [3, 4]. Все белки, входящие в семейства
эритроидных клетках KLF2, KLF5 и KLF15 ин
KLF и Sp, содержат по три цинковых пальца,
дуцируют, тогда как KLF8 подавляет экспрес
каждый из которых состоит из 21-23 аминокис
сию γ глобина [10]. По своим функциональным
лот. Цинковые пальцы факторов KLF и Sp име
характеристикам, которые коррелируют со
ют следующую структуру: CysX4CysX12HisX3His
структурными различиями, факторы KLF мож
(X - любая аминокислота). Сходство аминокис
но разделить на три основные группы. В 1 ю
лотных последовательностей ДНК связываю
группу входят факторы KLF3, KLF8 и KLF12; их
щего домена Sp1 подобных факторов и факто
действие направлено исключительно на подав
ров семейства KLF составляет >65% [3, 5]. Ами
ление транскрипции. Во 2 ю группу - KLF1,
нокислотные остатки цинковых пальцев образу
KLF2 и KLF4-KLF7; они активируют тран
ют α спиральную структуру, которая стабилизи
скрипцию зависимых генов. В 3 ю группу входят
рована координационными связями ионов Zn2+.
KLF9-KLF11, KLF13, KLF14 и KLF16; они
Между пальцами расположены вставки из 7
способны как активировать, так и подавлять
аминокислот с высоко консервативной структу
транскрипцию зависимых генов (рис. 2) [3]. Ха
рой TGEKP(Y/F)X. При связывании с ДНК три
рактер действия KLF15 и KLF17 остается невы
аминокислоты (-1, +3 и +6 по нумерации
ясненным. Транскрипционный эффект KLF 3 й
α спирали) каждого из цинковых пальцев всту
группы зависит от структуры промоторных об
пают в контакт с тремя последовательно распо
ластей контролируемых ими генов и от типа
ложенными нуклеотидными парами. Амино
клеток. Так, например, KLF13 подавляет
кислоты +2 и +6 соседних α спиральных струк
CYP1A1 (цитохром P450) в клетках CHO, но ак
тур взаимодействуют с нуклеотидами одной па
тивирует транскрипцию гена CCL5 (цитокин
ры, и тем самым 12 аминокислот ДНК связываю
RANTES) в T клетках [11, 12]. Экспрессия фак
щего домена образуют контакты с 10 нуклеотид
торов KLF происходит во всех (KLF6-KLF11 и
ными парами (рис. 1) [5]. Эти аминокислоты
KLF13-KLF16) или во многих тканях [3, 7]. Ге
определяют избирательность взаимодействия
нетическая инактивация факторов KLF1-
разных представителей семейства KLF со свои
KLF7 летальна уже на ранних стадиях эмбриоге
ми участками связывания на ДНК. Контролиру
неза или в раннем постнатальном периоде [3].
емые факторами KLF регуляторные последова
Зависимая от ряда KLF 2 й и 3 й групп
тельности сформированы фрагментами ДНК в
(KLF1, KLF2, KLF4, KLF5, KLF6, KLF11,
двух основных вариантах: CACCC или CCCAC
KLF13) активация транскрипции сопряжена с
(GT box) и CGCCC или CCCGC (GC box). По
образованием комплексов этих факторов с гис
видимому, факторы семейства KLF конкуриру
тонацетилтрансферазами CBP, p300 и PCAF. Для
ют между собой за связывание с одинаковыми
активации KLF необходимо их ацетилирование.
регуляторными последовательностями, однако
У KLF1 за связывание с кофакторами CBP, p300
этот вопрос недостаточно исследован [3, 4, 6-8].
и PCAF отвечают домены, обозначаемые как
Наряду с ДНК связывающим доменом факторы
EKLFTAD (1 и 2), которые содержат консерва
KLF содержат консервативную аминокислот
тивную последовательность ΦDXΦΦ (Φ - гид
ную последовательность, обеспечивающую
рофобные аминокислоты). Эти домены также
ядерную локализацию этих белков. У разных
участвуют в связывании KLF1 с общим факто
факторов KLF такие структуры расположены
ром транскрипции TFIIH, который входит в
либо между цинковыми пальцами, либо примы
состав большого РНК полимеразного комплек
кают к N концевому цинковому пальцу (как,
са [13, 14].
например, у KLF2 и KLF4) [6].
Подавление транскрипции под действием
Факторы KLF сильно различаются по N
KLF обусловлено связыванием деацетилаз.
концевым аминокислотным последовательнос
Факторы KLF3, KLF8 и KLF12, будучи связан
тям, которые отвечают за взаимодействие с дру
ными с ДНК, образуют многокомпонентные
гими белками и предопределяют функциональ
комплексы с транскрипционными корепрессо
ные различия между разными факторами KLF
рами CtBP1 или CtBP2 (C terminal Binding
[6, 8]. Некоторые факторы KLF участвуют в ре
Protein, что указывает на связывание CtBP с C
гуляции одних и тех же внутриклеточных про
концевым участком аденовирусного белка E1A).
цессов, при этом оказывая на них противопо
Связывание происходит через N концевые до
ложное воздействие. Например, в жировой тка
мены факторов KLF, содержащие консерватив
ни KLF2, KLF3 и KLF7 подавляют дифферен
ную аминокислотную последовательность
цировку преадипоцитов в зрелые адипоциты,
PXDLS. За исключением этого фрагмента меж
тогда как KLF4, KLF5, KLF6 и KLF15 стимули
ду N концевыми доменами перечисленных фак
руют этот процесс, что может быть связано с ак
торов нет заметных гомологий. Обусловленное
тивацией экспрессии фактора PPARγ [6, 9]. В
CtBP подавление транскрипции основано на
5 БИОХИМИЯ том 85 вып. 1 2020
66
ТУРПАЕВ
a
б
в
5′
3′
3′
5′
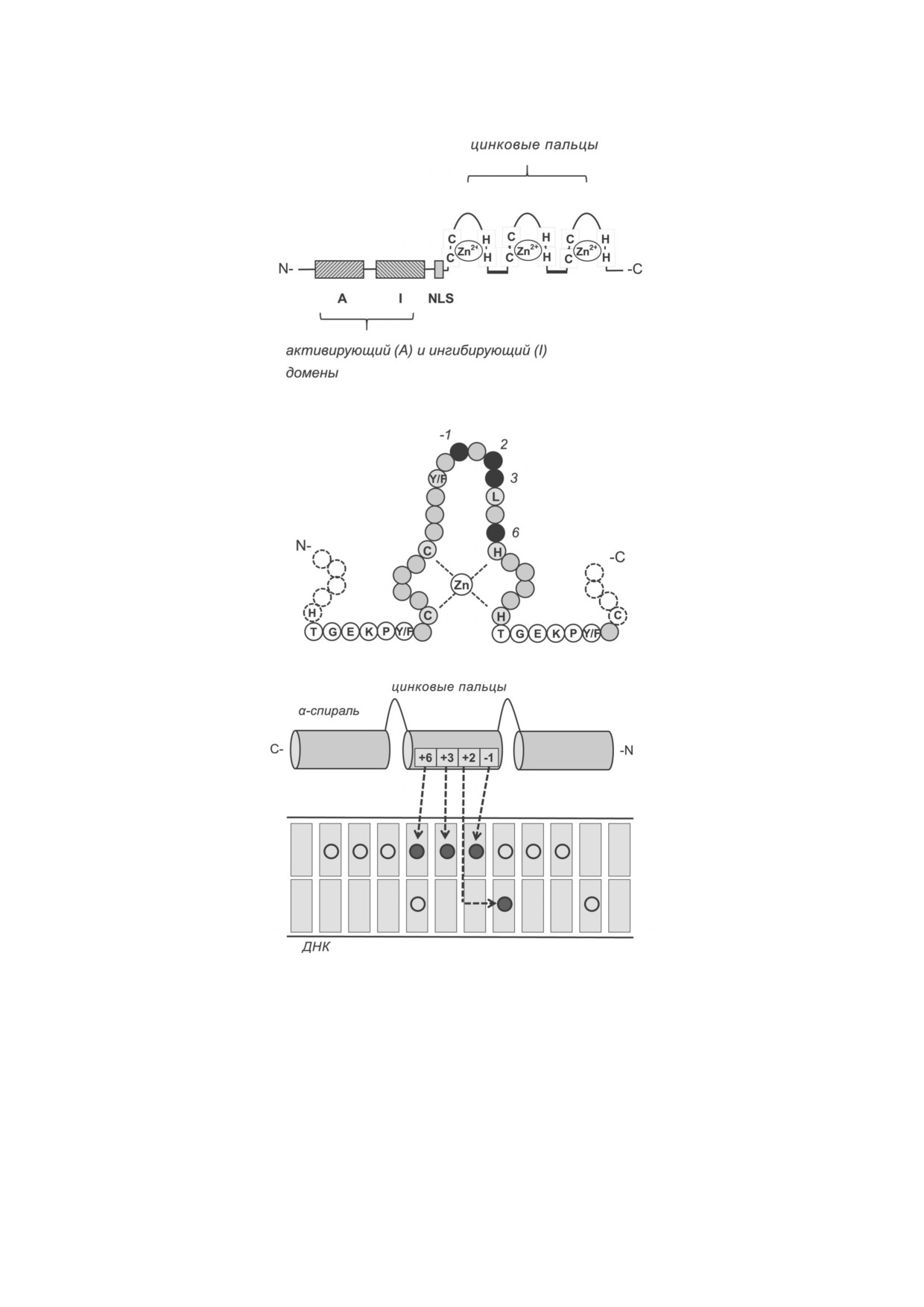
Рис. 1. Структура фактора KLF2 и схема его контактов с регуляторной последовательностью ДНК. а - Примерное распо
ложение функциональных доменов на полипептидной цепи KLF2. Показаны расположенные тандемом три C концевые
цинковые пальца, каждый из которых связывает один ион Zn2+. Аналогичную структуру имеют родственные KLF2 фак
торы KLF1 и KLF4. б - Примерная структура второго цинкового пальца. Аминокислотные остатки, которые образуют
контакты с нуклеотидами участка связывания ДНК, выделены черным цветом и перенумерованы по своему положению
в α спиральной структуре. Для KLF2 и всех транскрипционных факторов семейства KLF - это Arg (-1), Asp (+2), Glu
(+3) и Arg (+6). Обозначены консервативные для всех KLF аминокислоты. в - Взаимодействие α спиральных структур,
образуемых цинковыми пальцами, с ДНК. Приведена нумерация аминокислотных остатков, которые вступают в контакт
с ДНК. Аминокислота в позиции +2 вступает в контакт с нуклеотидом, комплементарным тому, с которым связывается
аминокислота +6 соседнего цинкового пальца. Отмечены нуклеотидны,образующие участок связывания KLF2 (10 нуклео
тидных пар). Заштрихованными кружками помечены нуклеотиды, вступающие в контакт с аминокислотами 2 го цинко
вого пальца. Сокращение: NLS - сигнал ядерной локализации
БИОХИМИЯ том 85 вып. 1 2020
ФАКТОР ТРАНСКРИПЦИИ KLF2
67
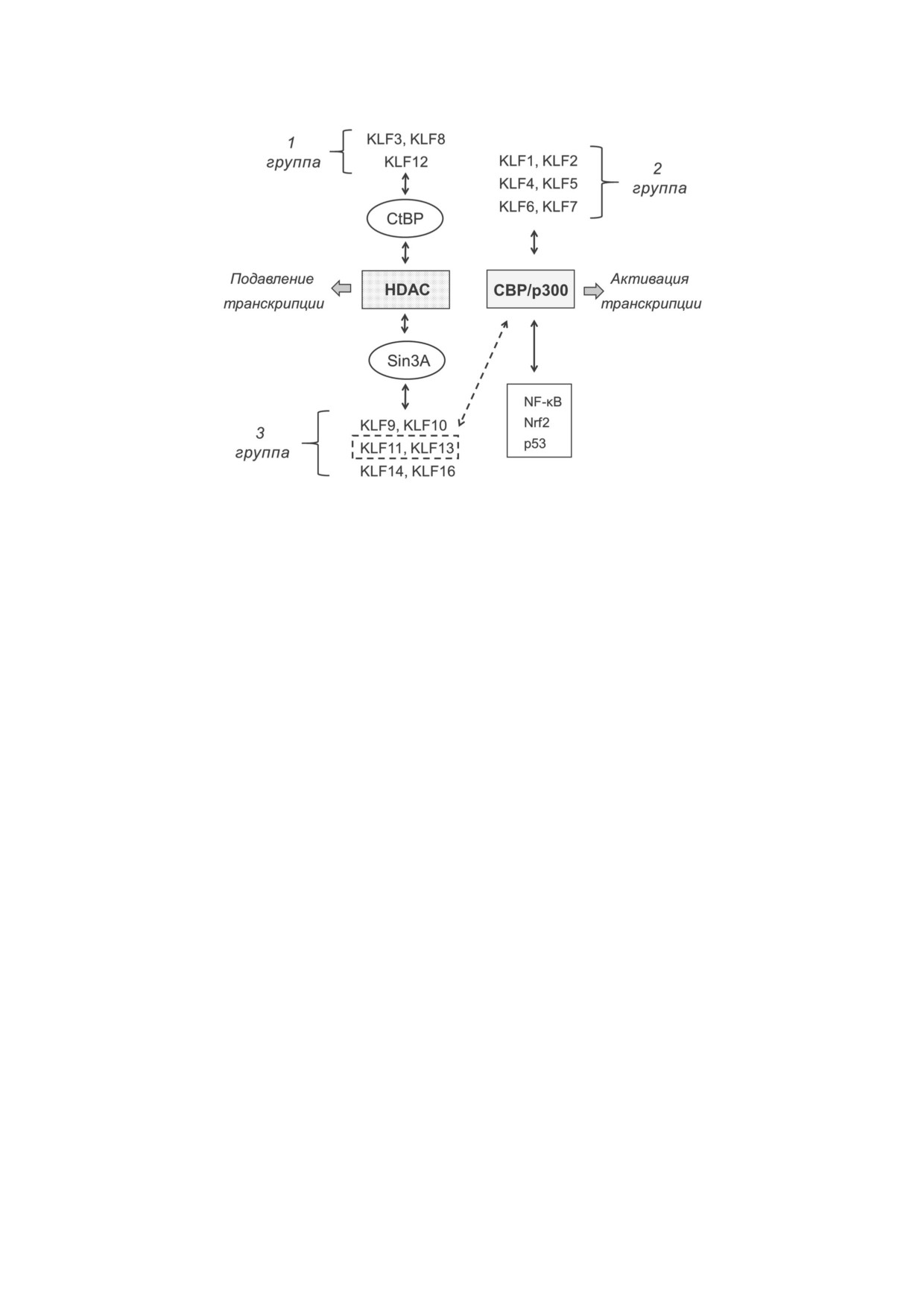
Рис. 2. Классификация факторов KLF. Входящие в семейство KLF транскрипционные факторы распределены по трем
группам: 1 я группа) - KLF, содержащие участок связывания с адаптерными белками CtBP, участвующий в дальнейшем
формировании комплекса с HDAC; 2 я группа) - KLF, взаимодействующие с гистонацетилтрансферазами CBP и p300;
3 я группа) - KLF, содержащие участок связывания с Sin3A, который также образует комплекс с HDAC. Два фактора KLF
3 й группы (KLF11 и KLF13) также могут взаимодействовать с CBP и p300
последующем формировании многокомпонент
также происходит в селезенке, сердце, тимусе,
ного комплекса с Zn2+ зависимыми гистондеа
жировой ткани, скелетных мышцах, сосудистом
цетилазами HDAC4 и HDAC5 (подгруппа IIa).
эндотелии, клетках миелоидного и лимфоидно
Под действием HDAC происходит изменение
го ряда. KLF2 участвует в клеточной дифферен
баланса между ацетилированными и неацетили
цировке и регуляторных процессах в иммунной
рованными гистонами и другими ДНК связы
и кровеносной системах легочной и жировой
вающими белками, что меняет структуру хрома
тканей [18, 19]. Фактор KLF2, наряду с KLF4 и
тина и влияет на транскрипцию генов [15]. Ин
KLF5, имеет значение для поддержания эмбрио
гибирование транскрипции факторами KLF 3 й
нальных клеток в состоянии плюрипотентности.
группы (KLF9, KLF10, KLF11, KLF13, KLF14 и
Гиперэкспрессия этих факторов способствует
KLF16) основано на связывании адаптерного
перепрограммированию дифференцированных
белка Sin3A и последующим присоединением
клеток в плюрипотентные. KLF4 входит в число
HDAC. Связывание адаптерного Sin3A с KLF
факторов Яманаки, которые критически необхо
происходит по консервативному участку SID [4,
димы для генерации индуцированных стволовых
8]. HDAC также деацетилируют негистоновые
клеток. OCT4, один из факторов Яманаки, конт
белки, в частности транскрипционные факторы
ролирует экспрессию KLF2 [6, 20, 21].
p65/NF κB и p53, что приводит к снижению их
Фактор KLF4 из всех представителей семей
активности [16].
ства KLF наиболее близок структурно и функ
ционально с KLF2. Экспрессия фактора KLF4
имеет близкую тканевую специфичность с KLF2
ОБЩАЯ ХАРАКТЕРИСТИКА ФАКТОРА
и характерна для эндотелия сосудов, лимфоид
KLF2. ГОМОЛОГИЯ KLF2 И KLF4
ных клеток, эпителиальных клеток кожи, ки
шечника, почек и легких [20, 22]. Основные ак
KLF2 был обнаружен в 1995 г. в геноме мыши
тиваторы гена KLF2 (гидродинамическое сопро
при поиске генов, имеющих цинк связывающие
тивление, статины, ресвератрол - см. ниже)
домены, гомологичные имеющемуся в обнару
также индуцируют ген KLF4. В клетках сосудис
женном ранее гене KLF1. Самый высокий уро
того эндотелия KLF2 и KLF4 стимулируют
вень экспрессии KLF2 был выявлен в легочной
экспрессию эндотелиальной синтазы окиси азо
ткани, и поэтому его первоначальное обозначе
та (eNOS), тромбомодулина (THBD) и гемокси
ние - LKLF (Lung KLF) [17]. Экспрессия KLF2
геназы 1 (HO 1) [18, 23]. KLF2 и KLF4 связыва
БИОХИМИЯ том 85 вып. 1 2020
5*
68
ТУРПАЕВ
ются с участками ДНК, содержащими последо
в клетках сосудистого эндотелия, где он проис
вательности типа CACCC [18]. Наряду с ДНК
ходит под действием гидродинамических фак
связывающим KLF2 содержит активирующий
торов. Основные функции эндотелия состоят в
транскрипцию N концевой домен (аминокис
формировании барьера между кровью и тканя
лотные остатки 1-110) (рис. 1). Также KLF2 со
ми, регуляции тонуса сосудов, мобилизации
держит ингибиторный домен (остатки 111-267),
клеток иммунной системы, контроле процессов
по которому происходит присоединение убик
свертывания крови и ангиогенеза. KLF2 участ
витинлигаз WWP1 и FBW7, что приводит к про
вует во всех этих процессах. Выстилая стенки
теолитической деградации KLF2 [24, 25].
кровеносных сосудов, клетки эндотелия не об
разуют на них идеально ровную поверхность.
При длине 20-150 мкм вблизи ядра их толщина
УСЛОВИЯ АКТИВАЦИИ
составляет 3-5 мкм и на периферии - <1 мкм.
И МОЛЕКУЛЯРНЫЙ МЕХАНИЗМ
Люминальная мембрана клеток эндотелия фор
РЕГУЛЯЦИИ ЭКСПРЕССИИ KLF2
мирует гликокаликс, характерную ультраструк
туру, состоящую из гликопротеинов и гликоли
Регуляция фактора KLF2 основана, прежде
пидов. Между током крови и эндотелием проис
всего, на изменении его экспрессии. Промотор
ходит механическое взаимодействие трех основ
ная область гена KLF2 обогащена нуклеотидны
ных видов: гидродинамическое сопротивление
ми парами GC и содержит несколько участков
стенок сосуда движению крови (также извест
связывания факторов транскрипции EGR1, Sp1
ное как напряжение сдвига, shear stress), гидро
и семейства KLF. В клетках эндотелия решающее
статическое давление крови и связанная с ним
значение для экспрессии гена KLF2 имеет учас
сила растяжения кровеносных сосудов
ток промоторной последовательности -141/-103
(рис. 4, а) [18, 30-32]. При ламинарном тече
от начала транскрипции [26]. Этот фрагмент
нии, когда все слои потока крови перемещают
ДНК связывает транскрипционный фактор
ся параллельно стенкам сосудов, сила гидроди
MEF2 (миоцитарный энхансерный фактор 2,
намического сопротивления пропорциональна
myocyte enhancer factor 2). Обобщенная структура
скорости кровотока и обратно пропорциональ
участка связывания MEF2: YTA(A/T)4TAR. Ак
на R4 (формула Пуазейля; R - радиус кровенос
тивность MEF2 контролирует митоген активи
ного сосуда). Сила гидродинамического сопро
руемая протеинкиназа ERK5 (синонимы -
тивления наиболее велика в небольших артерио
BMK1, Big MAP Kinase) [27]. ERK5 и контроли
лах (10-70 дин/см2) и менее всего выражена в
рующие ее протеинкиназы образуют четвертый,
крупных венах (~1 дин/см2). Сила растяжения
и если сравнивать с ERK1/2, JNK и p38, менее
стенок сосудов или тангенциального напряже
изученный MAP киназный каскад. Фосфори
ния пропорциональна гидростатическому дав
лирование (по остаткам Thr218 и Tyr220) и акти
лению и обратно пропорциональна R (формула
вацию ERK5 осуществляет двойная треонин ти
Лапласа). После сердечного сокращения сила
розиновая киназа MEK5 (синоним - MAP2K5).
растяжения превышает 104 дин/см2 и превосхо
Известны две изоформы MEK5, которые обра
дит гидродинамическое сопротивление более
зуются при альтернативном сплайсинге. В свою
чем в 100 раз. Турбулентное течение, при кото
очередь, активность MEK5 контролируют двой
ром поток крови перемещается не только парал
ные серин треониновые киназы MEKK2 и
лельно стенкам сосудов, но и в других направле
MEKK3 (синонимы - MAP3K2 и MAP3K3 соот
ниях, происходит при сужении артерий, их из
ветственно), которые фосфорилируют MEK5 по
гибах, ветвлении, а также при патологических
аминокислотным остаткам Ser311 и Thr315
процессах (рис. 4, б) [32-35]. В клетках эндоте
(рис. 3, а) [27, 28]. Наряду с MEF2 субстратами
лия индукция гена KLF2 происходит при лами
ERK5 служат регуляторные белки Sap1, c Fos и
нарном течении крови и, соответственно, высо
c Myc. После активации ERK5 производит фос
ких значениях напряжения сдвига. В модельных
форилирование собственной полипептидной
экспериментах на клетках HUVEC показано,
цепи по Thr732 и нескольким C концевым ос
что пульсирующий ламинарный поток, в боль
таткам серина. В результате происходит высво
шей степени воспроизводящий физиологичес
бождение ERK5 из комплекса с HSP90 и пере
кие условия, вызывает больший рост уровня
мещение в клеточное ядро. Фосфорилирование
KLF2, чем стационарный поток [30, 32, 34].
ERK5 по остатку Thr732 также производит зави
В клетках эндотелия рецепцию гидродина
симая от ростовых факторов MAP киназа
мического сопротивления и трансформацию
ERK1/2 [28, 29].
механического сигнала в биохимический осу
Наиболее полно молекулярный механизм
ществляет целый ряд регуляторных систем и
индукции транскрипции гена KLF2 исследован
клеточных компонентов. К ним относятся ион
БИОХИМИЯ том 85 вып. 1 2020
ФАКТОР ТРАНСКРИПЦИИ KLF2
69
a
б
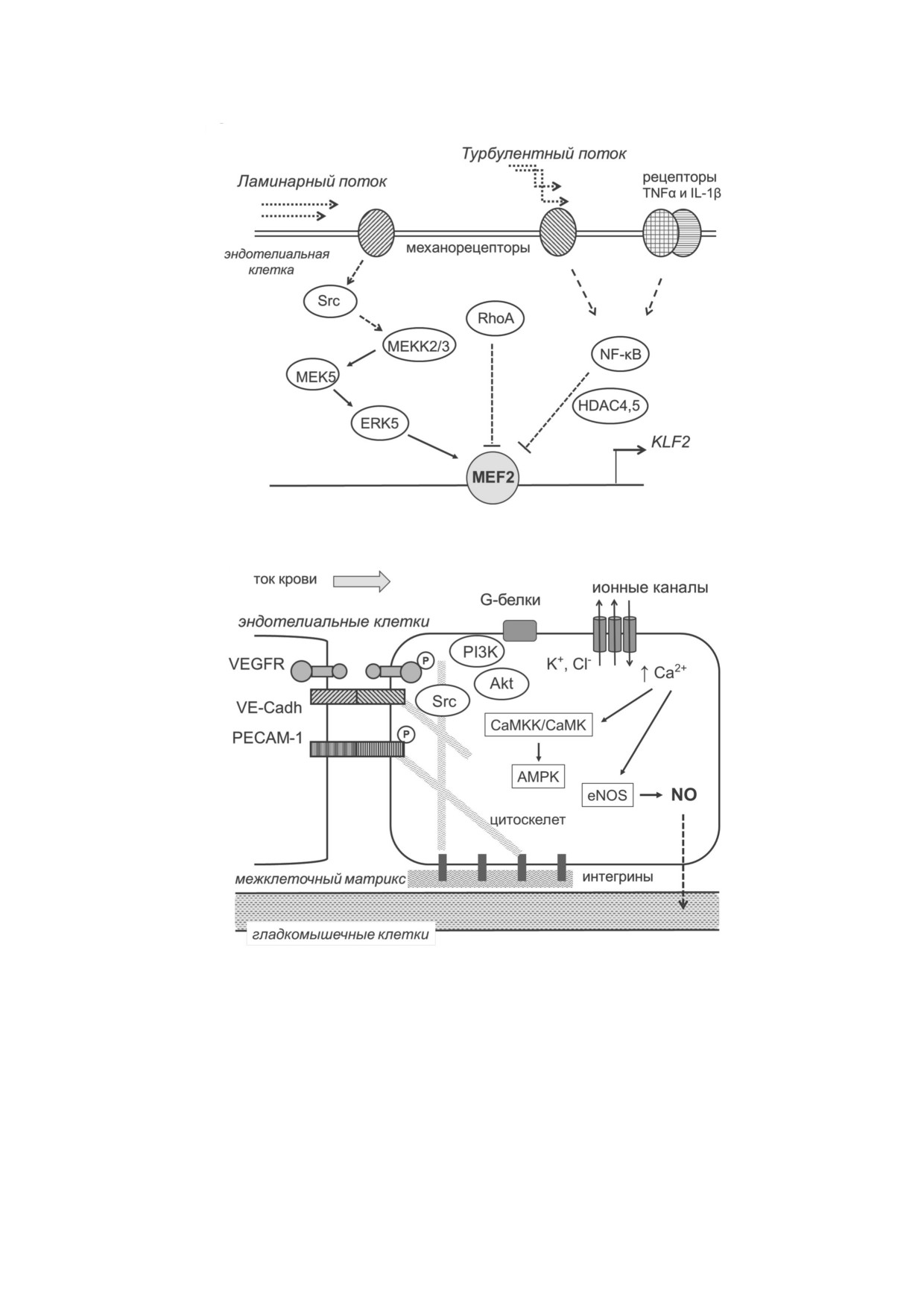
Рис. 3. Молекулярный механизм регуляции KLF2 в клетках сосудистого эндотелия. а - Общая схема регуляции KLF2 в эн
дотелиальных клетках: активация при ламинарном и подавление при турбулентном токах крови. Экспрессию гена KLF2 ак
тивирует транскрипционный фактор MEF2. Транскрипцию гена KLF2 подавляют сигнальные системы RhoA и NF κB. Ак
тивация NF κB происходит при турбулентном токе крови и под действием про воспалительных цитокинов. Ингибирую
щее действие NF κB на транскрипцию гена KLF2 обусловлено HDAC 4 и 5. Показанное на рисунке расположение механо
рецепторов на люминальной стороне эндотелия достаточно условно. б - Механосенсоры и сигнальные системы, актива
ция которых происходит при ламинарном токе крови. Быстрый и кратковременный ответ на напряжение сдвига состоит в
последовательном открывании K+ и Cl- ионных каналов, повышении внутриклеточного Ca2+, активации eNOS и зависи
мом от NO расслаблении гладкомышечных клеток. Также рост концентрации Ca2+ вызывает активацию Ca2+ зависимых
протеинкиназ CaMKKβ и CaMK и контролируемой ими AMPK. Долговременный ответ опосредован изменением конфор
мации мембранных белков PECAM 1 и VE кадгерина (VE Cadh), фосфорилировании PECAM 1 и рецепторов VEGFR2/3
и активации сигнальных систем Src и PI3K/Akt. Рисунок не отображает реальную морфологию клеток эндотелия
БИОХИМИЯ том 85 вып. 1 2020
70
ТУРПАЕВ
a
лок PECAM 1 (platelet/endothelial cell adhesion
molecule 1) [36]. Ранний ответ клеток на возрас
тание гидродинамического сопротивления со
стоит в обусловленной открытием K+ каналов
гиперполяризации мембран, которая вызывает
открытие плазматических Ca2+ каналов. Впослед
ствии мембранный потенциал выравнивается
открытием Cl- каналов. По видимому, ионные
каналы обеспечивают быструю и кратковремен
ную реакцию клеток на изменения гидродина
мического сопротивления, сила которого перио
дически меняется из за пульсирующего харак
тера тока крови. Рост концентрации внутрикле
точного Ca2+ активирует eNOS и стимулирует
б
образование оксида азота и вызывает последую
щее расширение кровеносных сосудов [37, 38].
Из всех механосенсорных комплеков, участ
вующих в реализации долговременного ответа
клеток на высокое гидродинамическое сопро
тивление, наиболее полно изучена многокомпо
нентная система, в которую входят трансмем
бранные белки PECAM 1, VE кадгерин и
VEGFR2/3, локализованные в зоне контактов
между эндотелиальными клетками [36]. Под
действием силы трения крови о стенки сосудов
происходит изменение морфологии клеток эн
дотелия и механической нагрузки на PECAM 1
и VE кадгерин (рис. 3, б и 4, в). При этом проис
ходит ослабление нагрузки на VE кадгерин и
в
усиление - на PECAM 1. Последующее измене
ние конформации PECAM 1 способствует обра
зованию контакта между ним и виментином,
белком, участвующим в построении цитоскеле
та, а также образование комплекса VE кадгери
на с VEGFR2/3. Далее происходит активация
одной из тирозиновых киназ семейства src, фос
форилирование PECAM 1 и VEGFR2/3 по ос
таткам тирозина, активация протеинкиназы Akt
и зависимых внутриклеточных сигнальных сис
тем (рис. 3). Также происходят изменения ак
тивности G белков: снижение Rho и увеличение
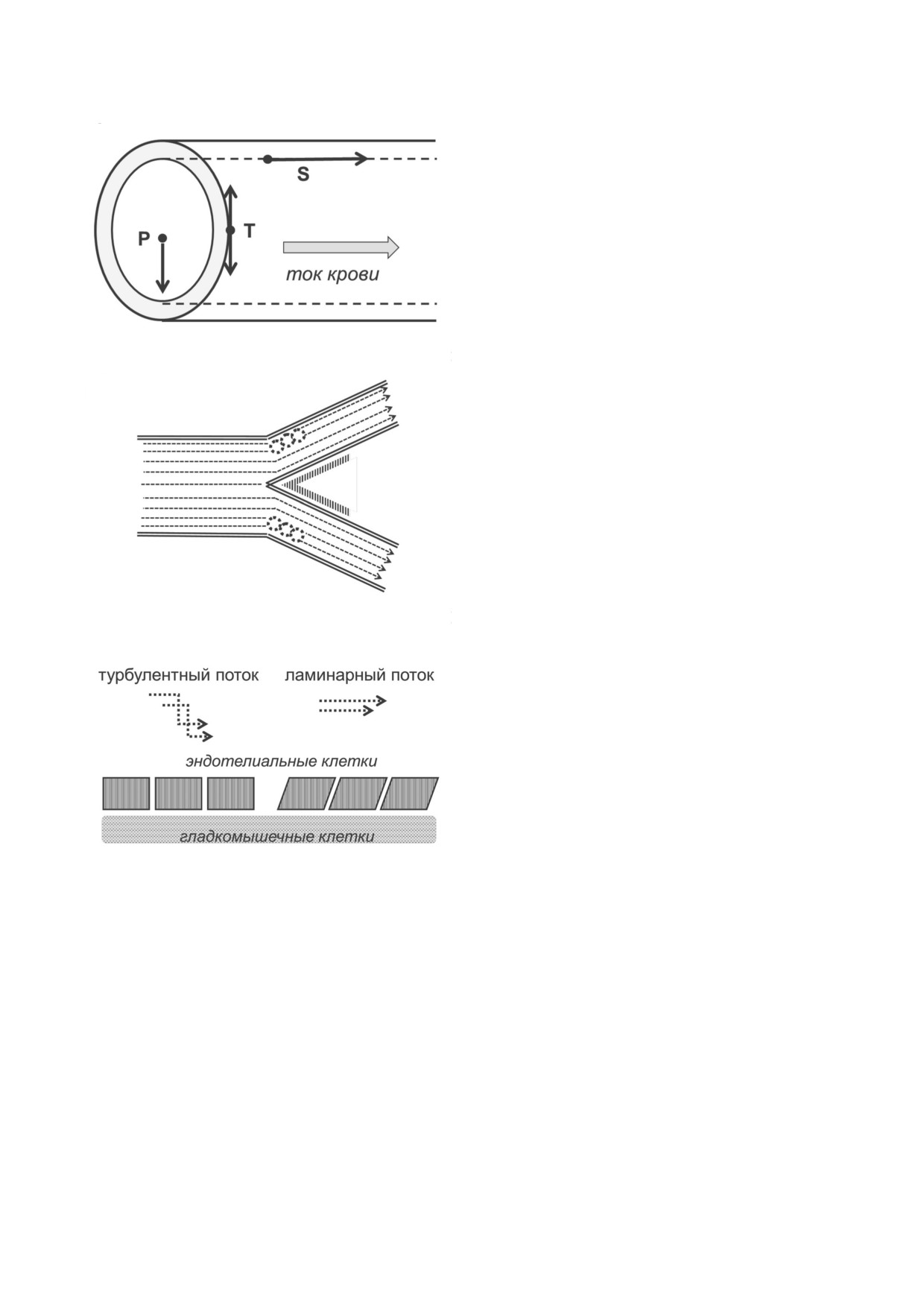
Рис. 4. Обобщенная схема гемодинамики кровеносных со
активности Rac [36-40].
судов. а - Силы, действующие на стенки артериальных со
Дополнительным фактором, контролирую
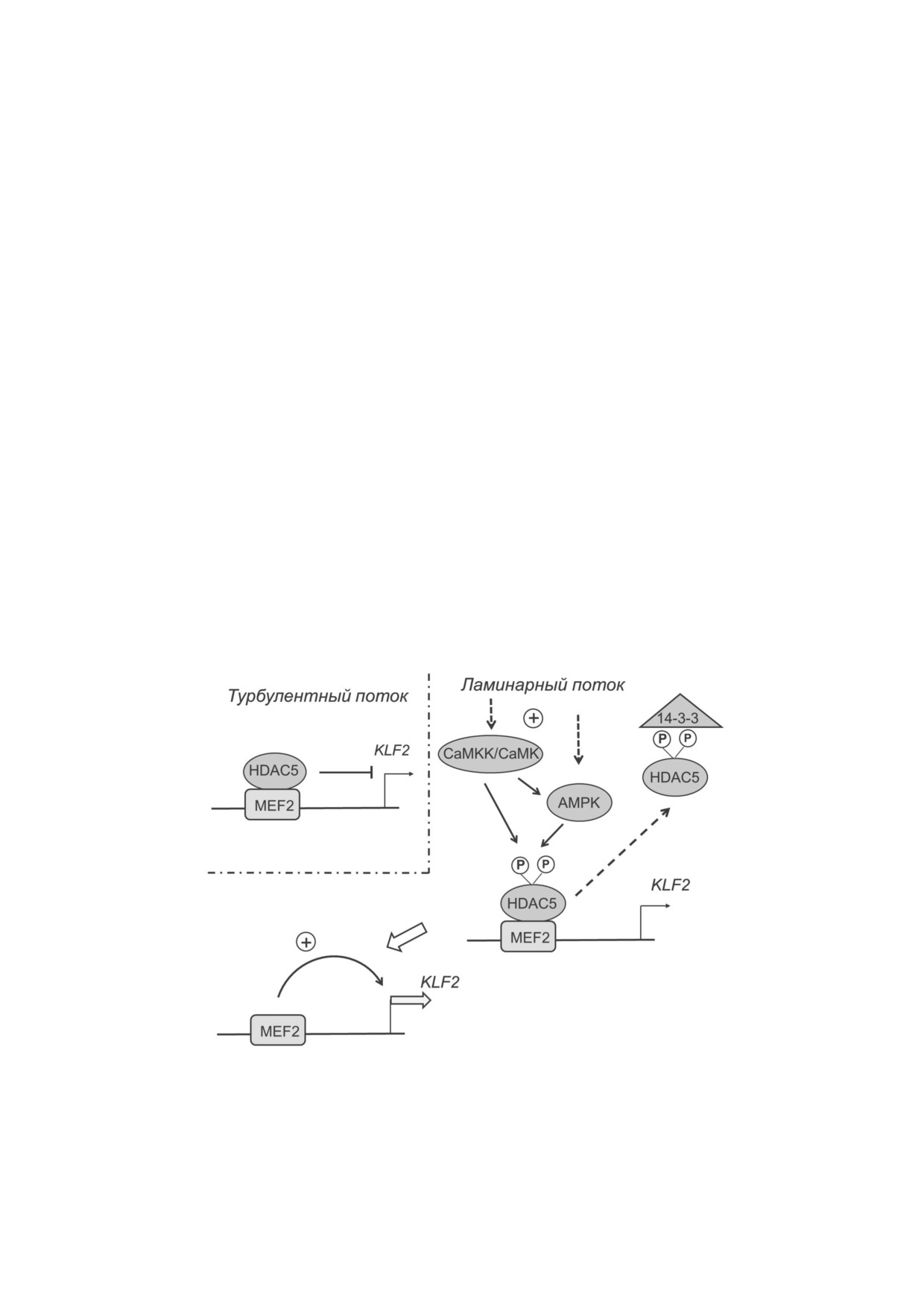
судов: гидростатическое давление, направленное перпенди
щим экспрессию гена KLF2, является тран
кулярно стенкам сосуда (P), тангенциальное напряжение,
растягивающее стенки сосуда (T), и направленная вдоль по
скрипционный репрессор HDAC5. В эндотели
тока сила трения крови о стенки сосуда (S). б - Зона турбу
альных клетках в условиях турбулентного тече
лентности, возникающая при ветвлении и изгибе артери
ния крови и при низких значениях гидродина
альных сосудов. В зоне турбулентности, которая обозначена
мического сопротивления HDAC5 находится в
пунктирными кругами, гидродинамическое сопротивление
снижено. В противоположной области, в зоне с большей ду
комплексе со связанным с ДНК фактором MEF2
гой изгиба (отмечена штриховкой), гидродинамическое
и подавляет транскрипцию KLF2. При ламинар
сопротивление повышено. в - Схема деформирующего
ном течении крови и высоких значениях гидро
действия ламинарного потока на клетки эндотелия
динамического сопротивления (>10 дин/см2) в
клетках эндотелия происходит активация каль
ные каналы, интегрины, G белки, рецепторы
ций кальмодулин зависимых протеинкиназ
VEGF (фактор роста эндотелия сосудов) -
(CaMK), которые фосфорилируют HDAC5 по
VEFGR2 и VEFGR3, белки клеточной адгезии -
остаткам Ser259 и Ser498, что вызывает диссоциа
VE кадгерин и иммуноглобулин подобный бе
цию ее из комплекса с MEF2. Далее с участием
БИОХИМИЯ том 85 вып. 1 2020
ФАКТОР ТРАНСКРИПЦИИ KLF2
71
фактора
1433 происходит перемещение
[42-44]. В эндотелии рост гидродинамического
HDAC5 из ядра в цитоплазму (рис. 5) [41]. В от
сопротивления приводит к активации Nrf2.
личие от ламинарного потока, турбулентный
Этот эффект обусловлен активацией липидки
ток крови стимулирует экспрессию чувстви
назы PI3K, мембранной NAD(P)H оксидазы и
тельных к стрессу и про воспалительным сти
eNOS, что повышает уровень эндогенных элек
мулам транскрипционных факторов NF κB,
трофилов - активных форм кислорода и азота.
AP 1 и EGR 1. При этом функцию механоре
В результате активации Nrf2 происходит индук
цепторов выполняют, по видимому, интегрины.
ция HO 1, NAD(P)H хиноноксидоредуктазы 1
В дальнейшей передаче сигнала участвуют
(NQO1), пероксиредоксинов и других антиок
G белки Gα13 и RhoA, протеинкиназы JNK,
сидантных генов [42, 43]. Параллельно с индук
PKCζ и p90RSK и транскрипционный кофактор
цией защитных генов Nrf2 (также как и KLF2,
YAP. Серин треониновая киназа p90RSK подав
см. далее) участвует в негативной регуляции
ляет активность ERK5 через фосфорилирование
транскрипционного фактора NF κB. Ингиби
по остатку Ser496 [31, 34, 36].
рующее действие основано на конкуренции
В клетках эндотелия при высоких значениях
между Nrf2 и NF κB за связывание с транскрип
гидродинамического сопротивления, наряду с
ционными кофакторами CBP и p300 [44, 45].
индукцией гена KLF2, происходит активация и
ядерная транслокация фактора транскрипции
Nrf2, который контролирует экспрессию генов,
ИНГИБИРОВАНИЕ KLF2
повышающих устойчивость клеток к эндоген
ным и экзогенным электрофильным соедине
Подавление экспрессии KLF2 происходит
ниям. Активность Nrf2 контролирует репрес
под действием про воспалительных цитокинов
сорный белок Keap1, который действует как ре
IL 1β и TNFα. В эндотелии экспрессию KLF2
цептор электрофильных соединений и адаптер
также подавляют бактериальные эндотоксины и
ный белок убиквитинлигазы Cul3. Окисление
липопротеины низкой плотности. В клетках
или алкилирование специфических тиольных
HUVEC ингибирующее действие TNFα опосре
групп Keap1 вызывает диссоциацию комплекса
довано активацией фактора NF κB. Регулятор
Keap1/Nrf2 и рост уровня Nrf2 в клетках
ная область гена KLF2 содержит несколько по
Рис. 5. Схема участия HDAC5 в регуляции экспрессии KLF2 в эндотелиальных клетках. При низких значениях гидроди
намического сопротивления HDAC5 находится в комплексе с MEF2 в промоторной области гена KLF2. При возрастании
силы гидродинамического сопротивления внутриклеточная концентрация Ca2+ возрастает, происходит активация проте
инкиназ CaMK, фосфорилирование и высвобождение HDAC5 и активация транскрипции KLF2. Далее HDAC5 образует
комплекс с фактором 14 3 3 и переносится из ядра в цитоплазму. Фосфорилирование HDAC5 также происходит при ак
тивации AMPK. Активность AMPK зависит от системы CaMKKβ/CaMK
БИОХИМИЯ том 85 вып. 1 2020
72
ТУРПАЕВ
тенциальных участков связывания NF κB. Че
ры G белков Rho и зависимой от Rho протеин
рез посредство NF κB происходит присоедине
киназы ROCK. Так, например, в моноцитах ли
ние гистондеацетилаз HDAC4 и HDAC5 к про
нии U937 ингибитор геранилгеранилтрансфера
моторному участку гена KLF2 (рис. 3, а) [19, 41,
зы GGTI 298 вызывает значительную индукцию
46]. В эндотелии в негативной регуляции KLF2
гена KLF2 [56]. В клетках разных типов под
также участвует транскрипционный фактор
действием статинов возрастает уровень KLF2 и
FOXO1. При инкубации клеток HUVEC в среде
происходит подавление экспрессии генов, зави
с высоким уровнем глюкозы (30 мМ) в них про
симых от про воспалительных стимулов. В мо
исходит дефосфорилирование и активация
ноцитах THP 1 церивастатин подавляет
FOXO1, что приводит к подавлению транскрип
экспрессию MCP 1 (monocyte chemoattractant
ции гена KLF2 [47]. Кроме того, экспрессию ге
protein 1) и ССК2 (C C Chemokine Receptor 2), в
на KLF2 подавляет транскрипционный фактор
эндотелии питавастатин подавляет зависимую
p53. В промоторной области гена KLF2 присут
от TNFα индукцию молекул адгезии клеток эн
ствует участок связывания p53, который распо
дотелия сосудов 1 (VCAM 1, vascular cell adhe
ложен поблизости от участка связывания MEF2.
sion molecule 1), в T клетках статины подавляют
Ингибирующий эффект p53 на экспрессию
экспрессию IFNγ [53, 57]. Cтатины имеют ши
KLF2 опосредован связыванием гистондеацети
рокое клиническое применение для снижения
лаз [18, 48]. В клетках HUVEC генетическая
уровня холестерина [55, 58, 59]. По видимому,
инактивация p53 вызывает повышение уровня
ряд дополнительных эффектов статинов, таких
KLF2 в клетках и индуцирует экспрессию генов
как подавление воспалительных процессов,
eNOS и THBD. Напротив, активация p53 приво
обусловлен активацией KLF2 [6].
дит к индукции гена PAI 1, экспрессию которо
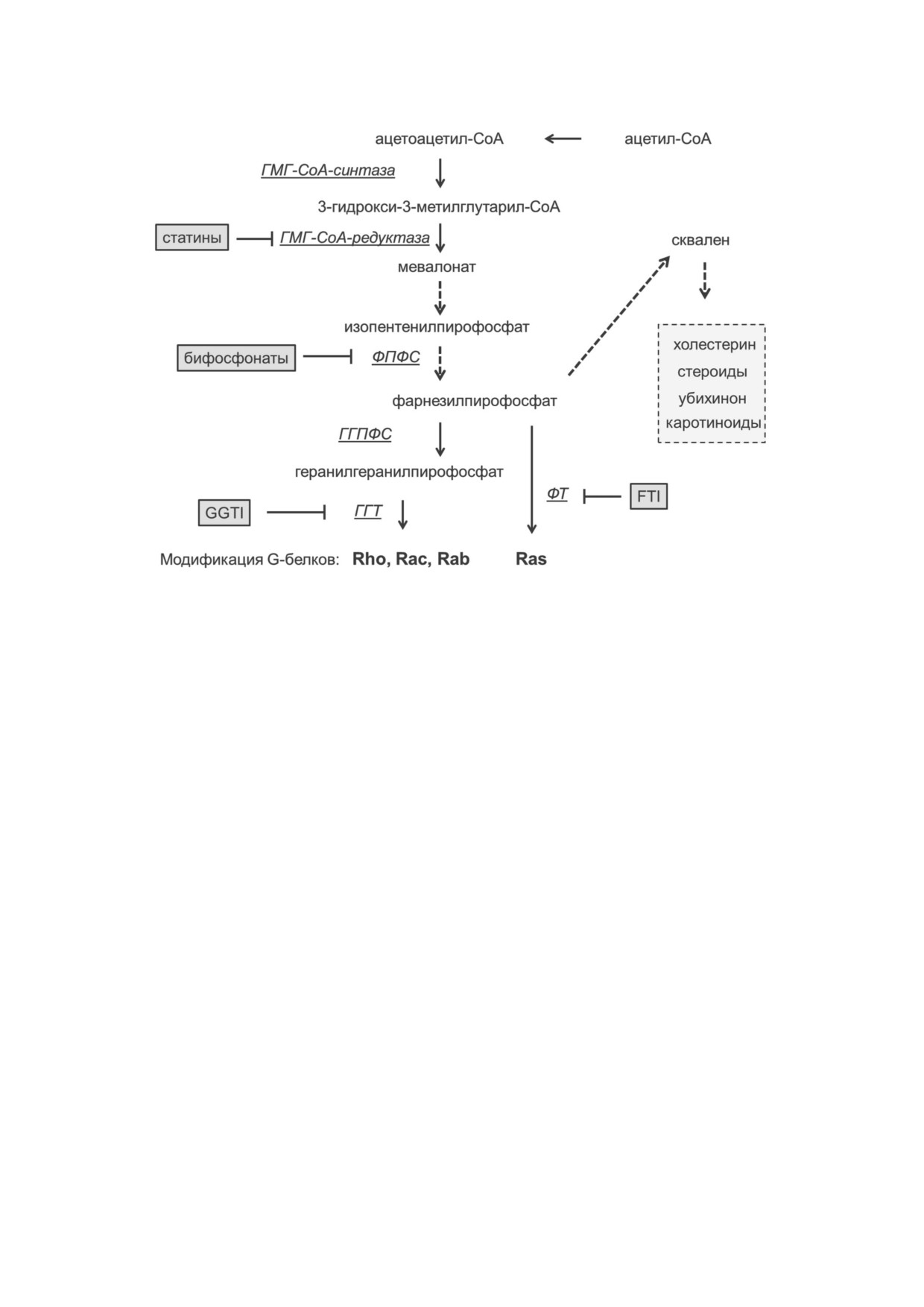
Также подавляют пренилирование G белков
го подавляет KLF2. Показано также, что в физио
и активируют экспрессию KLF2 бифосфонаты,
логических условиях опосредованное p53 подав
прежде всего - азотсодержащие бифосфонаты
ление KLF2 стимулирует агрегацию тромбоци
как, например, золедроновая кислота. Показа
тов [48].
но, что золедроновая кислота активирует
В эндотелиальных клетках в регуляции KLF2
экспрессию KLF2 в клетках эпителиального
участвует также микроРНК miR 92a, которая
происхождения MCF 7 [60]. Действие бифос
подавляет трансляцию мРНК KLF2. Экспрессия
фонатов основано на ингибировании фарнезил
miR 92a снижена при ламинарном и возрастает
пирофосфат синтазы (рис. 6). Бифосфонаты
при турбулентном течении крови. В свою оче
были разработаны для лечения остеопороза. В
редь, фактор KLF2 контролирует экспрессию
физиологических условиях их действие ограни
ряда микроРНК (например, miR 126 и miR 150)
чено остеокластами, что обусловлено прочным
[49-52].
связыванием с гидроксиапатитом костей. Из за
отрицательного заряда бифосфонаты не прохо
дят через плазматическую мембрану и проника
ФАРМАКОЛОГИЧЕСКАЯ
ют в клетки через эндоцитоз. Бифосфонаты по
СТИМУЛЯЦИЯ KLF2
глощаются остеокластами при закислении ими
среды и разрушении минеральной составляю
Статины в клетках разных типов активируют
щей костной ткани. Подавление пренилирова
экспрессию KLF2 и зависимого от KLF2 гена
ния регуляторных G белков приводит к функ
eNOS [53, 54]. Действие статинов основано на
циональной инактивации остеокластов. Кроме
ингибировании редуктазы 3 окси 3 метилглу
остеокластов бифосфонаты могут поглощаться,
тарил СоА (HMG CoA), ключевого фермента
хотя и в меньшей степени, другими клетками
синтеза мевалоновой кислоты, предшественни
моноцитарного происхождения [61].
ка холестерина и изопреноидов (рис. 6). Как
В клетках эндотелия индукцию гена KLF2
следствие, статины подавляют образование в
вызывает ресвератрол, природное полифеноль
клетках фарнезилпирофосфата и геранилгера
ное соединение [62]. Ресвератрол также стиму
нилпирофосфата, которые служат предшествен
лирует экспрессию KLF2 в культуре панкреати
никами для пренилирования G белков семейств
ческих β клеток MIN6 и адипоцитах 3T3 L1.
Ras, Rac, Rab и Rho по SH группам C концевых
Действие ресвератрола основано на параллель
остатков цистеина с образованием изопренил
ной активации транскрипционного фактора
цистеина. Такая модификация необходима для
Nrf2 и NAD зависимой лизиндеацетилазы
прикрепления этих белков к клеточной мембра
SIRT1 (HDAC III типа). В индукции KLF2 под
не и их функциональной активности [55]. Ана
действием ресвератрола участвует сигнальный
логичное со статинами воздействие на экспрес
каскад MEK5/MEF2 [50, 63, 64]. Активация
сию KLF2 оказывают избирательные ингибито
KLF2 также происходит под действием других
БИОХИМИЯ том 85 вып. 1 2020
ФАКТОР ТРАНСКРИПЦИИ KLF2
73
Рис. 6. Схема синтеза производных изопрена и пренилирования G белков. Показаны основные ингибиторы синтеза клю
чевых интермедиатов. Сокращения: ГМГ - 3 окси 3 метилглутарил; ГГПФС - геранилгеранилпирофосфатсинтаза;
ГГТ - геранилгеранилтрансфераза; ФПФС - фарнезилпирофосфатсинтаза; ФТ - фарнезилтрансфераза; GGI - GGTI 298
(ингибитор ГГТ); FTI - FTI 277 (ингибитор ФТ)
природных биологически активных полифено
тельных цитокинов (IL 1β и TNFα). Гуманин
лов, таких как таниновая кислота, кверцетин,
предотвращает активацию экспрессии этих ге
рутин и экстракт фенольных соединений из
нов [70]. Индукцию KLF2 вызывает ряд других
морской бурой водоросли Ecklonia cava (т.н. си
сигнальных молекул. Эритропоэтин стимулирует
полинол/seapolynol) [65-67]. Сиполинол подав
дифференцировку стволовых клетках ECFC
ляет дифференцировку адипоцитов линии 3T3 L1
(Endothelial Colony Forming Cells) и стимулирует
и накопление липидов в жировой ткани in vivo,
в них экспрессию генов KLF2 и eNOS. Индуциру
что может быть связано с индукцией KLF2. Ин
ющее действие эритропоэтина опосредовано ак
гибирующее действие KLF2 на адипогенез обус
тивацией AMP зависимой протеинкиназы
ловлено подавлением транскрипционного фак
(AMPK) [71]. В клетках HUVEC экспрессию
тора PPARγ [68].
KLF2 активирует ангиопоэтин, что обусловлено
Согласно недавно полученным данным, в
активацией рецепторной тирозиновой киназы
клетках HUVEC экспрессию KLF2 активирует
Tie2 PI3K/Akt, фактора MEF2 и не связано с ак
гуманин (пептид из 24 аминокислот) и фактор
тивностью ERK5 [72]. В клетках моноцитарного
межклеточной сигнализации, уникальный рас
происхождения U937 значительная индукция ге
положением кодирующего его гена в митохон
на KLF2 происходит под действием химического
дриальной ДНК (внутри гена 16S rRNA) [69]. Гу
донора оксида азота DETA NO. При этом уро
манин активирует ERK5, а также предотвращает
вень индукции гена KLF2 под действием NO
снижение фосфорилирования ERK5 и экспрес
критически зависит от плотности клеток U937 в
сии KLF2 при инкубации клеток HUVEC в сре
суспензионной культуре. Механизм этого эф
де, содержащей 25 мМ глюкозы. Гуманин также
фекта неясен, известно только, что рост экспрес
восстанавливает способность клеток к индукции
сии KLF2 не связан с активацией ERK5 [56, 73].
зависимого от KLF2 гена eNOS. Инкубация кле
Эти данные указывают на возможность регуля
ток HUVEC в среде с высокой концентрацией
ции образования в клетках NO по принципу по
глюкозы стимулирует экспрессию факторов ад
ложительной обратной связи: KLF2 способству
гезии (E селектин и VCAM 1) и про воспали
ет индукции eNOS и увеличению генерации
БИОХИМИЯ том 85 вып. 1 2020
74
ТУРПАЕВ
клетками оксида азота, который, в свою очередь,
нии с ионами Zn2+ в активном центре HDAC I и
вызывает транскрипционную активацию KLF2.
II типа. Известен ряд ингибиторов HDAC с
Из числа распространенных фармакологи
иными механизмами действия (например, ко
ческих препаратов индукцию гена KLF2 вызы
роткоцепочечные жирные кислоты и производ
вает метформин, активатор протеинкиназы
ные бензамида) [76, 79, 80].
AMPK. После активации AMPK фосфорилиру
ет HDAC5 по остатку Ser498, что вызывает ее пе
ремещение из ядра в цитоплазму и рост тран
РОЛЬ KLF2 В КЛЕТКАХ ЭНДОТЕЛИЯ
скрипции гена KLF2 (рис. 5). Кроме того, в клет
ках эндотелия AMPK фосфорилирует и активи
В клетках эндотелия KLF2 участвует во мно
рует eNOS [74, 75]. Ресвератрол также активиру
гих регуляторных процессах. Действие KLF2
ет AMPK и eNOS. Этот эффект опосредован ак
направлено на стимуляцию циркуляции крови,
тивацией SIRT1 [76]. В эндотелиальных клетках
подавление агрегации тромбоцитов и способнос
и моноцитах индукцию KLF2 вызывают синте
ти клеток эндотелия к связыванию лимфоцитов
тические ингибиторы HDAC, производные гид
и моноцитов. Активация KLF2 вызывает индук
роксамовой кислоты (например, вориностат и
цию THBD, HO 1 и вазодилатационных генов
трихостатин) [77, 78]. При действии на эндоте
eNOS и NPPC (предшественник натрийуретичес
лий вориностат подавляет зависимую от TNFα
кого пептида C). Вместе с тем KLF2 подавляет
индукцию про воспалительных генов [77]. При
экспрессию таких сосудосуживающих факторов,
действии на моноциты ингибиторы HDAC пре
как эндотелин 1 (ET1) и ангиотензинпревращаю
пятствуют их дифференцировке, что обусловле
щий фермент (ACE) [81]. Действие другой функ
но ингибированием HDAC4, связанной с KLF2,
циональной группы зависимых от KLF2 генов
и проявляется в подавлении экспрессии метал
направлено на подавление коагуляции крови.
лопротеиназы MMP9
[78]. Ингибирующее
KLF2 стимулирует экспрессию тромбомодулина,
действие гидроксаматов основано на связыва
что далее способствует активации антитромботи
Влияние KLF2 на экспрессию генов в клетках иммунной системы и эндотелия
T и B лимфоциты
Моноциты
Эндотелий
цитокины и хемокины
факторы адгезии
↑ L селектин
↓ TNFα
↓ VCAM 1
↑ p21/Cip1
↓ IL 1β
↓ ICAM 1
↓ CD154
↓ MIP 1α
↓E селектин
↓ c myc
↓ MCP 1
↓ IL 8
коагуляция и фибринолиз
↑ eNOS
↑ tPA
↑ тромбомодулин
↓ PAI 1
↓ VWF
про и анти воспалительные ферменты
тонус сосудов
↑ HO 1
↑ eNOS
↓ COX2
↓ ACE
Обозначения: подавление (↓) и активация (↑) экспрессии генов.
БИОХИМИЯ том 85 вып. 1 2020
ФАКТОР ТРАНСКРИПЦИИ KLF2
75
ческого протеина C. Вместе с тем KLF2 ингиби
рует экспрессию протромботического фактора
фон Виллебранда (VWF) и подавляющего фибри
нолиз ингибитора активации плазминогена 1
(PAI 1) [18]. Кроме того, KLF2 ослабляет прот
ромботический эффект цитокинов, которые вы
зывают рост экспрессии PAI 1 и снижают уро
вень тромбомодулина. Также KLF2 подавляет ба
зовую экспрессию и зависимую от IL 1β, IFNγ и
липополисахаридов индукцию VCAM 1, ICAM 1
(Inter Cellular Adhesion Molecule 1), E селектина
и мембранной дифосфогидролазы ENTPD1
(CD39) (таблица). Как следствие, активация
KLF2 ослабляет агрегацию T клеток и макрофа
гов с сосудистым эндотелием [18, 19, 70]. Инги
бирующий эффект KLF2 на экспрессию генов,
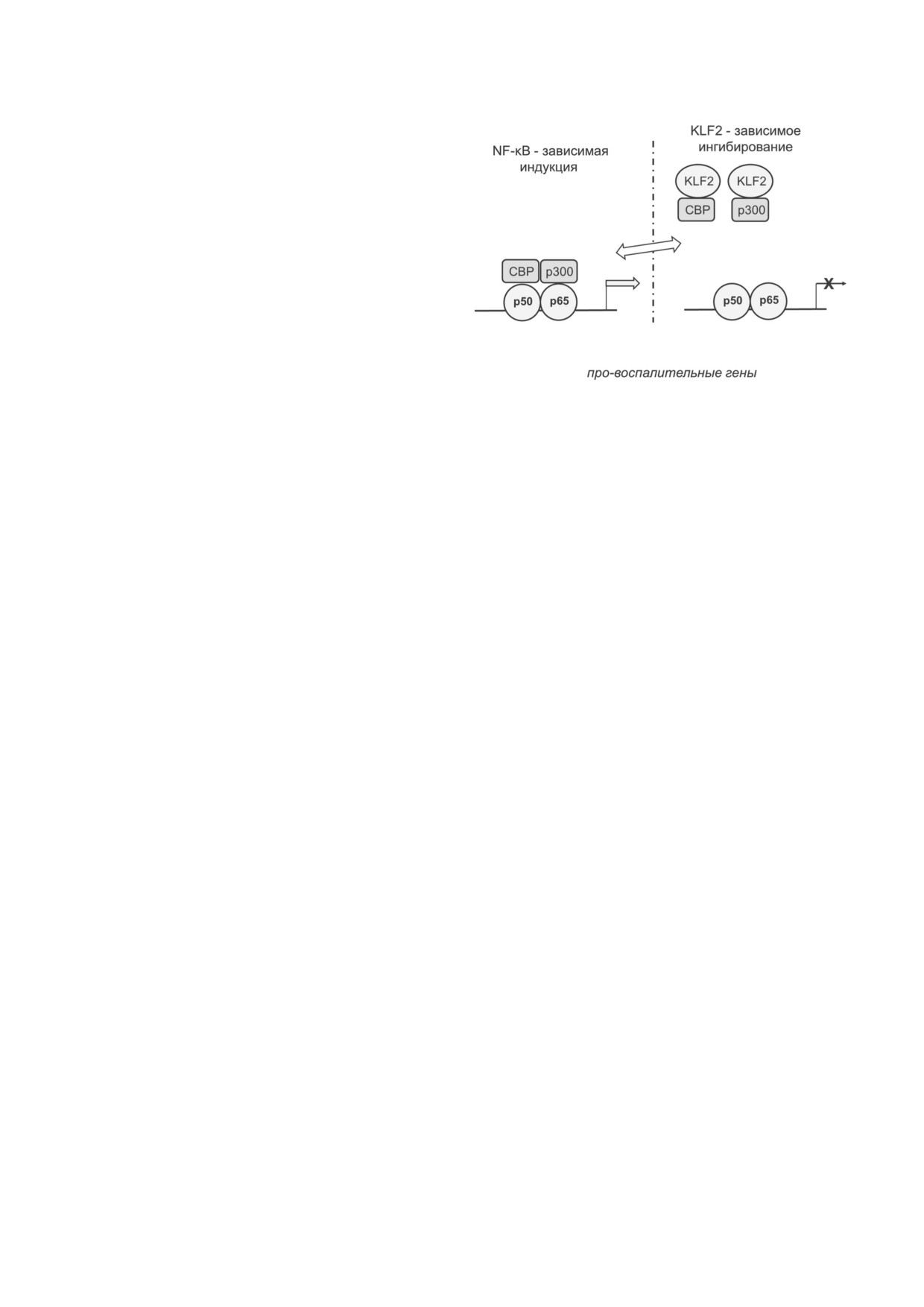
Рис. 7. Обобщенная схема участия KLF2 в подавлении
зависимых от про воспалительных цитокинов,
транскрипции зависимых от NF κB про воспалительных
генов. Ингибирующее действие основано на конкуренции
обусловлен подавлением фактора транскрипции
между KLF2 и субъединицами NF κB p50 и p65 за связыва
NF κB [62, 82]. Тем самым контролирующая
ние с гистонацетилтрансферазами CBP и p300
KLF2 сигнальная система ERK5/MEF2 и систе
мы, контролирующие NF κB, находятся в ре
ципрокных отношениях. По видимому, этот эф
РОЛЬ KLF2 В РЕГУЛЯЦИИ КЛЕТОК
фект основан на антагонизме между транскрип
ИММУННОЙ СИСТЕМЫ
ционными факторами MEF2 и NF κB. Оба фак
тора оказывают воздействие на ацетилирование
Экспрессия KLF2 характерна для целого ря
белков транскрипционного комплекса. Ингиби
да клеток иммунной системы: моноцитов, B
рующее действие NF κB на экспрессию KLF2
клеток, T клеток CD4+ (хелперы) и CD8+ (кил
опосредовано привлечением HDAC4 и HDAC5 в
леры) [18, 19, 83]. В B клетках действие KLF2
промоторную область гена KLF2, действие MEF2
направлено на подавление пролиферации, что
- конкуренцией с NF κB за образование комп
опосредовано ростом экспрессии p21/Cip1 и
лекса с гистонацетилтрансферазами CBP и p300
снижением c Myc [84]. В моноцитах, также как
(рис. 5 и 7) [18, 19, 83]. Молекулярный механизм
и в эндотелиальных клетках, про воспалитель
конкуренции между KLF2 и NF κB за связыва
ные стимулы - IL 1β, TNFα и липополисахари
ние с CBP/p300 остается неясным.
ды - подавляют экспрессию KLF2. В то же вре
При ламинарном токе крови происходит
мя KLF2 подавляет зависимую от липополиса
погружение клеток эндотелия в состояние по
харидов активацию моноцитов и экспрессию
коя, подавление их пролиферации и апоптоза.
циклооксигеназы 2 (COX2), IL 1β, IL 8, TNFα,
По видимому, цитостатический эффект KLF2
MIP 1α (макрофагальный белок воспаления 1β,
обусловлен активацией экспрессии ингибитора
macrophage inflammatory protein 1α) и MCP 1
циклин зависимых протеинкиназ p21/Cip1 [33].
[83, 85]. Уровень KLF2 в моноцитарных клетках
Для морфологии эндотелия сосудов при высо
снижается при их дифференцировке и превра
ких значениях напряжения сдвига характерно
щении в макрофаги [82]. В T клетках при их ак
вытягивание клеток вдоль направления потока,
тивации также происходит быстрое снижение
что снижает механическую нагрузку на цитоске
экспрессии KLF2, обусловленное, наряду со
лет. В условиях турбулентности происходит
снижением транскрипции гена KLF2, убиквити
морфологическая перестройка стенок крове
нированием и ускоренной протеолитической
носных сосудов, эндотелиальные клетки не вы
деградацией. Эти процессы инициируются свя
тянуты в направлении потока, они могут прини
зыванием рецепторов TCR со своими лиганда
мать полигональную форму, в них повышены
ми. В T клетках с генотипом KLF2-/- происхо
уровни пролиферации и апоптоза [30, 34, 35]. В
дит их спонтанная активация [86, 87]. Напро
этих условиях в эндотелиальных клетках возрас
тив, ослабляющий иммунные реакции фактор
тает активность NF κB и экспрессия адгезион
TGFβ стабилизирует уровень KLF2
[88].
ных белков VCAM 1, ICAM 1 и E селектина,
Экспрессия KLF2 возрастает в зрелых T клетках
что способствует связыванию моноцитов. Для
памяти. В процессе дифференцировки тимоци
участков сосудов с турбулентным током крови
тов KLF2 стимулирует образование индуциро
характерен повышенный риск возникновения
ванных регуляторных T клеток (iTreg) [88]. Тем
атеросклеротических повреждений [30, 34].
самым действие KLF2 направлено на поддержа
БИОХИМИЯ том 85 вып. 1 2020
76
ТУРПАЕВ
ние T клеток в состоянии покоя и ослаблении
ленных на ослабление воспалительных процес
клеточного иммунитета. Активация KLF2 таки
сов и сопряженных с ними аутоиммунных забо
ми фармакологическими препаратами, как,
леваний, таких как атеросклероз и нарушения
например, статины, подавляет аутоиммунные
липидного обмена. Также активация KLF2
процессы. Статины снижают риск возникнове
должна способствовать подавлению ангиогене
ния ревматоидного артрита. Они также облегча
за. Вместе с тем биологически активные соеди
ют течение ревматоидного артрита, множест
нения, которые могли бы подавлять экспрессию
венного склероза и болезни Крона, но не влия
KLF2 в T лимфоцитах и моноцитах, могут спо
ют на ход системной красной волчанки и нейро
собствовать усилению иммунных процессов.
дегенеративных заболеваний. Вместе с тем
Известно большое число фармакологических
можно ожидать, что статины ослабляют зависи
препаратов и эндогенных сигнальных молекул,
мую от иммунной системы элиминацию транс
способных модулировать активность KLF2, что
формированных клеток. Тем не менее такие
не является при этом их основным биологичес
опасения не подтверждаются статистическими
ким эффектом. Многие из таких препаратов
исследованиями [89].
воздействуют на целую группу родственных ре
гуляторных белков или белков с близкими
Из всего множества известных эффектов
структурными доменами и влияют на широкий
KLF2, по видимому, более всего исследовано
спектр клеточных процессов. Так, например,
участие этого фактора в поддержании гомеоста
статины ингибируют все G белки семейств Rho
за в сосудистом эндотелии, где KLF2 влияет на
и Ras, а также и синтез стероидов, гидроксаматы
экспрессию широкого спектра генов. Через ин
ингибируют все HDAC I го и II го типа, мет
дукцию гена eNOS и последующий рост эндоте
формин активирует AMPK и ингибирует мито
лиальной генерации оксида азота KLF2 вовле
хондриальный NADH дегидрогеназный комп
чен в регуляцию циркуляции крови. Кроме того,
лекс, ресвератрол активирует лизиндеацетилазу
действие KLF2 направлено на ослабление вос
SIRT1 и редокс чувствительную систему
палительных процессов в эндотелии, подавле
Keap1/Nrf2. Все эти соединения оказывают
ние свертывания крови и агрегации тромбоци
множественное и не всегда благоприятное воз
тов. Также KLF2 вовлечен в негативную регуля
действие на протекающие в организме биохи
цию клеточного иммунитета, что проявляется в
мические и физиологические процессы, что ог
подавлении активации, дифференцировки и ад
раничивает возможности их применения. По
гезии T лимфоцитов и моноцитов. Зависимое
добное затруднение может быть преодолено при
от KLF2 ослабление ответа клеток на про вос
создании соединений, которые имели бы высо
палительные стимулы обусловлено подавлени
кую избирательность в отношении именно тех
ем транскрипционной активности NF κB. При
регуляторных факторов, которые контролируют
этом факторы KLF2 и NF κB проявляют себя
экспрессию KLF2, таких как, например, RhoA и
как взаимные антагонисты. В клетках актив
HDAC4 и HDAC5. Также можно надеяться на
ность KLF2 определяется уровнем его экспрес
дальнейшее исследование активации KLF2 под
сии, который в наибольшей степени зависит от
действием эндогенных сигнальных молекул, та
фактора транскрипции MEF2. Активность
ких как эритропоэтин, ангиопоэтин, гуманин и
MEF2 контролируют две сигнальные системы:
оксид азота. В настоящее время это направление
одна, позитивная, включает протеинкиназу
представлено только единичными работами [56,
ERK5 и другая, негативная, включает гистон
70-72]. Также можно предположить, что впос
деацетилазы HDAC4 и HDAC5. Кроме того,
ледствии будут разработаны биологически ак
экспрессия KLF2 зависит от значительного чис
тивные олигопептидные аналоги эритропоэти
ла других сигнальных молекул и регуляторных
на и гуманина, высокоизбирательные в отноше
систем: мембранных K+ каналов, сопряженных
нии контролирующих KLF2 сигнальных систем.
с тирозиновыми киназами механорецепторов,
G белков семейства Rho, ацетилтрансфераз
CBP, p300 и PCAF, транскрипционных факторов
Финансирование. Работа была выполнена в
NF κB и FOXO1, лизиндеацетилазы SIRT1,
рамках Государственного задания № АААА
AMPK и Ca2+ зависимых протеинкиназ
А18 118012390247 0.
CaMKKβ и CaMK [90, 91], а также некоторых
Конфликт интересов. Автор заявляет об отсут
эндокринных и паракринных факторов.
ствии конфликта интересов.
Представляется очевидным, что, будучи во
Соблюдение этических норм. Настоящая
влеченным в столь большое число регуляторных
статья не содержит каких либо исследований с
процессов, KLF2 служит значимым объектом
участием людей или использованием животных
для фармакологических воздействий, направ
в качестве объектов исследований.
БИОХИМИЯ том 85 вып. 1 2020
ФАКТОР ТРАНСКРИПЦИИ KLF2
77
СПИСОК ЛИТЕРАТУРЫ
1.
Miller, I.J., and Bieker, J.J. (1993) A novel, erythroid cell
20.
Ghaleb, A.M., and Yang, V.W. (2017) Krüppel like factor 4
specific murine transcription factor that binds to the
(KLF4): what we currently know, Gene, 611, 27-37.
CACCC element and is related to the Krüppel family of
21.
Chestkov, I.V., Khomyakova, E.A., Vasilieva, E.A.,
nuclear proteins, Mol. Cell. Biol., 13, 2776-2786.
Lagarkova, M.A., and Kiselev, S.L. (2014) Molecular bar
2.
Pei, J., and Grishin N.V. (2015) C2H2 zinc finger proteins of
riers to processes of genetic reprogramming and cell trans
the SP/KLF, Wilms tumor, EGR, Huckebein, and Klumpfuss
formation, Biochemistry (Moscow), 79, 1297-1307.
families in metazoans and beyond, Gene, 573, 91-99.
22.
Kunes, P., Holubcová, Z., and Krejsek, J.
(2009)
3.
Pollak, N.M., Hoffman, M., Goldberg, I.J., and Drosatos, K.
Occurrence and significance of the nuclear transcription
(2018) Krüppel like factors: crippling and un crippling
factor Krüppel like factor 4 (KLF4) in the vessel wall, Acta
metabolic pathways, JACC Basic Transl. Sci., 3, 132-156.
Medica (Hradec Kralove), 52, 135-139.
4.
Lomberk, G., and Urrutia, R. (2005) The family feud: turning
23.
Villarreal, G. Jr., Zhang, Y., Larman, H.B., Gracia
off Sp1 by Sp1 like KLF proteins, Biochem. J., 392, 1-11.
Sancho, J., Koo, A., and Garc a Cardeña, G. (2010)
5.
Stubbs, L., Sun, Y., and Caetano Anolles, D.
(2011)
Defining the regulation of KLF4 expression and its down
Function and evolution of C2H2 zinc finger arrays,
stream transcriptional targets in vascular endothelial cells,
Subcell. Biochem., 52, 75-94.
Biochem. Biophys. Res. Commun., 391, 984-989.
6.
Bialkowska, A.B., Yang, V.W., and Mallipattu, S.K. (2017)
24.
Zhao, Y., and Sun, Y. (2013) The FBW7 KLF2 axis regu
Krüppel like factors in mammalian stem cells and develop
lates endothelial functions, Cell Res., 23, 741-743.
ment, Development, 144, 737-754.
25.
Zhang, X., Srinivasan, S.V., and Lingrel, J.B.
(2004)
7.
Pearson, R., Fleetwood, J., Eaton, S., Crossley, M., and
WWP1 dependent ubiquitination and degradation of the
Bao, S. (2008) Krüppel like transcription factors: a func
lung Krüppel like factor, KLF2, Biochem. Biophys. Res.
tional family, Int. J. Biochem. Cell Biol., 40, 1996-2001.
Commun., 316, 139-148.
8.
Kaczynski, J., Cook, T., and Urrutia, R. (2003) Sp1 and
26.
Sohn, S.J., Li, D., Lee, L.K., and Winoto, A. (2005) Transcrip
Krüppel like transcription factors, Genome Biol., 4, 206.
tional regulation of tissue specific genes by the ERK5 mitogen
9.
Wu, Z., and Wang, S. (2013) Role of Krüppel like tran
activated protein kinase, Mol. Cell. Biol., 25, 8553-8566.
scription factors in adipogenesis, Dev. Biol., 373, 235-243.
27.
Chen, X., Gao, B., Ponnusamy, M., Lin, Z., and Liu, J.
10.
Zhang, P., Basu, P., Redmond, L.C., Morris, P.E., Rupon, J.W.,
(2017) MEF2 signaling and human diseases, Oncotarget, 8,
Ginder, G.D., and Lloyd, J.A. (2005) A functional screen
112152-112165.
for Krüppel like factors that regulate the human gamma
28.
Roberts, O.L., Holmes, K., Müller, J., Cross, D.A., and
globin gene through the CACCC promoter element, Blood
Cross, M.J. (2009) ERK5 and the regulation of endothelial
Cells Mol. Dis., 35, 227-235.
cell function, Biochem. Soc. Trans., 37, 1254-1259.
11.
Huang, B., Ahn, Y.T., McPherson, L., Clayberger, C., and
29.
Drew, B.A., Burow, M.E., and Beckman, B.S. (2012)
Krensky, A.M. (2007) Interaction of PRP4 with Kruppel
MEK5/ERK5 pathway: the first fifteen years, Biochim.
like factor 13 regulates CCL5 transcription, J. Immunol.,
Biophys. Acta, 1825, 37-48.
178, 7081-7087.
30.
Nakajima, H., and Mochizuki, N. (2017) Flow pattern
12.
Kaczynski, J.A., Conley, A.A., Fernandez Zapico, M.,
dependent endothelial cell responses through transcrip
Delgado, S.M., Zhang, J.S., and Urrutia, R.
(2002)
tional regulation, Cell Cycle, 16, 1893-1901.
Functional analysis of basic transcription element (BTE)
31.
Nigro, P., Abe, J., and Berk, B.C. (2011) Flow shear stress
binding protein (BTEB) 3 and BTEB4, a novel Sp1 like
and atherosclerosis: a matter of site specificity, Antioxid.
protein, reveals a subfamily of transcriptional repressors for
Redox Signal., 15, 1405-1414.
the BTE site of the cytochrome P4501A1 gene promoter,
32.
Simmons, R.D., Kumar, S., and Jo, H. (2016) The role of
Biochem. J., 366, 873-882.
endothelial mechanosensitive genes in atherosclerosis and
13.
Mas, C., Lussier Price, M., Soni, S., Morse, T.,
omics approaches, Arch. Biochem. Biophys., 591, 111-131.
Arseneault, G., Di Lello, P., Lafrance Vanasse, J., Bieker, J.J.,
33.
Lu, L., Huang, W., Hu, W., Jiang, L., Li, Y., Wu, X., Yuan, D.,
and Omichinski, J.G. (2011) Structural and functional
and Li, M. (2019) Kruppel like factor 2 mediated anti prolif
characterization of an atypical activation domain in ery
erative and anti metastasis effects of simvastatin in p53 mutant
throid Kruppel like factor (EKLF), Proc. Natl. Acad. Sci.
colon cancer, Biochem. Biophys. Res. Commun., 511, 772-779.
USA, 108, 10484-10489.
34.
Heo, K.S., Berk, B.C., and Abe, J. (2016) Disturbed flow
14.
Presnell, J.S., Schnitzler, C.E., and Browne, W.E. (2015)
induced endothelial proatherogenic signaling via regulating
KLF/SP Transcription factor family evolution: expansion,
post translational modifications and epigenetic events,
diversification, and innovation in eukaryotes, Genome Biol.
Antioxid. Redox Signal., 25, 435-450.
Evol., 7, 2289-2309.
35.
Ballermann, B.J., Dardik, A., Eng, E., and Liu, A. (1998) Shear
15.
Schmitz, M.L., and de la Vega, L. (2015) New insight into
stress and the endothelium, Kidney Int. Suppl., 67, S100-108.
the role of histone deacetylases as coactivators of inflamma
36.
Givens, C., and Tzima, E. (2016) Endothelial mechanosig
tory gene expression, Antioxid. Redox Signal., 23, 85-98.
naling: does one sensor fit all? Antioxid. Redox Signal., 25,
16.
Wagner, T., Brand, P., Heinzel, T., and Krämer, O.H. (2014)
373-388.
Histone deacetylase 2 controls p53 and is a critical factor in
37.
Liu, H.B., Zhang, J., Xin, S.Y., Liu, C., Wang, C.Y., Zhao, D.,
tumorigenesis, Biochim. Biophys. Acta, 1846, 524-538.
and Zhang, Z.R. (2013) Mechanosensitive properties in the
17.
Anderson, K.P., Kern, C.B., Crable, S.C., and Lingrel,
endothelium and their roles in the regulation of endothelial
J.B. (1995) Isolation of a gene encoding a functional zinc
function, J. Cardiovasc. Pharmacol., 61, 461-470.
finger protein homologous to erythroid Krüppel like fac
38.
Ando, J., and Yamamoto, K. (2013) Flow detection and
tor: identification of a new multigene family, Mol. Cell.
calcium signalling in vascular endothelial cells, Cardiovasc.
Biol., 15, 5957-5965.
Res., 99, 260-268.
18.
Novodvorsky, P., and Chico, T.J. (2014) The role of the
39.
Snyder, J.L., McBeath, E., Thomas, T.N., Chiu, Y.J.,
transcription factor KLF2 in vascular development and
Clark, R.L., and Fujiwara, K. (2017) Mechanotransduction
disease, Prog. Mol. Biol. Transl. Sci., 124, 155-188.
properties of the cytoplasmic tail of PECAM 1, Biol. Cell,
19.
Jha, P., and Das, H. (2017) KLF2 in regulation of NF κB
109, 312-321.
mediated immune cell function and inflammation, Int. J.
40.
Conway, D.E., Coon, B.G., Budatha, M., Arsenovic, P.T.,
Mol. Sci., 18, E2383.
Orsenigo, F., Wessel, F., Zhang, J., Zhuang, Z., Dejana, E.,
БИОХИМИЯ том 85 вып. 1 2020
78
ТУРПАЕВ
Vestweber, D., and Schwartz, M.A. (2017) VE cadherin
human monocytic U937 cells exposed to various fluxes of
phosphorylation regulates endothelial fluid shear stress
nitric oxide, Free Radic. Biol. Med., 48, 298-305.
responses through the polarity protein LGN, Curr. Biol.,
57.
Xu, Q., Luan, T., Fu, S., Yang, J., Jiang, C., and Xia, F.
27, 2219-2225.
(2014) Effects of pitavastatin on the expression of VCAM 1
41.
Kwon, I.S., Wang, W., Xu, S., and Jin, Z.G. (2014) Histone
and its target gene miR 126 in cultured human umbilical
deacetylase 5 interacts with Krüppel like factor 2 and
vein endothelial cells, Cardiovasc. Ther., 32, 193-197.
inhibits its transcriptional activity in endothelium,
58.
Arefieva, T.I., Filatova, A.Y., Potekhina, A.V., and
Cardiovasc. Res., 104, 127-137.
Shchinova, A.M. (2018) Immunotropic effects and pro
42.
McSweeney, S.R., Warabi, E., and Siow, R.C. (2016) Nrf2
posed mechanism of action for 3 hydroxy 3 methyl
as an endothelial mechanosensitive transcription factor:
glutaryl coenzyme A reductase inhibitors (statins),
going with the flow, Hypertension, 67, 20-29.
Biochemistry (Moscow), 83, 874-889.
43.
Takabe, W., Warabi, E., and Noguchi, N. (2011) Anti
59.
Davies, J.T., Delfino, S.F., Feinberg, C.E., Johnson, M.F.,
atherogenic effect of laminar shear stress via Nrf2 activa
Nappi, V.L., Olinger, J.T., Schwab, A.P., and Swanson, H.I.
tion, Antioxid. Redox Signal., 15, 1415-1426.
(2016) Current and emerging uses of statins in clinical
44.
Turpaev, K.T. (2013) Keap1 Nrf2 signaling pathway:
therapeutics: a review, Lipid Insights, 9, 13-29.
mechanisms of regulation and role in protection of cells
60.
Ebert, R., Zeck, S., Meissner Weigl, J., Klotz, B.,
against toxicity caused by xenobiotics and electrophiles,
Rachner, T.D., Benad, P., Klein Hitpass, L., Rudert, M.,
Biochemistry (Moscow), 78, 111-126.
Hofbauer, L.C., and Jakob, F. (2012) Krüppel like factors
45.
Wardyn, J.D., Ponsford, A.H., and Sanderson, C.M. (2015)
KLF2 and 6 and Ki 67 are direct targets of zoledronic acid
Dissecting molecular cross talk between Nrf2 and NF κB
in MCF 7 cells, Bone, 50, 723-732.
response pathways, Biochem. Soc. Trans., 43, 621-626.
61.
Rogers, M.J., Crockett, J.C., Coxon, F.P., and
46.
Kumar, A., Lin, Z., SenBanerjee, S., and Jain, M.K.
Mönkkönen, J. (2011) Biochemical and molecular mech
(2005) Tumor necrosis factor alpha mediated reduction of
anisms of action of bisphosphonates, Bone, 49, 34-41.
KLF2 is due to inhibition of MEF2 by NF kappaB and
62.
Chu, H., Li, H., Guan, X., Yan, H., Zhang, X., Cui, X., Li, X.,
histone deacetylases, Mol. Cell. Biol., 25, 5893-5903.
and Cheng, M. (2018) Resveratrol protects late endothelial
47.
Lee, H.Y., Youn, S.W., Cho, H.J., Kwon, Y.W., Lee, S.W.,
progenitor cells from TNF α induced inflammatory dam
Kim, S.J., Park, Y.B., Oh, B.H., and Kim, H.S. (2013)
age by upregulating Krüppel like factor 2, Mol. Med. Rep.,
FOXO1 impairs whereas statin protects endothelial func
17, 5708-5715.
tion in diabetes through reciprocal regulation of Kruppel
63.
Bai, X., Yao, L., Ma, X., and Xu, X. (2018) Small mole
like factor 2, Cardiovasc. Res., 97, 143-152.
cules as SIRT modulators, Mini Rev. Med. Chem., 18,
48.
Kumar, A., Kim, C.S., Hoffman, T.A., Naqvi, A., Dericco, J.,
1151-1157.
Jung, S.B., Lin, Z., Jain, M.K., and Irani, K. (2011) p53
64.
Santos, J.C., Gotardo, E.M., Brianti, M.T., Piraee, M.,
Impairs endothelial function by transcriptionally repress
Gambero, A., and Ribeiro, M.L. (2014) Effects of yerba
ing Kruppel like factor 2, Arterioscler. Thromb. Vasc. Biol.,
maté, a plant extract formulation (“YGD”) and resveratrol
31, 133-141.
in 3T3 L1 adipogenesis, Molecules, 19, 16909-16924.
49.
Wu, W., Xiao, H., Laguna Fernandez, A., Villarreal, G.,
65.
Xu, Y., Liu, P., Xu, S., Koroleva, M., Zhang, S., Si, S., and
Wang, K.C., Geary, G.G., Zhang, Y., Wang, W.C., Huang, H.D.,
Jin, Z.G. (2017) Tannic acid as a plant derived polyphenol
Zhou, J., Li, Y.S., Chien, S., Garcia Cardena, G., and
exerts vasoprotection via enhancing KLF2 expression in
Shyy, J.Y. (2011) Flow dependent regulation of Kruppel
endothelial cells, Sci. Rep., 27, 6686.
like factor 2 is mediated by microRNA 92a, Circulation,
66.
Arçari, D.P., Santos, J.C., Gambero, A., and Ribeiro,
124, 633-641.
M.L. (2013) The in vitro and in vivo effects of yerba mate
50.
Xin, Y., Zhang, H., Jia, Z., Ding, X., Sun, Y., Wang, Q.,
(Ilex paraguariensis) extract on adipogenesis, Food Chem.,
and Xu, T. (2018) Resveratrol improves uric acid induced
141, 809-815.
pancreatic β cells injury and dysfunction through regula
67.
Jeon, H.J., Choi, H.S., Lee, Y.J., Hwang, J.H., Lee, O.H.,
tion of miR 126, Biomed. Pharmacother., 102, 1120-1126.
Seo, M.J., Kim, K.J., and Lee, B.Y. (2015) Seapolynol
51.
Manoharan, P., Basford, J.E., Pilcher Roberts, R.,
extracted from Ecklonia cava inhibits adipocyte differenti
Neumann, J., Hui, D.Y., and Lingrel, J.B. (2014) Reduced
ation in vitro and decreases fat accumulation in vivo,
levels of microRNAs miR 124a and miR 150 are associat
Molecules, 20, 21715-21731.
ed with increased proinflammatory mediator expression in
68.
Lee, J.E., and Ge, K. (2014) Transcriptional and epigenet
Krüppel like factor 2 (KLF2) deficient macrophages, J.
ic regulation of PPARgamma expression during adipogen
Biol. Chem., 289, 31638-31646.
esis, Cell Biosci., 4, 29.
52.
Marin, T., Gongol, B., Chen, Z., Woo, B., Subramaniam, S.,
69.
Kim, S.J., Xiao, J., Wan, J., Cohen, P., and Yen, K. (2017)
Chien, S., and Shyy, J.Y. (2013) Mechanosensitive
Mitochondrially derived peptides as novel regulators of
microRNAs role in endothelial responses to shear stress
metabolism, J. Physiol., 595, 6613-6621.
and redox state, Free Radic. Biol. Med., 64, 61-68.
70.
Wang, X., Wu, Z., He, Y., Zhang, H., Tian, L., Zheng, C.,
53.
Chu, U.B., Duellman, T., Weaver, S.J., Tao, Y., and Yang, J.
Shang, T., Zhu, Q., Li, D., and He, Y. (2018) Humanin
(2015) Endothelial protective genes induced by statin are
prevents high glucose induced monocyte adhesion to
mimicked by ERK5 activation as triggered by a drug com
endothelial cells by targeting KLF2, Mol. Immunol., 101,
bination of FTI 277 and GGTI 298, Biochim. Biophys.
245-250.
Acta, 1850, 1415-1425.
71.
Wang, D., Song, Y., Zhang, J., Pang, W., Wang, X., Zhu, Y.,
54.
Zhao, J., Natarajan, S.K., Chronos, N., and Singh, J.P.
and Li, X. (2017) AMPK KLF2 signaling pathway medi
(2015) Cerivastatin represses atherogenic gene expression
ates the proangiogenic effect of erythropoietin in endothe
through the induction of KLF2 via isoprenoid metabolic
lial colony forming cells, Am. J. Physiol. Cell Physiol., 313,
pathways, Cell. Mol. Biol. Lett., 20, 825-839.
C674-C685.
55.
Jeong, A., Suazo, K.F., Wood, W.G., Distefano, M.D., and
72.
Sako, K., Fukuhara, S., Minami, T., Hamakubo, T., Song, H.,
Li, L. (2018) Isoprenoids and protein prenylation: implications
Kodama, T., Fukamizu, A., Gutkind, J.S., Koh, G.Y., and
in the pathogenesis and therapeutic intervention of Alzheimer’s
Mochizuki, N. (2009) Angiopoietin 1 induces Kruppel
disease, Crit. Rev. Biochem. Mol. Biol., 53, 279-310.
like factor 2 expression through a phosphoinositide 3
56.
Turpaev, K., Glatigny, A., Bignon, J., Delacroix, H., and
kinase/AKT dependent activation of myocyte enhancer
Drapier, J.C. (2010) Variation in gene expression profiles of
factor 2, J. Biol. Chem., 284, 5592-5601.
БИОХИМИЯ том 85 вып. 1 2020
ФАКТОР ТРАНСКРИПЦИИ KLF2
79
73.
Турпаев К.Т. (2017) Гены и регуляторные системы кле
82. Das, M., Lu, J., Joseph, M., Aggarwal, R., Kanji, S.,
ток, зависимые от NO и модификации рецепторных ти
McMichael, B.K., Lee, B.S., Agarwal, S., Ray Chaudhury, A.,
ольных групп, Автореф. дисс. докт. наук, Институт мо
Iwenofu, O.H., Kuppusamy, P., Pompili, V.J., Jain, M.K.,
лекулярной биологии РАН, Москва.
and Das, H. (2012) Kruppel like factor 2 (KLF2) regulates
74.
Tian, R., Li, R., Liu, Y., Liu, J., Pan, T., Zhang, R., Liu, B.,
monocyte differentiation and functions in mBSA and IL
Chen, E., Tang, Y., and Qu, H. (2019) Metformin amelio
1β induced arthritis, Curr. Mol. Med., 12, 113-125.
rates endotoxemia induced endothelial pro inflammatory
83. Zhong, F., Lee, K., and He, J.C. (2018) Role of Krüppel
responses via AMPK dependent mediation of HDAC5 and
like factor 2 in kidney disease, Nephrology (Carlton), 23,
KLF2, Biochim. Biophys. Acta Mol. Basis Dis., 1865,
Suppl. 4, 53-56.
1701-1712.
84. Winkelmann, R., Sandrock, L., Kirberg, J., Jäck, H.M., and
75.
Triggle, C.R., and Ding, H. (2016) Metformin is not just an
Schuh, W. (2014) KLF2 - a negative regulator of pre B cell
antihyperglycaemic drug but also has protective effects on the
clonal expansion and B cell activation, PLoS One, 29, e97953.
vascular endothelium, Acta Physiol. (Oxf.), 219, 138-151.
85. Nayak, L., Goduni, L., Takami, Y., Sharma, N., Kapil, P.,
76.
Chistiakov, D.A., Orekhov, A.N., and Bobryshev, Y.V.
Jain, M.K., and Mahabeleshwar, G.H. (2013) Kruppel
(2017) Treatment of cardiovascular pathology with epige
like factor 2 is a transcriptional regulator of chronic and
netically active agents: focus on natural and synthetic
acute inflammation, Am. J. Pathol., 182, 1696-1704.
inhibitors of DNA methylation and histone deacetylation,
86. Pabbisetty, S.K., Rabacal, W., Volanakis, E.J., Parekh, V.V.,
Int. J. Cardiol., 227, 66-82.
Olivares Villagómez, D., Cendron, D., Boyd, K.L., Van
77.
Xu, Y., Xu, S., Liu, P., Koroleva, M., Zhang, S., Si, S., and
Kaer, L., and Sebzda, E. (2016) Peripheral tolerance can
Jin, Z.G. (2017) Suberanilohydroxamic acid as a pharma
be modified by altering KLF2 regulated Treg migration,
cological Kruppel like factor 2 activator that represses vas
Proc. Natl. Acad. Sci. USA, 113, E4662-E4670.
cular inflammation and atherosclerosis, J. Am. Heart
87. Li, M., Wang, X., Fu, W., He, S., Li, D., and Ke, Q. (2011)
Assoc., 6, e007134.
CD4+CD25+Foxp3+ regulatory T cells protect endothelial
78.
Das, M., Laha, D., Kanji, S., Joseph, M., Aggarwal, R.,
function impaired by oxidized low density lipoprotein via
Iwenofu, O.H., Pompili, V.J., Jain, M.K., and Das, H.
the KLF 2 transcription factor, Cell. Physiol. Biochem., 28,
(2019) Induction of Krüppel like factor 2 reduces K/BxN
639-648.
serum induced arthritis, J. Cell. Mol. Med.,
23,
88. Pabbisetty, S.K., Rabacal, W., Maseda, D., Cendron, D.,
1386-1395.
Collins, P.L., Hoek, K.L., Parekh, V.V., Aune, T.M., and
79.
Hadden, M.J., and Advani, A. (2018) Histone deacetylase
Sebzda, E. (2014) KLF2 is a rate limiting transcription
inhibitors and diabetic kidney disease, Int. J. Mol. Sci., 19,
factor that can be targeted to enhance regulatory T cell
E2630.
production, Proc. Natl. Acad. Sci. USA, 111, 9579-9584.
80.
Yoon, S., and Eom, G.H. (2016) HDAC and HDAC
89. Pisanti, S., Picardi, P., Ciaglia, E., D’Alessandro, A., and
inhibitor: from cancer to cardiovascular diseases,
Bifulco, M. (2014) Novel prospects of statins as therapeu
Chonnam. Med. J., 52, 1-11.
tic agents in cancer, Pharmacol. Res., 88, 84-98.
81.
Dekker, R.J., van Thienen, J.V., Rohlena, J., de Jager, S.C.,
90. Fullerton, M.D. (2016) AMP activated protein kinase and
Elderkamp, Y.W., Seppen, J., de Vries, C.J., Biessen, E.A.,
its multifaceted regulation of hepatic metabolism, Curr.
van Berkel, T.J., Pannekoek, H., and Horrevoets, A.J.
Opin. Lipidol., 27, 172-80.
(2005) Endothelial KLF2 links local arterial shear stress
91. Marcelo, K.L., Means, A.R., and York, B, (2016) The
levels to the expression of vascular tone regulating genes,
Ca(2+)/calmodulin/CaMKK2 axis: nature’s metabolic
Am. J. Pathol., 167, 609-618.
CaMshaft, Trends Endocrinol. Metab., 27, 706-718.
TRANSCRIPTION FACTOR KLF2 AND ITS ROLE
IN THE REGULATION OF INFLAMMATORY PROCESSES
Review
K. T. Turpaev
Center for Theoretical Problems of Physicochemical Pharmacology, Russian Academy of Sciences,
119991 Moscow, Russia; E mail: kyril.turpaev@yahoo.com
Received May 11, 2019
Revised August 2, 2019
Accepted October 7, 2019
KLF2 is a member of the Krüppel like transcription factor family of proteins containing highly conserved DNA bind
ing zinc finger domains. KLF2 participates in the differentiation and regulation of the functional activity of mono
cytes, T lymphocytes, adipocytes, and vascular endothelial cells. The activity of KLF2 is controlled by several regu
latory systems, including the MEKK2,3/MEK5/ERK5/MEF2 MAP kinase cascade, Rho family G proteins, histone
acetyltransferases CBP and p300, and histone deacetylases HDAC4 and HDAC5. Activation of KLF2 in endothelial
cells induces eNOS expression and provides vasodilatory effect. Many KLF2 dependent genes participate in the sup
pression of blood coagulation and aggregation of T cells and macrophages with the vascular endothelium, thereby pre
venting atherosclerosis progression. KLF2 can have a dual effect on the gene transcription. Thus, it induces expres
sion of multiple genes but suppresses transcription of NF κB dependent genes. Transcription factors KLF2 and NF
κB are reciprocal antagonists. KLF2 inhibits induction of NF κB dependent genes, whereas NF κB downregulates
KLF2 expression. KLF2 mediated inhibition of NF κB signaling leads to the suppression of cell response to the pro
inflammatory cytokines IL 1β and TNF and results in the attenuation of inflammatory processes.
Keywords: KLF2, zinc fingers, regulation of transcription, pro inflammatory cytokines, endothelium
БИОХИМИЯ том 85 вып. 1 2020