БИОХИМИЯ, 2020, том 85, вып. 1, с. 93 - 103
УДК 577.112
ШАПЕРОННАЯ И ИММУНОГЛОБУЛИНСВЯЗЫВАЮЩАЯ
АКТИВНОСТИ Skp ИЗ Yersinia pseudotuberculosis*
© 2020
Е.В. Сидорин**, В.А. Хоменко, Н.Ю. Ким, Т.Ф. Соловьева
Тихоокеанский институт биоорганической химии им. Г.Б. Елякова ДВО РАН,
690022 Владивосток, Россия; электронная почта: sev1972@mail.ru
Поступила в редакцию 20.05.2019
После доработки 20.08.2019
Принята к публикации 10.09.2019
Данная работа посвящена изучению шаперонной и иммуноглобулинсвязывающей активностей рекомбинант
ного белка Skp (rSkp) из Yersinia pseudotuberculosis с помощью методов динамического рассеяния света и по
верхностного плазмонного резонанса. В качестве белков субстратов использовали коммерческие образцы
поликлонального IgG человека, а также Fc и Fab фрагменты IgG человека. Было показано, что активность
rSkp сильно зависит от рН среды. Наиболее устойчивые низкомолекулярные комплексы с гидродинамичес
ким радиусом до 10 нм шаперон образует с белками субстратами при кислом значении рН буферного раст
вора. В этих условиях rSkp Y. pseudotuberculosis показывает наибольшую устойчивость к самоассоциации,
максимальную аффинность связывания с IgG человека и его Fc и Fab фрагментами и наиболее эффектив
но препятствует их агрегации, т.е. демонстрирует максимальную шаперонную активность. По мере увеличе
ния рН среды сила взаимодействия rSkp с IgG и его фрагментами снижается, шаперон не может полностью
предотвратить агрегацию белковых субстратов, но значительно замедляет этот процесс. Полученная инфор
мация может представлять практический интерес, поскольку стабильность терапевтических препаратов IgG
является важной проблемой безопасности и эффективности их применения в медицине.
КЛЮЧЕВЫЕ СЛОВА: шаперон Skp, Yersinia pseudotuberculosis, иммуноглобулин G человека, Fc и Fab
фрагменты IgG, белок белковые взаимодействия, динамическое рассеяние света, поверхностный плазмон
ный резонанс.
DOI: 10.31857/S0320972520010078
В современной литературе накоплено боль
тами Skp как шаперона являются белки наруж
шое количество экспериментальных данных о
ной мембраны бактерий. Skp избирательно свя
полифункциональной активности белков. Од
зывает несвернутые белки наружной мембраны,
ним из ярких примеров такого поведения био
когда они после транслокации через плазмати
полимеров является белок шаперон Skp (seven
ческую мембрану перемещаются в периплазму,
teen kilodalton protein), широко представленный
и защищает их от агрегации [5-7]. Кроме того,
в энтеробактериях. Он относится к семейству
Skp также функционирует как шаперон, кото
гомологичных низкомолекулярных белков
рый помогает в сворачивании растворимых бел
(14-20 кДа) с ярко выраженными основными
ков в периплазме бактерий [8]. В этом качестве
свойствами (pI 9-10) [1-4]. Главными субстра
Skp при его коэкспрессии увеличивает выход и
способствует корректному фолдингу экспресси
Принятые сокращения: rSkp - рекомбинантный бе
рованных белков, включая полноразмерные им
лок Skp (seventeen kilodalton protein); IgG - иммуноглобу
муноглобулины (антитела), их Fab фрагменты и
лин G человека; ДРС - динамическое рассеяние света; многочисленные одноцепочечные производные
Z average - средний гидродинамический радиус частиц об
[9-11]. Наряду со способностью взаимодейство
разца (при анализе кумулянтов); RH - гидродинамический
радиус частиц (при анализе распределения); ППР - поверх
вать с белками наружной мембраны в качестве
ностный плазмонный резонанс; KD - кинетическая конс
шаперона, белки Skp обладают и другими свой
танта диссоциации комплекса; kd
- константа скорости ствами, которые могут быть биологически и фи
диссоциации комплекса; ka - константа скорости ассоциа
зиологически значимыми. Они проявляют ли
ции комплекса; RU - резонансная единица (resonance unit).
пополисахарид и ДНК связывающую актив
* Первоначально английский вариант рукописи опубли
ности [1, 2, 12, 13] и являются хемоаттрактанта
bio.msu.ru/biokhimiya, в рубрике «Papers in Press», BM19
ми для моноцитов и полиморфноядерных лей
150, 02.12.2019.
коцитов [14]. Между Skp и антигеном гистосов
** Адресат для корреспонденции.
местимости человека HLA B27 существует мо
93
94
СИДОРИН и др.
лекулярная мимикрия: в их аминокислотных
В качестве буферных систем применяли PBS
последовательностях имеются гомологичные
(10 мМ NaH2PO4, 137 мM NaCl, 2 мM KCl, рН 7,4);
участки [15]. Это позволило предположить, что
50 или 100 мМ СH3COONa/СH3COOH, рН 5,0
данные белки могут обладать свойствами анти
(буфер А); 50 мМ Tris НСl, pH 7,4 (буфер Б); 50
генов, иммунологически перекрестно реагиру
или 100 мМ Tris НСl, pH 8,0 (буфер В); 50 мМ
ющих с HLA B27. В то же время показано, что
СH3COONa/СH3COOH, рН 6,0 (буфер Г).
гомологичные участки в последовательности
Подготовка образцов IgG человека, Fc5 и Fab5
Skp не распознаются гуморальной иммунной
фрагментов IgG человека, rSkp из Y. pseudotuber
системой пациентов с заболеваниями, связан
culosis. С целью подготовки коммерческого об
ными с HLA B27 [16].
разца каждого белка, выбранного в качестве
Ранее нами было показано, что Skp Yersinia
белка субстрата в реакции связывания с Skp
pseudotuberculosis обладает свойством неиммун
Y. pseudotuberculosis, использовали гель фильт
ным способом (минуя антигенсвязывающие
рацию. Навеску каждого лиофилизованного
участки IgG (антител)) связывать IgG человека и
белка растворяли в воде, полученные растворы
кролика как в виде мономера Skp [17], так и в
пропускали через фильтр 0,45 мкм и проводили
форме гомотримера (Skp3) [18]. С помощью
гель фильтрацию на колонке Superdex
200
компьютерного моделирования были построе
10/300 GL, предварительно уравновешенной
ны модели пространственной структуры Skp,
раствором PBS. Образцы наносили на колонку в
Skp3 и его комплексов с Fc и Fab фрагментами
объеме 0,25 мл, скорость элюции составляла
IgG1 человека. На основании полученных моде
0,5 мл/мин. Фракции объемом 0,5-0,7 мл, со
лей было выявлено, что наиболее вероятные
державшие белок, собирали и определяли ин
сайты связывания на молекуле иммуноглобули
тенсивность оптического поглощения элюата
на находятся в области Fc и Fab фрагментов.
при 280 нм. Фракции объединяли по результа
Построенные модели свидетельствуют о том,
там Ds Na ПААГ электрофореза и концентри
что взаимодействие сразу двух молекул Skp3 с
ровали с помощью центрифужных пробирок
молекулой IgG вполне вероятно. Нами было
для концентрирования (диаметр пор 3 кДа). Об
также установлено, что Skp Y. pseudotuberculosis
щее содержание белка в полученных образцах
связывается с порообразующим белком OmpF и
IgG, Fc и Fab фрагментов определяли методом
фосфолипазой А из наружной мембраны этой
Брэдфорд [20] с использованием лизоцима в ка
бактерии [19].
честве калибровочного белка.
Целью данной работы являлось определение
Рекомбинантный белок Skp (rSkp) Y. pseudo*
качественных и количественных характеристик
tuberculosis экспрессировали в E. coli, выделяли
шаперонной и связывающей активностей Skp в
из клеток и очищали, как описано нами ранее
отношении IgG человека и его Fc и Fab фраг
[18]. Концентрацию rSkp Y. pseudotuberculosis оп
ментов при разных значениях pH среды.
ределяли по УФ спектрам в максимуме погло
щения при 280 нм, принимая величину А0,1%1 см
равной 0,185 (Swiss Prot, P31520 и Q667J8).
МЕТОДЫ ИССЛЕДОВАНИЯ
Ds5Na5ПААГ5электрофорез. Электрофорез
проводили в присутствии Ds Na по методу Лэмм
Материалы. В работе использовали Superdex
ли [21]. Все образцы для электрофореза гото
200 10/300 GL («GE Healthcare», США), акрила
вили без прогревания при 100 °С в буфере для
мид («Serva», Германия); центрифужные пробир
образцов, не содержавшем меркаптоэтанол. В
ки для концентрирования с диаметром пор 3 кДа
качестве маркеров использовали набор окра
Amicon Ultra («Merck Millipore», Германия); Ds
шенных белков с молекулярными массами 11,
Na, 96 луночные микропланшеты ProteOn, сен
17, 24, 33, 40, 55, 72, 100 и 130 кДа. Белки, разде
сорный чип GLC («Bio Rad», США); набор ок
ленные в геле, окрашивали раствором кумасси
рашенных белков маркеров («Fermentas», Лит
R 250 в 10% ной уксусной кислоте и 45% ном
ва); кумасси R 250 («Sigma», США); IgG челове
этаноле.
ка и Fc фрагмент IgG человека
(«ICN
Метод динамического рассеяния света (ДРС).
Biomedicals», США); Fab фрагмент IgG человека
Размер частиц, образованных rSkp Y. pseudotu*
(«MP Biomedicals», США); БСА, овальбумин,
berculosis, белками субстратами и их комплекса
химотрипсиноген, миоглобин, цитохром с («ICN
ми с шапероном в растворе, в зависимости от
Biomedicals», США); целлюлозные мембранные
времени инкубации и рН (5,1; 6,7 и 7,9) опреде
фильтры 0,45 мкм («Agilent», США); PBS, рН 7,4
ляли методом ДРС на приборе ZetaSizer Nano
(«Helicon», Россия). Все остальные реактивы
ZS («Malvern», Великобритания), оснащенном
имели квалификацию х.ч. («Реахим», Россия),
He Ne лазером (λ = 633 нм, 4 мВт), при угле
их использовали без дополнительной очистки.
173°. Измерения проводили в кювете 10 × 10 мм
БИОХИМИЯ том 85 вып. 1 2020
ИММУНОГЛОБУЛИНСВЯЗЫВАЮЩАЯ АКТИВНОСТЬ Skp
95
при комнатной температуре (20 °С). Время на
sis с IgG человека и его Fc и Fab фрагментами
копления данных составляло 15-30 мин. Перед
использовали метод ППР. Кинетику связывания
определением размеров частиц готовили смесь
rSkp (аналит) с иммобилизованными на поверх
буферных растворов: 0,24 мл PBS + 0,34 мл
ности сенсорного чипа GLC белками субстра
50 мМ буфера А + 0,62 мл либо 100 мМ буфера А
тами (лиганды) определяли с помощью матрич
(рН 5,1), либо 50 мМ буфера Б (рН 6,7), либо
ного биосенсора ProteOn XPR 36 («Bio Rad»,
100 мМ буфера В (рН 7,9). При выполнении
США). Ковалентную иммобилизацию лигандов
экспериментов, в зависимости от задачи иссле
на чипе проводили с использованием набора ре
дования, использовали PBS, содержавший либо
активов Amin Coupling Kit («Bio Rad», США)
IgG
(0,15 мг/мл), либо Fc фрагмент IgG
согласно инструкции производителя. Уровень
(0,12 мг/мл), либо Fab фрагмент IgG (0,12 мг/мл),
связывания лиганда контролировали по изме
а также 50 мМ буфер А, содержавший rSkp
нению сигнала биосенсора (RU - resonance unit,
(0,28 мг/мл).
резонансная единица). Плотность посадки сос
Расчет Z average (среднего гидродинамичес
тавила 1420 RU для IgG, 690 RU для Fc фраг
кого радиуса частиц образца) и RH (гидродина
мента и 1060 RU для Fab фрагмента IgG. В каче
мического радиуса) частиц при анализе их объ
стве контрольного канала служил канал без им
емного распределения выполняли с помощью
мобилизованного белка. В ходе выполнения
программного обеспечения к прибору (ZetaSizer
экспериментов использовали буферные систе
Nano ZS, «Malvern», Великобритания).
мы: 50 мМ буферы А, Б, В и Г. Концентрацию
Спектры КД. Спектры КД регистрировали на
аналита изменяли в интервале 0,1-5,0 мкМ. В
Chirascan plus CD спектрометре
(«Applied
каждом эксперименте стадии ассоциации и дис
Photophysics», Великобритания) в кварцевых
социации аналита проводили при скорости по
кюветах с длиной оптического пути 0,1 и 1 см
тока 25 мкл/мин в течение 500 с. Все экспери
для съемки спектров в пептидной и ароматичес
менты осуществляли при температуре 25 °С. Ре
кой областях соответственно. В пептидной об
генерацию поверхности сенсорного чипа вы
ласти спектра КД (190-240 нм) рассчитывали
полняли 50 мМ раствором NaOH при скорости
эллиптичность [θ] среднего остатка, принимая
потока 30 мкл/мин в течение 60 с. Для удаления
молекулярную массу последнего равной 110 Да,
возможных артефактов связывания экспери
по формуле:
ментальные данные, полученные на реакцион
ных поверхностях лиганд-аналит, последова
[θ] = [θ]набл S × 110/(Cd) (град м2 дмоль-1),
тельно обрабатывали путем вычитания резуль
татов, полученных на контрольных поверхнос
где S - чувствительность шкалы прибора; C -
тях (reference surfaces) и при введении буферных
концентрация белка, мг/мл; d - толщина кюве
систем без образцов белка (blank injections).
ты, см. В ароматической области спектра КД
Дальнейший анализ сенсограмм проводили с
(240-320 нм) рассчитывали молярную эллип
помощью программного обеспечения ProteOn
тичность [θ]М, принимая молекулярную массу
Manager 3.0 («Bio Rad», США).
белка равной 16,1 кДа. Для снятия спектров КД
rSkp при разных значениях pH среды белок пе
реводили в составные буферные растворы со
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
значениями рН 5,1; 6,7 и 7,9, как описано выше.
Определение олигомерной структуры rSkp
Влияние pH среды на агрегацию Skp Y. pseudo
Y. pseudotuberculosis. Подтверждение олигомер
tuberculosis. Наши наблюдения показали, что
ной структуры rSkp Y. pseudotuberculosis прово
rSkp Y. pseudotuberculosis может длительное вре
дили в нативных условиях с помощью FPLC
мя храниться в буферных растворах с низкими
хроматографа («Amersham Pharmacia Biotech»,
значениями рН (4,0-5,0), сохраняя иммуногло
США) в буфере А методом гель фильтрации на
булинсвязывающую активность, но достаточно
колонке Superdex 200 10/300 GL, как описано
быстро (в течение недели) агрегирует и выпада
нами ранее [18]. Колонку предварительно ка
ет в осадок при нейтральных и основных значе
либровали с помощью белков с известными мо
ниях pH. Поэтому перед изучением шаперон
лекулярными массами: БСА - 67, овальбумин -
ной и иммуноглобулинсвязывающей активнос
45, химотрипсиноген - 24, миоглобин - 18, ци
тей Skp Y. pseudotuberculosis методом динамичес
тохром с - 13 кДа. Относительная ошибка опре
кого рассеяния света (ДРС) было исследовано
деления молекулярной массы составила 7%.
поведение rSkp в растворах в зависимости от
Метод поверхностного плазмонного резонанса
значения рН и времени инкубации. Получен
(ППР). Для получения количественных харак
ные результаты представлены на рис. 1 и в
теристик взаимодействия Skp Y. pseudotuberculo*
табл. 1.
БИОХИМИЯ том 85 вып. 1 2020
96
СИДОРИН и др.
а
б
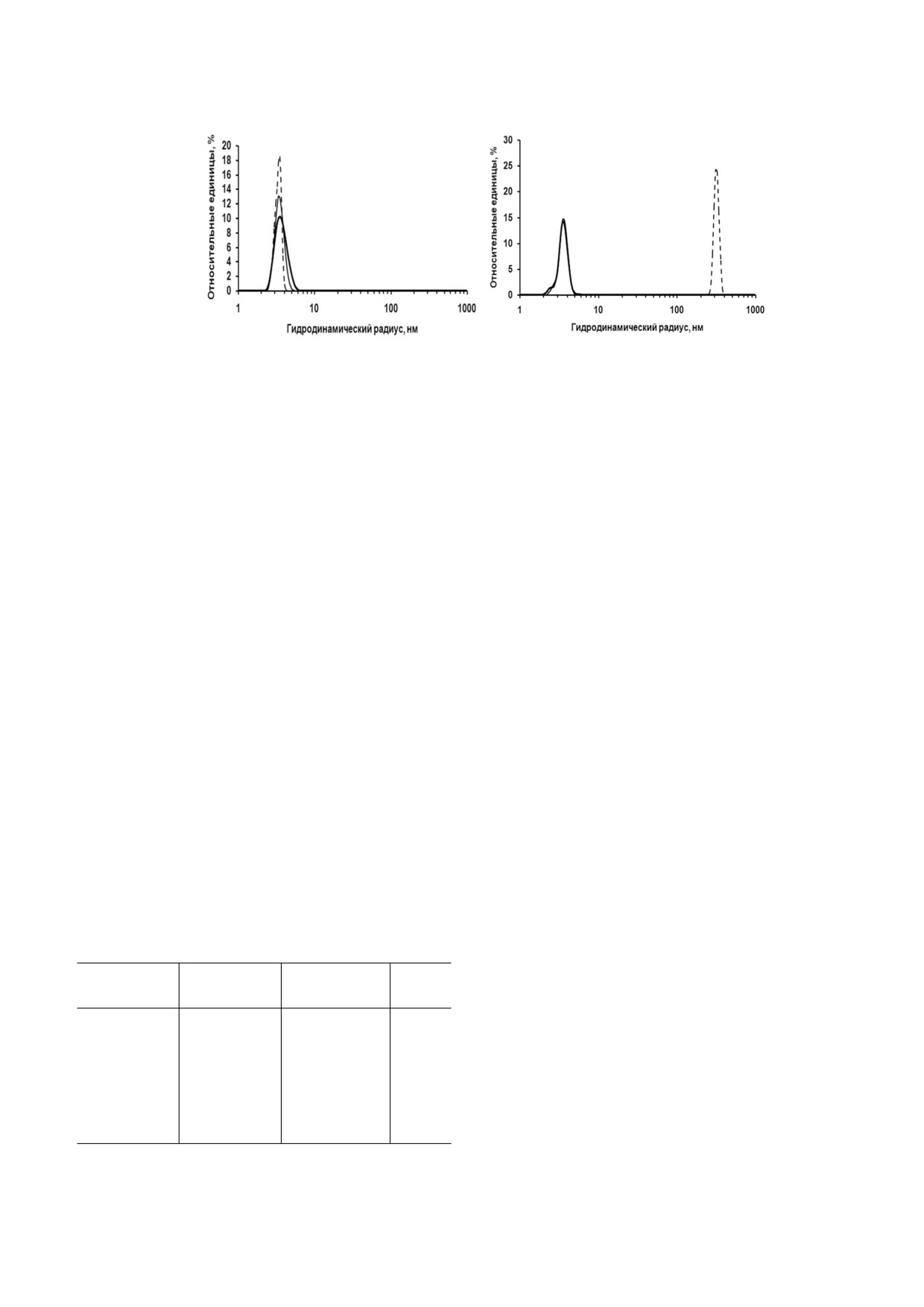
Рис. 1. Объемное распределение по размеру частиц rSkp Y. pseudotuberculosis: а - в буфере с pH 5,0, инкубация в течение
6 дней (сплошная толстая линия); в буфере с pH 6,7, инкубация в течение 4 ч (сплошная тонкая линия) и 24 ч (пунктир
ная линия); б - в буфере с pH 7,9, инкубация в течение 1 ч (сплошная толстая линия), 4 ч (сплошная тонкая линия) и 24 ч
(пунктирная линия)
По данным метода ДРС, rSkp в 50 мМ нат
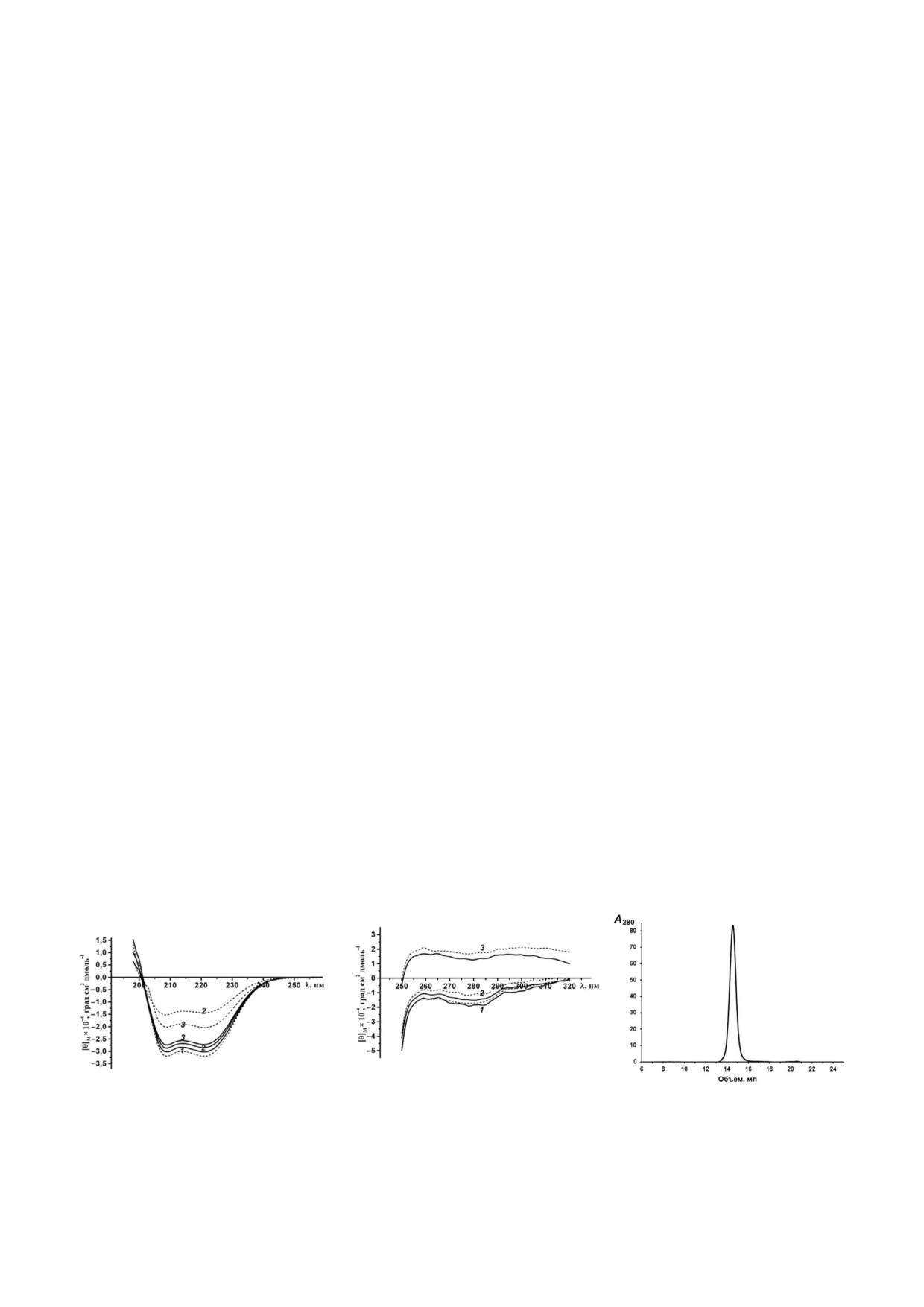
Пространственная структура rSkp. Влияние
рий ацетатном буфере (рН 5,0) имел в течение
рН на структуру белка изучали с помощью КД
шести дней мономодальное распределение с
спектроскопии и ДРС. Спектры КД rSkp в бу
преимущественным содержанием частиц с RH и
ферных растворах с рН 5,0; 6,7 и 7,9 в дальней
Z average, равными 3,8 и 6,4 нм соответственно
УФ области имеют одинаковую интенсивность
(рис. 1, а; табл. 1). Подобное распределение час
сигнала и форму с минимумами при 208 и 222 нм,
тиц шаперона по RH также наблюдалось в тече
что указывает на преобладание в белке α струк
ние первых 4 ч в растворах с нейтральным и ще
туры (рис. 2, а). Спектры остаются неизменны
лочным значениями рН, но при этом величина
ми при инкубации белка в растворе в течение
Z average образцов резко возрастала (табл. 1),
первых 24 ч (1, 4 и 24 ч). При дальнейшей выде
что свидетельствует о начале процесса самоассо
ржке rSkp (72 ч) при рН 5,0 характеристики
циации белка. Дальнейшая инкубация растворов
спектра практически не изменяются, а при
в течение 24 ч приводила к еще большему увели
рН 6,7 и 7,9 заметно уменьшается амплитуда
чению Z average и появлению изменений в рас
спектров при сохранении их формы, что может
пределении частиц по размерам: в растворе с
быть связано с присутствием в растворе белко
рН 6,7 преимущественно сохранялись мелкие
вых агрегатов, которые не определяются мето
частицы (3,6 нм), в то время как в буфере с
дом КД спектроскопии [22].
рН 7,9 частиц с RH < 200 нм не наблюдалось
Спектры КД rSkp в ближней УФ области
(рис. 1, б). Таким образом, можно сделать вывод
были использованы для выявления возможных
о том, что при изменении значений рН среды от
трансформаций в третичной структуре белка
кислых к щелочным наблюдаются самоассоциа
при изменении рН среды (рис. 2, б). Как изве
ция и агрегация rSkp Y. pseudotuberculosis, и ско
стно, спектры в области 260-320 нм обусловле
рость этих процессов увеличивается с возраста
ны ароматическими аминокислотами. Зрелый
нием рН в направлении к изоэлектрической точ
Skp имеет два остатка Tyr и четыре остатка Phe
ке белка (pI 9,33).
на мономер, часть из которых находится в
конформационно гибкой области молекулы
(α спиральный домен в форме щупалец) [18,
Таблица 1. Средние значения гидродинамических радиусов
) rSkp Y. pseudotuberculosis в водных раство
(Z average и RH
23]. Как видно на рис. 2, б, наибольшую ампли
рах при разных значениях pH и сроках инкубации
туду и наиболее выраженную тонкую структу
Значение рН
Время
Z average, нм
RH, нм
ру (пики при 260 и 270 нм, характерные для
инкубации
Phe, и при 278 и 285 нм, относящиеся к Tyr)
имеет спектр белка в буфере с рН 5,0. При рН
5,0
6 дней
6,4
3,8
6,7 наблюдаются небольшие изменения в
6,7
4 ч
61,1
3,7
спектре: немного уменьшается величина сиг
24 ч
341,2
3,5
нала и высота пиков. Возрастание рН до 7,9
приводит к изменению знака спектра, дальней
7,9
1 ч
155,3
4,0
шему уменьшению его амплитуды и сглажива
4 ч
153,9
4,6
24 ч
382,6
319,2
нию при сохранении характеристических пи
ков. Увеличение времени инкубации белка от 1
БИОХИМИЯ том 85 вып. 1 2020
ИММУНОГЛОБУЛИНСВЯЗЫВАЮЩАЯ АКТИВНОСТЬ Skp
97
до 72 ч не приводит к существенным изменени
взаимодействия и агрегации молекул IgG
ям в спектрах.
[28-30] и факторов, влияющих на эти процессы
Согласно результатам ДРС, в интервале рН
[31-34], представляет не только фундаменталь
5,0-8,0 наблюдается симметричное мономо
ный, но и прикладной интерес при разработке
дальное распределение rSkp с небольшой шири
лекарственных препаратов. В данной работе мы
ной и RH, равным (3,7 ± 0,3) нм (рис. 1). Как
наблюдали агрегацию IgG, Fc и Fab фрагмен
видно на рис. 2, в, рекомбинантный белок элю
тов при переводе из PBS в буферные растворы с
ируется с колонки Superdex 200 10/300 GL в ви
меньшей ионной силой с кислым, нейтральным
де одного симметричного пика, который соот
или основным значениями pH. Исследуемые
ветствует белку с кажущейся молекулярной мас
белки демонстрировали увеличение Z average,
сой (45,2 ± 3,0) кДа и, следовательно, тример
ширины распределения по размерам (мульти
ной форме шаперона [18].
модальное распределение) и относительного со
Таким образом, увеличение рН от 5,0 до 7,9
держания (%) частиц с RH > 10 нм. На рис. 3
не оказывает влияния на вторичную и олигомер
приведены диаграммы относительного содер
ную структуру rSkp, но, возможно, вызывает не
жания (%) частиц при их объемном распределе
которую дестабилизацию третичной структуры.
нии по размеру (RH) и Z average частиц, образо
Влияние rSkp на агрегацию IgG и его фрагмен5
ванных белками субстратами при разной дли
тов при разных значениях pH среды. В качестве
тельности их инкубации в растворах при трех
белков субстратов для связывания с шапероном
значениях рН (5,1; 6,7 и 7,9 соответственно) в
rSkp использовали коммерческие образцы по
отсутствие (рис. 3, а-в) и в присутствии rSkp
ликлонального IgG, Fc и Fab фрагменты IgG.
Y. pseudotuberculosis (рис. 3, г-е).
Перед проведением экспериментов исследуе
Как можно видеть из диаграмм, IgG, Fc и
мые белки дополнительно очищали с помощью
Fab фрагменты агрегируют с разной скоростью
гельпроникающей хроматографии на колонке
в зависимости от значения рН среды. При кис
Superdex 200 10/300 GL, уравновешенной раст
лых и щелочных значениях pH (рис. 3, а, в) ско
вором PBS. По данным ДРС, образец иммуно
рость агрегации исследуемых белков намного
глобулина в PBS имел мономодальное объемное
выше, чем в нейтральной среде (рис. 3, б), при
распределение по размерам, RH составлял (5,6 ±
этом в кислых условиях она максимальна.
± 0,5) нм, что согласуется с размером мономера
Рост относительного содержания мелких
IgG, приведенным в литературе [24-27], и вели
частиц с RH менее 10 и 200 нм при увеличении
чину Z average, равную 17 нм. Образцы Fc и
времени выдерживания в кислых растворах до
Fab фрагментов IgG также демонстрировали
24 ч и более (рис. 3, а), вероятно, связан с обра
мономодальное объемное распределение по
зованием крупных седиментирующих агрегатов,
размерам и имели величины Z average 14 и 11 нм
которые выпадают в осадок из раствора и не
соответственно и RH (3,3 ± 0,3) нм, одинаковые
учитываются при анализе.
для обоих белков.
C целью изучения возможных шаперонных
В последние годы большое внимание уде
свойств rSkp Y. pseudotuberculosis в отношении
ляется изучению стабильности биофармацев
IgG и его фрагментов, т.е. его способности пред
тических препаратов на основе биологически
отвращать агрегацию исследуемых белков, об
активных белков. Одним из таких белков, по
разуя с ними растворимые комплексы, в раство
лучивших широкое применение в медицине,
ры иммуноглобулинов с разными значениями
является IgG. Изучение различных аспектов
рН добавляли шаперон в молярном соотноше
а
б
в
Рис. 2. Спектры КД rSkp в дальней (а) и ближней (б) областях УФ спектра при значениях pH среды 5,0 (1), 6,7 (2) и 7,9 (3)
в течение 1 ч (сплошная линия) и 72 ч (пунктирная линия). Гель фильтрация rSkp (в) на колонке Superdex 200 HR в 50 мМ
натрий ацетатном буфере, pH 5,0
7 БИОХИМИЯ том 85 вып. 1 2020
98
СИДОРИН и др.
Рис. 3. Объемное распределение по размеру (RH) и Z average частиц, образованных белками субстратами в растворе, в за
висимости от времени инкубации и рН. Растворы белков в отсутствие (а-в) и в присутствии rSkp (г-е)
БИОХИМИЯ том 85 вып. 1 2020
ИММУНОГЛОБУЛИНСВЯЗЫВАЮЩАЯ АКТИВНОСТЬ Skp
99
нии Skp3 : IgG (8 : 1) и Skp3 : Fc или Fab фраг
По своим шаперонным свойствам Skp имеет
менты IgG (3,5 : 1) (в расчетах использовали мо
сходство с недавно открытыми гомодимерными
лекулярную массу тримера Skp3). По данным
шаперонами HdeA и HdeB, которые обеспечива
ДРС, в присутствии rSkp скорость процессов са
ют устойчивость Escherichia coli к кислотному
моассоциации и агрегации белков субстратов
стрессу [38, 39]. Эти шапероны, подобно Skp, на
существенно снижалась: рост относительного
ходятся в периплазме, имеют небольшую моле
содержания (%) частиц с RH > 10 нм и значений
кулярную массу, являются АТФ независимыми
Z average образцов заметно замедлялся (рис. 3,
и защищают белки периплазмы от разворачива
г-е). В проведенных экспериментах наблюда
ния и агрегации в кислых условиях. Они активи
лось значительное влияние рН среды на прояв
руются при низких значениях рН и функциони
ление rSkp шаперонной активности. В случае
руют в форме частично развернутых мономеров.
кислого значения рН раствора (в условиях наи
В то же время Skp при кислых значениях рН, как
большей стабильности rSkp) шаперон образо
было показано, сохраняет нативную вторичную
вывал с белками устойчивые (до 48 ч) низкомо
и олигомерную структуру. Однако для того чтобы
лекулярные комплексы с RH до
10 нм
однозначно говорить о различии между выше
(99,5-99,8%; рис. 3, г). В растворах с нейтраль
названными шаперонами по свойствам и меха
ным и щелочным значениями рН (6,7 и 7,9) ша
низму действия, необходимо изучить шаперон
перонная активность rSkp заметно снижалась
ную активность и структуру Skp при более низ
(рис. 3, д, е). При этих значениях рН достаточно
ких значениях рН (< 5), при которых HdeA и
высокое (98,2-99,8%) относительное содержа
HdeB активны и функционируют.
ние образованных в первые 20 мин низкомоле
Кинетические характеристики связывания Skp
кулярных комплексов (RH до 10 нм) сохранялось
с IgG, Fc5 или Fab5фрагментами при разных значе5
в течение первых 4-5 ч. Исключение составил
ниях pH среды. Для изучения взаимодействия и
раствор, содержавший шаперон с Fab фрагмен
определения количественных характеристик
том IgG при рН 7,9: образующиеся частицы
связывания Skp с IgG человека и его Fc и Fab
имели RH в интервале 10-200 нм (100%). Даль
фрагментами при разных значениях pH среды
нейшая инкубация растворов в течение 24 и 48 ч
использовали метод поверхностного плазмон
приводила к значительному увеличению доли
ного резонанса (ППР).
крупных частиц (рис. 3, д, е), размер которых
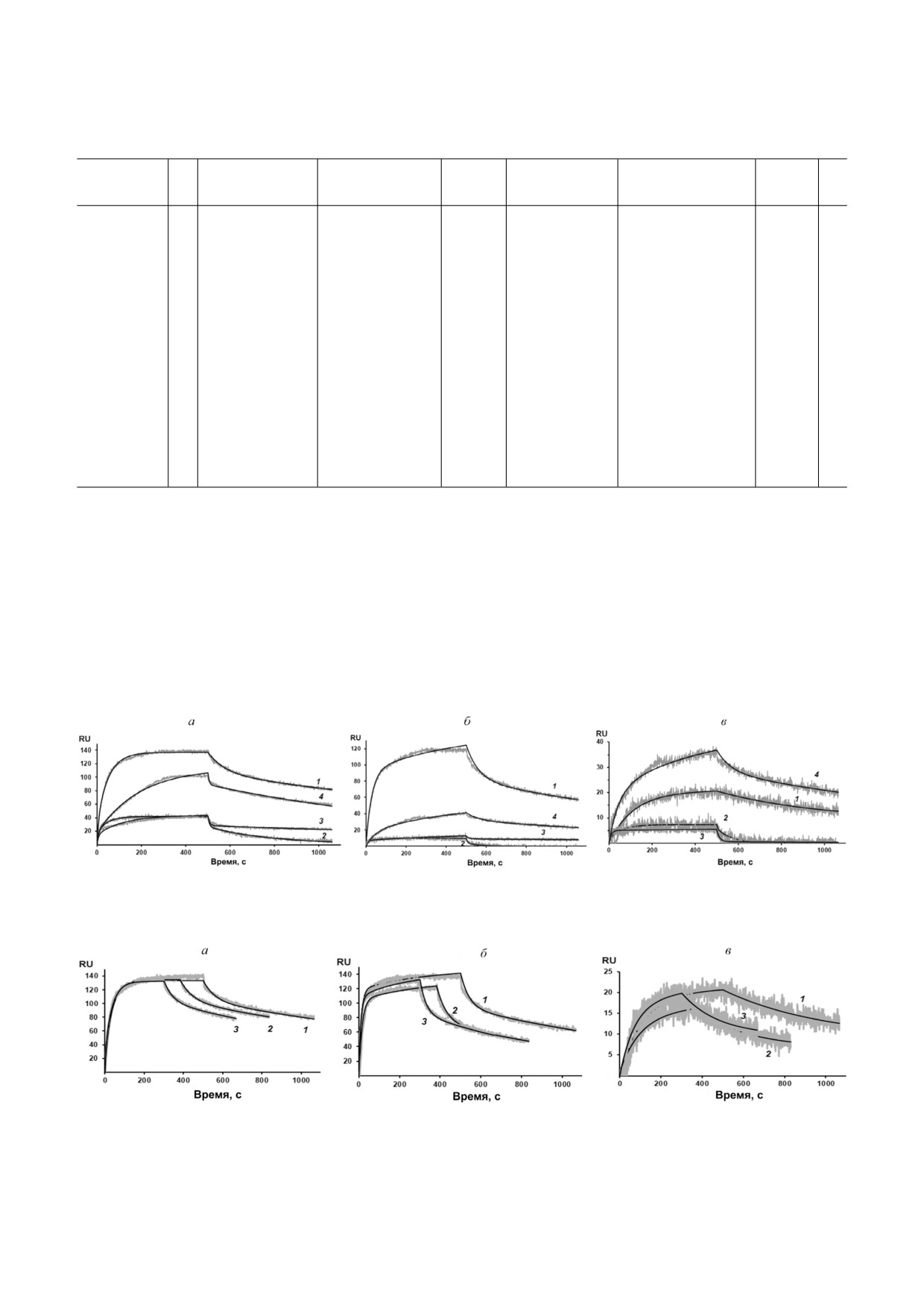
На рис. 4 представлены сенсограммы (экспе
составлял 10-200 нм и более при рН 6,7 и свыше
риментальные и теоретические) связывания
200 нм (100%) при рН 7,9. Полученные результа
rSkp с IgG человека и его фрагментами при раз
ты говорят о том, что при pH 6,7 и 7,9 rSkp не
ных значениях pH среды. Количественные ха
способен полностью предотвратить самоассо
рактеристики связывания: кинетическая конс
циацию и агрегацию IgG и его фрагментов, но
танта диссоциации комплексов (KD), главный
может существенно замедлять эти процессы.
параметр, определяющий силу связывания ли
В последнее время появляется все больше
ганд-аналит, константы скорости ассоциации и
данных о том, что нарушения в структуре бел
диссоциации комплексов (ka и kd соответствен
ков, вызванные изменениями рН среды, влияют
но) - приведены в табл. 2. Графические данные
на их шаперонную активность [35-37]. Полу
(рис. 4) и значения квадратичных отклонений
ченные результаты также хорошо демонстриру
(χ2, табл. 2) свидетельствуют в пользу того, что
ют рН зависимый характер шаперонной актив
использованные для аппроксимации получен
ности rSkp Y. pseudotuberculosis. Наиболее устой
ных результатов модели, согласно которым свя
чивые низкомолекулярные комплексы (RH до
зывание rSkp с Fc и Fab фрагментами IgG наи
10 нм) между шапероном и IgG, Fc или Fab
лучшим образом соответствует кинетической
фрагментами образуются только при кислых
модели «двух состояний», а с IgG - модели «ге
значениях рН среды. При повышении рН шапе
терогенного лиганда», можно считать удовлет
ронная активность rSkp снижается, и агрегация
ворительными для расчета количественных ха
белков субстратов замедляется незначительно.
рактеристик межмолекулярных взаимодействий
На основании полученных нами данных можно
лиганд-аналит. Анализ связывания rSkp с бел
предложить модель ингибирующего действия
ками субстратами при одной концентрации ша
шаперона на рН индуцированную агрегацию
перона и одном значении pH среды (5,0), но
белков, согласно которой rSkp стабильно связы
разной скорости протока аналита через ячейку
вает белки субстраты при низких значениях рН,
(25, 35 и 45 мкл/мин; рис. 5) показал, что в реак
тем самым предотвращая их необратимую агре
ции лиганд-аналит отсутствуют эффекты, огра
гацию, рН нейтрализация реакционной среды
ничивающие массоперенос.
вызывает медленное высвобождение белков из
Константы диссоциации изученных комп
их комплексов с шапероном.
лексов имеют достаточно низкие значения, что
БИОХИМИЯ том 85 вып. 1 2020
7*
100
СИДОРИН и др.
Таблица 2. Количественные характеристики связывания rSkp с IgG человека, Fc и Fab фрагментами IgG при разных
значениях pH среды
Иммуно
pH
ka, 1/Ms
kd, 1/s
KD1,
ka2, 1/s
kd2, 1/s
KD2,
χ2,
глобулин
kd/ka
kd/ka
RU
Fc фрагмент
5,0
(1,10 ± 0,02) × 105
(9,1 ± 0,4) × 10-3
8,0 × 10-8
(2,1 ± 0,1) × 10-3
(6,8 ± 0,7) × 10-4
-
5,7
IgG
6,0
(5,4 ± 2,5) × 104
(1,4 ± 0,3) × 10-1
2,6 × 10-6
(6,1 ± 1,7) × 10-3
(9,0 ± 0,01) × 10-1
-
2,1
-2
-7
-3
7,4
(3,0 ± 0,2) × 105
(5,6 ± 0,5) × 10
1,9 × 10
(3,6 ± 0,1) × 10
(2,8 ± 0,3) × 10-4
-
0,8
−3
-7
-3
8,0
(2,50 ± 0,06) × 104
(7,2 ± 0,4) × 10
2,9 × 10
(2,4 ± 0,1) × 10
(4,4 ± 0,2) × 10-4
-
2,9
Fab фрагмент
5,0
(7,7 ± 0,3) × 104
(2,4 ± 0,3) × 10-3
3,1 × 10-8
(8,1 ± 1,4) × 10-4
(6,7 ± 1,7) × 10-5
-
2,1
IgG
6,0
(1,6 ± 0,3) × 105
(1,5 ± 0,4) × 10-1
9,7 × 10-7
(8,2 ± 1,6) × 10-3
(4,400 ± 0,006) × 10-1
-
2,1
-2
-6
-4
7,4
(5,0 ± 0,6) × 104
(8,5 ± 0,7) × 10
1,7 × 10
(6,5 ± 0,7) × 10
(8,7 ± 3,4) × 10-4
-
0,9
−3
-7
-3
8,0
(4,10 ± 0,08) × 104
(7,5 ± 0,4) × 10
1,8 × 10
(3,0 ± 0,2) × 10
(6,8 ± 0,4) × 10-4
-
2,1
IgG
5,0
(1,10 ± 0,01) × 105
(6,1 ± 0,2) × 10-4
5,6 × 10-9
(2,3 ± 0,3) × 105
(1,6 ± 0,07) × 10-2
6,9 × 10-8
2,8
-2
-7
5
6,0
(1,9 ± 0,1) × 105
(5,1 ± 0,4) × 10
2,6 × 10
(5,0 ± 0,3) × 10
(3,6 ± 0,2) × 10-2
7,1 × 10-8
2,9
−2
-8
4
7,4
(4,4 ± 0,3) × 105
(1,10 ± 0,03) × 10
2,6 × 10
(9,1 ± 0,6) × 10
(4,4000 ± 0,0005) × 10-3
6,5 × 10-7
2,5
8,0
(4,3 ± 0,3) × 104
(4,7 ± 0,5) × 10-2
1,1 × 10-6
(7,3 ± 0,7) × 104
(7,3 ± 0,8) × 10-2
1,0 × 10-6
6,8
указывает на специфические взаимодействия
прежде всего значительным увеличением ско
между компонентами. Сила связывания rSkp с
рости диссоциации комплексов.
IgG человека и его фрагментами сильно зависит
В условиях pH среды, близких к нейтраль
от значений pH среды: при pH 5,0 она является
ным (6,0 и 7,4), наблюдаются наибольшие разли
максимальной со всеми белками субстратами и
чия в кинетике образования и распада комплек
значительно уменьшается при увеличении pH
сов rSkp с белками лигандами. Если при увели
(рис. 6, табл. 2). Уменьшение аффинности взаи
чении pH от 6,0 к 7,4 характер изменения kd
модействия с ростом величины pH обусловлено
комплексов для Fc и Fab фрагментов IgG оди
Рис. 4. Сенсограммы связывания rSkp с IgG (а), Fc фрагментом (б) и Fab фрагментом (в) IgG человека в буферных раст
ворах, pH среды: 5,0 (1), 6,0 (2), 7,4 (3) и 8,0 (4)
Рис. 5. Сенсограммы связывания rSkp с IgG (а), Fc фрагментом (б) и Fab фрагментом (в) IgG человека в натрий ацетат
ном буфере, pH 5,0, при скорости протока аналита 25 (1), 35 (2) и 45 (3) мкл/мин
БИОХИМИЯ том 85 вып. 1 2020
ИММУНОГЛОБУЛИНСВЯЗЫВАЮЩАЯ АКТИВНОСТЬ Skp
101
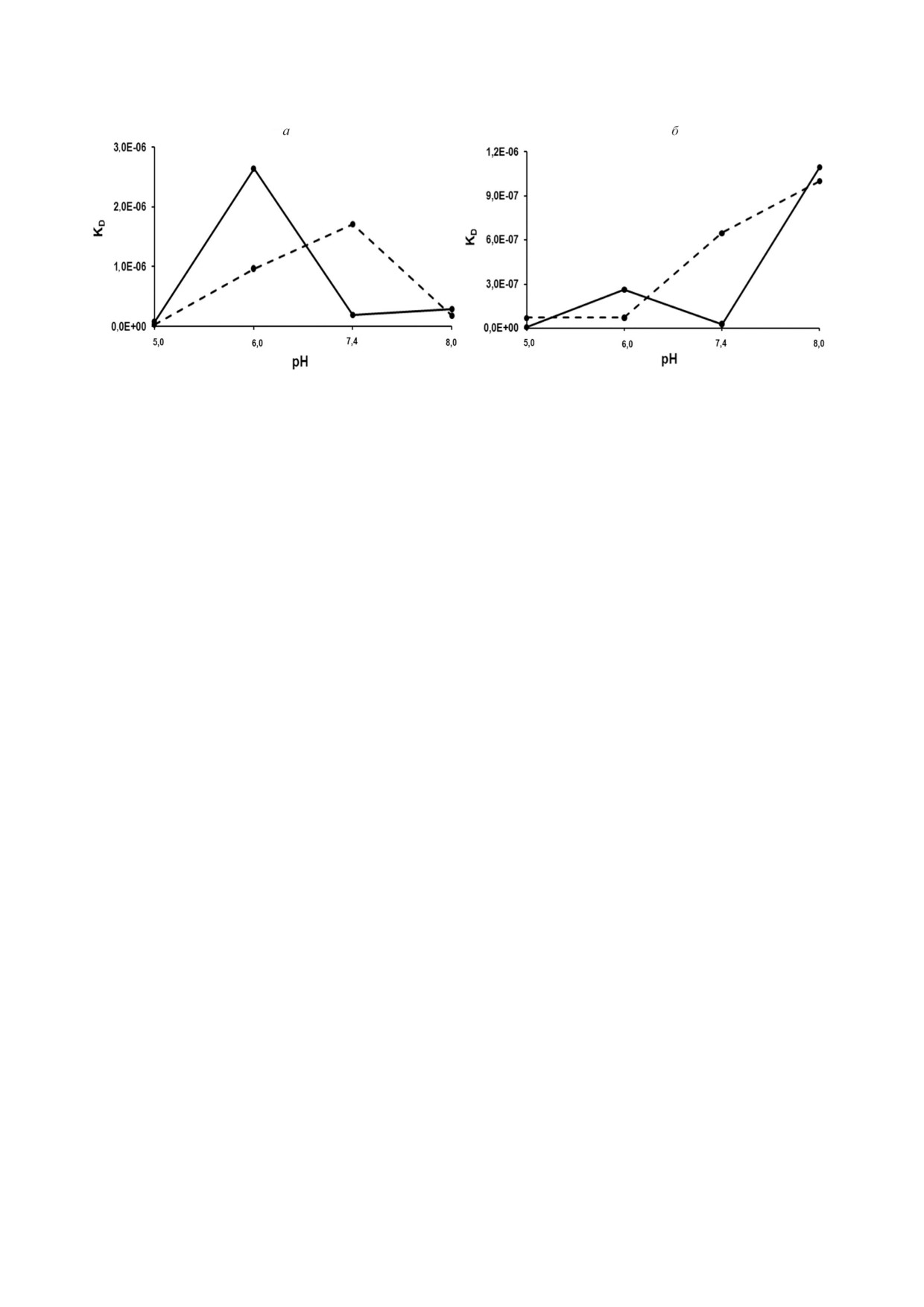
Рис. 6. Зависимость KD комплексов rSkp Y. pseudotuberculosis с IgG и его Fc и Fab фрагментами от pH среды. Взаимодей
ствие шаперона: а - с Fc фрагментом (сплошная линия) и Fab фрагментом (пунктирная линия); б - с IgG человека;
KD1 - сплошная линия, KD2 - пунктирная линия
наков (уменьшение в 2,5 и 1,8 раза соответствен
было описано в литературе [41]. На молекуле IgG
но), то ka для Fc фрагмента увеличивается в 5,6
при pH 8,0 в сравнении с другими значениями pH
раза, а для Fab фрагмента - уменьшается в 3,2
оба сайта связывания демонстрируют самую низ
раза (табл. 2). Это приводит к тому, что в данном
кую аффинность взаимодействия (рис. 6, б;
интервале pH аффинность связывания с Fc
табл. 2), что хорошо согласуется с проявлением
фрагментом возрастает, а с Fab фрагментом -
rSkp низкой шаперонной активности, наблюдае
уменьшается (рис. 6, а). Полученные данные
мой методом ДРС при pH 7,9 (рис. 3, е). Однако
коррелируют с результатами ДРС, согласно ко
это не исключает того, что значения KD могут
торым шаперонная активность rSkp при pH 6,7
быть занижены по причине самоассоциации rSkp.
выше по отношению к Fc фрагменту, чем к Fab
Проведенное исследование показало, что в
фрагменту IgG (рис. 3, д). Возможно, различия
интервале pH 5,0-8,0 максимальную иммуно
между Fc и Fab фрагментами при взаимодей
глобулинсвязывающую и шаперонную актив
ствии с rSkp объясняются тем, что изоэлектри
ности rSkp Y. pseudotuberculosis проявляет в рас
ческие точки этих белков находятся в области
творе с кислым значением pH, при котором он
рН 6,0-7,4, и при этом Fc фрагмент имеет более
наиболее стабилен. По мере увеличения pH сре
низкое значение pI, чем Fab фрагмент [40]. В
ды наблюдается медленная самоассоциация и
случае IgG характер зависимости величин конс
агрегация шаперона, а также заметное сниже
тант диссоциации от pH в интервале 6,0-7,4 для
ние его связывающих свойств.
сайта с KD1 подобен таковому для Fc фрагмента,
Полученная информация может представлять
а для сайта с KD2 совпадает с таковым для Fab
практический интерес в связи с тем, что имму
фрагмента (рис. 6, б). Это позволяет предпола
ноглобулины широко используются в медицине
гать, что KD1 и KD2 относятся к связыванию rSkp
в качестве эффективных терапевтических препа
с Fc и Fab фрагментами (соответственно) на
ратов для лечения ряда аутоиммунных заболева
иммобилизованном IgG человека.
ний, рака и других патологий. Агрегаты IgG, ко
При увеличении pH среды от 7,4 до 8,0 аф
торые образуются при длительном хранении,
финность взаимодействия rSkp с Fc фрагментом
увеличивают иммуногенность препаратов, а так
остается неизменной, а с Fab фрагментом - уве
же изменяют их физические свойства, в первую
личивается (рис. 6, а, табл. 2). Эти результаты
очередь вязкость. Контроль над агрегацией явля
плохо соответствуют данным ДРС, согласно ко
ется ключом к производству качественных и ста
торым rSkp имеет самую низкую шаперонную ак
бильных биофармацевтических препаратов.
тивность при pH 7,9 (рис. 3, е). Возможно, это яв
ляется результатом занижения значений KD за
счет быстрой самоассоциации rSkp в качестве
Конфликт интересов. Авторы заявляют об от
аналита в щелочной среде вблизи изоэлектричес
сутствии конфликта интересов.
кой точки (табл. 1). Подобное кажущееся увели
Соблюдение этических норм. Настоящая
чение аффинности, наблюдаемое методом ППР, с
статья не содержит описания каких либо иссле
ростом размеров агрегатов, участвующих в реак
дований с участием людей или использованием
ции лиганд рецепторного взаимодействия, ранее
животных в качестве объектов.
БИОХИМИЯ том 85 вып. 1 2020
102
СИДОРИН и др.
СПИСОК ЛИТЕРАТУРЫ
1.
Holck, A., Lossius, I., Aasland, R., Haarr, L., and Kleppe, K.
16.
Lahesmaa, R., Skurnik, M., Vaara, M., Leirisalo
(1987) DNA and RNA binding proteins of chromatin
Repo, M., Nissila, M., Granfors, K., and Toivanen, P.
from Escherichia coli, Biochim. Biophys. Actа, 908,
(1991) Molecular mimickry between HLA B27 and
188-199, doi: 10.1016/0167 4781(87)90058 3.
Yersinia, Salmonella, Shigella and Klebsiella within the
2.
Holck, A., and Kleppe, K. (1988) Cloning and sequencing of
same region of HLA α1 helix, Clin. Exp. Immunol., 86,
the gene for the DNA binding 17K protein of Escherichia coli,
399-404, doi: 10.1111/j.1365 2249.1991.tb02944.x.
Gene, 67, 117-124, doi: 10.1016/0378 1119(88)90014 5.
17.
Сидорин Е.В., Зиганшин Р.Х., Набережных Г.А., Лихац
3.
Koski, P., Rhen, M., Kantele, J., and Vaara, M. (1989)
кая Г.Н., Трифонов Е.В., Анастюк С.Д., Черников О.В.,
Isolation, cloning, and primary structure of a cationic 16
Соловьева Т.Ф. (2009) Белок шаперон Skp из Yersinia
kDa outer membrane protein of Salmonella typhimurium,
pseudotuberculosis обладает способностью связывать
J. Biol. Chem., 264, 18973-18980.
иммуноглобулины G, Биохимия, 74, 501-514.
4.
Koski, P., Hirvas, L., and Vaara, M. (1990) Complete
18.
Сидорин Е.В., Тищенко Н.М., Хоменко В.А., Исаева М.П.,
sequence of the ompH gene encoding the 16 kDa cationic
Дмитренок П.С., Ким Н.Ю., Лихацкая Г.Н., Соловье
outer membrane protein of Salmonella typhimurium, Gene,
ва Т.Ф. (2012) Молекулярное клонирование, выделе
88, 117-120, doi: 10.1016/0378 1119(90)90068 3.
ние и характеристика шаперона Skp из Yersinia pseudo*
5.
De Cock, Y., Schafer, U., Potgeter, M., Demel, R., Muller, M.,
tuberculosis, Биохимия, 77, 1571-1583.
and Tommassen, J. (1999) Affinity of the periplasmic chap
19.
Сидорин Е.В., Сидорова О.В., Тищенко Н.М., Хомен
erone Skp of Escherichia coli for phospholipids, lipopoly
ко В.А., Новикова О.Д., Соловьева Т.Ф. (2015) Шапе
sacharides and nonnative outer membrane proteins. Role of
ронная активность иммуноглобулинсвязывающего
Skp in the biogenesis of outer membrane protein, Eur. J.
белка Yersinia pseudotuberculosis, Биол. мембр., 32,
Biochem., 259, 96-103, doi: 10.1046/j.1432 1327.1999.00010.x.
217-220, doi: 10.7868/S0233475515030081.
6.
Harms, N., Koningstein, G., Dontje, W., Muller, M.,
20.
Bradford, M.M. (1976) A rapid and sensitive method for
Oudega, B., Luirink, J., and de Cock, H. (2001) The early
the quantitation of microgram quantities of protein utiliz
interaction of the outer membrane protein PhoE with the
ing the principle of protein dye binding, Anal. Biochem.,
periplasmic chaperone Skp occurs at cytoplasmic mem
72, 248-254, doi: 10.1006/abio.1976.9999.
brane, J. Biol. Chem., 276, 18804-18811, doi: 10.1074/jbc.
21.
Laemmli, U.K. (1970) Cleavage of structural proteins dur
M011194200.
ing the assembly of the head of bacteriophage T4, Nature,
7.
Соловьева Т.Ф., Новикова О.Д., Портнягина О.Ю.
227, 680-685, doi: 10.1038/227680a0.
(2012) Биогенез β баррельных интегральных белков на
22.
Ioannou, J.C., Donald, A.M., and Tromp, R.H. (2015)
ружной мембраны бактерий, Биохимия, 77, 1459-1477.
Characterizing the secondary structure changes occurring
8.
Entzminger, K.C., Chang, C., Myhre, R.O., McCallum, K.C.,
in high density systems of BLG dissolved in aqueous pH 3
and Maynard, J.A. (2012) The Skp chaperone helps fold
buffer, Food Hydrocolloids, 46, 216-225, doi: 10.1016/
soluble proteins in vitro by inhibiting aggregation,
j.foodhyd.2014.12.027.
Biochemistry, 51, 4822-4834, doi: 10.1021/bi300412y.
23.
Walton, T.A., and Sousa, M.C. (2004) Crystal structure of
9.
Mazor, Y., Van Blarcom, T., Mabry, R., Iverson, B.L., and
Skp, a prefoldin like chaperone that protects soluble and
Georgiou, G. (2007) Isolation of engineered, full length
membrane proteins from aggregation, Mol. Cell, 15,
antibodies from libraries expressed in Escherichia coli, Nat.
367-374, doi: 10.1016/j.molcel.2004.07.023.
Biotechnol., 25, 563-565, doi: 10.1038/nbt1296.
24.
Hawea, A., Kasperb, J.C., Friessb, W., and Jiskoot, W.
10.
Levy, R., Weiss, R., Chen, G., Iverson, B.L., and
(2009) Structural properties of monoclonal antibody aggre
Georgiou, G. (2001) Production of correctly folded Fab
gates induced by freeze-thawing and thermal stress, Eur. J.
antibody fragment in the cytoplasm of Escherichia coli trxB
Pharm. Sci., 38, 79-87, doi: 10.1016/j.ejps.2009.06.001.
gor mutants via the coexpression of molecular chaperones
25.
Arosio, P., Barolo, G., Muller Spath, T., Wu, H., and
protein expression and purification, Protein Expr. Purif.,
Morbidelli, M. (2011) Aggregation stability of a mono
23, 338-347, doi: 10.1006/prep.2001.1520.
clonal antibody during downstream processing, Pharm.
11.
Sonoda, H., Kumada, Y., Katsuda, T., and Yamaji, H.
Res., 28, 1884-1894, doi: 10.1007/s11095 011 0416 7.
(2011) Effects of cytoplasmic and periplasmic chaperones
26.
Amani, S., Nasim, F., Khan, T.A., Fazili, N.A., Furkan, M.,
on secretory production of single chain Fv antibody in
Bhat, I.A., Khan, J.M., Khan, R.H., and Naeem, A. (2014)
Escherichia coli, J. Biosci. Bioeng.,
111,
465-470,
Detergent induces the formation of IgG aggregates: a multi
doi: 10.1016/j.jbiosc.2010.12.015.
methodological approach, Spectrochimica Acta A Mol. Biomol.
12.
Geyer, R., Galanos, C., Westphal, O., and Golecki, J. (1979)
Spectrosc., 120, 151-160, doi: 10.1016/j.saa.2013.09.141.
A lipopolysaccharide binding cell surface protein from
27.
Esfandiary, R., Parupudi, A., Casas Finet, J., Gadre, D.,
Salmonella minnesota. Isolation, partial characterization and
and Sathish, H. (2015) Mechanism of reversible self asso
occurrence in different Enterobacteriaceae, Eur. J. Biochem.,
ciation of a monoclonal antibody: role of electrostatic and
98, 27-38, doi: 10.1111/j.1432 1033.1979.tb13156.x.
hydrophobic interactions, J. Pharm. Sci., 104, 577-586,
13.
Holck, A., Lossius, I., Aasland, R., and Kleppe, K. (1987)
doi: 10.1002/jps.24237.
Purification and characterization of the 17 K protein, a
28.
Nezlin, R. (2010) Interactions between immunoglobulin G
DNA binding protein from Escherichia coli, Biochim. Biophys.
molecules, Immunol. Lett., 132, 1-5, doi: 10.1016/j.imlet.
Acta, 914, 49-54, doi: 10.1016/0167 4838(87)90160 9.
2010.06.006.
14.
Shrestha, A., Shi, L., Tanase, S., Tsukamoto, M., Nishino, N.,
29.
Joubert, M.K., Luo, Q., Nashed Samuel, Y., Wypych, J.,
Tokita, K., and Yamamoto, T. (2004) Bacterial chaperone pro
and Narhi, L.O. (2011) Classification and characterization
tein, Skp, induces leukocyte chemotaxis via C5a receptor, Am.
of therapeutic antibody aggregates, J. Biol. Chem., 286,
J. Pathol., 164, 763-772, doi: 10.1016/S0002 9440(10)63164 1.
25118-25133, doi: 10.1074/jbc.M110.160457.
15.
Vuorio, R., Hirvas, L., Raybourne, R.B., Yu, D.T.Y., and
30.
Luo, Q., Joubert, M.K., Stevenson, R., Ketchem, R.R.,
Vaara, M. (1991) The nucleotide and deduced amino acid
Narhi, L.O., and Wypych, J. (2011) Chemical modifica
sequence of the cationic 19 kDa outer membrane protein
tions in therapeutic protein aggregates generated under dif
OmpH of Yersinia pseudotuberculosis, Biochim. Biophys.
ferent stress conditions, J. Biol. Chem., 286, 25134-25144,
Acta, 1129, 124-126, doi: 10.1016/0167 4781(91)90226 C.
doi: 10.1074/jbc.M110.160440.
БИОХИМИЯ том 85 вып. 1 2020
ИММУНОГЛОБУЛИНСВЯЗЫВАЮЩАЯ АКТИВНОСТЬ Skp
103
31.
Wang, W. (2005) Protein aggregation and its inhibition in bio
37. Bose, D., Patra, M., and Chakrabarti, A. (2017) Effect of
pharmaceutics, Intern. J. Pharm., 289, 1-30, doi: 10.1016/
pH on stability, conformation, and chaperone activity of
j.ijpharm.2004.11.014.
erythroid & non erythroid spectrin, Biochim. Biophys. Actа
32.
Arosio, P., Rima, S., and Morbidelli, M.
(2013)
Proteins Proteom., 1865, 694-702, doi: 10.1016/j.bba
Aggregation mechanism of an IgG2 and two IgG1 mono
pap.2017.03.012.
clonal antibodies at low pH: from oligomers to larger
38. Malki, A., Le, H. T., Milles, S., Kern, R., Caldas, T.,
aggregates, Pharm. Res., 30, 641-654, doi: 10.1007/
Abdallah, J., and Richarme, G. (2008) Solubilization of
s11095 012 0885 3.
protein aggregates by the acid stress chaperones HdeA and
33.
Gil, D., and Schrum, A.G. (2013) Strategies to stabilize
HdeB, J. Biol. Chem., 283, 13679 -13687, doi: 10.1074/
compact folding and minimize aggregation of antibody
jbc.M800869200.
based fragments, Adv. Biosci. Biotechnol., 4, 73-84,
39. Tapleya, T.L., Korner, J.L., Bargea, M.T., Hupfelda, J.,
doi: 10.4236/abb.2013.44A011.
Schauertec, J.A., Gafnic, A., Jakoba, U., and Bardwella, J.C.A.
34.
Roberts, C.J. (2014) Therapeutic protein aggregation:
(2009) Structural plasticity of an acid activated chaperone
mechanisms, design, and control, Trends Biotechnol., 32,
allows promiscuous substrate binding, Proc. Natl. Acad.
372-380, doi: 10.1016/j.tibtech.2014.05.005.
Sci. USA,
106,
5557-5562, doi:
10.1073/pnas.
35.
Poon, S., Rybchyn, M.S., Easterbrook Smith, S.B.,
0811811106.
Carver, J.A., Pankhurst, G.J., and Wilson, M.R. (2002)
40. Coleman, L., and Mahler, S.M. (2003) Purification of Fab
Mildly acidic pH activates the extracellular molecular
fragments from a monoclonal antibody papain digest by
chaperone clusterin, J. Biol. Chem., 277, 39532-39540,
Gradiflow electrophoresis, Protein Expres. Purif., 32,
doi: 10.1074/jbc.M204855200.
246-251, doi: 10.1016/j.pep.2003.07.005.
36.
Tapley, T.L., Franzmann, T.M., Chakraborty, S., Jakob, U.,
41. Luo, Y., Lu, Z., Raso, S.W., Entrican, C., and Tangarone, B.
and Bardwell, J.C.A. (2010) Protein refolding by pH trig
(2009) Dimers and multimers of monoclonal IgG1 exhibit
gered chaperone binding and release, Proc. Natl. Acad. Sci.
higher in vitro binding affinities to Fcγ receptors, mAbs, 1,
USA, 107, 1071-1076, doi: 10.1073/pnas.0911610107.
491-504.
THE CHAPERONE AND IMMUNOGLOBULIN5BINDING ACTIVITIES
OF Skp PROTEIN FROM Yersinia pseudotuberculosis*
E. V. Sidorin**, V. A. Khomenko, N. Yu. Kim, and T. F. Solov’eva
Elyakov Pacific Institute of Bioorganic Chemistry, Far*Eastern Branch of the Russian Academy of Sciences,
690022 Vladivostok, Russia; E*mail: sev1972@mail.ru
Received May 20, 2019
Revised August 20, 2019
Accepted September 10, 2019
Here, we determined qualitative and quantitative characteristics of the chaperone and immunoglobulin binding activ
ities of recombinant Skp protein (rSkp) from Yersinia pseudotuberculosis using the methods of dynamic light scatter
ing and surface plasmon resonance. Commercial human polyclonal IgG and Fc and Fab fragments of human IgG
were used as substrate proteins. The activity of rSkp strongly depended on the medium pH. The most stable low mole
cular weight complexes with a hydrodynamic radius up to 10 nm were formed by rSkp and protein substrates at acidic
pH values. Under these conditions, rSkp exhibited the lowest propensity to self association and the highest affinity for
human IgG and its Fc and Fab fragments, as well as prevented their aggregation most efficiently (i.e., demonstrated
the maximal chaperone activity). As the medium pH increased, the affinity of rSkp for IgG and its fragments
decreased; rSkp was not able to completely prevent the aggregation of protein substrates, but significantly slowed it
down. The obtained information may be of practical interest, since the stability of therapeutic IgG preparations affects
their safety and efficacy in medical applications.
Keywords: Skp chaperone, Yersinia pseudotuberculosis, human immunoglobulin G, Fc and Fab fragments of IgG, pro
tein-protein interactions, dynamic light scattering, surface plasmon resonance
БИОХИМИЯ том 85 вып. 1 2020