БИОХИМИЯ, 2020, том 85, вып. 1, с. 104 - 115
УДК 577.22; 577.322.2
ПРОВЕРКА ПОДХОДА К СОЗДАНИЮ СТАБИЛЬНЫХ ФОРМ
БЕЛКОВ, ОСНОВАННОГО НА ПРЕДСКАЗАНИИ
НАТИВНО РАЗВЕРНУТЫХ УЧАСТКОВ,
НА ПРИМЕРЕ РИБОСОМНЫХ БЕЛКОВ L1*
© 2020
Г.С. Нагибина**, В.В. Марченков, К.А. Глухова, Т.Н. Мельник, Б.С. Мельник
Институт белка PАН, 142290, Пущино Моcковcкая обл., Россия;
электронная почта: galina$nagibina@phys.protres.ru
Поступила в редакцию 09.08.2019
После доработки 27.09.2019
Принята к публикации 27.09.2019
В наших предыдущих работах была высказана идея о том, что для поиска ослабленных участков в белке
можно использовать программы, предсказывающие нативно!развернутые участки по аминокислотной по!
следовательности. Участки, предсказанные такими программами, являются подходящими мишенями для
введения мутаций, стабилизирующих белок. Однако при исследовании каждого конкретного белка остает!
ся непонятным, что является определяющим для стабилизации - аминокислотная последовательность
(и, соответственно, предсказание ослабленности) или пространственная структура белка. Чтобы это выяс!
нить, необходимо исследовать два белка, одинаковых по структуре, но отличающихся по аминокислотной
последовательности и, соответственно, с разным предсказанием ослабленности. Введение одинаковых му!
таций в одинаковые структурные элементы в разных белках поможет экспериментально выяснить, что яв!
ляется определяющим фактором для повышения стабильности белка - предсказания ослабленности или
пространственная упаковка белка. Для таких исследований мы выбрали рибосомные белки L1 из галофиль!
ной археи Haloarcula marismortui (HmaL1) и L1 из экстремофильной бактерии Aquifex aeolicus (AaeL1). Эти
белки одинаковы по структуре, но различны по аминокислотной последовательности. Показано, что ди!
сульфидная связь, введенная в участок, предсказанный как структурированный в белке AaeL1, не привела
к повышению температуры плавления белка. В то же время дисульфидная связь, введенная в такой же
структурный элемент, но предсказанный как ослабленный участок в белке HmaL1, привела к повышению
температуры плавления приблизительно на 10 градусов.
КЛЮЧЕВЫЕ СЛОВА: рибосомный белок L1, стабилизация глобулярных белков, нативно!развернутые
участки белков, дисульфидные связи.
DOI: 10.31857/S032097252001008X
В середине прошлого века были открыты
ретических подходах (например, нейронные се!
белки, не имеющие фиксированной третичной
ти - DISOPRED [4] или подсчет статистики
структуры - так называемые «неупорядочен!
встречаемости отдельных аминокислотных ос!
ные» белки [1]. Активное изучение таких белков
татков в разных белках в участках, которые не
началось в конце 1990!х гг. Последние несколь!
детектируются методом рентгеноструктурного
ко лет исследованию таких белков было посвя!
анализа - DisEMBL [5]). Также существуют
щено большое количество работ [2, 3]. Интерес
программы, объединяющие в себе несколько
к нативно!развернутым белкам инициировал
разных подходов, так называемые метапредик!
активное развитие теоретических программ,
торы: PONDR!FIT [6].
позволяющих предсказывать по аминокислот!
Оказалось, что, несмотря на различия в тео!
ной последовательности, к какому из классов
ретических подходах, результаты предсказаний
относится белок: к полностью структурирован!
разных программ довольно хорошо согласуют!
ным или к нативно!развернутым [2, 3]. Такие
ся. Более того, по расчетам таких программ вид!
программы основаны на совершенно разных тео!
но, что практически в любом плотно упакован!
ном белке есть небольшие участки полипептид!
ной цепи, которые предсказываются как натив!
* Первоначально английский вариант рукописи опубли!
но!развернутые, хотя по своей структуре они
bio.msu.ru/biokhimiya, в рубрике «Papers in Press», BM19!
плотно упакованы, структурированы и ничем
242, 02.12.2019.
особо не отличаются от других участков иссле!
** Адресат для корреспонденции.
дованных белков [7]. Мы предположили, что реа!
104
ИССЛЕДОВАНИЕ РИБОСОМНОГО БЕЛКА L1
105
лизованные в этих программах алгоритмы поз!
соко консервативна. К сожалению, достаточно
воляют предсказать не только нативно!развер!
отличающаяся аминокислотная последователь!
нутые участки (подвижные и неструктурирован!
ность, у которой достоверно различаются пред!
ные), но и участки, не способные к самостоя!
сказания нативно!развернутых участков, оказа!
тельному приобретению жесткой упаковки. В
лась только у белков, «приспособленных» к
нашей предыдущей работе мы проверили идею,
функционированию в разных условиях. По!
что именно такие участки могут являться
скольку в данной работе не стояла задача срав!
«целью» для введения стабилизирующих струк!
нить между собой белки L1 из разных организ!
туру мутаций, а именно искусственных дисуль!
мов, нам нужно сравнить белок дикого типа и
фидных связей, введенных на поверхности бел!
мутантный, т.е. понять тенденцию, как повлия!
ка [8]. Нашей целью была стабилизация белка
ли дисульфидные связи, введенные в одинако!
Gαo из Drosophila melanogaster, который долгое
вые участки структуры белка, но с разными
время не удавалось закристаллизовать. Мы
предсказаниями нативно!развернутости, на ста!
предположили, что проблема заключается в
бильность белков. Безусловно, сравнение в каж!
подвижности и нестабильности отдельных
дой паре белков проводилось в одинаковых ус!
участков полипептидной цепи этого белка.
ловиях.
Аминокислотная последовательность белка
Далее мы остановимся на анализе домена II
Gαo была проанализирована с помощью про!
этих белков, поскольку предсказания нативно!
грамм PONDR!FIT и isUnstruct [6, 9]. Один из
развернутости этого домена отличаются для
участков структуры этого белка был предсказан
двух исследуемых белков: в белке HmaL1 домен II
как нативно!развернутый. В этом участке нами
предсказывается как нативно!развернутый, а в
была спроектирована дисульфидная связь, ко!
белке AaeL1 - как частично структурирован!
торая привела к стабилизации структуры белка
ный. Поэтому дизайн мутаций во втором доме!
Gαo на 4 градуса при тепловой денатурации [8].
не белков L1 позволит сравнить влияние введе!
Эта работа показала, что для поиска ослабленных
ния дисульфидных связей в одинаковых струк!
участков в белках действительно можно исполь!
турных элементах на белки с одинаковой струк!
зовать программы, предсказывающие нативно!
турой, но с разным аминокислотным составом,
развернутые участки полипептидной цепи.
и потому с разной предрасположенностью быть
Для более детальной проверки этой идеи не!
нативно!развернутыми. Такие исследования
обходимо убедиться, что основным параметром,
позволят нам проверить предположение о том,
влияющим на стабилизацию белка при введе!
что для дизайна мутаций, повышающих ста!
нии мутации, является именно предсказанная
бильность белков, можно использовать теорети!
ослабленность участка полипептидной цепи, а
ческие подходы, предсказывающие нативно!
не особенности вторичной или третичной
развернутые участки белков.
структуры белка.
Наши предположения полностью подтвер!
Для этого необходимо исследовать два белка
дились. Дисульфидная связь, введенная в
одинаковых по структуре, но достаточно сильно
HmaL1 на участке аминокислотной последова!
отличающихся по аминокислотной последова!
тельности, предсказанной как нативно!развер!
тельности.
нутый, привела к повышению стабильности
Такими объектами были выбраны рибосом!
белка. Дисульфидная связь, введенная в такой
ные белки L1 из галофильной археи Haloarcula
же по структуре, но предсказанный как структу!
marismortui (HmaL1) и L1 из экстремофильной
рированный участок белка AaeL1, не повлияла
бактерии Aquifex aeolicus (AaeL1). Структура
на стабильность белка.
AaeL1 известна [10], для белка HmaL1 структура
была смоделирована [11]. Оба эти белка имеют
характерную для рибосомных белков L1 струк!
МЕТОДЫ ИССЛЕДОВАНИЯ
туру, в которой можно выделить два домена, со!
единенные двухтяжевой междоменной перетяж!
Генетическую конструкцию, содержащую ген
кой. N! и С$концы белка располагаются в доме!
белка AaeL1 (pET11a!PL!AaeL1) экспрессиро!
не I, который отвечает за связывание 23S рРНК.
вали в штамме!суперпродуценте Escherichia coli
Домен II участвует в процессе узнавания рРНК
BL21 (DE3). Плазмида с геном мутантной фор!
[11]. Особенность этих белков заключается в
мы белка AaeL1 была сконструирована на осно!
том, что они различаются по своей аминокис!
ве вектора pET11a!PL!AaeL1 («Novagen», США)
лотной последовательности (идентичность
и пары праймеров («Евроген», Россия), указан!
33%), но схожи по пространственной структуре.
ных в таблице, методом сайт!направленного му!
Именно поэтому мы остановили свой выбор на
тагенеза с использованием полимеразы KOD
рибосомных белках L1, структура которых вы!
Hot Start DNA Polymerase («Novagen», США) в
БИОХИМИЯ том 85 вып. 1 2020
106
НАГИБИНА и др.
соответствии с инструкцией производителя.
тем центрифугировали
(«Beckman», США)
Последовательность конструкций проверяли
40 мин при 90 000 g и 4 °С. Белок, меченый гек!
секвенированием («Евроген», Россия). Белки
согистидиновой последовательностью, очища!
AaeL1 и AaeL1!D101C!K127C были получены
ли путем аффинной хроматографии на колонке
как описано Nikonova et al. [10]. Плазмида мутант!
HisTrap HP (5 мл) («GE Healthcare», США),
ной формы белка HmaL1!E82C!D114C была
уравновешенной буфером, содержащим 50 мМ
сконструирована на основе плазмиды pET11a!
Tris!HCl pH 7,5; 2 М NaCl, 20 мМ имидазол и
PL!HmaL1 («Novagen», США), несущей ген бел!
50 мМ MgCl2. Элюцию проводили градиентом
ка дикого типа, по стандартной ПЦР!методике
буфера 50 мМ Tris!HCl pH 7,5; 2 М NaCl, 200 мМ
с использованием вектора pET11a!PL в качестве
имидазол, 50 мМ MgCl2. Фракции, содержащие
матрицы. Для увеличения эффективности выде!
HmaL1, собирали и концентрировали для даль!
ления и очистки белка в генетическую
нейшей очистки. Гель!фильтрацию проводили
конструкцию была добавлена гексогистидино!
на колонке HiLoad 26/600 Superdex 75 prep grade
вая последовательность, располагающаяся на
(«GE Healthcare», США), уравновешенной
С!конце белка. Для этого фрагмент ДНК, коди!
50 мМ Tris!HCl pH 7,5; 3 М NaCl, 50 мМ MgCl2,
рующий гексогистидиновую последователь!
500 мМ NH4Cl. Чистоту препарата оценивали с
ность, был получен путем гидролиза эндонуклеа!
помощью электрофореза по Лэммли [13]. Очи!
зами рестрикции NdeI и XbaI
(«Thermo»,
щенный белок концентрировали и хранили при
США) из плазмиды pET19mod («Novagen»,
4 °С. Аналогичным образом проводили выделе!
США) и субклонирован в вектор pET11a!PL!
ние и очистку мутантной формы белка HmaL1!
HmaL1!E82C!D114C [12]. Соответствие после!
E82C!D114C, добавляя 5 мМ β!меркаптоэтано!
довательностей белков проверяли секвенирова!
ла для предупреждения образования межмоле!
нием. Клетки E. coli штамма Rosetta (DE3)
кулярных дисульфидных связей.
(«Novagen», США) трансформировали плазми!
Окисление свободных SH групп. Окисление
дами, содержащими ген белка HmaL1, и высева!
свободных SH!групп в мутантной форме белка
ли на жидкую среду LB («Amresco», США). Био!
AaeL1!D101C!K127C происходило спонтанно в
массу выращивали («Eppendorf», Германия) при
растворе. Для окисления свободных SH!групп в
температуре 37 °С и хорошей аэрации до погло!
мутантной форме белка HmaL1!E82C!D114C
щения (А600нм) 0,8-1,0, после чего добавляли ин!
использовали буфер, содержащий 200 мM Tris!
дуктор экспрессии IPTG до конечной концент!
HCl pH 8,8; 2 M NaCl, 50 мМ MgCl2, 500 мМ
рации 1 мМ. Клеточную культуру растили при
NH4Cl и 1 мM EDTA. Окисление белка прово!
37 °С до поглощения (А600нм) 1,8-2,0. Экспрес!
дили в присутствии окисленного и восстанов!
сию гена проверяли при помощи электрофореза
ленного глутатионов в конечной концентрации
в ПААГ в присутствии ДСН. Клетки, осажден!
10 мМ и 2 мМ соответственно. Инкубацию про!
ные центрифугированием (8000 g, 15 мин)
водили при комнатной температуре 24 ч. После
(«Hermle», Германия), растворяли в буфере
инкубации осуществляли перевод белка в бу!
(50 мМ Tris!HCl pH 7,5; 2 М LiCl, 100 мМ ими!
фер, содержащий 50 мМ Tris!HCl pH 7,5; 3М
дазол, 50 мМ MgCl2, 1мМ ЭДТА, 1 мМ PMSF)
NaCl, 50 мМ MgCl2 и 500 мМ NH4Cl. Проверку
(«Sigma», Германия). Биомассу подвергали раз!
формирования цистеиновых мостиков в мутант!
рушению с помощью гомогенизатора высокого
ных формах белков проводили методом электро!
давления EmulsiFlex!C3 («Avestin», Канада) и за!
фореза по Лэммли с некоторой модификацией:
Последовательности праймеров, использованных в работе
Название праймера
5′-3′ последовательность праймеров
AaeL1_Asp101CysF
ACTACGTAGGCGGCTGCGAACTCATAAACAA
AaeL1_Asp101CysR
TTGTTTATGAGTTCGCAGCCGCCTACGTAGT
AaeL1_Lys127CysF
GGAGATGATGCCATGTGTTGCAAAACTTG
AaeL1_Lys127CysR
CAAGTTTTGCAACACATGGCATCATCTCC
HmaL1_Glu82CysF
GACGTACTCGACTGCGATGAACTCGAAGAA
HmaL1_Glu82CysR
TTCCTCGAGTTCATCGCAGTCGAGTACGTC
HmaL1_Asp114CysF
GGACTGATGCAGTGCATCGGTCGCTAC
HmaL1_Asp114CysR
CTAGCGACCGATGCACTGCATCAGTCC
БИОХИМИЯ том 85 вып. 1 2020
ИССЛЕДОВАНИЕ РИБОСОМНОГО БЕЛКА L1
107
наличие в белках дисульфидных связей контро!
липтичности от температуры при 215 нм изме!
лировали добавлением β!меркаптоэтанола.
ряли со скоростью нагрева 1 °C/мин. Исследо!
Концентрацию белка AaeL1 определяли по
вания AaeL1 и AaeL1!D101C!K127C проводили
поглощению при 280 нм с коэффициентом экс!
в 20 мМ натрий!фосфатном буфере при pH 7,5 в
тинкции А1см1мг/мл = 0,59 [10]. Коэффициент экстинк!
присутствии 4 М мочевины. Исследования
ции для HmaL1 (А1см1мг/мл = 0,176) был определен
HmaL1 и HmaL1!E82C!D114C проводили в
расчетным способом, используя программу
50 мМ Tris!HCl pH 7,5; 3 М NaCl, 50 мМ MgCl2
Vector!NTI.
и 50 мМ NH4Cl.
Измерения собственной флуоресценции
Фрагмент 23S рРНК H. marismortui (спирали
белков проводили на спектрофлуориметре
76-78) был любезно предоставлен С.В. Тищен!
Varian Cary 100 («Varian», Австралия) c использо!
ко (ИБ РАН, лаборатория структурных исследо!
ванием кварцевых кювет с длиной оптического
ваний аппарата трансляции). Последователь!
пути 1 см. Длина волны возбуждающего света
ность фрагмента: ggGUCGCCGAUGUGCA!
составляла 280 нм, регистрацию спектров ис!
GCAUAGGUAGGAGACACUACACAGGUACC!
пускания флуоресценции проводили в интерва!
CGCGCUAGCGGGCCACCGAGUCAACAGU!
ле 290-500 нм. Исследования проводили в 20
GAAAUACUACCCGUCGGUGACcc.
мМ натрий!фосфатном буфере, рН 7,5 в прису!
Для формирования РНК-белкового комп!
тствии 4 M мочевины, в диапазоне температур
лекса раствор с фрагментом рРНК инкубирова!
21-98 °C. Рабочая концентрация белка состав!
ли при 70 °C в течение 10 мин, затем охлаждали
ляла 0,2 мг/мл.
на льду. Далее к раствору рРНК добавляли бе!
Эксперименты с белками AaeL1 и AaeL1!
лок, диализованный против буфера для связы!
D101C!K127C проводили с помощью диффе!
вания (50 мМ Tris!HCl pH 7,5; 3 M NaCl, 500 мМ
ренциального сканирующего микрокалоримет!
NH4Cl, 10 мМ MgCl2) в молярном соотношении
ра («СКАЛ!1», Россия) со стеклянной ячейкой
рРНК/белок - 1/1. Полученный раствор инку!
объемом 0,33 мл при скорости нагрева 1 °C/мин
бировали при комнатной температуре 30 мин.
(1,0 К/мин) и под давлением 2,5 атм [14]. Образ!
Для оценки образования комплекса рРНК/
цы переводили в соответствующий буферный
белок in vitro мы использовали эксклюзионную
раствор
(20 мМ натрий!фосфатный буфер,
хроматографию. Для анализа мы использовали
рН 7,5; 4 M мочевины) путем продолжительно!
хроматографическую систему Varian ProStar
го диализа. Концентрации белков в экспери!
HPLC («Varian», Австралия) с колонкой для гель!
ментах (1,0 мг/мл) измеряли спектрофотомет!
фильтрации Superdex
200
(24 мл)
(«GE
рически («Экром», Россия). Для записи данных
Healthcare», США), предварительно уравнове!
использовали программу SCAL («СКАЛ», Рос!
шенной буфером 50 мМ Tris!HCl pH 7,5; 3 M
сия). Зависимость молярной теплоемкости от
NaCl, 500 мМ NH4Cl, 20 мМ MgCl2. Препарат
температуры рассчитывали стандартным спосо!
рРНК/белок (0,2 мг/мл, рРНК/белок в моляр!
бом [15] и в дальнейшем анализировали с ис!
ном соотношении 1/1, v = 200 мкл) наносили на
пользованием программы SigmaPlot («SigmaPlot»,
колонку и элюировали со скоростью 0,4 мл/мин.
США).
Калибровочную кривую строили с использова!
Спектры кругового дихроизма (КД) измеря!
нием белков БСА, овальбумин, рибонуклеаза и
ли на спектрополяриметре Chirascan («Applied
апротинин («Bio!Rad», США).
Photophysics», Англия). Для измерений КД в
дальней ультрафиолетовой области использова!
ли кюветы с длиной оптического пути 0,1 см.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Концентрация белка для измерений спектров
дальнего КД составляла 0,2 мг/мл для AaeL1 и
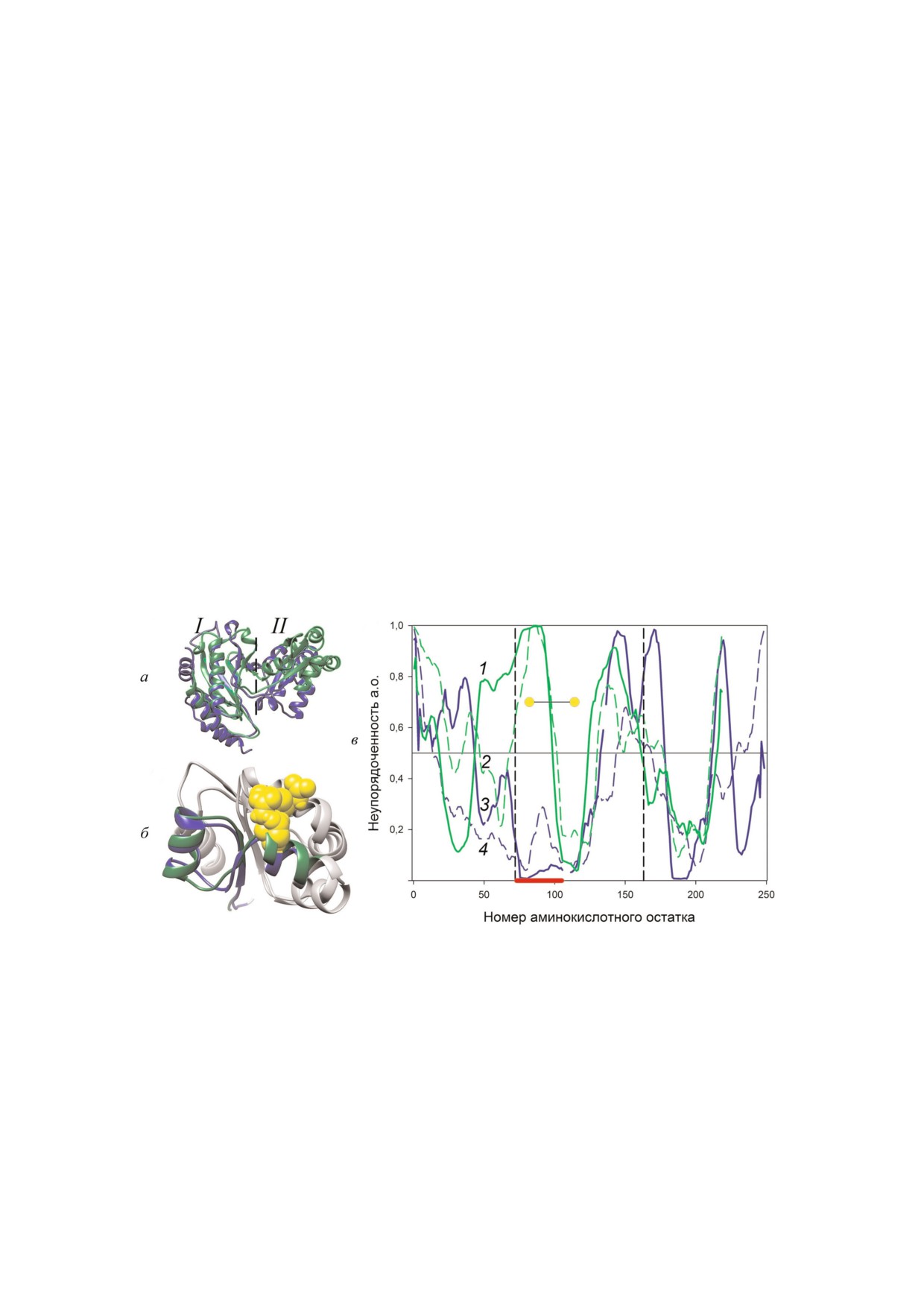
Сравнение пространственной структуры и
AaeL1!D101C!K127C и 0,4 мг/мл для HmaL1 и
аминокислотных последовательностей белков
HmaL1!E82C!D114C. Спектры регистрировали
AaeL1 и HmaL1. Пространственная структура
в интервале длин волн 200-250 нм.
рибосомных белков L1 отличается высокой кон!
Значения молярной эллиптичности рассчи!
сервативностью: в ней можно выделить два до!
тывали по уравнению:
мена (I и II), которые соединены гибкой пере!
тяжкой, позволяющей им менять взаимное рас!
[θ] = [θ]изм × М/(L × C),
положение. Известно два варианта взаимного
расположения доменов в растворе: «открытое» и
где С - концентрация белка (мг/мл), L - длина
«закрытое» [10]. «Открытая» конформация ха!
оптического пути кюветы (мм), [θ]изм - изме!
рактерна для архейных белков L1 (к ним отно!
ренная эллиптичность (градусы) и М - средняя
сится HmaL1) и подразумевает такое располо!
молекулярная масса белка (Да). Зависимость эл!
жение доменов друг относительно друга, при
БИОХИМИЯ том 85 вып. 1 2020
108
НАГИБИНА и др.
котором РНК!связывающие участки открыты и
дим их хорошее наложение (рис. 1, б). Видно, что
доступны для РНК. «Закрытая» конформация -
оба этих домена имеют топологию укладки по
это такое расположение доменов, когда они
Россману [16], когда параллельный четырехтя!
сближены, а РНК!связывающие участки скры!
жевой β!слой закрыт двумя α!спиралями с од!
ты. Такая конформация присуща бактериаль!
ной стороны и четырьмя α!спиралями с другой.
ным белкам L1 и была обнаружена у белка
Сравнение аминокислотных последователь!
AaeL1 [10].
ностей белков, выполненное в программе
На рис. 1, а представлено наложение прост!
ранственной структуры белка AaeL1 (синим) и
показало, что идентичность аминокислотных
модели пространственной структуры белка
последовательностей белков AaeL1 и HmaL1
HmaL1 (зеленым). Оба белка имеют характер!
составляет 33%. На рис. 2 показано выравнива!
ную для белков L1 двухдоменную структуру: N! и
ние аминокислотных последовательностей двух
С!концы расположены в домене I, который свя!
белков, серым цветом показаны идентичные
зан двухцепочечной перетяжкой с доменом II.
аминокислотные остатки. Белки AaeL1 и HmaL1
Видно, что основные элементы вторичной
отличаются по своей длине: AaeL1 состоит из
структуры домена I двух белков (четырехтяжевой
242 а.о., белок HmaL1 - из 212 а.о. Интересно,
антипараллельный β!слой, закрытый с одной
что белок HmaL1 имеет в своей последователь!
стороны двумя α! спиралями) хорошо наклады!
ности ~1/4 отрицательно заряженных а.о. (аспар!
ваются друг на друга, за исключением С!конце!
тат и глутамат), располагающихся в основном на
вой α!спирали в домене I белка AaeL1. При срав!
поверхности домена II, что является нехарактер!
нении структур двух белков видно характерное
ным для белков L1 из других организмов [11].
различие архейных и бактериальных белков L1,
Поиск неупорядоченных участков и дизайн ди
заключающееся в разном повороте домена II от!
сульфидных связей в белках AaeL1 и HmaL1. По!
носительно домена I. Однако если отдельно
иск неупорядоченных участков в последова!
сравнить структуры доменов II, мы также уви!
тельностях белков проводился с помощью про!
Рис. 1. Сравнение пространственной структуры и аминокислотных последовательностей белков AaeL1 и HmaL1. а - На!
ложение пространственной структуры белка AaeL1 (PDB:3QOY) (синим) и модели пространственной структуры HmaL1
(зеленым). Пунктирной линией разделены домены I и II. б - Наложение пространственных структур доменов II белка
AaeL1 и HmaL1. Синим цветом окрашен участок полипептидной цепи белка AaeL1, предсказанный программами
PONDR!FIT и IsUnstruct как структурированный. Зеленым цветом окрашен участок полипептидной цепи белка HmaL1,
предсказанный как неупорядоченный. Желтым цветом и объемом выделены аминокислотные остатки, выбранные нами
для замены на остатки цистеинов. в - Вероятность аминокислотных остатков в белках HmaL1 (зеленые линии 1 и 2) и
AaeL1 (синие линии 3 и 4) быть неупорядоченными (в нативно!развернутом состоянии), выполненные с помощью про!
грамм PONDR!FIT (сплошными линиями) и IsUnscruct (пунктирными линиями). Вертикальными линиями выделены
участки аминокислотных последовательностей белков, образующие домен II. Красной линией внизу графика показан
участок аминокислотной последовательности, в котором предсказания неупорядоченности участков для белков AaeL1 и
HmaL1 различаются. Желтыми кружками показаны позиции для введения дисульфидных связей.
biokhsm/
БИОХИМИЯ том 85 вып. 1 2020
ИССЛЕДОВАНИЕ РИБОСОМНОГО БЕЛКА L1
109
Рис. 2. Сравнение аминокислотных последовательностей рибосомных белков HmaL1 и AaeL1. Идентичные остатки вы!
делены серым цветом
грамм PONDR!FIT и IsUnstruct [6, 9]. На
ше, чем отличия между предсказаниями про!
рис. 1, в показана вероятность разных амино!
грамм PONDR!FIT и IsUnstruct.
кислотных остатков белков AaeL1 (синим цве!
На рис. 1, б показано наложение простран!
том) и HmaL1 (зеленым цветом) быть в натив!
ственных структур доменов II белков AaeL1 и
но!развернутом состоянии. Данные получены
HmaL1. В них синим и зеленым цветами соответ!
программами PONDR!FIT (сплошной линией)
ственно показаны участки аминокислотных
и IsUnstruct (пунктирной линией). Вертикаль!
последовательностей белков, выбранных нами
ными линиями выделен участок аминокислот!
для введения дисульфидных связей, исходя из
ной последовательности, относящийся к домену II
предсказаний, выполненных программами
этих белков. В этом домене мы видим большую
PONDR!FIT и IsUnstruct. Желтым цветом и
разницу в предсказаниях программ (участок вы!
объемом показаны аминокислотные остатки,
делен красным отрезком внизу графика). Для
выбранные нами для замены на остатки цистеи!
белка AaeL1 этот участок предсказывается как
нов. Ими оказались D101 и K127 в белке AaeL1
стабильный, в то время как для белка HmaL1
и E82 и D114 в белке HmaL1. Выбор аминокис!
этот участок предсказывается как неупорядо!
лотного остатка для замены на остатки цистеи!
ченный. Именно такой участок подходит для
нов проводили по двум критериям: расстояние
проверки нашей идеи. Если результат работы
между Сβ!атомами аминокислотных остатков
программ типа PONDR!FIT и IsUnstruct
должно быть ~5 Å, и остатки в пространстве
действительно можно интерпретировать как
должны быть направлены друг на друга.
предсказание стабильных и ослабленных частей
Формирование дисульфидных связей в мутант
полипептидной цепи белка, тогда введение ди!
ных формах белков AaeL1 D101C K127C и
сульфидной связи в участок, предсказанный как
HmaL1 E82C D114C. Мутантные формы белков
неупорядоченный, найденный в HmaL1, приве!
AaeL1 и HmaL1 были выделены и очищены, как
дет к повышению стабильности и уменьшению
описано в «Методах исследования». Проверку
подвижности этого белка, а введение дисуль!
формирования дисульфидных связей в мутант!
фидной связи в такой же участок, но предска!
ных формах белка проводили методом ПААГ
занный как структурированный в AaeL1, не из!
электрофореза в присутствии ДСН. Это воз!
менит стабильность белка или даже уменьшит
можно благодаря различию гидродинамическо!
ее. Если более важным для стабилизации белка
го радиуса денатурированных белков с завязан!
является его пространственная структура, то
ной дисульфидной связью и без нее. На рис. 3
введенные мутации одинаковым образом долж!
показаны результаты электрофореза в ПААГ в
ны повлиять на оба белка.
присутствии ДСН для белка AaeL1 дикого типа
Дополнительно мы проверили, насколько
и AaeL1!D101C!K127C (рис. 3, а) и HmaL1 ди!
сам факт замен а.о. в позициях D101 и K127 в
кого типа и HmaL1!E82C!D114C (рис. 3, б). В
белке AaeL1 и E82 и D114 в белке HmaL1 повлия!
условиях, когда SH!группы восстановлены - в
ет на предсказания программ PONDR!FIT и
присутствии β!меркаптоэтанола (дорожки 1 и 2
IsUnstruct. Незначительные изменения в амино!
на обоих рисунках) белки дикого типа и мутант!
кислотной последовательности белков (замена
ных форм имеют одинаковую подвижность в ге!
двух а.о.) слабо влияют на кривые, показанные
ле. В условиях, когда дисульфидные связи завя!
на рис. 1, в. По крайней мере это влияние мень!
заны, т.е. в условиях отсутствия β!меркаптоэта!
БИОХИМИЯ том 85 вып. 1 2020
110
НАГИБИНА и др.
Теперь, когда мы подобрали условия для ис!
следования белка AaeL1, необходимо проверить
не нарушила ли дисульфидная связь нативную
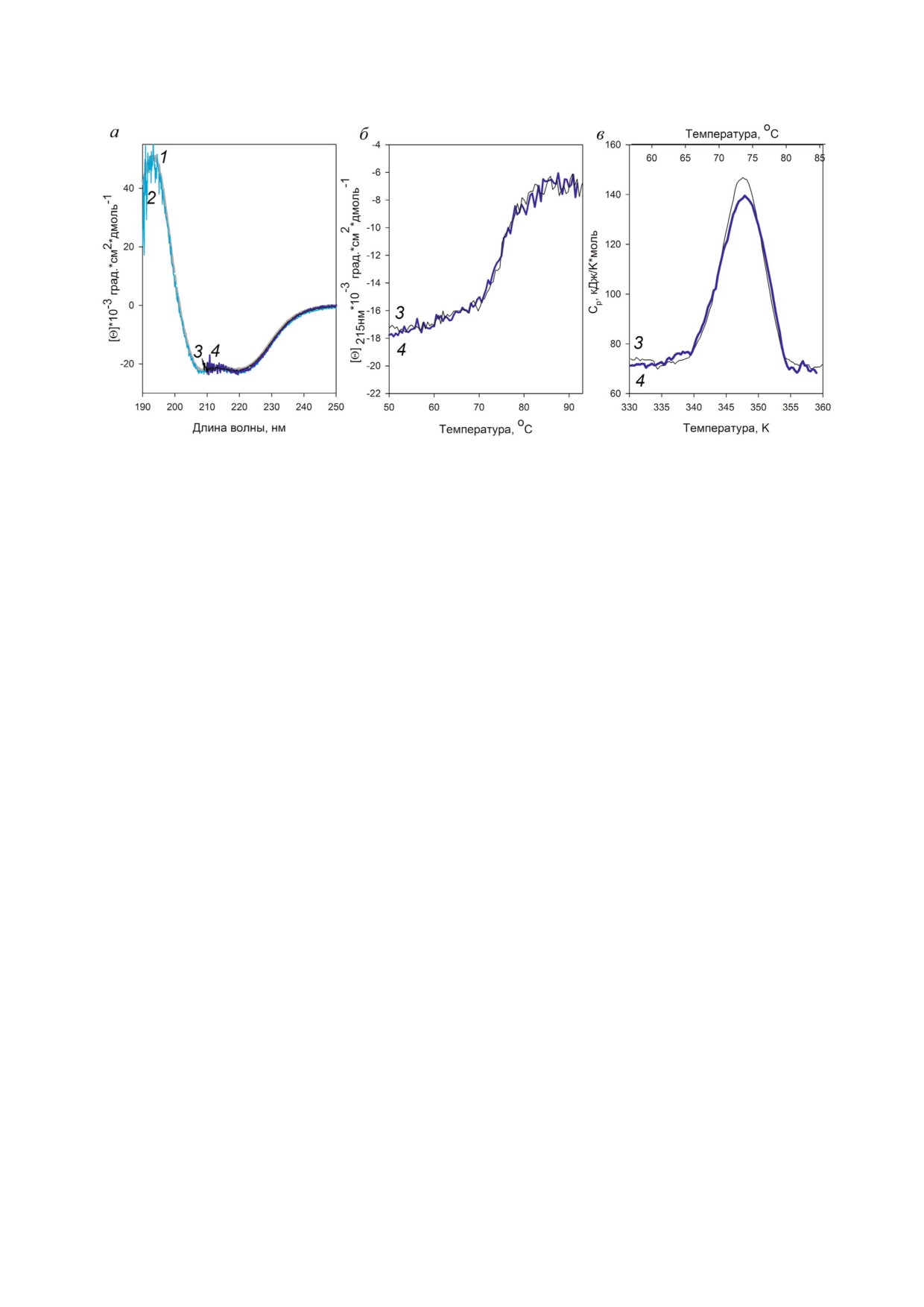
упаковку белка. На рис. 5, а показаны спектры
КД, полученные для белка AaeL1 дикого типа и
мутантной формы в отсутствие денатуранта и в
присутствии 4 М мочевины. Видно, что в натив!
ных условиях (в отсутствие мочевины) форма
спектров белков дикого типа и мутантной фор!
мы хорошо совпадает и характерна для α!спи!
ральных белков. В присутствии 4 М мочевины,
несмотря на зашумленность, видно, что форма
спектров белка дикого типа и мутантной формы
совпадают, а также эти спектры совпадают со
спектрами белков в нативных условиях. Таким
образом, можно сделать вывод, что ни присут!
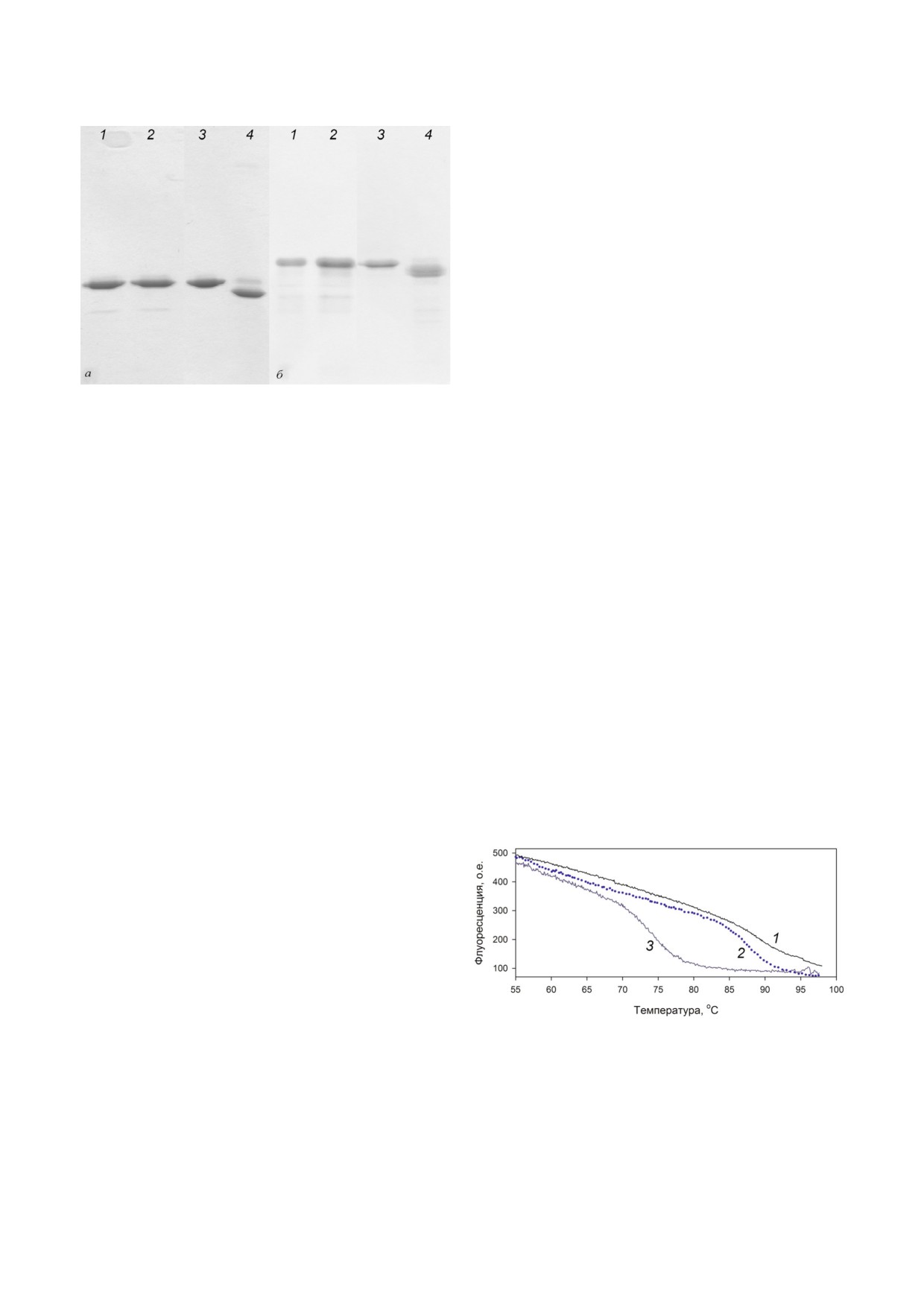
Рис. 3. Результаты анализа методом электрофореза в ПААГ
в присутствии ДСН белков AaeL1 и AaeL1!D101C!K127C
ствие 4 М мочевины, ни введенная дисульфид!
(а), HmaL1 и HmaL1!E82C!D114C (б): в условиях восста!
ная связь не нарушили вторичную структуру в
новленных дисульфидных связей (дорожки 1 и 2) и окис!
белке.
ленных дисульфидных связей (дорожки 3 и 4)
Процесс плавления белка AaeL1 и AaeL1!
D101C!K127C был исследован методом спект!
нола (дорожки 3 и 4 на обоих рисунках) подвиж!
роскопии кругового дихроизма. На рис. 5, б по!
ность белков дикого типа и белков с завязанны!
казаны кривые зависимости интенсивности мо!
ми дисульфидными связями различается. Ре!
лярной эллиптичности при 215 нм от температу!
зультаты, показанные на рис. 3, говорят о том,
ры. Видно, что кривые для белка AaeL1 дикого
что введенные нами дисульфидные связи спро!
типа и мутантной формы с введенной дисуль!
ектированы корректно и завязываются спонтан!
фидной связью AaeL1!D101C!K127C совпада!
но в растворе в белке AaeL1!D101C!K127C, а
ют. Для уточнения температуры плавления бел!
также формируются в процессе окисления в
ков AaeL1 дикого типа и AaeL1!D101C!K127C
белке HmaL1!E82C!D114C, как описано в «Ме!
мы исследовали процессы плавления этих бел!
тодах исследования».
ков методом дифференциальной сканирующей
Исследование стабильности белка AaeL1 с
микрокалориметрии. На рис. 5, в показаны кри!
введенной дисульфидной связью. AaeL1 - белок
вые плавления белка AaeL1 и его мутантной
из термофильной бактерии, его отличает высо!
формы с введенной дисульфидной связью в
кая термостабильность. Для того чтобы иссле!
присутствии 4 М мочевины. Видно, что для бел!
довать процесс его плавления, нам было необ!
ка дикого типа и для белка с введенной дисуль!
ходимо немного уменьшить его стабильность,
фидной связью температура плавления совпада!
например, присутствием дополнительного де!
ет и составляет 347К (74 °С).
натуранта. На рис. 4 показано плавление белка
AaeL1 в присутствии разных концентраций мо!
чевины, исследованное методом флуоресцен!
ции. Видно, что в отсутствие денатуранта тем!
пература плавления белка находится за преде!
лами 100 °С. В присутствии 1 М мочевины - в
районе 90 °С, в присутствии 4 М мочевины - в
районе 75 °С. На рис. 5, а серым и черным цве!
тами показаны спектры КД для белка AaeL1 ди!
кого типа в отсутствие денатуранта (кривая 1) и
в присутствии 4 М мочевины (кривая 3). Видно,
что форма спектров белка в 0 М мочевины и в
4 М мочевины совпадает. Т.е. 4 М мочевины
Рис. 4. Изменение интенсивности флуоресценции в про!
практически не влияют на структуру нативного
цессе тепловой денатурации для белка AaeL1 дикого типа в
состояния, но дестабилизируют его при даль!
нативных условиях (1), в присутствии 1 М мочевины (2) и
4 М мочевины (3). Измерения проводились в 20 мМ нат!
нейшем повышении температуры. Поэтому
рий!фосфатном буфере, рН 7,5.
дальнейшие эксперименты с белком AaeL1 мы
С цветным вариантом рис. 4 можно ознакомиться в элект!
решили проводить в присутствии 4 М моче!
вины.
journal/biokhsm/
БИОХИМИЯ том 85 вып. 1 2020
ИССЛЕДОВАНИЕ РИБОСОМНОГО БЕЛКА L1
111
Рис. 5. Исследование стабильности белка AaeL1 с введенной дисульфидной связью. а - Спектры кругового дихроизма
(КД) белка AaeL1 дикого типа (кривые 1 и 3) и мутантной формы с введенной дисульфидной связью AaeL1!D101C!K127C
(кривые 2 и 4) в присутствии различных концентраций мочевины: 1 и 2 (серым и голубым цветом соответственно) в отсут!
ствие денатуранта, 3 и 4 (черным и синим цветом соответственно) в присутствии 4М мочевины. Измерения проводились
в 20мМ натрий!фосфатном буфере, рН 7,5. б - Температурная зависимость молярной эллиптичности на 215 нм - 3 (чер!
ным цветом) для белка AaeL1 дикого типа в присутствии 4М мочевины, 4 (синим цветом) для белка AaeL1!D101C!K127C
в присутствии 4М мочевины. в - Зависимость избыточной теплоемкости белка AaeL1 дикого типа (3, черным цветом) и
AaeL1!D101C!K127C с завязанной дисульфидной связью (4, синим цветом) от температуры в присутствии 4 М мочевины.
biokhsm/
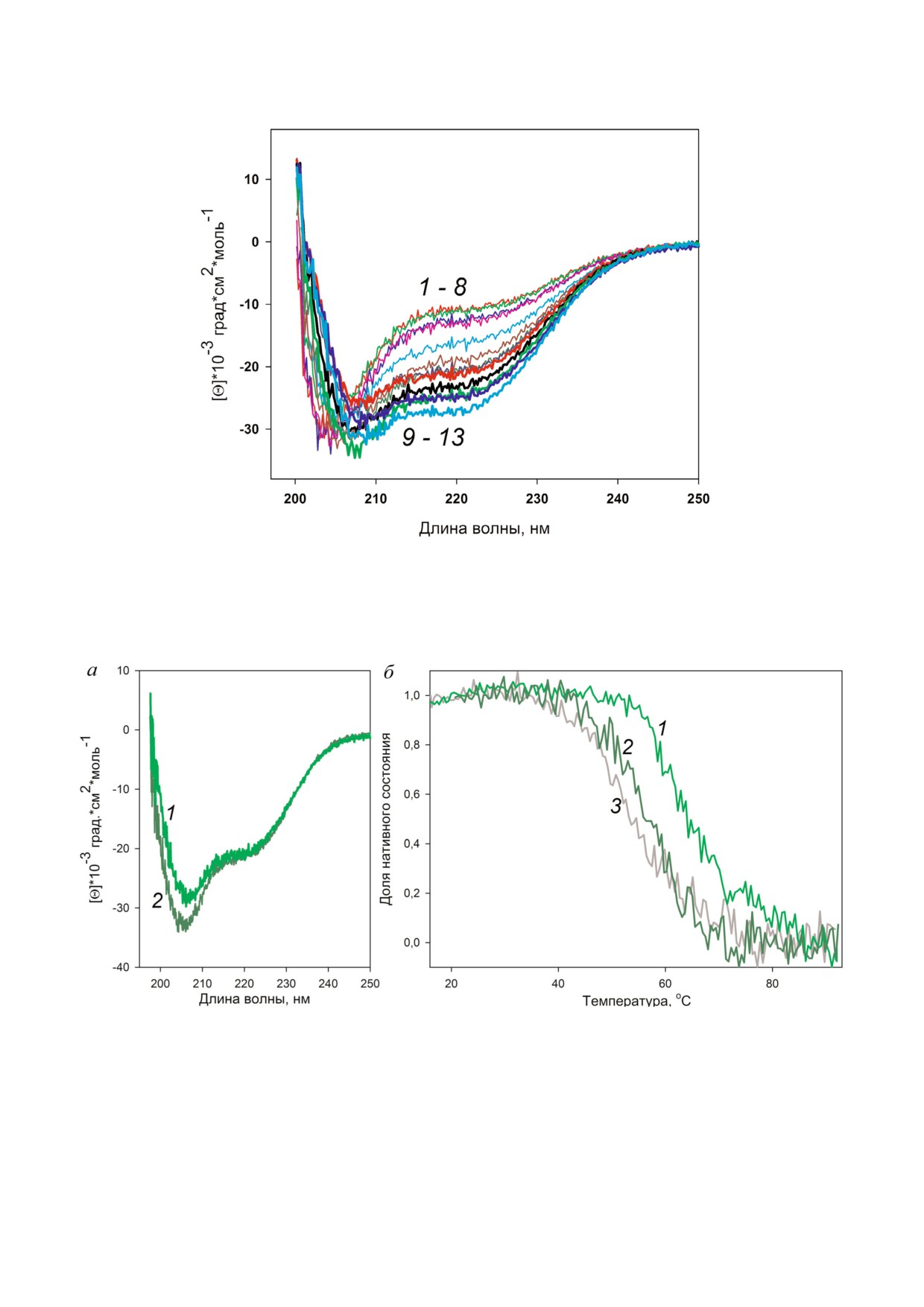
Исследование стабильности белка HmaL1 с
HmaL1 дикого типа и его мутантной формы с
введенной дисульфидной связью. Белок HmaL1
завязанной дисульфидной связью HmaL1!
является белком из экстремально галофильного
E82C!D114C. Видно, что дисульфидная связь,
организма, обитающего в условиях высоких
введенная в неупорядоченный участок белка,
концентраций соли, близких к сатурации [17].
увеличила количество вторичной структуры в
Поэтому на начальном этапе работы с данным
белке. Методом спектроскопии КД был иссле!
белком мы подобрали такие условия (концент!
дован процесс плавления белков HmaL1. На
рация NaCl), в которых белок будет структури!
рис. 7, б показан график зависимости доли на!
рованным. На рис. 6 показаны спектры КД, по!
тивного состояния белка HmaL1 дикого типа и
лученные для белка HmaL1 в присутствии раз!
мутантной формы с введенной дисульфидной
личных концентраций NaCl. Видно, что в кон!
связью HmaL1!E82C!D114C, рассчитанной
центрациях 0-2 М NaCl (кривые 1-8) белок
интенсивности молярной эллиптичности при
HmaL1 неструктурирован или слабоструктури!
215 нм от температуры. Видно, что белок
рован. Наибольшее количество вторичной
HmaL1 дикого типа плавится при 55 °С, в то
структуры белок HmaL1 имеет в условиях 3 М
время как белок HmaL1!E82C!D114C с завя!
NaCl (кривая 13, голубым цветом). Таким обра!
занной дисульфидной связью плавится при
зом, была определена минимальная концентра!
65 °С. Это подтверждает нашу гипотезу о том,
ция NaCl (3 M), необходимая для структуриро!
что дисульфидная связь, введенная в участок,
ванности белка HmaL1.
предсказанный как неупорядоченный (несмот!
Проектирование дисульфидной связи в бел!
ря на то что в структуре этого белка он структу!
ке HmaL1 было основано на модели структуры
рирован), приводит к повышению стабильнос!
белка, предложенной в работе Gabdulkhakov et
ти белка.
al. [11]. Для корректного завязывания дисуль!
Так как белок HmaL1 является слабострукту!
фидных связей в этом белке проводили окисле!
рированным и не содержит остатков триптофана
ние, как указано в «Методах исследования».
в последовательности, а также требует высокой
Исследование влияния введенной дисульфид!
концентрации соли и склонен к агрегации, изу!
ной связи на структуру белка HmaL1 проводили
чить процесс его плавления методами собствен!
с использованием метода спектроскопии КД.
ной флуоресценции и дифференциальной ска!
На рис. 7, а показаны спектры КД белков
нирующей микрокалориметрии оказалось не!
БИОХИМИЯ том 85 вып. 1 2020
112
НАГИБИНА и др.
Рис. 6. Спектры КД белка HmaL1 в присутствии различных концентраций NaCl: от 0 М (кривая 1) до 3.5 М (кривая 13) с
шагом 0,25 М NaCl. Измерения проводились в буфере 50 мМ Tris!HCl, рН 7,5.
biokhsm/
Рис. 7. Исследование стабильности белка HmaL1 с введенной дисульфидной связью. а - Спектры КД белка HmaL1 ди!
кого типа (2, темно!зеленым цветом) и HmaL1!E82C!D114C (1, зеленым цветом). Измерения проводились в буфере
50 мМ Tris!HCl, рН 7,5; 3М NaCl, 50 мМ MgCl2. б - Зависимость доли нативного состояния белка HmaL1 дикого типа
(2, темно!зеленым цветом), HmaL1!E82C!D114C с завязанной (1, зеленым цветом) и с разорванной (3, серым цветом) ди!
сульфидной связью от температуры. Доля нативного состояния белка рассчитывалась из величины молярной эллиптич!
ности на 215 нм.
biokhsm/
БИОХИМИЯ том 85 вып. 1 2020
ИССЛЕДОВАНИЕ РИБОСОМНОГО БЕЛКА L1
113
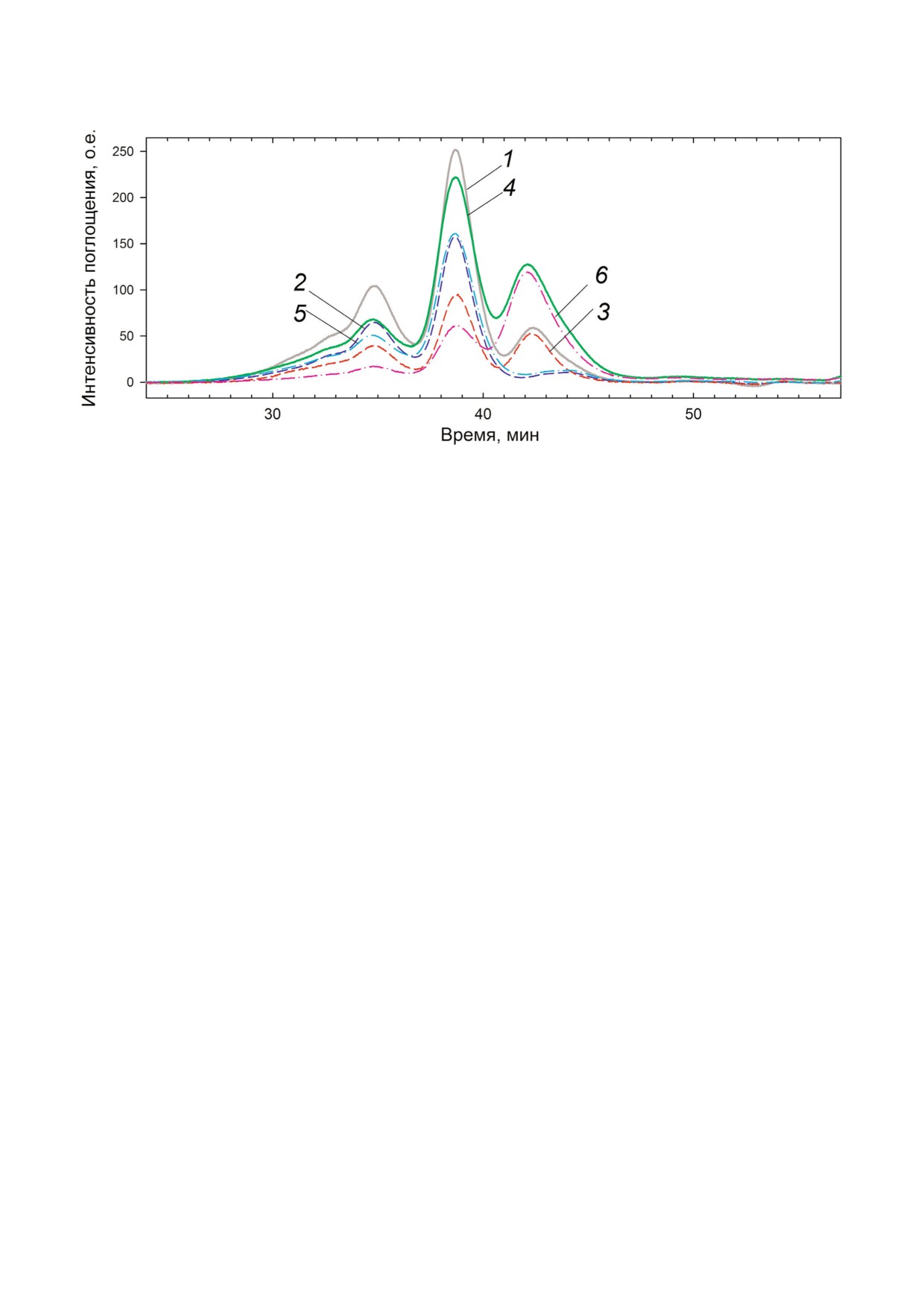
Рис. 8. Профиль элюции HmaL1/23S рРНК (1); HmaL1!E82C!D114C/23S рРНК (4), а также вклад белков HmaL1 (3) и
HmaL1!E82C!D114C (6) в комплекс. Кривые 2 и 5 показывают вклад 23S рРНК в комплексы с белком HmaL1 дикого ти!
па и HmaL1 с введенной дисульфидной связью соответственно.
biokhsm/
возможным. Мы решили проверить, как повлия!
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ла введенная дисульфидная связь на биологичес!
кую функцию белка. Белок L1 - высоко консер!
Цель данной работы заключалась в подтвер!
вативный рибосомный белок, который связыва!
ждении нашего предположения, что введение
ется с 23S рРНК. За связывание РНК отвечает
дисульфидных связей в участок, предсказывае!
домен I белка, домен II, в который мы ввели ди!
мый программами типа PONDR!FIT и
сульфидную связь, участвует в процессе узнава!
IsUnstruct как нативно!развернутый, приведет
ния РНК. Исследование комплекса HmaL1/
к повышению стабильности и уменьшению
рРНК мы проводили с использованием гель!
подвижности структуры белка, в то время как
фильтрационной хроматографии. Связывание
введение дисульфидной связи в такой же учас!
белка и рРНК проводили, как описано в «Мето!
ток, предсказанный как структурированный, не
дах исследования». На рис. 8 показаны профили
повлияет на стабильность белка. В структурах
элюции свободной H77!H78 23S рРНК, комп!
белков AaeL1 и HmaL1 мы нашли участок, оди!
лексов белков HmaL1/H77!H78 23S рРНК и
наковый по пространственной структуре, но
HmaL1!E82C!D114C/H77!H78 23S рРНК, а так!
предсказанный программами как структуриро!
же показан вклад белка и рРНК в эти комплек!
ванный в белке AaeL1 и как неупорядоченный в
сы. По высоте пиков на профиле элюции (рис. 8)
белке HmaL1. Мы спроектировали дисульфид!
видно, что 2/3 белка HmaL1 дикого типа связы!
ные связи в одинаковом положении в двух бел!
вает РНК, а 1/3 остается свободной. В случае
ках и исследовали их влияние на стабильность
комплекса рРНК с белком HmaL1!E82C!D114C
их структур. В результате можно сделать следу!
с введенной дисульфидной связью, непосред!
ющие выводы: (1) дисульфидная связь, введен!
ственно в комплексе с рРНК находится 1/3 бел!
ная в участок, предсказанный как структуриро!
ка, 2/3 белка остаются в свободном состоянии.
ванный, не повлияла на стабильность белка
Из этого можно сделать вывод о том, что введен!
AaeL1; (2) дисульфидная связь, введенная в
ная во II!ой домен дисульфидная связь не нару!
участок, предсказанный как нативно!разверну!
шает биологическую функцию белка, но снижа!
тый, привела к повышению температуры плав!
ет ее. Это можно объяснить тем, что уменьшение
ления белка HmaL1; (3) мутантный белок
подвижности структуры домена II (из!за дисуль!
HmaL1 с повышенной стабильностью сохранил
фидной связи) повлияло на процесс узнавания
свою функциональную активность. Таким об!
целевой рРНК, для которого, возможно, необхо!
разом, мы получили подтверждение нашей
дима его подвижность.
гипотезы о том, что предсказания программ
8 БИОХИМИЯ том 85 вып. 1 2020
114
НАГИБИНА и др.
типа PONDR!FIT и IsUnstruct действительно
очередь, потенциально могут быть причиной су!
коррелируют с ослабленностью или стабиль!
ществования более подвижных нестабильных
ностью участков полипептидной цепи белка L1,
промежуточных состояний и, соответственно,
а не с особенностями его пространственной
влиять на переход между нативным и другими
структуры.
состояниями при плавлении или разворачива!
Результаты наших исследований, выполнен!
нии белка денатурантами.
ных в этой и предыдущей работе [8], позволяют
высказать предположение, что стабильность
белка зависит не столько от структуры нативно!
Финансирование. Исследование выполнено
го состояния (жестко упакованного), а скорее от
при финансовой поддержке Российского фонда
особенностей развернутых и промежуточных
фундаментальных исследований в рамках науч!
состояний (подвижных с несформировавшими!
ного проекта 18!34!00243 мол_а.
ся контактами). Эта мысль может показаться
Конфликт интересов. Авторы заявляют об от!
простой с точки зрения теоретика, но она весь!
сутствии конфликта интересов в финансовой
ма сложна с точки зрения экспериментального
или какой!либо иной сфере.
подтверждения и тем более с позиции экспери!
Соблюдение этических норм. Настоящая
ментатора, перед которым стоит задача увели!
статья не содержит описания выполненных ав!
чить стабильность конкретного белка. Выпол!
торами исследований с участием людей или ис!
ненные нами исследования позволяют исполь!
пользованием животных в качестве объектов.
зовать программы по предсказанию нативно!
Благодарности. Авторы выражают благодар!
развернутых участков как инструмент для поис!
ность С.В. Тищенко за предоставленный препа!
ка ослабленных частей белка, которые, в свою рат рРНК.
СПИСОК ЛИТЕРАТУРЫ
1.
Jirgensons, S.C., Hnilica, B., and Capetillo, L.S. (1966) Visco!
10. Nikonova, E.Yu., Tishchenko, S.V., Gabdulkhakov, A.G.,
sity and conformation of calf thymus histones, Die Makromol.
Shklyaeva, A.A., Garber, M.B., Nikonov, S.V., and
Chemie, 97, 216-224, doi: 10.1002/macp.1966.020970120.
Nevskaya, N.A. (2011) Crystal structure of ribosomal pro!
2.
DeForte, S., and Uversky, V. (2016) Order, disorder, and
tein L1 from the bacterium Aquifex aeolicus, Crystallogr.
everything in between, Molecules, 21, 1090, doi: 10.3390/
Rep., 56, 648-652, doi: 10.1134/S1063774511040158.
molecules21081090.
11. Gabdulkhakov, A., Tishchenko, S., Mikhaylina, A.,
3.
He, B., Wang, K., Liu, Y., Xue, B., Uversky, V.N., and
Garber, M., Nevskaya, N., and Nikonov, S. (2017) Crystal
Dunker, A.K. (2009) Predicting intrinsic disorder in proteins:
structure of the 23S rRNA fragment specific to r!protein L1
an overview, Cell Res., 19, 929-949, doi: 10.1038/cr.2009.87.
and designed model of the ribosomal L1 stalk from Haloarcula
4.
Jones, D.T., and Cozzetto, D. (2015) DISOPRED3:
marismortui, Crystals, 7, 37, doi: 10.3390/cryst7020037.
Precise disordered region predictions with annotated pro!
12. Muller, M.P., Peters, H., Blumer, J., Blankenfeld, W.,
tein!binding activity, Bioinformatics,
31,
857-863,
Goody, R., and Itzen, A. (2010) The Legionella effector
doi: 10.1093/bioinformatics/btu744.
protein DrrA AMPylates the membrane traffic regulator
5.
Linding, R., Jensen, L.J., Diella, F., Bork, P., Gibson, T.J.,
Rab1b, Science, 329, 946-949.
and Russell, R.B. (2003) Protein disorder prediction:
13. Laemmli, U.K. (1970) Cleavage of structural proteins dur!
implications for structural proteomics, Structure, 11,
ing the assembly of the head of bacteriophage T4, Nature,
1453-1459, doi: 10.1016/j.str.2003.10.002.
227, 680-685, doi: 10.1038/227680a0.
6.
Xue, B., Dunbrack, R.L., Williams, R.W., Dunker, A.K.,
14. Senin, A.A., Potekhin, S.A., Tiktopulo, E.I., and
and Uversky, V.N. (2010) PONDR!FIT: a meta!predictor
Filimonov, V.V. (2000) Differential scanning microcalorime!
of intrinsically disordered amino acids, Biochim. Biophys.
ter SCAL!1, J. Therm. Anal. Calorim., 62, 153-160,
Acta, 1804, 996-1010, doi: 10.1016/j.bbapap.2010.01.011.
doi: 10.1023/A:1010171013669.
7.
Li, J., Feng, Y., Wang, X., Li, J., Liu, W., Rong, L., and
15. Privalov, P.L., and Potekhin, S.A. (1986) Scanning
Bao, J. (2015) An overview of predictors for intrinsically
microcalorimetry in studying temperature!induced
disordered proteins over 2010-2014, Int. J. Mol. Sci., 16,
changes in proteins, Methods Enzymol., 131, 4-51,
23446-23462, doi: 10.3390/ijms161023446.
doi: 10.1016/0076!6879(86)31033!4.
8.
Nagibina, G.S., Tin, U.F., Glukhov, A.S., Melnik, T.N., and
16. Rao, S.T., and Rossmann, M.G. (1972) Comparison of
Melnik, B.S. (2016) Intrinsic disorder!based design of stabiliz!
super!secondary structures in proteins, J. Mol. Biol., 4,
ing disulphide bridge in Galphao protein, Protein Pept. Lett.,
241-250, doi: 10.1016/0022!2836(73)90388!4.
23, 176-184, doi: 10.2174/092986652302160105130540.
17. Camacho Córdova, D.I., Camacho Ru z, R.M., Mateos
9.
Lobanov, M.Y., and Galzitskaya, O.V. (2011) The Ising
D az, J.C., Córdova López, J.A., and Rodr guez González, J.A.
model for prediction of disordered residues from protein
(2014) Haloarcula marismortui, eighty!four years after its
sequence alone, Phys. Biol., 8, 35004, doi: 10.1088/1478!
discovery in the Dead Sea, Int. J. Eng. Res. Technol., 3,
3975/8/3/035004.
1257-1267.
БИОХИМИЯ том 85 вып. 1 2020
ИССЛЕДОВАНИЕ РИБОСОМНОГО БЕЛКА L1
115
VERIFICATION OF THE STABILIZED PROTEIN DESIGN
BASED ON THE PREDICTION OF INTRINSICALLY
DISORDERED REGIONS: RIBOSOMAL PROTEINS L1
G. S. Nagibina*, V. V. Marchenkov, K. A. Glukhova, T. N. Melnik, and B. S. Melnik
Institute of Protein Research, Russian Academy of Sciences, 142290 Pushchino,
Moscow Region, Russia; E$mail: galina$nagibina@phys.protres.ru
Received August 9, 2019
Revised September 27, 2019
Accepted September 27, 2019
In our previous papers, we proposed the idea that programs predicting intrinsically disordered regions in amino acid
sequences can be used for finding weakened sites in proteins. The regions predicted by such programs are suitable tar!
gets for the introduction of protein!stabilizing mutations. However, for each specific protein, it remains unclear what
determines protein stabilization - the amino acid sequence (and accordingly, prediction of weakened sites) or the 3D
structure. To answer this question, it is necessary to study two proteins with similar structures but different amino acid
sequences and, consequently, different predictions of weakened regions. By introducing identical mutations into iden!
tical elements of the two proteins, we will be able to reveal whether predictions of the weakened sites or the 3D pro!
tein structure are the key factors in the protein stability increase. Here, we have chosen ribosomal proteins L1 from
the halophilic archaeon Haloarcula marismortui (HmaL1) and extremophilic bacterium Aquifex aeolicus (AaeL1).
These proteins are identical in their structures but different in amino acid sequences. A disulfide bond introduced into
the region predicted as the structured one in AaeL1 did not lead to the increase in the protein melting temperature.
At the same time, a disulfide bond introduced into the same region in HmaL1 that was predicted as a weakened one,
resulted in the increase in the protein melting temperature by approximately 10°C.
Keywords: ribosomal protein L1, globular protein stabilization, protein intrinsically disordered regions, disulfide
bonds
БИОХИМИЯ том 85 вып. 1 2020
8*