БИОХИМИЯ, 2020, том 85, вып. 1, с. 126 - 138
УДК 577.218
СНИЖЕНИЕ УРОВНЯ мРНК ГЕНА PTPN11 ПРЕПЯТСТВУЕТ
ИЗМЕНЕНИЮ ЭКСПРЕССИИ ГЕНОВ, КОНТРОЛИРУЮЩИХ
КЛЕТОЧНЫЙ ЦИКЛ, УСТОЙЧИВОСТЬ К ХИМИОТЕРАПИИ
И ОНКОГЕН ИНДУЦИРУЕМОЕ КЛЕТОЧНОЕ СТАРЕНИЕ,
В ОТВЕТ НА ЭКСПРЕССИЮ ОНКОГЕНА BRAF V600E
В КЛЕТКАХ ЩИТОВИДНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА*,**
© 2020
Л.В. Путляева1,2, Д.Э. Демин1,3, А.Н. Уварова1,4, Л.С. Зиневич5,
М.М. Прокофьева1, Г.Р. Газизова6, Е.И. Шагимарданова6, А.М. Шварц1***
1 Институт молекулярной биологии имени В.А. Энгельгардта РАН,
119991 Москва, Россия; электронная почта: shvarec@yandex.ru
2 Центр наук о жизни, Сколковский институт науки и технологии, 121205 Москва, Россия
3 Московский физико4технический институт, 141701 Долгопрудный, Россия
4 Московский государственный университет имени М.В. Ломоносова,
биологический факультет, 119234 Москва, Россия
5 Институт биологии развития им. Н.К. Кольцова РАН, 119334 Москва, Россия
6 Институт фундаментальной медицины и биологии,
Казанский федеральный университет, 420008 Казань, Россия
Поступила в редакцию 21.09.2019
После доработки 21.09.2019
Принята к публикации 20.10.2019
Сигнальный путь MAPK (RAS/BRAF/MEK/ERK) представляет собой киназный каскад, участвующий в ре
гуляции клеточной пролиферации, дифференцировки и выживаемости в ответ на внешние стимулы. В раз
личных опухолях обнаруживается мутация V600E гена BRAF, приводящая к 500× усилению киназной актив
ности BRAF. Однако монотерапия селективными ингибиторами BRAF V600E часто приводит к реактива
ции сигнального каскада MAPK и возникновению резистентности к ингибитору, поэтому разрабатываются
новые мишени для дополнительного ингибирования компонентов аберрантно активированного каскада.
Недавно было обнаружено, что резистентность к ингибиторам онкогена BRAF V600E может быть связана с
активностью тирозинфосфатазы SHP 2, кодируемой геном PTPN11. В данной работе мы проанализирова
ли влияние подавления транскрипции PTPN11 на экспрессию генов, задействованных в регуляции проли
ферации, устойчивости к химиотерапии и онкоген индуцируемого старения (ОИС) клеток, в условиях се
лективного подавления BRAF V600E на модели фолликулярного эпителия щитовидной железы. Было пока
зано, что подавление экспрессии PTPN11 с помощью малых интерферирующих РНК действительно пред
отвращает повышение экспрессии генов CCNA1 и NOTCH4, участвующих в формировании лекарственной
устойчивости опухолей, в ответ на действие вемурафениба. С другой стороны, подавление экспрессии
PTPN11 блокирует активацию транскрипции ряда генов, участвующих в регуляции клеточного цикла и во
влеченных в процесс ОИС: p21, p15, p16, RB1 и IGFBP7, в ответ на экспрессию онкогена BRAF V600E. Та
ким образом, можно предположить, что фосфатаза SHP 2 может участвовать не только в формировании ле
карственной устойчивости опухолевых клеток, но и в развитие процесса ОИС клетки.
КЛЮЧЕВЫЕ СЛОВА: SHP 2, BRAF V600E, опухоли щитовидной железы, онкоген индуцируемое старение.
DOI: 10.31857/S0320972520010108
Принятые сокращения: EGFR - рецептор эпидермального фактора роста, ОИС - онкоген индуцируемое старе
ние, ЩЖ - щитовидная железа, РВ ПЦР - ПЦР в реальном времени.
biokhimiya, в рубрике «Papers in Press», BM19 271, 02.12.2019.
** Приложение к статье на английском языке опубликовано на сайте журнала «Biochemistry» (Moscow) и на сайте изда
*** Адресат для корреспонденции.
126
SHP 2 КОНТРОЛИРУЕТ ДЕЛЕНИЕ И СТАРЕНИЕ КЛЕТОК
127
Аберрантная активация сигнального пути
Экспрессия PTPN11 повышена и у пациентов с
RAS/RAF/MEK/ERK (MAPK каскад) способ
опухолями щитовидной железы, она коррелиру
ствует выживанию и метастазированию клеток
ет с низкой степенью дифференцировки опухо
и является часто встречающимся механизмом
лей, высоким уровнем злокачественности и уве
возникновения и прогрессии рака [1]. Одной из
личением количества метастазов в лимфатичес
наиболее часто встречающихся драйверных му
ких узлах [21]. В той же мере высокий уровень
таций, затрагивающих компоненты данного
экспрессии PTPN11 выявляется в тиреоидных
каскада, является мутация BRAF V600E, встре
опухолевых клеточных линиях SW579, IHH 4,
чающаяся во многих типах рака, в частности,
FTC 133, TPC 1, DRO, TA K и ML 1 [21]. На
рака щитовидной железы (ЩЖ) [2]. В клетках,
мышиной модели легочной аденокарциномы и
содержащих белок BRAF V600E, повышены
клеточных моделях рака прямой кишки было
уровни хромосомной нестабильности и митоти
показано, что ингибирование SHP 2 может пред
ческой активности, а также способность к инва
отвращать реактивацию каскада RAS/RAF/
зии за счет MEK зависимого увеличения
MEK/ERK, опосредованную активацией рецеп
экспрессии матричных металлопротеиназ (на
торов эпидермального фактора роста (EGFR)
пример, MMP 3, MMP 9 и MMP 13). BRAF
[22, 23]. Также известно, что подавление экс
V600E содержащие опухоли имеют более агрес
прессии PTPN11 с помощью антисмысловых
сивный характер [3] и ассоциируются с плохим
олигонуклеотидов замедляет рост опухолевых
ответом на терапию радиоактивным йодом и с
клеток и индуцирует апоптоз в тиреоидной кле
повышенной смертностью пациентов [4]. Учи
точной линии SW579 [21]. В то же время сущест
тывая все вышеописанные данные, в последние
вуют данные и о позитивном, и о негативном
годы BRAF V600E стал основной терапевтичес
влиянии активирующих мутаций PTPN11 на ра
кой мишенью в этих видах рака.
боту сигнального каскада Ras/MAPK у больных
SHP 2, кодируемая геном PTPN11, была
с синдромом Нунана [14]. Существуют данные
первой протеинфосфатазой, идентифицирован
об отсутствии влияния ингибирования экспрес
ной как онкоген [5-7]. Она экспрессируется в
сии PTPN11 с помощью shRNA на рост и проли
различных типах клеток и участвует в онкоген
ферацию опухолевой клеточной линии A2058,
ных процессах при лейкемии, раке груди и лег
содержащей мутацию BRAF V600E [24].
кого, регулируя процессы инвазии, метастази
Недавно было обнаружено, что тирозинфос
рования, апоптоза, онкоген индуцированного
фатаза SHP 2 часто активирована в образцах
старения (ОИС), повреждения ДНК, пролифе
меланомы человека и клеточных линиях мела
рации клеток, прогрессии клеточного цикла и
номы. Также было показано, что SHP 2 участву
лекарственной устойчивости [8, 9]. Активность
ет в активации сигнального каскада RAS/
SHP 2, как полагают, играет важную роль в ак
RAF/MAPK в клетках меланомы, экспрессиру
тивации белков семейства Ras
[10,
11],
ющих мутантный белок NRAS, и в клетках,
JAK/STAT, PI3K/Akt и других компонентов сиг
экспрессирующих BRAF дикого типа (WT), а
нальных каскадов [12].
нокдаун PTPN11 приводит к подавлению деле
Инактивация гена PTPN11 приводит к гибе
ния клеток и активации ERK в линиях клеток
ли в эмбриональном периоде и множественным
меланомы человека WM3211 и MeWo [19].
дефектам развития на стадии гаструляции у раз
Вемурафениб (PLX4032) является низкомо
личных типов организмов - мышей, мух, червей
лекулярным ингибитором BRAF V600E и был
[13]. Также к физиологическим функциям SHP 2
одобрен Управлением США по санитарному
относится регуляция функционирования сиг
надзору для терапии метастатической меланомы
нального пути инсулина [14], участие в развитии
в 2011 году [25]. При терапии меланомы и кар
сердца, и центральной нервной системы [15,
циномы щитовидной железы было обнаружено,
16]. В опухолях различной этиологии роль дан
что вемурафениб индуцирует стимуляцию пере
ной фосфатазы различается в зависимости от
дачи сигнала через рецепторные тирозиновые
стадии и локализации опухоли. SHP 2 выполня
киназы (РТК), что может приводить к быстрой
ет роль опухолевого супрессора при раке печени
реактивации и стимуляции передачи сигнала
[17] и раке кости/хряща [18] и напротив, являет
через EGFR [26, 27]. В свою очередь, тирозин
ся онкогеном при лейкемии, раке легких, груди
фосфатаза SHP 2 участвует в передаче сигнала
и меланоме
[19]. Активирующие мутации
от активированных рецепторов EGF к
PTPN11 были обнаружены в пробах, взятых у
p21Ras (RASА1), к другим сигнальным молеку
больных с острым миелоидным лейкозом, ра
лам, вследствие чего ингибирование SHP 2 мо
ком желудка, глиобластомой и анапластической
жет уменьшать реактивацию MAPK каскада.
крупноклеточной лимфомой, что и позволило
Согласно некоторым данным, вемурафениб мо
определить PTPN11 как протоонкоген [20].
жет вызывать активацию SHP 2 и реактивацию
БИОХИМИЯ том 85 вып. 1 2020
128
ПУТЛЯЕВА и др.
передачи сигнала через MEK ERK при наличии
тализованных клеток эпителия ЩЖ Nthy ori 3 1
экспрессии фактора роста гепатоцитов (HGF) в
(«Sigma», США) выращивали в среде RPMI1640
вемурафениб резистентных клетках [22].
(«ПанЭко», Россия) с добавлением 10% эмбрио
Целью данной работы была оценка влияния
нальной телячьей сыворотки («Biosera», Фран
подавления транскрипции PTPN11 на экспрес
ция), L глютамина (2 мМ), смеси пенициллина
сию генов, задействованных в регуляции проли
(100 Ед/мл), стрептомицина (100 мкг/мл), а так
ферации, устойчивости к химиотерапии и ОИС
же с добавлением пирувата натрия (1 мМ). На
клеток в условиях селективного подавления
основе данной линии были получены 2 клеточ
BRAF V600E. Для определения групп генов,
ных линии - деривата - трансдуцированные
экспрессия которых меняется наиболее выра
двумя разными вариантами лентивирусных век
женно в данном эксперименте, был проведен
торов: исходным вектором LeGO iPuro2 и векто
транскриптомный анализ. На основе данного
ром iPuro2 BRAF V600E, несущим драйверную
анализа был выбран ряд генов, задействованных
онкогенную мутацию V600E гена BRAF человека.
в регуляции клеточного цикла и реализации
Вирусные частицы были получены, как описано
программы клеточного старения, и для них был
в статье Prokofjeva et al. [29]. Селекцию трансду
произведен анализ экспрессии с помощью ко
цированных клеток на пуромицине (финальная
личественной ПЦР в реальном времени (РВ
концентрация 1 мкг/мл) проводили в течение
ПЦР). В результате данной работы мы обнару
7 дней. Изменение транскрипционной програм
жили, что подавление экспрессии гена PTPN11
мы клетки после встраивания целевых генов до
с помощью малых интерферирующих РНК
полнительно подтверждали с помощью РВ ПЦР
(миРНК, siRNA) снижает влияние экспрессии
с использованием праймеров CCND1 F/R,
онкогена BRAF V600E на транскрипцию ряда
PAPSS2 F/R, FBLN1 F/R, (таблица), а также с
генов, участвующих в регуляции клеточного
помощью анализа данных экспрессионного про
цикла. В частности, подавление транскрипции
филирования.
PTPN11 препятствует повышению экспрессии
Подавление экспрессии гена PTPN11 и селек
(в ответ на действие BRAF V600E и/или вемура
тивное подавление BRAF V600E. Для ингибиро
фениба) генов, вовлеченных в онкоген индуци
вания BRAF V600E использовали селективный
рованное старение: RB1, p21, p15, p16 и IGFBP.
ингибитор - вемурафениб (PLX4032, «Selleck»,
Это позволяет предполагать, что тирозинфос
США) в концентрации 1 мкM. Подавление гена
фатаза SHP 2 участвует в индукции ОИС клетки
PTPN11 в клетках Nthy ori 3.1 и Nthy ori 3.1/
и, возможно, за счет этого выполняет функцию
BRAF V600E проводили с помощью малых ин
опухолевого супрессора.
терферирующих РНК, для трансфекции ис
пользовали реагент RNAiMAX («Thermo fisher
scientific», США) согласно протоколу произво
МЕТОДЫ ИССЛЕДОВАНИЯ
дителя. В случае совместного использования
миРНК добавлялись через 72 ч после добавле
Клонирование лентивирусных векторов, со
ния вемурафениба. Для нокдауна гена PTPN11
держащих кодирующую последовательность гена
использовали ранее опубликованные последо
BRAF с мутацией V600E. Для клонирования гена
вательности миРНК и последовательности со
BRAF, содержащего онкогенную мутацию
ответствующих контрольных sсRNA
[30]
V600E, 5′ конец гена BRAF вырезали из коммер
(табл. S1 Приложения).
чески доступной плазмиды pBABE Puro
Выделение РНК, синтез кДНК и количествен
BRAF(V600E) («Addgene», США) [28] по сайтам
ная РВ ПЦР. Суммарная РНК из клеточных ли
рестрикции BamHI и MunI, а 3′ конец ампли
ний Nthy ori 3 1 и Nthy ori 3 1/BRAF V600E бы
фицировали с помощью ПЦР, используя прай
ла выделена с использованием реагента Trizol
меры BRAF in Mun F и BRAF Not R (табли
(«Invitrogen», США) согласно инструкции про
ца). В качестве вектора использовали коммер
изводителя. Реакцию обратной транскрипции
чески доступную плазмиду LeGO iPuro2, содер
проводили с использованием 2 мкг тотальной
жащую ген устойчивости к пуромицину
РНК при помощи набора MMLV RT Kit («Евро
(«Lentiviral Gene Ontology Vectors», Германия). В
ген», Россия). Количественный ПЦР анализ
последовательность плазмиды заранее вводили
проводили, как описано в статье Schwartz et al.
сайты рестрикции BamHI (5′ конец) и NotI
[31]. Последовательности праймеров приведены
(3′ конец) для клонирования в лентивирусный
в соответствующем разделе таблицы.
вектор. Последовательности всех использован
Вестерн блот анализ. Вестерн блот анализ
ных в работе праймеров приведены в таблице.
проводили, как описано в статье Afanasyeva et al.
Работа с клеточной линией и трансдукция ленти
[32]. Лизаты клеток смешивали в соотношении
вирусными векторами. Клеточную линию иммор
3/1 с 4× буфером Лэммли, инкубировали 5 мин
БИОХИМИЯ том 85 вып. 1 2020
SHP 2 КОНТРОЛИРУЕТ ДЕЛЕНИЕ И СТАРЕНИЕ КЛЕТОК
129
Последовательности использованных в работе праймеров
Название праймера
5′ 3′ последовательность праймеров
Описание
1
2
3
PTPN11 F
5′
CGGTGAATGACTTTTGGCGG 3′
праймеры для анализа
PTPN11 R
5′
GTTCCTAACACGCATGACGC 3′
экспрессии PTPN11
PTPN11siRNA F
5′
GGAGAACGGUUUGAUUCUUTT 3′
РНК олигонуклеотиды с двумя
PTPN11siRNA R
5′
AAGAAUCAAACCGUUCUCCTCtt 3′
дезоксирибонуклеотидами на
3′ конце, используемые для
получения siRNA
PTPN11scRNA F
5′
AGUACAGCAAACGAUACGGtt 3′
РНК олигонуклеотиды с двумя
PTPN11scRNA R
5′
CCGUAUCGUUUGCUGUACUtt 3′
дезоксирибонулеотидами на
3′ конце, используемые для
получения scRNA
bACT F
5′
TGCGTGACATTAAGGAGAAG 3′
праймеры для анализа
bACT R
5′
GTCAGGCAGCTCGTAGCTCT 3′
экспрессии β актина
GAPDH F
5′
CAAGGTCATCCATGACAACTTTG 3′
праймеры для анализа
GAPDH R
5′
GGCCATCCACAGTCTTCTGG 3′
экспрессии GAPDH
CCND1 F
5′
GGCGGAGGAGAACAAACAGA 3′
праймеры для анализа
CCND1 R
5′
TGTGAGGCGGTAGTAGGACA 3′
экспрессии CCND1
PAPSS2 F
5′
TGCACTTTGACACCCTGCT 3′
праймеры для анализа
PAPSS2 R
5′
CAGCGTTCCTCTTTTCTGTGT 3′
экспрессии PAPSS2
FBLN1 F
5′
ATCAGAAGGACTGCTCGCTG 3′
праймеры для анализа
FBLN1 R
5′
ATGGCAGCACCTCTTCACAA 3′
экспрессии FBLN1
BRAF in Mun F
5′
TGATGATGAGAGGTCTAATCCCAGAGTG 3′
праймеры для клонирования
BRAF Not R
5′
TTTTGCGGCCGCTCAGTGGACAGGAAACGCACCA 3′
C конца BRAF(V600E)
P21 F
5′
ACTCTCAGGGTCGAAAACGG 3′
праймеры для анализа
P21 R
5′
GATGTAGAGCGGGCCTTTGA 3′
экспрессии p21
MAPK3 F
5′
CACCCTGGAAGCCATGAGAG 3′
праймеры для анализа
MAPK3 R
5′
TGGCGGAGTGGATGTACTTG 3′
экспрессии MAPK3 (ERK1)
CCNA1 F
5′
TAGGGCTGCTAACTGCAAATGG 3′
праймеры для анализа
CCNA1 R
5′
CCGGTGTCTACTTCATACACATCC 3′
экспрессии CCNA1
CCND2 F
5′
ATCCGCAAGCATGCTCAGAC 3′
праймеры для анализа
CCND2 R
5′
GCTCAGTCAGGGCATCACAA 3′
экспрессии CCND2
CCNG2 F
5′
GCCCAGAACCTCCACAACAG 3′
праймеры для анализа
CCNG2 R
5′
GGTGCACTCTTGATCACTGG 3′
экспрессии CCNG2
CDKN1C F
5′
AAGAGATCAGCGCCTGAGAAG 3′
праймеры для анализа
CDKN1C R
5′
TGGGCTCTAAATTGGCTCACC 3′
экспрессии CDKN1C
Notch4 F
5′
GGAGGAAGAAGAGGGGCAGT 3′
праймеры для анализа
Notch4 R
5′
CCCTCTGGGTCTGACCACT 3′
экспрессии Notch4
CCNC F
5′
AGTTATTGCCACTGCTACGGT 3′
праймеры для анализа
CCNC R
5′
AGCAGCAGCAATCAATCTTGT 3′
экспрессии CCNC
CCNB2 F
5′
AGTTCCAGTTCAACCCACCAA 3′
праймеры для анализа
CCNB2 R
5′
TTGCAGAGCAAGGCATCAGA 3′
экспрессии CCNB2
DUSP6 F
5′
ACCTGGAAGGTGGCTTCAGT 3′
праймеры для анализа
DUSP6 R
5′
GCACTATTGGGGTCTCGGTC 3′
экспрессии DUSP6
Mek1 F
5′
ATGCCCAAGAAGAAGCCGAC 3′
праймеры для анализа
Mek1 R
5′
GCTCTAGCTCCTCCAGCTTC 3′
экспрессии Mek1
9 БИОХИМИЯ том 85 вып. 1 2020
130
ПУТЛЯЕВА и др.
Окончание таблицы
1
2
3
P15 F
5′ GGGAAAGAAGGGAAGAGTGTCGTT 3′
праймеры для анализа
P15 R
5′ GCATGCCCTTGTTCTCCTCG 3′
экспрессии p15
P16 F
5′ GGGGGCACCAGAGGCAGT 3′
праймеры для анализа
P16 R
5′ GGTTGTGGCGGGGGCAGTT 3′
экспрессии p16
IGFBP7 F
5′ GGCATGGAGTGCGTGAAGAG 3′
праймеры для анализа
IGFBP7 R
5′ CTTGCTGACCTGGGTGATGG 3′
экспрессии IGFBP7
LeGO BRAF F
5′ TTCACCGCAGTGCATCAGAA 3′
праймеры для анализа
LeGO BRAF R
5′ AAACGCACACCGGCCTTATT 3′
экспрессии лентивирусного
вектора, содержащего ген
BRAF V600E
IL8 F
5′ ACCACCGGAAGGAACCATCT 3′
праймеры для анализа
IL8 R
5′ GAATTCTCAGCCCTCTTCAA 3′
экспрессии IL8
VEGFA F
5′ CTTGCCTTGCTGCTCTACCT 3′
праймеры для анализа
VEGFA R
5′ GCAGTAGCTGCGCTGATAGA 3′
экспрессии VEGFA
RB1 F
5′ GGACCGAGAAGGACCAACTG 3′
праймеры для анализа
RB1 R
5′ CTTCTGGGTCTGGAAGGCTG 3′
экспрессии RB1
IL6 F
5′ CATCCTCGACGGCATCTCA 3′
праймеры для анализа
IL6 R
5′ CAGGCAAGTCTCCTCATTGAA 3′
экспрессии IL6
при 95 °С и вносили в 10% ный ПААГ из расче
там кДНК были лигированы адаптеры, после
та 30 мкг белка на лунку. Анализ фосфорилиро
чего библиотеки были баркодированы, ампли
ванного варианта белка Erk1/2 проводили с ис
фицированы и очищены на магнитных части
пользованием антител Phospho p44/42 MAPK
цах. Все вышеперечисленные этапы были вы
(Erk1/2) (Thr202/Tyr204) («Cell signaling», США)
полнены с помощью набора реагентов NEBNext
в разведении 1 : 2000 согласно протоколу произ
Ultra II Directional RNA Library preparation kit for
водителя; в качестве вторичных антител были
Illumina («New England Biolabs», Англия). Кон
использованы конъюгированные с пероксида
центрацию библиотеки измеряли на флуори
зой хрена антитела козы к IgG кролика
метре Qubit 3.0 («Invitrogen», США), качество
(«Thermo Scientific», США) в разведении
библиотеки было проверено на Bioanalyser 2100
1 : 30 000. Для анализа содержания тотального
(«Agilent technologies», США). Перед секвениро
Erk1/2 использовали антитела p44/42 MAPK
ванием количество молекул библиотеки было
(Erk1/2) («Cell signaling», США) в разведении
валидировано с помощью РВ ПЦР при исполь
1 : 2000 и вторичные антитела козы к IgG мыши,
зовании 2,5× реакционной смеси для PCR PB с
конъюгированные с пероксидазой («Thermo
EVA Green («Синтол», Россия) и праймеров для
Scientific», США) в разведении 1 : 30 000.
адаптеров Illumina («Евроген», Россия). Далее с
Анализ транскриптома клеток. Тотальные РНК
учетом эффективной концентрации библиотека
клеточных линий Nthy ori 3 1 и Nthy ori 3 1/
была разведена до 2 нМ и смешана в пул в соот
BRAF V600E были получены, как описано вы
ветствии с ожидаемой глубиной секвенирова
ше. Из 400 нг тотальной РНК была выделена
ния. Секвенирование было выполнено на плат
мРНК с помощью набора реагентов NebNext
форме HiSeq 2500 («Illumina», Германия) в ре
PolyA mRNA Isolation Module («New England
жиме одноконцевых чтений длиной 57 п.н. с по
Biolabs», Англия). Полученная мРНК была
мощью набора HiSeq SR Cluster Kit v4 cBot и
фрагментирована (14 мин при 94 °С) в присут
HiSeq SBS Kit V4 50 cycle kit («Illumina», Герма
ствии случайных праймеров. На матрице фраг
ния). Исходные данные доступны на ресурсе
ментов мРНК была произведена обратная тран
SRA ncbi.nlm.nih.gov/sra/ (номер проекта
скрипция и синтезирована кДНК. После этого
PRJNA529086). Результаты были обработаны
проводили очистку продуктов реакции на маг
при помощи программы Trimmomatic для обрез
нитных частицах AMPure XP
(«Beckman
ки чтений [33], программы STAR для картирова
Coulter», США). Далее к полученным фрагмен
ния чтений на референсную последователь
БИОХИМИЯ том 85 вып. 1 2020
SHP 2 КОНТРОЛИРУЕТ ДЕЛЕНИЕ И СТАРЕНИЕ КЛЕТОК
131
ность человека (релиз GRCh38) [34] и алгоритма
MAPK) [41] и его фосфорилированной изофор
FeatureCounts для подсчета чтений для генов
мы - pErk - в клеточных линиях Nthy ori 3 1 и
[35]. Вышеописанные расчеты были выполнены
Nthy ori 3 1/BRAF V600E и показано, что в кле
с помощью оборудования ЦКП «Геном» http://
точной линии, содержащей мутацию V600E, ко
личество фосфорилированного белка Erk (pErk)
прочтений в каждом образце было нормализо
возрастает (рис. 1, г).
вано с помощью алгоритма DESeq2 [36]. Значе
Мы также провели сравнение полученных
ние корреляции определяли, как линейный ко
нами данных транскриптомного анализа кле
эффициент корреляции Пирсона (r Пирсона).
точных линий Nthy ori 3 1 и Nthy ori 3 1/BRAF
Для анализа дифференциальной экспрессии
V600E с аналогичными исследованиями, опуб
были выбраны гены, уровень мРНК которых из
ликованными ранее [42]. Корреляция тран
менялся в два и более раз. Для расчета обогаще
скриптомных данных, полученных для опубли
ния функциональных групп дифференциально
кованного ранее списка генов и созданной нами
экспрессируемыми генами использовали сервис
клеточной линии Nthy ori/BRAF V600E, равна
Metascape [37].
0,76, что демонстрирует достаточно высокую
степень схожести результатов.
Таким образом, полученные данные свиде
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
тельствуют о том, что созданная нами клеточная
линия Nthy ori/BRAF V600E, стабильно
Экспрессия гена BRAF с мутацией V600E в
экспрессирующая онкоген BRAF V600E, демон
клетках Nthy ori 3 1 активирует внутриклеточные
стрирует все признаки онкоген опосредуемого
сигнальные каскады RAS RAF MEK ERK. Для
изменения транскрипционной программы
исследования влияния фосфатазы SHP 2 на
клетки.
транскрипционную программу в опухолях щито
Подавление экспрессии гена PTPN11 умень
видной железы, содержащих онкогенную мута
шает экспрессию генов, участвующих в ОИС и ак
цию BRAF V600E, использовали ранее создан
тивации сигнальных путей MAPK и P13K AKT в
ную нами клеточную линию, стабильно экспрес
клетках, экспрессирующих BRAF V600E. Для
сирующую онкоген BRAF V600E. Для ее созда
сравнения совместного и раздельного использо
ния была использована клеточная линия фолли
вания селективного ингибитора BRAF V600E и
кулярного эпителия человека Nthy ori
3 1,
подавления экспрессии PTPN11 на экспресси
трансдуцированная лентивирусным конструк
онный профиль клеток эпителия щитовидной
том LeGO iPuro2 BRAF V600E (см. раздел «Ме
железы, содержащих мутацию BRAF V600E, был
тоды исследования»). Экспрессия лентивирус
произведен нокдаун гена PTPN11 на клеточных
ной мРНК, содержащей последовательность ис
линиях Nthy ori 3 1 и Nthy ori 3 1/BRAF V600E
следуемого онкогена, была подтверждена с по
с помощью малых интерферирующих РНК. Эф
мощью РВ ПЦР (рис. 1, а).
фективность подавления экспрессии PTPN11
Полученную клеточную линию Nthy ori/
была измерена с помощью метода количествен
BRAF V600E охарактеризовали с помощью ана
ной РВ ПЦР в исследуемых клеточных линиях.
лиза экспрессии ключевого эффектора MAP
Видно, что происходит существенное подавле
киназного каскада и PI3K AKT сигнального пу
ние экспрессии SHP 2 в случае обоих дериватов
ти, гена циклина D1 (CCND1) [38-40], экспрес
данной клеточной линий (рис. 2).
сия которого активирована в BRAF V600E со
Для изучения возможной роли SHP 2 в мо
держащих опухолях, а также анализа экспрессии
дуляции ответа исследуемых клеток на вемура
3′ фосфоаденозин 5′ фосфосульфат синтетазы
фениб мы провели анализ транскриптомов об
2 (PAPSS2) и фибулина 1 (FBLN1), экспрессия
разцов с нормальной и подавленной экспресси
которых в опухолях ЩЖ с данной мутацией
ей гена PTPN11, а также с воздействием вемура
значительно снижена (по результатам анализа
фениба и без него (результаты представлены в
публично доступных данных транскриптомного
табл. S1 Приложения). В результате проведен
профилирования [39] (рис. 1, б)). Нами было
ного анализа были получены группы генов, ре
показано, что экспрессия мутантной формы
гуляция которых в наибольшей степени меня
BRAF V600E приводила к умеренному повыше
лась при данных воздействиях. В ответ на воз
нию экспрессии CCND1 (примерно в 2-2,5 раза
действие вемурафениба в клетках, экспрессиру
по сравнению с нетрансфецированными клет
ющих онкоген BRAF V600E, можно отметить
ками), и к выраженному снижению экспрессии
выраженное изменение уровня мРНК генов, от
PAPSS2 и FBLN1 (рис. 1, в). Также было произ
носящихся к группам «внеклеточный матрикс»
ведено измерение количества ключевого эле
(группы 1 и 3), «клеточный ответ на воздействие
мента MAPK каскада, белка Erk1/2 (p44/42
ионов кальция» (группа 4) и «ответ на ксеноби
БИОХИМИЯ том 85 вып. 1 2020
9*
132
ПУТЛЯЕВА и др.
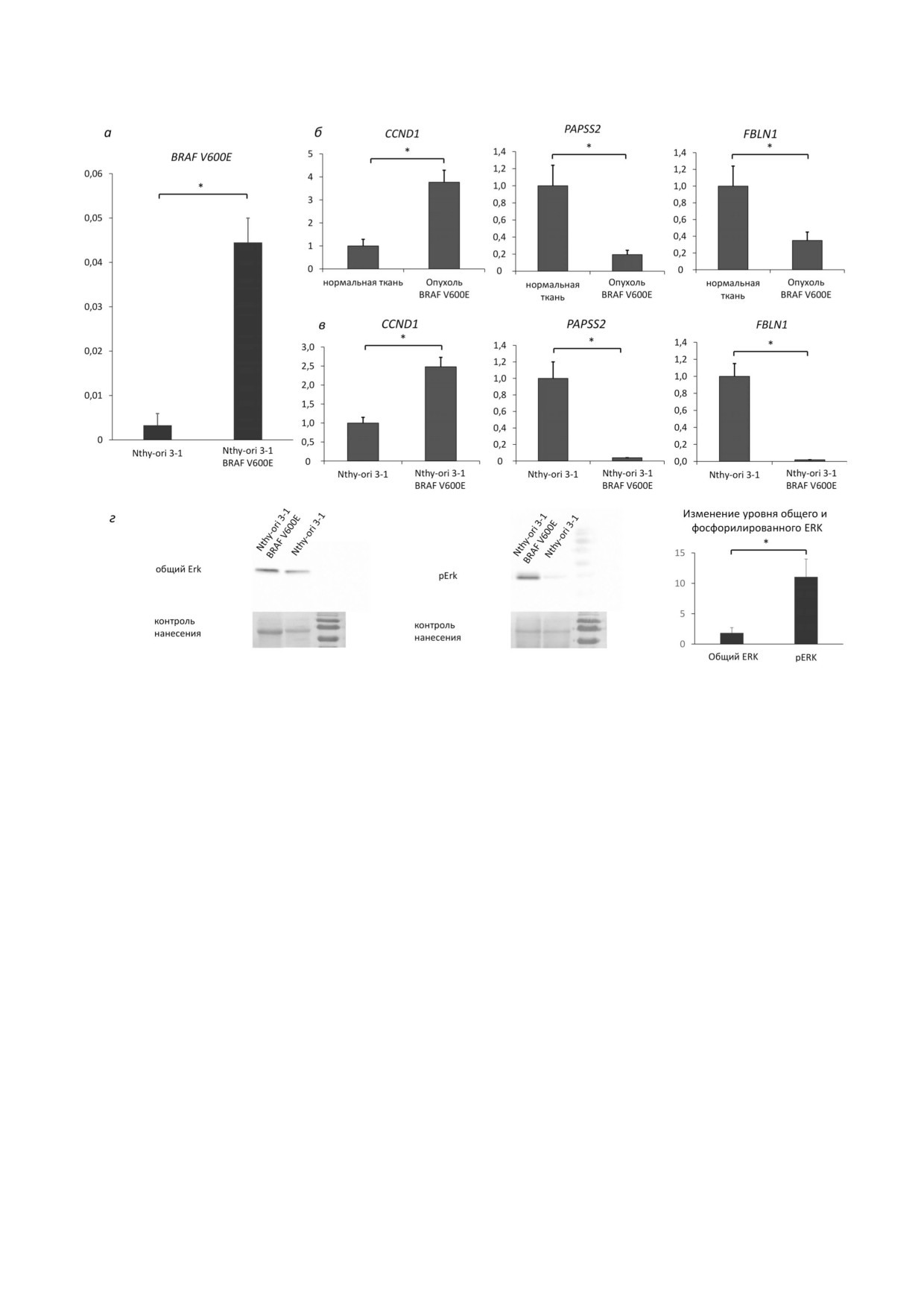
Рис. 1. a - Экспрессия лентивирусной мРНК, кодирующей онкоген BRAF V600E, нормализованная на уровень экспрес
сии GAPDH (ось ординат). По оси абсцисс указаны разные варианты исследуемых клеток, исходные клетки «Nthy ori 3.1»
и «Nthy ori 3.1 BRAF V600E» клетки, экспрессирующие данный онкоген. Указаны средние значения по 3 м независимым
измерениям ± SEM. * - Достоверные отличия между указанными значениями (р значение < 0,05 по критерию Стьюден
та). б - Экспрессионный профиль генов CCND1, PAPSS2, FBLN1 в нормальной ткани ЩЖ и опухоли ЩЖ, содержащей
мутацию BRAF V600E, по данным транскриптомного анализа (GEO dataset ID - GSE27155 [37]). Приведены уровни
экспрессии, нормированные на средние значения экспрессии соответствующих генов в нормальной ткани ЩЖ (ось ор
динат). Указаны средние значения для каждого типа опухоли ± SEM. * - Достоверные отличия между указанными значе
ниями (р значение < 0,05 по критерию Стьюдента). в - Экспрессионный профиль генов CCND1, PAPSS2, FBLN1 в не
трансфецированных клетках «Nthy ori 3.1» и в клетках с оверэкспрессией исследуемого онкогена «Nthy ori 3.1 BRAF
V600E», по данным РВ ПЦР (ось ординат). Нормализация на уровень экспрессии GAPDH и экспрессию мРНК соответ
ствующего гена в нетрансфецированных клетках Nthy ori 3.1. Указаны средние значения по 3 м независимым измерени
ям ± SEM. * - Достоверные отличия между указанными значениями (р значение < 0,05 по критерию Стьюдента). г - Вес
терн блот анализ фосфорилирования белка Erk1/2 (p44/42 MAPK). Справа показан результат анализа на фосфорилиро
ванный Erk1/2, слева - на общий. В обоих случаях приведен контроль нанесения (окраска мембраны красителем Понсо
S). На графике указано относительное значение роста общего и фосфорилированного Erk1/2 в клетках, экспрессирующих
BRAF V600E, относительно исходных клеток Nthy ori 3.1. Средние значения по 3 м независимым измерениям ± SEM.
* - Достоверные отличия между указанными значениями (р значение < 0,05 по критерию Стьюдента)
отики первой фазы» (группа 5) (рис. S1 а, в
мурафениба и коротких интерферирующих
Приложении). Подавление экспрессии гена
РНК к гену PTPN11 снижение уровня экспрес
PTPN11 приводило к изменению экспрессии ге
сии последнего было недостаточным, чтобы в
нов, относящихся к группам «хронический вос
полной мере оценить влияние данных воздей
палительный процесс» (группа 2), «клеточный
ствий на транскриптом. В связи с этим на осно
ответ на воздействие кортикостероидов» (груп
вании анализа других образцов был отобран ряд
па 3) и «позитивная регуляция секреции IL8»
генов, задействованных в процессах клеточного
(группа 4) (рис. S1 b, в Приложении). К сожале
роста, выживания и чувствительности к химио
нию, в образце с одновременным действием ве
терапии. Прежде всего, мы обратили внимание
БИОХИМИЯ том 85 вып. 1 2020
SHP 2 КОНТРОЛИРУЕТ ДЕЛЕНИЕ И СТАРЕНИЕ КЛЕТОК
133
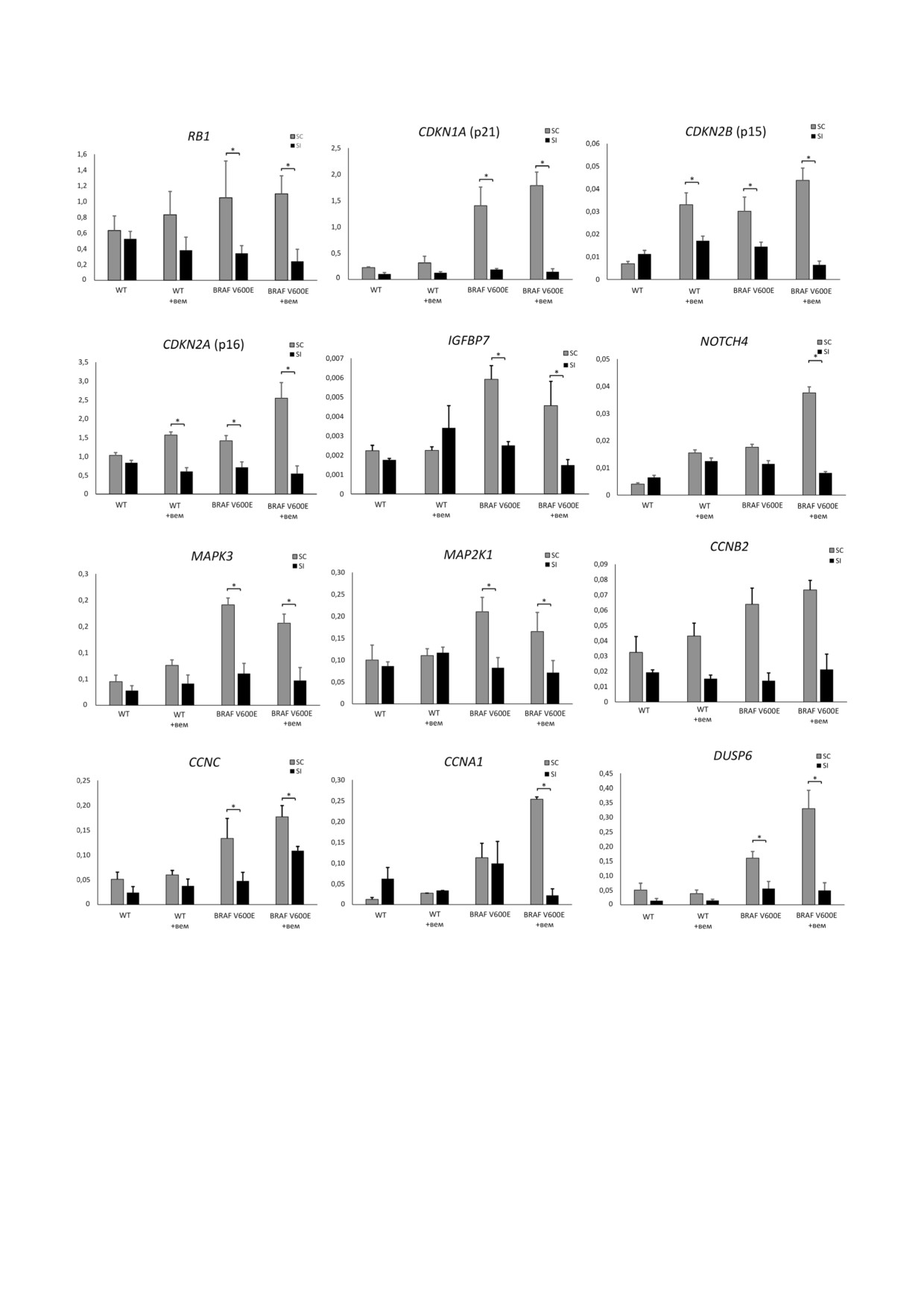
на выраженное влияние подавления экспрессии
нирует как важный элемент регуляции ОИС.
гена PTPN11 на экспрессию IL8, а также ряда
Любопытно, что добавление селективного ин
других провоспалительных и ростовых факто
гибитора BRAF V600E - вемурафениба - само
ров. Изменение уровня мРНК этих генов харак
по себе повышает экспрессию генов p15 и р16
терно для клеток, находящихся в состоянии он
даже в клетках, не содержащих онкоген, однако
коген индуцированного старения [43]. Кроме
этот эффект также пропадает в случае нокдауна
того, данное воздействие привело к изменению
PTPN11 (рис. 3).
экспрессии ряда ключевых факторов развития
Также мы показали, что введение мутации
ОИС (IL8, p15, p16, p21 и IGFBP7). Так фактор
BRAF V600E увеличивает экспрессию ряда ге
p21 способен осуществлять остановку клеточ
нов, участвующих в активации сигнальных пу
ного цикла в двух фазах (G1 и G2) за счет инги
тей MAPK и P13K AKT при агрессивном фено
бирования циклин зависимой киназы 1А [41,
типе опухоли: Notch4 [44], MAPK3 (ERK1),
42]. Фактор p16 оказывает воздействие через
MEK1, а также многих представителей семей
сигнальный путь pRb, подавляя действие цик
ства циклинов (гены CCNB2, CCNC и CCNA1).
лин зависимых киназ, что приводит к останов
Также было отмечено увеличение экспрессии не
ке клеточного цикла в фазе G1 [44], а фактор
гативного регулятора гиперактивации BRAF -
p15 реализует остановку пролиферации через
DUSP6 [45, 46]. Стоит отметить, что для выше
путь TGF β, его мишенями также являются
перечисленных генов использование вемурафе
циклин зависимые киназы (CDK4 и CDK6)
ниба зачастую усиливало эффект введения он
[45]. В свою очередь, для белка IGFBP7 показа
когена BRAF V600E, который затем нивелиро
на ключевая роль BRAF в ингибировании сиг
вался при подавлении PTPN11 (гены Notch4,
нального пути BRAF MEK ERK и активации
CCNA1, DUSP6 и др.). Известно, что гены Notch4
программы ОИС в невусе, содержащем мута
и CCNA1 участвуют в развитии лекарственной
цию V600E гена BRAF [46].
устойчивости при лечении рака груди [47] и ра
Таким образом, в результате анализа тран
ка яичников [48]. Также известно, что при повы
скриптома было обнаружено изменение
шении уровня экспрессии CCNA1 повышается
экспрессии этих генов, а также других, непосред
ственно задействованных в регуляции пролифе
рации и выживания клеток. Верификация изме
нения экспрессии ряда генов, задействованных
в данных процессах, была проведена с помощью
количественной РВ ПЦР в нескольких допол
нительных экспериментах (рис. 3).
Согласно полученным данным, экспрессия
ряда факторов участвующих в развитии онкоген
индуцируемого старения (p15, p16, p21 и IGFBP7)
повышена в клеточной линии Nthy ori 3 1/
BRAF V600E по сравнению с исходными им
мортализированными клетками фолликулярно
го эпителия ЩЖ (линия Nthy ori 3 1) (рис. 3).
Также экспрессия онкогена BRAF V600E приво
дит к повышению уровня РНК, кодирующих
белки IL6, IL8 и VEGFA, повышенная секреция
которых характерна для клеток, находящихся в
состоянии ОИС [43] (рис. S2 в Приложении).
Это говорит в пользу нашего предположения о
том, что экспрессия данных генов вызвана на
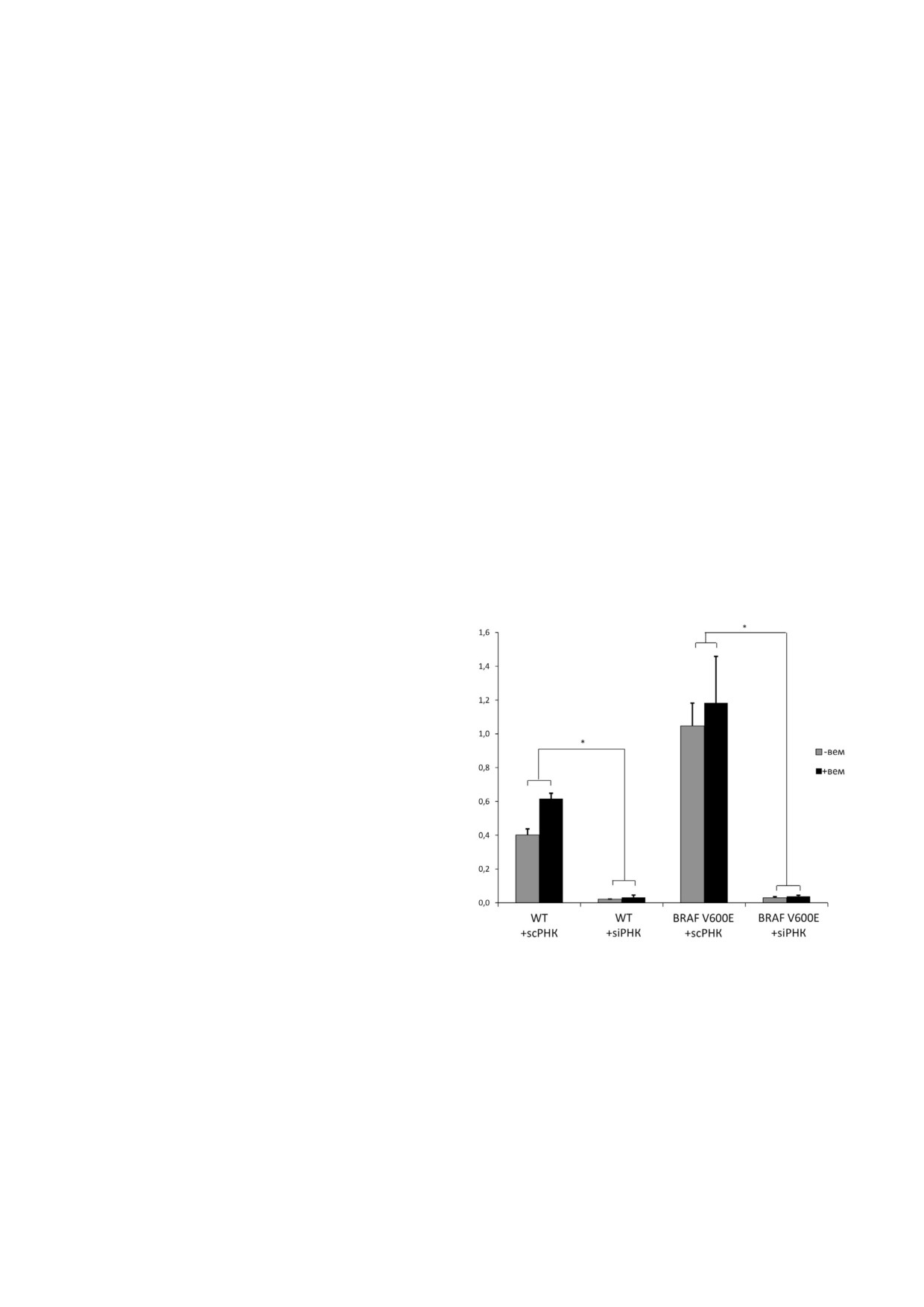
Рис. 2. Подавление экспрессии гена PTPN11 с помощью
личием в клетке онкогена BRAF V600E. Также
малых интерферирующих РНК в нетрансфецированных
было показано, что нокдаун гена PTPN11 значи
клетках «WT» и в клетках с оверэкспрессией исследуемого
онкогена «BRAF V600E», подвергнутых обработке вемура
тельно уменьшает экспрессию регуляторов
фениба (+вем) и без обработки. Клетки, обработанные
ОИС (RB1, P15, p16, p21 и IGFBP7) и генов
миРНК к гену PTPN11, обозначены «SI»; клетки, обрабо
ОИС ассоциированного секреторного профиля
танные контрольными РНК, обозначены «SC». Приведен
(IL6, IL8 и VEGFA), приближая их экспрессию в
относительный уровень экспрессии гена, нормализованно
го на экспрессию гена GAPDH (ось ординат). Указаны сред
клетках Nthy ori 3 1/BRAF V600E к уровню в
ние значения по двум независимым экспериментам ± SEM.
исходных клетках (рис. 3 и рис. S2 в Приложе
* - Достоверное отличие от образца, трансфецированного
нии). Исходя из этих данных, можно предполо
контрольными (scrambled) scРНК (р значение < 0,05 по
жить, что тирозинфосфатаза SHP 2 функцио
критерию Стьюдента)
БИОХИМИЯ том 85 вып. 1 2020
134
ПУТЛЯЕВА и др.
Рис. 3. Относительный уровень экспрессии ряда генов после подавления экспрессии гена PTPN11 с помощью миРНК
и/или селективного ингибирования BRAF V600E с использованием вемурафениба. По оси абсцисс указаны разные вари
анты исследуемых клеток, исходные клетки «WT» и клетки, экспрессирующие исследуемый онкоген «BRAF V600E», не
обработанные или обработанные вемурафенибом (+вем). Клетки, обработанные миРНК к гену PTPN11, обозначены
«SI», клетки, обработанные контрольными РНК, обозначены «SC». Приведены уровни экспрессии генов, нормализован
ные на экспрессию гена GAPDH (ось ординат). * - Означает достоверное отличие от образца, трансфецированного конт
рольными (scrambled) РНК (scRNA) (р значение < 0,05 по критерию Стьюдента)
частота развития острого лимфобластного лей
тальной аденокарциноме, раке молочной желе
коза в мышиной модели [49], а высокий уровень
зы [50] и аденоме гипофиза [51]. Подавление
экспрессии CCNB2 и CCNC может наблюдаться
экспрессии гена PTPN11 приводит к снижению
при развитии различных опухолей: колорек
влияния BRAF V600E на экспрессию генов цик
БИОХИМИЯ том 85 вып. 1 2020
SHP 2 КОНТРОЛИРУЕТ ДЕЛЕНИЕ И СТАРЕНИЕ КЛЕТОК
135
линов CCNA1, CCNB2 и CCNC и гена Notch4,
подавление компонентов каскада RAS/RAF/
что указывает на неоднозначную роль фосфота
MEK/ERK. С другой стороны, согласно полу
зы SHP 2 в развитии опухолей с мутацией BRAF
ченным нами данным фосфатаза SHP 2 играет
V600E.
важную роль в активации транскрипции фак
торов p15, p16, p21, RB1 и IGFBP7, участвующих
в ОИС, вызванной экспрессией BRAF V600E,
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
причем вемурафениб может удваивать ингиби
рующий эффект от подавления экспрессии
Нарушение пути передачи сигналов RAS/
PTPN11 в случае генов p15 и IGFBP7.
RAF/MEK/ERK характерно для многих типов
Таким образом, согласно нашему предполо
человеческих опухолей. Система контроля ак
жению, фосфатаза SHP 2 может играть важную
тивности компонентов MAPK каскада строит
роль в регуляции MAPK каскада и как фактор,
ся на негативной обратной связи между сами
передающий сигнал от EGFR, HER2 и др., и как
ми компонентами каскада. При нормальной
важный фактор, участвующий в негативной ре
активации данного каскада последовательно
гуляции каскада при нарушении его работы.
активируется ряд его элементов, однако при
Этим может объясняться двоякое влияние дан
появлении конститутивно активного участни
ной фосфатазы на процессы онкогенеза в зави
ка каскада (например, BRAF V600E) или при
симости от наличия или отсутствия мутаций
ингибировании какого то элемента каскада
компонентов MAPK каскада и компонентов
механизмы обратной связи могут соответ
ОИС, а также в зависимости от используемой
ственно блокировать или реактивировать про
терапии. Данные, представленные в этой статье,
хождение сигнала по каскаду. Мы предполага
указывают на возможные неоднозначные по
ем, что SHP 2 может играть важную роль в по
следствия подавления SHP 2 в клетках консти
добной регуляции данного каскада: с одной
тутивно активных участников каскада RAS/
стороны, участвовать в реактивации пролифе
RAF/MEK/ERK. С одной стороны, блокировка
рации в случае ингибирования определенных
данной фосфатазы позволяет предотвращать ре
элементов, а с другой стороны, подавлять деле
активацию пролиферации клеток в ответ на ис
ние клеток, экспрессирующих конститутивно
пользование ингибиторов отдельных компонен
активный компонент каскада. Так было пока
тов каскада, с другой - подавление SHP 2 мо
зано, что единичное терапевтическое ингиби
жет привести к активации пролиферации кле
рование одного компонента MAPK каскада
ток из за нарушения ОИС.
при опухолях различной этиологии (например,
MEK или RAF) приводит к повышению
экспрессии различных рецепторных тирозин
Финансирование. Исследование выполнено
киназ и, как следствие, возникновению адап
при финансовой поддержке Российского фонда
тивной устойчивости опухоли к ингибитору
фундаментальных исследований в рамках науч
[52-55]. Однако комбинация ингибиторов
ного проекта № 18 315 00171 мол_а; лентиви
против SHP 2 и ALK или MEK позволяет эф
русный вектор, содержащий ген BRAF V600E и
фективно подавлять рост опухолевых клеток с
данные для рис. 1, получены при финансовой
нарушенной регуляцией ALK [56] и RAS [57].
поддержке Российского научного фонда (грант
Полученные нами данные о роли SHP 2 в регу
№ 16 15 10423).
ляции транскрипции генов (Notch4, CCNA1),
Конфликт интересов. Авторы заявляют, что у
связанных с активацией опухолевого роста в
них нет конфликта интересов.
ответ на экспрессию онкогена BRAF V600E в
Соблюдение этических норм. Настоящая
присутствии вемурафениба, также указывают
статья не содержит каких либо исследований с
на способность SHP 2 участвовать в реактива
участием людей в качестве объектов исследова
ции регуляции пролиферации клеток в ответ на
ний или с использованием животных.
СПИСОК ЛИТЕРАТУРЫ
1.
Burotto, M., Chiou, V.L., Lee, J.M., and Kohn, E.C.
3.
Mesa, C. Jr., Mirza, M., Mitsutake, N., Sartor, M.,
(2014) The MAPK pathway across different malignancies:
Medvedovic, M., Tomlinson, C., Knauf, J.A., Weber, G.F.,
a new perspective, Cancer, 120, 3446-3456, doi: 10.1002/
and Fagin, J.A.
(2006) Conditional activation of
cncr.28864.
RET/PTC3 and BRAFV600E in thyroid cells is associated
2.
Davies, H., Bignell, G.R., Cox, C., Stephens, P., Edkins, S.,
with gene expression profiles that predict a preferential role
et al. (2002) Mutations of the BRAF gene in human can
of BRAF in extracellular matrix remodeling, Cancer Res.,
cer, Nature, 417, 949-954, doi: 10.1038/nature00766.
66, 6521-6529, doi: 10.1158/0008 5472.CAN 06 0739.
БИОХИМИЯ том 85 вып. 1 2020
136
ПУТЛЯЕВА и др.
4.
Long, G.V., Menzies, A.M., Nagrial, A.M., Haydu, L.E.,
16.
Qu, C.K., Shi, Z.Q., Shen, R., Tsai, F.Y., Orkin, S.H., and
Hamilton, A.L., Mann, G.J., Hughes, T.M., Thompson, J.F.,
Feng, G.S. (1997) A deletion mutation in the SH2 N
Scolyer, R.A., and Kefford, R.F. (2011) Prognostic and
domain of Shp 2 severely suppresses hematopoietic cell
clinicopathologic associations of oncogenic BRAF in
development, Mol. Cell. Biol., 17, 5499-5507.
metastatic melanoma, J. Clin. Oncol., 29, 1239-1246,
17.
Bard Chapeau, E.A., Li, S., Ding, J., Zhang, S.S.,
doi: 10.1200/JCO.2010.32.4327.
Zhu, H.H., Princen, F., Fang, D.D., Han, T., Bailly
5.
Loh, M.L., Vattikuti, S., Schubbert, S., Reynolds, M.G.,
Maitre, B., Poli, V., Varki, N.M., Wang, H., and
Carlson, E., Lieuw, K.H., Cheng, J.W., Lee, C.M., Stokoe, D.,
Feng, G.S. (2011) Ptpn11/Shp2 acts as a tumor suppressor
Bonifas, J.M., Curtiss, N.P., Gotlib, J., Meshinchi, S., Le
in hepatocellular carcinogenesis, Cancer Cell,
19,
Beau, M.M., Emanuel, P.D., and Shannon, K.M. (2004)
629-639, doi: 10.1016/j.ccr.2011.03.023.
Mutations in PTPN11 implicate the SHP 2 phosphatase in
18.
Yang, W., Wang, J., Moore, D.C., Liang, H., Dooner, M.,
leukemogenesis, Blood, 103, 2325-2331, doi: 10.1182/
Wu, Q., Terek, R., Chen, Q., Ehrlich, M.G., Quesenberry, P.J.,
blood 2003 09 3287.
and Neel, B.G. (2013) Ptpn11 deletion in a novel progeni
6.
Mohi, M.G., Williams, I.R., Dearolf, C.R., Chan, G.,
tor causes metachondromatosis by inducing hedgehog sig
Kutok, J.L., Cohen, S., Morgan, K., Boulton, C.,
nalling, Nature, 499, 491-495, doi: 10.1038/nature12396.
Shigematsu, H., Keilhack, H., Akashi, K., Gilliland, D.G.,
19.
Hill, K.S., Roberts, E.R., Wang, X., Marin, E., Park, T.D.,
and Neel, B.G. (2005) Prognostic, therapeutic, and mech
Son, S., Ren, Y., Fang, B., Yoder, S., Kim, S., Wan, L.,
anistic implications of a mouse model of leukemia evoked
Sarnaik, A.A., Koomen, J.M., Messina, J.L., Teer, J.K.,
by Shp2 (PTPN11) mutations, Cancer Cell, 7, 179-191,
Kim, Y., Wu, J., Chalfant, C.E., and Kim, M. (2019)
doi: 10.1016/j.ccr.2005.01.010.
PTPN11 plays oncogenic roles and is a therapeutic target
7.
Tartaglia, M., Mehler, E.L., Goldberg, R., Zampino, G.,
for BRAF wild type melanomas, Mol. Cancer Res., 17,
Brunner, H.G., Kremer, H., van der Burgt, I., Crosby, A.H.,
583-593, doi: 10.1158/1541 7786.MCR 18 0777.
Ion, A., Jeffery, S., Kalidas, K., Patton, M.A.,
20.
Zhan, Y., Counelis, G.J., and O’Rourke, D.M. (2009) The
Kucherlapati, R.S., and Gelb, B.D. (2001) Mutations in
protein tyrosine phosphatase SHP 2 is required for
PTPN11, encoding the protein tyrosine phosphatase SHP 2,
EGFRvIII oncogenic transformation in human glioblas
cause Noonan syndrome, Nat. Genet., 29, 465-468,
toma cells, Exp. Cell Res., 315, 2343-2357, doi: 10.1016/
doi: 10.1038/ng772.
j.yexcr.2009.05.001.
8.
Chan, G., Kalaitzidis, D., and Neel, B.G. (2008) The tyro
21.
Hu, Z.Q., Ma, R., Zhang, C.M., Li, J., Li, L., Hu, Z.T.,
sine phosphatase Shp2 (PTPN11) in cancer, Cancer
Gao, Q.I., and Li, W.M. (2015) Expression and clinical
Metastasis Rev., 27, 179-192, doi: 10.1007/s10555 008
significance of tyrosine phosphatase SHP2 in thyroid car
9126 y.
cinoma, Oncol. Lett., 10, 1507-1512, doi: 10.3892/
9.
Chan, R.J., and Feng, G.S. (2007) PTPN11 is the first
ol.2015.3479.
identified proto oncogene that encodes a tyrosine phos
22.
Prahallad, A., Heynen, G.J., Germano, G., Willems, S.M.,
phatase, Blood, 109, 862-867, doi: 10.1182/blood 2006
Evers, B., Vecchione, L., Gambino, V., Lieftink, C.,
07 028829.
Beijersbergen, R.L., Di Nicolantonio, F., Bardelli, A., and
10.
Li, S.M. (2016) Биологические функции SHP2 при за
Bernards, R. (2015) PTPN11 is a central node in intrinsic
болеваниях человека, Мол. Биол. (Москва), 50, 27-33,
and acquired resistance to targeted cancer drugs, Cell Rep.,
doi: 10.7868/S0026898416010110.
12, 1978-1985, doi: 10.1016/j.celrep.2015.08.037.
11.
Matozaki, T., Murata, Y., Saito, Y., Okazawa, H., and
23.
Schneeberger, V.E., Ren, Y., Luetteke, N., Huang, Q.,
Ohnishi, H. (2009) Protein tyrosine phosphatase SHP 2: a
Chen, L., Lawrence, H.R., Lawrence, N.J., Haura, E.B.,
proto oncogene product that promotes Ras activation,
Koomen, J.M., Coppola, D., and Wu, J. (2015) Inhibition
Cancer Sci.,
100,
1786-1793, doi:
10.1111/j.1349
of Shp2 suppresses mutant EGFR induced lung tumors in
7006.2009.01257.x.
transgenic mouse model of lung adenocarcinoma,
12.
Zhang, S.Q., Tsiaras, W.G., Araki, T., Wen, G.,
Oncotarget, 6, 6191-6202, doi: 10.18632/oncotarget.3356.
Minichiello, L., Klein, R., and Neel, B.G.
(2002)
24.
Chen, Y.N., LaMarche, M.J., Chan, H.M., Fekkes, P.,
Receptor specific regulation of phosphatidylinositol 3′
Garcia Fortanet, J., et al. (2016) Allosteric inhibition of
kinase activation by the protein tyrosine phosphatase Shp2,
SHP2 phosphatase inhibits cancers driven by receptor
Mol. Cell. Biol., 22, 4062-4072.
tyrosine kinases, Nature, 535, 148-152, doi: 10.1038/
13.
Saxton, T.M., Henkemeyer, M., Gasca, S., Shen, R.,
nature18621.
Rossi, D.J., Shalaby, F., Feng, G.S., and Pawson, T. (1997)
25.
Chapman, P.B., Hauschild, A., Robert, C., Haanen, J.B.,
Abnormal mesoderm patterning in mouse embryos mutant
Ascierto, P., et al. (2011) Improved survival with vemu
for the SH2 tyrosine phosphatase Shp 2, EMBO J., 16,
rafenib in melanoma with BRAF V600E mutation, N. Engl.
2352-2364, doi: 10.1093/emboj/16.9.2352.
J. Med., 364, 2507-2516, doi: 10.1056/NEJMoa1103782.
14.
Tajan, M., Batut, A., Cadoudal, T., Deleruyelle, S., Le,
26.
Montero Conde, C., Ruiz Llorente, S., Dominguez, J.M.,
Gonidec, S., Saint Laurent, C., Vomscheid, M., Wanecq, E.,
Knauf, J.A., Viale, A., Sherman, E.J., Ryder, M.,
Treguer, K., De Rocca Serra Nedelec, A., Vinel, C.,
Ghossein, R.A., Rosen, N., and Fagin, J.A. (2013) Relief
Marques, M.A., Pozzo, J., Kunduzova, O., Salles, J.P.,
of feedback inhibition of HER3 transcription by RAF and
Tauber, M., Raynal, P., Cave, H., Edouard, T., Valet, P.,
MEK inhibitors attenuates their antitumor effects in
and Yart, A. (2014) LEOPARD syndrome associated
BRAF mutant thyroid carcinomas, Cancer Discov., 3,
SHP2 mutation confers leanness and protection from diet
520-533, doi: 10.1158/2159 8290.CD 12 0531.
induced obesity, Proc. Natl. Acad. Sci. USA,
111,
27.
Nazarian, R., Shi, H., Wang, Q., Kong, X., Koya, R.C.,
E4494-E4503, doi: 10.1073/pnas.1406107111.
Lee, H., Chen, Z., Lee, M.K., Attar, N., Sazegar, H.,
15.
Chen, L., Chen, W., Mysliwski, M., Serio, J., Ropa, J.,
Chodon, T., Nelson, S.F., McArthur, G., Sosman, J.A.,
Abulwerdi, F.A., Chan, R.J., Patel, J.P., Tallman, M.S.,
Ribas, A., and Lo, R.S. (2010) Melanomas acquire resis
Paietta, E., Melnick, A., Levine, R.L., Abdel Wahab, O.,
tance to B RAF(V600E) inhibition by RTK or N RAS
Nikolovska Coleska, Z., and Muntean, A.G. (2015) Mutated
upregulation, Nature,
468,
973-977, doi:
10.1038/
Ptpn11 alters leukemic stem cell frequency and reduces the
nature09626.
sensitivity of acute myeloid leukemia cells to Mcl1 inhibition,
28.
Boehm, J.S., Zhao, J.J., Yao, J., Kim, S.Y., Firestein, R.,
Leukemia, 29, 1290-1300, doi: 10.1038/leu.2015.18.
Dunn, I.F., Sjostrom, S.K., Garraway, L.A., Weremowicz, S.,
БИОХИМИЯ том 85 вып. 1 2020
SHP 2 КОНТРОЛИРУЕТ ДЕЛЕНИЕ И СТАРЕНИЕ КЛЕТОК
137
Richardson, A.L., Greulich, H., Stewart, C.J., Mulvey, L.A.,
Priolo, C., Puxeddu, E., Finn, S., Jarzab, B., Hodin, R.A.,
Shen, R.R., Ambrogio, L., Hirozane Kishikawa, T., Hill, D.E.,
Pontecorvi, A., Nose, V., Lawler, J., and Parangi, S. (2010)
Vidal, M., Meyerson, M., Grenier, J.K., Hinkle, G., Root, D.E.,
B Raf(V600E) and thrombospondin 1 promote thyroid
Roberts, T.M., Lander, E.S., Polyak, K., and Hahn, W.C.
cancer progression, Proc. Natl. Acad. Sci. USA, 107,
(2007) Integrative genomic approaches identify IKBKE as
10649-10654, doi: 10.1073/pnas.1004934107.
a breast cancer oncogene, Cell,
129,
1065-1079,
41.
Roskoski, R. Jr. (2012) ERK1/2 MAP kinases: structure,
doi: 10.1016/j.cell.2007.03.052.
function, and regulation, Pharmacol. Res., 66, 105-143,
29.
Prokofjeva, M.M., Proshkina, G.M., Lebedev, T.D.,
doi: 10.1016/j.phrs.2012.04.005.
Shulgin, A.A., Spirin, P.V., Prassolov, V.S., and Deyev, S.M.
42.
Kim, B.A., Jee, H.G., Yi, J.W., Kim, S.J., Chai, Y.J., Choi, J.Y.,
(2017) Lentiviral gene delivery to plasmolipin expressing
and Lee, K.E. (2017) Expression profiling of a human thy
cells using Mus caroli endogenous retrovirus envelope pro
roid cell line stably expressing the BRAFV600E mutation,
tein, Biochimie, 142, 226-233, doi: 10.1016/j.biochi.
Cancer Genom. Proteomics, 14, 53-67, doi: 10.21873/
2017.09.004.
cgp.20018.
30.
Liu, Z., Zhao, Y., Fang, J., Cui, R., Xiao, Y., and Xu, Q.
43.
Coppe, J.P., Desprez, P.Y., Krtolica, A., and Campisi, J.
(2017) SHP2 negatively regulates HLA ABC and PD L1
(2010) The senescence associated secretory phenotype:
expression via STAT1 phosphorylation in prostate cancer
the dark side of tumor suppression, Annu. Rev. Pathol., 5,
cells, Oncotarget, 8, 53518-53530, doi: 10.18632/oncotarget.
99-118, doi: 10.1146/annurev pathol 121808 102144.
18591.
44.
Hardy, K.M., Kirschmann, D.A., Seftor, E.A., Margaryan, N.V.,
31.
Schwartz, A.M., Putlyaeva, L.V., Covich, M., Klepikova, A.V.,
Postovit, L.M., Strizzi, L., and Hendrix, M.J.
(2010)
Akulich, K.A., Vorontsov, I.E., Korneev, K.V., Dmitriev, S.E.,
Regulation of the embryonic morphogen Nodal by Notch4
Polanovsky, O.L., Sidorenko, S.P., Kulakovskiy, I.V., and
facilitates manifestation of the aggressive melanoma phe
Kuprash, D.V. (2016) Early B cell factor 1 (EBF1) is criti
notype, Cancer Res., 70, 10340-10350, doi: 10.1158/0008
cal for transcriptional control of SLAMF1 gene in human
5472.CAN 10 0705.
B cells, Biochim. Biophys. Acta,
1859,
1259-1268,
45.
Kim, Y.H., Choi, Y.W., Han, J.H., Lee, J., Soh, E.Y.,
doi: 10.1016/j.bbagrm.2016.07.004.
Park, S.H., Kim, J.H., and Park, T.J. (2014) TSH signaling
32.
Afanasyeva, M.A., Britanova, L.V., Korneev, K.V.,
overcomes B RafV600E induced senescence in papillary
Mitkin, N.A., Kuchmiy, A.A., and Kuprash, D.V. (2014)
thyroid carcinogenesis through regulation of DUSP6,
Clusterin is a potential lymphotoxin beta receptor target
Neoplasia,
16,
1107-1120, doi:
10.1016/j.neo.2014.
that is upregulated and accumulates in germinal centers of
10.005.
mouse spleen during immune response, PLoS One, 9,
46.
Moulana, F.I., Priyani, A.A.H., de Silva, M.V.C., and
e98349, doi: 10.1371/journal.pone.0098349.
Dassanayake, R.S.
(2018) BRAF oncogene induced
33.
Bolger, A.M., Lohse, M., and Usadel, B. (2014) Trimmo
senescence and the role of thyroid stimulating hormone
matic: a flexible trimmer for Illumina sequence data,
signaling in the progression of papillary thyroid carcinoma,
Bioinformatics, 30, 2114-2120, doi: 10.1093/bioinformatics/
Horm. Cancer, 9, 1-11, doi: 10.1007/s12672 017 0315 4.
btu170.
47.
Simões, B.M., O’Brien, C.S., Eyre, R., Silva, A., Yu, L.,
34.
Dobin, A., Davis, C.A., Schlesinger, F., Drenkow, J.,
Sarmiento Castro, A., Alferez, D.G., Spence, K.,
Zaleski, C., Jha, S., Batut, P., Chaisson, M., and Gingeras, T.R.
Santiago Gomez, A., Chemi, F., Acar, A., Gandhi, A.,
(2013) STAR: ultrafast universal RNA seq aligner,
Howell, A., Brennan, K., Ryden, L., Catalano, S., et al.
Bioinformatics, 29, 15-21, doi: 10.1093/bioinformatics/
(2015) Anti estrogen resistance in human breast tumors is
bts635.
driven by JAG1 NOTCH4 dependent cancer stem cell
35.
Liao, Y., Smyth, G.K., and Shi, W. (2014) featureCounts:
activity, Cell Rep., 12, 1968-1977, doi: 10.1016/j.celrep.
an efficient general purpose program for assigning
2015.08.050.
sequence reads to genomic features, Bioinformatics, 30,
48.
Huang, K.C., Yang, J., Ng, M.C., Ng, S.K., Welch, W.R.,
923-930, doi: 10.1093/bioinformatics/btt656.
Muto, M.G., Berkowitz, R.S., and Ng, S.W. (2016) Cyclin
36.
Love, M.I., Huber, W., and Anders, S. (2014) Moderated
A1 expression and paclitaxel resistance in human ovarian
estimation of fold change and dispersion for RNA seq data
cancer cells, Eur. J. Cancer,
67,
152-163,
with DESeq2, Genome Biol., 15, 550, doi: 10.1186/s13059
doi: 10.1016/j.ejca.2016.08.007.
014 0550 8.
49.
Liao, C., Wang, X.Y., Wei, H.Q., Li, S.Q., Merghoub, T.,
37.
Zhou, Y., Zhou, B., Pache, L., Chang, M., Khodabakhshi, A.H.,
Pandolfi, P.P., and Wolgemuth, D.J. (2001) Altered
Tanaseichuk, O., Benner, C., and Chanda, S.K. (2019)
myelopoiesis and the development of acute myeloid
Metascape provides a biologist oriented resource for the
leukemia in transgenic mice overexpressing cyclin A1,
analysis of systems level datasets, Nat. Commun., 10, 1523,
Proc. Natl. Acad. Sci. USA, 98, 6853-6858, doi: 10.1073/
doi: 10.1038/s41467 019 09234 6.
pnas.121540098.
38.
Castellone, M.D., De Falco, V., Rao, D.M., Bellelli, R.,
50.
Valladares, A., Hernandez, N.G., Gomez, F.S., Curiel
Muthu, M., Basolo, F., Fusco, A., Gutkind, J.S., and
Quezada, E., Madrigal Bujaidar, E., Vergara, M.D.,
Santoro, M. (2009) The beta catenin axis integrates multi
Martinez, M.S., and Arenas Aranda, D.J. (2006) Genetic
ple signals downstream from RET/papillary thyroid carci
expression profiles and chromosomal alterations in spo
noma leading to cell proliferation, Cancer Res., 69,
radic breast cancer in Mexican women, Cancer Genet.
1867-1876, doi: 10.1158/0008 5472.CAN 08 1982.
Cytogenet., 170, 147-151, doi: 10.1016/j.cancergencyto.
39.
Giordano, T.J., Kuick, R., Thomas, D.G., Misek, D.E.,
2006.06.002.
Vinco, M., Sanders, D., Zhu, Z., Ciampi, R., Roh, M.,
51.
Takashima, S., Saito, H., Takahashi, N., Imai, K., Kudo, S.,
Shedden, K., Gauger, P., Doherty, G., Thompson, N.W.,
Atari, M., Saito, Y., Motoyama, S., and Minamiya, Y.
Hanash, S., Koenig, R.J., and Nikiforov, Y.E.
(2005)
(2014) Strong expression of cyclin B2 mRNA correlates
Molecular classification of papillary thyroid carcinoma: dis
with a poor prognosis in patients with non small cell lung
tinct BRAF, RAS, and RET/PTC mutation specific gene
cancer, Tumour Biol., 35, 4257-4265, doi: 10.1007/
expression profiles discovered by DNA microarray analysis,
s13277 013 1556 7.
Oncogene, 24, 6646-6656, doi: 10.1038/sj.onc.1208822.
52.
Ahmed, T.A., Adamopoulos, C., Karoulia, Z., Wu, X.,
40.
Nucera, C., Porrello, A., Antonello, Z.A., Mekel, M.,
Sachidanandam, R., Aaronson, S.A., and Poulikakos, P.I.
Nehs, M.A., Giordano, T.J., Gerald, D., Benjamin, L.E.,
(2019) SHP2 Drives adaptive resistance to ERK signaling
БИОХИМИЯ том 85 вып. 1 2020
138
ПУТЛЯЕВА и др.
inhibition in molecularly defined subsets of ERK depen
inhibition in triple negative breast cancer, Cell, 149,
dent tumors, Cell Rep., 26, 65-78 e65, doi: 10.1016/j.celrep.
307-321, doi: 10.1016/j.cell.2012.02.053.
2018.12.013.
55. Karoulia, Z., Wu, Y., Ahmed, T.A., Xin, Q., Bollard, J.,
53.
Corcoran, R.B., Ebi, H., Turke, A.B., Coffee, E.M.,
Krepler, C., Wu, X., Zhang, C., Bollag, G., Herlyn, M.,
Nishino, M., Cogdill, A.P., Brown, R.D., Della Pelle, P.,
Fagin, J.A., Lujambio, A., Gavathiotis, E., and Poulikakos, P.I.
Dias Santagata, D., Hung, K.E., Flaherty, K.T., Piris, A.,
(2016) An integrated model of RAF inhibitor action pre
Wargo, J.A., Settleman, J., Mino Kenudson, M., and
dicts inhibitor activity against oncogenic BRAF signaling,
Engelman, J.A. (2012) EGFR mediated re activation of
Cancer Cell, 30, 485-498, doi: 10.1016/j.ccell.2016.
MAPK signaling contributes to insensitivity of BRAF
06.024.
mutant colorectal cancers to RAF inhibition with vemu
56. Dardaei, L., Wang, H.Q., Singh, M., Fordjour, P., Shaw, K.X.,
rafenib, Cancer Discov., 2, 227-235, doi: 10.1158/2159
et al. (2018) SHP2 inhibition restores sensitivity in ALK
8290.CD 11 0341.
rearranged non small cell lung cancer resistant to ALK
54.
Duncan, J.S., Whittle, M.C., Nakamura, K., Abell, A.N.,
inhibitors, Nat. Med., 24, 512-517, doi: 10.1038/nm.4497.
Midland, A.A., Zawistowski, J.S., Johnson, N.L.,
57. Mainardi, S., Mulero Sanchez, A., Prahallad, A.,
Granger, D.A., Jordan, N.V., Darr, D.B., Usary, J.,
Germano, G., Bosma, A., Krimpenfort, P., Lieftink, C.,
Kuan, P.F., Smalley, D.M., Major, B., He, X., Hoadley, K.A.,
Steinberg, J.D., de Wit, N., Goncalves Ribeiro, S., Nadal, E.,
Zhou, B., Sharpless, N.E., Perou, C.M., Kim, W.Y.,
Bardelli, A., Villanueva, A., and Bernards, R. (2018) SHP2
Gomez, S.M., Chen, X., Jin, J., Frye, S.V., Earp, H.S.,
is required for growth of KRAS mutant non small cell
Graves, L.M., and Johnson, G.L. (2012) Dynamic repro
lung cancer in vivo, Nat. Med., 24, 961-967, doi: 10.1038/
gramming of the kinome in response to targeted MEK
s41591 018 0023 9.
PTPN11 KNOCKDOWN PREVENTS CHANGES IN THE EXPRESSION
OF GENES CONTROLLING CELL CYCLE, CHEMOTHERAPY
RESISTANCE, AND ONCOGENE INDUCED SENESCENCE
IN HUMAN THYROID CELLS OVEREXPRESSING
BRAF V600E ONCOGENIC PROTEIN*,**
L. V. Putlyaeva1,2, D. E. Demin1,3, A. N. Uvarova1,4, L. S. Zinevich5, M. M. Prokofjeva1,
G. R. Gazizova6, E. I. Shagimardanova6, and A. M. Schwartz1***
1 Engelhardt Institute of Molecular Biology, Russian Academy of Sciences,
119991 Moscow, Russia; E4mail: shvarec@yandex.ru
2 Center of Life Sciences, Skolkovo Institute of Science and Technology, Moscow, Russia
3 Moscow Institute of Physics and Technology, 141701 Dolgoprudnyi, Moscow Region, Russia
4 Lomonosov Moscow State University, Faculty of Biology, 119234 Moscow, Russia
5 Koltzov Institute of Developmental Biology, Russian Academy of Sciences, 119334 Moscow, Russia
6 Institute of Fundamental Medicine and Biology, Kazan Federal University, 420008 Kazan, Russia
Received September 21, 2019
Revised September 21, 2019
Accepted October 20, 2019
The MAPK (RAS/BRAF/MEK/ERK) signaling pathway is a kinase cascade involved in the regulation of cell prolif
eration, differentiation, and survival in response to external stimuli. The V600E mutation in the BRAF gene has been
detected in various tumors, resulting in a 500 fold increase in the BRAF kinase activity. However, monotherapy with
selective BRAF V600E inhibitors often leads to the reactivation of MAPK signaling cascade and emergence of drug
resistance. Therefore, new targets are being developed for the inhibition of components of the aberrantly activated
cascade. It was recently discovered that resistance to the BRAF V600E inhibitors may be associated with the activity
of the tyrosine phosphatase SHP 2 encoded by the PTPN11 gene. In this paper, we analyzed transcriptional effects of
the PTPN11 gene knockdown and selective suppression of BRAF V600E in a model of thyroid follicular epithelium.
We found that the siRNA mediated knockdown of PTPN11 after vemurafenib treatment prevented an increase in the
expression of CCNA1 and NOTCH4 genes involved in the formation of drug resistance of tumors. On the other hand,
downregulation of PTPN11 expression blocked the transcriptional activation of genes (p21, p15, p16, and IGFBP7)
involved in the cell cycle regulation and oncogene induced senescence in response to the BRAF V600E expression.
Therefore, it can be assumed that SHP 2 participates not only in the drug resistance emergence in cancer cells, but
also in the oncogene induced cell senescence.
Keywords: SHP 2, BRAF V600E, thyroid tumor, oncogene induced senescence
БИОХИМИЯ том 85 вып. 1 2020