БИОХИМИЯ, 2020, том 85, вып. 10, с. 1331 - 1343
УДК 577.24
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ДЕМОНСТРИРУЕТ
ВЛИЯНИЕ СОСТАВА ФИЛАМЕНТОВ DED НА АКТИВНОСТЬ МАЛЫХ
МОЛЕКУЛ, НАЦЕЛЕННЫХ НА ГЕТЕРОДИМЕР КАСПАЗА 8/c FLIPL
© 2020
Н.В. Иванисенко1, И.Н. Лаврик1,2*
1 Институт цитологии и генетики СО РАН, 630090 Новосибирск, Россия;
электронная почта: n.ivanisenko@gmail.com
2 Translational Inflammation Research, Medical Faculty, Otto von Guericke University Magdeburg,
39106 Magdeburg, Germany; E%mail: ilav3103@gmail.com
Поступила в редакцию 17.07.2020
После доработки 24.07.2020
Принята к публикации 24.07.2020
Активация прокаспазы 8 в «сигнальном комплексе, индуцирующем гибель» клетки (DISC), приводит к за
пуску внешнего пути апоптоза. Активация прокаспазы 8 происходит в филаментах «эффекторного домена
смерти» (DED), и этот процесс регулируется белками c FLIP, в частности, т.н. длинной изоформой белка,
c FLIPL. Недавно было описано первое рационально сконструированное химическое соединение, FLIPin,
нацеленное на гетеродимер каспаза 8/c FLIPL. FLIPin повышает активность каспазы 8 при процессинге
гетеродимера. В настоящей работе с использованием кинетической модели были исследованы механизмы
действия FLIPin в комплексе DISC. Ключевой целью данной работы было предсказание активности FLIPin
в зависимости от различной стехиометрии и состава DED филамента. С помощью математического моде
лирования были получены оптимальные соотношения между белком c FLIPL и прокаспазой 8 в различных
внутриклеточных ландшафтах, благоприятствующих действию FLIPin. Анализ модели показал, что в моду
ляции активности FLIPin при снижении или повышении экспрессии c%FLIPL задействованы различные
молекулярные механизмы. Таким образом, комбинация математического моделирования и системной фар
макологии является важным инструментом для разработки более эффективных терапевтических подходов
и предсказания оптимальных стратегий лечения.
КЛЮЧЕВЫЕ СЛОВА: апоптоз, DISC, каспаза 8, FLIPin, DED, DRs.
DOI: 10.31857/S0320972520100024
ВВЕДЕНИЕ
фекторными доменами смерти и белков FADD,
прокаспазы 8, прокаспазы 10 и белка c FLIP.
Инициация внешнего пути апоптоза проис
Образованные филаменты DED служат в каче
ходит в результате активации т.н. рецепторов
стве платформы для димеризации и последую
смерти (DRs), в частности, CD95/Fas/APO 1
щей активации прокаспазы 8 [4-7].
или TRAIL R1/2 [1]. Это приводит к формиро
Димеризация каталитических доменов про
ванию макромолекулярной платформы, обозна
каспазы 8a/b приводит к конформационным из
чаемой как «сигнальный комплекс, индуцирую
менениям структуры прокаспазы 8a/b и положе
щий гибель» (DISC) [2, 3]. В состав DISC входят
ния т.н. петли L2, которая играет центральную
соответствующий рецептор смерти (DR), белок,
роль в структурной организации активного
взаимодействующий с доменом смерти Fas ре
центра данного фермента [8, 9]. Это событие
цептора (FADD), белки прокаспаза 8, прокас
приводит к формированию активного центра
паза 10 и c FLIP. Сборка DISC приводит к акти
каспазы 8 и далее к инициации активации про
вации прокаспазы 8, что происходит в составе
каспазы 8. Следует отметить, что вслед за акти
филаментов, образуемых эффекторными доме
вацией прокаспазы 8 происходит её автокатали
нами смерти (DED). Сборка DED филаментов
тический процессинг, который включает рас
происходит за счет взаимодействия между эф
щепление петли L2 в районе остатка аспарагино
вой кислоты D374 на фрагменты L2 («процесси
Принятые сокращения: DISC (death inducing signal
рованный» L2) и L2′. Данное событие приводит
ing complex) - сигнальный комплекс, индуцирующий ги
бель клетки; DED (death effector domain) - эффекторный
к образованию продуктов расщепления прокас
домен смерти; FLIPin (FLIP inhibitor) - ингибитор белка
пазы 8a/b (p43/p41 и p12) [10]. Последние далее
FLIP; DRs (death receptors) - рецепторы смерти.
подвергаются автокаталитическому процессингу
* Адресат для корреспонденции.
в результате протеолиза по аминокислотным ос
1331
1332
ИВАНИСЕНКО, ЛАВРИК
таткам D384 и D210/216 с образованием т.н. ак
которых было показано, что уровень экспрессии
тивных субъединиц каспазы 8 (p10 и p18), кото
c FLIPL играет важную роль в его про или анти
рые, в свою очередь, образуют гетеротетрамер
апоптотической функции. Кроме того, недавно
p102/p182 [11-14]. Показано, что гомодимер про
было показано, что антиапоптотическую роль
каспаза 8a/b и продукт его расщепления p43/p41
белка c FLIPL можно объяснить его влиянием на
обладают каталитической активностью, которая
состав и структуру филамента DED [18, 22]. В
тесным образом связана с конформационными
частности, было показано, что повышенная
изменениями в активном центре после димери
экспрессия c FLIP останавливает рост филамен
зации прокаспазы 8 [7, 11]. Кроме того, было
та DED, что приводит к укорочению филамен
показано, что активность прокаспазы 8 отлича
тов DED и ограничению активации каспазы 8.
ется от активности гетеротетрамера каспазы 8
Таким образом, количество белка c FLIP играет
(p102/p182), и оба комплекса характеризуются
роль чекпойнта, контролирующего длину фила
различной субстратной специфичностью [7, 11].
мента DED и его структуру [18].
Описаны три изоформы белка c FLIP, обоз
Ожидается, что после активации прокаспа
начаемые Long (L), Short (S) и Raji (R), т.е. c
зы 8 и последующего расщепления прокаспазы
FLIPL, c FLIPS и c FLIPR [15, 16]. Короткие изо
8 по остатку D374 в гетеродимере прокаспаза
формы белка c FLIP, а именно, c FLIPS и c
8/c FLIPL, «закрытая» конформация петли L2′ в
FLIPR блокируют активацию прокаспазы 8 в
молекуле прокаспазы 8 нарушается, что вызы
филаментах DED. В то же время c FLIPL в соста
вает ингибирование активности каспазы 8 в
ве DISC может действовать и как активатор
составе гетеродимера прокаспаза 8/c FLIPL [8,
апоптоза, и как его ингибитор [8, 9, 17- 19]. С
23]. Недавно была описана малая молекула, наз
позиции структурной биологии, проапоптоти
ванная FLIPin (FLIP inhibitor), которая была
ческая функция c FLIPL опосредована образова
разработана для увеличения каталитической ак
нием гетеродимеров прокаспаза 8/c FLIPL, в
тивности гетеродимера [23]. FLIPin был скон
которых петля L2 прокаспазы 8 и, тем самым, ее
струирован таким образом, чтобы связываться с
активный центр стабилизированы в «закрытой»
белком c FLIPL на интерфейсе гетеродимера
конформации через взаимодействия с белком c
каспаза 8/c FLIPL. FLIPin имитирует стабили
FLIPL. Это приводит к повышению фермента
зирующий эффект петли L2′ в «закрытой» кон
тивной активности каспазы 8 [8, 20, 21]. Было
формации (рис. 1). В частности, предположено,
показано, что проапоптотическое действие c
что FLIPin связывается с гетеродимером после
FLIPL наблюдается в случае низкого или средне
процессинга прокаспазы 8 и образования
го уровня экспрессии данного белка, в то время
p43/p41 и, тем самым, восстанавливает сеть вза
как при повышенной экспрессии данная изо
имодействий, приводя к стабилизации активно
форма действует как ингибитор апоптоза [17].
го центра каспазы 8. Данное соединение было
Данные выводы основаны на многих работах, в
получено в результате проведения виртуального
а
б
Рис. 1. Модель структуры гетеродимера каспаза 8/c FLIPL, связанного с FLIPin. а - Структура гетеродимера прокаспазы 8
(темно синий цвет) и c FLIPL (желтый цвет) [PDB ID 3H11]. Показана петля L2 в «закрытой» конформации; б - модель
структуры гетеродимера белка c FLIPL [PDB ID 3H11] и продукта протеолиза каспазы 8 p43/p10 [PDB ID 3H13], связан
ного с FLIPin (зеленый цвет) в предполагаемом связывающем центре. Показана петля L2′ в «открытой» конформации.
journal/biokhsm/)
БИОХИМИЯ том 85 вып. 10 2020
МАЛЫЕ МОЛЕКУЛЫ И ФИЛАМЕНТЫ DED
1333
скрининга in silico. Кроме того, на основе FLIPin
ные данные относительно роли c FLIPL и полу
было создано оптимизированное химическое
чить количественные представления о механиз
соединение FLIPinBγ, которое повышает актив
мах действия FLIPin, в настоящей работе был ис
ность каспазы 8 в комплексе DISC, усиливает
пользован метод математического моделирова
активацию эффекторных каспаз и DR опосре
ния с помощью системы ОДУ. На основе модели
дованный апоптоз [23].
рования предсказаны оптимальные количествен
Математическое моделирование сети апоп
ные соотношения между уровнями прокаспазы 8
тоза стало мощным инструментом для изучения
и белка c FLIPL в различных внутриклеточных
динамики регуляции гибели клеток [24, 25]. В
ландшафтах для получения максимальной актив
частности, был очень тщательно изучен процесс
ности FLIPin. Полученные результаты обеспечи
CD95 опосредованной передачи сигнала с ис
вают основу для разработки новых, более эффек
пользованием системы обыкновенных диффе
тивных терапевтических противораковых подхо
ренциальных уравнений (ОДУ; ODEs), а также
дов, а также позволяют дополнить представления
других математических формализмов, таких как
о механизмах регуляции филаментов DED.
булевые и агентные модели [5, 26-28]. С по
мощью математических моделей была получена
новая информация о контроле механизмов
МАТЕРИАЛЫ И МЕТОДЫ
внешнего пути апоптоза. В частности, было вы
явлено пороговое поведение CD95 опосредо
Моделирование. Математическая модель бы
ванной передачи сигнала и получено количест
ла основана на системе ОДУ (ODEs), описыва
венное представление о проапоптотической ро
ющих процессы активации каспазы 8 в комп
ли белков c FLIPL. Кроме того, были расшиф
лексе DISC в присутствии или отсутствии
рованы механизмы переключения про и анти
FLIPinBγ. Данный подход был ранее представ
апоптотических сигнальных путей, индуциро
лен в работе [23] и доработан в данном исследо
ванных через рецептор CD95 [26, 29, 30].
вании. Значения скоростей реакции и парамет
Недавно нами была разработана математи
ры модели были взяты из работы [23]. Для реше
ческая модель, которая позволяет проводить ана
ния ОДУ была использована программа
лиз влияния FLIPin на усиление активации про
Scipy.integrate.odeint из программного пакета
каспазы 8 в комплексе DISC [23]. Однако данная
модель не учитывала недавно открытую роль c
сана с помощью 12 дифференциальных уравне
FLIP в регуляции состава и стехиометрии комп
ний (1-2, табл. 1) и 8 параметров (табл. 2).
лекса DISC [18]. Чтобы учесть новые структур
Уравнения, использованные в модели:
БИОХИМИЯ том 85 вып. 10 2020
1334
ИВАНИСЕНКО, ЛАВРИК
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
ли целью разработать систему ОДУ, с помощью
которой можно анализировать эффекты FLIPin
ODE модель процесса активации каспазы 8 в
в различном клеточном контексте. В частности,
филаменте DED, описывающая влияние FLIPin.
было сосредоточено внимание на выявление за
FLIPin нацелен на гетеродимер каспаза 8/
висимости активности FLIPin от длины различ
c FLIPL, следовательно, количество гетероди
ных филаментов DED и соотношения c FLIPL:
меров прокаспаза 8/c FLIPL, образующихся на
прокаспаза 8.
филаменте DED, должно прямо коррелировать
Чтобы найти ответы на эти вопросы, была
с активностью FLIPin. Кроме того, недавно на
выбрана недавно разработанная система обык
ми было показано, что белок c FLIPL имеет два
новенных дифференциальных уравнений (ОДУ),
специфических сайта связывания в структуре
описывающая воздействие FLIPin на гетероди
филамента DED, и поэтому возможно как ми
мер каспаза 8/c FLIPL, и затем её расширили с
нимум две пространственные локализации,
учетом новой структурной информации, касаю
внутри которых может происходить сборка гете
щейся филаментов DED. С этой целью был до
родимера каспаза 8/c FLIPL [18]. А именно c
бавлен дополнительный параметр, определяю
FLIPL может связываться как с DED FADD, так
щий длину цепи DED. При построении структу
и с доменом DED2 прокаспазы 8, что и обеспе
ры модели принят во внимание тот факт, что три
чивает образование гетеродимеров. Кроме того,
цепи DED образуют один филамент DED, и что
данный факт приводит к возникновению ситуа
согласно результатам недавних протеомных ис
ции, при которой белок c FLIPL может ограни
следований, в среднем, на одну цепь DED при
чивать рост филаментов DED и при повышен
ходится одна молекула c FLIPL [18]. Топология
ной экспрессии укорачивать длину филаментов
модели включала образование гомо (прокаспа
DED [18]. Поэтому в данной работе мы постави
за 8/прокаспаза 8) и гетеродимеров (прокаспа
Таблица 1. Обозначения, использованные в модели, и их исходные значения
Обозначения
Исходные условия для
Описание
клеток HeLa CD95
DED _chain_length
9,71
длина цепи DED в филаменте DED. Длину цепи рассчитывали из
соотношения (P8+FLIP)/FLIP = DED chain length
FLIP
7,39 [нM]
c FLIPL
P8
64,4 [нM]
прокаспаза 8
C8
0
каспаза 8 (p43/p10)
FLIP_P8
0
гетеродимер C концевых доменов c FLIPL и прокаспазы 8 в DISC
P8_P8
0
гомодимер C концевых доменов прокаспаза 8/прокаспаза 8 в DISC
C8_C8
0
гетеротетрамер каспазы 8 (p43/p10/p18/p10)
P8_C8
0
димер C концевых доменов прокаспаза 8/каспаза 8 в DISC
FLIP_C8_FLIPin
0
каспаза 8/c FLIPL, стабилизированная FLIPin в DISC
CellDeathSubstrate
1
субстрат клеточной смерти
CellDeath
0
относительное количество погибших клеток
Procaspase 3
1,44 [нМ]
прокаспаза 3
Caspase 3
0
каспаза 3
σFLIPin
1 или 0 при условии, что
коэффициент, который указывает на присутствие FLIPin
FLIPin был добавлен или нет
соответственно
DISC_cat
FLIP_P8 + FLIP_C8_FLIPin +
суммарная каталитическая активность каспазы 8 в комплексе DISC
+ 2⋅P8_C8 + 2⋅C8_C8 + 2⋅P8_P8
БИОХИМИЯ том 85 вып. 10 2020
МАЛЫЕ МОЛЕКУЛЫ И ФИЛАМЕНТЫ DED
1335
Таблица 2. Параметры модели
Параметр
Описание
Значения
Размерность
kd
скорость димеризации (для каспаза 8/прокаспаза 8, прокаспаза 8/прокаспаза 8)
0,00102
[ч-1·нM-1]
γ
коэффициент увеличения скорости димеризации комплексов прокаспаза 8/
33,5796
-
c FLIPL и каспаза 8/каспаза 8
kp
скорость процессинга каспазой 8 субстратов DISC
3,14368
[ч-1·нM-1]
kdeg
скорость деградации DISC
0,693
[ч-1]
kcd
скорость процессинга субстрата клеточной смерти, опосредованного каспазой 8
0,12875
[ч-1·нM-1]
kcd_c3
скорость процессинга субстрата клеточной смерти, опосредованного каспазой 3
0,15725
[ч-1·нM-1]
kp3
скорость процессинга прокаспазы 3 каспазой 8
0,02093
[ч-1·нM-1]
kp3_c3
скорость процессинга прокаспазы 3 каспазой 3
1,12659
[ч-1·нM-1]
Примечание. Значения параметров взяты из работы [23].
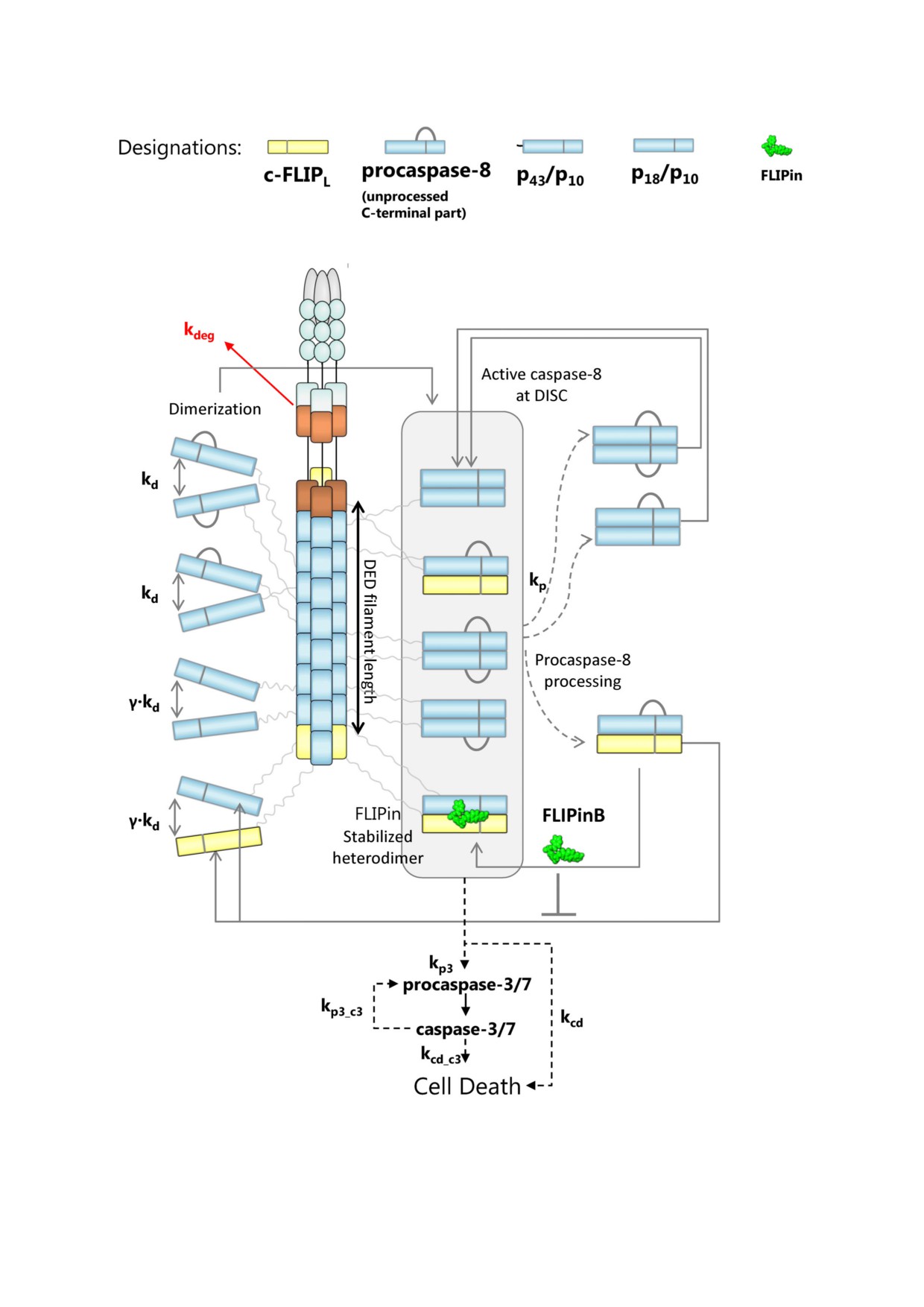
за 8/c FLIPL) в составе филаментов DED
гибели клетки. В структуре модели «общий уро
(рис. 2). После образования гомо и гетеродиме
вень гибели клеток» соответствует уровню рас
ров прокаспаза 8 подвергается аутокаталити
щепленного субстрата клеточной смерти, кото
ческой активации в филаменте DED, после чего
рый был интегрирован с течением времени. В
происходит внутри и межмолекулярный про
структуру модели были включены процессинг
цессинг димеров с образованием p43/p41 (p43
субстрата клеточной смерти, происходящий как
каспаза 8), p18 и p10 [10]. Также при построе
с участием каспазы 3, так и каспазы 8. Значе
нии топологии модели было сделано предполо
ния констант связывания и соответствующая
жение, что как гомодимер прокаспаза 8/про
параметризация были взяты из предыдущей мо
каспаза 8, так и продукты её расщепления, а
дели процесса активации комплекса DISC при
именно p43 каспаза 8/p43 каспаза 8 и p18/p43
добавлении FLIPin, которая была получена на
каспаза 8, обладают каталитической актив
экспериментальных данных, полученных при
ностью в филаменте DED. Эти предположения
работе с клетками HeLa CD95 [23].
были основаны на предыдущих сообщениях о
В настоящей работе, чтобы смоделировать
том, что гомодимер прокаспаза 8a/b, а также
эффекты FLIPin, основным предположением
продукт его расщепления p43/p41 обладают ка
было то, что белок c FLIPL ограничивает коли
талитической активностью, которая тесным об
чество активной прокаспазы 8 в комплексе
разом связана с конформационными изменени
DISC путем остановки сборки филамента DED .
ями в активном центре при димеризации про
В то же время было предположено, что повыше
каспазы 8 и последующей активации димера [7,
ние уровня c FLIPL в составе DISC не влияет на
11]. Другие предположения были сделаны в слу
соотношение FADD:c FLIPL. Кроме того, в
чае гетеродимера прокаспаза 8/c FLIPL. В этом
структуре модели было заложено, что сборка
случае было предположено, что только гетеро
филаментов DED происходит сразу после до
димер прокаспаза 8/c FLIPL обладает каталити
бавления CD95L. Точная стехиометрия фила
ческой активностью, в то время как продукт его
мента DED была определена начальными усло
расщепления p43 каспаза 8/c FLIPL каталити
виями модели. В частности, соотношения меж
чески неактивен, и в отсутствие FLIPin проис
ду прокаспазой 8 и c FLIPL в комплексе DISC
ходит его быстрая диссоциация. Также было
основывались на результатах количественного
предположено, что связывание FLIPin приводит
протеомного анализа, полученных в нашей пре
к восстановлению активности комплекса p43
дыдущей работе [18]. Данные результаты свиде
каспаза 8/c FLIPL, достигая значений актив
тельствуют о том, что в филаменте DED соотно
ности, характерных для гетеродимера прокаспа
шения между этими белками примерно равны
за 8/c FLIPL. Активация прокаспазы 8 сопро
1:9 (c FLIPL:прокаспаза 8). Однако при высо
вождается опосредованным каспазой 8 расщеп
ком уровне c FLIPL соотношение c FLIPL и
лением прокаспазы 3 с образованием каспазы 3
прокаспазы 8 оказалось примерно равным 1 к 1
и её последующей активацией, приводящей к
[18]. Таким образом, данные соотношения были
БИОХИМИЯ том 85 вып. 10 2020
1336
ИВАНИСЕНКО, ЛАВРИК
Рис. 2. Математическая модель процесса активации каспазы 8 в филаменте DISC/DED, учитывающая действие FLIPin.
Указаны структура модели, объекты модели и константы взаимодействия
БИОХИМИЯ том 85 вып. 10 2020
МАЛЫЕ МОЛЕКУЛЫ И ФИЛАМЕНТЫ DED
1337
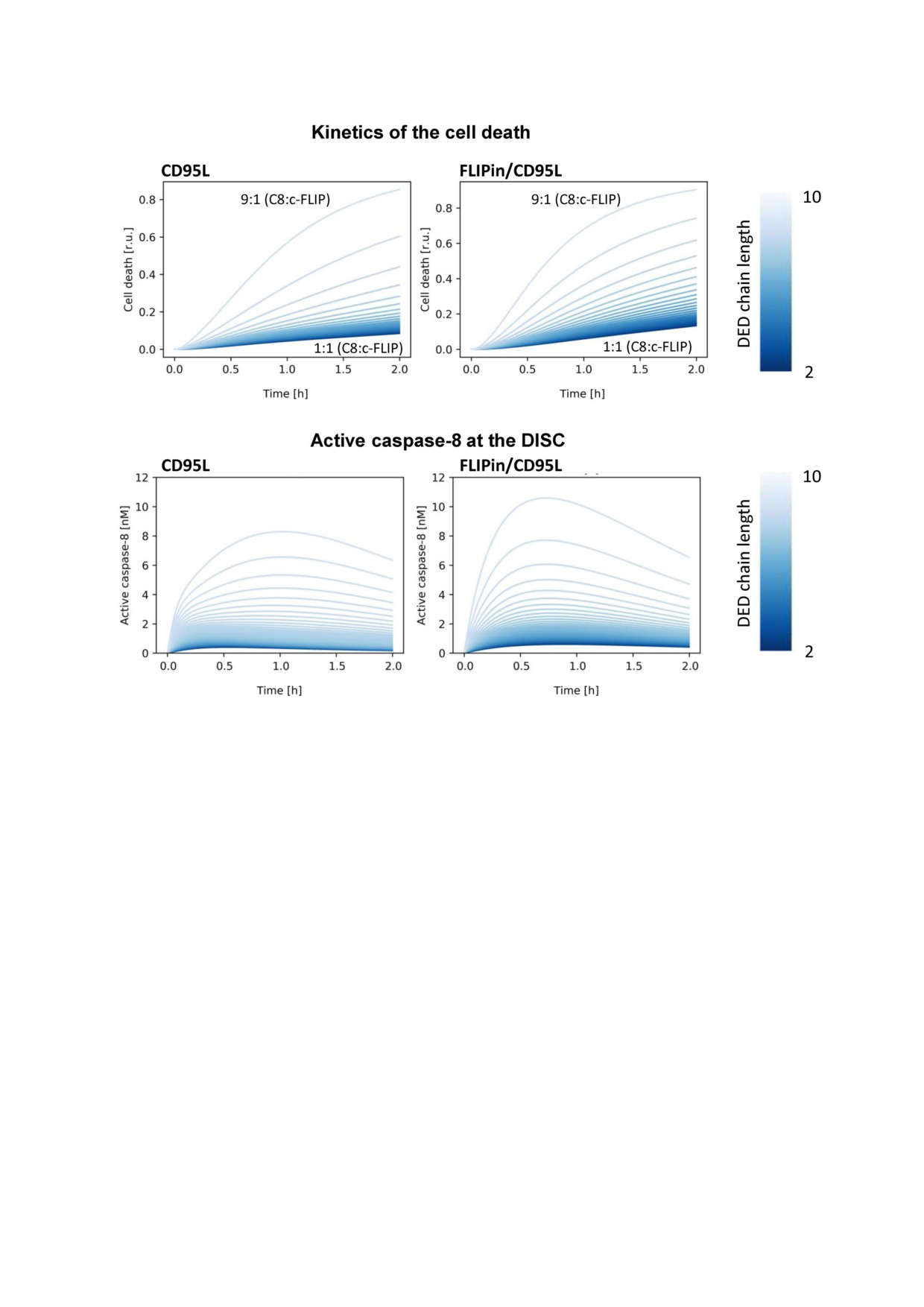
Рис. 3. Кинетика клеточной гибели (вверху) и активации каспазы 8 (внизу) при различных соотношениях прокаспазы 8
и c FLIP. Показана кинетика в случае стимуляции только CD95L (слева) и совместной стимуляции CD95L и FLIPin
(справа). Градиент интенсивности окраски от темного до светлого означает постепенное изменение длины цепи DED от
короткой (соотношение c FLIP:каспаза 8 равно 1 : 1, светлое окрашивание) до длинной цепи (соотношение c FLIP:кас
паза 8 равно 1 : 9, интенсивное окрашивание)
включены в модель, и следующим шагом было
c FLIPL, который соответствует эндогенному
изучение поведения этой системы in silico.
уровню этого белка (рис. 3). В клетках HeLa
С помощью математического моделирования
CD95 он соответствует соотношению, примерно
можно предсказать усиление гибели клеток и по
равному 1:9 (c FLIPL:прокаспаза 8) в комплексе
вышение активности каспазы 8 малой молекулой
DISC (рис. 3). Максимальные значения актив
FLIPin при различных соотношениях c FLIPL и
ности каспазы 8 при этих соотношениях наблю
прокаспазы 8. На первом этапе был проведен
дались примерно через 1 ч после стимуляции
анализ того, как активность FLIPin зависит от
CD95L in silico (рис. 3). При увеличении уровня
различного уровня белка c FLIPL (рис. 3). Дан
белка c FLIPL активность каспазы 8 в комп
ные расчеты проводилиcь при условии, что ко
лексе DISC и уровень индукции клеточной ги
личество комплекса CD95/CD95L/FADD со
бели понижались (рис. 3). На втором этапе было
временем не изменяется. Сначала было изучено
изучено действие FLIPin. При совместной обра
влияние уровня c FLIPL на каталитическую ак
ботке клеток FLIPin и CD95L в соотношении 1:9
тивность каспазы 8 и индукцию клеточной
(c FLIPL:прокаспаза 8) максимальное значение
смерти in silico. Как и ожидалось, значения наи
активности каспазы 8 наблюдалось в более ран
высшей активности каспазы 8 в комплексе
ний момент времени, который соответствовал
DISC и наибольшего уровня индукции клеточ
45 мин после стимуляции CD95L. Кроме того,
ной смерти были получены при низком уровне
при совместной обработке CD95L и FLIPin in
2 БИОХИМИЯ том 85 вып. 10 2020
1338
ИВАНИСЕНКО, ЛАВРИК
silico общая активность каспазы 8 была выше,
зали, что данные соотношения c FLIPL и про
чем при обработке только CD95L (рис. 3). По
каспазы 8 должны обеспечивать оптимальные
вышение активности каспазы 8 и усиление кле
соотношения между количеством гомодимеров
точной гибели при совместной обработке
прокаспазы 8 и гетеродимеров прокаспаза 8/c
CD95L и FLIPin также наблюдалось в случае
FLIPL, создавая оптимальный ландшафт для эф
всех изученных соотношений c FLIPL:прокас
фективного действия FLIPin.
паза 8 в комплексе DISC (рис. 3). Таким обра
Далее была проведена проверка соответ
зом, с помощью модели была получена картина
ствия предсказаний, сделанных с помощью
чувствительности комплекса к добавлению
предложенной модели, известным внутрикле
FLIPin, зависящая от уровня белка c FLIPL.
точным системам, в которых проверялось
Затем было изучено, как длина филаментов
действие FLIPin. Протеомным анализом было
DED влияет на активность FLIPin. Как было от
показано, что в случае клеток HeLa CD95 соот
мечено ранее, основным предположением мо
ношение c FLIPL:прокаспаза 8 в комплексе
дели было то, что увеличение уровня белка c
DISC было примерно равно 1:9. Это приводит к
FLIPL приводит к уменьшению длины фила
относительно низкому уровню гетеродимеров
мента DED. Укорочение филамента DED вызы
прокаспаза 8/c FLIPL [18]. На основе модели
вает снижение количества прокаспазы 8 в фи
было предсказано, что в клетках HeLa CD95
ламенте DED. Это приводит к снижению актив
имеет место относительно низкий вклад гетеро
ности каспазы 8 и индукции клеточной гибели,
димеров прокаспаза 8/c FLIPL в повышение ак
что нами наблюдалось in silico (рис. 3). Эти дан
тивности каспазы 8. Полученная оценка
ные хорошо согласуются с наблюдениями
действительна для всех значений - временных
Hillert et al. в условиях in vitro [18]. В частности,
интервалов, включая один час, который соотве
существенное снижение активности каспазы 8
тствует предсказанному максимуму активности
и уровня клеточной смерти наблюдалось в клет
CD95 DISC (рис. 3). Соответственно, это приво
ках HeLa CD95 FL, которые характеризуются
дит к предсказанной in silico относительно низ
повышенной экспрессией c FLIPL [18]. Инте
кой эффективности действия FLIPin в данной
ресно, что в данных условиях ожидалось, что ко
клеточной линии, которое действительно наб
личество гетеродимеров прокаспаза 8/c FLIPL
людалось экспериментально
[23]. В случае
увеличится, что может привести к увеличению
комплекса DISC в клетках HeLa CD95 FL, ко
активности каспазы 8, но эти предположения
торые характеризуются повышенной экспрес
не оправдались из за сильно уменьшенной сум
сией белка c FLIPL, протеомный анализ показал
марной концентрации прокаспазы 8 за счет
соотношение c FLIP: прокаспаза 8, равное 1:1
уменьшения длины филамента DED [18].
[18]. При этом соотношении происходит обра
Чтобы определить, как активность FLIPin
зование коротких филаментов DED, которые
зависит от длины филамента DED, был введен
скорее всего в основном состоят из гетеродиме
коэффициент эффективности действия FLIPin.
ров прокаспаза 8/c FLIPL. Интересно, что для
Этот коэффициент рассчитывался как соотно
данной клеточной линии предсказанный пик
шение значений увеличения активности каспа
активности каспазы 8 соответствует периодам
зы 8 в комплексе DISC и индукции гибели кле
времени, которые превышают рассчитанное
ток при обработке только CD95L или CD95L/
время полужизни комплекса DISC, что ограни
FLIPin. Более того, эффективность действия
чивает активность FLIPin, которая напрямую
FLIPin была проанализирована для различных
связана с максимальной активностью каспазы
соотношений c FLIPL и прокаспазы 8. Для это
8. Другой линией клеток, для которой был про
го были оценены значения длины филамента
веден количественный протеомный анализ
DED и соотношения c FLIPL:прокаспаза 8, при
комплекса DISC, была В лимфобластоидная
которых наблюдалась максимальная активность
клеточная линия SKW6.4 [5, 31, 32]. В этой ли
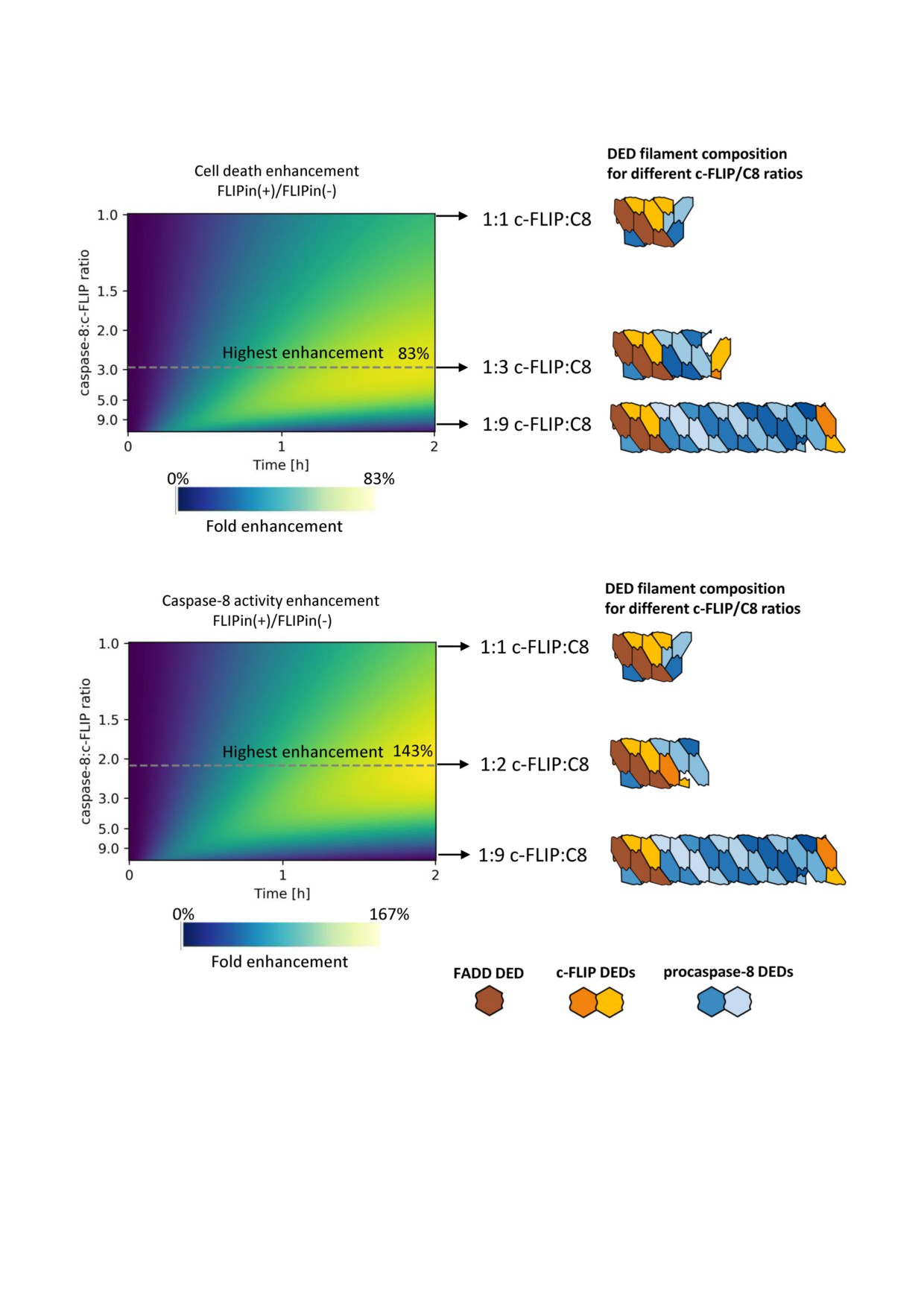
FLIPin in silico. Оказалось, что оптимальное зна
нии клеток действие FLIPin было протестирова
чение длины филамента наблюдается при про
но, однако, при этом не наблюдалось практи
межуточном диапазоне уровня экспрессии c
чески никакого действия со стороны этого сое
FLIPL (рис. 4). Увеличение гибели клеток дости
динения (данные не представлены). Это хорошо
гало своего пика при соотношении c
согласуется со стехиометрией комплекса DISC и
FLIPL:прокаспаза 8, примерно равном 1:3, при
филаментов DED в клетках SKW6.4. Последние
водя к увеличению более, чем на 80%, в то вре
содержат очень низкие количества c FLIPL с та
мя как наивысшая активность каспазы 8 наб
ким соотношением к прокаспазе 8, которое
людалась при соотношении 1:2 (c FLIPL:про
очень близко к стехиометрии комплекса DISC в
каспаза 8) и увеличении >140% (рис. 4). Пред
клетках HeLa CD95, т.е. 1:9 (c FLIPL:прокаспа
сказания, полученные на основе модели, пока
за 8). Кроме того, клетки SKW6.4 характеризу
БИОХИМИЯ том 85 вып. 10 2020
МАЛЫЕ МОЛЕКУЛЫ И ФИЛАМЕНТЫ DED
1339
Рис. 4. Относительное усиление гибели клеток (вверху) и повышение активности каспазы 8 (внизу) при различных соот
ношениях c FLIP и каспазы 8 в филаменте DED. Градиент интенсивности окрашивания обозначает кратное усиление ок
рашивания с помощью FLIPin. Филаменты DED, соответствующие наивысшей активности FLIPin, обозначены пунктир
ной линией. Эффекторные домены смерти (DEDs) белка FADD, прокаспазы 8 и белка c FLIP показаны соответственно
коричневым, синим и оранжевым цветом
БИОХИМИЯ том 85 вып. 10 2020
2*
1340
ИВАНИСЕНКО, ЛАВРИК
ются более быстрой активацией каспазы 8 и ин
архитектуры филамента DED. Полученные на
дукцией апоптоза в сравнении с клетками HeLa
ми результаты свидетельствуют о том, что уро
CD95 и более коротким временем полужизни
вень гетеродимеров в комплексе DISC является
комплекса DISC, которое, по видимому, не поз
ключевым фактором для проявления активнос
воляет детектировать влияние FLIPin на про
ти FLIPin. Кроме того, выяснилось, что сущест
цесс активации каспазы 8. В целом, проведен
вуют дополнительные факторы, контролирую
ный анализ хорошо объясняет полученные экс
щие активность FLIPin, такие как размер фила
периментальные данные и позволяет предло
мента DED. Таким образом, с помощью модели
жить проведение скрининга различных типов
была изучена роль структуры филамента DED в
клеток с целью идентификации клеточных ли
способности FLIPin усиливать гибель клеток и
ний, подходящих для наиболее эффективного
активность прокаспазы 8.
действия FLIPin.
Далее обнаружено, что повышение уровня
экспрессии белка c FLIPL непосредственно
влияет на активность соединения FLIPin. Од
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
нако это влияние не носило линейный харак
тер, в связи с чем применение метода математи
В предыдущей работе для создания малой
ческого моделирования для изучения данных
молекулы (FLIPin), целенаправленно действую
эффектов представляет большой интерес. В
щей на гетеродимер каспаза 8/c FLIPL, нами
частности, нелинейный характер объясняется
были применены современные методы компью
множественной ролью белка с FLIPL в регуля
терной биологии in silico [23]. Было предсказано,
ции активации каспазы 8, а именно его влия
что FLIPin будет имитировать стабилизирую
нием на длину филамента DED и вкладом гете
щий эффект петли L2′, находящейся в «закры
родимеров прокаспаза 8/c FLIPL в суммарную
той» конформации, который приводит к повы
активность каспазы 8 в комплексе DISC. Нап
шению активности каспазы 8 в комплексе
ример, в клетках HeLa CD95 имеется только
DISC и более эффективной индукции апоптоза.
ограниченное количество гетеродимеров про
Экспериментальные данные, полученные с оп
каспаза 8/c FLIPL по сравнению с гомодимера
тимизированной малой молекулой FLIPinBγ
ми каспазы 8, что ограничивает влияние
подтвердили предсказанный in silico механизм
FLIPin. Повышение концентрации c FLIPL в
действия этого гетеродимера [23]. В настоящей
филаменте DED должно привести к повыше
работе с помощью компьютерного моделирова
нию количества гетеродимеров прокаспаза 8/
ния нами были изучены отдельные параметры,
c FLIPL и увеличению активности FLIPin. В
определяющие эффективность действия
этой связи с использованием метода масс
FLIPin. Нами было показано, что соотношение
спектрометрии было показано, что повышение
c FLIPL и прокаспазы 8 в филаментах DED яв
концентрации белка c FLIPL приводит к более
ляется ключевым фактором, определяющим эф
эффективной концентрации гетеродимеров
фективность действия данного соединения. По
прокаспаза 8/c FLIPL [18]. Однако данный
лученный результат вытекает не только из роли
процесс также ограничивает рост филамента
уровня c FLIPL в осуществлении контроля соот
DED, тем самым вызывая значительное сниже
ношения между гомо и гетеродимерами в
ние количества гомодимеров прокаспазы 8 и
комплексе DISC, но он также ассоциирован с
оказывая ингибирующее влияние на актив
ключевой функцией c FLIPL в регуляции длины
ность FLIPin. Это хорошо согласуется с экспе
филамента DED.
риментальными данными, такими как не очень
Соотношения гомо и гетеродимеров про
значительное повышение активности FLIPin,
каспазы 8 в филаменте DED контролируются
которое наблюдалось в клетках HeLa FL при
рядом факторов. В их число входят уровень
сильном повышении экспрессии c FLIPL [23].
внутриклеточной экспрессии белка c FLIPL и
Результаты моделирования показали, что
прокаспазы 8, константы их ассоциации в
уровень белка c FLIPL в комплексе DISC, опти
комплексе DISC и структура филамента DED.
мальный для действия FLIPin, находится в диа
Данные факторы связаны между собой нели
пазоне значений соотношения c FLIPL/прокас
нейной динамикой, которая может быть проа
паза 8 между 1:9 и 1:1. В случае высокого содер
нализирована на количественном уровне с ис
жания прокаспазы 8 или низкого уровня
пользованием компьютерного моделирования.
экспрессии белка FLIPL происходит быстрая ак
В настоящей работе была создана компьютер
тивация каспазы 8, что выражается в низком
ная модель, которая позволила предсказать уро
вкладе стабилизированных гетеродимеров про
вень образующихся гетеродимеров в зависимос
каспаза 8/c FLIPL в увеличение активности
ти от соотношения прокаспазы 8 и c FLIPL и от
прокаспазы 8. Напротив, в случае низкого со
БИОХИМИЯ том 85 вып. 10 2020
МАЛЫЕ МОЛЕКУЛЫ И ФИЛАМЕНТЫ DED
1341
держания каспазы 8 или повышенной экспрес
ных, полученных на клеточной линии HeLa и
сии c FLIPL активность FLIPin ограничена ко
фиксированной концентрации CD95L. В буду
роткими филаментами DED, приводя к пони
щем может быть создана более детальная мо
женной активности каспазы 8. Кроме того, с
дель, которая будет учитывать явную динамику
помощью настоящей модели мы предсказываем,
образования филамента DED при различной
что наивысшая активность FLIPin наблюдается
силе стимуляции CD95, а также учитывать
тогда, когда соотношение каспаза 8:c FLIPL на
пространственные ограничения процесса обра
ходится в диапазоне от 2:1 до 3:1. Так, при соот
зования гетеродимеров c FLIPL и каспазы 8.
ношении 2:1 (каспаза 8:c FLIPL) наблюдалось
Кроме того, из предыдущих работ мы знаем, что
наибольшее увеличение скорости гибели кле
низкие или т.н. пороговые концентрации
ток, а при соотношении 3:1 наблюдалась наи
CD95L регулируют длину цепей филаментов
высшая активность каспазы 8 в DISC. В этой
DED [5, 26-28]. Важным направлением буду
связи следует особо подчеркнуть, что ряд линий
щих исследований является детальный анализ
раковых клеток характеризуется высоким уров
влияния на архитектуру филамента DED двух
нем белка c FLIPL, который близок к количест
факторов, а именно, стимуляции пороговыми
вам белка, предсказанным математической мо
концентрациями CD95L и различных уровней
делью для оптимального действия соединения
экспрессии c FLIP в клетке. Кроме того, рас
FLIPin. Это позволяет предположить, что разра
смотрение сложных взаимодействий c FLIPL и
ботка химических соединений на основе FLIPin
C концевых доменов прокаспазы 8 представля
в целом обладает чрезвычайно высоким тера
ет собой важный шаг на пути к количественно
певтическим потенциалом для разработки мето
му пониманию динамики филамента DED. В
дов лечения рака [33].
частности, взаимодействие близкорасположен
Модель ОДУ показала, что повышение ак
ных молекул DED в филаменте DED вероятно
тивности каспазы 8 с помощью FLIPin сразу
приводит к более эффективной димеризации C
после стимуляции CD95L способствует индук
концевых доменов, чем взаимодействие моле
ции апоптоза. Последнее может быть тесным
кул, расположенных на удаленных участках в
образом связано с высокой скоростью деграда
структуре филамента DED. В то же время стери
ции комплекса DISC, которая было описана в
ческие препятствия, вероятно, ограничивают
работе [10]. Действительно, рассчитанное время
активность каспазы 8 в коротких филаментах
полужизни комплекса DISC в клетках HeLa
DED, которые соответствуют стехиометрии 1
CD95 равно лишь одному часу [10], в то время
2:1:1 для комплекса c FLIP:прокаспаза
как, согласно нашей модели, требуется значи
8:FADD. Детальное моделирование процесса
тельно больше времени, чтобы активировать все
сборки филамента DED и ингибирование дан
молекулы прокаспазы 8 в комплексе DISC. В
ного процесса белком c FLIP позволит выявить
этой связи наш подход показал, что увеличение
связи между уровнем эндогенной экспрессии c
времени активности гетеродимера через стаби
FLIP, стехиометрией DISC и активностью
лизирующее влияние FLIPin может послужить
FLIPin.
многообещающей стратегией для разработки
Таким образом, проведенное исследование
противораковой терапии.
показывает важность сочетания методов мате
Большинство уже созданных моделей CD95
матического и структурного моделирования и
DISC не учитывают образование филаментов
системной фармакологии для определения мо
DED и их структуру [27, 34, 35]. Это обеспечива
лекулярных механизмов и разработки более эф
ет дополнительное важное направление в буду
фективных терапевтических подходов в персо
щих исследованиях количественной динамики
нализированной медицине.
контроля апоптоза. Настоящее исследование
показывает важность правильной стехиометрии
и структуры филамента DED для эффективной
Финансирование. Работа выполнена при фи
индукции апоптоза, подчеркивая необходи
нансовой поддержке грантов РФФИ (19 54
мость детального рассмотрения макромолеку
45015; 180400207) и Российского государ
лярных комплексов, индуцирующих клеточную
ственного бюджетного задания (АААА А17
гибель, чтобы понять механизмы принятия ре
117092070032 4).
шений в жизненном цикле клеток.
Конфликт интересов. Авторы заявляют об от
Представленная в настоящей работе модель
сутствии конфликта интересов.
может рассматриваться как минимальная мо
Соблюдение этических норм. Данная статья
дель для описания процессинга прокаспазы 8 в
не содержит исследований, выполненных с
комплексе DISC. Данная модель была провере
участием авторов, в которых были бы использо
на с использованием экспериментальных дан
ваны люди или животные.
БИОХИМИЯ том 85 вып. 10 2020
1342
ИВАНИСЕНКО, ЛАВРИК
СПИСОК ЛИТЕРАТУРЫ
1.
Krammer, P. H., Arnold, R., and Lavrik, I. N. (2007) Life
17.
Fricker, N., Beaudouin, J., Richter, P., Eils, R., Krammer,
and death in peripheral T cells, Nat. Rev. Immunol., 7, 532
P. H., and Lavrik, I. N. (2010) Model based dissection of
542.
CD95 signaling dynamics reveals both a pro and anti
2.
Lavrik, I. N., and Krammer, P. H. (2012) Regulation of
apoptotic role of c FLIPL, J. Cell Biol., 190, 377 389.
CD95/Fas signaling at the DISC, Cell Death Differ., 19,
18.
Hillert, L. K., Ivanisenko, N. V., Espe, J., Konig, C.,
36 41.
Ivanisenko, V. A., Kahne, T., and Lavrik, I. N. (2020) Long
3.
Zamaraev, A. V., Kopeina, G. S., Zhivotovsky, B., and
and short isoforms of c FLIP act as control checkpoints of
Lavrik, I. N. (2015) Cell death controlling complexes and
DED filament assembly, Oncogene, 39, 1756 1772.
their potential therapeutic role, Cell. Mol. Life Sci., 72,
19.
Ueffing, N., Keil, E., Freund, C., Kuhne, R., Schulze
505 517.
Osthoff, K., and Schmitz, I. (2008) Mutational analyses of
4.
Dickens, L. S., Boyd, R. S., Jukes Jones, R., Hughes, M. A.,
c FLIPR, the only murine short FLIP isoform, reveal
Robinson, G. L., Fairall, L., Schwabe, J. W., Cain, K., and
requirements for DISC recruitment, Cell Death Differ., 15,
Macfarlane, M. (2012) A death effector domain chain
773 782.
DISC model reveals a crucial role for caspase 8 chain
20.
Boatright, K. M., Deis, C., Denault, J. B., Sutherlin, D. P.,
assembly in mediating apoptotic cell death, Mol. Cell, 47,
and Salvesen, G. S. (2004) Activation of caspases 8 and
291 305.
10 by FLIP(L), Biochem. J., 382, 651 657.
5.
Schleich, K., Warnken, U., Fricker, N., Ozturk, S.,
21.
Pop, C., Oberst, A., Drag, M., Van Raam, B. J., Riedl, S. J.,
Richter, P., Kammerer, K., Schnolzer, M., Krammer, P. H.,
Green, D. R., and Salvesen, G. S. (2011) FLIP(L) induces
and Lavrik, I. N. (2012) Stoichiometry of the CD95 death
caspase 8 activity in the absence of interdomain caspase 8
inducing signaling complex: experimental and modeling
cleavage and alters substrate specificity, Biochem. J., 433,
evidence for a death effector domain chain model, Mol.
447 457.
Cell, 47, 306 319.
22.
Hughes, M. A., Powley, I. R., Jukes Jones, R., Horn, S.,
6.
Fu, T. M., Li, Y., Lu, A., Li, Z., Vajjhala, P. R., Cruz, A. C.,
Feoktistova, M., Fairall, L., Schwabe, J. W., Leverkus, M.,
Srivastava, D. B., DiMaio, F., Penczek, P. A., Siegel, R. M.,
Cain, K., and MacFarlane, M. (2016) Co operative and
et al. (2016) Cryo EM structure of caspase 8 tandem DED
hierarchical binding of c FLIP and caspase 8: a unified
filament reveals assembly and regulation mechanisms of
model defines how c FLIP isoforms differentially control
the death inducing signaling complex, Mol. Cell, 64, 236
cell fate, Mol. Cell, 61, 834 849.
250.
23.
Hillert, L. K., Ivanisenko, N. V., Busse, D., Espe, J.,
7.
Hughes, M. A., Harper, N., Butterworth, M., Cain, K.,
Konig, C., Peltek, S. E., Kolchanov, N. A., Ivanisenko, V. A.,
Cohen, G. M., and MacFarlane, M. (2009) Reconstitution
and Lavrik, I. N. (2020) Dissecting DISC regulation via
of the death inducing signaling complex reveals a substrate
pharmacological targeting of caspase 8/c FLIPL het
switch that determines CD95 mediated death or survival,
erodimer, Cell Death Differ., 27, 2117 2130.
Mol. Cell, 35, 265 279.
24.
Spencer, S. L., and Sorger, P. K. (2011) Measuring and
8.
Yu, J. W., Jeffrey, P. D., and Shi, Y. (2009) Mechanism of
modeling apoptosis in single cells, Cell, 144, 926 939.
procaspase 8 activation by c FLIPL, Proc. Natl. Acad. Sci.
25.
Flusberg, D. A., and Sorger, P. K. (2015) Surviving apop
USA, 106, 8169 8174.
tosis: life death signaling in single cells, Trends Cell Biol.,
9.
Micheau, O., Thome, M., Schneider, P., Holler, N.,
25, 446 458.
Tschopp, J., Nicholson, D. W., Briand, C., and Grutter,
26.
Bentele, M., Lavrik, I., Ulrich, M., Stosser, S., Heermann,
M. G. (2002) The long form of FLIP is an activator of cas
D. W., Kalthoff, H., Krammer, P. H., and Eils, R. (2004)
pase 8 at the Fas death inducing signaling complex, J.
Mathematical modeling reveals threshold mechanism in
Biol. Chem., 277, 45162 45171.
CD95 induced apoptosis, J. Cell Biol., 166, 839 851.
10.
Kallenberger, S. M., Beaudouin, J., Claus, J., Fischer, C.,
27.
Lavrik, I. N. (2014) Systems biology of death receptor net
Sorger, P. K., Legewie, S., and Eils, R. (2014) Intra and
works: live and let die, Cell Death Dis., 5, e1259.
interdimeric caspase 8 self cleavage controls strength and
28.
Schleich, K., and Lavrik, I. N. (2013) Mathematical mod
timing of CD95 induced apoptosis, Sci. Signal., 7, ra23.
eling of apoptosis, Cell Commun. Signal., 11, 44.
11.
Golks, A., Brenner, D., Schmitz, I., Watzl, C., Krueger, A.,
29.
Neumann, L., Pforr, C., Beaudouin, J., Pappa, A., Fricker, N.,
Krammer, P. H., and Lavrik, I. N. (2006) The role of CAP3
Krammer, P. H., Lavrik, I. N., and Eils, R.
(2010)
in CD95 signaling: new insights into the mechanism of
Dynamics within the CD95 death inducing signaling com
procaspase 8 activation, Cell Death Differ., 13, 489 498.
plex decide life and death of cells, Mol. Syst. Biol., 6, 352.
12.
Hoffmann, J. C., Pappa, A., Krammer, P. H., and Lavrik,
30.
Buchbinder, J. H., Pischel, D., Sundmacher, K., Flassig,
I. N. (2009) A new C terminal cleavage product of procas
R. J., and Lavrik, I. N. (2018) Quantitative single cell
pase 8, p30, defines an alternative pathway of procaspase
analysis uncovers the life/death decision in CD95 network.
8 activation, Mol. Cell Biol., 29, 4431 4440.
PLoS Comput. Biol., 14, e1006368.
13.
Lavrik, I., Krueger, A., Schmitz, I., Baumann, S., Weyd, H.,
31.
Warnken, U., Schleich, K., Schnolzer, M., and Lavrik, I.
Krammer, P. H., and Kirchhoff, S. (2003) The active cas
(2013) Quantification of high molecular weight protein
pase 8 heterotetramer is formed at the CD95 DISC, Cell
platforms by AQUA mass spectrometry as exemplified for
Death Differ., 10, 144 145.
the CD95 Death Inducing Signaling Complex (DISC),
14.
Ivanisenko, N. V., and Lavrik, I. N. (2019) Mechanisms of
Cells, 2, 476 495.
procaspase 8 activation in the extrinsic programmed cell
32.
Schleich, K., Buchbinder, J. H., Pietkiewicz, S., Kahne, T.,
death pathway, Mol. Biol. (Mosk.), 53, 830 837.
Warnken, U., Ozturk, S., Schnolzer, M., Naumann, M.,
15.
Ozturk, S., Schleich, K., and Lavrik, I. N. (2012) Cellular
Krammer, P. H., and Lavrik, I. N. (2016) Molecular archi
FLICE like inhibitory proteins (c FLIPs): fine tuners of
tecture of the DED chains at the DISC: regulation of pro
life and death decisions, Exp. Cell Res., 318, 1324 1331.
caspase 8 activation by short DED proteins c FLIP and
16.
Golks, A., Brenner, D., Fritsch, C., Krammer, P. H., and
procaspase 8 prodomain, Cell Death Differ, 23, 681 694.
Lavrik, I. N. (2005) c FLIPR, a new regulator of death
33.
Fulda, S. (2013) Targeting c FLICE like inhibitory pro
receptor induced apoptosis, J. Biol. Chem., 280, 14507
tein (CFLAR) in cancer, Expert Opin. Ther. Targets, 17,
14513.
195 201.
БИОХИМИЯ том 85 вып. 10 2020
МАЛЫЕ МОЛЕКУЛЫ И ФИЛАМЕНТЫ DED
1343
34. Spencer, S. L., Gaudet, S., Albeck, J. G., Burke, J. M., and
35. Aldridge, B. B., Gaudet, S., Lauffenburger, D. A., and
Sorger, P. K. (2009) Non genetic origins of cell to cell
Sorger, P. K. (2011) Lyapunov exponents and phase dia
variability in TRAIL induced apoptosis, Nature, 459, 428
grams reveal multi factorial control over TRAIL induced
432.
apoptosis, Mol. Syst. Biol., 7, 553.
MATHEMATICAL MODELING REVEALS A ROLE FOR THE COMPOSITION
OF DED FILAMENTS IN THE EFFECTS OF SMALL MOLECULES
TARGETING CASPASE 8/c FLIPL HETERODIMER
N. V. Ivanisenko1 and I. N. Lavrik1,2*
1 Institute of Cytology and Genetics SB RAS, 630090 Novosibirsk, Russia; E%mail: n.ivanisenko@gmail.com
2 Translational Inflammation Research, Medical Faculty, Otto von Guericke University Magdeburg,
39106 Magdeburg, Germany; E%mail: ilav3103@gmail.com
Received July 17, 2020
Revised July 24, 2020
Accepted July 24, 2020
Procaspase 8 activation at the death inducing signaling complex (DISC) triggers extrinsic apoptotic pathway.
Procaspase 8 activation takes place in the death effector domain (DED) filaments and is regulated by c FLIP pro
teins, in particular, by the long isoform c FLIPL. Recently, the first in class chemical probe targeting the caspase 8/c
FLIPL heterodimer was reported. This rationally designed small molecule, FLIPin, enhances caspase 8 activity after
initial heterodimer processing. Here, we used a kinetic mathematical model to gain an insight into the mechanisms
of FLIPin action in a complex with DISC, in particular, to unravel the effects of FLIPin at different stoichiometry
and composition of the DED filament. Analysis of this model has identified the optimal c FLIPL to procaspase 8
ratios in different cellular landscapes favoring the activity of FLIPin. We predicted that the activity FLIPin is regulat
ed via different mechanisms upon c FLIPL downregulation or upregulation. Our study demonstrates that a combina
tion of mathematical modeling with system pharmacology allows development of more efficient therapeutic
approaches and prediction of optimal treatment strategies.
Keywords: apoptosis, DISC, caspase 8, FLIPin, DED, death receptors
БИОХИМИЯ том 85 вып. 10 2020