БИОХИМИЯ, 2020, том 85, вып. 10, с. 1383 - 1397
УДК 571.27
НЕТоз: МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ,
РОЛЬ В ФИЗИОЛОГИИ И ПАТОЛОГИИ
Обзор
© 2020
Н.В. Воробьева1*, Б.В. Черняк2
1 Московский государственный университет имени М.В. Ломоносова, биологический факультет,
119991 Москва, Россия; электронная почта: nvvorobjeva@mail.ru
2 НИИ физико)химической биологии имени А.Н. Белозерского, Московский государственный университет
имени М.В. Ломоносова, 119991 Москва, Россия
Поступила в редакцию 20.06.2020
После доработки 16.07.2020
Принята к публикации 16.07.2020
НЕТоз - это программа образования нейтрофильных внеклеточных ловушек или NET (neutrophil extracel$
lular traps), состоящих из модифицированного хроматина и связанных с ним бактерицидных белков гранул
и цитоплазмы. НЕТоз могут вызывать различные патогены, антитела и иммунные комплексы, цитокины,
микрокристаллы и другие физиологические стимулы. Индукция НЕТоза зависит от активных форм кисло$
рода (АФК), основным источником которых служит NADPH$оксидаза. Активация NADPH$оксидазы зави$
сит от повышения концентрации Са2+ в цитоплазме и в некоторых случаях от генерации АФК в митохонд$
риях. В процессе НЕТоза происходит выход компонентов гранул в цитозоль, модификация гистонов, веду$
щая к деконденсации хроматина, разрушение ядерной оболочки, а также образование пор в плазматичес$
кой мембране. В обзоре обсуждаются основные представления о механизмах НЕТоза, а также роль НЕТоза
в патогенезе некоторых заболеваний, включая COVID$19.
КЛЮЧЕВЫЕ СЛОВА: нейтрофил, нейтрофильные внеклеточные ловушки, НЕТоз, NADPH$оксидаза, ак$
тивные формы кислорода, митохондриальная пора, COVID$19.
DOI: 10.31857/S0320972520100061
ВВЕДЕНИЕ
фагоцитируются. При инфицировании организ$
ма хозяина нейтрофилы немедленно мигрируют
Нейтрофилы являются самой многочислен$
из кровотока в очаг воспаления, обеспечивая
ной популяцией миелоидных лейкоцитов, сос$
«первую линию» защиты от патогенов.
тавляющей в норме 50-70% всех лейкоцитов
Будучи «профессиональными» фагоцитами,
крови. Нейтрофилы дифференцируются в кост$
нейтрофилы содержат в своих гранулах огром$
ном мозге из гематопоэтических стволовых кле$
ный антимикробный «арсенал», позволяющий
ток и после полного созревания выходят в кро$
им уничтожать патогены в процессе фагоцитоза.
вяное русло. В кровотоке нейтрофилы циркули$
Бактерицидные ферменты также могут выбра$
руют не более 72 ч, после чего они либо возвра$
сываться из клеток в процессе дегрануляции.
щаются в костный мозг, где их фагоцитируют
Активация NADPH$оксидазы приводит к мас$
резидентные макрофаги, или подвергаются
совой генерации активных форм кислорода
апоптозу в периферических тканях, где также
(АФК), которые участвуют в уничтожении пато$
генов как вне, так и внутри клеток. Наконец, су$
ществует еще один антимикробный механизм,
Принятые сокращения: GSDMD - газдермин D; который заключается в высвобождении нейтро$
МРО - миелопероксидаза; mPTP - неселективная мито$
фильных внеклеточных ловушек или NET, сос$
хондриальная пора (mitochondrial permeability transition
pore); NET - нейтрофильные внеклеточные ловушки (neu$
тоящих из модифицированного хроматина, «де$
trophil extracellular traps); РКС - протеинкиназа С; АФК -
корированного» бактерицидными белками гра$
активные формы кислорода; ЛПС - липополисахарид бак$ нул и цитоплазмы. Этот феномен был впервые
териальной стенки; НЭ
- нейтрофильная эластаза; описан в работе Takei et al. [1] и в дальнейшем
ОРДС - острый респираторный дистресс$синдром; ПГК -
детально охарактеризован Brinkmann et al. [2].
программированная гибель клетки; ФМА - форбол$12$ми$
ристат$13$ацетат; ХГБ - хроническая гранулематозная бо$
Поскольку первоначально было показано, что
лезнь; ХОБЛ - хроническая обструктивная болезнь легких.
образование NET сопровождается гибелью кле$
* Адресат для корреспонденции.
ток, этот процесс был назван НЕТозом [3].
1383
1384
ВОРОБЬЕВА, ЧЕРНЯК
Образование NET может активироваться
Образование NET было показано также у
различными патогенами, такими как бактерии,
других типов иммунных клеток - эозинофилов
грибы, простейшие, вирусы, а также липополи$
и тучных клеток [17], базофилов [18], моноци$
сахаридами бактериальной клеточной стенки
тов [19] и макрофагов [20]. Интересно, что де$
(ЛПС). НЕТоз могут индуцировать антитела и
конденсированный хроматин используют для
иммунные комплексы, цитокины и хемокины
защиты от патогенов не только животные, но и
(IL$8, TNF), микрокристаллы и другие физио$
одноклеточные эукариоты [21], а также расте$
логические стимулы [4-8]. В экспериментах in
ния [22]. Таким образом, можно предположить,
vitro для индукции НЕТоза часто используют
что использование хроматина с целью защиты
форболовые эфиры (в частности, форбол$12$
хозяина от патогенов возникло достаточно рано
миристат$13$ацетат, ФМА), которые имитируют
в эволюции эукариот.
действие диацилглицерола, активируя протеин$
В последние годы накапливаются данные о
киназу c, а также кальциевые (иономицин,
роли НЕТоза при многих патологиях, связанных
А23187) и калиевые (нигерицин) ионофоры.
с воспалительными процессами. Это привело к
В настоящее время описаны две принципи$
всплеску публикаций о НЕТозе. В базе данных
ально различающиеся формы НЕТоза: класси$
PubMed можно найти почти 3000 публикаций на
ческий или суицидальный НЕТоз, который при$
эту тему, и из них около трети приходятся на
водит к гибели клетки, и прижизненный или ви$
2018-2020 гг. Такие интенсивные исследования
тальный, при котором клетка сохраняет не толь$
позволили значительно продвинуться в понима$
ко жизнеспособность, но и многие эффектор$
нии природы НЕТоза, но одновременно приве$
ные функции (см. ниже).
ли к накоплению данных, которые противоре$
Классический НЕТоз представляет собой
чат друг другу. В данном обзоре рассмотрены ба$
особую форму программируемой гибели клеток
зовые представления о механизмах НЕТоза, оп$
(ПГК), для которой характерны выход компо$
ределяющие его место в ряду других форм ПГК.
нентов гранул в цитозоль, а также деконденса$
Кроме того, показана роль НЕТоза в патогенезе
ция хроматина, связанная с модификацией гис$
некоторых заболеваний.
тонов. В то же время многие черты, характер$
ные для других форм ПГК (апоптоз, некроптоз,
пироптоз, аутофагическая гибель, вторичный
МЕХАНИЗМЫ ОБРАЗОВАНИЯ NET
некроз), присущи и НЕТозу. Подобно апоптозу,
при НЕТозе происходят координированные из$
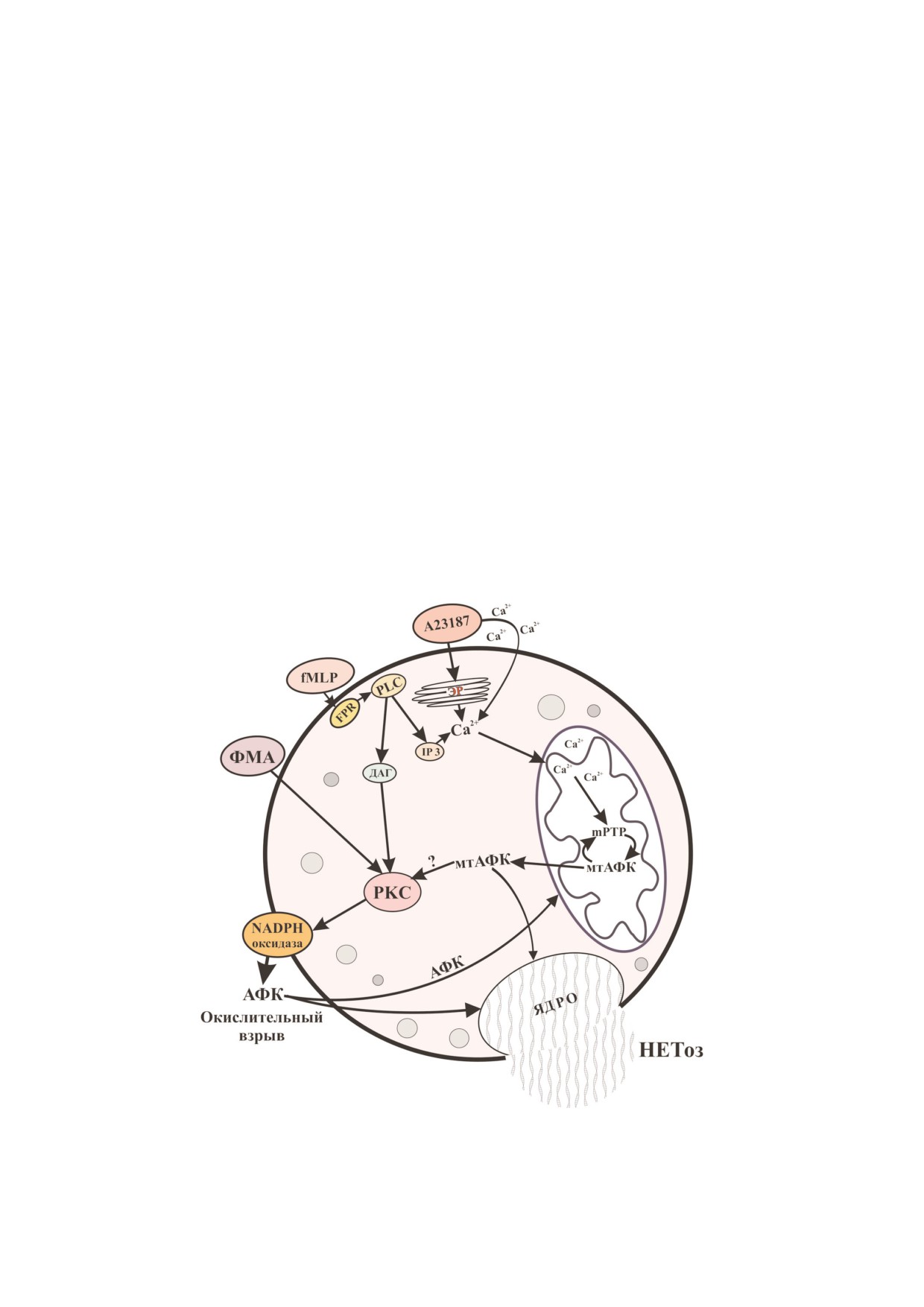
Участие АФК, образуемых NADPH5оксидазой
менения в ядре и цитоплазме, хотя природа из$
и митохондриями, в индукции НЕТоза. В первых
менений различна, и НЕТоз, в отличие от апоп$
классических работах А. Zychlinsky [23] было по$
тоза, не требует активации каспаз. При НЕТозе
казано, что НЕТоз, вызванный Staphilococcus
(как и при других формах ПГК) нарушаются
aureus или ФМА, зависит от АФК, продуцируе$
изолирующие свойства плазматической мемб$
мых NADPH$оксидазой. Интересно, что в нейт$
раны, и механизмы пермеабилизации сходны
рофилах больных хронической гранулематозной
для НЕТоза, пироптоза и некроптоза. Сигналь$
болезнью (ХГБ), не имеющих функциональной
ные механизмы НЕТоза могут включать актива$
NADPH$оксидазы, экзогенные АФК способ$
цию фосфоинозитид$3$киназы (PI3K) [9], ко$
ствовали образованию NET [23]. Основной ме$
торая контролирует также индукцию аутофаги$
ханизм активации NADPH$оксидазы связан с
ческой гибели, однако сборка аутофагосом для
фосфорилированием её субъединиц при участии
НЕТоза не требуется [10]. Особенно тесно могут
протеинкиназы с (РКС), что ведет к сборке ак$
переплетаться пути, ведущие к НЕТозу и нек$
тивного фермента на мембране [24]. В то же вре$
роптозу [11-13]. Долгое время считалось, что
мя при НЕТозе, вызванном Helicobacter pylori, ак$
митохондрии не играют заметной роли в функ$
тивация NADPH$оксидазы происходила при
ционировании нейтрофилов, поскольку в этих
участии киназ c$Raf, MEK, Akt и ERK, и РКС
клетках их содержание невелико, энергетика
была также необходима [25]. НЕТоз, индуциро$
поддерживается гликолизом, а основным ис$
ванный паразитом Entamoeba histolytica, также за$
точником АФК служит NADPH$оксидаза. Да$
висел от активации киназного каскада c$Raf$
лее, однако, выяснилось, что митохондрии
MEK$ERK, но участия РКС не наблюдалось [26].
участвуют в передаче сигналов, определяющих
Интересно, что сигнальный модуль c$Raf$MEK$
основные ответы нейтрофилов на патогены
ERK, а также РКС стимулируют экспрессию
[14]. Было установлено, что митохондриальные
Mcl$1, основного антиапоптозного белка нейт$
АФК участвуют в активации NADPH$оксидазы
рофилов [25]. По$видимому, индукция НЕТоза
и индукции НЕТоза, вызванного различными
может быть сопряжена с подавлением апоптоза,
стимулами [15, 16].
что усиливает общий антимикробный эффект.
БИОХИМИЯ том 85 вып. 10 2020
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ НЕТоза
1385
Основные механизмы активации NADPH$
Са2+$зависимая генерация мтАФК может
оксидазы при НЕТозе, скорее всего, мало отли$
служить преобладающим источником АФК в
чаются от тех, которые обеспечивают окисли$
случае индукции НЕТоза, вызванного Са2+$ио$
тельный взрыв нейтрофилов в ответ на патоге$
нофорами (А23187 и иономицин) [32] и некото$
ны и иные стимулы. Изучая активацию
рыми другими стимулами [33, 34]. Это обстоя$
NADPH$оксидазы под действием пептидного
тельство привело к формированию представле$
хемоаттрактанта N$формил$метионил$лейцил$
ний о двух различных механизмах НЕТоза, один
фенилаланина (fMLP), который вызывает окис$
из которых не зависит от NADPH$оксидазы (см.
лительный взрыв и дегрануляцию, но не НЕТоз,
обзор [5]). В действительности, в большинстве
мы обнаружили, что в этих процессах важную
таких случаев мтАФК стимулируют NADPH$ок$
роль играют митохондрии. Митохондриально$
сидазу, которая вносит свой вклад в инициацию
направленный антиоксидант SkQ1 в субмикро$
НЕТоза. Так, например, в недавно проведенной
молярных концентрациях предотвращал акти$
нами работе [16] было показано, что НЕТоз, ин$
вацию NADPH$оксидазы под действием fMLP,
дуцированный А23187, подавляется как под
но не ФМА [15]. Митохондриальные АФК
действием митохондриально$направленного
(мтАФК) стимулировали NADPH$оксидазу при
антиоксиданта SkQ1, так и специфических ин$
участии РКС, но непосредственная мишень их
гибиторов NADPH$оксидазы. Вместе с тем бы$
действия осталась неизвестной. Это может быть
ло также показано, что в нейтрофилах, выделен$
и сама РКС, которая имеет два редокс$чувстви$
ных из крови пациентов с Х$сцепленной ХГБ,
тельных серно$цинковых кластера в диацилгли$
образование NET в ответ на А23187 зависит от
церол$связывающем домене. Кроме того, неко$
усиленной генерации мтАФК без участия
торые члены семейства Src$киназ (в частности,
NADPH$оксидазы [16]. Предположено, что у
киназа Lyn), стимулирующие РКС благодаря
дефицитных по NADPH$оксидазе нейтрофилов
фосфорилированию остатков тирозина, активи$
мтАФК образуются с повышенной интенсив$
руются под действием АФК [27]. Еще один ре$
ностью благодаря избыточному накоплению
докс$чувствительный механизм активации
Са2+, и их количества хватает для запуска НЕТоза
NADPH$оксидазы нейтрофилов основан на
[35]. Неконтролируемое поступление Са2+ в ци$
АФК$зависимой ассоциации белка дисульфи$
топлазму нейтрофилов при ХГБ объясняется,
дизомеразы с субъединицей p47phox, что приво$
по$видимому, отсутствием электрогенной функ$
дит к её транслокации на мембрану с последую$
ции NADPH$оксидазы и деполяризации мемб$
щей сборкой NADPH$оксидазы [28].
раны при активации [36].
Активация NADPH$оксидазы под действи$
Наши исследования показали, что генера$
ем мтАФК была впервые продемонстрирована
ция мтАФК, вызванная как fMLP, так и А23187,
Dikalova et al. [29] на эндотелиальных клетках.
зависит от открытия неселективной митохонд$
Они показали, что митохондриально$направ$
риальной поры (mPTP) [16]. Этот факт долго ос$
ленный антиоксидант MitoTEMPO и экспрес$
тавался незамеченным, вероятно, из$за того, что
сия митохондриальной супероксиддисмутазы
наиболее известный ингибитор mPTP циклос$
SOD2 подавляют активацию NADPH$оксидазы,
порин А (CsA) является также ингибитором ци$
вызванную гормоном ангиотензином II, стиму$
топлазматической фосфатазы кальциневрина,
лирующим гипертонию. Дальнейшие исследо$
которая участвует в передаче многочисленных
вания показали, что мтАФК в эндотелии стиму$
Са2+$зависимых сигналов [37]. Мы же использо$
лируют лишь одну из четырех изоформ
вали ингибиторы mPTP санглиферин А и
NADPH$оксидазы - NOX2 [30], и именно эта
бонгкрековую кислоту, которые не влияют на
изоформа характерна для нейтрофилов. В нейт$
кальциневрин. Интересно, что при активации
рофилах была описана активация NADPH$ок$
fMLP не наблюдалось значительного снижения
сидазы под действием миксотиазола, ингибито$
мембранного потенциала митохондрий и не
ра комплекса III дыхательной цепи, который
происходило их набухания, характерного для
стимулировал продукцию мтАФК [31]. В нашем
продолжительного открытия mPTP. Скорее все$
исследовании [15] повышение мтАФК и актив$
го, в данном случае происходило кратковремен$
ности NADPH$оксидазы было вызвано сигна$
ное обратимое открытие поры, вызванное крат$
лом от G$белок$связанного рецептора fMLP, ко$
ковременным повышением цитоплазматичес$
торый инициирует освобождение Ca2+ из внут$
кого Са2+, характерного для стимуляции fMLP.
риклеточных депо, а также Са2+$независимую
Этот режим открытия mPTP был описан как для
активацию PI3K. Оба этих сигнальных пути, по$
изолированных митохондрий [37], так и для
видимому, важны для рецептор$опосредован$
клеточных моделей [38]. Сигнальная функция
ной активация NADPH$оксидазы в нейтрофи$
открытия mPTP и связанная с этим продукция
лах [27].
мтАФК была описана ранее в эндотелиальных
5 БИОХИМИЯ том 85 вып. 10 2020
1386
ВОРОБЬЕВА, ЧЕРНЯК
Рис. 1. Электронная микроскопия нейтрофилов, находящихся на ранних стадиях НЕТоза. а, б - Интактный нейтрофил
человека; в, г - нейтрофил, стимулированный 2 мкМ А23187 в течение 30 мин. В клетках наблюдалась деконденсация
хроматина, характерная для НЕТоза. Одновременно происходило набухание митохондрий, что свидетельствовало об
открытии неселективной митохондриальной поры (mPTP). Масштаб: 2 мкм (а, в) и 500 нм (б, г) [16]. Изображения по$
лучены С.А. Голышевым (НИИ ФХБ им. А.Н. Белозерского, МГУ) и цитируются с любезного разрешения издательства
Elsevier
клетках [30] и нейтрофилах, обработанных мик$
тельный стресс [37]. Возможно, АФК, образуе$
сотиазолом [31].
мые NADPH$оксидазой, проникнув в клетку,
НЕТоз, индуцированный А23187, также за$
стимулируют открытие mPTP, создавая петлю
висел от открытия mPTP [16]. В данном случае
усиления, ведущую к НЕТозу (рис. 2).
электронно$микроскопическое исследование
Открытие митохондриальной поры издавна
выявило значительное набухание митохонд$
рассматривается как один из этапов реализации
рий, которое совпадало с деконденсацией хро$
программы апоптоза [39]. Первоначально пред$
матина и разрушением ядерной оболочки
полагалось, что вызванное порой набухание
(рис. 1).
матрикса вызывает разрыв внешней мембраны
Можно полагать, что значительное повыше$
митохондрий и выход проапоптозных белков (в
ние цитоплазматического Са2+ под действием
частности, цитохрома с) из межмембранного
А23187 привело к продолжительному открытию
пространства в цитоплазму. В дальнейшем эта
поры. Са2+$зависимое открытие mPTP стимули$
гипотеза была модифицирована с учётом дан$
ровало образование мтАФК, а ингибиторы
ных о выходе цитохрома с через белковые поры
mPTP предотвращали их накопление. Непосред$
в мембране. Предполагалось, что открытие
ственной причиной избыточного образования
mPTP способствует изменению морфологии
мтАФК, возможно, послужил выход из митохон$
внутренней мембраны и освобождению цитох$
дрий через пору основных компонентов их ан$
рома с из пространства внутри крист [40]. Дета$
тиоксидантной защиты, NADPH [38] и восста$
ли этого механизма остаются не вполне понят$
новленного глутатиона [16]. Наряду с Ca2+ эф$
ными, но не вызывает сомнений, что специфи$
фективным индуктором mPTP является окисли$
ческие ингибиторы поры предотвращают апоп$
БИОХИМИЯ том 85 вып. 10 2020
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ НЕТоза
1387
тоз в различных моделях. Несомненна также и
он, используя в качестве субстратов хлор и пе$
возможность участия mPTP в индукции некро$
роксид водорода. Показано, что АФК вызывают
тической гибели. В частности, это наблюдается
диссоциацию азуросомы, что приводит к выхо$
при ишемии/реперфузии сердца и определяет
ду сериновых протеаз и МРО из гранул в цито$
защитное действие ингибиторов поры [41].
золь [42]. Сериновые протеазы (прежде всего,
Приведенные выше данные позволяют поста$
НЭ) расщепляют элементы цитоскелета, что
вить НЕТоз, индуцированный кальциевыми ио$
способствует протеканию НЕТоза [43]. Кроме
нофорами, в этот ряд ПГК. Обнаруженное нами
того, они мигрируют в ядро, где расщепляют
участие мтАФК в активации NADPH$оксидазы
ламину и гистоны, способствуя деконденсации
при таком НЕТозе, который часто называют
хроматина и разрушению ядерной оболочки.
NADPH$оксизада$независимым, указывает на
Важную роль в диссоциации азуросомы и выхо$
то, что его правильнее именовать митохондри$
де протеаз из гранул играет MPO [42, 44]. Инте$
ально$зависимым НЕТозом.
ресно, что ферментативная активность МРО
Механизмы реализации программы НЕТоза.
для этого не нужна. Возможно, этот гем$содер$
Важным событием при НЕТозе является выход
жащий белок служит внутриклеточным рецеп$
различных белков из гранул в цитозоль. Прежде
тором перекиси водорода. Тем не менее, актив$
всего, это касается азурофильных гранул, в сос$
ность МРО требуется для НЕТоза, поскольку
тав которых входит белковый комплекс «азуро$
гипохлорит$анион стимулирует активность
сома». Она включает восемь типов белков, три
нейтрофильной эластазы [42]. Следует отме$
из которых представляют собой высокогомоло$
тить, что АФК$зависимый выход белков из гра$
гичные сериновые протеазы - нейтрофильная
нул при НЕТозе во многом напоминает АФК$
эластаза (НЭ), катепсин G и азуроцидин, и,
зависимую пермеабилизацию лизосом и выход
кроме того, миелопероксидазу (МРО), фер$
из них катепсинов, что характерно для многих
мент, который вырабатывает гипохлорит$ани$
вариантов некроза [45].
Рис. 2. Схема, иллюстрирующая различные механизмы НЕТоза
БИОХИМИЯ том 85 вып. 10 2020
5*
1388
ВОРОБЬЕВА, ЧЕРНЯК
Из цитоплазмы в ядро также поступает пеп$
дит к пермеабилизации митохондрий и усиле$
тидил$аргинин дезаминаза 4 (PAD4), которая
нию апоптоза, а также ко вторичному некрозу
катализирует цитруллинирование гистонов, что
[52, 53]. При некроптозе под действием RIP ки$
приводит к окончательной деконденсации хро$
наз происходит активация другого порообразу$
матина. Ингибирование PAD4 предотвращает
ющего белка MLKL (не родственного газдерми$
деконденсацию хроматина и НЕТоз, вызванные
нам), что также приводит к выбросу NET
Са2+$ионофором или бактерией Shigella flexneri,
[11-13].
а нейтрофилы, полученные из мышей с нокау$
Физиологическая модуляция НЕТоза. В физио$
том по гену PAD4, не формируют NET в ответ на
логических условиях отношение концентраций
ФМА [46]. Пептидил$аргинин дезаминазы яв$
CO2/HCO–, рН и содержание O2 могут модули$
ляются Са2+$связывающими белками и их ак$
ровать НЕТоз. В умеренно щелочных условиях и
тивность стимулируется Са2+. С другой стороны,
при сниженном соотношении CO2/HCO– уро$
PAD4 активируется и вызывает цитруллиниро$
вень НЕТоза, вызванного ФМА, Са2+$ионофо$
вание гистонов в ответ на добавку пероксида во$
ром, микрокристаллами мочевой кислоты и
дорода [46]. Кроме того, ЛПС$зависимое цит$
ЛПС, был повышен [54]. Повышение рН в ци$
руллинирование гистонов и НЕТоз зависят от
топлазме нейтрофилов вызывало увеличение
интактности микротрубочек [47]. По всей види$
концентрации Са2+ и усиленную продукцию
мости, сочетание всех этих факторов необходи$
АФК как NADPH$оксидазой, так и митохонд$
мо для активации PAD4. Наряду с пептидил$ар$
риями [55]. Снижение рН среды вызывает угне$
гинин дезаминазой, модификация гистонов при
тение НЕТоза, возможно, благодаря торможе$
НЕТозе может включать и ацетилирование, но
нию гликолиза [56]. Кроме того, при низком рН
его роль в НЕТозе пока мало изучена [5]. Декон$
резко снижается вероятность открытия mPTP
денсация хроматина, а также протеолитическое
[37], что может понизить продукцию мтАФК
повреждение ядерной ламины приводят к раз$
[16]. Предполагается, что рН$зависимость НЕТоза
рушению ядерной оболочки и выходу хромати$
приводит к тому, что на периферии очага воспа$
на в цитоплазму. Недавно было показано, что
ления он максимально активирован и предохра$
НЕТоз может происходить благодаря активации
няет ткань от проникновения патогенов, а в
циклин$зависимых киназ (CDK), которые спо$
центре очага, для которого характерен низкий
собствуют вступлению в клеточный цикл [48].
рН, НЕТоз ослаблен и не усиливает поврежде$
Возможно, такие части аппарата митоза, как
ние тканей [54]. Сведения о влиянии гипоксии
фосфорилирование ламина и расхождение
на НЕТоз противоречивы. С одной стороны, но$
центросом, используются для разрушения ядер$
каут Hif$1α (основного транскрипционного
ной оболочки при НЕТозе.
фактора, регулирующего адаптацию к гипок$
На завершающей стадии НЕТоза происходит
сии) подавлял НЕТоз, а фармакологическая ста$
образование пор в плазматической мембране и
билизация Hif$1α его стимулировала [57]. С дру$
освобождение хроматина во внешнюю среду с
гой стороны, НЕТоз, вызванный ФМА (но не S.
образованием NET. Белки, вышедшие из гра$
aureus), при гипоксии понижался, и этот эффект
нул, прочно связываются с деконденсирован$
не зависел от Hif$1α [58]. Помимо состава сре$
ным хроматином благодаря электростатическо$
ды, НЕТоз зависит от её осмолярности, так что
му взаимодействию. Поры, пропускающие эти
гипертоническая среда подавляла продукцию
гигантские комплексы, формируются белком
АФК и НЕТоз. Уровень АФК в данном случае
газдермином D (GSDMD), который формирует
был критичен, так как добавление пероксида
также поры в мембране макрофагов при пироп$
водорода восстанавливало НЕТоз [59].
тозе. В отличие от пироптоза, где активация
Цитокины и медиаторы воспаления играют
GSDMD происходит благодаря расщеплению
важную роль в активации НЕТоза, в то же время
под действием каспаз$1 и $4/5 (каспаза$11, у
некоторые антивоспалительные факторы могут
мышей), в нейтрофилах его расщепляет и акти$
вызывать обратный эффект. Так, простагландин
вирует преимущественно нейтрофильная элас$
E2, играющий важную роль в разрешении вос$
таза [49, 50]. Активация GSDMD, возможно,
паления, ингибирует НЕТоз благодаря увеличе$
приводит к формированию пор не только в
нию внутриклеточного содержания цикличес$
плазматической, но и в ядерной мембране [51].
кого АМФ [60, 61]. Активированный С$белок
Каспаза$зависимая активация GSDMD в нейт$
(сериновая протеиназа, обладающая противос$
рофилах также возможна в результате некано$
вертывающим и противовоспалительным
нической активации инфламмасомы [51], одна$
действием) также может ингибировать НЕТоз
ко роль этого механизма в НЕТозе требует даль$
благодаря связыванию со специфическим ре$
нейшего изучения. Родственный GSDMD газ$
цептором (EPCR) или взаимодействию с проте$
дермин Е активируется каспазой$3, что приво$
аза$активируемым рецептором 3 (PAR3) и ин$
БИОХИМИЯ том 85 вып. 10 2020
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ НЕТоза
1389
тегринами CD11b/CD18 (Mac$1). Интересно,
ние, в дальнейшем не была исследована. Сход$
что тот же активированный С$белок может рас$
ный витальный выброс хроматина наблюдали in
щеплять гистоны, входящие в состав NET [62].
vivo при заражении кожи грамположительными
Показано, что НЕТоз подавляется важным про$
бактериями [69]. Для индукции этого процесса
тивовоспалительным цитокином IL$10 [63].
требовалась опсонизация бактерий, которые
Пептиды, эффективно подавляющие образова$
взаимодействовали с TLR2 и активировали сис$
ние NET, были обнаружены в пуповинной кро$
тему комплемента. Интересно, что после выб$
ви. Наиболее распространенный пептид полу$
роса хроматина безъядерные нейтрофилы были
чил название «неонатальный NET$ингибирую$
способны к хемотаксису и фагоцитозу бакте$
щий фактор» (nNIF). Этот пептид избирательно
рий.
ингибировал НЕТоз, не влияя на фагоцитоз и
Массированный и очень быстрый выброс
другие функции нейтрофилов. Его внутривен$
митохондриальной ДНК (мтДНК) без утраты
ное введение защищало мышей от системного
жизнеспособности наблюдался в эозинофилах и
воспаления, вызванного ЛПС, и от микробного
нейтрофилах, праймированных провоспали$
сепсиса [64].
тельными цитокинами IL$5/IFN$γ или GM$
Патогенные микроорганизмы обладают ши$
CSF, соответственно, и стимулированных ЛПС
роким спектром приспособлений, препятствую$
[70, 71]. В обоих типах гранулоцитов этот про$
щих микробицидному действию NET
[65].
цесс зависел от активности NADPH$оксидазы.
Многие микроорганизмы вырабатывают лити$
Аналогичный феномен наблюдался и в случае
ческие ферменты (прежде всего, эндонуклеазы),
базофилов [18]. Сходный выброс мтДНК был
разрушающие NET. Такие бактерии, как
обнаружен у В$ и Т$лимфоцитов, а также у нату$
Pseudomonas aeruginosa, Mycobacterium tuberculo)
ральных киллерных клеток (NK$клетки) в ответ
sis, а также грибы рода Aspergillus, вырабатывают
на олигодезоксинуклеотиды [72]. В отличие от
защитные и маскирующие внеклеточные обо$
гранулоцитов, выброс митохондриальной ДНК
лочки. В случае P. аeruginosa покрытие сиаловы$
из лимфоцитов не зависел от NADPH$оксида$
ми кислотами вызывает продукцию IL$10, кото$
зы. Вопрос о функциональной роли внеклеточ$
рый подавляет НЕТоз. Этот же механизм, по$
ной мтДНК остается открытым. Низкое содер$
видимому, использует вирус иммунодефицита
жание митохондрий в нейтрофилах и особенно
человека (HIV$1). Вирионы HIV$1 стимулируют
в эозинофилах делает маловероятным образова$
выработку IL$10 дендритными клетками, что за$
ние функциональных митохондриальных лову$
щищает вирус от литического действия фермен$
шек. В случае лимфоцитов внеклеточная
тов, входящих в NET [63]. Вирус гепатита В
мтДНК не содержала литических ферментов и,
(HBV) ингибирует НЕТоз, подавляя продукцию
скорее всего, выполняла сигнальную функцию.
АФК в нейтрофилах с помощью белка оболочки
В частности, мтДНК стимулировала экспрес$
HBE и корового белка HBC [66].
сию и секрецию интерферонов I типа мононук$
леарами периферической крови [72]. Следует
отметить, что внеклеточная мтДНК (часто окис$
ПРИЖИЗНЕННОЕ ОБРАЗОВАНИЕ NET
ленная) встречается в крови при широком
спектре патологий, включая системную красную
Наряду с описанным выше суицидальным
волчанку, аутоиммунное заболевание, в патоге$
НЕТозом существуют также механизмы выброса
незе которого важную роль играет НЕТоз [33].
ДНК, при которых нейтрофилы сохраняют свою
жизнеспособность и естественные эффекторные
функции [6]. Для описания этих процессов был
РОЛЬ НЕТоза В ЗАЩИТЕ ХОЗЯИНА
использован термин «витальный НЕТоз». Одна$
И ПАТОЛОГИИ
ко Комитет по номенклатуре клеточной гибели
в 2018 г. [67] не рекомендовал использовать тер$
В первых же работах по НЕТозу высказывали
мин НЕТоз для процессов, не сопряженных с
соображения о физиологической защитной ро$
гибелью клетки. Впервые прижизненный выб$
ли этого явления. В частности, структуры, по$
рос хроматина был описан в системе, где при$
добные NET, были обнаружены в содержимом
сутствовали нейтрофилы и тромбоциты, акти$
аппендикса [2]. В дальнейшем NET были обна$
вированные ЛПС, которые связывались с
ружены в очень большом числе органов и тка$
TLR4 [68]. НЕТоз в данном случае происходил
ней [6], однако вопрос о его защитном действии
значительно быстрее, чем при индукции ФМА,
по$прежнему остается открытым. НЕТоз наб$
а роль NADPH$оксидазы и АФК не была изу$
людается в очагах инфекций и, по$видимому,
чена. К сожалению, эта интересная модель,
замедляет распространение патогенов. Так, по$
имеющая очевидное физиологическое значе$
казано, что НЕТоз при стафилококковой ин$
БИОХИМИЯ том 85 вып. 10 2020
1390
ВОРОБЬЕВА, ЧЕРНЯК
фекции кожи тормозит проникновение патоге$
на патогены, облегчающей их захват в фибрино$
нов в кровоток [69]. Мыши, не способные к
вом сгустке. Кроме того, тромбы мелких сосудов
НЕТозу из$за нокаута гена PAD4, значительно
могут создавать отсеки, где патогены могут быть
сильнее страдали от некротического фасциита,
эффективно уничтожены. При этом послед$
вызванного Streptococcus pyogenes группы A [46].
ствия такой реакции могут быть трагическими.
Однако избыточное образование NET, связан$
Недавнее масштабное клиническое исследова$
ное как с усиленным НЕТозом, так и с наруше$
ние выявило корреляцию между уровнем НЕТоза
нием механизмов их устранения, может приво$
и тяжестью ишемического инсульта и инфаркта
дить к воспалительным и аутоиммунным пато$
миокарда [84]. НЕТоз может активироваться
логиям, а также к закупорке протоков и крове$
микрокристаллами холестерина и участвовать в
носных сосудов.
патогенезе атеросклероза. Гистоны в составе
НЕТоз на поверхности эпителия. Микроорга$
NET вызывают TLR4$зависимую активацию
низмы постоянно атакуют эпителиальные барь$
макрофагов и выброс цитокинов, активирую$
еры, индуцируя образование NET на поверхнос$
щих T$хелперные клетки (Th17) [85, 86]. Воспа$
ти слизистой полости рта, глаз и коже. Поэтому
лительный процесс в бляшках может служить
образование NET и их деградация должны стро$
одной из причин тромбоза. Еще одной причи$
го регулироваться, чтобы не вызвать воспаления
ной тромбоза могут быть онкологические забо$
в этих тканях. Был описан ряд заболеваний, в
левания, и НЕТоз, предположительно, участвует
которых NET играют как противомикробную,
в тромбообразовании [87]. С другой стороны,
так и патогенетическую роль.
терапевтическое вирусное инфицирование опу$
На поверхности роговицы глаза НЕТоз
холей индуцирует нейтрофил$зависимую внут$
участвует в защите как от бактериальной, так и
риопухолевую коагуляцию и гибель раковых
грибковой инфекции. У пациентов с выражен$
клеток. Однако предстоит еще выяснить,
ным НЕТозом грибковый кератит протекал зна$
действительно ли этот процесс обусловлен
чительно легче [73], однако НЕТоз осложнял
НЕТозом [88]. Тромбоз, характерный для раз$
течение кератита, вызванного клиническими
личных вирусных инфекций, может быть связан
изолятами P. aeruginosa в мышиной модели [74].
с избыточным НЕТозом, и, по$видимому, участ$
В случае стерильного воспаления роговицы при
вует в патогенезе COVID$19 (см. ниже).
синдроме сухого глаза также наблюдалось на$
В протоках поджелудочной железы НЕТоз
копление NET [75]. Одной из причин НЕТоза
может быть вызван микрокристаллами карбона$
могла быть повышенная осмолярность слёзной
та кальция, что ведет к закупорке панкреатичес$
жидкости, омывающей роговицу
[76]. Для
кого протока и панкреатиту [89]. Подобные
синдрома сухого глаза, который часто возника$
кристаллы вызывают НЕТоз в желчных прото$
ет как проявление реакции «трансплантат про$
ках и желчном пузыре, что может вести к обра$
тив хозяина» при пересадках костного мозга
зованию желчных камней [90].
[77], и для аутоиммунного синдрома Шегрена
Роль НЕТоза в развитии легочных заболева5
[78] также характерно накопление NET в слёз$
ний. В дыхательных путях НЕТоз вносит свой
ной жидкости. Интересно, что митохондриаль$
вклад в защиту от инфекции, повышая вязкость
но$направленный антиоксидант SkQ1 (в соста$
слизи и способствуя уничтожению патогенов,
ве глазных капель «Визомитин») доказал свою
однако многие из них (в частности, Streptococcus
высокую эффективность при терапии синдрома
pneumoniae, Haemophilus influenzae) вырабатыва$
сухого глаза различной этиологии [79]. Можно
ют эндонуклеазы, которые расщепляют NET и
полагать, что этот эффект SkQ1 отчасти связан с
защищают себя от гибели [91]. Вместе с тем
обнаруженным нами подавлением НЕТоза [16].
НЕТоз способствует развитию осложнений ин$
Роль НЕТоза в тромбообразовании. НЕТоз иг$
фекционных заболеваний легких, таких как ост$
рает важную роль в патогенезе тромбозов раз$
рый респираторный дистресс$синдром (ОРДС),
личного происхождения [80, 81]. Так, например,
хроническая обструктивная болезнь легких
в модели стеноза нижней полой вены у мышей с
(ХОБЛ), а также бронхиальная астма и др. Про$
нокаутом гена PAD4 вероятность тромбоза была
веденное недавно (но до начала эпидемии
значительно снижена [82]. Участие НЕТоза в
COVID$19) клиническое исследование внеболь$
тромбозе определяется взаимодействием NET с
ничной пневмонии показало корреляцию со$
эндотелием и тромбоцитами, а также задержкой
держания NET и тяжести заболевания [92]. Ост$
мелких тромбов. НЕТоз, по$видимому, опреде$
рое повреждение легких (ОПЛ) и более тяжелый
ляет тромбоз, связанный с избыточными реак$
ОРДС, обусловленные разнообразной этиоло$
циями врожденного иммунитета («иммунот$
гией, сопровождаются избыточным НЕТозом
ромбоз») [83]. Иммунотромбоз, предположи$
[93]. НЕТоз при этих патологиях может участво$
тельно, является защитной реакцией организма
вать в повреждении альвеолярного эпителия и
БИОХИМИЯ том 85 вып. 10 2020
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ НЕТоза
1391
эндотелия. Для ХОБЛ, которая, как правило,
воспалительных цитокинов (включая интерфе$
связана с курением и загрязнением воздуха, и
роны I типа) и значительно легче входят в
тяжелой «нейтрофильной» астмы также харак$
НЕТоз, чем нормальные нейтрофилы. Их NET
терно накопление NET в мокроте и смывах из
содержат больше аутоантигенов и окисленной
дыхательных путей [94]. Риновирусная инфек$
митохондриальной ДНК [33], что делает их бо$
ция на фоне астмы значительно повышала со$
лее сильными иммуностимуляторами. Одной из
держание NET [95]. При астме образование хро$
особенностей гранулоцитов низкой плотности
матин$содержащих ловушек может происходить
является усиленная продукция митохондриаль$
также при гибели эозинофилов, подобной
ных АФК. Недавно было показано, что митохон$
НЕТозу [96].
дриально$направленный антиоксидант MitoQ
Тяжелая острая респираторная инфекция
(сходный по структуре с SkQ1) подавляет НЕТоз
COVID$19 (corona virus disease$19), вспыхнув$
и патологические проявления в мышиной моде$
шая в декабре 2019 г. в китайском городе Ухань и
ли системной красной волчанки [102].
впоследствии переросшая в пандемию, порази$
При ревматоидном артрите (РА) развитие
ла в настоящее время более 15 млн человек из
патологии коррелировало с накоплением мар$
250 стран мира. Заболевание было вызвано но$
керов NET, комплексов ДНК с МПО и антител
вым коронавирусом, названным SARS$CoV$2
к цитруллинированным гистонам [103, 104].
(severe acute respiratory syndrome coronavirus 2), и
Кроме того, на модели РА было установлено,
сопровождалось вирусной пневмонией, часто
что поглощение NET фибробластами стимули$
прогрессирующей в ОРДС и полиорганную не$
ровало образование антител против цитрулли$
достаточность. Повышенный уровень нейтро$
нированных гистонов [105]. Подобные наблю$
филов в крови указывает на тяжесть этого забо$
дения свидетельствуют об участии НЕТоза в та$
левания и плохой прогноз [97]. При обследова$
ких аутоиммунных заболеваниях, как васкулит,
нии пациентов, инфицированных SARS$CoV$2,
ассоциированный с «антителами против нейт$
в крови был обнаружен повышенный уровень
рофилов» (AAV), антифосфолипидный синд$
маркеров НЕТоза (свободной ДНК, комплексов
ром, рассеянный склероз и псориаз [106]. Инте$
МПО$ДНК и цитруллинированного гистона
ресно, что при некоторых заболеваниях НЕТоз
Н3) и маркера гибели клеток лактатдегидроге$
может играть антивоспалительную роль. Так,
назы [98]. Концентрация свободной ДНК кор$
при падагре НЕТоз, индуцированный кристал$
релировала с содержанием нейтрофилов, с
лами мочевой кислоты, сопровождается выбро$
уровнем маркера острой фазы воспаления С$ре$
сом литических ферментов, которые расщепля$
активным белком и маркером тромбоза D$ди$
ют провоспалительные цитокины в очаге воспа$
мером. Сыворотки пациентов с COVID$19 ин$
ления. Предполагается, что НЕТоз при подагре
дуцировали НЕТоз у здоровых доноров в систе$
предотвращает развитие хронического заболе$
ме in vitro. Одним из проявлений COVID$19 яв$
вания [107].
ляется встречающийся у детей синдром Каваса$
ки (васкулит), для которого характерен избы$
точный НЕТоз [99]. НЕТоз при COVID$19 мо$
ТЕРАПИЯ НЕТоза
жет быть вызван эпителиальными и эндотели$
альными клетками, пораженными вирусом, ак$
Выявленное участие НЕТоза в различных па$
тивированными тромбоцитами и воспалитель$
тологиях привело к интенсивному изучению и
ными цитокинами. В то же время избыточный
испытаниям различных терапевтических подхо$
НЕТоз участвует в развитии «цитокинового
дов. Одна их часть включает применение
шторма» и тромбоза, которые являются основ$
средств, препятствующих НЕТозу. К ней отно$
ной причиной тяжелого течения COVID$
сится антицитокиновая терапия, направленная
19 [100].
на предотвращение накопления нейтрофилов в
НЕТоз и аутоиммунные заболевания. Многие
очагах поражения и их активацию, а также при$
компоненты NET, в частности, двуспиральная
менение ингибиторов компонентов программы
ДНК, белки гранул и гистоны, вызывают выра$
НЕТоза: НЭ, PAD4 и GSDMD. Другая часть свя$
ботку антител и могут стимулировать развитие
зана с подходами, направленными на разруше$
аутоиммунных заболеваний. Впервые участие
ние NET или ослабление их повреждающего
НЕТоза в патогенезе аутоиммунных заболева$
действия. Антицитокиновая терапия, направ$
ний было детально исследовано на примере сис$
ленная против IL$1β, широко используется при
темной красной волчанки [101]. При этом забо$
различных воспалительных и аутоиммунных за$
левании в крови появляется особая форма гра$
болеваниях. Одной из её мишеней может яв$
нулоцитов, названная «гранулоциты низкой
ляться избыточный НЕТоз. Рекомбинантный
плотности». Эти клетки вырабатывают больше
белок Анакинра, антагонист рецептора IL$1β, в
БИОХИМИЯ том 85 вып. 10 2020
1392
ВОРОБЬЕВА, ЧЕРНЯК
настоящее время проходит клинические испы$
TNF [111]. Сходный по структуре с SkQ1 анти$
оксидант MitoQ также подавлял НЕТоз в мыши$
NCT04324021, NCT04330638, NCT02735707). Из
ной модели системной красной волчанки [102].
ингибиторов НЕТоза наиболее далеко продви$
Эти результаты позволяют надеяться на то, что
нулись испытания ингибиторов НЭ. Первый из
на основе митохондриально$направленных ан$
них, сивелестат, был разрешен к применению
тиоксидантов могут быть созданы препараты
при ОРДС в Японии и Южной Корее, но мета$
для терапии болезней, связанных с избыточным
анализ клинических данных не подтвердил его
НЕТозом и, в частности, с COVID$19.
эффективность [108]. Новое поколение ингиби$
торов НЭ в настоящее время находится лишь на
Программа образования нейтрофильных
первой стадии клинических испытаний. Ингиби$
внеклеточных ловушек (НЕТоз) изучается с вы$
торы GSDMD и PAD4 находятся на доклиничес$
сокой интенсивностью, однако многие вопросы
кой стадии разработки. Большой интерес предс$
относительно его механизмов и физиологичес$
тавляет использование существующих лекар$
кой роли остаются открытыми. Прежде всего,
ственных препаратов. Так, дисульфирам, который
это относится к сигнальным механизмам ини$
используется для лечения алкоголизма, ингиби$
циации НЕТоза. В частности, остаются неясны$
рует GSDMD и защищает мышей от гибели в мо$
ми процессы, ведущие к модификации хромати$
дели сепсиса, вызванного ЛПС [109]. Надо отме$
на и его деконденсации. Не определены пока
тить, что GSDMD является также критическим
мишени для действия мтАФК и детали мтАФК$
компонентом программы пироптоза, и авторы
зависимой активации NADPH$оксидазы. Пред$
исследования связывают его эффект с предотвра$
полагается, что избыточный НЕТоз играет важ$
щением пироптоза макрофагов. Эксперименты
ную роль в патогенезе многих инфекционных,
in vitro показали, что НЕТоз предотвращается ин$
воспалительных и аутоиммунных заболеваний,
гибиторами микротрубочек [47]. К этой группе
но доказательств этому пока собрано недоста$
препаратов относится колхицин, и в настоящее
точно. Новый толчок к изучению патофизиоло$
время ведутся клинические испытания колхици$
гической роли НЕТоза может быть связан с его
предполагаемой ролью в патогенезе COVID$19.
NCT04326790, NCT04328480, NCT04322565,
Разработка новых лекарственных средств, пред$
NCT04322682).
отвращающих НЕТоз, включая митохондриаль$
Среди препаратов, направленных на разру$
но$направленные антиоксиданты, представля$
шение NET, наиболее детально исследованы
ется перспективным направлением фармаколо$
ДНКаза I и антитела против гистонов. Рекомби$
гических исследований.
нантная ДНКаза I была успешно использована
практически во всех моделях патологий, сопря$
женных с НЕТозом. В частности, введение
Благодарности. Авторы выражают благодар$
ДНКазы I значительно облегчает течение ОРДС
ность сотрудникам НИИ ФХБ им. А.Н. Белозер$
[93] и ХОБЛ [94] в моделях на животных. У па$
ского МГУ О.Ю.Плетюшкиной, И.И.Галкину,
циентов с муковисцидозом ингаляция ДНКазы
С.А.Голышеву, Р.А.Зиновкину и А.С.Приходько,
улучшала функцию легких, а нейтрофильная
принявших активное участие в эксперименталь$
эластаза способствовала растворению мокроты,
ной работе, посвященной изучению НЕТоза,
делая её более доступной для ДНКазы [110].
дегрануляции и окислительного взрыва нейтро$
Клинические испытания актин$резистентной
филов человека. Мы также от всего сердца бла$
ДНКазы (PRX$110) проходят вторую фазу и да$
годарим Владимира Петровича Скулачева, ко$
торый инициировал наши работы в области ми$
trials.gov: NCT02605590, NCT02722122). Можно
тохондриологии, и поздравляем нашего дорого$
надеяться, что ДНКаза будет не только разжи$
го учителя с 85$летним юбилеем.
жать мокроту, но и сможет препятствовать раз$
Финансирование. Работа выполнена при фи$
витию ОРДС, как это наблюдалось в экспери$
нансовой поддержке РФФИ (грант
17$00$
ментах на животных.
00088).
Наши эксперименты с митохондриально$
Конфликт интересов. Авторы заявляют об от$
направленным антиоксидантом SkQ1 показали
сутствии конфликта интересов.
его потенциальную эффективность против
Соблюдение этических норм. Настоящая
НЕТоза [16]. В модели системного воспалитель$
статья не содержит описания каких$либо иссле$
ного синдрома на мышах SkQ1 предотвращал
дований с использованием животных в качестве
летальное действие воспалительного цитокина
объектов.
БИОХИМИЯ том 85 вып. 10 2020
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ НЕТоза
1393
СПИСОК ЛИТЕРАТУРЫ
1.
Takei, H., Araki, A., Watanabe, H., Ichinose, A., and
(2017) Mitochondrial reactive oxygen species are involved
Sendo, F. (1996) Rapid killing of human neutrophils by the
in chemoattractant$induced oxidative burst and degranula$
potent activator phorbol 12$myristate 13$acetate (PMA)
tion of human neutrophils in vitro, Eur. J. Cell. Biol., 96,
accompanied by changes different from typical apoptosis
254$265, doi: 10.1016/j.ejcb.2017.03.003.
or necrosis, J. Leukoc. Biol., 59, 229$240, doi: 10.1002/
16.
Vorobjeva, N., Galkin, I., Pletjushkina, O., Golyshev, S.,
jlb.59.2.229.
Zinovkin, R., Prikhodko, A., Pinegin, V., Kondratenko, I.,
2.
Brinkmann, V., Reichard, U., Goosmann, C., Fauler, B.,
Pinegin, B., and Chernyak, B. (2020) Mitochondrial perme$
Uhlemann, Y., Weiss, D. S., Weinrauch, Y., and
ability transition pore is involved in oxidative burst and
Zychlinsky, A. (2004) Neutrophil extracellular traps kill
NETosis of human neutrophils, Biochim. Biophys. Acta Mol.
bacteria, Science, 303, 1532$1535, doi: 10.1126/science.
Basis. Dis., 1866, 165664, doi: 10.1016/j.bbadis.2020.165664.
1092385.
17.
Von Köckritz$Blickwede, M., Goldmann, O., Thulin, P.,
3.
Steinberg, B. E., and Grinstein, S. (2007) Unconventional
Heinemann, K., Norrby$Teglund, A., Rohde, M., and
roles of the NADPH oxidase: signaling, ion homeostasis,
Medina, E. (2008) Phagocytosis$independent antimicrobial
and cell death, Sci. STKE, 379, pe11, doi: 10.1126/stke.
activity of mast cells by means of extracellular trap formation,
3792007pe11.
Blood, 111, 3070$3080, doi: 10.1182/blood$2007$07$104018.
4.
Vorobjeva, N. V., and Pinegin, B. V. (2014) Neutrophil
18.
Morshed, M., Hlushchuk, R., Simon, D., Walls, A. F.,
extracellular traps: mechanisms of formation and role in
Obata$Ninomiya, K., Karasuyama, H., Djonov, V., Eggel, A.,
health and disease, Biochemistry (Moscow), 79, 1286$1296,
Kaufmann, T., Simon, H. U., and Yousefi, S. (2014)
doi: 10.1134/S0006297914120025.
NADPH oxidase$independent formation of extracellular
5.
Ravindran, M., Khan, M. A., and Palaniyar, N. (2019)
DNA traps by basophils, J. Immunol., 192, 5314$5323,
Neutrophil extracellular trap formation: physiology,
doi: 10.4049/jimmunol.1303418.
pathology, and pharmacology, Biomolecules, 9, 365,
19.
Granger, V., Faille, D., Marani, V., Noël, B., Gallais, Y.,
doi: 10.3390/biom9080365.
Szely, N., Flament, H., Pallardy, M., Chollet$Martin, S.,
6.
Yousefi, S., Simon, D., Stojkov, D., Karsonova, A.,
and de Chaisemartin, L. (2017) Human blood monocytes
Karaulov, A., and Simon, H. U. (2020) In vivo evidence for
are able to form extracellular traps, J. Leukoc. Biol., 102,
extracellular DNA trap formation, Cell Death Dis., 11, 300,
775$781, doi: 10.1189/jlb.3MA0916$411R.
doi: 10.1038/s41419$020$2497$x.
20.
Chow, O. A., von Köckritz$Blickwede, M., Bright, A. T.,
7.
Rada, B. (2017) Neutrophil extracellular traps and micro$
Hensler, M. E., Zinkernagel, A. S., Cogen, A. L., Gallo, R. L.,
crystals, J. Immunol. Res., 2017, 2896380, doi: 10.1155/
Monestier, M., Wang, Y., Glass, C. K., and Nizet, V.
2017/2896380.
(2010) Statins enhance formation of phagocyte extracellu$
8.
Pinegin, B., Vorobjeva, N., and Pinegin, V.
(2015)
lar traps. Statins enhance formation of phagocyte extracel$
Neutrophil extracellular traps and their role in the develop$
lular traps, Cell. Host Microbe, 8, 445$454, doi: 10.1016/
ment of chronic inflammation and autoimmunity,
j.chom.2010.10.005.
Autoimmun. Rev., 14, 633$640, doi: 10.1016/j.autrev.
21.
Zhang, X., Zhuchenko, O., Kuspa, A., and Soldati, T.
2015.03.002.
(2016) Social amoebae trap and kill bacteria by casting
9.
Remijsen, Q., Vanden Berghe, T., Wirawan, E., Asselbergh, B.,
DNA nets, Nat. Commun., 7, 10938, doi: 10.1038/
Parthoens, E., De Rycke, R., Noppen, S., Delforge, M.,
ncomms10938.
Willems, J., and Vandenabeele, P. (2011) Neutrophil extra$
22.
Hawes, M., Allen, C., Turgeon, B. G., Curlango$Rivera, G.,
cellular trap cell death requires both autophagy and super$
Minh Tran, T., Huskey, D. A., and Xiong, Z. (2016) Root
oxide generation, Cell Res., 21, 290$304, doi: 10.1038/
border cells and their role in lant defense, Annu. Rev.
cr.2010.150.
Phytopathol., 54, 143$161, doi: 10.1146/annurev$phyto$
10.
Germic, N., Stojkov, D., Oberson, K., Yousefi, S., Simon, H. U.
080615$100140.
(2017) Neither eosinophils nor neutrophils require ATG5$
23.
Fuchs, T. A., Abed, U., Goosmann, C., Hurwitz, R.,
dependent autophagy for extracellular DNA trap forma$
Schulze, I., Wahn, V., Weinrauch, Y., Brinkmann, V., and
tion, Immunology, 152, 517$525, doi: 10.1111/imm.12790.
Zychlinsky, A. (2007) Novel cell death program leads to
11.
Desai, J., Kumar, S. V., Mulay, S. R., Konrad, L., Romoli, S.,
neutrophil extracellular traps, J. Cell. Biol., 176, 231$241,
et al. (2016) PMA and crystal$induced neutrophil extracel$
doi: 10.1083/jcb.200606027.
lular trap formation involves RIPK1$RIPK3$MLKL sig$
24.
Lu, D. J., Furuya, W., and Grinstein, S. (1993) Involve$
naling, Eur. J. Immunol., 46, 223$229, doi: 10.1002/eji.
ment of multiple kinases in neutrophil activation, Blood
201545605.
Cells, 19, 343$351.
12.
Schreiber, A., Rousselle, A., Becker, J. U., von
25.
Hakkim, A., Fuchs, T. A., Martinez, N. E., Hess, S., Prinz, H.,
Mässenhausen, A., Linkermann, A., and Kettritz, R.
Zychlinsky, A., and Waldmann, H. (2011) Activation of the
(2017) Necroptosis controls NET generation and mediates
Raf$MEK$ERK pathway is required for neutrophil extra$
complement activation, endothelial damage, and autoim$
cellular trap formation, Nat. Chem. Biol., 7, 75$77,
mune vasculitis, Proc. Natl. Acad. Sci. USA, 114, E9618$
doi: 10.1038/nchembio.496.
E9625, doi: 10.1073/pnas.1708247114.
26.
Fonseca, Z., D az God nez, C., Mora, N., Alemán, O. R.,
13.
D’Cruz, A. A., Speir, M., Bliss$Moreau, M., Dietrich, S.,
Uribe$Querol, E., Carrero, J. C., and Rosales, C. (2018).
Wang, S., et al. (2018) The pseudokinase MLKL activates
Entamoeba histolytica
induce
signaling
via
PAD4$dependent NET formation in necroptotic neu$
Raf/MEK/ERK for neutrophil extracellular trap (NET)
trophils, Sci. Signal., 11, eaao1716, doi: 10.1126/scisignal.
formation, Front. Cell. Infect. Microbiol.,
8,
226,
aao1716.
doi: 10.3389/fcimb.2018.00226.
14.
Pinegin, B., Vorobjeva, N., Pashenkov, M., and Chernyak, B.
27.
Steinberg, S. F. (2015) Mechanisms for redox$regulation of
(2018) The role of mitochondrial ROS in antibacterial
protein kinase C, Front. Pharmacol., 6, 128, doi: 10.3389/
immunity, J. Cell. Physiol., 233, 3745$3754, doi: 10.1002/
fphar.2015.00128.
jcp.26117.
28.
Trevelin, S. C., and Lopes, L. R. (2015) Protein disulfide iso$
15.
Vorobjeva, N., Prikhodko, A., Galkin, I., Pletjushkina, O.,
merase and Nox: new partners in redox signaling, Curr. Pharm.
Zinovkin, R., Sud’ina, G., Chernyak, B., and Pinegin, B.
Des., 21, 5951$5963, doi: 10.2174/1381612821666151029112523.
БИОХИМИЯ том 85 вып. 10 2020
1394
ВОРОБЬЕВА, ЧЕРНЯК
29.
Dikalova, A. E., Bikineyeva, A. T., Budzyn, K.,
43.
Papayannopoulos, V., Metzler, K. D., Hakkim, A., and
Nazarewicz, R. R., McCann, L., Lewis, W., Harrison, D.
Zychlinsky, A. (2010) Neutrophil elastase and myeloperox$
G., and Dikalov, S. I. (2010) Therapeutic targeting of mito$
idase regulate the formation of neutrophil extracellular
chondrial superoxide in hypertension, Circ. Res., 107, 106$
traps, J. Cell. Biol., 191, 677$691, doi: 10.1083/jcb.
116, doi: 10.1161/CIRCRESAHA.109.214601.
201006052.
30.
Nazarewicz, R. R., Dikalova, A. E., Bikineyeva, A., and
44.
Metzler, K. D., Fuchs, T. A., Nauseef, W. M., Reumaux,
Dikalov, S. I. (2013) Nox2 as a potential target of mito$
D., Roesler, J., Schulze, I., Wahn, V., Papayannopoulos,
chondrial superoxide and its role in endothelial oxidative
V., and Zychlinsky, A. (2011) Myeloperoxidase is required
stress, Am. J. Physiol. Heart Circ. Physiol., 305, H1131$
for neutrophil extracellular trap formation: implications for
1140, doi: 10.1152/ajpheart.00063.2013.
innate immunity, Blood, 117, 953$959, doi: 10.1182/
31.
Kröller Schön, S., Steven, S., Kossmann, S., Scholz, A.,
blood$2010$06$290171.
Daub, S., et al. (2014) Molecular mechanisms of the
45.
Repnik, U., Hafner Česen, M., and Turk, B. (2014)
crosstalk between mitochondria and NADPH oxidase
Lysosomal membrane permeabilization in cell death: con$
through reactive oxygen species$studies in white blood cells
cepts and challenges, Mitochondrion, 19 Pt. A, 49$57,
and in animal models, Antioxid. Redox Signal., 20, 247$
doi: 10.1016/j.mito.2014.06.006.
266, doi: 10.1089/ars.2012.4953.
46.
Li, P., Li, M., Lindberg, M. R., Kennett, M. J., Xiong, N.,
32.
Douda, D. N., Khan, M. A., Grasemann, H., and
and Wang, Y. (2010) PAD4 is essential for antibacterial
Palaniyar, N. (2015) SK3 channel and mitochondrial ROS
innate immunity mediated by neutrophil extracellular
mediate NADPH oxidase$independent NETosis induced
traps, J. Exp. Med., 207, 1853$1862, doi: 10.1084/jem.
by calcium influx, Proc. Natl. Acad. Sci. USA, 112, 2817$
20100239.
2822, doi: 10.1073/pnas.1414055112.
47.
Neeli, I., Dwivedi, N., Khan, S., and Radic, M. (2009)
33.
Lood, C., Blanco, L. P., Purmalek, M. M., Carmona$
Regulation of extracellular chromatin release from neu$
Rivera, C., De Ravin, S. S., et al. (2016) Neutrophil extra$
trophils, J. Innate Immun., 1, 194$201, doi: 10.1159/
cellular traps enriched in oxidized mitochondrial DNA are
000206974.
interferogenic and contribute to lupus$like disease, Nat.
48.
Amulic, B., Knackstedt, S. L., Abu Abed, U.,
Med., 22, 146$153, doi: 10.1038/nm.4027.
Deigendesch, N., Harbort, C. J., Caffrey, B. E.,
34.
Kenny, E. F., Herzig, A., Krüger, R., Muth, A., Mondal,
Brinkmann, V., Heppner, F. L., Hinds, P. W., and
S., Thompson, P. R., Brinkmann, V., Bernuth, H. V., and
Zychlinsky, A. (2017) Cell$cycle proteins control produc$
Zychlinsky, A. (2017) Diverse stimuli engage different neu$
tion of neutrophil extracellular traps, Dev. Cell, 43, 449$
trophil extracellular trap pathways, Elife, 6, pii: e24437,
462.e5, doi: 10.1016/j.devcel.2017.10.013.
doi: 10.7554/eLife.24437.
49.
Kambara, H., Liu, F., Zhang, X., Liu, P., Bajrami, B.,
35.
Vorobjeva, N. V., and Chernyak, B. V. (2020) NADPH oxi$
Teng, Y., Zhao, L., Zhou, S., Yu, H., Zhou, W.,
dase modulates Ca2+$dependent formation of neutrophil
Silberstein, L. E., Cheng, T., Han, M., Xu, Y., and Luo, H.
extracellular traps, Vestn. Mosk. Univ. Ser. 16. Biol., 75 (in
R. (2018) Gasdermin D exerts anti$inflammatory effects
press).
by promoting neutrophil death, Cell Rep., 22, 2924$2936,
36.
Tintinger, G. R., Theron, A. J., Steel, H. C., and
doi: 10.1016/j.celrep.2018.02.067.
Anderson, R. (2001) Accelerated calcium influx and
50.
Sollberger, G., Choidas, A., Burn, G. L., Habenberger, P.,
hyperactivation of neutrophils in chronic granulomatous
Di Lucrezia, R., Kordes, S., Menninger, S., Eickhoff, J.,
disease, Clin. Exp. Immunol.,
123,
254$263,
Nussbaumer, P., Klebl, B., Krüger, R., Herzig, A., and
doi: 10.1046/j.1365$2249.2001.01447.x.
Zychlinsky, A. (2018) Gasdermin D plays a vital role in the
37.
Bernardi, P., Rasola, A., Forte, M., and Lippe, G. (2015)
generation of neutrophil extracellular traps, Sci. Immunol.,
The mitochondrial permeability transition pore: channel
3, eaar6689, doi: 10.1126/sciimmunol.aar6689.
formation by F$ATP synthase, integration in signal trans$
51.
Chen, K. W., Monteleone, M., Boucher, D., Sollberger,
duction, and role in pathophysiology, Physiol. Rev., 95,
G., Ramnath, D., Condon, N. D., von Pein, J. B., Broz,
1111$1155, doi: 10.1152/physrev.00001.2015.
P., Sweet, M. J., and Schroder, K. (2018) Noncanonical
38.
Dumas, J. F., Argaud, L., Cottet$Rousselle, C., Vial, G.,
inflammasome signaling elicits gasdermin D$dependent
Gonzalez, C., Detaille, D., Leverve, X., and Fontaine, E.
neutrophil extracellular traps, Sci. Immunol., 3, eaar6676,
(2009) Effect of transient and permanent permeability
doi: 10.1126/sciimmunol.aar6676.
transition pore opening on NAD(P)H localization in intact
52.
Rogers, C., Fernandes$Alnemri, T., Mayes, L., Alnemri,
cells, J. Biol. Chem., 284, 15117$15125, doi: 10.1074/jbc.
D., Cingolani, G., and Alnemri, E. S. (2017) Cleavage of
M900926200.
DFNA5 by caspase$3 during apoptosis mediates progres$
39.
Kroemer, G., Dallaporta, B., and Resche$Rigon, M.
sion to secondary necrotic/pyroptotic cell death, Nat.
(1998) The mitochondrial death/life regulator in apoptosis
Commun., 8, 14128, doi: 10.1038/ncomms14128.
and necrosis, Annu. Rev. Physiol.,
60,
619$642,
53.
Rogers, C., Erkes, D. A., Nardone, A., Aplin, A. E.,
doi: 10.1146/annurev.physiol.60.1.619.
Fernandes$Alnemri, T., and Alnemri, E. S.
(2019)
40.
Scorrano, L., Ashiya, M., Buttle, K., Weiler, S., Oakes, S. A.,
Gasdermin pores permeabilize mitochondria to augment
Mannella, C. A., and Korsmeyer, S. J. (2002) A distinct
caspase$3 activation during apoptosis and inflammasome
pathway remodels mitochondrial cristae and mobilizes
activation, Nat. Commun., 10, 1689, doi: 10.1038/s41467$
cytochrome c during apoptosis, Dev. Cell, 2, 55$67,
019$09397$2.
doi: 10.1016/S1534$5807(01)00116$2.
54.
Maueröder, C., Mahajan, A., Paulus, S., Gößwein, S.,
41.
Griffiths, E. J., and Halestrap, A. P. (1995) Mitochondrial
Hahn, J., Kienhöfer, D., Biermann, M. H., Tripal, P.,
non$specific pores remain closed during cardiac
Friedrich, R. P., Munoz, L. E., Neurath, M. F., Becker, C.,
ischaemia, but open upon reperfusion, Biochem. J., 307,
Schett, G. A., Herrmann, M., and Leppkes, M. (2016)
93$98, doi: 10.1042/bj3070093.
Ménage à$Trois: the ratio of bicarbonate to CO2 and
42.
Metzler, K. D., Goosmann, C., Lubojemska, A.,
the pH regulate the capacity of neutrophils to form
Zychlinsky, A., and Papayannopoulos, V.
(2014) A
NETs, Front. Immunol., 7, 583, doi: 10.3389/fimmu.2016.
myeloperoxidase$containing complex regulates neutrophil
00583.
elastase release and actin dynamics during NETosis, Cell.
55.
Naah de Souza, C., Breda, L. C. D., Khan, M. A., de
Rep., 8, 883$896, doi: 10.1016/j.celrep.2014.06.044.
Almeida, S. R., Câmara, N. O. S., Sweezey, N., and
БИОХИМИЯ том 85 вып. 10 2020
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ НЕТоза
1395
Palaniyar, N. (2017) Alkaline pH promotes NADPH oxi$
68.
Clark, S. R., Ma, A. C., Tavener, S. A., McDonald, B.,
dase$independent neutrophil extracellular trap formation:
Goodarzi, Z., et al. (2007) Platelet TLR4 activates neu$
a matter of mitochondrial reactive oxygen species genera$
trophil extracellular traps to ensnare bacteria in septic
tion and citrullination and cleavage of histone, Front.
blood, Nat. Med., 13, 463$469, doi: 10.1038/nm1565.
Immunol., 8, 1849, doi: 10.3389/fimmu.2017.01849.
69.
Yipp, B. G., Petri, B., Salina, D., Jenne, C. N., Scott, B. N.,
56.
Behnen, M., Möller, S., Brozek, A., Klinger, M., and
et al. (2012) Infection$induced NETosis is a dynamic
Laskay, T. (2017) Extracellular acidification inhibits the
process involving neutrophil multitasking in vivo, Nat.
ROS$dependent formation of neutrophil extracellular
Med., 18, 1386$1393, doi: 10.1038/nm.2847.
traps, Front. Immunol., 8, 184, doi: 10.3389/fimmu.
70.
Yousefi, S., Gold, J. A., Andina, N., Lee, J. J., Kelly, A. M.,
2017.00184.
Kozlowski, E., Schmid, I., Straumann, A., Reichenbach, J.,
57.
Lodge, K. M., Cowburn, A. S., Li, W., and Condliffe, A. M.
Gleich, G. J., and Simon, H. U. (2008) Catapult$like
(2020) The impact of hypoxia on neutrophil degranulation
release of mitochondrial DNA by eosinophils contributes
and consequences for the host, Int. J. Mol. Sci., 21, 1183,
to antibacterial defense, Nat. Med.,
14,
949$953,
doi: 10.3390/ijms21041183.
doi: 10.1038/nm.1855.
58.
Branitzki$Heinemann, K., Möllerherm, H., Völlger, L.,
71.
Yousefi, S., Mihalache, C., Kozlowski, E., Schmid, I., and
Husein, D. M., de Buhr, N., Blodkamp, S., Reuner, F.,
Simon, H. U. (2009) Viable neutrophils release mitochon$
Brogden, G., Naim, H. Y., and von Köckritz Blickwede, M.
drial DNA to form neutrophil extracellular traps, Cell
(2016) Formation of neutrophil extracellular traps under
Death Dis., 16, 1438$1444, doi: 10.1038/cdd.2009.96.
low oxygen level, Front. Immunol., 7, 518, doi: 10.3389/
72.
Ingelsson, B., Söderberg, D., Strid, T., Söderberg, A.,
fimmu.2016.00518.
Bergh, A. C., Loitto, V., Lotfi, K., Segelmark, M., Spyrou, G.,
59.
Nadesalingam, A., Chen, J. H. K., Farahvash, A.,
and Rosén, A. (2018) Lymphocytes eject interferogenic
Khan, M. A. (2018) Hypertonic saline suppresses NADPH
mitochondrial DNA webs in response to CpG and non$
oxidase$dependent neutrophil extracellular trap formation
CpG oligodeoxynucleotides of class C, Proc. Natl. Acad.
and promotes apoptosis, Front. Immunol.,
9,
359,
Sci. USA, 115, E478$E487, doi: 10.1073/pnas.1711950115.
doi: 10.3389/fimmu.2018.00359.
73.
Jin, X., Zhao, Y., Zhang, F., Wan, T., Fan, F., Xie, X., and
60.
Domingo$Gonzalez, R., Mart nez Colón, G. J., Smith, A. J.,
Lin, Z. (2016) Neutrophil extracellular traps involvement
Smith, C. K., Ballinger, M. N., Xia, M., Murray, S.,
in corneal fungal infection, Mol. Vis., 22, 944$952.
Kaplan, M. J., Yanik, G. A., and Moore, B. B. (2016)
74.
Shan, Q., Dwyer, M., Rahman, S., and Gadjeva, M.
Inhibition of neutrophil extracellular trap formation after
(2014) Distinct susceptibilities of corneal Pseudomonas
stem cell transplant by prostaglandin E2, Am. J. Respir.
aeruginosa clinical isolates to neutrophil extracellular trap$
Crit. Care Med., 193, 186$197, doi: 10.1164/rccm.201501$
mediated immunity, Infect. Immun., 82, 4135$4143,
0161OC.
doi: 10.1128/IAI.02169$14.
61.
Shishikura, K., Horiuchi, T., Sakata, N., Trinh, D. A.,
75.
Sonawane, S., Khanolkar, V., Namavari, A., Chaudhary, S.,
Shirakawa, R., Kimura, T., Asada, Y., and Horiuchi, H.
Gandhi, S., et al. (2012) Ocular surface extracellular DNA
(2016) Prostaglandin E2 inhibits neutrophil extracellular
and nuclease activity imbalance: a new paradigm for
trap formation through production of cyclic AMP, Br. J.
inflammation in dry eye disease, Invest. Ophthalmol. Vis.
Pharmacol., 173, 319$331, doi: 10.1111/bph.13373.
Sci., 53, 8253$8263, doi: 10.1167/iovs.12$10430.
62.
Healy, L. D., Puy, C., Fernández, J. A., Mitrugno, A.,
76.
Tibrewal, S., Ivanir, Y., Sarkar, J., Nayeb$Hashemi, N.,
Keshari, R. S., Taku, N. A., Chu, T. T., Xu, X., Gruber, A.,
Bouchard, C. S., Kim, E., and Jain, S.
(2014)
Lupu, F., Griffin, J. H., and McCarty, O. J. T. (2017)
Hyperosmolar stress induces neutrophil extracellular trap
Activated protein C inhibits neutrophil extracellular trap
formation: implications for dry eye disease, Invest.
formation in vitro and activation in vivo, J. Biol. Chem.,
Ophthalmol. Vis. Sci., 55, 7961$7969, doi: 10.1167/iovs.14$
292, 8616$8629, doi: 10.1074/jbc.M116.768309.
15332.
63.
Saitoh, T., Komano, J., Saitoh, Y., Misawa, T., Takahama, M.,
77.
An, S., Raju, I., Surenkhuu, B., Kwon, J. E., Gulati, S.,
Kozaki, T., Uehata, T., Iwasaki, H., Omori, H., Yamaoka, S.,
Karaman, M., Pradeep, A., Sinha, S., Mun, C., and Jain, S.
Yamamoto, N., and Akira, S. (2012) Neutrophil extracel$
(2019) Neutrophil extracellular traps (NETs) contribute to
lular traps mediate a host defense response to human
pathological changes of ocular graft$vs.$host disease
immunodeficiency virus$1, Cell Host Microbe, 12, 109$116,
(oGVHD) dry eye: Implications for novel biomarkers and
doi: 10.1016/j.chom.2012.05.015.
therapeutic strategies, Ocul. Surf.,
17,
589$614,
64.
Yost, C. C., Schwertz, H., Cody, M. J., Wallace, J. A.,
doi: 10.1016/j.jtos.2019.03.010.
Campbell, R. A., et al. (2016) Neonatal NET$inhibitory
78.
De Bont, C. M., Stokman, M. E. M., Faas, P., Thurlings,
factor and related peptides inhibit neutrophil extracellular
R. M., Boelens, W. C., Wright, H. L., and Pruijn, G. J.
trap formation, J. Clin. Invest.,
126,
3783$3798,
(2020) Autoantibodies to neutrophil extracellular traps
doi: 10.1172/JCI83873.
represent a potential serological biomarker in rheumatoid
65.
Hahn, S., Giaglis, S., Chowdhury, C. S., Hösli, I., and
arthritis, J. Autoimmun., 102484, doi: 10.1016/j.jaut.2020.
Hasler, P. (2013) Modulation of neutrophil NETosis: inter$
102484.
play between infectious agents and underlying host physi$
79.
Brzheskiy, V. V., Efimova, E. L., Vorontsova, T. N.,
ology, Semin. Immunopathol., 35, 439$453, doi: 10.1007/
Alekseev, V. N., Gusarevich, O. G., et al. (2015) Results of
s00281$013$0380$x.
a multicenter, randomized, double$masked, placebo$con$
66.
Hu, S., Liu, X., Gao, Y., Zhou, R., Wei, M., Dong, J., Yan, H.,
trolled clinical study of the efficacy and safety of visomitin
and Zhao, Y. (2019) Hepatitis B virus inhibits neutrophil
eye drops in patients with dry eye syndrome, Adv. Ther., 32,
extracellular trap release by modulating reactive oxygen
1263$1279, doi: 10.1007/s12325$015$0273$6.
species production and autophagy, J. Immunol., 202, 805$
80.
Martinod, K., and Wagner, D. D. (2014) Thrombosis: tan$
815, doi: 10.4049/jimmunol.1800871.
gled up in NETs, Blood, 123, 2768$2776, doi: 10.1182/
67.
Galluzzi, L., Vitale, I., Aaronson, S. A., Abrams, J. M.,
blood$2013$10$463646.
Adam, D., et al. (2018) Molecular mechanisms of cell
81.
Moschonas, I. C., and Tselepis, A. D. (2019) The pathway
death: recommendations of the Nomenclature Committee
of neutrophil extracellular traps towards atherosclerosis
on cell death 2018, Cell. Death Differ., 25, 486$541,
and thrombosis, Atherosclerosis, 288, 9$16, doi: 10.1016/
doi: 10.1038/s41418$017$0012$4.
j.atherosclerosis.2019.06.919.
БИОХИМИЯ том 85 вып. 10 2020
1396
ВОРОБЬЕВА, ЧЕРНЯК
82.
Martinod, K., Demers, M., Fuchs, T. A., Wong, S. L.,
96. Choi, Y., Pham, D., Lee, D.$H., Lee, S.$H., Kim, S.$H.,
Brill, A., Gallant, M., Hu, J., Wang, Y., and Wagner, D. D.
and Park, H.$S. (2018) Biological function of eosinophil
(2013) Neutrophil histone modification by peptidylargi$
extracellular traps in patients with severe eosinophilic asth$
nine deiminase 4 is critical for deep vein thrombosis in
ma, Exp. Mol. Med., 50, 104, doi: 10.1038/s12276$018$
mice, Proc. Natl. Acad. Sci. USA, 110, 8674$8679,
0136$8.
doi: 10.1073/pnas.1301059110.
97. Mehta, P., McAuley, D. F., Brown, M., Sanchez, E.,
83.
Zucoloto, A. Z., and Jenne, C. N. (2019) Platelet$neu$
Tattersall, R. S., and Manson, J. J., HLH Across
trophil interplay: insights into neutrophil extracellular trap
Speciality Collaboration, UK (2020) COVID$19: con$
(NET)$driven coagulation in infection, Front. Cardiovasc.
sider cytokine storm syndromes and immunosuppres$
Med., 6, 85, doi: 10.3389/fcvm.2019.00085.
sion, Lancet, 395, 1033$1034, doi: 10.1016/S0140$
84.
Novotny, J., Oberdieck, P., Titova, A., Pelisek, J.,
6736(20)30628$0.
Chandraratne, S., et al. (2020) Thrombus NET content is
98. Zuo, Y., Yalavarthi, S., Shi, H., Gockman, K., Zuo, M.,
associated with clinical outcome in stroke and myocardial
Madison, J. A., Blair, C. N., Weber, A., Barnes, B. J.,
infarction, Neurology, 94, e2346$e2360, doi: 10.1212/
Egeblad, M., Woods, R. J., Kanthi, Y., and Knight, J. S.
WNL.0000000000009532.
(2020) Neutrophil extracellular traps in COVID$19, JCI
85.
Warnatsch, A., Ioannou, M., Wang, Q., and
insight, 138999. Advance online publication, doi: 10.1172/
Papayannopoulos, V. (2015) Inflammation. Neutrophil
jci.insight.138999.
extracellular traps license macrophages for cytokine pro$
99. Yoshida, Y., Takeshita, S., Kawamura, Y., Kanai, T.,
duction in atherosclerosis, Science,
349,
316$320,
Tsujita, Y., and Nonoyama, S. (2020) Enhanced formation
doi: 10.1126/science.aaa8064.
of neutrophil extracellular traps in Kawasaki disease,
86.
Tsourouktsoglou, T. D., Warnatsch, A., Ioannou, M.,
Pediatr. Res., 87, 998$1004, doi: 10.1038/s41390$019$
Hoving, D., Wang, Q., and Papayannopoulos, V. (2020)
0710$3.
Histones, DNA, and citrullination promote neutrophil
100. Barnes, B. J., Adrover, J. M., Baxter$Stoltzfus, A.,
extracellular trap inflammation by regulating the localiza$
Borczuk, A., Cools$Lartigue, J., et al. (2020) Targeting
tion and activation of TLR4, Cell Rep., 31, 107602,
potential drivers of COVID$19: neutrophil extracellular
doi: 10.1016/j.celrep.2020.107602.
traps, J. Exp. Med., 217, e20200652, doi: 10.1084/jem.
87.
Snoderly, H. T., Boone, B. A., and Bennewitz, M. F. (2019)
20200652.
Neutrophil extracellular traps in breast cancer and beyond:
101. Gupta, S., and Kaplan, M. J. (2016) The role of neu$
current perspectives on NET stimuli, thrombosis and
trophils and NETosis in autoimmune and renal diseases,
metastasis, and clinical utility for diagnosis and treatment,
Nat. Rev. Nephrol., 12, 402$413, doi: 10.1038/nrneph.
Breast Cancer Res., 21, 145, doi: 10.1186/s13058$019$
2016.71.
1237$6.
102. Fortner, K. A., Blanco, L. P., Buskiewicz, I., Huang, N.,
88.
Breitbach, C. J., De Silva, N. S., Falls, T. J., Aladl, U.,
Gibson, P. C., et al. (2020) Targeting mitochondrial oxida$
Evgin, L., et al. (2011) Targeting tumor vasculature with an
tive stress with MitoQ reduces NET formation and kidney
oncolytic virus, Mol. Ther., 19, 886$894, doi: 10.1038/
disease in lupus$prone MRL$lpr mice, Lupus Sci. Med., 7,
mt.2011.26.
e000387, doi: 10.1136/lupus$2020$000387.
89.
Leppkes, M., Maueroder, C., Hirth, S., Nowecki, S.,
103. Khandpur, R., Carmona$Rivera, C., Vivekanandan$Giri, A.,
Gunther, C., et al. (2016) Externalized decondensed neu$
Gizinski, A., Yalavarthi, S., et al. (2013) NETs are a source
trophil chromatin occludes pancreatic ducts and drives
of citrullinated autoantigens and stimulateinflammatory
pancreatitis, Nat. Commun., 7, 10973, doi: 10.1038/
responses in rheumatoid arthritis, Sci. Transl. Med., 5,
ncomms10973.
178ra40, doi: 10.1126/scitranslmed.3005580.
90.
Muñoz, L. E., Boeltz, S., Bilyy, R., Schauer, C., Mahajan, A.,
104. Wang, W., Peng, W., and Ning, X. (2018) Increased levels
et al. (2019) Neutrophil extracellular traps initiate gallstone
of neutrophil extracellular trap remnants in the serum of
formation, Immunity, 51, 443$450.e4, doi: 10.1016/
patients with rheumatoid arthritis, Int. J. Rheum. Dis., 21,
j.immuni.2019.07.002.
415$421, doi: 10.1111/1756$185X.13226.
91.
Twaddell, S. H., Baines, K. J., Grainge, C., and Gibson, P. G.
105. Carmona$Rivera, C., Carlucci, P. M., Moore, E.,
(2019) The emerging role of neutrophil extracellular traps
Lingampalli, N., Uchtenhagen, H., et al. (2017) Synovial
in respiratory disease, Chest, 156, 774$782, doi: 10.1016/
fibroblast$neutrophil interactions promote pathogenic
j.chest.2019.06.012.
adaptive immunity in rheumatoid arthritis, Sci. Immunol.,
92.
Ebrahimi, F., Giaglis, S., Hahn, S., Blum, C. A.,
2, eaag3358, doi: 10.1126/sciimmunol.aag3358.
Baumgartner, C., Kutz, A., van Breda, S. V., Mueller, B.,
106. Fousert, E., Toes, R., and Desai, J. (2020) Neutrophil
Schuetz, P., Christ$Crain, M., and Hasler, P.
(2018)
extracellular traps (NETs) take the central stage in driving
Markers of neutrophil extracellular traps predict adverse
autoimmune responses, Cells, 9, 915, doi: 10.3390/
outcome in community$acquired pneumonia: secondary
cells9040915.
analysis of a randomised controlled trial, Eur. Respir. J., 51,
107. Schauer, C., Janko, C., Munoz, L. E., Zhao, Y.,
1701389, doi: 10.1183/13993003.01389$2017.
Kienhöfer, D., et al. (2014) Aggregated neutrophil extra$
93.
Vassallo, A., Wood, A. J., Subburayalu, J., Summers, C.,
cellular traps limit inflammation by degrading cytokines
and Chilvers, E. R. (2019) The counter$intuitive role of the
and chemokines, Nat. Med., 20, 511$517, doi: 10.1038/
neutrophil in the acute respiratory distress syndrome, Br.
nm.3547.
Med. Bull., 131, 43$55, doi: 10.1093/bmb/ldz024.
108. Tagami, T., Tosa, R., Omura, M., Fukushima, H., Kaneko, T.,
94.
Uddin, M., Watz, H., Malmgren, A., and Pedersen, F.
et al. (2014) Effect of a selective neutrophil elastase
(2019) NETopathic inflammation in chronic obstructive
inhibitor on mortality and ventilator$free days in patients
pulmonary disease and severe asthma, Front. Immunol., 10,
with increased extravascular lung water: a post hoc analysis
47, doi: 10.3389/fimmu.2019.00047.
of the PiCCO pulmonary edema study, J. Intensive Care, 2,
95.
Toussaint, M., Jackson, D. J., Swieboda, D., Guedan, A.,
67, doi: 10.1186/s40560$014$0067$y.
Tsourouktsoglou, T. D., et al. (2017). Host DNA released
109. Hu, J. J., Liu, X., Xia, S., Zhang, Z., Zhang, Y., et al.
by NETosis promotes rhinovirusinduced type$2 allergic
(2020) FDA$approved disulfiram inhibits pyroptosis by
asthma exacerbation, Nat. Med.,
23,
681$691,
blocking gasdermin D pore formation, Nat. Immunol., 21,
doi: 10.1038/nm.4332.
736$745, doi: 10.1038/s41590$020$0669$6.
БИОХИМИЯ том 85 вып. 10 2020
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ НЕТоза
1397
110. Papayannopoulos, V., Staab, D., and Zychlinsky, A. (2011)
Krysko, O., Skulachev, V. P., and Popova, E. N. (2017)
Neutrophil elastase enhances sputum solubilization in cys$
Low concentration of uncouplers of oxidative phosphory$
tic fibrosis patients receiving DNase therapy, PLoS One, 6,
lation decreases the TNF$induced endothelial permeabil$
e28526, doi: 10.1371/journal.pone.0028526.
ity and lethality in mice, Biochim. Biophys. Acta. Mol.
111. Zakharova, V. V., Pletjushkina, O. Y., Galkin, I. I.,
Basis Dis., 1863, 968$977, doi: 10.1016/j.bbadis.2017.
Zinovkin, R. A., Chernyak, B. V., Krysko, D. V., Bachert, C.,
01.024.
NETosis: MOLECULAR MECHANISMS,
ROLE IN PHYSIOLOGY AND PATHOLOGY
Review
N. V. Vorobjeva1* and B. V. Chernyak2
1 Lomonosov Moscow State University, Biology Faculty, 119991 Moscow, Russia; E)mail: nvvorobjeva@mail.ru
2 Belozersky Institute of Physico)Chemical Biology, Lomonosov Moscow State University, 119991 Moscow, Russia
Received June 20, 2020
Revised July 16, 2020
Accepted July 16, 2020
NETosis is a program for formation of neutrophil extracellular traps (NETs), which consist of modified chromatin
decorated with bactericidal proteins from granules and cytoplasm. Various pathogens, antibodies and immune com$
plexes, cytokines, microcrystals, and other physiological stimuli can cause NETosis. Induction of NETosis depends
on reactive oxygen species (ROS), the main source of which is NADPH oxidase. Activation of NADPH oxidase
depends on increase in the concentration of Ca2+ in the cytoplasm and in some cases on the generation of ROS in
mitochondria. NETosis includes release of the granule components into the cytosol, modification of histones leading
to chromatin decondensation, destruction of the nuclear envelope, as well as formation of pores in the plasma mem$
brane. In this review, basic mechanisms of NETosis, as well as its role in the pathogenesis of some diseases including
COVID$19 are discussed.
Keywords: neutrophil, neutrophil extracellular traps, NETosis, NADPH oxidase, reactive oxygen species, mitochon$
drial pore, COVID$19
БИОХИМИЯ том 85 вып. 10 2020