БИОХИМИЯ, 2020, том 85, вып. 10, с. 1421 - 1441
УДК 577.24
ТАРГЕТИРОВАНИЕ БЕЛКОВ СЕМЕЙСТВА Bcl 2: ЧТО, ГДЕ, КОГДА?
Обзор
© 2020
В.В. Сеничкин1, Н.В. Первушин1, А.П. Зуев1,
Б. Животовский1,2, Г.С. Копеина1*
1 Московский государственный университет имени М.В. Ломоносова, факультет фундаментальной медицины,
119991 Москва, Россия; электронная почта: lirroster@gmail.com
2 Институт медицины окружающей среды, Каролинский институт, 17177 Стокгольм, Швеция
Поступила в редакцию 15.07.2020
После доработки 15.07.2020
Принята к публикации 08.08.2020
Белки семейства Bcl 2 являются регуляторами апоптоза, одного из наиболее изученных типов программи
руемой клеточной гибели. Данное семейство белков представлено как про , так и антиапоптотическими
членами. Антиапоптотические белки семейства Bcl 2 нередко используются опухолевыми клетками в каче
стве механизма устойчивости к гибели, играя важную роль как в процессе возникновения онкологических
заболеваний, так и в приобретении злокачественными клетками резистентности к терапевтическим воздей
ствиям. Следовательно, эти белки представляют собой привлекательные мишени для противоопухолевой
терапии. Детальное изучение взаимодействий между Bcl 2 белками, лежащих в основе регуляции запуска
апоптоза, позволило сделать существенный прорыв в разработке высокоселективных ингибиторов отдель
ных антиапоптотических представителей семейства. В настоящее время данные вещества активно изучают
на доклинических и клинических стадиях, и большим прорывом можно считать одобрение для медицинс
кого применения Венетоклакса, селективного ингибитора белка Bcl 2. Подавление активности антиапоп
тотических белков Bcl 2 семейства обладает существенным терапевтическим потенциалом, который только
предстоит раскрыть. В грядущую эру персонализированной медицины необходимо детальное изучение ме
ханизмов, ответственных за чувствительность или резистентность опухолевых клеток к различным терапев
тическим агентам, а также подбор наиболее эффективных комбинаций. В обзоре рассмотрены существую
щие сведения о фундаментальных основах функционирования белков семейства Bcl 2, принципах их инги
бирования с помощью малых молекул, успехах такого подхода в противоопухолевой терапии и, наконец,
биохимических особенностях, которые могут послужить основой для дальнейшего совершенствования ис
пользования ингибиторов антиапоптотических белков семейства Bcl 2 в терапии опухолевых заболеваний.
КЛЮЧЕВЫЕ СЛОВА: апоптоз, Bcl 2 семейство, противоопухолевая терапия, BH3 миметики.
DOI: 10.31857/S0320972520100097
ВВЕДЕНИЕ
апоптоз, представляющий собой, среди прочего,
важный онкосупрессорный механизм [1].
Одной из ключевых задач современной ме
Наиболее изученными способами запуска
дицины является борьба с опухолевыми заболе
апоптотической гибели на молекулярном уров
ваниями. В основе биологии опухолевых клеток
не являются внутренний (митохондриальный) и
лежат принципы отбора в пользу наиболее прис
внешний (рецептор зависимый) пути индукции
пособленных к выживанию клонов. В результате
апоптоза. Внешний путь запуска апоптотичес
такие клоны характеризуются рядом приобре
кой программы реализуется, в частности, в ре
тенных адаптационных преимуществ, в том чис
зультате связывания соответствующих лигандов
ле, устойчивостью к программируемой клеточ
(например, TNF α, FAS L) с «рецепторами
ной гибели (ПКГ) [1]. Одним из наиболее изу
смерти» на поверхности клетки, что ведет к ак
ченных типов ПКГ в настоящее время является
тивации каспазного каскада и последующей
элиминации клетки [2]. В реализации внутрен
него пути индукции апоптоза задействованы
Принятые сокращения: BH домен - домен гомоло
митохондрии, в межмембранном пространстве
гии белков Bcl 2; ММ
- множественная миелома;
которых в норме локализуются различные про
НМРЛ - немелкоклеточный рак легкого; ОМЛ - острый
миелоидный лейкоз; ХЛЛ - хронический лимфоцитарный
апоптотические факторы, выполняющие не
лейкоз.
связанные с апоптозом функции, - цитохром c,
* Адресат для корреспонденции.
SMAC/DIABLO и другие. Попадание данных
1421
1422
СЕНИЧКИН и др.
факторов в цитоплазму также ведет к запуску
опухолевых клеток к действию ингибиторов
каспазного каскада и последующей гибели кле
Bcl 2 белков. Также особенно остро стоит воп
ток, потому целостность внешней митохондри
рос подбора комбинаций, которые могут прояв
альной мембраны находится под строгим конт
лять существенный синергизм в элиминации
ролем белков семейства Bcl 2 [3].
опухолевых клеток.
Эти белки, хотя и обладают существенной
В настоящей работе мы предприняли попыт
степенью гомологии друг с другом, подразделя
ку ответа на три основных вопроса, касающихся
ются на две функциональные подгруппы со
ингибирования антиапоптотических Bcl 2 бел
строго противоположной ролью. Одни предста
ков. 1) Что? Что из себя представляют антаго
вители данного семейства способствуют перме
нисты данных белков и каков их основной меха
абилизации внешней митохондриальной мемб
низм действия; 2) Где? В каких опухолях инги
раны (ПВММ), проявляя проапоптотические
бирование тех или иных антиапоптотических
свойства, другие препятствуют функциональ
белков представляется особенно эффективным,
ной активности проапоптотических Bcl 2 бел
какие механизмы могут лежать в основе описы
ков, тем самым проявляя антиапоптотическую
ваемых феноменов и как эти знания могут быть
активность. Регуляция как про , так и анти
использованы для дальнейших исследований;
апоптотических белков семейства Bcl 2 может
3) Когда? В каких случаях могут быть использо
быть нарушена в опухолевых клетках, что может
ваны те или иные антагонисты антиапоптоти
вести к их повышенной устойчивости к апопто
ческих белков Bcl 2, а именно, каковы прогнос
тическим стимулам. Особенно часто опухоле
тические факторы чувствительности/устойчи
вые клетки используют повышенную экспрес
вости к этим веществам, каковы наиболее перс
сию антиапоптотических белков семейства Bcl
пективные комбинации данных веществ с дру
2 в качестве механизма приобретения устойчи
гими препаратами и, наконец, какие механизмы
вости к апоптозу [3].
лежат в основе этих наблюдений.
Данный факт повышает интерес к этим бел
кам как к мишеням для терапевтического воз
действия. За последние 15 лет был разработан
ЧТО: БЕЛКИ СЕМЕЙСТВА Bcl 2
ряд ингибиторов антиапоптотических белков
КАК МИШЕНИ ПРОТИВООПУХОЛЕВОЙ
семейства Bcl 2. Некоторые из них только не
ТЕРАПИИ
давно вступили в фазу клинических испытаний
(в частности, ингибиторы Mcl 1) [4]. Ингибиро
Контроль запуска внутреннего пути апоптоза
вание другой мишени, Bcl xL, вело к выражен
белками семейства Bcl 2. Ключевым событием и
ным побочным эффектам [5], что стало боль
одновременно точкой невозврата в запуске внут
шой проблемой для дальнейших клинических
реннего пути апоптоза является выход из межмем
испытаний селективных антагонистов данного
бранного пространства митохондрий в цитоп
белка. В то же время имеются и существенные
лазму различных проапоптотических факторов
успехи в таргетировании антиапоптотических
[3]. В основе данного феномена лежит ПВММ за
белков этого семейства, в частности, к таковым
счет образования белковых пор во внешней
относится одобрение Венетоклакса для лечения
мембране митохондрий. Этот процесс осущест
пациентов с рядом гематологических заболева
вляется путем олигомеризации порообразующих
ний [6].
белков эффекторов семейства Bcl 2 - Bak и Bax
Тем не менее, следует отметить, что, хотя ус
[7]. В норме эти белки находятся в виде мономе
тойчивость к апоптозу и является широко расп
ров: Bak - на поверхности внешней митохонд
ространенным явлением для различных типов
риальной мембраны, Bax - в цитоплазме [3]. Ак
опухолей, Венетоклакс в настоящее время име
тивация порообразующих белков Bak и Bax ведет
ет скорее ограниченное применение, в особен
к их димеризации, а образующиеся димеры да
ности, в случае монотерапии. То же, вполне ве
лее олигомеризуются на поверхности внешней
роятно, может ожидать и другие ингибиторы ан
мембраны митохондрий, образуя поры.
тиапоптотических Bcl 2 белков в случае их
Вторая группа проапоптотических белков
одобрения к медицинскому применению. Эта
семейства Bcl 2 включает BH3 only белки (Bim,
проблема во многом отражает недостаточность
Puma, Noxa, Bad и другие), состоящие из одного
наших знаний о том, как наиболее рационально
(BH3) домена гомологии белков Bcl 2 (BH). Не
использовать ингибиторы данных белков для
которые из них, т.н. «BH3 only активаторы»,
элиминирования опухолевых клеток. Наиболее
связываясь с порообразующими белками Bcl 2
важным представляется расширение наших зна
семейства Bak и Bax, способны вести к их акти
ний о механизмах, отвечающих за повышенную
вации [8]. В то же время некоторые из BH3 only
чувствительность или, напротив, устойчивость
белков, т.н. «BH3 only сенситайзеры», напря
БИОХИМИЯ том 85 вып. 10 2020
ТАРГЕТИРОВАНИЕ Bcl 2 БЕЛКОВ
1423
мую не взаимодействуют с порообразующими
бирующих взаимодействий между представите
белками. Проапоптотическая активность этой
лями Bcl 2 семейства лежит способность белков
подгруппы белков осуществляется только за
одной функциональной подгруппы связывать
счет взаимодействия с антиапоптотическими
белки другой функциональной подгруппы. Та
белками Bcl 2 семейства и их нейтрализации.
ким образом, белки физически нейтрализуют
Важно отметить, что BH3 only активаторы так
друг друга, образуя гетеродимеры, а их активи
же ингибируют антиапоптотические Bcl 2 белки
рующие функции реализуются только взаимо
[8]. Таким образом, нейтрализация антиапопто
действием BH3 only активаторов с порообразу
тических белков Bcl 2 семейства - общий меха
ющими Bak и Bax, что способствует димериза
низм проапоптотической активности BH3 only
ции последних [3].
белков независимо от их способности напрямую
Каковы механизмы взаимодействия белков
активировать порообразующие белки Bak и Bax.
семейства Bcl 2? Порообразующие и антиапоп
Наконец, антиапоптотические белки семей
тотические белки семейства Bcl 2 имеют в своем
ства Bcl 2 (Bcl 2, Mcl 1, Bcl xL, Bcl w, Bcl A1)
строении четыре BH домена - BH1-BH4, ко
связывают и нейтрализуют проапоптотические
торые участвуют в формировании глобулярной
белки - как порообразующие, так и BH3 only
структуры данных белков [3]. В структуре BH3
[3]. Как итог, три функциональные группы бел
only белков присутствует только домен BH3, от
ков семейства Bcl 2 образуют трехстороннюю
куда эта подгруппа белков и получила свое наз
систему контроля над ПВММ: белки эффекто
вание. Именно данный домен наделяет белки
ры непосредственно образуют поры в наружной
проапоптотической активностью [8]. В структу
мембране митохондрий, тогда как BH3 only и
ре глобулярных белков, как порообразующих,
антиапоптотические белки регулируют актив
так и антиапоптотических, домен BH3 совмест
ность порообразующих белков. В основе инги
но с другими BH доменами принимает участие
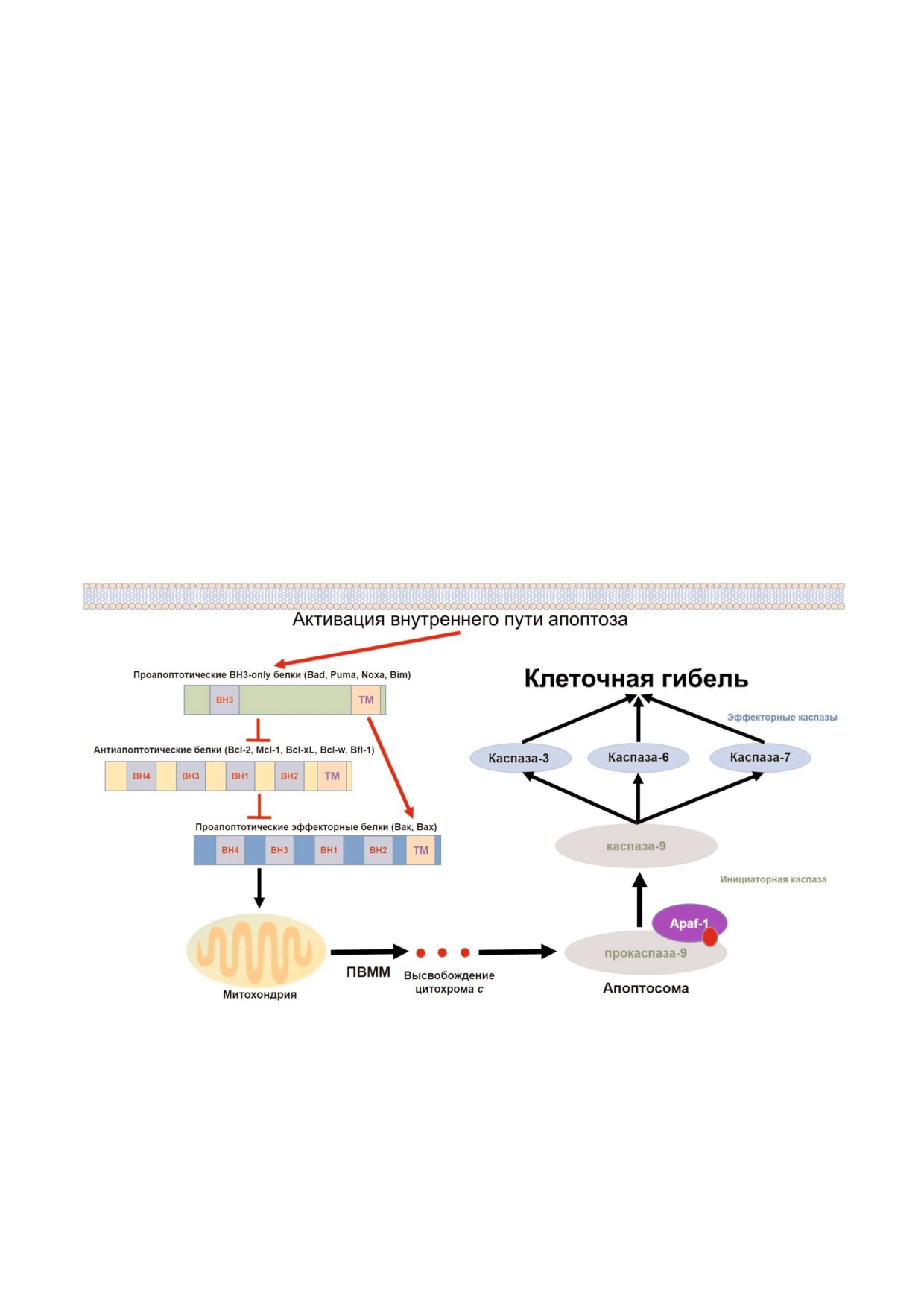
Рис. 1. Активация внутреннего пути апоптоза и схема строения членов белкового семейства Bcl 2. Различные стимулы
(например, повреждения ДНК, депривация ростовых факторов или действие химиотерапевтических препаратов) могут
вести к активации внутреннего пути апоптоза. Проапоптотические ВН3 only белки приводят к нейтрализации действия
антиапоптотических белков и/или прямой активации проапоптотических эффекторных белков. В результате действия
белков Bak и Bax наблюдается ПВММ за счет образования белковых пор на поверхности внешней мембраны митохонд
рий. Высвобождение из межмембранного пространства цитохрома с приводит к образованию в цитоплазме апоптосомы -
комплекса активации инициаторной каспазы 9 (при участии цитозольного белка Apaf 1 и за счет энергии АТФ). Каспа
за 9 ведет к дальнейшей активации каспазного каскада и гибели клеток за счет действия эффекторных каспаз.
БИОХИМИЯ том 85 вып. 10 2020
1424
СЕНИЧКИН и др.
в формировании гидрофобного кармана - уг
опухолевые клетки могут использовать наруше
лубления на поверхности белка, способного
ния в функционировании проапоптотических
связываться с экспонированными BH3 домена
белков и оверэкспрессию антиапоптотических
ми других белков. Отсюда данная структура по
белков для повышения устойчивости к апоптозу.
лучила название «BH3 связывающий карман».
Действительно, ряд имеющихся данных подтверж
Проапоптотические Bax и Bak способны экспо
дает подобное предположение. Так, у пациентов
нировать свой BH3 связывающий домен, сохра
с лимфомой Бёркитта наблюдается гипермети
няя при этом структуру BH3 связывающего
лирование промотора гена BCL2L11 [13], коди
кармана. Подобный конформационный пере
рующего BH3 only белок Bim, а у пациентов с
ход может происходить при связывании порооб
мантийноклеточной лимфомой - гомозиготная
разующими белками BH3 only активаторов [9].
делеция локуса 2q13 [14], содержащего этот же
В подобной активированной конфигурации
ген. Мутации, ведущие к сдвигу рамки считыва
белки Bax и Bak димеризуются за счет взаимо
ния в гене BAX, кодирующем одноименный бе
действий BH3 домен - BH3 связывающий кар
лок, были обнаружены у пациентов с колорек
ман, что служит подспорьем для дальнейшей
тальным раком с микросателлитной нестабиль
олигомеризации и процесса ПВММ. Антиапоп
ностью [15]. Многочисленные эксперименты на
тотические белки не экспонируют свои BH3 до
опухолевых клеточных линиях демонстрируют
мены, что является их принципиальным отли
значимость нарушений функционирования
чием от порообразующих белков. Вместо этого
проапоптотических белков для приобретения
антиапоптотические белки нейтрализуют BH3
устойчивости к апоптозу, индуцированному
only белки или активированные Bak и Bax за
противоопухолевыми агентами [16]. Наконец,
счет связывания их экспонированных BH3 до
была показана корреляция между уровнем про
менов (рис.1) [3]. Описанные взаимодействия
апоптотических белков и прогнозом пациентов
между BH3 доменами и BH3 связывающими
при лечении различными препаратами [17].
карманами лежат в основе функционирования
Одним из наиболее ярких примеров исполь
представителей семейства Bcl 2 и были исполь
зования опухолевыми клетками антиапоптоти
зованы для создания терапевтических подходов,
ческих белков является оверэкспрессия Bcl 2 у
нацеленных на данные белки [10].
пациентов с фолликулярной лимфомой. Причи
Чем больше уровень антиапоптотических
ной повышенного уровня Bcl 2 является транс
белков в клетке, тем активнее при прочих рав
локация t (14;18), в результате которой ген BCL2
ных они будут связывать активированные белки
попадает в транскрипционно активный участок
Bak и Bax, препятствуя их димеризации и про
на хромосоме 14, содержащий гены тяжелых це
цессу ПВММ. Дополнительно антиапоптоти
пей иммуноглобулина. Подобная транслокация
ческие белки способны снижать и уровень сво
наблюдается у ~90% пациентов с фолликуляр
бодных BH3 only активаторов, которые могли
ной лимфомой. Помимо этого, при опухолевых
бы вызвать димеризацию Bak и Bax. Напротив,
заболеваниях могут происходить амплифика
при повышении уровня BH3 only белков боль
ции генов антиапоптотических белков Bcl 2 се
шее количество антиапоптотических белков бу
мейства, в частности, BCL2, MCL1, BCL2L1
дет связываться с ними, освобождая, во первых,
(последний кодирует Bcl xL) [18]. Высокая
Bak и Bax, во вторых, BH3 only активаторы,
экспрессия этих белков наблюдается у пациен
способствуя дополнительной активации Bak и
тов с различными онкологическими заболева
Bax [11]. Помимо изменений концентрации в
ниями [19], при этом показана корреляция
клетке, активность анти и проапоптотических
уровня их экспрессии с отрицательным прогно
белков семейства Bcl 2 регулируется за счет их
зом пациентов [20, 21]. Все эти данные подчер
посттрансляционных модификаций, что может
кивают значимость апоптоза как противоопухо
повышать их сродство к партнерам связывания
левого механизма и указывают на перспектив
или вести к изменениям внутриклеточной лока
ность использования белков семейства Bcl 2 в
лизации [12]. Таким образом, в описанной сис
качестве потенциальных терапевтических ми
теме трехстороннего контроля над ПВММ по
шеней.
рообразующие белки являются исполнителями,
Следует отметить, что в ряде случаев наблю
тогда как BH3 only и антиапоптотические белки
даются обратные результаты. Так, согласно ме
регулируют их активность и, следовательно, го
та анализу, пациенты с позитивным по Bcl 2 не
товность клетки перейти к точке невозврата в
мелкоклеточным раком легкого (НМРЛ) имеют
запуске программы апоптоза.
более благоприятный прогноз в сравнении с па
Роль белков семейства Bcl 2 в канцерогенезе.
циентами с негативными по Bcl 2 случаями того
Учитывая роль апоптоза в противоопухолевой
же заболевания, хотя разницы между двумя
защите организма, логично предположить, что
группами не наблюдалось среди пациентов
БИОХИМИЯ том 85 вып. 10 2020
ТАРГЕТИРОВАНИЕ Bcl 2 БЕЛКОВ
1425
только с I стадией [22]. У пациентов с раком
тики разрушают их комплексы с проапоптоти
яичника уровень экспрессии гена BCL2 прямо
ческими представителями Bcl 2 семейства, нап
коррелирует с благоприятным прогнозом [23]. В
рямую вызывая апоптоз [29]. При этом при ин
то же время уровень Bcl 2 у больных с раком
гибировании антиапоптотических белков воз
яичника обратно коррелирует со стадией прог
можно достичь определенной степени избира
рессии опухоли, что может в существенной сте
тельности в отношении опухолевых клеток, что
пени объяснять наблюдаемый феномен [24]. Бо
обусловлено, вероятно, их высокой склон
лее того, низкий уровень экспрессии гена одно
ностью к апоптозу и зависимостью от отдельных
го антиапоптотического белка вовсе не исклю
белков семейства Bcl 2 для выживания.
чает того, что опухоль данного типа может ис
Учитывая принципиальное сходство BH3
пользовать повышенную экспрессию генов дру
связывающих карманов различных антиапопто
гих антиапоптотических белков для выживания.
тических белков, некоторые малые молекулы
Так, для НМРЛ была показана значимость Mcl
могут взаимодействовать с несколькими из них.
1 и его связь с неблагоприятным прогнозом [25],
Такие BH3 миметики широкого спектра
а для рака яичника установлено значение Bcl xL
действия (например, Обатоклакс) используются
и Mcl 1 в устойчивости к химиотерапии [26, 27].
как инструмент индукции апоптоза в экспери
Следовательно, тот или иной белок может иметь
ментах in vitro. Они показали некоторую эффек
бóльшую роль в одних типах опухолевых заболе
тивность в испытаниях in vivo и были протести
ваний и меньшую - в других.
рованы в клинических испытаниях, где, впро
Таргетирование BH3 миметиками. Учитывая
чем, не продемонстрировали существенной эф
то, что опухолевые клетки нередко характеризу
фективности [31]. С развитием методов дизайна
ются нарушениями процессов клеточной гибе
химических веществ появились более селектив
ли, запуск апоптоза представляется перспектив
ные BH3 миметики [30, 32, 33]. Существенным
ным подходом в контексте противоопухолевой
преимуществом данных агентов в сравнении с
терапии. Теоретически воздействовать на регу
неселективными BH3 миметиками, во первых,
ляцию ПВММ белками семейства Bcl 2 можно
является возможность изучить вклад индивиду
по меньшей мере двумя способами. Во первых,
альных белков в выживаемость опухолевых и
возможно создание молекул, которые напрямую
нормальных клеток в различных условиях. Во
активировали бы Bax и Bak аналогично BH3
вторых, селективные BH3 миметики представ
only активаторам [10]. Во вторых, можно инги
ляют собой перспективные противоопухолевые
бировать антиапоптотические белки семейства
препараты, так как позволяют целенаправленно
Bcl 2, что смещало бы равновесие в клетке к ак
ингибировать необходимый белок, а в случае
тивности проапоптотических белков [3]. В нас
необходимости заблокировать несколько анти
тоящее время первый из упомянутых подходов
апоптотических представителей Bcl 2 семей
находится лишь на стадии подбора эффектив
ства, дозы каждого из селективных BH3 миме
ных кандидатов для прямой активации Bax и
тиков могут быть подобраны индивидуально в
Bak [28]. Вместе с тем один из главных вопро
соответствии с тем, от каких белков в наиболь
сов, касающийся подобной стратегии, заключа
шей степени зависит выживаемость опухолевых
ется в селективности подхода, т.е. в том, не будут
клеток в конкретном случае.
ли прямые активаторы порообразующих белков
Среди антиапоптотических белков семей
токсичны за счет массовой индукции апоптоза в
ства Bcl 2 наиболее изучены пять членов: Bfl 1,
клетках нормальных тканей. Дальнейшие ис
Bcl w, Bcl xL, Mcl 1, Bcl 2 [11]. Для каждого из
следования должны дать ответ на этот и другие
этих белков показана роль в выживании опухо
вопросы, касающиеся возможности прямой ак
левых клеток, следовательно, все из них являют
тивации Bax и Bak в качестве терапевтической
ся потенциальными мишенями для действия
стратегии.
BH3 миметиков. Вместе с тем в настоящее вре
Второй подход в таргетировании белков се
мя прогресс в разработке и применении ингиби
мейства Bcl 2 - ингибирование антиапоптоти
торов данных белков существенно разнится.
ческих представителей данного семейства - до
Таргетирование белка Bcl 2. Белок Bcl 2 стал
бился существенного прогресса за последние 15
не только первым открытым представителем од
лет. Главным инструментом в ингибировании
ноименного семейства, но и очевидным лиде
анти апоптотической активности Bcl 2 белков
ром среди указанных белков в контексте подбо
стали вещества, имитирующие действие BH3
ра ингибиторов и их использования в медицин
доменов проапоптотических белков, откуда они
ской практике. Существенным прорывом в ин
и получили свое название - BH3 миметики [29,
гибировании Bcl 2 послужило получение BH3
30]. Взаимодействуя с BH3 связывающим кар
миметиков ABT 737 и АВТ 263 (Навитоклакс)
маном антиапоптотических белков, BH3 миме
[34,35]. Указанные соединения, помимо Bcl 2,
БИОХИМИЯ том 85 вып. 10 2020
1426
СЕНИЧКИН и др.
также подавляли Bcl w и Bcl xL, хотя некоторые
токлакса наглядно показал ключевые проблемы
исследования указывали на то, что именно Bcl
таргетирования Bcl xL. Как было сказано выше,
2 является их основной мишенью в клетках [36].
основной причиной ограничения использова
Обладая, в отличие от ABT 737, подходящими
ния этого препарата стала выраженная тромбо
фармакологическими свойствами (в частности,
цитопения, возникающая вследствие ингибиро
возможностью перорального применения) [35],
вания Bcl xL в тромбоцитах [40]. Развитие тром
Навитоклакс был исследован в ряде клиничес
боцитопении также наблюдалось и при исполь
ких испытаний [5,10]. Однако выраженная
зовании в экспериментах на мышах соединения
тромбоцитопения, обусловленная ингибирова
A 1155463, которое обладает пикомолярной аф
нием Bcl xL, привела к ограничению макси
финностью к Bcl xL [32]. Именно выраженные
мальной дозы Навитоклакса и лишь умеренной
побочные эффекты (в частности, тромбоцито
терапевтической эффективности [5].
пения) и вытекающая из них необходимость ог
Дальнейшие попытки разработчиков были
раничения дозы стали наиболее существенными
сосредоточены на создании BH3 миметика, ко
препятствиями в продвижении ингибиторов
торый селективно подавлял бы Bcl 2. Первым
Bcl xL в терапевтическую практику [10].
таким соединением стал ABT 199 (Венеток
В настоящее время активно исследуются
лакс), обладающий сходной структурой с ABT
способы решения указанной проблемы [41].
737 и Навитоклаксом [30]. В то же время введе
Так, одним из направлений для устранения сис
ние индольного фрагмента в структуру Венеток
темных побочных эффектов является таргетная
лакса позволило обеспечить селективность взаи
доставка лекарства в опухоль (например, с по
модействия с Bcl 2 за счет образования водород
мощью конъюгации с моноклональным антите
ной связи с остатком Асп103. У Bcl xL в анало
лом). Конъюгат антитела с лекарственным пре
гичной позиции находится остаток глутамата
паратом ABBV 155, нацеленный на поверхност
(Глу96), что затрудняет его взаимодействие с Ве
ный маркер B7H3 и несущий антагонист Bcl
нетоклаксом и служит основой высокой селек
xL, недавно вступил в первую фазу клиничес
тивности данного соединения [30]. Венетоклакс
ких испытаний (NCT03595059). Кроме того,
был исследован в ряде клинических испытаний
проходит набор пациентов с гормон чувстви
и в связи с выраженной эффективностью полу
тельным раком предстательной железы и метас
чил одобрение для лечения пациентов с хрони
тазированием в лимфоузлах для клинических
ческим лимфоцитарным лейкозом (ХЛЛ) [6, 37,
испытаний вакцины Bcl xl_42 CAF09b, содер
38]. Также Венетоклакс (в комбинации с Азаци
жащей Bcl xl_42 (пептидный фрагмент белка
тидином, или Децитабином, или низкими доза
Bcl xL) и адъювант CAF09b (NCT03412786). Та
ми Цитарабина) одобрен для лечения острого
кие терапевтические подходы могут в будущем
миелоидного лейкоза (ОМЛ) у пожилых паци
стать новой опцией в таргетировании Bcl xL в
ентов и пациентов, которым противопоказаны
опухолевых клетках, что позволит устранить не
интенсивные режимы химиотерапии. В настоя
желательные побочные эффекты в виде тром
щее время эффективность Венетоклакса актив
боцитопении.
но исследуется для лечения различных опухоле
Проблемы подавления белка Bcl w. Белок Bcl
вых заболеваний, в особенности гематологичес
w участвует в широком спектре как физиологи
ких. Необходимо отметить, что описаны и дру
ческих, так и патологических процессов, в том
гие селективные антагонисты Bcl 2, например,
числе в развитии опухолевых заболеваний [42].
S55746 [39]. В будущем такие соединения могут
Следовательно, ингибиторы этого белка могли
пополнить арсенал BH3 миметиков, применяе
бы расширить арсенал противоопухолевых пре
мых в клинической практике, и использоваться,
паратов. Однако в настоящее время селектив
например, в случае возникновения резистент
ные ингибиторы Bcl w отсутствуют, а сложность
ных к Венетоклаксу мутаций в структуре Bcl 2.
их создания может объясняться конформацион
Bcl xL как мишень в терапии. В качестве по
ной «гибкостью» этого белка [43]. ВН3 мимети
тенциальных ингибиторов Bcl xL изучалось
ки АВТ 737 и Навитоклакс способны ингибиро
большое количество соединений, таких как А
вать Bcl w наряду с Bcl 2 и Bcl xL. Однако было
385358, S44563, WEHI 539, A 1331852, A
показано, что ABT 737 разрушаeт в клетках
1155463, Навитоклакс, различные производные
комплексы между Bcl w и проапоптотическими
Госсипола и другие. Однако, несмотря на дан
партнерами менее эффективно, чем аналогич
ные, демонстрирующие определенную эффек
ные взаимодействия с белками Bcl 2 и Bcl xL
тивность ингибиторов Bcl xL в доклинических
[36]. Эти данные, вероятно, касаются и Нави
исследованиях, было проведено лишь неболь
токлакса, учитывая его схожесть с ABT 737. Та
шое число клинических испытаний с антаго
ким образом, вопрос разработки селективных
нистами этого белка. Опыт применения Нави
антагонистов Bcl w остается открытым.
БИОХИМИЯ том 85 вып. 10 2020
ТАРГЕТИРОВАНИЕ Bcl 2 БЕЛКОВ
1427
Перспективы подавления белка Bfl 1. Bfl 1
лечении онкологических заболеваний ключе
(Bcl 2A1) является наименее изученным анти
вым является вопрос, насколько данные веще
апоптотическим белком семейства Bcl 2. Для
ства способны вызывать апоптоз в злокачест
Bfl 1 не описано BH3 миметиков, в том числе
венных клетках, не затрагивая выживание нор
неселективных. Роль данного белка в процессе
мальных. Имеющиеся данные указывают на то,
канцерогенеза также исследована недостаточно,
что бóльшая часть нормальных клеток не
хотя имеющиеся данные показывают потенци
чувствительна к апоптозу, индуцированному
альную роль данного белка в обеспечении ус
BH3 миметиками [11, 49].
тойчивости к действию BH3 миметиков [43].
Одним из основных объяснений подобного
Было показано, что в строении ВН3 связываю
феномена является неодинаковая «близость» к
щего кармана белка Bfl 1 присутствует цистеи
апоптозу различных клеток [49, 50]. Так, нор
новый аминокислотный остаток (С55), что от
мальные клетки гематологического происхож
личает данный белок от остальных антиапопто
дения находятся в числе наиболее чувствитель
тических представителей семейства Bcl 2 [44].
ных к апоптозу, в то время как постмитотичес
Следовательно, в будущем возможно создание
кие клетки, такие как нейроны и кардиомиоци
специфичных ковалентных высокоаффинных
ты, в существенной степени менее склонны к
ингибиторов Bfl 1.
запуску апоптотической программы [51]. Как
Таргетирование белка Mcl 1. Важным струк
итог, первые демонстрируют высокую чувстви
турным отличием Mcl 1 от других антиапопто
тельность к апоптозу, индуцированному BH3
тических представителей семейства Bcl 2 явля
миметиками, тогда как последние относительно
ется конформационная ригидность его BH3
устойчивы к данным агентам [49].
связывающего кармана, что осложняло созда
Вместе с тем важно понять, какие факторы
ние молекул, эффективно взаимодействующих
отвечают за указанную склонность клеток к ги
с данным белком [45]. Как итог, до недавнего
бели. Интересным и важным наблюдением в
времени не было представлено селективных ан
контексте описываемого феномена является бо
тагонистов Mcl 1. Однако за последние годы
лее высокая экспрессия белков регуляторов
был сделан существенный прорыв в этом нап
апоптоза в активно делящихся клетках и сниже
равлении [46] и был описан ряд BH3 мимети
ние уровня данных белков в постмитотических
ков, направленных на Mcl 1 и обладающих вы
клетках [51]. Первые, при этом, демонстрируют
сокой селективностью и аффинностью к мише
значительно бóльшую чувствительность к апо
ни, таких как S63845 [33], AZD 5991 [47], AMG
птотическим стимулам. Отсюда можно сделать
176 [48] и другие [46]. Эти соединения или их
предположение, что склонность клетки к апоп
производные сейчас находятся в I фазе клини
тозу определяется уровнем экспрессии компо
ческих испытаний среди пациентов с различны
нентов, отвечающих за функционирование
ми гематологическими заболеваниями как в ка
апоптотической машины [11, 49]. Именно такие
честве индивидуальных агентов, так и в комби
клетки и являются наиболее чувствительными к
нации с Венетоклаксом.
действию различных агентов и стимулов, инду
Также стоит отметить, что уникальной осо
цирующих апоптоз, в том числе BH3 мимети
бенностью Mcl 1 среди других белков семейства
ков.
Bcl 2 является его короткий период полужизни.
В процессе перерождения злокачественные
Это обстоятельство позволяет ингибировать
клетки сталкиваются с большим количеством
Mcl 1 непрямыми способами за счет понижения
факторов, которые могут вести к увеличению
его содержания в клетке на различных уровнях
уровня и активности проапоптотических бел
регуляции - транскрипционном, трансляцион
ков. Так, некоторые онкогены, например Myc,
ном и посттрансляционном [12].
ведут к их повышенной экспрессии [51]. Чтобы
выжить в подобных условиях, опухолевые клет
ки могут полагаться на увеличенную экспрес
ГДЕ: В КАКИХ ОПУХОЛЯХ ЭФФЕКТИВНА
сию антиапоптотических белков [52]. При этом
ТЕРАПИЯ BH3 МИМЕТИКАМИ?
отбор происходит в пользу клонов, которые
имеют уровень данных белков, достаточный для
«Близость» к гибели как необходимое условие
нейтрализации их контрпартнеров. Проходя че
эффективности BH3 миметиков. Важным факто
рез множество «стрессовых испытаний» в про
ром для практического применения того или
цессе своей эволюции, опухолевые клетки, в ко
иного агента в качестве противоопухолевой те
нечном итоге, приходят к состоянию, в котором
рапии является его избирательность в отноше
большое количество проапоптотических белков
нии опухолевых клеток. Следовательно, для по
компенсируется высоким содержанием анти
тенциального применения BH3 миметиков в
апоптотических [49, 53]. Верно подобранный
БИОХИМИЯ том 85 вып. 10 2020
1428
СЕНИЧКИН и др.
стрессовый стимул может подтолкнуть опухоле
2/Mcl 1 в большей степени коррелировало с эф
вую клетку к апоптозу, оказав при этом меньшее
фективностью, чем уровень только мРНК Bcl 2
влияние на клетки, менее склонные к запуску
[55].
данной программы гибели. В случае BH3 миме
Важным шагом в изучении зависимостей
тиков их действие приведет к высвобождению
разных типов опухолей от отдельных антиапоп
большого числа проапоптотических факторов и
тотических белков семейства Bcl 2 послужило
запуску гибели в тех клетках, которые находятся
использование BH3 профайлинга [50]. Данный
в состоянии «близости» к апоптозу. Вместе с
метод основан на количественной оценке
тем, склонные к апоптозу нормальные клетки,
ПВММ после добавления BH3 пептидов к клет
для которых подобный стимул окажется нас
кам опухолевых тканей пациентов с различны
только же существенным, также вступят в про
ми онкологическими заболеваниями. Исполь
цесс гибели, что обусловит токсичность терапии
зование BH3 пептидов, селективно взаимодей
[11, 49].
ствующих с отдельными белками, позволяет вы
«Анти апоптотическая зависимость» клеток.
яснить, насколько тот или иной антиапоптоти
Указанное условие «близости» опухолевых кле
ческий представитель отвечает за выживание
ток к гибели является необходимым, но недос
опухолевых клеток. Так, если добавление BH3
таточным для эффективного действия индиви
пептида белка Noxa, селективно взаимодейству
дуальных BH3 миметиков. Ключевую роль в оп
ющего с Mcl 1, приведет к существенному вы
ределении чувствительности этих клеток к дан
ходу цитохрома с из митохондрий, можно сде
ным препаратам играет их различная зависи
лать вывод о зависимости клеток от Mcl 1 и,
мость от того или иного белка семейства Bcl 2
следовательно, потенциальной эффективности
для своего выживания [50, 53, 54]. В случае, ког
ингибирования этого белка [49]. Кроме того,
да опухолевые клетки преимущественно полага
ВН3 профайлинг позволяет оценить степень
ются на один белок для выживания, ингибиро
«прайминга» опухолевых клеток (т.е. предвари
вание этого белка может эффективно индуциро
тельной «готовности») к запуску апоптоза. Сос
вать апоптоз [53]. Впрочем, гибели будут под
тояние «высокого прайминга» означает, что
вержены и те нормальные клетки, которые по
нейтрализация небольшого количества анти
лагаются на тот же белок семейства Bcl 2. В слу
апоптотических белков приведет к эффективно
чае же, когда опухолевые клетки полагаются на
му высвобождению проапоптотических белков
несколько антиапоптотических белков семей
и индукции апоптоза. Напротив, «низкий прай
ства Bcl 2, необходимо использование комби
минг» требует ингибирования большого количе
нации BH3 миметиков, что, однако, будет по
ства антиапоптотических белков для индукции
вышать вероятность возникновения нежела
апоптоза. В будущем метод ВН3 профайлинга
тельных эффектов.
может стать важным инструментом для предска
Именно зависимость клеток различных опу
зания ответа пациентов на BH3 миметики и пе
холей от того или иного белка формирует их
рехода к персонализированной медицине, что
чувствительность к BH3 миметикам и опреде
позволит подбирать терапию не только для
ляет потенциал терапии [37, 38, 53]. Зависи
конкретных типов опухолей, но и для отдельных
мость же нормальных клеток от тех же белков,
пациентов [49].
напротив, является фактором, ограничиваю
Спектр действия BH3 миметиков. Хотя высо
щим применение BH3 миметиков. Как было от
кая чувствительность к BH3 миметикам была
мечено выше, ярким примером побочных реак
показана для клеточных линий ряда карцином
ций, наблюдаемых при действии BH3 мимети
[34], опухоли гематологического происхожде
ков, является возникновение тромбоцитопении
ния демонстрируют существенно более высокий
при применении Навитоклакса [5, 40].
уровень ответа на BH3 миметики. И хотя дан
Вероятно, в основе формирования зависи
ных относительно селективных антагонистов
мости от одного белка лежит не столько повы
Bcl xL существенно меньше, чтобы можно было
шенный уровень его экспрессии, сколько отсут
сделать вывод об их эффективности на большой
ствие компенсаторного воздействия со стороны
выборке клеточных линий, более высокая эф
других представителей семейства Bcl 2. Так, в
фективность BH3 миметиков к Bcl 2 и Mcl 1 в
ряде работ показана значимость Mcl 1 для при
клетках гематологических опухолей не вызывает
обретения устойчивости клеток к действию На
сомнений [48, 49]. Это отражается в том числе и
витоклакса и Венетоклакса [29]. Напротив, эф
в выборе направлений клинических исследова
фективность ингибирования Mcl 1 обратно
ний данных препаратов. Так, на сегодняшний
коррелирует с уровнем мРНК Bcl xL [33]. Более
день III фаза клинических испытаний для Вене
того, в клинических испытаниях Венетоклакса
токлакса инициирована только для пациентов с
соотношение уровней мРНК Bcl 2/Bcl xL и Bcl
опухолями гематологического происхождения.
БИОХИМИЯ том 85 вып. 10 2020
ТАРГЕТИРОВАНИЕ Bcl 2 БЕЛКОВ
1429
BH3 миметики к Mcl 1, недавно вступившие в
метазоном показал высокий объективный уро
фазу клинических испытаний, также тестируют
вень ответа (67%) при лечении пациентов с ре
ся исключительно среди пациентов с гематоло
лапсирующей/рефрактерной множественной
гическими опухолями.
миеломой (ММ) [59]. Как итог, были иницииро
Как сказано выше, в основе подобного фе
ваны клинические испытания III фазы для лече
номена, вероятно, лежит как бóльшая «бли
ния пациентов с некоторыми из указанных за
зость» клеток гематологических опухолей к
болеваний. Результаты данных исследований
апоптозу, так и бóльшая частота их зависимости
могут расширить область применения Венеток
от одного антиапоптотического белка для вы
лакса.
живания [49]. Тем не менее имеющиеся данные
Результаты клинических испытаний BH3
показывают, что даже среди гематологических
миметиков к Mcl 1 на сегодняшний день боль
опухолей действие BH3 миметиков имеет огра
шей частью недоступны. На большой выборке
ниченную эффективность [56]. В настоящее
клеточных линий (952 линии) ингибитор Mcl 1
время единственным известным исключением
продемонстрировал эффективность преимуще
является ХЛЛ, для которого показана строгая
ственно среди клеток гематологических опухо
зависимость от Bcl 2 [53], а также выраженный
лей, в особенности ММ и ОМЛ [48]. Вместе с
ответ пациентов с данным заболеванием [37,38].
тем, ввиду отсутствия строгой зависимости от
Неудивительно, что Венетоклакс впервые полу
Mcl 1 клеток ММ и ОМЛ [54,60], как и клеток
чил одобрение к медицинскому применению
других гематологических опухолей, маловероят
именно для данной болезни [6].
но, что ингибиторы Mcl 1 продемонстрируют
Также Венетоклакс в комбинации с химио
исключительную эффективность у пациентов с
терапевтическими препаратами одобрен для ле
данными заболеваниями. Имеющиеся проме
чения ОМЛ, клетки которого демонстрируют
жуточные результаты тестирования ингибитора
преимущественную, но не абсолютную зависи
Mcl 1 AMG 176 среди пациентов с релапсирую
мость от Bcl 2 [54]. Вместе с тем, встречаются
щей/рефрактерной ММ подтверждают данное
случаи зависимости от Mcl 1, а ряд исследова
предположение: большинство пациентов
ний показывает не только значимость Mcl 1 для
(22/26) прекращали лечение из за прогрессии
клеток данного типа опухоли, но и синергизм
заболевания [61]. Таким образом, на сегодняш
ингибирования Mcl 1 и Bcl 2 в них [57]. Следо
ний день BH3 миметики имеют ограниченное
вательно, по крайней мере в некоторых случаях
применение, и огромный потенциал, которым
клетки ОМЛ полагаются одновременно на Mcl
обладает данный класс препаратов, вероятно,
1 и Bcl 2 для выживания, и подавление одного
остается не раскрытым. Дальнейшие исследова
белка может быть неэффективно. Как итог, тре
ния должны привести к решению указанной
буется комбинация BH3 миметиков. Отметим,
проблемы.
клинические испытания комбинации BH3 ми
метиков к Mcl 1 и Венетоклакса были иниции
рованы именно для пациентов с ОМЛ.
КОГДА: КАК РАСШИРИТЬ ОБЛАСТЬ
Как и для ОМЛ (и в отличие от ХЛЛ), для ря
ПРИМЕНЕНИЯ BH3 МИМЕТИКОВ?
да других гематологических опухолей не было
выявлено строгой зависимости от одного анти
Строгая зависимость от Bcl 2, которую де
апоптотического белка семейства Bcl 2 [49].
монстрируют клетки ХЛЛ, закономерно отра
Клинические испытания Венетоклакса проде
жается в высокой эффективности Венетоклакса
монстрировали его различную эффективность
при лечении пациентов с данным заболеванием.
на пациентах с разными формами неходжкинс
Для других злокачественных опухолей может
ких лимфом. Так, объективный уровень ответа
наблюдаться зависимость от разных белков, от
при лечении пациентов с релапсирующи
личающихся от пациента к пациенту. В этом
ми/рефрактерными диффузной В клеточной
случае нацеленное действие на белок, который
крупноклеточной лимфомой, фолликулярной
определяет выживание клеток опухоли, может
лимфомой и мантийноклеточной лимфомой
привести в выраженному ответу. Стало быть, не
составил 18%, 38% и 75% соответственно [56].
обходимо детальное изучение механизмов, ко
Вместе с тем, комбинация Венетоклакса с Ри
торые лежат в основе формирования зависимос
туксимабом и Бендамустином не показала су
ти от каждого из этих белков, а также молеку
щественного преимущества при лечении паци
лярных маркеров, позволяющих выявить подоб
ентов с релапсирующей/рефрактерной фолли
ные случаи. Следовательно, одним из ключевых
кулярной лимфомой в сравнении с действием
направлений в области применения BH3 миме
только Ритуксимаба и Бендамустина [58]. Вене
тиков является поиск предиктивных биомарке
токлакс в комбинации с Бортезомибом и Декса
ров, то есть молекулярно генетических характе
БИОХИМИЯ том 85 вып. 10 2020
1430
СЕНИЧКИН и др.
ристик пациента, которые могут предсказать от
кой практики для предсказания ответа пациен
вет на терапию. Также важную роль в развитии
тов на этот препарат и, в будущем, на другие
использования BH3 миметиков играет исследо
BH3 миметики. Необходимы проспективные
вание механизмов, которые лежат в основе фор
клинические исследования, чтобы оценить при
мирования резистентности к BH3 миметикам, а
менимость метода BH3 профайлинга для стра
также способов ее преодоления. Наконец, важ
тификации пациентов. Более того, определен
ным аспектом является изучение рациональных
ные сложности могут возникнуть и с техничес
комбинаций BH3 миметиков друг с другом либо
ким применением метода. Так, в упомянутом
с другими препаратами. Данные комбинации
испытании Венетоклакса для лечения пациен
могут вести к преодолению устойчивости к ин
тов с ОМЛ только для 12 из 18 пациентов образ
дивидуальным BH3 миметикам, а также демон
цы соответствовали установленным в исследо
стрировать более высокую эффективность в
вании критериям (более чем 50% выживаемость
элиминировании опухолевых клеток. Действие
клеток после разморозки образцов и более чем
комбинаций BH3 миметиков друг с другом мо
5% содержание бластов ОМЛ в образце) [62].
жет быть особенно эффективно в случае зависи
Другим способом определения зависимости
мости опухолей одновременно от нескольких
опухолевых клеток от антиапоптотических бел
антиапоптотических белков семейства Bcl 2.
ков семейства Bcl 2 может быть оценка уровня
Изучение указанных аспектов - биомаркеров
различных представителей данного семейства.
эффективности, факторов устойчивости и ком
Высокий уровень экспрессии мишени и низкий
бинаторных подходов - позволит существенно
уровень антиапоптотических белков семейства
расширить область применения BH3 мимети
Bcl 2, которые не являются мишенью для того
ков, в том числе, вероятно, на пациентов с со
или иного BH3 миметика, вполне закономерно
лидными опухолями.
может быть предиктором ответа на данный BH3
Предиктивные биомаркеры для использования
миметик. Так, ответ клеточных линий неходж
BH3 миметиков. Как указано выше, одним из
кинских лимфом и мелкоклеточного рака легкого
потенциальных предикторов эффективности
на Венетоклакс коррелирует с уровнем экспрес
Венетоклакса является оценка зависимости
сии Bcl 2 [30,63]. Для клеточных линий ММ от
опухолевых клеток от Bcl 2 с помощью метода
вет на этот препарат определяется соотношени
BH3 профайлинга [50]. Для проведения этого
ем мРНК Bcl 2/Bcl xL и Bcl 2/Mcl 1 [64]. Ана
метода необходимо получить материал от паци
логичным образом данные соотношения корре
ентов, в котором присутствуют опухолевые
лировали и с ответом пациентов с ММ, при этом
клетки, например, аспират костного мозга [62].
уровень корреляции снижался в ряду Bcl 2/Bcl
Вместе с тем, в подобных образцах процент опу
xL
> Bcl xL
> Bcl 2/Mcl 1
> Bcl 2
> Mcl 1
холевых клеток может быть относительно невы
[55]. Для пациентов с ОМЛ показана зависи
соким. Следовательно, необходимо отделять от
мость ответа на Венетоклакс от процента клеток,
вет опухолевых клеток от ответа нормальных. С
экспрессирующих Bcl 2 и не экспрессирующих
этой целью может быть использован метод про
Bcl xL [62]. Для ингибитора Mcl 1 S63845 эф
точной цитофлуориметрии с прокраской поверх
фективность в клеточных линиях ОМЛ не кор
ностных маркеров опухолевых клеток антитела
релировала с уровнем мРНК мишени, но демон
ми. Далее измеряют эффективность ПВММ,
стрировала обратную зависимость от содержа
вызванной BH3 пептидами, обладающими раз
ния мРНК Bcl xL [33]. Аналогичные данные бы
личной избирательностью в отношении отдель
ли получены и на широкой выборке клеточных
ных антиапоптотических белков [50,54]. В слу
линий для BH3 миметика к Mcl 1 AMG 176
чае, когда ПВММ происходит эффективно в ре
[48]. Также высокая эффективность S63845 по
зультате нейтрализации Bcl 2, можно ожидать
казана на клеточных линиях мелкоклеточного
высокий уровень ответа на Венетоклакс. Логич
рака легкого с высоким содержанием Mcl 1 и
но предположить, что метод BH3 профайлинга
низким содержанием Bcl xL [65].
может быть применим и для предсказания эф
Содержание проапоптотических белков так
фективности BH3 миметиков к другим анти
же может быть биомаркером ответа на BH3 ми
апоптотическим белкам семейства Bcl 2.
метики. Например, для ингибиторов Mcl 1 по
Метод BH3 профайлинга показывает высо
казана роль порообразующего белка Bak в каче
кую предиктивную способность в случае анали
стве предиктора ответа [48]. Вместе с тем, дан
за ответа клеточных линий [54,60]. Также дан
ные относительно роли проапоптотических бел
ный метод показал корреляцию с ответом на Ве
ков в предсказании ответа на BH3 миметики
нетоклакс пациентов с ОМЛ [62]. Вместе с тем,
скорее остаются спорными. Так, в доклиничес
пока неизвестно, какова будет эффективность
ких исследованиях был показан Bim зависимый
данного метода в условиях реальной клиничес
механизм действия Венетоклакса [66], а на кле
БИОХИМИЯ том 85 вып. 10 2020
ТАРГЕТИРОВАНИЕ Bcl 2 БЕЛКОВ
1431
точных линиях диффузной В клеточной круп
ственны за исходную устойчивость к ним, а
ноклеточной лимфомы белковый уровень Bim
именно, нарушения регуляции анти и проапоп
(равно как Bcl 2 и Bak) прямо коррелировал с
тотических представителей семейства Bcl 2. Так,
ответом на Венетоклакс [67]. Кроме того, более
повышение уровня антиапоптотических белков
низкое соотношение белков Bcl 2/Bim отража
(не являющихся мишенью используемого пре
лось в повышенной чувствительности к этому
парата) в опухолевых клетках с приобретенной
препарату на клетках фолликулярной лимфомы
устойчивостью к Венетоклаксу показано в ряде
[68]. Все эти данные свидетельствуют в пользу
работ in vitro [74]. Аналогичные данные имеются
того, что уровень Bim должен прямо коррелиро
и для других BH3 миметиков, например, ABT
вать с ответом на Венетоклакс. Однако в одном
737 [75]. При этом в основе упомянутых меха
из испытаний на пациентах с ОМЛ, напротив,
низмов нарушения регуляции белков семейства
была показана обратная корреляция уровня
Bcl 2 может лежать действие различных сиг
мРНК Bim с ответом на данный BH3 миметик
нальных каскадов, часто подверженных актива
[69].
ции в опухолевых клетках, таких как MEK/ERK
Таким образом, уровень экспрессии (либо
[76] и PI3K/AKT/mTOR [77]. Приобретенная ус
соотношение уровней экспрессии) различных
тойчивость к действию BH3 миметиков также
членов семейства Bcl 2 может быть полезным
может сопровождаться снижением уровня про
биомаркером в предсказании ответа на BH3 ми
апоптотических белков, например, Bax и Bim
метики. В то же время необходимо определить
[68, 74]. Снижение функциональной активности
наилучшие соотношения для каждого конкрет
проапоптотических белков, например, точечная
ного заболевания. Также важно определить и
мутация G179E в Bax, вело к нарушению транс
наиболее подходящие методы детекции в каж
локации данного белка из цитоплазмы к внеш
дом конкретном случае, так как определение
ней митохондриальной мембране [78]. Изучение
экспрессии на уровне мРНК, хотя и обладает
механизмов возникновения устойчивости к
относительной простотой, может в существен
действию BH3 миметиков имеет большое зна
ной степени не отражать уровень белка в клетке.
чение для подбора рациональных терапий. Так,
В особенности это справедливо для белков, чей
при активации различных внутриклеточных
уровень сильно зависит от посттрансляционных
каскадов использование ингибиторов соответ
модификаций, например, для Bim и Mcl 1.
ствующих сигнальных путей может быть эффек
Некоторые генетические аберрации также
тивно для преодоления резистентности к BH3
коррелируют с зависимостью опухолей от инди
миметикам. Вместе с тем, в случае возникнове
видуальных белков семейства Bcl 2. Так, ярким
ния мутаций в порообразующих белках опухоле
примером является транслокация t(11;14) в
вые клетки могут приобретать рефрактерность к
клетках ММ, которая встречается примерно у
апоптозу, что приведет к нерациональности ис
20% пациентов [70]. В in vitro экспериментах по
пользования этих агентов.
казано, что Венетоклакс специфически эффек
Отдельного упоминания в контексте устой
тивен в отношении клеточных линий с указан
чивости к BH3 миметикам заслуживают «резис
ной транслокацией, при этом она коррелирует с
тентные мутации» - изменения в структуре бел
высоким соотношением мРНК Bcl 2/Mcl 1 [71].
ка, которые ведут к снижению эффективности
Как итог, при использовании Венетоклакса в ка
препарата, нацеленного на данную мишень. Ре
честве монотерапии для лечения пациентов с
зистентные мутации известны для большого
ММ ответ наблюдается преимущество в случае
числа препаратов, например, для ингибиторов
наличия транслокации t(11;14) [55]. Другим
рецепторов с тирозинкиназной активностью.
примером формирования зависимости от Bcl 2
Вместе с тем появляются данные о том, что ре
являются мутации в генах изоцитратдегидроге
зистентные мутации могут обуславливать устой
наз, IDH1 и IDH2, в клетках ОМЛ [72].
чивость к действию Венетоклакса. Так, мутация
Механизмы возникновения резистентности к
G101V была обнаружена у 7 из 15 пациентов с
BH3 миметикам. Одной из главных проблем в
ХЛЛ, у которых наблюдалась прогрессия на фо
лечении опухолевых заболеваний является воз
не применения этого препарата [79]. Наличие
никновение резистентности к терапии. Очевид
данной аминокислотной замены в белке ведет к
но, данная проблема касается и применения
снижению аффинности Венетоклакса к Bcl 2
BH3 миметиков (рис. 2). Так, описаны случаи
примерно в 180 раз [79]. Недавно были опубли
возникновения устойчивости к Венетоклаксу у
кованы обновленные результаты данного иссле
пациентов с ХЛЛ [73].
дования на более широкой выборке пациентов.
В основе формирования приобретенной ре
Как итог, мутация G101V была обнаружена еще
зистентности к BH3 миметикам нередко лежат
у 4 пациентов вдобавок к 7 ранее описанным
те же механизмы, которые могут быть ответ
случаям. При этом в 10 из 11 таких случаев в
БИОХИМИЯ том 85 вып. 10 2020
1432
СЕНИЧКИН и др.
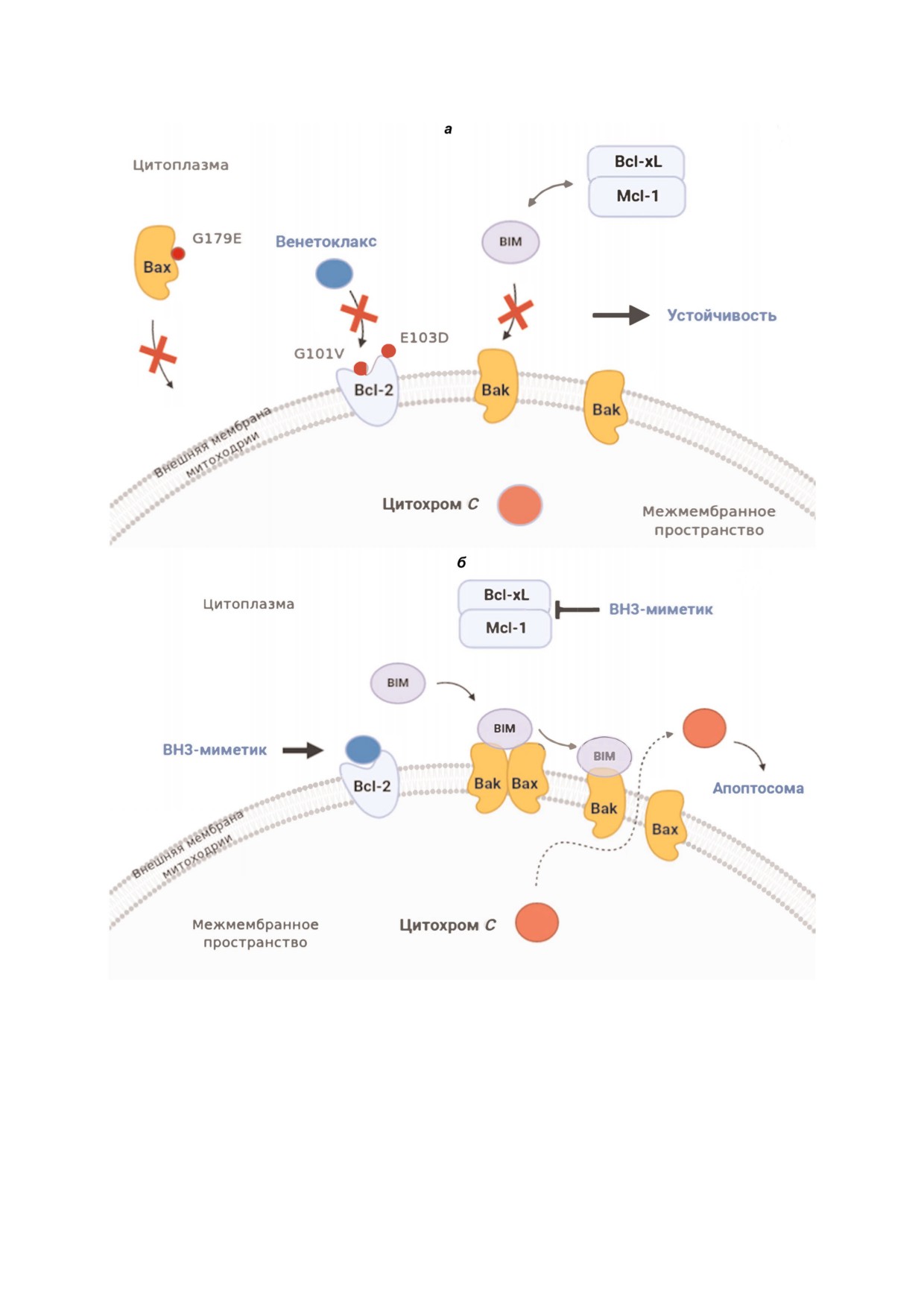
Рис. 2. а - Механизмы возникновения резистентности к BH3 миметикам (на примере Венетоклакса) включают появление
точечных мутаций в мишени - белке Bcl 2 (например, G101V и E103D), нарушения в работе проапоптотических белков
(например, за счет точечной мутации G179E в Bax), а также повышенную экспрессию антиапоптотических белков Bcl xL
и Mcl 1; б - предполагаемый механизм преодоления резистентности с помощью комбинаций различных BH3 миметиков
белке Bcl 2 были выявлены и другие мутации, а
E103D (в описываемом исследовании выявлена
медианное значение мутаций для этих пациен
у 4 пациентов) [73]. Как отмечено ранее, имен
тов равнялось трем [73]. Примечательно, одной
но наличие аспартата в позиции 103 обуславли
из обнаруженных аминокислотных замен была
вает избирательность Венетоклакса в отноше
БИОХИМИЯ том 85 вып. 10 2020
ТАРГЕТИРОВАНИЕ Bcl 2 БЕЛКОВ
1433
нии Bcl 2 в сравнении с Bcl xL, у которого в
Одним из возможных направлений в поиске
альтернативной позиции (96) находится глута
рациональных комбинаций BH3 миметиков яв
мат [30]. Следовательно, замена E103D законо
ляется комбинирование нескольких препаратов
мерно должна вести к снижению эффективнос
данного класса. Как отмечалось выше, в ряде
ти этого BH3 миметика. Что касается замены
работ показан выраженный синергизм при ис
G101V, она также была описана другой группой
пользовании двух BH3 миметиков, в то время
исследователей у 3 из 4 пациентов, которые
как использование их по отдельности было су
приобрели резистентность к Венетоклаксу [80].
щественно менее успешно [57,81-84]. Так, была
Помимо мутаций, обнаруженных в указанных
показана эффективность одновременного инги
выше исследованиях [73,79,80], кандидатом на
бирования Bcl 2 и Mcl 1 [57,81], Bcl 2 и Bcl xL
роль резистентной для Венетоклакса мутации
[83], Mcl 1 и Bcl xL [84]. Очевидно, в указанных
является замена F104L [74]. Замены альтерна
случаях клетки демонстрируют зависимость
тивной аминокислоты в структуре мышиного
сразу от двух белков семейства Bcl 2. Вместе с
Bcl 2 (F101C и F101L) ухудшали связывание
тем, важной является возможность практичес
Bcl 2 с этим препаратом [78].
кого применения комбинаций различных BH3
Важно отметить, что частота встречаемости
миметиков. В случае использования ингибито
аллелей с мутациями в структуре Bcl 2 сущест
ров Bcl 2 и Mcl 1 в экспериментах in vivo пока
венно варьировала среди пациентов (так, для
зано, что подобная комбинация обладает уме
аллелей G101V от 0,1 до 68,4%) [73]. Также пока
ренной токсичностью, не влияя существенно на
зано, что различные клоны опухолевых клеток,
гемопоэз [57,81]. В настоящее время комбина
полученные от одного пациента, либо характе
ции Венетоклакса и различных BH3 миметиков
ризовались повышенным уровнем Bcl xL, либо
к Mcl 1 оцениваются на первой стадии клини
имели мутацию Bcl 2 G101V [79]. Таким обра
ческих испытаний для лечения пациентов с
зом, резистентность к Венетоклаксу может
ОМЛ. Опыт одновременного ингибирования
иметь комплексный характер для отдельных па
Bcl 2 и Bcl xL в существенной степени может
циентов. В подобных случаях необходимо учи
быть оценен на примере использования Нави
тывать все механизмы возникновения устойчи
токлакса, в том числе и в ряде клинических ис
вости к BH3 миметикам для каждого индивиду
пытаний [5,10]. Как отмечено выше, выражен
ального больного. Что касается возможных спо
ная тромбоцитопения оказалась дозолимитиру
собов преодоления устойчивости к Венетоклак
ющим фактором для применения Навитоклак
су клеток с резистентными формами белка, в
са. В то же время данный побочный эффект свя
дальнейшем могут быть разработаны новые
зан с ингибированием Bcl xL, тогда как не было
BH3 миметики к Bcl 2, чье взаимодействие с
выявлено существенных побочных эффектов,
мишенью не будет нарушаться указанными
ассоциированных специфически с одновремен
аминокислотными заменами. Подобный подход
ным подавлением Bcl 2 и Bcl xL. Следователь
был успешно применен для преодоления устой
но, есть надежда на потенциальное применение
чивости клеток к ингибиторам различных ми
комбинации BH3 миметиков к Bcl 2 и Bcl xL.
шеней, например, EGFR и BCR ABL.
Что касается одновременного использования
Перспективные комбинации BH3 миметиков.
ингибиторов Mcl 1 и Bcl xL, подобная комби
Использование комбинаций различных терапий
нация, вероятно, будет обладать существенной
обладает рядом преимуществ в сравнении с
токсичностью. Помимо важной роли Bcl xL в
действием индивидуальных препаратов. Во
выживании тромбоцитов, показана значимость
первых, ингибирование одного белка/пути пе
Mcl 1 и Bcl xL для подавления апоптоза в мега
редачи сигнала может быть неэффективно ввиду
кариоцитах - предшественниках тромбоцитов
наличия компенсаторной активности со сторо
[85]. Следовательно, блокирование данных бел
ны других белков/сигнальных путей, тогда как
ков может в существенной степени обострять
действие на оба звена приведет к выраженному
тромбоцитопению, возникающую при подавле
ответу. Во вторых, даже при высокой эффектив
нии Bcl xL.
ности монотерапии в популяции опухолевых
Также большим потенциалом обладают ком
клеток могут быть отдельные клоны, в которых
бинации BH3 миметиков с различными препа
блокирование одного белка/сигнального пути
ратами нацеленного действия или с химиотера
будет недостаточно для индукции апоптоза. Как
певтическими агентами. Данные доклиничес
итог, подобные клоны могут быть ответственны
ких исследований о синергизме действия BH3
за возникновение рецидива у пациентов, при
миметиков с такими препаратами, о молекуляр
этом использованная ранее терапия будет неэф
ных механизмах, лежащих в его основе, а также
фективна для потомков исходно резистентных
о клинических испытаниях указанных комбина
клонов.
ций суммированы в таблице.
8 БИОХИМИЯ том 85 вып. 10 2020
1434
СЕНИЧКИН и др.
Перспективные комбинации BH3 миметиков с другими противоопухолевыми препаратами
Комбинация
Экспериментальная модель
Возможный механизм
Примеры клинических
Ссылки
синергизма
исследований
BH3 миметики к Bcl 2
Навитоклакс +
выраженный эффект комбина
одним из эффектов Ритуксима
фаза II, Ритуксимаб +
[35]
Ритуксимаб
ции на клеточной линии
ба является ингибирование ак
+ Навитоклакс; пациенты
DoHH2 (B клеточная лимфома)
тивности NF kB, что ведет к
с ХЛЛ (NCT01087151),
в экспериментах in vivo (ксено
уменьшению экспрессии Bcl xL
исследование завершено
графты)
Навитоклакс +
выраженный эффект комбина
действие Эрлотиниба приводит
фаза I, Эрлотиниб + На
[86]
Эрлотиниб
ции на клеточных линиях не
к понижению уровня экспрес
витоклакс; пациенты с
(ингибитор
мелкоклеточного рака легкого в
сии Mcl 1, а также к увеличе
солидными опухолями
EGFR)
экспериментах in vitro и in vivo
нию уровня Bim
(NCT01009073), исследо
(ксенографты)
вание завершено
Навитоклакс +
выраженный эффект комбина
снижение уровня белка Mcl 1
фаза I, Доцетаксел + На
[86]
Доцетаксел
ции на клеточной линии адено
при действии Доцетаксела
витоклакс; пациенты с
(ингибитор
карциномы яичника SKOV3 in
солидными опухолями
разбора
vitro и in vivo (ксенографты)
(NCT00888108), исследо
микротрубочек)
вание завершено
Навитоклакс +
повышенная эффективность
Траметиниб приводит к увели
фаза I/II, Траметиниб +
[87]
Траметиниб
комбинации на клеточных
чению уровня Bim
+ Навитоклакс; пациенты
(ингибитор
линиях разных тканей мутант
с солидными опухолями
MEK)
ных по гену KRAS в экспери
(NCT02079740), исследо
ментах in vitro и in vivo (ксено
вание активно
графты)
Венетоклакс +
повышенная эффективность
Селинексор ингибирует экспор
фаза I, Селинексор +
[88]
Селинексор
комбинации на клеточной ли
тин 1 (XPO1), что приводит к
+ Венетоклакс; пациен
нии ОМЛ THP 1 в эксперимен
уменьшению уровня Mcl 1
ты с рецидивирующими
тах in vitro
гематологическими за
болеваниями
(NCT03955783), иссле
дование активно
Венетоклакс +
выраженный эффект комбина
[89]
Воруциклиб
ции на линиях ОМЛ MV4 11,
(ингибитор
THP 1 в экспериментах in vitro и
действие ингибиторов CDK9
фаза I, CYC065 (ингиби
CDK9)
клетках MV4 11 in vivo (ксено
(Воруциклиба или AZD4573) ве
тор CDK 2/9) + Вене
графты)
дет к уменьшению содержания
токлакс; пациенты с
Mcl 1 за счет негативной регу
ХЛЛ (NCT03739554) и
Венетоклакс +
выраженный эффект комбина
ляции на транскрипционном
ОМЛ (NCT04017546),
[90]
AZD4573
ции на линиях SU DHL 4 и
уровне
исследования активны
(ингибитор
OCI AML3 в экспериментах in
CDK9)
vitro и in vivo (ксенографты)
Венетоклакс +
выраженный эффект комбина
действие Дувелисиба ведет к
фаза II, Дувелисиб + Ве
[91]
Дувелисиб
ции на ex vivo клеточных образ
увеличению экспрессии белка
нетоклакс; пациенты с
(ингибитор
цах, взятых у пациентов с ХЛЛ
Bcl 2 и ВН3 only белков в клет
ХЛЛ (NCT03534323), ис
PI3K δ и PI3K γ)
ках ХЛЛ, что может быть опос
следование активно
редовано ингибированием
PI3K δ и PI3K γ
Венетоклакс +
повышенная эффективность
Карфилзомиб ведет к подавле
фаза II, Дексаметазон/
[92]
Дексаметазон/
комбинации Венетоклакс +
нию Mcl 1 предположительно за
Карфилзомиб + Вене
Карфилзомиб
Дексаметазон/Карфилзомиб на
счет увеличения экспрессии
токлакс; пациенты с
(ингибитор
линии мантийноклеточной
ВН3 only белка Noxa - негатив
мантийноклеточной
протеасом)
лимфомы KMS18 в экспери
ного регулятора Mcl 1. Действие
лимфомой
ментах in vitro. Повышение
Дексаметазона ведет к увеличе
(NCT02899052), исследо
чувствительности к Венетоклак
нию уровня Bim
вание активно
су при сочетании с Дексамета
зоном в ex vivo образцах паци
ентов с ММ
БИОХИМИЯ том 85 вып. 10 2020
ТАРГЕТИРОВАНИЕ Bcl 2 БЕЛКОВ
1435
Продолжение таблицы
Комбинация
Экспериментальная модель
Возможный механизм
Примеры клинических
Ссылки
синергизма
исследований
Венетоклакс +
выраженный эффект комбина
высокие дозы Идарубицина
фаза I, Идарубицин/ Ци
[93]
Идарубицин/
ций на клеточных линиях ОМЛ
снижают уровень экспрессии
тарабин + Венетоклакс;
Цитарабин
в экспериментах in vitro и in vivo
Mcl 1
пациенты с ОМЛ
(ксенографты)
(NCT03194932), исследо
вание активно
Венетоклакс +
выраженный эффект комбина
действие Квизартиниба приво
фаза I/II, Квизартиниб +
[94]
Квизартиниб
ции на линиях мантийнокле
дит к снижению уровня Mcl 1 и
+ Венетоклакс; пациенты
(ингибитор
точной лимфомы в эксперимен
Bcl xL за счет ингибирования
с ОМЛ с мутацией FLT3/
FLT3)
тах in vitro и in vivo (ксено
рецептора FLT3 ITD
ITD (NCT03735875), ис
графты)
следование активно
Венетоклакс +
выраженный эффект комбина
действие Эназидениба приводит
фаза I/II, Эназидениб +
[95]
Эназидениб
ции на ex vivo клеточных образ
к уменьшению уровня Bcl 2 за
+ Венетоклакс; пациенты
(ингибитор
цах, взятых у пациентов с ОМЛ,
счет ингибирования мутантной
с ОМЛ (NCT04092179),
мутантной
а также в экспериментах in vivo
формы IDH2
исследование активно
IDH2)
(ксенографты)
BH3 миметики к Mcl 1
AZD 5991 +
выраженный эффект комбина
действие Бортезомиба приводи
-
[47]
Бортезомиб
ции на клеточной линии ММ
ло к увеличению уровня Bim,
(ингибитор
NCI H929 в экспериментах in
вероятно, за счет блокирования
протеасом)
vitro и in vivo (ксенографты)
деградации этого белка в проте
асомах
AZD 5991 +
выраженный эффект комбина
механизм не изучен
-
[96]
CHOP режим
ции на моделях Т клеточных
лимфом в экспериментах in vivo
(ксенографты)
AMG 176 +
выраженный эффект комбина
действие Траметиниба приводи
-
[97]
Траметиниб
ции на KRAS мутантных кле
ло к повышению экспрессии
(ингибитор
точных линиях немелкоклеточ
белка Bim
MEK)
ного рака легкого in vivo (ксе
нографты)
AMG 176 +
выраженный эффект комбина
механизм не изучен (вероятно,
фаза I, AMG 176 + Кар
[48]
Карфилзомиб
ции на ортотопической модели
аналогичен действию Бортезо
филзомиб + Дексамета
(ингибитор
ММ в экспериментах in vivo
миба)
зон; пациенты с ММ
протеасом)
(ксенографты)
(NCT02675452), испыта
ние активно
S63845 + Доце
выраженный эффект комбина
механизм не изучен
-
[98]
таксел (инги
ции на клеточную линию рака
битор разбора
молочной железы SK BR 3 в
микротрубо
экспериментах in vitro и трой
чек)
ном негативном раке молочной
железы в экспериментах in vivo
(ксенографты)
S63845 + Трас
выраженный эффект комбина
механизм не изучен для Трасту
–
[98]
тузумаб (мо
ций на клеточную линию рака
зумаба; Лапатиниб способствует
ноклональное
молочной железы SK BR 3 в
увеличению экспрессии белка
антитело к
экспериментах in vitro и на мо
Bim, предположительно, за счет
HER2) или Ла
делях HER 2 позитивного рака
уменьшения активации сигналь
патиниб (инги
молочной железы в экспери
ных каскадов AKT и ERK, пре
битор рецеп
ментах in vivo (ксенографты)
пятствуя тем самым фосфорили
торных тиро
рованию Bim и его деградации
зинкиназ)
БИОХИМИЯ том 85 вып. 10 2020
8*
1436
СЕНИЧКИН и др.
Окончание таблицы
Комбинация
Экспериментальная модель
Возможный механизм
Примеры клинических
Ссылки
синергизма
исследований
BH3 миметики к Bcl xL
A 1155463 +
выраженный эффект комбина
механизм не изучен
-
[99]
Доцетаксел
ций на различных моделях не
(ингибитор
мелкоклеточного рака легкого,
разбора мик
рака яичников, рака молочной
ротрубочек)
железы в экспериментах in vitro
и in vivo (ксенографты)
A 385358 +
выраженный эффект комбина
механизм не изучен
-
[100]
Паклитаксел
ции на клеточные линии немел
(ингибитор
коклеточного рака легкого А549
разбора мик
и LX 1 в экспериментах in vivo
ротрубочек)
(ксенографты)
Отдельно стоит упомянуть и показанную в
метиков с другими препаратами, в особенности
клинических испытаниях эффективность ком
в случае эффективности подобных комбинаций
бинаций Венетоклакса с другими препаратами.
для лечения пациентов, может дать ответы на
Так, комбинация этого ВН3 миметика с гипо
вопрос о расширении области применения
метилирующими агентами, Азацитидином и Де
BH3 миметиков и снижении вероятности воз
цитабином, показала высокую эффективность
никновения к ним резистентности.
при лечении пожилых пациентов с ОМЛ: объек
Выводы. Белки семейства Bcl 2 играют важ
тивный уровень ответа 68% и медианное значе
ную роль в контроле запуска апоптоза, а потому
ние выживаемости 17,5 мес., что существенно
опухолевые клетки нередко характеризуются
выше аналогичных показателей для монотера
нарушениями в их работе. Тщательное изучение
пии гипометилирующими агентами [101]. Си
механизмов функционирования этих белков
нергизм действия данной комбинации может
привело к созданию BH3 миметиков - ингиби
быть связан с тем, что гипометилирующие ве
торов антиапоптотических белков указанного
щества вызывают транскрипционную индук
семейства. Одобрение для медицинского при
цию Noxa - BH3 only белка, специфически взаи
менения Венетоклакса, селективного ингибито
модействующего с Mcl 1. Примечательно, ин
ра Bcl 2, стало важным достижением в области
дукция Noxa была связана с не зависящим от
изучения BH3 миметиков. Вместе с тем, пока
эпигенетической регуляции механизмом
спектр применения этого препарата остается от
действия Азацитидина [102]. В другом исследо
носительно узким, а BH3 миметики к другим
вании показано, что действие комбинации Аза
мишеням в лучшем случае только вступают в
цитидина и Венетоклакса подавляет окисли
фазу клинических испытаний. Дальнейшие ис
тельное фосфорилирование в лейкемических
следования, безусловно, должны привести к су
стволовых клетках [103]. Также стоит отметить
щественному расширению области применения
успех использования комбинации Венетоклакса
BH3 миметиков. Этому должно способствовать
с ингибитором BTK Ибрутинибом, который
изучение предикторов чувствительности к ним,
был продемонстрирован при лечении пациен
в частности, исследование факторов, отвечаю
тов с плохим прогнозом с ХЛЛ [104] и мантий
щих за формирование зависимости опухолевых
ноклеточной лимфомой [105]. Данная комбина
клеток от того или иного белка семейства Bcl 2.
ция оценивается в ряде клинических испытаний
Не должно остаться в стороне и изучение факто
III фазы для лечения пациентов с указанными
ров возникновения устойчивости к BH3 миме
заболеваниями. В доклинических исследовани
тикам, а данные о возникновении к ним резис
ях установлено, что одним из механизмов усиле
тентных мутаций указывают на необходимость
ния проапоптотической активности Венеток
разработки новых соединений этого класса. На
лакса при действии Ибрутиниба может быть
конец, пристальное внимание необходимо уде
снижение уровня антиапоптотических белков
лить и поиску наиболее эффективных комбина
Bcl xL и Mcl 1 [106]. Детальное изучение меха
ций BH3 миметиков как друг с другом, так и с
низмов, лежащих в основе синергизма BH3 ми
препаратами других классов.
БИОХИМИЯ том 85 вып. 10 2020
ТАРГЕТИРОВАНИЕ Bcl 2 БЕЛКОВ
1437
Финансирование. Работа выполнена при под
Конфликт интересов. Авторы заявляют об от
держке гранта РНФ (проект 17 75 20102). Рабо
сутствии конфликта интересов.
та в лабораториях авторов также поддержана
Соблюдение этических норм. Настоящая ра
грантами РФФИ (20 015 00500), Шведским
бота не содержит описания выполненных авто
(190345) и Стокгольмским (181301) онкологи
рами исследований с участием людей или ис
ческими фондами.
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Hanahan, D., and Weinberg, R. A. (2011) Hallmarks of
14.
Tagawa, H., Karnan, S., Suzuki, R., Matsuo, K., Zhang, X.,
cancer: the next generation, Cell,
144,
646674,
Ota, A., Morishima, Y., Nakamura, S., and Seto, M.
doi: 10.1016/j.cell.2011.02.013.
(2005) Genome wide array based CGH for mantle cell
2.
Dickens, L. S., Powley, I. R., Hughes, M. A., and
lymphoma: identification of homozygous deletions of the
MacFarlane, M. (2012) The “complexities” of life and
proapoptotic gene BIM, Oncogene,
24,
13481358,
death: death receptor signalling platforms, Exp. Cell Res.,
doi: 10.1038/sj.onc.1208300.
318, 1269 1277, doi: 10.1016/j.yexcr.2012.04.005.
15.
Rampino, N., Yamamoto, H., Ionov, Y., Li, Y., Sawai, H.,
3.
Czabotar, P. E., Lessene, G., Strasser, A., and Adams, J. M.
Reed, J. C., and Perucho, M. (1997) Somatic frameshift
(2013) Control of apoptosis by the BCL 2 protein family:
mutations in the BAX gene in colon cancers of the
implications for physiology and therapy, Nat. Rev. Mol. Cell
microsatellite mutator phenotype, Science, 275, 967 969,
Biol., 15, 49 63, doi: 10.1038/nrm3722.
doi: 10.1126/science.275.5302.967.
4.
Senichkin, V. V., Streletskaia, A. Y., Zhivotovsky, B., and
16.
Yu, J., Yue, W., Wu, B., and Zhang, L. (2006) PUMA sen
Kopeina, G. S. (2019) Molecular comprehension of Mcl
sitizes lung cancer cells to chemotherapeutic agents and
1: from gene structure to cancer therapy, Trends Cell Biol.,
irradiation, Clin. Cancer Res.,
12,
29282936,
29, 549 562, doi: 10.1016/j.tcb.2019.03.004.
doi: 10.1158/1078 0432.CCR 05 2429.
5.
Wilson, W. H., O’Connor, O. A., Czuczman, M. S.,
17.
Sinicrope, F. A., Rego, R. L., Okumura, K., Foster, N. R.,
LaCasce, A. S., Gerecitano, J. F., et al. (2010) Navitoclax,
O’Connell, M. J., Sargent, D. J., and Windschitl, H. E.
a targeted high affinity inhibitor of BCL 2, in lymphoid
(2008) Prognostic impact of Bim, Puma, and Noxa expres
malignancies: a phase 1 dose escalation study of safety,
sion in human colon carcinomas, Clin. Cancer Res., 14,
pharmacokinetics, pharmacodynamics, and antitumour
5810 5818, doi: 10.1158/1078 0432.CCR 07 5202.
activity, Lancet Oncol., 11, 11491159, doi: 10.1016/
18.
Beroukhim, R., Mermel, C. H., Porter, D., Wei, G.,
S1470 2045(10)70261 8.
Raychaudhuri, S., et al. (2010) The landscape of somatic
6.
Deeks, E. D. (2016) Venetoclax: first global approval,
copy number alteration across human cancers, Nature,
Drugs, 76, 979 987, doi: 10.1007/s40265 016 0596 x.
463, 899 905, doi: 10.1038/nature08822.
7.
Westphal, D., Kluck, R. M., and Dewson, G. (2014)
19.
Wesarg, E., Hoffarth, S., Wiewrodt, R., Kröll, M.,
Building blocks of the apoptotic pore: how Bax and Bak are
Biesterfeld, S., Huber, C., and Schuler M. (2007) Targeting
activated and oligomerize during apoptosis, Cell Death
BCL 2 family proteins to overcome drug resistance in non
Differ., 21, 196 205, doi: 10.1038/cdd.2013.139.
small cell lung cancer, Int. J. Cancer, 121, 2387 2394,
8.
Kuwana, T., Bouchier Hayes, L., Chipuk, J. E., Bonzon, C.,
doi: 10.1002/ijc.22977.
Sullivan, B. A., Green, D. R., and Newmeyer, D. D.
20.
Faderl, S., Keating, M. J., Do, K. A., Liang, S. Y.,
(2005) BH3 Domains of BH3 only proteins differentially
Kantarjian, M., O’Brien, S., Garcia Manero, G.,
regulate Bax mediated mitochondrial membrane perme
Manshouri T., and Albitar, M. (2002) Expression profile of
abilization both directly and indirectly, Mol. Cell, 17, 525
11 proteins and their prognostic significance in patients
535, doi: 10.1016/j.molcel.2005.02.003.
with chronic lymphocytic leukemia (CLL), Leukemia, 16,
9.
Czabotar, P. E., Westphal, D., Dewson, G., Ma, S.,
1045 1052, doi: 10.1038/sj.leu.2402540.
Hockings, C., et al. (2013) Bax crystal structures reveal
21.
Han, Y., Wu, N., Jiang, M., Chu, Y., Wang, Z., Liu, H.,
how BH3 domains activate Bax and nucleate its oligomer
Cao, J., Liu, H., Xu, B., and Xie, X. (2019) Long non cod
ization to induce apoptosis, Cell,
152,
519531,
ing RNA MYOSLID functions as a competing endogenous
doi: 10.1016/j.cell.2012.12.031.
RNA to regulate MCL 1 expression by sponging miR 29c
10.
Cory, S., Roberts, A. W., Colman, P. M., and Adams, J. M.
3p in gastric cancer, Cell Prolif., 12678, doi: 10.1111/
(2016) Targeting BCL 2 like proteins to kill cancer cells,
cpr.12678.
Trends Cancer, 2, 443 460, doi: 10.1016/j.trecan.2016.
22.
Zhang, J., Wang, S., Wang, L., Wang, R., Chen, S., Pan, B.,
07.001.
Sun, Y., and Chen, H. (2015) Prognostic value of Bcl 2
11.
Singh, R., Letai, A., and Sarosiek, K. (2019) Regulation of
expression in patients with non small cell lung cancer: a
apoptosis in health and disease: the balancing act of BCL
meta analysis and systemic review, Oncol. Targets Ther., 8,
2 family proteins, Nat. Rev. Mol. Cell Biol., 20, 175 193,
3361 3369, doi: 10.2147/OTT.S89275.
doi: 10.1038/s41580 018 0089 8.
23.
Henriksen, R., Wilander, E., and Löberg, K.
(1995)
12.
Senichkin, V. V., Streletskaia, A. Y., Gorbunova, A. S.,
Expression and prognostic significance of Bcl 2 in ovarian
Zhivotovsky, B., and Kopeina, G. S. (2020) Saga of Mcl 1:
tumours, Br. J. Cancer, 72, 1324 1329, doi: 10.1038/bjc.
regulation from transcription to degradation, Cell Death
1995.509.
Differ., 27, 405 419, doi: 10.1038/s41418 019 0486 3.
24.
Chan, W. Y., Cheung, K. K., Schorge, J. O., Huang, L. W.,
13.
Richter Larrea, J. A., Robles, E. F., Fresquet, V., Beltran, E.,
Welch, et al. (2000) Bcl 2 and p53 protein expression,
Rullan, A. J., Agirre, X., Calasanz, M. J., Panizo, C.,
apoptosis, and p53 mutation in human epithelial ovarian
Richter, J. A., Hernandez, J. M., Roman Gomez, J.,
cancers, Am. J. Pathol., 156, 409 417, doi: 10.1016/S0002
Prosper, F., and Martinez Climent, J. A. (2010) Reversion
9440(10)64744 X.
of epigenetically mediated BIM silencing overcomes
25.
Nakano, T., Liu, D., Nakashima, N., Yokomise, H., Nii, K.,
chemoresistance in Burkitt lymphoma, Blood, 116, 2531
Go, T., Tarumi, S., Matsuura, N., Chang, S., Fujiwara, A.,
2542, doi: 10.1182/blood 2010 02 268003.
and Kakehi, Y. (2018) MCL 1 expression of non small cell
БИОХИМИЯ том 85 вып. 10 2020
1438
СЕНИЧКИН и др.
lung cancer as a prognostic factor and MCL 1 as a promis
40.
Mason, K. D., Carpinelli, M. R., Fletcher, J. I., Collinge,
ing target for gene therapy, J. Clin. Oncol., 36, doi: 10.1200/
J. E., Hilton, A. A., et al. (2007) Programmed anuclear cell
jco.2018.36.15_suppl.e24236.
death delimits platelet life span, Cell, 128, 1173 1186,
26.
Wu, X., Luo, Q., Zhao, P., Chang, W., Wang, Y., Shu, T.,
doi: 10.1016/j.cell.2007.01.037.
Ding, F., Li, B., and Liu, Z. (2019) MGMT activated
41.
Zhang, X., Liu, X., Zhou, D., and Zheng, G. (2020)
DUB3 stabilizes MCL1 and drives chemoresistance in
Targeting anti apoptotic BCL 2 family proteins for cancer
ovarian cancer, Proc. Natl. Acad. Sci. USA, 116, 2961 2966,
treatment, Future Med. Chem.,
12,
563565,
doi: 10.1073/pnas.1814742116.
doi: 10.4155/fmc 2020 0004.
27.
Williams, J., Lucas, P. C., Griffith, K. A., Choi, M.,
42.
Hartman, M. L., and Czyz, M. (2020) BCL w: apoptotic
Fogoros, S., Hu, Y. Y., and Liu, J. R. (2005) Expression of
and non apoptotic role in health and disease, Cell Death
Bcl xL in ovarian carcinoma is associated with chemore
Dis., doi: 10.1038/s41419 020 2417 0.
sistance and recurrent disease, Gynecol. Oncol., 96 , 287
43.
Lee, E. F., Dewson, G., Smith, B. J., Evangelista, M.,
295, doi: 10.1016/j.ygyno.2004.10.026.
Pettikiriarachchi, A., Dogovski, C., Perugini, M. A.,
28.
Reyna, D. E., Garner, T. P., Lopez, A., Kopp, F.,
Colman, P. M., and Fairlie, W. D. (2011) Crystal structure
Choudhary, G. S., et al. (2017) Direct activation of BAX by
of a BCL W domain swapped dimer: Implications for the
BTSA1 overcomes apoptosis resistance in acute myeloid
function of BCL 2 family proteins, Structure, 19, 1467
leukemia,Cancer Cell, 32, 490 505, doi: 10.1016/j.ccell.
1476, doi: 10.1016/j.str.2011.07.015.
2017.09.001.
44.
Harvey, E. P., Hauseman, Z. J., Cohen, D. T.,
29.
Konopleva, M., Contractor, R., Tsao, T., Samudio, I.,
Rettenmaier, T. J., Lee, S., et al. (2020) Identification of a
Ruvolo, P. P., Kitada, S., Deng, X., Zhai, D., and Shi, Y. X.,
covalent molecular inhibitor of anti apoptotic BFL 1 by
et al. (2006) Mechanisms of apoptosis sensitivity and resis
disulfide tethering, Cell Chem. Biol., 27, 647656.e6,
tance to the BH3 mimetic ABT 737 in acute myeloid
doi: 10.1016/j.chembiol.2020.04.004.
leukemia, Cancer Cell, 10, 375 388, doi: 10.1016/j.ccr.
45.
Czabotar, P. E., Lee, E. F., van Delft, M. F., Day, C. L.,
2006.10.006.
Smith, B. J., Huang, D. C. S., Fairlie, W. D., Hinds, M. G.,
30.
Souers, A. J., Leverson, J. D., Boghaert, E. R., Ackler, S. L.,
and Colman, P. M. (2007) Structural insights into the
Catron, N. D., et al. (2013) ABT 199, a potent and selec
degradation of Mcl 1 induced by BH3 domains, Proc. Natl.
tive BCL 2 inhibitor, achieves antitumor activity while
Acad. Sci. USA, 104, 62176222, doi: 10.1073/pnas.
sparing platelets, Nat. Med., 19, 202 208, doi: 10.1038/
0701297104.
nm.3048.
46.
Pervushin, N. V., Senichkin, V. V., Zhivotovsky, B., and
31.
Arellano, M. L., Borthakur, G., Berger, M., Luer, J., and
Kopeina, G. S. (2020) Mcl 1 as a “barrier” in cancer treat
Raza, A. (2014) A phase II, multicenter, open label study
ment: can we target it now? Intern. Rev. Cell Mol. Biol.,
of obatoclax mesylate in patients with previously untreated
pp. 23 55, doi: 10.1016/bs.ircmb.2020.01.002.
myelodysplastic syndromes with anemia or thrombocy
47.
Tron, A. E., Belmonte, M. A., Adam, A., Aquila, B. M.,
topenia, Clin. Lymphoma Myeloma Leuk., 14, 534 539,
Boise, L. H., et al. (2018) Discovery of Mcl 1 specific
doi: 10.1016/j.clml.2014.04.007.
inhibitor AZD5991 and preclinical activity in multiple
32.
Tao, Z. F., Hasvold, L., Wang, L., Wang, X., Petros, A. M.,
myeloma and acute myeloid leukemia, Nat. Commun., 9,
et al. (2014) Discovery of a potent and selective BCL X
5341, doi: 10.1038/s41467 018 07551 w.
Linhibitor with in vivo activity, ACS Med. Chem. Lett., 5,
48.
Caenepeel, S., Brown, S. P., Belmontes, B., Moody, G.,
1088 1093, doi: 10.1021/ml5001867.
Keegan, K. S., Chui, D., et al. (2018) AMG 176, a selec
33.
Kotschy, A., Szlavik, Z., Murray, J., Davidson, J.,
tive MCL1 inhibitor, is effective in hematological cancer
Maragno, A. L., et al. (2016) The MCL1 inhibitor S63845
models alone and in combination with established thera
is tolerable and effective in diverse cancer models, Nature,
pies, Cancer Discov., 8, 1582 1597, doi: 10.1158/2159
538, 477 482, doi: 10.1038/nature19830.
8290.CD 18 0387.
34.
Oltersdorf, T., Elmore, S. W., Shoemaker, A. R.,
49.
Montero, J., and Letai, A. (2018) Why do BCL 2
Armstrong, R. C., Augeri, D. J., et al. (2005) An inhibitor
inhibitorswork and where should we use them in the clinic?
of Bcl 2 family proteins induces regression of solid
Cell Death Differ., 25, 56 64, doi: 10.1038/cdd.2017.183.
tumours, Nature, 677 681, doi: 10.1038/nature03579.
50.
Certo, M., Moore, V. D. G., Nishino, M., Wei, G.,
35.
Tse, C., Shoemaker, A. R., Adickes, J., Anderson, M. G.,
Korsmeyer, S., Armstrong, S. A., and Letai, A. (2006)
Chen, J., et al. (2008) ABT 263: a potent and orally
Mitochondria primed by death signals determine cellular
bioavailable Bcl 2 family inhibitor, Cancer Res., 68, 3421
addiction to antiapoptotic BCL 2 family members, Cancer
3428, doi: 10.1158/0008 5472.CAN 07 5836.
Cell, 9, 351 365, doi: 10.1016/j.ccr.2006.03.027.
36.
Mérino, D., Khaw, S. L., Glaser, S. P., Anderson, D. J.,
51.
Sarosiek, K. A., Fraser, C., Muthalagu, N., Bhola, P. D.,
Belmont, L. D., et al. (2012) Bcl 2, Bcl x L, and Bcl w are
Chang, W., et al. (2017) Developmental regulation of mito
not equivalent targets of ABT 737 and navitoclax (ABT
chondrial apoptosis by c Myc governs age and tissue spe
263) in lymphoid and leukemic cells, Blood, 119, 5807
cific sensitivity to cancer therapeutics, Cancer Cell, 31,
5816, doi: 10.1182/blood 2011 12 400929.
142 156, doi: 10.1016/j.ccell.2016.11.011.
37.
Roberts, A. W., Davids, M. S., Pagel, J. M., Kahl, B. S.,
52.
Xiang, Z., Luo, H., Payton, J. E., Cain, J., Ley, T. J.,
Puvvada, S. D., et al. (2016) Targeting BCL2 with veneto
Opferman, J. T., and Tomasson, M. H. (2010) Mcl1 hap
clax in relapsed chronic lymphocytic leukemia, N. Engl. J.
loinsufficiency protects mice from Myc induced acute
Med., 374, 311 322, doi: 10.1056/NEJMoa1513257.
myeloid leukemia, J. Clin. Invest., 120, 21092118,
38.
Seymour, J. F., Kipps, T. J., Eichhorst, B., Hillmen, P.,
doi: 10.1172/JCI39964.
D’Rozario, J., et al. (2018) Venetoclax-Rituximab in relapsed
53.
Moore, V. D. G., Brown, J. R., Certo, M., Love, T. M.,
or refractory chronic lymphocytic leukemia, N. Engl. J. Med.,
Novina, C. D., and Letai, A. (2007) Chronic lymphocytic
378, 1107 1120, doi: 10.1056/NEJMoa1713976.
leukemia requires BCL2 to sequester prodeath BIM,
39.
Casara, P., Davidson, J., Claperon, A., Toumelin Braizat,
explaining sensitivity to BCL2 antagonist ABT 737, J.
G. L. Le, Vogler, M., et al. (2018) S55746 is a novel orally
Clin. Invest., 117, 112 121, doi: 10.1172/JCI28281.
active BCL 2 selective and potent inhibitor that impairs
54.
Pan, R., Hogdal, L. J., Benito, J. M., Bucci, D., Han, L.,
hematological tumor growth, Oncotarget, 9, 20075 20088,
et al. (2014) Selective BCL 2 inhibition by ABT 199 caus
doi: 10.18632/oncotarget.24744.
es on target cell death in acute myeloid leukemia, Cancer
БИОХИМИЯ том 85 вып. 10 2020
ТАРГЕТИРОВАНИЕ Bcl 2 БЕЛКОВ
1439
Discov., 4, 362675, doi: 10.1158/2159 8290.CD 13
Cancer Res.,
24,
39673980, doi:
10.1158/1078
0609.
0432.CCR 17 3004.
55.
Kumar, S., Kaufman, J. L., Gasparetto, C., Mikhael, J.,
68.
Bodo, J., Zhao, X., Durkin, L., Souers, A. J., Phillips, D. C.,
Vij, R., et al. (2017) Efficacy of venetoclax as targeted ther
Smith, M. R., and His, E. D. (2016) Acquired resistance to
apy for relapsed/refractory t(11;14) multiple myeloma,
venetoclax (ABT 199) in t(14;18) positive lymphoma cells,
Blood, 130, 24012409, doi: 10.1182/blood 2017 06
Oncotarget, 7, 70007010, doi: 10.18632/oncotarget.
788786.
12132.
56.
Davids, M. S., Roberts, A. W., Seymour, J. F., Pagel, J. M.,
69.
Kontro, M., Kumar, A., Majumder, M. M., Eldfors, S.,
Kahl, B. S., et al. (2017) Phase i first in human study of
Parsons, A., et al. (2017) HOX gene expression predicts
venetoclax in patients with relapsed or refractory non
response to BCL 2 inhibition in acute myeloid leukemia,
hodgkin lymphoma, J. Clin. Oncol.,
35,
826833,
Leukemia, 31, 301 309, doi: 10.1038/leu.2016.222.
doi: 10.1200/JCO.2016.70.4320.
70.
Avet Loiseau, H., Attal, M., Moreau, P., Charbonnel, C.,
57.
Moujalled, D. M., Pomilio, G., Ghiurau, C., Ivey, A.,
Garban, F., et al. (2007) Genetic abnormalities and sur
Salmon, J., et al. (2019) Combining BH3 mimetics to tar
vival in multiple myeloma: the experience of the
get both BCL 2 and MCL1 has potent activity in pre clin
Intergroupe Francophone du Myélome, Blood, 109, 3489
ical models of acute myeloid leukemia, Leukemia, 33, 905
3495, doi: 10.1182/blood 2006 08 040410.
917, doi: 10.1038/s41375 018 0261 3.
71.
Touzeau, C., Dousset, C., Gouill, S. Le, Sampath, D.,
58.
Zinzani, P. L., Topp, M. S., Yuen, S. L., Rusconi, C.,
Leverson, J. D., Souers, A. J., Ma ga, S., Béné, M. C.,
Fleury, I., et al. (2016) Phase 2 study of Venetoclax plus
Moreau, P., Pellat Deceunynck, C., and Amiot M. (2014)
Rituximab or Randomized Ven plus Bendamustine+
The Bcl 2 specific BH3 mimetic ABT 199: a promising
Rituximab (BR) Versus BR in patients with Relapsed/
targeted therapy for t(11;14) multiple myeloma, Leukemia,
Refractory follicular lymphoma: interim data, Blood, 128,
28, 210 212, doi: 10.1038/leu.2013.216.
617 617, doi: 10.1182/blood.v128.22.617.617.
72.
Chan, S. M., Thomas, D., Corces Zimmerman, M. R.,
59.
Moreau, P., Chanan Khan, A., Roberts, A. W., Agarwal,
Xavy, S., Rastogi, S., Hong, W. J., Zhao, F., Medeiros, B. C.,
A. B., Facon, T., et al. (2017) Promising efficacy and
Tyvoll, D. A., and Majeti, R. (2015) Isocitrate dehydroge
acceptable safety of venetoclax plus bortezomib and dex
nase 1 and 2 mutations induce BCL 2 dependence in acute
amethasone in relapsed/refractory MM, Blood, 130, 2392
myeloid leukemia, Nat. Med.,
21,
178184,
2400, doi: 10.1182/blood 2017 06 788323.
doi: 10.1038/nm.3788.
60.
Touzeau, C., Ryan, J., Guerriero, J., Moreau, P.,
73.
Blombery, P., Thompson, E. R., Nguyen, T., Birkinshaw,
Chonghaile, T. N., Gouill, S. Le, Richardson, P.,
R. W., Gong, J. N., et al. (2020) Multiple BCL2 mutations
Anderson, K., Amiot, M., and Letai, A. (2016) BH3 pro
cooccurring with Gly101Val emerge in chronic lymphocyt
filing identifies heterogeneous dependency on Bcl 2 fami
ic leukemia progression on venetoclax, Blood, 135, 773
ly members in multiple myeloma and predicts sensitivity to
777, doi: 10.1182/blood.2019004205.
BH3 mimetics, Leukemia, 30, 761 764, doi: 10.1038/leu.
74.
Tahir, S. K., Smith, M. L., Hessler, P., Rapp, L. R., Idler,
2015.184.
K. B., Park, C. H., Leverson, J. D., and Lam, L. T. (2017)
61.
Spencer, A., Rosenberg, A. S., Jakubowiak, A., Raje, N.,
Potential mechanisms of resistance to venetoclax and
Chatterjee, M., et al. (2019) A phase 1, first in human
strategies to circumvent it, BMC Cancer,
17,
399,
study of AMG 176, a selective MCL 1 inhibitor, in patients
doi: 10.1186/s12885 017 3383 5.
with relapsed or refractory multiple myeloma, Clin.
75.
Mazumder, S., Choudhary, G. S., Al Harbi, S., and
Lymphoma Myeloma Leuk., 19, 53 54, doi: 10.1016/j.clml.
Almasan, A. (2012) Mcl 1 phosphorylation defines ABT
2019.09.081.
737 resistance that can be overcome by increased NOXA
62.
Konopleva, M., Pollyea, D. A., Potluri, J., Chyla, B.,
expression in leukemic B cells, Cancer Res., 72, 3069 3079,
Hogdal, L., et al. (2016) Efficacy and biological correlates
doi: 10.1158/0008 5472.CAN 11 4106.
of response in a phase II study of venetoclax monotherapy
76.
Konopleva, M., Milella, M., Ruvolo, P., Watts, J. C.,
in patients with acute myelogenous leukemia, Cancer
Ricciardi, M. R., et al. (2012) MEK inhibition enhances
Discov., 6, 1106 1117, doi: 10.1158/2159 8290.CD 16
ABT 737 induced leukemia cell apoptosis via prevention
0313.
of ERK activated MCL 1 induction and modulation of
63.
Lochmann, T. L., Floros, K. V., Naseri, M., Powell, K. M.,
MCL 1/BIM complex, Leukemia,
26,
778787,
Cook, W., et al. (2018) Venetoclax is effective in small cell
doi: 10.1038/leu.2011.287.
lung cancers with high BCL 2 expression, Clin. Cancer
77.
Choudhary, G. S., Al Harbi, S., Mazumder, S., Hill, B. T.,
Res., 24, 360 369, doi: 10.1158/1078 0432.CCR 17 1606.
Smith, M. R., Bodo, J., His, E. D., and Almasan, A.
64.
Wong, K. Y., and Chim, C. S. (2020) Venetoclax, borte
(2015) MCL 1 and BCL xL dependent resistance to the
zomib and S63845, an MCL1 inhibitor, in multiple myelo
BCL 2 inhibitor ABT 199 can be overcome by preventing
ma, J. Pharm. Pharmacol., 72, 728 737, doi: 10.1111/jphp.
PI3K/AKT/mTOR activation in lymphoid malignancies,
13240.
Cell Death Dis., 6, 1593, doi: 10.1038/cddis.2014.525.
65.
Yasuda, Y., Ozasa, H., Kim, Y. H., Yamazoe, M., Ajimizu, H.,
78.
Fresquet, V., Rieger, M., Carolis, C., Garc a Barchino, M. J.,
et al. (2020) MCL1 inhibition is effective against a subset of
and Martinez Climent, J. A. (2014) Acquired mutations in
small cell lung cancer with high MCL1 and low BCL XL
BCL2 family proteins conferring resistance to the BH3
expression, Cell Death Dis., 11, 1 15, doi: 10.1038/s41419
mimetic ABT 199 in lymphoma, Blood, 123, 4111 4119,
020 2379 2.
doi: 10.1182/blood 2014 03 560284.
66.
Khaw, S. L., Mérino, D., Anderson, M. A., Glaser, S. P.,
79.
Blombery, P., Anderson, M. A., Gong, J. N., Thijssen, R.,
Bouillet, P., Roberts, A. W., and Huang, D. C. S. (2014)
Birkinshaw, R. W., et al. (2019) Acquisition of the recurrent
Both leukaemic and normal peripheral B lymphoid cells
Gly101Val mutation in BCL2 confers resistance to veneto
are highly sensitive to the selective pharmacological inhibi
clax in patients with progressive chronic lymphocytic
tion of prosurvival Bcl 2 with ABT 199, Leukemia, 28,
leukemia, Cancer Discov., 9, 342 353, doi: 10.1158/2159
1207 1215, doi: 10.1038/leu.2014.1.
8290.CD 18 1119.
67.
Pham, L. V., Huang, S., Zhang, H., Zhang, J., Bell, T., et
80.
Tausch, E., Close, W., Dolnik, A., Bloehdorn, J., Chyla, B.,
al. (2018), Strategic therapeutic targeting to overcome
Bullinger, L., Döhner, H., Mertens, D., and Stilgenbauer, S.
venetoclax resistance in aggressive B cell lymphomas, Clin.
(2019) Venetoclax resistance and acquired BCL2 muta
БИОХИМИЯ том 85 вып. 10 2020
1440
СЕНИЧКИН и др.
tions in chronic lymphocytic leukemia, Haematologica,
94. Mali, R. S., Zhang, Q., DeFilippis, R., Cavazos, A.,
104, 434 437, doi: 10.3324/haematol.2019.222588.
Kuruvilla, V. M., et al. (2020) Venetoclax combines syner
81.
Ramsey, H. E., Fischer, M. A., Lee, T., Gorska, A. E.,
gistically with FLT3 inhibition to effectively target
Arrate, M. P., et al. (2018) A novel MCL1 inhibitor com
leukemic cells in FLT3 ITD+ acute myeloid leukemia
bined with venetoclax rescues venetoclax resistant acute
models, Haematologica, 244020, doi: 10.3324/haema
myelogenous leukemia, Cancer Discov., 8, 1566 1581,
tol.2019.244020.
doi: 10.1158/2159 8290.CD 18 0140.
95. Cathelin, S., Sharon, D., Subedi, A., Cojocari, D.,
82.
Lee, E. F., Harris, T. J., Tran, S., Evangelista, M.,
Phillips, D. C., et al. (2018) Combination of enasidenib
Arulananda, S., et al. (2019) BCL XL and MCL 1 are the
and venetoclax shows superior anti leukemic activity
key BCL 2 family proteins in melanoma cell survival, Cell
against IDH2 mutated AML in patient derived xenograft
Death Dis., 10, 1 14, doi: 10.1038/s41419 019 1568 3.
models, Blood, 132, 562 562, doi: 10.1182/blood 2018
83.
Khaw, S. L., Suryani, S., Evans, K., Richmond, J.,
99 119688.
Robbins, A., et al. (2016) Venetoclax responses of pediatric
96. Koch, R., Christie, A. L., Crombie, J. L., Palmer, A. C.,
ALL xenografts reveal sensitivity of MLL rearranged
Plana, D., et al. (2019) Biomarker driven strategy for
leukemia, Blood, 128, 1382 1395, doi: 10.1182/blood
MCL1 inhibition in T cell lymphomas, Blood, 133, 566
2016 03 707414.
575, doi: 10.1182/blood 2018 07 865527.
84.
Weeden, C. E., Ah Cann, C., Holik, A. Z., Pasquet, J.,
97. Nangia, V., Siddiqui, F. M., Caenepeel, S., Timonina, D.,
Garnier, J. M., Merino, D., Lessene, G., and Asselin
Bilton, S. J., et al. (2018) Exploiting MCL1 dependency
Labat, M. L. (2018) Dual inhibition of BCL XL and
with combination MEK + MCL1 inhibitors leads to induc
MCL 1 is required to induce tumour regression in lung
tion of apoptosis and tumor regression in KRAS Mutant
squamous cell carcinomas sensitive to FGFR inhibition,
non small cell lung cancer, Cancer Discov., 8, 1598 1613,
Oncogene, 37, 4475 4488, doi: 10.1038/s41388 018 0268 2.
doi: 10.1158/2159 8290.CD 18 0277.
85.
Debrincat, M. A., Josefsson, E. C., James, C., Henley, K. J.,
98. Merino, D., Whittle, J. R., Vaillant, F., Serrano, A., Gong,
Ellis, S., et al. (2012) Mcl 1 and Bcl x L coordinately reg
J. N., et al. (2017) Synergistic action of the MCL 1
ulate megakaryocyte survival, Blood, 119, 5850 5858,
inhibitor S63845 with current therapies in preclinical mod
doi: 10.1182/blood 2011 12 398834.
els of triple negative and HER2 amplified breast cancer,
86.
Chen, J., Jin, S., Abraham, V., Huang, X., Liu, B., Mitten,
Sci. Transl. Med., 9, 401, doi: 10.1126/scitranslmed.
M. J., et al. (2011) The Bcl 2/Bcl X L/Bcl w inhibitor,
aam7049.
navitoclax, enhances the activity of chemotherapeutic
99. Leverson, J. D., Phillips, D. C., Mitten, M. J., Boghaert,
agents in vitro and in vivo, Mol. Cancer Ther., 10, 2340
E. R., Diaz, D., et al. (2015) Exploiting selective BCL 2
2349, doi: 10.1158/1535 7163.MCT 11 0415.
family inhibitors to dissect cell survival dependencies and
87.
Corcoran, R. B., Cheng, K. A., Hata, A. N., Faber, A. C.,
define improved strategies for cancer therapy, Sci. Transl.
Ebi, H., et al. (2013) Synthetic lethal interaction of com
Med., 7, doi: 10.1126/scitranslmed.aaa4642.
bined BCL XL and MEK inhibition promotes tumor
100. Shoemaker, A. R., Oleksijew, A., Bauch, J., Belli, B. A.,
regressions in KRAS mutant cancer models, Cancer Cell,
Borre, T., et al. (2006) A small molecule inhibitor of Bcl
23, 121 128, doi: 10.1016/j.ccr.2012.11.007.
XL potentiates the activity of cytotoxic drugs in vitro and in
88.
Luedtke, D. A., Su, Y., Liu, S., Edwards, H., Wang, Y.,
vivo, Cancer Res., 66, 8731 8739, doi: 10.1158/0008
Lin, H., Taub, J. W., and Ge, Y. (2018) Inhibition of XPO1
5472.CAN 06 0367.
enhances cell death induced by ABT 199 in acute myeloid
101. DiNardo, C. D., Pratz, K., Pullarkat, V., Jonas, B. A.,
leukaemia via Mcl 1, J. Cell. Mol. Med., 22, 6099 6111,
Arellano, M., et al. (2019) Venetoclax combined with
doi: 10.1111/jcmm.13886.
decitabine or azacitidine in treatment naive, elderly
89.
Luedtke, D. A., Su, Y., Ma, J., Li, X., Buck, S. A., et al.
patients with acute myeloid leukemia, Blood, 133, 7 17,
(2020) Inhibition of CDK9 by voruciclib synergistically
doi: 10.1182/blood 2018 08 868752.
enhances cell death induced by the Bcl 2 selective inhibitor
102. Jin, S., Cojocari, D., Purkal, J. J., Popovic, R., Talaty, N. N.,
venetoclax in preclinical models of acute myeloid leukemi,
et al. (2020) 5 Azacitidine induces NOXA to prime AML
Signal. Transduct. Target. Ther., 5, 1 11, doi: 10.1038/
cells for venetoclax mediated apoptosis, Clin. Cancer Res.,
s41392 020 0112 3.
doi: 10.1158/1078 0432.ccr 19 1900.
90.
Cidado, J., Boiko, S., Proia, T., Ferguson, D., Criscione,
103. Pollyea, D. A., Stevens, B. M., Jones, C. L., Winters, A.,
S. W., et al. (2020) AZD4573 is a highly selective CDK9
Pei, S., et al. (2018) Venetoclax with azacitidine disrupts
inhibitor that suppresses Mcl 1 and induces apoptosis in
energy metabolism and targets leukemia stem cells in
hematologic cancer cells, Clin. Cancer Res., 26, 922 934,
patients with acute myeloid leukemia, Nat. Med., 24, 1859
doi: 10.1158/1078 0432.CCR 19 1853.
1866, doi: 10.1038/s41591 018 0233 1.
91.
Patel, V. M., Balakrishnan, K., Douglas, M., Tibbitts, T.,
104. Jain, N., Keating, M., Thompson, P., Ferrajoli, A., Burger, J.,
Xu, E. Y., et al. (2017) Duvelisib treatment is associated
et al. (2019) Ibrutinib and venetoclax for first line treat
with altered expression of apoptotic regulators that helps in
ment of CLL, N. Engl. J. Med., 380, 20952103,
sensitization of chronic lymphocytic leukemia cells to
doi: 10.1056/NEJMoa1900574.
venetoclax (ABT 199), Leukemia,
31,
18721881,
105. Tam, C. S., Anderson, M. A., Pott, C., Agarwal, R.,
doi: 10.1038/leu.2016.382.
Handunnetti, S., et al. (2018) Ibrutinib plus venetoclax for
92.
Matulis, S. M., Gupta, V. A., Nooka, A. K., Hollen, H. V.,
the treatment of mantle cell lymphoma, N. Engl. J. Med.,
Kaufman, J. L., Lonial, S., and Boise, L. H. (2016) Dexa
378, 1211 1223, doi: 10.1056/NEJMoa1715519.
methasone treatment promotes Bcl 2 dependence in mul
106. Cervantes Gomez, F., Lamothe, B., Woyach, J. A.,
tiple myeloma resulting in sensitivity to venetoclax,
Wierda, W. G., Keating, M. J., Balakrishnan, K., and
Leukemia, 30, 1086 1093, doi: 10.1038/leu.2015.350.
Gandhi, V. (2015) Pharmacological and protein profiling
93.
The, T. C., Nguyen, N. Y., Moujalled, D. M., Segal, D.,
suggests venetoclax (ABT 199) as optimal partner with
Pomilio, G., et al. (2018) Enhancing venetoclax activity in
ibrutinib in chronic lymphocytic leukemia, Clin. Cancer
acute myeloid leukemia by co targeting MCL1, Leukemia,
Res., 21, 3705 3715, doi: 10.1158/1078 0432.CCR 14
32, 303 312, doi: 10.1038/leu.2017.243.
2809.
БИОХИМИЯ том 85 вып. 10 2020
ТАРГЕТИРОВАНИЕ Bcl 2 БЕЛКОВ
1441
TARGETING Bcl 2 FAMILY PROTEINS: WHAT, WHERE, WHEN?
Review
V. V. Senichkin1, N. V. Pervushin1, A. P. Zuev1, B. Zhivotovsky1,2, and G. S. Kopeina1*
1 Faculty of Basic Medicine, Lomonosov Moscow State University, 119991 Moscow, Russia; E3mail: lirroster@gmail.com
2 Institute of Environmental Medicine, Karolinska Institutet, 17177 Stockholm, Sweden
Received July 15, 2020
Revised July 15, 2020
Accepted August 8, 2020
Proteins of the Bcl 2 family are known as regulators of apoptosis, one of the most studied forms of programmed cell
death. The Bcl 2 protein family is represented by both pro and antiapoptotic members. Antiapoptotic proteins are
often exploited by tumor cells to avoid their death, thus playing an important role in carcinogenesis and in acquisition
of resistance to various therapeutic agents. Therefore, antiapoptotic proteins represent attractive targets for cancer
therapy. A detailed investigation of interactions between Bcl 2 family proteins resulted in the development of highly
selective inhibitors of individual antiapoptotic members. These agents are currently being actively studied at the pre
clinical and clinical stages and represent a promising therapeutic strategy, which is highlighted by approval of veneto
clax, a selective inhibitor of Bcl 2, for medical use. Meanwhile, inhibition of antiapoptotic Bcl 2 family proteins has
significant therapeutic potential that is yet to be revealed. In the coming era of precision medicine, a detailed study of
the mechanisms responsible for the sensitivity or resistance of tumor cells to various therapeutic agents, as well as the
search for the most effective combinations, is of great importance. Here, we discuss mechanisms of how the Bcl 2
family proteins function, principles of their inhibition by small molecules, success of this approach in cancer therapy,
and, eventually, biochemical features that can be exploited to improve the use of Bcl 2 family inhibitors as anticancer
drugs.
Keywords: apoptosis, Bcl 2 family, cancer therapy, BH3 mimetics
БИОХИМИЯ том 85 вып. 10 2020