БИОХИМИЯ, 2020, том 85, вып. 10, с. 1474 - 1488
УДК 577.29
АКТИВНЫЕ ФОРМЫ КИСЛОРОДА И АНТИОКСИДАНТЫ
В КАНЦЕРОГЕНЕЗЕ И ТЕРАПИИ ОПУХОЛЕЙ
Обзор
© 2020
С.М. Вострикова1,2, А.Б. Гринев2, В.Г. Гогвадзе1,3*
1 Московский государственный университет имени М.В. Ломоносова, факультет фундаментальной медицины,
119991 Москва, Россия; электронная почта: vlad_gogvadze@rambler.ru
2 Первый московский государственный медицинский университет им. И.М. Сеченова
(Сеченовский университет) 119991 Москва, Россия
3 Institute of Environmental Medicine, Division of Toxicology, Karolinska Institutet, Stockholm, 17177 Sweden
Поступила в редакцию 14.07.2020
После доработки 07.08.2020
Принята к публикации 07.08.2020
Тщательно регулируемый баланс между образованием активных форм кислорода (АФК) и их утилизацией
лежит в основе нормального функционирования организма. АФК играют важную роль в регуляции большо%
го числа метаболических процессов, однако превышение их уровня в организме чревато развитием разного
рода заболеваний, в частности, онкологических, что происходит вследствие вызванных АФК мутаций ДНК.
В опухолях повышенный фон кислородных радикалов способствует процессам пролиферации и метастази%
рования. С другой стороны, высокий уровень АФК способен вызывать гибель клеток; это свойство АФК ис%
пользуется в противоопухолевой терапии. Водо% и жирорастворимые антиоксиданты, а также антиоксидант%
ные ферментные системы подавляют появление АФК, однако использовать их следует с осторожностью.
Антиоксиданты могут подавлять зависимую от АФК пролиферацию и метастазирование, но в то же время в
процессе противоопухолевой терапии они будут ингибировать гибель клеток опухоли в случае использова%
ния терапевтических средств, стимулирующих окислительный стресс. Данные по действию антиоксидантов
на гибель опухолевых клеток, а также относительно применения антиоксидантов в качестве диетических
добавок во время противоопухолевой терапии достаточно противоречивы. В обзоре рассмотрены механиз%
мы, согласно которым антиоксиданты могут действовать на опухолевые и здоровые клетки.
КЛЮЧЕВЫЕ СЛОВА: рак, антиоксиданты, канцерогенез, активные формы кислорода, программируемая
гибель клеток, митохондрии.
DOI: 10.31857/S0320972520100139
ВВЕДЕНИЕ
тканях избавляться от клеток, выполнивших
свои функции, а также дефектных и потенциаль%
Развитие опухоли - многоступенчатый про%
но опасных клеток. Нарушение этого процесса
цесс, характеризующийся определенными нару%
чревато развитием опухолей. Одним из наиболее
шениями клеточного метаболизма. Hanahan и
изученных форм ПГК является апоптоз, препят%
Weinberg [1] выделяют 10 физиологических приз%
ствующий накоплению клеток с генетическими
наков, отличающих опухолевую клетку от нор%
отклонениями, что предотвращает опухолевую
мальной. Одним из основных признаков являет%
трансформацию. Стимуляция апоптоза в опухо%
ся подавление процесса программируемой гибе%
левых клетках является действенной стратегией
ли клеток (ПГК), позволяющего в нормальных
противоопухолевой терапии. Помимо апоптоза в
настоящее время известен целый ряд различных
видов ПГК, различающихся по биохимическим
Принятые сокращения: АФК - активные формы
кислорода; SОD - супероксиддисмутаза; GPx - глутати%
и морфологическим признакам - некроптоз,
онпероксидаза; NF%κB - ядерный фактор каппа%Би;
ферроптоз, аутофагическая гибель клетки, анои%
TNF%α - фактор некроза опухолей; ПГК - программируе% кис [2]. В подавляющем большинстве из них
мая гибель клеток; NOX - NADPH%оксидаза; МАО - мо% важную роль в их стимуляции и протекании иг%
ноаминоксидаза; HIF - фактор, индуцированный гипок%
сией; MPT - индукция неспецифической проницаемости
рают активные формы кислорода (АФК).
митохондриальной мембраны (mitochondrial permeability
Действие целого ряда противоопухолевых пре%
transition).
паратов основано на стимуляции в клетках окис%
* Адресат для корреспонденции.
лительного стресса и генерации АФК в количе%
1474
АНТИОКСИДАНТЫ И ТЕРАПИЯ ОПУХОЛЕЙ
1475
стве, превышающем способности защитных
пи. Однако присутствие в цепи переноса элект%
систем клетки. Стимуляция окислительного
ронов нескольких окислительно%восстанови%
стресса способна инициировать различные фор%
тельных центров (например, в комплексе I и III)
мы гибели клеток, в частности, апоптоз, что ве%
(рис. 1, а) ведет к «утечке» электронов с образо%
дет к уничтожению опухолевых клеток.
ванием супероксид радикала, который можно
Следует отметить, что АФК не только участ%
рассматривать как предшественник большин%
вуют в стимуляции апоптоза, но и являются од%
ства АФК. Такое одноэлектронное восстановле%
ним из факторов, способствующим возникнове%
ние кислорода термодинамически благоприят%
нию опухолей. АФК канцерогенны по своей
но для большинства митохондриальных оксидо%
природе [3]. Окислительное повреждение кле%
редуктаз [4]. В дополнение к дыхательной цепи,
точной ДНК способно вызывать мутации и, сле%
источником АФК, в частности перекиси водо%
довательно, играть важную роль в инициации и
рода (H2O2), служит моноаминоксидаза (МАО)
прогрессии многостадийного процесса канце%
(рис. 1, б), флавопротеин, локализованный на
рогенеза. Не следует забывать, что на физиоло%
внешней мембране митохондрий. МАО катали%
гическом уровне АФК играют роль регуляторов
зирует окислительное дезаминирование первич%
клеточного метаболизма. Образование АФК в
ных ароматических аминов наряду с длинноце%
дыхательной цепи митохондрий, в реакциях с
почечными диаминами и третичными цикли%
участием циклооксигеназ, NADPH%оксидаз
ческими аминами [5]. Поскольку H2O2 легко
(NOX), ксантиноксидаз и липоксигеназ создает
проходит через митохондриальные мембраны,
определённый фон АФК и обеспечивает работу
МАО может способствовать повышению концент%
важнейших внутриклеточных процессов, вклю%
рации АФК в митохондриальном матриксе и
чая пролиферацию и дифференциацию.
цитозоле.
Накоплению АФК препятствуют антиокси%
Источником АФК могут быть не только ми%
дантные системы клетки, а также водо% и жиро%
тохондрии, но и NADPH%оксидазы - фермента%
растворимые антиоксиданты, которые способ%
тивный комплекс, осуществляющий реакцию
ны, с одной стороны, подавлять пролиферацию
окисления NADPH до NADP+ с переносом
раковых клеток, а с другой - ингибировать их
электронов с внутренней стороны цитоплазма%
гибель в случае использования терапевтических
тической мембраны на внешнюю, где из моле%
средств, стимулирующих окислительный стресс.
кулярного кислорода среды образуется суперок%
Данные по действию антиоксидантов на гибель
сид радикал (рис. 1, в) [6]. Один из членов се%
опухолевых клеток, а также относительно при%
мейства - NOX4 - генерирует H2O2, способную
менения антиоксидантов в качестве диетичес%
проникать через мембраны [7]. Стимуляция
ких добавок во время противоопухолевой тера%
экспрессии NOX4 способствует развитию ост%
пии достаточно противоречивы. В настоящем
рой почечной недостаточности [8], что приво%
обзоре рассмотрены механизмы, согласно кото%
дит к диабетической нефропатии и почечной
рым антиоксиданты могут действовать на опу%
карциноме. В основе этих нарушений лежит
холевые и здоровые клетки.
один из видов ПГК, некроптоз - запрограмми%
рованный некроз.
Следует отметить, что митохондрии являют%
АКТИВНЫЕ ФОРМЫ КИСЛОРОДА
ся не только источником АФК, но также их
И ИХ РОЛЬ В ФИЗИОЛОГИИ
чувствительной мишенью. АФК, продуцируе%
И ПАТОЛОГИИ ОРГАНИЗМА
мые митохондриями, могут окислять белки и
вызывать перекисное окисление липидов, нару%
АФК вовлечены в широкий спектр патоло%
шая барьерные свойства биологических мемб%
гий, включая злокачественные новообразова%
ран. Одна из мишеней АФК - митохондриаль%
ния, сахарный диабет II типа, атеросклероз,
ная ДНК (мтДНК), которая кодирует несколько
хронические воспалительные процессы, нару%
ферментов дыхательной цепи митохондрий. В
шения, вызванные ишемией и последующей ре%
условиях повышенного образования АФК
перфузией, а также нейродегенеративные забо%
(окислительного стресса) уровень окислитель%
левания. Клетка не только подвергается воздей%
но%модифицированных оснований в мтДНК в
ствию АФК извне, но и сама продуцирует ради%
10-20 раз выше, чем в ядерной ДНК [9]. Пов%
калы кислорода. Одним из основных источни%
реждение мтДНК способно приводить к накоп%
ков АФК в клетке являются митохондрии.
лению повреждений дыхательной цепи и, как
Обычное четырех электронное восстановление
следствие, к деэнергизации и гибели клетки.
О2 в дыхательной цепи, в результате чего образу%
Неконтролируемое накопление АФК в клет%
ются две молекулы воды, катализируется комп%
ке сдерживается присутствием водо% и жирора%
лексом IV митохондриальной дыхательной це%
створимых антиоксидантов (глутатион, витами%
БИОХИМИЯ том 85 вып. 10 2020
1476
ВОСТРИКОВА и др.
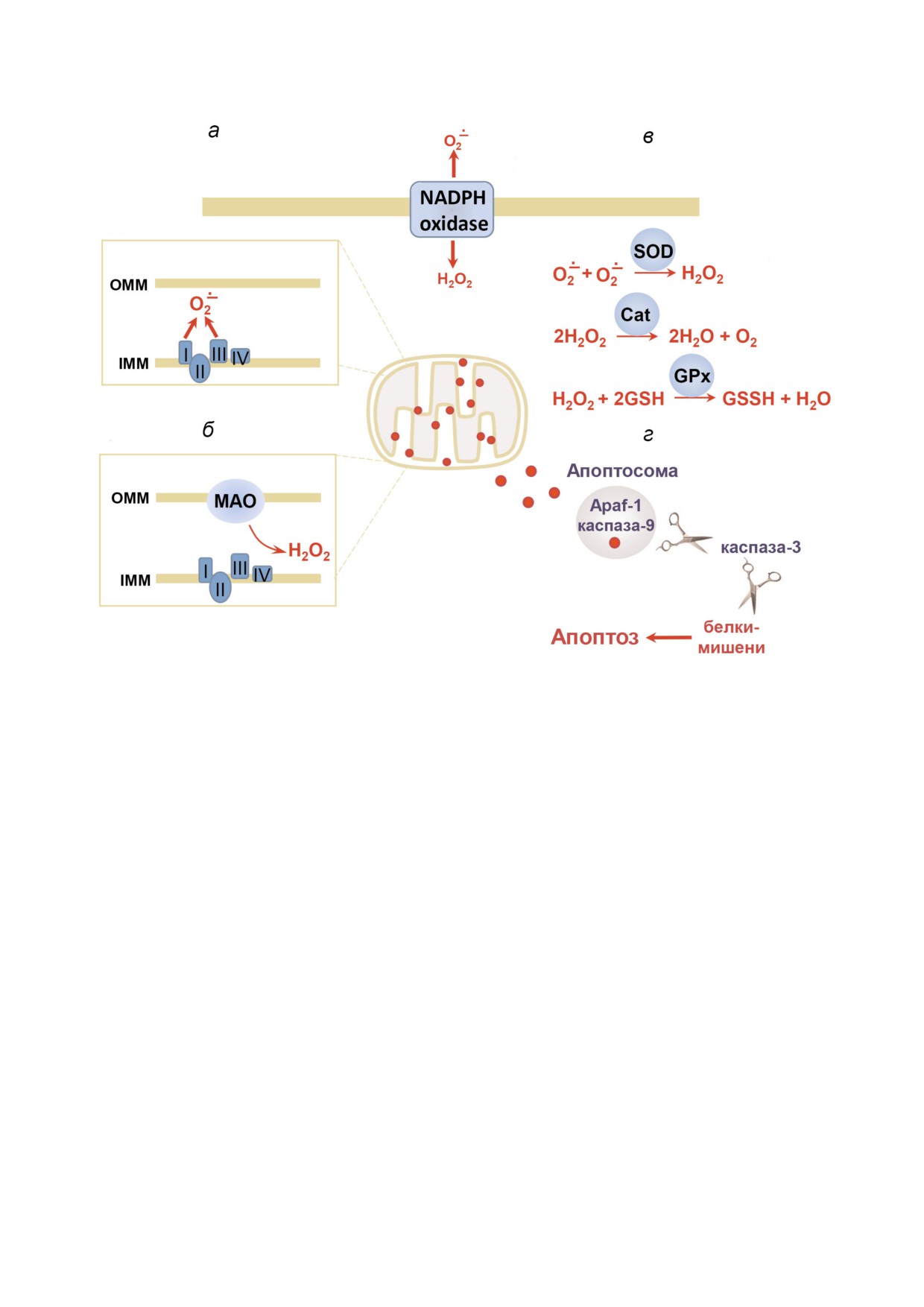
Рис. 1. Основными источниками активных форм кислорода (АФК) в клетке являются дыхательная цепь митохондрий на
внутренней митохондриальной мембране (а); моноаминоксидаза (MAO) на внешней митохондриальной мембране (б);
NADPH оксидаза на плазматической мембране (в); образование АФК сдерживается антиоксидантными системами клет%
ки - каталазой (Cat), супероксиддисмутазой (SOD), глутатионпероксидазой (GPx) (г); АФК стимулируют пермеабилиза%
цию внешней мембраны митохондрий, запуская митохондриальный путь апоптоза (д); IMM - внутренняя мембрана ми%
тохондрий, OMM - внешняя мембрана митохондрий
ны A, C и E и флавоноиды), а также работой
SOD) на раннем этапе развития не проявлялись
ферментативных систем детоксикации актив%
сколь либо выраженные аномалии, но при этом
ных форм кислорода. Так, дисмутация суперок%
возрастал риск развития гепатоцеллюлярной
сидных радикалов ферментом супероксиддис%
карциномы из%за усиленной пролиферации и
мутазой приводит к образованию H2O2, которая
повреждения жизненно важных макромолекул
может впоследствии утилизироваться фермен%
вследствие повышенного содержания АФК [10].
том каталазой или зависимой от глутатиона
Отсутствие Mn%SOD у мышей способствует раз%
ферментной системой, включающей глутатион%
витию кардиомиопатии и метаболического аци%
пероксидазу и глутатионредуктазу (рис. 1, г). В
доза, накоплению липидов в скелетной мышце
присутствии металлов переменной валентности
и печени, что, в конечном итоге, вызывает ле%
H2O2 может разлагаться в реакции Хабе%
тальный исход вскоре после рождения [11]. Эти
ра-Вейсса с образованием высоко реактивного
данные подчеркивают важнейшую роль Mn%
и токсичного гидроксильного радикала.
SOD в регуляции окислительного стресса и сви%
Дисбаланс между образованием АФК и уров%
детельствуют о способности АФК при высоких
нем антиоксидантной защиты способствует раз%
концентрациях вызывать серьезные поврежде%
витию таких патологий как атеросклероз, диа%
ния в клетке.
бет, фиброз легких, артрит, а также болезней
В физиологических концентрациях АФК иг%
Альцгеймера, Паркинсона, Хантингтона [6]. В
рают регуляторную роль в клеточных метаболи%
частности, у мышей с дефицитом медь% и цинк%
ческих процессах, активируя различные фер%
содержащей супероксиддисмутазы (Cu%Zn%
ментативные каскады и транскрипционные
БИОХИМИЯ том 85 вып. 10 2020
АНТИОКСИДАНТЫ И ТЕРАПИЯ ОПУХОЛЕЙ
1477
факторы. Несмотря на то, что АФК являются
Причины повышенного содержания АФК в
побочными продуктами дыхания, обладающи%
клетках опухоли достаточно разнообразны. В
ми токсичными свойствами и способствующи%
дополнение к АФК, возникающим в результате
ми развитию многих заболеваний, они вовлече%
утечки электронов из дыхательной цепи мито%
ны в процессы регуляции клеточного метабо%
хондрий, образованию АФК в клетке способ%
лизма, в частности, пролиферации клеток. Об%
ствует экспрессия известных онкогенов, таких
разование АФК происходит при стимуляции
как KRAS и MYC [18, 19]. В качестве белков, свя%
клеток цитокинами, такими как трансформиру%
зывающих GTP, HRas, KRas и NRas участвуют в
ющий фактор роста - β1 [12], интерлейкин%1 и
процессе внутриклеточной сигнализации. Од%
фактор некроза опухолей [13]. Это показывает,
нако мутированный KRAS, обнаруживаемый в
что продукция в цитозоле АФК является регули%
30% опухолей, постоянно активирован. Воздей%
руемым процессом, и АФК служат в качестве
ствуя на NADPH%оксидазу, KRas стимулирует
сигнальных молекул, участвующих в многооб%
образование АФК, что обеспечивает усиленную
разных клеточных процессах, включая передачу
пролиферацию и выживание опухолевых кле%
сигналов фактора роста, воспаление, вовлече%
ток [20].
ние интегринов, адгезию к внеклеточному мат%
Стимуляция АФК в клетке способствует пе%
риксу. Подавление образования АФК приводит
репрограммированию ее метаболизма. Большин%
к блокировке передачи внутриклеточных сигна%
ство солидных опухолей развиваются в условиях
лов [14].
гипоксии - пониженного содержания кислоро%
Процессы образования и детоксикации АФК
да. Это приводит к стабилизации фактора, инду%
сбалансированы в тканях организма. Так, белок
цированного гипоксией (HIF, hypoxia%inducible
OxyR, экспрессируемый в Salmonella typhimurium
factor), необходимого для адаптации к новым
и Escherichia coli, активируемый в результате
условиям [21]. Так, в условиях гипоксии HIF ак%
окислительной модификации, регулирует, в
тивирует гены, обеспечивающие выживание
свою очередь, транскрипцию генов, отвечаю%
клеток злокачественной опухоли, а также гены,
щих за предотвращение окислительного стресса
регулирующие метаболизм глюкозы, ангиогенез
[15]. Нарушение этого баланса может вызывать
(например, фактор роста эндотелия сосудов) и
различные формы патологий. Неконтролируе%
опухолевую инвазию. Следует отметить, что HIF
мое умеренное повышение содержания АФК
может стабилизироваться и под действием АФК.
может привести к временной или постоянной
Так, в условиях гипоксии комплекс III дыха%
задержке роста, т.е. к репликативному старе%
тельной цепи митохондрий продуцирует избы%
нию - явлению, связанному с утратой клетками
точное количество супероксид радикала, внося
способности к делению. Тогда как значительное
вклад в стабилизацию HIF [22].
возрастание уровня АФК в клетке может при%
Наряду с повышенной продукцией АФК
вести к гибели клетки путем аутофагии, апопто%
опухолевыми клетками, для них также характер%
за, некроптоза или некроза [16].
но увеличение активности антиоксидантных
ферментов, что позволяет клеткам избегать ги%
бели, вызванной избытком АФК, в то же время
АФК И РАК
поддерживая уровень радикалов, способствую%
щий пролиферации и метастазированию [23].
АФК канцерогенны по своей природе и игра%
Исследователями была отмечена стимуляция
ют ведущую роль в развитии злокачественных
экспрессии таких антиоксидантных ферментов,
новообразований [17]. Многочисленные канце%
как SOD, глутатионпероксидаза и глутатион%S%
рогены способны генерировать АФК в процессе
трансфераза в митохондриях клеток колорек%
их метаболизирования. Последующее окисли%
тального рака человека в сравнении с неопухо%
тельное повреждение ядерной и митохондриаль%
левыми клетками [24]. При изучении клеток
ной ДНК приводит к мутациям, что играет важ%
астроцитомы, глиальной опухоли головного
ную роль в инициации и прогрессии канцероге%
мозга было обнаружено увеличенное содержа%
неза [3]. Вызванные АФК повреждения ДНК, та%
ние MnSOD в клетках глиобластомы III и IV
кие как модификация оснований, нарушение
степени злокачественности [25]. В то же время в
нуклеотидной последовательности ДНК, непра%
клетках астроцитомы II степени злокачествен%
вильное кодирование, дупликация генов и акти%
ности не наблюдалось повышения содержания
вация онкогенов, вовлечены в этиологию раз%
этого фермента, это свидетельствует о том, что с
личных видов рака. Способность АФК воздей%
увеличением степени злокачественности может
ствовать на основные метаболические процессы,
увеличивается как уровень окислительного
такие как пролиферация, апоптоз, старение,
стресса в клетках, так и соответствующий уро%
косвенно влияет на процессы малигнизации.
вень защиты. Интересно отметить, что стимуля%
БИОХИМИЯ том 85 вып. 10 2020
1478
ВОСТРИКОВА и др.
ция экспрессии MnSOD подавляла рост опухо%
жащие селен соединения, воздействуют на C%
ли путем снижения содержания HIF%1 и факто%
концевой домен, модификация которого приво%
ра роста эндотелия сосудов
[26]. Помимо
дит к снижению ферментативной активности
MnSOD, увеличение содержания SOD наблюда%
PKC [35]. Таким образом, антиоксиданты спо%
лось в клетках карциномы яичников [27]. В до%
собны снизить активность PKC в опухолевых
полнение к этому было зафиксировано повы%
клетках, что может сдерживать их пролифера%
шенное содержание антиоксиданта глутатиона,
цию и дальнейшее развитие опухоли. Предрас%
что лежит в основе резистентности клеток кар%
положенность к неконтролируемому делению
циномы яичников к цисплатину и таксану, сое%
клеток обусловлена активацией транскрипци%
динениям, применяемым в терапии этих опухо%
онного фактора c%Myc, что подавлялось добав%
лей [28].
лением антиоксидантов аскорбиновой кислоты
Важно отметить, что в геноме клеток некото%
и митохондриально%направленного витамина E
рых раковых опухолей могут быть мутации, по%
[36]. Антиоксидант N%ацетил%L%цистеин (NAC)
вышающие антиоксидантную защиту клетки,
подавлял развитие привитой B%клеточной лим%
что приводит к снижению количества АФК, и,
фомы, экспрессирующей c%Myc, при этом сни%
соответственно, к угнетению апоптоза. Так, бы%
жался и уровень HIF, что говорит о функцио%
ла обнаружена корреляция между наличием оп%
нальной взаимосвязи этих транскрипционных
ределенных аллелей в нескольких «антиоксидант%
факторов. Действуя согласованно, HIF и c%Myc
ных» генах, регулирующих метаболизм селена и
способны «перепрограммировать» метаболизм,
витамина E, и высоким риском развития рака
синтез белка и клеточный цикл клетки, реализуя
простаты [29]. Двухаллельная инактивация гена
ее адаптационный ответ к пониженному содер%
KEAP1, часто наблюдаемая в клетках немелко%
жанию кислорода [36, 37].
клеточного рака легких (НМРЛ), приводит к
В условиях гипоксии отмечается активация
конститутивной экспрессии ядерного фактора
транскрипционного фактора NF%kB, регулиру%
Nrf2 (nuclear factor erythroid%2 related factor 2),
ющего экспрессию генов, отвечающих за кле%
ответственного за содержание антиоксидантных
точную пролиферацию, миграцию и апоптоз
белков, защищающих клетку от окислительного
[38]. Активация NF%kB в условиях гипоксии за%
стресса [30].
висит от АФК, а добавление антиоксиданта
Повышенное образование АФК не только
NAC подавляет образование свободных радика%
лежит в основе мутагенеза, но и способствует
лов и блокирует активацию этого фактора [22].
клеточной пролиферации и последующей опу%
Аналогичным образом обработка фибробластов
холевой инвазии. Поэтому можно предполо%
с онкогенным Ras антиоксидантом NAC приво%
жить, что применение антиоксидантов позволи%
дит к снижению митотической активности этих
ло бы ограничить рост опухоли. Действительно,
клеток [18].
как выяснилось, стимуляция экспрессии супер%
Неоднократно была отмечена способность
оксиддисмутазы способна подавлять пролифе%
опухолевых клеток к усиленной пролиферации,
рацию как минимум 13 типов опухолей [31]. В
в основе которой лежала реализация пути, конт%
клетках НМРЛ А549, обладающий антиоксида%
ролирующего активность белка ретинобласто%
нтными свойствами куркумин, подавлял проли%
мы (pRb) [39]. В норме данный белок ограничи%
ферацию, а также повышал содержание SOD и
вает клеточную пролиферацию, связываясь с
гамма%глутамилцистеин синтетазы, фермента,
транскрипционным фактором E2F и ингибируя
участвующего в синтезе глутатиона [32]. АФК
его, в результате чего pRb приостанавливает
воздействуют на клеточную пролиферацию раз%
репликацию ДНК и не дает клетке перейти в S%
ными путями, используя различные мишени.
фазу клеточного цикла [40]. В случае фосфори%
Так, повышенная каталитическая активность
лирования pRb он становится неактивен, и
протеинкиназы С (PKC) обеспечивает рост опу%
клетка переходит из G1 в фазу S [41]. При онко%
холи и дальнейшую инвазию [33]. Некоторые
генезе компоненты Rb%E2F пути часто модифи%
изоформы PKC имеют структурные особеннос%
цируются, в ходе чего стимулируется неконтро%
ти, которые делают их восприимчивыми к окис%
лируемая клеточная пролиферация. Мутации
лительным модификациям. N%концевая регуля%
гена, кодирующего pRb, выполняющего функ%
торная часть легко окисляется перекисью, в ре%
ции супрессора опухолей, либо компонентов,
зультате чего нарушается ее аутоингибирующая
регулирующих путь CDK%Rb%E2F, обнаружены
функция и фермент активируется. Это происхо%
практически во всех опухолях человека. В ис%
дит в определенном диапазоне концентраций
следовании влияния природного антиоксидан%
АФК, поскольку избыток АФК ведет к инакти%
та, полученного из экстракта шпината, на клет%
вации фермента [34]. Антиоксиданты, такие как
ки рака предстательной железы была обнаруже%
витамин E, куркумин, полифенольные и содер%
на задержка клеточного цикла в G1%фазе [42].
БИОХИМИЯ том 85 вып. 10 2020
АНТИОКСИДАНТЫ И ТЕРАПИЯ ОПУХОЛЕЙ
1479
Более того, в клетках была снижена экспрессия
МЕХАНИЗМЫ АПОПТОЗА
E2F, а также наблюдалось пониженное содержа%
ние фосфорилированной формы pRb. В недав%
Различают два пути индукции апоптоза: ре%
нем исследовании было изучено влияние анти%
цептор%зависимый сигнальный путь (внешний)
оксидантa эпигаллокатехин%3%галлата (относит%
и митохондриальный (внутренний) [48]. Внеш%
ся к группе флавоноидов), содержащемся в зе%
ний путь реализуется с участием рецепторов
леном чае, на клетки миелоидного лейкоза, в
клеточной смерти. Внутренний путь включает в
ходе чего также наблюдали снижение клеточной
себя пермеабилизацию внешней митохондри%
пролиферации наряду с повышенной экспрес%
альной мембраны с последующим выходом ци%
сией pRb и ингибированием связывания E2F с
тохрома с и других белков из межмембранного
ДНК [43].
пространства митохондрий. Оказавшись в цито%
Нельзя не отметить, что использование ан%
золе, цитохром с взаимодействует в присутствии
тиоксидантов для подавления роста опухоли
dATP с его адаптерной молекулой, фактором,
следует проводить крайне осторожно, посколь%
активирующим апоптотические протеазы (Apaf%
ку зачастую антиоксиданты способны, напро%
1, apoptotic protease activating factor%1), что при%
тив, стимулировать рост опухоли. Так, на мы%
водит к образованию комплекса апоптосомы, в
шиных моделях рака легких, вызванного
которой происходит процессинг и активация
экспрессией BRAF и KRAS, добавка к рациону
каспазы%9. Активная каспаза%9, в свою очередь,
антиоксидантов NAC и витамина E значительно
расщепляет и активирует каспазу%3 и каспазу%7.
стимулировала прогрессию опухоли и снижала
Следовательно, пермеабилизация внешней
выживаемость. Как и ожидалось, антиоксидан%
мембраны митохондрий является решающим
ты снижали содержание АФК и повреждение
событием индукции митохондриального пути
ДНК, но помимо этого они снижали экспрес%
апоптоза (рис. 1, д).
сию р53 [44]. Причем инактивация р53 имела та%
Митохондрии могут участвовать и во внеш%
кие же последствия, как и использование анти%
нем пути активации гибели клеток. Так, каспа%
оксидантов. По мнению авторов, антиоксидан%
за%8 способна расщеплять не только каспазу%3,
ты могут способствовать росту опухоли на ран%
но и цитозольный белок Bid. Усеченная форма
них стадиях, либо даже в предраковом состоя%
этого белка tBid (truncated Bid) способствует
нии у групп с определенной степенью риска, в
олигомеризации белков Bax или Bak и встраива%
частности, у курильщиков или пациентов с за%
нию их во внешнюю мембрану митохондрий с
болеванием легких. Антиоксиданты не только
образованием неспецифической поры, через
способствуют росту опухоли, но и стимулируют
которую, как сказано выше, белки из межмемб%
процессы метастазирования. Это происходит
ранного пространства митохондрий выходят в
вследствие стабилизации транскрипционного
цитозоль. Антиапоптотические белки семейства
фактора BACH1, активирующего транскрип%
Bcl%2 на уровне митохондрий способны связы%
цию гексокиназы II и GAPDH, что повышает
вать проапоптотические, блокируя образование
вклад гликолиза в энергетику клетки и стимули%
поры, и, соответственно, индукцию апопто%
рует процесс зависимого от гликолиза метаста%
за [49].
зирования [45]. Ведущую роль в этом процессе
В ряде случаев выход цитохрома с происхо%
играет белок Nrf2, активирующий метастазиро%
дит по пути, независимому от белков Bax или
вание путем подавления деградации BACH1
Bak [50]. Пермеабилизация может происходить
[46].
вследствие индукции так называемой неспеци%
Таким образом, повышенное содержание
фической проницаемости митохондриальной
АФК в клетках опухоли способствует не только
мембраны (mitochondrial plermeability transition,
стабильной клеточной пролиферации и после%
MPT) вследствие открытия неспецифической
дующей опухолевой инвазии [47], но и приоб%
поры во внутренней мембране митохондрий
ретению устойчивости этих клеток к химиоте%
[51]. Открытие сопровождается падением мемб%
рапевтическим препаратам, предполагающим
ранного потенциала, неконтролируемым пос%
их элиминацию посредством стимуляции окис%
туплением воды и растворенных веществ в мат%
лительного стресса. Антиоксиданты можно рас%
рикс митохондрий, что ведет к набуханию орга%
сматривать в качестве агентов, способных сни%
нелл. Вследствие набухания внутренняя мемб%
жать интенсивность пролиферативных сигна%
рана расправляется, вызывая разрыв внешней
лов в опухолевых клетках. Однако если защит%
мембраны и выход белков из межмембранного
ные системы не справляются, а образование
пространства в цитозоль. Этот механизм перме%
АФК происходит слишком интенсивно, это мо%
абилизации внешней митохондриальной мемб%
жет привести к гибели клеток, в частности к
раны более характерен для некротической гибе%
апоптозу.
ли клеток, однако в ряде случаев наблюдается и
БИОХИМИЯ том 85 вып. 10 2020
1480
ВОСТРИКОВА и др.
при апоптозе, в частности, когда пермеабилиза%
(рис. 2, б). Кроме того, АФК способны окислять
ции подвергается небольшая субпопуляция ми%
кардиолипин, связывающий цитохром с
тохондрий, находящихся в зонах повышенной
(рис. 2, в), что не только увеличивает пул сво%
концентрации ионов кальция (например, в не%
бодного цитохрома с [54], но и способствует вы%
посредственной близости от эндоплазматичес%
ходу проапоптотических факторов из митохон%
кого ретикулума), в то время как большая их
дрий [55].
часть остается интактной.
АФК могут также образовываться и в про%
Таким образом, сохраняя интактность мито%
цессе апоптоза, что в данном случае является не
хондрий, можно предотвратить развитие гибели
причиной, а следствием индукции гибели кле%
клеток, тогда как воздействие на митохондрии с
ток. Так, выход цитохрома с приводит к наруше%
целью пермеабилизации внешней митохондри%
нию работы дыхательной цепи, что стимулирует
альной мембраны может стимулировать клеточ%
утечку электронов с образованием супероксид
ную гибель.
радикала [56]. Кроме того, в качестве проокси%
данта может выступать сам цитохром с, способ%
ный окислять связанный с ним кардиолипин во
УЧАСТИЕ АФК В ГИБЕЛИ КЛЕТКИ
внутренней митохондриальной мембране [54].
Окисление катализируется благодаря перокси%
Как отмечалось выше, ключевое событие
дазной активности цитохрома с. Образование
митохондриального пути апоптоза - выход ци%
АФК происходит и при стимуляции внешнего
тохрома с из митохондрий - может быть опосре%
пути апоптоза воздействием на TNF%рецепторы
дован как проапоптотическими белками семей%
для формирования сигнала, индуцирующего
ства Bcl%2, так и открытием неспецифической
апоптоз [57]. Одним из объяснений этому слу%
поры во внутренней митохондриальной мемб%
жит расщепление каспазами протеинкиназы δ и
ране. АФК способны стимулировать оба из этих
последующая активация NADPH оксидазного
путей. Так, АФК способствуют открытию неспе%
комплекса (NOX4) [58]. Еще одним источником
цифической поры во внутренней мембране ми%
АФК в митохондриях апоптотических клеток
тохондрий вследствие окисления тиоловых
является белок p66Shs, окислительно%восстано%
групп переносчика адениновых нуклеотидов,
вительный фермент, который использует вос%
одного из структурных компонентов поры [52].
становительные эквиваленты, полученные из
Последующее набухание органелл и разрыв
митохондриальной цепи переноса электронов в
внешней митохондриальной мембраны приво%
результате окисления цитохрома с с образовани%
дят к выходу проапоптотических факторов
ем H2O2 в межмембранном пространстве [59].
(рис. 2, а). С другой стороны, АФК вызывают
Частично этот фермент локализован в митохон%
образование дисульфидных мостиков между мо%
дриях, где образует комплекс с митохондриаль%
номерами Bax, что облегчает его встраивание во
ным Hsp70. При индукции апоптоза диссоциа%
внешнюю мембрану с образованием поры [53]
ция этого комплекса сопровождается высво%
бождением мономерного p66Shc и его взаимо%
действие с цитохромом с ведет к образованию
перекиси водорода. Редокс%дефектные мутанты
p66Shc не способны стимулировать образование
митохондриальных АФК и повреждение мито%
хондрий in vitro или опосредовать митохондри%
альный апоптоз in vivo. В подобных ситуациях
образование АФК служит своеобразной петлей
амплификации, ускоряя гибель клетки.
Регулятором уровня АФК в клетке косвенно
является транскрипционный фактор р53. Он не
только отвечает за индукцию апоптоза, но и за%
щищает геном от АФК. К примеру, одной из ми%
шеней p53 является ген глютаминазы, которая
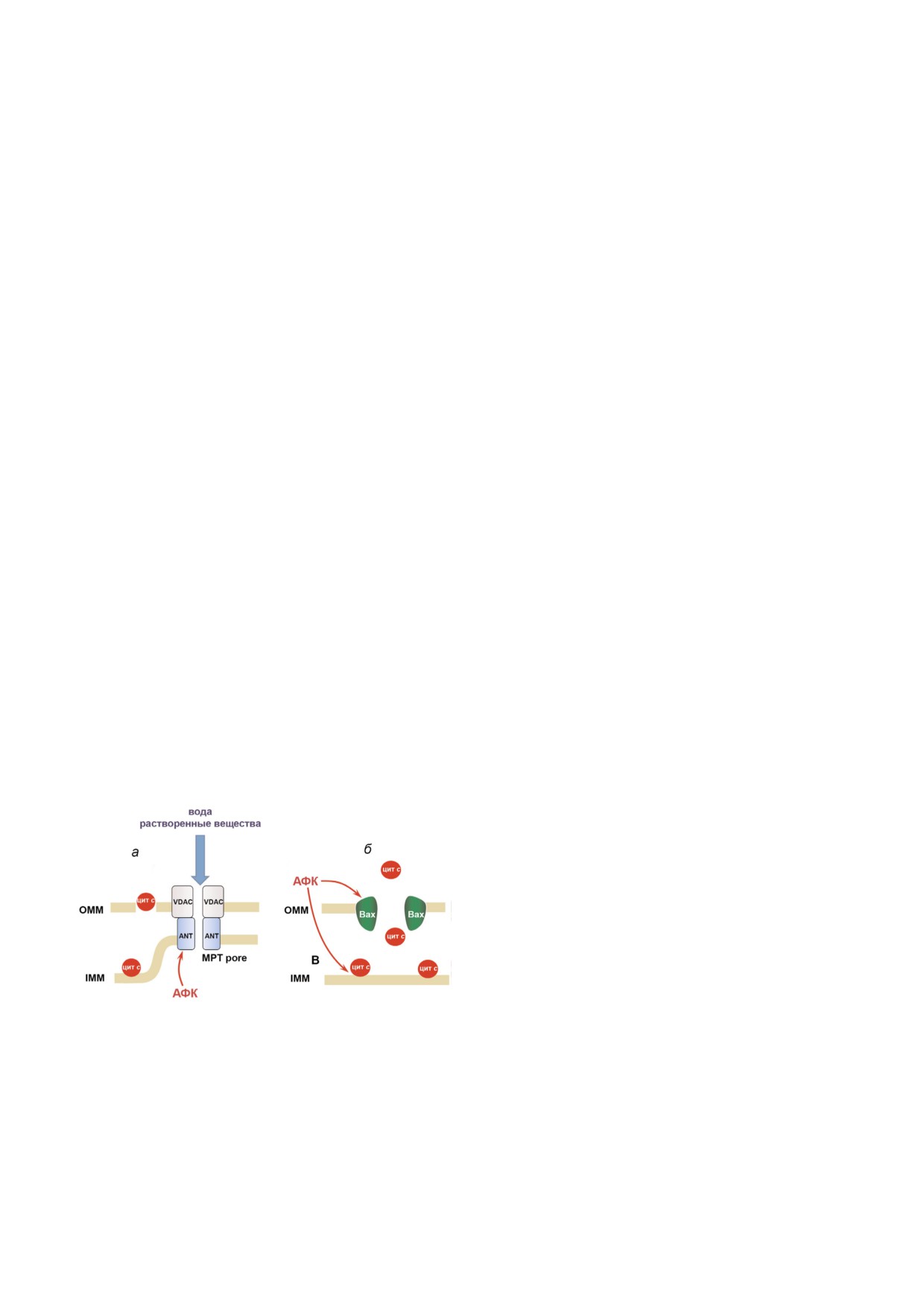
Рис. 2. АФК стимулируют пермеабилизацию внешней
катализирует превращение глютамина в пред%
мембраны митохондрий: а - вызывая индукцию неспеци%
фической проницаемости в результате окисления сульф%
шественник антиоксиданта глутатиона - глута%
гидрильных групп переносчика адениновых нуклеотидов
мат. Это способствует повышению содержания
(ANT); б - вследствие образования дисульфидных мости%
глутатиона в клетках, что снижает уровень АФК
ков между мономерами Bax, что облегчает их встраивание
[60]. Подавление р53 стимулирует окислитель%
во внешнюю мембрану с образованием поры; в - в резуль%
тате окисления кардиолипина, связывающего цитохром с,
ное повреждение ДНК, повышает образование
что приводит к увеличению пула свободного цитохрома с
мутаций и нестабильность генома [61]. Таким
БИОХИМИЯ том 85 вып. 10 2020
АНТИОКСИДАНТЫ И ТЕРАПИЯ ОПУХОЛЕЙ
1481
образом, при утрате p53 либо вследствие его му%
онпероксидазы 4 (GPX4), либо депривацией ан%
тации клетки могут подвергаться повышенному
тиоксидантов, тогда как повышенная экспрес%
риску малигнизации, что и наблюдается в по%
сия этого фермента может внести вклад в разви%
давляющем большинстве опухолей. Однако в
тие опухоли. Так, повышенное содержание
некоторых случаях активация р53, напротив,
GPX4 в клетках диффузной В%клеточной лим%
способствуют образованию АФК. Так, в клет%
фомы наблюдалось у 35% пациентов, а клетки с
ках, чувствительных к зависимому от р53 апоп%
повышенной экспрессией GPX4 были устойчи%
тозу, стимуляция гибели сопровождалась обра%
вы к гибели, вызванной накоплением АФК [68].
зованием свободных радикалов, тогда как в ре%
Снижение содержания или ингибирование
зистентных клетках подобная активация не наб%
GPX4 также может быть вовлечено, при опреде%
людалась [62]. Одним из объяснений этому яв%
ленных обстоятельствах, в индукцию апоптоза
ляется тот факт, что p53 может оказывать влия%
[69] и некроптоза [70], что говорит о взаимопро%
ние на потребление кислорода митохондриями,
никновении метаболических путей, регулирую%
поддерживая активность цитохромоксидазы,
щих эти формы гибели клеток.
одного из центров утечки электронов из дыха%
АФК способны стимулировать аутофагию,
тельной цепи [63].
естественный процесс утилизации содержимого
В зависимости от концентрации АФК могут
клетки - органелл и макромолекул, в клеточных
по%разному влиять на каталитическую актив%
компартментах, образующихся при слиянии ау%
ность каспаз - основных ферментов апоптоза.
тофагосом с лизосомами при стрессорных воз%
Так, в умеренных концентрациях перекись во%
действиях, таких как ишемия с последующей
дорода активирует каспазы в результате стиму%
реперфузией, состояние гипоксии в опухолях,
ляции митохондриального пути апоптоза, но
недостаток питательных веществ. Результатом
при увеличении ее концентрации возможна
прогрессирующей аутофагии может быть как
инактивация этих ферментов вследствие окис%
гибель клеток, так и их выживание. Взаимосвязь
ления цистеиновых остатков в каталитическом
между АФК и аутофагией проявляется в двух ас%
центре, что приведет к гибели клеток по некро%
пектах - индукция аутофагии в условиях окис%
тическому типу [64]. Более того, избыточная вы%
лительного стресса и подавление образования
работка АФК может привести к изменению pH в
АФК при стимуляции аутофагии [71]. Аутофа%
цитозоле клетки, что снизит каталитическую
гия, направленная на митохондрии - митофа%
активность каспаз [65]. В ряде исследований по%
гия, является своего рода контролем качества
казано, что антиапоптотические белки семей%
митохондрий в клетке. Митофагия позволяет
ства Bcl%2 обладают выраженной антиоксидант%
клетке удалять поврежденные митохондрии ли%
ной активностью. Так, стимуляция экспрессии
бо органеллы, представляющие опасность для
белка Bcl%2 защищает клетку от перекисного
клетки, к примеру, генерирующие активные
окисления липидов и тиолов, вызванных пере%
формы кислорода. Стимуляция аутофагии и ми%
кисью водорода [66]. Это, наряду с их способ%
тофагии может снизить эффект противоопухо%
ностью связывать проапоптотические белки,
левых препаратов, поскольку поврежденные
способствует предотвращению апоптоза.
митохондрии с пермеабилизованной внешней
Окислительный стресс играет первостепен%
мембраной и генерирующие АФК будут элими%
ную роль в инициации ферроптоза, одной из
нироваться [72]. Это следует учитывать при вы%
форм ПГК, зависящей от присутствия ионов
боре противоопухолевого препарата, а также не
железа и характеризующейся накоплением пе%
исключает применение ингибиторов аутофагии
рекисей липидов. Ферроптоз связан с патологи%
для усиления противоопухолевого эффекта.
ческой клеточной гибелью при нейродегенера%
тивных заболеваниях, таких как болезни Альц%
геймера, Паркинсона, Хантингтона, инсульт,
АФК И ТЕРАПИЯ ОПУХОЛЕЙ
внутримозговое кровоизлияние, черепно%моз%
говая травма и им подобные [67]. Генетически и
Способность АФК вызывать гибель клеток
биохимически ферроптоз отличается от других
используется в противоопухолевой терапии [73].
форм регулируемой гибели клеток, в частности
Так, в настоящее время проводится большое ко%
от апоптоза. Поскольку в ферроптозе весомую
личество исследований по изучению эффектив%
роль играют продукты перекисного окисления
ности использования натуральных препаратов,
липидов, судьба клетки будет определяться ее
способствующих стимуляции гибели клеток за
антиоксидантным статусом. Гибель опухолевых
счет продуцирования АФК. Было установлено,
клеток по механизму ферроптоза может быть
что добавление к клеткам рака простаты аурику%
вызвана подавлением зависимой от глутатиона
лазина - препарата, вызывающего выработку
антиоксидантной защиты, в частности глутати%
свободных радикалов в клетках - приводит к
11 БИОХИМИЯ том 85 вып. 10 2020
1482
ВОСТРИКОВА и др.
индукции апоптоза. Исследователи наблюдали
вышающем защитный порог опухолевой клет%
интенсивную фрагментацию ДНК опухолевых
ки, что вызывает ее гибель. Таким свойством об%
клеток, а также расщепление в них мишени кас%
ладает, к примеру, доксорубицин, соединение,
пазы%3 белка-PARP, увеличение содержания
повреждающее ДНК, но при этом стимулирую%
белка AIF, а также смещение баланса между бел%
щее образование АФК
[81]. Аналогичным
ками Bcl%2 семейства в сторону проапоптоти%
действием обладают и другие противоопухоле%
ческих [74]. Обработка клеток колоректального
вые препараты, такие как цисплатин и этопо%
рака человека гиненозидами (относятся к се%
зид. В этой ситуации использование антиокси%
мейству тритерпеновых гликозидов) также при%
дантов защитит опухолевую клетку от разруши%
водила к повышенной продукции АФК, в ре%
тельного действия АФК, что может существенно
зультате стимулировался не только апоптоз, но
снизить терапевтический эффект [82]. Однако
и аутофагия. Более того, добавление этого аген%
не все вещества, обладающие антиоксидантной
та вызывало задержку клеточного цикла в
активностью, способны защищать клетки от ги%
G0/G1%фазе, что вело к ингибированию роста
бели; некоторые антиоксиданты могут, зачас%
опухоли [75].
тую, способствовать развитию окислительного
На данный момент появляется все больше
стресса и запуску каскада реакций, приводящих
исследований возможностей целенаправленно%
к апоптозу. Так, добавление галловой кислоты -
го воздействия на клетки злокачественных опу%
природного растительного фенола с антиокси%
холей. Так, была выдвинута модель, предполага%
дантной активностью - к клеткам острого про%
ющая использование молекул, стимулирующих
миелоцитарного лейкоза HL%60RG вызывало
выработку АФК исключительно в клетках ма%
апоптоз на фоне накопления перекиси водорода
лигнизированных тканей [76]. Появился целый
и супероксидного радикала. Следует отметить,
ряд соединений под общим названием митока%
что продукция АФК была вызвана не в результа%
ны (mitocans, что является сочетанием слов
те антиоксидантной активности вещества, а
MITOchondria и CANcer) [77]. Одним из таких
вследствие нарушения гомеостаза клетки по
соединений является производное альфа%токо%
Ca2+ [83]. Другой пример, диферулоилметан,
ферола - альфа%токоферил сукцинат. Связыва%
или куркумин, - вещество полифенольной
ясь с комплексом II дыхательной цепи митохон%
структуры, часто применяющееся в качестве
дрий, он стимулирует утечку электронов и обра%
приправы и красителя в пищевых продуктах.
зование АФК. Благодаря воздействию на мито%
Как отмечалось, куркумин обладает выражен%
хондрии, альфа%токоферил сукцинат способен
ной антиоксидантной активностью: так, он спо%
вызывать гибель клеток, резистентных к тера%
собен предотвратить развитие окислительного
пии, в частности в гипоксических условиях [78],
стресса в эпителиальных клетках сосудов [84].
а также вследствие амплификации протоонко%
Однако недавние исследования подтверждают
гена MYCN [79]. Данный метод может быть при%
также наличие у куркумина и прооксидантной
меним на практике в сочетании с химиотерапи%
активности [85]. Так, куркумин индуцировал
ей, что позволит увеличить эффект терапии в
апоптоз в клетках острого промиелоцитарного
целом, а также снизить побочные эффекты про%
лейкоза, а воздействие таких антиоксидантов,
тивоопухолевых препаратов. На генерации АФК
как NAC, L%аскорбиновая кислота, токоферол,
основан метод фотодинамической терапии опу%
каталаза, SOD, снижало гибель клеток, что сви%
холей. Фотосенсибилизаторы, к примеру, про%
детельствует о свободно%радикальном механиз%
изводные порфиринов, конъюгированные с
ме индукции апоптоза [86]. Совместное добав%
глюкозой [80], способны селективно накапли%
ление галловой кислоты и куркумина к клеткам
ваться в ткани опухолей и при локальном воз%
рака молочной железы продемонстрировало по%
действии облучения определенной длины вол%
ложительные терапевтические эффекты, что
ны генерировать АФК, в частности синглетный
было связано с генерацией АФК в опухолевых
кислород, стимулируя гибель опухолевых кле%
клетках, истощением в них глутатиона, повы%
ток.
шением содержания проапоптотического белка
Таким образом, стимуляция окислительного
Bax, снижением содержания антиапоптотичес%
стресса в опухолевых клетках является эффек%
кого белка Bcl%2, и сопровождалось процессин%
тивной стратегией их элиминации. К сожале%
гом каспазы%3 и ее активацией [85]. Некоторые
нию, при этом могут страдать и здоровые ткани,
соединения, в частности, витамин C, обладаю%
поэтому поиск путей их защиты является на%
щие выраженной антиоксидантной актив%
сущным вопросом противоопухолевой терапии.
ностью, при определенных концентрациях спо%
Действие препаратов, традиционно исполь%
собны индуцировать апоптоз, выступая в каче%
зуемых в противоопухолевой терапии, нередко
стве прооксиданта [87]. Так, добавление вита%
связано с образованием АФК в количестве, пре%
мина C повышало содержание TRAIL%лиганда,
БИОХИМИЯ том 85 вып. 10 2020
АНТИОКСИДАНТЫ И ТЕРАПИЯ ОПУХОЛЕЙ
1483
участвующего в реализации рецептор%зависи%
экспрессии глутатионперокидазы подавляла
мого сигнального пути апоптоза, а также акти%
апоптоз в эндотелиальных клетках и кардиомио%
вации проапоптотического белка Bax и каспаз.
цитах, но не в клетках опухоли. Обнаруженное
Исходя из этого, можно заключить, что некото%
механистическое различие в действии доксору%
рые антиоксиданты, в силу своих структурных
бицина на нормальные и опухолевые клетки
особенностей и в зависимости от концентра%
позволит разработать новые препараты, способ%
ции, способны стимулировать продукцию АФК,
ные селективно подавлять токсические эффекты
а также увеличивать восприимчивость клеток к
доксорубицина, не затрагивая его противоопу%
проапоптотическим воздействиям. Следует от%
холевые эффекты [90]. Так, сочетанная терапия
метить, что эффективность используемого хи%
клеток рака молочной железы с использованием
миотерапевтического препарата может быть
доксорубицина и каротиноидов, обладающих
различной в зависимости от метаболического
антиоксидантной активностью, продемонстри%
состояния опухоли. Так, снижение антиоксида%
ровала положительные эффекты - каротиноиды
нтного статуса клетки нейробластомы деприва%
способствовали увеличению цитотоксичности в
цией глютамина подавляло апоптоз, вызванный
опухолевых клетках без повышения таковой в
этопозидом, но при этом стимулировало гибель,
нормальных [91]. Таким образом, добавление в
вызванную цисплатином. В условиях деприва%
ряде случаев антиоксидантов может предотвра%
ции глютамина подавление апоптоза в клетках,
тить накопление повреждений в клетках окружа%
обработанных этопозидом, было результатом
ющих неопухолевых тканей, не влияя при этом
снижения экспрессии транскрипционного фак%
на чувствительность опухолевых клеток к проти%
тора р53. Тогда как в случае цисплатина стиму%
воопухолевой терапии. Исходя из этого, к выбо%
ляция апоптоза объяснялась активацией капа%
ру антиоксидантов для защиты нормальных тка%
зы%8, вследствие снижения уровня ее ингибито%
ней в условиях химиотерапии следует подходить
ра FLIP%S [88].
с осторожностью.
К сожалению, противоопухолевая терапия,
основанная на выработке чрезмерного количе%
ства АФК, приводит к гибели не только опухоле%
АНТИОКСИДАНТЫ И ЛУЧЕВАЯ ТЕРАПИЯ:
вых, но и нормальных клеток. Так, развитие док%
ЗА И ПРОТИВ
сорубицин%опосредованной кардиомиопатии и
повреждение кардиомиоцитов является одним
В последние десятилетия в лечении онколо%
из основных побочных эффектов лечения дан%
гических заболеваний широко применяют луче%
ным химиотерапевтическим препаратом [89]. В
вую (или радиационную) терапию. Ее целью яв%
этих условиях использование антиоксидантов
ляется стимуляция повреждений в ДНК опухо%
позволило бы защитить здоровые ткани. Как бы%
левых клеток, которые в большей степени
ло сказано выше, противоопухолевое действие
чувствительны к облучению из%за их предраспо%
доксорубицина основано как на стимуляции
ложенности к неконтролируемому активному
экспрессии р53 вследствие повреждения ДНК,
делению. Радиация может воздействовать на
так и на индукции окислительного стресса. Со%
клетки напрямую, вызывая повреждение моле%
поставление механизмов индукции апоптоза в
кул ДНК, а также косвенно через накопление
нормальных клетках (клетки эндотелия и кардио%
АФК, образующихся в результате воздействия
миоциты) и опухолевых клетках (клетки терато%
излучения на молекулы воды. Это ведет к на%
карциномы яичника РА%1 и рака молочной же%
коплению гидроксильных радикалов, обладаю%
лезы MCF%7) показало, что в эндотелиальных
щих наиболее разрушительной силой, суперок%
клетках активация каспазы%3, опосредованная
сидов радикалов и других окислителей, в том
АФК, предшествовала активации р53, тогда как
числе перекиси водорода. Так как антиоксидан%
в опухолевых клетках доксорубицин вызывал
ты способны нейтрализовать действие АФК в
раннюю активацию р53, что вело к активации
клетках, неоднократно было высказано предпо%
каспазы%3 и фрагментации ДНК. По мнению ав%
ложение, что употребление антиоксидантов в
торов, активация р53 в нормальных клетках не
качестве пищевых добавок во время лучевой те%
столь существенна для индукции апоптоза по
рапии может вызвать устойчивость опухолевых
сравнению с опухолевыми клетками. Действи%
клеток к радиации [92], в частности, было уста%
тельно, ингибитор р53, пифитрин%α, полностью
новлено, что витамин E снижает действие облу%
подавлял активацию р53 как в опухолевых, так и
чения как на нормальные, так и на злокачест%
в нормальных клетках, однако при этом подав%
венные клетки [93]. В клетках острого миелоид%
ление апоптоза наблюдалось лишь в клетках
ного лейкоза, к которым добавлялся витамин C,
опухоли. Напротив, добавка в качестве антиок%
также наблюдалось снижение апоптоза, инду%
сидантов металлопорфиринов либо стимуляция
цированного воздействием радиационного из%
БИОХИМИЯ том 85 вып. 10 2020
11*
1484
ВОСТРИКОВА и др.
Показано, что витамины E и C способны сни%
зить данный побочный эффект после лучевой
терапии; в частности, пациенты с раком проста%
ты и гинекологическими опухолями, принима%
ющие данные антиоксиданты в течение года,
сообщили об устойчивом снижении симптомов
заболеваний [98]. Еще одним частым осложне%
нием после облучения брюшной или тазовой
полости является радиационный энтерит. Было
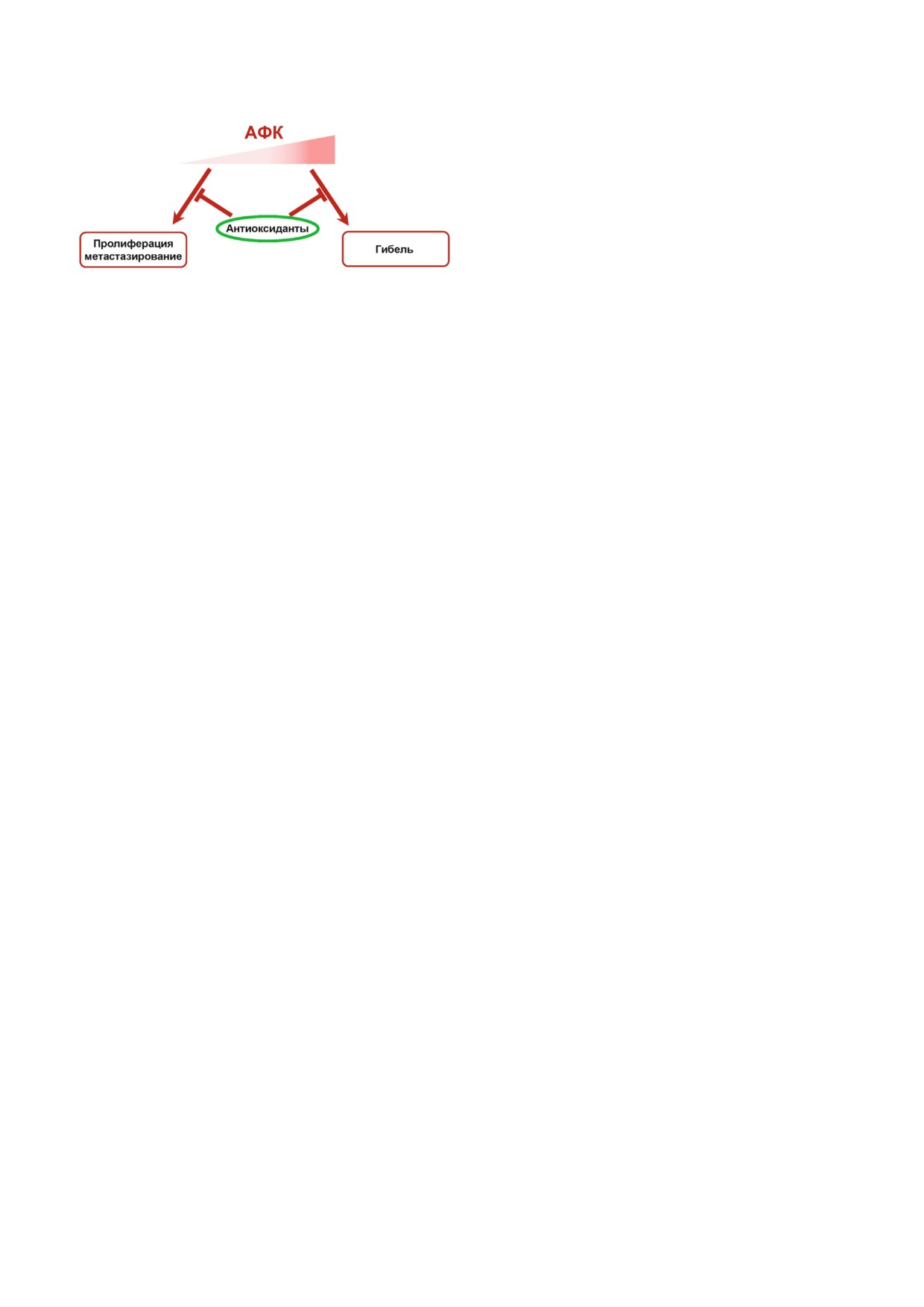
Рис. 3. Умеренно повышенное образование АФК, сбалан%
также установлено, что добавление антиокси%
сированное работой антиоксидантных систем клетки, под%
держивает пролиферацию опухолевых клеток и играет
дантов приводит к снижению повреждения кле%
важную роль в процессах метастазирования. Неконтроли%
ток, вызванного накоплением в них АФК. Сов%
руемое образование АФК под действием противоопухоле%
местный прием витамина E и пентоксифиллина
вых препаратов в количестве, превышающем мощности
(не обладающего выраженными антиоксидант%
защитных систем клетки, будет вызывать гибель опухоле%
вых клеток. Применение антиоксидантов способно сдер%
ными свойствами) вызывал регрессию фиброза,
живать как пролиферацию, так и метастазирование. Одна%
индуцированного радиацией [100].
ко использование антиоксидантов в процессе противоопу%
В целом отмечается, что пациенты, прини%
холевой терапии будет подавлять гибель клеток, снижая ее
мающие антиоксиданты, лучше переносят луче%
эффективность
вую терапию [101]. Это может быть связано с
тем, что в тканях, подверженных воздействию
лучения [94]. При этом во многих исследовани%
радиации, наблюдается истощение пула некото%
ях отмечаются отрицательные последствия ис%
рых антиоксидантов; в частности, было показа%
пользования антиоксидантов при лучевой тера%
но снижение содержания витаминов C и E в
пии в целом [82]. Так, например, прием антиок%
тканях после облучения всего тела рентгеновс%
сидантов во время радиационной терапии рака
кими лучами [102]. Более того, с возрастом вы%
молочной железы снижал общую выживае%
работка эндогенных антиоксидантов в тканях
мость, а также повышал вероятность рецидивов
снижается, а также уменьшается способность
заболевания [95]. Эти работы демонстрируют,
клеток к репарации ДНК. Исследование анти%
что, несмотря на способность уменьшать побоч%
оксидантных свойств плазмы людей в возрасте
ные эффекты, прием высоких доз антиоксидан%
от 30 до 80 лет продемонстрировала обратную
тов может привести к снижению эффективнос%
зависимость от возраста [103]. Таким образом,
ти лучевой терапии в целом.
можно предположить, что добавление антиок%
Несмотря на это, предполагается, что анти%
сидантов во время лучевой терапии позволит
оксиданты могут снижать интенсивность радиа%
восполнить их недостаток в тканях, повышая
ционного воздействия на нормальные клетки,
устойчивость неопухолевых клеток к радиаци%
не повышая устойчивости опухолевых клеток к
онному воздействию.
излучению. Так, было показано, что добавление
Антиоксиданты способны подавлять проли%
витамина E в условиях лучевой терапии предо%
феративные сигналы в опухолевых клетках, тем
твращает накопление повреждений в нормаль%
самым предотвращая развитие и метастазирова%
ных клетках, усиливая воздействие излучения
ние опухолей. Однако в условиях терапии опу%
на опухолевые клетки, в результате чего подав%
холи с использованием соединений, стимулиру%
ляется рост опухоли [96]. Недавние исследова%
ющих окислительный стресс, антиоксиданты
ния демонстрируют положительные эффекты от
будут снижать эффективность терапии (рис. 3).
внутривенного приема аскорбиновой кислоты
В настоящее время проводится множество
(витамина C) во время лучевой терапии при аде%
исследований, целью которых является дать
нокарциноме поджелудочной железы. Было ус%
окончательный ответ на вопрос, является ли
тановлено, что витамин C усиливает воздей%
прием антиоксидантов в терапии злокачествен%
ствие радиации на опухолевые клетки, защищая
ных опухолей целесообразным и безопасным.
клетки немалигнизированных тканей от радиа%
Несмотря на большое количество уже имею%
ционного воздействия [97].
щихся научных данных, спрогнозировать путь,
Снижение побочных эффектов лучевой те%
по которому будет реализовываться ответ клеток
рапии в случае приема пациентами антиокси%
на добавление к ним того или иного антиокси%
дантов было продемонстрировано в целом ряде
данта, по%прежнему является сложной задачей.
работ [98, 99]. Одним из последствий облучения
Механизм, согласно которому антиоксидант бу%
является хронический лучевой проктит - воспа%
дет действовать на клетки, зависит не только от
ление слизистой оболочки прямой кишки, час%
его природы и концентрации, но и от этиологии
то развивающееся после тазового облучения.
клеток, которые подвергаются воздействию.
БИОХИМИЯ том 85 вып. 10 2020
АНТИОКСИДАНТЫ И ТЕРАПИЯ ОПУХОЛЕЙ
1485
Именно поэтому в основе успешного использо%
Финансирование. Работа выполнена при фи%
вания антиоксидантов в терапии опухолей дол%
нансовой поддержке РНФ (грант 19%14%00122).
жен лежать индивидуальный подход в каждом
Работа в лабораториях авторов также поддержа%
отдельном случае заболевания.
на грантами РФФИ (20%015%00105), Шведским
(190345) и Стокгольмским (181301) онкологи%
ческими фондами.
Благодарности. Авторы выражают благодар%
Конфликт интересов. Авторы заявляют об от%
ность проф. Б.Д. Животовскому за помощь в ра%
сутствии конфликта интересов.
боте над рукописью, ценные замечания и предло%
Соблюдение этических норм. Настоящая ра%
жения. Мы приносим свои извинения тем авто%
бота не содержит описания выполненных авто%
рам, чьи публикации не могли быть процитирова%
рами исследований с участием людей или ис%
ны в силу ограниченного объема нашего обзора.
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Hanahan, D., and Weinberg, R. A. (2000) The hallmarks of
lasts release reactive oxygen species in response to inter%
cancer, Cell,
100,
57%70, doi:
10.1016/s0092%
leukin%1 or tumour necrosis factor%alpha, Biochem. J., 263,
8674(00)81683%9.
539%545, doi: 10.1042/bj2630539.
2.
Galluzzi, L., Vitale, I., Aaronson, S. A., Abrams, J. M.,
14.
Redza%Dutordoir, M., and Averill%Bates, D. A. (2016)
Adam, D., et al. (2018) Molecular mechanisms of cell
Activation of apoptosis signalling pathways by reactive oxy%
death: recommendations of the nomenclature committee
gen species, Biochim. Biophys. Acta, 1863, 2977%2992,
on cell death 2018, Cell Death Differ., 25, 486%541,
doi: 10.1016/j.bbamcr.2016.09.012.
doi: 10.1038/s41418%017%0012%4.
15.
Kim, S. Y., Park, C., Jang, H. J., Kim, B. O., Bae, H. W.,
3.
Halliwell, B. (1999) Oxygen and nitrogen are pro%carcino%
et al. (2019) Antibacterial strategies inspired by the oxida%
gens. Damage to DNA by reactive oxygen, chlorine and
tive stress and response networks, J. Microbiol., 57, 203%
nitrogen species: measurement, mechanism and the effects
212, doi: 10.1007/s12275%019%8711%9.
of nutrition, Mutat. Res., 443, 37%52, doi: 10.1016/s1383%
16.
Wu, M. Y., Yiang, G. T., Liao, W. T., Tsai, A. P., Cheng, Y.
5742(99)00009%5.
L., et al. (2018) Current mechanistic concepts in ischemia
4.
Andreyev, A. Y., Kushnareva, Y. E., Murphy, A. N., and
and reperfusion injury, Cell. Physiol. Biochem., 46, 1650%
Starkov, A. A. (2015) Mitochondrial ROS metabolism: 10
1667, doi: 10.1159/000489241.
years later, Biochemistry (Moscow),
80,
517%531,
17.
Rodic, S., and Vincent, M. D. (2018) Reactive oxygen
doi: 10.1134/S0006297915050028.
species (ROS) are a key determinant of cancer’s metabolic
5.
Gaweska, H., and Fitzpatrick, P. F. (2011) Structures and
phenotype, Int. J. Cancer, 142, 440%448, doi: 10.1002/ijc.
meanism of the monoamine oxidase family, Biomol.
31069.
Concepts, 2, 365%377, doi: 10.1515/BMC.2011.030.
18.
Irani, K., Xia, Y., Zweier, J. L., Sollott, S. J., Der, C. J.,
6.
Liguori, I., Russo, G., Curcio, F., Bulli, G., Aran, L., et al.
Fearon, E. R., Sundaresan, M., Finkel, T., and Goldschmidt%
(2018) Oxidative stress, aging and diseases, Clin. Interv.
Clermont, P. J. (1997) Mitogenic signaling mediated by oxi%
Aging, 13, 757%772, doi: 10.2147/CIA.S158513.
dants in Ras%transformed fibroblasts, Science, 275, 1649%
7.
Schroder, K., Zhang, M., Benkhoff, S., Mieth, A.,
1652, doi: 10.1126/science.275. 5306.1649.
Pliquett, R., et al. (2012) Nox4 is a protective reactive oxy%
19.
Vafa, O., Wade, M., Kern, S., Beeche, M., Pandita, T. K.,
gen species generating vascular NADPH oxidase, Circ. Res.,
Hampton, G. M., and Wahl, G. M. (2002) c%Myc can
110, 1217%1225, doi: 10.1161/CIRCRESAHA.112.267054.
induce DNA damage, increase reactive oxygen species,
8.
Meng, X. M., Ren, G. L., Gao, L., Yang, Q., Li, H. D., et
and mitigate p53 function: a mechanism for oncogene%
al. (2018) NADPH oxidase 4 promotes cisplatin%induced
induced genetic instability, Mol. Cell, 9, 1031%1044,
acute kidney injury via ROS%mediated programmed cell
doi: 10.1016/s1097%2765(02)00520%8.
death and inflammation, Lab. Invest.,
98,
63%78,
20.
Hole, P. S., Pearn, L., Tonks, A. J., James, P. E., Burnett,
doi: 10.1038/labinvest.2017.120.
A. K., Darley, R. L., and Tonks, A. (2010) Ras%induced
9.
Haag%Liautard, C., Coffey, N., Houle, D., Lynch, M.,
reactive oxygen species promote growth factor%indepen%
Charlesworth, B., and Keightley, P. D. (2008) Direct esti%
dent proliferation in human CD34+ hematopoietic progen%
mation of the mitochondrial DNA mutation rate in
itor cells, Blood, 115, 1238%1246, doi: 10.1182/blood%
Drosophila melanogaster, PLoS Biol., 6, e204, doi: 10.1371/
2009%06%222869.
journal.pbio.0060204.
21.
Semenza, G. L. (2003) Targeting HIF%1 for cancer thera%
10.
Elchuri, S., Oberley, T. D., Qi, W., Eisenstein, R. S.,
py, Nat. Rev. Cancer, 3, 721%732, doi: 10.1038/nrc1187.
Jackson Roberts, L., et al. (2005) CuZnSOD deficiency
22.
Chandel, N. S., McClintock, D. S., Feliciano, C. E.,
leads to persistent and widespread oxidative damage and
Wood, T. M., Melendez, J. A., Rodriguez, A. M., and
hepatocarcinogenesis later in life, Oncogene, 24, 367%380,
Schumacker, P. T. (2000) Reactive oxygen species generat%
doi: 10.1038/sj.onc.1208207.
ed at mitochondrial complex III stabilize hypoxia%
11.
Li, Y., Huang, T. T., Carlson, E. J., Melov, S., Ursell, P. C.,
inducible factor%1alpha during hypoxia: a mechanism of O2
et al. (1995) Dilated cardiomyopathy and neonatal lethali%
sensing,
J.
Biol.
Chem.,
275,
25130%25138,
ty in mutant mice lacking manganese superoxide dismu%
doi: 10.1074/jbc.M001914200.
tase, Nat. Genet., 11, 376%381, doi: 10.1038/ng1295%376.
23.
Aggarwal, V., Tuli, H. S., Varol, A., Thakral, F., Yerer, M. B.,
12.
Thannickal, V. J., and Fanburg, B. L. (1995) Activation of
et al. (2019) Role of reactive oxygen species in cancer pro%
an H2O2%generating NADH oxidase in human lung
gression: molecular mechanisms and recent advancements,
fibroblasts by transforming growth factor beta 1, J. Biol.
Biomolecules, 9, doi: 10.3390/biom9110735.
Chem., 270, 30334%30338, doi: 10.1074/jbc.270.51.30334.
24.
Kanbagli, O., Ozdemirler, G., Bulut, T., Yamaner, S.,
13.
Meier, B., Radeke, H. H., Selle, S., Younes, M., Sies, H.,
Aykac%Toker, G., and Uysal, M. (2000) Mitochondrial
Resch, K., and Habermehl, G. G. (1989) Human fibrob%
lipid peroxides and antioxidant enzymes in colorectal ade%
БИОХИМИЯ том 85 вып. 10 2020
1486
ВОСТРИКОВА и др.
nocarcinoma tissues, Jpn. J. Cancer Res., 91, 1258%1263,
cell%cycle control in plants, Semin. Cell. Dev. Biol., 16, 385%
doi: 10.1111/j.1349%7006.2000.tb00912.x.
396, doi: 10.1016/j.semcdb.2005.02.004.
25.
Cobbs, C. S., Levi, D. S., Aldape, K., and Israel, M. A.
42.
Bakshi, S., Bergman, M., Dovrat, S., and Grossman, S.
(1996) Manganese superoxide dismutase expression in
(2004) Unique natural antioxidants (NAOs) and derived
human central nervous system tumors, Cancer Res., 56,
purified components inhibit cell cycle progression by
3192%3195.
downregulation of ppRb and E2F in human PC3 prostate
26.
Wang, M., Kirk, J. S., Venkataraman, S., Domann, F. E.,
cancer cells, FEBS Lett., 573, 31%37, doi: 10.1016/j.feb%
Zhang, H. J., et al. (2005) Manganese superoxide dismu%
slet.2004.06.101.
tase suppresses hypoxic induction of hypoxia%inducible
43.
Henry, D., Brumaire, S., and Hu, X. (2019) Involvement of
factor%1alpha and vascular endothelial growth factor,
pRb%E2F pathway in green tea extract%induced growth
Oncogene, 24, 8154%8166, doi: 10.1038/sj.onc.1208986.
inhibition of human myeloid leukemia cells, Leuk. Res.,
27.
Nakata, T., Suzuki, K., Fujii, J., Ishikawa, M., Tatsumi, H.,
77, 34%41, doi: 10.1016/j.leukres.2018.12.014.
et al. (1992) High expression of manganese superoxide dis%
44.
Sayin, V. I., Ibrahim, M. X., Larsson, E., Nilsson, J. A.,
mutase in 7,12%dimethylbenz[a]anthracene%induced ovari%
Lindahl, P., and Bergo, M. O. (2014) Antioxidants acceler%
an cancer and increased serum levels in the tumor%bearing
ate lung cancer progression in mice, Sci. Transl. Med., 6,
rats, Carcinogenesis, 13, 1941%1943, doi: 10.1093/carcin/
221ra215, doi: 10.1126/scitranslmed.3007653.
13.10.1941.
45.
Wiel, C., Le Gal, K., Ibrahim, M. X., Jahangir, C. A.,
28.
Nunes, S. C., and Serpa, J. (2018) Glutathione in varian
Kashif, M., et al. (2019) BACH1 stabilization by antioxi%
cancer: a double%edged sword, Int. J. Mol. Sci., 19,
dants stimulates lung cancer metastasis, Cell, 178, 330%
doi: 10.3390/ijms19071882.
345.e322, doi: 10.1016/j.cell.2019.06.005.
29.
Chan, J. M., Darke, A. K., Penney, K. L., Tangen, C. M., et
46.
Lignitto, L., LeBoeuf, S. E., Homer, H., Jiang, S.,
al. (2016) Selenium% or vitamin E%related gene variants,
Askenazi, M., et al. (2019) Nrf2 activation promotes lung
interaction with supplementation, and risk of high%grade
cancer metastasis by inhibiting the degradation of Bach1,
prostate cancer in select, Cancer Epidemiol. Biomarkers Prev.,
Cell, 178, 316%329.e318, doi: 10.1016/j.cell.2019.06.003.
25, 1050%1058, doi: 10.1158/1055%9965.EPI%16%0104.
47.
Kumari, S., Badana, A. K., G, Mohan, M., Shailender, G.,
30.
Singh, A., Misra, V., Thimmulappa, R. K., Lee, H., Ames, S.,
and Malla, R. (2018) Reactive oxygen species: a key con%
et al. (2006) Dysfunctional KEAP1%NRF2 interaction in
stituent in cancer survival, Biomark. Insights,
13,
non%small%cell lung cancer, PLoS Med.,
3, e420,
1177271918755391, doi: 10.1177/1177271918755391.
doi: 10.1371/journal.pmed.0030420.
48.
Gogvadze, V., Orrenius, S., and Zhivotovsky, B. (2008)
31.
Oberley, L. W. (2001) Anticancer therapy by overexpression
Mitochondria in cancer cells: what is so special about
of superoxide dismutase, Antioxid. Redox Signal., 3, 461%
them? Trends Cell Biol., 18, 165%173, doi: 10.1016/
472, doi: 10.1089/15230860152409095.
j.tcb.2008.01.006.
32.
Wang, J. Y., Wang, X., Wang, X. J., Zheng, B. Z., Wang, Y.,
49.
Eskes, R., Desagher, S., Antonsson, B., and Martinou, J. C.
Wang, X., and Liang, B. (2018) Curcumin inhibits the
(2000) Bid induces the oligomerization and insertion of
growth via Wnt/beta%catenin pathway in non%small%cell
Bax into the outer mitochondrial membrane, Mol. Cell.
lung cancer cells, Eur. Rev. Med. Pharmacol. Sci., 22, 7492%
Biol., 20, 929%935, doi: 10.1128/mcb.20.3.929%935.2000.
7499, doi: 10.26355/eurrev_201811_16290.
50.
Gogvadze, V., Orrenius, S., and Zhivotovsky, B. (2006)
33.
Isakov, N. (2018) Protein kinase C (PKC) isoforms in can%
Multiple pathways of cytochrome c release from mitochon%
cer, tumor promotion and tumor suppression, Semin.
dria in apoptosis, Biochim. Biophys. Acta, 1757, 639%647,
Cancer Biol.,
48,
36%52, doi:
10.1016/j.semcancer.
doi: 10.1016/j.bbabio.2006.03.016.
2017.04.012.
51.
Hunter, D. R., and Haworth, R. A. (1979) The Ca2+%
34.
Knock, G. A., and Ward, J. P. (2011) Redox regulation of
induced membrane transition in mitochondria. I. The pro%
protein kinases as a modulator of vascular function,
tective mechanisms, Arch. Biochem. Biophys., 195, 453%
Antioxid. Redox Signal., 15, 1531%1547, doi: 10.1089/
459, doi: 10.1016/0003%9861(79)90371%0.
ars.2010.3614.
52.
McStay, G. P., Clarke, S. J., and Halestrap, A. P. (2002)
35.
Natarajan, K., Gottipati, K. R., Berhane, K., Samten, B.,
Role of critical thiol groups on the matrix surface of the
Pendurthi, U., and Boggaram, V. (2016) Proteases and oxi%
adenine nucleotide translocase in the mechanism of the
dant stress control organic dust induction of inflammatory
mitochondrial permeability transition pore, Biochem. J.,
gene expression in lung epithelial cells, Respir. Res., 17,
367, 541%548, doi: 10.1042/BJ20011672.
137, doi: 10.1186/s12931%016%0455%z.
53.
Neuzil, J., Wang, X. F., Dong, L. F., Low, P., and Ralph, S. J.
36.
Sagun, K. C., Cárcamo, J. M., and Golde, D. W. (2006)
(2006) Molecular mechanism of “mitocan”%induced
Antioxidants prevent oxidative DNA damage and cellular
apoptosis in cancer cells epitomizes the multiple roles of
transformation elicited by the over%expression of c%MYC,
reactive oxygen species and Bcl%2 family proteins, FEBS
Mutat. Res.,
593,
64%79, doi:
10.1016/j.mrfmmm.
Lett., 580, 5125%5129, doi: 10.1016/j.febslet.2006.05.072.
2005.06.015.
54.
Ott, M., Robertson, J. D., Gogvadze, V., Zhivotovsky, B.,
37.
Gordan, J. D., Thompson, C. B., and Simon, M. C. (2007)
and Orrenius, S. (2002) Cytochrome c release from mito%
HIF and c%Myc: sibling rivals for control of cancer cell
chondria proceeds by a two%step process, Proc. Natl. Acad.
metabolism and proliferation, Cancer Cell, 12, 108%113,
Sci. USA, 99, 1259%1263, doi: 10.1073/pnas.241655498.
doi: 10.1016/j.ccr.2007.07.006.
55.
Kagan, V. E., Bayir, H. A., Belikova, N. A., Kapralov, O.,
38.
Dolcet, X., Llobet, D., Pallares, J., and Matias%Guiu, X.
Tyurina, Y. Y., et al. (2009) Cytochrome c/cardiolipin rela%
(2005) NF%κB in development and progression of human
tions in mitochondria: a kiss of death, Free Radic. Biol. Med.,
cancer, Virchows Arch., 446, 475%482, doi: 10.1007/
46, 1439%1453, doi: 10.1016/j.freeradbiomed.2009.03.004.
s00428%005%1264%9.
56.
Cai, J., and Jones, D. P. (1999) Mitochondrial redox sig%
39.
Johnson, J., Thijssen, B., McDermott, U., Garnett, M.,
naling during apoptosis, J. Bioenerg. Biomembr., 31, 327%
Wessels, L. F., and Bernards, R. (2016) Targeting the RB%
334, doi: 10.1023/a:1005423818280.
E2F pathway in breast cancer, Oncogene, 35, 4829%4835,
57.
Cabeca, T. K., de Mello Abreu, A., Andrette, R., de Souza
doi: 10.1038/onc.2016.32.
Lino, V., Morale, M. G., et al. (2019) HPV%mediated resis%
40.
Nevins, J. R. (2001) The Rb/E2F pathway and cancer, Hum.
tance to TNF and TRAIL is characterized by global alter%
Mol. Genet., 10, 699%703, doi: 10.1093/hmg/10.7.699.
ations in apoptosis regulatory factors, dysregulation of
41.
De Jager, S. M., Maughan, S., Dewitte, W., Scofield, S.,
death receptors, and induction of ROS/RNS, Int. J. Mol.
and Murray, J. A. (2005) The developmental context of
Sci., 20, doi: 10.3390/ijms20010198.
БИОХИМИЯ том 85 вып. 10 2020
АНТИОКСИДАНТЫ И ТЕРАПИЯ ОПУХОЛЕЙ
1487
58.
Choi, K., Ryu, S. W., Song, S., Choi, H., Kang, S. W., and
74.
Cho, H. D., Lee, J. H., Moon, K. D., Park, K. H., Lee, M. K.,
Choi, C. (2010) Caspase%dependent generation of reactive
and Seo, K. I. (2018) Auriculasin%induced ROS causes
oxygen species in human astrocytoma cells contributes to
prostate cancer cell death via induction of apoptosis, Food
resistance to TRAIL%mediated apoptosis, Cell. Death
Chem. Toxicol., 111, 660%669, doi: 10.1016/j.fct.2017.
Differ., 17, 833%845, doi: 10.1038/cdd.2009.154.
12.007.
59.
Giorgio, M., Migliaccio, E., Orsini, F., Paolucci, D.,
75.
Wu, Q., Deng, J., Fan, D., Duan, Z., Zhu, C., Fu, R., and
Moroni, M., et al. (2005) Electron transfer between
Wang, S. (2018) Ginsenoside Rh4 induces apoptosis and
cytochrome c and p66Shc generates reactive oxygen
autophagic cell death through activation of the
species that trigger mitochondrial apoptosis, Cell, 122,
ROS/JNK/p53 pathway in colorectal cancer cells,
221%233, doi: 10.1016/j.cell.2005.05.011.
Biochem. Pharmacol., 148, 64%74, doi: 10.1016/j.bcp.2017.
60.
Hu, W., Zhang, C., Wu, R., Sun, Y., Levine, A., and Feng, Z.
12.004.
(2010) Glutaminase 2, a novel p53 target gene regulating
76.
Nicco, C., and Batteux, F. (2017) ROS modulator mole%
energy metabolism and antioxidant function, Proc. Natl.
cules with therapeutic potential in cancers treatments,
Acad. Sci. USA, 107, 7455%7460, doi: 10.1073/pnas.
Molecules, 23, doi: 10.3390/molecules23010084.
1001006107.
77.
Biasutto, L., Dong, L. F., Zoratti, M., and Neuzil, J.
61.
Sablina, A. A., Budanov, A. V., Ilyinskaya, G. V., Agapova,
(2010) Mitochondrially targeted anti%cancer agents,
L. S., Kravchenko, J. E., and Chumakov, P. M. (2005) The
Mitochondrion, 10, 670%681, doi: 10.1016/j.mito.2010.
antioxidant function of the p53 tumor suppressor, Nat.
06.004.
Med., 11, 1306%1313, doi: 10.1038/nm1320.
78.
Kulikov, A. V., Vdovin, A. S., Zhivotovsky, B., and
62.
Johnson, T. M., Yu, Z. X., Ferrans, V. J., Lowenstein, R. A.,
Gogvadze, V. (2014) Targeting mitochondria by alpha%
and Finkel, T. (1996) Reactive oxygen species are down%
tocopheryl succinate overcomes hypoxia%mediated tumor
stream mediators of p53%dependent apoptosis, Proc. Natl.
cell resistance to treatment, Cell Mol. Life Sci., 71, 2325%
Acad. Sci. USA, 93, 11848%11852, doi: 10.1073/pnas.
2333, doi: 10.1007/s00018%013%1489%8.
93.21.11848.
79.
Kruspig, B., Nilchian, A., Bejarano, I., Orrenius, S.,
63.
Matoba, S., Kang, J. G., Patino, W. D., Wragg, A., Boehm, M.,
Zhivotovsky, B., and Gogvadze, V. (2012) Targeting mito%
et al. (2006) p53 regulates mitochondrial respiration,
chondria by alpha%tocopheryl succinate kills neuroblas%
Science, 312, 1650%1653, doi: 10.1126/science.1126863.
toma cells irrespective of MycN oncogene expression, Cell
64.
Hampton, M. B., and Orrenius, S. (1997) Dual regulation
Mol. Life Sci., 69, 2091%2099, doi: 10.1007/s00018%012%
of caspase activity by hydrogen peroxide: implications for
0918%4.
apoptosis, FEBS Lett., 414, 552%556, doi: 10.1016/s0014%
80.
Ito, H., and Matsui, H. (2016) Mitochondrial reactive oxy%
5793(97)01068%5.
gen species and photodynamic therapy, Laser Ther., 25,
65.
Akram, S., Teong, H. F., Fliegel, L., Pervaiz, S., and
193%199, doi: 10.5978/islsm.16%OR%15.
Clement, M. V. (2006) Reactive oxygen species%mediated
81.
Ubezio, P., and Civoli, F. (1994) Flow cytometric detection
regulation of the Na+%H+ exchanger 1 gene expression
of hydrogen peroxide production induced by doxorubicin
connects intracellular redox status with cells’ sensitivity to
in cancer cells, Free Radic. Biol. Med., 16, 509%516,
death triggers, Cell Death Differ.,
13,
628%641,
doi: 10.1016/0891%5849(94)90129%5.
doi: 10.1038/sj.cdd.4401775.
82.
Lawenda, B. D., Kelly, K. M., Ladas, E. J., Sagar, S. M.,
66.
Pohl, S. O., Agostino, M., Dharmarajan, A., and Pervaiz, S.
Vickers, A., and Blumberg, J. B. (2008) Should supple%
(2018) Cross talk between cellular redox state and the anti%
mental antioxidant administration be avoided during
apoptotic protein Bcl%2, Antioxid. Redox Signal., 29, 1215%
chemotherapy and radiation therapy? J. Natl. Cancer Inst.,
1236, doi: 10.1089/ars.2017.7414.
100, 773%783, doi: 10.1093/jnci/djn148.
67.
Stockwell, B. R., Friedmann Angeli, J. P., Bayir, H., Bush,
83.
Isuzugawa, K., Inoue, M., and Ogihara, Y. (2001) Ca2+%
A. I., Conrad, M., et al. (2017) Ferroptosis: a regulated cell
dependent caspase activation by gallic acid derivatives,
death nexus linking metabolism, redox biology and disease,
Biol. Pharm. Bull., 24, 844%847, doi: 10.1248/bpb.24.844.
Cell, 171, 273%285, doi: 10.1016/j.cell.2017.09.021.
84.
Motterlini, R., Foresti, R., Bassi, R., and Green, C. J.
68.
Kinowaki, Y., Kurata, M., Ishibashi, S., Ikeda, M.,
(2000) Curcumin, an antioxidant and anti%inflamma%
Tatsuzawa, A., et al. (2018) Glutathione peroxidase 4 over%
tory agent, induces heme oxygenase%1 and protects
expression inhibits ROS%induced cell death in diffuse large
endothelial cells against oxidative stress, Free Radic.
B%cell lymphoma, Lab. Invest., 98, 609%619, doi: 10.1038/
Biol. Med.,
28,
1303%1312, doi:
10.1016/s0891%
s41374%017%0008%1.
5849(00)00294%x.
69.
Lubos, E., Loscalzo, J., and Handy, D. E.
(2011)
85.
Moghtaderi, H., Sepehri, H., Delphi, L., and Attari, F.
Glutathione peroxidase%1 in health and disease: from mol%
(2018) Gallic acid and curcumin induce cytotoxicity and
ecular mechanisms to therapeutic opportunities, Antioxid.
apoptosis in human breast cancer cell MDA%MB%231,
Redox Signal., 15, 1957%1997, doi: 10.1089/ars.2010.3586.
Bioimpacts, 8, 185%194, doi: 10.15171/bi.2018.21.
70.
Canli, O., Alankus, Y. B., Grootjans, S., Vegi, N., Hultner, L.,
86.
Kuo, M. L., Huang, T. S., and Lin, J. K. (1996) Curcumin,
et al. (2016) Glutathione peroxidase 4 prevents necroptosis
an antioxidant and anti%tumor promoter, induces apoptosis
in mouse erythroid precursors, Blood, 127, 139%148,
in human leukemia cells, Biochim. Biophys. Acta, 1317, 95%
doi: 10.1182/blood%2015%06%654194.
100, doi: 10.1016/s0925%4439(96)00032%4.
71.
Li, L., Tan, J., Miao, Y., Lei, P., and Zhang, Q. (2015)
87.
Sant, D. W., Mustafi, S., Gustafson, C. B., Chen, J.,
ROS and autophagy: interactions and molecular regulato%
Slingerland, J. M., and Wang, G. (2018) Vitamin C pro%
ry mechanisms, Cell Mol. Neurobiol.,
35,
615%621,
motes apoptosis in breast cancer cells by increasing TRAIL
doi: 10.1007/s10571%015%0166%x.
expression, Sci. Rep., 8, 5306, doi: 10.1038/s41598%018%
72.
Abdrakhmanov, A., Kulikov, A. V., Luchkina, E. A.,
23714%7.
Zhivotovsky, B., and Gogvadze, V. (2019) Involvement of
88.
Valter, K., Chen, L., Kruspig, B., Maximchik, P., Cui, H.,
mitophagy in cisplatin%induced cell death regulation, Biol.
Zhivotovsky, B., and Gogvadze, V. (2017) Contrasting effects
Chem., 400, 161%170, doi: 10.1515/hsz%2018%0210.
of glutamine deprivation on apoptosis induced by convention%
73.
Raza, M. H., Siraj, S., Arshad, A., Waheed, U., Aldakheel, F.,
ally used anticancer drugs, Biochim. Biophys. Acta Mol. Cell.
Alduraywish, S., and Arshad, M. (2017) ROS%modulated
Res., 1864, 498%506, doi: 10.1016/j.bbamcr.2016.12.016.
therapeutic approaches in cancer treatment, J. Cancer Res.
89.
Renu, K., Abilash, V., G., Tirupathi Pichiah, P. B., and
Clin. Oncol., 143, 1789%1809, doi: 10.1007/s00432%017%
Arunachalam, S. (2018) Molecular mechanism of doxoru%
2464%9.
bicin%induced cardiomyopathy
- an update, Eur. J.
БИОХИМИЯ том 85 вып. 10 2020
1488
ВОСТРИКОВА и др.
Pharmacol., 818, 241%253, doi:
10.1016/j.ejphar.2017.
a review, J. Am. Coll. Nutr., 22, 108%117, doi: 10.1080/
10.043.
07315724.2003.10719283.
90.
Wang, S., Konorev, E. A., Kotamraju, S., Joseph, J.,
97. Alexander, M. S., Wilkes, J. G., Schroeder, S. R., Buettner,
Kalivendi, S., and Kalyanaraman, B. (2004) Doxorubicin
G. R., Wagner, B. A., et al. (2018) Pharmacologic ascor%
induces apoptosis in normal and tumor cells via distinctly
bate reduces radiation%induced normal tissue toxicity and
different mechanisms. intermediacy of H(2)O(2)% and p53%
enhances tumor radiosensitization in pancreatic cancer,
dependent pathways, J. Biol. Chem., 279, 25535%25543,
Cancer Res., 78, 6838%6851, doi: 10.1158/0008%5472.
doi: 10.1074/jbc.M400944200.
CAN%18%1680.
91.
Vijay, K., Sowmya, P. R., Arathi, B. P., Shilpa, S., Shwetha,
98. Kennedy, M., Bruninga, K., Mutlu, E. A., Losurdo, J.,
H. J., Raju, M., Baskaran, V., and Lakshminarayana, R.
Choudhary, S., and Keshavarzian, A. (2001) Successful
(2018) Low%dose doxorubicin with carotenoids selectively
and sustained treatment of chronic radiation proctitis with
alters redox status and upregulates oxidative stress%mediat%
antioxidant vitamins E and C, Am. J. Gastroenterol., 96,
ed apoptosis in breast cancer cells, Food Chem. Toxicol.,
1080%1084, doi: 10.1111/j.1572%0241.2001.03742.x.
118, 675%690, doi: 10.1016/j.fct.2018.06.027.
99. Moss, R. W. (2007) Do antioxidants interfere with radia%
92.
D’Andrea, G. M. (2005) Use of antioxidants during
tion therapy for cancer? Integr. Cancer Ther., 6, 281%292,
chemotherapy and radiotherapy should be avoided, CA
doi: 10.1177/1534735407305655.
Cancer J. Clin., 55, 319%321, doi: 10.3322/canjclin.
100. Delanian, S., Balla%Mekias, S., and Lefaix, J. L. (1999)
55.5.319.
Striking regression of chronic radiotherapy damage in a clin%
93.
Sakamoto, K., and Sakka, M. (1973) Reduced effect of
ical trial of combined pentoxifylline and tocopherol, J. Clin.
irradiation on normal and malignant cells irradiated in vivo
Oncol., 17, 3283%3290, doi: 10.1200/JCO.1999.17.10.3283.
in mice pretreated with vitamin E, Br. J. Radiol., 46, 538%
101. Jaakkola, K., Lahteenmaki, P., Laakso, J., Harju, E.,
540, doi: 10.1259/0007%1285%46%547%538.
Tykka, H., and Mahlberg, K. (1992) Treatment with
94.
Witenberg, B., Kletter, Y., Kalir, H. H., Raviv, Z., Fenig, E.,
antioxidant and other nutrients in combination with
et al. (1999) Ascorbic acid inhibits apoptosis induced by X
chemotherapy and irradiation in patients with small%cell
irradiation in HL60 myeloid leukemia cells, Radiat. Res.,
lung cancer, Anticancer Res., 12, 599%606.
152, 468%478.
102. Umegaki, K., Aoki, S., and Esashi, T. (1995) Whole body
95.
Jung, A. Y., Cai, X., Thoene, K., Obi, N., Jaskulski, S., et
X%ray irradiation to mice decreases ascorbic acid concen%
al. (2019) Antioxidant supplementation and breast cancer
tration in bone marrow: comparison between ascorbic acid
prognosis in postmenopausal women undergoing chemo%
and vitamin E, Free Radic. Biol. Med., 19, 493%497,
therapy and radiation therapy, Am. J. Clin. Nutr., 109, 69%
doi: 10.1016/0891%5849(95)00033%t.
78, doi: 10.1093/ajcn/nqy223.
103. Lenton, K. J., and Greenstock, C. L. (1999) Ability of
96.
Prasad, K. N., Kumar, B., Yan, X. D., Hanson, A. J., and
human plasma to protect against ionising radiation is
Cole, W. C. (2003) Alpha%tocopheryl succinate, the most
inversely correlated with age, Mech. Ageing Dev., 107, 15%
effective form of vitamin E for adjuvant cancer treatment:
20, doi: 10.1016/s0047%6374(98)00128%6.
REACTIVE OXYGEN SPECIES AND ANTIOXIDANTS
IN CARCINOGENESIS AND TUMOR THERAPY
Review
S. M. Vostrikova1,2, A. B. Grinev2, and V. G. Gogvadze1,3*
1 Faculty of Medicine, Lomonosov Moscow State University, 119991 Moscow, Russia;
E-mail: vlad_gogvadze@rambler.ru
2 I.M. Sechenov First Moscow State Medical University, 119991 Moscow, Russia
3 Division of Toxicology, Institute of Environmental Medicine, Karolinska Institute, Stockholm, Sweden
Received July 14, 2020
Revised August 7, 2020
Accepted August 7, 2020
Strictly regulated balance between the formation and utilization of reactive oxygen species (ROS) is the basis of nor%
mal functioning of organisms. ROS play an important role in the regulation of many metabolic processes; however,
excessive content of ROS leads to the development of various disorders, including oncological diseases, as a result of
ROS%induced mutations in DNA. In tumors, high levels of oxygen radicals promote cell proliferation and metastasis.
On the other hand, high content of ROS can trigger cell death, a phenomenon used in the antitumor therapy. Water%
and lipid%soluble antioxidants, as well as antioxidant enzyme systems, can inhibit ROS generation; however, they
should be used with caution. Antioxidants can suppress ROS%dependent cell proliferation and metastasis, but at the
same time, they may inhibit the death of tumor cells if the antitumor therapeutic agents stimulate oxidative stress. The
data on the role of antioxidants in the death of tumor cells and on the effects of antioxidants taken as dietary supple%
ments during antitumor therapy, are contradictory. This review focuses on the mechanisms by which antioxidants can
affect tumor and healthy cells.
Keywords: cancer, antioxidants, carcinogenesis, reactive oxygen species, programmed cell death, mitochondria
БИОХИМИЯ том 85 вып. 10 2020