БИОХИМИЯ, 2020, том 85, вып. 11, с. 1519 - 1539
УДК 577.151;577.181.5
ИНГИБИТОРЫ β ЛАКТАМАЗ.
НОВАЯ ЖИЗНЬ β ЛАКТАМНЫХ АНТИБИОТИКОВ
Обзор
© 2020
А.М. Егоров, М.М. Уляшова, М.Ю. Рубцова*
Московский государственный университет имени М.В. Ломоносова, химический факультет,
119991 Москва, Россия; электронная почта: mrubtsova@gmail.com
Поступила в редакцию 09.07.2020
После доработки 14.08.2020
Принята к публикации 15.08.2020
β Лактамные антибиотики составляют около 60% от всех выпускаемых антибиотиков и благодаря своей вы
сокой активности и минимальным побочным эффектам широко используются для лечения различных ин
фекционных заболеваний человека и животных, включающих тяжелые госпитальные инфекции. Однако
глобальное распространение бактерий, резистентных к β лактамам, привело к их клинической неэффек
тивности. Поиск эффективных способов преодоления устойчивости бактерий к β лактамным антибиоти
кам, преимущественным механизмом которой является синтез разнообразных β лактамаз, разрушающих β
лактамное кольцо антибиотиков, является важнейшей задачей. Данный обзор посвящен анализу специфи
ческих ингибиторов сериновых и металло β лактамаз и подходов к созданию новых ингибиторов, которые
позволят продлить «жизнь» β лактамов.
КЛЮЧЕВЫЕ СЛОВА: антибиотикорезистентность бактерий, β лактамазы, ингибиторы, β лактамные ан
тибиотики.
DOI: 10.31857/S0320972520110020
ЭРА АНТИБИОТИКОВ
ном сходстве β лактамного кольца антибиотика
И РОЛЬ β ЛАКТАМОВ
с концевым D Ala D Ala фрагментом пента
пептидов, входящих в состав пептидогликана.
Инфекционные заболевания на протяжении
β Лактамы образуют ковалентный комплекс с
многих веков оставались постоянной угрозой
серином транспептидазного домена ПСБ и, та
здравоохранению, до начала 1900 х гг. на их до
ким образом, являются необратимыми ингиби
лю приходилось до 25% смертности [1]. Откры
торами синтеза пептидогликана, вызывая лизис
тие в 1929 г. британским микробиологом А. Фле
клеток бактерий и потерю ими жизнеспособ
мингом антимикробных свойств плесени
ности.
Penicillium notatum завершилось созданием пер
Высокая эффективность действия пеницил
вого β лактамного антибиотика - пенициллина
лина и его природных аналогов, относительно
и ознаменовало появление нового класса лекар
низкие токсичность и стоимость промышлен
ственных средств.
ного синтеза послужили толчком к созданию
β Лактамные антибиотики, продуцируемые
новых β лактамных антибиотиков [3]. Целью
различными бактериями и грибами, существуют
химической модификации β лактамов являлось
в природе более 2 млрд лет. Мишенью их
расширение спектра действия, улучшение фар
действия являются пенициллин связывающие
макокинетических свойств, а также противо
белки (ПСБ), катализирующие различные реак
действие механизмам резистентности. В настоя
ции синтеза пептидогликана, - основного эле
щее время к этому классу относятся четыре
мента клеточной стенки бактерий [2]. Антибак
группы соединений, содержащих четырехчлен
териальная активность основана на структур
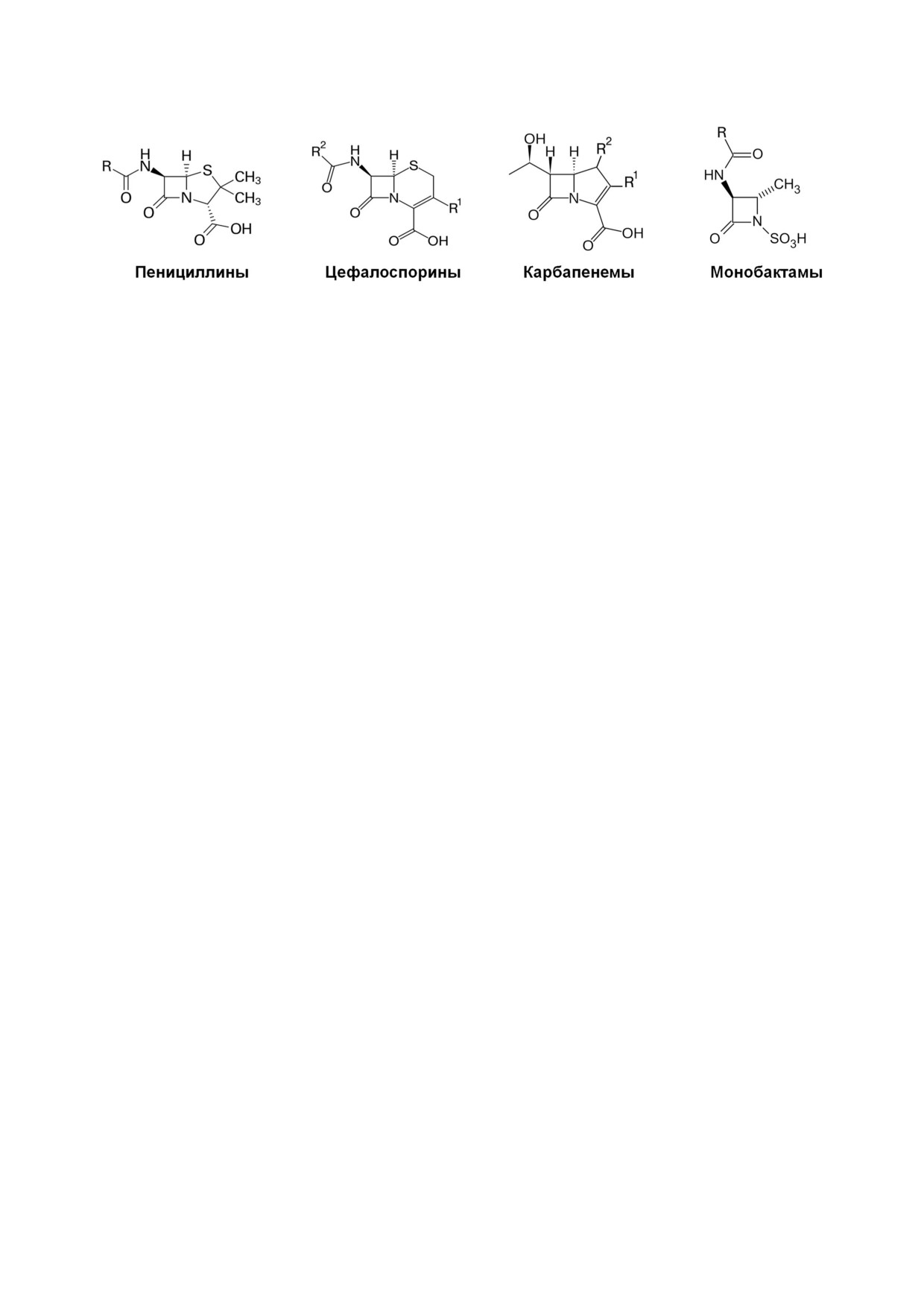
ное β лактамное кольцо: пенициллины, цефа
лоспорины, карбапенемы и монобактамы
(рис. 1).
Принятые сокращения: AMA - аспергилломараз
Открытие пенициллина явилось одним из
мин А; БЛ - β лактамазы; БЛРС - β лактамазы расширен
ного спектра; ДБО - диазабициклооктан; МБЛ - металло
наиболее значимых открытий ХХ века. Успехи в
β лактамазы; ПСБ - пенициллин связывающие белки.
химической модификации пенициллинов, це
* Адресат для корреспонденции.
фалоспоринов и карбапенемов позволили соз
1519
1520
ЕГОРОВ и др.
Рис. 1. Структуры основных групп β лактамных антибиотиков
дать несколько десятков лекарственных препа
лективное давление антибиотиков на микроор
ратов для подавления огромного количества
ганизмы в результате интенсивного использова
бактериальных инфекций, включая их тяжелые
ния в клинической медицине, и особенно в ве
внутрибольничные формы. Отсутствие в орга
теринарии и сельском хозяйстве, часто неконт
низме человека мишени действия β лактамов
ролируемое, привело к развитию различных ме
обуславливает низкую токсичность этого класса
ханизмов устойчивости, к которым относятся
антибиотиков. Благодаря своим свойствам β
эффлюкс (вывод антибиотика из клетки), моди
лактамные антибиотики уже более 70 лет после
фикация поринов - мембранных транспортных
начала их клинического применения остаются
белков, модификация структуры антибиотика
наиболее часто используемыми антибактери
или мишени его действия [6].
альными препаратами. Они составляют около
Бактериальные ферменты участвуют в реа
60% от всех антибиотиков, применяемых в ме
лизации всех механизмов резистентности мик
дицине и сельском хозяйстве для лечения и про
роорганизмов к антибиотикам [7]. Наиболее
филактики инфекционных заболеваний челове
распространенным механизмом устойчивости к
ка и животных [4]. Некоторые антибиотики это
β лактамам является экспрессия специфичес
го класса относятся к так называемой «группе
ких гидролаз - β лактамаз (БЛ, EC 3.5.2.6), ко
резерва».
торые катализируют гидролиз β лактамного
Основным фактором, ограничивающим
кольца антибиотика. Одним из первых был опи
клиническую эффективность β лактамных ан
сан гидролиз пенициллинов у грамположитель
тибиотиков, является эволюция микроорганиз
ных бактерий. Позднее у этих бактерий основ
мов, приводящая к развитию резистентности.
ным стал механизм устойчивости, обусловлен
Согласно отчету Всемирной организации здра
ный приобретением новых генов, например
воохранения (ВОЗ), устойчивость к антимик
mecA у метициллин резистентного стафилокок
робным препаратам была названа в 2019 г. одной
ка (MRSA), которые кодируют дополнительные
из десяти основных угроз здоровью населения
ПСБ с пониженным сродством к β лактамам
во всем мире [5]. В результате «жизненный
[8]. У грамотрицательных бактерий наиболее
цикл» в практической медицине многих β лак
распространенным механизмом устойчивости
тамов оказался ограниченным, а создание но
остается синтез БЛ, они образуют суперсемей
вых соединений этого класса антибактериаль
ство ферментов из ~2800 представителей [9].
ных препаратов фатально сократилось.
Постоянно обновляемая информация о БЛ раз
мещается на сайте National Center for
«ТРАГЕДИЯ» β ЛАКТАМНЫХ
ncbi.nlm.nih.gov/pathogens/beta lactamase data
АНТИБИОТИКОВ, β ЛАКТАМАЗЫ
resources).
И МЕХАНИЗМЫ РЕЗИСТЕНТНОСТИ
Общим свойством этих ферментов является
катализ гидролиза амидной связи β лактамного
Практически одновременно с открытием пе
кольца - главного структурного элемента, обес
нициллина появились первые сообщения о вы
печивающего антибактериальную активность.
делении штаммов микроорганизмов, обладаю
Особенностью БЛ является высокая скорость
щих природной резистентностью к этому анти
мутирования. Кодирующие БЛ гены, как прави
биотику. Это явление представляет собой за
ло, локализованы на мобильных генетических
щитный механизм бактерий, созданный в про
элементах (плазмидах, транспозонах и интегро
цессе их эволюционного развития и конкурент
нах), что способствует их быстрому распростра
ной борьбы с другими микроорганизмами. Се
нению среди бактерий, вызывающих инфекци
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ β ЛАКТАМАЗ
1521
онные заболевания, а также находящихся в ок
века - наиболее распространенными являются
ружающей среде (воде, почве) [10]. Сочетание в
БЛ класса А, относящиеся в первую очередь к
бактериальных клетках генов различных БЛ
типам ТЕМ, CTX M и SHV; в последние годы
вместе с другими генами устойчивости приводит
отмечается экспоненциальный рост карбапене
к появлению «множественной лекарственной
маз классов B, D и А [9].
резистентности» (MDR), «экстремальной лекар
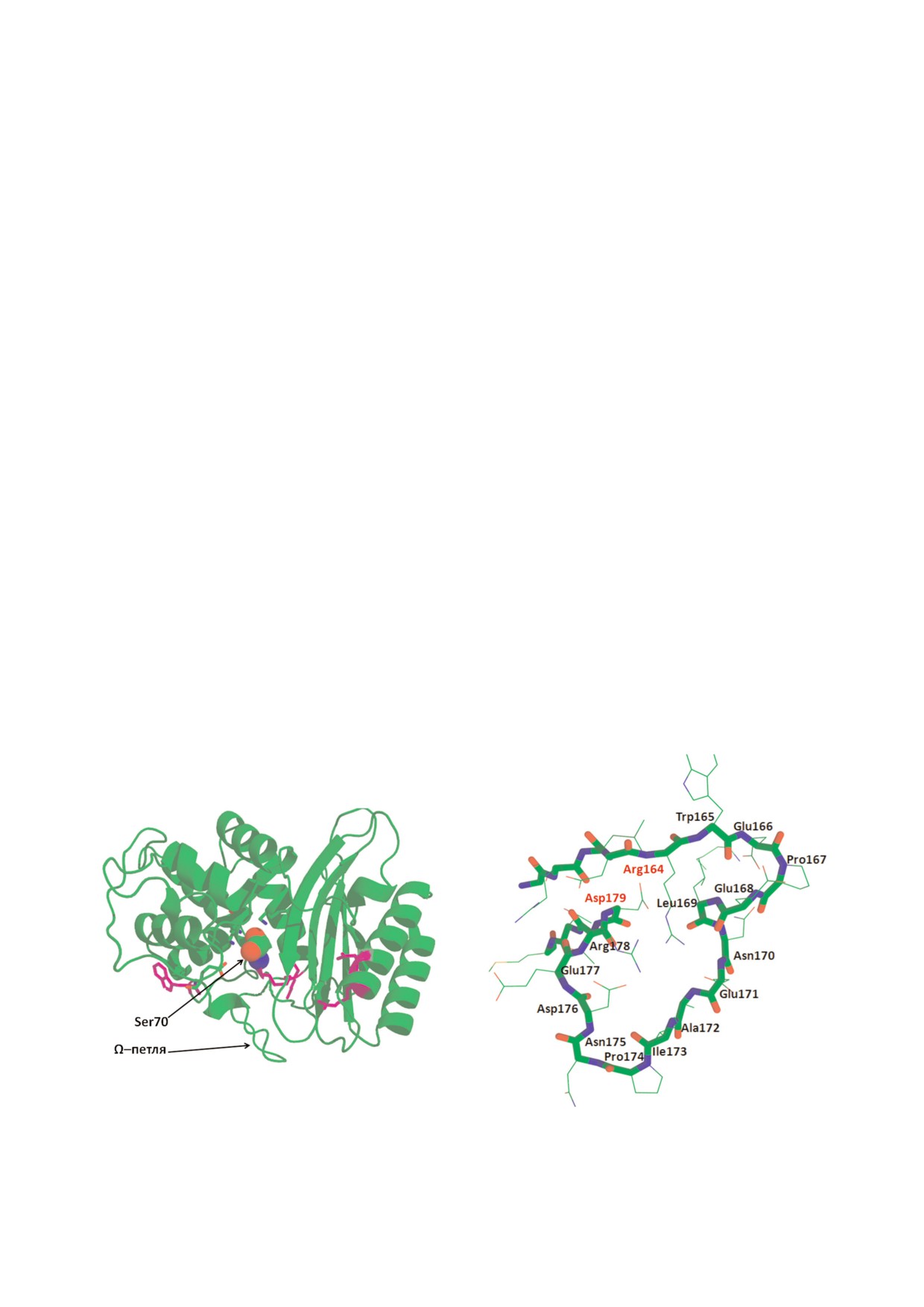
Все сериновые БЛ имеют компактную бел
ственной резистентности» (XDR) и «панрезистент
ковую глобулу, образованную одной полипеп
ности» (PDR) [11]. В результате многие возбуди
тидной цепью, вторичная структура которой
тели инфекций становятся смертельно опасны
включает 11 α спиралей, 5 β листов и петли не
ми и представляют глобальную угрозу.
регулярной структуры (рис. 2, а). Структура се
БЛ имеют общий с ПСБ белок предшест
риновых БЛ относится к типу сэндвич и состоит
венник, поэтому оба семейства характеризуются
из трех α/β/α доменов, соединенных сетью ион
общими структурными элементами. ПСБ и се
ных и водородных связей [12]. Сериновые БЛ
риновые БЛ образуют ковалентный комплекс
имеют компактное ядро скэффолд, состоящее
серина активного центра с молекулой антибио
из сближенных в пространстве α спирали и β
тика (ацил фермент), при этом происходит раз
листа, включающих консервативные участки из
рыв амидной связи в β лактамном кольце. Об
3-4 аминокислот, в том числе каталитический
разование комплекса антибиотика с ПСБ явля
серин. Хотя в целом структура белковой глобу
ется необратимым, что приводит к его ингиби
лы является достаточно жесткой, ее гибкость
рованию.
обусловлена движением петель, в которых чаще
На основании гомологии первичных после
всего происходят мутации [13, 14]. Важным кон
довательностей выделяют четыре молекулярных
сервативным структурным элементом является
класса БЛ: A, B, C и D. Ферменты классов A, C
Ω петля, расположенная в нижней части входа в
и D являются сериновыми гидролазами, пред
карман активного центра и содержащая катали
ставители класса B являются металло фермен
тически важный консервативный остаток Glu
тами и содержат в активном центре один или два
(рис. 2, б). Данный остаток играет ключевую
иона Zn2+ в качестве кофактора. БЛ каждого
роль в процессе деацилирования ацил фермент
класса делятся на типы ферментов, различаю
ного комплекса, в результате чего разрушенная
щихся по субстратной специфичности и
молекула антибиотика выводится из активного
чувствительности к действию различных инги
центра БЛ [15].
биторов. У устойчивых к β лактамам бактерий -
Механизм гидролиза β лактамов сериновы
возбудителей инфекционных заболеваний чело
ми БЛ разных классов достаточно общий и
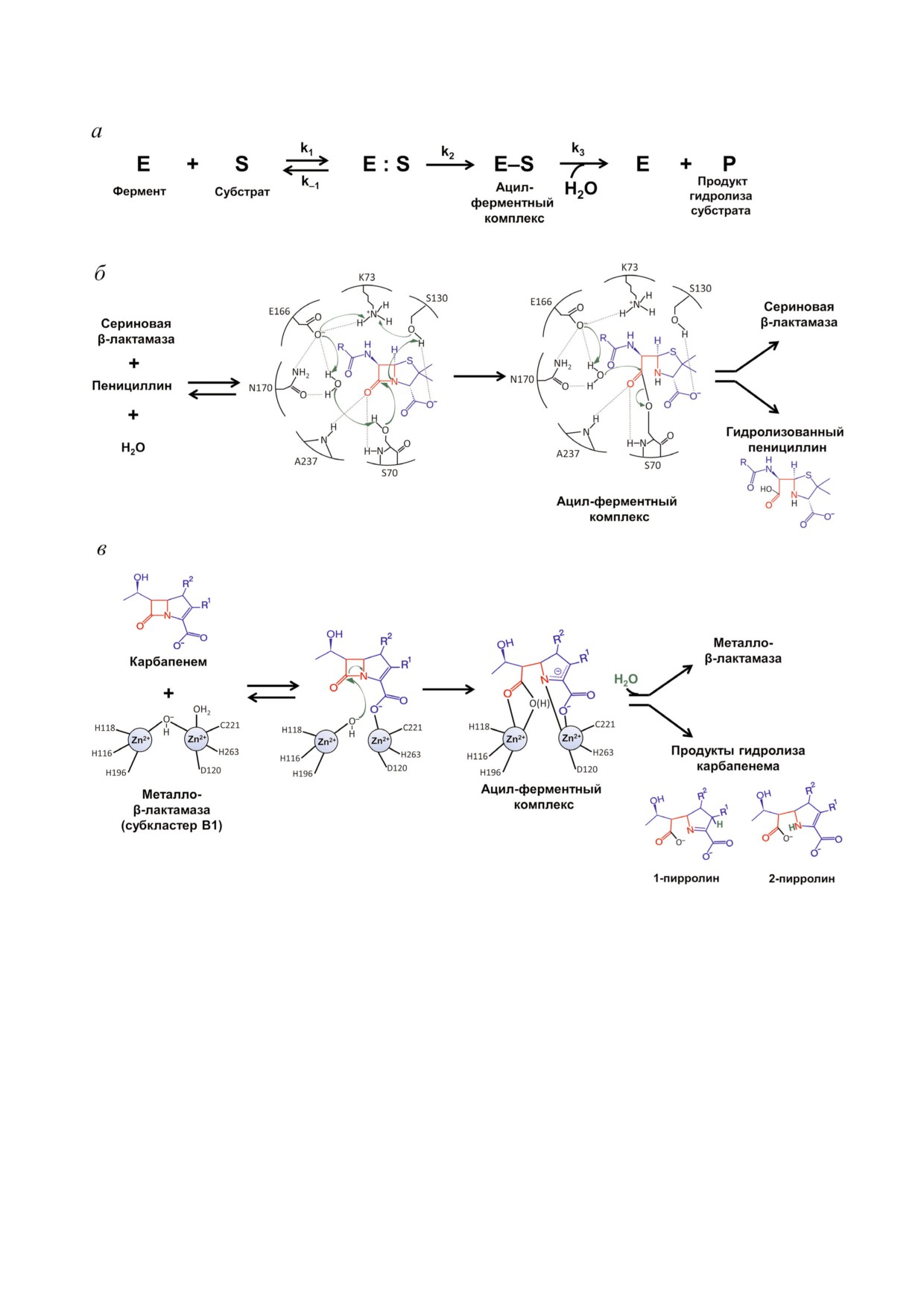
а
б
Рис. 2. а - Структура β лактамазы ТЕМ 1 класса А, каталитический Ser70 представлен в виде шара, б - структура Ω пет
ли β лактамаз ТЕМ типа
БИОХИМИЯ том 85 вып. 11 2020
1522
ЕГОРОВ и др.
включает три основные стадии (рис. 3, а). Об
ментов с расширенной субстратной специфич
щим для всех ферментов является образование
ностью, например карбапенемаз KPC типа
ковалентного ацил ферментного комплекса с
класса А и ОХА типа класса D.
остатком серина, в стабилизации которого при
Наиболее распространенными в настоящее
нимают участие различные а.о. в зависимости от
время являются сериновые БЛ класса А, относя
структуры активного центра. На первом этапе
щиеся к типам TEM, SHV, CTX M и КPC. Каж
происходит ориентация и связывание молекулы
дый тип представляет собой большое семейство
антибиотика в активном центре фермента и ак
от нескольких десятков до нескольких сотен
тивация гидроксильной группы каталитическо
ферментов, имеющих родоначальника, напри
го серина. Для БЛ ТЕМ типа класса А установ
мер ТЕМ 1 или SHV 1. Остальные ферменты
лено, что для активации серина необходимо
каждого типа представляют собой мутантные
депротонирование остатка Lys73. Этот путь де
формы, содержащие от одной до нескольких
протонирования включает образование цепочки
аминокислотных замен. Ферменты типов ТЕМ
водородных связей с участием остатков Glu166 и
и SHV разделяются на БЛ широкого спектра,
Asn170 Ω петли и молекулы воды (рис. 3, б) [16].
гидролизующие только пенициллины и цефа
Альтернативный путь депротонирования остат
лоспорины I поколения, и БЛРС с мутациями
ка Lys73 происходит с участием Ser130, располо
ключевых остатков, гидролизующие пеницил
женного на SDN петле (остатки Ser130 Asn132).
лины и цефалоспорины I-IV поколений. Осо
Далее гидроксильная группа серина действует
бенностью БЛ SHV типа является наличие вста
как нуклеофил и атакует карбонильную группу
вок в аминокислотную последовательность, в
β лактамного кольца антибиотика с образова
частности у БЛ SHV 16 имеется повтор участка
нием высокореакционного тетраэдрического
Ω петли от остатка Asp163 до остатка Thr168,
ацилированного интермедиата, превращающе
включающего каталитически важный остаток
гося в низкоэнергетический ацил ферментный
Glu166 [19]. Этот фермент характеризуется уве
комплекс, в котором серин активного центра
личенной конформационной подвижностью ка
ковалентно связан с молекулой антибиотика.
талитических участков, что улучшает доступ в
На третьей стадии молекула воды, координиро
активный центр цефалоспоринов III поколе
ванная в активном центре фермента с участием
ния, но при этом термостабильность фермента
остатка Glu166 и других заряженных остатков
понижается. По видимому, это связано с пере
Ω петли, атакует ковалентный ацил фермент
распределением внутренних контактов между
ный комплекс. В результате деацилирования
а.о. петли и их контактов с другими а.о. белко
амидной связи β лактамное кольцо молекулы
вой глобулы, которые изменяют стабильность
антибиотика разрушается, он выходит из актив
белковой глобулы [20].
ного центра, и молекула фермента высвобожда
Субстратами БЛ типа СТХ М являются це
ется для следующего каталитического акта [17].
фалоспорины III-IV поколений. Все ферменты
Причиной модификации структуры β лакта
этого типа являются БЛРС, и их распростране
маз являются мутации в кодирующих генах, ко
ние среди клинических возбудителей приняло
торые затрагивают как аминокислоты активного
глобальный характер [21]. На основании гомо
центра БЛ, так и периферийные области белко
логии первичных последовательностей БЛ этого
вой глобулы. Некоторые мутации, называемые
типа разделяются на пять субкластеров, они ха
ключевыми, приводят к изменениям структур
рактеризуются более низкой гомологией по
ных элементов, образующих активный центр. В
сравнению с ферментами типов ТЕМ и SHV
результате у мутантных ферментов изменяются
[22]. Различия в субстратной специфичности
каталитическая активность и субстратная спе
ферментов типа СТХ М состоят в изменениях
цифичность. Например, мутации остатков Ω
каталитической активности в отношении раз
петли (Arg164, расположенного на N конце пет
личных цефалоспоринов III поколения (цефо
ли у БЛ ТЕМ типа, и Asp179, расположенного
таксима, цефтазидима и цефепима). Особен
на С конце петли у БЛ SHV типа) приводят к
ностью данных ферментов является появление
изменению конформации петли и увеличению
гибридных ферментов, имеющих фрагменты
объема активного центра, в результате образу
структуры БЛ из разных субкластеров, напри
ются стабильные комплексы фермента с окси
мер БЛ СТХ М 116,
123 и
132 являются гиб
имино цефалоспоринами, имеющими объем
ридами БЛ СТХ М 15 и СТХ М 14 [23-25].
ные боковые группы [18]. Таким образом появи
Ключевые замены у этих ферментов способ
лись БЛ расширенного спектра (БЛРС), кото
ствуют улучшению эффективности гидролиза
рые эффективно гидролизуют цефалоспорины
цефтазидима, наиболее распространенными из
II-IV поколений [9]. Другим направлением эво
них являются Asp240Gly и замена в Ω петле
люции БЛ является появление новых типов фер
Pro167Ser/Thr.
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ β ЛАКТАМАЗ
1523
Комплекс
Михаэлиса-
Ментен
Комплекс
Михаэлиса-Ментен
Комплекс
Михаэлиса-Ментен
Рис. 3. а - Общая схема гидролиза β лактамных антибиотиков β лактамазами, б - механизм гидролиза пенициллина
β лактамазами класса А, в - механизм гидролиза карбапенемов металло β лактамазами
У БЛ класса С каталитическим является
рый занимает оптимальное положение в струк
Ser64, в роли общего основания выступает
туре фермента для активации молекулы воды,
Tyr150, важную роль в правильной фиксации
аналогичное Lys73 у ферментов класса А.
молекулы субстрата играет остаток Asn152 (ана
Молекулярный класс В объединяет большое
лог Asn132 у БЛ класса А). У БЛ класса D ката
семейство металло БЛ (МБЛ), содержащих в
литическим является Ser67, однако механизм
качестве кофактора один или два иона Zn2+ и
его активации для последующей нуклеофиль
гидролизующих три группы β лактамов (пени
ной атаки β лактамного кольца остаётся неяс
циллины, цефалоспорины и карбапенемы) (рис.
ным. По видимому, роль общего основания у
3, в) [16, 17]. Эволюционно они отделились от
этих ферментов выполняет остаток Lys70, кото
предшественников ПСБ раньше других БЛ и яв
БИОХИМИЯ том 85 вып. 11 2020
1524
ЕГОРОВ и др.
ляются членами огромного суперсемейства ме
фективно гидролизуют только карбапенемы и
талло гидролаз. На основании гомологии пер
проявляют низкую активность в отношении пе
вичной структуры, субстратного профиля и ко
нициллинов и цефаллоспоринов. Это может
личества ионов Zn2+ МБЛ делятся на три суб
быть связано с тем, что у данных ферментов ос
кластера: В1, В2 и В3. Ферменты субкластеров
таток His116, консервативный у МБЛ субклас
В1 и В3 являются бицинковыми, субкластера
теров В1 и В3, заменен на аспарагин.
В2 - моноцинковыми. Особенностью МБЛ яв
Процесс эволюции БЛ способствовал разви
ляется низкая степень гомологии (не более 20%
тию защитных механизмов бактерий и потере
внутри субкластеров), даже остатки, участвую
эффективности β лактамных антибиотиков.
щие в координации ионов металла, не являются
Согласно прогнозам ВОЗ, смертность от ин
консервативными у ферментов разных субклас
фекций, вызванных резистентными к антимик
теров. К наиболее клинически значимым типам
робным препаратам микроорганизмами, к се
МБЛ относятся ферменты субкластера В1: VIM,
редине XXI века может превысить смертность
IMP, и NDM.
от рака, и человечество может вернуться в доан
Активный центр МБЛ располагается на дне
тибиотическую эру [28]. Учитывая тот факт, что
широкой неглубокой впадины между двумя β
последний новый класс антибактериальных
листами. У ферментов субкластера В1 ион Zn2+ в
препаратов был открыт более 30 лет назад, раз
первом Zn связывающем центре имеет тетраэд
работка подходов возвращения активности β
рическое окружение с участием остатков His116,
лактамных антибиотиков является первооче
His118, His196, во втором - является пента ко
редной задачей для практического здравоохра
ординированным с участием остатков His263,
нения всего мира.
Cys221 и Asp120 (рис. 3, в) [16, 26]. В координа
Далее будут рассмотрены подходы к преодо
ции ионов Zn2+ принимают участие две молеку
лению резистентности к β лактамным антибио
лы воды, одна из которых (соединительная) со
тикам на основе ингибирования действия БЛ.
единяет два иона металла, другая (апикальная)
связана со вторым ионом Zn2+. Ионы металла
субкластера В3 сохраняют координацию с теми
ИНГИБИТОРЫ β ЛАКТАМАЗ
же остатками в первом центре связывания, во
втором - цистеин заменен на гистидин. Отли
Несмотря на различия в первичной структуре
чительной особенностью МБЛ субкластеров В1
сериновых БЛ, механизм их действия консерва
и В3 является подвижная L3 петля, располо
тивен, поэтому первоначально для поиска инги
женная у входа в активный центр между α3 спи
биторов был использован принцип конкурент
ралью и β7 листом. Конформация петли изме
ного ингибирования с использованием низко
няется при связывании субстрата, что приводит
молекулярных соединений, имеющих в структу
к изменениям эффективных значений диэлект
ре β лактамное кольцо. Выбор ингибиторов
рической проницаемости и стабилизирует про
состоял в поиске соединений, образующих бо
межуточные формы фермент субстратных
лее стабильный ацил ферментный комплекс, не
комплексов [26, 27].
подверженный деацилированию.
При связывании антибиотика бицинковыми
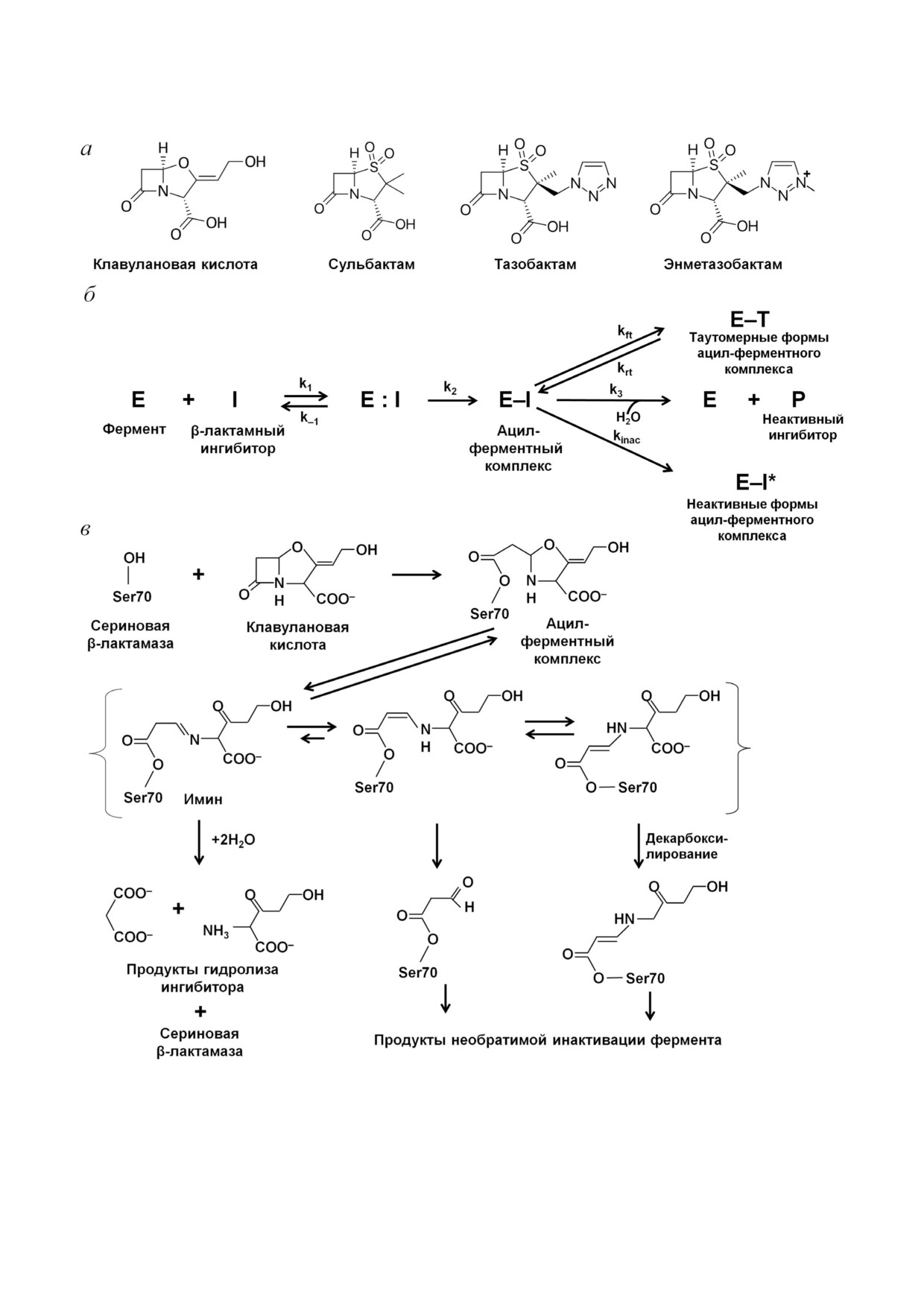
Ингибиторы сериновых β лактамаз I поколе
МБЛ происходит координация второго иона
ния. К ингибиторам БЛ I поколения относятся
Zn2+ с карбоксильной группой субстрата, выс
соединения на основе сульфонов и оксапене
вобождая гидроксид ион (рис. 3, в) [16]. Ион
мов, имеющих в своей структуре β лактамное
металла оттягивает электронную плотность с
кольцо (рис. 4, а). Основными представителями
карбонильного атома кислорода, повышая и
этой группы ингибиторов являются клавулано
стабилизируя положительный заряд на нем. Ко
вая кислота, сульбактам и тазобактам.
ординированный с ионом Zn2+ гидроксид ион
Первым ингибитором сериновых БЛ является
является лучшим нуклеофилом, чем молекула
клавулановая кислота, обнаруженная в 1980 х гг.
воды, он атакует карбонильный атом углерода
при скрининге природных соединений, выде
молекулы антибиотика. Образуется промежу
ленных из Streptomyces clavuligerus [29]. В своей
точный продукт с отрицательным зарядом, де
структуре она имеет β лактамное кольцо, кон
локализованным в пирролидиновом кольце. Да
денсированное с 5 членным кольцом, содержа
лее происходит протонирование с участием мо
щим атом кислорода и имеющим карбоксиль
лекулы воды, либо атома С2 с образованием 1
ную группу в качестве заместителя (рис. 4, а).
пирролина, либо атома N4 с образованием 2
Клавулановая кислота проявляет небольшую
пирролина.
собственную антимикробную активность, одна
Моноцинковые МБЛ субкластера В2 явля
ко при использовании ее в комбинации с амок
ются исключительно карбапенемазами: они эф
сициллином минимальная подавляющая кон
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ β ЛАКТАМАЗ
1525
центрация (МПК) антибиотика уменьшается в
вация с образованием таутомера E-T и медлен
отношении различных грамотрицательных бак
ное деацилирование с регенерацией активного
терий, продуцирующих БЛ класса А [30]. Позже
фермента E. Идеальным является ингибитор, у
были синтезированы другие соединения этой
которого преимущественной является необра
группы - сульбактам и тазобактам [31, 32]. Эти
тимая инактивация.
два ингибитора являются сульфонами пеницил
В качестве примера (рис. 4, в) представлен
лановой кислоты и имеют β лактамное кольцо,
механизм ингибирования сериновых БЛ класса
конденсированное с 5 членным кольцом, со
А клавулановой кислотой. Образование ацил
держащим карбоксильную группу (рис. 4, а).
ферментного комплекса происходит аналогич
Они отличаются по заместителю в положении
но взаимодействию β лактамных антибиотиков:
С2, который у сульбактама представляет собой
активация гидроксильной группы серина проте
метильную группу, а у тазобактама - триазолил
кает с участием остатков Lys73, Ser130 и Glu166
содержащий фрагмент.
[22]. После ацилирования молекула ингибитора
Все три соединения являются ингибиторами
подвергается β элиминации, что приводит к
сериновых БЛ класса А и обладают различной
раскрытию 5 членного оксазольного кольца с
ингибирующей способностью: клавулановая
образованием переходного промежуточного
кислота и тазобактам обладают сравнимой ин
имин ацил фермента. Этот комплекс может
гибирующей активностью в отношении фер
подвергаться таутомеризации с образованием
ментов типов ТЕМ, SHV и CTX M и более эф
промежуточных енаминов в транс или цис
фективны, чем сульбактам [33]. Однако суль
конформации. Транс и цис енамины имеют
бактам имеет более высокую собственную анти
сопряженную систему двойных связей с карбо
бактериальную активность, т.е. взаимодействует
нильной связью, что затрудняет нуклеофильную
с ПСБ. Сульбактам и клавулановая кислота об
атаку молекулой воды карбонильного углерода
ладают низкой ингибирующей активностью в
и препятствует быстрому деацилированию [37].
отношении KPC и других сериновых карбапене
В зависимости от строения активного центра БЛ
маз класса А.
и свойств ингибитора промежуточный имин/
Новым представителем класса β лактамных
енаминовый комплекс может претерпевать ряд
ингибиторов является производное тазобакта
перегруппировок с образованием в результате
ма - энметазобактам, представляющий собой
неактивных форм фермента или подвергаться
метилированный сульфон пенициллановой
медленному деацилированию с регенерацией
кислоты (рис. 4, а). Он характеризуется улуч
активной БЛ. Существует несколько возмож
шенными свойствами проникновения в бакте
ностей необратимой инактивации: образование
риальную клетку и обладает активностью про
комплексов фермента с фрагментами ингибито
тив многих сериновых БЛ класса А, особенно
ра с молекулярной массой 70 или 88 Да, присое
БЛРС [34].
диненными к Ser70; декарбоксилирование ена
Все представители ингибиторов I поколения
минной формы и последующий медленный гид
имеют общий механизм ингибирования серино
ролиз образовавшихся сложных эфиров; нуклео
вых БЛ класса А (рис. 4, б) [17]. Связывание мо
фильная атака Ser130 линейного имин ациль
лекул β лактамных ингибиторов в активном
ного комплекса фермента, в результате чего
центре фермента происходит аналогично β лак
происходит фрагментация ингибитора и образу
тамным антибиотикам. На начальном этапе об
ется комплекс фермента с фрагментом ингиби
разуется нековалентный комплекс (E : I), кар
тора с молекулярной массой 52 Да. Этот комп
боксильный фрагмент молекулы ингибитора
лекс подвергается дальнейшей деградации, что
располагается в консервативной области актив
приводит к нескольким формам инактивиро
ного центра, он связывается водородными свя
ванного фермента.
зями с остатками Thr235 и Ser130 и находится в
Ингибиторы I поколения эффективны в от
пределах расстояний электростатического взаи
ношении сериновых БЛ класса А, но мало эф
модействия от остатков Arg244 и Lys234 [35].
фективны в отношении сериновых БЛ классов
Карбонильный кислород располагается в окси
C и D. Только тазобактам обладает невысокой
анионном кармане, образованном атомами азо
активностью в отношении БЛ класса С [38], а
та пептидного остова остатков Ser70 и Ala237,
его производное - энметазобактам - может ин
тем самым ориентируя карбонильный углерод
гибировать некоторые БЛ ОХА типа [34]. Пос
для нуклеофильной атаки каталитическим Ser70
кольку строение активного центра МБЛ карди
и образования ацил фермента E-I [36]. Сущест
нально отличается от сериновых БЛ, ингибито
вует три возможных пути дальнейших превра
ры этой группы неактивны в отношении этих
щений ацил ферментного комплекса: необра
ферментов и, более того, являются субстратами
тимая инактивация (E-I*), обратимая инакти
для МБЛ, т.е. гидролизуются ими [39].
БИОХИМИЯ том 85 вып. 11 2020
1526
ЕГОРОВ и др.
Комплекс
Михаэлиса-
Ментен
Цис енамин
Транс енамин
Рис. 4. а - Структурные формулы β лактамных ингибиторов I поколения, б - схема ингибирования сериновых β лакта
маз класса А β лактамными ингибиторами, в - механизм ингибирования β лактамаз класса А клавулановой кислотой и
пути превращений ацил ферментного комплекса
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ β ЛАКТАМАЗ
1527
Ингибирующее действие фармацевтических
щих по такому же механизму, оказался принци
комбинаций ингибиторов I поколения с β лакта
пиально ограниченным: ацил ферментные
мами. Все описанные выше β лактамные инги
комплексы с данными ингибиторами могут раз
биторы применяются в клинической практике в
рушаться по другим механизмам, и широкое ис
фармацевтических комбинациях с антибиоти
пользование ингибиторов в составе фармацев
ками. Принцип выбора сочетаний антибио
тических комбинаций стимулировало развитие
тик/ингибитор основан на подборе соединений,
резистентности к ним. Кроме этого, существуют
обладающих сходными фармакокинетическими
трудности поиска подходящих комбинаций ан
свойствами, т.е. они действуют либо одновре
тибиотик/ингибитор, выбор пар является огра
менно, либо ингибитор связывается с фермен
ниченным из за различий в фармакокинетичес
том раньше субстрата. В настоящее время широ
ких свойствах.
ко используются следующие фармацевтические
Огромным вызовом для клинической меди
комбинации: амоксициллин/клавулановая кис
цины явилось появление мультирезистентных
лота, тикарциллин/клавулановая кислота, ам
возбудителей инфекционных заболеваний, ус
пициллин/сульбактам и пиперациллин/тазо
тойчивых одновременно к разным классам ан
бактам [40, 41]. Недавно была одобрена новая
тибиотиков. Как правило, эти бактерии являют
комбинация с новым антибиотиком группы це
ся продуцентами нескольких БЛ, относящихся
фалоспоринов (цефтолозан/тазобактам), пока
к разным классам, и поэтому использование для
завшая свою эффективность для лечения ос
их подавления ингибиторов β лактамной при
ложненных инфекций [42]. Ее преимуществами
роды ограничено из за узкой специфичности,
являются высокая активность против БЛРС
отсутствия активности в отношении БЛ классов
продуцирующих бактерий семейства Entero
В, C и D, а также способности МБЛ разрушать
bacteriaceae и Pseudomonas aeruginosa с множест
данные ингибиторы. Для подавления мультире
венной лекарственной устойчивостью [43, 44].
зистентных патогенов была разработана новая
На третьей фазе клинических исследований на
группа β лактамных препаратов - карбапенемы
ходится комбинация с новым β лактамным ин
(рис. 1), и для лечения тяжелых инфекций было
гибитором (цефепим/энметазобактам), пока
предложено использовать их комбинации. Пер
завшая активность in vitro при подавлении ус
вой была комбинация эртапенема и высоких
тойчивости штаммов семейства Enterobacteria
концентраций дорипенема или меропенема, ис
ceae, продуцирующих карбапенемазы KPC типа
пользованная для подавления мультирезистент
[45].
ных бактерий семейства Enterobacteriaceae [46].
Несмотря на положительный опыт исполь
Предполагаемый механизм действия данного
зования в клинической практике комбинаций
сочетания препаратов заключается в том, что
пенициллинов и цефалоспоринов с β лактам
эртапенем, характеризующийся высоким срод
ными ингибиторами I поколения против сери
ством к карбапенемазам KPC типа, образует с
новых БЛ класса А, которые остаются самыми
ними стабильный комплекс и ингибирует их, в
распространенными, в последние годы стало
то время как меропенем или дорипенем
очевидно, что данный подход имеет серьезные
действуют как антибактериальные препараты на
ограничения. Для всех ингибиторов β лактам
ПСБ и подавляют рост бактерий. На модельных
ной природы были обнаружены медленные ста
клетках in vitro и in vivo было продемонстрирова
дии деацилирования ацил ферментных комп
но, что данные двойные комбинации снижают
лексов, т.е. ни один из них не является необра
бактериальный рост клеток на три и один поря
тимым. Эволюция механизмов резистентности у
док величины соответственно. Клинические ис
сериновых БЛ привела к появлению мутаций
следования подтвердили эффективность данной
некоторых периферийных остатков (например,
комбинированной терапии в сравнении с други
остатков 69, 130, 244, 275 и 276 у БЛ ТЕМ типа),
ми антибактериальными препаратами, однако
которые приводят к устойчивости к ингибито
только в отношении патогенов, продуцирую
рам β лактамной природы [13]. Мутации неко
щих БЛ KPC типа [47].
торых остатков БЛ разрушают сеть водородных
Новое поколение ингибиторов. Появление
связей, участвующих в депротонировании Ser70
новой группы β лактамных антибиотиков -
и таким образом затрудняют образование ацил
карбапенемов для лечения тяжелых внутриболь
ферментного комплекса. Другие мутации БЛ из
ничных инфекций привело к появлению новых
меняют распределение заряженных групп, что
БЛ - карбапенемаз, способных их гидролизо
приводит к смещениям положения молекулы
вать. По своему строению данные ферменты
воды и снижению сродства к ингибиторам.
очень разнообразны и относятся к разным моле
Подход к поиску конкурентных ингибито
кулярным классам. В связи с ростом продуциру
ров на основе аналогов субстратов, действую
ющих карбапенемазы бактерий возбудителей
БИОХИМИЯ том 85 вып. 11 2020
1528
ЕГОРОВ и др.
инфекционных заболеваний требовалось созда
ванном состоянии, что делает невозможным
ние новых ингибиторов с более широкой инги
дальнейшее деацилирование с участием остат
бирующей специфичностью по сравнению с β
ков петли [50]. Гидролиз молекулы ингибитора
лактамными ингибиторами I поколения.
также затруднен вследствие наличия в аромати
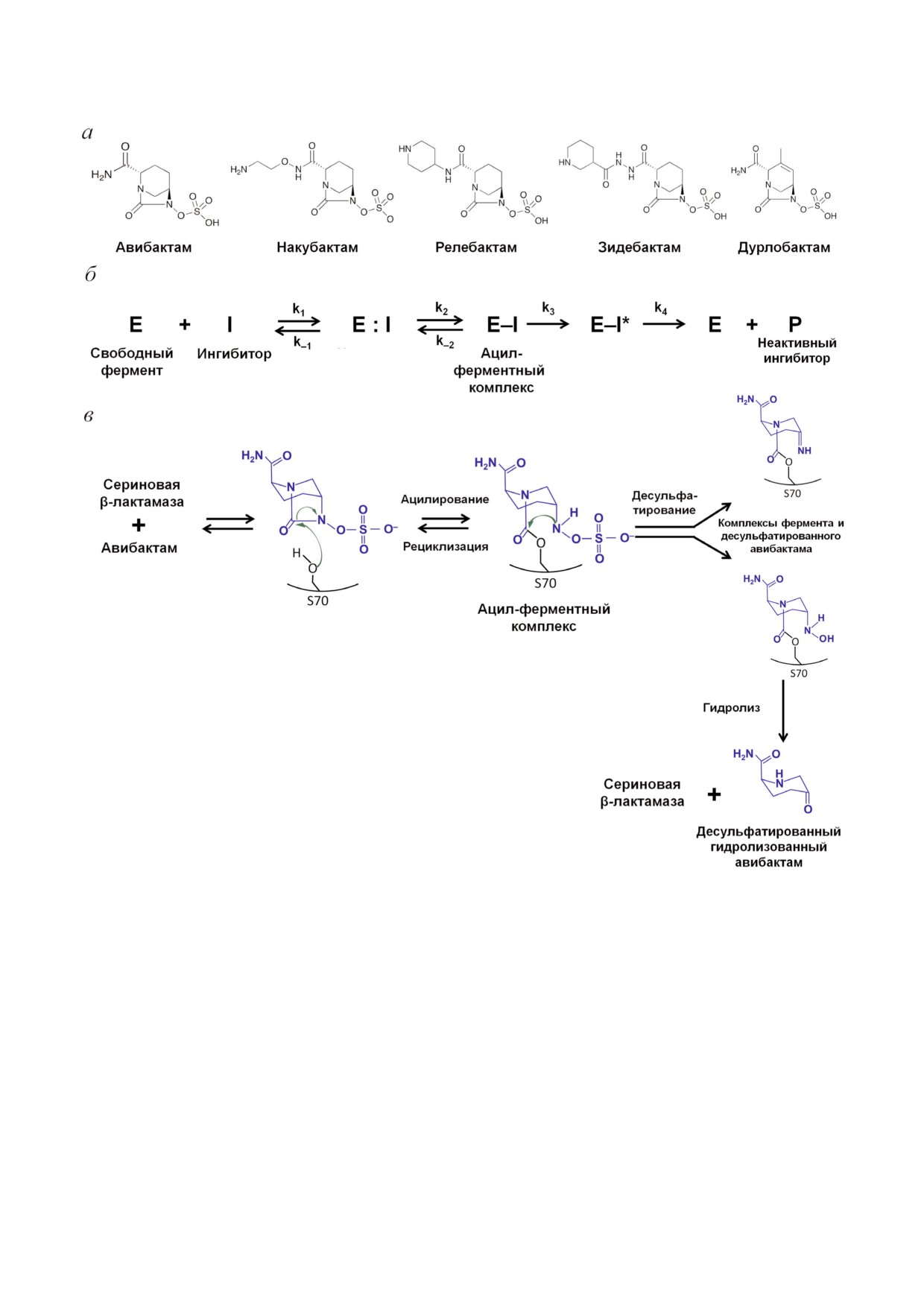
Ингибиторы группы диазобициклооктанов.
ческой системе атома азота, связанного с ато
Первые не β лактамные ингибиторы сериновых
мом углерода карбонильной группы. Для этих
БЛ, относящиеся к классу мостиковых диазаби
ингибиторов возможны два других пути разру
циклооктанов (ДБО), были предложены в сере
шения ацил ферментного комплекса (рис. 5, в):
дине 1990 х гг. [48]. К настоящему времени эта
рециклизация кольца ДБО с высвобождением
группа включает авибактам, релебактам, наку
нативной молекулы ингибитора, которая даль
бактам, зидебактам и дурлобактам (рис. 5, а), их
ше может опять взаимодействовать с фермен
общим структурным элементом является 5
том; и медленное десульфатирование, в резуль
членное бициклическое ядро ДБО. Различия
тате которого молекула ингибитора гидролизу
между ингибиторами определяются типом за
ется и не может больше участвовать в подавле
местителей у атома C2, у дурлобактама в ядре
нии активности БЛ. Рециклизация наблюдается
ДБО имеется двойная связь. В отличие от кар
у БЛ классов С и А, за исключением ферментов
боксильной группы в β лактамных ингибито
KPC типа, у ферментов класса D этот процесс
рах, у данных ингибиторов имеется отрицатель
протекает существенно медленнее [50]. У фер
но заряженная сульфатная группа.
ментов КРС типа преимущественно происхо
Механизм ингибирования БЛ обусловлен
дит десульфатирование.
взаимодействием серина активного центра с
Авибактам. Преимуществами авибактама
амидной группой кольца ДБО (рис. 5, б). Пра
перед β лактамными ингибиторами I поколе
вильная ориентация молекулы ингибитора в
ния являются высокая активность против кли
активном центре фермента обеспечивается сох
нически значимых БЛ CTX M 15 класса A и БЛ
ранением расстояния между карбонильным
AmpC класса C, а также длительный период по
кислородом и отрицательно заряженным ато
лувыведения [51]. Использование авибактама в
мом кислорода сульфатной группы, которое
комбинации с цефтазидимом было эффективно
аналогично расстоянию между эквивалентны
против мультирезистентных бактерий семейства
ми атомами (карбонильным кислородом и кис
Enterobacteriaceae и P. aeruginosa [52]. В то же
лородом карбоксильной группы) в ингибиторах
время авибактам не способен инактивировать
β лактамной природы. Карбоксамидная боко
МБЛ и большинство ферментов класса D (кро
вая цепь взаимодействует с заряженными ос
ме OXA 48), поэтому данная комбинация не мо
татками Asn/Gln, входящими в состав триады
жет быть использована против карбапенем ре
консервативных остатков с участием каталити
зистентных штаммов Acinetobacter spp. и P. aerugi-
ческого серина (Ser X Asn) и Ω петли. В ре
nosa, а также против МБЛ продуцирующих
зультате образования ацил ферментного комп
штаммов Enterobacteriaceae [53].
лекса с каталитическим серином происходит
В настоящее время проводятся испытания
разрыв связи C7 N6 и раскрытие 5 ти членного
фармацевтической комбинации азтреонам/ави
кольца ДБО [49].
бактам в отношении мультирезистентных штам
Существует несколько отличий в строении
мов Enterobacteriaceae, продуцирующих серино
ацил ферментных комплексов БЛ с ингибито
вые БЛ совместно с МБЛ [54]. Этот выбор обус
рами ДБО по сравнению с комплексами с β
ловлен тем, что МБЛ не гидролизуют монобак
лактамными ингибиторами: сульфатная группа
тамы, а авибактам добавляется для ингибирова
взаимодействует с консервативной триадой ос
ния БЛРС и сериновых карбапенемаз.
татков Lys Thr Gly, атом N6 взаимодействует с
Релебактам. Релебактам отличается от ави
консервативными остатками Ser130 сериновых
бактама наличием пиперидинового кольца. Он
БЛ класса A или Tyr150 сериновых БЛ класса C.
используется в комбинации с имипенемом для
Образование дополнительных связей молекулы
лечения осложненных инфекций мочевыводя
ингибитора в активном центре фермента обус
щих путей и интраабдоминальных инфекций,
ловливает их более широкую специфичность в
вызванных устойчивыми к карбапенемам штам
отношении БЛ разных классов.
мами Enterobacteriaceae и P. aeruginosa, продуци
У ингибиторов данного типа наблюдается
рующими БЛ KPC типа класса А и БЛ класса С
изменение механизмов модификации ацил
[55]. Комбинация имипенем/релабактам пока
ферментного комплекса: в БЛ класса A атом
зала хорошую активность в отношении штам
азота молекулы ингибитора образует водород
мов Klebsiella pneumoniae и Enterobacter spp., ус
ную связь с молекулой воды, в результате чего
тойчивых к имипенему вследствие экспрессии
остаток Glu166 Ω петли находится в протониро
БЛРС или БЛ AmpC класса С и нарушения про
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ β ЛАКТАМАЗ
1529
Комплекс
Михаэлиса-
Ментен
Комплекс
Михаэлиса-Ментен
Рис. 5. а - Структурные формулы ингибиторов группы диазобициклооктанов, б - схема обратимого ингибирования се
риновых β лактамаз авибактамом, в - механизм ингибирования сериновых β лактамаз авибактамом
ницаемости клеточной стенки. Однако эта ком
фепином проявляют активность против серино
бинация была неэффективной для штаммов
вых БЛ классов A и C, а также МБЛ [57, 58]. Зи
Enterobacteriaceae, экспрессирующих БЛ OXA
дербактам может ингибировать β лактамазу
48 или МБЛ [56].
ОХА 48 класса D. Дурлобактам был специально
Накубактам, зидебактам, дурлобактам. К
разработан для расширения спектра ингибиро
новым ингибиторам группы ДБО относятся на
вания в отношении различных БЛ класса D
кубактам, зидебактам и дурлобактам. К их преи
(OXA 48 бактерий семейства Enterobacteriaceae
муществам можно отнести собственную анти
и OXA 23/24/58 Acinetobacter baumannii) [59].
бактериальную активность, обусловленную вза
Этот ингибитор используется в комбинации с
имодействием с некоторыми ПСБ. Комбинации
сульбактамом, который, кроме способности ин
накубактама с меропенемом и зидебактама с це
гибировать сериновые БЛ класса А, имеет анти
2 БИОХИМИЯ том 85 вып. 11 2020
1530
ЕГОРОВ и др.
бактериальную активность и связывается с не
Enterobacteriaceae и P. aeruginosa [66]. Этот инги
которыми ПСБ у Acinetobacter spp., Neisseria gon-
битор показал в 50-50 000 раз более высокую
orrhoeae и Haemophilus influenza [60]. Показано,
эффективность в отношении клинически зна
что комбинация этих двух ингибиторов обеспе
чимых МБЛ по сравнению с ваборбактамом.
чивает хорошую активность против множест
Рентгеноструктурный анализ комплексов
венной лекарственной устойчивости у A. bau-
двух клинически значимых БЛ (сериновой БЛ
mannii.
CTX M 15 и МБЛ VIM 2) с таниборбактамом
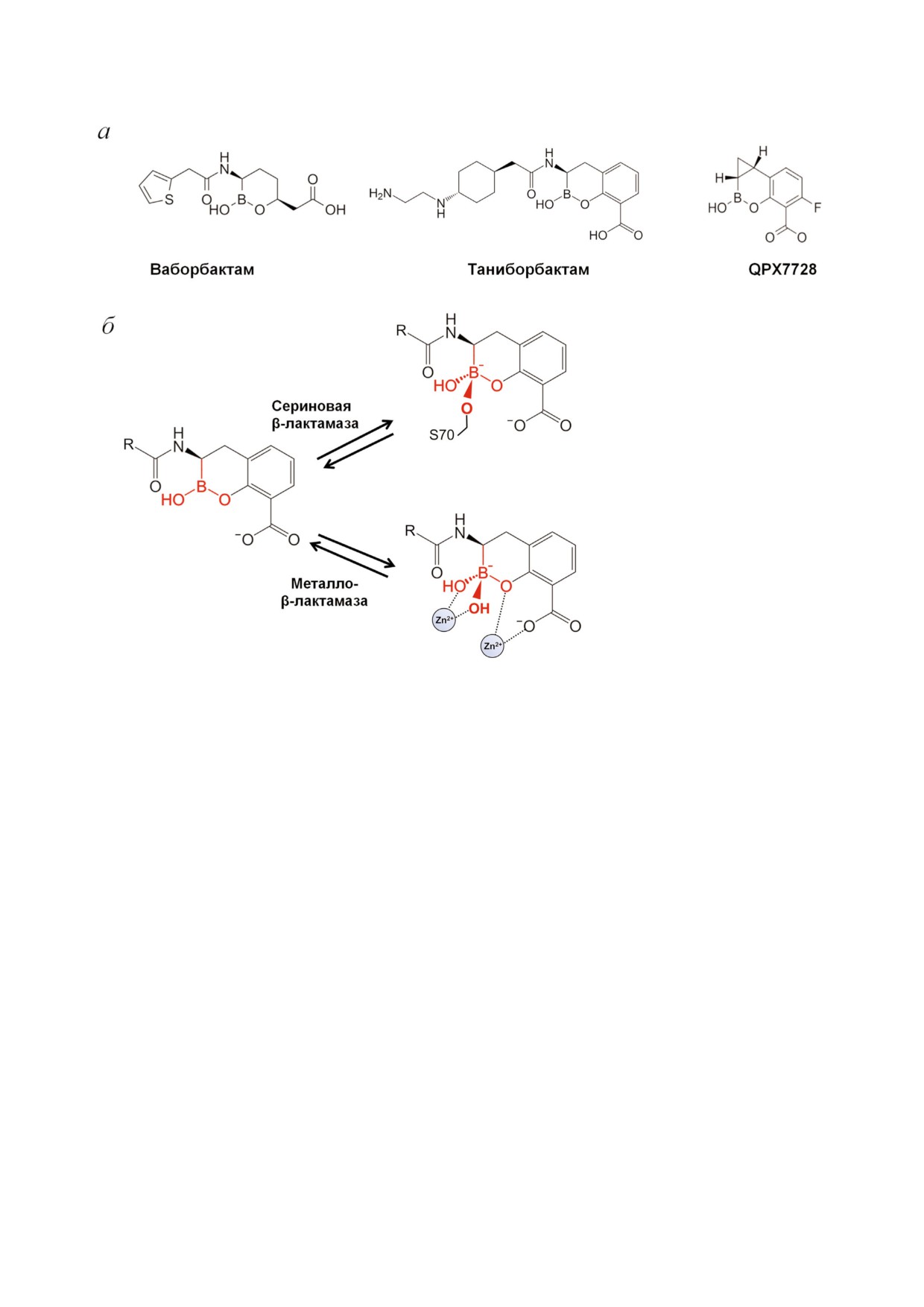
Ингибиторы - производные бороновых кислот.
показал, что при образовании тетраэдрических
Новой группой ингибиторов БЛ являются сое
интермедиатов с участием атома бора и катали
динения бороновых кислот, обладающие спо
тического серина БЛ CTX M 15 или иона Zn2+ в
собностью ингибировать сериновые протеазы
МБЛ VIM 2 наблюдаются дополнительные ста
микроорганизмов [61], однако у первых ингиби
билизирующие взаимодействия, например N
торов этой группы наблюдались побочные эф
(2 аминоэтил)циклогексиламиновой части ин
фекты, связанные с ингибированием сериновых
гибитора с отрицательно заряженными а.о.
протеаз млекопитающих. Для улучшения спе
(Glu149 в МБЛ VIM 2 и NDM 1) [67]. Комбина
цифичности действия в отношении БЛ были
ция цефепим/таниборбактам показала актив
изучены циклические боронаты (рис. 6, а). Пер
ность как in vitro, так и in vivo против БЛРС и
вым соединением, показавшим активность про
карбапенемазо продуцирующих штаммов Entero
тив сериновых БЛ класса A (типов CTX M, SHV,
bacteriaceae и P. aeruginosa [66].
TEM и КРС), БЛ класса C, но не ингибировав
Новым ингибитором группы циклических
шим сериновые протеазы млекопитающих, был
боронатов является QPX7728, проявляющий
ваборбактам [62].
широкую ингибирующую специфичность про
При связывании ингибитора группы произ
тив БЛРС и карбапенемаз класса A и БЛ класса
водных бороновых кислот в активном центре
C с эффективностью сопоставимой или превы
фермента его карбоксильный фрагмент распо
шающей эффективность ингибиторов группы
лагается в карбоксил связывающем кармане,
ДБО (авибактама, релебактама и ваборбактама)
атомы ароматической системы формируют гид
[68]. В отличие от других ингибиторов, QPX7728
рофобные контакты с боковыми группами ос
также является эффективным ингибитором кар
татков Tyr/Trp, амидная группа взаимодействует
бапенемаз класса D, в частности OXA 48 бакте
с остатками Ser237, Asn132 и Asn102 аналогично
рий семейства Enterobacteriaceae и OXA
амидной группе пенициллинов [61]. Известно,
23/24/58 A. baumannii, а также МБЛ (NDM,
что борная кислота может образовывать ковалент
VIM, IMP и других). Расширение спектра инги
ные связи со спиртами, поэтому атом бора ин
бирования QPX7728 может быть обусловлено
гибитора имитирует карбонильный углерод в β
его более компактной структурой и отсутствием
лактамах и является мишенью нуклеофильной
объемных заместителей, что позволяет молекуле
атаки гидроксильной группы каталитического
полностью входить в активный центр фермента.
серина. В результате образуется тетраэдричес
Обобщающая информация о специфичнос
кий комплекс, в котором серин ковалентно свя
ти действия ингибиторов сериновых БЛ приве
зан с атомом бора - аналог переходного состоя
дена в таблице. Ингибиторы I поколения актив
ния ацил ферментного комплекса БЛ с β лакта
ны в основном против БЛ класса А, за исключе
мами (рис. 6, б). По принципу действия данные
нием карбапенемаз. Новый ингибитор этой
соединения являются ингибиторами переходно
группы - энметазобактам - активен в отноше
го состояния, поскольку их комплекс с фермен
нии карбапенемаз класса А КРС типа и некото
том имеет тетраэдрическую конформацию,
рых БЛ класса D ОХА типа. Отличием ингиби
имитирующую переходное состояние тетраэд
торов нового поколения групп ДБО и производ
рического оксианиона в реакциях ацилирова
ных бороновых кислот является более широкая
ния и деацилирования [63].
специфичность: они активны против сериновых
В результате скрининга циклических боро
БЛ и карбапенемаз класса А, БЛ класса С, ряда
натов были выявлены ингибиторы всех четырех
БЛ и карбапенемаз класса D, а также МБЛ.
классов БЛ, включая МБЛ [64, 65]. К преимуще
Ингибиторы металло β лактамаз. Особен
ствам этих ингибиторов относится также их
ностью последних десятилетий является расту
способность ингибировать ПСБ5 [61]. Ингиби
щее распространение мульти и пан резистент
тор таниборбактам (VNRX 5133) проявляет ак
ных грамотрицательных патогенных бактерий,
тивность в отношении сериновых БЛ классов A
которые синтезируют несколько БЛ. Среди них
и C, отдельных карбапенемаз класса D (OXA 48)
особую роль играют высокоактивные МБЛ с
и МБЛ типов VIM и NDM, продуцируемых кар
широкой субстратной специфичностью в отно
бапенем резистентными бактериями семейства
шении практически всех групп β лактамов. Ин
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ β ЛАКТАМАЗ
1531
Рис. 6. а - Структуры циклических производных бороновых кислот - ингибиторов β лактамаз. б - Образование тетраэд
рического ацил ферментного комплекса атома бора производных бороновых кислот с серином активного центра β лак
тамазы и ионом Zn2+ металло β лактамазы
гибиторы сериновых БЛ I поколения практи
широкого кармана. Кроме того, двухвалентные
чески неактивны в отношении МБЛ класса В, в
катионы (Ca2+, Mg2+), циркулирующие в высо
связи с чем особо актуальным является поиск
ких концентрациях (порядка мМ) в плазме кро
ингибиторов данных ферментов [69, 70]. К нас
ви и тканях, могут конкурировать за связывание
тоящему времени описаны уже несколько сотен
с Zn зависимыми ингибиторами.
химических соединений - ингибиторов МБЛ,
Zn зависимые ингибиторы. Zn зависимые
однако ни одно из них не зарегистрировано для
ингибиторы МБЛ разделяются на группы по ме
клинического применения [16]. Сложность раз
ханизму действия на фермент: 1) хелатирующие
работки связана со структурным разнообразием
агенты, экстрагирующие ионы металлов из ак
ферментов и различиями в механизмах гидроли
тивного центра, 2) ингибиторы, конкурирую
за. Существуют две основные стратегии поиска
щие с антибиотиками за связывание с ионами
потенциальных ингибиторов МБЛ: связывание
металла и а.о. активного центра.
с ионами Zn2+ и Zn2+ независимое связывание с
Хелатирующие агенты. Распространенным
белком, каждая имеет свои ограничения. Zn за
способом ингибирования МБЛ является удале
висимые ингибиторы чаще проявляют неспеци
ние ионов Zn2+ из активного центра хелатирую
фические эффекты, поскольку металло зависи
щими агентами. Наиболее известный хелат -
мые ферменты очень распространены в биохи
ЭДТА - из за высокой токсичности непригоден
мических процессах человека. Поиск Zn неза
для терапевтического применения и использу
висимых ингибиторов с широкой специфич
ется только для идентификации МБЛ при диаг
ностью затруднен в связи с ограниченным коли
ностике резистентных бактерий [71]. Другим
чеством консервативных аминокислот у МБЛ
примером подобных ингибиторов являются
разных типов и формой активного центра в виде
цинк селективные аналоги спиродигидроиндо
БИОХИМИЯ том 85 вып. 11 2020
2*
1532
ЕГОРОВ и др.
ризуются низкой токсичностью в отношении
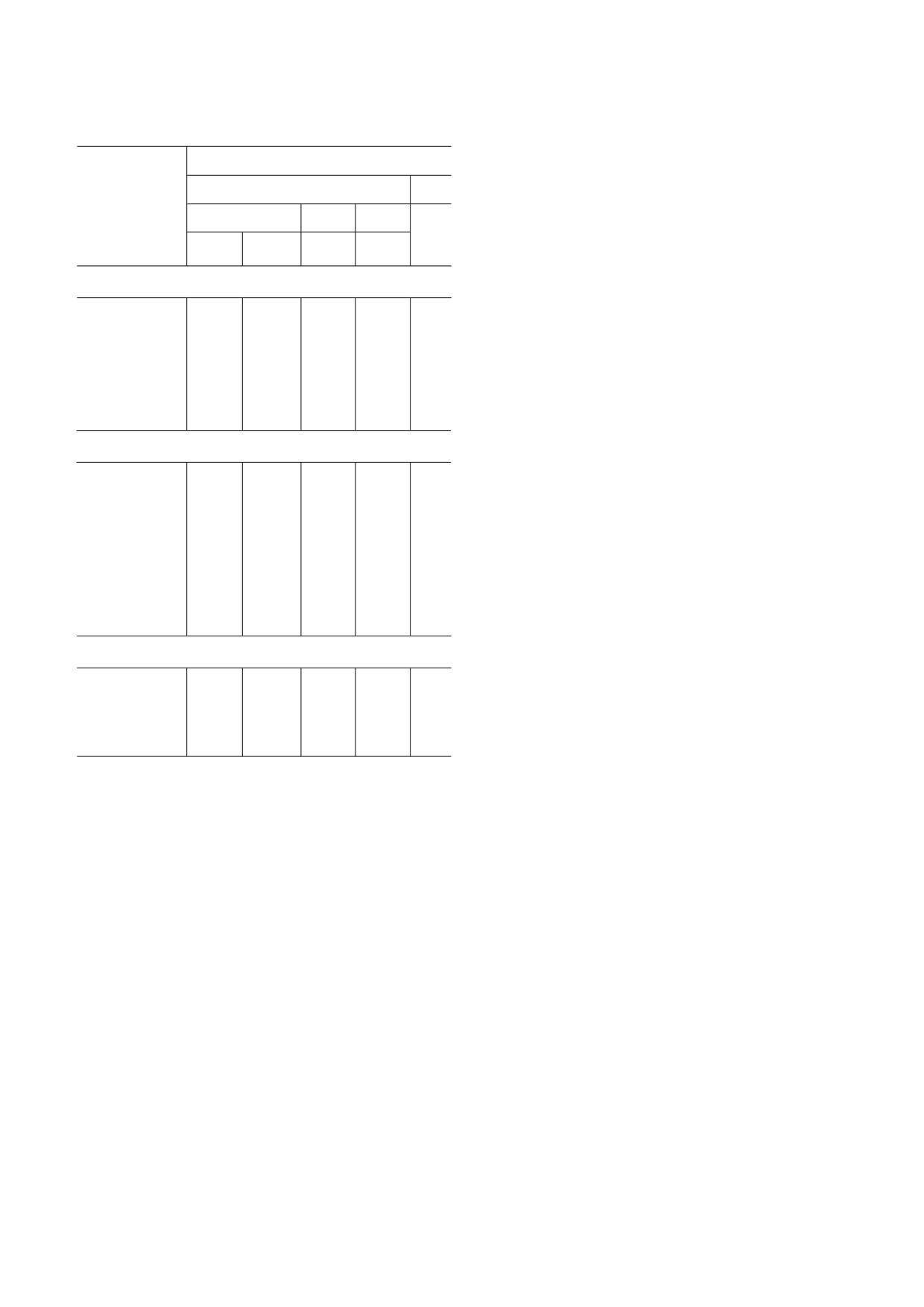
Активность ингибиторов сериновых β лактамаз и МБЛ
клеток млекопитающих.
β Лактамазы, классы/типы
Zn-связывающие соединения. Наиболее перс
пективными ингибиторами МБЛ являются под
Сериновые БЛ
МБЛ
Ингибитор
робно описанные в предыдущем разделе произ
A
C
D
водные циклических бороновых кислот, инги
B бирующие как сериновые БЛ, так и МБЛ [64].
БЛРС
КРС
AmpC
OXA
Широкая специфичность ингибирования пока
зана для их аналогов, циклобутанонов [77].
Сульфон-замещенные β-лактамы
Еще одной группой Zn связывающих инги
Клавулановая
+
-
-
-
-
биторов с высокой константой комплексообра
кислота
зования являются соединения, содержащие тио
ловые группы [78, 79]. К ним относится извест
Сульбактам
+
-
-
-
-
ный лекарственный препарат L каптоприл - ин
Тазобактам
+
-
-
-
-
гибитор ангиотензин превращающего фермента
[80]. Наиболее эффективным в отношении МБЛ
Энметазобактам
+
+
-
+/-
-
среди четырех диастереомеров каптоприла ока
зался D каптоприл, который ингибирует in vitro
Ингибиторы группы диазобициклооктанов
МБЛ субкластеров В1 и В3, но не В2 [81]. Это
Авибактам
+
+
-
+/-1
-
объясняется различиями в механизме действия
(рис. 7, б): в комплексе с бицинковой МБЛ
+
+
-
+/-1
-
NDM 1 (субкластер B1) тиоловая группа D кап
_
топрила связывает два иона Zn2+ и, таким обра
Релебактам
+
+
-
-
зом, замещает нуклеофильный гидроксид [82], в
Накубактам
+
+
+
+/-1
+
комплексе с моноцинковой БЛ CphA (субклас
тер B2) тиоловая группа D каптоприла взаимо
Зидебактам
+
+
-
+/-1
-
действует с гидрофобными остатками активного
Дурлобактам
+
+
-
+
-
центра фермента, а ион Zn2+ очень слабо коорди
нируется его карбоксильной группой [83].
Производные бороновых кислот
В качестве потенциальных ингибиторов
МБЛ широкого спектра действия рассматрива
Ваборбактам
+
+
-
-
-
ются некоторые азотсодержащие гетероцикли
Таниборбактам
+
+
+
+/-1
+
ческие соединения, в частности имеющие азо
лил тиоацетамидный каркас [84]. Ингибирую
QPX7728
+
+
+
+
+ щая активность этих соединений была показана
в отношении МБЛ NDM 1 и VIM 2.
1 БЛ ОХА 48 (БЛ OXA 23, OXA 24/40 и OXA 58 не ингиби
Высокую связывающую способность в отно
руются)
шении ионов Zn2+ продемонстрировали фосфо
натсодержащие соединения (6 фосфонометил
ла тиадиазола, эффективность которых показа
пиридин 2 карбоксилаты): значения констант
на на мышиных моделях [72].
ингибирования МБЛ in vitro находятся в нано
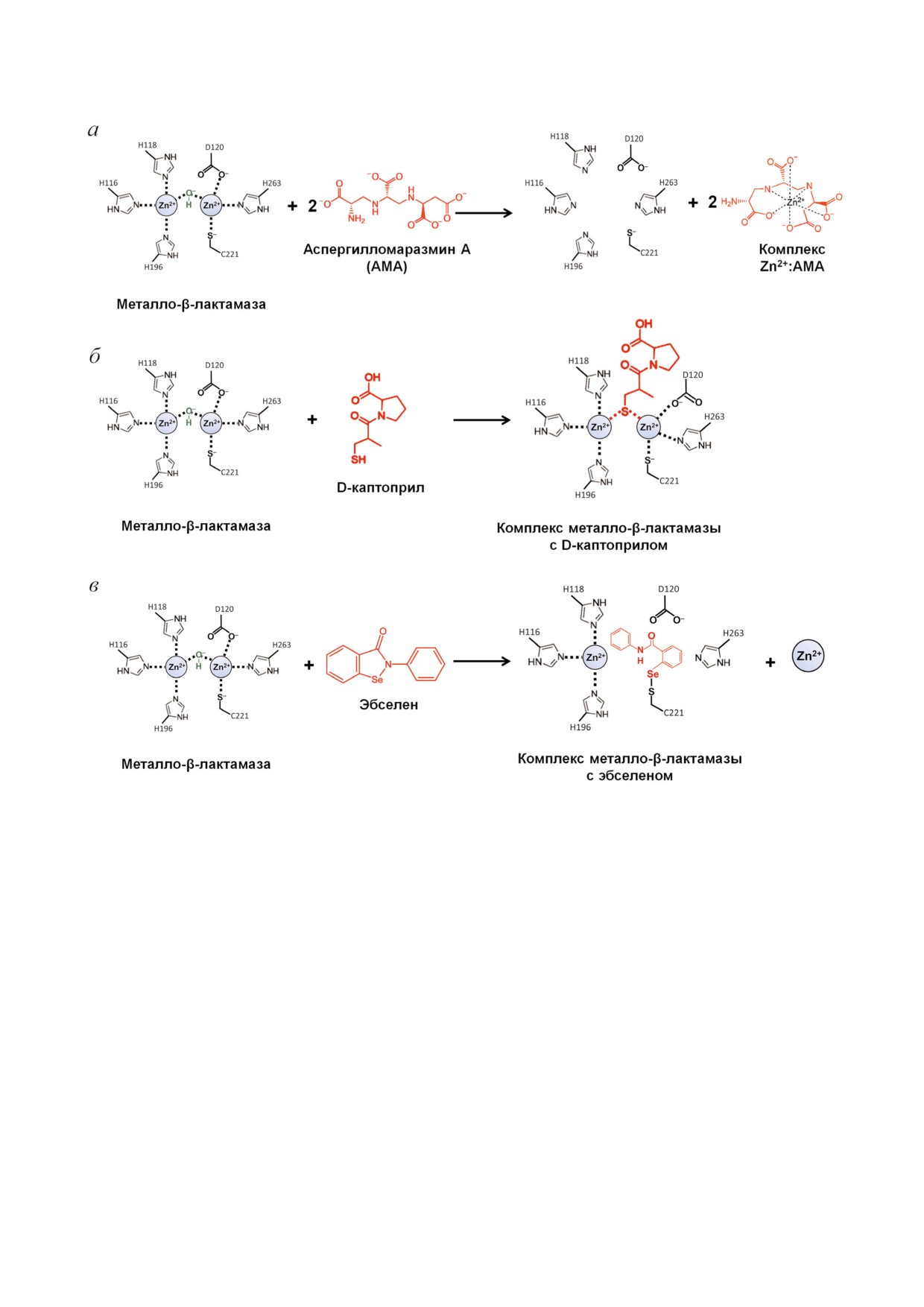
Одним из многообещающих хелатирующих
молярном диапазоне [85]. Аналогичными значе
агентов является природное соединение аспер
ниями констант связывания ионов Zn2+ харак
гилломаразмин А (AMA), которое может эф
теризуются производные карбоновых кислот
фективно ингибировать МБЛ типов NDM, VIM
(нитрилтриуксусная кислота и N (фосфономе
и IMP [73, 74]. Действие AMA состоит в
тил)иминодиуксусная кислота), активные in
экстракции Zn2+ из активного центра фермен
vitro в отношении ферментов типов NDM, VIM
тов, при этом 2 эквивалента AMA могут эффек
и IMP. Однако маловероятно, что такие сильные
тивно удалять 1 эквивалент Zn2+ (рис. 7, а).
Zn связывающие низкомолекулярные карбок
Известны другие хелатирующие агенты, та
силаты будут использоваться в качестве лекар
кие как 1,4,7,10 тетраазациклододекан 1,4,7,10
ственных препаратов, скорее всего они станут
тетрауксусная кислота (DOTA) и 1,4,7 триаза
основой пролекарств, активирующихся при
циклононан 1,4,7 триуксусная кислота (NOTA)
проникновении в бактериальную клетку.
[75] и их производные [76], которые в комбина
Zn независимые ингибиторы. К Zn независи
ции с меропенемом проявляют активность в от
мым ингибиторам относятся активированные
ношении различных патогенных бактерий, про
эфиры 3 меркаптопропионовой кислоты, взаи
дуцирующих МБЛ. Все эти соединения характе
модействующие с консервативным остатком
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ β ЛАКТАМАЗ
1533
Рис. 7. Схема ингибирующего действия аспергилломаразмина А (а), D каптоприла (б) и эбселена (в) в отношении метал
ло β лактамаз
Lys224 в активном центре МБЛ субкластера B1
щает процесс клинических исследований при
[86]. Селен содержащий ингибитор эбселен эф
регистрации препаратов на их основе.
фективно ингибирует БЛ NDM 1, образуя кова
Главным преимуществом новых ингибито
лентную связь Se-S с остатком активного цент
ров не β лактамной природы является их широ
ра Cys221 (рис. 7, в) [87]. Найдены ингибиторы
кая ингибирующая специфичность в отноше
МБЛ субкластеров B1 и B2, взаимодействующие
нии БЛ разных молекулярных классов (табли
одновременно с Lys224 и Cys221 [88].
ца). Некоторые из них имеют собственную ан
В качестве ингибитора МБЛ предложено ис
тибактериальную активность и действуют си
пользовать коллоидный раствор сульфата вис
нергетически в комбинации с β лактамными
мута, принцип действия которого основан на
антибиотиками, что позволяет дать им «вторую
вытеснении Zn2+ из активного центра NDM 1 с
жизнь» при лечении тяжелых инфекций, выз
образованием неактивного комплекса Bi3+ [89].
ванных мультирезистентными микроорганиз
Важно отметить, что эбселен и коллоидный
мами [90].
сульфат висмута используются в клинических
Несмотря на достигнутый прогресс, созда
целях для терапии других патологий, что упро ние препаратов для ингибирования МБЛ in vivo
БИОХИМИЯ том 85 вып. 11 2020
1534
ЕГОРОВ и др.
всё еще остается сложной задачей, в том числе
ров для описания характеристик молекул позво
из за необходимости снижения их сродства к
лил найти структурные аналоги известных ал
другим Zn содержащим металло ферментам,
лостерических ингибиторов БЛ класса А [91].
например ангиотензин превращающему фер
Были найдены два новых ингибитора не β лак
менту.
тамной природы, относящиеся по структуре к
другим химическим классам, но проявляющие
сходную биологическую активность в отно
НОВЫЕ НАПРАВЛЕНИЯ СОЗДАНИЯ
шении тех же мишеней и показавшие более вы
ИНГИБИТОРОВ β ЛАКТАМАЗ
сокую эффективность в отношении БЛ ТЕМ
типа по сравнению со стартовыми молекулами
Начало эпохи применения антибиотиков в
[92, 93].
клинической практике было чрезвычайно ус
Активное изучение структурных и функцио
пешным: для борьбы с бактериями, вызываю
нальных особенностей БЛ с использованием
щими инфекционные заболевания, было синте
новейших методов структурной биологии, фи
зировано несколько десятков тысяч различных
зико химической биологии и молекулярного
антибиотиков, многие из которых стали произ
моделирования позволяет выявить новые поверх
водиться в промышленных масштабах. Однако
ностные «горячие точки» белковой глобулы БЛ
спустя 50 лет активного применения антибакте
и использовать их в качестве новых мишеней
риальных препаратов произошло катастрофи
для воздействия на активность и стабильность.
ческое изменение бактерий и появление форм,
В качестве таких мишеней интерес представля
устойчивых к антибиотикам и обладающих бо
ют подвижные петли, мутации в которых могут
лее выраженной патогенностью и вирулент
способствовать изменению каталитических
ностью при действии на организм человека и
функций и появлению новых свойств фермен
животных. К этому привело недостаточное зна
тов. У сериновых БЛ такой мишенью может яв
ние и непонимание биохимических и генети
ляться Ω петля, форма которой обеспечивается
ческих механизмов экологической адаптации
фиксацией концевых аминокислот на сближен
бактерий к токсическим веществам, в том числе
ном расстоянии друг от друга. Петли подобной
к антибиотикам. Несмотря на дальнейшие по
формы описаны у 60 белков, для некоторых из
иски новых антибиотиков, резистентность бак
них установлены функции аллостерического ре
терий остается непреодолимой, и ее главными
гулирования [94]. Ω Петля сериновых БЛ рас
механизмами являются ферментативный гидро
положена у входа в активный центр фермента и
лиз и модификация антибиотиков, а также мо
включает каталитически важный консерватив
дификация мишеней, на которые воздействуют
ный остаток Glu166, мутации которого приво
антибиотики [7]. Подход для преодоления ус
дят к практически полной потере активности
тойчивости грамотрицательных бактерий к β
фермента. Ω Петля принимает участие на всех
лактамам, основанный на использовании инги
стадиях каталитического цикла гидролиза, при
биторов ферментов БЛ, был предложен около 50
этом ее роль особенно критична на стадии деа
лет назад. Несмотря на успешное применение
цилирования и высвобождения гидролизован
ингибиторов I поколения, их использование
ной молекулы антибиотика [95]. Несмотря на
стало ограниченным из за узкой специфичнос
различия в аминокислотной последовательнос
ти и развития к ним резистентности. Новое по
ти БЛ разных типов, пространственная укладка
коление ингибиторов оказалось более успеш
их Ω петли одинакова. Исходя из структуры и
ным и позволило вернуть β лактамы в практи
функций Ω петли, ее можно рассматривать как
ческое использование при комбинировании их
«мозаичную» модель мишеней для действия ал
с ингибиторами. Однако и первое, и второе по
лостерических ингибиторов.
коление ингибиторов были направлены против
Поиск аллостерических ингибиторов ведет
активных центров БЛ, и поэтому они, также как
ся и для МБЛ, хотя на данный момент пока точ
и антибиотики, оказались под давлением меха
но не установлены мишени для воздействия на
низмов резистентности.
это семейство ферментов [96]. Показано, что
Новыми перспективными подходами в по
ряд трициклических природных соединений из
иске новых ингибиторов БЛ не β лактамной
экстракта грибов Chaetomium funicola могут быть
природы являются использование методов
ингибиторами некоторых МБЛ (IMP 1 из
компьютерного моделирования и виртуальный
Bacillus cereus II и P. aeruginosa, CfiA из
скрининг для поиска новых мишеней и эффек
Bacteroides fragilis) с достаточно низкими конс
тивных лигандов для них. Виртуальный скри
тантами ингибирования (порядок нескольких
нинг на основе изменения структурного остова
мкМ) [97]. Одно соединение имело сродство к
лигандов c использованием набора дескрипто
петле, расположенной около активного центра
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ β ЛАКТАМАЗ
1535
фермента. В качестве аллостерических ингиби
ки и нуклеиновые кислоты абсолютно специфи
торов также исследуются макромолекулы (пеп
ческие для микроорганизмов.
тиды, наноантитела, аптамеры), направленные
на участки, удаленные от активного центра. Ме
тодом фагового дисплея было найдено наноан
ЗАКЛЮЧЕНИЕ
титело, эпитопом которого являются фрагмен
ты петли L6 и α2 спирали, способное ингибиро
Объем промышленного производства β лак
вать активность МБЛ VIM 4 со значением Ki в
тамных антибиотиков увеличивается, несмотря
микромолярном диапазоне [98]. Новым подхо
на рост резистентности бактерий к ним. Потреб
дом к ингибированию является использование
ление β лактамов, согласно мировым прогно
конструкций на основе самоорганизации ДНК,
зам, может удвоиться к 2030 г., что делает проб
которые ингибировали МБЛ разных классов,
лему создания ингибиторов БЛ на основе новых
включая NDM 1, со значениями IC50 ~10 нM
принципов и химических структур особенно ак
[99].
туальной. Перспективным для расширения спе
Ожидаемое мировое расширение производ
цифичности ингибиторов в отношении разных
ства промышленных β лактамных антибиоти
БЛ является поиск новых мишеней, в том числе
ков неизбежно приведет к появлению не только
аллостерических, удаленных от активного цент
новых БЛ, но и к дальнейшей мутационной из
ра фермента. Создание новых аллостерических
менчивости существующих ферментов. Уже
ингибиторов и их совместное использование с
сейчас наблюдается расширение разнообразия
антибиотиками позволит продлить «жизненный
МБЛ класса В [9], образование гибридных мо
цикл» β лактамов, терапевтическое действие ко
лекул из различных БЛ [23-25]. Возможны дру
торых хорошо изучено и характеризуется преи
гие варианты эволюции данного суперсемей
муществами в широкой специфичности
ства ферментов, их направления трудно пред
действия, низкой токсичности и аллергенности
сказать. Выходом из этого положения должно
по сравнению с другими антибиотиками.
стать изучение генетических механизмов синте
за и регуляции новых ферментов. Индукция
синтеза БЛ представляет собой сложный про
Финансирование. Работа выполнена при фи
цесс с участием самих антибиотиков, продуктов
нансовой поддержке Российским научным
гидролиза самой бактериальной стенки, фер
фондом (грант № 15 14 00014 П, анализ инги
ментов, принимающих участие в сигнальных
биторов сериновых β лактамаз) и госзаданием
путях и регулирующих процессы в бактериаль
МГУ имени М.В. Ломоносова (AAAA A16
ных генах. Анализ этих процессов позволит вы
116052010081 5, анализ ингибиторов металло β
явить новые белки мишени, ингибирование ко
лактамаз).
торых влияет на синтез БЛ. В связи с расшире
Конфликт интересов. Авторы обзора заявля
нием генетических исследований механизмов
ют об отсутствии конфликта интересов.
регуляции биосинтеза бактериальных клеток
Соблюдение этических норм. Настоящая
это направление может оказаться весьма эффек
статья не содержит описания каких либо иссле
тивным в создании новых антибактериальных
дований с участием людей или животных в каче
препаратов, мишенью которых могут быть бел
стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Smith, P. W., Watkins, K., and Hewlett, A. (2012) Infection
2015, Proc. Natl. Acad. Sci. USA, 115, E3463 E3470,
control through the ages, Am. J. Infect. Control, 40, 35 42,
doi: 10.1073/pnas.1717295115.
doi: 10.1016/j.ajic.2011.02.019.
5.
2.
Zapun, A., Contreras Martel, C., and Vernet, T. (2008)
global health in 2019.
Penicillin binding proteins and β lactam resistance, FEMS
6.
King, D. T., Sobhanifar, S., and Strynadka, N. C. J. (2017)
Microbiol. Rev.,
32,
361385, doi:
10.1111/j.1574
The Mechanisms of resistance to β lactam antibiotics, in
6976.2007.00095.x.
Handbook of Antimicrobial Resistance A (Berghuis, A.,
3.
Bush, K., and Bradford, P. A. (2016) β Lactams and
Matlashewski, G., Wainberg, M. A., and Sheppard, D.,
β lactamase inhibitors: an overview, Cold Spring Harb.
eds.), Springer New York, pp. 177 201, doi: 10.1007/978
Perspect. Medici., 6, a025247, doi: 10.1101/cshperspect.
1 4939 0694 9_10.
a025247.
7.
Egorov, A. M., Ulyashova, M. M., and Rubtsova, M. Y.
4.
Klein, E. Y., Van Boeckel, T. P., Martinez, E. M., Pant, S.,
(2018) Bacterial enzymes and antibiotic resistance, Acta
Gandra, S., Levin, S. A., Goossens, H., and
Naturae, 10, 33 48.
Laxminarayan, R. (2018) Global increase and geographic
8.
Fishovitz, J., Hermoso, J. A., Chang, M., and Mobashery, S.
convergence in antibiotic consumption between 2000 and
(2014) Penicillin binding protein 2a of methicillin resis
БИОХИМИЯ том 85 вып. 11 2020
1536
ЕГОРОВ и др.
tant Staphylococcus aureus, IUBMB Life, 66,
572 577,
23.
Cantón, R., González Alba, J. M., and Galán, J. C. (2012)
doi: 10.1002/iub.1289.
CTX M enzymes: origin and diffusion, Front. Microbiol.,
9.
Bush, K. (2018) Past and present perspectives on β lacta
3, 110, doi: 10.3389/fmicb.2012.00110.
mases, Antimicrob. Agents Chemother., 62, e01076 18,
24.
Zhao, W. H., and Hu, Z. Q. (2013) Epidemiology and
doi: 10.1128/AAC.01076 18.
genetics of CTX M extended spectrum β lactamases in
10.
Rozwandowicz, M., Brouwer, M. S. M., Fischer, J.,
gram negative bacteria, Crit. Rev. Microbiol., 39, 79 101,
Wagenaar, J. A., Gonzalez Zorn, B., Guerra, B.,
doi: 10.3109/1040841X.2012.691460.
Mevius, D. J., and Hordijk, J. (2018) Plasmids carrying
25.
Fursova, N., Pryamchuk, S., Kruglov, A., Abaev, I.,
antimicrobial resistance genes in Enterobacteriaceae, J.
Pecherskikh, E., Kartsev, N., Svetoch, E., and Dyatlov, I.
Antimicrob. Chemother., 73, 1121 1137, doi: 10.1093/jac/
(2013) The novel CTX M 116 β lactamase gene discov
dkx488.
ered in Proteus mirabilis is composed of parts of the CTX
11.
Magiorakos, A. P., Srinivasan, A., Carey, R. B., Carmeli, Y.,
M 22 and CTX M 23 genes, Antimicrob. Agents
Falagas, M. E., Giske, C. G., Harbarth, S., Hindler, J. F.,
Chemother., 57, 1552 1555, doi: 10.1128/AAC.01471 12.
Kahlmeter, G., Olsson Liljequist, B., Paterson, D. L.,
26.
Palzkill, T. (2013) Metallo β lactamase structure and
Rice, L. B., Stelling, J., Struelens, M. J., Vatopoulos, A.,
function, Ann. N. Y. Acad. Sci.,
1277,
91104,
Weber, J. T., and Monnet, D. L. (2012) Multidrug resis
doi: 10.1111/j.1749 6632.2012.06796.x.
tant, extensively drug resistant and pandrug resistant
27.
Malabanan, M. M., Amyes, T. L., and Richard, J. P. (2010)
bacteria: an international expert proposal for interim stan
A role for flexible loops in enzyme catalysis, Curr. Opin.
dard definitions for acquired resistance, Clin. Microbiol.
Struct. Biol., 20, 702 710, doi: 10.1016/j.sbi.2010.09.005.
Infect.,
18,
268281, doi:
10.1111/j.1469 0691.2011.
28.
Boucher, H. W., Talbot, G. H., Bradley, J. S., Edwards, J. E.,
03570.x.
Gilbert, D., Rice, L. B., Scheld, M., Spellberg, B., and
12.
Stec, B., Holtz, K. M., Wojciechowski, C. L., and
Bartlett, J. (2009) Bad bugs, no drugs: no ESKAPE! An
Kantrowitz, E. R. (2005) Structure of the wild type TEM 1
update from the infectious diseases society of America,
β lactamase at 1.55 Å and the mutant enzyme Ser70Ala at
Clin. Infect. Dis., 48, 1 12, doi: 10.1086/595011.
2.1 Å suggest the mode of noncovalent catalysis for the
29.
Reading, C., and Cole, M. (1977) Clavulanic acid: a beta
mutant enzyme, Acta Cryst., 61, 1072 1079, doi: 10.1107/
lactamase inhibiting beta lactam from Streptomyces
S0907444905014356.
clavuligerus, Antimicrob. Agents Chemother., 11, 852 857,
13.
Egorov, A., Ulyashova, M., and Rubtsova, M. (2020) Impact
doi: 10.1128/AAC.11.5.852.
of key and secondary drug resistance mutations on structure
30.
Brown, A. G. (1986) Clavulanic acid, a novel beta lacta
and activity of β lactamases, in Antibiotic Drug Resistance
mase inhibitor - a case study in drug discovery and devel
(Martinez, J. C., and G. Igrejas, G., eds.), Antibiotic Drug
opment, Drug Des. Deliv., 1, 1 21.
Resistance, John Wiley and Sons, Inc., pp. 121 140.
31.
English, A. R., Retsema, J. A., Girard, A. E., Lynch, J. E.,
14.
Abriata, L. A., Salverda, M. L. M., and Tomatis, P. E.
and Barth, W. E. (1978) CP 45,899, a beta lactamase
(2012) Sequence function stability relationships in pro
inhibitor that extends the antibacterial spectrum of beta lac
teins from datasets of functionally annotated variants: the
tams: initial bacteriological characterization, Antimicrob.
case of TEM β lactamases, FEBS Lett., 586, 3330 3335,
Agents Chemother., 14, 414 419, doi: 10.1128/ AAC.14.3.414.
doi: 10.1016/j.febslet.2012.07.010.
32.
Fisher, J., Belasco, J. G., Charnas, R. L., Khosla, S., and
15.
Bush, K. (2013) The ABCD’s of β lactamase nomencla
Knowles, J. R. (1980) Beta lactamase inactivation by
ture, J. Infect. Chemother., 19, 549 559, doi: 10.1007/
mechanism based reagents, Philos. Trans. R. Soc. Lond. B
s10156 013 0640 7.
Biol. Sci., 289, 309 319, doi: 10.1098/rstb.1980.0048.
16.
Tooke, C. L., Hinchliffe, P., Bragginton, E. C., Colenso,
33.
Payne, D. J., Cramp, R., Winstanley, D. J., and Knowles,
C. K., Hirvonen, V. H. A., Takebayashi, Y., and Spencer, J.
D. J. C. (1994) Comparative activities of clavulanic acid,
(2019) β Lactamases and β lactamase inhibitors in the
sulbactam, and tazobactam against clinically important β
21st century, J. Mol. Biol., 431, 3472 3500, doi: 10.1016/
lactamases, Antimicrob. Agents Chemother., 38, 767 772,
j.jmb.2019.04.002.
doi: 10.1128/AAC.38.4.767.
17.
Drawz, S. M., and Bonomo, R. A. (2010) Three decades of
34.
Papp Wallace, K. M., Bethel, C. R., Barnes, M. D., Rutter,
β lactamase inhibitors, Clin. Microbiol. Rev., 23, 160 201,
J. D., Taracila, M. A., Bajaksouzian, S., Jacobs, M. R., and
doi: 10.1128/CMR.00037 09.
Bonomo, R. A. (2017) AAI101, a novel β lactamase
18.
Liakopoulos, A., Mevius, D., and Ceccarelli, D. (2016) A
inhibitor: microbiological and enzymatic profiling, Open
review of SHV extended spectrum β lactamases: neglected
Forum Infect. Dis., 4, S375.
yet ubiquitous, Front. Microbiol., 7, 1374, doi: 10.3389/
35.
Manageiro, V., Ferreira, E., Cougnoux, A., Albuquerque, L.,
fmicb.2016.01374.
Caniça, M., and Bonnet, R. (2012) Characterization of the
19.
Arpin, C., Labia, R., Andre, C., Frigo, C., El Harrif, Z.,
inhibitor resistant SHV β lactamase SHV 107 in a clinical
and Quentin, C. (2001) SHV 16, a β lactamase with a pen
Klebsiella pneumoniae strain coproducing GES 7 enzyme,
tapeptide duplication in the omega loop, Antimicrob. Agents
Antimicrob. Agents Chemother.,
56,
10421046,
Chemother., 45, 2480 2485, doi: 10.1128/AAC.45.9.2480
doi: 10.1128/AAC.01444 10.
2485.2001.
36.
Rodkey, E. A., Drawz, S. M., Sampson, J. M., Bethel, C. R.,
20.
Shcherbinin, D., Veselovsky, A., Rubtsova, M.,
Bonomo, R. A., and Van Den Akker, F. (2012) Crystal
Grigorenko, V., and Egorov, A. (2020) The impact of long
structure of a preacylation complex of the β lactamase
distance mutations on the Ω loop conformation in TEM
inhibitor sulbactam bound to a sulfenamide bond contain
type β lactamases, J. Biomol. Struct. Dyn., 38, 2369 2376,
ing thiol β lactamase, J. Am. Chem. Soc., 134, 16798
doi: 10.1080/07391102.2019.1634642.
16804, doi: 10.1021/ja3073676.
21.
D’Andrea, M. M., Arena, F., Pallecchi, L., and Rossolini,
37.
Van den Akker, F., and Bonomo, R. A. (2018) Exploring
G. M. (2013) CTX M type β lactamases: a successful
additional dimensions of complexity in inhibitor design for
story of antibiotic resistance, Int. J. Med. Microbiol., 303,
serine β lactamases: mechanistic and intra and inter mol
305 317, doi: 10.1016/j.ijmm.2013.02.008.
ecular chemistry approaches, Front. Microbiol., 9, 1 10,
22.
Bonnet, R. (2004) Growing group of extended spectrum
doi: 10.3389/fmicb.2018.00622.
beta lactamases: the CTX M enzymes, Antimicrob. Agents
38.
Grace, M. E., Fu, K. P., Gregory, F. J., and Hung, P. P.
Chemother., 48, 1 14, doi: 10.1128/aac.48.1.1 14.2004.
(1987) Interaction of clavulanic acid, sulbactam and
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ β ЛАКТАМАЗ
1537
cephamycin antibiotics with beta lactamases, Drugs Exp.
Molecular basis of selective inhibition and slow reversibili
Clin. Res., 13, 145 148.
ty of avibactam against class D carbapenemases: a struc
39.
Docquier, J. D., and Mangani, S. (2018) An update on β
ture guided study of OXA 24 and OXA 48, ACS Chem.
lactamase inhibitor discovery and development, Drug
Biol., 10, 591 600, doi: 10.1021/cb500703p.
Resist. Updat., 36, 13 29, doi: 10.1016/j.drup.2017.11.002.
51.
Livermore, D. M., Mushtaq, S., Warner, M., Zhang, J.,
40.
Horita, N., Shibata, Y., Watanabe, H., Namkoong, H., and
Maharjan, S., Doumith, M., and Woodford, N. (2011)
Kaneko, T. (2017) Comparison of antipseudomonal β lac
Activities of NXL104 combinations with ceftazidime and
tams for febrile neutropenia empiric therapy: systematic
aztreonam against carbapenemase producing Enterobac
review and network meta analysis, Clin. Microbiol. Infect.,
teriaceae, Antimicrob. Agents Chemother., 55, 390 394,
23, 723 729, doi: 10.1016/j.cmi.2017.03.024.
doi: 10.1128/AAC.00756 10.
41.
Nimmich, E. B., Bookstaver, P. B., Kohn, J., Justo, J. A.,
52.
Levasseur, P., Girard, A. M., Miossec, C., Pace, J., and
Hammer, K. L., Albrecht, H., and Al Hasan, M. N. (2017)
Coleman, K. (2015) In vitro antibacterial activity of the
Development of institutional guidelines for management of
ceftazidime avibactam combination against Enterobacte
gram negative bloodstream infections: incorporating local
riaceae, including strains with well characterized β lacta
evidence, Hosp. Pharm., 52, 691697, doi: 10.1177/
mases, Antimicrob. Agents Chemother., 59, 1931 1934,
0018578717720506.
doi: 10.1128/AAC.04218 14.
42.
Zhanel, G. G., Chung, P., Adam, H., Zelenitsky, S.,
53.
Zhanel, G. G., Lawson, C. D., Adam, H., Schweizer, F.,
Denisuik, A., Schweizer, F., Lagacé Wiens, P. R. S.,
Zelenitsky, S., Lagacé Wiens, P. R. S., Denisuik, A.,
Rubinstein, E., Gin, A. S., Walkty, A., Hoban, D. J.,
Rubinstein, E., Gin, A. S., Hoban, D. J., Lynch, J. P., and
Lynch, J. P., and Karlowsky, J. A. (2014) Ceftolozane/
Karlowsky, J. A. (2013) Ceftazidime avibactam: a novel
Tazobactam: a novel cephalosporin/β lactamase inhibitor
cephalosporin/β lactamase inhibitor combination, Drugs,
combination with activity against multidrug resistant
73, 159 177, doi: 10.1007/s40265 013 0013 7.
gram negative bacilli, Drugs, 74, 31 51, doi: 10.1007/
54.
Biedenbach, D. J., Kazmierczak, K., Bouchillon, S. K.,
s40265 013 0168 2.
Sahm, D. F., and Bradford, P. A. (2015) In vitro activity of
43.
Shortridge, D., Duncan, L. R., Pfaller, M. A., and Flamm,
aztreonam avibactam against a global collection of gram
R. K. (2019) Activity of ceftolozane tazobactam and com
negative pathogens from 2012 and 2013, Antimicrob. Agents
parators when tested against gram negative isolates collect
Chemother., 59, 4239 4248, doi: 10.1128/AAC.00206 15.
ed from paediatric patients in the USA and Europe
55.
Livermore, D. M., Warner, M., and Mushtaq, S. (2013)
between 2012 and 2016 as part of a global surveillance pro
Activity of MK 7655 combined with imipenem against
gramme, Int. J. Antimicrob. Agents,
53,
637643,
Enterobacteriaceae and Pseudomonas aeruginosa, J.
doi: 10.1016/j.ijantimicag.2019.01.015.
Antimicrob. Chemother., 68, 2286 2290, doi: 10.1093/jac/
44.
Walkty, A., Adam, H., Baxter, M., Lagacé Wiens, P.,
dkt178.
Karlowsky, J. A., Hoban, D. J., and Zhanel, G. G. (2018)
56.
Lapuebla, A., Abdallah, M., Olafisoye, O., Cortes, C.,
In vitro activity of ceftolozane/tazobactam versus antimi
Urban, C., Landman, D., and Quale, J. (2015) Activity of
crobial non susceptible Pseudomonas aeruginosa clinical
imipenem with relebactam against gram negative
isolates including MDR and XDR isolates obtained from
pathogens from New York City, Antimicrob. Agents
across Canada as part of the CANWARD study, 2008 16, J.
Chemother., 59, 5029 5031, doi: 10.1128/AAC.00830 15.
Antimicrob. Chemother., 73, 703 708, doi: 10.1093/jac/
57.
Morinaka, A., Tsutsumi, Y., Yamada, M., Suzuki, K.,
dkx468.
Watanabe, T., Abe, T., Furuuchi, T., Inamura, S.,
45.
Tselepis, L., Langley, G. W., Aboklaish, A. F., Widlake, E.,
Sakamaki, Y., Mitsuhashi, N., Ida, T., and Livermore, D. M.
Jackson, D. E., Walsh, T. R., Schofield, C. J., Brem, J., and
(2015) OP0595, a new diazabicyclooctane: mode of action
Tyrrell, J. M. (2020) In vitro efficacy of imipenem relebac
as a serine β lactamase inhibitor, antibiotic and β lactam
tam and cefepime AAI101 against a global collection of
“enhancer”, J. Antimicrob. Chemother., 70, 2779 2786,
ESBL positive and carbapenemase producing Enterobac
doi: 10.1093/jac/dkv166.
teriaceae, Int. J. Antimicrob. Agents,
56,
105925,
58.
Livermore, D. M., Mushtaq, S., Warner, M., Vickers, A.,
doi: 10.1016/j.ijantimicag.2020.105925.
and Woodford, N. (2017) In vitro activity of cefepime/zide
46.
Bulik, C. C., and Nicolau, D. P. (2011) Double carbapen
bactam (WCK 5222) against gram negative bacteria, J.
em therapy for carbapenemase producing Klebsiella pneu-
Antimicrob. Chemother., 72, 1373 1385, doi: 10.1093/jac/
moniae, Antimicrob. Agents Chemother., 55, 3002 3004,
dkw593.
doi: 10.1128/AAC.01420 10.
59.
Durand Réville, T. F., Guler, S., Comita Prevoir, J., Chen, B.,
47.
De Pascale, G., Martucci, G., Montini, L., Panarello, G.,
et al. (2017) ETX2514 is a broad spectrum β lactamase
Cutuli, S. L., Di Carlo, D., Di Gravio, V., Di Stefano, R.,
inhibitor for the treatment of drug resistant gram negative
Capitanio, G., Vallecoccia, M. S., Polidori, P., Spanu, T.,
bacteria including Acinetobacter baumannii, Nat.
Arcadipane, A., and Antonelli, M. (2017) Double car
Microbiol., 2, 17104, doi: 10.1038/nmicrobiol.2017.104.
bapenem as a rescue strategy for the treatment of severe
60.
Higgins, P. G., Wisplinghoff, H., Stefanik, D., and Seifert,
carbapenemase producing Klebsiella pneumoniae infec
H. (2004) In vitro activities of the β lactamase inhibitors
tions: a two center, matched case control study, Crit. Care,
clavulanic acid, sulbactam, and tazobactam alone or in
21, 1 10, doi: 10.1186/s13054 017 1769 z.
combination with β lactams against epidemiologically
48.
Coleman, K. (2011) Diazabicyclooctanes (DBOs): a
characterized multidrug resistant Acinetobacter baumannii
potent new class of non β lactam β lactamase inhibitors,
strains, Antimicrob. Agents Chemother., 48, 1586 1592,
Curr. Opin. Microbiol., 14, 550 555, doi: 10.1016/j.mib.
doi: 10.1128/AAC.48.5.1586 1592.2004.
2011.07.026.
61.
Hecker, S. J., Reddy, K. R., Totrov, M., Hirst, G. C.,
49.
King, D. T., King, A. M., Lal, S. M., Wright, G. D., and
Lomovskaya, O., Griffith, D. C., et al. (2015) Discovery of
Strynadka, N. C. J. (2016) Molecular mechanism of
a cyclic boronic acid β lactamase inhibitor (RPX7009)
avibactam mediated β lactamase inhibition, ACS Infect.
with utility vs class A serine carbapenemases, J. Med.
Dis., 1, 175 184, doi: 10.1021/acsinfecdis.5b00007.
Chem.,
58,
36823692, doi:
10.1021/acs.jmedchem.
50.
Lahiri, S. D., Mangani, S., Jahić, H., Benvenuti, M.,
5b00127.
Durand Reville, T. F., De Luca, F., Ehmann, D. E.,
62.
Lomovskaya, O., Sun, D., Rubio Aparicio, D., Nelson, K.,
Rossolini, G. M., Alm, R. A., and Docquier, J. D. (2015)
Tsivkovski, R., Griffith, D. C., and Dudley, M. N. (2017)
БИОХИМИЯ том 85 вып. 11 2020
1538
ЕГОРОВ и др.
Vaborbactam: spectrum of beta lactamase inhibition and
mine A with metallo β lactamases NDM 1, VIM 2, and
impact of resistance mechanisms on activity in
IMP 7, ACS Infect. Dis., 4, 135145, doi: 10.1021/
Enterobacteriaceae, Antimicrob. Agents Chemother., 61, 1
acsinfecdis.7b00106.
15, doi: 10.1128/AAC.01443 17.
75.
Somboro, A. M., Tiwari, D., Bester, L. A., Parboosing, R.,
63.
Rojas, L. J., Taracila, M. A., Papp Wallace, K. M., Bethel,
Chonco, L., Kruger, H. G., Arvidsson, P. I., Govender, T.,
C. R., Caselli, E., Romagnoli, C., Winkler, M. L.,
Naicker, T., and Essack, S. Y. (2015) NOTA: a potent met
Spellberg, B., Prati, F., and Bonomo, R. A. (2016) Boronic
allo β lactamase inhibitor, J. Antimicrob. Chemother., 70,
acid transition state inhibitors active against KPC and
1594 1596, doi: 10.1093/jac/dku538.
other Class A β lactamases: structure activity relationships
76.
Zhang, E., Wang, M. M., Huang, S. C., Xu, S. M., Cui,
as a guide to inhibitor design, Antimicrob. Agents
D. Y., Bo, Y. L., Bai, P. Y., Hua, Y. G., Xiao, C. L., and
Chemother., 60, 1751 1759, doi: 10.1128/AAC.02641 15.
Qin, S. (2018) NOTA analogue: A first dithiocarbamate
64.
Brem, J., Cain, R., Cahill, S., McDonough, M. A.,
inhibitor of metallo β lactamases, Bioorg. Med. Chem.
Clifton, I. J., Jiménez Castellanos, J. C., Avison, M. B.,
Lett., 28, 214 221, doi: 10.1016/j.bmcl.2017.10.074.
Spencer, J., Fishwick, C. W. G., and Schofield, C. J. (2016)
77.
Abboud, M. I., Kosmopoulou, M., Krismanich, A. P.,
Structural basis of metallo β lactamase, serine β lacta
Johnson, J. W., Hinchliffe, P., Brem, J., Claridge, T. D. W.,
mase and penicillin binding protein inhibition by cyclic
Spencer, J., Schofield, C. J., and Dmitrienko, G. I. (2018)
boronates, Nat. Commun.,
7,
1 8, doi:
10.1038/
Cyclobutanone mimics of intermediates in metallo β lac
ncomms12406.
tamase catalysis,
Chemistry,
24,
57345737,
65.
Cahill, S. T., Cain, R., Wang, D. Y., Lohans, C. T.,
doi: 10.1002/chem.201705886.
Wareham, D. W., Oswin, H. P., Mohammed, J., Spencer, J.,
78.
Büttner, D., Kramer, J. S., Klingler, F. M., Wittmann, S. K.,
Fishwick, C. W. G., McDonough, M. A., Schofield, C. J.,
Hartmann, M. R., et al. (2018) Challenges in the develop
and Brema, J. (2017) Cyclic boronates inhibit all classes of
ment of a thiol based broad spectrum inhibitor for metal
β lactamases, Antimicrob. Agents Chemother.,
61,
lo β lactamases, ACS Infect. Dis.,
4,
360372,
doi: 10.1128/AAC.02260 16.
doi: 10.1021/acsinfecdis.7b00129.
66.
Hamrick, J. C., Docquier, J. D., Uehara, T., Myers, C. L.,
79.
Liu, S., Jing, L., Yu, Z. J., Wu, C., Zheng, Y., Zhang, E.,
Six, D. A., et al. (2020) VNRX 5133 (Taniborbactam), a
Chen, Q., Yu, Y., Guo, L., Wu, Y., and Li, G. B. (2018)
broad spectrum inhibitor of serine and metallo β lacta
((S) 3 Mercapto 2 methylpropanamido)acetic
acid
mases, restores activity of cefepime in enterobacterales and
derivatives as metallo β lactamase inhibitors: synthesis,
Pseudomonas aeruginosa, Antimicrob. Agents Chemother.,
kinetic and crystallographic studies, Eur. J. Med. Chem.,
64, doi: 10.1128/AAC.01963 19.
145, 649 660, doi: 10.1016/j.ejmech.2018.01.032.
67.
Liu, B., Trout, R. E. L., Chu, G. H., Mcgarry, D., Jackson,
80.
Klingler, F. M., Wichelhaus, T. A., Frank, D., Cuesta
R. W., et al. (2020) Discovery of taniborbactam (VNRX
Bernal, J., El Delik, J., Müller, H. F., et al.
(2015)
5133): a broad spectrum serine and metallo β lactamase
Approved drugs containing thiols as inhibitors of metallo
inhibitor for carbapenem resistant bacterial infections,
β lactamases: Strategy to combat multidrug resistant bac
J. Med. Chem., 63, 2789 2801, doi: 10.1021/acs.jmedchem.
teria, J. Med. Chem., 58, 3626_3630, doi: 10.1021/
9b01518.
jm501844d.
68.
Tsivkovski, R., Totrov, M., and Lomovskaya, O. (2020)
81.
Brem, J., van Berkel, S. S., Zollman, D., Lee, S. Y.,
Biochemical characterization of QPX7728, a new ultra
Gileadi, O., McHugh, P. J., Walsh, T. R., McDonough, M. A.,
broad spectrum beta lactamase inhibitor of serine and
and Schofield, C. J. (2016) Structural basis of metallo β
metallo beta lactamases, Antimicrob. Agents Chemother.,
lactamase inhibition by captopril stereoisomers, Antimicrob.
64, e00130 20, doi: 10.1128/aac.00130 20.
Agents Chemother., 60, 142 150, doi: 10.1128/AAC.01335 15.
69.
Cheng, Z., Thomas, C. A., Joyner, A. R., Kimble, R. L.,
82.
King, D. T., Worrall, L. J., Gruninger, R., and Strynadka,
Sturgill, A. M., et al. (2020) MBlinhibitors.com, a website
N. C. J. (2012) New delhi metallo β lactamase: structural
resource offering information and expertise for the contin
insights into β lactam recognition and inhibition, J. Am.
ued development of metallo β lactamase inhibitors,
Chem. Soc., 134, 11362 11365, doi: 10.1021/ja303579d.
Biomolecules, 10, doi: 10.3390/biom10030459.
83.
Liénard, B. M. R., Garau, G., Horsfall, L., Karsisiotis, A. I.,
70.
Ju, L. C., Cheng, Z., Fast, W., Bonomo, R. A., and
Damblon, C., Lassaux, P., et al. (2008) Structural basis for
Crowder, M. W. (2018) The continuing challenge of metal
the broad spectrum inhibition of metallo β lactamases by
lo β lactamase inhibition: mechanism matters, Trends
thiols, Org. Biomol. Chem., 6, 2282 2294, doi: 10.1039/
Pharmacol. Sci., 39, 635 647, doi: 10.1016/j.tips.2018.
b802311e.
03.007.
84.
Xiang, Y., Chang, Y. N., Ge, Y., Kang, J.S., Zhang, Y. L.,
71.
Ma, J., McLeod, S., MacCormack, K., Sriram, S., Gao, N.,
Liu, X. L., Oelschlaeger, P., and Yang, K. W. (2017) Azolyl
Breeze, A. L., and Hu, J. (2014) Real time monitoring of
thioacetamides as a potent scaffold for the development of
New Delhi metallo β lactamase activity in living bacterial
metallo β lactamase inhibitors, Bioorg. Med. Chem. Lett.,
cells by 1H NMR spectroscopy, Angew. Chem. Int. En
27, 5225 5229, doi: 10.1016/j.bmcl.2017.10.038.
Engl., 53, 2130 2133, doi: 10.1002/anie.201308636.
85.
Hinchliffe, P., Tanner, C. A., Krismanich, A. P., Labbé, G.,
72.
Falconer, S. B., Reid Yu, S. A., King, A. M., Gehrke, S. S.,
Goodfellow, V. J., et al. (2018) Structural and kinetic stud
Wang, W., Britten, J. F., Coombes, B. K., Wright, G. D.,
ies of the potent inhibition of metallo β lactamases by 6
and Brown, E. D. (2015) Zinc chelation by a small mole
phosphonomethylpyridine 2 carboxylates, Biochemistry,
cule adjuvant potentiates meropenem activity in vivo
57, 1880 1892, doi: 10.1021/acs.biochem.7b01299.
against NDM 1 producing Klebsiella pneumoniae, ACS
86.
Kurosaki, H., Yamaguchi, Y., Higashi, T., Soga, K.,
Infect. Dis., 1, 533 543, doi: 10.1021/acsinfecdis.5b00033.
Matsueda, S., Yumoto, H., Misumi, S., Yamagata, Y.,
73.
King, A. M., Reid Yu, S. A., Wang, W., King, D. T., De
Arakawa, Y., and Goto, M. (2005) Irreversible inhibition of
Pascale, G., Strynadka, N. C., Walsh, T. R., Coombes, B. K.,
metallo β lactamase (IMP 1) by 3 (3 mercaptopropi
and Wright, G. D. (2014) Aspergillomarasmine A over
onylsulfanyl) propionic acid pentafluorophenyl ester,
comes metallo beta lactamase antibiotic resistance,
Angewandte Chemie, 44, 3861 3864, doi: 10.1002/anie.
Nature, 510, 503 506, doi: 10.1038/nature13445.
200500835.
74.
Bergstrom, A., Katko, A., Adkins, Z., Hill, J., Cheng, Z.,
87.
Chiou, J., Wan, S., Chan, K. F., So, P. K., He, D., Chan,
et al. (2018) Probing the interaction of aspergillomaras
E. W. C., Chan, T. H., Wong, K. Y., Tao, J., and Chen, S.
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ β ЛАКТАМАЗ
1539
(2015) Ebselen as a potent covalent inhibitor of New Delhi
93. Antipin, R. L., Beshnova, D. A., Petrov, R. A., Shiryaeva,
metallo β lactamase (NDM 1), Chem. Commun., 51,
A. S., Andreeva, I. P., et al. (2017) Synthesis, SAR and
9543 9546, doi: 10.1039/c5cc02594j.
molecular docking study of novel non β lactam inhibitors
88.
Chen, C., Xiang, Y., Yang, K. W., Zhang, Y., Wang, W. M.,
of TEM type β lactamase, Bioorg. Med. Chem. Lett., 27,
Su, J. P., Ge, Y., and Liu, Y. (2018) A protein structure
1588 1592, doi: 10.1016/j.bmcl.2017.02.025.
guided covalent scaffold selectively targets the B1 and B2
94. Papaleo, E., Saladino, G., Lambrughi, M., Lindorff
subclass metallo β lactamases, Chem. Commun., 54, 4802
Larsen, K., Gervasio, F. L., and Nussinov, R. (2016) The
4805, doi: 10.1039/c8cc01067f.
role of protein loops and linkers in conformational dynam
89.
Wang, R., Lai, T. P., Gao, P., Zhang, H., Ho, P. L.,
ics and allostery, Chem. Rev.,
116,
63916423,
Woo, P. C. Y., Ma, G., Kao, R. Y. T., Li, H., and Sun, H.
doi: 10.1021/acs.chemrev.5b00623.
(2018) Bismuth antimicrobial drugs serve as broad spec
95. Egorov, A., Rubtsova, M., Grigorenko, V., Uporov, I., and
trum metallo β lactamase inhibitors, Nat. Commun., 9, 1
Veselovsky, A. (2019) The role of the Ω loop in regulation
12, doi: 10.1038/s41467 018 02828 6.
of the catalytic activity of TEM type β lactamases,
90.
Papp Wallace, K. M., Nguyen, N. Q., Jacobs, M. R.,
Biomolecules, 9, doi: 10.3390/biom9120854.
Bethel, C. R., Barnes, M. D., et al. (2018) Strategic
96. Fast, W., and Sutton, L. D. (2013) Metallo β lactamase:
approaches to overcome resistance against gram negative
inhibitors and reporter substrates, Biochim. Biophys. Acta,
pathogens using β lactamase inhibitors and β lactam
1834, 1648 1659, doi: 10.1016/j.bbapap.2013.04.024.
enhancers: activity of three novel diazabicyclooctanes WCK
97. Payne, D. J., Hueso Rodr guez, J. A., Boyd, H., Concha,
5153, Zidebactam (WCK 5107), and WCK 4234, J. Med.
N. O., Janson, C. A., et al. (2002) Identification of a series
Chem., 61, 4067 4086, doi: 10.1021/acs.jmedchem.8b00091.
of tricyclic natural products as potent broad spectrum
91.
Beshnova, D. A., Carolan, C., Grigorenko, V. G.,
inhibitors of metallo β lactamases, Antimicrob. Agents
Rubtsova, M. Y., Gbekor, E., Lewis, J., Lamzin, V. S., and
Chemother., 46, 1880 1886, doi: 10.1128/AAC.46.6.1880
Egorov, A. M. (2019) Scaffold hopping computational
1886.2002.
approach for searching novel β lactamase inhibitors,
98. Sohier, J. S., Laurent, C., Chevigné, A., Pardon, E.,
Biomed. Khim.,
65,
468476, doi:
10.18097/
Srinivasan, V., et al. (2013) Allosteric inhibition of VIM
pbmc20196506468.
metallo β lactamases by a camelid nanobody, Biochem. J.,
92.
Grigorenko, V. G., Andreeva, I. P., Rubtsova, M. Y.,
450, 477 486, doi: 10.1042/BJ20121305.
Deygen, I. M., Antipin, R. L., et al. (2017) Novel non β
99. Ouyang, X., Chang, Y. N., Yang, K. W., Wang, W. M., Bai,
lactam inhibitor of β lactamase TEM 171 based on acylat
J. J., et al. (2017) A DNA nanoribbon as a potent inhibitor
ed phenoxyaniline, Biochimie, 132, 45 53, doi: 10.1016/
of metallo β lactamases, Chem. Commun., 53, 8878 8881,
j.biochi.2016.10.011.
doi: 10.1039/c7cc04483f.
INHIBITORS OF β LACTAMASES. NEW LIFE OF β LACTAM ANTIBIOTICS
Review
A. M. Egorov, M. M. Ulyashova, and M. Yu. Rubtsova*
Faculty of Chemistry, Lomonosov Moscow State University, 119991 Moscow, Russia; E-mail: mrubtsova@gmail.com
Received July 9, 2020
Revised August 14, 2020
Accepted August 15, 2020
β Lactam antibiotics account for about 60% of all produced antibiotics. Due to a high activity and minimal side
effects, they are the most commonly used class of antibacterial drugs for the treatment of various infectious diseases
of humans and animals, including severe hospital infections. However, the emergence of bacteria resistant to β lac
tams has led to the clinical inefficiency of these antibiotics, and as a result, their use in medicine has been limited.
The search for new effective ways for overcoming the resistance to β lactam antibiotics is an essential task. The
major mechanism of bacterial resistance is the synthesis of β lactamases (BLs) that break the antibiotic β lactam
ring. Here, we review specific inhibitors of serine β lactamases and metallo β lactamases and discuss approaches
for creating new inhibitors that would prolong the “life” of β lactams.
Keywords: antibiotic resistance of bacteria, β lactamases, inhibitors, β lactam antibiotics
БИОХИМИЯ том 85 вып. 11 2020