БИОХИМИЯ, 2020, том 85, вып. 11, с. 1540 - 1549
УДК 577.18
ИНГИБИРОВАНИЕ ХЛАМИДИЙНОЙ ИНФЕКЦИИ ПУТЕМ
CRISPR/Cas9 SAM ОПОСРЕДОВАННОГО УСИЛЕНИЯ
ЭКСПРЕССИИ ГЕНОВ ПЕПТИДОГЛИКАН РАСПОЗНАЮЩИХ
БЕЛКОВ ЧЕЛОВЕКА В КЛЕТКАХ ЛИНИИ HeLa
© 2020
П.А. Бобровский1*, В.Д. Мороз1, В.Н. Лавренова1,2,
В.А. Манувера1, В.Н. Лазарев1
1 Федеральный научно клинический центр физико химической медицины ФМБА России
119435 Москва, Россия; электронная почта: pbobrovskiy@gmail.com
2 Московский государственный университет имени М.В. Ломоносова,
биологический факультет, 119991 Москва, Россия
Поступила в редакцию 07.07.2020
После доработки 22.08.2020
Принята к публикации 23.08.2020
Глобальная проблема роста антибиотикорезистентности микроорганизмов делает актуальным поиск новых
природных веществ, обладающих антибактериальными свойствами. К данной группе относят пептидогли
кан распознающие белки (PGLYRP), являющиеся компонентами врожденного иммунитета многих орга
низмов, в том числе и человека. Эти белки обладают уникальным механизмом действия, позволяющим из
бегать формирования резистентности к ним бактерий, а также быть активными как против грамположи
тельных, так и против грамотрицательных бактерий. Однако применение рекомбинантных пептидогликан
распознающих белков не всегда целесообразно из за сложности локальной доставки белков и их стабиль
ности, в связи с этим представляется актуальным активация компонентов собственного врожденного им
мунитета. Целью данного исследования было увеличить уровень экспрессии собственных генов пептидог
ликан распознающих белков человека в клетках линии HeLa с помощью технологии редактирования гено
ма, используя синергичные медиаторы активации (CRISPR/Cas9 SAM), чтобы оценить антихламидийный
эффект PGLYRP. Мы показали активацию генов двухкомпонентной системы хламидий ctcB ctcC, играющей
ключевую роль в механизме действия пептидогликан распознающих белков. Нами были получены клетки
линии HeLa, трансдуцированные лентивирусами, кодирующими активационную систему CRISPR/Cas9
SAM с повышенной экспрессией генов pglyrp. Мы показали, что активация экспрессии генов собственных
пептидогликан распознающих белков человека в линии клеток HeLa приводит к ингибированию развития
хламидийной инфекции. Предложенный подход позволяет использовать возможности врожденного имму
нитета для борьбы с инфекционными заболеваниями, вызываемыми грамположительными и грамотрица
тельными бактериями.
КЛЮЧЕВЫЕ СЛОВА: пептидогликан, Chlamydia trachomatis, PGLYRP, CRISPR/Cas9.
DOI: 10.31857/S0320972520110032
ВВЕДЕНИЕ
ности терапии социально значимых инфекци
онных заболеваний. Заболевания, вызываемые
На сегодняшний день рост количества анти
резистентными штаммами, труднее поддаются
биотикорезистентных штаммов является гло
лечению и часто протекают в более тяжелой
бальной проблемой. Возникновение резистент
форме [1]. Описаны серьезные побочные эф
ных штаммов приводит к снижению эффектив
фекты применения некоторых антибиотиков [2,
3]. В этой связи становится актуальным поиск
Принятые сокращения: CRISPR - короткие палин
новых природных веществ, обладающих бакте
дромные повторы, регулярно расположенные группами;
рицидными свойствами. Перспективными кан
dCas9 - дефектная нуклеаза Cas9; DMEM - модифициро
дидатами являются пептидогликан распознаю
ванная по способу Дульбекко среда Игла; HSF1 - фактор щие белки (PGLYRP, peptidoglycan recognition
теплового шока; PEI - полиэтиленимин; PGLYRP - пеп
proteins), обнаруженные у многих организмов от
тидогликан распознающие белки; p65 - субъединица
транскрипционного фактора NF κB; SAM - синергичные
насекомых до млекопитающих. Эти белки явля
медиаторы активации.
ются компонентами системы врожденного им
* Адресат для корреспонденции.
мунитета, выполняющей роль первого барьера
1540
АКТИВАЦИЯ ЭКСПРЕССИИ pglyrp С ПОМОЩЬЮ CRISPR/Cas9 SAM
1541
иммунной защиты организма [4]. Все PGLYRP
тивные элементарные тельца, и неинфекцион
содержат пептидогликан распознающие доме
ные, метаболически активные ретикулярные
ны, связывающие пептидогликан в пептидогли
тельца [16]. Уникальные особенности взаимоот
кан связывающей бороздке, открывающейся
ношений хламидий с иммунной системой чело
при клеточном делении [5]. Также они содержат
века часто способствуют развитию персистиру
сайты связывания с липополисахаридами и ли
ющей формы инфекции [17]. Ранее мы проде
потейхоевыми кислотами [6, 7]. Таким образом,
монстрировали антибактериальную активность
PGLYRP способны узнавать пептидогликан, ли
рекомбинантных PGLYRP человека в отноше
пополисахариды и липотейхоевые кислоты кле
нии внутриклеточной патогенной бактерии
точных стенок грамположительных и грамотри
Chlamydia trachomatis и активацию экспрессии
цательных бактерий [7]. У млекопитающих опи
генов двухкомпонентной системы CtcB CtcC
сано четыре PGLYRP: PGLYRP1, PGLYRP3,
после контакта хламидийных элементарных те
PGLYRP4, которые были идентифицированы
лец с PGLYRP [18]. Альтернативой применения
как бактерицидные белки, и PGLYRP2, который
рекомбинантных антимикробных белков, полу
дополнительно обладает амидазной актив
ченных в гетерологичных системах экспрессии,
ностью. В 2011 г. был предложен механизм
является использование различных генотера
действия этих белков. PGLYRP связываются с
певтических подходов. Одним из способов
пептидогликаном бактериальной клеточной
борьбы с инфекционными заболеваниями с по
стенки или липополисахаридами наружных
мощью генной терапии является введение гене
мембран и активируют белок чувствительную
тических конструкций, кодирующих различные
двухкомпонентную систему [5]. Бактерии име
компоненты врожденного иммунитета, напри
ют множество двухкомпонентных систем, кото
мер антимикробные пептиды [19-21], или акти
рые состоят из сенсорных и регуляторных ком
вация экспрессии белков врожденного иммуни
понентов и позволяют бактериям быстро реаги
тета [22]. В данной работе с использованием тех
ровать на изменяющиеся условия окружающей
нологии геномного редактирования, применяя
среды. Двухкомпонентные системы CssR CssS у
синергичные медиаторы активации (SAM,
Bacillus subtilis и CpxA CpxR у Escherichia coli яв
Synergistic Activation Mediator), мы смоделиро
ляются функциональными гомологами, и ана
вали ингибирование развития хламидийной ин
логичные двухкомпонентные системы характер
фекции путем увеличения уровня экспрессии
ны для большинства бактерий [8, 9]. Эти двух
генов пептидогликан распознающих белков в
компонентные системы обнаруживают и эли
клетках линии HeLa. Полученные данные демон
минируют секретируемые и мембранные белки
стрируют, что данный подход может являться
с неправильной структурой, причем они реаги
многообещающим инструментом для специфи
руют как на собственные, так и на чужеродные
ческой и целевой активации компонентов врож
белки, независимо от причины накопления бел
денного иммунитета для борьбы с тяжелыми ин
ка в примембранном компартменте [10, 11]. По
фекционными заболеваниями.
мимо этого, они также могут подавать сигнал в
клетку для активации продукции гидроксиль
ных радикалов, деполяризации мембраны,
МАТЕРИАЛЫ И МЕТОДЫ
прекращения синтеза белов, РНК и ДНК, что
приводит к гибели бактериальной клетки [12].
Бактериальные штаммы и клеточные линии. В
Поскольку эти белки являются частью системы
работе использовали штамм E. coli TOP10
врожденного иммунитета человека, высокая
(«Invitrogen», США), генотип F - mcrA Δ(mrr
бактерицидная активность по отношению к па
hsdRMS mcrBC) ϕ80lacZΔM15 ΔlacX74 nupG
тогенным микроорганизмам и устойчивость
recA1 araD139 Δ(ara leu)7697 galE15 galK16
собственной микрофлоры [13] являются неос
rpsL(StrR) endA1 λ , элементарные тельца штам
поримыми преимуществами по сравнению с ан
ма C. trachomatis D/UW 3/Cx (ATCC VR 885)
тибиотиками. Особый интерес представляет ак
(«ATCC», США), очищенные путем ультрацент
тивность PGLYRP по отношению к внутрикле
рифугирования в градиенте урографина, как
точным паразитам, таким как, например
описано ранее [23].
Chlamydia, которая является патогенной грамот
В работе использовали клеточные линии
рицательной бактерией с уникальным жизнен
HeLa («ATCC CCL 2», США) и HEK 293FT
ным циклом. Хламидии вызывают серьезные
(«Thermo Fisher Scientific», США). Клетки HeLa
патологии беременности и родов, непроходи
культивировали в среде DMEM («Thermo Fisher
мость маточных труб и офтальмохламидиоз [14,
Scientific», США), содержащей 10% ную инак
15]. Хламидии существуют в организме в двух
тивированную эмбриональную телячью сыво
формах: инфекционные, метаболически неак
ротку (ЭТС) («Thermo Fisher Scientific», США) и
БИОХИМИЯ том 85 вып. 11 2020
1542
БОБРОВСКИЙ и др.
ности с использованием среды без антибиоти
Список олигонуклеотидов, использованных в работе
ков. Клетки заражали элементарными тельцами
Праймеры для
C. trachomatis с множественностью инфекции
клонирования
Последовательность праймеров (5'-3')
0,9-1,0 ВОЕ (включение образующих единиц)
протоспейсеров
на клетку центрифугированием в течение 1 ч
pglyrp1 1F
caccgagaagatgtgccaatgcccc
при 900 g. После центрифугирования клетки
культивировали в термостате при температуре
pglyrp1 2F
caccgaacttacatcgcagaggcc
37 °С в атмосфере 5% CO2. Для продукции
pglyrp2 1F
caccgagaagagactgggggagacc
PGLYRP клетки продуценты HeLa PGLYRP,
pglyrp2 2F
caccgtctgaaccacctggtctcc
полученные нами ранее [18], культивировали в
pglyrp3 1F
caccgattagtgccctcacatttat
среде DMEM c 10 мкг/мл гентамицина и без
ЭТС в течение 72 ч.
pglyrp3 2F
caccggccccgagaagcctgagcc
Количественная ПЦР. Выделение РНК из об
pglyrp4 1F
caccgctggaggagaaggcgccagt
разцов проводили реагентом Trizol («Thermo
pglyrp4 2F
caccgggcactccctccctgggaa
Fisher Scientific», США). Суммарную РНК обра
pglyrp1 1R
aaacggggcattggcacatcttctc
батывали 2 е.а. ДНКазы I («Thermo Fisher
pglyrp1 2R
aaacggcctctgcgatgtaagttcc
Scientific», США) в присутствии 20 е.а. ингиби
тора рибонуклеаз («Thermo Fisher Scientific»,
pglyrp2 1R
aaacggtctcccccagtctcttctc
США). Синтез первой цепи кДНК проводили с
pglyrp2 2R
aaacggagaccaggtggttcagacc
помощью RevertAid RT Reverse Transcription Kit
pglyrp3 1R
aaacataaatgtgagggcactaatc
(«Thermo Fisher Scientific», США) с использова
pglyrp3 2R
aaacggctcaggcttctcggggccc
нием гексамерных праймеров. Последователь
pglyrp4 1R
aaacactggcgccttctcctccagc
ности праймеров («Литех», Россия), использо
ванных в работе, представлены в таблице. ПЦР
pglyrp4 2R
aaacttcccagggagggagtgcccc
в режиме реального времени проводили на ам
плификаторе CFX96 Touch («BioRad», США) с
Праймеры для
количественной
использованием Taq полимеразы («Литех», Рос
ПЦР
сия) и
0,1× SYBR Green
(«Thermo Fisher
Scientific», США). Количество РНК, соответ
pglyrp 1qF1
gccctgaggtccaactatgt
ствующей целевым и референсным генам, опре
деляли по разности порогового цикла реакции
pglyrp 1qR1
cggtagtgtggccaattctg
(Ct) для каждого образца. Для определения
pglyrp 2qF1
cctgctcatggactctgtca
уровня экспрессии pglyrp1-pglyrp4 использовали
pglyrp 2qR1
cttagtgggcagggatccaa
специфические праймеры. Нормализацию дан
pglyrp 3qF1
tgccctaggaattgccttca
ных проводили по уровню референсного гена β
pglyrp 3qR1
gcccatcagcaggtagtttg
актина (использовали пару праймеров actbF/
actbR). Для определения уровня активации
pglyrp 4qF1
tgactcccaactacctgctg
двухкопонентной системы хламидий использо
pglyrp 4qR1
tgagccaagctggatggtta
вали пары праймеров ctcbF/ctcbR и ctccF/ctccR.
ctcbF
tctcacgacttcctcttcct
Данные были нормированы по уровню генов euo
ctcbR
caggatctatagagcgctgt
и omcB (использовали пары праймеров
ctccF
caagcgctacaacaagaca
euoF/euoR и omcbF/omcbR) (таблица).
Конструирование плазмидных векторов для
ctccR
tggcttgcaaatggatcgga
активации экспрессии генов PGLYRP. Система
euoF
gcagcaagaagagaatgctg
активации экспрессии SAM включает в себя три
euoR
tgcgctcagcttccttct
плазмидных вектора: lenti sgRNA(MS2)_puro,
omcbF
tgcaacagtatgcgcttgtc
lenti MS2 P65 HSF1_Hygro и lenti dCAS
omcbR
aagaccaatctgctcctgca
VP64_Blast («Addgene», США) [24]. Для получе
ния вектора, кодирующего химерную гидовую
actbF
agagctacgagctgcctgac
РНК, вектор lenti sgRNA(MS2)_puro был обра
actbR
agcactgtgttggcgtacag
ботан эндонуклеазой рестрикции BsmBI
(«Thermo Fisher Scientific», США), после чего
были клонированы олигонуклеотидные дуплек
10 мкг/мл гентамицина
(«Thermo Fisher
сы, соответствующие протоспейсерным после
Scientific», США). При моделировании хлами
довательностям, расположенных в промотор
дийной инфекции клетки HeLa культивировали
ных областях пептидогликан распознающих
до достижения монослоем 80-90% конфлюент
белков (таблица). Подбор протоспейсерных
БИОХИМИЯ том 85 вып. 11 2020
АКТИВАЦИЯ ЭКСПРЕССИИ pglyrp С ПОМОЩЬЮ CRISPR/Cas9 SAM
1543
последовательностей проводили с помощью
ва клеток и включений с использованием флуо
сервиса crispor по наличию специфических
ресцентной микроскопии не менее чем в 10 по
PAM последовательностей в промоторных ре
лях зрения в трех повторах. Изображения были
гионах [25].
получены с помощью микроскопа Nikon Eclipse
Продукция лентивирусов и трансдукция. Для
E800 («Nikon», Япония) с аргоновым (488 нм) и
сборки лентивирусов клеткам HEK 293FT меня
гелий неоновым (594 нм) лазерами. Изображе
ли среду на DMEM с 25 мкМ хлорохин дифосфа
ния получали с помощью программного обеспе
та («Sigma», США) и инкубировали в течение 5 ч.
чения EZ C1 («Nikon», Япония), а анализирова
Клетки, культивированные в матрасах площадью
ли с использованием программного обеспече
225 см2, трансфицировали одновременно че
ния ImageJ 1.48 [27]. Для определения антихла
тырьмя плазмидами с помощью полиэтиленими
мидийной активности PGLYRP определяли ко
на (PEI): PEIMAX 40K (1мг/мл) («Polysciences»,
личество включений в клетках, синтезирующих
США) (соотношение ДНК/PEI = 1/3), согласно
PGLYRP относительно немодифицированных
описанной ранее методике [26]. После инкуба
клеток HeLa.
ции в течение 20 мин при комнатной температу
Статистический анализ данных. Для количе
ре смесь ДНК/PEI по каплям добавляли к клет
ственного анализа экспрессии генов pglyrp ис
кам и инкубировали в течение 6 ч. Затем среду
пользовали метод Pfaffl [28]. Для количествен
меняли на OptiMEM с 2 мМ бутиратом натрия
ного анализа экспрессии генов двухкомпонент
(«Sigma», США). Через 48 ч среду, содержащую
ной системы использовали метод 2-ΔΔCT [29].
лентивирусы, концентрировали на колонках
Анализ данных проводили с использованием t
Amicon 30 кДа («Merk», США) до уменьшения
критерия Стьюдента и теста множественных
объема в 50 раз, после чего замораживали при
сравнений (двухсторонний дисперсионный ана
-70 °С.
лиз) с использованием программного обеспече
Сконцентрированные вирусные частицы до
ния Statistica 8.0 («StatSoft», Россия). Данные
бавляли к клеткам HeLa в среду DMEM, содер
представлены как среднее значение ± стандарт
жащую 50 мкг/мл протамина сульфата («Элла
ная ошибка. Различия между средними значе
ра», Россия). Клетки инкубировали в течение
ниями считались значимыми при р < 0,05.
6 ч. Далее среду меняли на DMEM с соответ
ствующим антибиотиком и культивировали
клетки при 37 °С в атмосфере 5% CO2 до момен
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
та гибели всех нетрансдуцированных клеток.
Получение трансдуцированных линий с акти
Модификация клеток HeLa с использованием
вированной экспрессией PGLYRP. Для получения
технологии CRISPR/Cas9 SAM для транскрип
трансдуцированных линий с активированной
ционной активации генов pglyrp. Для каждого ге
экспрессией собственных PGLYRP проводили
на pglyrp было подобрано по две протоспейсер
последовательную трансдукцию тремя лентиви
ных последовательности в области промоторов.
русами с промежуточной селекцией. Для селек
В результате было сконструировано 8 плазмид
ции клеток HeLa, трансдуцированных лентиви
ных векторов, кодирующих гидовые РНК для
русом dCAS VP64_Blast, использовали бласти
распознавания промоторных областей генов
цидин (3 мкг/мл). Для селекции клеток HeLa,
pglyrp. Эти векторы были использованы для по
трансдуцированных MS2 P65 HSF1_Hygro, ис
лучения лентивирусов и трансдукции клеток
пользовали бластицидин и гигромицин
HeLa dCas9 MS2. Эти клетки синтезируют де
(3 мкг/мл и 550 мкг/мл соответственно). Полу
фектную нуклеазу Cas9, не способную вносить
ченную клеточную линию назвали HeLa dCas9
разрывы в цепь ДНК после связывания с гидо
MS2. Для селекции клеток HeLa, трансдуциро
вой РНК, слитую с тетрамером VP16 для актива
ванных лентивирусом sgRNA(MS2)_puro
ции транскрипции, а также химерный белок фа
PGLYRP1 4, использовали бластицидин, гигро
га MS2, слитый с активационным доменом фак
мицин и пуромицин (3 мкг/мл, 550 мкг/мл и
тора теплового шока 1 (HSF1), и субъединицы
0,5 мкг/мл соответственно). Для анализа анти
p65 фактора транскрипции NF κB для привле
хламидийной активности культуральную среду
чения транскрипционных факторов. Для опре
меняли на DMEM без антибиотиков.
деления транскрипционной активации генов
Флуоресцентная микроскопия. Клетки, инфи
pglyrp была выделена суммарная РНК, получена
цированные C. trachomatis, окрашивали антите
кДНК с использованием гексамерных прайме
лами РекомбиСлайд («Галарт Диагностикум»,
ров, после чего была проведена ПЦР в режиме
Россия) по описанной ранее методике [18] через
реального времени. Было показано, что в клет
48 ч после заражения. Степень заражения опре
ках, трансдуцированных лентивирусами, коди
деляли количественно путем подсчета количест
рущими гидовые РНК с протоспейсерными
БИОХИМИЯ том 85 вып. 11 2020
1544
БОБРОВСКИЙ и др.
(рис. 1). Для дальнейшей работы были исполь
зованы трансдуцированные клетки с наиболь
шим уровнем экспрессии.
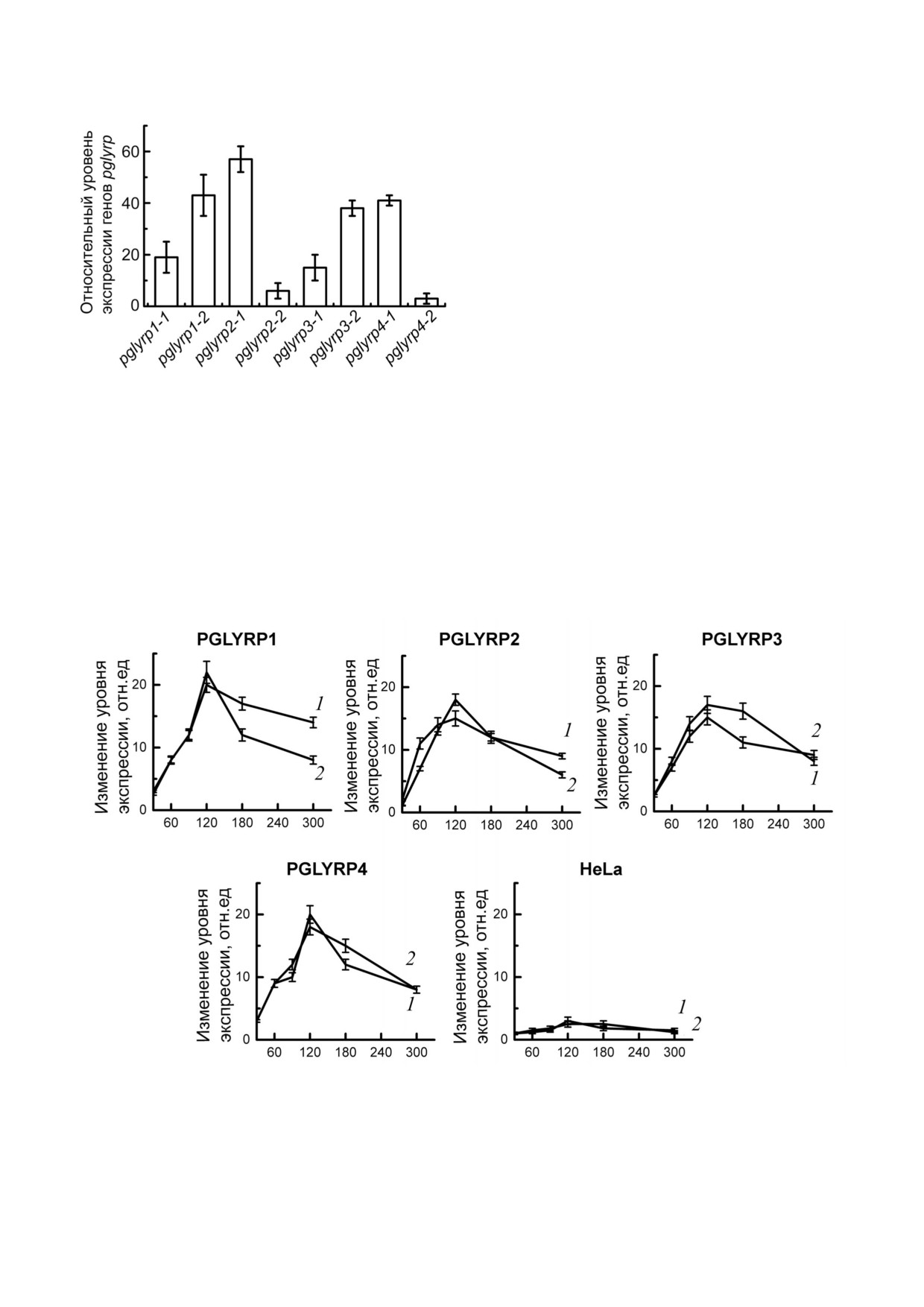
Анализ активации двухкомпонентной системы
C. trachomatis. Для изучения активации экспрес
сии генов двухкомпонентной системы CtcB
CtcC хламидий в ответ на PGLYRP мы исполь
зовали стабильные линии клеток продуцентов
рекомбинантных PGLYRP, полученных нами
ранее [18]. Мы выделили суммарную РНК из
клеток, инфицированных C. trachomatis, через
30, 60, 90, 120, 180 и 300 мин после заражения. С
помощью ПЦР в режиме реального времени бы
ла показана активация экспрессии генов двух
Рис. 1. Относительное изменение уровня экспрессии генов
компонентной системы хламидий (ctcB и ctcC)
pglyrp в трансдуцированной линии клеток HeLa лентиви
после инфицирования клеточных линий проду
русами, кодирующими компоненты активационной систе
центов рекомбинантных PGLYRP. Уровни
мы CRISPR/Cas9 SAM. Для каждого гена pglyrp было по
мРНК ctcB ctcC сравнивали с исходным количе
добрано по два протоспейсера для конструирования гидо
ством мРНК этих генов в интактных элементар
вой РНК. На гистограмме столбцы соответствуют разным
протоспейсерным последовательностям гидовых РНК
ных тельцах. Мы показали, что инкубация хла
мидийных элементарных телец в культуральной
среде c рекомбинантными PGLYRP приводила к
последовательностями pglyrp1 2, pglyrp2 1,
значительному увеличению уровня мРНК генов
pglyrp3 1 и pglyrp4 1, относительный уровень
ctcB и ctcC (рис. 2).
экспрессии целевых генов составил 43,2 ± 8,1,
Максимальные уровни мРНК наблюдали че
57,0 ± 5,2, 38,5 ± 3,1 и 41,8 ± 2,6 соответственно рез 2 ч после контакта элементарных телец с
Рис. 2. Анализ активации двухкомонентой системы CtcB CtcC C. trachomatis после взаимодействия с рекомбинантными
PGLYRP. Суммарную РНК выделяли из клеток через 30, 60, 90, 120, 180 и 300 мин после заражения. Данные ПЦР в режи
ме реального времени нормировали по уровню генов euo и omcB. Данные представлены как изменение уровня экспрес
сии, рассчитанные по методу 2-ΔΔCT. Изменение уровня экспрессии генов ctcB (линия 1) и ctcC (линия 2) оценивали отно
сительно уровня РНК в интактных элементарных тельцах, не контактировавших с PGLYRP
БИОХИМИЯ том 85 вып. 11 2020
АКТИВАЦИЯ ЭКСПРЕССИИ pglyrp С ПОМОЩЬЮ CRISPR/Cas9 SAM
1545
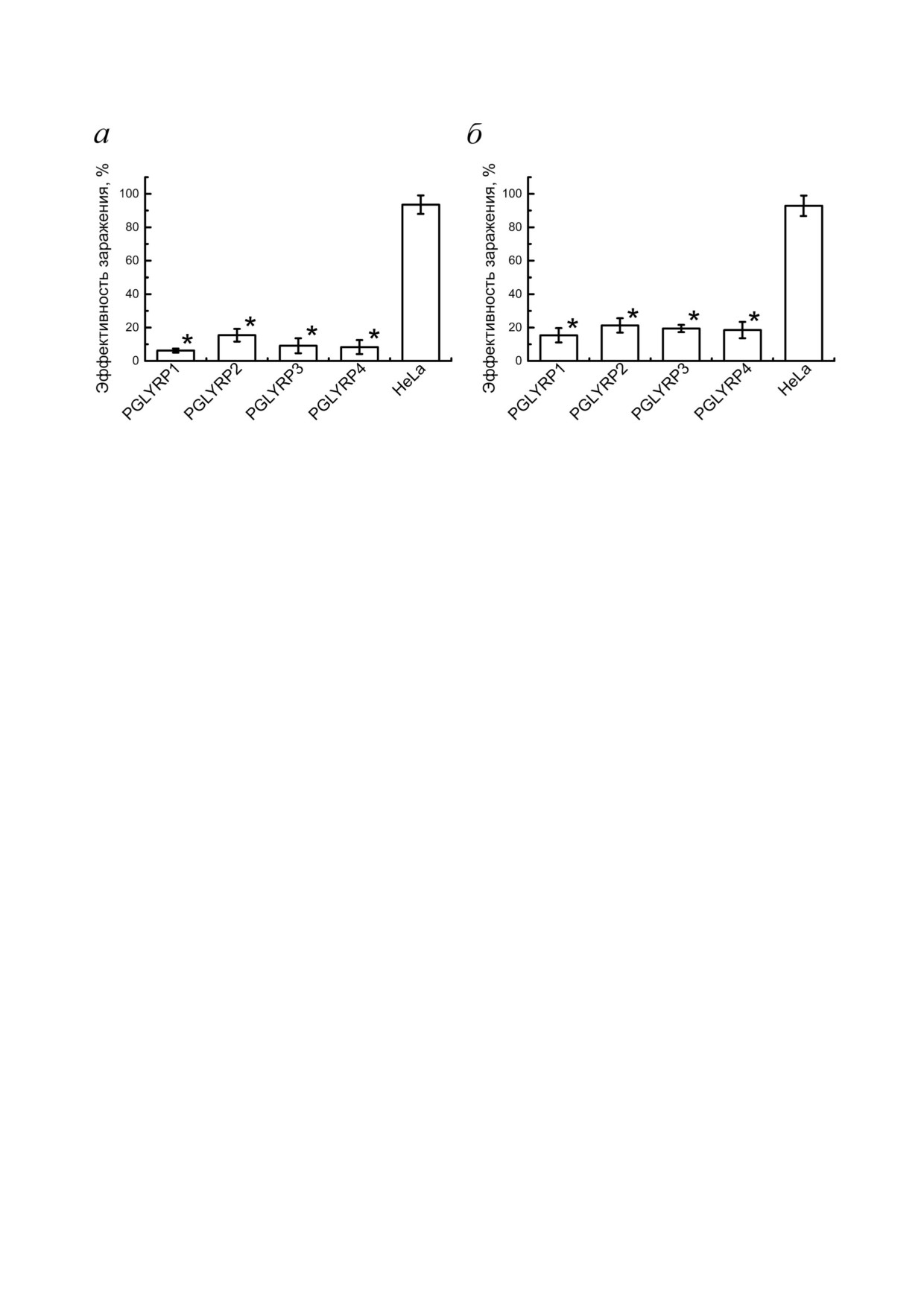
Рис. 3. Определение антихламидийной активности PGLYRP. а - Гистограмма, показывающая эффективность заражения
клеток HeLa - продуцентов рекомбинантных PGLYRP. б - Гистограмма, показывающая эффективность заражения транс
дуцированных клеток HeLa с активированной экспрессией генов собственных PGLYRP с помощью технологии геномно
го редактирования CRISPR/Cas9 SAM (* р < 0,05)
PGLYRP. Экспрессия гена ctcB увеличилась в
± 6,9% (рис. 3, б). Данные представлены как
15-20 раз, а ctcC - в 15-22 раза от исходного ко
среднее значение ± стандартная ошибка.
личества мРНК в хламидийных элементарных
Таким образом, мы показали, что активация
тельцах. После добавления элементарных телец
экспрессии генов пептидогликан распознаю
в среду к контрольным клеткам HeLa уровни
щих белков человека в линии клеток HeLa при
мРНК существенно не отличались от исходного
водит к ингибированию развития хламидийной
количества мРНК ctcB ctcC в элементарных
инфекции в условиях in vitro.
тельцах.
Антихламидийная активность PGLYRP. Для
определения антихламидийной активности
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
PGLYRP мы подсчитали количество включений
C. trachomatis, образующихся в клетках стабиль
Кожа и слизистые оболочки защищают орга
ных линий HeLa, продуцирующих рекомбинант
низм от проникновения патогенной микрофло
ные PGLYRP, и в трансдуцированных клетках
ры. Эти ткани образуют не только механичес
линии HeLa c активированной экспрессией ге
кий барьер, но также синтезируют и секретиру
нов pglyrp через 48 ч после добавления элемен
ют различные антимикробные пептиды и белки
тарных телец в среду, содержащую PGLYRP. Бы
[30, 31]. Антимикробные белки и пептиды счи
ла определена эффективность заражения ((ко
таются наиболее перспективными противоин
личество включений/общее количество клеток) ×
фекционными агентами, поскольку они вызы
× 100%). Эффективность заражения клеток
вают меньше побочных эффектов по сравнению
продуцентов рекомбинантных PGLYRP, инфи
с антибиотиками [32], и развитие резистентнос
цированных C. trachomatis составляла 6,2 ± 1,0%,
ти к ним затруднено в силу специфического ме
15,4 ± 2,9%, 9,1 ± 3,3% и 8,3 ± 4,0% для
ханизма действия [33]. Одним из направлений
PGLYRP1, PGLYRP2, PGLYRP3 и PGLYRP4 со
поиска новых антимикробных препаратов, как
ответственно, в то время как для контрольных
альтернативы антибиотикам, является исследо
клеток эффективность заражения составляла
вание врожденных систем защиты организма.
93,5 ± 6,2% (рис. 3, а). Через 48 ч после зараже
Пептидогликан распознающие белки представ
ния элементарными тельцами пулов трансдуци
ляют собой класс бактерицидных белков систе
рованных клеток HeLa PGLYRP эффектив
мы врожденного иммунитета. Эти белки актив
ность заражения составила 15,4 ± 3,2%, 21,3 ±
ны против патогенных грамотрицательных и
± 3,2%, 19,4 ± 1,8% и 18,5±3,7% для клеток про
грамположительных бактерий in vivo и in vitro
дуцентов PGLYRP1, PGLYRP2, PGLYRP3 и
[12, 34] и обладают уникальным механизмом
PGLYRP4 соответственно. Эффективность за
действия. Он заключается в том, что PGLYRP
ражения контрольных клеток составила 92,9 ±
связываются с пептидогликаном клеточной
3 БИОХИМИЯ том 85 вып. 11 2020
1546
БОБРОВСКИЙ и др.
стенки бактерии во время деления и активируют
тканях, где постоянно секретируются PGLYRP
бактериальную двухкомпонентную систему от
(например, в коже, глазах и слизистых оболоч
вета на стресс, в результате чего происходит ин
ках секретируются PGLYRP3 и PGLYRP4), и
дукция деполяризации мембраны и продукции
могут колонизировать эти области. Бактерио
гидроксил радикалов в цитоплазме [12]. Этот
статическое действие PGLYRP на бактерии нор
процесс сопровождается прекращением всех ос
мальной флоры имеет физиологический смысл
новных внутриклеточных биосинтетических ре
для хозяина - бактерии нормальной флоры не
акций, вероятно, из за нехватки энергии, зави
погибают, но их разрастание ограничено [13].
сящей от мембранного потенциала [35]. Двух
Пептидогликан является основным компо
компонентные белок чувствительные системы,
нентом клеточных стенок бактерий и мишенью
которые играют роль в этом механизме
для некоторых антибактериальных препаратов.
действия, предназначены для обнаружения и
Ранее считалось, что у хламидий нет пептидог
утилизации бактериальных белков с неправиль
ликана, хотя в геноме присутствуют все компо
ной структурой, которые не смогли выйти в пе
ненты для его биосинтеза [40, 41], в связи с этим
риплазматическое пространство или экспорти
влияние PGLYRP на хламидии не исследова
роваться из клетки, застряв в мембране [8, 9].
лось. В 2014 г. было показано наличие пептидог
Связывание PGLYRP с пептидогликаном вызы
ликана у хламидий [42]. Также у хламидий при
вает изменение в PGLYRP, что блокирует пепти
сутствует двухкомпонентная система (CtcB
догликан в пептидогликан связывающей борозд
CtcC) [43], которая может принимать участие в
ке и делает связывание необратимым [36].
механизме действия PGLYRP. Хламидии явля
PGLYRP также имеют гидрофобную часть на
ются облигатными внутриклеточными грамот
противоположной стороне от пептидогликан
рицательными бактериями, способными обхо
связывающей бороздки, в результате чего эти
дить механизмы иммунной защиты и сохраняю
белки распознаются как белки с неправильной
щими жизнеспособность в клетках в течение
структурой, которые обычно имеют открытые
длительного периода времени [44]. Ранее мы
гидрофобные участки, либо как агрегированные
впервые показали антихламидийную актив
белки, поскольку неправильно свернутые белки
ность выделенных и очищенных рекомбинант
часто агрегируют и связываются с пептидогли
ных пептидогликан распознающих белков, по
каном [37]. Особенность механизма действия
лученных в клетках человека Expi293, определи
PGLYRP заключается в том, что PGLYRP убива
ли минимальные подавляющие концентрации
ет бактерии, одновременно вызывая у них окис
[18] и оценили уровень накопления белков в ли
лительный, тиол дисульфидный и металличес
ниях продуцентах [45]. В этой работе мы оцени
кий стресс. Окислительный стресс, индуциро
ли антихламидийный эффект стабильных ли
ванный PGLYRP, возникает из за повышенной
ний клеток HeLa, которые секретируют реком
выработки перекиси водорода и гидроксильных
бинантные человеческие PGLYRP1, PGLYRP2,
радикалов [5, 38, 39].Тиол дисульфидный стресс
PGLYRP3 и PGLYRP4. Мы показали, что при
возникает из за истощения пула внутриклеточ
заражении линий продуцентов рекомбинатных
ных тиолов, в особенности глутатиона (более
PGLYRP количество идентифицируемых хла
чем на 90%), а металлический стресс возникает
мидийных включений внутри клеток ниже, чем
в связи с увеличением внутриклеточной концент
при заражении контрольных клеток (рис. 3, а).
рации ионов Zn2+ и Cu2+ [38, 39]. Для бактери
Мы показали, что контакт PGLYRP с эле
цидного эффекта требуется индукция всех трех
ментарными тельцами C. trachomatis способству
стрессовых реакций. Каждая реакция на стресс
ет увеличению уровня экспрессии генов двух
в отдельности является только бактериостати
компонентной системы, что может приводить к
ческой, и только комбинированная индукция
ингибированию хламидийной инфекции (рис.
всех трех событий является бактерицидной [39].
2). При этом максимальное количество мРНК
Устойчивость к PGLYRP могла бы возникнуть,
генов двухкомпонентной системы наблюдается
если бы все три реакции на стресс (т.е. на окис
через 2 ч после контакта с раствором рекомби
лительный, тиоловый и металлический стресс)
нантного белка. Для некоторых бактериальных
индуцировались PGLYRP через один сигналь
двухкомпонентных систем описан механизм ау
ный путь. Однако PGLYRP индуцирует окисли
тоактивации, который может объяснить чрез
тельный, тиоловый и металлический стресс тре
мерную индукцию реакции на стресс [46]. Та
мя независимыми путями [38]. При этом каж
ким образом, вероятно, механизм действия
дый PGLYRP обладает разным спектром бакте
PGLYRP на хламидии схож с действием этих
рицидной активности [34]. По всей видимости,
белков на другие бактерии.
бактерии нормальной флоры выработали устой
Существуют ограничения на использование
чивость к бактерицидным белкам в органах и
рекомбинантных белков для терапии инфекци
БИОХИМИЯ том 85 вып. 11 2020
АКТИВАЦИЯ ЭКСПРЕССИИ pglyrp С ПОМОЩЬЮ CRISPR/Cas9 SAM
1547
онных заболеваний. Это низкая стабильность
не представлены). Мы показали, что в клетках, в
некоторых выделенных рекомбинантных бел
которых активирована экспрессия генов пепти
ков [47], а также ограниченная возможность ло
догликан распознающих белков, на 79,5-85%
кального применения [48]. Альтернативным ва
снижается эффективность заражения клеток
риантом применения рекомбинантных белков
хламидиями по сравнению с контролем
могут служить генотерапевтические подходы
(рис. 3, б).
путем активации собственных генов системы
Применение антибиотиков приводит к обра
врожденного иммунитета для борьбы с инфек
зованию резистентных штаммов. Одним из нап
цией [49]. Генная терапия инфекционных забо
равлений решения проблемы устойчивости бак
леваний имеет значительный потенциал для ле
терий к используемым препаратам может слу
чения инфекций, которые не поддаются стандарт
жить применение белков врожденного иммуни
ному клиническому лечению [50-54]. При этом
тета, к которым затруднено развитие резистент
одним из способов терапии является индукция
ности в связи со специфическими механизмами
врожденного иммунитета, например через акти
действия данных белков. Несмотря на то что
вацию сигнальных путей Toll подобных рецеп
применение рекомбинантных белков врожден
торов [55, 56].
ного иммунитета, полученных в гетеро и гомо
Для определения антихламидийной актив
логичных системах экспрессии, выгодно за счет
ности PGLYRP человека мы повысили уровень
отсутствия токсических эффектов, использова
экспрессии генов pglyrp в клетках линии HeLa с
ние их ограничено из за трудности локального
помощью системы CRISPR/Cas9 SAM. Система
применения. В этой работе описывается подход,
синергичных медиаторов активации состоит из
позволяющий решить этот недостаток терапев
трех компонентов: специфичная химерная гидо
тического использования белков врожденного
вая РНК, имеющая два аптамера MS2 для связы
иммунитета путем активации экспрессии генов
вания с димеризованными белками оболочки
пептидогликан распознающих белков в эукарио
бактериофага MS2; белки MS2 с различными ак
тических клетках. Предложенный подход позво
тиваторами, такими как активационный домен
ляет использовать ресурсы врожденного имму
p65 транскрипционного фактора NF κB и акти
нитета для борьбы с инфекциями, в том числе и
вационный домен белка теплового шока HSF1,
с теми, которые вызываются антибиотико ре
которые привлекают факторы транскрипции
зистентными штаммами.
вокруг промотора гена мишени; и дефектная
нуклеаза dCas9 VP64, которая слита с тетраме
ром VP16, являющимся активатором транскрип
Финансирование. Работа выполнена при фи
ции. Такая система позволяет существенно уве
нансовой поддержке Российского научного
личивать экспрессию целевых генов [57].
фонда (грант № 20 15 00270).
Клетки HeLa после трансдукции лентивиру
Конфликт интересов. Авторы заявляют об от
сами, кодирующими активационную систему
сутствии конфликта интересов.
CRISPR/Cas9 SAM продемонстрировали повы
Соблюдение этических норм. Настоящая
шенный уровень экспрессии генов пептидогли
статья не содержит описания каких либо иссле
кан распознающих белков (рис. 1), а также при
дований с участием людей или животных в каче
сутствие белков в культуральной среде (данные
стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Prestinaci, F., Pezzotti, P., and Pantosti, A.
(2015)
tion proteins kill bacteria by activating protein sensing
Antimicrobial resistance: a global multifaceted phenome
two component systems, Nat. Med.,
17,
676683,
non, Pathog. Glob. Health, 109, 309 318, doi: 10.1179/
doi: 10.1038/nm.2357.
2047773215y.0000000030.
6.
Sharma, P., Dube, D., Singh, A., Mishra, B., Singh, N., et
2.
Grill, M. F., and Maganti, R. K. (2011) Neurotoxic effects
al. (2011) Structural basis of recognition of pathogen asso
associated with antibiotic use: management considera
ciated molecular patterns and inhibition of proinflamma
tions, Br. J. Clin. Pharmacol., 72, 381 393, doi: 10.1111/
tory cytokines by camel peptidoglycan recognition protein,
j.1365 2125.2011.03991.x.
J. Biol. Chem., 286, 1620816217, doi: 10.1074/jbc.
3.
Roberts, M. C. (2002) Antibiotic toxicity, interactions and
M111.228163.
resistance development, Periodontol. 2000, 28, 280 297,
7.
Tydell, C. C., Yuan, J., Tran, P., and Selsted, M. E. (2006)
doi: 10.1034/j.1600 0757.2002.280112.x.
Bovine peptidoglycan recognition protein S: antimicrobial
4.
Liu, C., Xu, Z., Gupta, D., and Dziarski, R. (2001) Pepti
activity, localization, secretion, and binding properties., J.
doglycan recognition proteins: a novel family of four human
Immunol., 176, 1154 1162, doi: 10.4049/jimmunol.176.2.1154.
innate immunity pattern recognition molecules, J. Biol.
8.
Hyyryläinen, H. L., Bolhuis, A., Darmon, E.,
Chem., 276, 34686 34694, doi: 10.1074/jbc.M105566200.
Muukkonen, L., Koski, P., Vitikainen, M., Sarvas, M.,
5.
Kashyap, D. R., Wang, M., Liu, L. H., Boons, G. J.,
Prágai, Z., Bron, S., van Dijl, J. M., and Kontinen, V. P.
Gupta, D., and Dziarski, R. (2011) Peptidoglycan recogni
(2001) A novel two component regulatory system in
БИОХИМИЯ том 85 вып. 11 2020
3*
1548
БОБРОВСКИЙ и др.
Bacillus subtilis for the survival of severe secretion stress,
25.
Haeussler, M., Schönig, K., Eckert, H., Eschstruth, A.,
Mol. Microbiol., 41, 11591172, doi: 10.1046/j.1365
Mianné, J., et al. (2016) Evaluation of off target and on
2958.2001.02576.x.
target scoring algorithms and integration into the guide
9.
Kohanski, M. A., Dwyer, D. J., Wierzbowski, J., Cottarel, G.,
RNA selection tool CRISPOR, Genome Biol., 17, 148,
and Collins, J. J. (2008) Mistranslation of membrane pro
doi: 10.1186/s13059 016 1012 2.
teins and two component system activation trigger antibi
26.
Tiscornia, G., Singer, O., and Verma, I. M.
(2006)
otic mediated cell death, Cell,
135,
679690,
Production and purification of lentiviral vectors, Nat.
doi: 10.1016/j.cell.2008.09.038.
Protoc., 1, 241 245, doi: 10.1038/nprot.2006.37.
10.
Darmon, E., Noone, D., Masson, A., Bron, S., Kuipers,
27.
Schneider, C. A., Rasband, W. S., and Eliceiri, K. W.
O. P., Devine, K. M., and van Dijl, J. M. (2002) A novel
(2012) NIH Image to ImageJ: 25 years of image analysis,
class of heat and secretion stress responsive genes is con
Nat. Methods, 9, 671 675, doi: 10.1038/nmeth.2089.
trolled by the autoregulated CssRS two component system
28.
Pfaffl, M. W. (2001) A new mathematical model for relative
of Bacillus subtilis, J. Bacteriol.,
184,
56615671,
quantification in real time RT PCR, Nucleic Acids Res.,
doi: 10.1128/jb.184.20.5661 5671.2002.
29, e45, doi: 10.1093/nar/29.9.e45.
11.
Westers, H., Westers, L., Darmon, E., van Dijl, J. M.,
29.
Rao, X., Huang, X., Zhou, Z., and Lin, X. (2013) An
Quax, W. J., and Zanen, G. (2006) The CssRS two com
improvement of the 2′( delta delta CT) method for quanti
ponent regulatory system controls a general secretion stress
tative real time polymerase chain reaction data analysis,
response in Bacillus subtilis, FEBS J., 273, 3816 3827,
Biostat. Bioinform. Biomath., 3, 71 85.
doi: 10.1111/j.1742 4658.2006.05389.x.
30.
Schittek, B., Paulmann, M., Senyürek, I., and Steffen, H.
12.
Dziarski, R., Kashyap, D. R., and Gupta, D. (2012)
(2008) The role of antimicrobial peptides in human skin
Mammalian peptidoglycan recognition proteins kill bacte
and in skin infectious diseases, Infect. Dis. Drug Targets, 8,
ria by activating two component systems and modulate
135 143, doi: 10.2174/1871526510808030135.
microbiome and inflammation., Microb. Drug Res., 18,
31.
Schauber, J., and Gallo, R. L. (2008) Antimicrobial pep
280 285, doi: 10.1089/mdr.2012.0002.
tides and the skin immune defense system, J. Allergy
13.
Dziarski, R., and Gupta, D. (2006) Mammalian PGRPs:
Clin. Immunol., 122, 261 266, doi: 10.1016/j.jaci.2008.03.
novel antibacterial proteins, Cell. Microbiol., 8, 1059 1069,
027.
doi: 10.1111/j.1462 5822.2006.00726.x.
32.
Huang, G. T., Zhang, H. B., Kim, D., Liu, L., and Ganz, T.
14.
O’Connell, C. M., and Ferone, M. E. (2016) Chlamydia
(2002) A model for antimicrobial gene therapy: demon
trachomatis genital infections, Microb. Cell, 3, 390 403,
stration of human beta defensin 2 antimicrobial activities
doi: 10.15698/mic2016.09.525.
in vivo, Hum. gene Ther., 13, 2017 2025, doi: 10.1089/
15.
Kalayoglu, M. V. (2002) Ocular chlamydial infections:
10430340260395875.
pathogenesis and emerging treatment strategies, Curr. Drug
33.
Joo, H. S., Fu, C. I., and Otto, M. (2016) Bacterial strate
Targets Infect. Disord.,
2,
8591, doi:
10.2174/
gies of resistance to antimicrobial peptides, Philos. Trans.
1568005024605918.
R. Soc. Lond. B Biol. Sci., 371, 20150292, doi: 10.1098/
16.
Moulder, J. W. (1991) Interaction of chlamydiae and host
rstb.2015.0292.
cells in vitro, Microb. Rev., 55, 143 190.
34.
Lu, X., Wang, M., Qi, J., Wang, H., Li, X., Gupta, D., and
17.
Panzetta, M. E., Valdivia, R. H., and Saka, H. A. (2018)
Dziarski, R. (2006) Peptidoglycan recognition proteins are
Chlamydia persistence: a survival strategy to evade antimi
a new class of human bactericidal proteins, J. Biol. Chem.,
crobial effects in vitro and in vivo, Front. Microbiol., 9,
281, 5895 5907, doi: 10.1074/jbc.M511631200.
3101, doi: 10.3389/fmicb.2018.03101.
35.
Dimroth, P., Kaim, G., and Matthey, U. (2000) Crucial
18.
Bobrovsky, P., Manuvera, V., Polina, N., Podgorny, O.,
role of the membrane potential for ATP synthesis by
Prusakov, K., Govorun, V., and Lazarev, V.
(2016)
F(1)F(o) ATP synthases, J. Exp. Biol., 203, 51 59.
Recombinant human peptidoglycan recognition proteins
36.
Wang, Z. M., Li, X., Cocklin, R. R., Wang, M., Wang, M.,
reveal antichlamydial activity, Infect. Immun.,
84,
Fukase, K., et al. (2003) Human peptidoglycan recognition
doi: 10.1128/IAI.01495 15.
protein L is an N acetylmuramoyl L alanine amidase, J. Biol.
19.
Zhu, M., Miao, B., Zhu, J., Wang, H., and Zhou, Z.
Chem., 278, 49044 49052, doi: 10.1074/jbc.M307758200.
(2017) Expression and antimicrobial character of cells
37.
Lim, J. H., Kim, M. S., Kim, H. E., Yano, T., Oshima, Y.,
transfected with human β defensin 3 against periodonti
et al. (2006) Structural basis for preferential recognition of
tis associated microbiota in vitro, Mol. Med. Rep., 16,
diaminopimelic acid type peptidoglycan by a subset of
2455 2460, doi: 10.3892/mmr.2017.6913.
peptidoglycan recognition proteins, J. Biol. Chem., 281,
20.
Zhang, J., Xie, L., Xu, D., Yue, S., Li, Y., Guo, X., and
8286 8295, doi: 10.1074/jbc.M513030200.
Lai, X. (2017) Targeting expression of antimicrobial pep
38.
Kashyap, D. R., Kuzma, M., Kowalczyk, D. A., Gupta,
tide CAMA Syn by adenovirus vector in macrophages
D., and Dziarski, R. (2017) Bactericidal peptidoglycan
inhibits the growth of intracellular bacteria, Gene, 630, 59
recognition protein induces oxidative stress in Escherichia
67, doi: 10.1016/j.gene.2017.07.079.
coli through a block in respiratory chain and increase in
21.
Ramos Espinosa, O., Hernández Bazán, S., Francisco
central carbon catabolism, Mol. Microbiol., 105, 755 776,
Cruz, A., Mata Espinosa, D., Barrios Payán, J., et al.
doi: 10.1111/mmi.13733.
(2016) Gene therapy based in antimicrobial peptides and
39.
Kashyap, D. R., Rompca, A., Gaballa, A., Helmann, J. D.,
proinflammatory cytokine prevents reactivation of experi
Chan, J., Chang, C. J., Hozo, I., Gupta, D., and Dziarski, R.
mental latent tuberculosis, Pathog. Dis., 74, doi: 10.1093/
(2014) Peptidoglycan recognition proteins kill bacteria by
femspd/ftw075.
inducing oxidative, thiol, and metal stress, PLoS Pathogens,
22.
Dolgachev, V., Panicker, S., Balijepalli, S., McCandless, L. K.,
10, e1004280, doi: 10.1371/journal.ppat.1004280.
Yin, Y., et al. (2018) Electroporation mediated delivery of
40.
Chopra, I., Storey, C., Falla, T. J., and Pearce, J. H. (1998)
FER gene enhances innate immune response and improves
Antibiotics, peptidoglycan synthesis and genomics: the
survival in a murine model of pneumonia, Gene Therapy,
chlamydial anomaly revisited, Microbiol. (Reading), 144,
25, 359 375, doi: 10.1038/s41434 018 0022 y.
2673 2678, doi: 10.1099/00221287 144 10 2673.
23.
Scidmore, M. A. (2005) Cultivation and laboratory main
41.
Stephens, R. S., Kalman, S., Lammel, C., Fan, J.,
tenance of Chlamydia trachomatis, Curr. Protoc. Microbiol.,
Marathe, R., et al. (1998) Genome sequence of an obligate
11, 11A.11, doi: 10.1002/9780471729259.mc11a01s00.
intracellular pathogen of humans: Chlamydia trachomatis,
24.
Joung, J., Konermann, S., Gootenberg, J. S., Abudayyeh,
Science, 282, 754 759, doi: 10.1126/science.282.5389.
O. O., Platt, R. J., Brigham, M. D., Sanjana, N. E., and
754.
Zhang, F. (2017) Genome scale CRISPR Cas9 knockout
42.
Liechti, G. W., Kuru, E., Hall, E., Kalinda, A., Brun, Y. V.,
and transcriptional activation screening, Nat. Protoc., 12,
VanNieuwenhze, M., and Maurelli, A. T. (2014) A new
828 863, doi: 10.1038/nprot.2017.016.
metabolic cell wall labelling method reveals peptidoglycan
БИОХИМИЯ том 85 вып. 11 2020
АКТИВАЦИЯ ЭКСПРЕССИИ pglyrp С ПОМОЩЬЮ CRISPR/Cas9 SAM
1549
in Chlamydia trachomatis, Nature,
506,
507510,
51. Bergmann, B., Fei, Y., Jirholt, P., Hu, Z., Bergquist, M., et
doi: 10.1038/nature12892.
al. (2020) Pre treatment with IL2 gene therapy alleviates
43.
Koo, I. C., and Stephens, R. S. (2003) A developmentally
Staphylococcus aureus arthritis in mice, BMC Infect. Dis.,
regulated two component signal transduction system in
20, 185, doi: 10.1186/s12879 020 4880 8.
Chlamydia, J. Biol. Chem., 278, 17314 17319, doi: 10.1074/
52. Chandler, L. C., Yusuf, I. H., McClements, M. E.,
jbc.M212170200.
Barnard, A. R., MacLaren, R. E., and Xue, K. (2020)
44.
Witkin, S. S., Minis, E., Athanasiou, A., Leizer, J., and
Immunomodulatory effects of hydroxychloroquine and
Linhares, I. M. (2017) Chlamydia trachomatis: the persis
chloroquine in viral infections and their potential applica
tent pathogen, Clin. Vaccine Immunol., 24, doi: 10.1128/
tion in retinal gene therapy, Int. J. Mol. Sci., 21,
cvi.00203 17.
doi: 10.3390/ijms21144972.
45.
Bobrovsky, P. A., Larin, A. K., Polina, N. F., and Lazarev,
53. Verma, R., Sahu, R., Singh, D. D., and Egbo, T. E. (2019)
V. N. (2019) Transcriptional analysis of HELA cells - pro
A CRISPR/Cas9 based polymeric nanoparticles to
ducers of the recombinant peptidoglycan recognition pro
treat/inhibit microbial infections, Seminars Cell Dev. Biol.,
tein PGLYRP1 at different stages of the Chlamydia tra
96, 44 52, doi: 10.1016/j.semcdb.2019.04.007.
chomatis infection development, Biomed. Chem. Res.
54. Lazarev, V. N., Polina, N. F., Shkarupeta, M. M.,
Methods, 2, e00113, doi: 10.18097/BMCRM00113.
Kostrjukova, E. S., Vassilevski, A. A., Kozlov, S. A.,
46.
De Wulf, P., Kwon, O., and Lin, E. C. (1999) The CpxRA
Grishin, E. V., and Govorun, V. M. (2011) Spider venom
signal transduction system of Escherichia coli: growth
peptides for gene therapy of Chlamydia infection,
related autoactivation and control of unanticipated target
Antimicrob. Agents Chemother., 55, 5367 5369, doi: 10.1128/
operons, J. Bacteriol., 181, 6772 6778.
aac.00449 11.
47.
Deller, M. C., Kong, L., and Rupp, B. (2016) Protein stabil
55. Abe, T., Kaname, Y., Wen, X., Tani, H., Moriishi, K.,
ity: a crystallographer’s perspective, Acta Crystallogr. F Struct.
Uematsu, S., Takeuchi, O., Ishii, K. J., Kawai, T., Akira, S.,
Biol. Commun., 72, 72 95, doi: 10.1107/s2053230x15024619.
and Matsuura, Y. (2009) Baculovirus induces type I inter
48.
Muheem, A., Shakeel, F., Jahangir, M. A., Anwar, M.,
feron production through toll like receptor dependent and
Mallick, N., Jain, G. K., Warsi, M. H., and Ahmad, F. J.
independent pathways in a cell type specific manner,
(2016) A review on the strategies for oral delivery of pro
J. Virol., 83, 7629 7640, doi: 10.1128/jvi.00679 09.
teins and peptides and their clinical perspectives, Saudi
56. Abe, T., Hemmi, H., Miyamoto, H., Moriishi, K.,
Pharm. J., 24, 413 428, doi: 10.1016/j.jsps.2014.06.004.
Tamura, S., Takaku, H., Akira, S., and Matsuura, Y.
49.
O’Neill, L. A., Bryant, C. E., and Doyle, S. L. (2009)
(2005) Involvement of the toll like receptor 9 signaling
Therapeutic targeting of toll like receptors for infectious
pathway in the induction of innate immunity by bac
and inflammatory diseases and cancer, Pharmacol. Rev.,
ulovirus, J. Virol., 79, 2847 2858, doi: 10.1128/jvi.79.5.
61, 177 197, doi: 10.1124/pr.109.001073.
2847 2858.2005.
50.
Sierra Delgado, J. A., Bautista Nino, P. K., Vargas
57. Konermann, S., Brigham, M. D., Trevino, A. E., Joung, J.,
Castellanos, C. I., Serrano Diaz, N. C., and Rincon, M. Y.
Abudayyeh, O. O., et al. (2015) Genome scale transcrip
(2019) Immune response and gene therapy with adenoas
tional activation by an engineered CRISPR Cas9 complex,
sociated viral vectors, Medicina, 79, 493 501.
Nature, 517, 583 588, doi: 10.1038/nature14136.
INHIBITION OF CHLAMYDIAL INFECTION BY CRISPR/Cas9 SAM
MEDIATED ENHANCEMENT OF HUMAN PEPTIDOGLYCAN
RECOGNITION PROTEINS GENE EXPRESSION IN HeLa CELLS
P. A. Bobrovsky1*, V. D. Moroz1, V. N. Lavrenova1,2, V. A. Manuvera1, and V. N. Lazarev1
1 Federal Research and Clinical Center of Physical Chemical Medicine of Federal Medical Biological Agency,
119435 Moscow, Russia; E mail: pbobrovskiy@gmail.com
2 Faculty of Biology, Lomonosov Moscow State University, 119991 Moscow, Russia
Received July 7, 2020
Revised August 22, 2020
Accepted August 23, 2020
The global problem of emerging resistance of microorganisms to antibiotics makes the search for new natural sub
stances with antibacterial properties relevant. Such substances include peptidoglycan recognition proteins
(PGLYRP), which are the components of the innate immunity of many organisms, including humans. These proteins
have a unique mechanism of action that allows them to evade the resistance of bacteria to them, as well as to be active
against both Gram positive and Gram negative bacteria. However, the use of antimicrobial recombinant proteins is
not always advisable due to the complexity of local delivery of the proteins and their stability; in this regard it seems
appropriate to activate the components of the innate immunity. The aim of this study was to increase the expression
level of native peptidoglycan recognition protein genes in HeLa cells using genome editing technology with synergis
tic activation mediators (CRISPR/Cas9 SAM) and evaluate antichlamydial effect of PGLYRP. We demonstrated
activation of the chlamydial two component gene system (ctcB ctcC), which played a key role in the mechanism of
action of the peptidoglycan recognition proteins. We generated the HeLa cell line transduced with lentiviruses encod
ing CRISPR/Cas9 SAM activation system with increased PGLYRP gene expression. It was shown that activation of
the own peptidoglycan recognition proteins gene expression in the cell line caused inhibition of the chlamydial infec
tion development. The proposed approach makes it possible to use the capabilities of innate immunity to combat
infectious diseases caused by Gram positive and Gram negative bacteria.
Keywords: peptidoglycan, Chlamydia trachomatis, PGLYRP, CRISPR/Cas9
БИОХИМИЯ том 85 вып. 11 2020