БИОХИМИЯ, 2020, том 85, вып. 11, с. 1550 - 1568
УДК 577.182.48
ИСПОЛЬЗОВАНИЕ РАСШИРЕННОГО ХИМИЧЕСКОГО
ПРОСТРАНСТВА ЛАНТИБИОТИКОВ ДЛЯ СОЗДАНИЯ
ИСКУССТВЕННОГО БИОРАЗНООБРАЗИЯ ГЕНЕТИЧЕСКИ
КОДИРУЕМЫХ АНТИБИОТИКОВ
Обзор
© 2020
С.О. Пипия1, С.С. Терехов1,2, Ю.А. Мокрушина1,2, В.Д. Кнорре1,
И.В. Смирнов1,2*, А.Г. Габибов1,2
1 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова
Российской академии наук, 117997 Москва, Россия; электронная почта: smirnov@ibch.ru
2 Московский государственный университет имени М.В. Ломоносова,
химический факультет, 119991 Москва, Россия
Поступила в редакцию 11.08.2020
После доработки 28.09.2020
Принята к публикации 07.10.2020
Открытие антибиотиков послужило одним из ключевых этапов развития человечества, многократно увели
чившим выживаемость и повысившим продолжительность жизни миллионов людей по всему миру. Бескон
трольное применение антибиотиков привело к селекции резистентных штаммов бактерий, ставящих под
угрозу эффективность современной антимикробной терапии, актуализируя тем самым проблему поиска но
вых антибиотиков. В течение долгого времени антимикробные пептиды (АМП) считались перспективными
кандидатами на роль антибиотиков нового поколения. В то же время практическое применение АМП не
нашло широкого применения ввиду спектра проблем с терапевтическими индексами, фармакокинетикой и
фармакодинамикой этих соединений, зачастую предопределённого их пептидной природой. Тем не менее
генетически кодируемая природа АМП позволяет создавать широкие репертуары искусственного биоразно
образия антибиотиков, открывая беспрецедентные возможности для направленной эволюции антибиоти
ческой активности. Лантибиотики представляют собой уникальный класс АМП, обладающих расширен
ным химическим пространством. Разнообразие посттрансляционных модификаций, механизмов действия
на бактериальные мембраны и генетически кодируемая структура делают их удобной молекулярной матри
цей для создания высокопредставительных библиотек антимикробных соединений. Поиск новых лекар
ственных кандидатов среди представителей этого синтетического биоразнообразия чрезвычайно привлека
телен, однако требует проведения широкомасштабного высокопроизводительного скрининга антибиоти
ческой активности. Комбинация методов синтетической биологии и ультра высокопроизводительных мик
рофлюидных платформ позволяет реализовать концепцию направленной эволюции лантибиотиков для
быстрого и эффективного создания новых перспективных лекарственных кандидатов.
КЛЮЧЕВЫЕ СЛОВА: направленная эволюция антимикробной активности, генетически кодируемые ан
тибиотики, ультра высокопроизводительный скрининг, микрофлюидика, биоинженерия лантибиотиков,
открытие лекарственных препаратов, антибиотикорезистентность.
DOI: 10.31857/S0320972520110044
ВВЕДЕНИЕ
циллина наступила так называемая «Золотая эра
антибиотиков». В период с 1928 по 1980 г. было
Антибиотики десятилетиями служат на бла
открыто более 10 классов антибиотиков [1]. Од
го человечества, спасая миллионы жизней от
нако в настоящее время из за их бесконтроль
смертельных инфекций. После открытия пени
ного применения в сельском хозяйстве, а также
неправильного и чрезмерного их использования
Принятые сокращения: АМП - антимикробные в медицине человечество столкнулось с серьёз
пептиды; Dha - дегидроаланин; Dhb - дегидробутирин; ной угрозой, вызванной широкомасштабным
домен UEV - убиквитин связывающий домен (ubiquitin E2
возникновением устойчивости микроорганиз
variant); PE - фосфатидилэтаноламин; РПП - рибосо
мально синтезированные и посттрансляционно модифи
мов к противомикробным препаратам. Как со
цируемые пептиды.
общает Всемирная организация здравоохране
* Адресат для корреспонденции.
ния, человечество стоит на пороге постантибио
1550
СОЗДАНИЕ ИСКУССТВЕННОГО БИОРАЗНООБРАЗИЯ ЛАНТИБИОТИКОВ
1551
тической эры [2]. Этот сценарий осложняется и
Однако, несмотря на множественные попытки
появлением мультирезистентных штаммов, ко
создания терапевтических препаратов, анти
торые более не восприимчивы сразу к несколь
микробные пептиды (АМП) не нашли широко
ким классам антибиотиков. Самыми распрост
го применения на практике. Это обусловливает
ранёнными в клинической практике являются
ся рядом трудностей, зачастую связанных с их
метициллин резистентный золотистый стафи
низкой селективностью [10]. Естественный уро
лококк (MRSA), устойчивый к ванкомицину
вень продукции АМП довольно низок, их хими
Staphylococcus aureus (VRSA) и ванкомицин ре
ческий синтез часто сопряжён с техническими
зистентные энтерококки (VRE). Они представ
трудностями и большими финансовыми вложе
ляют основную причину серьёзных инфекций,
ниями [11]. Одним из наиболее серьёзных не
приобретённых в больнице. Помимо этого,
достатков АМП является их подверженность
клостридиальные инфекции являются часто
протеолитической деградации, кардинальным
встречающейся причиной больничной диареи.
образом ухудшающей их фармакокинетические
В последнее время число заражённых, а также
характеристики. Тем не менее среди АМП есть
смертность растут, и необходимо находить но
перспективные классы, для которых, используя
вые способы лечения [3]. Таким образом, науч
инструменты направленной эволюции и широ
ное и медицинское сообщество подчёркивает
комасштабного скрининга, возможно создание
приоритетную роль исследований, ведущих к
молекул с подходящими для клинического при
созданию альтернативных антимикробных пре
менения свойствами.
паратов.
Много внимания в настоящее время прико
В настоящее время разрабатывается целый
вано к рибосомально синтезированным и пост
ряд подходов для поиска новых антибиотиков.
трансляционно модифицируемым пептидам
Технологии синтетической биологии и методы
(RiPPs или РПП). Биосинтез РПП начинается с
рационального дизайна позволяют создавать со
образования пептида прекурсора. Он состоит из
единения с улучшенными антимикробными
лидерной последовательности, которую узнают
свойствами и характеристиками стабильности
модифицирующие ферменты, и структурной
[4]. Развитие биоинформатических методов и
последовательности, которая претерпевает пос
расширение геномных баз данных позволили
ледующие модификации. Последним этапом
использовать технологии геномного майнинга
является процессинг лидерной последователь
для поиска новых кластеров биосинтеза анти
ности протеазами и экспорт зрелого РПП во
микробных соединений [5]. Технологии высо
внеклеточную среду [12].
копроизводительного скрининга находят актив
Генетически кодируемая последовательность
ное применение в области поиска природных
таких пептидов позволяет легко вводить измене
антибиотиков среди экзотических микробных
ния в их структуру [13]. Большой набор возмож
сообществ [6]. Применение искусственного ин
ных модификаций потенциально создаёт широ
теллекта для виртуального скрининга библиотек
чайший спектр генерируемых структур и функ
химических соединений на способность прояв
циональных групп, соединённых в одной моле
лять значительную антимикробную активность
куле, которая, в свою очередь, может продуци
также показывает многообещающие результаты
роваться рекомбинантными организмами. Та
в данной области [7].
ким образом, РПП обладают уникальными пре
Для разработки новых соединений, приме
имуществами для создания соединений с раз
нимых в клинической практике, важными кри
личной биологической активностью, что также
териями являются безопасность и эффектив
позволяет улучшать стабильность этих молекул
ность. Пептиды являются перспективными кан
[14], делая их привлекательными объектами для
дидатами на роль модельных объектов для соз
терапевтического применения [15, 16].
дания новых препаратов. Они обладают высо
Немалый интерес к данной области под
кой селективностью и эффективностью взаимо
крепляется развитием технологий полногеном
действия с мишенями, их метаболизм в организ
ного секвенирования и метагеномного майнин
ме легко предугадать, развивающиеся техноло
га, благодаря которым увеличивается количество
гии пептидного синтеза и биотехнологии позво
идентифицированных кластеров генов, потен
ляют снижать затраты на производство [8]. К
циально отвечающих за биосинтез РПП [17, 18].
настоящему моменту более 60 препаратов пеп
Известно примерно 20 семейств РПП, каждое
тидной природы были выпущены на рынок и ус
из которых имеет свои особенности структуры,
пешно применяются для лечения диабета, рака
биосинтеза пептидов и биологической актив
и орфанных заболеваний [9].
ности [19]. К ним относятся лантипептиды, ци
Пептиды также представляют интерес в об
анобактины, ботрамицины, лассо пептиды,
ласти разработки антимикробных препаратов.
микровиридины и другие.
БИОХИМИЯ том 85 вып. 11 2020
1552
ПИПИЯ и др.
ЛАНТИПЕПТИДЫ И ЛАНТИБИОТИКИ
как lanА, ферменты, осуществляющие основные
модификации - lanВ и lanС или lanМ, lanL (для
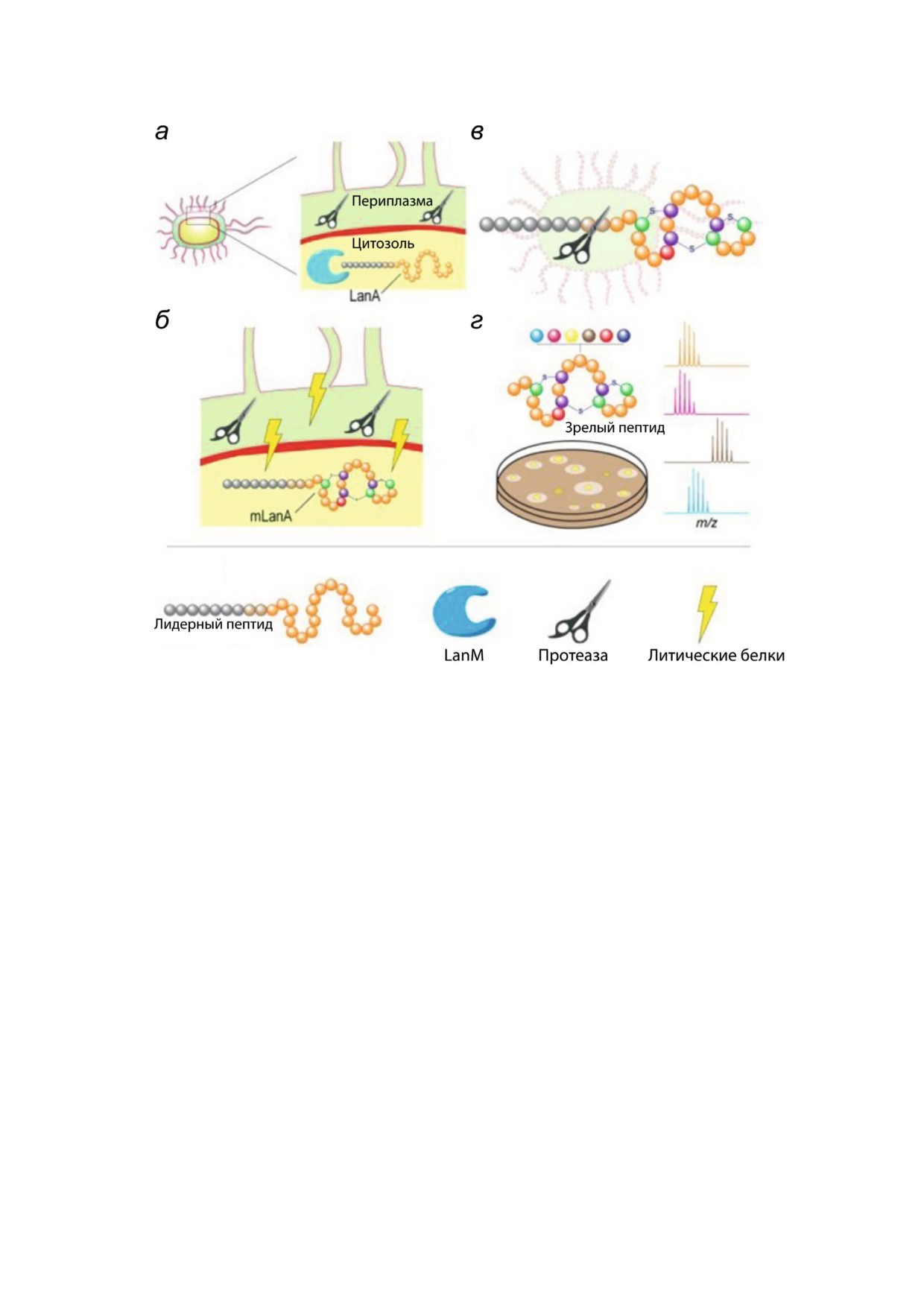
Лантипептиды - группа рибосомально син
мультифункциональных ферментов лантибио
тезированных и посттрансляционно модифи
тиков 2 и 4 класса), lanТ - для белка транспор
цированных пептидов, продуцируемых грампо
тера, lanР - для специфической протеазы, про
ложительными бактериями [20]. Они имеют в
цессирующей лидерную последовательность,
своём составе остатки неканонических амино
для дополнительных модифицирующих фер
кислот лантионина и метил лантионина, кото
ментов предусмотрены свои обозначения. Lan в
рые образуют внутримолекулярные тиоэфир
названии гена или его продукта заменяется на
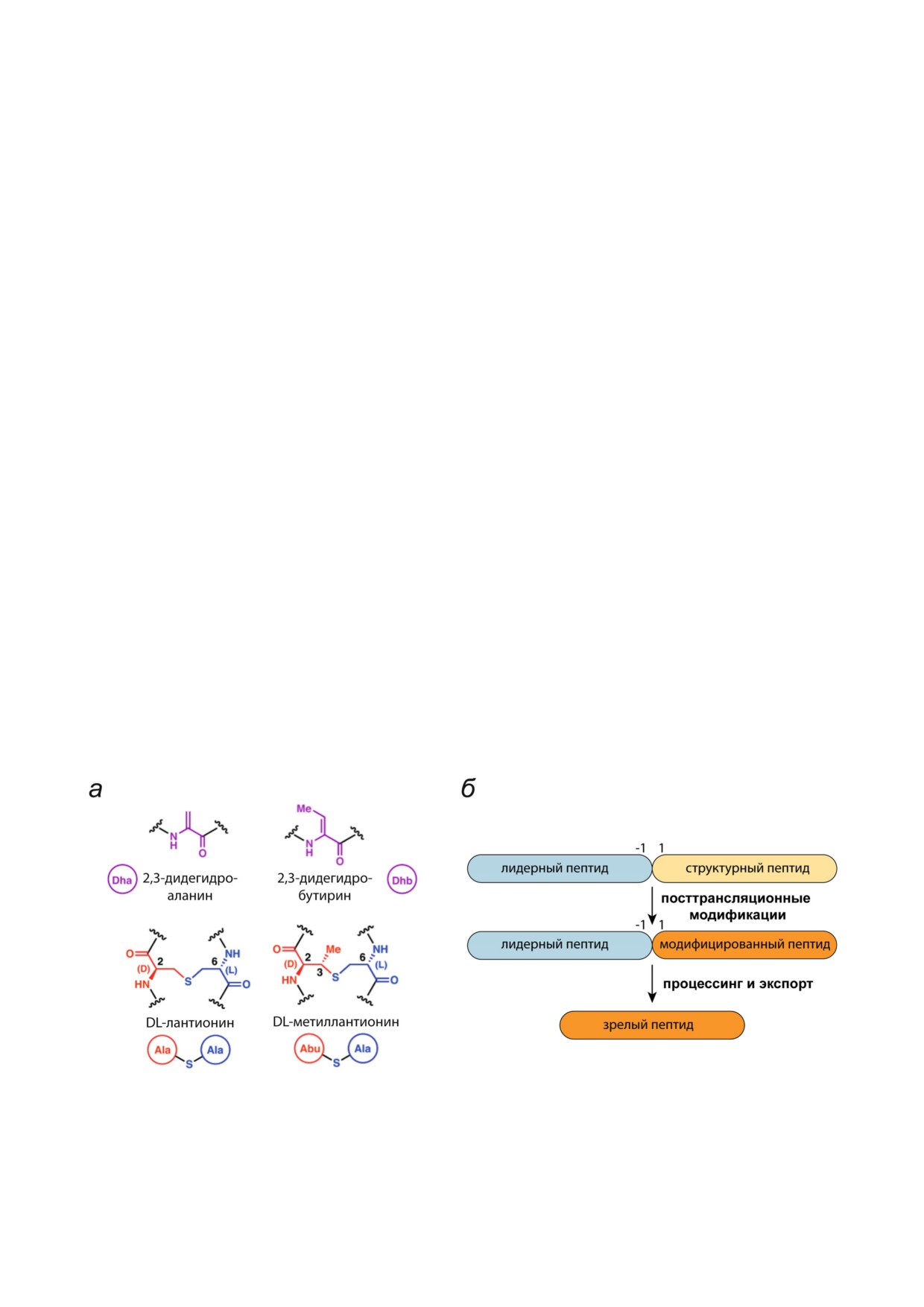
ные связи (рис. 1, а), и ряд других модифика
соответствующее сокращение, принятое для
ций, таких как дегидратирование остатков Thr
конкретного лантибиотика.
или Ser с образованием остатков дегидробути
рина (Dhb) и дегидроаланина (Dha), N конце
вое ацилирование и др. Лантипептиды закоди
КЛАССИФИКАЦИЯ ЛАНТИБИОТИКОВ
рованы в геноме продуцента в виде препептида,
состоящего из лидерной последовательности и
Современная система классификации лан
структурного пептида. Лидерная последователь
тибиотиков основана на различии в строении
ность распознается ферментами модификации
ферментов, осуществляющих дегидратацию и
и направляет созревание лантипептида. Струк
циклизацию структурного пептида, и механиз
турный пептид подвергается модификациям и
мах внесения данных модификаций [19]. На се
после отрезания лидерной последовательности
годняшний день выделяют 4 основных класса
становится активной молекулой (рис. 1, б). Из
лантипептидов (рис. 2).
вестно, что лантипептиды могут играть роль
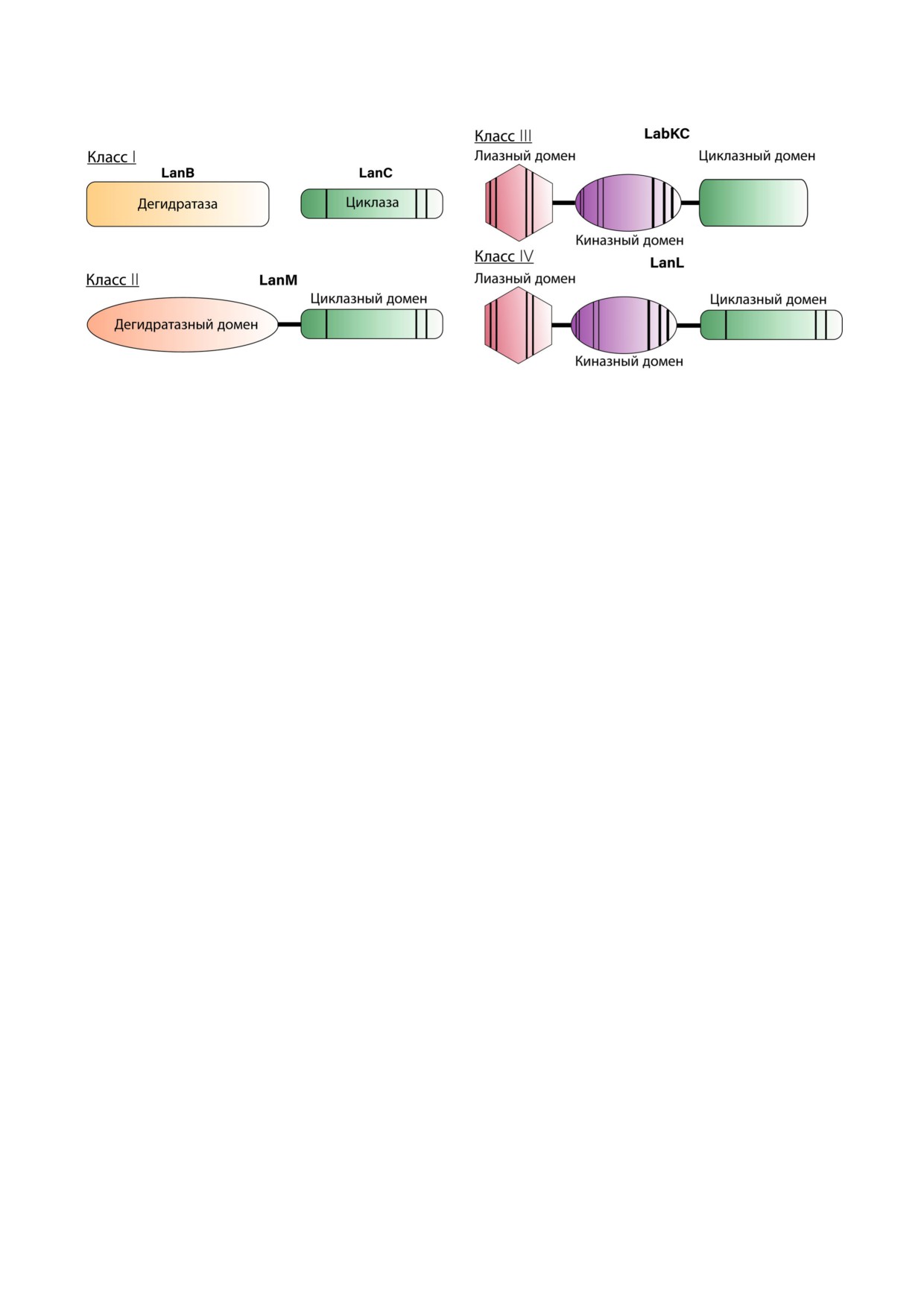
Класс I. К данному классу относятся ланти
сигнальных или регуляторных молекул [21, 22],
биотики, для которых основные модификации
однако наибольший интерес среди них вызыва
вносят два отдельных фермента: LanB, который
ют так называемые лантибиотики - лантипеп
осуществляет дегидратацию, и LanC, обеспечи
тиды, обладающие антимикробной актив
вающий циклизацию и образование остатков
ностью.
лантионина и метиллантионина. Также в клас
Гены, кодирующие ферменты биосинтеза
тер биосинтеза входят специфические протеа
лантипептидов, часто идентифицируют в виде
зы, АВС транспортеры, ферменты, вносящие
кластеров на хромосомах, мобильных элементах
дополнительные модификации, регуляторные
или плазмидах грамположительных бактерий.
элементы и белки, обеспечивающие собствен
Согласно принятым обозначениям [23], ген, ко
ный иммунитет продуцента к лантибиотику. Ге
дирующий структурный пептид, обозначается
номные исследования показали, что гены клас
препептид
Рис. 1. а - Структура дегидратированных аминокислотных остатков и тиоэфирных кросс сшивок, характерных для лан
типептидов. б - Общая схема биосинтеза лантипептидов; адаптировано из [20]; Dha - дегидроаланин, Dhb - дегидробу
тирин, Abu - альфа аминомасляная кислота. (С цветными вариантами рис. 1-8 можно ознакомиться в электронной вер
БИОХИМИЯ том 85 вып. 11 2020
СОЗДАНИЕ ИСКУССТВЕННОГО БИОРАЗНООБРАЗИЯ ЛАНТИБИОТИКОВ
1553
Рис. 2. Схематическое представление ферментов биосинтеза лантибиотиков. Вертикальные полосы обозначают консер
вативные участки, необходимые для каталитической активности, ширина полос схематически иллюстрирует относитель
ный размер консервативного участка
тера биосинтеза класса I лантибиотиков широко
мата с образованием дегидроаминокислоты
распространены среди бактерий, входящих в
(рис. 3, а).
разнообразные отделы [24].
Циклизация и формирование тиоэфирного
Также на основе сходства лидерной последо
кольца осуществляются ферментом LаnC. По
вательности препептида, которая узнается сис
своей структуре он является гомологом циклаз
темой модификации, лантипептиды данного
ного домена мультифункциональных фермен
класса подразделяются на подгруппы: низин
тов LanM [28] и LanL [29] лантибиотиков клас
подобные, эпидермин подобные и Pep5 подоб
сов II и IV соответственно. Сходство обусловле
ные лантипептиды.
но наличием у этих групп ферментов цинк свя
Отличительной особенностью класса I лан
зывающего домена, что может говорить о схо
тибиотиков является механизм дегидратации
жих механизмах циклизации.
структурного пептида. Его исследования в ос
Транспорт зрелого пептида осуществляется
новном были сконцентрированы на примере
посредством специфических транспортеров
низина, как наиболее изученного и значимого
LanT. Мембранная ассоциация, а также наличие
представителя класса. Однако, несмотря на ус
двух АТФ связывающих Уокер мотивов говорит
пехи в получении гетерологической системы
об их принадлежности к семейству АВС транс
биосинтеза низина [25], долгое время исследо
портеров [30]. В процессе транспорта LanT рас
вателям не удавалось реконструировать этот
познают лидерную последовательность, в то
процесс in vitro. Первые положительные резуль
время как структурный пептид может отличать
таты были продемонстрированы в работе Garg et
ся от природного [31]. Подобная лабильность
al. [26], в которой добавление в реакционную
позволяет использовать машинерию биосинтеза
смесь АТФ, MgCl2 и клеточного лизата из
лантибиотиков для создания разнообразных био
Escherichia coli к NisB приводило к полноценной
логически активных соединений с улучшенны
дегидратации препептида NisA. При анализе
ми свойствами in vivo. Процессинг лидерного
мутантных форм фермента было обнаружено
пептида осуществляется субтилизин подобной
образование глутаминированного промежуточ
сериновой протеазой LanP. Она может быть зая
ного соединения, которое было способно прев
корена на мембране или локализована в цито
ращаться в дегидратированный пептид без до
плазме. Однако не для всех протеаз до конца ус
бавления вспомогательных компонентов. Окон
тановлено, в какой момент происходит процес
чательный механизм дегидратации, осущест
синг лидерной последовательности - до или
вляемый NisB, был раскрыт после определения
после транспорта соответствующим LanT. Так,
роли источника остатков глутамата - глутамил
для NisP показана внеклеточная локализация, а
тРНК [27]. Таким образом, LanB активирует
протеолиз лидерной последовательности проис
гидроксил на боковой группе Ser/Thr через при
ходит уже после секреции препептида. Для эф
соединение остатка глутамата от глутамил
фективного узнавания субстрата и последующе
тРНК. Затем происходит направленная диссо
го протеолиза необходимо наличие хотя бы од
циация α протона активированной аминокис
ного лантионина в структурной части препепти
лоты, приводящая к β элиминированию глута
да [32].
БИОХИМИЯ том 85 вып. 11 2020
1554
ПИПИЯ и др.
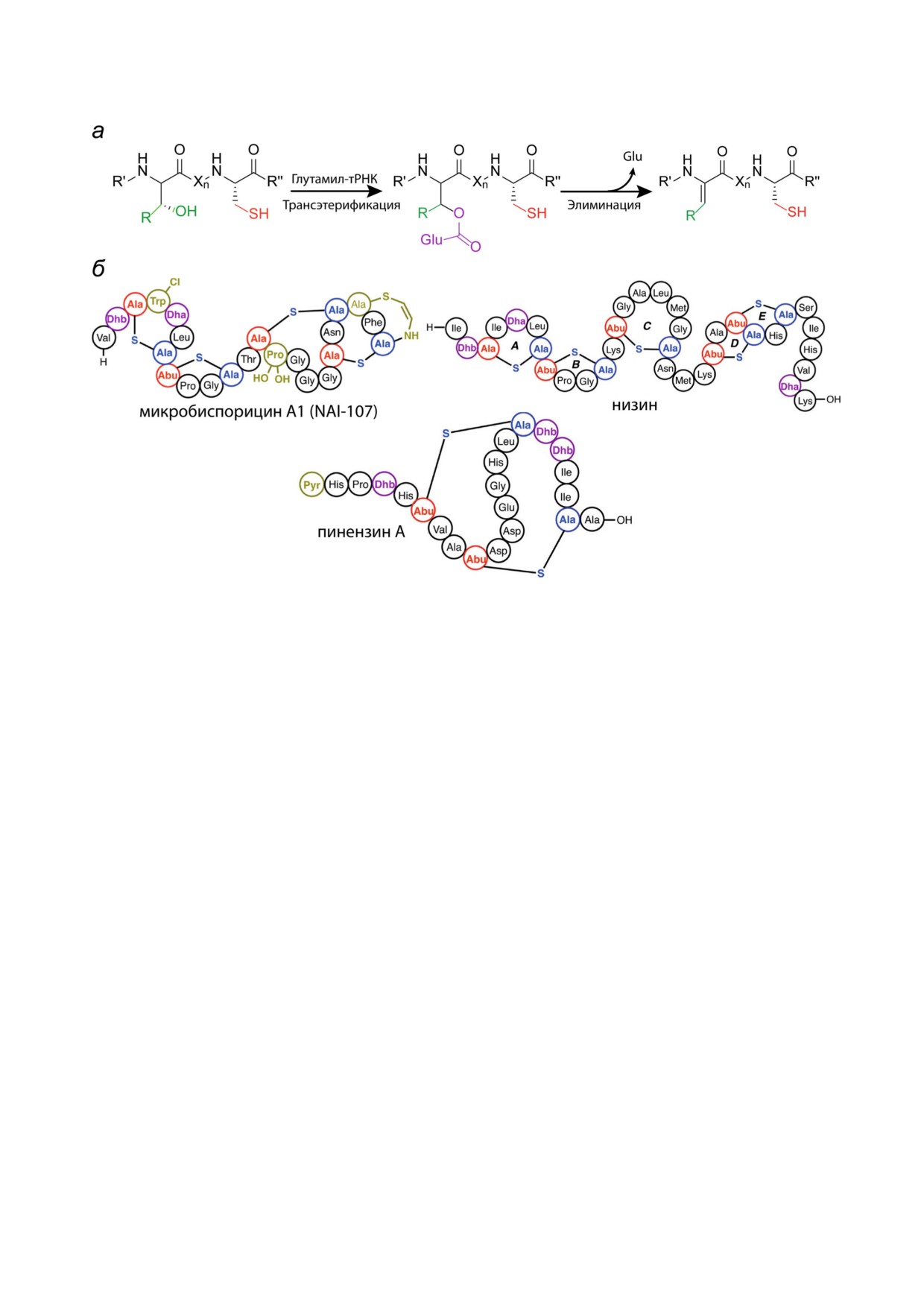
Рис. 3. а - Схема дегидратации лантибиотиков класса I ферментом LanB; б - структуры некоторых лантибиотиков клас
са I с различными посттрансляционными модификациями. Lac - лактат, Dha - дегидроаланин, Dhb - дегидробутирин,
Pyr - 2 оксопропионил, Abu - альфа аминомасляная кислота, R′, R′′ - участки полипептидной цепи лантипептида, Xn -
участок полипептидной цепи, состоящий из n кол ва остатков аминокислот, где n - число от 1 до 20; адаптировано из [20]
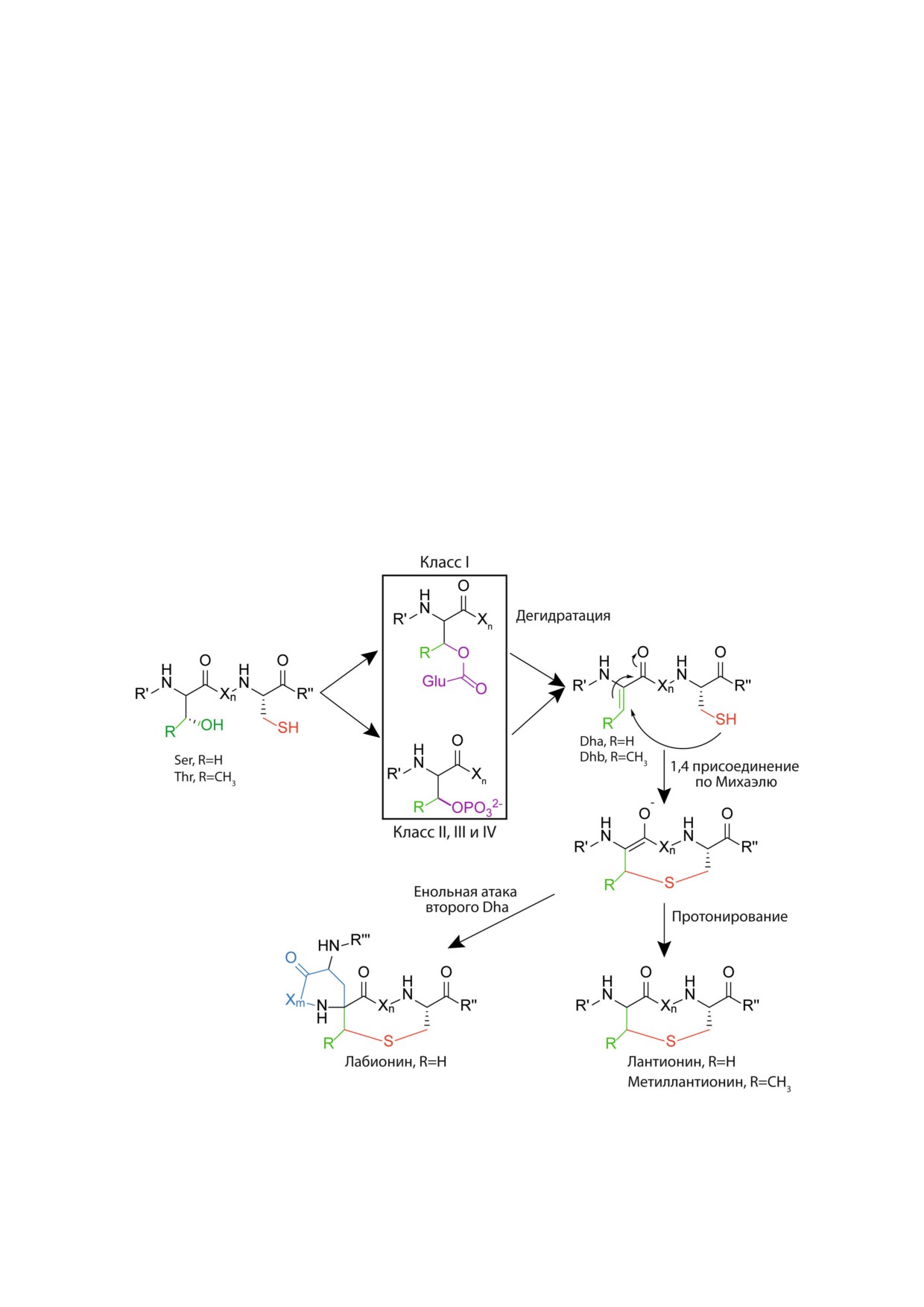
Помимо основных модификаций, среди
ственный за дегидратацию препептида. C кон
представителей данного класса лантипептидов
цевой домен гомологичен циклазе LanC ланти
распространено наличие лактата на N конце
биотиков класса I и имеет цинк связывающий
полипептидной цепи [33] или ацетилирования
домен. Исследования активности фермента
[34], а также образования аминовинил цистеина
in vitro показали, что для осуществления дегид
(AviCys) на С конце [35] (рис. 3, б). Самым изве
ратации необходимо присутствие АТФ и ионов
стным представителем лантибиотиков класса I
Mg2+, а использование аналогов природного
является низин, который более 50 лет успешно
субстрата приводило к образованию промежу
используется в качестве консерванта в пищевой
точного соединения, фосфорилированного по
промышленности [36]. Лантибиотик микробис
остаткам Ser/Thr [40]. Таким образом, у ланти
порицин А1, также известный как NAI 107, об
биотиков класса II, а также III и IV, описанных
ладает ярко выраженной активностью по отно
далее, дегидратация остатков Ser и Thr происхо
шению к клинически значимым патогенам, та
дит через стадию фосфорилирования, в то время
ким как S. aureus MRSA, Clostridium difficile. NAI
как для лантибиотиков класса I процесс идет че
107 проходит стадии предклинических исследо
рез глутаминированные производные (рис. 4).
ваний для лечения инфекций, вызванных муль
Для N концевого домена LanM была обнаруже
тирезистентными бактериями [37, 38]. Особен
на структурная гомология по отношению к эу
ностью данного лантибиотика является наличие
кариотическим липидкиназам, например фос
галогенированного остатка Trp и моно или ди
фоинозитид 3 киназе (PI3K) [41], при этом
гидроксилирование остатка Pro, которые необ
последовательности этих ферментов имеют низ
ходимы для обеспечения антимикробной актив
кую идентичность.
ности [39].
Дегидратация и циклизация осуществляют
Класс II. В этот класс входят лантибиотики,
ся ферментами LanM независимо, что подтверж
дегидратацию и циклизацию которых выполня
дается экспериментами с индивидуальной
ет мультифункциональный фермент LanM. На
экспрессией каждого домена [42, 43]. Важным
N конце фермента расположен домен, ответ
свойством лантипептидсинтетаз является стро
БИОХИМИЯ том 85 вып. 11 2020
СОЗДАНИЕ ИСКУССТВЕННОГО БИОРАЗНООБРАЗИЯ ЛАНТИБИОТИКОВ
1555
гая стереоселективность в образовании тио
ство ProcM подобных ферментов имеет самый
эфирных мостиков и региоселективность. Иск
широкий спектр субстратной специфичнос
лючительным случаем является фермент CylM,
ти [46].
модифицирующий двухкомпонентный ланти
В большинстве случаев транспорт осущест
биотик класса II, цитолизин, из Enterococcus
вляется специфическим АВС транспортером -
faecalis. Цитолизин состоит из двух пептидов:
LanT, который имеет также протеазный домен
цитолизин L и цитолизин S, которые содержат
[47]. В процессе транспорта препептида через
два варианта метиллантионина - в классичес
мембрану лидерная последовательность удаля
кой конфигурации DL, характерной для боль
ется, и во внеклеточную среду секретируется
шинства лантибиотиков, и более редкой - LL
уже активный лантибиотик. Протеолиз проис
[44]. Таким образом, CylM способен формиро
ходит в области Gly Gly мотива на С конце ли
вать тиоэфирные мостики разной конфигура
дера. Для осуществления транспорта LanT важ
ции внутри одного пептида. Лантипептидсин
на лидерная последовательность пептида, в то
тетаза ProcM имеет широкий спектр субстрат
время как структурный пептид может отличать
ной специфичности. Анализ кластера биосин
ся от нативного [48]. Однако в случае с прохло
теза прохлорозинов, к которому принадлежит
розинами и лихнецидином транспортер также
ProcM, показал наличие 30 пептидов с разной
толерантен и к лидерному пептиду, что подтве
аминокислотной последовательностью. Не
рждают найденные отличия в лидерной после
смотря на большое количество вариантов
довательности среди лантибиотиков одного
субстратов, ProcM модифицирует каждый пре
кластера. Для некоторых лантибиотиков класса
пептид в лантипептид со строго определенной
II обнаруживают отдельные протеазы, которые
морфологией [45]. На сегодняшний день семей
осуществляют протеолиз нескольких амино
Рис. 4. Схема формирования тиоэфирных аминокислот при биосинтезе лантипептидов разных классов. Dha - дегидро
аланин, Dhb - дегидробутирин, R′, R′′ - участки полипептидной цепи лантипептида, Xn, m - участок полипептидной це
пи, состоящий из n или m кол ва остатков аминокислот, где n и m - числа от 1 до 20
БИОХИМИЯ том 85 вып. 11 2020
1556
ПИПИЯ и др.
кислот с N конца структурного пептида уже
Класс III. Этот класс лантипептидов был
после процессинга лидерной последовательнос
выделен относительно недавно. Основные мо
ти [49].
дификации выполняет мультифункциональный
Лантибиотики класса II отличаются более
фермент LanKC [55]. В отличие от LanM,
глобулярной структурой по сравнению с клас
LanKC состоит из трех доменов: N концевого
сом I, также среди них выделяют уникальную
лиазного, центрального киназного и С конце
группу - двупептидные лантибиотики. Их ан
вого циклазного. Лиазный и киназный домены
тибиотическая активность обусловлена двой
осуществляют дегидратацию, а циклазный до
ственным механизмом связывания с липидом II
мен формирует тиоэфирные кольца. LanKC не
и формированием поры. Среди представителей
имеет цинк связывающего мотива, однако про
этой группы можно выделить лактицин 3147,
являет гомологию с другими циклазными доме
который активен против широкого спектра
нами [56]. Отличия наблюдаются и в структуре
грамположительных бактерий, в том числе ме
пептидов, поскольку среди некоторых предста
тицилин резистентного S. aureus, ванкомицин
вителей этого класса характерно формирование
резистентного E. faecalis, Propionibacterium acne
лабионина. Такие пептиды выделяют в группу
и Streptococcus mutans [50]. Другой двупептид
лабиринтопептинов. Образование дополни
ный лантибиотик - галодурацин - проявляет
тельной связи углерод-углерод в лабионине
большую активность по отношению к ванкоми
происходит при атаке дегидроаланином еноль
цин резистентному E. faecalis, чем низин, и об
ного промежуточного соединения, которое в
ладает большей стабильностью при физиологи
случае протонирования перешло бы в лантио
ческих условиях [51]. Традиционно в качестве
нин [57]. Реконструкция биосинтеза лабирин
источников новых лантибиотиков рассматри
топептинов in vitro показала, что процесс дегид
вались молочнокислые бактерии, однако благо
ратации происходит последовательно с C конца
даря развитию в области полногеномного сек
пептида к N концу, а лабионин формируется из
венирования и алгоритмов поиска новых клас
мотива Ser(Xxx)2Ser(Xxx)3Cys. Дегидратация
теров все больше активных лантибиотиков на
происходит через фосфорилированное произ
ходят и за пределами этой группы бактерий.
водное, как в случае с лантибиотиками класса
Кластер биосинтеза тицина А4 был обнаружен в
II. LanKC ферменты способны использовать в
бактерии Bacillus thuringiensis BMB3201 [52].
качестве субстрата разные нуклеозидтрифосфа
Данный лантибиотик проявлял сходную с ни
ты: LabKC при модификации лабиринтопепти
зином активность по отношению к широкому
на использует только ГТФ [58], а AviKC, синте
спектру грамположительных бактерий. Было
зирующий катенулипептин, способен использо
установлено, что тицин А4 сохранял антибио
вать в качестве субстрата АТФ, ТТФ, ГТФ и
тические свойства в диапазоне рН 2-9, а также
ЦТФ [59].
обладал умеренной устойчивостью к обработке
Долгое время было неизвестно, как именно
такими протеазами, как трипсин, папаин и α
происходит процессинг лидерной последова
амилаза.
тельности, поскольку внутри кластера биосин
Примером лантибиотика класса II, успеш
теза не было обнаружено специфической проте
ного с точки зрения медицинского примене
азы или транспортера с протеазным доменом. В
ния, является NVB302. Это полусинтетическое
процессе биосинтеза часто наблюдалось нали
производное дезоксиактагардина - лантибио
чие нескольких остатков от лидерной последо
тика из бактерии Actinoplanes garbadinensis. В
вательности на N конце структурного пептида,
2012 г. компания Novacta сообщила об успеш
поэтому основным предположением было нали
ном прохождении первой стадии клинических
чие эндопептидазы, которая процессирует ли
исследований NVB302 по лечению инфекций,
дер, и аминопептидазы, удаляющей оставшиеся
вызванных C. difficile. NVB302 имеет схожую с
аминокислоты. Открытие лантипептида NAI
ванкомицином эффективность против C. diffi/
122 и изучение его биосинтетического кластера
cile, его преимуществом является более быстрое
показало наличие специфической протеазы
восстановление популяции бактерий Bacteroides
AplP с двойственной функцией [60]. Это цинк
fragilis после окончания терапии [53]. B. fragilis
зависимая бифункциональная протеаза с эндо
являются частью нормальной микробиоты ки
и аминопептидазной активностью. Вначале
шечника. Предполагается, что менее жёсткое
AplP, как эндопептидаза, отрезает лидерную
влияние антибиотика на эту группу бактерий
последовательность по консервативному моти
при клостридиальных инфекциях ведёт к мень
ву EL Q, затем удаляет оставшиеся аминокис
шим флуктуациям в анаэробной кишечной
лоты, как аминопептидаза [61]. Дальнейший
микрофлоре и уменьшает риск возникновения
анализ показал наличие AplP подобных протеаз
рецидивов [54].
во всех геномах продуцентов лантипептидов
БИОХИМИЯ том 85 вып. 11 2020
СОЗДАНИЕ ИСКУССТВЕННОГО БИОРАЗНООБРАЗИЯ ЛАНТИБИОТИКОВ
1557
класса III, однако они находились за пределами
Streptomyces. Подобным образом был обнаружен
их кластера биосинтеза. In vitro была подтверж
другой лантипептид из этого семейства, проду
дена способность таких протеаз к формирова
цируемый Streptomyces collinus Tu 365, - стрепто
нию зрелых лантипептидов.
коллин [67]. На примере системы биосинтеза
Известные на сегодняшний день лантипеп
глобиспорицина было проведено исследование
тиды класса III не проявляют явных антимик
процессов дегидратации и циклизации фермен
робных свойств, поэтому к ним не применяется
том LanL [68]. Было установлено, что фермент
термин лантибиотики. Считается, что они вы
SgbL узнает α спиральный участок лидерного
полняют регуляторные функции в качестве сиг
пептида, расположенный в его N концевой час
нальных молекул. Для SapT показана способ
ти, при этом распознавание происходит в ки
ность стимулирования формирования воздуш
назной части SgbL, но не в лиазной. Процесс де
ных гиф у стрептомицетов [62]. Потенциальное
гидратации происходит последовательно с N
применение лантипептидов не ограничено на
конца к C концу структурного пептида через
личием антибиотической активности. Исследо
фосфорилированное производное.
вания на мышиной модели боли показали анти
Специфической протеазы для процессинга
ноцицептивное действие лантипептида NAI 122
лидерной последовательности лантипептидов
из Actinoplanes DSM 24059 [63]. Системное вве
класса IV на настоящий момент не обнаружено.
дение 1-10 мкг/кг NAI 122 приводило к дозоза
Предполагается, что созревание лантипептида
висимому снижению проявления болевого по
происходит при участии собственных эндопеп
ведения, вызванного формалином у мышей.
тидаз и аминопептидаз продуцента.
Также лантипептид проявлял активность в экс
В настоящее время биологическая функция
периментах по купированию хронической боли.
лантипептидов класса IV остаётся неизвестной.
Для некоторых лантипептидов было показано
Для стрептоколлина была обнаружена умерен
наличие противовирусных свойств. Лабиринто
ная ингибирующая активность по отношению к
пептин А1 проявлял значительную активность
протеинтирозинфосфатазе 1В (PTP1B) - 33%
против вируса иммунодефицита человека
ингибирования при концентрации стрептокол
(ВИЧ) и вируса герпеса на клеточных моделях
лина 50 мкМ [67].
[64]. Синергическое действие с клинически
одобренными антиретровирусными препарата
ми и низкая токсичность по отношению к ваги
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
нальным штаммам Lactobacillus показывают его
ЛАНТИБИОТИКОВ
потенциал в области лечения заболеваний, пе
редающихся половым путем.
Впервые антимикробный эффект лантибио
Класс IV. Это одна из наименее изученных
тиков был обнаружен в 1927 г. при изучении ин
групп лантипептидов, известных на сегодняш
гибирующего влияния Lactococcus lactis на рост
ний день. Первая охарактеризованная система
Lactobacillus bulgaricus [69], и в 1947 г. Mattick et al.
биосинтеза лантипептида класса IV была обна
[70] выделили из культивационной среды L. lac/
ружена в Streptomyces venezuelae после геномного
tis лантибиотик низин. Сейчас он широко ис
скрининга на поиск белков гомологичных
пользуется в пищевой промышленности многих
LanC. Пептид получил название венецуелин, а
стран в качестве консерванта (пищевая добавка
его синтетаза - VenL [65]. Лантипептидсинтета
Е243). Низин является наиболее исследован
зы класса IV LanL - это мультифункциональные
ным представителем лантибиотиков с широко
ферменты, состоящие из трех доменов: лиазный
изученным спектром антимикробной активнос
и киназный домены гомологичны таковым у
ти, механизмом действия и биосинтеза.
LanKC, а циклазный - LanM, поскольку имеет
Липид II является основной мишенью для
характерный цинк связывающий мотив. Нес
многих лантибиотиков на поверхности грампо
мотря на наличие всех компонентов кластера
ложительных бактерий. Эта молекула играет
биосинтеза венецуелина, его продукция не была
важнейшую роль в формировании клеточной
детектирована у штамма дикого типа. Определе
стенки бактерий. Она играет роль переносчика
ние структуры и свойств пептида и фермента
пептидогликанов клеточной стенки бактерий с
LanL проводилось in vitro. В ходе филогенети
внутренней стороны мембраны, где они образу
ческого анализа актинобактерий на наличие
ются, на наружную, где созревает клеточная
LanC подобных белков были выделены семей
стенка. Поскольку количество молекул липида
ства лантипептид подобных генетических клас
II в мембране бактерий ограничено [71], его свя
теров [66]. В частности, это позволило обнару
зывание с молекулами лантибиотика блокирует
жить несколько венецуелин подобных пепти
синтез клеточной стенки, что в дальнейшем при
дов, распространённых среди бактерий рода
водит к гибели клетки. Важной особенностью
БИОХИМИЯ том 85 вып. 11 2020
1558
ПИПИЯ и др.
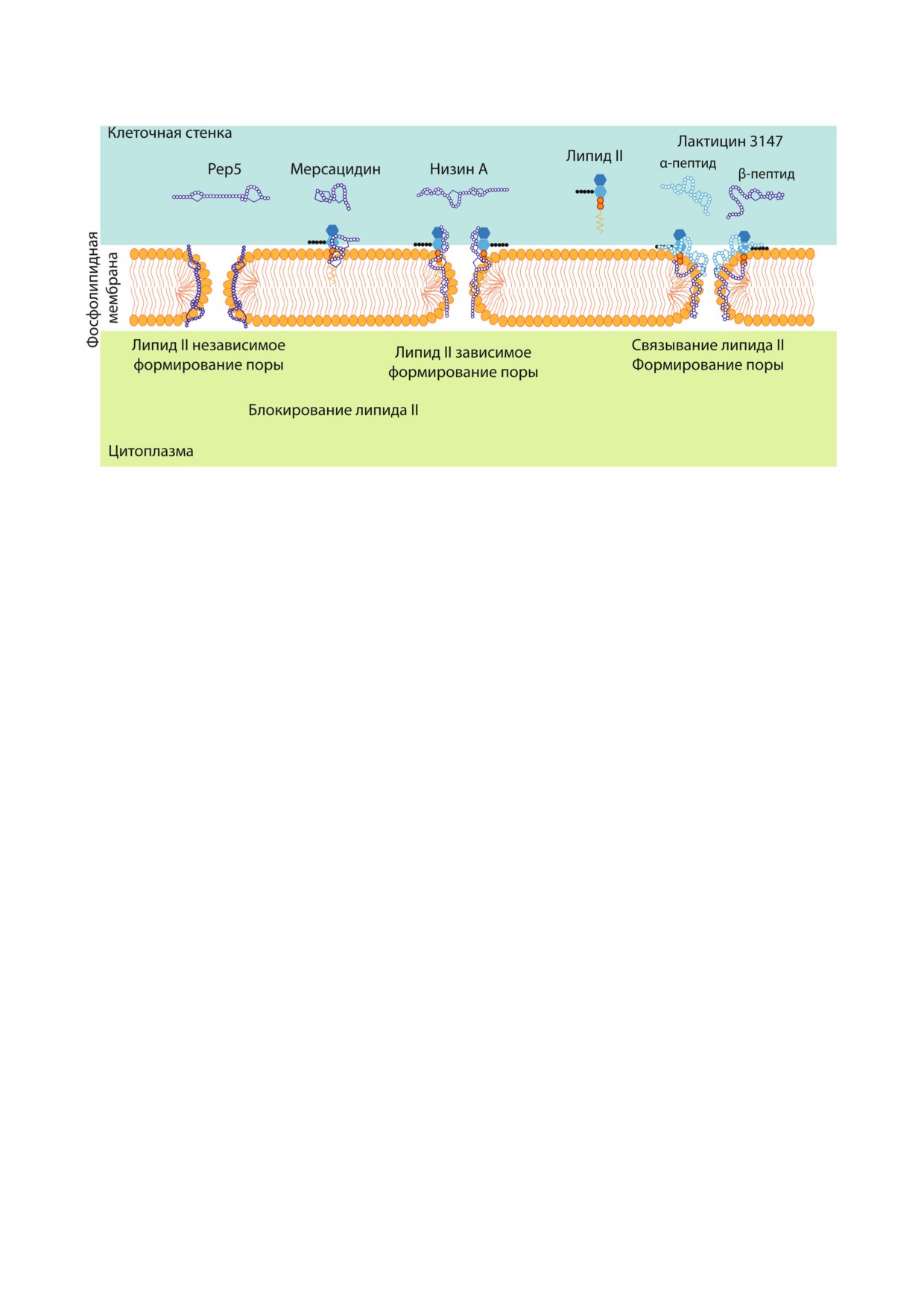
липида II является его консервативность среди
формировать поры в плазматической мембране
прокариот, поэтому антибиотики, связывающие
(рис. 6), что также приводит к гибели бактери
липид II, обладают широким спектром актив
альной клетки [74]. Образование поры в боль
ности и оставляют перспективную область ис
шинстве случаев является липид II зависимым,
следований для поиска новых антибиотиков
поскольку именно так лантибиотик связывается
[72]. Эта молекула является уникальной для про
с мембраной бактерии. В случае низина два
кариот, что делает подобные антимикробные
кольца в N концевой части формируют пиро
агенты потенциально безопасными для эукарио
фосфат связывающий карман, который связы
тических клеток. В группу антибиотиков, связы
вает ундекапренилпирофосфатную часть липи
вающих липид II, входит ванкомицин - трицик
да II, а C конец принимает участие в образова
лический гликопептид, использующийся в ме
нии поры [75]. В исследовании Hasper et al. [76]
дицине при лечении серьёзных инфекционных
было показано, что в образовании поры участ
заболеваний, в том числе вызванных мультире
вуют 8 молекул низина и 4 молекулы липида II,
зистентными бактериями, и является одним из
которые обеспечивают связывание лантибиоти
«антибиотиков последнего резерва». Однако в
ка с мембраной.
последнее время растёт количество штаммов па
Обособленно находится группа циннами
тогенных бактерий резистентных к ванкомици
цин подобных лантибиотиков, в которую так
ну. В этой связи лантибиотики могут перенять
же входит дурамицин и анковерин. Помимо
эстафету, поскольку связываются с другим участ
глобулярной структуры и наличия остатка не
ком на молекуле липида II (рис. 5) и могут инги
канонической аминокислоты - лизиноалани
бировать рост бактерий, резистентных к извест
на, они отличаются мишенью, с которой связы
ным антибиотикам. В экспериментах in vitro бы
ваются на клеточной мембране, а именно -
ло показано, что лантибиотик микробиспори
фосфатидилэтаноламином [77]. Фосфатидил
цин способен останавливать рост штамма E. fae/
этаноламин (PE) - важный представитель фос
calis, резистентного к ванкомицину с минималь
фолипидов, одной из функций которого явля
ной ингибирующей концентрацией 0,5 мкг/мл
ется распределение отрицательного заряда на
[39], низин - 4 мкг/мл [39], двупептидный лан
мембране, он также играет роль предшествен
тибиотик лактицин 3147 - 1,9 мкг/мл [73].
ника для синтеза других фосфолипидов, прини
Помимо ингибирования биосинтеза клеточ
мает участие в сигнальных каскадах [78] и при
ной стенки, некоторые лантибиотики способны
даёт особые физико химические свойства плаз
матической мембране, необходимые для функ
ционирования мембранных белков [79]. В эука
риотических клетках РЕ в основном представ
лен на внутренней поверхности плазматичес
кой мембраны. Для большинства бактерий РЕ
является главным цвиттерионным фосфолипи
дом. При этом у грамотрицательных бактерий
содержание РЕ в мембране выше, чем у грампо
ложительных бактерий [80]. Высокая селектив
ность циннамицин подобных лантибиотиков
по отношению к РЕ обеспечивается за счёт
формирования сети водородных связей с фос
фатами липидов. В отличие от более объёмной
холиновой группы фосфатидилхолина, компакт
ная структура амммоний связывающего доме
на циннамицин подобных лантибиотиков
комплементарна небольшой группе PE [81].
Точный механизм антимикробного действия
этой группы лантибиотиков до сих пор неизвес
тен, однако предполагается, что связывание
циннамицина с фосфатидилэтаноламином
приводит к увеличению проницаемости клеточ
ной мембраны, что и приводит к гибели клетки
[82]. Для дурамицина было показано изменение
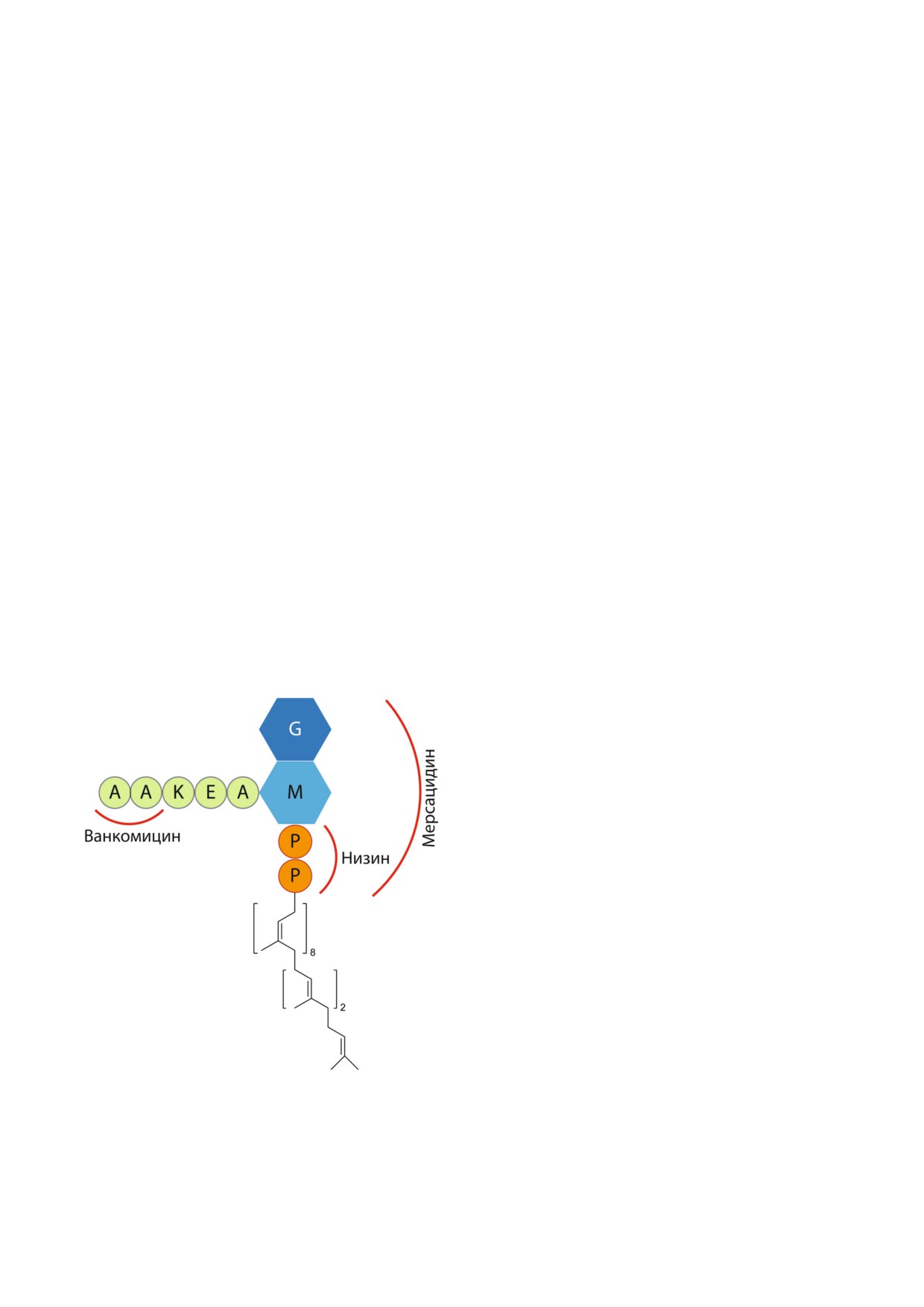
Рис. 5. Схема cтроения липида II; G - N ацетилглюкоза
морфологии и нарушение целостности клеток у
мин, M - N ацетилмурамовая кислота, P - фосфатная
группа; красными линиями отмечены области связывания
чувствительных штаммов Bacillus BC15 и
ванкомицина, низина и мерсацидина
Bacillus subtilis 168 [83]. Было установлено, что
БИОХИМИЯ том 85 вып. 11 2020
СОЗДАНИЕ ИСКУССТВЕННОГО БИОРАЗНООБРАЗИЯ ЛАНТИБИОТИКОВ
1559
Рис. 6. Схематическое представление разных механизмов антимикробного действия лантибиотиков на грамположитель
ные бактерии
чувствительные штаммы бактерий развивали
БИОИНЖЕНЕРИЯ ЛАНТИБИОТИКОВ
резистентность и к более высоким его концент
И НАПРАВЛЕННАЯ ЭВОЛЮЦИЯ
рациям после инкубации с низкой концентра
АНТИБИОТИЧЕСКОЙ АКТИВНОСТИ
цией лантибиотика. Анализ состава бактери
альных мембран до и после появления резистент
Лантибиотики обладают высоким потенциа
ности показал, что бактерии с приобретённой
лом в области создания новых противомикроб
устойчивостью имели пониженное содержание
ных препаратов. Традиционная стратегия в по
фосфатидилэтаноламина. Таким образом, чув
иске антибиотиков заключается в выделении
ствительность микроорганизмов к лантибиоти
природного штамма продуцента из разных ис
кам из семейства циннамицинов явно коррели
точников и анализе антимикробных свойств его
рует с фосфолипидным составом бактериаль
метаболитов. Такой подход имеет ограничения,
ных мембран, что ограничивает их применение
поскольку подходит только для культивируемых
в качестве антибиотиков широкого спектра.
бактерий. Благодаря развитию технологий пол
Тем не менее селективность по отношению к
ногеномного секвенирования и геномного май
РЕ находит потенциальное применение в меди
нинга появляется возможность открывать но
цине. Дурамицин проходит вторую фазу клини
вые ранее не выделенные из природных источ
ческих испытаний в качестве лекарства для ле
ников лантибиотики, в том числе и среди пред
чения муковисцидоза [84]. Связывание дурами
ставителей некультивируемых микроорганиз
цина с РЕ на поверхности эпителиальных кле
мов. Для изучения обнаруживаемых биосинте
ток лёгких стимулирует секрецию хлорид ио
тических кластеров лантибиотиков используют
нов, что, в свою очередь, влечёт секрецию воды
различные подходы синтетической биологии от
и стимулирует очищение лёгких от слизи. Цин
бесклеточных систем до гетерологической про
намицин подобные лантибиотики также нахо
дукции.
дят применение в биоимиджинге. Фосфатиди
Бесклеточные системы практически не огра
лэтаноламин становится широко представлен
ничены в размерах комбинаторной библиотеки,
ным на поверхности клетки при апоптозе [85], а
поскольку нет необходимости в трансформации
также при делении эукариотической клетки
клеток продуцента - стадии, лимитирующей
[86], что позволяет использовать его в качестве
данный параметр в клеточных системах биосин
молекулярного маркера при изучении клеточ
теза. In vitro система синтеза библиотеки ланти
ных процессов. Для детекции РЕ на поверхнос
пептидов была разработана на основе мРНК
ти клеток используют биотинилированные или
дисплея [88]. Основой для пептидного синтеза
радиоактивно меченные дурамицин и цинна
являлась in vitro транскрибированная мРНК.
мицин [87].
Для соединения мРНК с транслируемым пепти
БИОХИМИЯ том 85 вып. 11 2020
1560
ПИПИЯ и др.
дом использовался олигонуклеотид, несущий
[91]. Основываясь на подобной модульной сис
пуромицин на 3′ конце открытой рамки считы
теме, была создана библиотека искусственных
вания. Данный олигонуклеотид присоединялся
лантипептидов, которые состояли из комбина
к 3′ концу мРНК посредством фотоиндуцируе
ции модулей 12 известных лантибиотиков. Со
мой кросс сшивки за счёт наличия на его 5′
ответствующие генетические конструкции были
конце псоралена. Аминокислота лизин была за
использованы для трансформации бактерии
менена на 4 селенолизин, который при обра
продуцента L. lactis, имеющей в своём геноме
ботке перекисью водорода трансформировался
кластер биосинтеза низина, осуществляющего
в дегидроаланин. После иммобилизации пре
посттрансляционные модификации и транс
пептида на колонке и соответствующей смены
порт зрелого лантипептида во внеклеточную
буферов происходило формирование лантиони
среду. Для быстрого тестирования биологичес
нов. Таким образом, была получена полностью
кой активности бактерии продуценты помеща
искусственная бесферментативная система для
лись в альгинатные шарики вместе с индикатор
создания более чем 1011 вариантов лантипепти
ным штаммом бактерии и специфической про
дов. С её помощью были выделены молекулы с
теазой, процессирующей лидерный пептид для
высокой специфичностью к сортазе А - фер
высвобождения активного лантибиотика. После
менту, ответственному за вирулентность
инкубации и окрашивания флуоресцентным
S. aureus.
красителем шарики сортировались с помощью
Использование гетерологических систем
проточной цитофлуориметрии. Химерные мо
экспрессии позволяет нарабатывать их в коли
лекулы, состоящие из модулей галлидермина и
чествах, достаточных для проведения полноцен
низина, показали улучшенную активность по
ных исследований их структуры и функций. Ге
отношению к Streptococcus pneumoniae в сравне
терологические системы экспрессии кластеров
нии с природными лантибиотиками. Подобная
лантибиотиков находят применение в широко
технология имеет перспективы для тестирова
масштабном скрининге библиотек мутантных
ния активности потенциальных пептидных пре
вариантов лантибиотиков и поиске более актив
паратов in vivo, поиска соединений с новыми
ных и стабильных соединений.
спектрами биологической активности.
L. lactis - представитель молочнокислых
E. coli является самым распространенным
бактерий, который часто используется для гете
микроорганизмом для гетерологической экс
рологической экспрессии белков. На основе его
прессии белков и пептидов, в том числе и анти
кластера биосинтеза низина была создана сис
микробной природы [92]. Преимуществами её
тема экспрессии NICE (NIsin Controlled
использования в работе являются простота, лёг
Expression system) [89]. Продукция низина в
кость проведения генетических манипуляций,
L. lactis и других низин продуцирующих бакте
доступность различных вариантов экспрессии:
риях является автоиндуцируемой. При появле
от добавления меток для увеличения раствори
нии в среде низина мембранно ассоциирован
мости и упрощения очистки рекомбинантного
ная киназа NisK автофосфорилируется, затем
белка до направления продукции в периплазма
фосфорилирует внутриклеточный регулятор
тическое пространство [93]. Несколько систем
ный белок NisR, который связывается с промо
биосинтеза лантибиотиков были успешно реко
тором nisA и запускает экспрессию генов, стоя
нструированы с использованием E. coli в качест
щих за ним. Таким образом, обеспечивается ре
ве продуцента [25]. Прохлорозины, синтезиро
гулируемая гиперэкспрессия необходимого ре
ванные в E. coli, имели значительно больший
комбинантного лантибиотика. Кластер биосин
выход по сравнению с природным продуцентом
теза лантибиотика класса II нукацина ISK 1 был
Prochlorococcus MIT 9313, при этом являлись
исследован с помощью NICE системы [90]. Дан
полностью модифицированными.
ный подход позволил снизить уровень протео
После разработки гетерологических систем
литической деградации лантибиотика, которая
экспрессии следует этап их применения для по
наблюдалась у природного продуцента, а также
иска новых улучшенных вариантов лантибиоти
определить минимальный набор генов, необхо
ков. Лидерная последовательность ингибирует
димых для продукции активного лантибиотика.
антимикробные свойства полностью модифи
Многочисленные структурно функциональ
цированного лантибиотика. Поэтому после на
ные исследования лантибиотиков показали на
работки и очистки препептида используют ком
личие характерных мотивов и определенной то
мерчески доступные протеазы, процессирую
пологии колец, обеспечивающих присущий им
щие полипептид. Необходимость очистки, а
механизм действия, например пирофосфат свя
также последующей обработки протеазами ус
зывающая полость у низин подобных лантибио
ложняет процесс анализа активности лантибио
тиков [75] или мотив, связывающий липид II
тиков, особенно при скрининге большого коли
БИОХИМИЯ том 85 вып. 11 2020
СОЗДАНИЕ ИСКУССТВЕННОГО БИОРАЗНООБРАЗИЯ ЛАНТИБИОТИКОВ
1561
Структурный пептид
Препептид
Рис. 7. Схематическое изображение системы для продукции зрелых лантибиотиков класса II в E. coli; а - периплазмати
ческая компартментализация протеазы; б - температурная индукция экспрессии автолитических белков; в - процессинг
лидерного пептида после автолиза; г - структурно функциональный скрининг вариантов лантипептидов на колониях с
помощью метода диффузии в агаре и matrix assisted laser desorption ionization time of flight mass spectrometry (MALDI ToF
MS) анализа; адаптировано из [94]
чества вариантов. Для решения данной пробле
вать методы направленного или случайного му
мы была предложена система, позволяющая
тагенеза для создания лантибиотиков с улуч
процессировать лидерный пептид внутри коло
шенными свойствами, а также для понимания
ний E. coli для быстрого скрининга лантибиоти
их структурно функциональных особенностей.
ческой активности [94]. Лантипептид синтези
Мутации R13A и K2A/R13A лантибиотика мута
ровался внутриклеточно, в то время как продук
цин 1140 приводили к увеличению устойчивос
ция специфической лантипептидпротеазы LicP
ти к протеолизу трипсином [95]. Замена остатка
была направлена в периплазматическое прост
Met21 на Val в молекуле низина приводила к
ранство (рис. 7). После индуцированного темпе
увеличению активности по отношению к Listeria
ратурой автолиза клеток протеаза и препептид
monocytogenes, а мутант N20P был более активен
высвобождались из клеток, затем происходил
против S. aureus [96].
процессинг активного лантибиотика, который
Лантибиотики в основном действуют на
детектировали по образованию зон ингибирова
грамположительные бактерии, поскольку грам
ния роста. Успешное применение такой систе
отрицательные бактерии защищены от их
мы было продемонстрировано на примерах дву
действия внешней оболочкой. Для расширения
пептидного лантибиотика галодурацина и лан
спектра действия лантибиотиков принимаются
тибиотика лактицина 481.
различные попытки по созданию химерных мо
Благодаря генетически кодируемой природе
лекул, способных преодолевать внешнюю мем
лантибиотиков возможно легко вносить изме
брану и атаковать грамотрицательные бактерии.
нения в их структуру. Это позволяет использо
Было предложено использовать конъюгаты
4 БИОХИМИЯ том 85 вып. 11 2020
1562
ПИПИЯ и др.
лантибиотика галлидермина с молекулами си
Наличие макроциклов в структуре лантибио
дерофоров [97]. Предполагалось, что наличие
тиков делают их удобными мишенями для раз
специфических рецепторов к сидерофорам на
работки ингибиторов белок белковых взаимо
внешней мембране помогут конъюгату преодо
действий, поскольку они могут выступать в ро
леть внешний барьер и сделать внутреннюю
ли структурных аналогов природным лигандам.
мембрану доступной для лантибиотика. Одна
В сравнении с синтетическими методами синте
ко, несмотря на сохранившуюся активность по
за генетически кодируемая природа лантибио
отношению к индикаторной грамположитель
тиков позволяет создавать огромные библиоте
ной бактерии Lactococcus lactis subsp. cremoris
ки вариантов и совмещать пептидный синтез со
HP, грамотрицательные бактерии оказались не
скринингом внутри клетки. Существует множе
восприимчивы к антимикробному действию
ство подходов к отбору соединений из библио
конъюгата. Альтернативно, короткие пептиды с
тек с необходимыми свойствами, одним из них
известной активностью против грамотрица
является обратный двугибридный анализ
тельных бактерий были соединены с С концом
(reverse two hybrid system (RTHS)). Данный ме
полноразмерного или укороченного низина
тод был использован для получения ингибитора
[98]. Несколько вариантов таких химерных мо
взаимодействия между белком р6 вируса имму
лекул ингибировали рост индикаторных штам
нодефицита человека с убиквитин связываю
мов. Для наиболее перспективных вариантов
щим доменом UEV (ubiquitin E2 variant) белка
был проведен рациональный дизайн. В резуль
человека TSG101 [99]. Такие ингибиторы имеют
тате было получено соединение в 4-12 раз бо
высокий терапевтический потенциал в противо
лее активное по отношению к ряду важных грам
вирусной терапии, поскольку нарушают про
отрицательных патогенов в сравнении с низи
цесс отпочковывания ВИЧ от заражённой клет
ном.
ки. В качестве основы для создания библиотеки
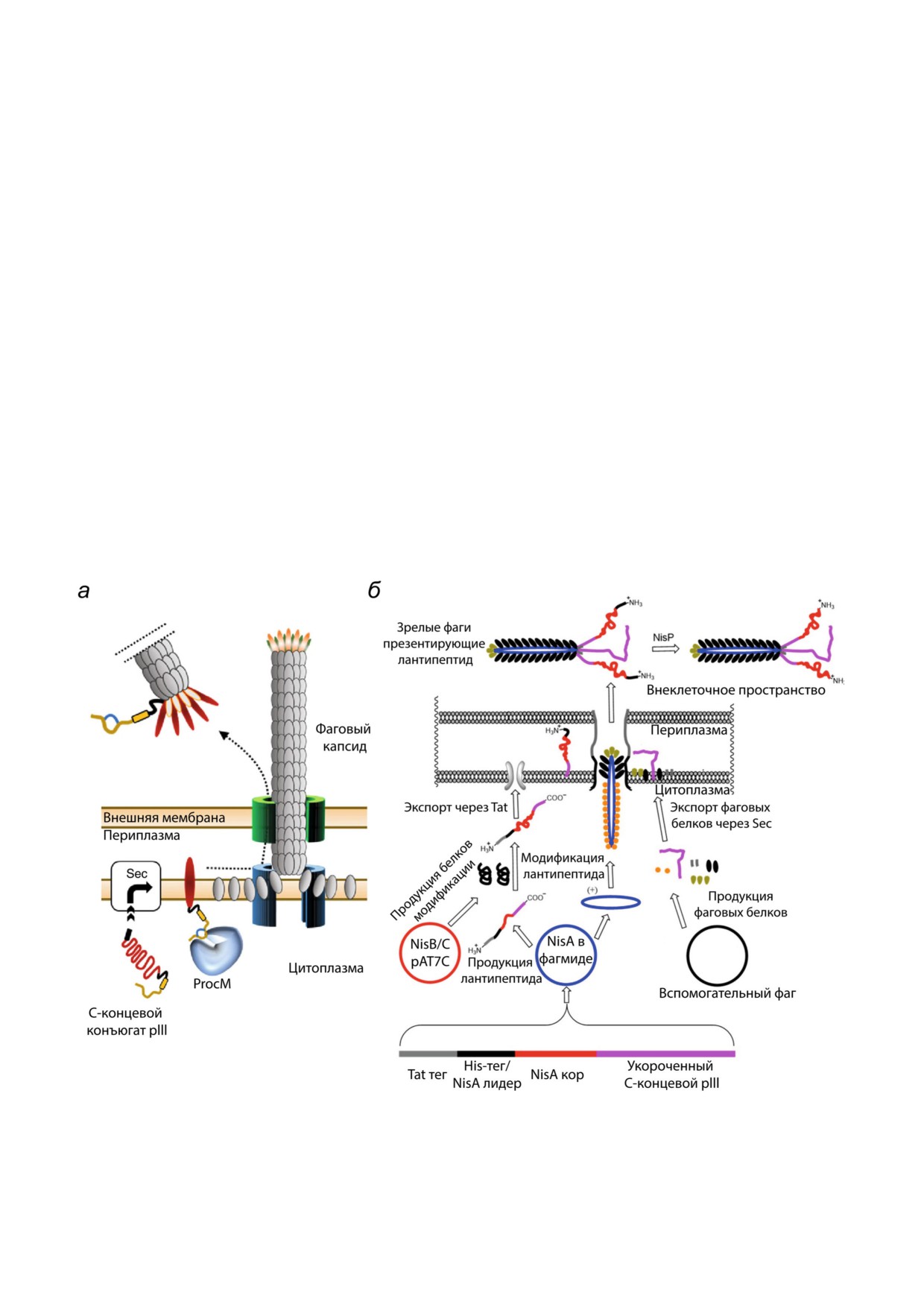
Рис. 8. Схема созревания фаговых частиц. а - С концевой дисплей лантипептидов, модифицированных ProcM; адапти
ровано из [101]; б - N концевой дисплей библиотеки лантипептидов на основе системы биосинтеза низина; адаптирова
но из [102]
БИОХИМИЯ том 85 вып. 11 2020
СОЗДАНИЕ ИСКУССТВЕННОГО БИОРАЗНООБРАЗИЯ ЛАНТИБИОТИКОВ
1563
макроциклов была использована последова
необходимых модификаций с помощью анализа
тельность лантипептида ProcA2.8, а формирова
биологической активности и масс спектромет
ние тиоэфирных связей осуществляла ланти
рии очищенного лантибиотика была создана
пептидсинтетаза ProcM, известная высокой то
библиотека аналогов лактицина 481. В ходе се
лерантностью к субстрату. Белки р6 и домен
лекции были получены пептиды, способные к
UEV продуцируются внутриклеточно в виде хи
связыванию с αvβ3 интегрином. Результаты ис
мерных молекул с функциональными репрессо
следования показывают универсальность при
рами. Их физическое взаимодействие приводит
менения лантипептидных кластеров биосинтеза
к ингибированию экспрессии репортерных ге
для поиска соединений с новыми биологичес
нов, обеспечивающих рост бактерии на селек
кими свойствами.
тивной среде. Таким образом, среди бактерий,
трансформированных библиотекой лантипеп
тидов, на селективной среде вырастут только те,
ВЫВОДЫ И ДАЛЬНЕЙШИЕ
чей вариант пептида ингибирует взаимодей
ПЕРСПЕКТИВЫ
ствие между р6 и доменом UEV. Результатом от
бора стал ингибитор XY3 3, который проявлял
В эпоху быстро распространяющейся резис
потенциальную противовирусную активность,
тентности к антибиотикам необходимо разраба
детектированную с использованием клеточной
тывать системы, позволяющие ускорить про
модели созревания вирусных частиц in vitro.
цесс идентификации новых антимикробных
Фаговый дисплей является мощным инстру
агентов. Для этого крайне важно находить но
ментом в in vitro селекции, широко используе
вые источники биологического разнообразия и
мый для скрининга пептидных лигандов к выб
создавать подходы для эффективного анализа
ранной мишени [100]. Эту технологию также
большого количества данных. Технологии нап
применяют для скрининга лантипептидных
равленной эволюции антибиотической актив
библиотек. Кластер биосинтеза прохлорозинов
ности позволяют создавать искусственное раз
с ProcM синтетазой был взят за основу для соз
нообразие антимикробных агентов и отбирать
дания C концевой библиотеки пептидов [101].
из этого разнообразия наиболее эффективные
Препептид соединяли с С концом pIII белка
варианты с точки зрения их практического при
капсида бактериофага М13. Все модификации
менения. Высокопроизводительный скрининг
проходили в цитоплазме. Фаговый дисплей мо
соединений, генерируемых биохимическими
дифицированных пептидов осуществлялся в ре
машинериями, представляет при этом особый
зультате включения конъюгата pIII в фаговую
интерес. Объединение этапов синтеза и провер
оболочку с последующей экструзией частицы
ки биологической активности в единой системе
фага в среду (рис. 8, а).
в перспективе позволят сократить количество
По результатам отбора были получены ли
стадий анализа молекул кандидатов, времени, а
ганды к стрептавидину и урокиназному актива
также экономических затрат.
тору плазминогена, что показывает потенциал
В настоящее время большое развитие полу
использования системы биосинтеза лантипеп
чили микрофлюидные технологии. В частности,
тидов совместно с технологией фагового дис
капельная микрофлюидика успешно применя
плея.
ется в различных биологических исследованиях.
Для дисплея библиотеки вариантов ланти
Основным преимуществом является возмож
биотика низина была разработана технология
ность локализации реакций в индивидуальных
N концевого фагового дисплея [102]. В отличие
каплях, что позволяет проводить сотни миллио
от предыдущей работы, секреция конъюгата в
нов реакций параллельно [103]. Это свойство ус
периплазму осуществлялась по Tat пути, кото
пешно применяется при разработке платформ
рый позволяет транслоцировать свернутые бел
полного цикла для ультра высокопроизводи
ки (рис. 8, б). Вектором отбора служила улуч
тельного скрининга и направленной эволюции
шенная стабильность производных низина при
полипептидов [104]. Инкапсуляция на уровне
более высоких значениях рН. Однако, несмотря
единичных клеток даёт возможность детально
на успешную селекцию нескольких вариантов и
изучать влияние множества факторов на физио
сохранение способности связывать липид II, ан
логическое состояние микроорганизмов [105],
тимикробная активность была утеряна. Также
проводить широкомасштабный скрининг анти
был представлен вариант дрожжевого дисплея, в
биотической активности среди представителей
котором лантибиотик лактицин 481 был соеди
разных микробиологических сообществ [106].
нён с белком клеточной стенки дрожжей. Моди
Лантибиотики, в свою очередь, имеют боль
фикации происходили в эндоплазматическом
шой потенциал в качестве универсальной матри
ретикулуме. После подтверждения наличия всех
цы для создания молекул с заданными биологи
БИОХИМИЯ том 85 вып. 11 2020
4*
1564
ПИПИЯ и др.
ческими функциями: от ингибиторов белок бел
дённой производительности скрининга, откры
ковых взаимодействий до терапевтических пре
вая уникальные возможности для анализа ланд
паратов и антибиотиков нового поколения. Объ
шафтов антимикробной активности генетически
единение биосинтетических машинерий, гене
кодируемых антибиотиков и создания высоко
рирующих множество вариантов лантибиоти
эффективных терапевтических агентов.
ков, с технологиями микрофлюидики позволит
проводить широкомасштабный поиск соедине
ний, активных по отношению к заданной мише
Финансирование. Исследования проведены
ни. Использование гетерологических систем
при финансовой поддержке Российского фонда
продукции лантибиотиков, а также адаптация
фундаментальных исследований (грант № 18
бесклеточных систем для генерации биологичес
29 08054) и Российского научного фонда (грант
ки активных лантибиотиков in vitro являются од
№ 17 74 30019).
ними из ключевых этапов дальнейшего развития
Конфликт интересов. Авторы заявляют об от
данной технологии. Объединение этапов био
сутствии конфликта интересов.
синтеза и тестирования биологической актив
Соблюдение этических норм. Настоящая
ности синтетического разнообразия рекомбинант
статья не содержит описания каких либо иссле
ных лантибиотиков в индивидуальных микро
дований с участием людей или животных в каче
компартментах позволит добиться непревзой стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Davies, J., and Davies, D. (2010) Origins and evolution of
Expert. Rev. Anti. Infect. Ther.,
12,
14771486,
antibiotic resistance, Microbiol. Mol. Biol. Rev., 74, 417
doi: 10.1586/14787210.2014.976613.
433, doi: 10.1128/mmbr.00016 10.
12.
Ortega, M. A., and van der Donk, W. A. (2016) New
2.
O’Neill, J. (2014) Antimicrobial Resistance: Tackling A
insights into the biosynthetic logic of ribosomally synthe
Crisis For The Health And Wealth Of Nations, Review on
sized and post translationally modified peptide natural
Antimicrobial Resistance, London.
products, Cell Chem. Biol., 23, 31 44, doi: 10.1016/j.chembiol.
3.
Czepiel, J., Drozdz, M., Pituch, H., Kuijper, E. J.,
2015.11.012.
Perucki, W., Mielimonka, A., Goldman, S., Wultanska, D.,
13.
McIntosh, J. A., Donia, M. S., and Schmidt, E. W. (2009)
Garlicki, A., and Biesiada, G. (2019) Clostridium difficile
Ribosomal peptide natural products: bridging the riboso
infection: review, Eur. J. Clin. Microbiol. Infect. Dis., 38,
mal and nonribosomal worlds, Nat. Prod. Rep., 26, 537
1211 1221, doi: 10.1007/s10096 019 03539 6.
559, doi: 10.1039/b714132g.
4.
Wang, J., Xiong, Z., Meng, H., Wang, Y., and Wang, Y.
14.
Muller, M. M. (2018) Post translational modifications of
(2012) Synthetic biology triggers new era of antibiotics
protein backbones: unique functions, mechanisms, and
development, Subcell Biochem., 64, 95 114, doi: 10.1007/
challenges, Biochemistry, 57, 177 185, doi: 10.1021/acs.
978 94 007 5055 5_5.
biochem.7b00861.
5.
Foulston, L. (2019) Genome mining and prospects for
15.
Hudson, G. A., and Mitchell, D. A. (2018) RiPP antibi
antibiotic discovery, Curr. Opin. Microbiol., 51, 1 8,
otics: biosynthesis and engineering potential, Curr. Opin.
doi: 10.1016/j.mib.2019.01.001.
Microbiol., 45, 61 69, doi: 10.1016/j.mib.2018.02.010.
6.
Terekhov, S. S., Smirnov, I. V., Malakhova, M. V.,
16.
Mullane, K., Lee, C., Bressler, A., Buitrago, M., Weiss, K.,
Samoilov, A. E., Manolov, A. I., et al. (2018) Ultrahigh
et al. (2015) Multicenter, randomized clinical trial to com
throughput functional profiling of microbiota communi
pare the safety and efficacy of LFF571 and vancomycin for
ties, Proc. Natl. Acad. Sci. USA,
115,
95519556,
Clostridium difficile infections, Antimicrob. Agents
doi: 10.1073/pnas.1811250115.
Chemother., 59, 1435 1440, doi: 10.1128/aac.04251 14.
7.
Stokes, J. M., Yang, K., Swanson, K., Jin, W., Cubillos
17.
Poorinmohammad, N., Bagheban Shemirani, R., and
Ruiz, A., et al. (2020) A deep learning approach to antibi
Hamedi, J. (2019) Genome mining for ribosomally synthe
otic discovery, Cell, 180, 688 702, doi: 10.1016/j.cell.2020.
sised and post translationally modified peptides (RiPPs)
01.021.
reveals undiscovered bioactive potentials of actinobacteria,
8.
Lau, J. L., and Dunn, M. K. (2018) Therapeutic peptides:
Antonie Van Leeuwenhoek, 112, 1477 1499, doi: 10.1007/
historical perspectives, current development trends, and
s10482 019 01276 6.
future directions, Bioorg. Med. Chem., 26, 2700 2707,
18.
Velasquez, J. E., and van der Donk, W. A. (2011) Genome
doi: 10.1016/j.bmc.2017.06.052.
mining for ribosomally synthesized natural products, Curr.
9.
Fosgerau, K., and Hoffmann, T. (2015) Peptide the
Opin. Chem. Biol., 15, 11 21, doi: 10.1016/j.cbpa.2010.
rapeutics: current status and future directions, Drug
10.027.
Discov. Today, 20, 122 128, doi: 10.1016/j.drudis.2014.10.
19.
Arnison, P. G., Bibb, M. J., Bierbaum, G., Bowers, A. A.,
003.
Bugni, T. S., et al. (2013) Ribosomally synthesized and
10.
Lei, J., Sun, L., Huang, S., Zhu, C., Li, P., He, J., Mackey, V.,
post translationally modified peptide natural products:
Coy, D. H., and He, Q. (2019) The antimicrobial peptides
overview and recommendations for a universal nomencla
and their potential clinical applications, Am. J. Transl.
ture, Nat. Prod. Rep.,
30,
108 160, doi:
10.1039/
Res., 11, 3919 3931.
C2NP20085F.
11.
Kang, S. J., Park, S. J., Mishig Ochir, T., and Lee, B. J.
20.
Repka, L. M., Chekan, J. R., Nair, S. K., and van der
(2014) Antimicrobial peptides: therapeutic potentials,
Donk, W. A. (2017) Mechanistic understanding of lan
БИОХИМИЯ том 85 вып. 11 2020
СОЗДАНИЕ ИСКУССТВЕННОГО БИОРАЗНООБРАЗИЯ ЛАНТИБИОТИКОВ
1565
thipeptide biosynthetic enzymes, Chem. Rev., 117, 5457
36.
de Arauz, L. J., Jozala, A. F., Mazzola, P. G., and Vessoni
5520, doi: 10.1021/acs.chemrev.6b00591.
Penna, T. C. (2009) Nisin biotechnological production and
21.
Kleerebezem, M. (2004) Quorum sensing control of lan
application: a review, Trends Food Sci. Technol., 20, 146
tibiotic production; nisin and subtilin autoregulate their
154, doi: 10.1016/j.tifs.2009.01.056.
own biosynthesis, Peptides, 25, 1405 1414, doi: 10.1016/
37.
Lepak, A. J., Marchillo, K., Craig, W. A., and Andes, D. R.
j.peptides.2003.10.021.
(2015) In vivo pharmacokinetics and pharmacodynamics
22.
Willey, J. M., Willems, A., Kodani, S., and Nodwell, J. R.
of the lantibiotic NAI 107 in a neutropenic murine thigh
(2006) Morphogenetic surfactants and their role in the for
infection model, Antimicrob. Agents Chemother., 59, 1258
mation of aerial hyphae in Streptomyces coelicolor, Mol.
1264, doi: 10.1128/AAC.04444 14.
Microbiol., 59, 731 742, doi: 10.1111/j.1365 2958.2005.
38.
Thomsen, T. T., Mojsoska, B., Cruz, J. C., Donadio, S.,
05018.x.
Jenssen, H., Lobner Olesen, A., and Rewitz, K. (2016)
23.
Bierbaum, G., Gotz, F., Peschel, A., Kupke, T., van de
The Lantibiotic NAI 107 efficiently rescues Droso/
Kamp, M., and Sahl, H. G. (1996) The biosynthesis of the
phila melanogaster from infection with methicillin resi
lantibiotics epidermin, gallidermin, Pep5 and epilancin
stant Staphylococcus aureus USA300, Antimicrob.
K7, Antonie Van Leeuwenhoek, 69, 119 127, doi: 10.1007/
Agents Chemother., 60, 5427 5436, doi: 10.1128/AAC.
BF00399417.
02965 15.
24.
Zhang, Q., Yu, Y., Velasquez, J. E., and van der Donk, W. A.
39.
Castiglione, F., Lazzarini, A., Carrano, L., Corti, E.,
(2012) Evolution of lanthipeptide synthetases, Proc. Natl.
Ciciliato, I., et al. (2008) Determining the structure and
Acad. Sci. USA, 109, 18361 18366, doi: 10.1073/pnas.
mode of action of microbisporicin, a potent lantibiotic
1210393109.
active against multiresistant pathogens, Chem. Biol., 15,
25.
Shi, Y., Yang, X., Garg, N., and van der Donk, W. A. (2011)
22 31, doi: 10.1016/j.chembiol.2007.11.009.
Production of lantipeptides in Escherichia coli, J. Am. Chem.
40.
Chatterjee, C., Miller, L. M., Leung, Y. L., Xie, L., Yi, M.,
Soc., 133, 2338 2341, doi: 10.1021/ja109044r.
Kelleher, N. L., and van der Donk, W. A. (2005) Lacticin
26.
Garg, N., Salazar Ocampo, L. M., and van der Donk, W. A.
481 synthetase phosphorylates its substrate during lantibi
(2013) In vitro activity of the nisin dehydratase NisB, Proc.
otic production, J. Am. Chem. Soc., 127, 15332 15333,
Natl. Acad. Sci. USA, 110, 7258 7263, doi: 10.1073/pnas.
doi: 10.1021/ja0543043.
1222488110.
41.
Dong, S. H., Tang, W., Lukk, T., Yu, Y., Nair, S. K., and
27.
Ortega, M. A., Hao, Y., Zhang, Q., Walker, M. C., van der
van der Donk, W. A. (2015) The enterococcal cytolysin
Donk, W. A., and Nair, S. K. (2015) Structure and mecha
synthetase has an unanticipated lipid kinase fold, eLife, 4,
nism of the tRNA dependent lantibiotic dehydratase NisB,
e07607, doi: 10.7554/eLife.07607.
Nature, 517, 509 512, doi: 10.1038/nature13888.
42.
Ma, H., Gao, Y., Zhao, F., and Zhong, J.
(2015)
28.
Siezen, R. J., Kuipers, O. P., and de Vos, W. M. (1996) Com
[Individual catalytic activity of two functional domains of
parison of lantibiotic gene clusters and encoded proteins,
bovicin HJ50 synthase BovM], Wei Sheng Wu Xue Bao, 55,
Antonie Van Leeuwenhoek, 69, 171 184, doi: 10.1007/
50 58.
BF00399422.
43.
Shimafuji, C., Noguchi, M., Nishie, M., Nagao, J.,
29.
Goto, Y., Okesli, A., and van der Donk, W. A. (2011)
Shioya, K., Zendo, T., Nakayama, J., and Sonomoto, K.
Mechanistic studies of Ser/Thr dehydration catalyzed by a
(2015) In vitro catalytic activity of N terminal and C ter
member of the LanL lanthionine synthetase family,
minal domains in NukM, the post translational modifica
Biochemistry, 50, 891 898, doi: 10.1021/bi101750r.
tion enzyme of nukacin ISK 1, J. Biosci. Bioeng., 120, 624
30.
Hollenstein, K., Dawson, R. J., and Locher, K. P. (2007)
629, doi: 10.1016/j.jbiosc.2015.03.020.
Structure and mechanism of ABC transporter proteins,
44.
Tang, W., Jimenez Oses, G., Houk, K. N., and van der
Curr. Opin. Struct. Biol., 17, 412 418, doi: 10.1016/j.sbi.
Donk, W. A. (2015) Substrate control in stereoselective
2007.07.003.
lanthionine biosynthesis, Nat. Chem.,
7,
5764,
31.
Kuipers, A., de Boef, E., Rink, R., Fekken, S., Kluskens,
doi: 10.1038/nchem.2113.
L. D., Driessen, A. J., Leenhouts, K., Kuipers, O. P., and
45.
Thibodeaux, C. J., Ha, T., and van der Donk, W. A. (2014)
Moll, G. N. (2004) NisT, the transporter of the lantibiotic
A price to pay for relaxed substrate specificity: a compara
nisin, can transport fully modified, dehydrated, and
tive kinetic analysis of the class II lanthipeptide synthetases
unmodified prenisin and fusions of the leader peptide with
ProcM and HalM2, J. Am. Chem. Soc., 136, 17513 17529,
non lantibiotic peptides, J. Biol. Chem., 279, 22176 22182,
doi: 10.1021/ja5089452.
doi: 10.1074/jbc.M312789200.
46.
Cubillos Ruiz, A., Berta Thompson, J. W., Becker, J. W.,
32.
Lagedroste, M., Smits, S. H. J., and Schmitt, L. (2017)
van der Donk, W. A., and Chisholm, S. W. (2017)
Substrate specificity of the secreted nisin leader peptidase
Evolutionary radiation of lanthipeptides in marine
NisP, Biochemistry, 56, 40054014, doi: 10.1021/acs.
cyanobacteria, Proc. Natl. Acad. Sci. USA, 114, E5424
biochem.7b00524.
E5433, doi: 10.1073/pnas.1700990114.
33.
Velasquez, J. E., Zhang, X., and van der Donk, W. A.
47.
Nishie, M., Sasaki, M., Nagao, J., Zendo, T., Nakayama, J.,
(2011) Biosynthesis of the antimicrobial peptide epilancin
and Sonomoto, K. (2011) Lantibiotic transporter requires
15X and its N terminal lactate, Chem. Biol., 18, 857 867,
cooperative functioning of the peptidase domain and the
doi: 10.1016/j.chembiol.2011.05.007.
ATP binding domain, J. Biol. Chem., 286, 11163 11169,
34.
Huang, E., and Yousef, A. E. (2015) Biosynthesis of paeni
doi: 10.1074/jbc.M110.212704.
bacillin, a lantibiotic with N terminal acetylation, by
48.
Kuipers, A., Meijer Wierenga, J., Rink, R., Kluskens, L. D.,
Paenibacillus polymyxa, Microbiol. Res., 181, 1521,
and Moll, G. N. (2008) Mechanistic dissection of the
doi: 10.1016/j.micres.2015.08.001.
enzyme complexes involved in biosynthesis of lacticin 3147
35.
Allgaier, H., Jung, G., Werner, R. G., Schneider, U., and
and nisin, Appl. Environ. Microbiol., 74, 65916597,
Zähner, H. (1985) Elucidation of the structure of epider
doi: 10.1128/AEM.01334 08.
min, a ribosomally synthesized, tetracyclic heterodetic
49.
Caetano, T., Barbosa, J., Moesker, E., Sussmuth, R. D.,
polypeptide antibiotic, Angew. Chem. Internat. Ed. Engl.,
and Mendo, S. (2014) Bioengineering of lanthipeptides in
24, 1051 1053, doi: 10.1002/anie.198510511.
Escherichia coli: assessing the specificity of lichenicidin and
БИОХИМИЯ том 85 вып. 11 2020
1566
ПИПИЯ и др.
haloduracin biosynthetic machinery, Res. Microbiol., 165,
63.
Kodani, S., Lodato, M. A., Durrant, M. C., Picart, F., and
600 604, doi: 10.1016/j.resmic.2014.07.006.
Willey, J. M. (2005) SapT, a lanthionine containing pep
50.
Galvin, M., Hill, C., and Ross, R. P. (1999) Lacticin 3147
tide involved in aerial hyphae formation in the strepto
displays activity in buffer against gram positive bacterial
mycetes, Mol. Microbiol., 58, 1368 1380, doi: 10.1111/
pathogens which appear insensitive in standard plate
j.1365 2958.2005.04921.x.
assays, Lett. Appl. Microbiol., 28, 355 358, doi: 10.1046/
64.
Ferir, G., Petrova, M. I., Andrei, G., Huskens, D.,
j.1365 2672.1999.00550.x.
Hoorelbeke, B., et al. (2013) The lantibiotic peptide
51.
Oman, T. J., and van der Donk, W. A. (2009) Insights into
labyrinthopeptin A1 demonstrates broad anti HIV and
the mode of action of the two peptide lantibiotic halodu
anti HSV activity with potential for microbicidal applica
racin, ACS Chem. Biol., 4, 865874, doi: 10.1021/
tions, PLoS One, 8, e64010, doi: 10.1371/journal.pone.
cb900194x.
0064010.
52.
Xin, B., Zheng, J., Xu, Z., Li, C., Ruan, L., Peng, D., and
65.
Goto, Y., Li, B., Claesen, J., Shi, Y., Bibb, M. J., and van
Sun, M. (2015) Three novel lantibiotics, ticins A1, A3, and
der Donk, W. A. (2010) Discovery of unique lanthionine
A4, have extremely stable properties and are promising
synthetases reveals new mechanistic and evolutionary
food biopreservatives, Appl. Environ. Microbiol., 81, 6964
insights, PLoS Biol., 8, e1000339, doi: 10.1371/journal.
6972, doi: 10.1128/aem.01851 15.
pbio.1000339.
53.
Crowther, G. S., Baines, S. D., Todhunter, S. L., Freeman, J.,
66.
Zhang, Q., Doroghazi, J. R., Zhao, X., Walker, M. C., and
Chilton, C. H., and Wilcox, M. H. (2013) Evaluation of
van der Donk, W. A. (2015) Expanded natural product
NVB302 versus vancomycin activity in an in vitro human
diversity revealed by analysis of lanthipeptide like gene
gut model of Clostridium difficile infection, J. Antimicrob.
clusters in actinobacteria, Appl. Environ. Microbiol., 81,
Chemother., 68, 168 176, doi: 10.1093/jac/dks359.
4339 4350, doi: 10.1128/AEM.00635 15.
54.
Louie, T. J., Emery, J., Krulicki, W., Byrne, B., and Mah, M.
67.
Iftime, D., Jasyk, M., Kulik, A., Imhoff, J. F., Stegmann,
(2009) OPT 80 eliminates Clostridium difficile and is spar
E., Wohlleben, W., Süssmuth, R. D., and Weber, T. (2015)
ing of bacteroides species during treatment of C. difficile
Streptocollin, a type IV lanthipeptide produced by
Infection, Antimicrob. Agents Chemother., 53, 261 263,
Streptomyces collinus Tü 365, Chembiochem., 16, 2615
doi: 10.1128/aac.01443 07.
2623, doi: 10.1002/cbic.201500377.
55.
Knerr, P. J., and van der Donk, W. A. (2012) Discovery,
68.
Hegemann, J. D., and van der Donk, W. A. (2018)
biosynthesis, and engineering of lantipeptides, Annu. Rev.
Investigation of substrate recognition and biosynthesis in
Biochem., 81, 479 505, doi: 10.1146/annurev biochem
class IV lanthipeptide systems, J. Am. Chem. Soc., 140,
060110 113521.
5743 5754, doi: 10.1021/jacs.8b01323.
56.
Kodani, S., Hudson, M. E., Durrant, M. C., Buttner, M. J.,
69.
Rogers, L. A. (1928) The inhibiting effect of Streptococcus
Nodwell, J. R., and Willey, J. M. (2004) The SapB mor
Lactis on Lactobacillus Bulgaricus, J. Bacteriol., 16, 321
phogen is a lantibiotic like peptide derived from the prod
325, doi: 10.1128/JB.16.5.321 325.1928.
uct of the developmental gene ramS in Streptomyces coeli/
70.
Mattick, A. T. R., Hirsch, A., and Berridge, N. J. (1947)
color, Proc. Natl. Acad. Sci. USA, 101, 11448 11453,
Further observations on an inhibitory substance (nisin)
doi: 10.1073/pnas.0404220101.
from lactic streptococci, Lancet, 250, 5 8, doi: 10.1016/
57.
Meindl, K., Schmiederer, T., Schneider, K., Reicke, A.,
S0140 6736(47)90004 4.
Butz, D., et al. (2010) Labyrinthopeptins: a new class of
71.
van Heijenoort, Y., Gomez, M., Derrien, M., Ayala, J.,
carbacyclic lantibiotics, Angew. Chem. Int. Ed. Engl., 49,
and van Heijenoort, J. (1992) Membrane intermediates in
1151 1154, doi: 10.1002/anie.200905773.
the peptidoglycan metabolism of Escherichia coli: possible
58.
Krawczyk, B., Ensle, P., Müller, W. M., and Süssmuth, R. D.
roles of PBP 1b and PBP 3, J. Bacteriol., 174, 3549 3557,
(2012) Deuterium labeled peptides give insights into the
doi: 10.1128/jb.174.11.3549 3557.1992.
directionality of class III lantibiotic synthetase LabKC,
72.
Breukink, E., and de Kruijff, B. (2006) Lipid II as a target
J. Am. Chem. Soc., 134, 9922 9925, doi: 10.1021/ja3040224.
for antibiotics, Nat. Rev. Drug Discov., 5, 321323,
59.
Muller, W. M., Schmiederer, T., Ensle, P., and Sussmuth,
doi: 10.1038/nrd2004.
R. D. (2010) In vitro biosynthesis of the prepeptide of type
73.
Piper, C., Draper, L. A., Cotter, P. D., Ross, R. P., and
III lantibiotic labyrinthopeptin A2 including formation of a
Hill, C. (2009) A comparison of the activities of lacticin
C C bond as a post translational modification, Angew.
3147 and nisin against drug resistant Staphylococcus aureus
Chem. Int. Ed. Engl., 49, 2436 2440, doi: 10.1002/anie.
and Enterococcus species, J. Antimicrob. Chemother., 64,
200905909.
546 551, doi: 10.1093/jac/dkp221.
60.
Völler, G. H., Krawczyk, J. M., Pesic, A., Krawczyk, B.,
74.
Dischinger, J., Basi Chipalu, S., and Bierbaum, G. (2014)
Nachtigall, J., and Süssmuth, R. D. (2012) Characteriza
Lantibiotics: promising candidates for future applications
tion of new class III lantibiotics-erythreapeptin, aver
in health care, Int. J. Med. Microbiol., 304, 5162,
mipeptin and griseopeptin from Saccharopolyspora erythraea,
doi: 10.1016/j.ijmm.2013.09.003.
Streptomyces avermitilis and Streptomyces griseus demon
75.
Hsu, S. T. D., Breukink, E., Tischenko, E., Lutters, M. A. G.,
strates stepwise N terminal leader processing, Chembiochem,
de Kruijff, B., Kaptein, R., Bonvin, A. M. J. J., and van
13, 1174 1183, doi: 10.1002/cbic. 201200118.
Nuland, N. A. J. (2004) The nisin-lipid II complex reveals
61.
Iorio, M., Sasso, O., Maffioli, S. I., Bertorelli, R.,
a pyrophosphate cage that provides a blueprint for novel
Monciardini, P., et al. (2014) A glycosylated, labionin
antibiotics, Nat. Struct. Mol. Biol.,
11,
963967,
containing lanthipeptide with marked antinociceptive
doi: 10.1038/nsmb830.
activity, ACS Chem. Biol., 9, 398404, doi: 10.1021/
76.
Hasper, H. E., de Kruijff, B., and Breukink, E. (2004)
cb400692w.
Assembly and stability of nisin lipid II pores, Biochemistry,
62.
Chen, S., Xu, B., Chen, E., Wang, J., Lu, J., Donadio, S.,
43, 11567 11575, doi: 10.1021/bi049476b.
Ge, H., and Wang, H. (2019) Zn dependent bifunctional
77.
Märki, F., Hänni, E., Fredenhagen, A., and van Oostrum, J.
proteases are responsible for leader peptide processing of
(1991) Mode of action of the lanthionine containing pep
class III lanthipeptides, Proc. Natl. Acad. Sci. USA, 116,
tide antibiotics duramycin, duramycin B and C, and cin
2533 2538, doi: 10.1073/pnas.1815594116.
namycin as indirect inhibitors of phospholipase A2,
БИОХИМИЯ том 85 вып. 11 2020
СОЗДАНИЕ ИСКУССТВЕННОГО БИОРАЗНООБРАЗИЯ ЛАНТИБИОТИКОВ
1567
Biochem. Pharmacol., 42, 2027 2035, doi: 10.1016/0006
ing motif, Appl. Environ. Microbiol., 75, 44274434,
2952(91)90604 4.
doi: 10.1128/aem.00262 09.
78.
Vance, J. E., and Tasseva, G. (2013) Formation and func
92. Li, Y. (2011) Recombinant production of antimicrobial
tion of phosphatidylserine and phosphatidylethanolamine
peptides in Escherichia coli: a review, Protein Expr. Purif.,
in mammalian cells, Biochim. Biophys. Acta, 1831, 543
80, 260 267, doi: 10.1016/j.pep.2011.08.001.
554, doi: 10.1016/j.bbalip.2012.08.016.
93. Mesa Pereira, B., Rea, M. C., Cotter, P. D., Hill, C., and
79.
Gbaguidi, B., Hakizimana, P., Vandenbussche, G., and
Ross, R. P. (2018) Heterologous expression of biopreserva
Ruysschaert, J. M. (2007) Conformational changes in a
tive bacteriocins with a view to low cost production, Front.
bacterial multidrug transporter are phosphatidylethanol
Microbiol., 9, 1654, doi: 10.3389/fmicb.2018.01654.
amine dependent, Cell. Mol. Life Sci., 64, 1571 1582,
94. Si, T., Tian, Q., Min, Y., Zhang, L., Sweedler, J. V., van der
doi: 10.1007/s00018 007 7031 0.
Donk, W. A., and Zhao, H. (2018) Rapid screening of lan
80.
Epand, R. M., and Epand, R. F. (2009) Lipid domains in
thipeptide analogs via in colony removal of leader peptides
bacterial membranes and the action of antimicrobial
in Escherichia coli, J. Am. Chem. Soc., 140, 11884 11888,
agents, Biochim. Biophys. Acta,
1788,
289294,
doi: 10.1021/jacs.8b05544.
doi: 10.1016/j.bbamem.2008.08.023.
95. Geng, M., and Smith, L. (2018) Modifying the lantibiotic
81.
Vestergaard, M., Berglund, N. A., Hsu, P. C., Song, C.,
mutacin 1140 for increased yield, activity, and stability,
Koldso, H., Schiott, B., and Sansom, M. S. P. (2019)
Appl. Environ. Microbiol., 84, doi: 10.1128/AEM.00830 18.
Structure and dynamics of cinnamycin lipid complexes:
96. Field, D., Connor, P. M., Cotter, P. D., Hill, C., and Ross, R. P.
mechanisms of selectivity for phosphatidylethanolamine
(2008) The generation of nisin variants with enhanced activ
lipids, ACS Omega,
4,
1888918899, doi:
10.1021/
ity against specific gram positive pathogens, Mol. Microbiol.,
acsomega.9b02949.
69, 218 230, doi: 10.1111/j.1365 2958.2008.06279.x.
82.
Choung, S. Y., Kobayashi, T., Takemoto, K., Ishitsuka, H.,
97. Yoganathan, S., Sit, C. S., and Vederas, J. C.
(2011)
and Inoue, K. (1988) Interaction of a cyclic peptide, Ro09
Chemical synthesis and biological evaluation of gallider
0198, with phosphatidylethanolamine in liposomal mem
min siderophore conjugates, Org. Biomol. Chem., 9, 2133
branes, Biochim. Biophys. Acta,
940,
180187,
2141, doi: 10.1039/c0ob00846j.
doi: 10.1016/0005 2736(88)90193 9.
98. Li, Q., Montalban Lopez, M., and Kuipers, O. P. (2018)
83.
Hasim, S., Allison, D. P., Mendez, B., Farmer, A. T.,
Increasing the antimicrobial activity of nisin based lantibi
Pelletier, D. A., Retterer, S. T., Campagna, S. R.,
otics against gram negative pathogens, Appl. Environ.
Reynolds, T. B., and Doktycz, M. J. (2018) Elucidating
Microbiol., 84, doi: 10.1128/AEM.00052 18.
duramycin’s bacterial selectivity and mode of action on the
99. Yang, X., Lennard, K. R., He, C., Walker, M. C., Ball, A. T.,
bacterial cell envelope, Front. Microbiol.,
9,
219,
Doigneaux, C., Tavassoli, A., and van der Donk, W. A.
doi: 10.3389/fmicb.2018.00219.
(2018) A lanthipeptide library used to identify a
84.
Jones, A. M., and Helm, J. M. (2009) Emerging treatments
protein-protein interaction inhibitor, Nat. Chem. Biol., 14,
in cystic fibrosis, Drugs, 69, 1903 1910, doi: 10.2165/
375 380, doi: 10.1038/s41589 018 0008 5.
11318500 000000000 00000.
100. Nixon, A. E., Sexton, D. J., and Ladner, R. C. (2014)
85.
Elvas, F., Stroobants, S., and Wyffels, L.
(2017)
Drugs derived from phage display: from candidate identifi
Phosphatidylethanolamine targeting for cell death imaging
cation to clinical practice, MAbs,
6,
7385,
in early treatment response evaluation and disease diagno
doi: 10.4161/mabs.27240.
sis, Apoptosis, 22, 971987, doi: 10.1007/s10495 017
101. Urban, J. H., Moosmeier, M. A., Aumuller, T., Thein, M.,
1384 0.
Bosma, T., et al. (2017) Phage display and selection of lan
86.
Emoto, K., Kobayashi, T., Yamaji, A., Aizawa, H., Yahara, I.,
thipeptides on the carboxy terminus of the gene 3 minor
Inoue, K., and Umeda, M. (1996) Redistribution of phos
coat protein, Nat. Commun., 8, 1500, doi: 10.1038/s41467
phatidylethanolamine at the cleavage furrow of dividing
017 01413 7.
cells during cytokinesis, Proc. Natl. Acad. Sci. USA, 93,
102. Hetrick, K. J., Walker, M. C., and van der Donk, W. A.
12867 12872, doi: 10.1073/pnas.93.23.12867.
(2018) Development and application of yeast and phage
87.
Zhao, M.
(2011) Lantibiotics as probes for phos
display of diverse lanthipeptides, ACS Cent. Sci., 4, 458
phatidylethanolamine, Amino acids,
41,
10711079,
467, doi: 10.1021/acscentsci.7b00581.
doi: 10.1007/s00726 009 0386 9.
103. Convery, N., and Gadegaard, N. (2019) 30 years of
88.
Hofmann, F. T., Szostak, J. W., and Seebeck, F. P. (2012)
microfluidics, Micro and Nano Engineering, 2, 76 91,
In vitro selection of functional lantipeptides, J. Am. Chem.
doi: 10.1016/j.mne.2019.01.003.
Soc., 134, 8038 8041, doi: 10.1021/ja302082d.
104. Fallah Araghi, A., Baret, J. C., Ryckelynck, M., and
89.
Zhou, X. X., Li, W. F., Ma, G. X., and Pan, Y. J. (2006) The
Griffiths, A. D. (2012) A completely in vitro ultrahigh
nisin controlled gene expression system: construction,
throughput droplet based microfluidic screening system
application and improvements, Biotechnol. Adv., 24, 285
for protein engineering and directed evolution, Lab. Chip.,
295, doi: 10.1016/j.biotechadv.2005.11.001.
12, 882 891, doi: 10.1039/c2lc21035e.
90.
Aso, Y., Nagao, J. I., Koga, H., Okuda, K. I., Kanemasa, Y.,
105. Mahler, L., Wink, K., Beulig, R. J., Scherlach, K., Tovar, M.,
Sashihara, T., Nakayama, J., and Sonomoto, K. (2004)
et al. (2018) Detection of antibiotics synthetized in
Heterologous expression and functional analysis of the
microfluidic picolitre droplets by various actinobacteria,
gene cluster for the biosynthesis of and immunity to the
Sci. Rep., 8, 13087, doi: 10.1038/s41598 018 31263 2.
lantibiotic, nukacin ISK 1, J. Biosci. Bioeng., 98, 429 436,
106. Terekhov, S. S., Smirnov, I. V., Stepanova, A. V., Bobik, T. V.,
doi: 10.1016/S1389 1723(05)00308 7.
Mokrushina, Y. A., et al. (2017) Microfluidic droplet plat
91.
Böttiger, T., Schneider, T., Martнnez, B., Sahl, H. G., and
form for ultrahigh throughput single cell screening of bio
Wiedemann, I. (2009) Influence of Ca2+ ions on the activi
diversity, Proc. Natl. Acad. Sci. USA, 114, 2550 2555,
ty of lantibiotics containing a mersacidin like lipid II bind
doi: 10.1073/pnas.1621226114.
БИОХИМИЯ том 85 вып. 11 2020
1568
ПИПИЯ и др.
ENGINEERING ARTIFICIAL BIODIVERSITY OF LANTIBIOTICS
TO EXPAND THE CHEMICAL SPACE OF DNA[ENCODED ANTIBIOTICS
Review
S. O. Pipiya1, S. S. Terekhov1,2, Yu. A. Mokrushina1,2,
V. D. Knorre1, I. V. Smirnov1,2*, and A. G. Gabibov1,2
1 Shemyakin and Ovchinnikov Institute of Bioorganic Chemistry of the Russian Academy of Sciences,
117997 Moscow, Russia; E/mail: smirnov@ibch.ru
2 Faculty of Chemistry, Lomonosov Moscow State University, 119991 Moscow, Russia
Received August 11, 2020
Revised September 28, 2020
Accepted October 7, 2020
The discovery of antibiotics was one of the fundamental stages in the development of humanity, leading to a dramat
ic increase in the life expectancy of millions of people all over the world. The uncontrolled use of antibiotics resulted
in the selection of resistant strains of bacteria, limiting the effectiveness of antimicrobial therapy nowadays.
Antimicrobial peptides (AMPs) were considered promising candidates for next generation antibiotics for a long time.
However, the practical application of AMPs is restricted by their low therapeutic indices, impaired pharmacokinetics,
and pharmacodynamics, which is predetermined by their peptide structure. Nevertheless, the DNA encoded nature
of AMPs enables creating broad repertoires of artificial biodiversity of antibiotics, making them versatile templates for
the directed evolution of antibiotic activity. Lantibiotics are a unique class of AMPs with an expanded chemical space.
A variety of post translational modifications, mechanisms of action on bacterial membranes, and DNA encoded
nature make them a convenient molecular template for creating highly representative libraries of antimicrobial com
pounds. Isolation of new drug candidates from this synthetic biodiversity is extremely attractive but requires high
throughput screening of antibiotic activity. The combination of synthetic biology and ultrahigh throughput microflu
idics allows implementing the concept of directed evolution of lantibiotics for accelerated creation of new promising
drug candidates.
Keywords: directed evolution of antimicrobial activity, DNA encoded antibiotics, ultrahigh throughput screening,
microfluidics, lantibiotic bioengineering, drug discovery, antibiotic resistance
БИОХИМИЯ том 85 вып. 11 2020