БИОХИМИЯ, 2020, том 85, вып. 11, с. 1587 - 1600
УДК 579.61
БАКТЕРИОФАГИ КАК ТЕРАПЕВТИЧЕСКИЕ ПРЕПАРАТЫ:
ЧТО СДЕРЖИВАЕТ ИХ ПРИМЕНЕНИЕ В МЕДИЦИНЕ
Обзор
© 2020
В.В. Власов*, Н.В. Тикунова, В.В. Морозова
Институт химической биологии и фундаментальной медицины СО РАН,
630090 Новосибирск, Россия; электронная почта: vvlassov@mail.ru
Поступила в редакцию 15.06.2020
После доработки 18.08.2020
Принята к публикации 18.08.2020
Все более широкое распространение бактериальных патогенов, обладающих множественной устойчи!
востью к антибиотикам, требует разработки новых подходов для борьбы с инфекциями. Одним из подходов,
на который возлагаются большие надежды, является фаготерапия. В последние годы научные организации
и ряд фармацевтических компаний активизировали исследования, направленные на создание терапевти!
ческих препаратов на основе бактериофагов. В США и европейских странах созданы центры, в которых фа!
готерапия в экспериментальном режиме применяется для лечения пациентов, не поддающихся терапии ан!
тибиотиками. В настоящем обзоре описаны особенности бактериофагов как средств терапии, критически
обсуждаются результаты клинических испытаний препаратов бактериофагов и оцениваются перспективы
применения фаготерапии для лечения отдельных видов инфекционных заболеваний.
КЛЮЧЕВЫЕ СЛОВА: бактериофаги, фаготерапия, бактериальные инфекции, множественная лекарствен!
ная устойчивость, синтетические бактериофаги.
DOI: 10.31857/S0320972520110068
ВВЕДЕНИЕ
Наиболее активно и успешно использовали
бактериофаги в СССР преимущественно для ле!
Множественная антибиотикоустойчивость
чения раневых инфекций, включая послеопера!
патогенных бактерий в настоящее время рас!
ционные осложнения [3-5], и кишечных забо!
сматривается как глобальная проблема. Смерт!
леваний, в том числе и во время вспышек холе!
ность от инфекций, вызываемых такими бакте!
ры [6-8].
риями, с каждым годом растет, и, по оценкам
После появления антибиотиков, с помощью
специалистов Всемирной организации здраво!
которых в первые годы их применения удава!
охранения, к 2050 г. может достичь 10 млн смер!
лось успешно решить проблему бактериальных
тей в год и превысить смертность от онкологи!
инфекций, интерес к фаготерапии угас, в том
числе и в связи в недостаточной готовностью
room/detail/29!04!2019!new!report). К наиболее
науки и технологий того времени для производ!
опасным относят обладающие множественной
ства сложных биофармацевтических препаратов
лекарственной устойчивостью бактерии из груп!
бактериофагов. В 1960-2000 гг. фаготерапия
пы ESKAPE: Enterococcus faecium, Staphylococcus
применялась лишь в нескольких центрах - в
aureus, Klebsiella pneumoniae, Acinetobacter bau*
Польше и в Грузии, а единственной страной, где
mannii, Pseudomonas aeruginosa и Enterobacter
бактериофаги для медицинских целей произво!
species. В сложившейся ситуации ведется интен!
дились промышленно, был СССР и впослед!
сивный поиск новых препаратов и подходов для
ствии Российская Федерация. Терапевтические
борьбы с патогенными бактериями. В качестве
препараты бактериофагов применяли в виде мо!
одного из таких перспективных подходов в нас!
нотерапии [9-11] или в комплексном лечении
тоящее время рассматривается фаготерапия.
совместно с антибиотиками [10, 12, 13].
Впервые терапия бактериофагами была приме!
Все изменилось в последние годы. Совре!
нена столетие назад для лечения острых кишеч!
менные методы позволяют детально характери!
ных заболеваний и кожных инфекций [1, 2].
зовать бактериофаги, вносить изменения в их
геномы и даже конструировать синтетические
* Адресат для корреспонденции.
бактериофаги, производить препараты индиви!
1587
1588
ВЛАСОВ и др.
дуальных бактериофагов в условиях GMP. Инте!
могут перемещаться через слизистые оболочки в
рес к фаготерапии в последние годы был подо!
кровь и далее в органы дыхания, в выделитель!
грет рядом сообщений об успешном применении
ные органы или к месту размножения бактерий
бактериофагов для лечения пациентов в крити!
в организме. В мочевой пузырь бактериофаги
ческом состоянии, зараженных микроорганиз!
могут попадать напрямую из кишечника. Пола!
мами с множественной лекарственной устойчи!
гают, что ежедневно в организме человека из ки!
востью [14-17]. Второй год в США и в Европе
шечника трансцитозом попадает в другие ткани
проводятся крупные конгрессы по фаготерапии,
и органы около 109 фаговых частиц, формируя
тематика которых ориентирована на практичес!
фаговое сообщество, влияющее на здоровье и
иммунитет [20, 21]. Бактериофаги способны
kisacoresearch.com/events/phage!futures!europe;
проникать через некоторые физиологические
барьеры, например гематоэнцефалический
2019). Появился ряд компаний, разрабатываю!
барьер, а также попадать в пораженные остео!
щих препараты бактериофагов; во многих стра!
миелитом кости [22]. В присутствии целевых
нах ведутся клинические испытания таких пре!
бактерий фаги размножаются в пораженных
паратов. Однако, по мнению авторов обзора,
участках организма, например в инфицирован!
рассмотрение свойств бактериофагов, крити!
ной ране, а после уничтожения патогена фаги
ческий взгляд на результаты исследований бак!
разрушаются тканевыми макрофагами, в про!
териофагов в экспериментальных моделях ин!
цесс выведения бактериофагов вовлечены пе!
фекций и результаты клинических испытаний
чень и почки [23].
не дают поводов для эйфории и указывают на
Высокая специфичность бактериофагов яв!
значительные трудности, которые исследовате!
ляется не только их достоинством, но и недос!
лям предстоит преодолеть для создания
татком. Для надежного подавления инфекцион!
действительно эффективных методов фаготера!
ного агента требуется целый набор фагов, спе!
пии.
цифичных ко всем штаммам инфекционного
агента, или для успешного лечения пациента не!
обходимо подбирать препарат фага, специфич!
СВОЙСТВА БАКТЕРИОФАГОВ КАК
ный именно к тому штамму, который вызвал ин!
ПОТЕНЦИАЛЬНЫХ ТЕРАПЕВТИЧЕСКИХ
фекцию. Более того, существует возможность
АНТИБАКТЕРИАЛЬНЫХ ПРЕПАРАТОВ
возникновения устойчивости целевой бактерии
к применяемому бактериофагу в процессе тера!
Вирусы бактерий - бактериофаги - являют!
пии, и в этом случае необходимо искать новый
ся одной из наиболее распространенных форм
бактериофаг [13, 14]. В этом заключается одна
жизни на планете. Они присутствуют повсе!
из проблем фаготерапии, приводящая к тому,
местно, в воде и на суше, и, вероятно, для каж!
что бактериофаги не могут рассматриваться как
дого бактериального штамма можно найти спе!
препараты первой линии терапии. Лечение бак!
цифичный бактериофаг. Бактериофаги чрезвы!
териальной инфекции в большинстве случаев
чайно эффективны как бактерицидные агенты и
может быть успешно проведено применением
как потенциальные терапевтические препараты,
одного!двух антибиотиков, которые дешевы в
они обладают рядом достоинств. Бактериофа!
производстве, хорошо хранятся и обладают ши!
ги - это природные объекты, при их примене!
рокой специфичностью. Бактериофаги стано!
нии не возникает экологических проблем. Они
вятся необходимыми лишь в случае неудачи ан!
не приносят вреда клеткам высших организмов,
тибиотикотерапии, и рынок для них меньше.
не токсичны, высокоспецифичны и, убивая це!
Важно, что бактериофаги можно применять
левые патогенные бактерии, не приносят вреда
совместно с антибиотиками [24, 25].
нормальной микрофлоре макроорганизма. Бак!
У бактерий существует множество механиз!
териофаги регулируют состав микробиоты, у
мов защиты от бактериофагов, блокирующих
здоровых людей в кишечнике насчитывают бо!
каждый из этапов инфицирования клеток. К наи!
лее 1000 разновидностей фагов. Наиболее рас!
более известным механизмам защиты относят!
пространенные фаги, обнаруживаемые в кишеч!
ся: изменение рецептора - поверхностного бел!
нике, принадлежат к порядку Caudovirales (се!
ка бактерии, узнаваемого фаговой частицей, что
мейства Myoviridae, Siphoviridae и Podoviridae), к
препятствует адсорбции фага на бактерии; из!
тому же порядку, представители которого ис!
менение белков, функции которых необходимы
пользуются в фаготерапии [18, 19].
для проникновения нуклеиновой кислоты бак!
Бактериофаги способны проникать через
териофага в клетку; системы рестрикции!моди!
слои клеток эпителия желудочно!кишечного
фикации, защищающие от ферментов рестрик!
тракта (ЖКТ) по механизму трансцитоза - они
ции бактериальную ДНК и позволяющие этим
БИОХИМИЯ том 85 вып. 11 2020
БАКТЕРИОФАГИ КАК ТЕРАПЕВТИЧЕСКИЕ ПРЕПАРАТЫ
1589
ферментам избирательно расщеплять фаговую
риофагу, обусловленная изменениями структу!
ДНК; а также системы типа CRISPR!Cas, обес!
ры бактериального рецептора или других бел!
печивающие распознавание и избирательное
ков, может негативно сказаться на жизнеспо!
разрушение ранее встречавшихся бактериям фа!
собности бактерии, так как приводит к повыше!
говых нуклеиновых кислот [26]. Бактерии могут
нию ее чувствительности к антибиотикам [47].
защищаться от бактериофагов также, как и от
антибиотиков и от клеток иммунной системы -
формируя физический барьер, биоплёнки. Не!
ПРЕПАРАТЫ БАКТЕРИОФАГОВ
которые бактериофаги обладают способностью
разрушать биопленки с помощью специальных
Бактериофаги выделяют из самых различ!
ферментов и лизировать содержащиеся в них
ных источников окружающей среды. В настоя!
бактерии [27, 28]. Одним из способов борьбы с
щее время в исследовательских организациях
устойчивостью бактерий является использова!
разных стран имеется большое количество бак!
ние коктейлей бактериофагов [29-31]. Если фа!
териофагов, многие из которых исследованы с
ги убивают бактерии быстрее, чем они реплици!
помощью современных молекулярно!биологи!
руются, риск возникновения устойчивости сни!
ческих методов: расшифрованы их геномы, ис!
жается.
следованы их специфичность и противобакте!
Введение бактериофагов в организм вызыва!
риальные свойства. В ряде стран имеются банки
ет иммунный ответ, сила которого определяется
бактериофагов, например Félix d’Hérelle
природой фага, методом его введения и особен!
Reference Center for Bacterial Viruses at the
ностями организма [32, 33]. Показано, что денд!
University of Laval, Leibniz Institute DSMZ!
ритные клетки реагируют на бактериофаги как
German Collection of Microorganisms and Cell
на инфекционные агенты, и при контакте с ни!
Cultures и Bacteriophage Bank of Korea, которые
ми происходит стимуляция врожденного и
распространяют бактериофаги на коммерчес!
адаптивного иммунного ответа [34-36]. Выска!
кой основе. Компании, разрабатывающие про!
зывались предположения, что иммунный ответ
дукты для фаготерапии, имеют собственные
организма может снижать эффективность пов!
коллекции, доступ к которым ограничен.
торного применения одного и того же препара!
Практика показала, что для выбора бактерио!
та бактериофага у пациента. Бактериофаги яв!
фага, требующегося для лечения конкретного
ляются частью микробиоты здоровых людей,
больного, может быть необходим широкий по!
присутствуют в организме в больших количест!
иск в разных коллекциях. Например, в извест!
вах, и их взаимодействие с иммунной системой
ном случае успешного излечения пациента, за!
оказывается весьма сложным и на данный мо!
раженного A. baumannii с множественной устой!
мент недостаточно исследованным [37, 38].
чивостью к антибиотикам, потребовалось де!
Эксперименты показали, что для достижения
вять различных бактериофагов, которые нашли
клинически значимого иммунного ответа необ!
в трех разных коллекциях [14].
ходимо введение значительного количества бак!
Для экстренного поиска нужного бактерио!
териофагов, гораздо большего, чем количество
фага при лечении конкретного пациента создан
необходимое для фаготерапии. В ряде исследо!
координирующий орган - «Каталог» организа!
ваний не было найдено связи между продукцией
ций более чем из 20 стран, занимающихся фаго!
нейтрализующих антител против бактериофагов
и клиническим результатом терапии [32, 39-41].
быстро находить контакты для обмена фагами,
Однако в других исследованиях такая зависи!
требующимися для лечения больных.
мость была обнаружена [39, 42]. Вероятно, ли!
При создании препаратов бактериофагов
зис бактерий фагами происходит до того, как
для терапии используется два подхода. Первый
иммунная система начинает продуцировать ан!
из них предусматривает формирование коктей!
титела против бактериофагов. Сообщалось, что
ля бактериофагов, действующих на разные
введение фагов может благотворно влиять на
штаммы определенного патогена или даже на
функции иммунной системы: введение бактерио!
несколько патогенов, которые участвуют в раз!
фагов снижает уровень провоспалительных ци!
витии инфекции определенного типа. В Грузии
токинов и инфильтрацию лейкоцитов в ткани
компанией «Biochimfarm Georgi» (Биохимфарм
[36, 38, 43]. Вместе с тем имеются и противопо!
АО) производятся и обновляются дважды в год
ложные наблюдения [44, 45].
препараты «Пиофаг», содержащий бактериофа!
Исследования показали, что в ряде случаев
ги против Streptococcus, Staphylococcus, Esche*
при совместном использовании антибиотиков и
richia coli, P. aeruginosa и Proteus, а также «Интес!
бактериофагов наблюдался синергический эф!
тифаг», включающий бактериофаги против бак!
фект [46]. Возникающая устойчивость к бакте!
терий, наиболее значимых в этиологии кишеч!
БИОХИМИЯ том 85 вып. 11 2020
1590
ВЛАСОВ и др.
ных заболеваний. Эти коктейли используют для
Современные методы синтетической био!
лечения инфекционных и кишечных заболева!
логии позволяют комбинировать геномы бакте!
ний. В Российской Федерации НПО «Микро!
риофагов и даже синтезировать полные искус!
ственные геномы [59-61]. Это открывает прин!
десяти различных комплексных препаратов бак!
ципиальную возможность получать бактерио!
териофагов для лечения бактериальных инфек!
фаги с модифицированной специфичностью, а
ций у людей. Компания НПЦ «Микромир» про!
также бактериофаги, несущие гены, кодирую!
изводит несколько ветеринарных препаратов
щие продукты, токсичные для бактериальной
бактериофагов, а также бактериофаг!содержа!
клетки и воздействующие на определенные
щие гели, предназначенные для нормализации
бактериальные гены [60]. Описано получение
микробного состава кожи и полости рта (на дан!
химерных бактериофагов, обладающих повы!
ный момент гели производства НПЦ «Микро!
шенной литической активностью и поражаю!
мир» не являются лекарственными средствами).
щих расширенный спектр бактерий!хозяев [62,
Второй вариант фаготерапии предусматри!
63]. Получены бактериофаги, содержащие ге!
вает персонализированный подход, то есть под!
ны, кодирующие ферменты, разрушающие бак!
бор бактериофага или формирование фагового
териальные биопленки [64]. В геном фага вво!
коктейля против конкретного патогена/патоге!
дили элементы, обеспечивающие продукцию в
нов, обнаруженных у пациента. Такой подход
бактериальной клетке системы геномного ре!
давно используется в Польше, «Ludwik Hirszfeld
дактирования CRISPR!Cas, что позволяло из!
Institute of Immunology and Experimental
бирательно повредить бактериальные гены, от!
Therapy», и в Грузии, «Центре фаготерапии»
ветственные за лекарственную устойчивость. С
помощью такого фага удалось вызвать гибель
рают бактериофаги в имеющейся коллекции и
бактерий, обладающих лекарственной устойчи!
даже проводят поиск новых фагов, если в кол!
востью, но не оказать повреждающего действия
лекции нужного фага не обнаруживается.
на клетки того же микроорганизма, не содер!
В настоящее время для фаготерапии исполь!
жащего целевые генетические элементы [65,
зуют только литические фаги [48, 49], не спо!
66].
собные встраивать свой геном в геном бактерий,
для того чтобы избежать возможность горизон!
тального переноса нежелательных генов. Бакте!
СПОСОБЫ ВВЕДЕНИЯ
риофаг должен быть проверен на отсутствие не!
БАКТЕРИОФАГОВ В ОРГАНИЗМ
желательных генов, определяющих токсичность
и антибиотикоустойчивость, а также генетичес!
Бактериофаги могут быть введены в орга!
ких элементов, отвечающих за перенос фаговых
низм различными методами - пероральным,
генов в бактериальный геном, что возможно
ингаляционным, местным и инъекционным
сделать методами пиросеквенирования [50, 51].
(внутривенно, внутримышечно и подкожно в
Существуют очевидные современные требо!
место поражения). При пероральном примене!
вания к препаратам бактериофагов для приме!
нии фаги подвергаются воздействию кислой
нения в медицине: производство должно осущест!
среды в желудке, и для снижения повреждаю!
вляться в условиях GMP; сам препарат должен
щего действия этого фактора необходимо пред!
быть стерильным и не содержать компоненты
варительно нейтрализовать кислую среду или
бактериальных клеток, например пирогенные
поместить препарат бактериофага в соответ!
субстанции, способные вызвать нежелательные
ствующие капсулы. При пероральном введении
эффекты.
бактериофаги, хотя и не всегда, могут обнару!
В настоящее время не вполне решен вопрос
живаться в кровотоке [23, 41, 67]. Для ингаляци!
создания лекарственных форм бактериофагов,
онной доставки фагов обычно используют небу!
обеспечивающих их стабильность при хранении
лайзеры [25, 68-70]. Местное применение фа!
и при разных способах введения в организм. Не!
гов, входящих в состав кремов, мазей, эмульсий
которые фаги хорошо хранятся в растворе, дру!
и гидрогелей, используют для лечения ожогов,
гие - в сухих препаратах, получаемых лиофили!
гнойных ран при диабетической стопе, акне и
зацией в присутствии стабилизирующих аген!
других бактериальных поражениях кожи. Са!
тов, таких как сахара (трегалоза, сорбитол) или
мый простой способ - орошение раны и/или
молочный белок [52, 53]. Для стабилизации фа!
прикладываемой салфетки раствором препарата
говые частицы можно заключать в липосомы
бактериофага. При внутривенном введении фа!
[54-57], для защиты фагов от действия иммун!
ги попадают практически во все органы и ткани.
ной системы предлагалось модифицировать их
В этом случае выведение фагов из кровотока
поверхность полиэтиленгликолем [58].
происходит в течение 60 минут.
БИОХИМИЯ том 85 вып. 11 2020
БАКТЕРИОФАГИ КАК ТЕРАПЕВТИЧЕСКИЕ ПРЕПАРАТЫ
1591
Возможно также использование бактерио!
уничтожают бактерии в условиях, когда бакте!
фагов в качестве антибактериального покрытия
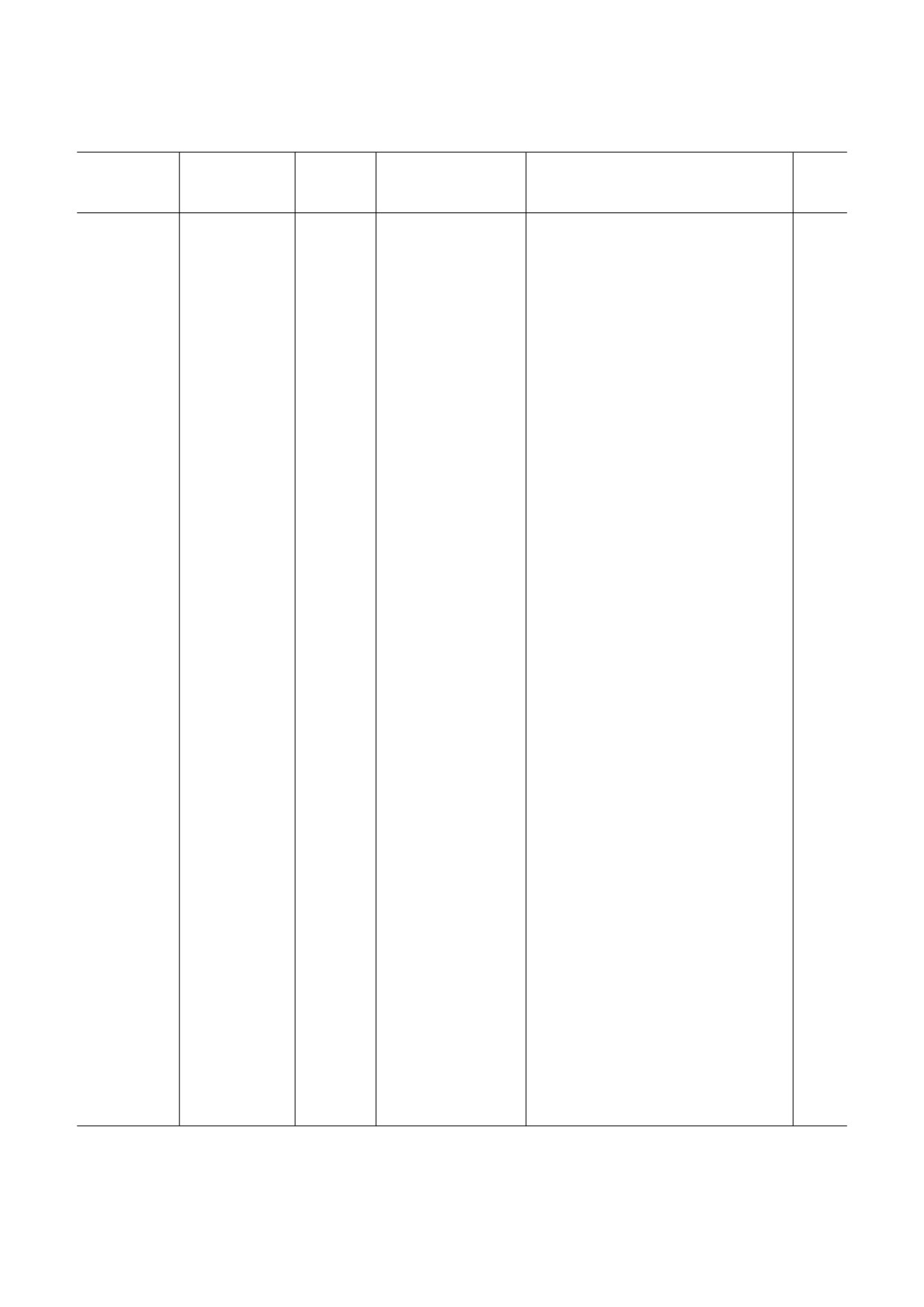
рии им легко доступны (таблица).
имплантов для предотвращения инфекций, воз!
никающих при имплантировании протезов в
ортопедии [71-73].
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
ПРЕПАРАТОВ БАКТЕРИОФАГОВ
И ИХ ПРИМЕНЕНИЕ В ПРАКТИЧЕСКОЙ
ИСПЫТАНИЯ АКТИВНОСТИ ПРЕПАРАТОВ
МЕДИЦИНЕ
БАКТЕРИОФАГОВ В ОПЫТАХ
НА ЖИВОТНЫХ
Эффективность лечения бактериофагами
обосновывается упоминаниями положительных
Возможности фаготерапии широкого спект!
результатов, описанных в литературе в середине
ра инфекционных заболеваний изучали на раз!
прошлого века, когда не было практики прове!
личных животных моделях [55, 74-77]. К сожа!
дения экспериментов с использованием плаце!
лению, почти все эти модели не соответствова!
бо и контрольных групп, а отрицательные ре!
ли реальным моделям заболеваний человека.
зультаты обычно не публиковались [74, 90-93].
Бактериемия у человека зачастую развивается
Между тем в случае лечения инфекций эффект
как вторичное поражение, возникающее на фо!
плацебо может быть велик.
не ранений, вирусных поражений или ослабле!
В последние годы интерес к фаготерапии
ния иммунной системы. При развитии инфек!
возрос, в том числе и благодаря нескольким ши!
ции бактерии выходят из начального очага по!
роко обсуждавшимся случаям излечения препа!
ражения и образуют метастатические пораже!
ратами бактериофагов больных, находившихся
ния в различных местах организма. Терапия на!
в критическом состоянии. Однако значимость
чинается, как правило, при уже развившемся
этих событий преувеличена прессой; о каждом
инфекционном процессе. Почти во всех опи!
спасенном бактериофагами пациенте были на!
санных экспериментах здоровых животных за!
писаны десятки сообщений, а о неудачных слу!
ражали большими дозировками бактерий и од!
чаях публикаций не было, поскольку для журна!
новременно или спустя недолгое время вводили
листов такие случаи не представляли интереса.
препараты бактериофагов. В такой схеме экспе!
Анализ случаев излечения тяжелых больных
римента, когда инфекция не успевала распрост!
препаратами бактериофагов показал сложности
раниться за пределы места инъекции, живот!
такого лечения и возникающие проблемы.
ные, по сути, играли роль пробирки. Результаты
Так, описан случай успешного применения
экспериментов показали, что введение бакте!
фаготерапии для лечения 68!летнего пациента,
риофагов оказывало терапевтический эффект в
страдающего диабетом и некротизирующим
том случае, если фаги вводили сразу или вскоре
панкреатитом, осложненным лекарственно!ус!
после заражения животного. При введении бак!
тойчивым штаммом A. baumannii. Антибиотико!
териофагов через несколько часов после зара!
терапия не помогала, и пациенту провели лече!
жения наблюдаемый эффект был в ряде случаев
ние бактериофагами, подобранными на основе
значительно слабее. Важным неожиданным ре!
тестирования бактерий, выделенных у самого
зультатом исследований оказалась сильная до!
пациента. Бактериофаги вводили внутривенно и
зозависимость действия препаратов бактерио!
трансдермально в абсцесс. В результате лечения
фагов. Можно было ожидать, что в организме
удалось подавить инфекцию A. baumannii и до!
инфицированных животных фаги будут быстро
биться выздоровления пациента [14].
размножаться в бактериях!хозяевах, и для дос!
Известен еще один случай излечения боль!
тижения терапевтического эффекта должны
ного, находившегося в критическом состоянии.
требоваться минимальные дозы фагов. Именно
Пятнадцатилетнему пациенту с муковисцидо!
такую возможность упоминают всегда, описы!
зом и диссеминированными микобактериаль!
вая теоретические преимущества фагов как
ными абсцессами после трансплантации легких
средств терапии. Однако в экспериментах на
был проведен курс лечения трехкомпонентным
животных хороший терапевтический результат
фаговым коктейлем. Литические фаги, эффек!
наблюдали лишь при введении высоких доз
тивно убивающие инфекционный штамм
бактериофагов, которые не применяли в изве!
Micobacterium abscessus, были разработаны мето!
стных клинических исследованиях [55, 74,
дами синтетической биологии. Исследователи
78-89].
отмечали, что внутривенное лечение фагами пе!
Основные результаты экспериментов на жи!
реносилось хорошо и сопровождалось объек!
вотных - бактериофаги безвредны для организ!
тивным клиническим улучшением, включая
ма млекопитающих; бактериофаги эффективно
закрытие раны на грудине, улучшение функции
БИОХИМИЯ том 85 вып. 11 2020
1592
ВЛАСОВ и др.
Эксперименты по применению бактериофагов в животных моделях
Модель
Инфекционный
Модельное
Способ введения
заболевания
агент
животное
бактериофага
Результат введения бактериофагов
Ссылка
Острый и
S. aureus
кролик
инъекция в область
острый остеомиелит - полное излече!
[80]
хронический
поражения
ние; хронический остеомиелит - кли!
остеомиелит
ническое улучшение, подтвержденное
гистологически
Раневая
S. aureus,
свинья,
местное применение
уменьшение бактериальной нагрузки,
[83]
инфекция
P. aeruginosa
крыса
коктейля через 4 дня,
значительное улучшение
108-109 БОЕ
Раневая
MDR
крыса
спрей, 3 × 109 БОЕ
уменьшение бактериальной нагрузки и
[84]
инфекция
A. baumannii
периода эпителизации, сокращение ра!
невой поверхности по сравнению с
контрольными животными, получав!
шими антибиотикотерапию
Диабетическая
S. aureus
мышь
инъекция коктейля
препарат бактериофагов был эффекти!
[89]
стопа
из 3!х фагов, 108-109
вен в модели диабетической раны и
БОЕ каждого фага
недиабетической раны; антибиотик был
совместно или без анти!
неэффективен в модели диабетической
биотика через 30 мин
стопы
после заражения
Ожог
K. pneumoniae
мышь
местное применение
результаты фаготерапии были лучше,
[81]
чем при применении антибиотиков и
нитрата серебра
Абсцесс
S. aureus
мышь
подкожное введение
уменьшение размера абсцесса, умень!
[78]
однократное или
шение бактериальной нагрузки на 2 по!
4 инъекции в день,
рядка (однократное введение) или 4 по!
109 БОЕ
рядка (4!х кратное введение)
Абсцесс
S. aureus
кролик
подкожное введение
отсутствие результата при введении
[88]
через 0, 5, 12 или
5 × 107 БОЕ через 5, 12 или 24 ч; умень!
24 ч, 5 × 107 БОЕ
шение размера абсцесса, уменьшение
бактериальной нагрузки при введении
5 × 109 БОЕ одновременно с заражением
Кишечная
Shigella sonnei
мышь
пероральное введе!
уменьшение бактериальной нагрузки
[82]
инфекция
ние коктейля фагов
было эффективнее по сравнению с вве!
дением ампициллина
Инфекция
Burkholderia
мышь
ингаляция через нос
уменьшение бактериальной нагрузки
[85]
легких
cepacia
Инфекция
P. aeruginosa
мышь
интраназальное вве!
при одновременном введении бактерии
[84]
легких
дение, 2,5 × 107 БОЕ
и фага - отсутствие патогена у 100%
мышей; при введении фага через 24 ч
после заражения - отсутствие патогена
у 86% мышей
Хроническая
P. aeruginosa
мышь
интраназальное вве!
отсутствие патогена у 70% мышей;
[87]
инфекция
дение в различные
уменьшение бактериальной нагрузки у
легких
сроки после зараже!
30% мышей
ния
Хронический
P. aeruginosa
собака
введение в ухо фаго!
уменьшение бактериальной нагрузки на
[79]
отит
вого коктейля (6 фа!
30-97% у разных животных
гов, 105 БОЕ каждого)
БОЕ - бляшкообразующие единицы.
БИОХИМИЯ том 85 вып. 11 2020
БАКТЕРИОФАГИ КАК ТЕРАПЕВТИЧЕСКИЕ ПРЕПАРАТЫ
1593
печени и заживление воспаленных лимфоузлов
яснили нестабильностью фагового препарата и
кожи [17].
недостаточной концентрацией фагов в препара!
В описанных случаях больные параллельно с
тах [99].
бактериофагами по этическим соображениям
В 2016-2017 гг. было проведено рандомизи!
продолжали получать антибиотики. Потребова!
рованное плацебо!контролируемое двойное
лось длительное лечение высокими дозами фа!
слепое клиническое исследование безопасности
гов. Препараты пришлось подбирать, подклю!
и влияния на микробиоту ЖКТ пребиотической
чая множество организаций, и даже конструи!
добавки «PreforPro», состоящей из четырех
ровать фаги, используя методы синтетической
бактериофагов (клиническое исследование
биологии.
№ NCT03269617, финансированное Универси!
В последние годы был проведен ряд клини!
тетом Колорадо, США). В ходе исследования
ческих испытаний препаратов бактериофагов,
были получены данные о безопасности приме!
однако не все исследования проводились в соот!
нения бактериофагов и о некоторых статисти!
ветствии с современными стандартами [94-103].
чески достоверных изменениях в микробиоме
Только часть этих исследований показала кли!
ЖКТ после приема препарата [104, 105].
ническую эффективность фаготерапии [96-98,
В 2017-2018 гг. было проведено рандомизи!
103]. К сожалению, результаты большинства
рованное плацебо!контролируемое двойное сле!
других экспериментов нельзя назвать выдающи!
пое клиническое исследование безопасности и
мися. На сегодня основным результатом прове!
эффективности лечения адаптированным пре!
денных клинических испытаний является толь!
паратом «Пиофаг» инфекций мочевыводящих
ко то, что бактериофаги действительно безопас!
путей у пациентов, перенесших трансуретраль!
ны при различных способах введения, в том
ную резекцию предстательной железы. Исследо!
числе и при внутривенном введении. Новостью
вание проводилось на базе Национального цент!
это назвать трудно, так как фаги доказали свою
ра урологии в Тбилиси, Грузия и финансирова!
безопасность в течение многих десятилетий
лось «Balgrist University Hospital», Швейцария
применения в медицине.
(клиническое исследование № NCT03140085)
Институт иммунологии и эксперименталь!
[106]. В результате была показана безопасность
ной терапии Польской академии наук (Вроцлав,
применения препарата и выявлено снижение
Польша) в 2005 г. начал клинические исследова!
титров инфекционных бактерий (от 1 до 5 log) у
ния терапии бактериальных инфекций фагами
шести из девяти пациентов [107].
(клиническое исследование № NCT00945087).
Недавно было проведено исследование в
Результаты данного исследования к настоящему
«Westmead Hospital», Австралия. Четырнадцати
времени не опубликованы.
пациентам с инфекционным эндокардитом и
В 2009 г. компания «BioContol Ltd.» сообщи!
сепсисом, вызванным Staphylococcus, внутри!
ла о положительных результатах лечения фагами
венно вводили фаговый коктейль AB!SA01,
инфекции ушей, вызванной P. aeruginosa [98].
включающий три разных бактериофага произ!
Позднее эти результаты нигде не упоминались.
водства «AmpliPhi Biosciences», США. Коктейль
Компания «Nestlé» спонсировала испытания
вводили два раза в день на протяжении двух не!
в Бангладеш фагового препарата против E. coli
дель. В результате исследователи наблюдали
для лечения диареи у детей [100-102]. Доказа!
снижение воспалительных реакций и уменьше!
тельств эффективности фаготерапии получено
ние бактериальной нагрузки
[103]. Однако
не было. Неудачу объяснили тем, что только
контрольной группы в исследовании не было.
60% пациентов имели E. coli в фекалиях, для ос!
Компания «AmpliPhi Biosciences» получила раз!
тальных пациентов препарат был бесполезен.
решение FDA на проведение испытаний внут!
Широко обсуждались клинические испыта!
ривенного фагового препарата для лечения
ния фагового коктейля, содержащего 12 бакте!
гнойных ран и кожных инфекций, вызванных
риофагов, для лечения ожоговых ран, инфици!
метициллин!устойчивыми штаммами S. aureus
рованных P. aeruginosa и E. coli, - «Phagoburn
(methicillin!resistant S. aureus, MRSA).
На сегодня фаготерапия не является разре!
Trials database, № 2014!000714!65 и Clinical Trials
шенным для широкого применения методом
gov, № NCT02116010). Обработка препаратами
терапии в США и европейских странах. Вместе
проводилась местно, ежедневно в течение семи
с тем в 2018 г. в США был открыт центр IPATH
дней. Результаты испытаний не показали эф!
(The Center for Innovative Phage Applications and
фективного терапевтического действия бакте!
Therapeutics), в котором фаготерапия исследу!
риофагов. Стандартное лечение больных суль!
ется и применяется как экспериментальный
фадиазином серебра оказалось эффективнее,
метод лечения (eIND, experimental investigation!
чем фаготерапия. Неудачу этих испытаний объ!
al new drug) в «University of California San Diego
6 БИОХИМИЯ том 85 вып. 11 2020
1594
ВЛАСОВ и др.
School of Medicine». В Польше в
«Ludwik
жен ли он содержать только конкретные бакте!
Hirszfeld Institute of Immunology and Experi!
риофаги с точно установленной структурой,
mental Therapy» применяют фаготерапию в рам!
прошедшие весь комплекс испытаний, как и
ках экспериментального лечения в соответствии
химические препараты. Или препарат может
с Хельсинкской декларацией (Article
37,
включать бактериофаги/коктейли бактериофа!
Unproven Interventions in Clinical Practice of the
гов, выделенные специально для конкретного
пациента. Какова должна быть стандартная
щей применение недоказанных методов тера!
процедура подбора препарата бактериофагов
пии для пациентов, которым не помогают офи!
для лечения конкретных пациентов, поражен!
циально одобренные препараты и методы лече!
ных определенными бактериальными штамма!
ния [108]. В соответствии с Хельсинкской дек!
ми? Какими должны быть стандартизованные
ларацией возможно проведение терапии бакте!
методы очистки бактериофага, гарантированно
риофагами и в других европейских странах, од!
обеспечивающие его стерильность и безопас!
нако бюрократический процесс для получения
ность?
разрешения на экспериментальное лечение не
Одной из важнейших задач является созда!
прост. Поэтому в настоящее время пациенты
ние платформ, позволяющих быстро идентифи!
пользуются возможностью получить лечение
цировать патогенные бактерии и определять их
бактериофагами в Грузии, в Польше, а в послед!
чувствительность к препарату бактериофага.
нее время и в США.
Пока этот процесс занимает не менее 3-5 дней,
что во многих случаях недопустимо долго, и ле!
чащему врачу легче немедленно применить ан!
ПРОБЛЕМЫ ФАГОТЕРАПИИ
тибиотик широкого спектра действия, который
с вероятностью 50% подействует на инфекцион!
Фаготерапия выглядит как идеальный пер!
ный агент.
сонализированный подход к лечению инфекци!
Именно поэтому большие надежды возлага!
онных заболеваний: принцип действия бактерио!
ют на применение методов синтетической био!
фагов доказан; в модельных системах показана
логии для получения бактериофагов с заданны!
их эффективность; описаны достоверные слу!
ми свойствами
- расширенной специфич!
чаи, когда терапия бактериофагами была успеш!
ностью, повышенной литической активностью,
ной и позволила спасти жизни людей или суще!
способностью поражать только бактерии, со!
ственно улучшить их состояние. Бактериофаги
держащие целевые генетические элементы, нап!
безопасны; они классифицированы FDA как
ример гены, определяющие лекарственную ус!
«Generally Recognized As Safe» и, следовательно,
тойчивость. Опубликован ряд работ, демонстри!
могут проходить клинические испытания в ряде
рующих возможности синтетической биологии
стран. Однако внедрение фагов в медицинскую
для получения фагов с измененными отдельны!
практику происходит крайне медленно.
ми функциями и характеристиками. Однако
Одна из причин заключается в том, что мо!
проблемы, стоящие на пути создания терапев!
лекулярные механизмы взаимоотношения бак!
тических бактериофагов, глубоки и многочис!
териофагов с бактериями и их поведение в орга!
ленны. Так, в качестве выдающегося примера
низме остаются недостаточно изученными. Фа!
дизайна высокоспецифичных бактериофагов
ги принципиально отличаются от обычных хи!
приводятся работы, в которых фаги были снаб!
миотерапевтических препаратов; они могут
жены генами, кодирующими системы геномно!
размножаться в организме пациента в зависи!
го редактирования, которые нарушают лишь за!
мости от концентрации бактерий!хозяев и из!
данные гены бактерий [109-111]. Однако снаб!
меняться (мутировать), чего не бывает с обыч!
жение фагов этим высокоточным оружием не
ными лекарствами. В связи с этим не ясна ситу!
решает проблемы создания терапевтического
ация с необходимой дозировкой фаговых препа!
препарата. Со специфичностью поражения бак!
ратов, поскольку если бактериофаг не попадет в
териальных штаммов бактериофагами проблем
соответствующую патогенную бактерию, то его
не было никогда. Наоборот, проблемой является
терапевтический эффект буден сведен к нулю.
узкая специфичность бактериофагов.
Не вполне изучена фармакокинетика и фарма!
Помимо проблем, связанных с необходи!
кодинамика бактериофагов. Еще предстоит раз!
мостью глубоких исследований бактериофагов,
работать оптимальные лекарственные формы
на пути широкого внедрения фаготерапии су!
препаратов на основе бактериофагов для приме!
ществует ряд экономических и бюрократичес!
нения при различных типах инфекций.
ких барьеров.
Не решен практический вопрос о том, ка!
Интерес фарминдустрии к бактериофагам
ким должен быть одобренный препарат. Дол!
ограничен в связи с проблемами защиты интел!
БИОХИМИЯ том 85 вып. 11 2020
БАКТЕРИОФАГИ КАК ТЕРАПЕВТИЧЕСКИЕ ПРЕПАРАТЫ
1595
лектуальной собственности. Кроме того, из!за
также не может пройти сквозь существующие
узкой специфичности фаговых препаратов и
регулирующие барьеры.
возникновения к ним устойчивости у бактерий
Можно отметить, что имеется пример ус!
зачастую невозможно долгое время применять
пешного применения упрощенных правил
неизмененный стандартный препарат фага. Ча!
одобрения препаратов. Речь идет о производ!
ще всего бактериофаги требуются для примене!
стве противогриппозных вакцин, которые тре!
ния в критических случаях для относительно уз!
буют регулярной модификации.
кого круга больных там, где бессильными оказа!
В сложившейся ситуации в ряде стран
лись все виды антибиотиков. По оценкам спе!
предпринимаются попытки разработать специ!
циалистов, таких случаев в США лишь несколь!
альные правила для препаратов на основе бакте!
ко тысяч в год. Поэтому производство фаговых
риофагов. В Бельгии внедряется подход, осно!
препаратов для фармацевтических компаний
ванный на применении бактериофагов как ма!
экономически не выгодно.
гистральных препаратов [112], которые фарма!
Принципиальная проблема на пути развития
цевты могут составлять по рецепту лечащих вра!
фаготерапии состоит в том, что в большинстве
чей для конкретных пациентов из стандартных
стран разрешительные органы предъявляют к
бактериофагов. В таких препаратах бактериофа!
бактериофагам те же требования, что применя!
ги должны соответствовать требованиям фарма!
ются к препаратам на основе химических соеди!
копеи. Однако, кроме стандартных бактериофа!
нений. Бактериофаги, не являющиеся вещест!
гов, в составе магистральных препаратов могут
вами со строго фиксированной неизменной
применяться не авторизованные бактериофаги,
структурой, в принципе не могут соответство!
получившие сертификат анализа в лаборатори!
вать этим требованиям. Кроме того, бактерио!
ях, аккредитованных в Бельгийских регулирую!
фаги, хотя и не заражают клетки человека, явля!
щих органах. Магистральные препараты бакте!
ются вирусами. Само это слово зачастую напря!
риофагов могут использоваться для лечения
гает медицинских и не медицинских чиновни!
конкретных пациентов, и ответственность за их
ков. При обсуждении возможности использова!
применение лежит на лечащем враче и/или фар!
ния бактериофагов как терапевтических препа!
мацевте. В Грузии персонализированные фаго!
ратов выдвигаются надуманные проблемы, оп!
вые препараты также могут изготовляться как
ровергнутые многолетним применением бакте!
магистральные в аккредитованных аптеках, по!
риофагов в клинике. Повторяются опасения о
лучивших лицензии от Министерства здравоох!
возможности переноса бактериофагами фраг!
ранения Грузии.
ментов генетического материала между бакте!
В Российской Федерации, лидировавшей в
риями, хотя организм человека содержит огром!
производстве и применении бактериофагов, в
ное множество разных бактериофагов, и добав!
настоящее время только препараты бактериофа!
ление еще одного родственного бактериофага
гов, производимые ФГУП НПО «Микроген»,
не может создать никаких дополнительных
распространяются через аптечную сеть и приме!
проблем. Тем более что для лечения пациентов
няются как фармако!терапевтические медицин!
не используют бактериофаги, имеющие систе!
ские иммунобиологические препараты, соглас!
мы переноса генетических элементов.
но Государственному реестру Министерства
В какой!то степени соответствовать стандарт!
здравоохранения РФ. Препараты других произ!
ным подходам регуляторов могут препараты
водителей не являются лекарственными сред!
фиксированного состава - коктейли из опреде!
ствами. Фаготерапия в РФ не развивается, пос!
ленных детально изученных бактериофагов. Од!
кольку в стране не разрешено применение пер!
нако такие препараты недостаточно гибки для
сонализированных методов фаготерапии, а пре!
того, чтобы обеспечивать воздействие на посто!
параты бактериофагов производства ФГУП
янно мутирующие штаммы бактерий. В
НПО «Микроген» не входят в «Перечень жиз!
действительности, в процессе производства
ненно необходимых и важнейших лекарствен!
препаратов композиция входящих в их состав
ных препаратов для медицинского примене!
бактериофагов может изменяться, обеспечивая
ния». Кроме того, стандартные препараты, вы!
«адаптацию» препарата к вновь появившимся
пускаемые российскими компаниями, не позво!
штаммам инфекционных агентов. Недавние ус!
ляют реализовать главное преимущество фаго!
пехи в лечении терминальных пациентов фаго!
терапии - персонализированный подход.
выми препаратами показали, что успешная те!
Очевидно, что бюрократические барьеры
рапия была достигнута лишь при использова!
должны быть устранены в интересах пациентов.
нии персонализированных коктейлей фагов и
Бактериофаги не представляют опасностей для
даже подбора или конструирования специаль!
человека, что доказано их столетним примене!
ных фагов [14, 17]. Такой вариант фаготерапии
нием в медицине.
БИОХИМИЯ том 85 вып. 11 2020
6*
1596
ВЛАСОВ и др.
ЗАКЛЮЧЕНИЕ
гов в организме; разработать способы конструи!
рования бактериофагов с заданными свойства!
Фаготерапия - это, очевидно, перспектив!
ми с помощью методов синтетической биологии
ный подход для лечения бактериальных инфек!
и создать технологии получения стабильных
ций. Ее возможности наиболее ярко были про!
препаратов бактериофагов и средств их достав!
демонстрированы при персонализированном
ки. Требуется проведение полноценных клини!
применении, когда для конкретных пациентов,
ческих испытаний для выяснения вопросов,
которым не помогла антибиотикотерапия, под!
связанных с изучением дозировок, способов
бирались специальные коктейли бактериофа!
введения и возможных схем терапевтического
гов.
применения препаратов бактериофагов.
Бактериофаги не смогут стать заменой анти!
Необходимо организовать широкое между!
биотиков, которые дешевы, обладают широкой
народное сотрудничество с целью создания ус!
специфичностью, оказываются эффективными
ловий, позволяющих быстро получать бактерио!
в большом количестве случаев и поэтому оста!
фаги, которые необходимы для лечения конк!
нутся препаратами первого выбора для лечения
ретных пациентов.
инфекционных заболеваний. Однако фаги поз!
Существующие подходы к регистрации те!
воляют справляться с тяжелыми инфекциями,
рапевтических препаратов не применимы к
не поддающимися терапии антибиотиками, и
препаратам бактериофагов и полностью закры!
открывают возможность персонализированной
вают дорогу к развитию фаготерапии, которая
терапии пациентов, позволяющей щадящим об!
наиболее успешно может быть реализована в
разом воздействовать на их микрофлору. Фаго!
варианте персонализированной терапии, пре!
терапия не cможет полностью решить проблему
дусматривающей подбор бактериофагов для ле!
антибиотикоустойчивых инфекционных аген!
чения конкретного пациента, зараженного оп!
тов. Наиболее перспективные приложения фа!
ределенными бактериями. Для успешного раз!
готерапии связаны с лечением инфекционных
вития фаготерапии, как и для других видов те!
поражений, не поддающихся антибиотикотера!
рапии, основанных на применении вирусов,
пии, при которых наиболее адекватным будет
клеток и клеточных продуктов, должны быть
местное применение. Кроме того, фаготерапия
созданы новые принципы разрешительных
будет полезна в тех случаях, когда антибиотики
процедур.
вследствие широты их действия могут нарушить
микробиоту или негативно повлиять на и без то!
го ослабленный организм пациента с тяжелым
Финансирование. Работа была поддержана
заболеванием. Фаги могут успешно применять!
Российским фондом фундаментальных иссле!
ся в тех местах, куда их легко доставить и откуда
дований (грант № 18!29!08015).
они не будут быстро выводиться.
Конфликт интересов. Авторы обзора заявля!
Для создания эффективных препаратов на
ют об отсутствии конфликта интересов в фи!
основе бактериофагов и разработки технологий
нансовой или какой!либо иной сфере.
лечения требуется проведение фундаменталь!
Соблюдение этических норм. Настоящая
ных исследований. Необходимо детально изу!
статья не содержит описания выполненных ав!
чить механизмы ко!эволюции фагов и бакте!
торами исследований с участием людей или ис!
рий, фармакодинамику и фармакокинетику фа!
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Д’Эррель Ф. (1935) Бактериофаг и феномен выздоров*
6.
Сапир И. Б. (1939) Наблюдения и замечания по поводу
ления, Издательство Тифлисского государственного
лечения дизентерии бактериофагом, Издательство
университета, Тифлис.
Московского областного института инфекционных
2.
Chanishvili, N. (2012) Phage therapy - history from Twort
болезней, Москва.
and d’Herelle through soviet experience to current
7.
Беликова М. А. (1941) Опыт фагопрофилактики ди!
approaches, Adv. Virus Res., 83, 4!40.
зентерии детей раннего возраста в Сталинграде,
3.
Покровска М. П., Каганова Л. С., Морозенко М. А.,
Ж. Микробиол. Эпидемиол. Иммунол., 5!6, 168!183.
Булгакова А. Г., Скаценко Е. Е. (1941) Лечение ран бак*
8.
Ермольева З. В. (1942) Холера, Медгиз, Москва.
териофагами, Медгиз, Москва, Ленинград.
9.
Жуков!Вережников Н. Н., Пермитина Л. Д., Берилло
4.
Цулукидзе А. П. (1941) К методике применения бакте!
Э. А., Комиссаров В. П., Бардымов В. М., Хволес А. Г.,
риофага в хирургической практике, Вестник хирургии,
Угрюмов Л. Б. (1978) Изучение терапевтического эф!
6, 679!685.
фекта препаратов бактериофага в комплексном лече!
5.
Кокин Г. А. (1941) Применение бактериофагов в хи!
нии гнойных хирургических заболеваний, Советская
рургии, Советская медицина, 9, 15!18.
медицина, 12, 64!66.
БИОХИМИЯ том 85 вып. 11 2020
БАКТЕРИОФАГИ КАК ТЕРАПЕВТИЧЕСКИЕ ПРЕПАРАТЫ
1597
10.
Кочеткова В. А., Мамонтов А. С., Московцева Р. Л.,
biofilms, Antibiotics (Basel),
8,
103, doi:
10.3390/
Ерастова Е. И., Трофимов Е. И., Попов М. И., Джуба!
antibiotics8030103.
лиева С. К. (1989) Фаготерапия послеоперационных
25.
Lin, Y., Chang, R., Britton, W. J., Morales, S., Kutter, E.,
гнойно!воспалительных осложнений у онкологичес!
and Chan, H. K. (2018) Synergy of nebulized phage
ких больных, Советская медицина, 6, 23!26.
PEV20 and ciprofloxacin combination against
11.
Брюсов П. Г., Зубрицкий В. Ф., Исламов Р. Н., Низо!
Pseudomonas aeruginosa, Int. J. Pharm., 551, 158!165,
вой А. В., Фоминых В. М. (2011) Фагопрофилактика и
doi: 10.1016/j.ijpharm.2018.09.024.
фаготерапия хирургических инфекций, Военно*меди*
26.
Samson, J. E., Magadán, A. H., Sabri, M., and Moineau, S.
цинский журнал, 4, 34!39.
(2013) Revenge of the phages: defeating bacterial defences,
12.
Хайруллин И. Н., Поздеев О. К., Шаймарданов Р. Ш.
Nat. Rev. Microbiol.,
11,
675!687, doi:
10.1038/
(2002) Эффективность применения специфических
nrmicro3096.
бактериофагов в лечении и профилактике хирурги!
27.
Basu, S., Agarwal, M., Bhartiya, S. K., Nath, G., and
ческих и послеоперационных инфекций, Казанский
Shukla, V. (2015) An in vivo wound model utilizing bacte!
медицинский журнал, 83, 258!261.
riophage therapy of Pseudomonas aeruginosa biofilms,
13.
Morozova, V. V., Kozlova, Y. N., Ganichev, D. A., and
Ostomy Wound Manage., 61, 16-23.
Tikunova, N. V. (2018) Bacteriophage treatment of infect!
28.
Fong, S. A., Drilling, A., Morales, S., Cornet, M. E.,
ed diabetic foot ulcers, Methods Mol. Biol., 1693, 151!158,
Woodworth, B. A., Fokkens, W. J., Psaltis, A. J., Vreugde, S.,
doi: 10.1007/978!1!4939!7395!8_13.
and Wormald, P. J. (2017) Activity of bacteriophages in
14.
Schooley, R. T., Biswas, B., Gill, J. J., Hernandez!
removing biofilms of Pseudomonas aeruginosa isolates from
Morales, A., Lancaster, J., et al. (2017) Development and
chronic rhinosinusitis patients, Front. Cell. Infect.
use of personalized bacteriophage!based therapeutic cock!
Microbiol., 7, 418, doi: 10.3389/fcimb.2017.00418.
tails to treat a patient with a disseminated resistant
29.
Chan, B. K., Abedon, S. T., and Loc!Carrillo, C. (2013)
Acinetobacter baumannii infection, Antimicrob. Agents
Phage cocktails and the future of phage therapy, Future
Chemother., 61, e00954!17. doi: 10.1128/AAC.00954!17.
Microbiol., 8, 769!783, doi: 10.2217/fmb.13.47.
15.
Chan, B. K., Turner, P. E., Kim, S., Mojibian, H. R.,
30.
Yuan, Y., Wang, L., Li, X., Tan, D., Cong, C., and Xu, Y.
Elefteriades, J. A., and Narayan, D. (2018) Phage treat!
(2019) Efficacy of a phage cocktail in controlling phage
ment of an aortic graft infected with Pseudomonas aerugi*
resistance development in multidrug resistant Acinetobacter
nosa, Evol. Med. Public Health., 1, 60!66, doi: 10.1093/
baumannii, Virus Res., 272, 197734, doi: 10.1016/j.virusres.
emph/eoy005.
2019.197734.
16.
Onsea, J., Soentjens, P., Djebara, S., Merabishvili, M.,
31.
Górski, A., Mi dzybrodzki, R., Łobocka, M., Głowacka
Depypere, M., et al. (2019) Bacteriophage application for
Rutkowska, A., Bednarek, A., et al. (2018) Phage therapy:
difficult!to!treat musculoskeletal infections: development
what have we learned? Viruses, 10, 288, doi: 10.3390/
of a standardized multidisciplinary treatment protocol,
v10060288.
Viruses., 11, 891, doi: 10.3390/v11100891.
32.
Łusiak Szelachowska, M., Zaczek, M., and Weber
17.
Dedrick, R. M., Guerrero!Bustamante, C. A., Garlena, R. A.,
D browska, B. (2014) Phage neutralization by sera of
Russell, D. A., Ford, K., et al. (2019) Engineered bacterio!
patients receiving phage therapy, Viral Immunol., 27, 295!
phages for treatment of a patient with a disseminated drug!
304, doi: 10.1089/vim.2013.0128.
resistant Mycobacterium abscessus, Nat. Med., 25, 730!733,
33.
Majewska, J., Beta, W., Lecion, D., Hodyra!Stefaniak, K.,
doi: 10.1038/s41591!019!0437!z.
Kłopot, A., et al. (2015) Oral application of T4 phage
18.
Dutilh, B. E., Cassman, N., McNair, K., Sanchez, S. E.,
induces weak antibody production in the gut and in the
Silva, G. G., et al. (2014) A highly abundant bacteriophage
blood, Viruses, 7, 4783!99, doi: 10.3390/v7082845.
discovered in the unknown sequences of human faecal
34.
Hodyra!Stefaniak, K., Miernikiewicz, P., Drapała, J.,
metagenomes, Nat. Commun., 5, 4498, doi: 10.1038/
Drab, M., Jończyk Matysiak, E. J., et al.
(2015)
ncomms5498.
Mammalian host!versus!phage immune response deter!
19.
Sausset, R., Petit, M. A., Gaboriau!Routhiau, V., and De
mines phage fate in vivo, Sci. Rep.,
5,
14802,
Paepe, M. (2020) New insights into intestinal phages,
doi: 10.1038/srep14802.
Mucosal Immunol., 13, 205!215, doi: 10.1038/s41385!019!
35.
Górski, A., Mi dzybrodzki, R., Borysowski, J., D brows
0250!5.
ka, K., Wierzbicki, P., et al. (2012) Phage as a modulator of
20.
Górski, A., Wazna, E., D browska, B. W., D browska, K.,
immune responses: practical implications for phage thera!
Switała Jeleń, K., and Miedzybrodzki, R.
(2006)
py, Adv. Virus Res., 83, 41!71, doi: 10.1016/B978!0!12!
Bacteriophage translocation, FEMS Immunol. Med.
394438!2.00002!5.
Microbiol.,
46,
313!319, doi:
10.1111/j.1574!
36.
Górski, A., Mi dzybrodzki, R., Jończyk Matysiak, E.,
695X.2006.00044.x.
Żaczek, M., and Borysowski, J. (2019) Phage!specific
21.
Nguyen, S., Baker, K., Padman, B. S., Patwa, R., Dunstan,
diverse effects of bacterial viruses on the immune system,
R. A., et al. (2017) Bacteriophage transcytosis provides a
Future Microbiol., 14, 1171!1174, doi: 10.2217/fmb!2019!
mechanism to cross epithelial cell layers, mBio., 8, e01874!
0222.
17, doi: 10.1128/mBio.01874!17.
37.
Sinha, A., and Maurice, C. F. (2019) Bacteriophages:
22.
Fish, R., Kutter, E., Bryan, D., Wheat, G., and Kuhl, S.
uncharacterized and dynamic regulators of the immune
(2018) Resolving digital Staphylococcal osteomyelitis
system,
Mediators
Inflamm.,
2019,
3730519,
using bacteriophage - a case report, Antibiotics (Basel), 7,
doi: 10.1155/2019/3730519.
87, doi: 10.3390/antibiotics7040087.
38.
Van Belleghem, J. D., D browska, K., Vaneechoutte, M.,
23.
Huh, H., Wong, S., St Jean, J., and Slavcev, R. (2019)
Barr, J., and Bollyky, P. (2018) Interactions between bacte!
Bacteriophage interactions with mammalian tissue: thera!
riophage, bacteria, and the mammalian immune system,
peutic applications, Adv. Drug Deliv. Rev., 145, 4!17,
Viruses, 11, 10, doi: 10.3390/v11010010.
doi: 10.1016/j.addr.2019.01.003.
39.
D browska, K., Miernikiewicz, P., Piotrowicz, A.,
24.
Akturk, E., Oliveira, H., Santos, S. B., Costa, S.,
Hodyra, K., Owczarek, B., Lecion, D., Kaźmierczak, Z.,
Kuyumcu, S., Melo, L. D. R., and Azeredo, J. (2019)
Letarov, A., and Górski, A. (2014) Immunogenicity studies
Synergistic action of phage and antibiotics: parameters to
of proteins forming the T4 phage head surface, J. Virol., 88,
enhance the killing efficacy against mono and dual!species
12551!12557, doi: 10.1128/JVI.02043!14.
БИОХИМИЯ том 85 вып. 11 2020
1598
ВЛАСОВ и др.
40.
Zaczek, M., Łusiak Szelachowska, M., Jończyk
55.
Chang, R. Y. K., Wallinb, M., Lina, Y., Leung, S. S. Y.,
Matysiak, E., Weber D browska, B., Miedzybrodzki, R.,
Wang, Y., Morales, S., and Chan, H.!K. (2018) Phage
et al. (2016) Antibody production in response to staphylo!
therapy for respiratory infections, Adv. Drug Deliv. Rev.,
coccal MS!1 phage cocktail in patients undergoing phage
133, 76!86, doi: 10.1016/j.addr.2018.08.001.
therapy, Front. Microbiol., 7, 1!14, doi: 10.3389/fmicb.
56.
Otero, J., Garc a Rodr guez, A., Cano Sarabia, M.,
2016.01681.
Maspoch, D., Marcos, R., Cortés, P., and Llagostera, M.
41.
D browska, K. (2019) Phage therapy: what factors shape
(2019) Biodistribution of liposome!encapsulated bacterio!
phagepharmacokinetics and bioavailability? Systematic
phages and their transcytosis during oral phage therapy,
and critical review, Med. Res. Rev., 1, 1!26, doi: 10.1002/
Front. Microbiol., 10, 689, doi: 10.3389/fmicb.2019.
med.21572.
00689.
42.
Bochkareva, S. S., Aleshkin, A. V., Ershova, O. N.,
57.
Singla, S., Harjai, K., Katare, O. P., and Chhibber, S.
Novikova, L. I., Karaulov, A. V., et al. (2017) Anti!phage
(2016) Encapsulation of bacteriophage in liposome accen!
antibody response in phage therapy against healthcare!
tuates its entry in to macrophage and shields it from neu!
associated infections (HAIs), Infectious diseases, 15, 35!40,
tralizing antibodies, PLoS One,
11, e0153777,
doi: 10.20953/1729!9225!2017!1!35!40.
doi: 10.1371/journal.pone.0153777.
43.
Weber!D browska, B., Zimecki, M., and Mulczyk, M.
58.
Kim, K. P., Cha, J. D., Jang, E. H., Klumpp, J., Hagens, S.,
(2000) Effective phage therapy is associated with normal!
Hardt, W.!D., Lee, K.!J., Loessner, M. J.
(2008)
ization of cytokine production by blood cell cultures, Arch.
PEGylation of bacteriophages increases blood circulation
Immunol. Ther. Exp. (Warsz), 48, 31!37.
time and reduces T!helper type 1 immune response,
44.
Roach, D. R., Chollet!Mmartin, S., Noël, B., and
Microb. Biotechnol., 1, 247!257, doi: 10.1111/j.1751!
Granger, V., Debarbieux, L., and de Chaisemartin, L.
7915.2008.00028.x.
(2019) Human neutrophil response to Pseudomonas bacte!
59.
Rita Costa, A., Milho, C., Azeredo, J., and Pires, D. P.
riophages, bioRxiv, 1!10, doi: 10.1101/786905.
(2018) Synthetic biology to engineer bacteriophage
45.
Roach, D. R., Leung, C. Y., Henry, M., Morello, E.,
genomes, Methods Mol. Biol.,
1693,
285!300,
Singh, D., Di Santo, J. P., Weitz, J. S., and Debarbieux, L.
doi: 10.1007/978!1!4939!7395!8_21.
(2017) Synergy between the host immune system and bac!
60.
Pires, D. P., Cleto, S., Sillankorva, S., Azeredo, J., and Lu,
teriophage is essential for successful phage therapy against
T. K. (2016) Genetically engineered phages: a review of
an acute respiratory pathogen, Cell Host Microbe, 22, 38!
advances over the last decade, Microbiol. Mol. Biol. Rev.,
47.e4, doi: 10.1016/j.chom.2017.06.018.
80, 523!543, doi: 10.1128/MMBR.00069!15.
46.
Dickey, J., and Perrot, V. (2019) Adjunct phage treatment
61.
Ando, H., Lemire, S., Pires, D. P., and Lu, T. K. (2015)
enhances the effectiveness of low antibiotic concentration
Engineering modular viral scaffolds for targeted bacterial
against Staphylococcus aureus biofilms in vitro, PLoS One,
population editing, Cell Syst., 1, 187!196, doi: 10.1016/
14, e0209390, doi: 10.1371/journal.pone.0209390.
j.cels.2015.08.013.
47.
Rodriguez!Gonzalez, R. A., Leung, C. Y., Chan, B. K.,
62.
Lu, T. K., and Koeris, M. S. (2011) The next generation of
Turner, P. E., and Weitz, J. S. (2020) Quantitative models
bacteriophage therapy, Curr. Opin. Microbiol., 14, 524!531,
of phage!antibiotic combination therapy, mSystems, 5,
doi: 10.1016/j.mib.2011.07.028.
e00756!19, doi: 10.1128/mSystems.00756!19.
63.
Kilcher, S., Studer, P., Muessner, C., Klumpp, J., and
48.
Poglazov, B. F. (1973) Morphogenesis of T*even bacterio*
Loessner, M. J. (2018) Cross!genus rebooting of custom!
phages, Karger Publishers.
made, synthetic bacteriophage genomes in L!form bacte!
49.
Летаров А. В. (2019) Современные концепции биологии
ria, Proc. Natl. Acad. Sci. USA,
115,
567!572,
бактериофагов, ДеЛи, Москва.
doi: 10.1073/pnas.1714658115.
50.
Тикунова Н. В., Ворошилова Н. Н., Полыгач О. А.,
64.
Lu, T. K., and Collins, J. J. (2007) Dispersing biofilms with
Морозова В. В., Тикунов А. Ю., Курильщиков А. М.,
engineered enzymatic bacteriophage, Proc. Natl. Acad. Sci.
Власов В. В. (2016) Генетическая характеристика и
USA, 104, 11197!11202, doi: 10.1073/pnas.0704624104.
спектр антибактериальной активности бактериофа!
65.
Cobb, L. H., Park, J., Swanson, E. A., Beard, M. C.,
гов, входящих в состав промышленных серий лекар!
McCabe, E. M., Rourke, A. S., Seo, K. S., Olivier, A. K.,
ственного препарата Пиобактериофаг поливалентный
and Priddy, L. B. (2019) CRISPR!Cas9 modified bacterio!
очищенный, Эпидемиология и Вакцинопрофилактика,
phage for treatment of Staphylococcus aureus induced
15, 93!100, doi: 10.31631/2073!3046!2016!15!2!93!100.
osteomyelitis and soft tissue infection, PLoS One, 14,
51.
Полыгач О. А., Ворошилова Н. Н., Тикунова Н. В.,
e0220421, doi: 10.1371/journal.pone.0220421.
Морозова В. В., Тикунов А. Ю., Крылов В. Н., Юнусо!
66.
Yehl, K., Lemire, S., Yang, A. C., Ando, H., Mimee, M.,
ва А. А., Дабижева А. Н. (2018) Современные подходы
Der Torossian Torres, M.,de la Fuente!Nunez, C.,and Lu, T. K.
к способам создания фаговой основы лечебно!профи!
(2019) Engineering phage host!range and suppressing bac!
лактического препарата бактериофагов Pseudomonas
terial resistance through phage tail fiber mutagenesis, Cell,
aeruginosa, Эпидемиология и Вакцинопрофилактика, 2,
179, 459!469, doi: 10.1016/j.cell.2019.09.015.
37!45, doi: 10.24411/2073!3046!2018!10004.
67.
Barr, J. J. (2017) A bacteriophages journey through the
52.
Malik, D. J., Sokolov, I. J., Vinner, G. K., Mancuso, F.,
human body, Immunol. Rev., 279, 106!122, doi: 10.1111/
Cinquerrui, S., et al. (2017) Formulation, stabilisation and
imr.12565.
encapsulation of bacteriophage for phage therapy, Adv.
68.
Cooper, C. J., Denyer, S. P., and Maillard, J. Y. (2014)
Colloid Interface Sci., 249, 100!133, doi: 10.1016/j.cis.
Stability and purity of a bacteriophage cocktail preparation
2017.05.014.
for nebulizer delivery, Lett. Appl. Microbiol., 58, 118!122,
53.
Manohar, P., and Ramesh, N. (2019) Improved lyophiliza!
doi: 10.1111/lam.12161.
tion conditions for long!term storage of bacteriophages,
69.
Carrigy, N. B., Chang, R.Y., Leungm, S. S. Y., Harrison, M.,
Sci. Rep., 9, 15242, doi: 10.1038/s41598!019!51742!4.
Petrova, Z., et al. (2017) Anti!tuberculosis bacteriophage
54.
Chadha, P., Katare, O. P., and Chhibber, S.
(2017)
D29 delivery with a vibrating mesh nebulizer, jet nebulizer,
Liposome loaded phage cocktail: Enhanced therapeutic
and soft mist inhaler, Pharm. Res., 34, 2084!2096,
potential in resolving Klebsiella pneumoniae mediated burn
doi: 10.1007/s11095!017!2213!4.
wound infections, Burns, 43, 1532!1543, doi: 10.1016/
70.
Astudillo, A., Leung, S. S. Y., Kutter, E., Morales, S., and
j.burns.2017.03.029.
Chan, H. K. (2018) Nebulization effects on structural sta!
БИОХИМИЯ том 85 вып. 11 2020
БАКТЕРИОФАГИ КАК ТЕРАПЕВТИЧЕСКИЕ ПРЕПАРАТЫ
1599
bility of bacteriophage PEV 44, Eur. J. Pharm. Biopharm.,
84.
Pabary, R., Singh, C., Morales, S., Bush, A., Alshafi, K., et
125, 124!130, doi: 10.1016/j.ejpb.2018.01.010.
al. (2016) Antipseudomonal bacteriophage reduces infec!
71.
Самохин А. Г., Козлова Ю. Н., Корнеев Д. В., Таранов
tive burden and inflammatory response in murine lung,
О. С., Фёдоров Е. А., Павлов В. В., Морозова В. В.,
Antimicrob. Agents Chemother., 60, 744!751.
Тикунова Н. В. (2018) Экспериментальное исследова!
85.
Semler, D. D., Goudie, A. D., Finlay, W. H., and Dennis,
ние антибактериальной активности литического ста!
J. J. (2014) Aerosol phage therapy efficacy in Burkholderia
филококкового бактериофага ph20 и литического бак!
cepacia complex respiratory infections, Antimicrob. Agents
териофага синегнойной палочки ph57 при моделиро!
Chemother., 58, 4005!4013.
вании их импрегнации в ортопедические полимерные
86.
Shivaswamy, V. C., Kalasuramath, S. B., Sadanand, C. K.,
конструкции из полиметилметакрилата (костного це!
Basavaraju, A. K., Ginnavaram, V., Bille, S., Ukken, S. S.,
мента), Вестник РАМН, 73, 59!68, doi: 10.15690/
and Pushparaj, U. N. (2015) Ability of bacteriophage in
vramn905.
resolving wound infection caused by multidrug!resistant
72.
Алешкин А. В., Зулькарнеев Э. Р., Киселева И. А.,
Acinetobacter baumannii in uncontrolled diabetic rats,
Емельяненко К. А., Емельяненко А. М., Бойнович Л. Б.
Microb. Drug Resist., 21, 171!177.
(2018) Опыт использования органо!неорганических
87.
Waters, E. M., Neill, D. R., Kaman, B., Sahota, J. S.,
гибридных покрытий с сорбированными бактериофа!
Clokie, M. R., Winstanley, C., and Kadioglu, A. (2017)
гами для снижения риска развития STEC!инфекций,
Phage therapy is highly effective against chronic lung infec!
Бюллетень экспериментальной биологии и медицины,
tions with Pseudomonas aeruginosa, Thorax, 72, 666!667.
165, 473!476.
88.
Wills, Q. F., Kerrigan, C., and Soothill, J. S.
(2005)
73.
Morris, J., Kelly, N., Elliott, L., Grant, A., Wilkinson, M.,
Experimental bacteriophage
protection
against
Hazratwala, K., and McEwen, P. (2019) Evaluation of bac!
Staphylococcus aureus abscesses in a rabbit model,
teriophage anti!biofilm activity for potential control of
Antimicrob. Agents Chemother., 49, 1220!1221.
orthopedic implant!related infections caused by
89.
Albac, S., Medina, M., Labrousse, D., Hayez, D., Bonnot,
Staphylococcus aureus, Surg. Infect. (Larchmt), 20, 16!24,
D., et al. (2020) Efficacy of bacteriophages in a Staphylo*
doi: 10.1089/sur.2018.135.
coccus aureus nondiabetic or diabetic foot infection murine
74.
Gelman, D., Eisenkraft, A., Chanishvili, N., Nachman, D.,
model, Antimicrob. Agents Chemother., 64, e01870!19,
Glazer, C. S., and Hazan, R. (2018) The history and
doi: 10.1128/AAC.01870!19.
promising future of phage therapy in the military service, J.
90.
Morozova, V. V., Vlassov, V. V., and Tikunova, N. V. (2018)
Trauma Acute Care Surg., 85, S18!S26, doi: 10.1097/
Applications of bacteriophages in the treatment of local!
TA.0000000000001809.
ized infections in humans, Front. Microbiol., 9, 1696,
75.
Kortright, K. E., Chan, B. K., Koff, J. L., and Turner, P. E.
doi: 10.3389/fmicb.2018.01696.
(2019) Phage therapy: a renewed approach to combat
91.
Sulakvelidze, A., Alavidze, Z., and Morris, J. G. (2001)
antibiotic!resistant bacteria, Cell Host Microbe, 25, 219!
Bacteriophage therapy, Antimicrob. Agents Chemother., 45,
232, doi: 10.1016/j.chom.2019.01.014.
649!659, doi: 10.1128/AAC.45.3.649!659.2001.
76.
Abedon, S. T. (2019) Use of phage therapy to treat long!
92.
Chanishvili, N. (2009) A literature review of the practical
standing, persistent, or chronic bacterial infections, Adv.
application of bacteriophage research, Nova Science
Drug Deliv. Rev., 145, 18!39, doi: 10.1016/j.addr.2018.06.
Publishers, New York.
018.
93.
Chanishvili, N. (2016) Bacteriophages as therapeutic and
77.
Principi, N., Silvestri, E., and Esposito, S.
(2019)
prophylactic means: summary of the soviet and post!soviet
Advantages and limitations of bacteriophages for the treat!
experiences, Curr. Drug Deliv., 13, 309!323, doi: 10.2174/
ment of bacterial infections, Front. Pharmacol., 10, 513,
156720181303160520193946.
doi: 10.3389/fphar.2019.00513.
94.
Schmidt, C. (2019) Phage therapy’s latest makeover, Nat.
78.
Capparelli, R., Parlato, M., Borriello, G., Salvatore, P.,
Biotechnol., 37, 58!586, doi: 10.1038/s41587!019!0133!z.
and Iannelli, D. (2007) Experimental phage therapy
95.
Altamirano, F., and Barr, J. (2019) Phage therapy in the
against Staphylococcus aureus in mice, Antimicrob. Agents
postantibiotic era, Clin. Microbiol. Rev., 32, e00066!18,
Chemother., 51, 2765!2773.
doi: 10.1128/CMR.00066!18.
79.
Hawkins, C., Harper, D., Burch, D., Anggard, E., and
96.
Rhoads, D. D., Wolcott, R. D., Kuskowski, M. A.,
Soothill, J. (2010) Topical treatment of Pseudomonas
Wolcott, B. M., Ward, L. S., and Sulakvelidze, A. (2009)
aeruginosa otitis of dogs with a bacteriophage mixture: a
Bacteriophage therapy of venous leg ulcers in humans:
before/after clinical trial, Vet. Microbiol., 145, 309!313.
results of a phase I safety trial, J. Wound Care, 18, 240!243.
80.
Kishor, C., Mishra, R. R., Saraf, S. K., Kumar, M.,
97.
Markoishvili, K., Tsitlanadze, G., Katsarava, R., Morris, J. G.,
Srivastav, A. K., and Nath, G. (2016) Phage therapy of
and Sulakvelidze, A. (2002) A novel sustained!release
staphylococcal chronic osteomyelitis in experimental ani!
matrix based on biodegradable poly(ester amide)s and
mal model, Indian J. Med. Res., 143, 87!94.
impregnated with bacteriophages and an antibiotic shows
81.
Kumari, S., Harjai, K., and Chhibber, S.
(2011)
promise in management of infected venous stasis ulcers and
Bacteriophage versus antimicrobial agents for the treat!
other poorly healing wounds, Int. J. Dermatol., 41, 453!
ment of murine burn wound infection caused by Klebsiella
458, doi: 10.1046/j.1365!4362.2002.01451.x.
pneumoniae B5055, J. Med. Microbiol., 60, 205!210.
98.
Wright, A., Hawkins, C. H., Anggård, E. E., and Harper,
82.
Mai, V., Ukhanova, M., Reinhard, M. K., Li, M., and
D. R. (2009) A controlled clinical trial of a therapeutic
Sulakvelidze, A. (2015) Bacteriophage administration sig!
bacteriophage preparation in chronic otitis due to antibiot!
nificantly reduces Shigella colonization and shedding by
ic!resistant Pseudomonas aeruginosa; a preliminary report
Shigella!challenged mice without deleterious side effects
of efficacy, Clin. Otolaryngol., 34, 349!357, doi: 10.1111/
and distortions in the gut microbiota, Bacteriophage, 5,
j.1749!4486.2009.01973.x.
e1088124.
99.
Jault, P., Leclerc, T., Jennes, S., Pirnay, J. P., Que, Y. A., et
83.
Mendes, J. J., Leandro, C., Corte!Real, S., Barbosa, R.,
al. (2018) Efficacy and tolerability of a cocktail of bacterio!
Cavaco!Silva, P., Melo!Cristino, J., Gorski, A., and
phages to treat burn wounds infected by Pseudomonas
Garcia, M. (2013) Wound healing potential of topical bac!
aeruginosa (PhagoBurn): a randomised, controlled, dou!
teriophage therapy on diabetic cutaneous wounds, Wound
ble!blind phase 1/2 trial, Lancet Infect. Dis., 19, 35!45,
Repair Regen., 21, 595!603.
doi: 10.1016/S1473!3099(18)30482!1.
БИОХИМИЯ том 85 вып. 11 2020
1600
ВЛАСОВ и др.
100. Sarker, S. A., McCallin, S., Barretto, C., Berger, B., Pittet,
106. Leitner, L., Sybesma, W., Chanishvili, N., Goderdzishvili, M.,
A. C., et al. (2012) Oral T4!like phage cocktail application
Chkhotua, A., et al. (2017) Bacteriophages for treating uri!
to healthy adult volunteers from Bangladesh, Virology, 434,
nary tract infections in patients undergoing transurethral
222!232, doi: 10.1016/j.virol.2012.09.002.
resection of the prostate: a randomized, placebo!con!
101. Sarker, S. A., Sultana, S., Reuteler, G., Moine, D.,
trolled, double!blind clinical trial, BMC Urol., 17, 90,
Descombes, P., et al. (2016) Oral phage therapy of acute
doi: 10.1186/s12894!017!0283!6.
bacterial diarrhea with two coliphage preparations: a ran!
107. Ujmajuridze, A., Chanishvili, N., Goderdzishvili, M.,
domized trial in children from Bangladesh, EBioMedicine,
Leitner, L., Mehnert, U., Chkhotua, A., Kessler, T. M.,
4, 124!137, doi: 10.1016/j.ebiom.2015.12.023.
and Sybesma, W. (2018) Adapted bacteriophages for treat!
102. McCallin, S., Sarker, S. A., and Barretto, C.
(2013)
ing urinary tract infections, Front. Microbiol., 9, 1832,
Safety analysis of a Russian phage cocktail: from metage!
doi: 10.3389/fmicb.2018.01832.
nomic analysis to oral application in healthy human sub!
108. Mi dzybrodzki, R., Borysowski, J., Weber D browska, B.,
jects, Virology, 443, 187!196, doi: 10.1016/j.virol.2013.
Wojciech Fortuna, W., Letkiewicz, S., et al. (2012) Clinical
05.022.
aspects of phage therapy, Adv. Virus Res., 83, 73!121,
103. Petrovic Fabijan, A., Lin, R. C. Y., Ho, J., Maddocks, S.,
doi: 10.1016/B978!0!12!394438!2.00003!7.
Ben Zakour, N. L., and Iredell, J. R. (2020) Safety of bac!
109. Goren, M., Yosef, I., and Qimron, U. (2017) Sensitizing
teriophage therapy in severe Staphylococcus aureus infec!
pathogens to antibiotics using the CRISPR!Cas system, Drug
tion, Nat. Microbiol., 5, 465!472, doi: 10.1038/s41564!
Resist. Updat., 30, 1!6, doi: 10.1016/j.drup.2016.11.001.
019!0634!z.
110. Park, J. Y., Moon, B. Y., Park, J. W., Thornton, J. A., Park,
104. Febvre, H. P., Rao, S., Gindin, M., Goodwin, N. D. M.,
Y. H., and Seo, K. S. (2017) Genetic engineering of a tem!
Finer, E., et al. (2019) PHAGE study: effects of supple!
perate phage!based delivery system for CRISPR/Cas9
mental bacteriophage intake on inflammation and gut
antimicrobials against Staphylococcus aureus, Sci. Rep., 7,
microbiota in healthy adults, Nutrients,
11, E666,
44929, doi: 10.1038/srep44929.
doi: 10.3390/nu11030666.
111. Pursey, E., Sünderhauf, D., Gaze, W. H., Westra, E. R.,
105. Gindin, M., Febvre, H. P., Rao, S., Wallace, T. C., and
and Van Houte, S. (2018) CRISPR!Cas antimicrobials:
Weir, T. L. (2019) Bacteriophage for gastrointestinal
challenges and future prospects, PLoS Pathog., 14,
health (PHAGE) study: evaluating the safety and tolera!
e1006990, doi: 10.1371/journal.ppat.1006990.
bility of supplemental bacteriophage consumption, J. Am.
112. Pirnay, J. P., Verbeken, G., Ceyssens, P. J., Huys, I., De
Coll. Nutr., 38, 68!75, doi: 10.1080/07315724.2018.
Vos, D., Ameloot, C., and Fauconnier, A. (2018) The
1483783.
magistral phage, Viruses, 10, 64, doi: 10.3390/v10020064.
BACTERIOPHAGES AS THERAPEUTIC PREPARATIONS:
WHAT RESTRICTS THEIR APPLICATION IN MEDICINE
Review
V. V. Vlassov*, N. V. Tikunova, and V. V. Morozova
Institute of Chemical Biology and Fundamental Medicine, Siberian Branch of the Russian Academy of Sciences,
630090 Novosibirsk, Russia; E*mail: vvlassov@mail.ru
Received June 15, 2020
Revised August 18, 2020
Accepted August 18, 2020
The increasing prevalence of bacterial pathogens with multiple antibiotic resistance requires development of new
approaches to control infections. Phage therapy is one of the most promising approaches. In recent years, research
organizations and a number of pharmaceutical companies have intensified investigations aimed at developing bacte!
riophage!based therapeutics. In the United States and European countries, special centers have been established that
experimentally apply phage therapy to treat patients who do not respond to antibiotic therapy. This review describes
the features of bacteriophages as therapeutic tools, critically discusses the results of clinical trials of bacteriophage
preparations, and assesses the prospects for using phage therapy to treat certain types of infectious diseases.
Keywords: bacteriophages, phage therapy, bacterial infections, multidrug resistance, synthetic bacteriophages
БИОХИМИЯ том 85 вып. 11 2020