БИОХИМИЯ, 2020, том 85, вып. 11, с. 1601 - 1614
УДК 579.6; 577.18
АНТИБИОТИКИ ИЗ МОРСКИХ БАКТЕРИЙ
Обзор
© 2020
В.А. Стоник*, Т.Н. Макарьева, Л.K. Шубина
Тихоокеанский институт биоорганической химии им. Г.Б. Елякова, Дальневосточное отделение РАН,
690022 Владивосток, Россия; электронная почта: stonik@piboc.dvo.ru
Поступила в редакцию 03.07.2020
После доработки 05.08.2020
Принята к публикации 05.08.2020
В обзорной статье рассмотрены основные направления и результаты изучения антибиотиков, продуцируе
мых бактериями, обитающими в морской среде. Показано, что за последние годы изучено много облигатно
морских видов и штаммов, из экстрактов которых получены разнообразные по своему строению, часто не
имеющие аналогов, токсичные для опухолевых клеток, патогенных бактерий, вирусов и малярийного плаз
модия метаболиты. Некоторые из них стали основой применяемых в клинике медицинских препаратов,
другие - находятся на разных этапах доклинических или клинических исследований. Большое внимание
уделяют в последние годы продуцентам морских антибиотиков, выделенным из глубоководных мест обита
ния, с поверхности морских беспозвоночных и водорослей, а также из симбионтных микроорганизмов.
КЛЮЧЕВЫЕ СЛОВА: морские бактерии, антибиотики, цитотоксическое действие, противобактериальное
действие, антифунгальное действие, противовирусное действие, противопаразитарное действие.
DOI: 10.31857/S032097252011007X
ВВЕДЕНИЕ
лей тяжелых инфекций, которая получила на
звание «ESKAPE BUGS» («избегающие оши
Открытие и широкое применение антибио
бок»), а само слово «ESKAPE», созвучное анг
тиков имело огромное значение для судьбы че
лийскому «ESCAPE» (избегать), в этом наборе
ловечества и резко уменьшило число жертв эпи
слов было составлено из первых букв латинских
демий, которые на протяжении многих столе
названий нечувствительных к антибиотикам
тий уносили жизни миллионов людей. Считает
возбудителей: Enterococcus faecium, Staphylococ+
ся, что это стало одной из главных причин уве
cus aureus, Klebsiella pneumoniae, Acinetobacter
личения средней продолжительности жизни.
baumanii, Pseudomonas aeruginosa и Enterobacter
Например, в России в конце 19 го века она сос
spp. Позже действие этих патогенов было более
тавляла около 30 лет, к 1961-1962 гг. выросла до
детально охарактеризовано [2]. Еще позже вы
67,85 г., а в наше время равняется приблизитель
росла угроза заражения антибиотико устойчи
но 73,4 г. (2018 г.). Однако основной природный
выми штаммами еще нескольких патогенных
источник антибиотиков - почвенные микроор
бактерий, в том числе Helicobacter pylori,
ганизмы - к настоящему времени в существен
Campylobacter spp., Neisseria gonorrhoeae и др. [3].
ной мере исчерпал свой потенциал, а число но
Острая необходимость поиска новых анти
вых антибиотиков, выделяемых из почвенных
биотиков вынудила обратить внимание на труд
бактерий, уменьшилось.
ные для изучения природные источники этих
В то же время изыскание новых антибиоти
биологически активных веществ, в особеннос
ков остается актуальной задачей из за увеличи
ти на морские микроорганизмы - на бактерии
вающегося числа случаев тяжелых инфекций,
и микроскопические грибы, обитающие в
вызываемых различными патогенами, в первую
экстремальных условиях - так называемые
очередь лекарственно устойчивыми штаммами.
экстремофилы (барофилы, психрофилы, тер
Так, растет число жертв лекарственно устойчи
мофилы и др.), а также на эпифитную и симбио
вого туберкулеза. В 2017 г. туберкулезом болели
тическую микробиальные флоры беспозвоноч
10 млн человек, а 1,6 млн человек (в том числе
ных и водорослей. Применяя новые возмож
0,3 млн человек с ВИЧ) умерли от этой болезни
ности поиска антибиотиков, в том числе спус
[1]. В 2008 г. была объявлена группа возбудите
каемые подводные аппараты и научные кораб
ли, учёные исследовали противобактериаль
* Адресат для корреспонденции.
ные, антифунгальные, противовирусные веще
1601
1602
СТОНИК и др.
ства и соединения, ингибирующие патогенных
imentorum gen. nov., sp. nov. (в честь острова Рей
простейших, из таких нетрадиционных проду
неке, близ которого из песчаного грунта на не
центов антибиотиков, как животные, особенно
большой глубине были выделены соответствую
морские беспозвоночные, как обитатели под
щие микроорганизмы) и другие. Только за пери
водных горячих источников; искали эти веще
од 1995-2005 гг. в лаборатории микробиологии
ства в Арктике и Антарктиде, на максимальных
нашего Института были открыты более 100 но
глубинах океана, в глубоких пещерах и пусты
вых видов, около 40 новых родов и одно новое
нях. В результате была найдена серия веществ,
семейство морских бактерий [13]. Некоторые из
обладающих противопатогенными свойствами,
них продуцируют разнообразные биоактивные
которые можно рассматривать в качестве ли
соединения, в том числе антибиотики [14]. К
дерных соединений при создании новых меди
настоящему времени число новых видов и родов
цинских препаратов.
в коллекции морских микроорганизмов (КММ)
К настоящему времени опубликованы нес
ТИБОХ ДВО РАН существенно увеличилось.
колько обзорных статей о различных аспектах
Тем не менее не так давно, в 1996 г., только 7
поиска антибиотиков, выделенных из морских
родов бактерий считались исключительно морс
микроорганизмов [4-10], а более сотни таких со
кими, в том числе Oceanospirillum, Marinomonas,
единений были открыты и описаны. Появились
Planococcus, Listonella, Leucothrix, Platobacterium и
и обзоры результатов поиска метаболитов, инги
Prochloron [5]. Многие из них ассоциированы с
бирующих метициллин резистентные S. aureus
морскими рыбами, беспозвоночными или водо
[11] и ванкомицин резистентные энтерококки
рослями. Затем ситуация изменилась, и число
[11, 12].
таких родов увеличилось. Более того, были най
Хотя значительное число морских микроор
дены таксоны более высокого таксономическо
ганизмов пока не удается культивировать, те из
го ранга, все представители которых являются
них, которые все же были изучены, часто отли
облигатно морскими.
чаются от своих наземных аналогов рядом фи
С другой стороны, даже в тех случаях, когда
зиологических и морфологических особеннос
среди морских бактерий обнаруживали извест
тей, которые помогают им адаптироваться и вы
ные в наземной среде виды, их в большинстве
живать в условиях морей и океанов. Среди
случаев нельзя было считать просто смытыми с
морских микроорганизмов много ранее неизве
суши и сохранившими в новой среде свои свой
стных видов, родов и даже семейств бактерий, и
ства. Адаптация к морской среде часто приводит
их открытие сильно изменило современную
к отбору таких метаболических путей, которые
микробиологию.
ведут к ранее неизвестным метаболитам, что
Например, несколько сотен новых видов
объясняет значительное биохимическое разно
бактерий были валидно описаны учеными из на
образие в этих микроорганизмах и способствует
шего Института под руководством чл. корр.
их изучению в качестве новых источников анти
РАН Валерия Викторовича Михайлова. Как и
биотиков.
другие морские бактерии, они продуцируют са
Актинобактерии являются наиболее извест
мые разнообразные биоактивные метаболиты
ными бактериальными продуцентами антибио
[10, 13]. Первым валидно описанным новым ви
тиков. Они относятся к семейству Actinomyceta
дом гетеротрофных бактерий на Дальнем Восто
ceae, включающему роды Streptomyces, Actino+
ке России стал вид Alteromonas fuliginea (типовой
baculum, Actinomyces и другие. Большинство этих
штамм КММ 216Т), обитающий в водах залива
грамположительных бактерий продуцируют ве
Петра Великого (1995 г.). Позже этот вид был пе
щества с уникальным химическим строением
ренесён в появившийся к тому времени род
токсичные для других бактерий, в том числе па
Pseudoalteromonas и включён в вид Pseudoaltero+
тогенных. Более 60% всех производимых фар
monas citrea. За последующие 10 лет были откры
мацевтической промышленностью антибиоти
ты Marinomonas primoryensis sp. nov. (назван в
ков получают при культивировании актинобак
честь Приморья), Vitellibacter vladivostokensis gen.
терий [15, 16]. Среди них - стрептомицин, акти
nov., sp. nov. (назван в честь Владивостока),
номицин, стрептотрицин, цефамицины, полие
Arenibacter troitsensis sp. nov. (в честь бухты Трои
ны, тетрациклины, макролиды и другие лекар
цы, в водах которой обитает этот вид, и на бере
ственные препараты. Считают, что каждый
гах которой расположена Морская эксперимен
штамм актинобактерий благодаря своему гене
тальная станция (МЭС) ТИБОХ ДВО РАН),
тическому потенциалу способен к биосинтезу
Mesonia algae gen. nov., sp. nov. (в честь МЭС),
15-25 различных вторичных метаболитов. Рас
Salinibacterium amurskyense gen. nov., sp. nov. (эти
считано, что около 10 тыс. новых биоактивных
бактерии были изолированы из образца морс
веществ самого различного происхождения бу
кой воды Амурского залива), Reinekea marinised+
дет найдено в актинобактериях [16].
БИОХИМИЯ том 85 вып. 11 2020
АНТИБИОТИКИ ИЗ МОРСКИХ БАКТЕРИЙ
1603
На протяжении многих десятков лет для по
в 2005 г. [25]. После того как методика культиви
иска и создания антибиотиков применяли на
рования была отработана, Salinispora spp. были
земные источники - главным образом почвен
найдены также в некоторых морских беспозво
ные микроорганизмы. Хотя ещё в 1969 г. появи
ночных (губки, асцидии) и в водорослях. Бакте
лось сообщение о выделении первой мицелий
рии этого рода оказались облигатно морскими
формирующей актинобактерии из морских дон
видами, а их дальнейшее изучение привело к
ных осадков [17]. Более того, высказывались
открытию нескольких антибиотиков, проявля
предположения о том, что морские антибиоти
ющих сильное противоопухолевое действие
ки, в том числе выделенные из симбионтных
[26].
микроорганизмов морских беспозвоночных, бу
Первые интересные метаболиты из бактерий
дут иметь преимущество при создании новых
этого вида были получены, когда для их выделе
лекарств [17, 18].
ния использовали бактерии, полученные из
Среди различных родов актинобактерий род
предварительно нагретого образца донных осад
Streptomyces представляет особый интерес, пото
ков. Основное полученное вещество было назва
му что именно он оказался источником более
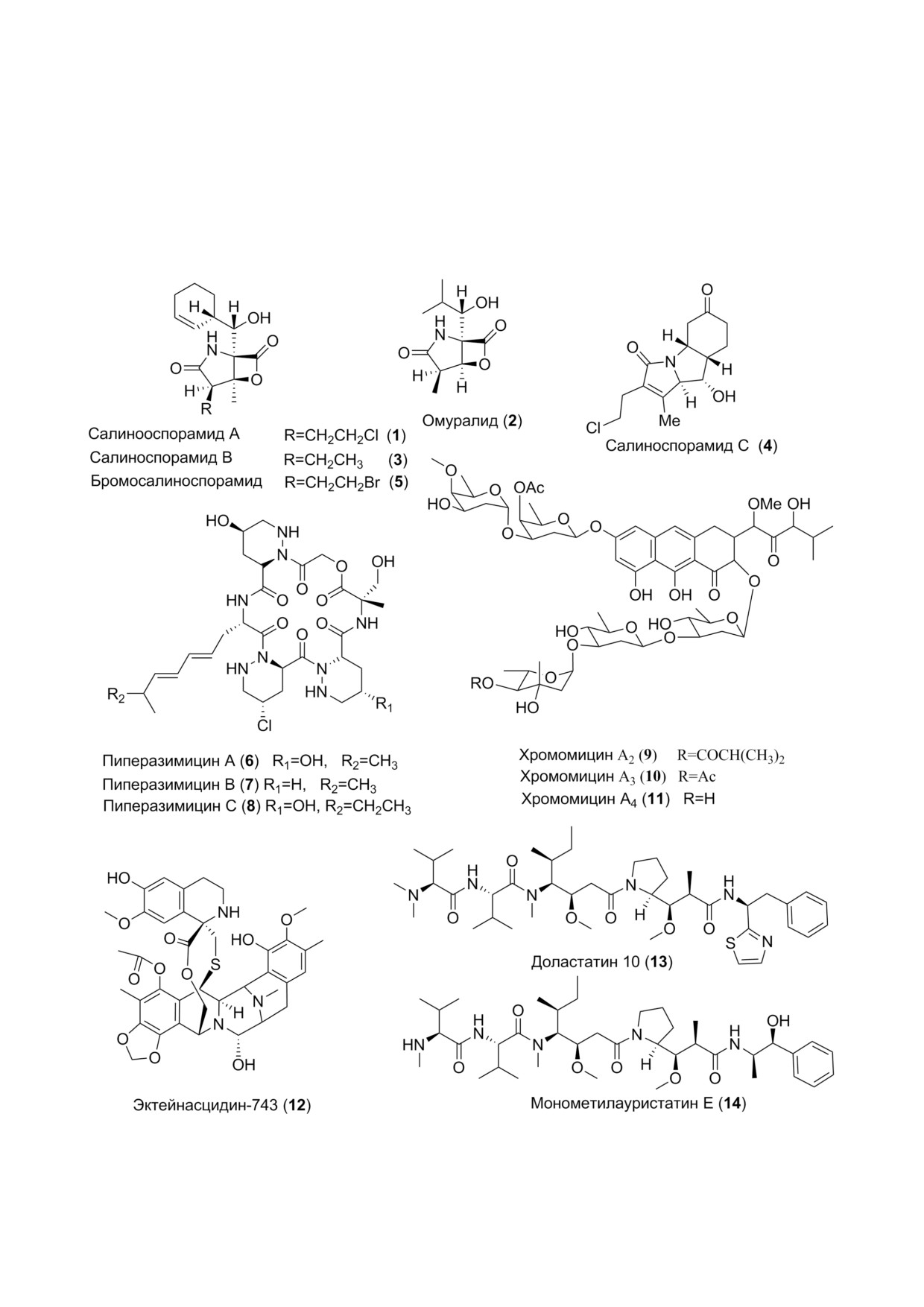
но салиноспорамидом А (1) [27]. Этот новый ан
половины всех применяемых сейчас в клини
тибиотик имеет скелетную систему, состоящую
ческой практике антибиотиков. В Genome
из γ лактама и β лактона (рис. 1), и обладает ци
OnLine Database зарегистрированы 5200 гено
тотоксическими свойствами в отношении опу
мов таких бактерий [19]. Интересно, что за пос
холевых клеток. Хотя его циклическая система
ледние годы были открыты новые виды этого
идентична таковой омуралида (2), выделенного
рода, которые можно считать исключительно
японскими микробиологами в 1991 г. из Strepto+
морскими стрептомицетами [20]. Более того, 5
myces lactacystennaosus, он существенно отличает
новых родов морских актиномицетов были не
ся от омуралида своими заместителями и их по
давно описаны: Marinactinospora [21], Jonesia
ложением. Салиноспорамид А оказался мощ
[22], Salinibacterium
[23], Sciscionella
[24] и
ным и селективным ингибитором протеасом, он
Salinispora [25]. Немало открыто и бактерий,
приблизительно в 35 раз более активен в этом
принадлежащих к другим таксономическим
тесте, чем омуралид. Антибиотик ингибирует
группам, в них также найдены высокоактивные
клеточные линии рака легкого NCI H226, опу
вторичные метаболиты.
холи головного мозга SF 539, меланом SK MEL
В этой небольшой обзорной статье мы при
28 и MDA MB 43, причем все значения IC50
ведем сведения об основных направлениях по
(концентрация, ингибирующая клетки на 50%) в
иска морских антибиотиков и проиллюстрируем
этих тестах были меньше 10 нМ. Салиноспора
эти направления только небольшим числом
мид успешно показал себя как противораковый
примеров перспективных морских антибиоти
агент в доклинических испытаниях и проходит
ков, группируя их по ингибирующему действию
клинические испытания на людях в качестве
в отношении опухолевых клеток, болезнетвор
средства для лечения меланомы. Соответствую
ных бактерий, грибов и других патогенов.
щий препарат под названием Marizomib разраба
тывается «Nereus Pharmaceutical» (Сан Диего,
США) по лицензии, полученной от Калифор
ЦИТОТОКСИЧЕСКИЕ АНТИБИОТИКИ ИЗ
нийского университета в Сан Диего.
БАКТЕРИЙ, ВЫДЕЛЕННЫХ ИЗ МОРСКИХ
Различные штаммы Salinispora spp. продуци
БИОЛОГИЧЕСКИХ ИСТОЧНИКОВ
руют и другие антибиотики. Так, изучение
штамма S. tropica CNB 392 привело к выделе
Поиск морских антибиотиков, обладающих
нию салиноспорамидов В (3) и С (4), а замена в
ингибирующим действием на опухолевые клет
среде NaCl на NaBr - к выделению соединения
ки, в последние годы активно проводят в нес
(5) (рис. 1), имеющему атом брома вместо хлора
кольких странах, в особенности в США и Япо
в боковой цепи и сохраняющему цитотоксичес
нии. Большое внимание микробиологов, хими
кие свойства [28, 29].
ков биооргаников и фармакологов привлекли
Перспективны для лечения опухолевых за
бактерии рода Salinispora. Их культивирование
болеваний циклические пептиды из бактерии
было впервые выполнено в 1989 г. после выделе
Streptomyces sp. (штамм CNQ 593) из морских
ния из образцов донных осадков, собранных на
донных осадков, собранных на глубине 20 мет
глубине 1100 метров. Оказалось, что, первона
ров недалеко от острова Гуам. Эти вещества бы
чально отнесенные к роду Micromonospora, эти
ли названы пиперазимицинами и имеют форму
бактерии не культивируются, если в средах
лы 6-8 (рис. 1) [30]. Пиперазимицины проявля
морская вода была заменена обычной деионизо
ют сильные токсические свойства в отношении
ванной водой. Как Salinispora они были описаны
опухолевых клеток. Среднее значение ингиби
БИОХИМИЯ том 85 вып. 11 2020
1604
СТОНИК и др.
рующей рост клеток концентрации (GC50) после
ства, хотя чувствительность к ним опухолевых
тестирования на 60 линиях опухолевых клеток,
клеток и патогенных бактерий может быть раз
предоставленных Национальным Институтом
личной. Например, новые производные аурео
Рака США, было равно приблизительно 100 нM.
ловой кислоты, хромомицины А2-А4 (9-11)
Во многих случаях высокоактивные метабо
(рис. 1), полученные из Streptomyces sp. (штамм
литы из морских бактерий проявляют как цито
КМ 9048 из нашей коллекции, который был вы
токсические, так и противобактериальные свой
делен из образца донных осадков, собранного в
Рис. 1. Некоторые цитотоксические метаболиты морских бактерий
БИОХИМИЯ том 85 вып. 11 2020
АНТИБИОТИКИ ИЗ МОРСКИХ БАКТЕРИЙ
1605
западной части Японского моря), показывали
ленных из природных источников и синтезиро
сильное противобактериальное действие против
ванных химиками токсичных для опухолевых
E. faecium, S. aureus, Staphylococcus epidermis и
клеток соединений. Они угнетают рост опухоле
Bacillus subtilis. Но их ингибирующие концент
вых клеток в пикомолярных концентрациях.
рации в отношении опухолевых клеток были
Доластатины были впервые выделены из мол
еще более низкими, в особенности концентра
люска Dolabellа auricularia, но их истинными
ции, ингибирующие образование микроколо
продуцентами являются цианобактерии Sym+
ний опухолевых клеток RPMI 7951 и SK Mel 28
ploca hydnoides и Lyngbya majuscula. Производное
(10-20 нМ) [31].
доластатина 10 (13), так называемый мономети
Морское изохинолиновое производное, эк
лауристатин E (14) (рис. 1), было выбрано в ка
тейнасцидин 743 (ET 743) (рис. 1) (12), стало
честве активной субстанции для создания про
активной субстанцией нового морского проти
тивоопухолевого лекарства Ведотина (Брентук
воракового препарата Трабектедин (YondelisR),
симаб или Адцетрис®), представителя нового
разработанного сотрудниками испанской ком
поколения противоопухолевых лекарств нап
пании «PharmaMar» (производитель - «Baxter
равленного действия, представляющего собой
oncology GmbH», Германия). Само это вещество
моноклональные антитела, соединенные с мо
было открыто в США в Иллинойском универси
нометилауристатином. Ведотин применяют с
тете проф. К. Ринехартом. Ему удалось выде
2011 г. для лечения лимфом и других онкологи
лить его из асцидии Ecteinascidia turbinata и по
ческих заболеваний [36, 37] (производитель -
казать очень высокую противоопухолевую ак
«BSP Pharmaceutical S.r.l.», Италия).
тивность [32]. Нобелевский лауреат Элиас Кори
синтезировал соединение 12, а позже его уда
лось получить из антибиотика суфрацина B. С
МОРСКИЕ АНТИБИОТИКИ
2007 г. Трабектедин применяется в клинической
С ПРОТИВОБАКТЕРИАЛЬНЫМИ
практике для лечения сарком, рака яичников и
СВОЙСТВАМИ
других злокачественных опухолей.
Недавно было найдено, что в этой асцидии
Однако наиболее многочисленные морские
содержится консорциум различных симбионт
антибиотики относятся к метаболитам с силь
ных бактерий, причем основным видом в нем
ным противобактериальным действием. Их по
является γ протеобактерия Candidatus Endo+
иск и открытие имеют большое значение, так
ecteinascidia frumentensis. Применение Meta
как инфекционные болезни остаются одной из
Omics техники позволило охарактеризовать этот
главных причин смерти людей. Среди них са
консорциум и выявило 25 генов, катализирую
мые разные по химическому строению соедине
щих образование ЕТ 743. Последующее секве
ния: гетероциклические производные, хинои
нирование показало, что истинным продуцен
ды, продукты поликетидного происхождения,
том активной субстанции препарата Трабекте
пептиды и др. Поиск таких веществ активно
дин является эта симбионтная бактерия [33].
проводят десятки научных коллективов из мно
На первом месте по распространенности
гих стран мира. Лаборатория профессора Виль
среди симбионтных бактерий беспозвоночных
яма Феникала из Скриппсовского института
находятся актинобактерии, они, по видимому,
океанографии (США), кроме салиноспорами
участвуют в биосинтезе многих метаболитов
дов, открыла еще несколько морских антибио
морских беспозвоночных, в том числе нашед
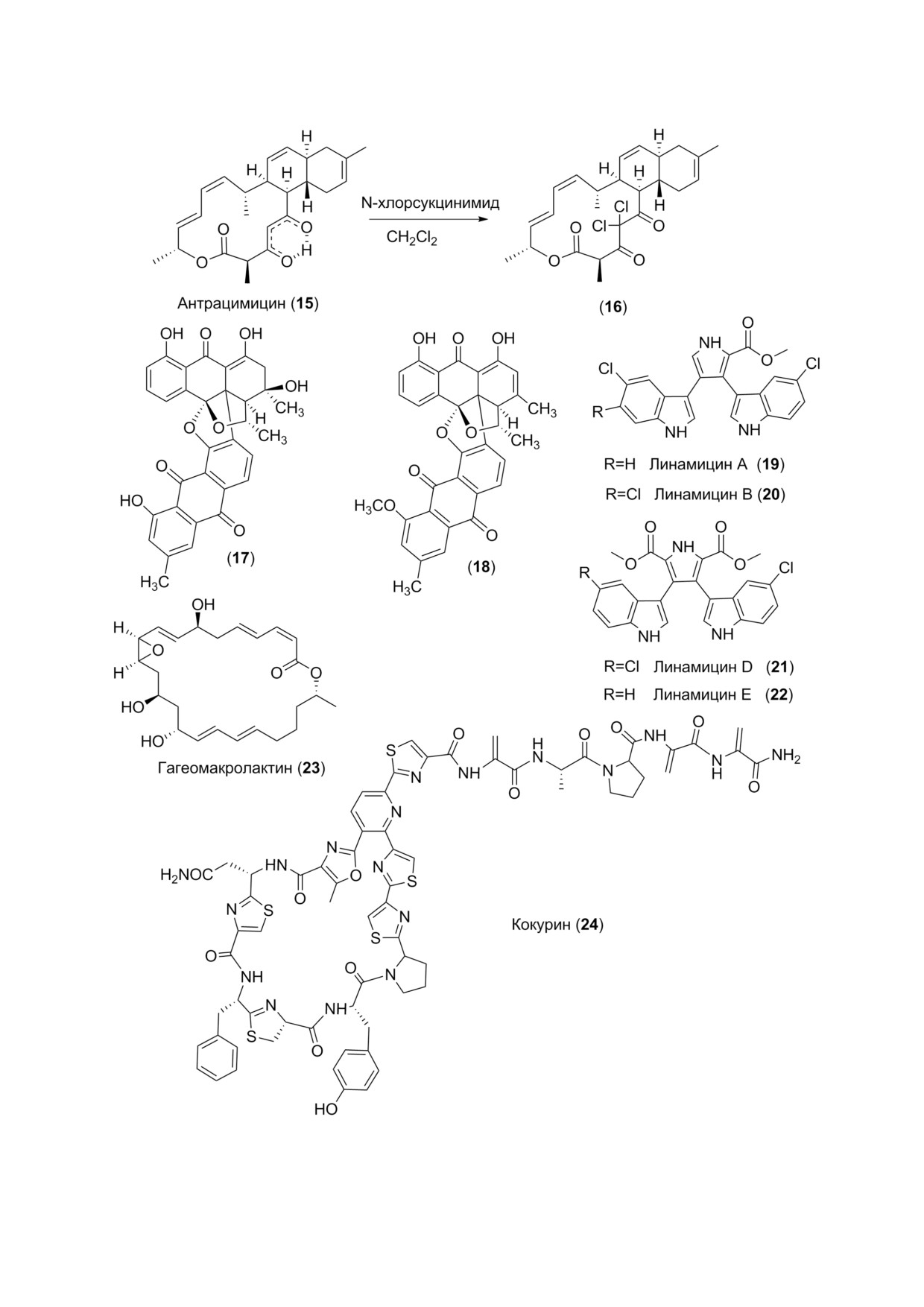
тиков, в том числе антрацимицин (15) с силь
ших применение в качестве активных субстан
ным противобактериальным действием. Этот
ций лекарств [34]. В морских беспозвоночных
антибиотик, выделенный из актинобактерии
найдены и другие симбионтные бактерии. Нап
Streptomyces sp. (штамм T676), собранной у ост
ример, в губках присутствует еще одна большая
рова Сент Джонс вблизи Сингапура, ингибиру
группа симбионтных бактерий, принадлежа
ет бактерию Bacillus anthracis - возбудителя си
щих к таксону более высокого ранга - предста
бирской язвы, вызывающего смертельно опас
вители нового типа Poribacteria, которые также
ное заболевание. B. anthracis уже была однажды
участвуют в биосинтезе различных вторичных
использована террористами, рассылавшими
метаболитов [35]. Другие симбионты морских
своим жертвам письма с её спорами. Впервые
беспозвоночных идентифицированы как циа
антрацимицин был получен из другого морско
нобактерии, фирмикуты и микроскопические
го стрептомицета (штамм CNH365), собранного
грибы.
из донных осадков у побережья Санта Барбары,
Цианобактерии известны своими экстре
Калифорния, США [38]. Химическое строение
мально активными пептидами, в том числе до
соединения 15 было установлено тщательным
ластатинами, самыми мощными из всех выде
анализом его ЯМР спектров и подтверждено
БИОХИМИЯ том 85 вып. 11 2020
1606
СТОНИК и др.
рентгеноструктурным анализом. Интересно,
2-4 мкг/мл ингибировал штаммы патогенных
что в его структуре имеется необычная водород
бактерий Streptococcus pneumonia, Haemophilus
ная связь, образованная двумя кетонными груп
influenzae и S. aureus [41].
пами, причем одна из них находится в енольной
Гагеомакролактины, например гагеомакро
форме (рис. 2). При обработке N бромсукцини
лактин (23) (рис. 2) из бактерий, выделенных из
мидом в дихлорэтане антрацимицин образует
донных осадков на рифе Гагео в водах Республи
дихлорпроизводное (16), которое также показы
ки Корея, проявляли высокую противобактери
вает высокую антибактериальную активность, в
альную активность в отношении как грамполо
особенности против метициллин резистентной
жительных (S. aureus, B. subtilis), так и грамотри
Escherichia coli и некоторых других патогенных
цательных бактерий (E. coli, Salmonella typhi,
бактерий.
P. aeruginosa) [42].
Биосинтез антрацимицина был изучен на ге
Пептидные антибиотики довольно часто на
нетическом уровне. Идентифицированный ген
ходят в различных морских бактериях, напри
ный кластер «atc», ответственный за его биосин
мер в актино и цианобактериях. Скрининг 44
тез, состоял из 53 253 пар оснований. В него вхо
морских актиномицетов из семейства Micro
дит ген поликетид синтазы типа I и ацилтранс
coccaceae, выделенных из губок, собранных у
феразы, катализирующей образование мало
побережья Флориды (США), привел к откры
нил и метилмалонил коферментов А, которые
тию новых продуцентов антибиотиков. Они бы
участвуют в построении скелетной системы сое
ли идентифицированы генетическими метода
динения 15. Экспрессия генного кластера в бак
ми как представители родов Kocuria и Micrococ+
терии Streptomyces coelicolor приводила к продук
cus и содержали гены нерибосомальной пептид
ции в этой бактерии антрацимицина. В биосин
синтазы и поликетидсинтаз. Три полученных
тезе участвуют 10 биосинтетических модулей,
изолята продуцировали пептидный антибиотик
причем под их действием сначала образуется де
кокурин (21) (рис. 2), новый член семейства ти
калиновая циклическая система, а завершает
азол содержащих циклических пептидов [43].
биосинтез тиоэстераза, катализирующая замы
Близкое по структуре соединение, названное
кание макроцикла с образованием лактонной
антибиотиком PM181104 (рис. 2), было получе
связи [39].
но индийскими химиками при культивировании
Новые противобактериальные агенты (17 и
принадлежащей к этому же роду бактерии из
18) (рис. 2) были найдены в морском изоляте
губки Spirastrella inconstans var. digitate, собранной
Streptomyces sp. из цианобактериальной массы,
в бухте Палк, Индия. Этот антибиотик ингиби
собранной у берегов Пуэрто Рико. Эти необыч
ровал различные патогенные бактерии, в том
ные бис антрахиноны проявляли сильное инги
числе антибиотико устойчивые штаммы, в кон
бирующее действие в отношении штаммов ван
центрациях приблизительно 1 нМ. В опытах
комицин устойчивой E. faecium, метициллин и
in vivo он на 100% защищал животных от сепси
тетрациклин устойчивых штаммов S. aureus.
са, вызванного метициллин устойчивой S. aureus
Кроме них, были изучены их синтетические
и ванкомицин устойчивыми энтерококками,
производные. Наиболее эффективный антибио
при введении мышам в дозах 5 и 10 мг/кг соответ
тик (17) демонстрировал минимальную 50%
ственно [44].
бактерицидную концентрацию (MIC50) 0,11;
Число перспективных антибиотиков из
0,23 и 0,90 мкM против выше названных опас
морских организмов растет год от года, что
ных бактериальных патогенов [40].
привлекает внимание все новых и новых науч
Из образцов донных осадков, собранных со
ных групп по всему миру.
дна бухты Миссон в Сан Диего (Калифорния),
был выделен бактериальный штамм NPS12745.
На основе последовательности нуклеотидов ге
АНТИФУНГАЛЬНЫЕ МОРСКИЕ
на 16S РНК эта бактерия была идентифициро
АНТИБИОТИКИ
вана как новый вид рода Marinispora. Экстракт
этого микроорганизма ингибировал рост как
Болезнетворные грибы, вызывающие тяже
грамположительных, так и грамотрицательных
лые микозы, остаются одной из главных угроз
патогенных бактерий. Структуры полученных
для раковых больных с ослабленной в результа
антибиотиков были установлены как новые бис
те химиотерапии иммунной системой, а также
индолилпиррольные производные, названные
для пациентов со СПИДом и другими болезня
линамицинами А-E (19-22) (рис. 2). Все они
ми, вызывающими иммунодефицитные состоя
обладают сильным противобактериальным
ния. Такие больные часто инфицируются оп
действием. Наиболее высокую активность пока
портунистическими грибами, например пред
зал линамицин B, причём он в концентрациях
ставителями родов Candida, Aspergillus и Crypto+
БИОХИМИЯ том 85 вып. 11 2020
АНТИБИОТИКИ ИЗ МОРСКИХ БАКТЕРИЙ
1607
Рис. 2. Некоторые противобактериальные метаболиты морских бактерий
БИОХИМИЯ том 85 вып. 11 2020
1608
СТОНИК и др.
coccus, с тяжелыми последствиями вплоть до ле
рывшие этот новый микробиальный источник
тальных исходов. Около 500 тыс. человек еже
ученые смогли увеличить продукцию антибио
годно погибают от таких инфекций, а ущерб
тика в 2,26 раза после обработки его продуцента
составляет около 12 млрд долларов. Поиск анти
ультрафиолетовыми лучами, а полученный му
фунгальных природных соединений и разработ
тантный штамм Ah22 использовали затем для
ка на этой основе лекарств - актуальная задача
выделения и установления строения самого ан
современной науки.
тибиотика. По своему строению соединение 25
Некоторые метаболиты морских бактерий, в
не отличается большой сложностью. Оно пред
особенности актиномицетов, в последние годы
ставляет собой продукт поликетидного биосин
стали известны своими антифунгальными свой
теза, имеющий α пироновый цикл, и является
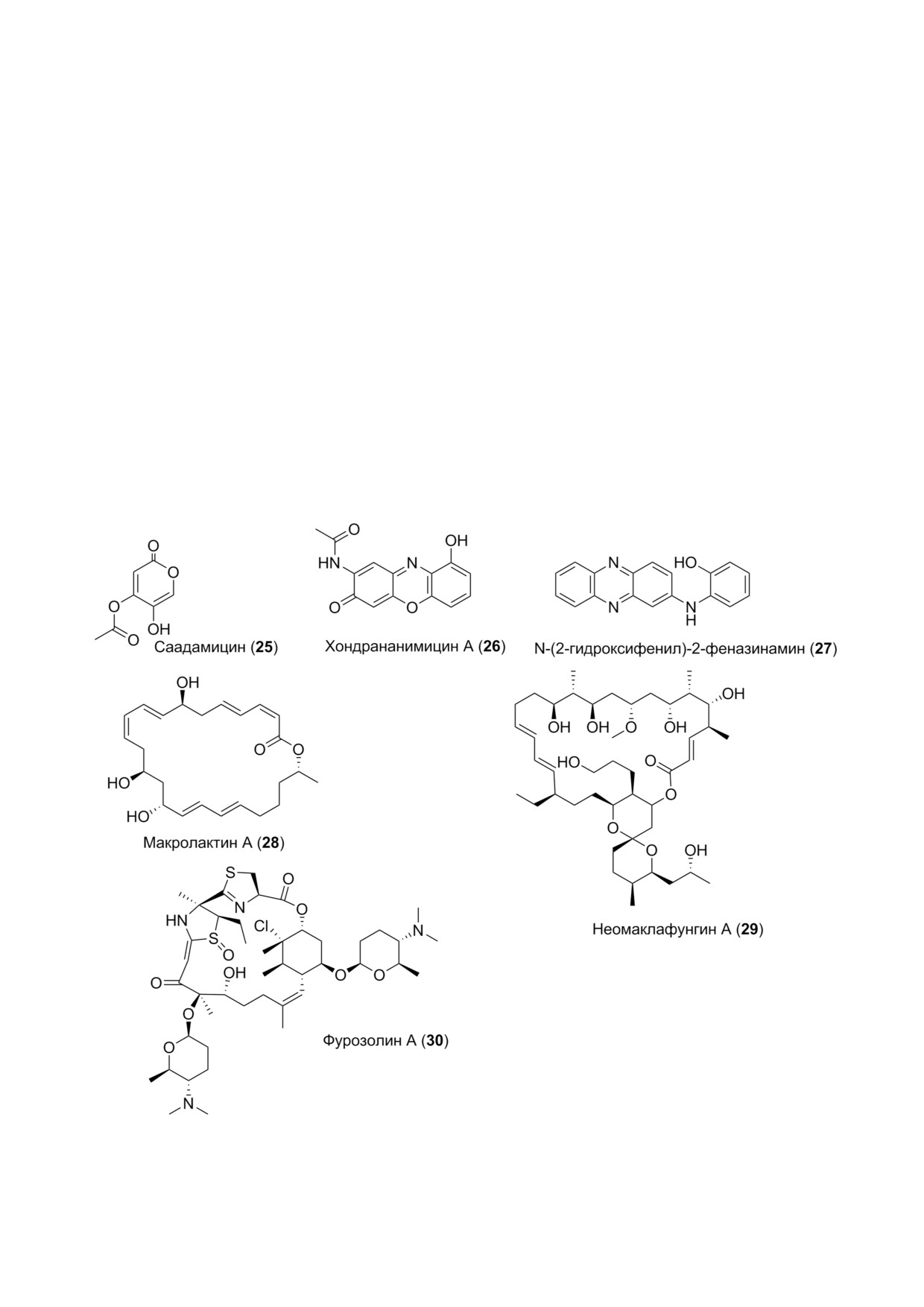
ствами. Например, саадамицин (25) (рис. 3), по
производным 5 гидрокси 2 оксо 2H пирана.
ликетидный антибиотик из актинобактерии
Феноксазиновое производное, хондранани
Streptomyces sp. (новый вид этого рода), выделен
мицин А (26) (рис. 3), и родственные ему соеди
ной из собранной у берегов Египта губки
нения были выделены из актинобактерии
Aplysina fistularis, обладает мощным антифун
Actinomadura sp. из донных осадков бухты Гуанд
гальным действием на Candida albicans,
жоу (КНР). Соединение 29 ингибирует ряд гри
Aspergillus и Cryptococcus с минимальной ингиби
бов, в том числе Mucor miehei, ферменты которо
рующей концентрацией (MIC) 1-5,2 мкг/мл и
го используют при производстве сыра [46].
минимальной фунгицидной концентрацией
Ряд актиномицетов, в том числе штамм BM
(MFC) 2-10 мкг/мл [45]. Интересно, что отк
17, были выделены из образца донных осадков,
Рис. 3. Некоторые антифунгальные метаболиты из морских микроорганизмов
БИОХИМИЯ том 85 вып. 11 2020
АНТИБИОТИКИ ИЗ МОРСКИХ БАКТЕРИЙ
1609
собранных в Арктическом океане. Этот штамм
вогрибковых лекарств может усиливаться в
был идентифицирован как Nocardia dassonvillei.
35 раз [53].
Новый вторичный метаболит, N (2 гидрокси
фенил) 2 феназинамин (27) (рис. 3) вместе с ра
нее известными феназиновыми антибиотиками
АНТИБИОТИКИ С ПРОТИВОВИРУСНЫМИ
был получен при культивировании этого штам
СВОЙСТВАМИ
ма. Это соединение показало значительную ан
тифунгальную активность против C. albicans с
Немного противовирусных метаболитов най
MIC50 64 мкг/мл и цитотоксическими свойства
дены среди метаболитов морских актинобакте
ми в отношении ряда линий опухолевых кле
рий. Возможно, это связано с менее интенсив
ток [47].
ным поиском таких веществ по сравнению с про
Другие морские макролиды также часто по
тивоопухолевыми и антифунгальными морски
казывают антифунгальные свойства. Например,
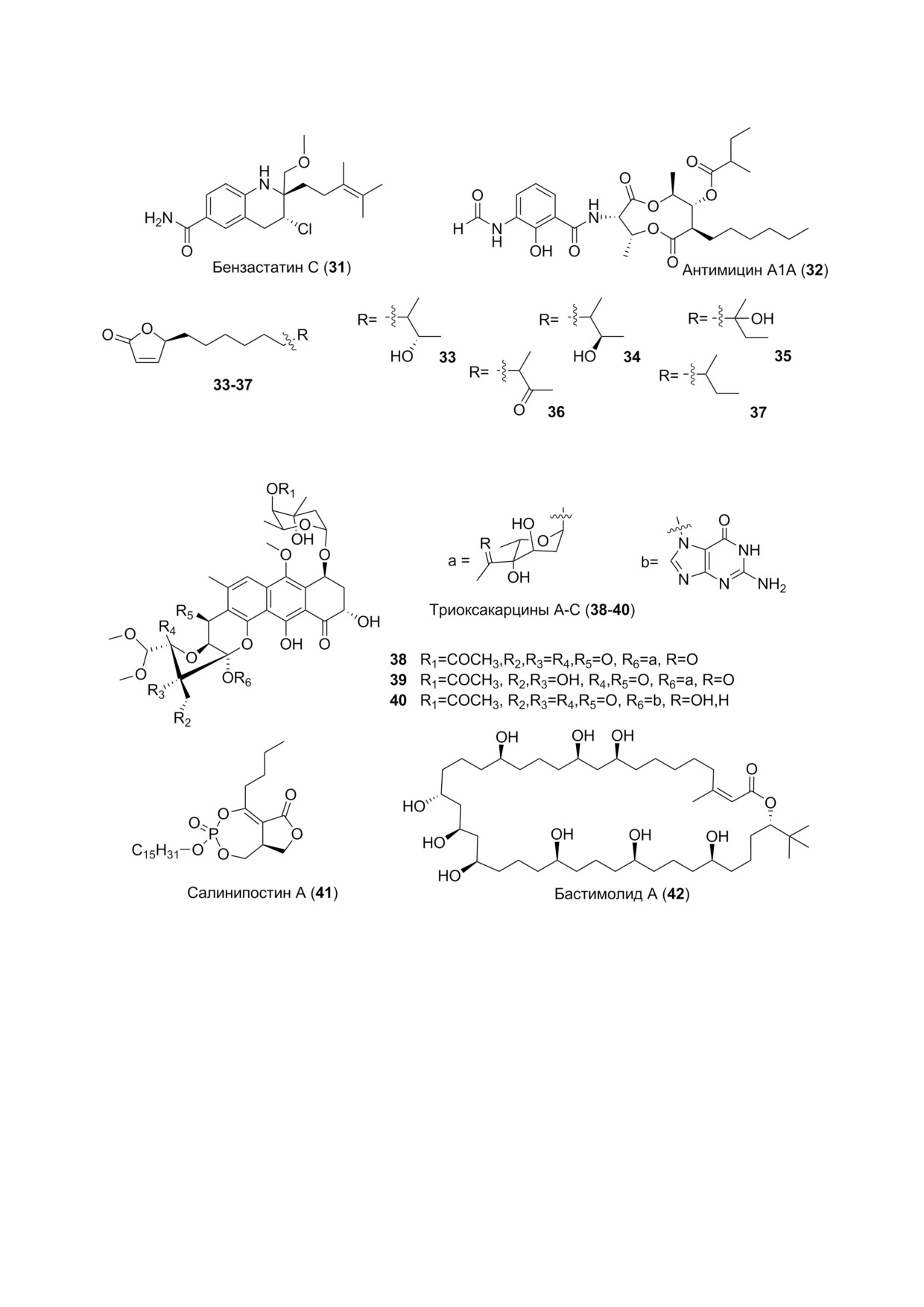
ми природными соединениями. Бензастатин С
макролактин А (28) (рис. 3) и близкие к нему
(31) (рис. 4) был получен из морской бактерии
макролактины, выделенные из бактерии B. sub+
Streptomyces nitrosporeus. Он показывает дозозави
tilis, собранной в районе уже упоминавшегося
симое ингибирующее действие с EC50 1,92 и 0,53 мкг/
рифа Гагео, проявляют сильное антифунгальное
мл против вирусов герпеса HSV 1 и HSV 2. Та
действие против Aspergillus niger, C. albicans,
ким образом, он был активнее в этих тестах, чем
Botrytis cinerea и Colletotrichum acutum. Мини
Ara C, известный лекарственный препарат, также
мальные ингибирующие концентрации были
созданный на основе морских природных соеди
низкими, всего 0,04-0,3 мкМ [48]. Некоторые
нений и ставший родоначальником нуклеозид
родственные им макролиды также проявляют
ных противовирусных препаратов. При этом ци
сильное антифунгальное действие [49].
тотоксические свойства 31 были невысокими.
Неомаклафунгин А (29) (рис. 3) из бактерии
Соединение 31 проявляет также противовирус
Actinoalloteichus sp. NPS702, выделенной из об
ное действие в отношении вируса везикулярного
разца донного осадка бухты Уса (Япония) [50],
стоматита. Показано, что присутствие хлора не
проявляет значительную антифунгальную ак
обходимо для проявления этим лидерным соеди
тивность против Trichophyton mentagraphites
нением противовирусного эффекта [54].
(MIC 1-3 мкг/мл). После синтеза его строение
Антимицин 1А (32) (рис. 4) [55] был выделен
было пересмотрено [51].
из нового вида, Streptomyces kaviengensis, полу
Как и бактерии, патогенные грибы быстро
ченного из образца донных осадков, собранных
вырабатывают механизмы лекарственной ус
у берегов острова Новая Ирландия (Папуа -
тойчивости и образуют флуконазол и амфоте
Новая Гвинея). Полученное соединение пока
рицин устойчивые штаммы, особенно это ха
зывает экстремально высокое противовирусное
рактернo для видов, относящихся к роду
действие (IС50 4 нМ) против вируса энцефалита
Candida. Кандидозами болеют около 400 тыс. че
лошадей. Механизм его действия связан со спо
ловек ежегодно. При этом грибы применяют
собностью ингибировать электрон транспорт
различные биохимические механизмы, чтобы
ную сеть в митохондриях и подавлять de novo био
избежать летального действия фунгицидов: нап
синтеза пиримидиновых производных. Введе
ример, они с помощью специальных транспорт
ние препарата in vivo увеличивает выживание
ных систем выбрасывают лекарства из клеток. В
животных, зараженных этим вирусом. Антими
последние годы найдены морские метаболиты,
цин ингибирует и другие РНК вирусы.
активные против таких штаммов. Так, с исполь
Бутенолидные производные (33-37) (рис. 4)
зованием жидкостной хроматографии и масс
из экстрактов Streptomyces sp. активны против
спектрометрии был открыт поликетидный мета
аденовирусов. Известно, что аденовирусные ин
болит - фурозолин из бактерии Actinimadura sp.
фекции связаны с высокой смертностью паци
Эта бактерия была высеяна из асцидии
ентов с иммунодeфицитными состояниями.
Ecteinascidia turbinatа. Фурозолин А (30) (рис. 4)
Считают, что эффективные медицинские сред
ингибирует патогенные грибы в дозе 16 мкг/мл,
ства для борьбы с такими инфекциями отсут
а также излечивает мышей с эксперименталь
ствуют. Актинобактерия, собранная в одном из
ным рассеянным кандидозом [52].
фиордов у берегов Норвегии, продуцировала
Интересно, что некоторые морские поляр
простые вещества, бутенолиды, в виде смесей
ные стероиды, например полярные стероиды из
родственных метаболитов с противоаденовирус
губки Dysidea arenaria, усиливают активность
ными свойствами. Наиболее активное вещество
противогрибковых медицинских препаратов и
имеет эффективную концентрацию EC50
отменяют флуконазольную резистентность па
91 мкМ и отсутствие заметной цитотоксичности
тогенных грибов. При этом активность проти
для клеток человека. Эти вещества представля
7 БИОХИМИЯ том 85 вып. 11 2020
1610
СТОНИК и др.
Рис. 4. Примеры морских антибиотиков с противовирусными свойствами
Рис. 5. Примеры новых антималярийных соединений из морских бактерий
ют интерес в качестве модельных соединений
раты первого и второго поколений. Хинин, хло
для создания соответствующих лекарств [56].
рохин и другие лекарственные средства защити
ли многие млн людей, но, к сожалению, позже
появились резистентные к таким лекарствам
ПРОТИВОПАРАЗИТАРНЫЕ СОЕДИНЕНИЯ
формы малярии. Как известно, эту болезнь вы
ИЗ МОРСКИХ БАКТЕРИЙ
зывает простейшее - малярийный плазмодий
(Plasmodium falciparum), переносимый к людям
На протяжении многих столетий малярия
при укусе комаров. В Африке малярия - самая
ежегодно уносила тысячи жизней, пока не были
распространенная болезнь, все больше жертв
созданы антималярийные лекарственные препа
она собирает в Южной Америке и Юго Восточ
БИОХИМИЯ том 85 вып. 11 2020
АНТИБИОТИКИ ИЗ МОРСКИХ БАКТЕРИЙ
1611
ной Азии. Поиск новых антималярийных соеди
зие метаболитов из морских изолятов бактерий и
нений и разработка соответствующих лекарств с
их перспективное биологическое действие делает
каждым годом становятся все более востребо
вполне реальным разработку на их основе новых
ванными. К недавним успехам можно отнести
медицинских препаратов, а несколько таких сое
результаты исследований, отмеченные Нобелев
динений уже стали основой новых лекарств или
ской премией по медицине за создание на осно
проходят в настоящее время доклинические или
ве природных соединений нового антималярий
клинические исследования. Структурная новиз
ного препарата артемизинина и противопарази
на и довольно сложное химическое строение
тарного препарата авермектина.
многих из них значительно затрудняют установ
К морским антималярийным соединениям
ление строения таких веществ, причем в ряде
относят триоксакарцины (38-40) (рис. 5), про
случаев эту задачу удается решить только с при
дуцируемые Streptomyсes ochraceus и Streptomyсes
менением рентгеноструктурного анализа. В от
bottropensis. Все триоксакарцины проявляют ан
личие от США и Японии, в России недостаточно
тибактериальные, противоопухолевые, а неко
развит направленный асимметрический синтез
торые (в особенности 38) и противомалярийные
природных соединений, чему следует уделить до
свойства [57].
полнительное внимание. Это затрудняет получе
Салинипостины А-K (были получены из
ние целевых веществ в необходимых для их глу
микробиального штамма Salinispora sp., собран
бокого изучения количествах. Проблему нара
ного со дна бухты Кеавекахека) ингибируют
ботки целевых веществ решают в основном од
хлорохин резистентные W2 штаммы P. falci+
ним из двух способов: получением суперпроду
parum c EC50 50 нМ-50 мкМ. Из них салинипос
центов методами селекции и мутагенеза или пе
тин А (41) проявляет самый сильный эффект
реносом соответствующих генных кластеров в
(ЕС50 50 нМ), он тормозит одну из ростовых ста
легко культивируемые виды бактерий.
дий плазмодия. Ожидают, что к нему, как не зат
Несмотря на существующие трудности и
рагивающему гем препарату, труднее будет вы
проблемы, мы в России имеем ряд преимуществ
рабатываться резистентность [58].
при работе в этой области. К ним относятся:
Новый полигидроксимакролид, бастимолид
1) большая береговая линия страны и широкие
А (42) (рис. 5), был выделен из тропической циа
возможности сбора нужного биологического
нобактерии Okeania hirsuta. Он ингибировал че
материала и 2) существование во Владивостоке
тыре лекарственно устойчивых штамма маля
единственной в стране живой коллекции морс
рийного плазмодия в наномолярных концент
ких бактерий и грибов, имеющей около 4 тыс.
рациях и был менее токсичен и для нормальных,
аксенических штаммов, собранных в различных
и для опухолевых клеток [59]. Высокая антима
географических зонах Мирового океана.
лярийная активность была найдена и для упо
Природа создала в Мировом океане уни
мянутого выше салиноспорамида А, который
кальные структурные богатства, изучение и ис
изучается в клинике как противоопухолевый
пользование которых является важной задачей
препарат. Предполагают, что он действует на 20S
фундаментальной и прикладной науки.
протеасому паразита. Введение салиноспорами
да А в дозе 130 мкг/кг защищает мышей от маля
рийной инфекции.
Финансирование. Работа выполнена при фи
нансовой поддержке Договора № 9188107 ОК
20 на выполнение научно исследовательской ра
ЗАКЛЮЧЕНИЕ
боты для нужд ФГАОУ ВО РНИМУ им. Н.И. Пи
рогова Минздрава России в 2020 году.
Морские природные соединения привлекают
Конфликт интересов. Авторы заявляют об от
в последние годы все больше внимания. В нашей
сутствии конфликта интересов.
стране их изучением занимаются не так уж мно
Соблюдение этических норм. Настоящая
го научных групп, причем они сосредоточены
статья не содержит описания каких либо иссле
только в двух городах - в Москве и Владивосто
дований с участием людей или животных в каче
ке. Неожиданно высокое структурное разнообра
стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
3.
detail/tuberculosis.
2017 who publishes list of bacteria for which new
2.
Pendleton, J. N, Gorman, S. P., and Gilmore, B. F. (2013)
antibiotics are urgently needed.
Clinical relevance of the ESKAPE pathogens, Exp. Rev.
4.
Schinke, C., Martins, T., Queiroz, S. C. N., Melo, I. S.,
Anti Infect. Ther., 11, 297 308, doi: 10.1586/eri.13.12.
and Reyes, F. G. R. (2017) Antibacterial compounds from
БИОХИМИЯ том 85 вып. 11 2020
7*
1612
СТОНИК и др.
marine bacteria, 2010-2015, J. Nat. Prod., 80, 1215 1228,
lated from the marine sponge Haliclona sp., Int. J. Syst.
doi: 10.1021/acs.jnatprod.6b00235.
Evol. Microbiol., 60, 2775 2779, doi: 10.1099/ijs.0.019869 0.
5.
Newman, D. J., and Cragg, D. J. (2007) Natural products
21.
Tian, X. P., Tang, S. K., Dong, J. D., Zhang, Y. Q., Xu, L. H.,
as sources of new drugs over the last 25 years, J. Nat. Prod.,
Zhang, S., and Li, W. J. (2009) Marinactinospora thermo+
70, 461 477, doi: 10.1021/np068054v.
tolerans gen. nov., sp. nov., a marine actinomycete isolated
6.
Jensen, P. R., and Fenical, W. (1996) Marine bacterial
from a sediment in the northern South China Sea, Int. J.
diversity as a resource for novel microbial products, J. Ind.
Syst. Evol. Microbiol.,
59,
948952, doi:
10.1099/
Microbiology, 17, 346 351, doi: 10.1007/BF01574765.
ijs.0.005231 0.
7.
Jensen, P. R., and Fenical, W. (1994) Strategies for the dis
22.
Schumann, P., Cui, X., Stackebrandt, E., Kroppenstedt,
covery of secondary metabolites from marine bacteria: eco
R. M., Xu, L., and Jiang, C. (2004) Jonesia quinghaiensis
logical perspectives, Annu. Rev. Microbiol., 48, 559 584,
sp. nov., a new member of the suborder Micrococcineae,
doi: 10.1146/annurev.mi.48.100194.003015.
Int. J. Syst. Evol. Microbiol., 54, 2181 2184, doi: 10.1099/
8.
Davidson, B. (1995) New dimensions in natural products
ijs.0.63223 0.
research: cultured marine microorganisms, Curr. Opin.
23.
Han, S. K., Nedashkovskaya, O. I., Mikhailov, V. V., Kim,
Biotechnol., 6, 284 291, doi: 10.1016/0958 1669(95)80049 2.
S. B., and Bae, K. S. (2003) Salinibacterium amurskyense
9.
Pietra, F. (1997) Secondary metabolites from marine
gen. nov., sp. nov., a novel genus of the family
microorganisms: bacteria, protozoa, algae and fungi.
Microbacteriaceae from the marine environment, Int. J.
Achievements and prospects, Nat. Prod. Rep., 14, 453 464,
Syst. Evol. Microbiol., 53, 2061 2066, doi: 10.1099/ijs.
doi: 10.1039/NP9971400453.
0.02627 0.
10.
Андрюков Б. Г., Михайлов В. В., Беседнова Н. Н., За
24.
Tian, X. P., Zhi, X. Y., Qiu, Y. Q., Zhang, Y. Q., Tang, S. K.,
порожец Т. С., Бынина Т. С., Матосова Е. В. (2018)
Xu, L. H., Zhang, S., and Li, W. J. (2009) Sciscionella
Бактериоцианогенный потенциал морских микроор
marina gen. nov., sp. nov., a marine actinomycete isolated
ганизмов, Биология моря, 44, 371 380, doi: 10.1134/
from a sediment in the northern South China Sea, Int. J.
S1063074018060020.
Syst. Evol. Microbiol., 59, 222228, doi: 10.1099/ijs.
11.
Eom, S. H., Kim, Y. M., and Kim, S. K. (2013) Marine
0.001982 0.
bacteria: potential sources for compounds to overcome
25.
Maldonado, L. A., Fenical, W., Jensen, P. R., Kauffman, C. A.,
antibiotic resistance, Appl. Microbiol. Biotechnol., 97,
Mincer, T. J., Ward, A. C., Bull, A. T., and Goodfellow, M.
4763 4773, doi: 10.1007/s00253 013 4905 y.
(2005) Salinispora arenicola gen. nov., sp. nov. and
12.
Rahman, H., Austin, B., Mitchell, W. J., Morris, P S.,
Salinispora tropica sp. nov. obligate marine actinomycetes
Jamieson, D. J., Adams, D. R., Spragg, A. M., and
belonging to the family Micromonosporaceae, Int. J. Syst.
Schweitzer, M. (2010) Novel anti infective compounds
Evol. Microbiol., 55, 1759 1766, doi: 10.1099/ijs.0.63625 0.
from marine bacteria, Mar. Drugs,
8,
498518,
26.
Jensen, P. R., Moore, B. S., and Fenical, W. (2015) The
doi: 10.3390/md8030498.
marine actinomycete genus Salinispora: a model organism
13.
Михайлов В. В. (2005) Морская микробиология в
for secondary metabolite discovery, Nat. Prod. Rep., 32,
ТИБОХ ДВО РАН, Вестник ДВО РАН, 2, 145 152.
738 751, doi: 10.1039/c4np00167b.
14.
Romanenko, L. A., Uchino, M., Frolova, G. M., Tanaka, N.,
27.
Feling, R. H., Buchanan, G. O., Mincer, T. J., Kauffman,
Kalinovskaya, N. I., Latyshev, N., and Mikhailov, V. V.
C. A., Jensen, P. R., and Fenical, W. (2003) Salinospor
(2007) Sphingomonas molluscorum sp. nov., a novel marine
amide A: A highly cytotoxic proteasome inhibitor from a
isolate with antimicrobial activity, Int. J. Syst. Evol.
novel microbial source, a marine bacterium of the new
Microbiol., 57, 358 363, doi: 10.1099/ijs.0.64441 0.
genus Salinispora, Angew. Chem. Int. Ed., 42, 355 357,
15.
Manivasagan, P., Venkatesan, S., Sivakumar, S., and Kim,
doi: 10.1002/anie.200390115.
S. K. (2014) Pharmaceutically active secondary metabo
28.
Williams, P. G., Buchanan, G. O., Feling, R. H.,
lites of marine actinobacteria, Microbiol. Res., 169, 262
Kauffman, C. A., Jensen, P. R., and Fenical, W. (2005)
278, doi: 10.1016/j.micres.2013.07.014.
New cytotoxic salinosporamides from the marine actino
16.
Ul Hassan, S. S., Anjum, K., Abbas, S. Q., Akhter, N.,
mycete Salinispora tropica, J. Org. Chem., 70, 6196 6203,
Shagufta, B. I., Shah, S. A. A., and Tasneem, U. (2017)
doi: 10.1021/jo050511+.
Emerging biopharmaceuticals from marine actinobacteria,
29.
Macherla, V. R., Mitchell, S. S., Manam, R. R., Reed, K. A.,
Environ. Toxicol. Pharmacol., 49, 34 47, doi: 10.1016/
Chao, T. H., et al. (2005) Structure activity relationship
j.etap.2016.11.015.
studies of salinosporamide A (NPI 0052), a novel marine
17.
Weyland, H. (1969) Actinomycetes in North Sea and
derived proteasome inhibitor, J. Med. Chem., 48, 3684
Atlantic Ocean sediments, Nature,
223,
858,
3687, doi: 10.1021/jm048995+.
doi: 10.1038/223858a0.
30.
Miller, E. D., Kauffman, C. A., Jensen, P. R., and Fenical,
18.
Thomas, T. R. A., Kavlekar, D. P., and LokaBharathi, P. A.
W.
(2007) Piperazimycins: cytotoxic hexadepsipep
(2010) Marine drugs from sponge microbe association - a
tides from a marine derived bacterium of the genus
review, Mar. Drugs,
8,
14171468, doi:
10.3390/
Streptomyces, J. Org. Chem., 72, 323 330, doi: 10.1021/
md8041417.
jo061064g.
19.
Reddy, T. B. K., Thomas, A. D., Stamatis, D., Bertsch, J.,
31.
Kalinovskaya, N. I., Romanenko, L. A., Kalinovsky, A. I.,
Isbandi, M., Jansson, J., Mallajosyula, J., Pagani, I.,
Ermakova, S. P., Dmitrenok, P. S., and Afiyatullov, S. S.
Lobos, E. A., and Kyrpides, N. C. (2014) The genome
(2017) The antitumor antibiotics complex of aureolic acids
online database (GOLD) v.5: a metadata management sys
from the marine sediment associated strain of Streptomyces
tem based on a four level (meta)genome project classifica
sp. KMM 9048, Nat. Prod. Comm., 12, 571 577.
tion, Nucleic Acids Res., 43, 1099 1106, doi: 10.1093/nar/
32.
Rinehart, K. L. (1999) Antitumor compounds from tuni
gku950.
cates, Med. Res. Revs., 20, 1 27, doi: 10.1002/(SICI)1098
20.
Khan, S. T., Tamura, T., Takagi, M., and Shin ya, K.
1128(200001)20:1<1::AID MED1>3.0.CO;2 A.
(2010) Streptomyces tateyamensis sp. nov., Streptomyces
33.
Rath, C. M., Janto, B., Earl, J., Ahmed, A., Hu, F. Z., et
marinus sp. nov. and Streptomyces haliclonae sp. nov., iso
al. (2011) Meta omic characterization of the marine inver
БИОХИМИЯ том 85 вып. 11 2020
АНТИБИОТИКИ ИЗ МОРСКИХ БАКТЕРИЙ
1613
tebrate microbial consortium that produces the
C: production of novel anticancer antibiotics from a
chemotherapeutic natural product ET 743, ACS Chem.
marine Actinomadura sp. isolate M048 by variation of
Biol., 6, 1244 1256, doi: 10.1021/cb200244t.
medium composition and growth conditions, J. Antibiot.,
34.
Blockley, A., Elliott, D. R., Roberts, A. P., and Sweet, M.
56, 622 629, doi: 10.7164/antibiotics.56.622.
(2017) Symbiotic microbes from marine invertebrates: dri
47.
Gao, X., Lu, Y., Xing, Y., Ma, Y., Lu, J., Bao, W., Wang, Y.,
ving a new era of natural product drug discovery, Diversity,
and Xi, T. (2012) A novel anticancer and antifungus
9, 49, doi: 10.3390/d9040049.
phenazine derivative from a marine actinomycete BM 17,
35.
Bibi, F., Faheem, M., Azhar, E. I., Yasir, M., Alvi, S. A.,
Microbial. Res., 167, 616 622, doi: 10.1016/j.micres.2012.
Kamal, M. A., Ullah, I., and Naseer, M. I. (2017) Bac
02.008.
teria from marine sponges: a source of new drugs,
48.
Nagao, T., Adachi, K., Sakai, M., Nishima, M., and Sano,
Curr. Drug Metab.,
18,
1118, doi:
10.2174/
H. (2001) Novel macrolactins as antibiotic lactones from a
1389200217666161013090610.
marine bacterium, J. Antibiot., 54, 333 339, doi: 10.7164/
36.
Francisco, J. A., Cerveny, C. G., Meyer, D. L., Mixan, B. J.,
antibiotics.54.333.
Klussman, K., et al. (2003) cAC10 vcMMAE, an anti
49.
Karpinsky, T. M. (2019) Marine macrolides with antibacte
CD30-monomethyl auristatin E conjugate with potent
rial and/or antifungal; activity, Mar. Drugs, 17, 241,
and selective antitumor activity, Blood, 102, 1458 1465,
doi: 10.3390/md17040241.
doi: 10.1182/blood 2003 01 0039.
50.
Sato, S., Iwata, F., Yamada, S., and Katayama, M. (2012)
37.
Zhou, Q., and Kim, J. (2015) Advances in the development
Neomaclafungins A-I: oligomycin class macrolides from
of site specific antibody drug conjugation, Anticancer
a marine derived actinomycete, J. Nat. Prod., 75, 1974
Agents Med. Chem.,
15,
828836, doi:
10.2174/
1982, doi: 10.1021/np300719g.
1871520615666150302125448.
51.
Zhu, S., and Wu, Y. (2017) Synthesis and configuration of
38.
Jang, K. H., Nam, S. J., Locke, J. B., Kauffman, C. A.,
neomaclafungin A, Chem. Asian J., 12, 22112215,
Beatty, D. S., Paul, L. A., and Fenical, W.
(2013)
doi: 10.1002/asia.201700950.
Anthracimycin, a potent anthrax antibiotic from a marine
52.
Wyche, T. P., Piotrowsky, J. S., Hou, Y., Braun, D,
derived actinomycete, Angew. Chem. Int. Ed., 52, 7822
Deshpande, R., et al. (2014) Furozoline A: marine derived
7824, doi: 10.1002/anie.201302749.
polyketide with antifungal in vivo efficacy, Angew. Chem.
39.
Alt, S., and Wilkinson, B. (2015) Biosynthesis of the novel
Int. Ed., 53, 1 5, doi: 10.1002/anie.201405990.
macrolide antibiotic anthracimycin, ACS Chem. Biol., 10,
53.
Abdelmohsen, U. R., Balasubramanian, S., Oelschlaeger,
2468 2479, doi: 10.1021/acschembio.5b00525.
T. A., Grkovic, T., Pham, N. B., Quinn, R. J., and
40.
Socha, A. M., LaPlante, K. L., and Rowley, D. C. (2006)
Hentschel, U. (2017) Potential of marine natural products
New bisanthraquinone antibiotics and semi synthetic
against drug resistant, viral, and parasitic infections,
derivatives with potent activity against clinical Staphylococ+
Lancet Infect. Dis., 17, e30 e41, doi: 10.1016/S1473
cus aureus and Enterococcus faecium isolates, Bioorg. Med.
3099(16)30323 1.
Chem., 14, 8446 8454, doi: 10.1016/j.bmc.2006.08.038.
54.
Lee, J. G., Yoo, I. D., and Kim, W. G. (2007) Differential
41.
McArthur, K. A., Mitchell, S. S., Tsueng, G., Rheingold, A.,
antiviral activity of benzastatin C and its dechlorinated
White, D. J., Grodberg, J., Lam, K. S, and Potts, B. C. M.
derivative from Streptomyces nitrosporeus, Biol. Pharm
(2008) Lynamicins A E, chlorinated bisindole pyrrole
Bull., 30, 795 797, doi: 10.1248/bpb.30.795.
antibiotics from a novel marine actinomycete, J. Nat.
55.
Raveh, A., Delecta, P. C., Dobry, C. J., Peng, W., Schultz,
Prod., 71, 1732 1737, doi: 10.1021/np800286d.
P. J., Blakely, P. K., and Miller, D. J. (2013) Discovery of
42.
Tareq, F. S., Kim, J. H., Lee, M. A., Lee, H. S., Lee, J. S.,
potent broad spectrum antivirals derived from marine acti
Lee, Y. J., and Shin, H. J. (2013) Antimicrobial gageo
nobacteria, PLOS One, 8, e 82318, doi: 10.1371/journal.
macrolactins characterized from the fermentation of the
pone.0082318.
marine derived bacterium Bacillus subtilis under optimum
56.
Strand, M., Carlsson, M., Uvell, H., Islam, K., Edlung, K.,
growth conditions, J. Agricult. Food Chem., 61, 3428 3434,
Cullman, I., et al. (2014) Isolation and characterization of
doi: 10.1021/jf4009229.
anti adenoviral secondary metabolites from marine acti
43.
Palomo, S., González, I., de la Cruz, M., Mart n, J.,
nobacteria, Mar. Drugs, 12, 799821, doi: 10.3390/
Tormo, J. R., Anderson, M., Hill, R. T., Vicente, F., Reyes, F.,
md12020799.
and Genilloud, O. (2013) Sponge derived Kocuria and
57.
Maskey, R. P., Helmke, E., Kayser, O., Fiebig, H. H.,
Micrococcus spp. as sources of the new thiazolyl peptide
Maier, A., Busche, A., and Laatsch, H. (2004) Anti cancer
antibiotic kocurin, Mar. Drugs, 11, 10711086, doi:
and antibacterial trioxacarcins with high anti malaria
10.3390/md11041071.
activity from a marine Streptomycete and their absolute
44.
Mahajan, G., Thomas, B., Parab, R., Patel, Z. E,
stereochemistry, J. Antibiot., 57, 771 779, doi: 10.7164/
Kuldharan, S., et al. (2013) In vitro and in vivo activities of
antibiotics.57.771.
antibiotic PM181104, Antimicrob. Agents Chemother., 57,
58.
Schulze, C. J., Navarro, G., Ebert, D., DeRisi, J., and
5315 5319, doi: 10.1128/AAC.01059 13.
Lenington, R. G. (2015) Salinipostins A K, long chain
45.
El Gendy, M. M. A., and El Bondkly, A. M. A. (2010)
bicyclic phosphotriesters as a potent and selective anti
Production and genetic improvement of a novel antimy
malarial chemotype, J. Org. Chem., 80, 13121320,
cotic agent, saadamycin, against dermatophytes and other
doi: 10.1021/jo5024409.
clinical fungi from endophytic Streptomyces sp. Hedaya48,
59.
Shao, C. L., Lenington, R. G., Balunas, M. J., Centeno, A.,
J. Indust. Microbiol. Biotech., 37, 831 841, doi: 10.1007/
Boudreau, P., et al. (2015) Bastimolide A, a potent anti
s10295 010 0729 2.
malarial polyhydroxy macrolide from a marine cyanobac
46.
Maskey, R. P., Li, F. C., Qin, S., Fiebig, H. H., and
terium Okeania hirsuta, J. Org. Chem., 80, 7849 7855,
Laatsch, H. (2003) Chandrananimycins A approximately
doi: 10.1021/acs.joc.5b01264.
БИОХИМИЯ том 85 вып. 11 2020
1614
СТОНИК и др.
ANTIBIOTICS FROM MARINE BACTERIA
Review
V. А. Stonik*, T. N. Makarieva, and L. K. Shubina
Elyakov Pacific Institute of Bioorganic Chemistry, Far Eastern Branch of the Russian Academy of Science,
690022 Vladivostok, Russia; E+mail: stonik@piboc.dvo.ru
Received July 3, 2020
Revised August 5, 2020
Accepted August 5, 2020
This review discusses main directions and results of the studies on antibiotics produced by bacteria living in the marine
environment. In recent years many obligate marine species and strains were studied, diverse metabolites were isolat
ed, and their chemical structures were elucidated. Among them here were natural compounds toxic against tumor
cells, pathogenic bacteria, viruses, and malaria plasmodial species; these compounds often had no analogues among
the natural products of terrestrial origin. Some isolated compounds form a basis of active ingredients in medicinal
preparations used in clinic practice, while others are under different stages of preclinical or clinical studies. Much
attention has been paid in recent years to producers of marine derived antibiotics isolated from the deep sea habitats,
from the surface of marine invertebrates and algae, as well as from symbiotic microorganisms.
Keywords: marine bacteria, antibiotics, cytotoxic effect, antibacterial effect, antifungal effect, antiviral effect, anti
parasitic effect
БИОХИМИЯ том 85 вып. 11 2020