БИОХИМИЯ, 2020, том 85, вып. 11, с. 1633 - 1675
УДК 577.12
КРАТКИЙ СПРАВОЧНИК ПО НИЗКОМОЛЕКУЛЯРНЫМ
ИНГИБИТОРАМ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ*
Обзор
© 2020
С.Е. Дмитриев1,2,3**, Д.О. Владимиров2, К.А. Лашкевич1
1 НИИ физико химической биологии имени А.Н. Белозерского,
Московский государственный университет имени М.В. Ломоносова, 119234 Москва, Россия;
электронная почта: sergey.dmitriev@belozersky.msu.ru
2 Московский государственный университет имени М.В. Ломоносова,
факультет биоинженерии и биоинформатики, 119234 Москва, Россия
3 Институт молекулярной биологии имени В.А.Энгельгардта РАН, Москва, 119991 Россия
Поступила в редакцию 26.08.2020
После доработки 04.10.2020
Принята к публикации 04.10.2020
Эукариотическая рибосома и аппарат кеп зависимой трансляции являются привлекательными мишенями
для противоопухолевой, антивирусной, противовоспалительной и антипаразитарной терапии. В настоящее
время известен широкий спектр низкомолекулярных ингибиторов, специфично подавляющих биосинтез
белка в клетках эукариот. Большое количество таких веществ обнаруживается среди хорошо изученных ан
тибиотиков, чьё действие направлено на рибосому. Они включают ингибиторы транслокации и пептидил
трансферазного центра, блокаторы рибосомного пептидного туннеля, индукторы ошибок декодирования,
преждевременной терминации и сквозного прочтения стоп кодонов, а также модуляторы связывания ком
понентов трансляционного аппарата с рибосомой. Отдельного внимания заслуживают низкомолекулярные
ингибиторы аминоацил тРНК синтетаз, трансляционных факторов и сигнальных путей, ассоциированных
с трансляцией, в том числе ингибиторы киназы mTOR. Рибосом направленные ингибиторы широко при
меняются для анализа экспрессии генов методом рибосомного профайлинга, при селекции культивируемых
клеток, используются в качестве фунгицидов в сельском хозяйстве и как противогрибковые и антигельминт
ные средства в медицине. С веществами, влияющими на точность распознавания стоп кодона, связаны на
дежды в терапии наследственных заболеваний, вызываемых нонсенс мутациями, и восстановлении функ
ции онкосупрессоров в опухолях. Некоторые ингибиторы биосинтеза белка обнаруживают также свойства
геропротекторов. В данном обзоре мы приводим список как хорошо изученных, так и малоизвестных инги
биторов эукариотической трансляции (не касаясь биосинтеза белка в митохондриях и пластидах), допол
ненный информацией об их непосредственных мишенях и краткой характеристикой механизмов действия.
Мы также представляем обновляемую базу данных, которая на данный момент содержит информацию о 370
КЛЮЧЕВЫЕ СЛОВА: низкомолекулярные ингибиторы, рибосомные 40S и 60S субчастицы, 4E BP1, фос
форилирование eIF2α, риботоксический стресс, циклогексимид, харрингтонин, трихотециновые микоток
сины, аминогликозиды, рапамицин.
DOI: 10.31857/S0320972520110093
ВВЕДЕНИЕ
консервативность функционального ядра, эука
риотическая рибосома по своей структуре до
Трансляционный аппарат эукариот имеет
вольно сильно отличается от бактериальной;
несколько особенностей, касающихся как
имея много общего с рибосомой архей, она тем
структуры его компонентов, так и механизмов
не менее содержит целый ряд специфических
трансляционного цикла [1-3]. Несмотря на
элементов: дополнительных сегментов рРНК,
Принятые сокращения: АРСаза - аминоацил тРНК синтетаза; ГАЦ - ГТФаза активирующий центр; ДЦ - деко
дирующий центр; ПТЦ - пептидилтрансферазный центр; РПТ - рибосомный пептидный туннель; 5′ TOP - 5′ концевой
олигопиримидиновый тракт, 5′ terminal oligopyrimidine tract; ISR - интегрированный стрессовый ответ, integrated stress
response.
* Статья на английском языке опубликована в режиме Open Access (открытого доступа) на сайте издательства Springer
** Адресат для корреспонденции.
1633
1634
ДМИТРИЕВ и др.
эукариот специфичных белков и их участков [2,
мости от своей концентрации, а при воздей
3]. В ходе эволюции эукариоты выработали уни
ствии на живые клетки способны вызывать ри
кальные особенности инициации трансляции,
ботоксический или другие виды стресса, что мо
терминации и рибосомного рециклинга [1,
жет изменять характер ответа на ингибитор со
4-6]. Наиболее яркой особенностью эукариоти
временем.
ческой трансляции является кеп зависимое ри
В данном обзоре мы предприняли попытку
босомное сканирование при инициации транс
составить систематизированный список низко
ляции, которое подразумевает посадку 40S ри
молекулярных ингибиторов эукариотической
босомной субчастицы вблизи 5′ конца мРНК
трансляции, представив их в формате таблиц с
(как правило, содержащего m7G кеп) и её нап
минималистичными комментариями (в данной
равленное движение в сторону 3′ конца до об
статье) и в формате обновляемой базы данных
наружения стартового кодона [1, 5].
на сайте НИИ ФХБ имени А.Н. Белозерского
Наличие как консервативных, так и специ
фичных черт обуславливает то, что набор ве
известные или типичные ингибиторы подробно
ществ, подавляющих биосинтез белка в эукарио
описаны в тексте данной статьи и представлены
тической клетке, включает как универсальные
на рисунке. В силу ограниченности места мы не
ингибиторы рибосом (действующие, как прави
рассматриваем здесь ингибиторы трансляции в
ло, на представителей всех царств живого), так и
митохондриях и пластидах, поскольку аппарат
эукариот специфичные блокаторы, направлен
этих органелл относится к бактериальному типу.
ные либо также на рибосому, либо на другие
Мы также не будем рассматривать ингибиторы
компоненты трансляционного аппарата. На ри
белковой природы - вещества типа рицина или
босоме вещества могут связываться с разными
дифтерийного токсина, несмотря на их важ
участками: с пептидилтрансферазным центром
ность и широкую распространённость.
(ПТЦ), Е сайтом, рибосомным пептидным тун
нелем (РПТ) или ГТФаза активирующим цент
ром (ГАЦ) на 60S субчастице; с декодирующим
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ
центром (ДЦ) или другими участками на 40S
РИБОСОМЫ
субчастице; с участками связывания трансляци
онных факторов и так далее [7-9].
Существует несколько типов рибосомных
Помимо мишеней и механизма действия,
ингибиторов, общих для представителей всех
ингибиторы отличаются также по эффекту на
царств живого. Большая их часть направлена на
полисомы, который легко наблюдать в прямом
консервативные стадии элонгационного цикла:
эксперименте. Те из них, которые блокируют
связывание лигандов, транспептидацию и
инициацию, но не блокируют элонгацию, как
транслокацию, их мы и рассмотрим в первую
правило, разбирают полисомы; ингибиторы
очередь (табл. 1). Те из них, которые действуют
элонгации могут как разбирать, так и стабили
на рибосомы всех типов, мы будем называть
зировать полисомы в зависимости от того,
«универсальными ингибиторами». В противном
действуют ли они на «внутренние» рибосомы в
случае речь будет идти об эукариот специфич
полисоме или только на новоинициировавшие
ных блокаторах рибосомы либо об архей и эу
рибосомы (см. ниже). Последний тезис не оче
кариот специфичных
(«АЭ ») ингибиторах.
виден и часто вызывает путаницу, когда некото
Специфичность действия определяется, как
рые вещества, действующие на стадии элонга
правило, тонкими различиями в строении места
ции (например, харрингтонин и лактимидоми
связывания: структурные исследования показы
цин), называют ингибиторами инициации. Ин
вают, что часто достаточно замены одного нук
гибиторы терминации могут вызывать стабили
леотида в рРНК или разницы в единственной
зацию полисом и увеличение в них числа рибо
аминокислотной позиции рибосомного белка,
сом, но если речь идёт об индукторах сквозного
чтобы конфигурация участка не позволяла ин
прочтения стоп кодонов, то влияния на поли
гибитору связаться. Многие из этих веществ бы
сомный профиль обычно не наблюдается. То же
ли идентифицированы ещё в 60-70 е годы
самое можно сказать и об индукторах наруше
прошлого века благодаря усилиям нескольких
ний декодирования, влияющих на правильность
групп авторов, среди которых стоит выделить
синтезируемых полипептидов, но не сказываю
Д. Васкеса, А. Химинеса и С. Пестка. Наш обзор
щихся на полисомном профиле. Индукторы
будет охватывать период с конца 60 х годов, оз
преждевременной терминации (пуромицин) за
накомиться же с более ранними работами и ис
кономерно разбирают полисомы. Картина ус
торией открытия тех ингибиторов, которые бы
ложняется тем, что некоторые ингибиторы про
ли найдены более полувека назад, можно в ста
являют разные механизмы действия в зависи
рых обзорах упомянутых классиков [10-13].
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1635
вортманнин
LY294002
дактолисиб
метионин сульфамид
охратоксин A
самотосилиб
гистидинол
боррелидин
омипалисиб
метионил аденилат
воксталисиб
этионин
фосмидозин
фебрифугин
реверомицин A
таваборол
галофугинон
фураномицин
торин 1, 2
PP242
INK128
Ku0063794
патеамин A
рапамицин
4EGI 1
салубринал
эверолимус
4E1RCat
Sal003
ридафоролимус
сордарин
4E2RCat
темсиролимус
GM193663
бувардин
RA VII
DDD107498
мориниафунгин
арнамиал
рибавирин ?
пурпуромицин
eIFsixty 4
аплидин
дидемнин A, B
тамандарин A, B
MDMP
цитотриенин А
микотриенины I,II
эдеин
нанноцистин А
MK 28
тернатин
CCT020312
элизабатин A
мефлоквин
сильвестрол
рокагламиды
гиппуристанол
гиперицин ?
мефлоквин ?
PF 06446846
BTdCPU
PF 0378503
тетраценомицин X
G418
TC007
дабрафениб
G418
паромомицин
NB124
MK1775
паромомицин
аталурен ?
амлексанокс
анизомицин
бластицидин S
RTC14
дезоксиниваленол
ликорин
нагилактон C
BZ16
веррукарин A
амицетин
агеластатин A
TCP 1109
T 2 токсин
бруцеантин
бактоболин A
гигромицин B ?
нарциклазин
харрингтонин
A201A
ауринтрикарбоновая к та
паромомицин ?
спарсомицин
гомохаррингтонин
пуромицин
пирокатехол фиолетовый
неомицин ?
шоудомицин
гиродазол
мириапорон 3/4
галлеин
апидаецин ?
циклогексимид
криптоплеврин
NSC119889
лактимидомицин
эметин
микаламид А, B
NH125
NSC119893
лиссоклимид
педерин
гигромицин B
филлантозид
амикумацин A
пактамицин
AICAR
A 769622
“991”
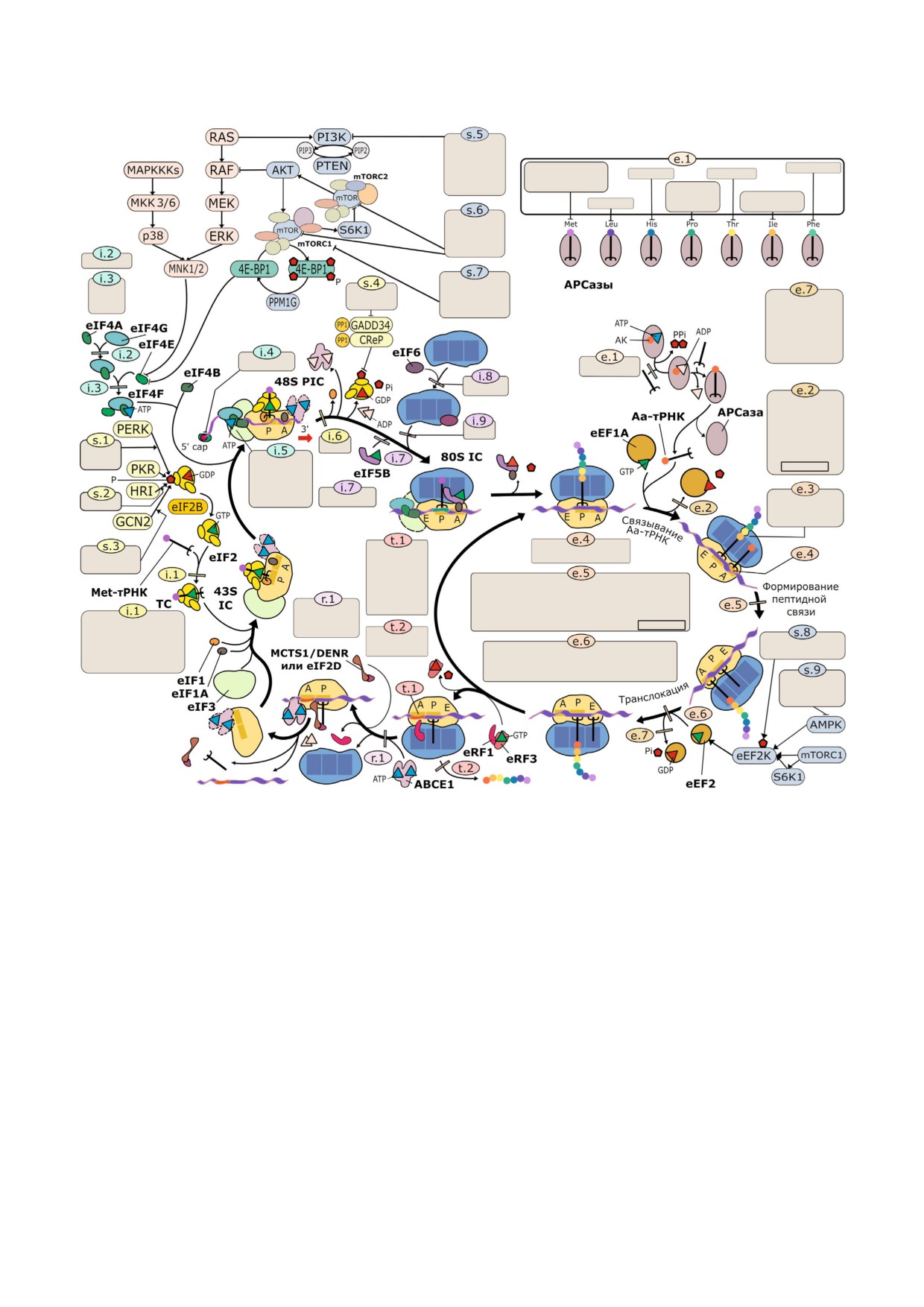
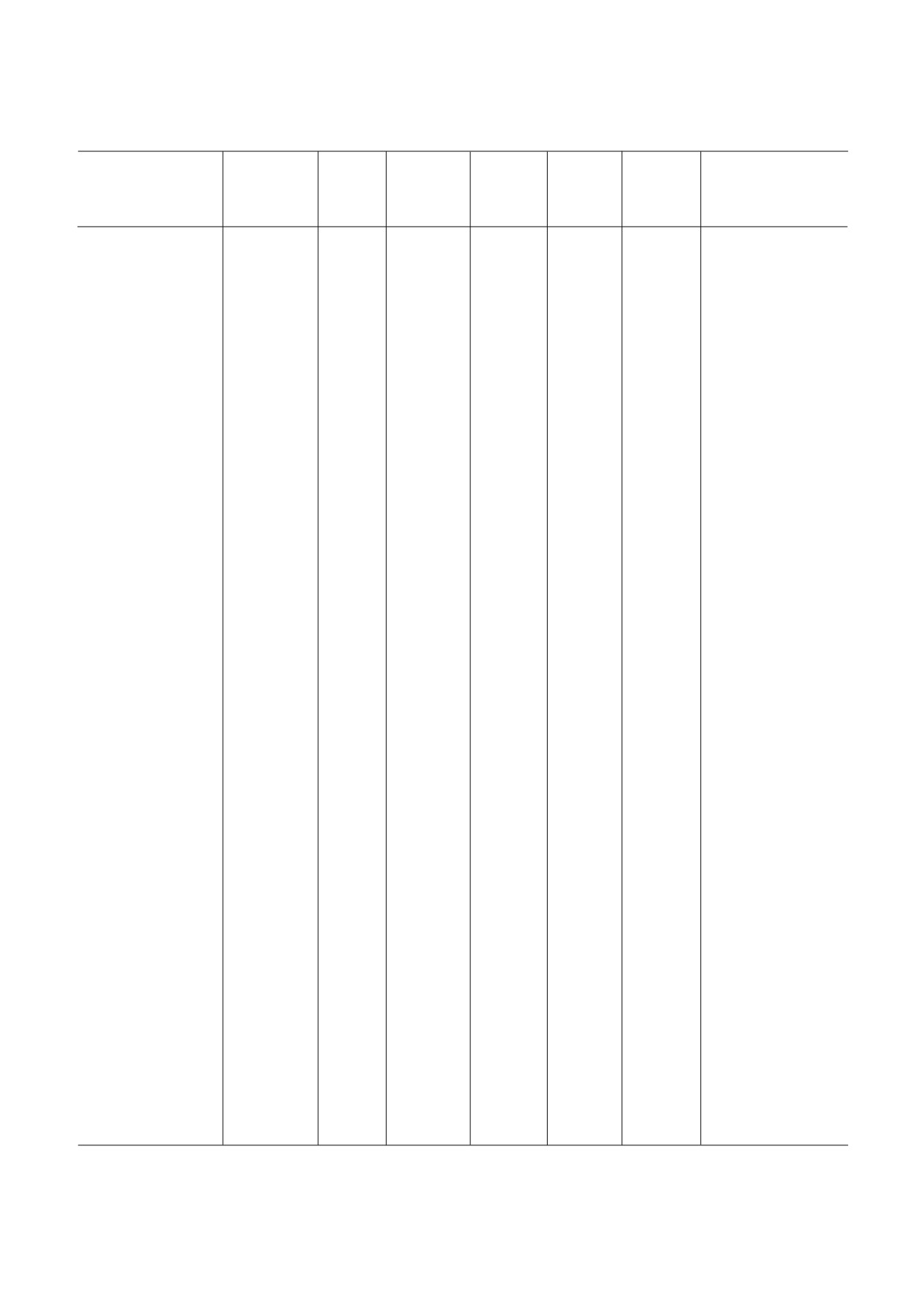
Схема трансляционного цикла эукариот и избранных сигнальных каскадов, регулирующих трансляционную активность,
с указанием наиболее широко используемых и хорошо охарактеризованных ингибиторов. Вещества сгруппированы в со
ответствии со стадиями синтеза белка, в которых участвуют их мишени. Стадии обозначены кодами. Инициация транс
ляции: i.1 - связывание eIF2 с Met тРНКi и образование тройственного комплекса eIF2/Met тРНКi/GTP (TC); i.2 - взаи
модействие eIF4A и eIF4G; i.3 - взаимодействие eIF4E и eIF4G; i.4 - связывание eIF4E с m7G кепом на 5′ конце мРНК;
i.5 - ингибирование хеликазной активности eIF4A при посадке eIF4F на мРНК и последующем рибосомном сканирова
нии; i.6 - узнавание AUG кодона при сканировании; i.7 - взаимодействие eIF5B с 60S субчастицей; i.8 - взаимодействие
eIF6 с 60S субчастицей; i.9 - присоединение 60S субчастицы к 48S преинициаторному комплексу (48S PIC) с образовани
ем 80S инициаторного комплекса (80S IC). Элонгация и сопутствующие реакции: e.1 - аминоацилирование тРНК; e.2 -
диссоциация eEF1A/GDP после доставки аминоацил тРНК (Аа тРНК); e.3 - продвижение полипептида в рибосомном
туннеле; e.4 - декодирование; e.5 - пептидилтрансферазная реакция; e.6 - транслокация; e.7 - диссоциация eEF2/GDP
после транслокации. Терминация: t.1 - узнавание стоп кодона; t.2 - гидролиз пептидил тРНК. Рециклинг: r.1 - диссо
циация 60S субчастицы. Коды модуляторов сигнальных каскадов: s.1-s.3 - активаторы киназ фактора eIF2; s.4 - ингиби
торы фосфатаз фактора eIF2; s.5 - ингибиторы киназы PI3K; s.6 - ингибиторы активного центра киназы mTOR; s.7 - ал
лостерические ингибиторы mTOR в составе комплекса mTORC1. Названия веществ, действующих на ту же стадию, но об
ладающих принципиально иным механизмом действия, выделены рамкой
Рибосом/направленные ингибиторы элонга/
липептида. К таким веществам относятся инги
ции. Подавляющее большинство известных сей
биторы пептидилтрансферазной реакции и
час ингибиторов, мишенью которых является
транслокации, блокаторы пептидного туннеля,
рибосома, действуют на стадии элонгации по
индукторы ошибок декодирования и прежде
БИОХИМИЯ том 85 вып. 11 2020
1636
ДМИТРИЕВ и др.
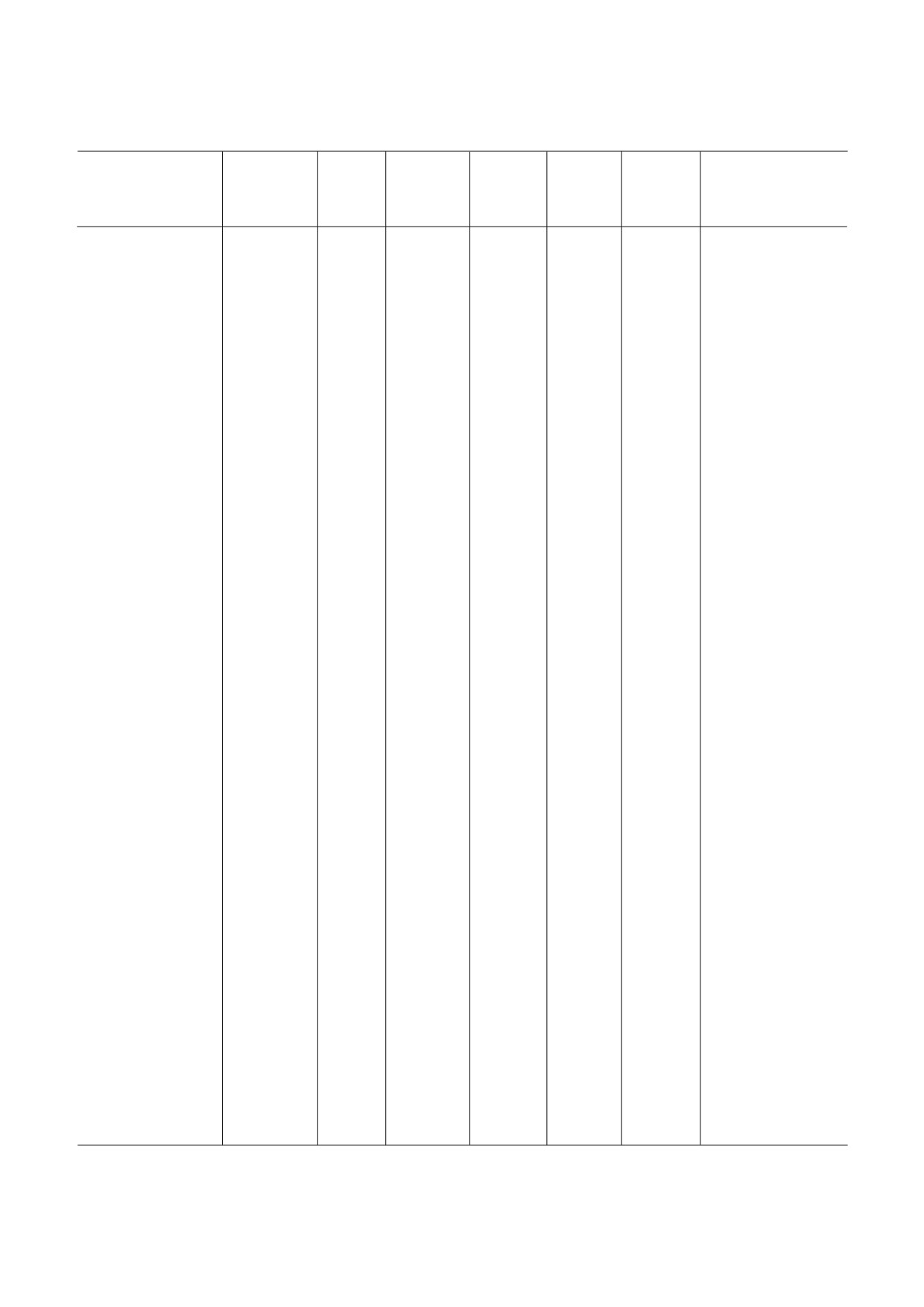
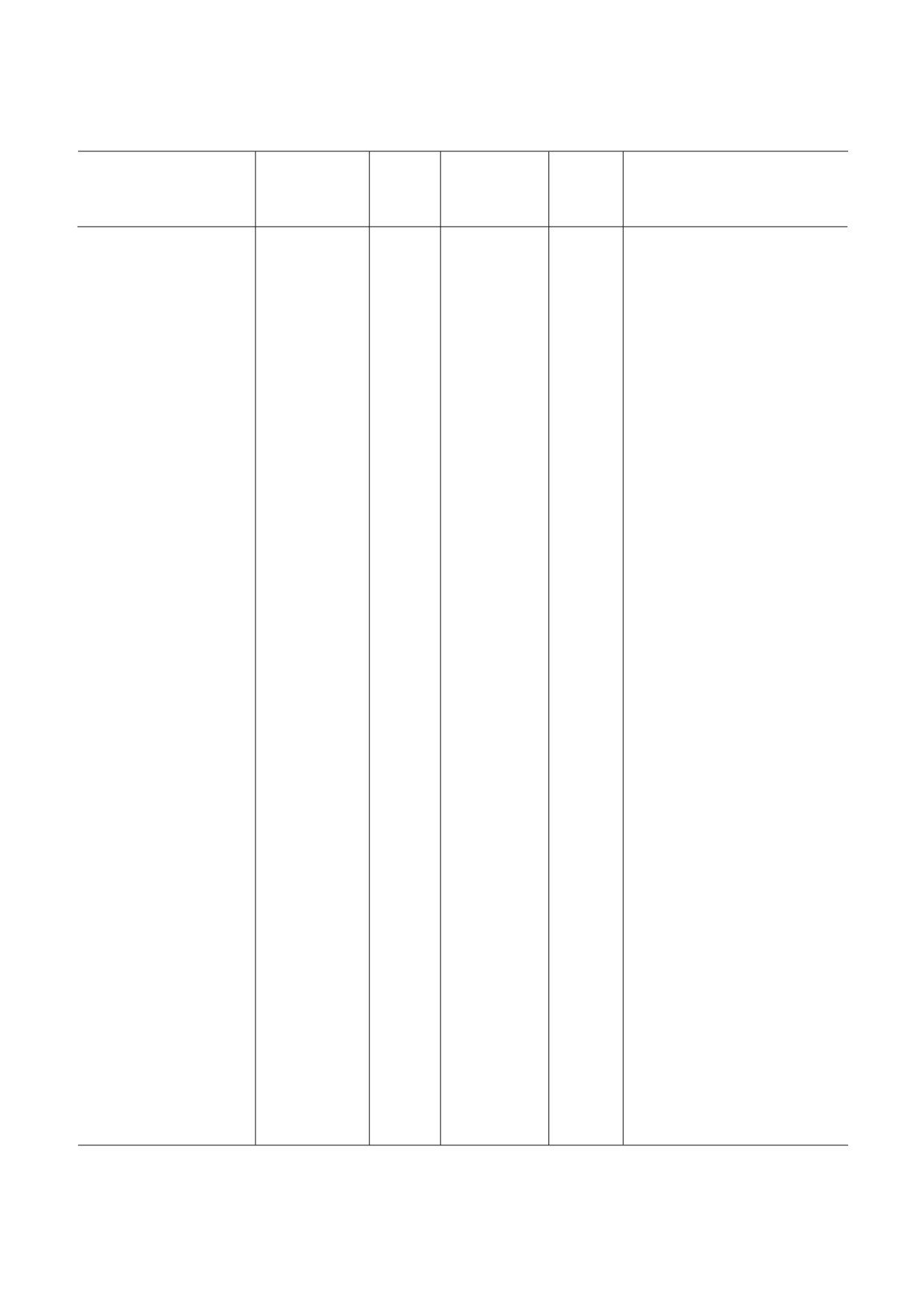
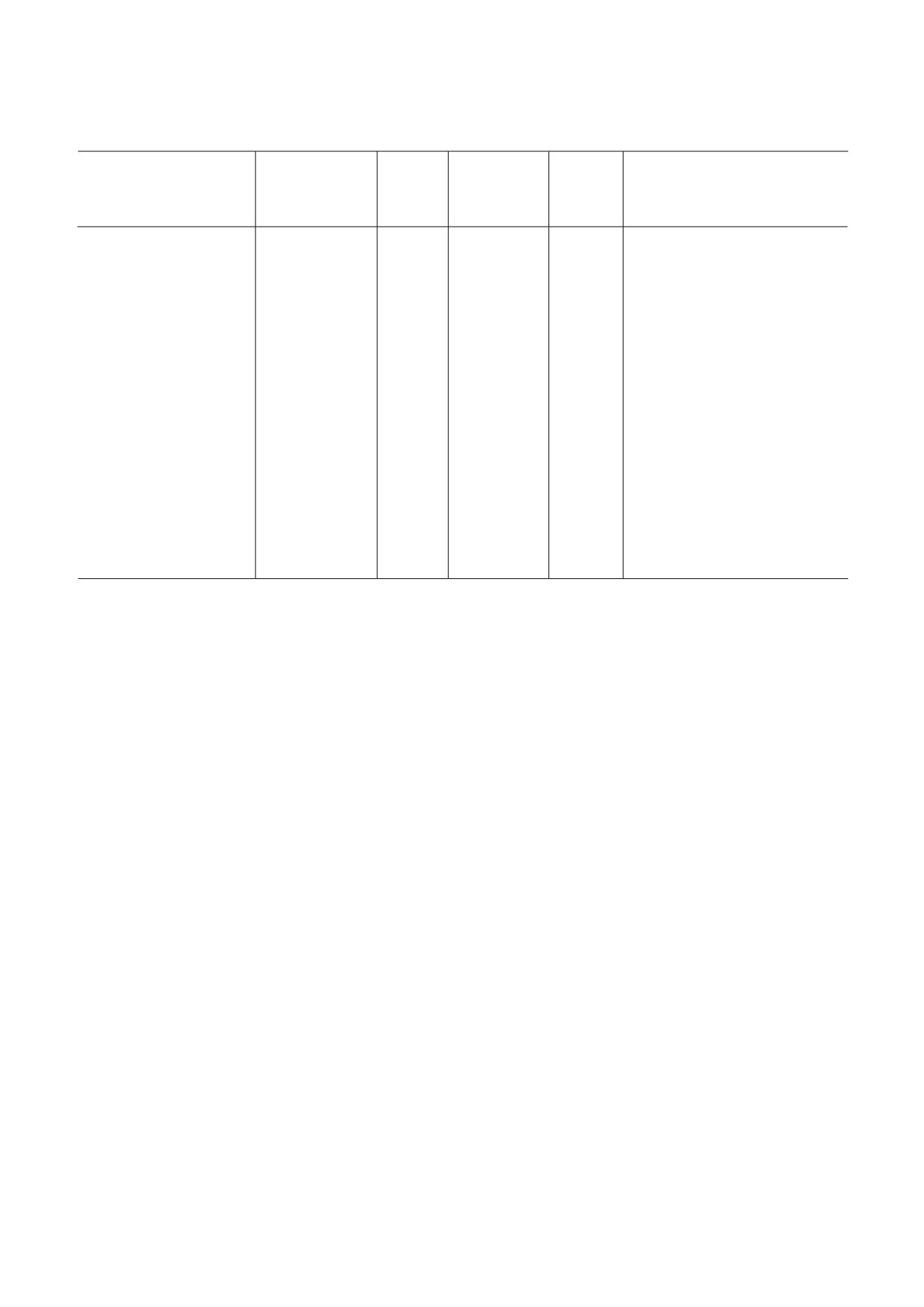
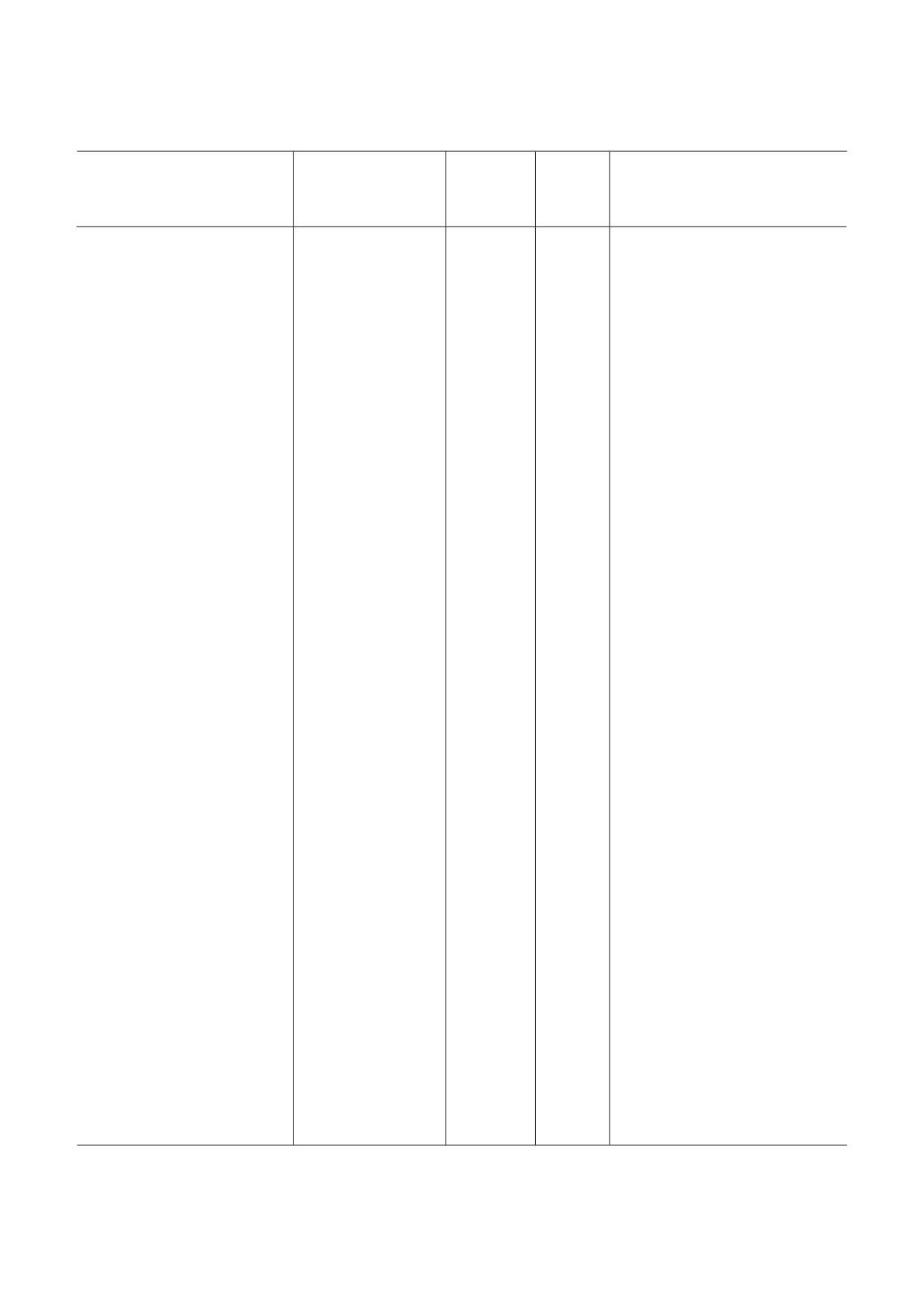
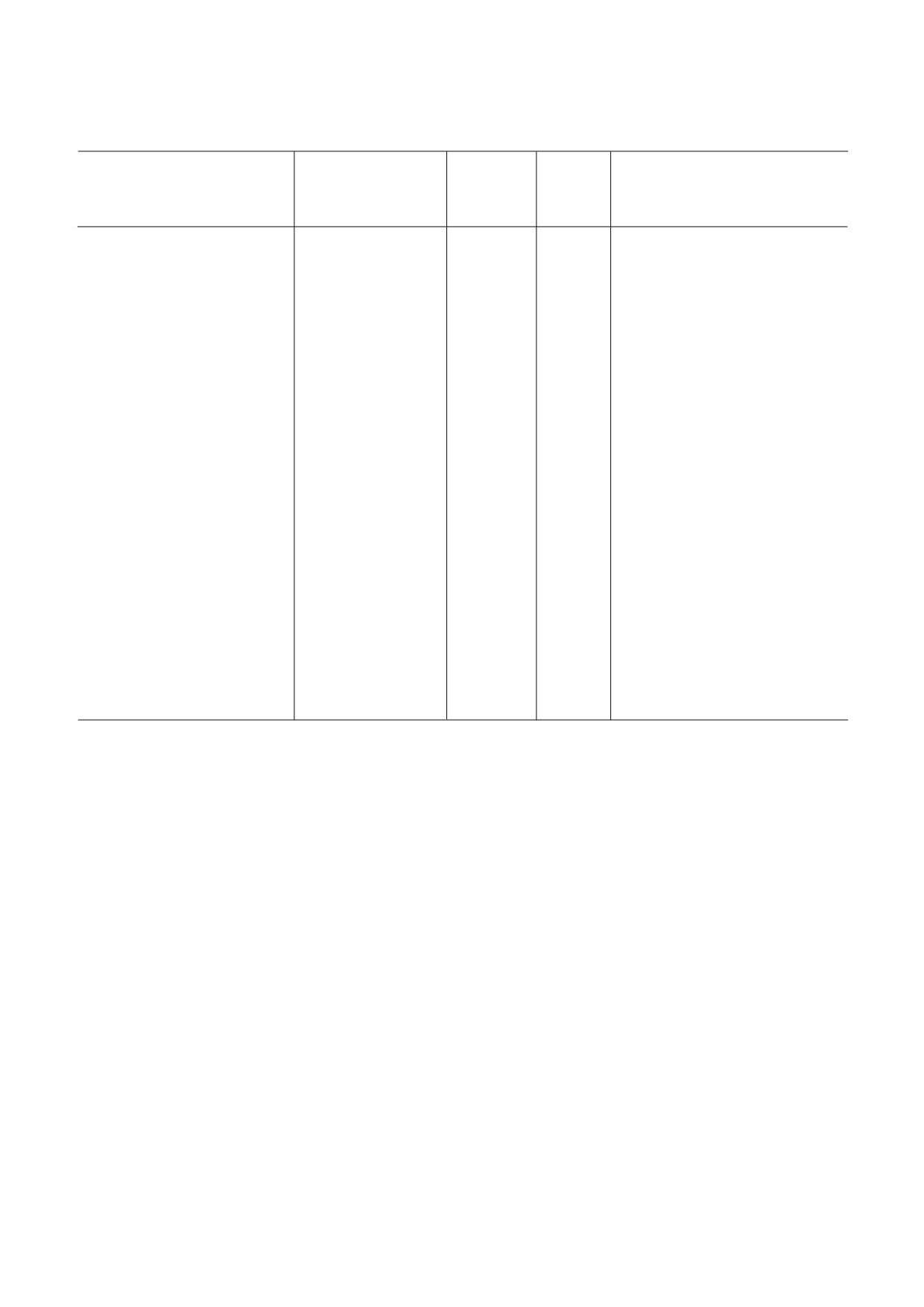
Таблица 1. Низкомолекулярные ингибиторы эукариотической рибосомы
Класс,
Специ
Взаимодей
Место свя
Стадия
Эффект
Название
группа
фичность
ствующая
зывания##
трансля
на поли
Механизм действия
веществ
(Б, А, Э)#
субчастица
ционного
сомы####
рибосомы
цикла###
Анизомицин/
пирролидин,
А, Э
60S
ПТЦ (А)
Э
стаб.
ингибитор ПТЦ
флагецидин
группа ани
(anisomycin/
зомицина
flagecidin)
Деацетиланизомицин
- // -
Э
60S
ПТЦ (А)
Э
стаб.?
- // -
(deacetylanisomycin)
Пруссин/L 657,398
- // -
Э
60S
ПТЦ (А)?
Э?
- // -
(preussin)
Калонектрин
трихотецин A
60S?
ПТЦ (А)?
Э
стаб./разб.
- // -
(calonectrin)
Неосоланиол
- // -
Э
60S?
ПТЦ (А)?
Э?
?
- // - ?
(neosolaniol)
Скирпентриол
- // -
Б, А, Э
60S
ПТЦ (A)
Э
стаб.
- // -
(scirpentriol)
Диацетоксискирпе
- // -
Б, А, Э
60S
ПТЦ (A)
Э
разб.
- // -
нол/ангидин
(diacetoxyscirpenol/
anguidine)
T 2 токсин
- // -
Э
60S
ПТЦ (A)
Э
разб.
- // -
(T 2 toxin)
HT 2 токсин
- // -
Э
60S
ПТЦ (А)?
Э?
?
- // - ?
(HT 2 toxin)
- // - ?
T 2 триол (T 2 triol)
- // -
Э
60S?
ПТЦ (А)?
Э?
?
Триходермин
- // -
Э
60S
ПТЦ
Э
стаб./разб.
- // -
(trichodermin)
Триходермол
- // -
Э
60S
ПТЦ
Э
стаб.
- // -
(trichodermol)
Диацетилверрукарол
- // -
Э
60S?
ПТЦ (А)?
Э?
?
- // - ?
(diacetylverrucarol)
Трихотеколон
- // -
Б, А, Э
60S?
ПТЦ (А)?
Э?
стаб./разб.
- // - ?
(trichothecolone)
Трихотецин
трихотецин B
Э
60S
ПТЦ (А)?
Э
стаб./разб.
- // -
(trichothecin)
Фузаренон X
- // -
Э
60S
ПТЦ
Э
стаб.
- // -
(fusarenon X)
Вомитоксин/
- // -
Э
60S
ПТЦ (А)
Э
разб.
- // -
дезоксиниваленол
(vomitoxin/
deoxynivalenol)
Ниваленол
- // -
Э
60S?
ПТЦ (А)?
Э?
разб.
- // - ?
(nivalenol)
Кротоцин (crotocin)
трихотецин C
Э
60S
ПТЦ
Э, Т?
стаб.
- // - ?
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1637
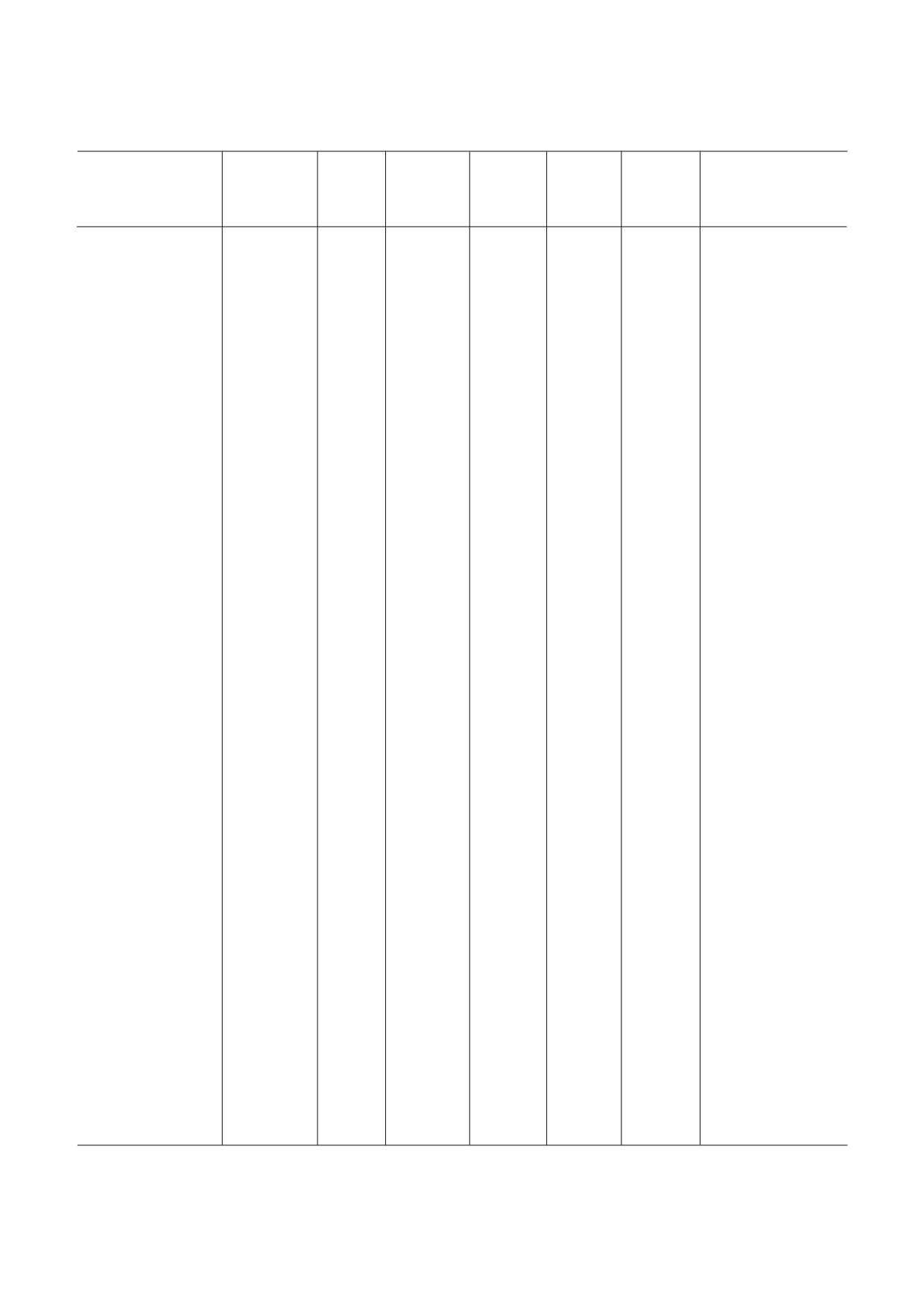
Продолжение таблицы 1
Класс,
Специ
Взаимодей
Место свя
Стадия
Эффект
Название
группа
фичность
ствующая
зывания##
трансля
на поли
Механизм действия
веществ
(Б, А, Э)#
субчастица
ционного
сомы####
рибосомы
цикла###
Сатратоксин G
трихотецин D
Э
60S
ПТЦ (A)
Э?
разб.
- // - ?
(satratoxin G)
Роридин A (roridin A)
- // -
Э
60S?
ПТЦ (А)?
Э?
?
- // - ?
Миротецин A
- // -
Э
60S?
ПТЦ (А)?
Э?
?
- // - ?
(myrothecin A)
Веррукарин A/
трихотецин D,
Э
60S
ПТЦ (A)
Э
стаб.
- // -
мукономицин A
мукономи
(verrucarin A/
цин
muconomycin A)
Мукономицин B
- // -
Э
60S?
ПТЦ (А)?
Э?
стаб.
- // -
(muconomycin B)
Нарциклазин
тетрагетеро
Б, А, Э
60S
ПТЦ (A)
Э
стаб.
- // -
(narciclasine)
циклический
алкалоид
Изонарциклазин
- // -
Б, А, Э
60S?
ПТЦ (A)?
Э
стаб.
- // -
(isonarciclasine)
Ликорин (lycorine)
- // -
Б, А, Э
60S
ПТЦ (A)
Э
?
- // -
Псевдоликорин
- // -
Б, А, Э
60S
ПТЦ (A)
Э
?
- // -
(pseudolycorine)
Гемантамин
- // -
А, Э
60S
ПТЦ (A)
Э
стаб.
- // -
(haemanthamine)
Гемантидин
- // -
А, Э
60S
ПТЦ (A)
Э
(стаб.)
- // -
(haemanthidine)
Булбиспермин/гама
- // -
Э
60S
ПТЦ (A)
Э
(стаб.)
- // -
ин (bulbispermine/
hamayne)
Претацеттин
- // -
Э
60S
ПТЦ (А)
Э
стаб.
- // -
(pretazettine)
Жонквейлин
- // -
Э?
60S?
ПТЦ (А)?
Э?
?
- // - ?
(jonquailine)
Кринамин
- // -
Б, А, Э
60S
ПТЦ (A)
Э
(стаб.)
- // -
(crinamine)
Агеластатин А
гетероцикли
Э
60S
ПТЦ (A)
Э
?
- // -
(agelastatin A)
ческий алка
лоид
Цефалотаксин
гетероцикли
(Э)
(60S)
ПТЦ (A)?
(Э)
(стаб.)
- // - (слабый)
(cephalotaxine)
ческий алка
лоид, группа
цефалотакси
на
Харрингтонин
– // -
АЭ
60S
ПТЦ (A)
Э
разб.
- // -
(harringtonine)
БИОХИМИЯ том 85 вып. 11 2020
1638
ДМИТРИЕВ и др.
Продолжение таблицы 1
Класс,
Специ
Взаимодей
Место свя
Стадия
Эффект
Название
группа
фичность
ствующая
зывания##
трансля
на поли
Механизм действия
веществ
(Б, А, Э)#
субчастица
ционного
сомы####
рибосомы
цикла###
Гомохаррингтонин/
- // -
А, Э
60S
ПТЦ (A)
Э
разб.
- // -
омацетаксин
мепесукцинат
(homoharringtonine/
omacetaxine
mepesuccinate)
Нагилактон C
дитерпеноид
Э
60S
ПТЦ (A)
Э
разб.
- // -
(nagilactone C)
Нагилактон E
- // -
Э
60S?
ПТЦ (A)?
Э
?
- // - ?
(nagilactone E)
Бруцеантин
квассиноид
А, Э
60S
ПТЦ (A)
Э
?
- // -
(bruceantin)
Грандилактон A
- // -
Э
60S?
ПТЦ (A)?
Э
?
- // -
(grandilactone A)
Грандилактон B
- // -
Э
60S?
ПТЦ (A)?
Э
?
- // -
(grandilactone B)
Брусатол (brusatol)
- // -
Э
60S?
ПТЦ (A)
Э?
?
- // - ?
Голакантон
- // -
Э?
60S
ПТЦ
?
?
- // -
(holacanthone)
Бакхаринол
- // -
Э
60S?
ПТЦ (A)?
Э?
?
- // - ?
(baccharinol)
Айлантинон
- // -
Э
60S?
ПТЦ (A)?
Э?
?
- // - ?
(ailanthinone)
Квассин (quassin)
- // -
Э?
60S?
ПТЦ (A)?
Э?
?
- // - ?
Спарсомицин
пиримидон,
Б, А, Э
60S
ПТЦ (A, P)
Э
стаб.
- // -
(sparsomycin)
группа спар
сомицина
Дигидрокси
- // -
Э
60S?
ПТЦ
Э?
?
- // - ?
спарсомицин
(A, P)?
(deshydroxy
sparsomycin)
Октилспарсомицин
- // -
Э
60S?
ПТЦ
Э?
?
- // - ?
(octylsparsomycin)
(A, P )?
Фенолаланин
- // -
Б, А, Э
60S?
ПТЦ
Э?
?
- // - ?
спарсомицин
(A, P)?
(phenol alanine
sparsomycin)
MDL 19152
- // -
Э
60S?
ПТЦ
Э?
?
- // - ?
(A, P)?
MDL 20828
- // -
Э
60S?
ПТЦ
Э?
?
- // - ?
(A, P)?
Антелмицин/хикизи
нуклеозид,
Б, А, Э
60S
ПТЦ (P)
Э
(стаб.)
- // -
мицин (anthelmycin/
пиримидон
hikizimycin)
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1639
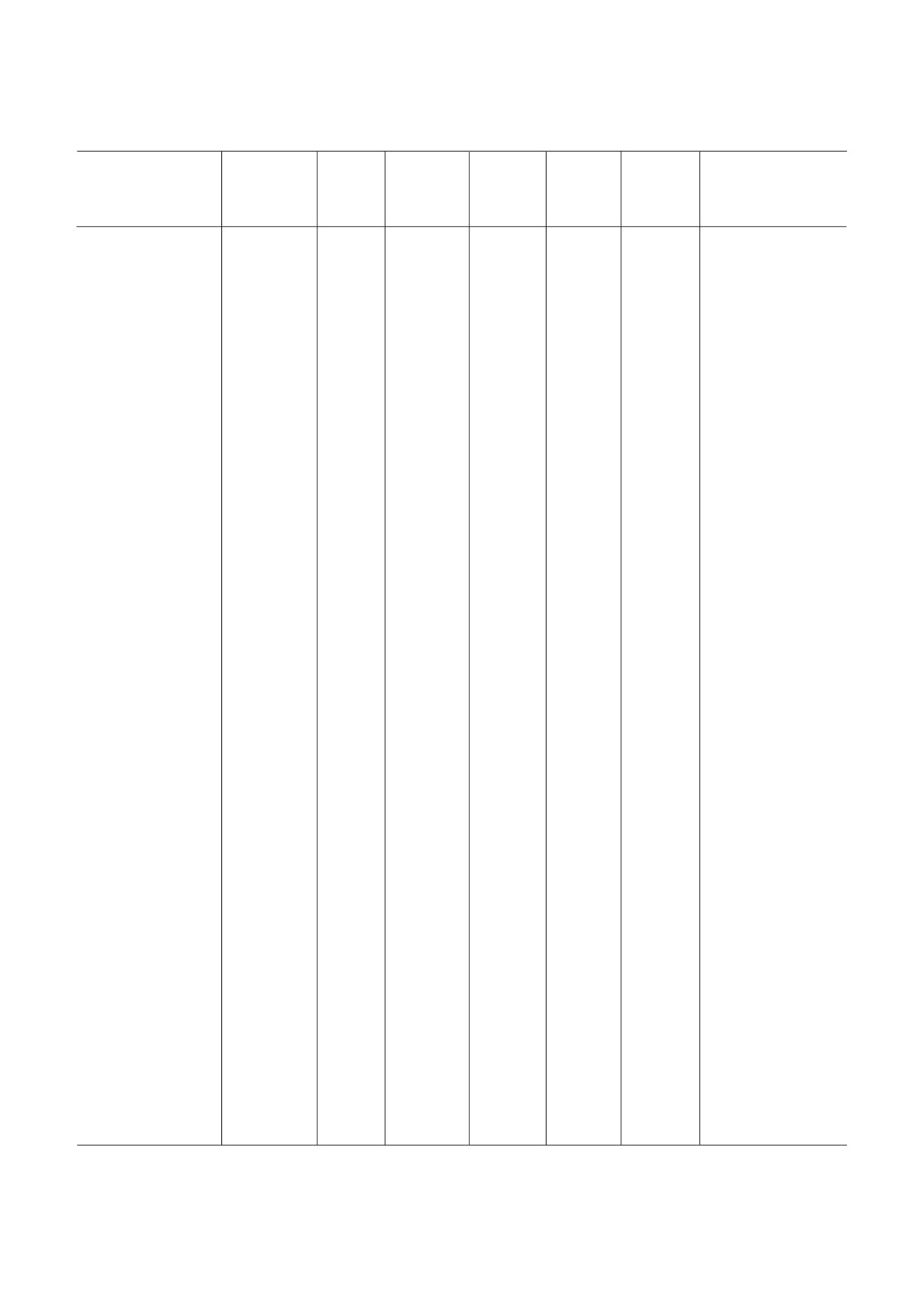
Продолжение таблицы 1
Класс,
Специ
Взаимодей
Место свя
Стадия
Эффект
Название
группа
фичность
ствующая
зывания##
трансля
на поли
Механизм действия
веществ
(Б, А, Э)#
субчастица
ционного
сомы####
рибосомы
цикла###
Бластицидин S
нуклеозид,
Б, А, Э
60S
ПТЦ (P)
Э
?
- // -
(blasticidin S)
группа блас
тицидина
Гугеротин
- // -
Б, А, Э
60S
ПТЦ
Э
разб.
- // -
(gougerotin)
Багугерамин A,B
- // -
Б, А, Э?
60S?
ПТЦ?
Э?
?
- // - ?
(bagougeramine A,B)
Амицетин (amicetin)
- // -
Б, А, Э
60S
ПТЦ
Э
стаб.
- // -
Бамицетин
- // -
Б, А, Э
60S
ПТЦ
Э
?
- // -
(bamicetin)
Милдиомицин
- // -
Б, А, Э
60S
ПТЦ
Э
?
- // -
(mildiomycin)
Пликацетин
- // -
Б, А, Э
60S?
ПТЦ?
Э?
?
- // - (слабый)
(plicacetine)
Аргиномицин
- // -
Б, А, Э
60S?
ПТЦ?
Э?
?
- // - ?
(arginomycin)
Пуромицин
аминоацил
Б, А, Э
60S
A
Э
разб.
вызывает преждевре
(puromycin)
нуклеозид
менную терминацию
A201A
- // -
Б, А, Э
60S
A
Э
ингибитор ПТЦ
Бактоболин
изокумарин
Б, А, Э?
60S
ПТЦ (P)
Э
?
- // -
(bactobolin)
Актиноболин
- // -
Б, А, Э
60S
ПТЦ
Э
?
- // -
(actinobolin)
Амикумацин A
- // -
Б, А, Э
40S
E сайт
Э
?
ингибитор
(amicoumacin A)
транслокации
Бацифелацин
- // -
Б, А, Э
?
?
И?
?
?
(baciphelacin)
Ооспонол (oosponol)
- // -
Б, А, Э?
?
?
?
?
?
AHR 1911
тиопсевдомо
Б, А, Э
60S?
ПТЦ?
Э
ингибитор ПТЦ
чевина
Тенуазоновая кисло
пирролин
Э
60S?
ПТЦ (A, P)
?
стаб.
- // -
та (tenuazonic acid)
Ботромицин A2
циклический
Б, А, Э?
60S?
ПТЦ?
Э?
стаб.?
- // - ?
(bottromycin A2)
пептид
Гризеовиридин
циклодекси
Б, А, Э
60S
ПТЦ
Э
?
- // - ?
(griseoviridin)
пептид
Циклопиазоновая
эрголиновый
Б, А, Э
60S?
?
Э
?
- // - ?
кислота (cyclopiazon
алкалоид
ic acid)
PF 06446846/PF846
Б, А, Э
60S
РПТ
Э
?
затрудняет продвиже
ние пептида в РПТ
БИОХИМИЯ том 85 вып. 11 2020
1640
ДМИТРИЕВ и др.
Продолжение таблицы 1
Класс,
Специ
Взаимодей
Место свя
Стадия
Эффект
Название
группа
фичность
ствующая
зывания##
трансля
на поли
Механизм действия
веществ
(Б, А, Э)#
субчастица
ционного
сомы####
рибосомы
цикла###
PF 06378503/PF8503
Э
60S?
РПТ?
Э
?
- // - ?
Тетраценомицин X
ароматичес
Б, А, Э
60S
РПТ
Э?
?
- // - ?
(tetracenomycin X)
кий полике
тид тетраце
номициново
го ряда
Тетрациклин Col 3
ароматичес
Б, А, Э
40S, 60S
РПТ и др.
Э?
?
?
(tetracycline Col 3)
кий полике
тид тетра
циклинового
ряда
Доксициклин
- // -
Б, А, Э
40S, 60S
РПТ и др.
Э?
?
?
(doxycycline)
Тигециклин
- // -
Б, А, Э
40S? 60S?
?
Э
?
связывание амино
(tigecycline)
ацил тРНК?
Миноциклин
- // -
Б, А, Э
40S? 60S?
?
Э?
?
?
(minocycline)
Доксорубицин
ароматичес
Э?
?
?
Т
?
способствует сквоз
(doxorubicin)
кий полике
ному прочтению
тид антра
стоп кодонов
циклинового
ряда
Циклогексимид/на
глутаримид
Э
60S
E сайт
Э
стаб.
ингибитор трансло
рамицин A/актидион
кации
(cycloheximide/
naramycin A/actidion)
Нарамицин B
- // -
Э
60S?
E сайт?
?
?
- // - ?
(naramycin B)
Ацетоксициклогек
- // -
Э
60S
E сайт?
Э
стаб.
- // - ?
симид (acetoxycyclo
heximide)
Стрептимидон
- // -
Э
60S
E сайт?
Э
?
- // - ?
(streptimidone)
Стрептовитацин A
- // -
Э
60S
E сайт?
Э?
стаб.
- // - ?
(streptovitacin A)
Актифенол
- // -
Э
60S?
E сайт?
Э?
?
- // - ?
(actiphenol)
Лактимидомицин
- // -
Э
60S
E сайт
Э
разб.
- // -
(lactimidomycin)
Изомиграстатин
- // -
Э
60S?
E сайт?
Э?
?
- // - ?
(isomigrastatin)
ECA LTM
- // -
Э
60S?
E сайт?
Э?
?
- // - ?
Стрептоглутаримид Н
– // -
Б, А, Э
60S?
E сайт?
Э?
?
- // - ?
(streptoglutarimide H)
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1641
Продолжение таблицы 1
Класс,
Специ
Взаимодей
Место свя
Стадия
Эффект
Название
группа
фичность
ствующая
зывания##
трансля
на поли
Механизм действия
веществ
(Б, А, Э)#
субчастица
ционного
сомы####
рибосомы
цикла###
Лиссоклимид
лабдановый
Э
60S
E сайт
Э
стаб.
- // -
(lissoclimide)
дитерпеноид
стаб.
- // -
Хлоролиссоклимид
- // -
Э
60S
E сайт
Э
(chlorolissoclimide)
Дихлоролиссокли
- // -
Э
60S
E сайт
Э
стаб.?
- // -
мид (dichlorolisso
climide)
Лиссоклимид С45
- // -
Э
60S
E сайт
Э
стаб.
- // - ?
(lissoclimide C45)
Хатерумаимиды
- // -
Э
60S?
E сайт?
Э
стаб.
- // -
A,N,Q (hateru
maimides A,N,Q)
Филлантозид
гликозид
Э
60S
E сайт
Э
разб.
- // -
(phyllanthoside)
S3′ дезацетил
- // -
Э
60S?
E сайт?
?
?
- // - ?
филлантозид
(S3′ desacetyl
phyllanthoside)
Педерин (pederine)
поликетид,
Э
60
E сайт
Э
стаб.
- // -
группа
педерина
Псимберин/
- // -
Э
60S
E сайт
Э
?
- // -
ирциниастатин А
(psymberin/
irciniastatin A)
Теопедерин B
- // -
А, Э
60S
E сайт
Э
?
- // -
(theopederin B)
Микаламид B
- // -
Б, А, Э
60S
E сайт
Э
разб.
- // -
(mycalamide B)
Микаламид А
- // -
Б, А, Э
60S
E сайт
Э
?
- // -
(mycalamide A)
Оннамид А
- // -
А? Э
60S
E сайт
Э
?
- // -
(onnamide A)
Теданолид
поликетид,
А? Э
60S
E сайт
Э
?
- // -
(tedanolide)
группа
теданолида
13 дезокситедано
- // -
А, Э
60S
E сайт
Э
?
- // -
илд/13 DT
(13 deoxytedanolide)
Мириапорон 3/4
- // -
А, Э
eEF2?
-
Э
?
(см. табл. 3)
(myriaporone 3/4)
Эметин (emetine)
эметин подоб
Э
40S
E сайт
Э
стаб.
ингибитор трансло
ный пиридо
кации
изохинолино
вый алкалоид
9 БИОХИМИЯ том 85 вып. 11 2020
1642
ДМИТРИЕВ и др.
Продолжение таблицы 1
Класс,
Специ
Взаимодей
Место свя
Стадия
Эффект
Название
группа
фичность
ствующая
зывания##
трансля
на поли
Механизм действия
веществ
(Б, А, Э)#
субчастица
ционного
сомы####
рибосомы
цикла###
Дегидроэметин
- // -
Э
40S?
E сайт?
Э?
(стаб.)
- // -
(dehydroemetine)
Цефалин (cephaeline)
- // -
Э
40S?
E сайт?
Э?
(стаб.)
- // -
Криптоплеврин
эметин по
Э
40S, 60S?
E сайт
Э
?
- // -
(cryptopleurine)
добный фе
нантрохино
лизидиновый
алкалоид
Тилокребрин
- // -
Б? Э
40S?
Е сайт?
Э
?
- // -
(tylocrebrine)
Тубулозин
- // -
Э
40S, 60S?
Е сайт?
Э
?
- // -
(tubulosine)
Тилофорин
- // -
Б? А, Э
40S
Е сайт?
Э
стаб.
- // -
(tylophorine/
DCB 3500)
DCB 3503
- // -
Э
40S?
Е сайт?
Э
?
- // -
Rac криптоплеврин
- // -
Э
40S?
Е сайт?
Э
?
- // -
(Rac cryptopleurin)
YXM 110
- // -
Э
40S?
Е сайт?
Э
?
- // -
Пактамицин
аминоцикло
Б, А, Э
40S
E сайт
Э (И?)
(разб.)
- // -
(pactamycin)
пентитол,
группа пакта
мицина
Де 6 MSA пактами
- // -
Б, А, Э
40S?
E сайт?
Э (И?)
?
- // - ?
цин (de 6 MSA
pactamycin)
Залузанин С
сесквитерпе
Э
?
?
Э
?
- // -
(zaluzanin C)
новый лактон
Гигромицин B
2 DOS ами
Б, А, Э
40S?
ДЦ
Э (Р?)
стаб.
- // -
(hygromycin B)
ногликозид,
неканони
ческий
Генетицин/G418
2 DOS ами
Б, Э
40S, 60S
ДЦ, РПТ
Э, Т
разб.
вызывает ошибки де
(geneticin)
ногликозид,
кодирования, способ
4,6 двузаме
ствует сквозному
щённый
прочтению стоп ко
донов и ингибирует
транслокацию
Гентамицины (gen
- // -
Б, Э
40S, 60S
ДЦ, РПТ
Э, Т
разб.
- // -
tamycins/gentamicins)
Тобрамицин
- // -
Б, Э?
40S, 60S?
ДЦ
Э, Т
разб.?
- // -
(tobramycin)
Амикацин (amikacin)
– // -
Б, Э
40S
ДЦ
Э, Т
разб.
- // -
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1643
Продолжение таблицы 1
Класс,
Специ
Взаимодей
Место свя
Стадия
Эффект
Название
группа
фичность
ствующая
зывания##
трансля
на поли
Механизм действия
веществ
(Б, А, Э)#
субчастица
ционного
сомы####
рибосомы
цикла###
Нетилмицин
- // -
Б, А, Э?
40S?
ДЦ?
Э?
разб.?
- // -
(netilmicin)
Паромомицин (paro
2 DOS ами
Б, Э
40S, 60S
ДЦ
Э, Т (Р?)
разб.
- // -
momycin)
ногликозид,
4,5 двузаме
щённый
Ливидомицин
- // -
Б, А, Э?
40S?
ДЦ?
Э
?
- // -
(lividomycin)
Неомицин
- // -
Б, А, (Э)
40S?
ДЦ?
Э, Т (Р?)
?
- // -
(neomycin)
TC007
- // -
Б, Э
40S, 60S
ДЦ, РПТ
Т
?
- // -
NB74
- // -
Б? Э
40S
ДЦ
Э, Т
?
- // -
NB124
- // -
Б? Э
40S
ДЦ?
Э, Т
?
- // -
NB156
- // -, про
Б? Э
40S
ДЦ
Э, Т
?
- // -
изводное
NB74
NB157
- // -, про
Б? Э
40S
ДЦ
Э, Т
?
- // -
изводное
NB124
Неамин (neamine)
2 DOS ами
Б, Э
60S?
ДЦ
Э, Т
разб.?
- // -
ногликозид,
4 монозаме
щённый
Апрамицин
- // -
Б, Э
40S?
ДЦ
Э
?
- // - ?
(apramycin)
Негамицин
группа нега
Б, А, Э
40S
?
T
стаб.
- // -
(negamycin)
мицина
3 эпи дезоксинега
- // -
Э
?
?
Т
?
- // - ?
мицин (3 epi
deoxynegamycin)
TCP 1109
- // -
Э
40S
Т
?
- // -
Аталурен/PTC124
оксадиазолы
Э
60S?
A?
Т?
?
- // - ?
(ataluren/PTC124)
Амлексанокс
бензопираны
Э
?
?
Т
- // -
(amlexanox)
RTC204
Э
?
?
Т
?
- // -
RTC219
Э
?
?
Т
?
- // -
GJ071
Э
?
?
Т
?
- // -
GJ072
Э
?
?
Т
?
- // -
БИОХИМИЯ том 85 вып. 11 2020
9*
1644
ДМИТРИЕВ и др.
Окончание таблицы 1
Класс,
Специ
Взаимодей
Место свя
Стадия
Эффект
Название
группа
фичность
ствующая
зывания##
трансля
на поли
Механизм действия
веществ
(Б, А, Э)#
субчастица
ционного
сомы####
рибосомы
цикла###
GJ103
Э
?
?
Т
?
- // -
RTC13
группа тиазо
Э
40S?
?
Т
?
- // -
лидинона
RTC14
- // -
Э
?
?
Т
?
- // -
BZ6
- // -
Э
?
?
Т
?
- // -
BZ16
- // -
Э
?
?
Т
?
- // -
CDX5 1
фталимид
?
?
?
?
?
усиливает сквозное
прочтение стоп кодо
нов, индуцируемое
аминогликозидами
Гиродазол/гиро
А, Э
60S
E сайт
Т
?
ингибирует высво
лин/RP 49532A
бождение синтезиро
(girodazole/girolline)
ванного пептида
Сангвинамид B
циклический
Б, А, Э
40S, 60S
uS17, uL3,
?
?
?
(sanguinamide B)
пептид
uL30, др.
Даптомицин
циклический
Б, А? Э
40S
eS19
?
?
?
(daptomycin)
липопептид
QL XII 47/QL47
группа QL47
Э
?
?
Э?
?
?
YKL 04 085
- // -
Э
?
?
Э?
?
?
Мефлоквин
хинолин
Э*
60S
ГАЦ
Э
?
нарушает аккомода
(mefloquine)
цию eEF1A, eEF2
Эдеин A (edein A)
Б, А, Э
40S
E сайт
И
?
мешает связыванию
или аккомодации
инициаторной Меt
тРНКi в Р сайте
Эдеин B (edein B)
Б, А, Э?
40S?
E сайт?
И?
?
- // - ?
MDMP
Э
40S? 60S?
?
И
разб.
препятствует присое
динению 60S к 48S
инициаторному
комплексу
eIFsixty 4
Э
60S
?
И
разб.
нарушает связывание
eIF6 с 60S субчасти
цей
Примечание. Буквенные коды:
# Б - бактерии, А - археи, Э - эукариоты. (*) обозначает более узкую группу организмов (например, грибы или прос
тейшие).
## ПТЦ (А) - А сайт ПТЦ, ПТЦ (Р) - Р сайт ПТЦ, остальные сокращения - как в основном тексте.
### И - инициация, Э - элонгация, Т- терминация, Р - рециклинг.
#### Стаб. - стабилизирует полисомы, Разб. - разбирает полисомы, Стаб. / Разб. - стабилизирует или разбирает в зависи
мости от концентрации.
Знак «?» обозначает «предположительно» (по аналогии с химически сходным веществом, по аналогии с другими организ
мами либо на основании спорных данных). В скобках - явление, которое менее выражено, чем основное.
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1645
временной терминации, а также некоторые дру
для ингибиторов элонгации, поэтому на нём
гие типы ингибиторов с нестандартными меха
стоит остановиться особо. Добавление таких ве
низмами действия.
ществ к клеткам приводит не к стабилизации, а
Ингибиторы пептидилтрансферазного цент
к разборке полисом, поэтому в литературе их
ра. В силу своей консервативности ПТЦ боль
иногда ошибочно причисляют к ингибиторам
шой субчастицы рибосомы является наиболее
инициации [25, 29]. Помимо харрингтонина,
уязвимым местом белоксинтезирующего аппа
подобное влияние на полисомы оказывают,
рата - именно там связывается, пожалуй, наи
например, некоторые из упоминавшихся выше
большее число ингибиторов как у про , так и у
трихотециновых микотоксинов [25]. В послед
эукариот (рисунок, e.5). Эти ингибиторы могут
нем случае это выглядит особенно интригующе:
относиться к разным типам химических соеди
так, Т 2 токсин, веррукарин А, ниваленол и ка
нений и по разному препятствовать работе ри
лонектрин разбирают полисомы, а трихотецин,
босомы.
триходермин и скирпентриол их стабилизируют
Так, некоторые из них мешают посадке или
[19, 30, 31]. Были даже найдены конкретные хи
аккомодации аминоацил тРНК в А сайте. К
мические радикалы, положение которых в опре
этому типу относятся, например классический
делённых позициях по отношению к ядру три
АЭ специфичный ингибитор анизомицин, ко
хотецинового антибиотика определяет тот или
торый связывается в А сайте ПТЦ и дестабили
иной эффект [19, 30, 32]. Впрочем, в случае не
зирует аминоацил тРНК [14-17]. С тем же
которых микотоксинов эффект может зависеть
участком связываются эукариот специфичные
от концентрации: так, диацетоксискирпенол и
трихотециновые микотоксины (производимые
фузаренон Х, которые в норме разбирают поли
паразитическими грибами Т 2 токсин, дезокси
сомы, при увеличении концентрации на два по
ниваленол, веррукарин А и, вероятно, ещё более
рядка начинают их стабилизировать [30, 33].
трёх десятков подобных им соединений, имею
Способность связываться лишь с вакантной ри
щих в своей основе сложный четырёхчленный
босомой и разбирать полисомы присуща и неко
гетероцикл [14, 17-19]); тетрагетероцикличес
торым ингибиторам транслокации - например,
кие растительные алкалоиды нарциклазин, ли
лактимидомицину [34], который будет рассмот
корин и гемантамин [14, 20] и, предположитель
рен в соответствующем разделе, - на его приме
но, их многочисленные производные - изонар
ре мы и рассмотрим предположительный меха
циклазин, псевдоликорин, претацеттин и дру
низм данного явления.
гие [21, 22]; а также харрингтонин [23], широко
А сайт ПТЦ является мишенью и для других
используемый в методике рибосомного профай
соединений, в химическом плане не имеющих
линга [24], и близкий к нему гомохаррингтонин
практически ничего общего с вышеперечислен
[14, 23, 25, 26]. Гомохаррингтонин в форме полу
ными, - веществ природного происхождения -
синтетического препарата омацетаксина мепе
нагилактона С [14, 35] и агеластатина А [36], а
сукцината является одним из очень немногих
также бруцеантина, представителя обширного
трансляционных ингибиторов, получивших
класса квассиноидов, среди которых много по
одобрение как европейского, так и американс
тенциальных антираковых препаратов [26, 37,
кого медико биологических агентств (EMA и
38]. Не исключено, что такой же механизм
FDA), он применяется для лечения хронических
действия имеет нагилактон E, у которого недав
миелолейкозов [27]. Кроме того, он вошёл в
но методами системной биологии была обнару
число перспективных лекарств для антивирус
жена активность ингибитора элонгации [39].
ной терапии при COVID 19 [28].
Аккомодацию аминоацил тРНК в А сайте на
Особенностью харрингтонина и гомохарринг
рушает также универсальный антибиотик
тонина является то, что они могут связаться
А201А, имеющий нуклеозид подобный участок,
лишь с вакантной рибосомой, только что соб
который напоминает ССА конец тРНК [13, 40].
равшейся из субчастиц и приступившей к транс
Некоторые вещества связываются не с А , а с
ляции, и останавливают её сразу (или вскоре)
Р сайтом ПТЦ. Примерами таких соединений
после старта [23]. При этом ранее инициировав
являются универсальные ингибиторы пептидил
шие рибосомы продолжают транслировать, и в
трансферазной реакции: бактоболин А (произ
итоге на мРНК остаётся только одна 80S рибо
водное изокумарина) [41, 42] и бластицидин S
сома в районе начала кодирующей части [25,
из группы нуклеозидных антибиотиков [14, 17,
29]. Это позволяет использовать харрингтонин
43, 44]. Интересно, что в случае бактерий блас
для картирования стартовых кодонов [24].
тицидин S ингибирует не столько элонгацию,
Нужно заметить, что подобное свойство
сколько терминацию трансляции [45], однако в
(неспособность связываться с активно трансли
эукариотической системе его эффект связан всё
рующими полисомами) не является редкостью
же именно с подавлением элонгации [46]. Ма
БИОХИМИЯ том 85 вып. 11 2020
1646
ДМИТРИЕВ и др.
лоизученные нуклеозидные антибиотики, похо
тирозин. Позднее толерантность к одним ами
жие на бластицидин, - антелмицин (хикизими
нокислотным остаткам на С конце растущего
цин), гугеротин, амицетин, бамицетин и другие
пептида и чувствительность к другим была вы
[47-49] - также ослабляют связывание амино
явлена для многих классических ингибиторов
ацил тРНК и препятствуют транспептида
ПТЦ, в том числе анизомицина, спарсомицина,
ции [43].
бластицидина S и ряда трихотециновых мико
Ещё один нуклеозидный аналог, также взаи
токсинов [51]. Аналогичное наблюдение было
модействующий с ПТЦ и сложным образом
сделано и для некоторых антибиотиков, блоки
влияющий на связывание и аккомодацию ли
рующих ПТЦ бактериальной рибосомы [53], хо
гандов, - спарсомицин [17, 18]. Структура его
тя в этом случае специфичность касалась ами
комплекса с эукариотической рибосомой пока
нокислотного остатка, предшествующего тому,
недоступна, но есть структурные данные, харак
что находился в P сайте: трансляцию останав
теризующие его взаимодействие с большой суб
ливал преимущественно аланин (и в меньшей
частицей архей [44]. На основании их можно
степени серин и треонин) в положении «-1»
предположить, что антибиотик образует множе
пептидил тРНК. Данное явление меняет предс
ственные контакты с ССА концом тРНК в P
тавления о механизме действия ингибиторов
сайте, одновременно препятствуя связыванию
ПТЦ и требует дальнейшего изучения [54].
аминоацил тРНК.
Ингибиторы, связывающиеся в пептидном
Следует признать, что ввиду недостатка
туннеле. Специфичность по отношению к пос
структурных и функциональных данных зачас
ледовательности синтезируемого пептида осо
тую нельзя сказать однозначно, связан ли меха
бенно ярко проявляется в случае группы инги
низм действия конкретного ингибитора ПТЦ с
биторов, местом связывания которых служит
нарушением связывания или аккомодации ли
РПТ. Для бактериальных рибосом таких веществ
гандов или же с конформационными перест
известно довольно много, их классическим при
ройками в самом ПТЦ, делающими невозмож
мером являются антибиотики макролиды [55,
ным эффективный катализ. Поэтому обычно не
56]. Интересно, что механизм их действия так
принято подразделять ингибиторы этого типа
же, по видимому, связан с угнетением работы
на более узкие подгруппы согласно стадии, на
ПТЦ: связываясь в пептидном туннеле, макро
которой они блокируют элонгационный цикл.
лиды распространяют аллостерическое влияние
Ситуация ещё более усложняется недавно отк
далеко за его пределы, индуцируя конформаци
рывшимся фактом аминокислотной специфич
онные перестройки внутри 50S субчастицы [57].
ности ингибиторов ПТЦ. Например, структур
Хотя с рибосомами архей некоторые макролиды
ные данные говорят о том, что харрингтонин и
связать удаётся, и связывание происходит при
его производные, а также трихотециновые ми
мерно с тем же участком, что и у бактерий
котоксины должны мешать посадке аминоацил
[58-60], ни один из известных на данный мо
тРНК или как минимум аккомодации амино
мент антибиотиков этого типа не способен
ацильного остатка в А сайте [14, 26]; однако
действовать по такому же механизму на эукарио
данные ту принтинга и рибосомного профай
тическую рибосому [56]; известен неканоничес
линга [50-52] говорят о том, что эти вещества
кий макролид 13 дезокситеданолид, который
допускают несколько элонгационных циклов,
связывается с 60S субчастицей [61], но совсем в
прежде чем рибосома остановится на опреде
другом месте (см. ниже). Тем не менее ингиби
лённой позиции, зависящей от аминокислотно
торы, связывающиеся в пептидном туннеле 60S
го остатка на С конце пептидил тРНК, распо
субчастицы, недавно были обнаружены среди
ложенной в Р сайте. Остаётся неясным, как ри
других классов веществ (рисунок, e.3). Здесь
босома может синтезировать фрагмент поли
нельзя не упомянуть о двух необычных ингиби
пептида длиной несколько аминокислот, когда
торах, PF 06446846 и PF 06378503, проявляю
её ПТЦ оккупирован крупной молекулой анти
щих настолько высокую селективность по отно
биотика, и почему одни аминокислоты при этом
шению к аминокислотной последовательности
могут встраиваться, а на других происходит ос
цепи в пептидном туннеле, что при всём много
тановка синтеза. Аминокислотная специфич
образии человеческих белков они блокируют
ность ингибиторов ПТЦ была впервые задоку
лишь синтез буквально нескольких из них [62,
ментирована в 2013 году для харрингтонина
63]. Структурное исследование комплекса PF
[50]: методом ту принтинга было показано, что
06446846 с рибосомой [64] показало локализа
он предпочтительно останавливает транслирую
цию места связывания в пептидном туннеле и
щую рибосому, когда последней аминокисло
арест транслирующей рибосомы в одном из пре
той, присоединённой к пептидил тРНК и нахо
транслокационных состояний. Совсем недавно
дящейся в P сайте, является лизин, аргинин или
был обнаружен и ещё один тип ингибиторов,
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1647
блокирующих белковый синтез в клетках эука
шийся ранее харрингтонин, и его тоже исполь
риот путём взаимодействия с пептидным тунне
зуют в рибосомном профайлинге для картиро
лем, - ароматические поликетиды: связывание
вания стартовых кодонов [82]. По видимому,
тетраценомицина Х с РПТ рибосомы человека
неспособность лактимидомицина эффективно
было показано структурными методами, подт
вытеснять тРНК из Е сайта связана именно с
верждено в in vitro системе и на культивируемых
медленной аккомодацией его крупного боково
клетках человека [65], а тетрациклинов Col 3 и
го радикала [14]. Возможно, эта же причина
доксициклина - определено биохимически [66].
объясняет и другие случаи, когда ингибиторы
Есть также указания и на активность в эукарио
элонгации, успешно взаимодействующие с ва
тической системе некоторых других тетрацик
кантными субчастицами, неактивны по отно
линов: тигециклина [67, 68] и миноциклина [69,
шению к уже транслирующим рибосомам в по
70]; последний может использоваться для лече
лисоме.
ния аутоиммунных расстройств, нейропатий и
Практически с тем же местом на 60S субчас
вирусных инфекций, а также выступает потен
тице, что и глутаримидные антибиотики, связы
циальным геропротектором. В обоих случаях
ваются лиссоклимиды (в частности, хлоролис
места связывания с эукариотической рибосо
соклимид и С45), получаемые из морских мол
мой остаются неизвестными. При этом класси
люсков, - по механизму действия они, вероят
ческий тетрациклин Tet, широко применяемый
но, аналогичны глутаримидам, на которые нем
в медицине как антибактериальный препарат,
ного похожи структурно [83-85]. Это же место
не блокирует трансляцию в эукариотической
является мишенью и для другого ингибитора
системе, а с бактериальной рибосомой связыва
трансляции, имеющего совершенно иную хи
ется совсем в другом месте, чем тетраценоми
мическую структуру, - филлантозида [14]. Точ
цин X, доксициклин и Col 3 [7].
ный механизм его действия неясен [35], однако,
Ингибиторы транслокации. Вещества, кото
скорее всего, он ингибирует именно транслока
рые блокируют рибосому на стадии транслока
цию. Его уникальной особенностью является
ции, представляют существенную долю ингиби
то, что при связывании он, по видимому, обра
торов эукариотической рибосомы (рису
зует ковалентную связь с Е сайтом рибосомы,
нок, e.6). Здесь речь также может идти о нес
вызывая её необратимое повреждение. Здесь же
кольких механизмах. Классический эукариот
связываются, по видимому, ингибиторы из об
специфичный ингибитор циклогексимид (он же
ширного класса поликетидов - например, педе
актидион или нарамицин А) препятствует
рины, вырабатываемые симбионтами некото
транслокации, оккупируя Е сайт 60S субчасти
рых ядовитых жуков и морских беспозвоноч
цы и, по видимому, мешая перемещению туда
ных: педерин, теопедерин А, оннамид А, мика
деацилированной тРНК из P сайта [14, 17, 25,
ламиды псимберин и другие [17, 86, 87], хотя на
71-75] - хотя в литературе обсуждался также и
дёжные структурные данные были получены
другой механизм действия [34, 76]. Циклогекси
только для одного представителя этой группы
мид широко используется для определения вре
веществ, микаламида А [60]. Все они также яв
мени полужизни белков, для стабилизации по
ляются ингибиторами транслокации [17, 87, 88].
лисом при анализе полисомных профилей в гра
Другие представители поликетидов - своеоб
диенте сахарозы, а также при анализе генной
разные макролиды теданолид и 13 дезокситеда
экспрессии методами рибосомного профайлин
нолид - также блокируют транслокацию путём
га и аффинного выделения транслирующих ри
связывания с тем же участком в Е сайте на боль
босом (TRAP) [77]. Он принадлежит к группе
шой субчастице, что и педерины [61, 89], а вот
веществ, называемых глутаримидами, среди ко
действие близких им по структуре мириапоро
торых есть и другие ингибиторы биосинтеза
нов [90], хотя также происходит на стадии элон
белка, изученные гораздо хуже (например,
гации [91], но опосредуется, как ни странно, не
стрептимидон, актифенол, ацетоциклогекси
прямым связыванием с рибосомой, а фосфори
мид, стрептовитацин и изомиграстатин)
лированием фактора элонгации eEF2 [92].
[78-80]. К этой же группе относится лактимидо
Эукариот специфичные ингибиторы эметин
мицин [34, 81], который связывается с тем же
и родственный ему криптоплеврин, а также
местом в Е сайте, но имеет дополнительное
универсальные антибиотики амикумацин А и
лактонное кольцо, затрудняющее аккомодацию
пактамицин взаимодействуют с одним и тем же
его молекулы [14]. В отличие от циклогексими
местом на рибосоме - оно тоже находится в
да, лактимидомицин не способен связываться с
районе связывания тРНК в Е сайте, однако в
активно транслирующими рибосомами, поэто
данном случае речь идёт о малой субчастице [14,
му его добавление к клеткам приводит к разбор
93-97]. Отсутствие структурных данных по их
ке полисом [34]. В этом он похож на упоминав
комплексам с эукариотической рибосомой в
БИОХИМИЯ том 85 вып. 11 2020
1648
ДМИТРИЕВ и др.
присутствии лигандов затрудняет понимание
аналогичную активность [73, 106]. Другие ами
механизма их действия, но он явно отличается
ногликозиды, несмотря на связывание в этом же
от такового для глутаримидов. О способности
участке, имеют иной механизм действия (опи
эметина и криптоплеврина ингибировать транс
санный ниже), однако в высоких концентраци
локацию известно ещё с 70 х годов [17, 25, 98].
ях некоторые из них также вызывают трансло
Химически сходные с ними цефалин, тилофо
кационный блок. Этот феномен хорошо задоку
рин, тилокребрин, тубулозин, DCB 3503 и
ментирован для бактериальных рибосом [107,
YXM 110 также являются известными ингиби
108] и может быть связан как с заякориванием
торами транслокации и связываются, по види
тРНК в А сайте при связывании в «классичес
мому, с тем же участком 40S субчастицы [95-97,
ком» месте посадки аминогликозидов в спирали
99-101]. Эметин уже больше века используется
h44, так и со связыванием в альтернативных
в медицине как антипротозойное (в частности,
участках - в спирали H69 большой субчастицы
антиамёбное и противомалярийное) и антигель
или в других местах [109, 110]. В эукариотичес
минтное средство, а недавно он вошёл в список
кой системе блок транслокации удаётся отсле
перспективных препаратов для борьбы с коро
дить методом ту принтинга только при очень
навирусной инфекцией, вызываемой SARS
высоких концентрациях паромомицина и
CoV 2 [28].
G418 [51].
Амикумацин А, действующий на ту же ста
В данном разделе можно было бы упомянуть
дию рибосомного цикла, имеет перспективы в
также вещества, блокирующие транслокацию
борьбе с онкологическими заболеваниями [93].
путём нарушения работы фактора элонгации
На бактериальных комплексах было показано,
eEF2 (например, сордарин), однако поскольку
что этот ингибитор, взаимодействуя одновре
местом их связывания не является непосред
менно с мРНК и рРНК [102], препятствует пере
ственно рибосома, они будут рассмотрены в от
мещению рибосом при транслокации. Поэтому
дельном разделе.
для эукариот, где движение транскрипта в
Вещества, вызывающие ошибки декодирова
мРНК канале важно не только при элонгации,
ния. Отдельный класс ингибиторов - вещества,
но и на стадии сканирования 5′ нетранслируе
которые уменьшают точность работы рибосо
мой области, можно было бы ожидать угнетения
мы, вызывая ошибки при встраивании амино
инициации трансляции, однако функциональ
кислот (рисунок, e.4). Классическим примером
ные тесты показали, что это не так: амикумацин
этого типа является обширный класс аминогли
А является типичным ингибитором элонга
козидных антибиотиков [111]. Их основное мес
ции [93].
то связывания на эукариотической рибосоме -
Не до конца понятным механизмом
спираль h44 в ДЦ малой субчастицы [14, 110].
действия на эукариотическую рибосому облада
Это связывание вызывает стабилизацию той
ет взаимодействующий с тем же участком пакта
конформации, которую рибосома должна при
мицин [14, 18, 25]: долгое время существовала
нимать лишь при наличии «правильной» амино
неопределённость в том, действует ли он на
ацил тРНК в А сайте [7]. В результате реакция
инициацию или на элонгацию (см. обсуждение
транспептидации может произойти, даже если
в [7, 103]). В конце концов, в случае бактериаль
там находится не соответствующая кодону
ной рибосомы было показано, что пактамицин
тРНК, и в растущий полипептид встраивается
ингибирует транслокацию [104], и наши данные
неверная аминокислота. Аминогликозиды так
свидетельствуют об аналогичном механизме в
же индуцируют сквозное прочтение стоп кодо
эукариотической системе [51]. Кстати, другой
нов, что придаёт им потенциал для терапии за
антибиотик, связывающийся примерно с тем же
болеваний, вызываемых нонсенс мутациями
районом малой субчастицы, эдеин
[14],
(см. ниже).
действительно ингибирует инициацию, и о нём
Наиболее высокую активность против рибо
будет рассказано в соответствующем разделе.
сом эукариотического типа демонстрируют
Иным механизмом подавления транслока
аминогликозиды с 4,6 или 4,5 двузамещённым
ции обладает атипичный аминогликозид гигро
2 дезоксистрептаминовым (2 DOS) кольцом:
мицин В. Структурные данные по его связыва
прежде всего - генетицин (G418, широко при
нию с эукариотической рибосомой отсутствуют,
меняющийся для генетической селекции при
но в случае бактерий он связывается с малой
культивировании эукариотических клеток) и
субчастицей в районе декодирующего центра
менее активные паромомицин, ливидомицины,
(ДЦ) в спирали h44 и вызывает конформацион
гентамицины и амикацин [112-117]. Высокую
ные изменения, которые препятствуют переме
активность имеют также менее токсичные ана
щению мРНК и тРНК между А и Р сайтами
логи G418 и паромомицина - NB50, NB54,
[103, 105]. В эукариотических системах он имеет
NB74, NB84, NB124, NB156, NB157 и другие
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1649
[118, 119], а также новый перспективный ами
эукариот же на данный момент известен лишь
ногликозид TC007 [110, 120]. Сходное химичес
один ингибитор с предположительно таким же
кое устройство аминогликозидов иногда приво
механизмом действия - это противомалярий
дит к путанице (как это случилось с гентамици
ный препарат мефлоквин (рисунок, e.2). Он
ном B1 [121]). Тем не менее большинство других
связывается с рибосомным белком uL13 и участ
известных антибиотиков этого типа, по види
ком ES13 28S рРНК в непосредственной близос
мому, бактериоспецифичны, что определяется
ти от ГАЦ [130]. Хотя это место не идентично
особенностями в структуре спирали h44 ДЦ эу
участку связывания ортосомицинов и тиопеп
кариот [14, 110, 122, 123]. Однако это не делает
тидов, скорее всего, он действует аналогичным
их безопасными для эукариотической клетки,
образом.
поскольку они могут подавлять белковый син
ГАЦ является мишенью для ингибиторов
тез в митохондрии и вызывать серьёзные побоч
ещё одного типа - растительных, грибных и
ные эффекты (в первую очередь нефро и ото
бактериальных токсинов, именуемых «рибосом
токсичность), что ограничивает их использова
инактивирующими белками» и «риботоксина
ние в медицине в качестве антибактериальных
ми», которые апуринизируют или расщепляют
препаратов [124, 125]. Как было сказано выше,
конкретные положения в сарцин рициновой
при повышенных концентрациях некоторые
петле 28S рРНК [131, 132]. Однако поскольку
аминогликозиды становятся ингибиторами
это высокомолекулярные ингибиторы, их рас
транслокации.
смотрение выходит за рамки данного обзора.
Прочие механизмы нарушения элонгации. Уни
Кроме того, работу трансляционных ГТФаз,
кальным механизмом действия обладает уни
связывающихся с ГАЦ, нарушают также вещест
версальный антибиотик пуромицин: он являет
ва, взаимодействующие непосредственно с са
ся молекулярным миметиком аминоацилиро
мими этими белками; их мы рассмотрим в од
ванного CCA конца тРНК и, попадая в А сайт,
ном из следующих разделов обзора.
вызывает преждевременную бесфакторную тер
Рибосом/направленные ингибиторы инициа/
минацию синтеза полипептида [7, 11]. Его
ции трансляции. Необычный механизм действия
действие настолько хорошо изучено, что реаген
имеет универсальный ингибитор эдеин (рису
ты на основе пуромицина с добавленными к не
нок, i.6) [18]. Он связывается с 40S субчастицей
му флуорофорами и биотином широко приме
в районе Е сайта [14], однако, в отличие от опи
няются в современных методах визуализации и
санных выше пактамицина, эметина и подоб
количественного анализа новосинтезируемых
ных им ингибиторов транслокации, препятству
белков, таких как PUNCH P, SUnSET, Puro
ет узнаванию стартового кодона при сканирова
PLA, RiboLace и RPM, а также используются в
нии [133, 134]. Скорее всего, эдеин мешает свя
мРНК дисплее [126]. Обработка клеток пуро
зыванию или аккомодации инициаторной Met
мицином в сочетании с циклогексимидом при
тРНКi в Р сайте, как это было показано для бак
водит к накоплению рибосом на стартовых ко
терий [7]. Считается, что в адекватных концент
донах, что позволяет идентифицировать их ме
рациях он не мешает элонгации, и поэтому его
тодом рибосомного профайлинга [127]. С дру
можно применять для анализа механизма ини
гой стороны, эффекты от сочетания разных ан
циации трансляции, хотя иногда эта точка зре
тибиотиков с пуромицином зависят от соотно
ния оспаривается [135]. Использование эдеина
шения их концентраций и не всегда предсказуе
при изучении инициации трансляции затрудня
мы, что может приводить к артефактам [128,
ет то, что в норме он не проникает в клетки мле
129]. Частично сходную с пуромицином струк
копитающих [136].
туру имеет упоминавшийся выше антибиотик
Вещество, сокращённо именуемое MDMP,
А201А [13, 40], однако он не может являться ак
действует на завершающую стадию инициации
цептором пептидной связи и лишь ингибирует
трансляции - присоединение 60S субчастицы
пептидилтрансферазную реакцию.
(рисунок, i.9), не препятствуя другим этапам
Среди ингибиторов бактериальной трансля
трансляционного цикла [137-140]. Мишенью
ции есть целый класс антибиотиков, связываю
для него является, по видимому, сама рибосома
щихся с большой субчастицей рибосомы в цент
[141], однако детали его связывания и ингиби
ре посадки трансляционных ГТФаз, называе
рующего действия пока остаются загадкой.
мом ГТФаза активирующим центром (ГАЦ), и
Не исключено, что на этапе eIF5B опосре
нарушающих работу этих факторов. Примерами
дованного присоединения 60S субчастицы мо
таких веществ являются ортосомицины и тио
жет действовать и рассмотренный в одном из
пептиды (эвернимицин, тиострептон, микро
предыдущих разделов мефлоквин, поскольку
кокцин и другие), они нарушают аккомодацию
место его связывания с рибосомой предполага
трансляционных факторов на рибосоме [7]. Для
ет, что вещество может препятствовать связыва
БИОХИМИЯ том 85 вып. 11 2020
1650
ДМИТРИЕВ и др.
нию не только элонгационных факторов, но и
важных генах, а многие случаи рака - с возник
этого фактора инициации (рисунок, i.7). По
новением преждевременных стоп кодонов в ге
крайней мере, функционально сходные с ним
нах супрессорах [148, 149]. Нонсенс супрессор
тиопептиды ингибируют связывание IF2 (орто
ная терапия направлена на повышение частоты
лога eIF5B) на аналогичном этапе инициации
аберрантного встраивания аминокислоты вмес
трансляции у бактерий [7, 8].
то гидролиза пептидил тРНК на стоп кодоне
Совсем недавно в направленном скрининге
[150, 151]. Эффективные и нетоксичные индук
была идентифицирована группа веществ, пре
торы сквозного прочтения могли бы быть вост
пятствующих взаимодействию 60S субчастицы с
ребованы для лечения сразу многих наслед
фактором инициации eIF6 (рисунок, i.8) -
ственных и онкологических заболеваний.
eIFsixty 1 (клофазимин), eIFsixty 4 и eIFsixty 6,
Хорошо охарактеризованными ингибитора
второй из которых оказывал наиболее действен
ми этого класса являются уже рассмотренные
ный эффект на трансляцию и рост клеток [142].
выше аминогликозиды (в частности, G418, па
Фактор eIF6 участвует в подготовке новосинте
ромомицин и гентамицин X2): вызываемое ими
зированных рибосом, поступивших из ядра, к
снижение точности декодирования приводит
вступлению в первый трансляционный раунд,
заодно и к пониженной частоте узнавания стоп
но также, вероятно, может принимать участие и
кодонов [110, 111, 113, 115, 152]. Некоторые
в трансляционных событиях [143]. К сожале
аминогликозиды (например, G418), будучи взя
нию, из за отсутствия структурных данных
тыми в определённых концентрациях, могут ин
нельзя сделать вывод о том, является ли ми
дуцировать сквозное прочтение, не приводя к
шенью этих веществ 60S субчастица или же сам
серьёзному снижению общей точности белково
фактор.
го синтеза и сильным изменениям в экспрессии
Рибосомные ингибиторы, влияющие на терми/
генов [113, 115, 117]. Много усилий направлено
нацию. Потенциальную роль в терапии наслед
на разработку синтетических производных ами
ственных и онкологических заболеваний, свя
ногликозидов, повышающих частоту сквозного
занных с нонсенс мутациями в важных генах
прочтения, но обладающих невысокой токсич
или онкосупрессорах, играют вещества, влияю
ностью. Примером такого вещества является
щие на терминацию трансляции. Однако специ
NB124 [114, 119].
фичных ингибиторов этой стадии с хорошо оха
Тем не менее полностью избежать побочных
рактеризованным механизмом действия извест
эффектов при применении аминогликозидов всё
но очень немного (рисунок, t.2). Описанный
же не удаётся: долговременная терапия связана с
выше пептидилтрансферазный ингибитор блас
рисками нефро и ототоксичности
[111,
тицидин S, с некоторой специфичностью бло
153-155]. Поэтому большие усилия направлены
кирующий терминацию в бактериях [45], в эука
на поиск индукторов сквозного прочтения не
риотической системе всё таки воздействует в
аминогликозидной природы. Наиболее извест
первую очередь на стадию элонгации [46]. Дру
ным таким веществом является аталурен
гой антибиотик, апидаецин (продуцируемый
(PTC124), на который возлагались большие на
насекомыми антимикробный пептид), связыва
дежды в терапии муковисцидоза и других наслед
ется с бактериальной рибосомой в начале пеп
ственных заболеваний, вызываемых нонсенс
тидного туннеля и останавливает её перед стоп
мутациями [156]. К сожалению, клинические
кодоном [144], однако про его активность в эу
испытания не дали желаемого эффекта [157,
кариотической системе пока ничего не извест
158]. Более того, его активность в качестве ин
но. Существуют данные о специфичном влия
дуктора сквозного прочтения была подвергнута
нии на терминацию антиракового агента гиро
сомнению, поскольку выяснилось, что вещество
дазола (он же гиролин или RP 49532A), который
влияет также на стабильность репортерного бел
взаимодействует с 60S субчастицей в районе Е
ка [159]. Помимо аталурена, известен ещё целый
сайта и препятствует высвобождению пептида в
ряд природных и синтетических индукторов
экспериментах in vitro [89, 145, 146]. Высокая
сквозного прочтения неаминогликозидной при
токсичность помешала использовать его в каче
роды с неизвестным пока механизмом действия -
стве лекарства [147], и дальнейшее изучение
GJ071, GJ072, RTC13, RTC14, BZ16, амлекса
этого ингибитора не проводилось.
нокс и другие, найденные в высокопроизводи
Гораздо больше известно веществ, которые
тельных биохимических скринингах [150, 160].
действуют не собственно на освобождение пеп
Аналогичное действие, вероятно, может вызы
тида, а на предыдущую стадию - узнавание
вать вещество TCP 1109 [161, 162] - производ
стоп кодона, индуцируя его сквозное прочтение
ное антибактериального дипептида негамицина;
(рисунок, t.1). Более 10% наследственных забо
последний связывается с бактериальной 30S суб
леваний связаны с наличием нонсенс мутаций в
частицей неподалёку от ДЦ и вызывает ошибки
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1651
декодирования, нарушение элонгации и терми
связывание может происходить как в растворе,
нации (см. [163] и ссылки в ней). Эффект нон
так и на рибосоме во время трансляционного
сенс супрессии в эукариотической системе был
цикла - в этом случае вещества могут контакти
показан также для доксорубицина [152].
ровать одновременно и с фактором, и с рибо
Крайне любопытная находка, сделанная от
сомными компонентами, однако мы всё же ре
носительно недавно, состоит в том, что некото
шили рассматривать их отдельно.
рые вещества усиливают действие аминоглико
Ингибиторы элонгационных факторов. Боль
зидов на терминацию. Так, фталимидное произ
шая группа химически разнородных веществ,
водное CDX5 1, а также уже упоминавшееся ве
выделяемых, как правило, из морских организ
щество мефлоквин (и ряд других производных
мов (как бактерий, так и эукариот), атакует фак
хинина) на два порядка повышают эффектив
тор элонгации eEF1A [172, 173]. Они связыва
ность сквозного прочтения, индуцируемого
ются с определённым местом на поверхности
G418 [164, 165]. Это позволяет добиваться дос
белка, модулируя динамику его конформацион
таточного количества полноразмерного продук
ных изменений, в результате чего eEF1A лиша
та при низких концентрациях аминогликозида,
ется способности диссоциировать с рибосомы
которые не вызывают серьёзных побочных эф
после гидролиза GTP (рисунок, e.2) и блокирует
фектов.
элонгацию. Непонятно, почему этот этап ока
Ингибиторы рибосомного рециклинга. Пос
зался особенно уязвимым для ингибиторов, но
ледняя стадия трансляционного цикла - рибо
один и тот же механизм действия имеют мало
сомный рециклинг, связанный с высвобождени
похожие циклические депсипептиды из группы
ем рибосом после гидролиза полипептида на
дидемнинов [174] (например, дидемнины А, В,
стоп кодоне [166]. Факторы рибосомного ре
С и М [175, 176], аплидин/плитидепсин [177],
циклинга и механизмы, лежащие в его основе,
тамандарины А и В [178]), ансамицины (цитот
различаются у бактерий и эукариот [167], а ве
риенин А [179] и сходные с ним триеномицины,
ществ, которые бы специфично действовали на
хинотриериксины и ансатриенины А и B, по
эту стадию, пока обнаружено не было. Тем не
другому называемые микотриенинами I и II
менее в случае бактерий влияние на рециклинг
[173, 180]), а также циклический пептид терна
оказывают, в частности, аминогликозиды [168],
тин [173]. Более сложное устройство, но такой
причём структурные основы этого эффекта
же механизм действия имеет и ещё одно макро
[109] подразумевают возможность подобных
циклическое соединение, нанноцистин A [181].
воздействий и на эукариотическую рибосому.
Все эти вещества являются, по сути, эукариот
Действительно, было показано [169, 170], что
направленными функциональными аналогами
паромомицин, неомицин и гигромицин препят
антибактериального антибиотика кирромици
ствуют диссоциации дрожжевых рибосом после
на, который стабилизирует комплекс амино
терминации (рисунок, r.1). Аналогичный эф
ацил тРНК с EF1α на рибосоме [7].
фект оказывают и ингибиторы транслокации -
Отдельная группа ингибиторов проделывает
циклогексимид и лактимидомицин [169, 170].
аналогичный трюк с другим элонгационным
Кроме того, некоторый эффект на диссоциацию
фактором, транслоказой eEF2 (рисунок, e.7).
субчастиц у дрожжей, как и у бактерий, могут
Классическим примером является фунгицид
иметь вещества, нарушающие цикл работы
сордарин и его многочисленные аналоги (мори
транслоказы eEF2, описанные в следующем
ниафунгин, GM193663, GR135402 и азасорда
разделе [169, 171]. Это вызывает некоторое
рины), действующие на eEF2 некоторых грибов,
удивление, поскольку сейчас считается, что
но безопасные для человеческих клеток
участие транслоказы - это специфика бактери
[182-185]. Связываясь с eEF2 [186, 187], они
ального, а не эукариотического типа рибосом
препятствуют его диссоциации с рибосомы и та
ного рециклинга [167]. Нельзя исключать, что
ким образом замораживают элонгационный
некоторые из этих наблюдений связаны со спе
комплекс в состоянии незавершённой трансло
цифической системой, использованной автора
кации [188]. Принцип действия сордаринов на
ми для изучения рециклинга в дрожжах [169].
поминает механизм работы известного проти
вобактериального антибиотика фузидовой кис
лоты, хотя в деталях взаимодействия с фактором
ИНГИБИТОРЫ ТРАНСЛЯЦИОННЫХ
есть различия [188]. Сама фузидовая кислота в
ФАКТОРОВ
эукариотической системе, по видимому, неспо
собна влиять на транслокацию, хотя может
В данном разделе мы опишем ингибиторы,
иметь некие неспецифичные эффекты [189].
мишенью и местом связывания которых явля
Интересно, что для функционирования сор
ются трансляционные факторы (табл. 2). Это
дарина нужна уникальная АЭ специфичная мо
БИОХИМИЯ том 85 вып. 11 2020
1652
ДМИТРИЕВ и др.
Таблица 2. Ингибиторы трансляционных факторов и АРСаз
Класс,
Специ
Стадия
Название
группа
фичность
Мишень
трансля
Механизм действия
веществ
(Б, А, Э)
ционного
цикла
Галлин (gallin)
ксантен
Б? А?, Э
40S? тРНК?
И(Э)
ингибитор связывания мРНК и
мРНК?
тРНК с рибосомой
Ауринтрикарбоновая
трифенилметан
Б, А, Э
40S? тРНК?
И(Э)
ингибитор формирования комп
кислота (aurintricarboxylic
мРНК?
лекса eIF2-GTP-Met тРНКi
acid)
(и связывания мРНК и тРНК
с рибосомой)
Пирокатехиновый
- // -
Б? А?, Э
40S? тРНК?
И(Э)
- // -
фиолетовый
мРНК? 60S?
(pyrochatechol violet)
Галлеин (gallein)
ксантен, аналог
Э?
40S? тРНК?
И?
- // -
флуоресцеина /
мРНК?
галлина
NSC119893
- // -
Э?
eIF2-GTP-
И*
- // -
Met тРНКi?
NSC119889
- // -
Э?
eIF2-GTP-
И*
- // -
Met тРНКi?
Шоудомицин
аналог уридина
Б, А, Э
eIF2, eEF2?
И, Э
- // -, ингибитор eEF2?
(showdomycin)
Дидемнин B (didemnin B)
циклический
Э
eEF1A
Э
удерживает eEF1A в комплексе
пептид
с Аа тРНК на рибосоме после
гидролиза GTP
Аплидин/плитидипсин/
- // -
Э
eEF1A
Э
- // -
дегидродидемнин B (apli
dine/plitidipsin/dehydro
didemnin B)
Нанноцистин А
- // -
Э
eEF1A
Э
- // -
(nannocystin A)
Цитотриенин А
- // -
Э
eEF1A
Э
- // -
(cytotrienin A)
Тамандарин A, B
- // -
Э
eEF1A
Э
- // -
(tamandarin A,B)
Ансатриенин A/
циклический
Э
eEF1A
Э
- // -
микотриенин I
пептид,
(ansatrienin A/
ансамицин
mycotrienin I)
Ансатриенин B/
- // -
Э
eEF1A?
Э?
- // -
микотриенин II
(ansatrienin B/
mycotrienin II)
Триеномицин A
- // -
Э
eEF1A?
Э
- // -
(trienomycin A)
Моноеномицин
- // -
?
eEF1A?
Э?
- // - ?
(monoenomycin)
Триеномицины J L
– // -
?
eEF1A?
Э?
- // - ?
(trienomycins J L)
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1653
Продолжение таблицы 2
Класс,
Специ
Стадия
Название
группа
фичность
Мишень
трансля
Механизм действия
веществ
(Б, А, Э)
ционного
цикла
Триериксин (trierixin)
- // -
Э
eEF1A?
Э
- // -
Хинотриериксин
- // -
Э
eEF1A?
Э
- // -
(quinotrierixin)
Тернатин (ternatin)
дитерпеновый
Э
eEF1A
Э
- // -
алкалоид
Тозилфенилаланилхлоро
хлорметил
Б, А, Э?
eEF1A?
Э
- // -
метан (tosylpheny
кетон
lalanylchloromethane)
Бувардин (bouvardin)
циклический
Э
eEF2
Э
блокирует диссоциацию eEF2 с
пептид, группа
рибосомы
бувардина
SVC112
- // -
Э
eEF2?
- // - ?
RA VII
- // -
Э
eEF2?
Э
- // -?
DDD107498
производное
Э*
eEF2
Э
- // -
хинолина
Сордарин (sordarin)
циклический
Э*
eEF2
Э
- // -
дитерпеновый
гликозид, груп
па сордарина
GM193663
- // -
Э*
eEF2
Э
- // -
GR135402
- // -
Э*
eEF2
Э
- // -
Мориниафунгин
- // -
Э*
eEF2
Э
- // -
(moriniafungin)
Дигидроармиллилоселли
поликетид
Э
eEF2
- // -
нат/DAO
сесквитерпен
(dihydroarmillylorsellinate)
Арнамиал (arnamial)
- // -
Э
eEF2
- // -
Фузидовая кислота
стероид
Б, А, (Э)
(eEF2)
Э
ингибитор транслокации?
(fusidic acid)
(вероятно, неспецифично)
Аллолауринтерол
сесквитерпен
Э
eIF4A
И
ингибирует ATPазную активность
(allolaurinterol)
eIF4A
Элизабатин A
- // -
Э
eIF4A
И
- // -
(elisabatin A)
Сильвестрол (silvestrol)
флаваглин
Э
eIF4A
И
ингибирует хеликазную актив
ность eIF4A
Патеамин A (pateamine A)
макродиолид
Э
eIF4A
И
нарушает связывание eIF4A с
eIF4G
Гиппуристанол
стероид
Э
eIF4A
И
аллостерический ингибитор
(hippuristanol)
eIF4A
Рокагламиды
флаваглин
Э
eIF4A
И
ингибирует хеликазную активность
(rocaglamides)
eIF4A и связывание eIF4F с мРНК
БИОХИМИЯ том 85 вып. 11 2020
1654
ДМИТРИЕВ и др.
Продолжение таблицы 2
Класс,
Специ
Стадия
Название
группа
фичность
Мишень
трансля
Механизм действия
веществ
(Б, А, Э)
ционного
цикла
Рибавирин (ribavirin)
аналог m7G
Э
eIF4E?
И
возможно, в некоторых условиях
может конкурировать с m7G ке
пом за связывание eIF4E?
4EGI 1
Э
eIF4E-eIF4G
И
связывается с eIF4E, препятствуя
взаимодействию с eIF4G
4E1RCat
Э
eIF4E-eIF4G
И
- // -
4E2RCat
Э
eIF4E-eIF4G
И
- // -
Гефироновая кислота
поликетид
Э
(eIF2)
И
связывается с eIF2 и влияет на
(gephyronic acid)
его активность?
CM16
бета карболин
Э
eIF1AX, eIF3
И
ингибирует eIF1AX и eIF3?
Охратоксин A
изокумарин
Б, А, Э
Phe тРНК
Э
ингибитор Phe тРНК синтетазы
(ochratoxin A)
синтетаза
Боррелидин (borrelidin)
поликетид
Б, А, Э
Thr тРНК
Э
ингибитор Thr тРНК синтетазы
синтетаза
Реверомицин А
- // -
Э
Ile тРНК
Э
ингибитор Ile тРНК синтетазы
(reveromycin A)
синтетаза
Спирофунгин А
- // -
Э
Ile тРНК
Э
- // -
(spirofungin A)
синтетаза
Фураномицин
аналог Ile
Б? А? Э
Ile тРНК
- // -
(furanomycin)
синтетаза
Метионин сульфамид
аналог Met
Б, А, Э
Met тРНК
Э
ингибитор Met тРНК синтетазы
(methionine sulfamide)
синтетаза
Метионил аденилат
- // -
Б, А, Э
Met тРНК
Э
- // -
(methionyl adenylate)
синтетаза
Метионин гидроксамат 20
- // -
Б, А, Э
Met тРНК
Э
- // -
(methionine hydroxamate 20)
синтетаза
Этионин (ethionine)
- // -
Б, А, Э
Met тРНК
И, Э
- // -
синтетаза
Таваборол
оксаборол
Э
Leu тРНК
Э
ингибитор Leu тРНК синтетазы
(AN2690, tavaborole)
синтетаза
Гистидинол (histidinol)
аналог His
Б, А, Э
His тРНК
Э
ингибитор His тРНК синтетазы
синтетаза
и биосинтеза His
Фосмидозин
нуклеозидный
Э
Pro тРНК
Э
ингибитор Pro тРНК синтетазы
(phosmidosine)
амидофосфит
синтетаза?
Фебрифугин (febrifugine)
хиназолиноно
?
Pro тРНК
Э
- // -
вый алкалоид
синтетаза
Галофугинон
хиназолиноно
?
Pro тРНК
Э
- // -
(halofuginone)
вый алкалоид,
синтетаза
аналог фебри
фугина
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1655
Окончание таблицы 2
Класс,
Специ
Стадия
Название
группа
фичность
Мишень
трансля
Механизм действия
веществ
(Б, А, Э)
ционного
цикла
Пурпуромицин
поликетид
Б, А, Э
тРНК
Э
связывает любые тРНК, препят
(purpuromycin)
ствуя их аминоацилированию
GC7
аналог сперми
Б, А, Э
DHPS/eIF5A
Э
ингибитор синтеза гипузина, не
дина
обходимого для работы eIF5A
Семапимод/CNI1493
анилид
Э
- // -
Э
- // -
(semapimod)
Дезоксиспергуалин/
Э
- // -
Э
- // -
гусперимус (deoxysper
gualin/gusperimus)
DHSI 15
Э
- // -
Э
- // -
Циклопирокс/лопрокс
производное
Э
DOHH/eIF5A
Э
ингибитор синтеза гипузина, не
(ciclopirox/loprox)
пиридона
обходимого для работы eIF5A
(хелатор железа)
Деферипрон (deferiprone)
- // -
Э
- // -
Э
- // -
Мимозин (mimosine)
– // -
Э
- // -
Э
- // -
Примечание. Буквенные коды и обозначения - как в табл. 1.
дификация eEF2 - дифтамид [190]. Эта же ами
рии, все так или иначе направлены на наруше
нокислота является мишенью для большой
ние взаимодействия факторов элонгации с ри
группы бактериальных белковых токсинов
босомой [130].
(дифтерийного и других), которые инактивиру
Мишенью для ингибиторов может служить
ют eEF2 путём ADF рибозилирования дифта
также ещё один фактор элонгации (ранее оши
мида, однако поскольку белковые ингибиторы
бочно считавшийся фактором инициации) -
не являются предметом данного обзора, заинте
eIF5A, точнее, уникальная модификация одного
ресованному читателю можно порекомендовать
из его аминокислотных остатков, гипузина, не
ознакомиться с другими обзорами на эту те
обходимая для его работы [196]. Вещества, бло
му [191].
кирующие разные стадии превращения консер
Вопрос о наличии аналога сордарина, кото
вативного остатка лизина eIF5A в гипузин, при
рый бы действовал на клетки млекопитающих,
водят к накоплению в клетке неактивного фак
пока остаётся открытым. Скорее всего, такой
тора. К таким ингибиторам относятся GC7, се
механизм действия можно приписать противо
мапимод (CNI1493), дезоксиспергуалин (гуспе
опухолевому препарату, циклическому пептиду
римус), DHSI15, а также циклопирокс, дефе
бувардину и его производным: RA VII, SVC112
рипрон и мимозин (см. обзор в [196]). Однако
и другим [192, 193]. Ранее сообщалось, что похо
эти вещества не являются высокоспецифичны
жим образом может действовать пурпуромицин
ми: некоторые из них влияют на работу других
[194], однако впоследствии оказалось, что его
ферментов, участвующих в метаболизме и
эффекты связаны с ингибированием аминоаци
транспорте полиаминов или других молекул, а
лирования (см. ниже). Зато недавно был открыт
последние три и вовсе являются хелаторами же
нетоксичный для клеток человека противомаля
леза. Кстати, для мимозина ранее в качестве
рийный препарат DDD107498, мишенью кото
вторичной мишени был идентифицирован и
рого является eEF2 малярийного плазмодия
другой трансляционный фактор - eIF3: это ве
[195]. Интересно, что в его состав входит хино
щество приводит к специфичному снижению
линовый гетероцикл, как и в состав вышеопи
экспрессии гена одной из его субъединиц, eIF3a
санного противомалярийного препарата меф
[197].
локвина. Не исключено, что вещества наподо
Ингибиторы инициаторных факторов. В отли
бие хинина, применяемые для лечения маля
чие от относительно консервативных элонгаци
БИОХИМИЯ том 85 вып. 11 2020
1656
ДМИТРИЕВ и др.
онных факторов, многие компоненты инициа
зали значимой ингибирующей активности
торного аппарата эукариот появились в эволю
(Лашкевич, Дмитриев, персональное сообще
ции с возникновением сканирования и являют
ние).
ся эукариот специфичными. В первую очередь
Взаимодействие eIF4E с m7G кепом на 5′
это относится к факторам инициации группы
конце мРНК также очень важно. В работе
eIF4, которые помогают мРНК связаться с ри
Kentsis et al. [209] было заявлено, что это взаи
босомой и участвуют в сканировании [1]. Не
модействие можно нарушить конкурентным ин
большой кеп связывающий белок eIF4E «заяко
гибитором (рисунок, i.4) - противовирусным
ривает» трёхсубъединичный комплекс eIF4F,
препаратом рибавирином (и его трифосфорили
компонентом которого он является, на m7G ке
рованной формой), напоминающим по своей
пированном 5′ конце клеточных мРНК, а его
структуре m7G кеп. Однако это утверждение
партнёр, мРНК связывающий фактор eIF4G,
было оспорено сразу двумя группами [210, 211],
выполняет роль платформы для посадки на
хотя авторы оригинальной работы остались при
мРНК ATP зависимой РНК хеликазы eIF4A и
своём мнении [212]. Позднее было также пока
служит «мостиком» между мРНК и факторами,
зано влияние рибавирина на сигнальный путь
входящими в состав рибосомного 43S преини
Akt [213], которое, возможно, и объясняет его
циаторного комплекса [1].
эффекты.
В направленном высокопроизводительном
Благодаря работам группы Pelletier et al. был
скрининге [198] было найдено вещество 4EGI 1,
открыт целый ряд новых ингибиторов, ми
которое связывается с белком eIF4E и аллосте
шенью которых является другой компонент
рически нарушает его ассоциацию с eIF4G (ри
комплекса eIF4F - РНК хеликаза eIF4A [214,
сунок, i.3), одновременно усиливая его взаимо
215]. Так, стероид гиппуристанол связывается и
действие с ингибитором 4Е ВР1 [199, 200]. Тем
аллостерически ингибирует eIF4A (рису
самым 4EGI 1 подавляет кеп зависимую транс
нок, i.5) [216], а патеамин А препятствует её
ляцию мРНК, не влияя на работу транскриптов,
взаимодействию с eIF4G (рисунок, i.2), усили
использующих неканонические механизмы
вая связывание eIF4A с мРНК [217, 218]. Нес
инициации трансляции (например, вирусных
колько хуже охарактеризован механизм
мРНК с участками внутреннего связывания ри
действия рокаглатов, в том числе Roc A, силь
босомы (IRES элементами) или клеточных
вестрола и других веществ из группы флавагли
мРНК с кеп независимыми трансляционными
нов, также приводящих к нарушению работы
энхансерами (CITE элементами) [201]). В дру
eIF4A (рисунок, i.5) [219-221]. С помощью ри
гом скрининге были идентифицированы ещё
босомного профайлинга было показано, что
два вещества с аналогичным механизмом
некоторые из них имеют специфичность к нук
действия, 4E1RCat [202] и 4E2RCat [203], пос
леотидной последовательности 5′ нетрансли
леднее из которых показало мощную противо
руемой области, на которой происходит оста
вирусную активность, подавляя развитие коро
новка сканирования из за угнетения функции
навирусов.
eIF4A (см. обсуждение в [221]), а последнее ис
Есть предположение, что сходным образом
следование выявило двойное действие этих ин
могут действовать некоторые сердечные глико
гибиторов: на стадию посадки фактора eIF4F и
зиды - например, уабаин [204]. Интересно, что
инициаторного комплекса на 5′ кеп, а также на
транскрипционный паттерн клеток, обработан
последующее рибосомное сканирование [221].
ных кардиогликозидами, сильно напоминает
Для некоторых из этих ингибиторов eIF4A по
картину, вызываемую классическими ингибито
лучены и охарактеризованы многочисленные
рами элонгации (циклогексимидом, анизоми
производные с целью их использования в про
цином, эметином и др.) [205], и в работе Perne
тивоопухолевой терапии [221, 222]. Недавно
et al. [206] было показано угнетение белкового
был проведён ещё один скрининг, в котором
синтеза этими веществами. Однако, скорее все
были выявлены два новых высокоспецифич
го, речь здесь идёт всё же о вторичных или вре
ных ATP конкурентных ингибитора eIF4A -
менных эффектах, поскольку сходство тран
элизабатин А и аллолауринтерол [223]. Извест
скрипционных паттернов, ярко выраженное на
ны и другие ингибиторы трансляционных
6 м часу обработки, к 24 часам исчезает [205].
РНК хеликаз (не только eIF4A, но и DDX3) -
Возможно, они ингибируют сигнальный путь
например, вещества нуклеозидной природы,
PI3K/Akt/mTOR [207], о котором речь пойдёт
такие как гиперицин, однако они действуют
ниже, или фактор eIF4A [208]. Однако в опытах
менее специфично [214].
по прямому влиянию на трансляцию репортер
Универсальными ингибиторами, действую
ных мРНК в бесклеточной системе из клеток
щими преимущественно на инициацию транс
млекопитающих сердечные гликозиды не пока
ляции и широко использовавшимися на заре
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1657
изучения механизмов биосинтеза белка, являют
ИНГИБИТОРЫ АМИНОАЦИЛ/тРНК/
ся ауринтрикарбоновая кислота (АТА) и сходные
СИНТЕТАЗ
с ней трифенилметановые и ксантеновые краси
тели: галлин, пирокатехиновый фиолетовый и
Помимо рибосом и фактор направленных
ряд других [18, 224, 225]. Однако специфичность
ингибиторов, высокоспецифичное влияние на
действия этих соединений вызывает вопросы,
биосинтез белка могут оказывать вещества, бло
поскольку в зависимости от концентрации они
кирующие вспомогательные компоненты
могут ингибировать разные стадии белкового
трансляционной машинерии - в первую оче
синтеза (см. обсуждение в [10]). АТА и подобные
редь ингибиторы аминоацил тРНК синтетаз
ей соединения, по всей вероятности, являются
(АРСаз), примеры которых также приведены в
умеренно специфичными разобщителями РНК
табл. 2 и на рисунке, e.1. Сульфамиды, гидрок
белковых контактов [226, 227], и их действие на
саматы и прочие производные аминокислот и
фактор опосредованное и бесфакторное связы
пептидов, а также эфиры и гидроксаматы ами
вание тРНК с рибосомой in vitro [228] вызвано
ноацил аденилатов ингибируют синтез соответ
нарушением этих взаимодействий (рисунок, i.1).
ствующих аминоацил тРНК. Например, L ме
Кроме того, использование данных веществ зат
тионинол, метионилсульфамид, L метионил
рудняет то, что они не проникают в клетки мле
гидроксамат и разные варианты метионил аде
копитающих [229]. По этой причине в наши дни
нилатов специфично подавляют синтез Met
они почти не используются для изучения эука
тРНК [234, 235], а 6 фтортриптофан, антаго
риотической трансляции.
нист Trp, ингибирует реакцию активации Trp
Тем не менее в 2004 году при поиске новых
при синтезе аминоациладенилата [236]. Работ, в
трансляционных ингибиторов было обнаружено
которых описаны такие производные, сущест
несколько похожих соединений (производных
вует великое множество [10], и их число быстро
галлеина и флуоресцеина), которые показали
растёт благодаря современным методам компь
интересное мРНК специфичное воздействие на
ютерного дизайна веществ [237-239]. В редких
трансляцию репортерных транскриптов [230].
случаях аналоги аминокислот (например, этио
Их добавление в бесклеточную систему подав
нин - S этиловый аналог метионина) не только
ляло кеп зависимую трансляцию, но почти не
ингибируют АРСазы, но и могут встраиваться в
сказывалось на трансляции, направляемой
белки, быстро приводя к пагубным для клетки
IRES элементом вируса гепатита С (HCV). Этот
последствиям [240].
IRES, помимо прочих своих особенностей, из
Большинство вышеописанных веществ яв
вестен тем, что в определённых условиях спосо
ляются универсальными ингибиторами биосин
бен обеспечивать eIF2 независимую инициа
теза белка и обладают свойством свободно про
цию трансляции [231, 232]. Более подробное
никать в клетки эукариот, однако из за сходства
изучение веществ NSC 119889 и NSC 119893
с аминокислотами они могут влиять и на другие
(последнее из которых оказалось способно про
процессы, а их эффективные концентрации
никать в культивируемые клетки млекопитаю
обычно находятся в относительно высоком
щих) показало, что они препятствуют связыва
(миллимолярном) диапазоне. Большей аффин
нию инициаторной Met тРНКi с eIF2 (рису
ностью к мишеням обладают высокоспецифич
нок, i.1) и тем самым блокируют образование
ные ингибиторы АРСаз, вырабатываемые неко
43S преинициаторного комплекса [232], обяза
торыми организмами. Так, боррелидин, произ
тельного интермедиата канонической инициа
водимый некоторыми морскими бактериями,
ции трансляции.
является высокоспецифичным ингибитором
Некоторые другие трансляционные факторы
треонил тРНК синтетазы [241], охратоксин А
(например, eIF1AX и eIF3 [197, 233]) также бы
из плесневых грибов поражает фенилаланил
ли идентифицированы в качестве мишеней для
тРНК синтетазу [242], фебрифугин и галофуги
низкомолекулярных ингибиторов, но пока эта
нон ингибируют пролиловую [243, 244], а тава
тема недостаточно изучена. Кроме того, фак
борол - лейциловую АРСазы [245]. Спирофун
тор опосредованные функции можно заблоки
гин А [246] и реверомицин А [247, 248] действу
ровать также негидролизуемыми аналогами ри
ют на изолейцил тРНК синтетазу, причём пос
бонуклеозидтрифосфатов (инициацию, элонга
ледний в некоторых тестах показывает специ
цию и терминацию трансляции - аналогами
фичность по отношению к определённому типу
GTP (например, GMPPNP или GMPPCP), а
клеток [249]. Немного особняком стоит необыч
инициацию и рециклинг - ещё и аналогами
ный ингибитор пурпуромицин, способный свя
ATP). Однако эти ингибиторы, разумеется, не
зываться с любой тРНК и препятствовать её
являются специфичными и, кроме того, как
аминоацилированию; при этом на связывание
правило, не проникают в клетку [229].
аминоацилированных тРНК с факторами элон
10 БИОХИМИЯ том 85 вып. 11 2020
1658
ДМИТРИЕВ и др.
гации, рибосомой и другими трансляционными
[260], а его отдельные компоненты тесно связа
компонентами он никак не влияет [250].
ны с продолжительностью жизни [261]. К мише
Многие ингибиторы АРСаз имеют важное
ням mTOR также относятся киназы S6K1/2,
медицинское значение, поскольку обладают
фосфорилирующие рибосомный белок eS6
иммуносупрессорным эффектом, применяются
(RPS6), фактор инициации трансляции eIF4B,
в антимикробной, противоопухолевой и анти
белок PDCD4 (ингибитор eIF4A), а также -
паразитарной терапии [239, 251]. Их действие на
опосредованно - eEF2 [253, 254]. Всё это делает
клетку обычно опосредовано не только угнете
mTOR привлекательной мишенью для новых
нием белкового синтеза, но и запуском особого
клинически значимых ингибиторов [259]. На
типа стрессового ответа [252], вызываемого на
данный момент таких ингибиторов найдено уже
коплением в цитоплазме деацилированных
довольно много (наиболее известные из них
тРНК и столкновениями транслирующих рибо
приведены в табл. 3). Их можно разделить на два
сом (см. ниже).
типа: прямые ATP конкурентные ингибиторы
активного центра киназы mTOR (рисунок, s.6) и
аллостерические, действующие опосредованно
ИНГИБИТОРЫ СИГНАЛЬНЫХ ПУТЕЙ,
через белок FKBP12 (рисунок, s.7) - компонент
СВЯЗАННЫХ С РЕГУЛЯЦИЕЙ
киназного комплекса mTORC1 (мишенями это
ТРАНСЛЯЦИИ
го комплекса как раз и являются вышеперечис
ленные трансляционные факторы). К первому
Как и любой другой сложный процесс в
типу относятся такие широко используемые ин
клетке, биосинтез белка тонко регулируется на
гибиторы, как торин 1, торин 2, INK128, AZD
разных уровнях. В частности, у эукариот суще
8055, OSI 027, WYE 132, Ku0063794, PP242 и
ствует несколько сигнальных каскадов, закан
другие [255, 262], ко второму - природный мак
чивающихся специализированными фермента
ролид рапамицин (сиролимус) и его синтетичес
ми, модифицирующими трансляционные ком
кие аналоги, именуемые «рапалогами», - эверо
поненты [253, 254]. Эти сигнальные каскады
лимус, темсиролимус и ридафоролимус [255,
могли бы стать темой для отдельного обзора, по
259]. Рапалоги давно и успешно применяются
этому мы не будем останавливаться на них под
для иммуносупрессии при пересадке органов, а
робно - однако было бы неправильно не упомя
также в противораковой терапии. В последнее
нуть хотя бы некоторые из наиболее важных ми
время всё больше внимания уделяется ингибито
шеней - компонентов таких каскадов - и нап
рам mTOR как перспективным геропротекто
равленных на них ингибиторов (табл. 3 и рису
рам, поскольку на многих животных моделях
нок).
была показана их способность увеличивать про
Ингибиторы киназы mTOR и сигнального кас/
должительность жизни [261].
када PI3K/Akt/mTOR. Крайне важным сигналь
Некоторые вещества, хорошо зарекомендо
ным путём является регуляторный каскад
вавшие себя в качестве ингибиторов кеп зави
PI3K/Akt/mTOR, интегрирующий сигналы от
симой трансляции, направлены не на саму ки
инсулина, ряда ростовых факторов и информа
назу mTOR, а на вышерасположенные компо
цию о доступности аминокислот [255, 256]. Одна
ненты каскада PI3K/Akt/mTOR (рисунок, s.5). С
из непосредственных мишеней киназы mTOR -
продвижением вверх по каскаду, разумеется,
уже упоминавшийся белок ингибитор 4E BP1,
увеличивается и спектр воздействия данных ве
который при фосфорилировании становится не
ществ, а специфичность эффектов уменьшает
активным и не мешает кеп связывающему фак
ся. Тем не менее довольно часто для подавления
тору eIF4E выполнять свою функцию [256]. Но
кеп зависимой трансляции используют ингиби
если mTOR инактивирована, 4E BP1 вытесняет
торы PI3K
- например, вортманин или
eIF4G из комплекса с eIF4E, в результате транс
LY294002, тем более что киназные домены PI3K
ляция в клетке в целом становится гораздо менее
и mTOR относятся к одному семейству и часто
интенсивной, а особый класс мРНК, содержа
подвержены действию одних и тех же ингибито
щих на 5′ конце олигопиримидиновый тракт (5′
ров [263]. В проведённом недавно поиске ве
TOP), и вовсе почти перестаёт транслироваться
ществ, направленных на избирательное подав
[201, 255]. 5′ TOP мРНК кодируют в основном
ление трансляции 5′ TOP мРНК [264], в число
компоненты трансляционного аппарата (рибо
наилучших вошли ингибиторы каждого из ком
сомные белки, факторы трансляции и так далее)
понентов каскада, а также, весьма неожиданно,
[257, 258], поэтому их трансляция особенно важ
киназы GCN2, о которой будет сказано ниже.
на для активно делящейся и метаболизирующей
Возможно, что с той или иной специфичностью
клетки - например, раковой [259]. Активность
ингибиторами пути PI3K/Akt/mTOR являются
этого пути также сильно меняется с возрастом
также сердечные гликозиды [207].
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1659
Тем не менее нужно помнить, что у киназы
цифичных для eIF2 комплексов фосфатазы PP1.
mTOR насчитывается не один десяток мише
Так, салубринал (и его водорастворимое произ
ней, многие из которых не имеют никакого от
водное Sal003) инактивирует стресс индуцируе
ношения к трансляции. Поэтому о высокоточ
мый комплекс GADD34/PP1 и конститутивно
ном влиянии её ингибиторов на белковый син
активный комплекс CReP/PP1 (рисунок, s.4),
тез речь идти не может. То же самое можно ска
вызывая угнетение биосинтеза белка в клетке
зать и о киназах MAPK каскадов (Ras/ERK/
[273, 274]. Сообщалось также о фосфорилирова
RSK и p38MAPK/Mnk1/2), частично пересека
нии eIF2 при обработке клеток окадаиковой
ющихся с путём PI3K/Akt/mTOR [253, 254]; хо
кислотой, ингибитором фосфатазы PP2A [275],
тя их мишенями служат в том числе eIF4E,
однако этот эффект, возможно, носит неспеци
eIF4B, eEF2 и другие общие факторы трансля
фичный характер, поскольку eIF2α считается
ции, однозначного мнения о том, как они влия
мишенью PP1, а не PP2A [276]. Тем не менее обе
ют на биосинтез белка в целом, пока нет, а их
фосфатазы играют большую роль в регуляции
воздействие на клетку носит широкий характер.
трансляционных факторов [277], поэтому они
Модуляторы фосфорилирования eIF2. Куда
представляют собой важные мишени для низко
более специфичное действие имеют киназы
молекулярных веществ.
фактора инициации eIF2, которых у млекопита
Что касается ингибиторов, а не активаторов
ющих насчитывается четыре: GCN2, HRI,
четырёх киназ eIF2, которые также известны в
PERK и PKR [265, 266]. eIF2 доставляет иници
большом количестве, то в обычных условиях
аторную Met тРНКi в P сайт 40S субчастицы и
они, как правило, слабо влияют на эффектив
обеспечивает сканирование [5], он является
ность синтеза белка в клетке, но способны пре
ключевым фактором, необходимым всем эука
пятствовать падению уровня трансляции при со
риотическим мРНК за исключением тех редчай
ответствующем стрессе. Поскольку временный
ших случаев, когда стартовый кодон мРНК ока
трансляционный блок является важной частью
зывается в P сайте рибосомы без сканирования
антистрессового ответа на многие воздействия,
[267]. Фосфорилирование α субъединицы eIF2
его нарушение зачастую имеет пагубные послед
нарушает его диссоциацию из комплекса с
ствия для стрессированной клетки. Однако рас
eIF2B фактором обмена GDP на GTP, в резуль
смотрение этих специфических эффектов, име
тате eIF2 выводится из игры. До недавних пор
ющих значение для антивирусной терапии, при
считалось, что для каждой из упомянутых киназ
лечении неврологических расстройств и в онко
фактор eIF2 - единственная мишень; сейчас из
логии для усиления действия хемиотерапевти
вестно, что это не совсем так [265, 268], однако
ческих препаратов выходит за рамки данного об
нет никаких сомнений в том, что основное их
зора; интересующимся этой темой можно поре
назначение - именно регуляция трансляции.
комендовать обзор Joshi et al. [268].
Поэтому вещества, модулирующие работу этих
Тем не менее одно вещество с очень любо
киназ, нельзя не рассмотреть в данном разделе.
пытным механизмом действия хотелось бы упо
BTdCPU и другие производные N,N′ диа
мянуть. Речь о малой молекуле транс ISRIB
рилмочевины являются специфическими акти
[278], которая способна связываться с eIF2B и
ваторами киназы HRI (рисунок, s.2) и рассмат
до определённых пределов поддерживать
риваются как перспективные антираковые пре
GDP/GTP обменивающую активность по отно
параты [269]. CCT020312 и MK 28 - фармако
шению к eIF2 при его фосфорилировании [279].
логические активаторы PERK (рисунок, s.1) с
Поскольку усиление трансляции в нейронах го
потенциалом применения в лечении нейропа
ловного мозга может положительно влиять на
тий [270, 271]. Вопрос о специфичных активато
консолидацию кратковременной памяти в дол
рах киназы GCN2 (рисунок, s.3) пока недоста
говременную, ISRIB способен улучшать память
точно изучен, однако в недавнем скрининге бы
и когнитивные способности животных [278].
ли определены два кандидата - низкомолеку
Говоря об ингибирующем эффекте фосфори
лярные вещества дабрафениб и MK1775 [264].
лирования eIF2, нельзя не упомянуть несколько
Интересно, что их действие на клетку приводит
веществ, которые очень часто используются для
к подавлению трансляции 5′ TOP мРНК и на
его опосредованной индукции. К таким вещест
поминает таким образом действие ингибиторов
вам относятся туникамицин (ингибитор глико
mTOR. Механизм этого не был установлен, од
зилирования белков, вызывающий стресс эн
нако в более раннем исследовании была показа
доплазматического ретикулума), тапсигаргин
на связь GCN2 и 5′ TOP мРНК, опосредованная
(индуктор высвобождения ионов Ca2+ из внут
белками TIA 1/TIAR [272].
риклеточных депо) и дитиотреитол (нарушаю
Резко повысить уровень фосфорилирования
щий тиольный обмен, что запускает стрессовый
eIF2 можно также путём нарушения работы спе
каскад ответа на несвернутые белки, известный
БИОХИМИЯ том 85 вып. 11 2020
10*
1660
ДМИТРИЕВ и др.
Таблица 3. Ингибиторы основных сигнальных путей, регулирующих биосинтез белка в клетках эукариот
Стадия
Название
Класс, группа
Мишень
трансля
Механизм действия
веществ
ционного
цикла
Рапамицин (rapamycin)
макролид, группа ра
mTORС1
И (Э)
аллостерический ингибитор mTOR;
памицина
(FKBP12)
активация 4E BP1 и подавление
кеп зависимой трансляции, в пер
вую очередь 5′ TOP мРНК
Эверолимус (everolimus)
макролид, группа ра
mTORС1
И (Э)
- // -
памицина (рапалог)
(FKBP12)
Темсиролимус (temsirolimus)
- // -
mTORС1
И (Э)
- // -
(FKBP12)
Ридафоролимус (ridaforolimus)
- // -
mTORС1
И (Э)
- // -
(FKBP12)
Торин 1 (torin 1)
пиридинонехинолин
mTOR
И (Э)
ATP конкурентный ингибитор
mTOR; активация 4E BP1 и подав
ление кеп зависимой трансляции, в
первую очередь 5′ TOP мРНК
Торин 2 (torin 2)
- // -
mTOR
И (Э)
- // -
Торкиниб/PP242 (torkinib)
пиразолопиримидин
mTOR
И (Э)
- // -
Сапанисертиб/MLN0128/
бензоксазол
mTOR
И (Э)
- // -
INK128/TAK 228 (sapanisertib)
Вистусертиб/AZD2014
фенилпиридин, груп
mTOR
И (Э)
- // -
(vistusertib)
па вистусертиба
AZD8055
- // -
mTOR
И (Э)
- // -
Дактолисиб/NVP BEZ235
фенилхинолин
PI3K/mTOR
И (Э)
- // -
(dactolisib)
Воксталисиб/SAR245409/XL765
пиразолилпиридин
PI3K/mTOR
И (Э)
- // -
(voxtalisib)
Самотосилиб/LY3023414
имидазохинолин
PI3K/mTOR
И (Э)
- // -
(samotosilib)
Омипалисиб/GSK2126458
хинолин
PI3K/mTOR
И (Э)
- // -
(omipalisib)
Вортманин (wortmannin)
стероид
PI3K/mTOR
И (Э)
- // -
LY294002
производное морфо
PI3K/mTOR
И (Э)
- // -
лина
Бимиралисиб/PQR309
пиридинамин
PI3K/mTOR
И (Э)
- // -
(bimiralisib)
Гедатолисиб/PKI 587/
бензоидпиперидин
PI3K/mTOR
И (Э)
- // -
PF 05212384 (gedatolisib)
Адавосертиб/МК1775
пиперазин
GCN2?
И
активатор GCN2? приводит к подав
(adavosertib)
лению трансляции 5′ TOP мРНК
Дабрафениб (dabrafenib)
сульфанилид
GCN2?
И
- // -
BTdCPU
HRI
И
активатор HRI, приводит к фосфо
N,N′ диарилмочевина
рилированию и инактивации eIF2
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1661
Окончание таблицы 3
Стадия
Название
Класс, группа
Мишень
трансля
Механизм действия
веществ
ционного
цикла
CCT020312
хинолин
PERK
И
активатор PERK, приводит к фос
форилированию и инактивации eIF2
MK 28
метиламипентанамид
PERK
И
- // -
Салубринал (salubrinal)
хинолин, группа
GADD34/
И
ингибитор eIF2 специфичных
салубринала
PP1?,
комплексов фосфатазы PP1
CReP/PP1?
(GADD34/PP1, CReP/PP1), приво
дит к инактивации eIF2
Sal003
- // -
GADD34/
И
- // -
PP1?,
CReP/PP1?
Окадаиковая кислота
поликетиное произ
PP2A
И
ингибитор фосфатазы PP2A, при
(okadaic acid)
водное С38 жирной
водит к фосфорилированию и
кислоты
инактивации eIF2
ISRIB
циклогексилацемид
eIF2B
И
модулятор активности eIF2B, пре
пятствует подавлению трансляции
Мириапорон 3/4 (myriaporone 3/4)
поликетид, аналог те
eEF2K?
Э
индуцирует фосфорилирование и
данолида (см. табл. 1)
инактивацию eEF2
Нелфинавир/вирацепт/1UN
eEF2K?
Э
- // -
(nelfinavir/viracept)
NH125
иодид метилимидазо
eEF2K?
Э
- // -
лия
A 484954
пиримидин 6 карбок
eEF2K
Э
ингибитор eEF2K, препятствует по
самид
давлению трансляции
Примечание. Буквенные коды и обозначения - как в табл. 1.
как UPR) - эти вещества вызывают опосредо
Индукторы фосфорилирования eEF2. Инги
ванную активацию PERK. Широко используют
бирующему фосфорилированию подвержен
ся арсенит натрия (также, по видимому,
также фактор элонгации eEF2. Его активность
действующий через SH группы некоторых бел
регулируют, вероятно, несколько киназ, но ос
ков, но более избирательно, что приводит к ак
новной является специализированная киназа
тивации HRI); неспецифичные окислители типа
eEF2K. Будучи мишенью S6K и mTOR, она на
перекиси водорода (вероятно, тоже посредством
ходится под негативным контролем каскада
HRI); длинная двухцепочечная РНК (активатор
PI3K/Akt/mTOR: eEF2K активируется, а eEF2
PKR); некоторые из уже упоминавшихся анало
частично теряет активность, когда этот путь по
гов аминокислот - ингибиторов АРСаз (активи
давлен [253]. Ингибиторы eEF2K не оказывают
рующие GCN2). Фосфорилирование eIF2 также
заметного воздействия на клетки [280], в то вре
индуцируют блокаторы дыхательной цепи мито
мя как активаторы могут существенно снижать
хондрий, гликолиза или ATP синтазы (миксоти
эффективность трансляции (рисунок, s.8). Нап
азол, 2 дезоксиглюкоза, олигомицин) и прочие
ример, поликетид мириапорон 3/4, напоминаю
ингибиторы энергетики и метаболизма. Однако
щий описанные выше рибосомные ингибиторы
мы не станем их подробно рассматривать, пос
теданолид и 13 дезокситеданолид [90], индуци
кольку их действие неспецифично, а ингибиро
рует фосфорилирование eEF2 [92] и таким обра
вание трансляции является лишь одной из вет
зом негативно воздействует на трансляцию [91].
вей многопланового интегрированного стрессо
Такой же эффект имеют антивирусный препарат
вого ответа (ISR), который клетка разворачивает
нелфинавир [281] и вещество NH125 (ранее
при подобных воздействиях [265, 266].
ошибочно считавшееся ингибитором eEF2K),
БИОХИМИЯ том 85 вып. 11 2020
1662
ДМИТРИЕВ и др.
хотя в последнем случае связь эффекта с кина
пактамицин) были начисто лишены такой спо
зой не так очевидна [269, 282]. Модуляторы ки
собности [287-290]. Дальнейшие исследования
назы eEF2K привлекают всё большее внимание
показали, что иногда даже химически близкие
исследователей в связи с её ролью в развитии
вещества, имеющие одинаковый механизм
депрессии, эпилепсии и нейродегенеративных
действия, могут принципиально отличаться по
заболеваний [283].
этому параметру. Например, близкое производ
В контексте фосфорилирования eEF2 стоит
ное того же анизомицина, диацетиланизоми
упомянуть ещё одну киназу, активно вовлечён
цин, не вызывает активации стрессового каскада
ную в регуляцию биосинтеза белка, - AMPK.
[288], а разные представители трихотециновых
Она является сенсором дефицита энергии в клет
микотоксинов, различающиеся лишь боковыми
ке и при активации способствует снижению ско
радикалами, сильно разнятся по этому парамет
рости элонгации путём передачи сигнала на
ру [288, 291, 292], хотя все они, как было описа
eEF2K и фосфорилирования eEF2 [253]. Сущест
но выше, относятся к ингибиторам ПТЦ. Теопе
вует множество низкомолекулярных веществ, ак
дерин, оннамид А и 13 дезокситеданолид связы
тивирующих AMPK (рисунок, s.9) как опосредо
ваются с другим местом на рибосоме и ингиби
ванно, путём истощения ATP (например, 2 де
руют транслокацию, однако активируют рибо
зоксиглюкоза, олигомицин и антидиабетичес
токсический стресс, аналогичный анизомици
кий препарат метформин), так и напрямую
новому [86, 293]. Циклогексимид же является
(A 769622, бензимидазоловое производное «991»
относительно слабым индуктором стресса [287,
и, наверное, самый известный активатор АМРК -
294], в то время как другой глутаримид, лакти
AICAR, используемый недобросовестными
мидомицин, вызывает сильную активацию
спортсменами в качестве допинга [284]). Все эти
p38MAPK [294]. Риботоксический стресс вызы
вещества индуцируют фосфорилирование eEF2,
вает и упоминавшийся выше цитотриенин А, хо
снижая эффективность трансляции [285]. Ко
тя его мишень - фактор eEF1A [295], а также не
нечно, как и в случае с каскадом PI3K/Akt/mTOR
которые аминогликозиды, известная ототоксич
(с которым у этого пути есть «пересекающиеся
ность которых может быть связана, в том числе,
мишени»), действие активаторов AMPK на клет
именно с индукцией этого стресса [296].
ку носит широкий характер и не ограничивается
До недавнего времени механизм запуска ри
подавлением трансляции [254].
ботоксического стресса представлял загадку, хо
тя промежуточные компоненты каскада - кина
зы JNK и p38MAPK - были идентифицированы
РИБОТОКСИЧЕСКИЙ СТРЕСС И ДРУГИЕ
ещё в первой работе по этой теме [287], а позд
ВИДЫ СТРЕССОВЫХ ОТВЕТОВ,
нее кандидатами в посредники или первичные
СВЯЗАННЫХ С ТРАНСЛЯЦИЕЙ
индукторы назывались киназы PKR и HCK
[287-290]. Недавно исследователи обратили
Говоря об эффектах трансляционных инги
внимание на то, что некоторые ингибиторы
биторов, невозможно не коснуться явлений,
элонгации, запускающие риботоксический
происходящих в эукариотической клетке в ответ
стрессовый ответ, перестают быть индукторами
на полную или частичную остановку белкового
при увеличении концентрации [67]. Это навело
синтеза. В клетках эукариот существует несколь
на мысль, что в основе данного явления лежит
ко специальных механизмов, связанных с отсле
активация специфических сигнальных каскадов
живанием общего состояния биосинтеза белка:
двумя или тремя столкнувшимися рибосомами:
доступности аминокислот, нарушений ко
в условиях, когда элонгация частично блокиру
трансляционного фолдинга, адресации продук
ется каким либо антибиотиком, такие случаи
тов и так далее, а также с контролем качества
резко учащаются, что приводит к запуску гене
трансляции отдельных транскриптов каждой ри
рализованного клеточного ответа, в то время
босомой [6, 286]. В конце прошлого века стало
как при одновременной остановке всех рибосом
известно, что под действием анизомицина и не
такие столкновения становятся невозможны.
которых других ингибиторов элонгации в клетке
Данная гипотеза блестяще подтвердилась в не
запускается особый вид клеточного ответа, кото
давнем исследовании, проведённом группой
рый был назван риботоксическим стрессом
Green [67]. Авторам удалось показать, что детек
[287]. Интересно, что при одной и той же степе
ция столкнувшихся рибосом лежит в основе за
ни подавления синтеза одни ингибиторы (ани
пуска трёх разных молекулярных механизмов,
зомицин, дезоксиниваленол) вызывали резкую
ранее казавшихся независимыми. В случае еди
активацию сигнального пути JNK/p38MAPK,
ничных событий сталкивания срабатывают ме
что приводило к разрезанию рРНК и уходу клет
ханизмы рибосомного контроля качества, RQC
ки в апоптоз, в то время как другие (например,
[6, 286], разбирающие конкретный «застряв
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1663
ший» элонгационный рибосомный комплекс
ускоренное развитие технологий высокопроиз
без последствий для клетки в целом; если таких
водительного скрининга [303], а также машин
событий больше (что наблюдается, например
ного обучения [304] и компьютерного модели
при недостатке аминокислот), то связывающие
рования в сочетании с современными методами
ся со столкнувшимися рибосомами белки
структурного анализа и химического синтеза
GCN1, GCN20 и MAP3K киназа ZAK активи
[84, 237-239] позволяет надеяться на быстрый
руют киназу GCN2, и та фосфорилирует eIF2
прогресс в разработке новых производных с усо
(см. выше); при резко возрастающем числе та
вершенствованными терапевтическими свой
ких событий (например, при обработке антибио
ствами. Будет набирать обороты и поиск новых
тиком или облучении ультрафиолетом) связав
ингибиторов методами системной биологии -
шаяся с рибосомами ZAK активирует сигналь
например, путём анализа клеточных транскрип
ный каскад JNK/p38MAPK, включая риботок
ционных паттернов, характеризующих воздей
сический стрессовый ответ [67, 294]. Действи
ствия новых или ранее известных веществ [39,
тельно, давно известно, что риботоксический
205]. Большие перспективы, на наш взгляд,
стресс можно частично подавить низкомолеку
имеет также разработка комбинированной тера
лярными ингибиторами DHP 2, сорафенибом и
пии с использованием ингибиторов разного ти
нилотинибом, мишенью которых является ZAK
па [164, 165]. Помимо прикладного использова
[297-299]. Это открытие, вероятно, поможет
ния, благодаря разнообразным принципам ра
также объяснить недавнее наблюдение, что ре
боты эти ингибиторы могут также широко при
акция клетки на ингибиторы АРСаз (см. выше)
меняться в фундаментальных исследованиях
принципиально отличается от изменений, вы
для изучения регуляции биосинтеза белка в раз
зываемых простым аминокислотным голодани
ных условиях [4, 16, 24, 82, 127, 134, 267, 305].
ем [252]: ведь доступность аминокислот «вычис
В данном обзоре мы попытались упомянуть
ляется» каскадом взаимодействий с участием
основные типы низкомолекулярных ингибито
киназы mTOR [300] и развивается по одному
ров эукариотической трансляции. Однако ко
сценарию (см. выше), в то время как ответ на де
личество известных на данный момент веществ
ацилированную тРНК и участившиеся столкно
с подобной активностью, даже если рассматри
вения рибосом использует другие сигнальные
вать лишь ингибиторы с хорошо охарактеризо
пути, включая активацию GCN2 и/или каскада
ванным механизмом действия, составляет нес
стрессовых MAPK киназ.
колько сотен, поэтому рассмотреть их все в
рамках одной статьи не представляется возмож
ным. Кроме того, этот список постоянно по
ЗАКЛЮЧЕНИЕ
полняется новыми веществами. Поэтому нами
была разработана обновляемая база данных
Биосинтез белка - один из главных метабо
низкомолекулярных ингибиторов биосинтеза
лических процессов, жизненно необходимый
белка - «EuPSIC» (от англ. Eukaryotic Protein
для поддержания всех функций организма. В
Synthesis Inhibiting Compounds»). В ней содер
активно пролиферирующих клетках на него рас
жатся дополнительные поля, облегчающие ма
ходуется существенная часть энергии, а наруше
шинную обработку данных, такие как номера
ние трансляции приводит к неизбежной оста
PubChem и ссылки на литературные источники
новке деления и клеточной смерти. Неудиви
в PubMed. База данных размещена по адресу
тельно, что биосинтез белка является «ахилле
совой пятой» опухолевых клеток и активно
размножающихся в клетке вирусов [136, 203,
259, 301, 302]. Разработка методов специфично
Финансирование. Работа выполнена при фи
го воздействия на биосинтез белка с помощью
нансовой поддержке Российского научного
низкомолекулярных ингибиторов имеет боль
фонда (грант № 18 14 00291).
шое значение для борьбы с раком, в иммуносуп
Благодарности. Авторы благодарят Максима
рессорной терапии, лечении наследственных,
Лашкевича за помощь в подготовке таблиц и ад
вирусных и грибковых заболеваний, в невроло
министрацию компьютерного сервера НИИ ФХБ
гии, паразитологии и гериатрии, в решении за
МГУ за помощь в размещении базы данных.
дач продления жизни, а также в сельском хозяй
Конфликт интересов. Авторы заявляют об от
стве, ветеринарии и других областях [8, 27, 132,
сутствии конфликта интересов.
148, 151, 155, 214, 259, 261, 301, 302]. Тем не ме
Соблюдение этических норм. Настоящая
нее в медицине их использование пока ограни
статья не содержит описания каких либо иссле
чено из за побочных эффектов, вызываемых
дований с участием людей или животных в каче
цитотоксичностью этих препаратов. Однако
стве объектов.
БИОХИМИЯ том 85 вып. 11 2020
1664
ДМИТРИЕВ и др.
СПИСОК ЛИТЕРАТУРЫ
1.
Pelletier, J., and Sonenberg, N. (2019) The organizing
18.
Fresno, M., Carrasco, L., and Vazquez, D.
(1976)
principles of eukaryotic ribosome recruitment, Annu. Rev.
Initiation of the polypeptide chain by reticulocyte cell free
Biochem., 88, 307 335, doi: 10.1146/annurev biochem
systems. Survey of different inhibitors of translation, Eur. J.
013118 111042.
Biochem., 68, 355 364, doi: 10.1111/j.1432 1033.1976.
2.
Yusupova, G., and Yusupov, M. (2014) High resolution
tb10822.x.
structure of the eukaryotic 80S ribosome, Annu. Rev.
19.
Cundliffe, E., Cannon, M., and Davies, J.
(1974)
Biochem., 83, 467 486, doi: 10.1146/annurev biochem
Mechanism of inhibition of eukaryotic protein synthesis by
060713 035445.
trichothecene fungal toxins, Proc. Natl. Acad. Sci. USA, 71,
3.
Weisser, M., and Ban, N. (2019) Extensions, extra factors,
30 34, doi: 10.1073/pnas.71.1.30.
and extreme complexity: ribosomal structures provide
20.
Pellegrino, S., Meyer, M., Zorbas, C., Bouchta, S. A.,
insights into eukaryotic translation, Cold Spring Harb.
Saraf, K., Pelly, S. C., Yusupova, G., Evidente, A.,
Perspect. Biol., 11, a032367, doi: 10.1101/cshperspect.
Mathieu, V., Kornienko, A., Lafontaine, D. L. J., and
a032367.
Yusupov, M. (2018) The amaryllidaceae alkaloid haeman
4.
Andreev, D. E., O’Connor, P. B., Loughran, G., Dmitriev,
thamine binds the eukaryotic ribosome to repress cancer
S. E., Baranov, P. V., and Shatsky, I. N. (2017) Insights into
cell growth, Structure, 26, 416 425 e414, doi: 10.1016/j.str.
the mechanisms of eukaryotic translation gained with ribo
2018.01.009.
some profiling, Nucleic acids Res.,
45,
513526,
21.
Baez, A., and Vazquez, D. (1978) Binding of [3H]narcicla
doi: 10.1093/nar/gkw1190.
sine to eukaryotic ribosomes. A study on a structure activ
5.
Hinnebusch, A. G. (2017) Structural insights into the
ity relationship, Biochim. Biophys. Acta, 518, 95 103,
mechanism of scanning and start codon recognition in
doi: 10.1016/0005 2787(78)90119 3.
eukaryotic translation initiation, Trends Biochem. Sci., 42,
22.
Jimenez, A., Santos, A., Alonso, G., and Vazquez, D.
589 611, doi: 10.1016/j.tibs.2017.03.004.
(1976) Inhibitors of protein synthesis in eukarytic cells.
6.
Schuller, A. P., and Green, R. (2018) Roadblocks and res
Comparative effects of some amaryllidaceae alkaloids,
olutions in eukaryotic translation, Nat. Rev. Mol. Cell Biol.,
Biochim. Biophys. Acta, 425, 342 348, doi: 10.1016/0005
19, 526 541, doi: 10.1038/s41580 018 0011 4.
2787(76)90261 6.
7.
Wilson, D. N. (2009) The A Z of bacterial translation
23.
Fresno, M., Jimenez, A., and Vazquez, D.
(1977)
inhibitors, Crit. Rev. Biochem. Mol. Biol., 44, 393 433,
Inhibition of translation in eukaryotic systems by harring
doi: 10.3109/10409230903307311.
tonine, Eur. J. Biochem., 72, 323 330, doi: 10.1111/j.1432
8.
Lin, J., Zhou, D., Steitz, T. A., Polikanov, Y. S., and
1033.1977.tb11256.x.
Gagnon, M. G. (2018) Ribosome targeting antibiotics:
24.
Ingolia, N. T., Lareau, L. F., and Weissman, J. S. (2011)
modes of action, mechanisms of resistance, and implica
Ribosome profiling of mouse embryonic stem cells reveals
tions for drug design, Annu. Rev. Biochem., 87, 451 478,
the complexity and dynamics of mammalian proteomes,
doi: 10.1146/annurev biochem 062917 011942.
Cell, 147, 789 802, doi: 10.1016/j.cell.2011.10.002.
9.
Yusupova, G., and Yusupov, M. (2017) Crystal structure of
25.
Tscherne, J. S., and Pestka, S. (1975) Inhibition of protein
eukaryotic ribosome and its complexes with inhibitors,
synthesis in intact HeLa cells, Antimicrob. Agents
Philos. Trans. R. Soc. London B Biol. Sci., 372, 20160184,
Chemother., 8, 479 487, doi: 10.1128/aac.8.4.479.
doi: 10.1098/rstb.2016.0184.
26.
Gurel, G., Blaha, G., Moore, P. B., and Steitz, T. A. (2009)
10.
Vazquez, D. (1979) Inhibitors of protein biosynthesis, Mol.
U2504 determines the species specificity of the A site cleft
Biol. Biochem. Biophys., 30, 1 312, doi: 10.1007/978 3
antibiotics: the structures of tiamulin, homoharringtonine,
642 81309 2.
and bruceantin bound to the ribosome, J. Mol. Biol., 389,
11.
Pestka, S. (1971) Inhibitors of ribosome functions, Annu.
146 156, doi: 10.1016/j.jmb.2009.04.005.
Rev. Microbiol., 25, 487 562, doi: 10.1146/annurev.mi.25.
27.
Winer, E. S., and DeAngelo, D. J. (2018) A review of
100171.002415.
omacetaxine: a chronic myeloid leukemia treatment resur
12.
Pestka, S. (1974) The use of inhibitors in studies on protein
rected, Oncol. Ther., 6, 9 20, doi: 10.1007/s40487 018
synthesis, Methods Enzymol., 30, 261 282, doi: 10.1016/
0058 6.
0076 6879(74)30030 4.
28.
Wang, Z., and Yang, L. (2020) Turning the tide: natural
13.
Jiménez, A., and Vázquez, D. (1983) Novel Inhibitors of
products and natural product inspired chemicals as poten
Translation in Eukaryotic Systems, in Modes and
tial counters to SARS CoV 2 infection, Front. Pharmacol.,
Mechanisms of Microbial Growth Inhibitors (Hahn, F. E.
11, 1013, doi: 10.3389/fphar.2020.01013.
ed.), Springer Berlin Heidelberg, Berlin, Heidelberg, pp.
29.
Huang, M. T. (1975) Harringtonine, an inhibitor of initia
248 254.
tion of protein biosynthesis, Mol. Pharmacol., 11, 511
14.
Garreau de Loubresse, N., Prokhorova, I., Holtkamp, W.,
519.
Rodnina, M. V., Yusupova, G., and Yusupov, M. (2014)
30.
Carter, C. J., and Cannon, M. (1977) Structural require
Structural basis for the inhibition of the eukaryotic ribo
ments for the inhibitory action of
12,13 epoxytri
some, Nature, 513, 517 522, doi: 10.1038/nature13737.
chothecenes on protein synthesis
in eukaryotes,
15.
Barbacid, M., and Vazquez, D. (1974) (3H)anisomycin
Biochem. J., 166, 399 409, doi: 10.1042/bj1660399.
binding to eukaryotic ribosomes, J. Mol. Biol., 84, 603 623,
31.
Cannon, M., Jimenez, A., and Vazquez, D.
(1976)
doi: 10.1016/0022 2836(74)90119 3.
Competition between trichodermin and several other
16.
Wu, C. C., Zinshteyn, B., Wehner, K. A., and Green, R.
sesquiterpene antibiotics for binding to their receptor
(2019) High resolution ribosome profiling defines discrete
site(s) on eukaryotic ribosomes, Biochem. J., 160, 137 145,
ribosome elongation states and translational regulation
doi: 10.1042/bj1600137.
during cellular stress, Mol. Cell, 73, 959970 e955,
32.
Ehrlich, K. C., and Daigle, K. W. (1987) Protein synthesis
doi: 10.1016/j.molcel.2018.12.009.
inhibition by 8 oxo 12,13 epoxytrichothecenes, Biochim.
17.
Barbacid, M., Fresno, M., and Vazquez, D.
(1975)
Biophys. Acta,
923,
206213, doi:
10.1016/0304
Inhibitors of polypeptide elongation on yeast polysomes,
4165(87)90005 5.
J. Antibiot. (Tokyo), 28, 453 462, doi: 10.7164/antibiotics.
33.
Carter, C. J., and Cannon, M. (1978) Inhibition of eukary
28.453.
otic ribosomal function by the sesquiterpenoid antibiotic
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1665
fusarenon X, Eur. J. Biochem., 84, 103 111, doi: 10.1111/
48.
Sikorski, M. M., Cerna, J., Rychlik, I., and Legocki, A. B.
j.1432 1033.1978.tb12146.x.
(1977) Peptidyl transferase activity in wheat germ ribo
34.
Schneider Poetsch, T., Ju, J., Eyler, D. E., Dang, Y., Bhat, S.,
somes. Effect of some antibiotics, Biochim. Biophys. Acta,
Merrick, W. C., Green, R., Shen, B., and Liu, J. O. (2010)
475, 123 130, doi: 10.1016/0005 2787(77)90346 x.
Inhibition of eukaryotic translation elongation by cyclo
49.
Leviev, I. G., Rodriguez Fonseca, C., Phan, H., Garrett,
heximide and lactimidomycin, Nat. Chem. Biol., 6, 209
R. A., Heilek, G., Noller, H. F., and Mankin, A. S. (1994)
217, doi: 10.1038/nchembio.304.
A conserved secondary structural motif in 23S rRNA
35.
Chan, J., Khan, S. N., Harvey, I., Merrick, W., and
defines the site of interaction of amicetin, a universal
Pelletier, J. (2004) Eukaryotic protein synthesis inhibitors
inhibitor of peptide bond formation, EMBO J., 13, 1682
identified by comparison of cytotoxicity profiles, RNA, 10,
1686.
528 543, doi: 10.1261/rna.5200204.
50.
Dmitriev, S. E., Akulich, K. A., Andreev, D. E., Terenin, I.
36.
McClary, B., Zinshteyn, B., Meyer, M., Jouanneau, M.,
M., and Shatsky, I. N. (2013) The peculiar mode of trans
Pellegrino, S., Yusupova, G., Schuller, A., Reyes, J. C. P.,
lation elongation inhibition by antitumor drug harring
Lu, J., Guo, Z., Ayinde, S., Luo, C., Dang, Y., Romo, D.,
tonin, FEBS J., 280, 51 51.
Yusupov, M., Green, R., and Liu, J. O. (2017) Inhibition of
51.
Akulich, K. A., Sinitcyn, P. G., Lomakin, I. B., Andreev,
eukaryotic translation by the antitumor natural product
D. E., Terenin, I. M., Smirnova, V. V., Mironov, A. A.,
agelastatin A, Cell Chem. Biol., 24, 605613 e605,
Shatsky, I. N., and Dmitriev, S. E. (2017) Peptidyl trans
doi: 10.1016/j.chembiol.2017.04.006.
ferase inhibitors arrest the ribosome at specific amino acid
37.
Cuendet, M., and Pezzuto, J. M. (2004) Antitumor activi
codons: insights from an integrated approach, FEBS J.,
ty of bruceantin: an old drug with new promise, J. Nat.
284, 296 296, doi: 10.1111/febs.14174.
Prod., 67, 269 272, doi: 10.1021/np030304+.
52.
Michel, A. M., Andreev, D. E., and Baranov, P. V. (2014)
38.
Fresno, M., Gonzales, A., Vazquez, D., and Jimenez, A.
Computational approach for calculating the probability of
(1978) Bruceantin, a novel inhibitor of peptide bond for
eukaryotic translation initiation from ribo seq data that
mation, Biochim. Biophys. Acta,
518,
104112,
takes into account leaky scanning, BMC Bioinform., 15,
doi: 10.1016/0005 2787(78)90120 x.
380, doi: 10.1186/s12859 014 0380 4.
39.
Zhang, L. L., Guo, J., Jiang, X. M., Chen, X. P., Wang, Y. T.,
53.
Marks, J., Kannan, K., Roncase, E. J., Klepacki, D., Kefi, A.,
Li, A., Lin, L. G., Li, H., and Lu, J. J. (2020) Identifica
Orelle, C., Vazquez Laslop, N., and Mankin, A. S. (2016)
tion of nagilactone E as a protein synthesis inhibitor with
Context specific inhibition of translation by ribosomal
anticancer activity, Acta pharmacol. Sin., 41, 698 705,
antibiotics targeting the peptidyl transferase center, Proc.
doi: 10.1038/s41401 019 0332 7.
Natl. Acad. Sci. USA, 113, 12150 12155, doi: 10.1073/
40.
Polikanov, Y. S., Starosta, A. L., Juette, M. F., Altman, R. B.,
pnas.1613055113.
Terry, D. S., Lu, W., Burnett, B. J., Dinos, G., Reynolds,
54.
Vazquez Laslop, N., and Mankin, A. S. (2018) Context
K. A., Blanchard, S. C., Steitz, T. A., and Wilson, D. N.
specific action of ribosomal antibiotics, Ann. Rev.
(2015) Distinct tRNA accommodation intermediates
Microbiol., 72, 185207, doi: 10.1146/annurev micro
observed on the ribosome with the antibiotics hygromycin
090817 062329.
A and A201A, Mol. Cell, 58, 832 844, doi: 10.1016/j.mol
55.
Kannan, K., Kanabar, P., Schryer, D., Florin, T., Oh, E.,
cel.2015.04.014.
Bahroos, N., Tenson, T., Weissman, J. S., and Mankin, A. S.
41.
Amunts, A., Fiedorczuk, K., Truong, T. T., Chandler, J.,
(2014) The general mode of translation inhibition by
Greenberg, E. P., and Ramakrishnan, V. (2015) Bactobolin
macrolide antibiotics, Proc. Natl. Acad. Sci. USA, 111,
A binds to a site on the 70S ribosome distinct from previ
15958 15963, doi: 10.1073/pnas.1417334111.
ously seen antibiotics, J. Mol. Biol., 427, 753755,
56.
Mankin, A. S. (2008) Macrolide myths, Curr. Opin.
doi: 10.1016/j.jmb.2014.12.018.
Microbiol., 11, 414421, doi: 10.1016/j.mib.2008.08.
42.
Hori, M., Suzukake, K., Ishikawa, C., Asakura, H., and
003.
Umezawa, H. (1981) Biochemical studies on bactobolin in
57.
Vazquez Laslop, N., Thum, C., and Mankin, A. S. (2008)
relation to actinobolin, J. Antibiot. (Tokyo), 34, 465 468,
Molecular mechanism of drug dependent ribosome
doi: 10.7164/antibiotics.34.465.
stalling, Mol. Cell, 30, 190202, doi: 10.1016/j.mol
43.
Cerna, J., Rychlik, I., and Lichtenthaler, F. W. (1973) The
cel.2008.02.026.
effect of the aminoacyl 4 aminohexosyl cytosine group of
58.
Tu, D., Blaha, G., Moore, P. B., and Steitz, T. A. (2005)
antibiotics on ribosomal peptidyl transferase, FEBS Lett.,
Structures of MLSBK antibiotics bound to mutated large
30, 147 150, doi: 10.1016/0014 5793(73)80639 8.
ribosomal subunits provide a structural explanation for
44.
Hansen, J. L., Moore, P. B., and Steitz, T. A. (2003)
resistance, Cell,
121,
257270, doi:
10.1016/j.cell.
Structures of five antibiotics bound at the peptidyl trans
2005.02.005.
ferase center of the large ribosomal subunit, J. Mol. Biol.,
59.
Hansen, J. L., Ippolito, J. A., Ban, N., Nissen, P., Moore, P. B.,
330, 1061 1075, doi: 10.1016/s0022 2836(03)00668 5.
and Steitz, T. A. (2002) The structures of four macrolide
45.
Svidritskiy, E., Ling, C., Ermolenko, D. N., and
antibiotics bound to the large ribosomal subunit, Mol. Cell,
Korostelev, A. A. (2013) Blasticidin S inhibits translation
10, 117 128, doi: 10.1016/s1097 2765(02)00570 1.
by trapping deformed tRNA on the ribosome, Proc. Natl.
60.
Gurel, G., Blaha, G., Steitz, T. A., and Moore, P. B. (2009)
Acad. Sci. USA, 110, 12283 12288, doi: 10.1073/pnas.
Structures of triacetyloleandomycin and mycalamide A
1304922110.
bind to the large ribosomal subunit of Haloarcula maris
46.
Lashkevich, K. A., Shlyk, V. I., Kushchenko, A. S.,
mortui, Antimicrob. Agents Chemother., 53, 5010 5014,
Gladyshev, V. N., Alkalaeva, E. Z., and Dmitriev, S. E.
doi: 10.1128/AAC.00817 09.
(2020) CTELS: a cell free system for the analysis of trans
61.
Nishimura, S., Matsunaga, S., Yoshida, M., Hirota, H.,
lation termination rate, Biomolecules,
10,
911,
Yokoyama, S., and Fusetani, N. (2005) 13 Deoxyteda
doi: 10.3390/biom10060911.
nolide, a marine sponge derived antitumor macrolide,
47.
Gonzalez, A., Vazquez, D., and Jimenez, A.
(1979)
binds to the 60S large ribosomal subunit, Bioorg. Med.
Inhibition of translation in bacterial and eukaryotic sys
Chem., 13, 449 454, doi: 10.1016/j.bmc.2004.10.012.
tems by the antibiotic anthelmycin (hikizimycin), Biochim.
62.
Lintner, N. G., McClure, K. F., Petersen, D., Londregan,
Biophys. Acta,
561,
403409, doi:
10.1016/0005
A. T., Piotrowski, D. W., Wei, L., Xiao, J., Bolt, M., Loria,
2787(79)90148 5.
P. M., Maguire, B., Geoghegan, K. F., Huang, A., Rolph, T.,
БИОХИМИЯ том 85 вып. 11 2020
1666
ДМИТРИЕВ и др.
Liras, S., Doudna, J. A., Dullea, R. G., and Cate, J. H.
ribosomal pretranslocation complex, Mol. Cell, 44, 214
(2017) Selective stalling of human translation through
224, doi: 10.1016/j.molcel.2011.07.040.
small molecule engagement of the ribosome nascent
75.
Myasnikov, A. G., Kundhavai Natchiar, S., Nebout, M.,
chain, PLoS Biol., 15, e2001882, doi: 10.1371/journal.
Hazemann, I., Imbert, V., Khatter, H., Peyron, J. F., and
pbio.2001882.
Klaholz, B. P. (2016) Structure function insights reveal the
63.
Liaud, N., Horlbeck, M. A., Gilbert, L. A., Gjoni, K.,
human ribosome as a cancer target for antibiotics, Nat.
Weissman, J. S., and Cate, J. H. D. (2019) Cellular
Commun., 7, 12856, doi: 10.1038/ncomms12856.
response to small molecules that selectively stall protein
76.
Pestova, T. V., and Hellen, C. U. (2003) Translation elon
synthesis by the ribosome, PLoS Genet., 15, e1008057,
gation after assembly of ribosomes on the Cricket paralysis
doi: 10.1371/journal.pgen.1008057.
virus internal ribosomal entry site without initiation factors
64.
Li, W., Ward, F. R., McClure, K. F., Chang, S. T.,
or initiator tRNA, Gen. Dev.,
17,
181186,
Montabana, E., Liras, S., Dullea, R. G., and Cate, J. H. D.
doi: 10.1101/gad.1040803.
(2019) Structural basis for selective stalling of human ribo
77.
Iwasaki, S., and Ingolia, N. T. (2017) The growing toolbox
some nascent chain complexes by a drug like molecule,
for protein synthesis studies, Trends Biochem. Sci., 42, 612
Nat. Struct. Mol. Biol., 26, 501 509, doi: 10.1038/s41594
624, doi: 10.1016/j.tibs.2017.05.004.
019 0236 8.
78.
Park, Y., Koga, Y., Su, C., Waterbury, A. L., Johnny, C. L.,
65.
Osterman, I. A., Wieland, M., Maviza, T. P., Lashkevich,
and Liau, B. B. (2019) Versatile synthetic route to cyclo
K. A., Lukianov, D. A., Komarova, E. S., Zakalyukina, Y.
heximide and analogues that potently inhibit translation
V., Buschauer, R., Shiriaev, D. I., Leyn, S. A., Zlamal, J. E.,
elongation, Angew. Chem. Int. Ed. Engl., 58, 5387 5391,
Biryukov, M. V., Skvortsov, D. A., Tashlitsky, V. N.,
doi: 10.1002/anie.201901386.
Polshakov, V. I., Cheng, J., Polikanov, Y. S., Bogdanov, A. A.,
79.
Landsman, D., Srikantha, T., and Bustin, M. (1988) Single
Osterman, A. L., Dmitriev, S. E., Beckmann, R.,
copy gene for the chicken non histone chromosomal pro
Dontsova, O. A., Wilson, D. N., and Sergiev, P. V. (2020)
tein HMG 17, J. Biol. Chem., 263, 3917 3923.
Tetracenomycin X inhibits translation by binding within
80.
Zhang, D., Yi, W., Ge, H., Zhang, Z., and Wu, B. (2019)
the ribosomal exit tunnel, Nat. Chem. Biol., 16, 1071 1077,
Bioactive streptoglutarimides A J from the marine derived
doi: 10.1038/s41589 020 0578 x.
Streptomyces sp. ZZ741, J. Nat. Prod., 82, 2800 2808,
66.
Mortison, J. D., Schenone, M., Myers, J. A., Zhang, Z.,
doi: 10.1021/acs.jnatprod.9b00481.
Chen, L., Ciarlo, C., Comer, E., Natchiar, S. K., Carr, S. A.,
81.
Sugawara, K., Nishiyama, Y., Toda, S., Komiyama, N.,
Klaholz, B. P., and Myers, A. G. (2018) Tetracyclines mod
Hatori, M., Moriyama, T., Sawada, Y., Kamei, H.,
ify translation by targeting key human rRNA substructures,
Konishi, M., and Oki, T. (1992) Lactimidomycin, a new
Cell Chem. Biol., 25, 1506 1518 e1513, doi: 10.1016/
glutarimide group antibiotic. Production, isolation, struc
j.chembiol.2018.09.010.
ture and biological activity, J. Antibiot. (Tokyo), 45, 1433
67.
Wu, C. C., Peterson, A., Zinshteyn, B., Regot, S., and
1441, doi: 10.7164/antibiotics.45.1433.
Green, R. (2020) Ribosome collisions trigger general stress
82.
Lee, S., Liu, B., Lee, S., Huang, S. X., Shen, B., and Qian,
responses to regulate cell fate, Cell, 182, 404 416 e414,
S. B. (2012) Global mapping of translation initiation sites
doi: 10.1016/j.cell.2020.06.006.
in mammalian cells at single nucleotide resolution, Proc.
68.
Jenner, L., Starosta, A. L., Terry, D. S., Mikolajka, A.,
Natl. Acad. Sci. USA, 109, E2424 2432, doi: 10.1073/
Filonava, L., Yusupov, M., Blanchard, S. C., Wilson, D. N.,
pnas.1207846109.
and Yusupova, G. (2013) Structural basis for potent
83.
Pellegrino, S., Meyer, M., Konst, Z. A., Holm, M., Voora,
inhibitory activity of the antibiotic tigecycline during pro
V. K., Kashinskaya, D., Zanette, C., Mobley, D. L.,
tein synthesis, Proc. Natl. Acad. Sci. USA, 110, 3812 3816,
Yusupova, G., Vanderwal, C. D., Blanchard, S. C., and
doi: 10.1073/pnas.1216691110.
Yusupov, M. (2019) Understanding the role of intermolec
69.
Solis, G. M., Kardakaris, R., Valentine, E. R., Bar Peled, L.,
ular interactions between lissoclimides and the eukaryotic
Chen, A. L., Blewett, M. M., McCormick, M. A.,
ribosome, Nucleic Acids Res.,
47,
32233232,
Williamson, J. R., Kennedy, B., Cravatt, B. F., and
doi: 10.1093/nar/gkz053.
Petrascheck, M.
(2018) Translation attenuation by
84.
Konst, Z. A., Szklarski, A. R., Pellegrino, S., Michalak, S. E.,
minocycline enhances longevity and proteostasis in old
Meyer, M., Zanette, C., Cencic, R., Nam, S., Voora, V. K.,
post stress responsive organisms, eLife, 7, doi: 10.7554/
Horne, D. A., Pelletier, J., Mobley, D. L., Yusupova, G.,
eLife.40314.
Yusupov, M., and Vanderwal, C. D. (2017) Synthesis facil
70.
Garrido Mesa, N., Zarzuelo, A., and Galvez, J. (2013)
itates an understanding of the structural basis for transla
Minocycline: far beyond an antibiotic, Br. J. Pharmacol.,
tion inhibition by the lissoclimides, Nat. Chem., 9, 1140
169, 337 352, doi: 10.1111/bph.12139.
1149, doi: 10.1038/nchem.2800.
71.
Obrig, T. G., Culp, W. J., McKeehan, W. L., and Hardesty, B.
85.
Robert, F., Gao, H. Q., Donia, M., Merrick, W. C.,
(1971) The mechanism by which cycloheximide and relat
Hamann, M. T., and Pelletier, J. (2006) Chlorolis
ed glutarimide antibiotics inhibit peptide synthesis on
soclimides: new inhibitors of eukaryotic protein synthesis,
reticulocyte ribosomes, J. Biol. Chem., 246, 174 181.
RNA, 12, 717 725, doi: 10.1261/rna.2346806.
72.
Klinge, S., Voigts Hoffmann, F., Leibundgut, M.,
86.
Lee, K. H., Nishimura, S., Matsunaga, S., Fusetani, N.,
Arpagaus, S., and Ban, N. (2011) Crystal structure of the
Horinouchi, S., and Yoshida, M. (2005) Inhibition of pro
eukaryotic 60S ribosomal subunit in complex with initia
tein synthesis and activation of stress activated protein
tion factor 6, Science, 334, 941 948, doi: 10.1126/science.
kinases by onnamide A and theopederin B, antitumor
1211204.
marine natural products, Cancer Sci., 96, 357364,
73.
Dmitriev, S. E., Pisarev, A. V., Rubtsova, M. P., Dunaevsky,
doi: 10.1111/j.1349 7006.2005.00055.x.
Y. E., and Shatsky, I. N. (2003) Conversion of 48S transla
87.
Brega, A., Falaschi, A., De Carli, L., and Pavan, M. (1968)
tion preinitiation complexes into 80S initiation complexes
Studies on the mechanism of action of pederine, J. Cell
as revealed by toeprinting, FEBS Lett., 533, 99 104,
Biol., 36, 485 496, doi: 10.1083/jcb.36.3.485.
doi: 10.1016/s0014 5793(02)03776 6.
88.
Jacobs Lorena, M., Brega, A., and Baglioni, C. (1971) Inhi
74.
Budkevich, T., Giesebrecht, J., Altman, R. B., Munro, J. B.,
bition of protein synthesis in reticulocytes by antibiotics. V.
Mielke, T., Nierhaus, K. H., Blanchard, S. C., and Spahn,
Mechanism of action of pederine, an inhibitor of initiation
C. M. (2011) Structure and dynamics of the mammalian
and elongation, Biochim. Biophys. Acta, 240, 263 272.
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1667
89. Schroeder, S. J., Blaha, G., Tirado Rives, J., Steitz, T. A.,
stabilizing mRNA interaction with the ribosome, Mol. Cell,
and Moore, P. B. (2007) The structures of antibiotics
56, 531 540, doi: 10.1016/j.molcel.2014.09.020.
bound to the E site region of the 50 S ribosomal subunit of
103. Brodersen, D. E., Clemons, W. M., Jr., Carter, A. P.,
Haloarcula marismortui: 13 deoxytedanolide and giroda
Morgan Warren, R. J., Wimberly, B. T., and
zole, J. Mol. Biol., 367, 1471 1479, doi: 10.1016/j.jmb.
Ramakrishnan, V. (2000) The structural basis for the action
2007.01.081.
of the antibiotics tetracycline, pactamycin, and
90. Taylor, R. E. (2008) Tedanolide and the evolution of
hygromycin B on the 30S ribosomal subunit, Cell, 103,
polyketide inhibitors of eukaryotic protein synthesis, Nat.
1143 1154, doi: 10.1016/s0092 8674(00)00216 6.
Prod. Rep., 25, 854 861, doi: 10.1039/b805700c.
104. Dinos, G., Wilson, D. N., Teraoka, Y., Szaflarski, W.,
91. Hines, J., Roy, M., Cheng, H., Agapakis, C. M., Taylor, R.,
Fucini, P., Kalpaxis, D., and Nierhaus, K. H. (2004)
and Crews, C. M. (2006) Myriaporone 3/4 structure—
Dissecting the ribosomal inhibition mechanisms of edeine
activity relationship studies define a pharmacophore tar
and pactamycin: the universally conserved residues G693
geting eukaryotic protein synthesis, Mol. Biosyst., 2, 371
and C795 regulate P site RNA binding, Mol. Cell, 13, 113
379, doi: 10.1039/b602936a.
124, doi: 10.1016/s1097 2765(04)00002 4.
92. Muthukumar, Y., Roy, M., Raja, A., Taylor, R. E., and
105. Borovinskaya, M. A., Shoji, S., Fredrick, K., and Cate, J. H.
Sasse, F. (2013) The marine polyketide myriaporone 3/4
(2008) Structural basis for hygromycin B inhibition of pro
stalls translation by targeting the elongation phase,
tein biosynthesis, RNA, 14, 1590 1599, doi: 10.1261/
Chembiochem, 14, 260 264, doi: 10.1002/cbic.201200522.
rna.1076908.
93. Prokhorova, I. V., Akulich, K. A., Makeeva, D. S.,
106. Gonzalez, A., Jimenez, A., Vazquez, D., Davies, J. E., and
Osterman, I. A., Skvortsov, D. A., Sergiev, P. V., Dontsova,
Schindler, D. (1978) Studies on the mode of action of
O. A., Yusupova, G., Yusupov, M. M., and Dmitriev, S. E.
hygromycin B, an inhibitor of translocation in eukaryotes,
(2016) Amicoumacin A induces cancer cell death by tar
Biochim. Biophys. Acta, 521, 459 469, doi: 10.1016/0005
geting the eukaryotic ribosome, Sci. Rep., 6, 27720,
2787(78)90287 3.
doi: 10.1038/srep27720.
107. Misumi, M., Nishimura, T., Komai, T., and Tanaka, N.
94. Wong, W., Bai, X. C., Brown, A., Fernandez, I. S.,
(1978) Interaction of kanamycin and related antibiotics
Hanssen, E., Condron, M., Tan, Y. H., Baum, J., and
with the large subunit of ribosomes and the inhibition of
Scheres, S. H.
(2014) Cryo EM structure of the
translocation, Biochem. Biophys. Res. Commun., 84, 358
Plasmodium falciparum 80S ribosome bound to the anti
365, doi: 10.1016/0006 291x(78)90178 x.
protozoan drug emetine, eLife,
3, doi:
10.7554/
108. Cabanas, M. J., Vazquez, D., and Modolell, J. (1978)
eLife.03080.
Inhibition of ribosomal translocation by aminoglycoside
95. Chang, S., and Wasmuth, J. J. (1983) Construction and
antibiotics, Biochem. Biophys. Res. Commun., 83, 991 997,
characterization of Chinese hamster cell EmtA EmtB dou
doi: 10.1016/0006 291x(78)91493 6.
ble mutants, Mol. Cell. Biol.,
3,
761772,
109. Borovinskaya, M. A., Pai, R. D., Zhang, W., Schuwirth, B. S.,
doi: 10.1128/mcb.3.5.761.
Holton, J. M., Hirokawa, G., Kaji, H., Kaji, A., and Cate,
96. Grant, P., Sanchez, L., and Jimenez, A.
(1974)
J. H. (2007) Structural basis for aminoglycoside inhibition
Cryptopleurine resistance: genetic locus for a 40S riboso
of bacterial ribosome recycling, Nat. Struct. Mol. Biol., 14,
mal component in Saccharomyces cerevisiae, J. Bacteriol.,
727 732, doi: 10.1038/nsmb1271.
120, 1308 1314, doi: 10.1128/JB.120.3.1308 1314.1974.
110. Prokhorova, I., Altman, R. B., Djumagulov, M., Shrestha,
97. Gupta, R. S., and Siminovitch, L. (1977) Mutants of CHO
J. P., Urzhumtsev, A., Ferguson, A., Chang, C. T., Yusupov, M.,
cells resistant to the protein synthesis inhibitors, crypto
Blanchard, S. C., and Yusupova, G. (2017) Aminoglyco
pleurine and tylocrebrine: genetic and biochemical evi
side interactions and impacts on the eukaryotic ribosome,
dence for common site of action of emetine, crypto
Proc. Natl. Acad. Sci. USA,
114, E10899 E10908,
pleurine, tylocrebine, and tubulosine, Biochemistry, 16,
doi: 10.1073/pnas.1715501114.
3209 3214, doi: 10.1021/bi00633a026.
111.
Krause, K. M., Serio, A. W., Kane, T. R., and Connolly, L. E.
98. Bucher, K., and Skogerson, L. (1976) Cryptopleurine—an
(2016) Aminoglycosides: an overview, Cold Spring Harb.
inhibitor of translocation, Biochemistry, 15, 4755 4759,
Perspect. Med., 6, doi: 10.1101/cshperspect.a027029.
doi: 10.1021/bi00667a001.
112. Wilhelm, J. M., Pettitt, S. E., and Jessop, J. J. (1978)
99. Carrasco, L., Jimenez, A., and Vazquez, D. (1976) Specific
Aminoglycoside antibiotics and eukaryotic protein synthe
inhibition of translocation by tubulosine in eukaryotic
sis: structure—function relationships in the stimulation of
polysomes, Eur. J. Biochem., 64, 1 5, doi: 10.1111/j.1432
misreading with a wheat embryo system, Biochemistry, 17,
1033.1976.tb10268.x.
1143 1149, doi: 10.1021/bi00600a001.
100. Wang, Y., Wong, H. C., Gullen, E. A., Lam, W., Yang, X.,
113. Howard, M., Frizzell, R. A., and Bedwell, D. M. (1996)
Shi, Q., Lee, K. H., and Cheng, Y. C.
(2012)
Aminoglycoside antibiotics restore CFTR function by
Cryptopleurine analogs with modification of e ring exhibit
overcoming premature stop mutations, Nat. Med., 2, 467
different mechanism to rac cryptopleurine and
469, doi: 10.1038/nm0496 467.
tylophorine, PloS One, 7, e51138, doi: 10.1371/journal.
114. Kandasamy, J., Atia Glikin, D., Shulman, E., Shapira, K.,
pone.0051138.
Shavit, M., Belakhov, V., and Baasov, T. (2012) Increased
101. Donaldson, G. R., Atkinson, M. R., and Murray, A. W.
selectivity toward cytoplasmic versus mitochondrial ribo
(1968) Inhibition of protein synthesis in Ehrlich ascites
some confers improved efficiency of synthetic aminoglyco
tumour cells by the phenanthrene alkaloids tylophorine,
sides in fixing damaged genes: a strategy for treatment of
tylocrebrine and cryptopleurine, Biochem. Biophys. Res.
genetic diseases caused by nonsense mutations, J. Med.
Commun., 31, 104 109, doi: 10.1016/0006 291x(68)90037
Chem., 55, 10630 10643, doi: 10.1021/jm3012992.
5.
115. Wangen, J. R., and Green, R. (2020) Stop codon context
102. Polikanov, Y. S., Osterman, I. A., Szal, T., Tashlitsky, V. N.,
influences genome wide stimulation of termination codon
Serebryakova, M. V., Kusochek, P., Bulkley, D.,
readthrough by aminoglycosides, eLife, 9, doi: 10.7554/
Malanicheva, I. A., Efimenko, T. A., Efremenkova, O. V.,
eLife.52611.
Konevega, A. L., Shaw, K. J., Bogdanov, A. A., Rodnina,
116. Kuang, L., Hashimoto, K., Huang, E. J., Gentry, M. S.,
M. V., Dontsova, O. A., Mankin, A. S., Steitz, T. A., and
and Zhu, H. (2020) Frontotemporal dementia non
Sergiev, P. V. (2014) Amicoumacin a inhibits translation by
sense mutation of progranulin rescued by aminoglycosides,
БИОХИМИЯ том 85 вып. 11 2020
1668
ДМИТРИЕВ и др.
Hum. Mol. Genet., 29, 624634, doi: 10.1093/hmg/
131. Shi, W. W., Mak, A. N., Wong, K. B., and Shaw, P. C.
ddz280.
(2016) Structures and ribosomal interaction of ribosome
117. Sabbavarapu, N. M., Shavit, M., Degani, Y., Smolkin, B.,
inactivating
proteins,
Molecules,
21,
1588,
Belakhov, V., and Baasov, T. (2016) Design of novel amino
doi: 10.3390/molecules21111588.
glycoside derivatives with enhanced suppression of dis
132. Olombrada, M., Lazaro Gorines, R., Lopez Rodriguez, J. C.,
eases causing nonsense mutations, ACS Med. Chem. Lett.,
Martinez Del Pozo, A., Onaderra, M., Maestro Lopez,
7, 418 423, doi: 10.1021/acsmedchemlett.6b00006.
M., Lacadena, J., Gavilanes, J. G., and Garcia Ortega, L.
118. Shalev, M., and Baasov, T. (2014) When proteins start to
(2017) Fungal ribotoxins: a review of potential biotechno
make sense: fine tuning aminoglycosides for PTC suppres
logical applications, Toxins,
9,
71, doi:
10.3390/
sion therapy, Medchemcomm., 5, 1092 1105, doi: 10.1039/
toxins9020071.
C4MD00081A.
133. Kozak, M., and Shatkin, A. J. (1978) Migration of 40 S
119. Bidou, L., Bugaud, O., Belakhov, V., Baasov, T., and Namy, O.
ribosomal subunits on messenger RNA in the presence of
(2017) Characterization of new generation aminoglyco
edeine, J. Biol. Chem., 253, 6568 6577.
side promoting premature termination codon readthrough
134. Vassilenko, K. S., Alekhina, O. M., Dmitriev, S. E.,
in cancer cells, RNA Biol., 14, 378 388, doi: 10.1080/
Shatsky, I. N., and Spirin, A. S. (2011) Unidirectional con
15476286.2017.1285480.
stant rate motion of the ribosomal scanning particle during
120. Mattis, V. B., Rai, R., Wang, J., Chang, C. W., Coady, T.,
eukaryotic translation initiation, Nucleic Acids Res., 39,
and Lorson, C. L. (2006) Novel aminoglycosides increase
5555 5567, doi: 10.1093/nar/gkr147.
SMN levels in spinal muscular atrophy fibroblasts, Hum.
135. Kozak, M. (2007) Some thoughts about translational regu
Genet., 120, 589 601, doi: 10.1007/s00439 006 0245 7.
lation: forward and backward glances, J. Cell. Biochem.,
121. Baradaran Heravi, A., Niesser, J., Balgi, A. D., Choi, K.,
102, 280 290, doi: 10.1002/jcb.21464.
Zimmerman, C., South, A. P., Anderson, H. J., Strynadka,
136. Contreras, A., and Carrasco, L. (1979) Selective inhibition
N. C., Bally, M. B., and Roberge, M. (2017) Gentamicin
of protein synthesis in virus infected mammalian cells,
B1 is a minor gentamicin component with major nonsense
J. Virol., 29, 114 122, doi: 10.1128/JVI.29.1.114 122.
mutation suppression activity, Proc. Natl. Acad. Sci. USA,
1979.
114, 3479 3484, doi: 10.1073/pnas.1620982114.
137. Baxter, R., Knell, V. C., Somerville, H. J., Swain, H. M.,
122. Fan Minogue, H., and Bedwell, D. M. (2008) Eukaryotic
and Weeks, D. P. (1973) Effect of MDMP on protein syn
ribosomal RNA determinants of aminoglycoside resistance
thesis in wheat and bacteria, Nat. New Biol., 243, 139 142,
and their role in translational fidelity, RNA, 14, 148 157,
doi: 10.1038/newbio243139a0.
doi: 10.1261/rna.805208.
138. Mokas, S., Mills, J. R., Garreau, C., Fournier, M. J.,
123. Recht, M. I., Douthwaite, S., and Puglisi, J. D. (1999)
Robert, F., Arya, P., Kaufman, R. J., Pelletier, J., and
Basis for prokaryotic specificity of action of aminoglyco
Mazroui, R. (2009) Uncoupling stress granule assembly
side antibiotics, EMBO J., 18, 3133 3138, doi: 10.1093/
and translation initiation inhibition, Mol. Biol. Cell, 20,
emboj/18.11.3133.
2673 2683, doi: 10.1091/mbc.E08 10 1061.
124. Wargo, K. A., and Edwards, J. D. (2014) Aminoglycoside
139. Weeks, D. P., and Baxter, R. (1972) Specific inhibition of
induced nephrotoxicity, J. Pharm. Pract., 27, 573 577,
peptide chain initiation by 2 (4 methyl 2,6 dinitroanili
doi: 10.1177/0897190014546836.
no) N methylpropionamide, Biochemistry, 11, 3060 3064,
125. Nguyen, T., and Jeyakumar, A. (2019) Genetic susceptibil
doi: 10.1021/bi00766a018.
ity to aminoglycoside ototoxicity, Int. J. Pediatr.
140. Baxter, R., and McGowan, J. E. (1976) MDMP action:
Otorhinolaryngol., 120, 15 19, doi: 10.1016/j.ijporl.2019.
degradative effects on polyribosomes from wheat roots and
02.002.
the inhibition of protein initiation, J. Exp. Bot., 27, 525
126. Aviner, R. (2020) The science of puromycin: from studies
531, doi: 10.1093/jxb/27.3.525.
of ribosome function to applications in biotechnology,
141. Gritz, L. R., Mitlin, J. A., Cannon, M., Littlewood, B.,
Comput. Struct. Biotechnol. J.,
18,
10741083,
Carter, C. J., and Davies, J. E. (1982) Ribosome structure,
doi: 10.1016/j.csbj.2020.04.014.
maturation of ribosomal RNA and drug sensitivity in tem
127. Fritsch, C., Herrmann, A., Nothnagel, M., Szafranski, K.,
perature sensitive mutants of Saccharomyces cerevisiae,
Huse, K., Schumann, F., Schreiber, S., Platzer, M.,
Mol. Gen. Genet., 188, 384 391, doi: 10.1007/BF00330038.
Krawczak, M., Hampe, J., and Brosch, M.
(2012)
142. Pesce, E., Miluzio, A., Turcano, L., Minici, C., Cirino, D.,
Genome wide search for novel human uORFs and
Calamita, P., Manfrini, N., Oliveto, S., Ricciardi, S.,
N terminal protein extensions using ribosomal footprint
Grifantini, R., Degano, M., Bresciani, A., and Biffo, S.
ing, Genome Res., 22, 2208 2218, doi: 10.1101/gr.139568.
(2020) Discovery and preliminary characterization of
112.
translational modulators that impair the binding of eIF6 to
128. Hobson, B. D., Kong, L., Hartwick, E. W., Gonzalez Jr.,
60S ribosomal subunits, Cells,
9, doi:
10.3390/
R. L., and Sims, P. A., (2020) Elongation inhibitors do not
cells9010172.
prevent the release of puromycylated nascent polypeptide
143. Brina, D., Miluzio, A., Ricciardi, S., and Biffo, S. (2015)
chains from ribosomes, Elife, 9, e60048, doi: 10.7554/
eIF6 anti association activity is required for ribosome bio
eLife.60048.
genesis, translational control and tumor progression,
129. Enam, S. U., Zinshteyn, B., Goldman, D. H., Cassani,
Biochim. Biophys. Acta, 1849, 830 835, doi: 10.1016/j.bbagrm.
M., Livingston, N. M., Seydoux, G., and Green, R. (2020)
2014.09.010.
Puromycin reactivity does not accurately localize transla
144. Florin, T., Maracci, C., Graf, M., Karki, P., Klepacki, D.,
tion at the subcellular level, Elife, 9, e60303, doi: 10.7554/
Berninghausen, O., Beckmann, R., Vazquez Laslop, N.,
eLife.60303.
Wilson, D. N., Rodnina, M. V., and Mankin, A. S. (2017)
130. Wong, W., Bai, X. C., Sleebs, B. E., Triglia, T., Brown, A.,
An antimicrobial peptide that inhibits translation by trap
Thompson, J. K., Jackson, K. E., Hanssen, E., Marapana,
ping release factors on the ribosome, Nat. Struct. Mol. Biol.,
D. S., Fernandez, I. S., Ralph, S. A., Cowman, A. F.,
24, 752 757, doi: 10.1038/nsmb.3439.
Scheres, S. H. W., and Baum, J. (2017) Mefloquine targets
145. Colson, G., Rabault, B., Lavelle, F., and Zerial, A. (1992)
the Plasmodium falciparum 80S ribosome to inhibit protein
Mode of action of the antitumor compound girodazole
synthesis, Nat. Microbiol., 2, 17031, doi: 10.1038/nmicrobiol.
(RP 49532A, NSC 627434), Biochem. Pharmacol., 43,
2017.31.
1717 1723, doi: 10.1016/0006 2952(92)90701 j.
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1669
146. Lavelle, F., Zerial, A., Fizames, C., Rabault, B., and
Natl. Acad. Sci. USA, 106, 3585 3590, doi: 10.1073/pnas.
Curaudeau, A. (1991) Antitumor activity and mechanism
0813345106.
of action of the marine compound girodazole, Invest. New
160. Altamura, E., Borgatti, M., Finotti, A., Gasparello, J.,
Drugs, 9, 233 244, doi: 10.1007/bf00176976.
Gambari, R., Spinelli, M., Castaldo, R., and Altamura, N.
147. Catimel, G., Coquard, R., Guastalla, J. P., Merrouche, Y.,
(2016) Chemical induced read through at premature ter
Le Bail, N., Alakl, M. K., Dumortier, A., Foy, M., and
mination codons determined by a rapid dual fluorescence
Clavel, M. (1995) Phase I study of RP 49532A, a new pro
system based on S. cerevisiae, PloS One, 11, e0154260,
tein synthesis inhibitor, in patients with advanced refracto
doi: 10.1371/journal.pone.0154260.
ry solid tumors, Cancer chemother. Pharmacol., 35, 246
161. Hamada, K., Omura, N., Taguchi, A., Baradaran Heravi, A.,
248, doi: 10.1007/BF00686555.
Kotake, M., Arai, M., Takayama, K., Taniguchi, A.,
148. Bordeira Carrico, R., Pego, A. P., Santos, M., and
Roberge, M., and Hayashi, Y. (2019) New negamycin
Oliveira, C. (2012) Cancer syndromes and therapy by stop
based potent readthrough derivative effective against TGA
codon readthrough, Trends Mol. Med., 18, 667678,
type nonsense mutations, ACS Med. Chem. Lett., 10, 1450
doi: 10.1016/j.molmed.2012.09.004.
1456, doi: 10.1021/acsmedchemlett.9b00273.
149. Mort, M., Ivanov, D., Cooper, D. N., and Chuzhanova, N. A.
162. Arakawa, M., Shiozuka, M., Nakayama, Y., Hara, T.,
(2008) A meta analysis of nonsense mutations causing
Hamada, M., Kondo, S., Ikeda, D., Takahashi, Y., Sawa, R.,
human genetic disease, Hum. Mut., 29, 10371047,
Nonomura, Y., Sheykholeslami, K., Kondo, K., Kaga, K.,
doi: 10.1002/humu.20763.
Kitamura, T., Suzuki Miyagoe, Y., Takeda, S., and
150. Keeling, K. M., Xue, X., Gunn, G., and Bedwell, D. M.
Matsuda, R. (2003) Negamycin restores dystrophin
(2014) Therapeutics based on stop codon readthrough,
expression in skeletal and cardiac muscles of mdx mice,
Annu. Rev. Genomics Hum. Genet.,
15,
371394,
J. Biochem., 134, 751 758, doi: 10.1093/jb/mvg203.
doi: 10.1146/annurev genom 091212 153527.
163. Olivier, N. B., Altman, R. B., Noeske, J., Basarab, G. S.,
151. Lee, H. L., and Dougherty, J. P. (2012) Pharmaceutical
Code, E., Ferguson, A. D., Gao, N., Huang, J., Juette, M. F.,
therapies to recode nonsense mutations in inherited dis
Livchak, S., Miller, M. D., Prince, D. B., Cate, J. H.,
eases, Pharmacol. Ther., 136, 227 266, doi: 10.1016/
Buurman, E. T., and Blanchard, S. C. (2014) Negamycin
j.pharmthera.2012.07.007.
induces translational stalling and miscoding by binding to
152. Ng, M. Y., Zhang, H., Weil, A., Singh, V., Jamiolkowski, R.,
the small subunit head domain of the Escherichia coli ribo
Baradaran Heravi, A., Roberge, M., Jacobson, A.,
some, Proc. Natl. Acad. Sci. USA, 111, 16274 16279,
Friesen, W., Welch, E., Goldman, Y. E., and Cooperman,
doi: 10.1073/pnas.1414401111.
B. S. (2018) New in vitro assay measuring direct interaction
164. Ferguson, M. W., Gerak, C. A. N., Chow, C. C. T.,
of nonsense suppressors with the eukaryotic protein syn
Rastelli, E. J., Elmore, K. E., Stahl, F., Hosseini
thesis machinery, ACS Med. Chem. Lett., 9, 1285 1291,
Farahabadi, S., Baradaran Heravi, A., Coltart, D. M., and
doi: 10.1021/acsmedchemlett.8b00472.
Roberge, M. (2019) The antimalarial drug mefloquine
153. Floquet, C., Rousset, J. P., and Bidou, L.
(2011)
enhances TP53 premature termination codon readthrough
Readthrough of premature termination codons in the ade
by aminoglycoside G418, PloS One, 14, e0216423,
nomatous polyposis coli gene restores its biological activity
doi: 10.1371/journal.pone.0216423.
in human cancer cells, PloS One, 6, e24125, doi: 10.1371/
165. Baradaran Heravi, A., Balgi, A. D., Zimmerman, C.,
journal.pone.0024125.
Choi, K., Shidmoossavee, F. S., Tan, J. S., Bergeaud, C.,
154. Prayle, A., and Smyth, A. R. (2010) Aminoglycoside use in
Krause, A., Flibotte, S., Shimizu, Y., Anderson, H. J.,
cystic fibrosis: therapeutic strategies and toxicity, Curr.
Mouly, V., Jan, E., Pfeifer, T., Jaquith, J. B., and Roberge, M.
Opin. Pulm. Med., 16, 604610, doi: 10.1097/MCP.
(2016) Novel small molecules potentiate premature termi
0b013e32833eebfd.
nation codon readthrough by aminoglycosides, Nucleic
155. Zingman, L. V., Park, S., Olson, T. M., Alekseev, A. E., and
Acids Res., 44, 6583 6598, doi: 10.1093/nar/gkw638.
Terzic, A. (2007) Aminoglycoside induced translational
166. Nurenberg Goloub, E., and Tampe, R. (2019) Ribosome
read through in disease: overcoming nonsense mutations
recycling in mRNA translation, quality control, and homeo
by pharmacogenetic therapy, Clin. Pharmacol. Ther., 81,
stasis, Biol. Chem., 401, 47 61, doi: 10.1515/hsz 2019
99 103, doi: 10.1038/sj.clpt.6100012.
0279.
156. Lentini, L., Melfi, R., Di Leonardo, A., Spinello, A.,
167. Buskirk, A. R., and Green, R. (2017) Ribosome pausing,
Barone, G., Pace, A., Palumbo Piccionello, A., and Pibiri, I.
arrest and rescue in bacteria and eukaryotes, Philos. Trans.
(2014) Toward a rationale for the PTC124 (Ataluren) pro
R. Soc. Lond. B Biol. Sci., 372, 20160183, doi: 10.1098/
moted readthrough of premature stop codons: a computa
rstb.2016.0183.
tional approach and GFP reporter cell based assay, Mol.
168. Hirokawa, G., Kiel, M. C., Muto, A., Selmer, M., Raj, V. S.,
Pharm., 11, 653 664, doi: 10.1021/mp400230s.
Liljas, A., Igarashi, K., Kaji, H., and Kaji, A. (2002) Post
157. Konstan, M. W., VanDevanter, D. R., Rowe, S. M.,
termination complex disassembly by ribosome recycling
Wilschanski, M., Kerem, E., Sermet Gaudelus, I.,
factor, a functional tRNA mimic, EMBO J., 21, 2272
DiMango, E., Melotti, P., McIntosh, J., and De Boeck, K.
2281, doi: 10.1093/emboj/21.9.2272.
(2020) Efficacy and safety of ataluren in patients with non
169. Kurata, S., Shen, B., Liu, J. O., Takeuchi, N., Kaji, A., and
sense mutation cystic fibrosis not receiving chronic
Kaji, H. (2013) Possible steps of complete disassembly of
inhaled aminoglycosides: The international, randomized,
post termination complex by yeast eEF3 deduced from
double blind, placebo controlled Ataluren Confirmatory
inhibition by translocation inhibitors, Nucleic Acids Res.,
Trial in Cystic Fibrosis (ACT CF), J. Cyst. Fibros., 19, 595
41, 264 276, doi: 10.1093/nar/gks958.
601, doi: 10.1016/j.jcf.2020. 01.007.
170. Kurata, S., Nielsen, K. H., Mitchell, S. F., Lorsch, J. R.,
158. Zainal Abidin, N., Haq, I. J., Gardner, A. I., and Brodlie, M.
Kaji, A., and Kaji, H. (2010) Ribosome recycling step in
(2017) Ataluren in cystic fibrosis: development, clinical
yeast cytoplasmic protein synthesis is catalyzed by eEF3
studies and where are we now? Exp. Opin. Pharmacother.,
and ATP, Proc. Natl. Acad. Sci. USA, 107, 10854 10859,
18, 1363 1371, doi: 10.1080/14656566.2017.1359255.
doi: 10.1073/pnas.1006247107.
159. Auld, D. S., Thorne, N., Maguire, W. F., and Inglese, J.
171. Borg, A., Pavlov, M., and Ehrenberg, M.
(2016)
(2009) Mechanism of PTC124 activity in cell based
Mechanism of fusidic acid inhibition of RRF and EF G
luciferase assays of nonsense codon suppression, Proc.
dependent splitting of the bacterial post termination ribo
БИОХИМИЯ том 85 вып. 11 2020
1670
ДМИТРИЕВ и др.
some, Nucleic Acids Res., 44, 3264 3275, doi: 10.1093/
derivative produced by Morinia pestalozzioides, Bioorg.
nar/gkw178.
Med. Chem., 14, 560 566, doi: 10.1016/j.bmc.2005.08.
172. Sanchez Murcia, P. A., Cortes Cabrera, A., and Gago, F.
046.
(2017) Structural rationale for the cross resistance of
185. Herreros, E., Almela, M. J., Lozano, S., Gomez de las
tumor cells bearing the A399V variant of elongation factor
Heras, F., and Gargallo Viola, D. (2001) Antifungal activ
eEF1A1 to the structurally unrelated didemnin B, ternatin,
ities and cytotoxicity studies of six new azasordarins,
nannocystin A and ansatrienin B, J. Comput. Aided Mol.
Antimicrob. Agents Chemother.,
45,
31323139,
Des., 31, 915 928, doi: 10.1007/s10822 017 0066 x.
doi: 10.1128/AAC.45.11.3132 3139.2001.
173. Carelli, J. D., Sethofer, S. G., Smith, G. A., Miller, H. R.,
186. Jorgensen, R., Ortiz, P. A., Carr Schmid, A., Nissen, P.,
Simard, J. L., Merrick, W. C., Jain, R. K., Ross, N. T., and
Kinzy, T. G., and Andersen, G. R. (2003) Two crystal struc
Taunton, J. (2015) Ternatin and improved synthetic vari
tures demonstrate large conformational changes in the
ants kill cancer cells by targeting the elongation factor 1A
eukaryotic ribosomal translocase, Nat. Struct. Biol., 10,
ternary complex, eLife, 4, doi: 10.7554/eLife.10222.
379 385, doi: 10.1038/nsb923.
174. Lee, J., Currano, J. N., Carroll, P. J., and Joullie, M. M.
187. Soe, R., Mosley, R. T., Justice, M., Nielsen Kahn, J.,
(2012) Didemnins, tamandarins and related natural prod
Shastry, M., Merrill, A. R., and Andersen, G. R. (2007)
ucts, Nat. Prod. Rep.,
29,
404424, doi:
10.1039/
Sordarin derivatives induce a novel conformation of the
c2np00065b.
yeast ribosome translocation factor eEF2, J. Biol. Chem.,
175. SirDeshpande, B. V., and Toogood, P. L.
(1995)
282, 657 666, doi: 10.1074/jbc.M607830200.
Mechanism of protein synthesis inhibition by didemnin B
188. Spahn, C. M., Gomez Lorenzo, M. G., Grassucci, R. A.,
in vitro, Biochemistry, 34, 91779184, doi: 10.1021/
Jorgensen, R., Andersen, G. R., Beckmann, R., Penczek,
bi00028a030.
P. A., Ballesta, J. P., and Frank, J. (2004) Domain move
176. Shao, S., Murray, J., Brown, A., Taunton, J.,
ments of elongation factor eEF2 and the eukaryotic 80S
Ramakrishnan, V., and Hegde, R. S. (2016) Decoding
ribosome facilitate tRNA translocation, EMBO J., 23,
mammalian ribosome mRNA states by translational
1008 1019, doi: 10.1038/sj.emboj.7600102.
GTPase complexes, Cell,
167,
12291240 e1215,
189. Malkin, M., and Lipmann, F. (1969) Fusidic acid: inhibi
doi: 10.1016/j.cell.2016.10.046.
tion of factor T2 in reticulocyte protein synthesis, Science,
177. Losada, A., Munoz Alonso, M. J., Garcia, C., Sanchez
164, 71 72, doi: 10.1126/science.164.3875.71.
Murcia, P. A., Martinez Leal, J. F., Dominguez, J. M.,
190. Botet, J., Rodriguez Mateos, M., Ballesta, J. P., Revuelta,
Lillo, M. P., Gago, F., and Galmarini, C. M. (2016)
J. L., and Remacha, M. (2008) A chemical genomic screen
Translation elongation factor eEF1A2 is a novel anticancer
in Saccharomyces cerevisiae reveals a role for diphthami
target for the marine natural product plitidepsin, Sci. Rep.,
dation of translation elongation factor 2 in inhibition of
6, 35100, doi: 10.1038/srep35100.
protein synthesis by sordarin, Antimicrob. Agents
178. Adrio, J., Cuevas, C., Manzanares, I., and Joullie, M. M.
Chemother., 52, 1623 1629, doi: 10.1128/AAC.01603 07.
(2007) Total synthesis and biological evaluation of taman
191. Yates, S. P., Jorgensen, R., Andersen, G. R., and Merrill,
darin B analogues, J. Org. Chem.,
72,
51295138,
A. R. (2006) Stealth and mimicry by deadly bacterial tox
doi: 10.1021/jo070412r.
ins, Trends Biochem. Sci., 31, 123 133, doi: 10.1016/
179. Lindqvist, L., Robert, F., Merrick, W., Kakeya, H., Fraser,
j.tibs.2005.12.007.
C., Osada, H., and Pelletier, J. (2010) Inhibition of trans
192. Stickel, S. A., Gomes, N. P., Frederick, B., Raben, D., and
lation by cytotrienin A—a member of the ansamycin fami
Su, T. T. (2015) Bouvardin is a radiation modulator with a
ly, RNA, 16, 2404 2413, doi: 10.1261/rna.2307710.
novel mechanism of action, Radiat. Res., 184, 392 403,
180. Yamada, Y., Tashiro, E., Taketani, S., Imoto, M., and
doi: 10.1667/RR14068.1.
Kataoka, T. (2011) Mycotrienin II, a translation inhibitor
193. Zalacain, M., Zaera, E., Vazquez, D., and Jimenez, A.
that prevents ICAM 1 expression induced by pro inflam
(1982) The mode of action of the antitumor drug bou
matory cytokines, J. Antibiot. (Tokyo), 64, 361366,
vardin, an inhibitor of protein synthesis in eukaryotic cells,
doi: 10.1038/ja.2011.23.
FEBS Lett.,
148,
9597, doi:
10.1016/0014
181. Krastel, P., Roggo, S., Schirle, M., Ross, N. T., Perruccio, F.,
5793(82)81250 7.
Aspesi, P., Jr., Aust, T., Buntin, K., Estoppey, D., Liechty, B.,
194. Rambelli, F., Brigotti, M., Zamboni, M., Denaro, M.,
Mapa, F., Memmert, K., Miller, H., Pan, X., Riedl, R.,
Montanaro, L., and Sperti, S. (1989) Effect of the antibi
Thibaut, C., Thomas, J., Wagner, T., Weber, E., Xie, X.,
otic purpuromycin on cell free protein synthesizing sys
Schmitt, E. K., and Hoepfner, D. (2015) Nannocystin A:
tems, Biochem. J., 259, 307 310, doi: 10.1042/bj2590307.
an Elongation Factor 1 Inhibitor from Myxobacteria with
195. Baragana, B., Hallyburton, I., Lee, M. C., Norcross, N.
Differential Anti Cancer Properties, Angew. Chem. Int. Ed.
R., Grimaldi, R., et al. (2015) A novel multiple stage anti
Engl., 54, 10149 10154, doi: 10.1002/anie.201505069.
malarial agent that inhibits protein synthesis, Nature, 522,
182. Justice, M. C., Hsu, M. J., Tse, B., Ku, T., Balkovec, J.,
315 320, doi: 10.1038/nature14451.
Schmatz, D., and Nielsen, J. (1998) Elongation factor 2 as
196. Turpaev, K. T. (2018) Translation factor eIF5A, modifica
a novel target for selective inhibition of fungal protein syn
tion with hypusine and role in regulation of gene expres
thesis, J. Biol. Chem., 273, 3148 3151, doi: 10.1074/jbc.
sion. eIF5A as a target for pharmacological interventions,
273.6.3148.
Biochemistry (Moscow),
83,
863873, doi:
10.1134/
183. Dominguez, J. M., Kelly, V. A., Kinsman, O. S., Marriott,
S0006297918080011.
M. S., Gomez de las Heras, F., and Martin, J. J. (1998)
197. Dong, Z., and Zhang, J. T. (2003) EIF3 p170, a mediator
Sordarins: a new class of antifungals with selective inhibi
of mimosine effect on protein synthesis and cell cycle pro
tion of the protein synthesis elongation cycle in yeasts,
gression,
Mol.
Biol.
Cell,
14,
39423951,
Antimicrob. Agents Chemother.,
42,
22742278,
doi: 10.1091/mbc.e02 12 0784.
doi: 10.1128/AAC.42.9.2274.
198. Moerke, N. J., Aktas, H., Chen, H., Cantel, S., Reibarkh,
184. Basilio, A., Justice, M., Harris, G., Bills, G., Collado, J.,
M. Y., Fahmy, A., Gross, J. D., Degterev, A., Yuan, J.,
de la Cruz, M., Diez, M. T., Hernandez, P., Liberator, P.,
Chorev, M., Halperin, J. A., and Wagner, G. (2007) Small
Nielsen kahn, J., Pelaez, F., Platas, G., Schmatz, D.,
molecule inhibition of the interaction between the transla
Shastry, M., Tormo, J. R., Andersen, G. R., and Vicente, F.
tion initiation factors eIF4E and eIF4G, Cell, 128, 257
(2006) The discovery of moriniafungin, a novel sordarin
267, doi: 10.1016/j.cell.2006.11.046.
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1671
199. Sekiyama, N., Arthanari, H., Papadopoulos, E.,
The antiviral drug ribavirin does not mimic the 7 methyl
Rodriguez Mias, R. A., Wagner, G., and Leger Abraham, M.
guanosine moiety of the mRNA cap structure in vitro,
(2015) Molecular mechanism of the dual activity of
RNA, 11, 1505 1513, doi: 10.1261/rna.2132505.
4EGI 1: dissociating eIF4G from eIF4E but stabilizing the
211. Yan, Y., Svitkin, Y., Lee, J. M., Bisaillon, M., and Pelletier, J.
binding of unphosphorylated 4E BP1, Proc. Natl. Acad.
(2005) Ribavirin is not a functional mimic of the 7 methyl
Sci. USA,
112, E4036 E4045, doi:
10.1073/pnas.
guanosine mRNA cap, RNA,
11,
12381244,
1512118112.
doi: 10.1261/rna.2930805.
200. Papadopoulos, E., Jenni, S., Kabha, E., Takrouri, K. J., Yi, T.,
212. Kentsis, A., Volpon, L., Topisirovic, I., Soll, C. E.,
Salvi, N., Luna, R. E., Gavathiotis, E., Mahalingam, P.,
Culjkovic, B., Shao, L., and Borden, K. L. (2005) Further
Arthanari, H., Rodriguez Mias, R., Yefidoff Freedman, R.,
evidence that ribavirin interacts with eIF4E, RNA, 11,
Aktas, B. H., Chorev, M., Halperin, J. A., and Wagner, G.
1762 1766, doi: 10.1261/rna.2238705.
(2014) Structure of the eukaryotic translation initiation
213. Tan, K., Culjkovic, B., Amri, A., and Borden, K. L. (2008)
factor eIF4E in complex with 4EGI 1 reveals an allo
Ribavirin targets eIF4E dependent Akt survival signaling,
steric mechanism for dissociating eIF4G, Proc. Natl. Acad.
Biochem. Biophys. Res. Commun.,
375,
341345,
Sci. USA,
111, E3187 3195, doi:
10.1073/pnas.
doi: 10.1016/j.bbrc.2008.07.163.
1410250111.
214. Chu, J., and Pelletier, J. (2015) Targeting the eIF4A RNA
201. Shatsky, I. N., Dmitriev, S. E., Andreev, D. E., and
helicase as an anti neoplastic approach, Biochim. Biophys.
Terenin, I. M. (2014) Transcriptome wide studies uncover
Acta, 1849, 781 791, doi: 10.1016/j.bbagrm.2014.09.006.
the diversity of modes of mRNA recruitment to eukaryotic
215. Naineni, S. K., Itoua Maiga, R., Cencic, R., Putnam, A. A.,
ribosomes, Crit. Rev. Biochem. Mol. Biol., 49, 164 177,
Amador, L. A., Rodriguez, A. D., Jankowsky, E., and
doi: 10.3109/10409238.2014.887051.
Pelletier, J. (2020) A comparative study of small molecules
202. Cencic, R., Hall, D. R., Robert, F., Du, Y., Min, J., Li, L.,
targeting eIF4A, RNA,
26,
541549, doi:
10.1261/
Qui, M., Lewis, I., Kurtkaya, S., Dingledine, R., Fu, H.,
rna.072884.119.
Kozakov, D., Vajda, S., and Pelletier, J. (2011) Reversing
216. Cencic, R., and Pelletier, J. (2016) Hippuristanol - a
chemoresistance by small molecule inhibition of the trans
potent steroid inhibitor of eukaryotic initiation factor 4A,
lation initiation complex eIF4F, Proc. Natl. Acad. Sci. USA,
Translation, 4, e1137381, doi: 10.1080/21690731.2015.
108, 1046 1051, doi: 10.1073/pnas.1011477108.
1137381.
203. Cencic, R., Desforges, M., Hall, D. R., Kozakov, D., Du, Y.,
217. Bordeleau, M. E., Matthews, J., Wojnar, J. M., Lindqvist, L.,
Min, J., Dingledine, R., Fu, H., Vajda, S., Talbot, P. J., and
Novac, O., Jankowsky, E., Sonenberg, N., Northcote, P.,
Pelletier, J. (2011) Blocking eIF4E eIF4G interaction as a
Teesdale Spittle, P., and Pelletier, J. (2005) Stimulation of
strategy to impair coronavirus replication, J. Virol., 85,
mammalian translation initiation factor eIF4A activity by a
6381 6389, doi: 10.1128/JVI.00078 11.
small molecule inhibitor of eukaryotic translation, Proc.
204. Cao, J., He, L., Lin, G., Hu, C., Dong, R., Zhang, J.,
Natl. Acad. Sci. USA, 102, 10460 10465, doi: 10.1073/
Zhu, H., Hu, Y., Wagner, C. R., He, Q., and Yang, B.
pnas.0504249102.
(2014) Cap dependent translation initiation factor, eIF4E,
218. Low, W. K., Dang, Y., Schneider Poetsch, T., Shi, Z.,
is the target for Ouabain mediated inhibition of HIF
Choi, N. S., Merrick, W. C., Romo, D., and Liu, J. O.
1alpha, Biochem. Pharmacol., 89, 20 30, doi: 10.1016/
(2005) Inhibition of eukaryotic translation initiation by the
j.bcp.2013.12.002.
marine natural product pateamine A, Mol. Cell, 20, 709
205. Huang, C. T., Hsieh, C. H., Oyang, Y. J., Huang, H. C.,
722, doi: 10.1016/j.molcel.2005.10.008.
and Juan, H. F. (2018) A large scale gene expression inten
219. Iwasaki, S., Iwasaki, W., Takahashi, M., Sakamoto, A.,
sity based similarity metric ford repositioning, iScience, 7,
Watanabe, C., Shichino, Y., Floor, S. N., Fujiwara, K.,
40 52, doi: 10.1016/j.isci.2018.08.017.
Mito, M., Dodo, K., Sodeoka, M., Imataka, H., Honma, T.,
206. Perne, A., Muellner, M. K., Steinrueck, M., Craig
Fukuzawa, K., Ito, T., and Ingolia, N. T. (2019) The
Mueller, N., Mayerhofer, J., Schwarzinger, I., Sloane, M.,
Translation inhibitor rocaglamide targets a bimolecular
Uras, I. Z., Hoermann, G., Nijman, S. M., and
cavity between eIF4A and polypurine RNA, Mol. Cell, 73,
Mayerhofer, M. (2009) Cardiac glycosides induce cell
738 748 e739, doi: 10.1016/j.molcel.2018.11.026.
death in human cells by inhibiting general protein synthe
220. Cencic, R., Carrier, M., Galicia Vazquez, G., Bordeleau,
sis, PloS One, 4, e8292, doi: 10.1371/journal.pone.
M. E., Sukarieh, R., Bourdeau, A., Brem, B., Teodoro, J. G.,
0008292.
Greger, H., Tremblay, M. L., Porco, J. A., Jr., and Pelletier, J.
207. Hossan, M. S., Chan, Z. Y., Collins, H. M., Shipton, F. N.,
(2009) Antitumor activity and mechanism of action of the
Butler, M. S., Rahmatullah, M., Lee, J. B., Gershkovich, P.,
cyclopenta[b]benzofuran, silvestrol, PloS One, 4, e5223,
Kagan, L., Khoo, T. J., Wiart, C., and Bradshaw, T. D.
doi: 10.1371/journal.pone.0005223.
(2019) Cardiac glycoside cerberin exerts anticancer activi
221. Chu, J., Zhang, W., Cencic, R., O’Connor, P. B. F.,
ty through PI3K/AKT/mTOR signal transduction inhibi
Robert, F., Devine, W. G., Selznick, A., Henkel, T.,
tion, Cancer Lett., 453, 5773, doi: 10.1016/j.canlet.
Merrick, W. C., Brown, L. E., Baranov, P. V., Porco, J. A.,
2019.03.034.
Jr., and Pelletier, J. (2020) Rocaglates induce gain of func
208. Howard, C. M., Estrada, M., Terrero, D., Tiwari, A. K.,
tion alterations to eIF4A and eIF4F, Cell Rep., 30, 2481
and Raman, D. (2020) Identification of cardiac glycosides
2488 e2485, doi: 10.1016/j.celrep.2020.02.002.
as novel inhibitors of eIF4A1 mediated translation in
222. Low, W. K., Li, J., Zhu, M., Kommaraju, S. S., Shah
triple negative breast cancer cells, Cancers,
12,
Mittal, J., Hull, K., Liu, J. O., and Romo, D. (2014)
doi: 10.3390/cancers12082169.
Second generation derivatives of the eukaryotic translation
209. Kentsis, A., Topisirovic, I., Culjkovic, B., Shao, L., and
initiation inhibitor pateamine A targeting eIF4A as poten
Borden, K. L. (2004) Ribavirin suppresses eIF4E mediat
tial anticancer agents, Bioorg. Med. Chem., 22, 116 125,
ed oncogenic transformation by physical mimicry of the 7
doi: 10.1016/j.bmc.2013.11.046.
methyl guanosine mRNA cap, Proc. Natl. Acad. Sci. USA,
223. Tillotson, J., Kedzior, M., Guimaraes, L., Ross, A. B.,
101, 18105 18110, doi: 10.1073/pnas.0406927102.
Peters, T. L., Ambrose, A. J., Schmidlin, C. J., Zhang, D. D.,
210. Westman, B., Beeren, L., Grudzien, E., Stepinski, J.,
Costa Lotufo, L. V., Rodriguez, A. D., Schatz, J. H., and
Worch, R., Zuberek, J., Jemielity, J., Stolarski, R.,
Chapman, E. (2017) ATP competitive, marine derived
Darzynkiewicz, E., Rhoads, R. E., and Preiss, T. (2005)
natural products that target the DEAD box helicase,
БИОХИМИЯ том 85 вып. 11 2020
1672
ДМИТРИЕВ и др.
eIF4A, Bioorg. Med. Chem. Lett.,
27,
40824085,
238. Lux, M. C., Standke, L. C., and Tan, D. S. (2019)
doi: 10.1016/j.bmcl.2017.07.045.
Targeting adenylate forming enzymes with designed sul
224. Stewart, M. L., Grollman, A. P., and Huang, M. T. (1971)
fonyladenosine inhibitors, J. Antibiot. (Tokyo), 72, 325
Aurintricarboxylic acid: inhibitor of initiation of protein
349, doi: 10.1038/s41429 019 0171 2.
synthesis, Proc. Natl. Acad. Sci. USA,
68,
97101,
239. Francklyn, C. S., and Mullen, P. (2019) Progress and chal
doi: 10.1073/pnas.68.1.97.
lenges in aminoacyl tRNA synthetase based therapeutics,
225. Huang, M. T., and Grollman, A. P. (1973) Pyrocatechol
J. Biol. Chem.,
294,
53655385, doi:
10.1074/jbc.
violet: an inhibitor of initiation of protein synthesis,
REV118.002956.
Biochem. Biophys. Res. Commun.,
53,
10491059,
240. Alix, J. H. (1982) Molecular aspects of the in vivo and in
doi: 10.1016/0006 291x(73)90571 8.
vitro effects of ethionine, an analog of methionine,
226. Gonzalez, R. G., Blackburn, B. J., and Schleich, T. (1979)
Microbiol. Rev., 46, 281 295.
Fractionation and structural elucidation of the active com
241. Fang, P., Yu, X., Jeong, S. J., Mirando, A., Chen, K.,
ponents of aurintricarboxylic acid, a potent inhibitor of
Chen, X., Kim, S., Francklyn, C. S., and Guo, M. (2015)
protein nucleic acid interactions, Biochim. Biophys. Acta,
Structural basis for full spectrum inhibition of translation
562, 534 545, doi: 10.1016/0005 2787(79)90116 3.
al functions on a tRNA synthetase, Nat. Commun., 6, 6402,
227. Liao, L. L., Horwitz, S. B., Huang, M. T., Grollman, A. P.,
doi: 10.1038/ncomms7402.
Steward, D., and Martin, J. (1975) Triphenylmethane dyes
242. el Khoury, A., and Atoui, A. (2010) Ochratoxin a: general
as inhibitors of reverse transcriptase, ribonucleic acid poly
overview and actual molecular status, Toxins, 2, 461 493,
merase, and protein synthesis. Structure activity relation
doi: 10.3390/toxins2040461.
ships, J. Med. Chem.,
18,
117120, doi:
10.1021/
243. Keller, T. L., Zocco, D., Sundrud, M. S., Hendrick, M.,
jm00235a029.
Edenius, M., Yum, J., Kim, Y. J., Lee, H. K., Cortese, J. F.,
228. Leader, D. P. (1972) Aurintricarboxylic acid inhibition of
Wirth, D. F., Dignam, J. D., Rao, A., Yeo, C. Y.,
the binding of phenylalanyl tRNAa to rat liver ribosomal
Mazitschek, R., and Whitman, M. (2012) Halofuginone
subunits, FEBS Lett., 22, 245 248, doi: 10.1016/0014
and other febrifugine derivatives inhibit prolyl tRNA syn
5793(72)80055 3.
thetase, Nat. Chem. Biol., 8, 311 317, doi: 10.1038/nchembio.
229. Contreras, A., Vazquez, D., and Carrasco, L.
(1978)
790.
Inhibition, by selected antibiotics, of protein synthesis in
244. Sundrud, M. S., Koralov, S. B., Feuerer, M., Calado, D. P.,
cells growing in tissue cultures, J. Antibiot. (Tokyo), 31,
Kozhaya, A. E., Rhule Smith, A., Lefebvre, R. E.,
598 602, doi: 10.7164/antibiotics.31.598.
Unutmaz, D., Mazitschek, R., Waldner, H., Whitman, M.,
230. Novac, O., Guenier, A. S., and Pelletier, J.
(2004)
Keller, T., and Rao, A. (2009) Halofuginone inhibits TH17
Inhibitors of protein synthesis identified by a high through
cell differentiation by activating the amino acid starvation
put multiplexed translation screen, Nucleic Acids Res., 32,
response, Science, 324, 1334 1338, doi: 10.1126/science.
902 915, doi: 10.1093/nar/gkh235.
1172638.
231. Terenin, I. M., Dmitriev, S. E., Andreev, D. E., and
245. Sarkar, J., Mao, W., Lincecum, T. L., Jr., Alley, M. R., and
Shatsky, I. N. (2008) Eukaryotic translation initiation
Martinis, S. A. (2011) Characterization of benzoxaborole
machinery can operate in a bacterial like mode without
based antifungal resistance mutations demonstrates that
eIF2, Nat. Struct. Mol. Biol., 15, 836 841, doi: 10.1038/
editing depends on electrostatic stabilization of the leucyl
nsmb.1445.
tRNA synthetase editing cap, FEBS Lett., 585, 2986 2991,
232. Robert, F., Kapp, L. D., Khan, S. N., Acker, M. G.,
doi: 10.1016/j.febslet.2011.08.010.
Kolitz, S., Kazemi, S., Kaufman, R. J., Merrick, W. C.,
246. Marjanovic, J., and Kozmin, S. A. (2007) Spirofungin A:
Koromilas, A. E., Lorsch, J. R., and Pelletier, J. (2006)
stereoselective synthesis and inhibition of isoleucyl tRNA
Initiation of protein synthesis by hepatitis C virus is refrac
synthetase, Angew. Chem. Int. Ed. Engl., 46, 8854 8857,
tory to reduced eIF2.GTP.Met tRNA(i)(Met) ternary
doi: 10.1002/anie.200702440.
complex availability, Mol. Biol. Cell, 17, 46324644,
247. Shimizu, T., Usui, T., Machida, K., Furuya, K., Osada, H.,
doi: 10.1091/mbc.e06 06 0478.
and Nakata, T.
(2002) Chemical modification of
233. Carvalho, A., Chu, J., Meinguet, C., Kiss, R.,
reveromycin A and its biological activities, Bioorg. Med.
Vandenbussche, G., Masereel, B., Wouters, J., Kornienko, A.,
Chem. Lett.,
12,
33633366, doi:
10.1016/s0960
Pelletier, J., and Mathieu, V. (2017) A harmine derived
894x(02)00782 5.
beta carboline displays anti cancer effects in vitro by tar
248. Miyamoto, Y., Machida, K., Mizunuma, M., Emoto, Y.,
geting protein synthesis, Eur. J. Pharmacol., 805, 25 35,
Sato, N., Miyahara, K., Hirata, D., Usui, T., Takahashi, H.,
doi: 10.1016/j.ejphar.2017.03.034.
Osada, H., and Miyakawa, T. (2002) Identification of
234. Lee, J., Kang, S. U., Kang, M. K., Chun, M. W., Jo, Y. J.,
Saccharomyces cerevisiae isoleucyl tRNA synthetase as a
Kwak, J. H., and Kim, S. (1999) Methionyl adenylate ana
target of the G1 specific inhibitor Reveromycin A, J. Biol.
logues as inhibitors of methionyl tRNA synthetase, Bioorg.
Chem., 277, 28810 28814, doi: 10.1074/jbc.M203827200.
Med. Chem. Lett., 9, 1365 1370, doi: 10.1016/s0960
249. Woo, J. T., Kawatani, M., Kato, M., Shinki, T., Yonezawa, T.,
894x(99)00206 1.
Kanoh, N., Nakagawa, H., Takami, M., Lee, K. H., Stern,
235. Lee, J., Kang, M. K., Chun, M. W., Jo, Y. J., Kwak, J. H.,
P. H., Nagai, K., and Osada, H. (2006) Reveromycin A, an
and Kim, S. (1998) Methionine analogues as inhibitors of
agent for osteoporosis, inhibits bone resorption by inducing
methionyl tRNA synthetase, Bioorg. Med. Chem. Lett., 8,
apoptosis specifically in osteoclasts, Proc. Natl. Acad. Sci.
3511 3514, doi: 10.1016/s0960 894x(98)00642 8.
USA, 103, 4729 4734, doi: 10.1073/pnas.0505663103.
236. Nevinsky, G. A., Favorova, O. O., Lavrik, O. I., Petrova, T.
250. Kirillov, S., Vitali, L. A., Goldstein, B. P., Monti, F.,
D., Kochkina, L. L., and Savchenko, T. I.
(1974)
Semenkov, Y., Makhno, V., Ripa, S., Pon, C. L., and
Fluorinated tryptophans as substrates and inhibitors of the
Gualerzi, C. O. (1997) Purpuromycin: an antibiotic
ATP—(32P)PPi exchange reaction catalysed by trypto
inhibiting tRNA aminoacylation, RNA, 3, 905 913.
phanyl tRNA synthetase, FEBS Lett., 43, 135138,
251. Van de Vijver, P., Ostrowski, T., Sproat, B., Goebels, J.,
doi: 10.1016/0014 5793(74)80985 3.
Rutgeerts, O., Van Aerschot, A., Waer, M., and Herdewijn, P.
237. Zhao, Y., Meng, Q., Bai, L., and Zhou, H. (2014) In silico
(2008) Aminoacyl tRNA synthetase inhibitors as potent
discovery of aminoacyl tRNA synthetase inhibitors, Int. J.
and synergistic immunosuppressants, J. Med. Chem., 51,
Mol. Sci., 15, 1358 1373, doi: 10.3390/ijms15011358.
3020 3029, doi: 10.1021/jm8000746.
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1673
252. Kim, Y., Sundrud, M. S., Zhou, C., Edenius, M., Zocco, D.,
S. E. (2016) Four translation initiation pathways employed
Powers, K., Zhang, M., Mazitschek, R., Rao, A., Yeo, C. Y.,
by the leaderless mRNA in eukaryotes, Sci. Rep., 6, 37905,
Noss, E. H., Brenner, M. B., Whitman, M., and Keller, T. L.
doi: 10.1038/srep37905.
(2020) Aminoacyl tRNA synthetase inhibition activates a
268. Joshi, M., Kulkarni, A., and Pal, J. K. (2013) Small mole
pathway that branches from the canonical amino acid
cule modulators of eukaryotic initiation factor 2alpha
response in mammalian cells, Proc. Natl. Acad. Sci. USA,
kinases, the key regulators of protein synthesis, Biochimie,
117, 8900 8911, doi: 10.1073/pnas.1913788117.
95, 1980 1990, doi: 10.1016/j.biochi.2013.07.030.
253. Proud, C. G.
(2019) Phosphorylation and Signal
269. Chen, T., Ozel, D., Qiao, Y., Harbinski, F., Chen, L.,
Transduction Pathways in Translational Control, Cold
Denoyelle, S., He, X., Zvereva, N., Supko, J. G., Chorev, M.,
Spring Harb. Perspect. Biol., 11, a033050, doi: 10.1101/
Halperin, J. A., and Aktas, B. H. (2011) Chemical genetics
cshperspect.a033050.
identify eIF2alpha kinase heme regulated inhibitor as an
254. Roux, P. P., and Topisirovic, I. (2012) Regulation of
anticancer target, Nat. Chem. Biol.,
7,
610616,
mRNA translation by signaling pathways, Cold Spring
doi: 10.1038/nchembio.613.
Harb. Perspect. Biol., 4, a012252, doi: 10.1101/cshperspect.
270. Ganz, J., Shacham, T., Kramer, M., Shenkman, M., Eiger, H.,
a012252.
Weinberg, N., Iancovici, O., Roy, S., Simhaev, L.,
255. Thoreen, C. C. (2017) The molecular basis of mTORC1
Da’adoosh, B., Engel, H., Perets, N., Barhum, Y.,
regulated translation, Biochem. Soc. Trans., 45, 213 221,
Portnoy, M., Offen, D., and Lederkremer, G. Z. (2020) A
doi: 10.1042/BST20160072.
novel specific PERK activator reduces toxicity and extends
256. Siddiqui, N., and Sonenberg, N. (2015) Signalling to
survival in Huntington’s disease models, Sci. Rep., 10,
eIF4E in cancer, Biochemical Soc. Trans., 43, 763 772,
6875, doi: 10.1038/s41598 020 63899 4.
doi: 10.1042/BST20150126.
271. Stockwell, S. R., Platt, G., Barrie, S. E., Zoumpoulidou, G.,
257. Andreev, D. E., Dmitriev, S. E., Loughran, G., Terenin, I. M.,
Te Poele, R. H., Aherne, G. W., Wilson, S. C., Sheldrake, P.,
Baranov, P. V., and Shatsky, I. N. (2018) Translation con
McDonald, E., Venet, M., Soudy, C., Elustondo, F.,
trol of mRNAs encoding mammalian translation initiation
Rigoreau, L., Blagg, J., Workman, P., Garrett, M. D., and
factors, Gene, 651, 174 182, doi: 10.1016/j.gene.2018.
Mittnacht, S. (2012) Mechanism based screen for G1/S
02.013.
checkpoint activators identifies a selective activator of
258. Cockman, E., Anderson, P., and Ivanov, P. (2020) TOP
EIF2AK3/PERK signalling, PloS One,
7, e28568,
mRNPs: molecular mechanisms and principles of regula
doi: 10.1371/journal.pone.0028568.
tion, Biomolecules, 10, doi: 10.3390/biom10070969.
272. Damgaard, C. K., and Lykke Andersen, J.
(2011)
259. Hua, H., Kong, Q., Zhang, H., Wang, J., Luo, T., and
Translational coregulation of 5’TOP mRNAs by TIA 1 and
Jiang, Y. (2019) Targeting mTOR for cancer therapy,
TIAR, Genes Dev., 25, 2057 2068, doi: 10.1101/gad.
J. Hematol. Oncol., 12, 71, doi: 10.1186/s13045 019 0754 1.
17355911.
260. Anisimova, A. S., Meerson, M. B., Gerashchenko, M. V.,
273. Costa Mattioli, M., Gobert, D., Stern, E., Gamache, K.,
Kulakovskiy, I. V., Dmitriev, S. E., and Gladyshev, V. N.
Colina, R., Cuello, C., Sossin, W., Kaufman, R., Pelletier, J.,
(2020) Multifaceted deregulation of gene expression and
Rosenblum, K., Krnjevic, K., Lacaille, J. C., Nader, K.,
protein synthesis with age, Proc. Natl. Acad. Sci. USA, 117,
and Sonenberg, N. (2007) eIF2alpha phosphorylation
15581 15590, doi: 10.1073/pnas.2001788117.
bidirectionally regulates the switch from short to long
261. Anisimova, A. S., Alexandrov, A. I., Makarova, N. E.,
term synaptic plasticity and memory, Cell, 129, 195 206,
Gladyshev, V. N., and Dmitriev, S. E. (2018) Protein syn
doi: 10.1016/j.cell.2007.01.050.
thesis and quality control in aging, Aging, 10, 4269 4288,
274. Boyce, M., Bryant, K. F., Jousse, C., Long, K., Harding,
doi: 10.18632/aging.101721.
H. P., Scheuner, D., Kaufman, R. J., Ma, D., Coen, D. M.,
262. Schenone, S., Brullo, C., Musumeci, F., Radi, M., and
Ron, D., and Yuan, J. (2005) A selective inhibitor of
Botta, M. (2011) ATP competitive inhibitors of mTOR: an
eIF2alpha dephosphorylation protects cells from ER stress,
update, Curr. Med. Chem.,
18,
29953014,
Science, 307, 935 939, doi: 10.1126/science.1101902.
doi: 10.2174/092986711796391651.
275. Kim, S. M., Yoon, S. Y., Choi, J. E., Park, J. S., Choi, J. M.,
263. Brunn, G. J., Williams, J., Sabers, C., Wiederrecht, G.,
Nguyen, T., and Kim, D. H. (2010) Activation of eukary
Lawrence, J. C., Jr., and Abraham, R. T. (1996) Direct
otic initiation factor 2 alpha kinases in okadaic acid treat
inhibition of the signaling functions of the mammalian tar
ed neurons, Neuroscience, 169, 1831 1839, doi: 10.1016/
get of rapamycin by the phosphoinositide 3 kinase
j.neuroscience.2010.06.016.
inhibitors, wortmannin and LY294002, EMBO J., 15,
276. Wakula, P., Beullens, M., van Eynde, A., Ceulemans, H.,
5256 5267.
Stalmans, W., and Bollen, M. (2006) The translation initi
264. Li, B. B., Qian, C., Gameiro, P. A., Liu, C. C., Jiang, T.,
ation factor eIF2beta is an interactor of protein phos
Roberts, T. M., Struhl, K., and Zhao, J. J. (2018) Targeted
phatase 1, Biochem. J., 400, 377383, doi: 10.1042/
profiling of RNA translation reveals mTOR 4EBP1/2
BJ20060758.
independent translation regulation of mRNAs encoding
277. Kolupaeva, V. (2019) Serine threonine protein phos
ribosomal proteins, Proc. Natl. Acad. Sci. USA, 115,
phatases: Lost in translation, Biochim. Biophys. Acta, Mol.
E9325 E9332, doi: 10.1073/pnas.1805782115.
Cell Res., 1866, 83 89, doi: 10.1016/j.bbamcr.2018.08.006.
265. Donnelly, N., Gorman, A. M., Gupta, S., and Samali, A.
278. Sidrauski, C., Acosta Alvear, D., Khoutorsky, A.,
(2013) The eIF2alpha kinases: their structures and func
Vedantham, P., Hearn, B. R., Li, H., Gamache, K.,
tions, Cell.
Mol. Life Sci.,
70,
34933511,
Gallagher, C. M., Ang, K. K., Wilson, C., Okreglak, V.,
doi: 10.1007/s00018 012 1252 6.
Ashkenazi, A., Hann, B., Nader, K., Arkin, M. R., Renslo,
266. Wek, R. C. (2018) Role of eIF2alpha kinases in transla
A. R., Sonenberg, N., and Walter, P. (2013) Pharmacolog
tional control and adaptation to cellular stress, Cold Spring
ical brake release of mRNA translation enhances cognitive
Harb. Perspect. Biol.,
10, doi:
10.1101/cshperspect.
memory, eLife, 2, e00498, doi: 10.7554/eLife.00498.
a032870.
279. Rabouw, H. H., Langereis, M. A., Anand, A. A., Visser, L. J.,
267. Akulich, K. A., Andreev, D. E., Terenin, I. M., Smirnova,
de Groot, R. J., Walter, P., and van Kuppeveld, F. J. M.
V. V., Anisimova, A. S., Makeeva, D. S., Arkhipova, V. I.,
(2019) Small molecule ISRIB suppresses the integrated stress
Stolboushkina, E. A., Garber, M. B., Prokofjeva, M. M.,
response within a defined window of activation, Proc. Natl.
Spirin, P. V., Prassolov, V. S., Shatsky, I. N., and Dmitriev,
Acad. Sci. USA, 116, 2097 2102, doi: 10.1073/pnas.1815767116.
11 БИОХИМИЯ том 85 вып. 11 2020
1674
ДМИТРИЕВ и др.
280. Chen, Z., Gopalakrishnan, S. M., Bui, M. H., Soni, N. B.,
stress activated protein kinases by 13 deoxytedanolide, an
Warrior, U., Johnson, E. F., Donnelly, J. B., and Glaser, K. B.
antitumor marine macrolide, Biosci. Biotechnol. Biochem.,
(2011)
1 Benzyl 3 cetyl 2 methylimidazolium iodide
70, 161 171, doi: 10.1271/bbb.70.161.
(NH125) induces phosphorylation of eukaryotic elonga
294. Vind, A. C., Snieckute, G., Blasius, M., Tiedje, C., Krogh, N.,
tion factor 2 (eEF2): a cautionary note on the anticancer
Bekker Jensen, D. B., Andersen, K. L., Nordgaard, C.,
mechanism of an eEF2 kinase inhibitor, J. Biol. Chem.,
Tollenaere, M. A. X., Lund, A. H., Olsen, J. V., Nielsen, H.,
286, 43951 43958, doi: 10.1074/jbc.M111.301291.
and Bekker Jensen, S. (2020) ZAKalpha recognizes stalled
281. De Gassart, A., Demaria, O., Panes, R., Zaffalon, L.,
ribosomes through partially redundant sensor domains,
Ryazanov, A. G., Gilliet, M., and Martinon, F. (2016)
Mol. Cell, 78, 700713 e707, doi: 10.1016/j.molcel.
Pharmacological eEF2K activation promotes cell death
2020.03.021.
and inhibits cancer progression, EMBO Rep., 17, 1471
295. Yamada, Y., Taketani, S., Osada, H., and Kataoka, T.
1484, doi: 10.15252/embr.201642194.
(2011) Cytotrienin A, a translation inhibitor that induces
282. Devkota, A. K., Tavares, C. D., Warthaka, M., Abramczyk, O.,
ectodomain shedding of TNF receptor 1 via activation of
Marshall, K. D., Kaoud, T. S., Gorgulu, K., Ozpolat, B.,
ERK and p38 MAP kinase, Eur. J. Pharmacol., 667, 113
and Dalby, K. N. (2012) Investigating the kinetic mecha
119, doi: 10.1016/j.ejphar.2011.05.072.
nism of inhibition of elongation factor 2 kinase by NH125:
296. Francis, S. P., Katz, J., Fanning, K. D., Harris, K. A.,
evidence of a common in vitro artifact, Biochemistry, 51,
Nicholas, B. D., Lacy, M., Pagana, J., Agris, P. F., and
2100 2112, doi: 10.1021/bi201787p.
Shin, J. B. (2013) A novel role of cytosolic protein synthe
283. Beretta, S., Gritti, L., Verpelli, C., and Sala, C. (2020)
sis inhibition in aminoglycoside ototoxicity, J. Neurosci.,
Eukaryotic elongation factor 2 kinase a pharmacological
33, 3079 3093, doi: 10.1523/JNEUROSCI.3430 12.2013.
target to regulate protein translation dysfunction in neuro
297. Jandhyala, D. M., Ahluwalia, A., Obrig, T., and Thorpe, C. M.
logical diseases, Neuroscience, 445, 42 49, doi: 10.1016/
(2008) ZAK: a MAP3Kinase that transduces Shiga toxin
j.neuroscience.2020.02.015.
and ricin induced proinflammatory cytokine expression,
284. Niederberger, E., King, T. S., Russe, O. Q., and
Cell. Microbiol., 10, 14681477, doi: 10.1111/j.1462
Geisslinger, G. (2015) Activation of AMPK and its impact
5822.2008.01139.x.
on exercise capacity, Sports Med.,
45,
14971509,
298. Wang, X., Mader, M. M., Toth, J. E., Yu, X., Jin, N.,
doi: 10.1007/s40279 015 0366 z.
Campbell, R. M., Smallwood, J. K., Christe, M. E.,
285. Johanns, M., Pyr Dit Ruys, S., Houddane, A.,
Chatterjee, A., Goodson, T., Jr., Vlahos, C. J., Matter, W. F.,
Vertommen, D., Herinckx, G., Hue, L., Proud, C. G., and
and Bloem, L. J. (2005) Complete inhibition of anisomycin
Rider, M. H. (2017) Direct and indirect activation of
and UV radiation but not cytokine induced JNK and p38
eukaryotic elongation factor 2 kinase by AMP activated
activation by an aryl substituted dihydropyrrolopyrazole
protein
kinase,
Cell.
Signal.,
36,
212221,
quinoline and mixed lineage kinase 7 small interfering
doi: 10.1016/j.cellsig.2017.05.010.
RNA, J. Biol. Chem., 280, 19298 19305, doi: 10.1074/
286. Sitron, C. S., and Brandman, O. (2020) Detection and
jbc.M413059200.
degradation of stalled nascent chains via ribosome associ
299. Sauter, K. A., Magun, E. A., Iordanov, M. S., and Magun,
ated quality control, Annu. Rev. Biochem., 89, 417 442,
B. E. (2010) ZAK is required for doxorubicin, a novel
doi: 10.1146/annurev biochem 013118 110729.
ribotoxic stressor, to induce SAPK activation and apopto
287. Iordanov, M. S., Pribnow, D., Magun, J. L., Dinh, T. H.,
sis in HaCaT cells, Cancer Biol. Ther., 10, 258 266,
Pearson, J. A., Chen, S. L., and Magun, B. E. (1997)
doi: 10.4161/cbt.10.3.12367.
Ribotoxic stress response: activation of the stress activated
300. Wolfson, R. L., and Sabatini, D. M. (2017) The dawn of
protein kinase JNK1 by inhibitors of the peptidyl trans
the age of amino acid sensors for the mTORC1 pathway,
ferase reaction and by sequence specific RNA damage to
Cell Metab., 26, 301 309, doi 10.1016/j.cmet.2017.07.001.
the alpha sarcin/ricin loop in the 28S rRNA, Mol. Cell.
301. Bhat, M., Robichaud, N., Hulea, L., Sonenberg, N.,
Biol., 17, 3373 3381, doi: 10.1128/mcb.17.6.3373.
Pelletier, J., and Topisirovic, I. (2015) Targeting the trans
288. Shifrin, V. I., and Anderson, P. (1999) Trichothecene
lation machinery in cancer, Nat. rev. Drug Discov., 14, 261
mycotoxins trigger a ribotoxic stress response that activates
278, doi: 10.1038/nrd4505.
c Jun N terminal kinase and p38 mitogen activated pro
302. Gilles, A., Frechin, L., Natchiar, K., Biondani, G.,
tein kinase and induces apoptosis, J. Biol. Chem., 274,
Loeffelholz, O. V., Holvec, S., Malaval, J. L., Winum, J. Y.,
13985 13992, doi: 10.1074/jbc.274.20.13985.
Klaholz, B. P., and Peyron, J. F. (2020) Targeting the
289. He, K., Zhou, H. R., and Pestka, J. J. (2012) Targets and
human 80S ribosome in cancer: from structure to function
intracellular signaling mechanisms for deoxynivalenol
and drug design for innovative adjuvant therapeutic strate
induced ribosomal RNA cleavage, Toxicol. Sci., 127, 382
gies, Cells, 9, 629, doi: 10.3390/cells9030629.
390, doi: 10.1093/toxsci/kfs134.
303. Osterman, I. A., Bogdanov, A. A., Dontsova, O. A.,
290. He, K., Zhou, H. R., and Pestka, J. J. (2012) Mechanisms for
and Sergiev, P. V. (2016) Techniques for screening
ribotoxin induced ribosomal RNA cleavage, Toxicol. Appl.
translation inhibitors, Antibiotics, 5, 22, doi: 10.3390/
Pharmacol., 265, 10 18, doi: 10.1016/j.taap.2012.09.017.
antibiotics5030022.
291. Yang, G. H., Jarvis, B. B., Chung, Y. J., and Pestka, J. J.
304. Ivanenkov, Y. A., Zhavoronkov, A., Yamidanov, R. S.,
(2000) Apoptosis induction by the satratoxins and other tri
Osterman, I. A., Sergiev, P. V., Aladinskiy, V. A.,
chothecene mycotoxins: relationship to ERK, p38 MAPK,
Aladinskaya, A. V., Terentiev, V. A., Veselov, M. S., Ayginin,
and SAPK/JNK activation, Toxicol. Appl. Pharmacol., 164,
A. A., Kartsev, V. G., Skvortsov, D. A., Chemeris, A. V.,
149 160, doi: 10.1006/taap.1999.8888.
Baimiev, A. K., Sofronova, A. A., Malyshev, A. S., Filkov,
292. Li, M., and Pestka, J. J. (2008) Comparative induction of
G. I., Bezrukov, D. S., Zagribelnyy, B. A., Putin, E. O., et
28S ribosomal RNA cleavage by ricin and the tri
al. (2019) Identification of novel antibacterials using
chothecenes deoxynivalenol and T 2 toxin in the
machine learning techniques, Front. Pharmacol., 10, 913,
macrophage, Toxicol. Sci., 105, 67 78, doi: 10.1093/toxsci/
doi: 10.3389/fphar.2019.00913.
kfn111.
305. Blanchard, S. C., Cooperman, B. S., and Wilson, D. N.
293. Lee, K. H., Nishimura, S., Matsunaga, S., Fusetani, N.,
(2010) Probing translation with small molecule inhibitors,
Ichijo, H., Horinouchi, S., and Yoshida, M.
(2006)
Chem. Biol., 17, 633 645, doi: 10.1016/j.chembiol.2010.
Induction of a ribotoxic stress response that stimulates
06.003.
БИОХИМИЯ том 85 вып. 11 2020
ИНГИБИТОРЫ ЭУКАРИОТИЧЕСКОЙ ТРАНСЛЯЦИИ
1675
A QUICK GUIDE TO SMALL/MOLECULE INHIBITORS
OF EUKARYOTIC PROTEIN SYNTHESIS*
Review
S. E. Dmitriev1,2,3**, D. O. Vladimirov2, and K. A. Lashkevich1
1 Belozersky Institute of Physico Chemical Biology, Lomonosov Moscow State University,
119234 Moscow, Russia; E mail: sergey.dmitriev@belozersky.msu.ru
2 Faculty of Bioengineering and Bioinformatics, Lomonosov Moscow State University, 119234 Moscow, Russia
3 Engelhardt Institute of Molecular Biology, Russian Academy of Sciences, 119991 Moscow, Russia
Received August 26, 2020
Revised October 04, 2020
Accepted October 04, 2020
The eukaryotic ribosome and cap dependent translation machinery are attractive targets for antitumor, antiviral, anti
inflammatory, and antiparasitic therapies. A wide range of small molecule drugs specifically inhibiting protein biosyn
thesis in eukaryotic cells is currently known. A large number of such compounds are found among the well studied
ribosome targeting antibiotics, which include drugs inhibiting translocation, blocking the peptidyltransferase center
or the ribosomal peptide tunnel, inducing miscoding, premature termination and stop codon readthrough, or modu
lating ribosomal binding of translation machinery components. Small molecule inhibitors of aminoacyl tRNA syn
thetases, translation factors, and translation associated signaling pathways, including mTOR kinase, are also in focus.
Ribosome targeting inhibitors are widely used in gene expression analysis by ribosome profiling, in cell culture tech
niques, as fungicides in agriculture, as anthelmintic and antifungal agents in medicine. Substances that affect the
accuracy of stop codon recognition are promising drugs for nonsense suppression therapy of hereditary diseases and
for restoring the function of tumor suppressors in cancer cells. Some translation inhibitors have geroprotective prop
erties. In this review, we present a list of both well studied and less well known inhibitors of eukaryotic protein syn
thesis (with the exception of translation in mitochondria and plastids), supplemented by information on their direct
targets and a brief description of their mechanisms of action. We also present a continuously updated database, cur
msu.ru/.
Keywords: small molecular drugs, 40S and 60S ribosomal subunits, 4E BP1, eIF2 phosphorylation, ribotoxic stress,
cycloheximide, harringtonine, trichothecene mycotoxins, aminoglycosides, rapamycin
БИОХИМИЯ том 85 вып. 11 2020
11*