БИОХИМИЯ, 2020, том 85, вып. 11, с. 1676 - 1689
УДК 577.052.2
ОСОБЕННОСТИ АКТИВАЦИИ ГИДРОЛИТИЧЕСКОЙ
АКТИВНОСТИ ФАКТОРОВ ЭЛОНГАЦИИ
Обзор
© 2020
Е.В. Полесскова, М.Ю. Каюмов, С.В. Кириллов, А.Л. Коневега*
Петербургский институт ядерной физики им. Б. П. Константинова
Национального исследовательского центра «Курчатовский институт», 188300 Гатчина,
Ленинградская обл., Россия; электронная почта: konevega_al@pnpi.nrcki.ru
Поступила в редакцию 05.07.2020
После доработки 01.08.2020
Принята к публикации 01.08.2020
Трансляционные ГТФазы (трГТФазы), относящиеся к классу G белков, играют ключевую роль на всех эта
пах биосинтеза белка на рибосоме. Однонаправленность и цикличность функционирования G белков
обеспечивается возможностью их переключения между активным и неактивным состояниями вследствие
гидролиза ГТФ, ускоряемого вспомогательными белками стимуляторами ГТФазной активности. Несмотря
на то что трГТФазы взаимодействуют с рибосомами, находящимися в разных конформационных состояни
ях, для активации они связываются с одной и той же консервативной областью, которая, в отличие от клас
сических белков стимуляторов ГТФазной активности, представлена РНК. В результате у всех факторов
элонгации образуется практически одинаковая структура активного каталитического центра, предполагаю
щая единый механизм реакции гидролиза ГТФ. Однако нюансы в процессе формирования активированно
го состояния, а также существенно отличающаяся скорость реакции гидролиза ГТФ указывают на сущест
вование особенностей при реализации гидролитической функции разными факторами элонгации. В дан
ной работе представлено современное видение механизмов регулирования ГТФазной активности факторов
элонгации EF Tu, EF G и SelB и гидролиза ГТФ, основанное на анализе структурных, биохимических и био
информатических данных.
КЛЮЧЕВЫЕ СЛОВА: факторы элонгации, трансляция, гидролиз ГТФ, EF Tu, EF G, SelB, рибосома.
DOI: 10.31857/S032097252011010X
ВВЕДЕНИЕ
тивным ГДФ связанным состояниями [4-6].
Переходы между этими двумя конформациями
Гидролиз ГТФ является ключевой реакцией
регулируются гидролизом ГТФ, который в ряде
на всех этапах биосинтеза белка [1, 2]. На рибо
случаев может ускоряться с помощью вспомога
соме эта реакция катализируется филогенети
тельных белков, стимулирующих ГТФазную ак
чески связанными белковыми факторами,
тивность G белков [5, 6].
трансляционными ГТФазами (трГТФазами),
Несмотря на различия в аминокислотной
представителями семейства которых являются
последовательности, структура Ras подобного
бактериальные факторы EF Tu, EF G, IF2, RF3,
нуклеотид связывающего G домена схожа у
LepA, SelB и их гомологи у архей и эукариот, а
всех ГТФаз. В его состав входят пять консерва
также некоторые другие белки [3]. Это семей
тивных областей, которые обеспечивают взаи
ство, в свою очередь, входит в состав суперсе
модействие с гуаниновым нуклеотидом [7, 8].
мейства ГТФ гидролизующих белков или G
G1 область - фосфат связывающая петля (P
белков, являющихся регуляторными молеку
петля) - связывает α и β фосфаты гуанинового
лярными переключателями, которые циркули
нуклеотида. G2 и G3 области - регионы switch I
руют между активным ГТФ связанным и неак
и switch II - взаимодействуют с γ фосфатом,
белками стимуляторами ГТФазной активности
Принятые сокращения: трГТФазы - трансляцион
и претерпевают значительные конформацион
ные ГТФазы; СРП - сарцин рициновая петля; GTPγS - ные изменения при гидролизе ГТФ [9]. G4 и G5
гуанозин 5′ O [γ тио]трифосфат; PDB - Protein Data
отвечают за связывание гуанинового основания,
Bank; ID - идентификационный код; Sec - селеноцисте
ин, 21 я протеиногенная аминокислота; SECIS - Sec
обеспечивая субстратную специфичность.
Insertion Sequence; аа тРНК - аминоацил тРНК.
Многолетние биохимические, генетические
* Адресат для корреспонденции.
и структурные исследования позволили иденти
1676
ГТФазная АКТИВНОСТЬ ФАКТОРОВ ЭЛОНГАЦИИ
1677
фицировать ключевые элементы, входящие в
рибосомы взаимодействует и инвариантный
состав каталитического центра трГТФаз. На
His84, предположительно выполняющий ката
конце региона switch II после глицинового ос
литическую роль [17, 22]. Анализ структурных и
татка консервативного мотива DXXG находится
биохимических данных показал, что СРП выс
остаток инвариантного для трГТФаз гистиди
тупает не только в роли платформы для эффек
на - His84 (нумерация а.о. трГТФаз здесь и да
тивного связывания трГТФаз с рибосомой [28,
лее по тексту приводится в соответствии с пос
29], но и участвует в регулировании их ГТФаз
ледовательностью EF Tu из Escherichia coli, если
ной активности [28, 30, 31]. Это позволяет пред
не указано иное) [4, 10]. Замена этого остатка
положить, что, в отличие от множества G бел
гистидина в факторах элонгации EF Tu и EF G
ков, для запуска эффективного гидролиза ГТФ
на другие а.о. приводит к ингибированию сти
которых необходимы белки, стимулирующие их
мулированной рибосомой реакции гидролиза
ГТФазную активность [7, 8], трГТФазы взаимо
ГТФ [11-16]. В структурных работах, визуали
действуют с РНК рибосомы, обеспечивающей
зирующих рибосомные комплексы, содержа
катализ или конформационные перегруппиров
щие элонгационные факторы EF Tu, EF G и
ки трГТФаз, необходимые для реакции гидро
SelB в активированном состоянии, остатки гис
лиза ГТФ [30, 31].
тидина обнаруживаются в схожих конформаци
Анализ структурных данных выявил, что
ях, направленных на γ фосфат ГТФ через так
консервативный остаток гистидина взаимодей
называемые «гидрофобные ворота» [17-23]. Ос
ствует с кислородом фосфатной группы A2662
новываясь на данных рентгеноструктурного
не только в случае EF Tu [17, 22, 32], но и в фак
анализа комплекса EF Tu с аналогом ГТФ β γ
торе EF G [19, 26, 33]. В результате появилась
метиленгуанозин 5′ трифосфатом (GDPCP) и
гипотеза об универсальном механизме, при реа
рибосомой, было предложено, что His84
лизации которого A2662 СРП переориентирует
действует как каталитический остаток, который
остаток His84 по сравнению с его положением в
депротонирует молекулу воды для атаки на связь
не связанном с рибосомой факторе таким обра
между β и γ фосфатами ГТФ [17]. Были также
зом, что остаток His84 может координировать
представлены и альтернативные механизмы, в
молекулу воды для атаки на γ фосфат ГТФ. По
которых His84 играет стабилизирующую роль
зиционирование боковой цепи остатка His84 в
для воды, выступающей в роли нуклеофила [24,
ГТФазном центре может приводить к повыше
25]. Дополнительная координация этой молеку
нию значения его константы диссоциации (pKa)
лы воды осуществляется за счёт водородных
вследствие локализации нескольких отрица
связей с остатками Thr61 из региона switch I и
тельных зарядов в непосредственной близости
глицина Gly83 из региона switch II, находящих
[34]. Это могло бы быть дополнительным под
ся в непосредственной близости от γ фосфата
тверждением того, что остаток His84 действует
ГТФ (рис. 1) [17, 20, 26]. Помимо регионов
как каталитическое основание для отрыва про
switch I и switch II в позиционировании гуани
тона и активации воды, выступающей в роли
нового нуклеотида внутри фактора участвуют
нуклеофила для реакции гидролиза ГТФ на ри
а.о. P петли. К ним относится остаток аспараги
босоме (рис. 2, а) [17]. Для реализации такого
новой кислоты Asp21 и универсально консерва
механизма молекула воды, быстро протонирую
тивная последовательность GKT, существующая
щая His84, должна оставаться в ГТФазном цент
не только в трГТФазах, но и во всех G белках
ре в виде гидроксид иона вблизи отрицательно
[27]. Asp21 занимает крайне важное положение -
заряженного γ фосфата достаточно долго для
он координирует вторую молекулу воды над γ
того, чтобы произошла относительно медленная
фосфатом ГТФ в EF G [19] и образует водород
нуклеофильная атака. Однако из за сильного
ные связи с кислородом, расположенным между
электростатического отталкивания связывание
β и γ фосфатами в EF Tu [17] и немостиковыми
гидроксид иона с γ фосфатом, вероятно, будет
кислородами этих фосфатов в SelB [20]. Атомы
очень нестабильным [35], и с высокой вероят
кислорода β и γ фосфатов дополнительно ко
ностью гидроксид ион будет замещен на моле
ординируются ионом Mg2+, который, по види
кулу воды растворителя в более короткие сро
мому, также помогает ГТФ принять правильную
ки, чем произойдет реакция гидролиза ГТФ [25].
конформацию для осуществления гидролиза
Молекула воды, скорее всего, ориентирова
[17]. Ещё один ион Mg2+ находится в положе
на таким образом, что ее атомы водорода нап
нии, связывающем Asp P петли и остаток A2662
равлены в сторону от His84 и образуют водород
консервативной области большой субъединицы
ные связи с карбонильным кислородом Thr61 и
рибосомы сарцин рициновой петли (СРП) в ас
одним из атомов кислорода γ фосфата, учиты
социированных с рибосомой комплексах SelB и
вая небольшое расстояние между нуклеофиль
EF G [19, 20]. С остатками именно этой области
ной молекулой воды и фосфатом. При этом тес
БИОХИМИЯ том 85 вып. 11 2020
1678
ПОЛЕССКОВА и др.
ный контакт между водой и ND1 His84 указыва
котором His84 выступает в качестве каталити
ет на то, что остаток гистидина, находясь в про
ческого основания в этом диапазоне значений
тонированной форме, образует водородную
рН [11, 12]. Причем похожие результаты были
связь с кислородом молекулы воды, тогда как
получены как для реакции гидролиза ГТФ, так и
азот другой боковой цепи образует водородную
в случае использования аналога ГТФ гуанозин
связь с фосфатной группой A2662 [25].
5′ O [γ тио]трифосфата (GTPγS), что подчерки
Более того, изучение зависимости гидроли
вает корректность использования этого аналога
тической активности EF Tu на рибосоме от pH
ГТФ в данной реакции. Примечательно, что
не обнаружило таковой в диапазоне рН 6,0-8,5,
конформационные изменения в SelB, индуци
что служит аргументом против механизма, при
руемые взаимодействием с GTPγS, в значитель
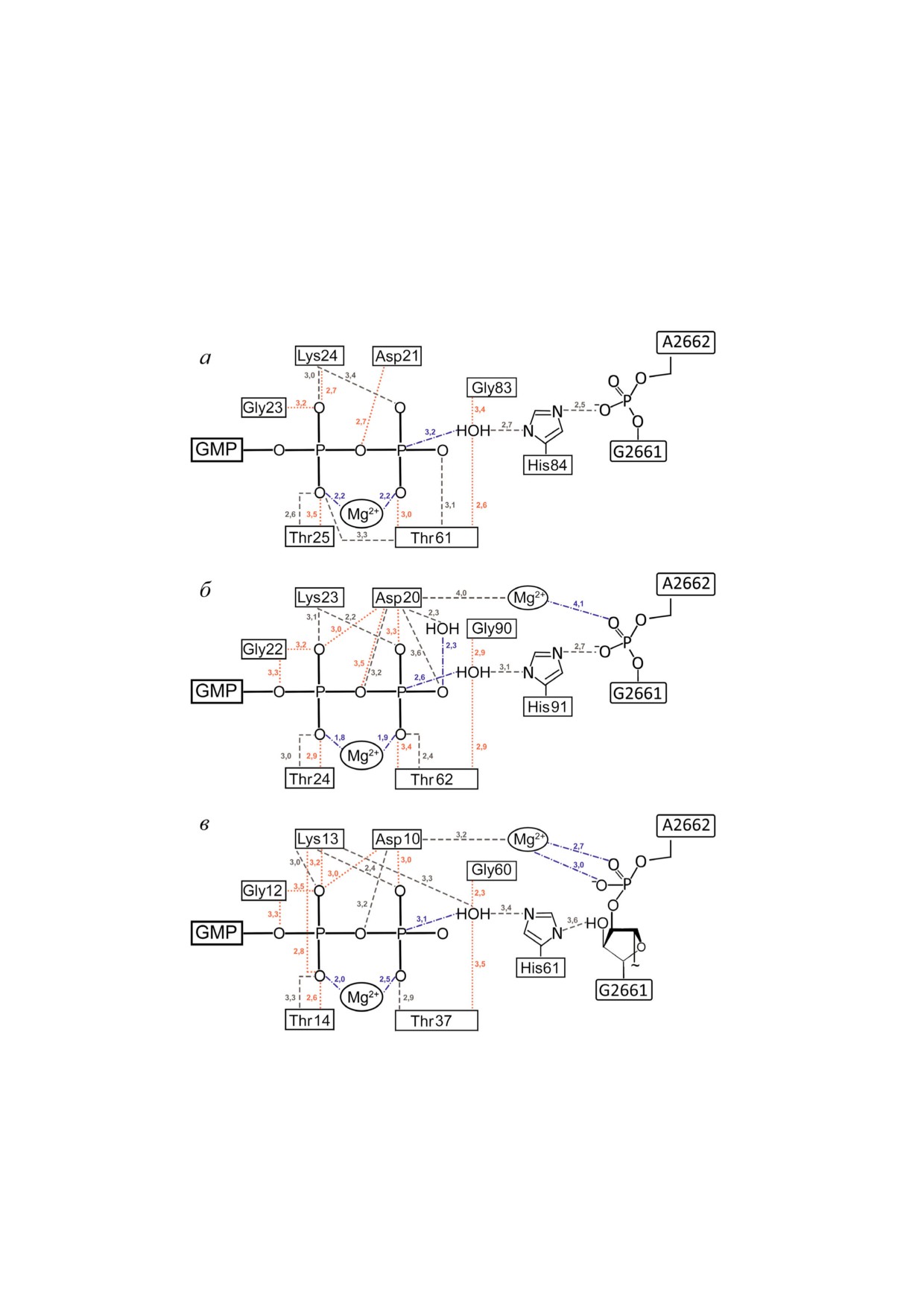
Рис. 1. Схематическое изображение активированного рибосомой нуклеотид связывающего сайта EF Tu (Protein Data
Bank (PDB) идентификационный (ID) код 4v5l [17]) (a), EF G (PDB ID код 4v9h [19]) (б) и SelB (PDB ID код 5lzd [20]) (в)
с заменой аналогов ГТФ на ГТФ. Взаимодействия боковой группы а.о. (− −), пептидного остова а.о. (⋅ ⋅ ⋅), прочие взаимо
действия (− ⋅ −). Расстояния указаны в Å. Нумерация в соответствии с последовательностью аминокислот в элонгацион
ных факторах из E. coli. (С цветными вариантами рис. 1-4 можно ознакомиться в электронной версии статьи на сайте:
БИОХИМИЯ том 85 вып. 11 2020
ГТФазная АКТИВНОСТЬ ФАКТОРОВ ЭЛОНГАЦИИ
1679
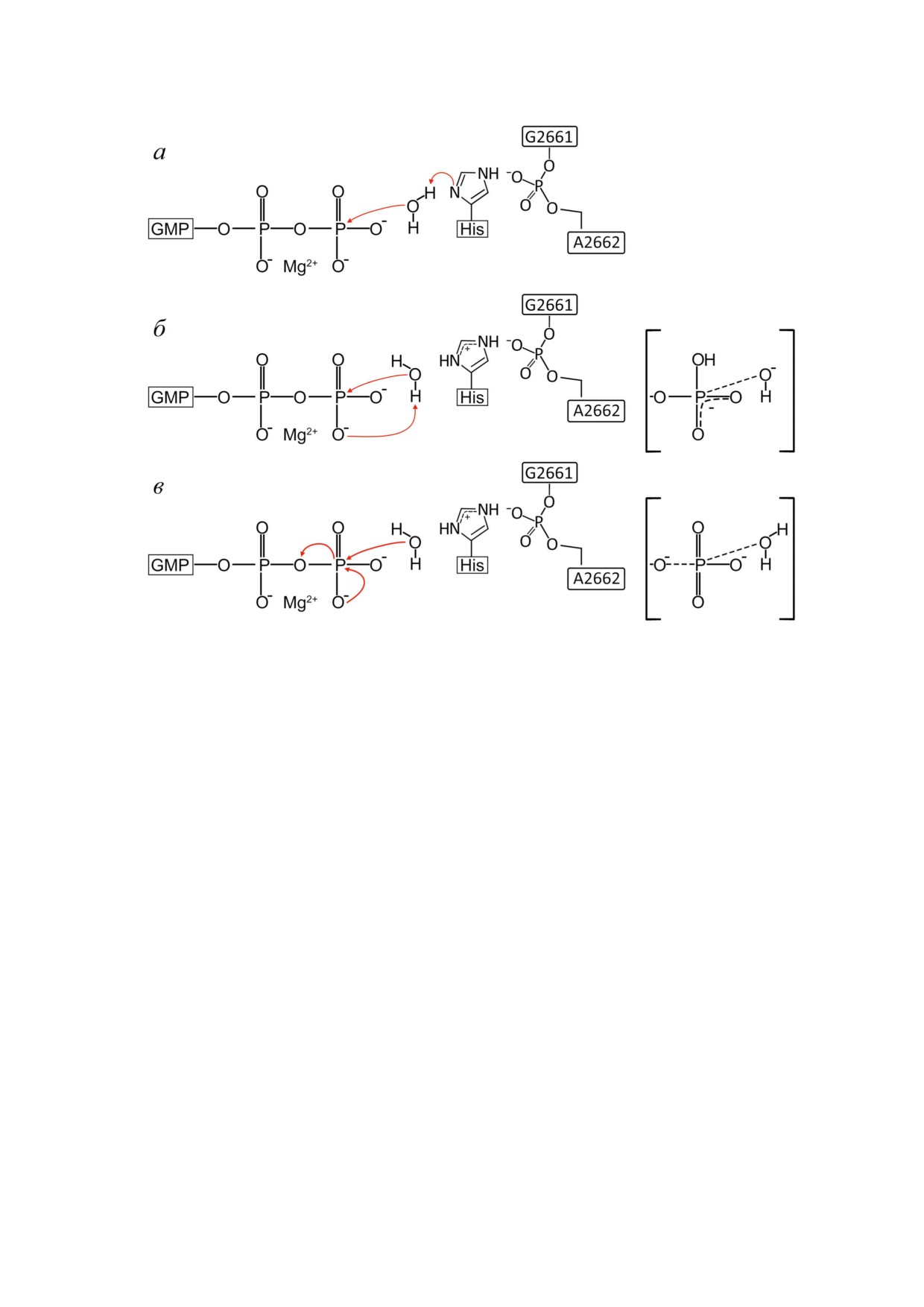
Рис. 2. Возможные механизмы реакции гидролиза ГТФ, соответствующие His84, выступающему в роли каталитического
основания (a), ассоциативному (б) и диссоциативному (в) вариантам. Переходные состояния ассоциативного и диссоци
ативного вариантов указаны структурами в скобках
ной степени соответствовали таковым в присут
диссоциативный путь, соответствует отрыву ме
ствии ГТФ [36]. Напротив, комплекс с другим
тафосфата с последующей атакой незаряженной
аналогом ГТФ, 5′ гуанилил имидодифосфатом
воды. В итоге перенос протона на уходящую
(GDPNP), больше напоминал неактивную кон
группу ГДФ будет происходить либо через кис
формацию белка SelB-ГДФ [36, 37]. Это указы
лород фосфата, либо при участии дополнитель
вает на то, что для обоих факторов элонгации,
ных молекул воды.
EF Tu и SelB, более предпочтительным анало
Несмотря на десятилетия исследований де
гом ГТФ является GTPγS.
тальный молекулярный механизм реакции гид
В свете приведенных выше аргументов наи
ролиза ГТФ до сих пор не до конца понятен и
более реалистичным представляется сценарий,
вызывает споры относительно пути протекания
при котором состояние активного комплекса
реакции и основы каталитической активности
соответствует структуре, в которой молекула во
ГТФаз. В этом обзоре приводятся результаты
ды находится между γ фосфатом и протониро
анализа современной литературы по теме сти
ванным остатком His84 [24]. Этот вариант пред
муляции ГТФазной активности трех факторов
полагает, что воздействие молекулы воды на
элонгации, EF Tu, EF G и SelB, а также меха
фосфат включает перенос протона от молекулы
низма реакции гидролиза ГТФ. Примечательно,
воды к одному из фосфатных кислородов, а не к
что существенно различающиеся аминокислот
остатку гистидина. Возможны два предельных
ные последовательности этих белков складыва
случая реализации такого механизма, соответ
ются в схожие структуры G домена для того,
ствующих ассоциативному и диссоциативному
чтобы обеспечить взаимодействие функцио
путям (рис. 2, б и в) [38, 39]. Ассоциативный
нально различных элонгационных факторов с
путь включает перенос протона на немостико
одной и той же областью рибосомы и образовать
вый кислород фосфата с последующей атакой
практически одинаковые каталитические сай
гидроксид иона. Второй предельный случай,
ты, позволяя предположить наличие общего ме
БИОХИМИЯ том 85 вып. 11 2020
1680
ПОЛЕССКОВА и др.
ханизма активации трГТФаз на рибосоме [2, 10].
G взаимодействует с рибосомой, что приводит к
Таким образом, данные, полученные для EF Tu,
быстрому протеканию реакции гидролиза ГТФ,
EF G и SelB, могут дополнять друг друга и спо
транслокации и последующему высвобождению
собствовать составлению более целостной кар
EF G-ГДФ и неорганического фосфата (Рi) из
тины функционирования трГТФаз на рибосоме.
рибосомы [51]. Учитывая схожую аффинность
EF G к ГТФ и ГДФ, кинетическую подвиж
ность комплекса фактора с нуклеотидом и высо
ФАКТОРЫ ЭЛОНГАЦИИ - G)БЕЛКИ
кую внутриклеточную концентрацию ГТФ,
фактор может спонтанно обменять ГДФ на ГТФ
В процессе биосинтеза белка удлинение по
без помощи фактора обмена нуклеотидов [52].
липептидной цепи происходит за счет цикли
Специализированный элонгационный фак
чески повторяющихся этапов декодирования
тор SelB в процессе рекодирования стоп кодона
(доставки аминоацил тРНК (аа тРНК) в А
UGA доставляет к рибосоме селеноцистеинило
сайт), образования пептидной связи и трансло
вую тРНК (SecтРНКSec) для встраивания нека
кации (перемещения рибосомы к следующему
нонической аминокислоты селеноцистеина
кодону мРНК). Высокая скорость и однонап
(Sec). SelB состоит из 4 доменов [53]. I-III доме
равленность цикла элонгации реализуется бла
ны структурно схожи с доменами EF Tu и вы
годаря функционированию трГТФаз факторов
полняют аналогичные функции: домен I (G до
элонгации: EF Tu, EF G и SelB.
мен) взаимодействует с гуаниновым нуклеоти
Элонгационный фактор EF Tu является од
дом и в комбинации со II и III доменами образу
ной из наиболее изученных трГТФаз. Он состо
ет область для связывания тРНК. IV домен уни
ит из трех доменов: домена I (G домена), кото
кален и не встречается в других трГТФазах, он
рый связывает гуаниновый нуклеотид, и двух β
обеспечивает взаимодействие фактора со спе
цилиндров - доменов II и III, которые вместе с
цифической вторичной структурой мРНК, так
доменом I обеспечивают поверхность связыва
называемым SECIS элементом (Sec Inserting
ния для акцепторной области аа тРНК [40]. В
Sequence), который у бактерий располагается
своей активной ГТФ связанной форме EF Tu
сразу после UGA кодона и определяет встраива
образует высокоаффинный комплекс с aa тРНК
ние Sec [54]. В отсутствие шпилькообразной
и доставляет ее в A сайт рибосомы [23, 41, 42].
SECIS структуры в мРНК кодон будет распоз
Распознавание кодона мРНК антикодоном
наваться как терминирующий. В своей актив
тРНК приводит к быстрому гидролизу ГТФ [43,
ной SelB-ГТФ форме фактор связывает
44]. При этом значительные конформационные
SecтРНКSec с экстраординарно высокой аффин
изменения EF Tu вызывают высвобождение ак
ностью (0,2 пM), что обеспечивает защиту ла
цепторного стебля aa тРНК из EF Tu и последу
бильного остатка Sec от преждевременного гид
ющую диссоциацию EF Tu-ГДФ из рибосомы
ролиза и окисления [55]. Нахождение тРНК ас
[21, 45]. Рециркуляция неактивной (связанной с
социированного фактора в непосредственной
ГДФ) формы EF Tu в EF Tu-ГТФ катализирует
близости от Sec встраивающего кодона обеспе
ся фактором обмена нуклеотидов EF Ts [46, 47].
чивается благодаря взаимодействию IV домена
Фактор элонгации EF G состоит из 5 доме
SelB со вторичной структурой мРНК. Гидролиз
нов
[48]. Домен I (G домен) связывает
ГТФ фактором после распознавания кодона
ГТФ/ГДФ и вместе с доменом II образует струк
мРНК приводит к высвобождению и аккомода
турный супердомен, характерный для многих
ции тРНК на рибосоме, SelB-ГДФ теряет аф
трГТФаз. Домены III-V специфичны для EF G
финность к рибосоме и шпильке мРНК и дис
и необходимы для выполнения основной функ
социирует [20]. В свободном состоянии SelB
ции фактора - транслокации тРНК и экспони
легко обменивает ГДФ на ГТФ, так как обладает
рования нового кодона мРНК в вакантном А
к последнему более высокой аффинностью
сайте рибосомы. Помимо канонической функ
[54, 55].
ции по активации транслокации EF G также
Несмотря на различные функции факторов
участвует в рециркуляции рибосом - процессе,
элонгации, наличие общей области связывания
при котором рибосома после окончания синтеза
с рибосомой, СРП рРНК, и схожее строение ка
полипептидной цепи диссоциирует на малую и
талитического сайта позволяют предположить
большую рибосомные субъединицы для подго
единый механизм активации гидролитической
товки к трансляции следующей мРНК [49]. У
активности трГТФаз на рибосоме. При этом ме
большинства бактерий обе функции выполня
ханизм реакции гидролиза ГТФ факторами в
ются одним белком, однако в ряде случаев эти
свободном состоянии вне рибосомы (спонтан
функции разделены между продуктами парало
ный гидролиз) может отличаться от такового на
гичных генов [50]. В ГТФ связанной форме EF
рибосоме.
БИОХИМИЯ том 85 вып. 11 2020
ГТФазная АКТИВНОСТЬ ФАКТОРОВ ЭЛОНГАЦИИ
1681
СПОНТАННЫЙ ГИДРОЛИЗ ГТФ
ся ли SelB в свободном состоянии [59] или свя
ФАКТОРАМИ ЭЛОНГАЦИИ
зан с рибосомой (рис. 3, в и е) [20]. Более того,
анализ молекулярной динамики SelB-ГТФ-
Трансляционные ГТФазы обладают низкой
SecтРНКSec в растворе предполагает, что инва
спонтанной активностью гидролиза ГТФ, что,
риантный His61 способен быстро колебаться
безусловно, оправдано с энергетической точки
между неактивной (направленной в сторону от
зрения. Изучение процесса гидролиза ГТФ фак
γ фосфата) и активной (направленной к γ фос
торами элонгации вне рибосомы, вероятно, не
фату) конформациями, а остатки Val9 и Met36,
имеющего функционального значения в реаль
гомологичные остаткам «гидрофобных ворот» в
ных условиях, может дать представление о меха
EF Tu и EF G, могут свободно раздвигаться
низме катализа и быть интересным с эволюци
[20]. Эти данные указывают на то, что, в отличие
онной точки зрения.
от EF Tu, в EF G и SelB «гидрофобные ворота»
Во всех известных структурах свободных
не блокируют возможность взаимодействия
ГТФ связанных факторов EF Tu [56, 57], EF G
предположительно каталитического остатка
[58] и SelB [37, 59], а также в составе тройного
гистидина с γ фосфатом ГТФ. Возможно, имен
комплекса, состоящего из EF Tu, ГТФ и аа
но с этим связан тот факт, что при переходе от
тРНК [41], His84 ориентирован в направлении
активированной рибосомой реакции к
от γ фосфата и не образует необходимых для ак
собственной гидролитической активности фак
тивации реакции гидролиза взаимодействий
тора скорость гидролиза EF Tu-ГТФ снижается
(рис. 3, а-в). В структуре свободного фактора в
на семь порядков [12], тогда как для EF G и SelB
активной конформации EF Tu-ГТФ вращение
это значение достигает лишь четырех порядков
боковой цепи His84 в направлении активного
[13, 20]. Таким образом, механизм реакции
сайта затруднено остатками Val20 и Ile60, кото
спонтанного гидролиза элонгационными фак
рые также называют «гидрофобными воротами»
торами может различаться, несмотря на высо
[6]. Функция данных остатков в случае свобод
кую степень консерватизма в структуре ГТФ
ного фактора в растворе - препятствие позицио
связывающего домена. His84, скорее всего, не
нированию молекулы воды между консерватив
участвует в катализе реакции гидролиза ГТФ
ным гистидином и ГТФ, а в случае фактора в
свободным EF Tu, однако может принимать
комплексе с рибосомой - приближение избы
участие в формировании каталитического цент
точных молекул растворителя к реакционному
ра в случае EF G и SelB. Увеличение скорости
центру. Таким образом, в несвязанном с рибосо
реакции гидролиза EF G-ГТФ и SelB при взаи
мой EF Tu переориентация His84 в направле
модействии с рибосомой на четыре порядка мо
нии γ фосфата невозможна, и His84 не участву
жет объясняться дополнительной стабилизаци
ет в катализе (рис. 3, а и г). Данные анализа мо
ей активированного состояния, отсутствующей
дифицированных вариантов фактора EF Tu
в случае свободных факторов. Для подтвержде
подтвердили данное предположение, продемон
ния этой теории необходимы дальнейшие
стрировав, что замена важного для активации
структурные и биохимические исследования,
реакции гидролиза ГТФ на рибосоме остатка
поскольку на данный момент существуют неко
His84 на ряд аминокислот не приводит к суще
торые расхождения в данных, не позволяющие
ственному изменению скорости спонтанного
однозначно установить возможность участия
гидролиза EF Tu-ГТФ вне рибосомы [12].
гистидина в реакции гидролиза ГТФ в свобод
Достаточно распространенной является точ
ном EF G. Так, результаты исследования Cunha
ка зрения о том, что сомкнутые «гидрофобные
et al. [14] демонстрируют полное исчезновение
ворота» препятствуют активации гидролиза
гидролитической активности EF G даже в при
ГТФ не только в случае EF Tu, но и в случае дру
сутствии рибосом в случае замены His на Ala,
гих элонгационных факторов, в частности EF G
тогда как в исследовании, проведенном
[13]. Однако в большинстве имеющихся прост
Koripella et al. [13], аналогичная замена приво
ранственных структур свободного фактора EF
дит лишь к десятикратному снижению скорости
G данные гидрофобные а.о. не разрешены [60,
реакции гидролиза ГТФ фактором EF G на ри
61], а в единственной структуре с разрешенны
босомах и практически не имеет эффекта в слу
ми «гидрофобными воротами» [58] данные ос
чае свободного фактора. Экспериментальное
татки располагаются довольно далеко от остатка
подтверждение потенциальной роли консерва
гистидина и не могут препятствовать активации
тивного остатка His в гидролизе ГТФ SelB пока
гидролиза ГТФ фактором вне рибосомы (рис. 3, б).
отсутствует.
В случае SelB гомологичные остатки находятся
Возможность разных вариантов механизма
приблизительно на одинаковом расстоянии
гидролиза изолированными факторами можно
друг от друга вне зависимости от того, находит
объяснить различиями в каталитическом центре
БИОХИМИЯ том 85 вып. 11 2020
1682
ПОЛЕССКОВА и др.
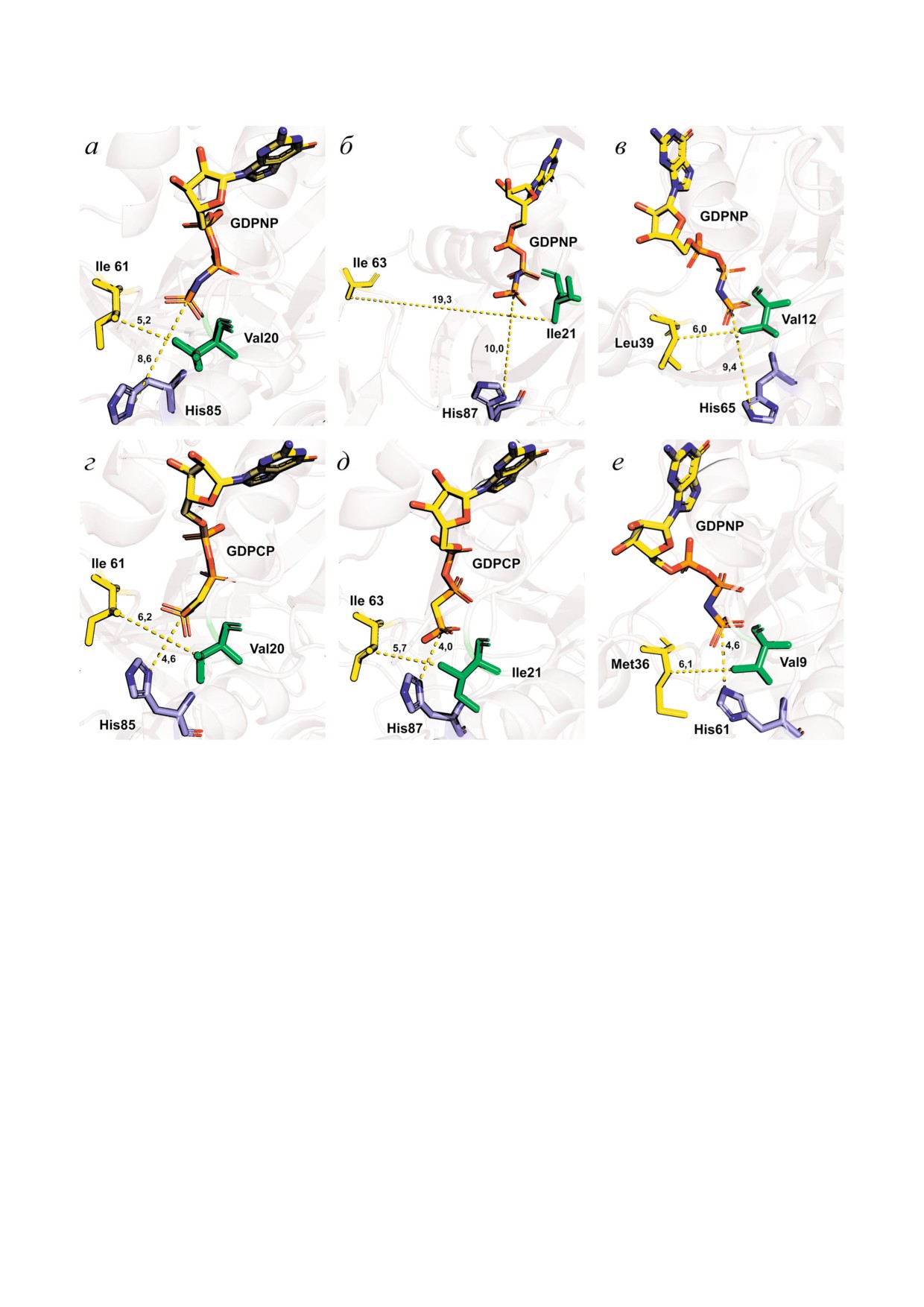
Рис. 3. Взаимное расположение остатка инвариантного His, аналога ГТФ и а.о. «гидрофобных ворот» EF Tu (PDB ID код
1exm [57]) (a), EF G (PDB ID код 2bv3 [58]) (б) и SelB (PDB ID код 4zu9 [59]) (в) в изолированном состоянии, EF Tu (PDB
ID код 4v5l [17]) (г), EF G (PDB ID код 4v90 [18]) (д) и SelB (PDB ID код 5lzd [20]) (е) в связанном с рибосомой состоя
нии. Расстояния указаны в Å
EF Tu и EF G. Так, критически важный для ре
Активация достигается благодаря связыванию
акции гидролиза на рибосоме остаток Asp21 Р
моновалентного катиона между консерватив
петли находится в активированном положении в
ным остатком Asp и инвариантным остатком Gly
EF Tu как на рибосоме, так и в свободном со
в регионе switch II [63], тогда как замена Asp на
стоянии, тогда как в EF G правильная ориента
Ala приводит к неспособности модифицирован
ция данного остатка достигается только при взаи
ного варианта белка координировать ион K+,
модействии фактора с рибосомами [19]. В отли
что нивелирует стимулирующий эффект [12].
чие от His84, Asp21, вероятно, участвует в реак
Таким образом, можно предположить, что
ции гидролиза EF Tu-ГТФ вне рибосомы, так
механизмы спонтанной гидролитической ак
как при замене остатка His скорость реакции
тивности могут различаться для разных факто
спонтанного гидролиза EF Tu практически не
ров. И если для EF G и SelB есть основания по
изменяется, тогда как замена Asp21 на ряд ами
лагать, что важным является остаток His регио
нокислот приводит к снижению гидролитичес
на switch II, то для спонтанной гидролитической
кой активности фактора вне рибосомы [12]. Бо
активности EF Tu большее значение имеет ос
лее того, было показано, что ион K+ играет роль
таток Asp21 P петли. Однако нельзя исключать
структурного кофактора и стимулирует
и вариант, при котором ни один из этих остат
собственную ГТФазную активность EF Tu [62].
ков не участвует в реакции гидролиза ГТФ изо
БИОХИМИЯ том 85 вып. 11 2020
ГТФазная АКТИВНОСТЬ ФАКТОРОВ ЭЛОНГАЦИИ
1683
лированными факторами элонгации, а процесс
тРНК к транслирующей рибосоме приводит к
реализуется по некоторому иному, пока не иден
возникновению дополнительных контактов ан
тифицированному механизму.
тикодона тРНК с кодоном мРНК, экспониро
ванным в А сайте рибосомы [17, 22, 44]. Именно
корректное кодон антикодоновое взаимодей
ВНЕШНЯЯ СТИМУЛЯЦИЯ ГТФазной
ствие является триггером продуктивных кон
АКТИВНОСТИ ФАКТОРОВ ЭЛОНГАЦИИ
формационных перестроек в тРНК, рибосоме и
EF Tu, ведущих к активации ГТФазной функ
Достаточно низкая спонтанная гидролити
ции. Закрепление антикодона тРНК в центре
ческая активность трГТФаз значительно стиму
декодирования на 30S рибосомной субъединице
лируется при взаимодействии с СРП 23S рРНК
приводит к деформации молекулы тРНК [66], в
большой рибосомной субъединицы [17, 31, 64],
результате которой происходит приближение
которая представляет собой одну из наиболее
EF Tu к СРП [21] и, вероятно, изменение кон
высоко консервативных последовательностей
формации региона switch II с переориентацией
рРНК. Конец этой петли близко подходит к свя
незаменимого остатка His84 EF Tu [43]. В таком
занной молекуле ГТФ в соответствующих G до
активированном состоянии боковая цепь His84
менах трГТФаз [17, 64].
направлена на γ фосфат ГТФ через «гидрофоб
Помимо взаимодействия с СРП, трГТФазы
ные ворота» и образует водородные связи с нук
могут иметь дополнительные элементы, стиму
леофильной молекулой воды и с фосфатным
лирующие ГТФазную активность, что является
кислородом нуклеотида A2662 СРП (рис. 1, а и
принципиальным для выполнения их функции.
3, г) [17, 22]. Дополнительную стабилизацию
Так, поскольку основная функция EF Tu - дос
конформации переходного состояния фактора
тавка аа тРНК для удлинения полипептидной
осуществляют нуклеотиды СРП 23S рРНК боль
цепочки, важной дополнительной детерминан
шой субъединицы рибосомы, обширные взаи
той является кодон антикодоновое взаимодей
модействия которых с switch регионами домена
ствие, обеспечивающее распознавание коррект
G были визуализированы при помощи рекон
ной аминокислоты. Поэтому взаимодействие
струкции методом криоэлектронной микроско
EF Tu с вакантными рибосомами приводит
пии структуры тройного комплекса на рибосоме
лишь к некоторому стимулирующему эффекту,
в момент после реакции гидролиза ГТФ, но до
тогда как максимальное значение активации
конформационной перегруппировки в ГДФ
гидролиза (ускорение реакции гидролиза на
форму [32, 67]. Гидролиз ГТФ дестабилизирует
шесть порядков) достигается в том случае, ког
switch регион EF Tu [45, 68], приводит к ослаб
да, помимо взаимодействия с СРП, происходит
лению взаимодействия фактора элонгации с аа
распознавание кодона мРНК на малой рибо
тРНК и СРП и, в конечном счете, к диссоциа
сомной субчастице [12]. Логично, что в случае
ции EF Tu-ГДФ.
SelB, который должен доставить SecтРНКSec на
Принципиальная значимость остатка гисти
рибосому, когда в А сайте располагается стоп
дина в положении 84 EF Tu для гидролиза ГТФ
кодон, обозначающий место встраивания Sec, а
на рибосоме была неоспоримо доказана мутаци
не окончание синтеза белковой цепи, добавля
онным анализом [11, 12, 15, 16]. Замена His на
ется еще одна детерминанта стимулятор ГТФаз
Leu, Ala и Arg приводила к значительному сни
ной активности фактора. Для активации гидро
жению скорости реакции, приближающемуся
литической функции SelB, помимо СРП и ко
по значению к скорости реакции гидролиза
дон антикодонового взаимодействия, необхо
ГТФ фактором вне рибосомы. При этом замена
димо взаимодействие VI домена SelB с SECIS
His84 на Gln, обнаруживаемый в данном поло
элементом мРНК, который располагается сразу
жении в Ras подобных и гетеротримерных G
после Sec определяющего кодона. Отсутствие
белках, приводила к менее выраженному сни
кодон антикодонового взаимодействия или взаи
жению скорости реакции гидролиза ГТФ, поз
модействия с SECIS элементом мРНК приво
воляя предположить, что NH2 группа Gln может
дит к снижению скорости реакции гидролиза на
в некоторой степени заменить NH группу His в
два порядка [20].
регионе switch II трГТФаз и стабилизировать пе
Механизм активации трГТФаз лучше всего
реходное состояние гидролиза ГТФ, как и в дру
изучен на примере элонгационного фактора EF
гих группах G белков [69]. Следует отметить,
Tu [10]. В составе тройного комплекса аа тРНК
что для реализации данного механизма в случае
прочно связана с EF Tu-ГТФ [65], взаимодей
EF Tu критически важным является раскрытие
ствуя в том числе и с регуляторными регионами
«гидрофобных ворот», а также взаимодействие
switch I и II G домена элонгационного фактора
His84 с A2662 СРП большой рибосомной субъ
своим акцепторным стеблем [41]. Доставка аа
единицы, тогда как в отсутствие рибосомы гид
БИОХИМИЯ том 85 вып. 11 2020
1684
ПОЛЕССКОВА и др.
ролиз ГТФ, вероятно, протекает по другому ме
лекулярной динамики, есть некоторые аспекты,
ханизму, который не вовлекает боковую цепь
которые позволяют представить ассоциативный
His84 региона switch II EF Tu.
путь более обоснованным. Структура оксианио
Несмотря на то, что благодаря структурным
новой дыры идеально приспособлена для разме
и биохимическим исследованиям были опреде
щения и стабилизации отрицательного заряда,
лены основные элементы каталитического
тогда как в случае реализации диссоциативного
центра реакции, возможные пути протекания
механизма в ней будет располагаться нейтраль
реакции до сих пор являются дискуссионными.
ная молекула воды. При этом прогнозируемая
роль His84 при диссоциативном механизме бу
дет менее значимой, чем в случае ассоциативно
РОЛЬ ОСТАТКА КОНСЕРВАТИВНОГО
го механизма, при реализации которого боль
ГИСТИДИНА В РЕАКЦИИ ГИДРОЛИЗА ГТФ
шой предполагаемый эффект наличия His84 в
активном состоянии хорошо согласуется с
Для определения роли остатка His в реакции
принципиальной значимостью остатка His в по
гидролиза EF Tu-ГТФ использовали метод
ложении 84, подтвержденной эксперименталь
компьютерного симулирования молекулярной
но [11, 12]. Оба вышеуказанных аспекта свиде
динамики [25] на основе существующей крис
тельствуют в пользу именно ассоциативного ме
таллической структуры комплекса рибосом с
ханизма реакции гидролиза ГТФ, который, ско
EF Tu-GDPCP [17]. Сравнение энергий нес
рее всего, можно распространить и на случаи
кольких возможных процессов в ГТФазном
других трГТФаз [70-72].
центре рибосомы и в водном растворе показало,
Важно отметить, что структура оксианионо
что механизм, при котором His84 действует как
вой дыры, образованная мотивом PGH вместе с
каталитическое основание (с нуклеофильной
NH группой главной цепи Thr61 и боковой
атакой и захватом протона His84) (рис. 2, а),
цепью His84, формирует полость, которая мо
крайне маловероятен из за значительной деста
жет стабилизировать не только гидроксид ион,
билизации (+17,5 ккал⋅моль-1), возникающей в
но и уходящую фосфатную группу [25]. Стаби
результате близкого расположения гидроксида к
лизация неорганического фосфата в нуклеотид
γ фосфату. Анализ свободной энергии реакций
связывающем кармане может быть причиной
образования промежуточного соединения в про
его замедленного по сравнению со скоростью
цессе гидролиза ГТФ выявил практически оди
протекания реакции гидролиза ГТФ высвобож
наковые значения стабилизации для предельных
дения [73].
случаев диссоциативного (-3,4 ккал⋅моль-1) и
Помимо координирования каталитической
ассоциативного (-3,7 ккал⋅моль-1) механизмов
молекулы воды и формирования оксианионо
реакции гидролиза ГТФ. В первом случае обра
вой дыры, боковая цепь His также может участ
зуются переходные комплексы с метафосфатом,
вовать в высвобождении Pi после реакции гид
находящимся между нейтральной молекулой
ролиза ГТФ, что является необходимым услови
воды и уходящим ГДФ (рис. 2, в). При этом от
ем для диссоциации трГТФаз с рибосомы [74].
сутствует взаимодействие между боковой цепью
Изучение структурных особенностей EF G
His84 и метафосфатом, который в основном ста
на рибосоме выявило радикальное изменение
билизируется взаимодействием с Lys24, основ
ориентации His91 при гидролизе ГТФ. В струк
ными NH группами Thr61 и Gly83, а также со
турах, содержащих EF G с негидролизуемым
связанным с субстратом ионом Mg2+. Во втором
аналогом ГТФ (активированное состояние пе
случае перенос протона воды на γ фосфат в при
ред реакцией гидролиза), боковая цепь His91
сутствии положительно заряженного остатка
указывает на γ фосфат [18, 19], тогда как в
His84 приводит к стабильному положению гид
структурах с EF G-ГДФ и фусидовой кислотой
роксид иона (рис. 2, б), которое хорошо согла
она поворачивается на 140° в противоположном
суется с кристаллической структурой [17]. Гид
направлении и оказывается в междоменном
роксид ион располагается в структуре оксиани
пространстве EF G [64, 75]. Если в соответствии
оновой дыры, которая образуется пептидным
с данными молекулярно динамического моде
остовом трех а.о. (Pro82 Gly83 His84) оконча
лирования Pi остается связанным с His91 после
ния консервативного мотива региона switch II
реакции гидролиза ГТФ, наиболее вероятно, что
DXXGH и боковой цепью активной протониро
он, следуя за His91, оказывается в области,
ванной формы His84 (рис. 4). В этом случае гид
представляющей собой беспрепятственный вы
роксид ион также последовательно сохраняет
ходной путь, и покидает рибосому [13]. В поддерж
свою водородную связь с карбонильной груп
ку этой теории говорят эксперименты с моди
пой Thr61. Несмотря на равную вероятность ре
фицированными вариантами EF G, в которых
ализации обоих механизмов, с точки зрения мо
His91 был заменен на Ala, Glu, Gln и Arg [13]. В
БИОХИМИЯ том 85 вып. 11 2020
ГТФазная АКТИВНОСТЬ ФАКТОРОВ ЭЛОНГАЦИИ
1685
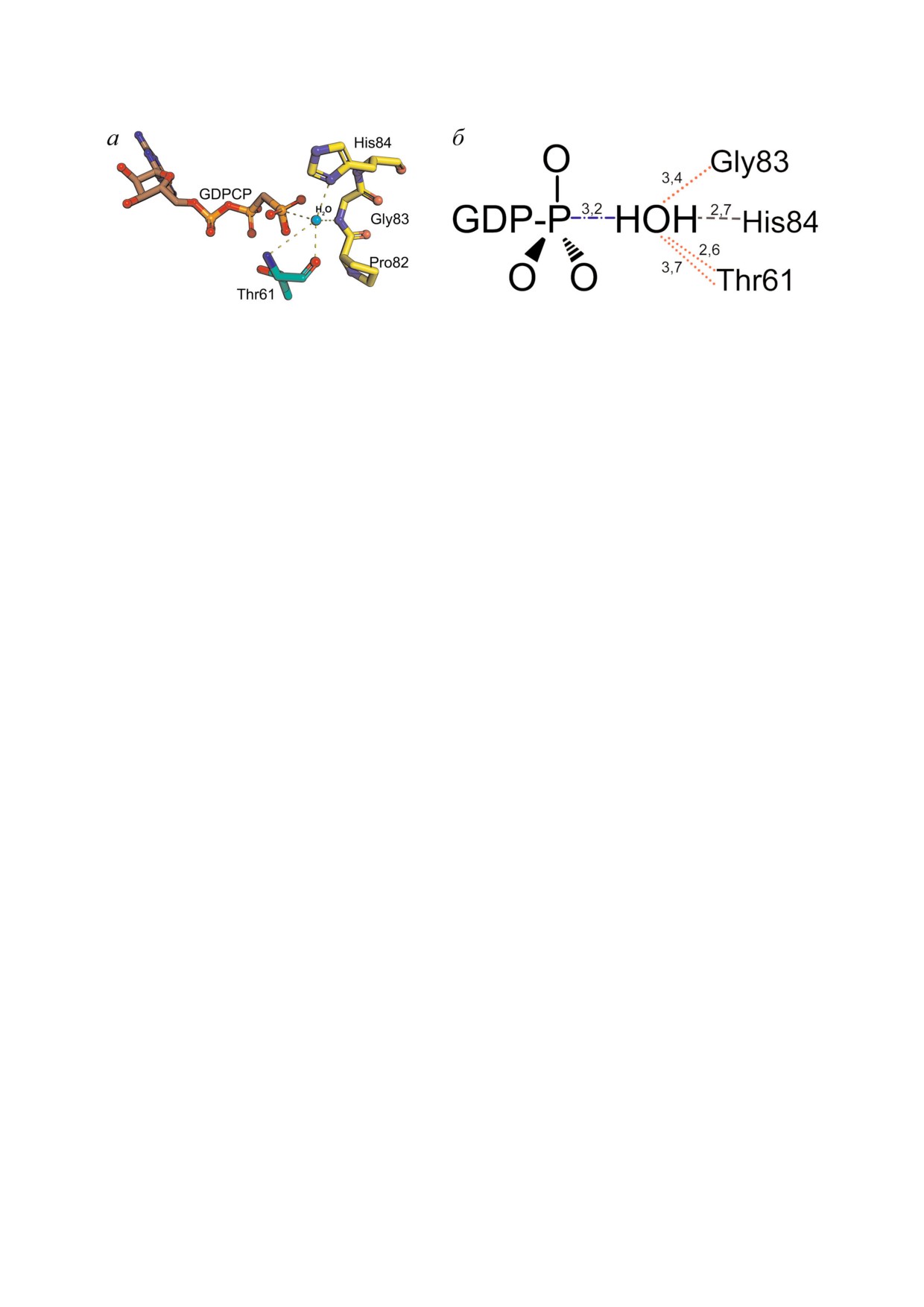
Рис. 4. Пространственная структура (a) и схематическое изображение (б) расположения молекулы воды в оксианионовой
дыре, образованной пептидным остовом а.о. Pro82 Gly83 His84, боковой цепью протонированной формы His84 и NH
группой главной цепи Thr61 EF Tu (PDB ID код 4v5l [17]). Взаимодействия боковой группы а.о. (− −), пептидного остова
а.о. (⋅ ⋅ ⋅), прочие взаимодействия (− ⋅ −). Расстояния указаны в Å. Нумерация E. coli
соответствии с эффектами, обнаруженными для
динируются нуклеотидами GAGA области СРП
EF Tu, замена консервативного His приводила к
(G2659-A2662) в полном соответствии с данны
разной степени нарушения гидролитической
ми о том, что эти нуклеотиды являются важны
активности фактора в зависимости от а.о., ока
ми детерминантами эффективного гидролити
зывающегося в реакционном центре. При этом
ческого функционирования EF G [30, 76].
во всех случаях относительное снижение ско
В отличие от EF G, в EF Tu и SelB, Asp P
рости высвобождения Pi превосходило наруше
петли находится в активированном, повернутом
ние реакции гидролиза. Таким образом, можно
в сторону ГТФ состоянии постоянно, и для это
предположить, что тесная координация Pi с
го не требуется взаимодействие с рибосомой.
His91 и переориентация боковой цепи этого а.о.
Однако при связывании с СРП расстояние меж
являются важными определяющими факторами
ду Asp и гуаниновым нуклеотидом уменьшается
для эффективного высвобождения Pi [13].
и образуются связи, координирующие положе
ние β и γ фосфатов ГТФ [20]. В рибосомном
комплексе с SelB дополнительная стабилизация
РОЛЬ ОСТАТКА КОНСЕРВАТИВНОЙ
достигается за счет координации Asp фосфатной
АСПАРАГИНОВОЙ КИСЛОТЫ
группой A2662 через ион Mg2+, аналогично EF
В РЕАКЦИИ ГИДРОЛИЗА ГТФ
G, тогда как в EF Tu этот контакт не был обна
ружен (рис. 1). Интересно, что различия между
Еще одним консервативным среди трГТФаз
факторами элонгации проявляются также и в
остатком, способствующим ускорению реакции
координации активного протонированного
гидролиза ГТФ на рибосомах, является остаток
His84 нуклеотидами СРП. Для EF Tu и EF G
аспарагиновой кислоты P петли. Замена Asp21
это контакт фосфатного кислорода A2662 с
на другие а.о. приводила к более выраженному
NE2 группой His, тогда как в случае SelB - это
снижению скорости реакции гидролиза ГТФ,
взаимодействие 2′ OH группы G2661 с ND1
стимулированной рибосомами, чем к измене
группой His [17, 19, 20].
нию спонтанной гидролитической активности
Значимость координации критически важ
EF Tu [12].
ных а.о. ГТФазного центра EF G (His91 и Asp20)
В EF G Asp20 обеспечивает оптимальную
нуклеотидом A2662 была оценена путем замены
ориентацию β и γ фосфатов. Asp20, аналогично
фосфатных кислородов A2662 на метильные
His91, указывает в сторону от связанного нуклео
группы [76]. Было показано, что нарушение
тида в изолированном состоянии EF G, но при
электростатического взаимодействия A2662 с
взаимодействии с рибосомой переориентирует
His91 путем замены одного из двух неравно
ся и приближается к ГТФ [19]. Asp20 контакти
значных кислородов на метильную группу при
рует с мостиковым кислородом, соединяющим
водит к полной потере способности фактора
β и γ фосфаты ГТФ, а также с кислородами
гидролизовать ГТФ. При этом замена второго
этих фосфатных групп (рис. 1, б). Подобно
кислорода фосфатной группы с нейтрализацией
His91, Asp20 приближает к γ фосфату молекулу
ее отрицательного заряда сохраняла реакцион
воды, которая может играть роль в катализе, об
ную способность фактора элонгации, приводя
разуя водородную связь с кислородом γ фосфа
лишь к 8× снижению скорости реакции. С од
та. Активированная конформация Asp20 стаби
ной стороны, этот эффект можно объяснить об
лизируется двумя ионами Mg2+, которые коор
щим снижением значения отрицательного заря
БИОХИМИЯ том 85 вып. 11 2020
1686
ПОЛЕССКОВА и др.
да в основной цепи A2662, тогда как отрицатель
При этом отрицательно заряженный γ фосфат
ный заряд должен способствовать увеличению
перемещается в результате однонаправленных
pKa остатка His, обеспечить протонирование
воздействий остатков Asp21 и His84 и стабили
имидазольного кольца [25] и позволить образо
зируется консервативным мотивом PGH. Рибо
вать прочную водородную связь с молекулой ка
сома не предоставляет каталитические остатки,
талитической воды. С другой стороны, замена
но стимулирует реакцию гидролиза, стабилизи
кислорода на метильную группу приводит к не
руя продуктивную конформацию каталитичес
способности A2662 координировать ион Mg2+,
кого центра [77]. Таким образом, ускорение ре
который, в свою очередь, призван стабилизиро
акции гидролиза ГТФ на несколько порядков,
вать активную конформацию Asp20 [19]. Слабо
осуществляемое рибосомой, достигается иск
выраженное снижение реакционной способ
лючительно электростатическими эффектами
ности фактора может объясняться тем фактом,
стабилизации и экранирования [12, 78, 79], яв
что достаточно большой радиус гидратирован
ляясь удивительным примером чрезвычайно
ного иона Mg2+ может обеспечить его координа
продуктивного использования ограниченной
цию другими нуклеотидами СРП, например
каталитической силы РНК [80].
G2655 или G2664. Более того, в стабилизации
Asp20 EF G участвует второй ион Mg2+, коорди
нация которого нуклеотидом G2659 сохраняет
Финансирование. Работа выполнена при фи
ся [19].
нансовой поддержке Российского научного
фонда (грант № 17 14 01416).
Таким образом, несмотря на некоторые раз
Благодарности. Мы благодарим за плодот
личия, возникающие на этапе активации
ворные дискуссии всех сотрудников лаборато
ГТФазной активности факторов элонгации,
рии биосинтеза белка ОМРБ НИЦ «КИ» -
достигается очень схожее активированное со
ПИЯФ.
стояние, в котором процесс гидролиза ГТФ во
Конфликт интересов. Авторы заявляют об от
многом определяется электростатическими взаи
сутствии конфликта интересов.
модействиями. Протонированный остаток His
Соблюдение этических норм. Настоящая
стимулирует перенос протона каталитической
статья не содержит описания каких либо иссле
воды на γ фосфатную группу ГТФ с последую
дований с участием людей или животных в каче
щей нуклеофильной атакой гидроксид иона. стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Schmeing, T. M., and Ramakrishnan, V. (2009) What
8. Wittinghofer, A., Scheffzek, K., and Ahmadian, M. R.
recent ribosome structures have revealed about the mecha
(1997) The Interaction of ras with GTPase activating pro
nism of translation, Nature, 461, 1234 1242, Doi: 10.1038/
teins, FEBS Lett., 410, 6367, doi: 10.1016/S0014
nature08403.
5793(97)00321 9.
2.
Maracci, C., and Rodnina, M. V. (2016) Review: transla
9. Vetter, I. R., and Wittinghofer, A. (2001) The guanine
tional GTPases, Biopolymers, 105, 463 475, doi: 10.1002/
nucleotide binding switch in three dimensions, Science,
bip.22832.
294, 1299 1304, doi: 10.1126/science.1062023.
3.
Atkinson, C. G. (2015) The evolutionary and functional
10. Ævarsson, A. (1995) Structure based sequence alignment
diversity of classical and lesser known cytoplasmic
of elongation factors Tu and G with related GTPases
and organellar translational GTPases across the tree of
involved in translation, J. Mol. Evol., 41, 1096104,
life, BMC Genomics, 16, 78, doi: 10.1186/s12864 015
doi: 10.1007/BF00173191.
1289 7.
11. Daviter, T., Wieden, H. J., and Rodnina, M. V. (2003)
4.
Bourne, H. R., Sanders, D. A., and McCormick, F. (1991)
Essential role of histidine 84 in elongation factor Tu for the
The GTPase superfamily: conserved structure and molecu
chemical step of GTP hydrolysis on the ribosome, J. Mol.
lar mechanism, Nature, 349, 117127, doi: 10.1038/
Biol., 332, 689 699, doi: 10.1016/S0022 2836(03)00947 1.
349117a0.
12. Maracci, C., Peske, F., Dannies, E., Pohl, C., and
5.
Vetter, I. R., Nowak, C., Nishimoto, T., Kuhlmann, J., and
Rodnina, M. V. (2014) Ribosome induced tuning of
Wittinghofer, A. (1999) Structure of a ran binding domain
GTP hydrolysis by a translational GTPase, Proc. Natl.
complexed with ran bound to a GTP analogue: implica
Acad. Sci. USA, 111, 14418 14423, doi: 10.1073/pnas.
tions for nuclear transport, Nature,
398,
3946,
1412676111.
doi: 10.1038/17969.
13. Koripella, R. K., Holm, M., Dourado, D., Mandava, C. S.,
6.
Hilgenfeld, R. (1995) Regulatory GTPases, Curr. Opin. Struct.
Flores, S., and Sanyal, S. (2015) A conserved histidine in
Biol., 5, 810 817, doi: 10.1016/0959 440X(95)80015 8.
switch II of EF G moderates release of inorganic phos
7.
Scheffzek, K., Ahmadian, M. R., Kabsch, W., Wiesmüller, L.,
phate, Sci. Rep., 5, doi: 10.1038/srep12970.
Lautwein, A., Schmitz, F., and Wittinghofer, A. (1997) The
14. Cunha, C. E., Belardinelli, R., Peske, F., Holtkamp, W.,
Ras RasGAP complex: structural basis for GTPase activa
Wintermeyer, W., and Rodnina, M. V. (2013) Dual use of
tion and its loss in oncogenic ras mutants, Science, 277,
GTP hydrolysis by elongation factor G on the ribosome,
333 338, doi: 10.1126/science.277.5324.333.
Translation, 1, e24315 11, doi: 10.4161/trla.24315.
БИОХИМИЯ том 85 вып. 11 2020
ГТФазная АКТИВНОСТЬ ФАКТОРОВ ЭЛОНГАЦИИ
1687
15.
Zeidler, W., Egle, C., Ribeiro, S., Wagner, A., Katunin, V.,
23S ribosomal RNA as key to EF G GTPase activation,
Kreutzer, R., Rodnina, M., Wintermeyer, W., and Sprinzl, M.
Nat. Chem. Biol., 6, 344 351, doi: 10.1038/nchembio.341.
(1995) Site directed mutagenesis of Thermus Thermophilus
31.
Moazed, D., Robertson, J. M., and Noller, H. F. (1988)
elongation factor Tu: replacement of His85, Asp81 and
Interaction of elongation factors EF G and EF Tu with a
Arg300, Eur. J. Biochem., 229, 596 604, doi: 10.1111/
conserved loop in 23S RNA, Nature, 334, 362 364,
j.1432 1033.1995.0596j.x.
doi: 10.1038/334362a0.
16.
Scarano, G., Krab, I. M., Bocchini, V., and Parmeggiani, A.
32.
Stark, H., Rodnina, M. V., Wieden, H. J., Zemlin, F.,
(1995) Relevance of histidine 84 in the elongation factor
Wintermeyer, W., and Van Heel, M. (2002) Ribosome
Tu GTPase activity and in poly(Phe) synthesis: its substitu
interactions of aminoacyl TRNA and elongation factor Tu
tion by glutamine and alanine, FEBS Lett., 365, 214 218,
in the codon recognition complex, Nat. Struct. Biol., 9,
doi: 10.1016/0014 5793(95)00469 P.
849 854, doi: 10.1038/nsb859.
17.
Voorhees, R. M., Schmeing, T. M., Kelley, A. C., and
33.
Lin, J., Gagnon, M. G., Bulkley, D., and Steitz, T. A.
Ramakrishnan, V. (2010) The mechanism for activation of
(2015) Conformational changes of elongation factor G on
GTP hydrolysis on the ribosome, Science, 330, 835 838,
the ribosome during TRNA translocation, Cell, 160, 219
doi: 10.1126/science.1194460.
227, doi: 10.1016/j.cell.2014.11.049.
18.
Chen, Y., Feng, S., Kumar, V., Ero, R., and Gao, Y. G.
34.
Voorhees, R. M., Schmeing, T. M., Kelley, A. C., and
(2013) Structure of EF G ribosome complex in a pre
Ramakrishnan, V. (2011) Response to comment on “The
translocation state, Nat. Struct. Mol. Biol., 20, 1077 1084,
mechanism for activation of GTP hydrolysis on the
doi: 10.1038/nsmb.2645.
ribosome”, Science,
333,
37, doi:
10.1126/science.
19.
Tourigny, D. S., Fernández, I. S., Kelley, A. C., and
1202532.
Ramakrishnan, V. (2013) Elongation factor G bound to the
35.
Kirby, A. J., and Jencks, W. P. (1965) The reactivity of
ribosome in an intermediate state of translocation,
nucleophilic reagents toward the P nitrophenyl phosphate
Science, 340, 1235490-1235497, doi: 10.1126/science.
dianion, J. Am. Chem. Soc., 87, 3209 3216, doi: 10.1021/
1235490.
ja01092a036.
20.
Fischer, N., Neumann, P., Bock, L. V., Maracci, C., Wang, Z.,
36.
Paleskava, A., Konevega, A. L., and Rodnina, M. V. (2012)
Paleskava, A., Konevega, A.L., Schröder, G. F.,
Thermodynamics of the GTP GDP operated conforma
Grubmüller, H., Ficner, R., Rodnina, M. V., and Stark, H.
tional switch of selenocysteine specific translation factor
(2016) The pathway to GTPase activation of elongation
SelB, J. Biol. Chem., 287, 27906 27912, doi: 10.1074/
factor SelB on the ribosome, Nature,
540,
8085,
jbc.M112.366120.
doi: 10.1038/nature20560.
37.
Leibundgut, M., Frick, C., Thanbichler, M., Böck, A., and
21.
Loveland, A. B., Demo, G., and Korostelev, A. A. (2020)
Ban, N. (2005) Selenocysteine TRNA specific elongation
Cryo EM of elongating ribosome with EF Tu•GTP eluci
factor SelB is a structural chimaera of elongation and initi
dates TRNA proofreading, Nature,
584,
640645,
ation factors, EMBO J.,
24,
1122, doi:
10.1038/
doi: 10.1038/s41586 020 2447 x.
sj.emboj.7600505.
22.
Loveland, A. B., Demo, G., Grigorieff, N., and
38.
Klähn, M., Rosta, E., and Warshel, A. (2006) On the
Korostelev, A. A. (2017) Ensemble Cryo EM elucidates the
mechanism of hydrolysis of phosphate monoesters dian
mechanism of translation fidelity, Nature, 546, 113 117,
ions in solutions and proteins, J. Am. Chem. Soc., 128,
doi: 10.1038/nature22397.
15310 15323, doi: 10.1021/ja065470t.
23.
Fischer, N., Neumann, P., Konevega, A. L., Bock, L. V.,
39.
Åqvist, J., Kolmodin, K., Florian, J., and Warshel, A.
Ficner, R., Rodnina, M. V., and Stark, H. (2015) Structure
(1999) Mechanistic alternatives in phosphate monoester
of the E. Coli ribosome EF Tu complex at <3 Å resolution
hydrolysis: what conclusions can be drawn from available
by Cs corrected Cryo EM, Nature,
520,
567570,
experimental data? Chem. Biol., 6, 71 80, doi: 10.1016/
doi: 10.1038/nature14275.
S1074 5521(99)89003 6.
24.
Liljas, A., Ehrenberg, M., and Åqvist, J. (2011) Comment
40.
Berchtold, H., Reshetnikova, L., Reiser, C. O. A.,
on “The mechanism for activation of GTP hydrolysis on
Schirmer, N. K., Sprinzl, M., and Hilgenfeld, R. (1993)
the ribosome”, Science, 333, 37, doi: 10.1126/science.
Crystal structure of active elongation factor Tu reveals
1202472.
major domain rearrangements, Nature, 365, 126 132,
25.
Wallin, G., Kamerlin, S. C. L., and Åqvist, J. (2013)
doi: 10.1038/365126a0.
Energetics of activation of GTP hydrolysis on the ribo
41.
Nissen, P., Kjeldgaard, M., Thirup, S., Polekhina, G.,
some, Nat. Commun., 4, 1733, doi: 10.1038/ncomms2741.
Reshetnikova, L., Clark, B. F. C., and Nyborg, J. (1995)
26.
Li, W., Liu, Z., Koripella, R. K., Langlois, R., Sanyal, S.,
Crystal structure of the ternary complex of Phe
and Frank, J. (2015) Activation of GTP hydrolysis in
TRNAPhe, EF Tu, and a GTP analog, Science, 270, 1464
MRNA TRNA translocation by elongation factor G, Sci.
1472, doi: 10.1126/science.270.5241.1464.
Adv., 1, e1500169 7, doi: 10.1126/sciadv.1500169.
42.
Fislage, M., Zhang, J., Brown, Z. P., Mandava, C. S.,
27.
Mercier, E., Girodat, D., and Wieden, H. J. (2015) A
Sanyal, S., Ehrenberg, M., and Frank, J. (2018) Cryo EM
Conserved P loop anchor limits the structural dynamics
shows stages of initial codon selection on the ribosome by
that mediate nucleotide dissociation in EF Tu, Sci. Rep., 5,
Aa TRNA in ternary complex with GTP and the GTPase
doi: 10.1038/srep07677.
deficient EF TuH84A, Nucleic Acids Res., 46, 5861 5874,
28.
Shi, X., Khade, P. K., Sanbonmatsu, K. Y., and Joseph, S.
doi: 10.1093/nar/gky346.
(2012) Functional role of the sarcin ricin loop of the 23s
43.
Rodnina, M. V., Fricke, R., Kuhn, L., and Wintermeyer, W.
RRNA in the elongation cycle of protein synthesis, J. Mol.
(1995) Codon dependent conformational change of elon
Biol., 419, 125 138, doi: 10.1016/j.jmb.2012.03.016.
gation factor Tu preceding GTP hydrolysis on the ribo
29.
Mitkevich, V. A., Shyp, V., Petrushanko, I. Y., Soosaar, A.,
some, EMBO J., 14, 2613 2619, doi: 10.1002/j.1460
Atkinson, G. C., Tenson, T., Makarov, A. A., and
2075.1995.tb07259.x.
Hauryliuk, V. (2012) GTPases IF2 and EF G bind GDP
44.
Pape, T., Wintermeyer, W., and Rodnina, M. V. (1998)
and the SRL RNA in a mutually exclusive manner, Sci.
Complete kinetic mechanism of elongation factor Tu
Rep., 2, 843, doi: 10.1038/srep00843.
dependent binding of aminoacyl TRNA to the A site of the
30.
Clementi, N., Chirkova, A., Puffer, B., Micura, R., and
E. Coli ribosome, EMBO J., 17, 7490 7497, doi: 10.1093/
Polacek, N. (2010) Atomic mutagenesis reveals A2660 of
emboj/17.24.7490.
БИОХИМИЯ том 85 вып. 11 2020
1688
ПОЛЕССКОВА и др.
45.
Yang, H., Perrier, J., and Whitford, P. C. (2018) Disorder
61.
Hansson, S., Singh, R., Gudkov, A. T., Liljas, A., and
guides domain rearrangement in elongation factor Tu,
Logan, D. T. (2005) Structural insights into fusidic acid
Proteins, 86, 1037 1046, doi: 10.1002/prot.25575.
resistance and sensitivity in EF G, J. Mol. Biol., 348, 939
46.
Abel, K., Yoder, M. D., Hilgenfeld, R., and Jurnak, F.
949, doi: 10.1016/j.jmb.2005.02.066.
(1996) An α to β conformational switch in EF Tu,
62.
Fasano, O., De Vendittis, E., and Parmeggiani, A. (1982)
Structure,
4,
11531159, doi:
10.1016/S0969
Hydrolysis of GTP by elongation factor Tu can be induced
2126(96)00123 2.
by monovalent cations in the absence of other effectors, J.
47.
Gromadski, K. B., Wieden, H. J., and Rodnina, M. V.
Biol. Chem., 257, 3145 3150.
(2002) Kinetic mechanism of elongation factor Ts cat
63.
Kuhle, B., and Ficner, R. (2014) A monovalent cation acts
alyzed nucleotide exchange in elongation factor Tu,
as structural and catalytic cofactor in translational GTP
Biochemistry, 41, 162 169, doi: 10.1021/bi015712w.
ases, EMBO J., 33, 25472563, doi: 10.15252/embj.
48.
AEvarsson, A., Brazhnikov, E., Garber, M., Zheltonosova, J.,
201488517.
Chirgadze, Y., Al Karadaghi, S., Svensson, L. A., and
64.
Gao, Y. G., Selmer, M., Dunham, C. M., Weixlbaumer, A.,
Liljas, A. (1994) Three dimensional structure of the ribo
Kelley, A. C., and Ramakrishnan, V. (2009) The structure
somal translocase: elongation factor G from Thermus
of the ribosome with elongation factor G trapped in the
Thermophilus, EMBO J., 13, 3669 3677, doi: 10.1002/
posttranslocational state, Science,
326,
694699,
j.1460 2075.1994.tb06676.x.
doi: 10.1126/science.1179709.
49.
Janosi, L., Hara, H., Zhang, S., and Kaji, A. (1996)
65.
LaRiviere, F. J., Wolfson, A. D., and Uhlenbeck, O. C.
Ribosome recycling by ribosome recycling factor (RRF) -
(2001) Uniform binding of aminoacyl TRNAs to elonga
an important but overlooked step of protein biosynthesis,
tion factor Tu by thermodynamic compensation, Science,
Adv. Biophys.,
32,
121201, doi:
10.1016/0065
294, 165 168, doi: 10.1126/science.1064242.
227X(96)84743 5.
66.
Mittelstaet, J., Konevega, A. L., and Rodnina, M. V.
50.
Margus, T., Remm, M., and Tenson, T. (2011) A computa
(2011) Distortion of TRNA upon near cognate codon
tional study of elongation factor G (EFG) duplicated
recognition on the ribosome, J. Biol. Chem., 286, 8158
genes: diverged nature underlying the innovation on the
8164, doi: 10.1074/jbc.M110.210021.
same structural template, PLoS One,
6, e22789,
67.
Valle, M., Sengupta, J., Swami, N. K., Grassucci, R. A.,
doi: 10.1371/journal.pone.0022789.
Burkhardt, N., Nierhaus, K. H., Agrawal, R. K., and
51.
Rodnina, M. V., Savelsbergh, A., Katunin, V. I., and
Frank, J. (2002) Cryo EM reveals an active role for
Wintermeyer, W. (1997) Hydrolysis of GTP by elongation
aminoacyl TRNA in the accommodation process, EMBO
factor G drives TRNA movement on the ribosome, Nature,
J., 21, 3557 3567, doi: 10.1093/emboj/cdf326.
385, 37 41, doi: 10.1038/385037a0.
68.
Schmeing, M. T., Voorhees, R. M., Kelley, A. C., Gao, Y. G.,
52.
Wilden, B., Savelsbergh, A., Rodnina, M. V., and
Murphy IV, F. V., Weir, J.R., and Ramakrishnan, V. (2009)
Wintermeyer, W. (2006) Role and timing of GTP binding
The crystal structure of the ribosome bound to EF Tu and
and hydrolysis during EF G dependent TRNA transloca
aminoacyl TRNA, Science, 326, 688 694, doi: 10.1126/
tion on the ribosome, Proc. Natl. Acad. Sci. USA, 103,
science.1179700.
13670 13675, doi: 10.1073/pnas.0606099103.
69.
Vetter, I. R., and Wittinghofer, A. (1999) Nucleoside
53.
Kromayer, M., Wilting, R., Tormay, P., and Böck, A.
triphosphate binding proteins: different scaffolds to
(1996) Domain structure of the prokaryotic selenocys
achieve phosphoryl transfer, Q. Rev. Biophys., 32, 1 56,
teine specific elongation factor SelB, J. Mol. Biol., 262,
doi: 10.1017/S0033583599003480.
413 420, doi: 10.1006/jmbi.1996.0525.
70.
Kötting, C., Blessenohl, M., Suveyzdis, Y., Goody, R. S.,
54.
Thanbichler, M., Böck, A., and Goody, R. S. (2000)
Wittinghofer, A., and Gerwert, K. (2006) A phosphoryl
Kinetics of the interaction of translation factor SelB from
transfer intermediate in the GTPase reaction of Ras in
Escherichia Coli with guanosine nucleotides and selenocys
complex with its GTPase activating protein, Proc. Natl.
teine insertion sequence RNA, J. Biol. Chem., 275, 20458
Acad. Sci. USA, 103, 13911 13916, doi: 10.1073/pnas.
20466, doi: 10.1074/jbc.M002496200.
0604128103.
55.
Paleskava, A., Konevega, A. L., and Rodnina, M. V. (2010)
71.
Pasqualato, S., and Cherfils, J. (2005) Crystallographic
Thermodynamic and kinetic framework of selenocysteyl
evidence for substrate assisted GTP hydrolysis by a small
TRNASec recognition by elongation factor SelB, J. Biol.
GTP binding protein, Structure, 13, 533 540, doi: 10.1016/
Chem., 285, 3014 3020, doi: 10.1074/jbc.M109.081380.
j.str.2005.01.014.
56.
Kjeldgaard, M., Nissen, P., Thirup, S., and Nyborg, J.
72.
Schweins, T., Geyer, M., Scheffzek, K., Warshel, A.,
(1993) The Crystal structure of elongation factor EF Tu
Kalbitzer, H. R., and Wittinghofer, A. (1995) Substrate
from Thermus Aquaticus in the GTP conformation,
assisted catalysis as a mechanism for Gtp hydrolysis of
Structure, 1, 35 50, doi: 10.1016/0969 2126(93)90007 4.
P21ras and other GTP binding proteins, Nat. Struct. Biol.,
57.
Hilgenfeld, R. (2000) Insights into the GTPase mechanism
2, 36 44, doi: 10.1038/nsb0195 36.
of EF Tu from structural studies, in: The Ribosome:
73.
Kothe, U., and Rodnina, M. V. (2006) Delayed release of
Structure, Function, Antibiotics, and Cellular Interactions,
inorganic phosphate from elongation factor Tu following
(Garrett, R., ed.), Washington, DC, pp. 347 357.
GTP hydrolysis on the ribosome, Biochemistry, 45, 12767
58.
Hansson, S., Singh, R., Gudkov, A. T., Liljas, A., and
12774, doi: 10.1021/bi061192z.
Logan, D. T. (2005) Crystal structure of a mutant elonga
74.
Savelsbergh, A., Mohr, D., Kothe, U., Wintermeyer, W.,
tion factor G trapped with a GTP analogue, FEBS Lett.,
and Rodnina, M. V. (2005) Control of phosphate release
579, 4492 4497, doi: 10.1016/j.febslet.2005.07.016.
from elongation factor G by ribosomal protein L7/12,
59.
Itoh, Y., Sekine, S. I., and Yokoyama, S. (2015) Crystal
EMBO J., 24, 4316 4323, doi: 10.1038/sj.emboj.7600884.
structure of the full length bacterial selenocysteine specif
75.
Zhou, J., Lancaster, L., Donohue, J. P., and Noller, H. F.
ic elongation factor SelB, Nucleic Acids Res., 43, 9028
(2013) Crystal structures of EF G - ribosome complexes
9038, doi: 10.1093/nar/gkv833.
trapped in intermediate states of translocation, Science,
60.
Czworkowski, J., Wang, J., Steitz, T. A., and Moore, P. B.
340, 1236086, doi: 10.1126/science.1236086.
(1994) The crystal structure of elongation factor G com
76.
Koch, M., Flür, S., Kreutz, C., Ennifar, E., Micura, R.,
plexed with GDP, at 2.7 Å resolution, EMBO J., 13, 3661
and Polacek, N. (2015) Role of a ribosomal RNA phos
3668, doi: 10.1002/j.1460 2075.1994.tb06675.x.
phate oxygen during the EF G triggered GTP hydrolysis,
БИОХИМИЯ том 85 вып. 11 2020
ГТФазная АКТИВНОСТЬ ФАКТОРОВ ЭЛОНГАЦИИ
1689
Proc. Natl. Acad. Sci. USA,
112, E2561 E2568,
Natl. Acad. Sci. USA, 108, 9827 9832, doi: 10.1073/
doi: 10.1073/pnas.1505231112.
pnas.1105714108.
77. Sondek, J., Lambright, D. G., Noel, J. P., Hamm, H. E.,
79. Prasad, B. R., Plotnikov, N. V., Lameira, J., and Warshel, A.
and Sigler, P. B. (1994) GTPase mechanism of Gproteins
(2013) Quantitative exploration of the molecular origin of
from the 1.7 Å crystal structure of transducin α GGDP
the activation of GTPase, Proc. Natl. Acad. Sci. USA, 110,
AIF 4, Nature, 372, 276 279, doi: 10.1038/372276a0.
20509 20514, doi: 10.1073/pnas.1319854110.
78. Adamczyk, A. J., and Warshel, A. (2011) Converting struc
80. Doudna, J. A., and Lorsch, J. R. (2005) Ribozyme cataly
tural information into an allosteric energy based picture
sis: not different, just worse, Nat. Struct. Mol. Biol., 12,
for elongation factor Tu activation by the ribosome, Proc.
395 402, doi: 10.1038/nsmb932.
PECULIARITIES IN ACTIVATION OF HYDROLYTIC ACTIVITY
OF ELONGATION FACTORS
Review
E. V. Paleskava, M. Y. Kaiumov, S. V. Kirillov, and A. L. Konevega*
Petersburg Nuclear Physics Institute named by B.P. Konstantinov of NRC “Kurchatov Institute”,
188300 Gatchina, Leningrad Region, Russia; E+mail: konevega_al@pnpi.nrcki.ru
Received July 5, 2020
Revised August 1, 2020
Accepted August 1, 2020
Translational GTPases (trGTPases) belong to the family of G proteins and play key roles at all stages of protein
biosynthesis on the ribosome. Unidirectional and cyclic functioning of G proteins is ensured by their ability to switch
between the active and inactive states due to GTP hydrolysis accelerated by the auxiliary GTPase activating proteins.
Although trGTPases interact with the ribosomes in different conformational states, they bind to the same conserved
region, which, unlike in classical GTPase activating proteins, is represented by ribosomal RNA. The resulting cat
alytic sites have almost identical structure in all elongation factors suggesting a common mechanism of GTP hydrol
ysis. However, fine details of the activated state formation and significantly different rates of GTP hydrolysis indicate
the existence of distinctive features upon GTP hydrolysis catalyzed by the different factors. Here, we present a con
temporary view on the mechanism of GTPase activation and GTP hydrolysis by the elongation factors EF Tu, EF
G, and SelB based on the analysis of structural, biochemical, and bioinformatics data.
Keywords: elongation factor, GTP hydrolysis, EF Tu, EF G, SelB, translation, ribosome
12 БИОХИМИЯ том 85 вып. 11 2020