БИОХИМИЯ, 2020, том 85, вып. 12, с. 1750 - 1765
УДК 577.22
МИТОПТОЗ, ДВАДЦАТЬ ЛЕТ СПУСТЯ
Обзор
© 2020
К.Г. Лямзаев1, Д.А. Кнорре1,2, Б.В. Черняк1*
1 НИИ физико химической биологии имени А.Н. Белозерского, Московский государственный университет
имени М.В. Ломоносова, 119991 Москва, Россия; электронная почта: bchernyak1@gmail.com
2 Первый московский государственный медицинский университет имени И.М. Сеченова, 119992 Москва, Россия
Поступила в редакцию 08.07.2020
После доработки 14.08.2020
Принята к публикации 14.08.2020
Термин «митоптоз» был предложен В.П. Скулачевым в 1999 г. для обозначения программированной элими!
нации митохондрий в живой клетке. В модели массированного повреждения митохондрий, связанного с
окислительным стрессом, был обнаружен новый механизм полной элиминации митохондрий, который
включал кластерообразование в перинуклеарной области, формирование «митоптозного тельца», окружен!
ного однослойной мембраной, и последующий выброс митохондрий из клетки. Выяснилось, что митоптоз
играет важную роль в процессах дифференцировки клеток, включая терминальную дифференцировку, в са!
моподдержании гематопоэтических стволовых клеток, а также в метаболической перестройке. К митопто!
зу можно отнести элиминацию отцовских митохондрий при материнском наследовании митохондриально!
го генома, а также асимметричное наследование митохондрий при делении дрожжей и некоторых клеток
животных. Наконец, особой формой митоптоза является селективная элиминация митохондрий с вредны!
ми мутациями в составе целых фолликулярных клеток яичников млекопитающих. Дальнейшее изучение
механизмов митоптоза в норме и при патологиях важно как для понимания процессов развития и старения,
так и для разработки терапевтических подходов при воспалительных, нейродегенеративных и других забо!
леваниях.
КЛЮЧЕВЫЕ СЛОВА: митохондрии, митоптоз, митофагия, мембранный потенциал, апоптоз, воспаление,
дифференцировка, асимметричное наследование митохондрий.
DOI: 10.31857/S0320972520120027
ВВЕДЕНИЕ
что «самурайский закон» лежит в основе запрог!
раммированного старения [4]. В.П. Скулачев
Термин «митоптоз» впервые ввел В.П. Ску!
предположил, что митоптоз запускается под
лачев в 1999 г. для обозначения программиро!
действием активных форм кислорода (АФК),
ванной гибели (элиминации) митохондрий в
которые вырабатывают сами митохондрии и,
живой клетке [1, 2]. Он предложил концепцию,
при нарушении баланса с антиоксидантными
согласно которой программированная гибель
системами, вызывают повреждения митохонд!
органелл (митоптоз, в случае митохондрий) яв!
риальных компонентов и нарушение их функ!
ляется движущей силой апоптоза, что может вы!
ций [3]. Одним из основных механизмов митоп!
зывать запрограммированную гибель организма
тоза, по мнению В.П. Скулачева, могло быть
или «феноптоз». Основой этой последователь!
открытие неселективной поры во внутренней
ности событий, по В.П. Скулачеву, является «са!
мембране митохондрий (mitochondrial perme!
мурайский закон» в биологии: «лучше умереть,
ability transition pore).
чем ошибиться» [3]. Дальнейшее развитие этой
Дальнейшие исследования показали, что
гипотезы привело ее автора к предположению, АФК!зависимое повреждение митохондрий
действительно является стимулом к апоптозу, но
Принятые сокращения: АФК - активные формы
ни долгосрочного открытия неселективной по!
кислорода; ЛПС - липополисахарид бактериальной стен!
ры, ни элиминации митохондрий при этом не
ки; ДНФ - 2,4!динитрофенол; CCCP - карбонилцианид происходит. Необратимые повреждения мито!
п!(трихлорметокси) фенилгидразон; FCCP — карбонил! хондрий, как правило, происходят на последую!
цианид п!(трифторметокси) фенилгидразон; мтДНК -
щих стадиях апоптоза и зависят от активации
митохондриальная ДНК; ГСК - гематопоэтические ство!
ловые клетки; NGF - фактор роста нервов; TNF - фактор
каспаз. Если предотвратить активацию каспаз с
некроза опухолей.
помощью специфического ингибитора, то ми!
* Адресат для корреспонденции.
тохондрии, потеряв часть белков межмембран!
1750
МИТОПТОЗ
1751
ного пространства и, в частности, цитохром с,
исследования не выявили прямой связи между
сохраняют способность к восстановлению цело!
фрагментацией митохондрий и апоптозом [16].
стности внутренней мембраны, к генерации
Более того, даже избирательная аутофагия пов!
мембранного потенциала и даже к окислитель!
режденных митохондрий (митофагия) может
ному фосфорилированию [5]. Таким образом,
происходить в отсутствие фрагментации мито!
выход белков из межмембранного пространства
хондрий [17].
митохондрий в цитоплазму, который служит
В данном обзоре авторы придерживаются
движущей силой апоптоза, не обязательно свя!
«узкого» значения термина митоптоз. Этот тер!
зан с необратимым повреждением митохонд!
мин предлагается использовать для описания
рий. Это, впрочем, не противоречит концепции
программированной массовой элиминации ми!
программированного старения и феноптоза, в
тохондрий независимо от механизма. Митофа!
основе которых лежит генерация митохондри!
гия является одним из механизмов, который мо!
альных АФК и повреждение митохондрий.
жет участвовать в митоптозе, однако, митоптоз,
Представлениe о программированной эли!
как будет показано ниже, может реализоваться и
минации митохондрий как о механизме защиты
в отсутствие митофагии. В обзоре обсуждаются
от некорректного функционирования повреж!
две основные стратегии митоптоза: выброс ми!
денных органелл (в полном соответствии с «са!
тохондрий из клетки и массированная деграда!
мурайским законом») имело продолжение как в
ция в цитоплазме. За рамками обзора остается
работах учеников и сотрудников В.П. Скулаче!
возможное участие в митоптозе митохондриаль!
ва, так и в независимых исследованиях. Термин
ных протеаз [18]. Для тех, кто интересуется
митоптоз получил широкое распространение.
ролью митохондрий в апоптозе или механизма!
При написании этого обзора в базе данных
ми митофагии, рекомендуем очень содержа!
тельные и еще не устаревшие обзоры [19, 20].
держивающей полнотекстовый поиск по науч!
ным публикациям и патентам, он встречается
1085 раз. Используется этот термин по!разному.
МЕХАНИЗМЫ МИТОПТОЗА,
Можно различить «широкое» толкование, кото!
СВЯЗАННЫЕ С ВЫБРОСОМ
рое включает и участие митохондрий в апоптозе
МИТОХОНДРИЙ ИЗ КЛЕТКИ
[6] и иных формах клеточной гибели [7], а также
нарушения митохондриального генома [8] и дег!
Митоптоз, вызванный разобщением окисли6
радацию поврежденных митохондрий [9]. В бо!
тельного фосфорилирования. Основная функция
лее «узком» значении термин митоптоз приме!
митохондрий — это образование АТФ в процес!
няется для описания программированной мас!
се окислительного фосфорилирования. Для
сированной элиминации митохондрий. Так,
синтеза АТФ на внутренней мембране митохо!
вскоре после «изобретения» термин митоптоз
ндрий поддерживается разность электрохими!
был использован для описания элиминации ми!
ческих протонных потенциалов не менее
тохондрий при созревании ретикулоцитов в
~180 мВ, которая образуется в результате окис!
эритропоэзе [10]. Мы использовали этот термин
ления субстратов дыхательной цепи. Падение
для обозначения особого механизма полного
мембранного потенциала служит для клетки
освобождения клеток от митохондрий при пол!
сигналом о необходимости запуска систем репа!
ном разобщении окислительного фосфорили!
рации митохондрий или их деградации, и это
рования [11, 12].
происходит независимо от снижения уровня
История исследований митоптоза тесно пе!
АТФ в клетке. В экспериментах рассеивание
реплетается с изучением процессов обратимой
мембранного потенциала обычно достигается с
фрагментации митохондрий. В 2004 г. В.П. Ску!
помощью протонофоров, разобщителей окис!
лачев и сотр. сформулировали гипотезу о том,
лительного фосфорилирования, таких как
что дробление митохондрий («переход нить—
FCCP, СCCP или ДНФ.
зерно», в терминологии авторов) при стрессе
В 2008 г. мы показали, что в клетках HeLa ра!
служит для выделения и уничтожения повреж!
зобщители FCCP или ДНФ в сочетании с инги!
денных органелл (митоптоз) и предшествует
биторами дыхательной цепи миксотиазолом
апоптозу [13]. Было установлено, что одним из
или антимицином вызывали окислительный
стимулов к фрагментации митохондрий может
стресс и быструю (в течение 1 ч) фрагментацию
быть избыточная продукция АФК в этих орга!
митохондрий, но не гибель клеток. Энергетику
неллах [14]. Drp1!зависимая фрагментация ми!
клеток в этих условиях поддерживал гликолиз.
тохондрий, вызванная проапоптотическими
Через 72-96 ч инкубации часть клеток погибала,
белками Bax/Bak, также была описана в терми!
а оставшиеся в живых клетки практически не
нах митоптоза [15]. В то же время дальнейшие
содержали митохондрий [11, 12].
БИОХИМИЯ том 85 вып. 12 2020
1752
ЛЯМЗАЕВ и др.
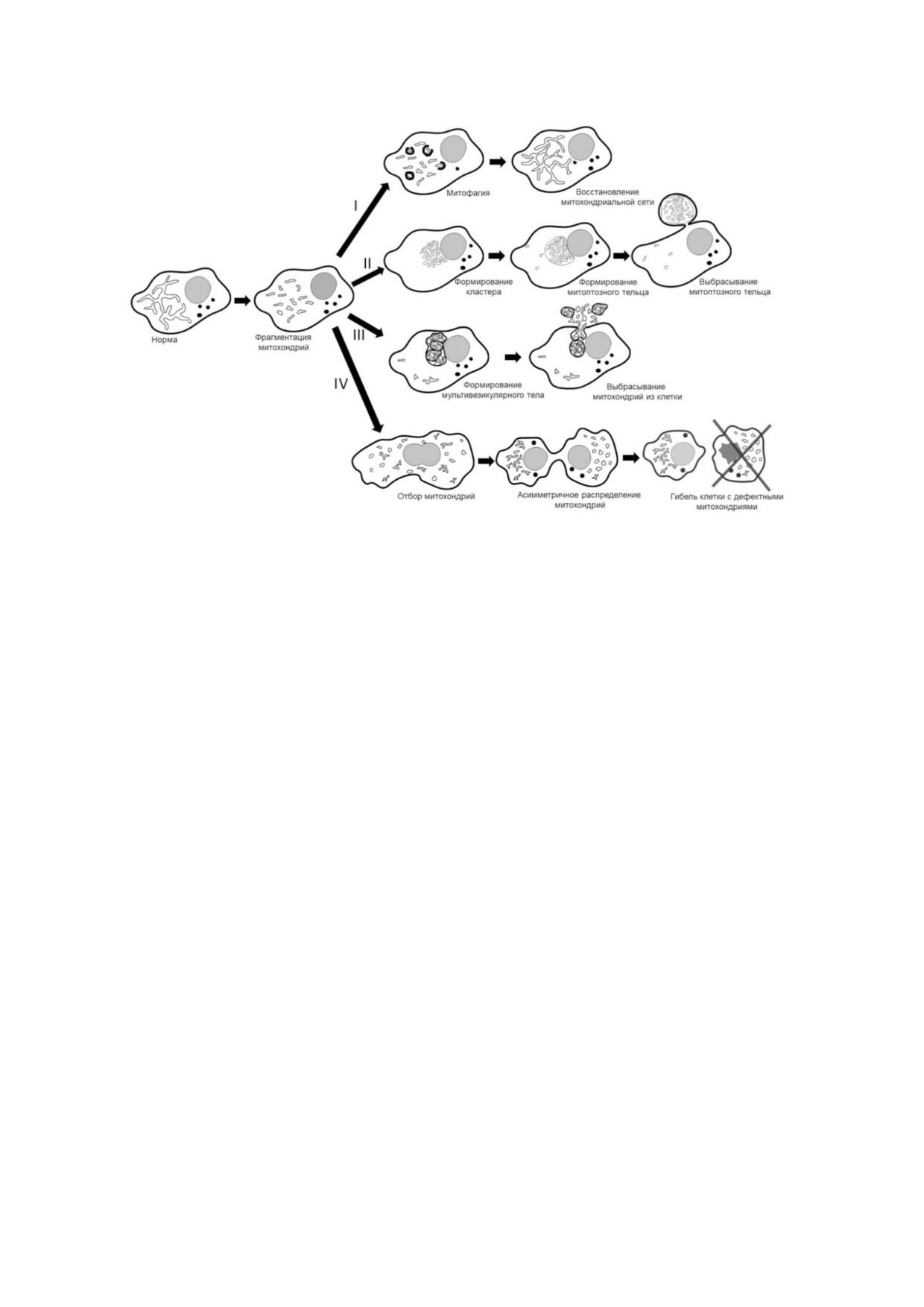
Различные механизмы реализации митоптоза. Элиминация митохондрий, как правило, начинается с фрагментации ми!
тохондриальной сети. Далее могут реализовываться различные механизмы: I - падение митохондриального потенциала
инициирует избирательную аутофагию митохондрий (митофагию); II - при массированном повреждении митохондрий
происходит формирование плотных митохондриальных кластеров, которые в дальнейшем окружаются мембраной, фор!
мируя митоптозное тельце, и выбрасываются из клетки; III - митохондрии выбрасываются из клетки в составе мультиви!
зикулярного тела по механизму, сходному с экзоцитозом (дифференцировка ретикулоцитов); IV - асимметричное расп!
ределение митохондрий между делящимися клетками. После деления клетка, получившая дефектные митохондрии, по!
гибает (ооцит) или прекращает делиться (ГСК)
Элиминация митохондрий начиналась с их
митохондрий, их кластеризация, образование
фрагментации, после чего фрагментированные
митоптозных телец и их выброс из клетки, выз!
митохондрии собирались около ядра и форми!
ванные совместным действием разобщителей и
ровали плотные кластеры. Далее эти кластеры
ингибиторов дыхания, не зависели от актив!
окружались мембраной, формируя «митоптоз!
ности каспаз. Кроме того, клетки, в которых
ное тельце», которое на финальной стадии выб!
наблюдалась полная элиминация митохондрий,
расывалось из клетки в межклеточное простра!
не имели признаков апоптоза: хроматин не был
нство [12] (рисунок, II). Сборка кластеров в
конденсирован, и фосфатидилсерин не был
этой модели не зависела ни от микротрубочек,
экспонирован на поверхности [12]. Кластериза!
ни от актинового цитоскелета. Возможно, в
ция митохондрий в перинуклеарной области
сборке кластеров участвовали промежуточные
наблюдалась также при окислительном стрессе
филаменты, которые определяют подвижность
[24], тепловом шоке [25] и при заражении ви!
митохондрий в цитоплазме [21]. Кластеры час!
русным белком [26] в отсутствие признаков
то собирались вблизи от ядра в области, харак!
апоптоза.
терной для сборки агрегатов денатурированных
Процесс образования митоптозного тельца
белков (агресом), однако механизмы агрегации
внешне напоминал макроаутофагию, но элект!
и последующей элиминации для митохондрий
ронная микроскопия показала, что его окружа!
и для денатурированных белков были различ!
ет однослойная мембрана, тогда как мембрана
ны. Известно, что для сборки агресом необхо!
аутофагосом двухслойная. Обнаруженная
димы микротрубочки [22]. Образование класте!
структура напоминала мультивезикулярное
ров митохондрий наблюдалось в некоторых мо!
тельце, но было значительно крупнее и содер!
делях апоптоза и зависело от движения по мик!
жала везикулы митохондриальной мембраны
ротрубочкам благодаря активности динеина,
диаметром 50-200 нм. Однако не было опреде!
который сохранял активность в то время, как
лено, где происходит распад митохондрий на
кинезин (обеспечивающий движение к перифе!
везикулы: в кластерах или в составе митоптоз!
рии) был инактивирован [23]. Фрагментация
ного тельца.
БИОХИМИЯ том 85 вып. 12 2020
МИТОПТОЗ
1753
Наши наблюдения не выявили значительной
Имеющиеся данные позволяют обсудить
колокализации митохондриальных кластеров и
возможные сигнальные механизмы, запускаю!
митоптозных телец с аутофагосомами, но в то
щие митоптоз при разобщении окислительного
же время происходила значительная стимуля!
фосфорилирования. Прежде всего, мы можем
ция аутофагии под действием разобщителей
исключить снижение уровня АТФ как сигнал к
[11, 12]. В значительно более поздней работе по!
митоптозу, поскольку в течение 48 ч в условиях
казано, что именно снижение мембранного по!
наших опытов это уровень не изменялся [30].
тенциала служит стимулом к аутофагии и мито!
Кроме того, блокирование АТФазной активнос!
фагии [27]. В модели митоптоза ингибиторы ау!
ти с помощью олигомицина не влияло на про!
тофагии (3!метиладенин и вортманнин) вызы!
цесс митоптоза. Интересно, что ни снижение
вали быструю гибель клеток, что указывает на
потенциала под действием ДНФ, ни остановка
защитное действие аутофагии в условиях нару!
дыхания с помощью миксотиазола не вызывали
шенного окислительного фосфорилирования.
митоптоз. Эффективна была лишь комбинация
Не возможно исключить участия аутофагии или
этих веществ. Другой разобщитель FCCP при
отдельных компонентов этого разветвленного
высокой концентрации (10 мкМ) вызывал ми!
механизма в процессе митоптоза, вызванного
топтоз, но в этих условиях он сильно подавлял
разобщением окислительного фосфорилирова!
дыхание. Условия индукции митоптоза совпада!
ния. Следует отметить, что клетки HeLa, на ко!
ли с условиями индукции максимального окис!
торых ставились эти опыты, имеют чрезвычай!
лительного стресса. В присутствии антиокси!
но низкий уровень белка Parkin, который необ!
дантов N!ацетилцистеина или Тролокса разоб!
ходим для митофагии вызванной снижением
щители вызывали быструю гибель клеток, что
потенциала (см. ниже).
указывает на участие АФК в защитном митоп!
На завершающей стадии митоптоза митоп!
тозном сигналинге [12].
тозное тельце выбрасывалось из клетки. В неко!
Известно, что антиоксиданты являются эф!
торых клетках удавалось наблюдать митоптоз!
фективными ингибиторами аутофагии [31]. На!
ное тельце в выросте плазматической мембра!
ши эксперименты подтвердили снижение уров!
ны, который напоминал «блеб», характерный
ня аутофагии, вызванной разобщителями, под
для апоптоза (рисунок, II). Во внеклеточной
действием антиоксидантов. Ингибиторы ауто!
среде можно было увидеть митоптозные тельца,
фагии стимулировали гибель клеток в присут!
окруженные мембраной, что указывало на воз!
ствии разобщителей [12]. Эти данные позволя!
можность отрыва блеба, содержавшего тельце,
ют предположить, что компоненты аутофагии
от клетки, подобно тому, как это происходит
необходимы для образования митоптозного
при апоптозе. В то же время, в отличие от апоп!
тельца, которое служит для защиты клеток от
тозных телец, митоптозные тельца не содержали
токсического действия поврежденных митохон!
ядерной ДНК, а их образование не зависело от
дрий. Для проверки этой гипотезы необходимы
активности каспаз. Наряду с этим механизмом,
дальнейшие исследования.
в некоторых клетках наблюдался экзоцитоз, при
Выброс митохондрий, сходный морфологи!
котором мембрана митоптозного тельца слива!
чески с описанным выше, наблюдался в нейро!
лась с плазматической мембраной, и митохонд!
нах нематоды Caenorhabditis elegans [32]. При
риальные везикулы оказывались вне клетки
протеотоксическом стрессе от нейронов отделя!
(рисунок, III). Эта картина очень напоминала
лись очень крупные (~4 мкм) мембранные вези!
выброс экзосом при экзоцитозе мультивезику!
кулы (их назвали «экзоферы»), содержащие ми!
лярных телец. Сходным образом, по!видимому,
тохондрии и агрегаты белков. Авторы показали,
может быть устроен экзоцитоз агресом. В част!
что нейроны, выбросившие эти везикулы, пере!
ности, показано, что тельца Леви (агресомы),
носили стресс значительно лучше, чем те, кото!
образующиеся в нейронах при болезни Паркин!
рым это сделать не удалось. Выброс митохонд!
сона, деменции и некоторых других заболевани!
рий наблюдался также у жгутиковых простей!
ях, выбрасываются из клетки с помощью экзо!
ших при значительном повышении уровня Са2+
цитоза, который не зависит от аппарата Гольджи
в цитоплазме [33]. Хотя механизмы митоптоза в
[28]. Интересно, что фибриллярные агрегаты α!
этих организмах значительно отличались, мож!
синуклеина, из которых в основном состоят
но полагать, что принцип элиминации повреж!
тельца Леви, подавляли аутофагию, что способ!
денных митохондрий путем их выброса из клет!
ствовало эндоцитозу [29]. Ниже представлены
ки имеет глубокие эволюционные корни.
примеры того, как клетки выбрасывают компо!
Митоптоз и апоптоз. Митохондрии служат
ненты митохондрий в составе экзосом или внек!
одним из основных компонентов сигнального
леточных везикул, окруженных плазматической
каскада усиления при апоптозе. Фрагментация
мембраной.
митохондрий при апоптозе является, вероятно,
БИОХИМИЯ том 85 вып. 12 2020
1754
ЛЯМЗАЕВ и др.
одной из самых ранних реакций клетки на
тем, что наблюдали Tolkovsky et al. на нейро!
стрессовое воздействие, которая препятствует
нах [34].
глобальной деполяризации митохондрий, свя!
Митоптоз в нейронах, возможно, защищает
занных между собой в единую сеть. В дальней!
их от повреждения, вызванного травмой мозга.
шем апоптоз развивается благодаря выходу из
Анализ содержания митохондриальных белков
межмембранного пространства митохондрий
и ДНК в мозге пациентов с травмой показал бо!
ряда белков (в частности, цитохрома с), участву!
лее чем двукратное снижение по сравнению со
ющих в активации каспаз. Если по какой!то
здоровым контролем [37]. В крысиной модели
причине активация каспаз не происходит, то
травмы мозга наблюдался аналогичный эффект.
митохондрии могут восстановить свою функци!
Авторы показали, что элиминация митохондрий
ональность [7]. Если восстановить митохондрии
связана с появлением на поверхности внешней
не удается, то дефектные органеллы уничтожа!
мембраны кардиолипина, специфического фос!
ются.
фолипида внутренней мембраны. Ранее было
Впервые массовая элиминация митохонд!
показано, что кардиолипин на поверхности ми!
рий при апоптозе была описана в работах
тохондрий служит сигналом для митофагии [38].
Tolkovsky et al. [34, 35]. Авторы исследовали
При травме мозга у крыс элиминация митохо!
апоптоз в культуре симпатических нейронов
ндрий играет защитную роль [37]. В этой же мо!
при лишении их фактора роста нервов (NGF) и
дели активация аутофагии с помощью рапами!
обнаружили, что даже при заблокированных
цина снижала нарушение когнитивных и двига!
каспазах восстановление уровня NGF в среде
тельных функций у крыс [39]. Приведенные ре!
после 1 сут. депривации не спасает клетки от ги!
зультаты можно сопоставить с данными о том,
бели, которая занимает несколько дней. Оказа!
что митофагия защищает мозг от повреждения
лось, что через 3 сут. после добавки NGF в клет!
как при болезни Паркинсона, так и при других
ках происходит практически полная элимина!
нейродегенеративных заболеваниях [40]. Воз!
ция митохондрий. Этому предшествует падение
можно, митоптоз в нейронах протекает по сце!
митохондриального потенциала и выход цитох!
нарию, сходному с тем, что был описан выше
рома с в цитоплазму. Авторы полагали, что эли!
[11, 12]. На это указывает тот факт, что при бо!
минация митохондрий происходит при участии
лезни Альцгеймера накопление тау!белка вызы!
аутофагии, однако бафиломицин А1, ингибитор
вает кластеризацию митохондрий в перинукле!
слияния аутофагосом с лизосомами, лишь час!
арной области [41]. Можно предполагать, что
тично подавлял митоптоз. Интересно, что эли!
митоптоз в нейронах начинается с избыточной
минация митохондрий в нейронах повышает их
продукции АФК в поврежденных митохондри!
устойчивость к гипоксии, что указывает на
ях. Это приводит к падению мембранного по!
адаптивный характер митоптоза при кратковре!
тенциала, фрагментации митохондрий и акти!
менном стрессе [35].
вации митофагии при участии PINK1/Parkin.
Сходная картина элиминации митохондрий
Если этот механизм не справляется с элимина!
наблюдалась на фоне блокированных каспаз в
цией митохондрий при их массовом поражении,
нейронах при индукции апоптоза цитозин ара!
то может активироваться кластеризация мито!
бинозидом, а также в клеточных линиях HeLa,
хондрий в перинуклеарной области, образова!
CHO, 3T3 и Rat 1 под действием стауроспорина
ние митоптотических телец, которые выбрасы!
[34, 36]. В работе Arnoult et al. [15] было показа!
ваются из клетки [12].
но, что стауроспорин или актиномицин Д в со!
Митоптоз, вызванный медиаторами воспале6
четании с ингибитором каспаз вызывают в клет!
ния. Митоптоз, связанный с апоптозом и вклю!
ках HeLa митоптоз, который зависит от белка
чающий выброс митохондрий из клеток, воз!
межмембранного пространства митохондрий
можно, играет важную роль в патогенезе воспа!
DDP/TIММ8a. В результате повышения прони!
лительных и аутоиммунных заболеваний. Появ!
цаемости внешней митохондриальной мембра!
ление в крови митохондриальных компонентов
ны под действием Bax/Bak белок DDP/TIММ8a
и соответствующих аутоантител характерно для
выходит из межмембранного пространства и
многих воспалительных патологий [42].
связывается с С!концом динамин!подобного
В работе Nakajima et al. [43] был изучен выб!
белка Drp1. Это взаимодействие повышает
рос митохондрий, вызванный провоспалитель!
способность Drp1 связываться с митохондрия!
ным цитокином, фактором некроза опухолей
ми, стимулирует их фрагментацию и последую!
(TNF). Авторы наблюдали фрагментацию мито!
щую массовую элиминацию. В этой модели ми!
хондрий и их захват в однослойные вакуоли, ко!
топтоз был связан с каспаз!независимой ги!
торые формировались из плазматической мемб!
белью клеток, которая развивалась в течение
раны. Было показано, что этот процесс зависит
3 сут. Этот сценарий практически совпадал с
от цитоскелета (как от актиновых фибрилл, так
БИОХИМИЯ том 85 вып. 12 2020
МИТОПТОЗ
1755
и от микротрубочек) и не тормозится ингибито!
обнаружен у В! и Т!лимфоцитов, а также у нату!
рами аутофагии. Вакуоли в этой модели слива!
ральных киллерных клеток в ответ на олигоде!
лись с плазматической мембраной, и «голые»
зоксинуклеотиды [47]. У лимфоцитов при этом
митохондрии оказывались во внеклеточной сре!
не наблюдалось признаков некроза, апоптоза
де, что принципиально отличает этот процесс от
или некроптоза, и не была активирована ауто!
блеббинга и формирования апоптотических те!
фагия. Внеклеточная мтДНК взаимодействова!
лец. Подобные результаты были получены при
ла с мононуклеарами периферической крови и
изучении гепатоцитов, выделенных из мышей,
стимулировала в них выработку противовирус!
получавших антитела к рецептору FAS!лиганда,
ного интерферона первого типа [47].
которые индуцировали сигналинг, сходный с
Тромбоциты. Основным источником митохо!
TNF!зависимым.
ндриального материала в крови являются тром!
Массированный выброс митохондриальных
боциты, составляющие ~5% форменных эле!
белков из гепатоцитов в кровоток наблюдался
ментов крови и имеющие высокое содержание
еще в одной модели острого воспаления, где
митохондрий. В составе экзосом и внеклеточ!
мышам внутрибрюшинно вводили липополиса!
ных везикул, секретируемых тромбоцитами при
харид бактериальной стенки (ЛПС) [44]. Важно,
стимуляции различными гуморальными факто!
что эти белки попадали в кровь значительно
рами, а также некоторыми клетками, обнаружи!
раньше, чем типичный маркер повреждения ге!
ваются компоненты митохондрий наряду с дру!
патоцитов аланинаминотрансфераза. Электрон!
гим клеточным содержимым [48]. Электронная
ная и иммунофлюоресцентная микроскопия
микроскопия показала, что выбрасываются как
выявила формирование крупных вакуолей
мембранные везикулы, содержащие митохонд!
вблизи от митохондрий, а ингибитор аутофаго!
рии, так и «голые» органеллы. Выброс митохо!
сомно!лизосомального пути хлорохин подавлял
ндрий в обоих случаях зависел от актинового
выброс митохондриальных белков. Более де!
цитоскелета, но не от микротрубочек [48]. Яр!
тальное исследование тех же авторов [45] пока!
кое подтверждение роли внеклеточных митохо!
зало, что ЛПС вызывает выброс митохондрий из
ндрий тромбоцитов в развитии патологий были
гепатоцитов и фибробластов in vitro. Как и в
получены при изучении концентратов тромбо!
опытах in vivo, ЛПС вызывал выход митохонд!
цитов, предназначенных для переливания крови
риальных белков из клеток задолго до проявле!
[49]. Оказалось, что содержание в них внекле!
ния признаков гибели. Для выброса митохонд!
точного митохондриального материала корре!
рий необходима активации аутофагии, но не ак!
лировало с вероятностью возникновения ос!
тивация каспаз. Данные электронной микрос!
ложнений после переливания. Правда, в данном
копии указывают на то, что аутофагосомы, зах!
случае, трудно было различить митохондрии,
ватившие митохондрии, сливаются не с лизосо!
выброшенные из живых клеток и разрушивших!
мами, а с плазматической мембраной, выбрасы!
ся тромбоцитов. В модели, не требующей выде!
вая «голые» митохондрии в среду. Кроме мито!
ления клеток, было показано, что содержание
хондриальных белков, во внеклеточной среде
митохондриального материала тромбоцитов в
появлялась и митохондриальная ДНК. Как и в
крови коррелировало с тяжестью протекания
работе, посвященной эффекту TNF и FAS!ли!
системной красной волчанки, тяжелого аутоим!
ганда, авторы предполагают, что выброс мито!
мунного заболевания [50].
хондрий способствует развитию воспалительно!
Выброс митохондриальной ДНК. Тромбоциты
го ответа.
не являются единственным источником мито!
Еще одним источником внеклеточных мито!
хондриальной ДНК и других компонентов ми!
хондриальных компонентов при воспалении
тохондрий во внеклеточных жидкостях. Так,
могут служить лимфоциты. При активации
при обработке моноцитов с помощью ЛПС
апоптоза в Т!клетках под действием FAS!лиган!
in vitro, а также в крови добровольцев после вве!
да наблюдаются различные формы деградации
дения низких доз ЛПС наблюдалось накопле!
митохондрий: фрагменты крист с конденсиро!
ние экзосом, обогащенных мтДНК и белками
ванным матриксом, но без внешней мембраны;
митохондрий [51]. Эти экзосомы стимулирова!
«тени» митохондрий, лишенные внутренней
ли продукцию воспалительных цитокинов в
мембраны и матрикса; митохондрии в составе
клетках эндотелия, причем эффективность сти!
аутофагосом [46]. В этой модели деградации ми!
муляции зависела от содержания в них митохо!
тохондрий предшествовало их «перемешива!
ндриального материала. Интересно, что предоб!
ние» с секреторными везикулами аппарата
работка моноцитов митохондриально!направ!
Гольджи [46], что предполагает возможность
ленным антиоксидантом MitoTEMPO значи!
выброса компонентов митохондрий из клетки.
тельно снижала способность экзосом к стимуля!
Быстрый массированный выброс мтДНК был
ции эндотелия. По!видимому, основным про!
БИОХИМИЯ том 85 вып. 12 2020
1756
ЛЯМЗАЕВ и др.
воспалительным действием обладали окислен!
из клеток выбрасывается, в основном, мтДНК,
ные компоненты митохондрий в составе экзо!
и жизнеспособность и естественные эффектор!
сом [51]. Известно, что эндотелий также участ!
ные функции нейтрофила сохраняются [56].
вует в образовании экзосом и в обмене сигнала!
Впервые прижизненный выброс ДНК нейтро!
ми с клетками крови [52].
филами был описан в системе, где присутство!
Стимуляция тучных клеток in vivo под
вали тромбоциты, активированные ЛПС [59].
действием иммунных комплексов (IgE/anti!IgE)
Сходный «витальный НЕТоз» наблюдался in vivo
или пептида «субстанции Р» приводила к секре!
при заражении кожи грамположительными бак!
ции экзосом, содержащих мтДНК [53]. Как и в
териями [60]. Интересно, что после этого безъя!
случае моноцитов, выброс митохондриальных
дерные нейтрофилы были способны к хемотак!
компонентов из тучных клеток мог способство!
сису и фагоцитозу бактерий. Массированный и
вать развитию как локального, так и системного
очень быстрый выброс митохондриальной
воспаления.
мтДНК без утраты жизнеспособности наблю!
Секреция митохондрий может служить для
дался в эозинофилах и нейтрофилах, предобра!
доставки митохондриальных компонентов в
ботанных воспалительными цитокинами IL!
другие клетки. Так, например, ДНК!содержа!
5/IFN!γ или GM!CSF, соответственно, и стиму!
щие везикулы, секретируемые активированны!
лированных ЛПС [61, 62]. В обоих типах грану!
ми Т!клетками, могут взаимодействовать с
лоцитов этот процесс зависел от активности
дендритными клетками, переносить в них ДНК
NADPH!оксидазы, как и в большинстве случаев
(включая митохондриальную) и индуцировать
«классического» НЕТоза. Вопрос о функцио!
реакции антивирусной защиты [54]. Предпола!
нальной роли массированного выброса мтДНК
гается, что межклеточный перенос митохонд!
остается открытым. Низкое содержание мито!
рий с помощью везикул, а также иных механиз!
хондрий в нейтрофилах и, особенно, в эозино!
мов, может выполнять не только сигнальные
филах делает маловероятным образование
функции, но и служить для усиления энергети!
функциональных ловушек для патогенов. В слу!
ческого метаболизма в клетках реципиентах
чае лимфоцитов (см. выше) фибриллярная
[55], однако эта гипотеза требует тщательной
мтДНК выполняет сигнальную функцию, сти!
проверки.
мулируя антивирусный ответ мононуклеаров
Все перечисленные выше примеры выброса
периферической крови [47]. Как уже отмеча!
митохондрий и мтДНК не связаны с гибелью
лось, внеклеточная мтДНК (часто окисленная)
клеток. Другим источником мтДНК в крови мо!
встречается в крови при широком спектре пато!
гут быть различные формы программированной
логий, включая системную красную волчанку,
гибели клеток. Наиболее хорошо исследована
аутоиммунное заболевание, в патогенезе кото!
гибель нейтрофилов (т.н. НЕТоз), при которой
рого важную роль играет НЕТоз [42].
из клетки выбрасывается деконденсированный
хроматин, и образуются «внеклеточные ловуш!
ки» (neutrophil extracellular traps, NETs) [56].
МИТОПТОЗ, СВЯЗАННЫЙ
НЕТоз может вызываться различными патоге!
С ЭЛИМИНАЦИЕЙ МИТОХОНДРИЙ
нами, такими как бактерии, грибы, простей!
ВНУТРИ КЛЕТКИ
шие, вирусы, а также ЛПС, иммунными комп!
лексами, микрокристаллами и другими физио!
Митоптоз при терминальной дифференциров6
логическими стимулами. Выброс ловушек спо!
ке. Основным механизмом элиминации мито!
собствует уничтожению патогенов, но при этом
хондрий внутри клетки является их селектив!
служит причиной мощных воспалительных и
ная аутофагия (митофагия) (рисунок, I). Этот
аутоиммунных реакций и связанных с ними за!
механизм использует основные компоненты
болеваний. Выброс гигантских ДНК!белковых
неселективной макроаутофагии, но с помощью
комплексов происходит без разрыва плазмати!
различных адаптерных белков выделяет пов!
ческой мембраны через поры, образованные
режденные митохондрии и направляет их в ау!
белком газдермином Д [57]. Интересно, что на
тофагосомы и далее в аутолизосомы. Наиболее
ранних стадиях НЕТоза может происходить раз!
хорошо исследована система контроля качества
рушение митохондрий, чему способствует отк!
митохондрий на основе белков PINK1/Parkin
рытие неселективной митохондриальной поры
[63]. Снижение мембранного потенциала мито!
[58]. Не вызывает сомнений, что мтДНК и дру!
хондрий препятствует транспорту протеинки!
гие компоненты митохондрий выходят из нейт!
назы PINK1 в матрикс митохондрии и его дег!
рофилов в процессе НЕТоза [42].
радации, что приводит к его экспонированию
Наряду с «классическим» НЕТозом описано
на внешней поверхности митохондрий и прив!
явление т.н. «витального НЕТоза», при котором
лечению убиквитин!лигазы Parkin. Убиквити!
БИОХИМИЯ том 85 вып. 12 2020
МИТОПТОЗ
1757
нирование митохондриальных белков с по!
мощью нокаута соответствующих генов, показа!
мощью Parkin служит сигналом для захвата ми!
ли, что Atg5, один из основных белков, участву!
тохондрий аутофагосомой. Кроме PINK1/
ющих в формировании аутофагосомы при кано!
Parkin!зависимой митофагии, в условиях ги!
нической аутофагии, не нужен для элиминации
поксии или при окислительном стрессе могут
митохондрий в ретикулоцитах [72]. Лишь час!
запускаться альтернативные варианты избира!
тично этот процесс зависит от белка Atg7, акти!
тельного уничтожения митохондрий при учас!
вирующего Atg5 [73]. Митофагия, независимая
тии таких белков, как DJ!1, BNIP3L/NIX,
от Atg7, наблюдалась в клетках при эритролей!
BNIP3 и FUNDC1 [64]. Главным предназначе!
кемии К562 в присутствии разобщителя окисли!
нием митофагии несомненно является конт!
тельного фосфорилирования [74]. Интересно,
роль качества митохондрий путем элиминации
что в фибробластах с нокаутом по Atg5 и овер!
поврежденных органелл. В то же время митофа!
экспрессией BNIP также наблюдалась элимина!
гия участвует в массовом уничтожении митохон!
ция деполяризованных митохондрий при учас!
дрий (митоптозе) при некоторых формах тер!
тии поздних эндосом, образующих однослой!
минальной дифференцировки и перестройке
ную мембрану вокруг митохондрий [75]. Воз!
метаболизма.
можное участие этих механизмов в дифферен!
Наиболее известен митоптоз при эритропоэ!
цировке ретикулоцитов еще только предстоит
зе. В кроветворных органах происходит энукле!
выяснить.
ация эритробластных предшественников с об!
Данных о возможном выбросе митохондрий
разованием ретикулоцитов, которые затем ли!
из ретикулоцитов в процессе дифференциров!
шаются митохондрий и превращаются в эритро!
ки, за исключением ранних электронно!мик!
циты. Электронно!микроскопические исследо!
роскопических наблюдений [65], нам обнару!
вания дифференцировки ретикулоцитов [65]
жить не удалось. Возможность экзоцитоза ауто!
показали, что сначала около митохондрий соби!
фагосом была продемонстрирована в различных
раются мембранные везикулы неизвестного
типах клеток [76]. С помощью этого механизма
происхождения, затем везикулы сливаются и
из клеток могут выбрасываться сигнальные мо!
окружают митохондрию двухслойной мембра!
лекулы (в частности, цитокины), агрегаты бел!
ной. Это процесс во многом напоминал аутофа!
ков, микроорганизмы и фрагменты органелл.
гию. В то же время наблюдался выход митохонд!
Кроме того, аутофагосомы могут взаимодей!
рий из клетки после слияния окружавшей их
ствовать с мультивезикулярными тельцами и
мембраны с плазматической, что не характерно
выбрасывать свое содержимое в составе экзо!
для «канонической» аутофагии. Детали процес!
сом. Ретикулоциты были первым типом клеток,
са выброса митохондрий из ретикулоцитов, как
для которого описано образование экзосом.
и в других подобных случаях митоптоза, остают!
Многочисленные данные о присутствии мито!
ся не до конца изученными.
хондриальных компонентов в экзосомах раз!
Важнейшим компонентом программы ми!
личных типов клеток мы уже приводили выше.
топтоза ретикулоцитов является белок
Наряду с экзосомами, в выбросе митохондрий
BNIP3L/NIX, который принадлежит к большо!
из ретикулоцитов могут участвовать и внекле!
му семейству белков, родственных Bcl!2, основ!
точные везикулы, образованные плазматичес!
ные функции которых связаны с регуляцией
кой мембраной. Такие везикулы, несущие ос!
участия митохондрий в апоптозе. Функции NIX,
новной сиалогликопротеид мембраны эритро!
однако, связаны с митофагией, а его участие в
цитов гликофорин А и содержащие компоненты
апоптозе слабо изучено [66, 67]. NIX связывает!
митохондрий и лизосом, были обнаружены в
ся с одним из основных белков аутофагосомы
процессе дифференцировки человеческих рети!
LC3 и служит адаптером при митофагии. При
кулоцитов in vitro [77].
дифференцировке ретикулоцитов экспрессия
Важную роль в элиминации митохондрий
NIX многократно возрастает [68], а его нокаут
ретикулоцитов, наряду с митофагией и выбро!
полностью останавливает митоптоз [69].
сом органелл, по!видимому, играет окислитель!
Еще одним белком, без которого не проис!
ная и протеолитическая деградация. В процессе
ходит митофагия в ретикулоцитах, является ки!
дифференцировки митохондриальные мембра!
наза ULK1 [70]. ULK1 участвует в инициации
ны подвергаются окислению с помощью 15!ли!
различных, но не всех известных форм аутофа!
поксигеназы [78]. Окисление мембран активи!
гии [71]. В канонической аутофагии ULK1 акти!
рует АТФ!зависимый протеолиз мембранных
вируется при недостатке субстратов, но причи!
белков [79]. Остается загадкой, как эти реакции
ны ее активации и мишени в ретикулоцитах не
соотносятся с механизмами, описанными выше.
выяснены. Исследования роли других белков
Интересно, что у мышей с генетически нару!
аутофагического каскада, проведенные с по!
шенной функцией исправления ошибок репли!
БИОХИМИЯ том 85 вып. 12 2020
1758
ЛЯМЗАЕВ и др.
кации в митохондриальной ДНК!полимеразе
происходит при участии митофагии, но в этом
PolG наблюдаются нарушения в процессе эли!
случае адаптером служит BNIP3L/NIX [88]. Ми!
минации митохондрий при эритропоэзе [80].
тофагия участвует в миогенной дифференци!
Эти данные указывают на то, что митохондрии
ровке, как было показано для иммортализован!
могут играть более активную роль в процессе
ных миобластов линии С2С12 [89] и предшест!
митоптоза в ретикулоцитах.
венников кардиомиоцитов [90, 91]. Интересно,
Помимо эритропоэза, митоптоз, в той или
что в последнем случае дифференцировка зави!
иной степени, участвует в терминальной диф!
села как от PINK1/Parkin, так и от адаптеров ми!
ференцировке волокон хрусталика, адипоцитов
тофагии BNIP3L/NIX и FUNDC1. Предполага!
и кератиноцитов. При формировании хрустали!
ется, что в мышечных клетках митофагия при!
ка митохондрии и все прочие органеллы элими!
водит к обновлению популяции митохондрий,
нируются в волокнах, которые образуют т.н. зо!
формированию разветвленной митохондриаль!
ну свободную от органелл. Таким образом дос!
ной сети и повышению эффективности окисли!
тигается максимальная возможная прозрач!
тельного фосфорилирования.
ность. Механизм митоптоза при дифференци!
Митоптоз и метаболическая перестройка. Из!
ровке хрусталика изучен недостаточно. Показа!
вестны случаи, когда дифференцировка и
но лишь, что для него необходим BNIP3L/NIX и
функционирование клеток зависят от перест!
это указывает на участие митофагии [81]. Нео!
ройки метаболизма, связанного с митоптозом.
жиданно оказалось, что этот белок необходим
Так, у дрожжей при голодании по источникам
также для элиминации аппарата Гольджи и эн!
азота и глюкозе происходит активация митофа!
доплазматического ретикулума, но не ядра. При
гии и значительное (более 50%) снижение со!
формировании хрусталика наблюдается выра!
держания митохондрий [92]. Митохондриаль!
женная активация аутофагии, но нокаут гена
ные белки в данном случае расщепляются и
Atg5 не нарушает образование «зоны, свободной
служат источником азота для синтеза нуклеоти!
от органелл» [82]. Интересно, что у мышей с но!
дов. Перестройка энергетического метаболизма
каутом гена Atg5 с возрастом быстро развивалась
c окислительного на гликолитический также
катаракта, что указывает на участие аутофагии в
может происходить при участии митоптоза. На!
поддержании прозрачности хрусталика. К сожа!
иболее ярко зависимость клеточной судьбы от
лению, возможность участия альтернативной
метаболической перестройки и митоптоза про!
Atg5/Atg7 независимой аутофагии в элимина!
является в случае стволовых клеток. Как эмбри!
ции органелл выяснить не удалось, поскольку
ональные, так и гематопоэтические стволовые
нокаут соответствующих генов нарушал образо!
клетки имеют низкое содержание митохонд!
вание хрусталика на ранних стадиях развития
рий, и их метаболизм полностью зависит от
[82]. Интересный пример обратимого митоптоза
гликолиза. В последнем случае такое состояние
наблюдается в колбочках сетчатки сусликов
соответствует гипоксии, характерной для гема!
[83]. В процессе гибернации в этих клетках ак!
топоэтической ниши, и поддерживается благо!
тивируется аутофагия, и практически пол!
даря активной митофагии [93]. Детальный ме!
ностью исчезают митохондрии, а также многие
ханизм митофагии в этих клетках неизвестен,
другие органеллы, однако после пробуждения
но показано, что нокаут гена Atg7 приводит к
клеточный состав восстанавливается.
нарушению как эритропоэза, так и лимфопоэза
При дифференцировке адипоцитов проис!
[94]. Зависимость «стволовости» от содержания
ходит уничтожение значительной части митохо!
митохондрий проявляется в том, что перепрог!
ндрий. Показано, что нарушение аутофагии [84]
раммирование соматических клеток в плюри!
или нокаут Parkin [85] приводят к превращению
потентные зависит от митофагии, которая ак!
белого жира в бежевый с повышенным содержа!
тивируется при участии BNIP3L/NIX [95], а
нием митохондрий. Подобно бурому жиру, он
также PINK1 [96]. Интересно, что в дрожжах
способен к поддержанию термогенеза. Диффе!
переход на гликолитический метаболизм, свя!
ренцировка адипоцитов из ранних предшест!
занный со снижением содержания митохонд!
венников зависит от рецептора митофагии
рий, зависит не от элиминации митохондрий, а
Bcl2l13, который способствует метаболической
от снижения экспрессии митохондриальных
перестройке клеток [86].
белков (т.н. «глюкозная репрессия»).
Митофагия может играть важную роль в
Приведенные выше примеры терминальной
дифференцировке клеток, которые сохраняют
дифференцировки при участии митоптоза (ре!
высокое содержание митохондрий. Так, диффе!
тикулоциты, волокна хрусталика, адипоциты)
ренцировка кератиноцитов зависит от BNIP3 и
также включают метаболическую перестройку.
активной аутофагии [87]. Интересно, что орого!
Еще одним примером зависимости метаболи!
вение кератиноцитов при росте волос также
ческой перестройки от митоптоза служит диф!
БИОХИМИЯ том 85 вып. 12 2020
МИТОПТОЗ
1759
ференцировка ганглионарных клеток сетчатки,
воляет им избавляться от мутантных вариантов
нейронов, аксоны которых образуют зритель!
мтДНК [101].
ный нерв [97]. Митоптоз в этом случае зависит
Удивительно велико разнообразие механиз!
от BNIP3L/NIX и активируется благодаря ги!
мов, с помощью которых происходит деграда!
поксии при участии транскрипционного факто!
ция отцовских митохондрий (или мтДНК) у раз!
ра Hif1a. В той же работе было показано, что
ных таксонов [102]. У плодовых мушек дрозо!
BNIP3L/NIX!зависимая митофагия участвует в
фил деградация мтДНК происходит еще в спер!
дифференцировке и метаболической перест!
матозоидах, в этом процессе принимает участие
ройке провоспалительных M1 макрофагов [97].
митохондриальная эндонуклеаза EndoG [103].
Гликолиз обеспечивает значительно более
При этом, если в гене EndoG содержится мута!
быстрое, хотя и менее эффективное, энергос!
ция, нарушающая ее функцию, то все равно
набжение клетки. Это ярко проявляется в случае
сперматозоиды избавляются от митохондриаль!
быстро делящихся клеток, однако и раковые
ной ДНК в результате «тримминга» их хвостов:
клетки, и активированные Т!лимфоциты сохра!
завершающий этап сперматогенеза заключается
няют высокое содержание митохондрий. Таким
в том, что 64 специальные структуры «investment
образом, митоптоз не является единственным
cones» крепятся к актиновым филаментам у яд!
возможным механизмом метаболической пере!
ра и с помощью различных миозинов двигаются
стройки.
к хвосту, собирая все остатки митохондрий и
Уничтожение отцовских митохондрий при ма6
другие органеллы. Кончик хвоста с собранным в
теринском наследовании мтДНК. Особым случа!
нем материалом затем отрезается [103]. Уничто!
ем, когда клетки избавляются от митохондрий,
жение митохондрий, по!видимому, происходит
является уничтожение отцовских митохондрий
без участия митофагии, но ее адаптерные белки
в зародышевой линии многоклеточных живот!
оказываются необходимы. Показано, что для
ных. Наследование мтДНК строго от одного из
мутантов по PINK1 или Parkin характерна мужс!
родителей (обычно матери) благодаря активно!
кая стерильность, однако детали возможного
му уничтожению отцовских митохондрий очень
участия митофагии в сперматогенезе остаются
широко распространено в природе, в то время
невыясненными. Если в в яйцеклетку вместе со
как передача мтДНК от обоих родителей - от!
сперматозоидом все же проникают митохонд!
носительно редкое исключение. Так, например,
рии, то они уничтожаются с помощью Parkin!
у нематоды C. elegans оплодотворение яйцеклет!
независимой аутофагии и эндосом, которые со!
ки приводит к активации аутофагии, с помощью
бираются в мультивезикулярные тельца [104].
которой разрушаются отцовские митохондрии.
У млекопитающих механизмы элиминации
Нарушение этого процесса, вызванное мутаци!
отцовской мтДНК (и митохондрий) и их эффек!
ей в гене LGG 1 (гомолог LC3, основного компо!
тивность до сих пор остаются неясными. Было
нента аутофагосомы), приводит к тому, что от!
обнаружено, что у мышей мтДНК отсутствует в
цовская мтДНК сохраняется в развивающемся
наиболее подвижных сперматозоидах, которые
эмбрионе [98]. На поверхности наружной мемб!
с наибольшей вероятностью участвуют в опло!
раны митохондрий сперматозоидов C. elegans
дотворении. В этих клетках были обнаружены
находится большое количество рецепторов ми!
вакуолизированные митохондрии и митохонд!
тофагии FNDC1 (гомолог FUNDC!1), что при!
риальные компоненты сохранялись после опло!
водит к селективному уничтожению отцовских
дотворения в некоторых клетках зиготы вплоть
митохондрий в зиготе независимо от убиквити!
до стадии морулы [105]. Однако эта работа не
нирования [99]. Одновременно в зиготе C. ele
получила подтверждения в дальнейшем. Напро!
gans происходит убиквитин!зависимая деграда!
тив, было показано, что митохондрии из спер!
ция отцовских митохондрий. Эта деградация за!
матозоида при попадании в яйцеклетку деполя!
висит от субъединиц протеасомы, которые слу!
ризуются в течение 48 ч и деградируют на этапе
жат рецепторами убиквитина, и способствует
3!ого деления бластомеров с помощью двух
созреванию аутофагосомы и ее слиянию с лизо!
убиквитин!лигаз Parkin и MUL1, каждая из
сомами [100].
которых участвует в элиминации [106]. Кроме
Интересно, что митофагия принимает учас!
них, в уничтожении отцовских митохондрий
тие в деградации митохондрий даже в тех случа!
участвуют компоненты аутофагии (белки
ях, когда не наблюдается строгого наследования
SQSTM1/p62 и GABARAP) и валозин!содержа!
мтДНК от одного из родителей. Так, например,
щий белок (VCP), который взаимодействует с
у пекарских дрожжей (наследование мтДНК от
убиквитином и протеасомной системой дегра!
обоих родителей) слияние клеток противопо!
дации белков [107]. Убиквитинирование мито!
ложного типа спаривания приводит к активации
хондрий также происходит у мышей при спер!
Atg32! и Atg33!зависимой митофагии. Это поз!
матогенезе [108].
БИОХИМИЯ том 85 вып. 12 2020
1760
ЛЯМЗАЕВ и др.
АСИММЕТРИЧНОЕ НАСЛЕДОВАНИЕ
ковыми сенсорами во внутреннем ухе, асиммет!
МИТОХОНДРИЙ
ричное распределение митохондрий происходит
при митозе и образовании поддерживающих
В предыдущих разделах были обсуждены
клеток [114].
сценарии, в которых митохондрии уничтожа!
Наиболее детально асимметричное распре!
лись специализированными внутриклеточными
деление митохондрий было исследовано в клет!
системами или выбрасывались из клетки. По!
ках, полученных из опухоли молочной железы и
мимо этих двух возможностей, избавление от
имеющих признаки стволовых раковых клеток
неправильно функционирующих митохондрий
[115]. В этих клетках экспрессировали митохо!
может происходить «вместе» с клеткой при
ндриально!адресованный фотоактивируемый
асимметричном распределении митохондрий
белок раGFP и затем активировали его ультра!
между делящимися клетками (рисунок, IV).
фиолетом. Поскольку после освещения синтез
Простейшим примером клеток с асиммет!
раGFP продолжался, флуоресценция сохраня!
ричным наследованием митохондрий могут слу!
лась только в «старых» митохондриях. Оказа!
жить почкующиеся дрожжи — Saccharomyces
лось, что при делении одна из дочерних клеток
cerevisiae. При вегетативном делении дрожжей
получает значительно больше «старых» митохо!
митохондрии не случайным образом распреде!
ндрий, а в другой — больше «новых» митохонд!
ляются между материнской и дочерней клетка!
рий. При этом клетки, получившие меньше
ми, а подвергаются сортировке. Этому процессу
«старых» митохондрий, демонстрировали более
способствует активный транспорт митохондрий
выраженные свойства стволовых клеток [115].
между клетками [109], а также селективное зая!
Такое распределение митохондрий зависело от
коривание в дочерней клетке митохондрий с вы!
динамин!подобного белка Drp1, участвующего
соким мембранным потенциалом [110] и уров!
в фрагментации митохондрий, и не терялось
нем восстановленности матрикса, измеренным с
при снижении мембранного потенциала. Позд!
помощью редокс!чувствительного флуоресцент!
нее в этой модели было показано [117], что бо!
ного белка roGFP [111]. Такая активная сегрега!
лее «стволовые» клетки получают митохондрии
ция митохондрий приводит к тому, что дочерние
с более высоким содержанием восстановленно!
клетки с большей вероятностью получают мито!
го глутатиона и сниженной продукцией АФК.
хондрии без каких!либо нарушений. Материнс!
Как и при распределении митохондрий в дрож!
кие клетки, наоборот, с каждым последующим
жах, «молодые» митохондрии закреплялись на
делением обогащаются дефектными митохонд!
плазматической мембране с помощью еще од!
риями. В результате этого обогащения уже после
ного динамин!подобного белка митофузина,
образования всего нескольких почек (дочерних
который участвует в слиянии митохондрий. В
клеток) в материнской клетке наблюдаются из!
«нестволовых» клетках из опухоли молочной
менения в структуре митохондриального ретику!
железы распределение митохондрий было сим!
лума и накапливаются деполяризованные мито!
метричным [117]. Асимметричное распределе!
хондрии [112]. После образования 15-25 дочер!
ние митохондрий было недавно обнаружено при
них клеток материнская клетка погибает, и уве!
делении гематопоэтических стволовых клеток
личение вероятности гибели материнской клет!
(ГСК) [116]. Для этих клеток характерно асим!
ки с каждой последующей образованной почкой
метричное деление, при котором одна из дочер!
получило название «репликативное старение».
них клеток сохраняет свойства ГСК, а другая
Асимметричное распределение митохонд!
дифференцируется. В этой работе было показа!
рий было также описано для клеток животных, в
но, что после трансплантации костного мозга
частности, при созревании ооцитов [113] и сен!
активация деления ГСК приводит к тому, что в
сорных клеток внутреннего уха [114], а также
клетках, которые остаются стволовыми, накап!
для раковых [115] и гематопоэтических [116]
ливаются дефектные митохондрии, имеющие
стволовых клеток. В процессе созревания мы!
низкий мембранный потенциал и высокий уро!
шиного ооцита происходит два мейоза, при ко!
вень продукции митохондриальных АФК. Об!
торых образуются и затем погибают т. н. поляр!
щее содержание митохондрий при этом не отли!
ные тельца. Полярное тельце, возникающее при
чалось от исходного, но они имели более вытя!
первом мейозе, практически лишено митохонд!
нутую форму и дезорганизованные кристы. Ав!
рий, и это происходит в результате их активного
торы полагают, что такое распределение мито!
движения в ооцит с помощью актиновых фила!
хондрий происходит благодаря инактивации
ментов [113]. Интересно, что при втором мейозе
Drp1. Фармакологическое или генетическое
митохондрии равномерно распределяются меж!
выключение Drp1 предотвращало дифференци!
ду ооцитом и полярным тельцем. При формиро!
ровку ГСК и сохраняло их стволовость. Как уже
вании волосковых клеток, которые служат зву!
отмечалось, неделящиеся ГСК имеют низкое
БИОХИМИЯ том 85 вып. 12 2020
МИТОПТОЗ
1761
содержание митохондрий, и оно поддерживает!
обозначения программированной гибели орга!
ся благодаря активной митофагии [93]. Возмож!
низма и как частный случай программы старе!
но, накопление дефектных митохондрий при
ния. Надо отметить, что в 1999 г. были лишь на!
делении ГСК определяет старение пула стволо!
чаты исследования системы контроля качества
вых клеток с возрастом.
митохондрий, а термин «митофагия» был пред!
Наиболее известным примером селекции
ложен Дж. Лемастерсом в 2005 г. В данном обзо!
митохондрий в составе целых клеток является
ре показано, что митоптоз включен в очень ши!
атрезия фолликулярных клеток яичников [118].
рокий круг процессов, включая дифференци!
На стадии первичного фолликула в зародыше!
ровку и воспаление, а митофагия может служить
вой линии млекопитающих происходит значи!
одним, но не единственным, механизмом прог!
тельное снижение числа копий митохондриаль!
раммированной элиминации митохондрий.
ной ДНК в расчете на одну клетку. Клетки, по!
Изучение механизмов митоптоза чрезвычайно
лучившие преимущественно мтДНК с вредны!
важно как для понимания нормальных физио!
ми мутациями, погибают с большей вероят!
логических процессов, так и различных патоло!
ностью, и, тем самым, снижается вероятность
гий, в том числе, воспалительных и нейродеге!
передачи дефектной мтДНК потомству [119].
неративных заболеваний. Эти механизмы очень
Атрезия фолликулов яичников, вероятно, явля!
разнообразны и некоторые их ключевые момен!
ется одним из механизмов контроля качества
ты, такие как процесс выброса митохондрий из
мтДНК и играет роль митоптоза в зародышевой
клетки, пока изучены недостаточно.
линии млекопитающих. Таким образом, селек!
Мы посвящаем этот обзор Владимиру Пет!
тивное уничтожение поврежденных митохонд!
ровичу Скулачеву, который не только стоял у
рий возможно и при внешне симметричном де!
истоков изучения митоптоза, но на многие годы
лении клеток животных за счет выбраковки це!
стал любимым Учителем для авторов, их друзей
лых клеток, получивших такие митохондрии.
и сотрудников. Мы от всей души поздравляем
Владимира Петровича с прошедшим юбилеем и
желаем ему долгой счастливой и плодотворной
В.П. Скулачев стал автором нескольких тер!
жизни на благо науки.
минов, прочно вошедших в современную науку.
Он, в частности, в 1968 г. предложил использо!
вать термин «биоэнергетика» для обозначения
Финансирование. Работа выполнена при фи!
науки, изучающей механизмы преобразования
нансовой поддержке Российского научного
энергии в живых организмах. Этот термин ранее
фонда (грант 17!14!01314!П), а также при под!
был использован нобелевским лауреатом
держке Междисциплинарной научно!образова!
А. Сент!Дьердьи для описания своих представ!
тельной школы Московского университета
лений о жизни и ее энергообеспечении, но не
«Молекулярные технологии живых систем и
получил распространения. Интересно, что отдел
синтетическая биология».
биоэнергетики в МГУ был организован Влади!
Конфликт интересов. Авторы заявляют об от!
миром Петровичем в 1965 г. за три года до офи!
сутствии конфликта интересов.
циальных «крестин» новой науки. Введение тер!
Соблюдение этических норм. Настоящая
мина «митоптоз» имело большое значение для
статья не содержит описания каких!либо иссле!
формирования концепции «феноптоза». Этот
дований с участием людей или животных в каче!
термин был предложен В.П. Скулачевым для
стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Skulachev, V. P. (1999) Mitochondrial physiology and
tion of mitochondrial structure and function after Bid! or
pathology; concepts of programmed death of organelles,
Bax!mediated cytochrome c release, J. Cell Biol., 150,
cells and organisms, Mol. Aspects Med., 20, 139!184,
1027!1030, doi: 10.1083/jcb.150.5.1027.
doi: 10.1016/s0098!2997(99)00008!4.
6.
Garcia Fernandez, M., Troiano, L., Moretti, L., Nasi, M.,
2.
Skulachev, V. P. (1999) Phenoptosis: programmed death of
Pinti, M., Salvioli, S., et al. (2002) Early changes in
an organism, Biochemistry, 64, 1418!1426.
intramitochondrial cardiolipin distribution during apopto!
3.
Skulachev, V. P. (2000) Mitochondria in the programmed
sis, Cell Growth Differ., 13, 449!455.
death phenomena; a principle of biology: “it is better to die
7.
Bota, D. A., Ngo, J. K., and Davies, K. J. A. (2005) Down!
than to be wrong”, IUBMB Life,
49,
365!373,
regulation of the human Lon protease impairs mitochondr!
doi: 10.1080/152165400410209.
ial structure and function and causes cell death, Free Radic.
4.
Skulachev, V. P. (2001) The programmed death phenome!
Biol. Med., 38, 665!677, doi: 10.1016/j.freeradbiomed.
na, aging, and the samurai law of biology, Exp. Gerontol.,
2004.11.017.
36, 995!1024, doi: 10.1016/s0531!5565(01)00109!7.
8.
Rose, G., Passarino, G., Franceschi, C., and De
5.
Von Ahsen, O., Renken, C., Perkins, G., Kluck, R. M.,
Benedictis, G. (2002) The variability of the mitochondrial
Bossy!Wetzel, E., and Newmeyer, D. D. (2000) Preserva!
genome in human aging: a key for life and death? Int. J.
3 БИОХИМИЯ том 85 вып. 12 2020
1762
ЛЯМЗАЕВ и др.
Biochem. Cell Biol., 34, 1449!1460, doi: 10.1016/s1357!
mitochondria in oxidatively stressed human choriocarci!
2725(02)00042!0.
noma cells, Folia Morphol., 63, 407!412.
9.
Tinari, A., Garofalo, T., Sorice, M., Esposti, M. D., and
25.
Agarwal, S., and Ganesh, S. (2020) Perinuclear mitochon!
Malorni, W. (2007) Mitoptosis: different pathways for
drial clustering, increased ROS levels, and HIF1 are
mitochondrial execution, Autophagy,
3,
282!284,
required for the activation of HSF1 by heat stress, J. Cell.
doi: 10.4161/auto.3924.
Sci., doi: 10.1242/jcs.245589.
10.
Géminard, C., de Gassart, A., and Vidal, M. (2002)
26.
Kim, S., Kim, H.!Y., Lee, S., Kim, S.W., Sohn, S., Kim, K.,
Reticulocyte maturation: mitoptosis and exosome release,
et al. (2007) Hepatitis B virus x protein induces perinuclear
Biocell, 26, 205!215.
mitochondrial clustering in microtubule! and Dynein!
11.
Lyamzaev, K. G., Pletjushkina, O. Y., Saprunova, V. B.,
dependent manners, J. Virol., 81, 1714!1726, doi: 10.1128/
Bakeeva, L. E., Chernyak, B. V., and Skulachev, V. P.
JVI.01863!06.
(2004) Selective elimination of mitochondria from living
27.
Lyamzaev, K. G., Tokarchuk, A. V., Panteleeva, A. A.,
cells induced by inhibitors of bioenergetic functions,
Mulkidjanian, A. Y., Skulachev, V. P., and Chernyak, B. V.
Biochem. Soc. Trans., 32, 1070!1071, doi: 10.1042/
(2018) Induction of autophagy by depolarization of mito!
BST0321070.
chondria, Autophagy, 14, 921!924, doi: 10.1080/15548627.
12.
Lyamzaev, K. G., Nepryakhina, O. K., Saprunova, V. B.,
2018.1436937.
Bakeeva, L. E., Pletjushkina, O. Y., et al. (2008) Novel
28.
Lee, H.!J., Patel, S., and Lee, S.!J. (2005) Intravesicular
mechanism of elimination of malfunctioning mitochon!
localization and exocytosis of alpha!synuclein and its
dria (mitoptosis): formation of mitoptotic bodies and
aggregates, J. Neurosci., 25, 6016!6024, doi: 10.1523/
extrusion of mitochondrial material from the cell,
JNEUROSCI.0692!05.2005.
Biochim. Biophys. Acta, 1777, 817!825, doi: 10.1016/
29.
Lee, H.!J., Cho, E.!D., Lee, K.W., Kim, J.!H., Cho, S.!G.,
j.bbabio.2008.03.027.
and Lee, S.!J. (2013) Autophagic failure promotes the exo!
13.
Skulachev, V. P., Bakeeva, L. E., Chernyak, B. V.,
cytosis and intercellular transfer of α!synuclein, Exp. Mol.
Domnina, L. V., Minin, A. A., et al. (2004) Thread!grain
Med., 45, 22, doi: 10.1038/emm.2013.45.
transition of mitochondrial reticulum as a step of mitopto!
30.
Izyumov, D. S., Avetisyan, A. V., Pletjushkina, O. Y.,
sis and apoptosis, Mol. Cell. Biochem., 2566257, 341!358,
Sakharov, D. V., Wirtz, K. W., et al. (2004) “Wages of fear”:
doi: 10.1023/b:mcbi.0000009880.94044.49.
transient threefold decrease in intracellular ATP level
14.
Pletjushkina, O. Y., Lyamzaev, K. G., Popova, E. N.,
imposes apoptosis, Biochim. Biophys. Acta, 1658, 141!147,
Nepryakhina, O. K., Ivanova, O. Y., et al. (2006) Effect of
doi: 10.1016/j.bbabio.2004.05.007.
oxidative stress on dynamics of mitochondrial reticulum,
31.
Ravikumar, B., Sarkar, S., Davies, J. E., Futter, M.,
Biochim. Biophys. Acta, 1757, 518!524, doi: 10.1016/
Garcia!Arencibia, M., Green!Thompson, Z. W., et al.
j.bbabio.2006.03.018.
(2010) Regulation of mammalian autophagy in physiology
15.
Arnoult, D., Rismanchi, N., Grodet, A., Roberts, R.G.,
and pathophysiology, Physiol. Rev.,
90,
1383!1435,
Seeburg, D.P., et al. (2005) Bax/Bak!dependent release of
doi: 10.1152/physrev.00030.2009.
DDP/TIMM8a promotes Drp1!mediated mitochondrial
32.
Melentijevic, I., Toth, M. L., Arnold, M. L., Guasp, R. J.,
fission and mitoptosis during programmed cell death, Curr.
Harinath, G., et al. (2017) C. elegans neurons jettison pro!
Biol., 15, 2112!2118, doi: 10.1016/j.cub.2005.10.041.
tein aggregates and mitochondria under neurotoxic stress,
16.
Ishihara, N., Nomura, M., Jofuku, A., Kato, H., Suzuki,
Nature, 542, 367!371, doi: 10.1038/nature21362.
S. O., Masuda, K., et al. (2009) Mitochondrial fission fac!
33.
Bisharyan, Y., and Clark, T. G. (2011) Calcium!dependent
tor Drp1 is essential for embryonic development and
mitochondrial extrusion in ciliated protozoa,
synapse formation in mice, Nat. Cell Biol., 11, 958!966,
Mitochondrion, 11, 909!918, doi: 10.1016/j.mito.2011.08.
doi: 10.1038/ncb1907.
001.
17.
Burman, J. L., Pickles, S., Wang, C., Sekine, S., Vargas,
34.
Fletcher, G. C., Xue, L., Passingham, S. K., and Tolkovsky,
J. N. S., et al. (2017) Mitochondrial fission facilitates the
A. M. (2000) Death commitment point is advanced by axo!
selective mitophagy of protein aggregates, J. Cell. Biol.,
tomy in sympathetic neurons, J. Cell. Biol., 150, 741!754,
216, 3231!3247, doi: 10.1083/jcb.201612106.
doi: 10.1083/jcb.150.4.741.
18.
Quirós, P. M., Langer, T., and López Ot n, C. (2015) New
35.
Xue, L., Fletcher, G. C., and Tolkovsky, A. M. (2001)
roles for mitochondrial proteases in health, ageing and dis!
Mitochondria are selectively eliminated from eukaryotic
ease, Nat. Rev. Mol. Cell. Biol., 16, 345!359, doi: 10.1038/
cells after blockade of caspases during apoptosis, Curr.
nrm3984.
Biol., 11, 361!365, doi: 10.1016/s0960!9822(01)00100!2.
19.
Palikaras, K., Lionaki, E., and Tavernarakis, N. (2018)
36.
Tolkovsky, A. M., Xue, L., Fletcher, G. C., and Borutaite, V.
Mechanisms of mitophagy in cellular homeostasis, physi!
(2002) Mitochondrial disappearance from cells: a clue to
ology and pathology, Nat. Cell. Biol., 20, 1013!1022,
the role of autophagy in programmed cell death and dis!
doi: 10.1038/s41556!018!0176!2.
ease? Biochimie,
84,
233!240, doi:
10.1016/s0300!
20.
Bock, F. J., and Tait, S. W. G. (2020) Mitochondria as mul!
9084(02)01371!8.
tifaceted regulators of cell death, Nat. Rev. Mol. Cell Biol.,
37.
Chao, H., Lin, C., Zuo, Q., Liu, Y., Xiao, M., et al. (2019)
21, 85!100, doi: 10.1038/s41580!019!0173!8.
Cardiolipin!dependent mitophagy guides outcome after
21.
Tolstonog, G. V., Belichenko!Weitzmann, I. V., Lu, J.!P.,
traumatic brain injury, J. Neurosci., 39, 1930!1943,
Hartig, R., Shoeman, R. L., Traub, U., et al. (2005)
doi: 10.1523/JNEUROSCI.3415!17.2018.
Spontaneously immortalized mouse embryo fibroblasts:
38.
Chu, C. T., Ji, J., Dagda, R. K., Jiang, J. F., Tyurina, Y. Y.,
growth behavior of wild!type and vimentin!deficient cells
et al. (2013) Cardiolipin externalization to the outer mito!
in relation to mitochondrial structure and activity, DNA
chondrial membrane acts as an elimination signal for
Cell. Biol., 24, 680!709, doi: 10.1089/dna.2005.24.680.
mitophagy in neuronal cells, Nat. Cell. Biol., 15, 1197!
22.
Kopito, R. R. (2000) Aggresomes, inclusion bodies and
1205, doi: 10.1038/ncb2837.
protein aggregation, Trends Cell Biol., 10, 524!530,
39.
Wang, C., Hu, Z., Zou, Y., Xiang, M., Jiang, Y., et al.
doi: 10.1016/s0962!8924(00)01852!3.
(2017) The post!therapeutic effect of rapamycin in mild
23.
Tanaka, Y., Kanai, Y., Okada, Y., Nonaka, S., Takeda, S.,
traumatic brain!injured rats ensuing in the upregulation of
et al. (1998) Targeted disruption of mouse conventional
autophagy and mitophagy, Cell. Biol. Int., 41, 1039!1047,
kinesin heavy chain, kif5B, results in abnormal perinuclear
doi: 10.1002/cbin.10820.
clustering of mitochondria, Cell,
93,
1147!1158,
40.
Lou, G., Palikaras, K., Lautrup, S., Scheibye!Knudsen, M.,
doi: 10.1016/s0092!8674(00)81459!2.
Tavernarakis, N., and Fang, E. F. (2020) Mitophagy and
24.
Hallmann, A., Milczarek, R., Lipiсski, M., Kossowska, E.,
neuroprotection, Trends Mol. Med.,
26,
8!20,
Spodnik, J. H., et al. (2004) Fast perinuclear clustering of
doi: 10.1016/j.molmed.2019.07.002.
БИОХИМИЯ том 85 вып. 12 2020
МИТОПТОЗ
1763
41.
Ebneth, A., Godemann, R., Stamer, K., Illenberger, S.,
56.
Yousefi, S., Simon, D., Stojkov, D., Karsonova, A.,
Trinczek, B., and Mandelkow, E. (1998) Overexpression of
Karaulov, A., and Simon, H.!U. (2020) In vivo evidence
tau protein inhibits kinesin!dependent trafficking of vesi!
for extracellular DNA trap formation, Cell Death Dis, 11,
cles, mitochondria, and endoplasmic reticulum: implica!
300, doi: 10.1038/s41419!020!2497!x.
tions for Alzheimer’s disease, J. Cell. Biol., 143, 777!794,
57.
Kambara, H., Liu, F., Zhang, X., Liu, P., Bajrami, B., et al.
doi: 10.1083/jcb.143.3.777.
(2018) Gasdermin D exerts anti!inflammatory effects by
42.
Lood, C., Blanco, L. P., Purmalek, M. M., Carmona!
promoting neutrophil death, Cell Rep., 22, 2924!2936,
Rivera, C., De Ravin, S. S., et al. (2016) Neutrophil extra!
doi: 10.1016/j.celrep.2018.02.067.
cellular traps enriched in oxidized mitochondrial DNA are
58.
Vorobjeva, N., Galkin, I., Pletjushkina, O., Golyshev, S.,
interferogenic and contribute to lupus!like disease, Nat.
Zinovkin, R., et al. (2020) Mitochondrial permeability
Med., 22, 146!153, doi: 10.1038/nm.4027.
transition pore is involved in oxidative burst and NETosis of
43.
Nakajima, A., Kurihara, H., Yagita, H., Okumura, K., and
human neutrophils, Biochim. Biophys. Acta Mol. Basis Dis.,
Nakano, H. (2008) Mitochondrial extrusion through the
1866, 165664, doi: 10.1016/j.bbadis.2020.165664.
cytoplasmic vacuoles during cell death, J. Biol. Chem., 283,
59.
Clark, S. R., Ma, A. C., Tavener, S. A., McDonald, B.,
24128!24135, doi: 10.1074/jbc.M802996200.
Goodarzi, Z., et al. (2007) Platelet TLR4 activates neu!
44.
Unuma, K., Aki, T., Matsuda, S., Funakoshi, T., Yoshida,
trophil extracellular traps to ensnare bacteria in septic
K.!I., and Uemura, K. (2013) Elimination and active
blood, Nat. Med., 13, 463!469, doi: 10.1038/nm1565.
extrusion of liver mitochondrial proteins during
60.
Yipp, B. G., Petri, B., Salina, D., Jenne, C. N., Scott,
lipopolysaccharide administration in rat, Hepatol. Res., 43,
B. N. V., et al. (2012) Infection!induced NETosis is a
526!534, doi: 10.1111/j.1872!034X.2012.01084.x.
dynamic process involving neutrophil multitasking in vivo,
45.
Unuma, K., Aki, T., Funakoshi, T., Hashimoto, K., and
Nat. Med., 18, 1386!1393, doi: 10.1038/nm.2847.
Uemura, K. (2015) Extrusion of mitochondrial contents
61.
Yousefi, S., Gold, J. A., Andina, N., Lee, J. J., Kelly,
from lipopolysaccharide!stimulated cells: involvement of
A. M., et al. (2008) Catapult!like release of mitochondrial
autophagy, Autophagy, 11, 1520!1536, doi: 10.1080/
DNA by eosinophils contributes to antibacterial defense,
15548627.2015.1063765.
Nat. Med., 14, 949!953, doi: 10.1038/nm.1855.
46.
Ouasti, S., Matarrese, P., Paddon, R., Khosravi!Far, R.,
62.
Yousefi, S., Mihalache, C., Kozlowski, E., Schmid, I., and
Sorice, M., et al. (2007) Death receptor ligation triggers
Simon, H. U. (2009) Viable neutrophils release mitochon!
membrane scrambling between Golgi and mitochondria,
drial DNA to form neutrophil extracellular traps, Cell
Cell Death Differ., 14, 453!461, doi: 10.1038/sj.cdd.
Death Differ., 16, 1438!1444, doi: 10.1038/cdd.2009.96.
4402043.
63.
Tanaka, K. (2020) The PINK1!parkin axis: an overview,
47.
Ingelsson, B., Söderberg, D., Strid, T., Söderberg, A.,
Neurosci Res., doi: 10.1016/j.neures.2020.01.006.
Bergh, A.!C., et al. (2018) Lymphocytes eject interferogenic
64.
Liu, L., Sakakibara, K., Chen, Q., and Okamoto, K.
mitochondrial DNA webs in response to CpG and non!
(2014) Receptor!mediated mitophagy in yeast and mam!
CpG oligodeoxynucleotides of class C, Proc. Natl. Acad. Sci.
malian systems, Cell Res., 24, 787!795, doi: 10.1038/
USA, 115, 478!487, doi: 10.1073/pnas.1711950115.
cr.2014.75.
48.
De Paoli, S. H., Tegegn, T. Z., Elhelu, O. K., Strader,
65.
Simpson, C. F., and Kling, J. M. (1968) The mechanism of
M. B., Patel, M., et al. (2018) Dissecting the biochemical
mitochondrial extrusion from phenylhydrazine!induced
architecture and morphological release pathways of the
reticulocytes in the circulating blood, J. Cell. Biol., 36, 103!
human platelet extracellular vesiculome, Cell Mol. Life Sci.,
109.
75, 3781!3801, doi: 10.1007/s00018!018!2771!6.
66.
Ney, P. A. (2015) Mitochondrial autophagy: origins, signif!
49.
Boudreau, L. H., Duchez, A.!C., Cloutier, N., Soulet, D.,
icance, and role of BNIP3 and NIX, Biochim. Biophys.
Martin, N., et al. (2014) Platelets release mitochondria
Acta,
1853,
2775!2783, doi:
10.1016/j.bbamcr.2015.
serving as substrate for bactericidal group IIA!secreted
02.022.
phospholipase A2 to promote inflammation, Blood, 124,
67.
Marinković, M., Šprung, M., and Novak, I. (2020)
2173!2183, doi: 10.1182/blood!2014!05!573543.
Dimerization of mitophagy receptor BNIP3L/NIX is
50.
Linge, P., Fortin, P. R., Lood, C., Bengtsson, A. A., and
essential for recruitment of autophagic machinery,
Boilard, E. (2018) The non!haemostatic role of platelets in
Autophagy, 1!12, doi: 10.1080/15548627.2020.1755120.
systemic lupus erythematosus, Nat. Rev. Rheumatol., 14,
68.
Aerbajinai, W., Giattina, M., Lee, Y. T., Raffeld, M., and
195!213, doi: 10.1038/nrrheum.2018.38.
Miller, J. L. (2003) The roapoptotic factor Nix is coexpressed
51.
Puhm, F., Afonyushkin, T., Resch, U., Obermayer, G.,
with Bcl!xL during terminal erythroid differentiation, Blood,
Rohde, M., et al. (2019) Mitochondria are a subset of
102, 712!717, doi: 10.1182/blood!2002!11!3324.
extracellular vesicles released by activated monocytes and
69.
Schweers, R. L., Zhang, J., Randall, M. S., Loyd, M. R.,
induce type I IFN and TNF responses in endothelial cells,
Li, W., et al. (2007) NIX is required for programmed mito!
Circ. Res., 125, 43!52, doi: 10.1161/CIRCRESAHA.
chondrial clearance during reticulocyte maturation, Proc.
118.314601.
Natl. Acad. Sci. USA, 104, 19500!19505, doi: 10.1073/
52.
Baruah, J., and Wary, K. K. (2019) Exosomes in the regu!
pnas.0708818104.
lation of vascular endothelial cell regeneration, Front. Cell
70.
Kundu, M., Lindsten, T., Yang, C.!Y., Wu, J., Zhao, F.,
Dev. Biol., 7, 353, doi: 10.3389/fcell.2019.00353.
et al. (2008) Ulk1 plays a critical role in the autophagic
53.
Zhang, B., Asadi, S., Weng, Z., Sismanopoulos, N., and
clearance of mitochondria and ribosomes during reticulo!
Theoharides, T. C. (2012) Stimulated human mast cells
cyte maturation, Blood, 112, 1493!1502, doi: 10.1182/
secrete mitochondrial components that have autocrine and
blood!2008!02!137398.
paracrine inflammatory actions, PLoS One, 7, e49767,
71.
Wong, P.!M., Puente, C., Ganley, I. G., and Jiang, X.
doi: 10.1371/journal.pone.0049767.
(2013) The ULK1 complex: sensing nutrient signals for
54.
Torralba, D., Baixauli, F., Villarroya!Beltri, C.,
autophagy activation, Autophagy, 9, 124!137, doi: 10.4161/
Fernández!Delgado, I., Latorre!Pellicer, A., et al. (2018)
auto.23323.
Priming of dendritic cells by DNA!containing extracellular
72.
Honda, S., Arakawa, S., Nishida, Y., Yamaguchi, H., Ishii, E.,
vesicles from activated T cells through antigen!driven con!
and Shimizu, S. (2014) Ulk1!mediated Atg5!independent
tacts, Nat. Commun., 9, 2658, doi: 10.1038/s41467!018!
macroautophagy mediates elimination of mitochondria
05077!9.
from embryonic reticulocytes, Nat. Commun., 5, 4004,
55.
Torralba, D., Baixauli, F., and Sánchez!Madrid, F. (2016)
doi: 10.1038/ncomms5004.
Mitochondria know no boundaries: mechanisms and func!
73.
Zhang, J., Randall, M. S., Loyd, M. R., Dorsey, F. C.,
tions of intercellular mitochondrial transfer, Front. Cell
Kundu, M., et al. (2009) Mitochondrial clearance is regu!
Dev. Biol., 4, 107, doi: 10.3389/fcell.2016.00107.
lated by Atg7!dependent and !independent mechanisms
БИОХИМИЯ том 85 вып. 12 2020
3*
1764
ЛЯМЗАЕВ и др.
during reticulocyte maturation, Blood, 114,
157!164,
C2C12 myoblasts, Autophagy, 12, 369!380, doi: 10.1080/
doi: 10.1182/blood!2008!04!151639.
15548627.2015.1115172.
74.
Wang, J., Fang, Y., Yan, L., Yuan, N., Zhang, S., Xu, L., et
90. Gong, G., Song, M., Csordas, G., Kelly, D. P., Matkovich,
al. (2016) Erythroleukemia cells acquire an alternative
S. J., and Dorn, G. W., 2nd. (2015) Parkin!mediated
mitophagy capability, Sci Rep, 6, 24641, doi: 10.1038/
mitophagy directs perinatal cardiac metabolic maturation
srep24641.
in mice, Science, 350, 2459, doi: 10.1126/science.aad2459.
75.
Hammerling, B. C., Shires, S. E., Leon, L. J., Cortez,
91. Lampert, M. A., Orogo, A. M., Najor, R. H., Hammerling,
M. Q., and Gustafsson, Å. B. (2020) Isolation of Rab5!
B. C., Leon, L. J., et al. (2019) BNIP3L/NIX and
positive endosomes reveals a new mitochondrial degrada!
FUNDC1!mediated mitophagy is required for mitochon!
tion pathway utilized by BNIP3 and Parkin, Small
drial network remodeling during cardiac progenitor cell
GTPases, 11, 69!76, doi: 10.1080/21541248.2017.1342749.
differentiation, Autophagy, 15, 1182!1198, doi: 10.1080/
76.
Laude!Taupin, A., Jia, J., Mudd, M., and Deretic, V.
15548627.2019.1580095.
(2017) Autophagy’s secret life: secretion instead of degra!
92. Kanki, T., and Klionsky, D. J. (2008) Mitophagy in yeast
dation, Essays Biochem., 61, 637!647, doi: 10.1042/
occurs through a selective mechanism, J. Biol. Chem., 283,
EBC20170024.
32386!32393, doi: 10.1074/jbc.M802403200.
77.
Griffiths, R. E., Kupzig, S., Cogan, N., Mankelow, T. J.,
93. Joshi, A., and Kundu, M. (2013) Mitophagy in hematopoi!
Betin, V. M. S., et al. (2012) Maturing reticulocytes inter!
etic stem cells: the case for exploration, Autophagy, 9,
nalize plasma membrane in glycophorin A!containing vesi!
1737!1749, doi: 10.4161/auto.26681.
cles that fuse with autophagosomes before exocytosis, Blood,
94. Mortensen, M., Ferguson, D. J. P., Edelmann, M.,
119, 6296!6306, doi: 10.1182/blood!2011!09!376475.
Kessler, B., Morten, K.J., et al. (2010) Loss of autophagy
78.
Schmidt, J., Prehn, S., and Rapoport, S. M.
(1985)
in erythroid cells leads to defective removal of mitochon!
Proteolysis during in vitro!maturation of rabbit reticulo!
dria and severe anemia in vivo, Proc. Natl. Acad. Sci. USA,
cytes, Biomed. Biochim. Acta, 44, 1429-1434.
107, 832!837, doi: 10.1073/pnas.0913170107.
79.
Rapoport, S. M., and Schewe, T. (1986) The maturational
95. Xiang, G., Yang, L., Long, Q., Chen, K., Tang, H., et al.
breakdown of mitochondria in reticulocytes, Biochim.
(2017) BNIP3L!dependent mitophagy accounts for mito!
Biophys. Acta,
864,
471!495, doi:
10.1016/0304!
chondrial clearance during 3 factors!induced somatic cell
4157(86)90006!7.
reprogramming, Autophagy, 13, 1543!1555, doi: 10.1080/
80.
Ahlqvist, K. J., Leoncini, S., Pecorelli, A., Wortmann,
15548627.2017.1338545.
S. B., Ahola, S., et al. (2015) MtDNA mutagenesis impairs
96. Vazquez!Martin, A., Van den Haute, C., Cuf , S.,
elimination of mitochondria during erythroid maturation
Corominas!Faja, B., Cuyàs, E., et al. (2016) Mitophagy!
leading to enhanced erythrocyte destruction, Nat.
driven mitochondrial rejuvenation regulates stem cell fate,
Commun., 6, 6494, doi: 10.1038/ncomms7494.
Aging, 8, 1330!1352, doi: 10.18632/aging.100976.
81.
Brennan, L. A., McGreal!Estrada, R., Logan, C. M.,
97. Esteban!Mart nez, L., Sierra Filardi, E., McGreal, R. S.,
Cvekl, A., Menko, A. S., and Kantorow, M. (2018)
Salazar Roa, M., Mariño, G., et al. (2017) Programmed
BNIP3L/NIX is required for elimination of mitochondria,
mitophagy is essential for the glycolytic switch during cell
endoplasmic reticulum and Golgi apparatus during eye
differentiation, EMBO J., 36, 1688!1706, doi: 10.15252/
lens organelle!free zone formation, Exp. Eye. Res., 174,
embj.201695916.
173!184, doi: 10.1016/j.exer.2018.06.003.
98. Al Rawi, S., Louvet!Vallée, S., Djeddi, A., Sachse, M.,
82.
Morishita, H., and Mizushima, N. (2016) Autophagy in
Culetto, E., et al. (2011) Postfertilization autophagy of sperm
the lens, Exp. Eye Res, 144, 22!28, doi: 10.1016/
organelles prevents paternal mitochondrial DNA transmis!
j.exer.2015.08.019.
sion, Science, 334, 1144!1147, doi: 10.1126/science.1211878.
83.
Remé, C. E., and Young, R. W. (1977) The effects of hiber!
99. Lim, Y., Rubio!Peña, K., Sobraske, P. J., Molina, P. A.,
nation on cone visual cells in the ground squirrel, Invest.
Brookes, P. S., et al. (2019) Fndc!1 contributes to paternal
Ophthalmol. Vis. Sci., 16, 815!840.
mitochondria elimination in C. elegans, Dev. Biol., 454, 15!
84.
Altshuler!Keylin, S., Shinoda, K., Hasegawa, Y., Ikeda, K.,
20, doi: 10.1016/j.ydbio.2019.06.016.
Hong, H., et al. (2016) Beige adipocyte maintenance is
100. Molina, P., Lim, Y., and Boyd, L. (2019) Ubiquitination is
regulated by autophagy!induced mitochondrial clearance,
required for the initial removal of paternal organelles in
Cell. Metab., 24, 402!419, doi: 10.1016/j.cmet.2016.
C. elegans, Dev. Biol., 453, 168!179, doi: 10.1016/j.ydbio.
08.002.
2019.05.015.
85.
Lu, X., Altshuler!Keylin, S., Wang, Q., Chen, Y.,
101. Karavaeva, I. E., Golyshev, S. A., Smirnova, E. A.,
Henrique Sponton, C., et al. (2018) Mitophagy controls
Sokolov, S. S., Severin, F. F., and Knorre, D. A. (2017)
beige adipocyte maintenance through a Parkin!dependent
Mitochondrial depolarization in yeast zygotes inhibits
and UCP1!independent mechanism, Sci. Signal., 11,
clonal expansion of selfish mtDNA, J. Cell Sci., 130, 1274!
doi: 10.1126/scisignal.aap8526.
1284, doi: 10.1242/jcs.197269.
86.
Fujiwara, M., Tian, L., Le, P. T., DeMambro, V. E.,
102. Sato, M., and Sato, K. (2013) Maternal inheritance of
Becker, K. A., et al. (2019) The mitophagy receptor Bcl!2!
mitochondrial DNA by diverse mechanisms to eliminate
like protein 13 stimulates adipogenesis by regulating mito!
paternal mitochondrial DNA, Biochim. Biophys. Acta,
chondrial oxidative phosphorylation and apoptosis in
1833, 1979!1984, doi: 10.1016/j.bbamcr.2013.03.010.
mice, J. Biol. Chem., 294, 12683!12694, doi: 10.1074/jbc.
103. DeLuca, S. Z., and O’Farrell, P. H. (2012) Barriers to male
RA119.008630.
transmission of mitochondrial DNA in sperm develop!
87.
Moriyama, M., Moriyama, H., Uda, J., Matsuyama, A.,
ment, Dev. Cell, 22, 660!668, doi: 10.1016/j.devcel.
Osawa, M., and Hayakawa, T. (2014) BNIP3 plays crucial
2011.12.021.
roles in the differentiation and maintenance of epidermal
104. Politi, Y., Gal, L., Kalifa, Y., Ravid, L., Elazar, Z., and
keratinocytes, J. Invest. Dermatol., 134, 1627!1635,
Arama, E. (2014) Paternal mitochondrial destruction after
doi: 10.1038/jid.2014.11.
fertilization is mediated by a common endocytic and
88.
Jones, L. A., Harland, D. P., Jarrold, B. B., Connolly, J. E.,
autophagic pathway in Drosophila, Dev. Cell, 29, 305!320,
and Davis, M. G. (2018) The walking dead: sequential
doi: 10.1016/j.devcel.2014.04.005.
nuclear and organelle destruction during hair develop!
105. Luo, S.!M., Ge, Z.!J., Wang, Z.!W., Jiang, Z.!Z., Wang,
ment, Br. J. Dermatol., 178, 1341!1352, doi: 10.1111/
Z.!B., et al. (2013) Unique insights into maternal mito!
bjd.16148.
chondrial inheritance in mice, Proc. Natl. Acad. Sci. USA,
89.
Sin, J., Andres, A. M., Taylor, D. J. R., Weston, T.,
110, 13038!13043, doi: 10.1073/pnas.1303231110.
Hiraumi, Y., et al. (2016) Mitophagy is required for mito!
106. Rojansky, R., Cha, M.!Y., and Chan, D. C. (2016)
chondrial biogenesis and myogenic differentiation of
Elimination of paternal mitochondria in mouse embryos
БИОХИМИЯ том 85 вып. 12 2020
МИТОПТОЗ
1765
occurs through autophagic degradation dependent on
113. Dalton, C. M., and Carroll, J. (2013) Biased inheritance of
PARKIN and MUL1, Elife, 5, doi: 10.7554/eLife.17896.
mitochondria during asymmetric cell division in the mouse
107. Song, W.!H., Yi, Y.!J., Sutovsky, M., Meyers, S., and
oocyte, J. Cell Sci., 126, 2955!2964, doi: 10.1242/jcs.128744.
Sutovsky, P. (2016) Autophagy and ubiquitin!proteasome
114. Rivolta, M. N., and Holley, M. C. (2002) Asymmetric seg!
system contribute to sperm mitophagy after mammalian
regation of mitochondria and mortalin correlates with the
fertilization, Proc. Natl. Acad. Sci. USA, 113, 5261!5270,
multi!lineage potential of inner ear sensory cell progenitors
doi: 10.1073/pnas.1605844113.
in vitro, Brain Res. Dev. Brain Res.,
133,
49!56,
108. Sutovsky, P., Moreno, R. D., Ramalho!Santos, J.,
doi: 10.1016/s0165!3806(01)00321!2.
Dominko, T., Simerly, C., and Schatten, G.
(1999)
115. Katajisto, P., Döhla, J., Chaffer, C. L., Pentinmikko, N.,
Ubiquitin tag for sperm mitochondria, Nature, 402, 371!
Marjanovic, N., et al. (2015) Stem cells. Asymmetric
372, doi: 10.1038/46466.
apportioning of aged mitochondria between daughter cells
109. Fehrenbacher, K. L., Yang, H.!C., Gay, A. C., Huckaba,
is required for stemness, Science,
348,
340!343,
T. M., and Pon, L. A. (2004) Live cell imaging of mito!
doi: 10.1126/science.1260384.
chondrial movement along actin cables in budding yeast,
116. Hinge, A., He, J., Bartram, J., Javier, J., Xu, J., et al.
Curr. Biol., 14, 1996!2004, doi: 10.1016/j.cub.2004.11.004.
(2020) Asymmetrically segregated mitochondria provide
110. Higuchi!Sanabria, R., Charalel, J. K., Viana, M. P.,
cellular memory of hematopoietic stem cell replicative his!
Garcia, E. J., Sing, C. N., et al. (2016) Mitochondrial
tory and drive HSC attrition, Cell. Stem. Cell, 26, 420!430,
anchorage and fusion contribute to mitochondrial inheri!
doi: 10.1016/j.stem.2020.01.016.
tance and quality control in the budding yeast Saccharo
117. Wu, M.!J., Chen, Y.!S., Kim, M.R., Chang, C.!C.,
myces cerevisiae, Mol. Biol. Cell, 27, 776!787, doi: 10.1091/
Gampala, S., et al. (2019) Epithelial!mesenchymal transi!
mbc.E15!07!0455.
tion directs stem cell polarity via regulation of mitofusin,
111.
McFaline!Figueroa, J. R., Vevea, J., Swayne, T. C., Zhou, C.,
Cell. Metab., 29, 993!1002, doi: 10.1016/j.cmet.2018.
Liu, C., et al. (2011) Mitochondrial quality control during
11.004.
inheritance is associated with lifespan and mother!daugh!
118. Krakauer, D. C., and Mira, A. (1999) Mitochondria and
ter age asymmetry in budding yeast, Aging Cell, 10, 885!
germ!cell death, Nature, 400, 125!126, doi: 10.1038/22026.
895. doi: 10.1111/j.1474!9726.2011.00731.x.
119. Floros, V. I., Pyle, A., Dietmann, S., Wei, W., Tang,
112. Knorre, D. A., Azbarova, A. V., Galkina, K. V., Feniouk,
W. C. W., et al. (2018) Segregation of mitochondrial DNA
B. A., and Severin, F. F. (2018) Replicative aging as a
heteroplasmy through a developmental genetic bottleneck
source of cell heterogeneity in budding yeast, Mech. Ageing
in human embryos, Nat. Cell. Biol.,
20,
144!151,
Dev., 176, 24!31, doi: 10.1016/j.mad.2018.09.001.
doi: 10.1038/s41556!017!0017!8.
MITOPTOSIS, TWENTY YEARS AFTER
Review
K. G. Lyamzaev1, D. A. Knorre1,2, and B. V. Chernyak1*
1 Belozersky Institute of Physico Chemical Biology, Lomonosov Moscow State University,
119991 Moscow, Russia; E mail: bchernyak1@gmail.com
2 Sechenov First Moscow State Medical University of the Ministry of Health of the Russian Federation
(Sechenov University), 119992 Moscow, Russia
Received July 8, 2020
Revised August 14, 2020
Accepted August 14, 2020
In 1999 V. P. Skulachev proposed the term “mitoptosis” to refer to the programmed elimination of mitochondria in
living cells. According to the initial thought, mitoptosis serves to protect cells from malfunctioning of the damaged
mitochondria. At the same time, a new mechanism of the complete mitochondria elimination was found under the
conditions of massive mitochondrial damage associated with oxidative stress. In this experimental model, mitochon!
drial cluster formation in the perinuclear region leads to the formation of “mitoptotic body” surrounded by a single!
layer membrane and subsequent release of mitochondria from the cell. Later, it was found that mitoptosis plays an
important role in various normal and pathological processes that are not necessarily associated with the mitochondr!
ial damage. It was found that mitoptosis takes place during cell differentiation, self!maintenance of hematopoietic
stem cells, metabolic remodelling, and elimination of the paternal mitochondria in organisms with the maternal
inheritance of the mitochondrial DNA. Moreover, the associated with mitoptosis release of mitochondrial compo!
nents into the blood may be involved in the transmission of signals between cells, but also leads to the development of
inflammatory and autoimmune diseases. Mitoptosis can be attributed to the asymmetric inheritance of mitochondria
in the division of yeast and some animal cells, when the defective mitochondria are transferred to one of the newly
formed cells. Finally, a specific form of mitoptosis appears to be selective elimination of mitochondria with deleteri!
ous mutations in whole follicular ovarian cells in mammals. During formation of the primary follicle, the mitochon!
drial DNA copy number is significantly reduced. After division, the cells that receive predominantly mitochondria
with deleterious mutations in their mtDNA die, thereby reducing the likelihood of transmission of these mutations to
offspring. Further study of the mechanisms of mitoptosis in normal and pathological conditions is important both for
understanding the processes of development and aging, and for designing therapeutic approaches for inflammatory,
neurodegenerative and other diseases.
Keywords: mitochondria, mitoptosis, mitophagy, membrane potential, apoptosis, inflammation, differentiation,
asymmetric inheritance of mitochondria
БИОХИМИЯ том 85 вып. 12 2020