БИОХИМИЯ, 2020, том 85, вып. 12, с. 1837 - 1848
УДК 577.2
МЕШАЮТ ЛИ МЕМБРАННЫЕ ПЕРЕНОСЧИКИ,
ОБЕСПЕЧИВАЮЩИЕ МНОЖЕСТВЕННУЮ ЛЕКАРСТВЕННУЮ
УСТОЙЧИВОСТЬ, ФУНКЦИОНИРОВАНИЮ КЛЕТКИ
В НОРМАЛЬНЫХ УСЛОВИЯХ?
Обзор
© 2020
Д.А. Кнорре1,2*, К.В. Галкина1, Т.С. Широковских3,
A. Банерджи4, Р. Прасад4
1 НИИ физико химической биологии имени А.Н. Белозерского, Московский государственный университет
имени М.В. Ломоносова, 119991 Москва, Россия; электронная почта: knorre@belozersky.msu.ru
2 Первый московский государственный медицинский университет имени И.М. Сеченова, 119992 Москва, Россия
3 Московский государственный университет имени М.В. Ломоносова,
факультет биоинженерии и биоинформатики, 119991 Москва, Россия
4 Amity Institute of Biotechnology and Amity Institute of Integrative Sciences and Health,
Amity University Haryana, Amity Education Valley, Gurugram, 122413 India
Поступила в редакцию 03.07.2020
После доработки 25.08.2020
Принята к публикации 25.08.2020
Эукариотические клетки обладают множеством механизмов защиты от чужеродных соединений. В частнос
ти, клетки могут ограничивать проницаемость токсичных молекул через плазматическую мембрану (ПМ)
или изолировать их в специализированных компартментах. Переносчики плазматической мембраны с ши
рокой субстратной специфичностью обеспечивают клеткам множественную лекарственную устойчивость
(МЛУ). Эти переносчики откачивают из клетки токсичные соединения, затрачивая при этом энергию гид
ролиза АТФ (ABC переносчики) или энергию переноса протона (MFS переносчики). Данный обзор посвя
щен обсуждению возможных издержек, возникающих при работе системы откачивания соединений из
клетки, на примере дрожжей. Известно, что ABC переносчики семейства PDR постоянно гидролизуют
АТФ, даже если они не осуществляют транспорт субстрата через мембрану. Кроме того, некоторые МЛУ пе
реносчики обладают флиппазной активностью, позволяющей им транспортировать липиды из внутренне
го во внешний слой плазматической мембраны. Таким образом, чрезмерная активность МЛУ переносчи
ков может непреднамеренно изменять свойства плазматической мембраны. Также есть вероятность, что
широкая субстратная специфичность ABC переносчиков может приводить к откачиванию из клеток есте
ственных метаболических интермедиатов. У некоторых микроорганизмов транспорт факторов «чувства
кворума» опосредован МЛУ переносчиками; сверхэкспрессия этих переносчиков может нарушать коорди
нацию роста и размножения клеток. Чтобы снизить эти издержки в нормальных условиях, клетки сохраня
ют гены МЛУ переносчиков в репрессированном состоянии и активируют их только при воздействии
стресса. Использование подобных ограничений работы системы откачивания соединений из клетки явля
ется многообещающей стратегией противодействия патогенным грибам с МЛУ.
КЛЮЧЕВЫЕ СЛОВА: множественная лекарственная устойчивость, дрожжи, ABC переносчики, сигналинг.
DOI: 10.31857/S0320972520120088
ВВЕДЕНИЕ
молекул [1, 2] и заканчивая сложными поведен
ческими паттернами социальных животных [3].
Живые организмы защищаются от враждеб
Чужеродные токсичные соединения (ксенобио
ной внешней среды на нескольких уровнях ор
тики) из за своего огромного разнообразия яв
ганизации: начиная от репарации отдельных
ляются одной из самых сложных проблем для
клеточных и организменных систем защиты от
Принятые сокращения: ABC - ATP binding cassette; стресса. Так, к настоящему времени уже описа
QS - quorum sensing; MDR - multiple drug resistance;
ны более 1500 различных вторичных метаболи
MFS - multiple facilitator superfamily; SAGA - Spt Ada
Gcn5 acetyltransferase; PDR - pleiotropic drug resistance;
тов грибов, многие из которых проявляют ши
МЛУ - множественная лекарственная устойчивость.
рокую (биоцидную) или узкую антимикробную
* Адресат для корреспонденции.
активность [4, 5].
1837
1838
КНОРРЕ и др.
На клеточном уровне организации сущест
медиатов метаболизма, занимать место в плазма
вует несколько дополняющих друг друга меха
тической мембране, необходимое для другие пе
низмов, которые защищают клетку от негатив
реносчиков, а также мешать межклеточной ком
ного воздействия ксенобиотиков: 1) абсорбция
муникации. Опубликованы результаты, по край
ксенобиотиков во внеклеточных компартмен
ней мере, трех исследований, показывающих,
тах, таких как внеклеточные везикулы, а также
что дрожжевые культуры с подавленной систе
избирательная проницаемость плазматической
мой МЛУ достигают более высокой плотности
мембраны может ограничивать накопление ксе
клеток, чем штаммы дикого типа [18-20]. Мы
нобиотиков в цитоплазме [6]; 2) клетки могут
также недавно показали, что клетки со снижен
изолировать токсичные соединения во внутрик
ной экспрессией генов МЛУ обгоняют по ско
леточных компартментах, например, в вакуолях
рости роста клетки дикого типа, если их выра
[7] или липидных каплях [8]; 3) в клетках суще
щивать на среде с несбраживаемым источником
ствует множество систем метаболической дегра
углерода в присутствии протонофора карбонил
дации токсичных молекул. Так, β лактамазы
цианид n трифторметокси фенилгидразона
разлагают антибиотики пенициллинового ряда
(FCCP) [21]. Кроме того, известно, что некото
и, тем самым, играют важную роль в устойчи
рые штаммы дрожжей с делециями генов, необя
вости бактерий к лекарственным препаратам
зательных для роста в нормальных условиях, те
[9]. Еще одним примером могут служить фер
ряют способность к пролиферации при актива
менты семейства цитохрома P450, которые ката
ции МЛУ. Так, например, экспрессия гена
лизируют окисление различных органических
PDR1+, содержащего мутацию с усилением
соединений и, таким образом, могут способ
функции, вызывает летальный фенотип у штам
ствовать устойчивости к токсинам [10]; 4) и, на
ма S.cerevisiae с делецией гена GCN5, кодирую
конец, некоторые ABC (ATP binding cassette)
щего каталитическую субъединицу ADA и SAGA
или MFS переносчики цитоплазматической
гистонацетилтрансферазных комплексов [22].
мембраны обеспечивают откачивание ксеноби
PDR1 кодирует транскрипционный фактор, ко
отиков из цитоплазмы в окружающую среду
торый активирует экспрессию генов основных
[11, 12]. В случае ABC переносчиков выброс
ABC переносчиков и, таким образом, обеспечи
ксенобиотиков из клетки сопряжен с гидроли
вает дрожжевые клетки множественной лекар
зом АТФ, в то время как MFS переносчики ис
ственной устойчивостью [23]. Вместе с тем, гене
пользуют протон движущую силу для трансло
тический скрининг на пекарских дрожжах пока
кации ксенобиотиков (рис. 1, а). Важно отме
зал, что повышенная экспрессия белков пере
тить, что вышеописанные механизмы часто
носчиков, обеспечивающих МЛУ, может инги
функционируют вместе. Так, например, у дрож
бировать рост дрожжей. Трансмембранный до
жей S. cerevisiae изоляция противогрибковых
мен ABC переносчиков (pfam00664) оказался
препаратов в вакуоли опосредована актив
перепредставлен среди фрагментов геномной
ностью ABC переносчика с широкой субстрат
ДНК, наличие которых токсично для клеток
ной специфичностью Ybt1p, а его гомолог Mlt1p
дрожжей [24]. Активация систем лекарственной
выполняет ту же функцию у дрожжей вида
устойчивости может снижать приспособлен
Candida albicans [7].
ность клеток не только в случае грибов. Было по
ABC и MFS переносчики с широкой суб
казано, что в условиях ограниченных ресурсов
стратной специфичностью вносят значительный
малярийные плазмодии, чувствительные к ксе
вклад в формирование системы множественной
нобиотикам, вытесняют своих обладающих ле
лекарственной устойчивости (МЛУ) — способ
карственной устойчивостью сородичей в орга
ности клеток противостоять вредоносному
низме хозяина [25].
действию различных химических соединений
В данном обзоре на примере пекарских дрож
[12, 13]. МЛУ снижает эффективность противо
жей Saccharomyces cerevisiae и патогенных видов
опухолевых препаратов [14] и лекарств, направ
дрожжей рода Candida обсуждается возможный
ленных на лечение инфекционных заболеваний
«сопутствующий ущерб», связанный с высокой
[15], а также ограничивает применение некото
активностью ABC переносчиков. МЛУ дрожжей
рых соединений, таких как митохондриально
обеспечивается ABC переносчиками PDR се
направленные антиоксиданты [16, 17]. В то же
мейства. Поэтому для многих генов МЛУ дрож
время высокий уровень экспрессии переносчи
жей используют аббревиатуру PDR. Дрожжевые
ков с широкой субстратной специфичностью в
клетки содержат множество PDR переносчиков,
отдельных клетках может иметь свои недостат
которые обеспечивают им защиту от противог
ки. Переносчики, обеспечивающие МЛУ (МЛУ
рибковых соединений (подробнее см. обзоры
переносчики), могут избыточно нагружать кле
[26, 27]), кроме того, экспрессия этих PDR пере
точную энергетику, менять соотношения интер
носчиков обычно повышена в клинических изо
БИОХИМИЯ том 85 вып. 12 2020
ИЗДЕРЖКИ СИСТЕМЫ МЛУ У ДРОЖЖЕЙ
1839
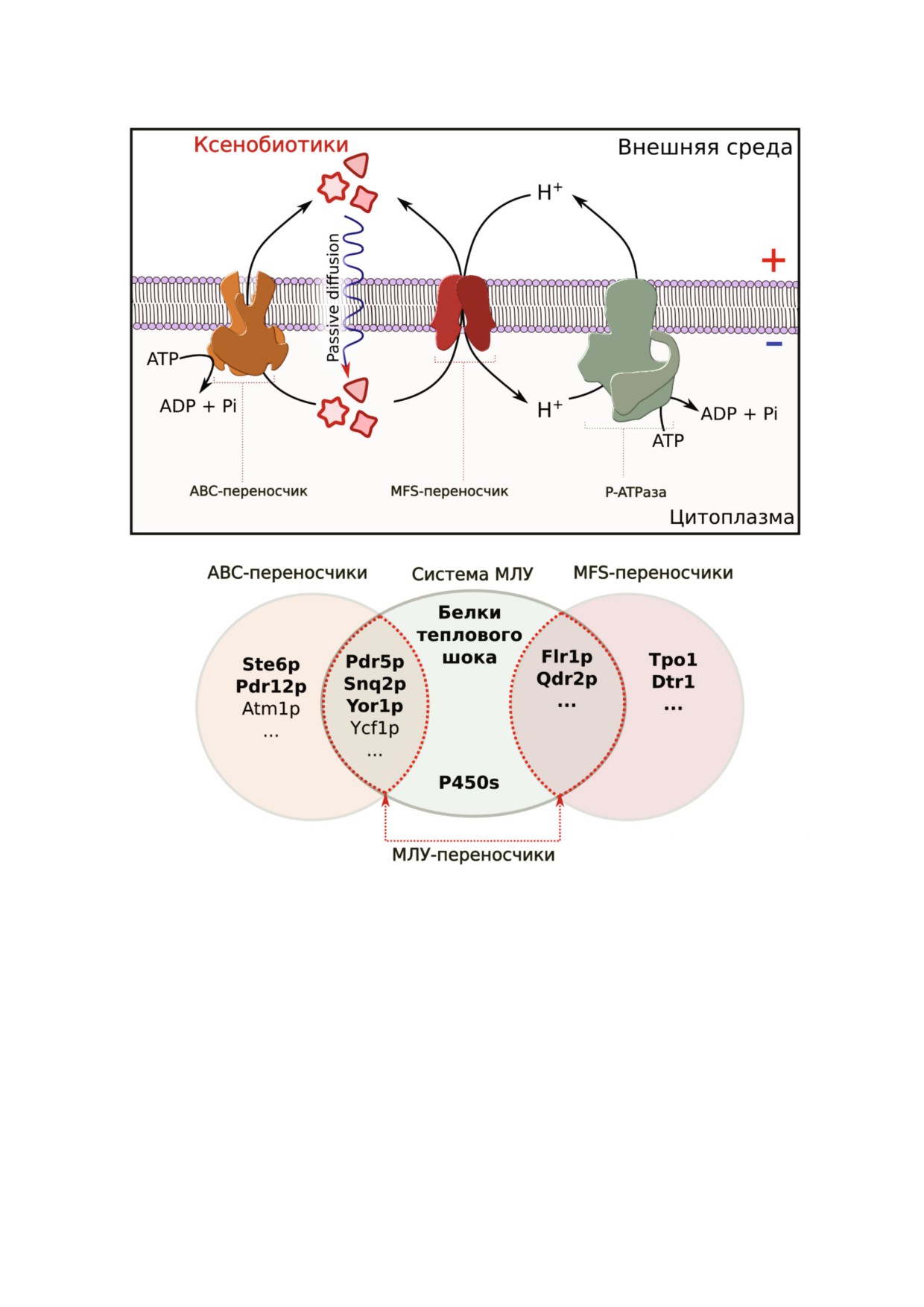
а
б
Рис. 1. ABC и MFS переносчики составляют систему откачивания ксенобиотиков из клетки. а - Откачивание перенос
чиками субстрата сопряжено с гидролизом АТФ (ABC переносчики, слева) или с переносом протона в клетку (MFS пе
реносчики - в середине). АТФаза P типа Pma1p (справа) генерирует электрохимический потенциал на плазматической
мембране дрожжевой клетки; б - диаграмма Венна иллюстрирует множество ABC и MFS переносчиков, являющихся
частью системы множественной лекарственной устойчивости. Белки теплового шока и микросомальные цитохромы P450
также могут обеспечивать устойчивость к химически различным токсинам. (С цветными вариантами рис. 1 и 2 можно оз
лятах патогенных грибов [28, 29]. В данном обзо
АКТИВНОСТЬ АВС7ПЕРЕНОСЧИКОВ
ре авторы ограничились рассмотрением работы
СОЗДАЕТ ДОПОЛНИТЕЛЬНУЮ НАГРУЗКУ
мембранных транспортеров, несмотря на то, что
НА КЛЕТОЧНУЮ ЭНЕРГЕТИКУ
множественная лекарственная устойчивость мо
жет обеспечиваться и с помощью других меха
МЛУ переносчики откачивают ксенобиоти
низмов (рис. 1, б), таких как повышенная
ки из цитоплазмы в окружающую среду за счет
экспрессия белков теплового шока [30].
гидролиза АТФ [31]. ABC переносчики напря
БИОХИМИЯ том 85 вып. 12 2020
1840
КНОРРЕ и др.
мую гидролизуют АТФ, в то время как MFS пе
как сохраняет ее белки переносчики в функци
реносчики используют мембранный электрохи
ональном состоянии, другими словами, такая
мический потенциал, генерируемый АТФ гид
клетка готова к откачиванию ксенобиотиков в
ролизующей плазматической мембранной P
любой момент [41].
АТФазой Pma1p (рис. 1, а). Известно, что транс
Следует отметить, что базовая активность
портируемые субстраты стимулируют АТPазную
гидролиза АТФ была определена для изолиро
активность P гликопротеина - ABC перенос
ванных переносчиков или переносчиков в сос
чика с широкой субстратной специфичностью
таве выделенных мембранных везикул, но ни
многоклеточных животных [32]. В то же время
когда не измерялась в интактных клетках. Поэ
ABC переносчики, в частности, переносчики
тому, теоретически, в условиях in vivo могут су
семейства PDR, могут осуществлять гидролиз
ществовать механизмы, предотвращающие по
АТФ, не связанный с транспортом субстрата
терю энергии. Более того, учитывая, что в усло
[33-35]. По этой причине изолированные ABC
виях брожения дрожжевые клетки содержат
переносчики проявляют базовую АТФазную ак
~10 000 молекул Pdr5p [42], а Vmax гидролиза
тивность без добавления субстратов для транс
АТФ белком Pdr5 составляет 200 нмоль/(мин ×
порта [36]. АТФазная активность основного
× мг белка) [40], интегральная скорость базово
ABC переносчика дрожжей Pdr5 остается неиз
го гидролиза АТФ Pdr5p равна ~4 нмоль/(мин ×
менной или даже может быть заингибирована
× мл цитоплазмы клетки). Чтобы рассчитать эту
добавлением транспортных субстратов [36, 37]
скорость гидролиза АТФ, мы приняли объем
за немногими заметными исключениями
дрожжевых клеток равным 65 мкм3 (что прибли
[33, 38]. Учитывая, что Km гидролиза АТФ
зительно соответствует диаметру клеток 5 мкм),
(0,44-1,9 мM АТФ) для белка Pdr5 находится в
а мол. массу Pdr5p - равной 170 кДа. Отметим,
пределах физиологического диапазона конце
что данное расчетное значение скорости при
нтраций АТФ [39, 40], Pdr5 может вносить зна
мерно на четыре порядка ниже, чем значение
чимый вклад в расход энергии неделящихся
скорости метаболического синтеза АТФ при
клеток (рис. 2, 1). Стоит, однако, отметить, что
брожении дрожжевых клеток [43]. Отсюда сле
наличие постоянно активированной системы
дует, что в условиях экспоненциального роста
PDR переносчиков может быть для клетки ско
влияние АТФ гидролизующей активности
рее преимуществом, нежели недостатком, так
Pdr5p на приспособленность дрожжевых клеток
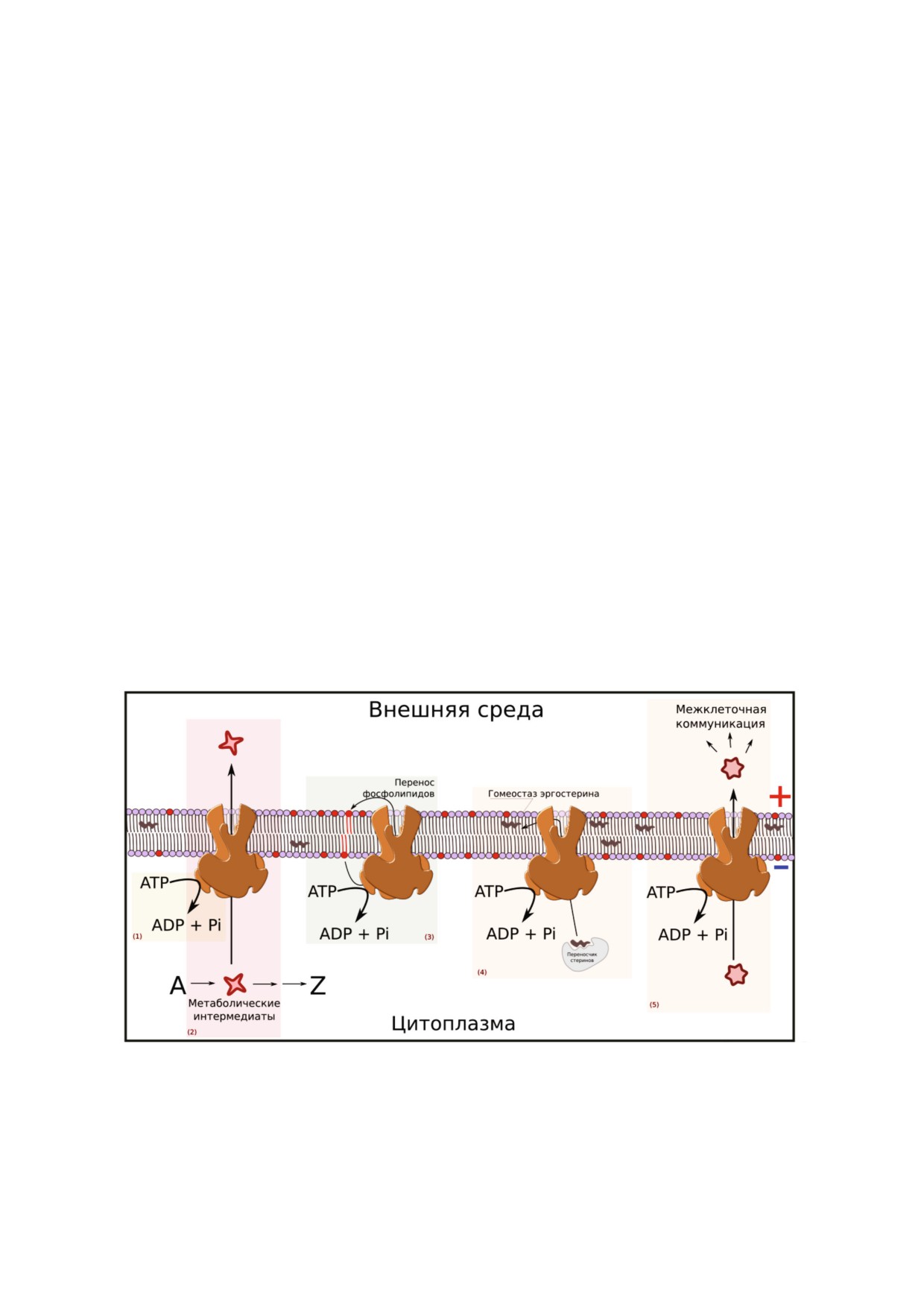
Рис. 2. Функции МЛУ переносчиков, которые могут влиять на нормальное функционирование клетки. (1) - Трата энер
гии за счет базальной АТФ гидролизующей активности; (2) - откачивание метаболических интермедиатов. Перенос фос
фолипидов из внутреннего во внешний монослой плазматической мембраны (флип флоп) - (3) или транспорт эргостер
ина (4) могут неблагоприятно для клетки изменять свойства мембраны; (5) - чрезмерный выброс в окружающую среду
низкомолекулярных соединений, передающих сигнал между клетками, может мешать межклеточной коммуникации.
Подробное обсуждение каждого из механизмов приведено в тексте
БИОХИМИЯ том 85 вып. 12 2020
ИЗДЕРЖКИ СИСТЕМЫ МЛУ У ДРОЖЖЕЙ
1841
должно быть незначительным. Однако ситуация
[48]. Pdr18p является паралогом Snq2p и обеспе
может значительно отличаться, если уровень
чивает клеткам устойчивость к различным ксе
экспрессии Pdr5p увеличивается и если дрожже
нобиотикам [48,49]. Подобно другим генам
вые клетки находятся в условиях дефицита
МЛУ, PDR18 регулируется транскрипционными
субстратов. Как мы упоминали выше, делеция
факторами Pdr1p и Pdr3p [50, 51]. В условиях ги
PDR5 увеличивает концентрацию АТФ в дрож
перосмотического стресса [52] дрожжевые клет
жах в стационарной фазе роста и конечный вы
ки изменяют содержание эргостерина в плазма
ход биомассы в культуре клеток дрожжей [19].
тической мембране за счет белков семейства Osh
и Lam, переносящих стерины между эндоплаз
матической сетью и ПМ (см. обзор [53]). Таким
МЛУ7ПЕРЕНОСЧИКИ
образом, мы предполагаем, что PDR18 может
И ОБМЕН ЛИПИДОВ
способствовать этому явлению или подобным
процессам адаптации к стрессовым условиям.
Помимо трат энергии, активность МЛУ пе
Известно, что ген PDR18 влияет на состав мемб
реносчиков может снижать общую эффектив
ран [54] и играет роль при изменении липидного
ность метаболизма из за непреднамеренного
состава мембраны в условиях стресса [48]. Нес
откачивания метаболических интермедиатов из
мотря на то, что Pdr18p, несомненно, обеспечи
клетки. Клетки дрожжей содержат тысячи мета
вает клетке МЛУ, в его случае трудно разграни
болитов [44], однако значительную часть кле
чить два возможных механизма, обеспечиваю
точного метаболома составляют фосфорилиро
щих МЛУ. С одной стороны, Pdr18 может отка
ванные соединения, которые не могут транс
чивать некоторые ксенобиотики, это следует из
портироваться МЛУ переносчиками. Тем не ме
его высокой степени гомологии с Snq2p. С дру
нее, нефосфорилированные метаболиты теоре
гой стороны, Pdr18 может оказывать косвенное
тически могут откачиваться из клетки перенос
влияние на активность других белков МЛУ, из
чиками с широкой субстратной специфич
меняя содержание эргостерина в плазматичес
ностью (рис. 2, 2). Так, например, некоторые
кой мембране. Важно отметить, что активность
поздние интермедиаты метаболического пути
МЛУ переносчиков очень чувствительна к сос
синтеза стеринов, вероятно, могут быть субстра
таву стеринов плазматической мембраны [55].
тами для ABC переносчиков с широкой
Для оценки относительного вклада этих двух не
субстратной специфичностью. Об этом свиде
исключающих друг друга механизмов необходи
тельствуют по крайней мере два эксперимен
мы дополнительные эксперименты по измере
тальных наблюдения: 1) человеческие стероид
нию эффективности откачивания химических
ные гормоны β эстрадиол, дезоксикортикосте
соединений клеткой. Несмотря на то что для не
рон и прогестерон являются субстратами и кон
которых ABC переносчиков (например, Pdr5p)
курентными ингибиторами переносчика Pdr5p
было напрямую показано откачивание ими
[45]; 2) ABC переносчики S. cerevisiae с низкой
субстратов, даже такие переносчики могут кос
субстратной специфичностью Pdr11p и Aus1p
венно изменять устойчивость к ксенобиотикам
являются хорошо охарактеризованными пере
опосредованно, влияя на липидный состав плаз
носчиками эргостерина, обеспечивающими его
матической мембраны (рис. 2, 4).
захват из окружающей среды в клетку [46]. В то
Активность ABC переносчиков может быть
же время эти два ABC переносчика гомологич
связана не только с накоплением эргостерина в
ны ABC переносчику с широкой субстратной
плазматической мембране, но также и с распре
специфичностью Snq2p [12]. Кроме пути био
делением стеринов внутри мембран. Молекулы
синтеза стеринов, нефосфорилированные ин
стерина распределены внутри фосфолипидного
термедиаты также присутствуют в путях био
бислоя неравномерно и неодинаково доступны
синтеза и катаболизма ароматических амино
ферментам со стороны цитоплазмы и со сторо
кислот. Наконец, было показано, что перенос
ны внеклеточного компартмента [56, 57]. Было
чик Cdr1p дрожжей Candida albicans может отка
показано, что активность ABC переносчика P
чивать конъюгаты глутатиона с фарнезолом
гликопротеина многоклеточных животных
[47]. В указанном исследовании авторы показа
уменьшает доступность холестерина для холес
ли, что при добавлении экзогенного фарнезола
терин оксидазы, добавленной к мембранным
повышенный уровень экспрессии CDR1 снижа
везикулам, содержащим P гликопротеин [58].
ет количество внутриклеточного глутатиона и
Следовательно, активность ABC переносчиков,
приводит к гибели дрожжевых клеток.
придающих клетке множественную лекарствен
Функция другого МЛУ переносчика дрож
ную устойчивость, может приводить к перерасп
жей S. cerevisiae Pdr18p связана с поддержанием
ределению стеринов внутри фосфолипидного
гомеостаза стеринов в плазматической мембране
бислоя.
8 БИОХИМИЯ том 85 вып. 12 2020
1842
КНОРРЕ и др.
Стерины не единственные липиды, на мемб
фифильной природе и регулировать переход от
ранный гомеостаз которых может влиять актив
почкующейся формы дрожжей к псевдогифам
ность МЛУ переносчиков. Некоторые ABC пе
[66, 67]. Однако молекулы QS могут оказывать
реносчики проявляют флиппазную активность
влияние на функционирование других систем
и переносят фосфолипиды с внутреннего на на
клетки, в том числе и МЛУ переносчики. Так,
ружный слой фосфолипидного бислоя. Этот пе
фарнезол конкурентно ингибирует откачивание
ренос уравновешивается активностью специфи
субстрата Cdr1p родамина 6G из клеток C. albi
ческих АТФаз Р типа, которые катализируют
cans и усиливает противогрибковую активность
перенос фосфолипидов (флип флоп) в обрат
азолов [68]. Тирозол, напротив, индуцирует ос
ном направлении [59]. Так, например, актива
новные гены ABC переносчиков МЛУ CDR1 и
ция транскрипционного фактора PDR1 умень
MDR1 в другом патогене человека C. parapsilo
шает накопление в мембране фосфатидилэтано
sis [69].
ламина, помеченного NBD (N (7 Nitrobenz 2
Поскольку делеция основных МЛУ пере
Oxa 1,3 Diazol 4 yl) 1,2 Dihexadecanoyl sn
носчиков увеличивает скорость роста дрожжей
Glycero 3 Phosphoethanolamine) [60, 61], а деле
после перехода культуры с брожения на аэроб
ция генов ABC переносчиков предотвращает
ное дыхание, было высказано предположение,
этот эффект и возобновляет накопление этого
что МЛУ переносчики могут обеспечивать от
соединения в мембране [61]. Таким образом,
качивание молекул QS из клеток дрожжей
МЛУ переносчики участвуют в регуляции ли
[18, 20]. В своей работе Hlavácek et al. [18] пред
пидного гомеостаза путем поддержания липид
положили, что Pdr5p может способствовать от
ной асимметрии плазматической мембраны
качиванию из клетки гипотетического метабо
(рис. 2, 3). Дрожжевые клетки координируют
лита, который ингибирует пролиферацию кле
транспорт липидов с активацией МЛУ перенос
ток в момент перехода от гликолиза к окисли
чиков. Например, транскрипционный фактор
тельному метаболизму (diauxic shift). В рамках
Pdr1p регулирует не только МЛУ переносчики,
другого исследования Prunuske et al. [20] пока
но и гены биосинтеза сфингозина [51]. Приме
зали, что клетки штамма Δsnq2Δpdr5 обгоняют
чательно, что при этом делеция PDR5 повышает
по скорости роста клетки дикого типа в момент
устойчивость клеток к фитосфингозину [62]. И
перехода от брожения к дыханию. При этом
хотя молекулярный механизм этого эффекта до
кондиционная среда, в которой были выраще
сих пор неясен, данное исследование дает нам
ны дрожжевые клетки дикого типа с активными
дополнительный пример вредной для клетки
ABC переносчиками, предотвращала рост кле
активности МЛУ переносчика.
ток Δsnq2Δpdr5. К сожалению, авторы этих двух
исследований не идентифицировали молекулы,
обеспечивающие МЛУ зависимое чувство кво
МЛУ7ПЕРЕНОСЧИКИ
рума. Более того, следует отметить, что, нас
И МЕЖКЛЕТОЧНАЯ КОММУНИКАЦИЯ
колько нам известно, до сих пор неизвестно,
являются ли триптофол, тирозол и фенилэта
Чтобы при исчерпании субстратов в среде
нол субстратами дрожжевых МЛУ переносчи
вовремя остановить рост культуры клеток, од
ков.
ноклеточные организмы взаимодействуют друг
МЛУ переносчики могут влиять на чувство
с другом с помощью химических сигналов. Для
кворума по крайней мере двумя способами. С
этого они транспортируют вторичные метабо
одной стороны, откачивание из клетки QS
литы или модифицированные олигопептиды из
факторов МЛУ переносчиками может препят
цитоплазмы в окружающую среду. При превы
ствовать детекции QS молекул, если QS рецеп
шении определенного порога концентрации
торы расположены в цитоплазме. Функциони
данные молекулы ингибируют рост продуциру
рование такого механизма предполагает, что
ющих их микроорганизмов. Эти механизмы са
инактивация генов МЛУ будет вызывать преж
моограничения роста культуры обычно называ
девременное торможение роста дрожжей экзо
ют кворум сенсинг (англ. quorum sensing, QS)
генными QS факторами. С другой стороны, ак
или чувство кворума. У дрожжей кворум сен
тивность МЛУ транспортеров может способ
синг обеспечивается фарнезолом [63] или аро
ствовать экспорту в окружающую среду QS
матическими спиртами: триптофолом и фенил
факторов голодающими клетками (например,
этанолом [64]. Список охарактеризованных сое
клетками в центре колонии). В таком случае
динений, обеспечивающий чувство кворума у
инактивация МЛУ переносчиков, напротив,
грибов, можно посмотреть в работе Wongsuk et al.
будет стимулировать рост клеток, несмотря на
[65]. Эти молекулы могут диффундировать через
дефицит питательных веществ. Вклад каждого
плазматическую мембрану благодаря своей ам
из этих двух гипотетических механизмов будет
БИОХИМИЯ том 85 вып. 12 2020
ИЗДЕРЖКИ СИСТЕМЫ МЛУ У ДРОЖЖЕЙ
1843
зависеть от концентрации QS веществ и актив
гликолиза к окислительному метаболизму наб
ности других регуляторных механизмов. Для
людается снижение активности МЛУ перенос
определения взаимосвязи между системами ре
чиков [80]. Подобная регуляция хорошо согла
гуляции кворума и МЛУ необходимы дальней
суется с предположением, что поддержание
шие исследования.
МЛУ переносчиков в условиях дефицита пита
тельных веществ может быть вредным для клет
ки. Но, несмотря на снижение базовой актив
РЕГУЛЯЦИЯ МЛУ
ности, PDR5 все еще может активироваться в
клетках, находящихся в стационарной фазе рос
Поскольку в нормальных условиях чрезмер
та, в ответ на добавление субстратов Pdr5p [79].
ная активность МЛУ переносчиков может быть
Более того, недавнее исследование показало,
вредной, клеткам выгодно снижать экспрессию
что в среде с низким содержанием глюкозы и
генов МЛУ переносчиков и активировать их
низким содержанием аммония, в условиях обра
только в условиях стресса. Действительно, ксе
зования дрожжевых псевдогиф, уровень
нобиотики индуцируют гены МЛУ в клетках
экспрессии и активность Pdr5p остаются посто
дрожжей [70-72]. Описано несколько механиз
янными, несмотря на значительные изменения
мов активации генов МЛУ переносчиков в от
концентраций других белков [81]. Таким обра
вет на ксенобиотики. Во первых, транскрипци
зом, можно предположить, что существует ряд
онный фактор Pdr1p может напрямую связывать
условий, в которых гены МЛУ переносчиков
различные чужеродные низкомолекулярные со
активно экспрессируются, несмотря на дефицит
единения, и это связывание вызывает актива
питательных веществ и энергии в клетке. Веро
цию экспрессии генов мишеней Pdr1p [71]. Во
ятно, в естественной среде эти условия связаны
вторых, некоторые соединения могут мешать
с повышенной вероятностью клетки столкнуть
митохондриям выполнять свои функции. В то
ся с антимикотиками, в этом случае подобная
же время известно, что дисфункция митохонд
регуляция МЛУ необходима, чтобы предотвра
рий индуцирует гены МЛУ через ретроградный
тить их воздействие на клетку путем увеличения
(Rtg ) сигнальный путь [73, 74]. Однако до сих
экспрессии генов МЛУ.
пор остается неясным, нарушение какой из ми
Как мы обсуждали выше, функционирова
тохондриальных функций приводит к актива
ние ABC переносчиков может нарушать гоме
ции МЛУ. Так, например, ингибирование мито
остаз стеринов. Таким образом, можно было бы
хондрий с помощью ингибитора дыхательной
ожидать координацию между активностью ме
цепи миксотиазола и ингибитора АТP синтазы
таболизма эргостерина и регуляцией МЛУ пе
олигомицина не приводит к накоплению белка
реносчиков. Действительно, чувствительный к
Pdr5p в дрожжевых клетках, при этом клетка
эргостерину транскрипционный фактор Upc2p
сохраняет способность активировать МЛУ в от
регулирует уровень экспрессии генов МЛУ пе
вет на другие ксенобиотики [72]. Нарушение ди
реносчика CDR1 и PDR1 в дрожжах C. glabrata
намики актинового цитоскелета из за мутации
[82]. Более того, недавно нами было обнаруже
актин связывающего белка кофилина запускает
но, что делеция генов LAM нарушает внутрик
митохондриальный ретроградный сигнальный
леточное распределение эргостерина и приво
путь и активацию генов МЛУ [75]. Наконец,
дит к накоплению Pdr5 GFP в клетках S. cere
экспрессия гена MFS переносчика FLR1, обес
visiae [83]. Эти данные показывают координа
печивающего резистентность к флуконазолу,
цию регуляции метаболизма и транспорта сте
увеличивается в ответ на окислительный стресс
ринов, с одной стороны, и экспрессии генов
[76, 77]. Окислительный стресс может быть
МЛУ, с другой стороны.
следствием непосредственного ингибирования
Следует отметить, что индивидуальные клет
противогрибковыми соединениями их основ
ки S. cerevisiae в значительной степени отлича
ных мишеней в цитоплазме [78]. В совокупнос
ются друг от друга по концентрации Pdr5p [84].
ти эти исследования показывают, что гены
Эту межклеточную гетерогенность обычно объ
МЛУ переносчиков активируются, когда клет
ясняют стохастичностью экспрессии и называют
ки подвергаются химическому стрессу.
транскрипционным шумом [85]. Мы предпола
Базовый уровень экспрессии генов МЛУ
гаем, что причиной этой фенотипической гете
также зависит от метаболического состояния
рогенности также может быть разница в репли
клеток. Так, например, экспрессия гена PDR5
кативном возрасте отдельных дрожжевых клеток
достаточно высокая во время экспоненциально
[86]. В то же время искусственно увеличенная ге
го роста клеток в гликолитических условиях, но
терогенность экспрессии PDR5 может увеличи
резко снижается, когда в среде заканчивается
вать устойчивость суспензии клеток S. cerevisiae к
глюкоза [79]. Как следствие, при переходе от
азолам [87]. Отсюда следует, что увеличение гете
БИОХИМИЯ том 85 вып. 12 2020
8*
1844
КНОРРЕ и др.
рогенности экспрессии генов МЛУ может обес
только при воздействии на клетки химического
печить субпопуляцию дрожжевых клеток преи
стресса. Однако подобная необходимость акти
муществами лекарственной устойчивости, избе
вации МЛУ делает клетки уязвимыми. Так,
гая затрат на поддержание МЛУ переносчиков
клетки окажутся беззащитны против гипотети
всеми дрожжевыми клетками в суспензии. Под
ческого токсина, который сможет избежать де
держание фенотипической гетерогенности мик
текции внутри клетки и, таким образом, не при
робных популяций в англоязычной литературе
ведет к активации МЛУ. Использование этой
обычно называют «bet hedging» (распределение
возможности - многообещающая стратегия для
рисков). Мы предполагаем, что подобное явле
разработки новых и эффективных противомик
ние вместе с тщательной регуляцией экспрессии
робных препаратов.
генов МЛУ -это эффективная стратегия клеток,
которая снижает негативное влияние МЛУ пе
реносчиков в нормальных условиях.
Благодарности. Мы благодарны В.П. Скула
чеву за плодотворное обсуждение основных
принципов регуляции множественной лекар
В данном обзоре проанализированы работы,
ственной устойчивости на организованных им
в которых было показано, что инактивация
семинарах по биоэнергетике.
МЛУ переносчиков увеличивает приспособ
Финансирование. Работа выполнена при фи
ленность клеток дрожжей к окружающим усло
нансовой поддержке Российского фонда фунда
виям среды, и обсуждены возможные механиз
ментальных исследований [грант INT/RUS/
мы негативного воздействия на клетки дрожже
RFBR/P 328 (Индия)/RFBR grant N 18 54
вых МЛУ переносчиков: таких как, например,
45001 IND A (Россия)]; Российского научного
бесполезный гидролиз АТФ, нарушение гомеос
фонда (грант 20 14 00268) (глава «Активность
таза липидов и межклеточной коммуникации.
ABC переносчиков создает дополнительную
Возможно, что некоторые из этих механизмов
нагрузку на клеточную энергетику»). Данная ра
справедливы также для P гликопротеина мле
бота также была поддержана грантом МГУ им.
копитающих и бактериальных ABC переносчи
М.В. Ломоносова для поддержки ведущих науч
ков. Высокая «стоимость» работы МЛУ пере
ных школ МГУ «Депозитарий живых систем
носчиков предполагает некий компромисс. С
Московского университета» в рамках Програм
одной стороны, эти переносчики могут защи
мы развития МГУ.
щать клетки от неожиданно появившихся в ок
Конфликт интересов. Авторы заявляют об от
ружающей среде ксенобиотиков. С другой сто
сутствии конфликта интересов между ними.
роны, они снижают общую приспособленность
Соблюдение этических норм. Данная работа
клеток в нормальных условиях. Регуляция
не содержит исследований, в которых в качестве
экспрессии ABC переносчиков решает эту
объектов были бы использованы люди или жи
проблему, активируя гены этих переносчиков
вотные.
СПИСОК ЛИТЕРАТУРЫ
1.
Aas, P. A., Otterlei, M., Falnes, P. O., Vågbø, C. B.,
6.
Zarnowski, R., Sanchez, H., Covelli, A. S., Dominguez, E.,
Skorpen, F., Akbari, M., et al. (2003) Human and bacteri
Jaromin, A., Bernhardt, J., et al. (2018) Candida albicans
al oxidative demethylases repair alkylation damage in both
biofilm induced vesicles confer drug resistance through
RNA and DNA, Nature, 421, 859 863, doi: 10.1038/
matrix biogenesis, PLoS Biol., 16, e2006872, doi: 10.1371/
nature01363.
journal.pbio.2006872.
2.
Chernova, T. A., Wilkinson, K. D., and Chernoff, Y. O.
7.
Khandelwal, N. K., Wasi, M., Nair, R., Gupta, M.,
(2017) Prions, chaperones, and proteostasis in yeast, Cold
Kumar, M., Mondal, A. K., et al. (2019) Vacuolar seques
Spring Harb. Perspect. Biol., 9, doi: 10.1101/cshperspect.
tration of azoles, a novel strategy of azole antifungal resis
a023663.
tance conserved across pathogenic and nonpathogenic
3.
Meunier, J. (2015) Social immunity and the evolution of
yeast, Antimicrob. Agents Chemother., 63, doi: 10.1128/
group living in insects, Philos. Trans. R Soc. Lond. B Biol.
AAC.01347 18.
Sci., 370, doi: 10.1098/rstb.2014.0102.
8.
Chang, W., Zhang, M., Zheng, S., Li, Y., Li, X., Li, W.,
4.
Keller, N. P., Turner, G., and Bennett, J. W. (2005) Fungal
et al. (2015) Trapping toxins within lipid droplets is a resis
secondary metabolism - from biochemistry to genomics,
tance mechanism in fungi, Sci. Rep.,
5,
15133,
Nat. Rev. Microbiol., 3, 937 947, doi: 10.1038/nrmicro1286.
doi: 10.1038/srep15133.
5.
Macheleidt, J., Mattern, D. J., Fischer, J., Netzker, T.,
9.
Bush, K., and Bradford, P. A. (2019) Interplay between
Weber, J., Schroeckh, V., et al. (2016) Regulation and role
β lactamases and new β lactamase inhibitors, Nat. Rev.
of fungal secondary metabolites, Annu. Rev. Genet., 50,
Microbiol.,
17,
295306, doi:
10.1038/s41579 019
371 392, doi: 10.1146/annurev genet 120215 035203.
0159 8.
БИОХИМИЯ том 85 вып. 12 2020
ИЗДЕРЖКИ СИСТЕМЫ МЛУ У ДРОЖЖЕЙ
1845
10.
Hlavica, P. (2013) Evaluation of structural features in fun
in Saccharomyces cerevisiae, Genome Biol., 5, 72, doi:
gal cytochromes P450 predicted to rule catalytic diversifi
10.1186/gb 2004 5 9 r72.
cation, Biochim. Biophys. Acta,
1834,
205220,
25.
Wale, N., Sim, D. G., Jones, M. J., Salathe, R., Day, T.,
doi: 10.1016/j.bbapap.2012.09.012.
and Read, A. F. (2017) Resource limitation prevents the
11.
Panwar, S. L., Pasrija, R., and Prasad, R.
(2008)
emergence of drug resistance by intensifying within host
Membrane homoeostasis and multidrug resistance in yeast,
competition, Proc. Natl. Acad. Sci. USA, 114,
13774
Biosci. Rep., 28, 217 228, doi: 10.1042/BSR20080071.
13779, doi: 10.1073/pnas.1715874115.
12.
Cannon, R. D., Lamping, E., Holmes, A. R., Niimi, K.,
26.
Prasad, R., and Goffeau, A. (2012) Yeast ATP binding cas
Baret, P. V., Keniya, M. V., et al. (2009) Efflux mediated
sette transporters conferring multidrug resistance, Annu.
antifungal drug resistance, Clin. Microbiol. Rev., 22, 291
Rev. Microbiol., 66, 39 63, doi: 10.1146/annurev micro
321, doi: 10.1128/CMR.00051 08.
092611 150111.
13.
Gottesman, M. M., Fojo, T., and Bates, S. E. (2002) Multi
27.
Moreno, A., Banerjee, A., Prasad, R., and Falson, P.
drug resistance in cancer: role of ATP dependent trans
(2019) PDR like ABC systems in pathogenic fungi, Res.
porters, Nat Rev Cancer, 2, 48 58, doi: 10.1038/nrc706.
Microbiol.,
170,
417425, doi:
10.1016/j.resmic.
14.
Di, C., and Zhao, Y. (2015) Multiple drug resistance due to
2019.09.002.
resistance to stem cells and stem cell treatment progress in
28.
Tsao, S., Rahkhoodaee, F., and Raymond, M. (2009)
cancer (review), Exp. Ther. Med.,
9,
289293,
Relative contributions of the Candida albicans ABC trans
doi: 10.3892/etm.2014.2141.
porters Cdr1p and Cdr2p to clinical azole resistance,
15.
Lewis, K. (2020) The science of antibiotic discovery, Cell,
Antimicrob. Agents Chemother.,
53,
13441352,
181, 29 45, doi: 10.1016/j.cell.2020.02.056.
doi: 10.1128/AAC.00926 08.
16.
Fetisova, E. K., Avetisyan, A. V., Izyumov, D. S.,
29.
Wasi, M., Khandelwal, N. K., Moorhouse, A. J., Nair, R.,
Korotetskaya, M. V., Chernyak, B. V., and Skulachev, V. P.
Vishwakarma, P., Bravo Ruiz, G., et al. (2019) ABC
(2010) Mitochondria targeted antioxidant SkQR1 selec
Transporter genes show upregulated expression in drug
tively protects MDR (Pgp 170) negative cells against
resistant clinical isolates of Candida auris: a genome wide
oxidative stress,
FEBS Lett.,
584,
562566,
characterization of ATP binding cassette (ABC) trans
doi: 10.1016/j.febslet.2009.12.002.
porter genes, Front. Microbiol., 10, 1445, doi: 10.3389/
17.
Nazarov, P. A., Osterman, I. A., Tokarchuk, A. V.,
fmicb.2019.01445.
Karakozova, M. V., Korshunova, G. A., et al. (2017)
30.
Cowen, L. E., and Lindquist, S. (2005) Hsp90 potentiates
Mitochondria targeted antioxidants as highly effective
the rapid evolution of new traits: drug resistance in diverse
antibiotics, Sci. Rep., 7, 1394, doi: 10.1038/s41598 017
fungi, Science,
309,
21852189, doi:
10.1126/sci
00802 8.
ence.1118370.
18.
Hlavácek, O., Kucerová, H., Harant, K., Palková, Z., and
31.
Sauna, Z. E., Bohn, S. S., Rutledge, R., Dougherty, M. P.,
Váchová, L. (2009) Putative role for ABC multidrug
Cronin, S., May, L., et al. (2008) Mutations define cross
exporters in yeast quorum sensing, FEBS Lett., 583, 1107
talk between the N terminal nucleotide binding domain
1113, doi: 10.1016/j.febslet.2009.02.030.
and transmembrane helix 2 of the yeast multidrug trans
19.
Krasowska, A., Łukaszewicz, M., Bartosiewicz, D., and
porter Pdr5: possible conservation of a signaling interface
Sigler, K. (2010) Cell ATP level of Saccharomyces cerevisi
for coupling ATP hydrolysis to drug transport, J. Biol.
ae sensitively responds to culture growth and drug inflicted
Chem., 283, 35010 35022, doi: 10.1074/jbc.M806446200.
variations in membrane integrity and PDR pump activity,
32.
Kim, Y., and Chen, J. (2018) Molecular structure of
Biochem. Biophys. Res. Commun., 395, 51 55, doi: 10.1016/
human P glycoprotein in the ATP bound, outward facing
j.bbrc.2010.03.133.
conformation, Science, 359, 915 919, doi: 10.1126/sci
20.
Prunuske, A. J., Waltner, J. K., Kuhn, P., Gu, B., and
ence.aar7389.
Craig, E. A. (2012) Role for the molecular chaperones
33.
Ernst, R., Kueppers, P., Stindt, J., Kuchler, K., and
Zuo1 and Ssz1 in quorum sensing via activation of the tran
Schmitt, L. (2010) Multidrug efflux pumps: substrate selec
scription factor Pdr1, Proc. Natl. Acad. Sci. USA, 109, 472
tion in ATP binding cassette multidrug efflux pumps - first
477, doi: 10.1073/pnas.1119184109.
come, first served? FEBS J., 277, 540 549, doi: 10.1111/
21.
Galkina, K. V., Finkelberg, J. M., Markova, O. V.,
j.1742 4658.2009.07485.x.
Azbarova, A. V., Banerjee, A., Kumari, S., et al. (2020)
34.
Gupta, R. P., Kueppers, P., Schmitt, L., and Ernst, R.
Protonophore FCCP provides fitness advantage to PDR
(2011) The multidrug transporter Pdr5: a molecular diode?
deficient yeast cells, J. Bioenerg. Biomembr., 52, 383 395,
Biol. Chem., 392, 53 60, doi: 10.1515/BC.2011.011.
doi: 10.1007/s10863 020 09849 1.
35.
Hofmann, S., Januliene, D., Mehdipour, A. R., Thomas,
22.
Usher, J., and Haynes, K. (2019) Attenuating the emer
C., Stefan, E., Brüchert, S., et al. (2019) Conformation
gence of anti fungal drug resistance by harnessing synthet
space of a heterodimeric ABC exporter under turnover
ic lethal interactions in a model organism, PLoS Genet., 15,
conditions, Nature, 571, 580 583, doi: 10.1038/s41586
e1008259, doi: 10.1371/journal.pgen.1008259.
019 1391 0.
23.
Moye Rowley, W. S. (2018) Multiple interfaces control
36.
Ernst, R., Kueppers, P., Klein, C. M., Schwarzmueller, T.,
activity of the Candida glabrata Pdr1 transcription factor
Kuchler, K., and Schmitt, L. (2008) A mutation of the H
mediating azole drug resistance, Curr. Genet., doi: 10.1007/
loop selectively affects rhodamine transport by the yeast
s00294 018 0870 4.
multidrug ABC transporter Pdr5, Proc. Natl. Acad. Sci.
24.
Boyer, J., Badis, G., Fairhead, C., Talla, E., Hantraye, F.,
USA, 105, 5069 5074, doi: 10.1073/pnas.0800191105.
Fabre, E., et al. (2004) Large scale exploration of growth
37.
Decottignies, A., Kolaczkowski, M., Balzi, E., and
inhibition caused by overexpression of genomic fragments
Goffeau, A. (1994) Solubilization and characterization of
БИОХИМИЯ том 85 вып. 12 2020
1846
КНОРРЕ и др.
the overexpressed PDR5 multidrug resistance nucleotide
recent duplication event, PDR18 being specific to the
triphosphatase of yeast, J. Biol. Chem., 269, 12797 12803.
Saccharomyces genus, Front. Genet., 9, 476, doi: 10.3389/
38.
Downes, M. T., Mehla, J., Ananthaswamy, N.,
fgene.2018.00476.
Wakschlag, A., Lamonde, M., Dine, E., et al. (2013) The
50.
Salin, H., Fardeau, V., Piccini, E., Lelandais, G., Tanty, V.,
transmission interface of the Saccharomyces cerevisiae mul
Lemoine, S., et al. (2008) Structure and properties of tran
tidrug transporter Pdr5: Val 656 located in intracellular loop
scriptional networks driving selenite stress response in
2 plays a major role in drug resistance, Antimicrob. Agents
yeasts, BMC Genomics, 9, 333, doi: 10.1186/1471 2164 9
Chemother., 57, 1025 034, doi: 10.1128/AAC.02133 12.
333.
39.
Golin, J., Kon, Z. N., Wu, C. P., Martello, J., Hanson, L.,
51.
Shahi, P., and Moye Rowley, W. S. (2009) Coordinate
Supernavage, S., et al. (2007) Complete inhibition of the
control of lipid composition and drug transport activities is
Pdr5p multidrug efflux pump ATPase activity by its trans
required for normal multidrug resistance in fungi, Biochim.
port substrate clotrimazole suggests that GTP as well as
Biophys. Acta,
1794,
852859, doi:
10.1016/j.bba
ATP may be used as an energy source, Biochemistry, 46,
pap.2008.12.012.
13109 13119, doi: 10.1021/bi701414f.
52.
Montañés, F. M., Pascual Ahuir, A., and Proft, M. (2011)
40.
Wagner, M., Smits, S. H. J., and Schmitt, L. (2019) In vitro
Repression of ergosterol biosynthesis is essential for stress
NTPase activity of highly purified Pdr5, a major yeast ABC
resistance and is mediated by the Hog1 MAP kinase and
multidrug transporter, Sci. Rep., 9, 7761, doi: 10.1038/
the Mot3 and Rox1 transcription factors, Mol. Microbiol.,
s41598 019 44327 8.
79, 1008 1023, doi: 10.1111/j.1365 2958.2010.07502.x.
41.
Golin, J., and Ambudkar, S. V. (2015) The multidrug trans
53.
Sokolov, S. S., Trushina, N. I., Severin, F. F., and Knorre,
porter Pdr5 on the 25th anniversary of its discovery: an
D. A. (2019) Ergosterol turnover in yeast: an interplay
important model for the study of asymmetric ABC trans
between biosynthesis and transport, Biochemistry, 84, 346
porters, Biochem. J.,
467,
353363, doi:
10.1042/
357, doi: 10.1134/S0006297919040023.
BJ20150042.
54.
Godinho, C. P., Prata, C. S., Pinto, S. N., Cardoso, C.,
42.
Ho, B., Baryshnikova, A., and Brown, G. W. (2018)
Bandarra, N. M., Fernandes, F., et al. (2018) Pdr18 is
Unification of protein abundance datasets yields a quanti
involved in yeast response to acetic acid stress counteract
tative Saccharomyces cerevisiae proteome, Cell Syst., 6, 192
ing the decrease of plasma membrane ergosterol content
205, doi: 10.1016/j.cels.2017.12.004.
and order, Sci. Rep., 8, 7860, doi: 10.1038/s41598 018
43.
Sheldon, J. G., Williams, S. P., Fulton, A. M., and Brindle,
26128 7.
K. M. (1996) 31P NMR magnetization transfer study of
55.
Kodedová, M., and Sychrová, H. (2015) Changes in the
the control of ATP turnover in Saccharomyces cerevisiae,
sterol composition of the plasma membrane affect mem
Proc. Natl. Acad. Sci. USA, 93, 6399 6404, doi: 10.1073/
brane potential, salt tolerance and the activity of multidrug
pnas.93.13.639.9.
resistance pumps in Saccharomyces cerevisiae, PLoS One,
44.
Ramirez Gaona, M., Marcu, A., Pon, A., Guo, A. C.,
10, e0139306, doi: 10.1371/journal.pone.0139306.
Sajed, T., Wishart, N. A., et al. (2017) YMDB 2.0: a signif
56.
Liu, S. L., Sheng, R., Jung, J. H., Wang, L., Stec, E.,
icantly expanded version of the yeast metabolome data
O’Connor, M. J., et al. (2017) Orthogonal lipid sensors
base, Nucleic Acids Res., 45, 440 445, doi: 10.1093/nar/
identify transbilayer asymmetry of plasma membrane cho
gkw1058.
lesterol, Nat. Chem. Biol., 13, 268 274, doi: 10.1038/
45.
Kolaczkowski, M., van der Rest, M., Cybularz
nchembio.2268.
Kolaczkowska, A., Soumillion, J. P., Konings, W. N., and
57.
Solanko, L. M., Sullivan, D. P., Sere, Y. Y., Szomek, M.,
Goffeau, A. (1996) Anticancer drugs, ionophoric peptides,
Lunding, A., Solanko, K. A., et al. (2018) Ergosterol is
and steroids as substrates of the yeast multidrug transporter
mainly located in the cytoplasmic leaflet of the yeast plasma
Pdr5p, J. Biol. Chem., 271, 31543 31548, doi: 10.1074/jbc.
membrane, Traffic, 19, 198 214, doi: 10.1111/tra.12545.
271.49.31543.
58.
Garrigues, A., Escargueil, A. E., and Orlowski, S. (2002)
46.
Wilcox, L. J., Balderes, D. A., Wharton, B., Tinkelenberg,
The multidrug transporter, P glycoprotein, actively medi
A. H., Rao, G., and Sturley, S. L. (2002) Transcriptional
ates cholesterol redistribution in the cell membrane, Proc.
profiling identifies two members of the ATP binding cas
Natl. Acad. Sci. USA, 99, 1034710352, doi: 10.1073/
sette transporter superfamily required for sterol uptake in
pnas.162366399.
yeast, J. Biol. Chem., 277, 32466 32472, doi: 10.1074/jbc.
59.
Pomorski, T., Holthuis, J. C. M., Herrmann, A., and van
M204707200.
Meer, G. (2004) Tracking down lipid flippases and their
47.
Zhu, J., Krom, B. P., Sanglard, D., Intapa, C., Dawson,
biological functions, J. Cell. Sci.,
117,
805813,
C. C., Peters, B. M., et al. (2011) Farnesol induced apop
doi: 10.1242/jcs.01055
tosis in Candida albicans is mediated by Cdr1 p extrusion
60.
Kean, L. S., Grant, A. M., Angeletti, C., Mahé, Y.,
and depletion of intracellular glutathione, PLoS One, 6,
Kuchler, K., Fuller, R. S., et al. (1997) Plasma membrane
e28830, doi: 10.1371/journal.pone.0028830.
translocation of fluorescent labeled phosphatidyl
48.
Cabrito, T. R., Teixeira, M. C., Singh, A., Prasad, R., and
ethanolamine is controlled by transcription regulators,
Sá Correia, I. (2011) The yeast ABC transporter Pdr18
PDR1 and PDR3, J. Cell. Biol.,
138,
255270,
(ORF YNR070w) controls plasma membrane sterol com
doi: 10.1083/jcb.138.2.255.
position, playing a role in multidrug resistance, Biochem.
61.
Decottignies, A., Grant, A. M., Nichols, J. W., de Wet, H.,
J., 440, 195 202, doi: 10.1042/BJ20110876.
McIntosh, D. B., and Goffeau, A. (1998) ATPase and mul
49.
Godinho, C. P., Dias, P. J., Ponçot, E., and Sá Correia, I.
tidrug transport activities of the overexpressed yeast ABC
(2018) The paralogous genes PDR18 and SNQ2, encoding
protein Yor1p, J. Biol. Chem.,
273,
126122622,
multidrug resistance ABC transporters, derive from a
doi: 10.1074/jbc.273.20.12612.
БИОХИМИЯ том 85 вып. 12 2020
ИЗДЕРЖКИ СИСТЕМЫ МЛУ У ДРОЖЖЕЙ
1847
62.
Kihara, A., and Igarashi, Y. (2004) Cross talk between
Identification of new surfaces of cofilin that link mito
sphingolipids and glycerophospholipids in the establish
chondrial function to the control of multi drug resistance,
ment of plasma membrane asymmetry, Mol. Biol. Cell, 15,
J. Cell. Sci., 125, 2288 2299, doi: 10.1242/jcs.099390.
4949 4959, doi: 10.1091/mbc.e04 06 0458.
76.
Chen, K. H., Miyazaki, T., Tsai, H. F., and Bennett, J. E.
63.
Hornby, J. M., Jensen, E. C., Lisec, A. D., Tasto, J. J.,
(2007) The bZip transcription factor Cgap1p is involved in
Jahnke, B., et al. (2001) Quorum sensing in the dimorphic
multidrug resistance and required for activation of mul
fungus Candida albicans is mediated by farnesol, Appl.
tidrug transporter gene CgFLR1 in Candida glabrata, Gene,
Environ. Microbiol., 67, 2982 2992, doi: 10.1128/AEM.
386, 63 72, doi: 10.1016/j.gene.2006.08.010.
67.7.2982 2992.2001.
77.
Galkina, K. V., Okamoto, M., Chibana, H., Knorre, D. A.,
64.
Chen, H., and Fink, G. R. (2006) Feedback control of
and Kajiwara, S. (2019) Deletion of CDR1 reveals redox
morphogenesis in fungi by aromatic alcohols, Genes Dev.,
regulation of pleiotropic drug resistance in Candida glabra
20, 1150 1161, doi: 10.1101/gad.1411806.
ta, Biochimie, 170, 49 56, doi: 10.1016/j.biochi.2019.
65.
Wongsuk, T., Pumeesat, P., and Luplertlop, N. (2016)
12.002.
Fungal quorum sensing molecules: role in fungal morpho
78.
Belenky, P., Camacho, D., and Collins, J. J.
(2013)
genesis and pathogenicity, J. Basic Microbiol., 56, 440 447,
Fungicidal drugs induce a common oxidative damage cel
doi: 10.1002/jobm.201500759.
lular death pathway, Cell Rep., 3, 350 358, doi: 10.1016/
66.
Enjalbert, B., and Whiteway, M. (2005) Release from quo
j.celrep.2012.12.021.
rum sensing molecules triggers hyphal formation during
79.
Mamnun, Y. M., Schьller, C., and Kuchler, K. (2004)
Candida albicans resumption of growth, Eukaryot. Cell, 4,
Expression regulation of the yeast PDR5 ATP binding cas
1203 1210, doi: 10.1128/EC.4.7.1203 1210.2005.
sette (ABC) transporter suggests a role in cellular detoxifi
67.
Davis Hanna, A., Piispanen, A. E., Stateva, L. I., and
cation during the exponential growth phase, FEBS Lett.,
Hogan, D. A. (2007) Farnesol and dodecanol effects on the
559, 111 117, doi: 10.1016/S0014 5793(04)00046 8.
Candida albicans Ras1 cAMP signalling pathway and the
80.
Cadek, R., Chládková, K., Sigler, K., and Gásková, D.
regulation of morphogenesis Internet, Mol. Microbiol., 47
(2004) Impact of the growth phase on the activity of mul
62, doi: 10.1111/j.1365 2958.2007.06013.x.
tidrug resistance pumps and membrane potential of
68.
Sharma, M., and Prasad, R. (2011) The quorum sensing
S. cerevisiae: effect of pump overproduction and carbon
molecule farnesol is a modulator of drug efflux mediated by
source, Biochim. Biophys. Acta,
1665,
111117,
ABC multidrug transporters and synergizes with drugs in
doi: 10.1016/j.bbamem.2004.06.020.
Candida albicans, Antimicrob. Agents Chemother., 55, 4834
81.
Rahman, H., Carneglia, J., Lausten, M., Robertello, M.,
4843, doi: 10.1128/AAC.00344 11.
Choy, J., and Golin, J. (2018) Robust, pleiotropic drug
69.
Jakab, Á., Tóth, Z., Nagy, F., Nemes, D., Bácskay, I.,
resistance 5 (Pdr5) mediated multidrug resistance is vigor
Kardos, G., et al. (2019) Physiological and transcriptional
ously maintained in Saccharomyces cerevisiae cells during
responses of Candida parapsilosis to exogenous tyrosol,
glucose and nitrogen limitation, FEMS Yeast Res., 18,
Appl. Environ. Microbiol., 85, doi: 10.1128/AEM.01388
doi: 10.1093/femsyr/foy029.
19.
82.
Vu, B. G., Thomas, G. H., and Moye Rowley, W. S. (2019)
70.
Teixeira, M. C., and Sá Correia, I. (2002) Saccharomyces
Evidence that ergosterol biosynthesis modulates activity of
cerevisiae resistance to chlorinated phenoxyacetic acid her
the Pdr1 transcription factor in Candida glabrata, MBio,
bicides involves Pdr1p mediated transcriptional activation
10, doi: 10.1128/mBio. 00934 19.
of TPO1 and PDR5 genes, Biochem. Biophys. Res.
83.
Sokolov, S. S., Vorobeva, M. A., Smirnova, A. I.,
Commun., 292, 530 537, doi: 10.1006/bbrc.2002.6691.
Smirnova, E. A., Trushina, N. I., et al. (2020) LAM Genes
71.
Thakur, J. K., Arthanari, H., Yang, F., Pan, S. J., Fan, X.,
contribute to environmental stress tolerance but sensibilize
Breger, J., et al. (2008) A nuclear receptor like pathway
yeast cells to azoles, Front. Microbiol.,
11,
38,
regulating multidrug resistance in fungi, Nature, 452, 604
doi: 10.3389/fmicb.2020.00038.
609, doi: 10.1038/nature06836.
84.
Azbarova, A. V., Galkina, K. V., Sorokin, M. I., Severin,
72.
Galkina, K. V., Besedina, E. G., Zinovkin, R. A., Severin,
F. F., and Knorre, D. A. (2017) The contribution of
F. F., and Knorre, D. A. (2018) Penetrating cations induce
Saccharomyces cerevisiae replicative age to the variations in
pleiotropic drug resistance in yeast, Sci. Rep., 8, 8131,
the levels of Trx2p, Pdr5p, Can1p and Idh isoforms, Sci.
doi: 10.1038/s41598 018 26435 z.
Rep., 7, 13220, doi: 10.1038/s41598 017 13576 w.
73.
Hallstrom, T. C., and Moye Rowley, W. S. (2000) Multiple
85.
Liu, J., François, J. M., and Capp, J. P. (2016) Use of
signals from dysfunctional mitochondria activate the
noise in gene expression as an experimental parameter to
pleiotropic drug resistance pathway in Saccharomyces cere
test
phenotypic effects, Yeast,
33,
209216,
visiae, J. Biol. Chem., 275, 37347 37356, doi: 10.1074/jbc.
doi: 10.1002/yea.3152.
M007338200.
86.
Knorre, D. A., Azbarova, A. V., Galkina, K. V., Feniouk,
74.
Zhang, X., and Moye Rowley, W. S.
(2001)
B. A., and Severin, F. F. (2018) Replicative aging as a
Saccharomyces cerevisiae multidrug resistance gene
source of cell heterogeneity in budding yeast, Mech. Ageing
expression inversely correlates with the status of the F(0)
Dev., 176, 24 31, doi: 10.1016/j.mad.2018.09.001.
component of the mitochondrial ATPase, J. Biol. Chem.,
87.
Bódi, Z., Farkas, Z., Nevozhay, D., Kalapis, D., Lázár, V.,
276, 47844 47852, doi: 10.1074/jbc.M106285200.
Csörg , B., et al. (2017) Phenotypic heterogeneity pro
75.
Kotiadis, V. N., Leadsham, J. E., Bastow, E. L.,
motes adaptive evolution, PLoS Biol., 15, e2000644,
Gheeraert, A., Whybrew, J. M., Bard, M., et al. (2012)
doi: 10.1371/journal.pbio.2000644.
БИОХИМИЯ том 85 вып. 12 2020
1848
КНОРРЕ и др.
DO MULTIPLE DRUG RESISTANCE TRANSPORTERS INTERFERE
WITH CELL FUNCTIONING UNDER NORMAL CONDITIONS?
Review
D. A. Knorre1,2*, K. V. Galkina1, T. Shirokovskikh3, A. Banerjee4, and R. Prasad4
1 Belozersky Institute of Physico Chemical Biology, Moscow State University,
119991 Moscow, Russia; E mail: knorre@belozersky.msu.ru
2 Institute of Molecular Medicine, Sechenov First Moscow State Medical University, 119992 Moscow, Russia
3 Faculty of Bioengineering and Bioinformatics, Moscow State University, 119991 Moscow, Russia
4 Amity Institute of Biotechnology and Amity Institute of Integrative Sciences and Health,
Amity University Haryana, Amity Education Valley, Gurugram, 122413, India
Received July 3, 2020
Revised August 25, 2020
Accepted August 25, 2020
Eukaryotic cells rely on multiple mechanisms to protect themselves from exogenous toxic compounds. For instance,
cells can limit penetration of toxic molecules through the plasma membrane or sequester them within the specialized
compartments. Plasma membrane transporters with broad substrate specificity confer multiple drug resistance
(MDR) to cells. These transporters efflux toxic compounds at the cost of ATP hydrolysis (ABC transporters) or pro
ton influx (MFS transporters). In our review, we discuss the possible costs of having an active drug efflux system using
yeast cells as an example. The pleiotropic drug resistance (PDR) subfamily ABC transporters are known to constitu
tively hydrolyze ATP even without any substrate stimulation or transport across the membrane. Besides, some MDR
transporters have flippase activity allowing transport of lipids from inner to outer lipid layer of the plasma membrane.
Thus, excessive activity of MDR transporters can adversely affect plasma membrane properties. Moreover, broad sub
strate specificity of ABC transporters also suggests the possibility of unintentional efflux of some natural metabolic
intermediates from the cells. Furthermore, in some microorganisms, transport of quorum sensing factors is mediat
ed by MDR transporters; thus, overexpression of the transporters can also disturb cell to cell communications. As a
result, under normal conditions, cells keep MDR transporter genes repressed and activate them only upon exposure
to stresses. We speculate that exploiting limitations of the drug efflux system is a promising strategy to counteract
MDR in pathogenic fungi.
Keywords: multiple drug resistance, yeast, ABC transporters, signalling, pleiotropic drug resistance
БИОХИМИЯ том 85 вып. 12 2020