БИОХИМИЯ, 2020, том 85, вып. 12, с. 1898 - 1917
УДК 577.151.6
РОТОРНЫЕ ИОН ТРАНСЛОЦИРУЮЩИЕ АТФазы/АТФ СИНТАЗЫ:
РАЗНООБРАЗИЕ, ОБЩИЕ ЧЕРТЫ И ОТЛИЧИЯ
Обзор
© 2020
В.М. Зубарева1, А.С. Лапашина1,2, Т.Е. Шугаева1, А.В. Литвин1, Б.А. Фенюк1,2*
1 Московский государственный университет имени М.В. Ломоносова, факультет биоинженерии
и биоинформатики, 119991 Москва, Россия; электронная почта: feniouk@fbb.msu.ru
2 НИИ физико*химической биологии имени А.Н. Белозерского, Московский государственный университет
имени М.В. Ломоносова, 119991 Москва, Россия
Поступила в редакцию 22.07.2020
После доработки 22.09.2020
Принята к публикации 09.10.2020
Ион транслоцирующие АТФазы катализируют гидролиз АТФ, сопряженный с переносом ионов через
мембрану, и включают АТФазы F , V и A типов, а также некоторые АТФазы P типа и ABC транспортеры.
F и A АТФазы, помимо гидролиза, способны к синтезу АТФ, т.е являются АТФ синтазами. F , V и A АТ
Фазы представляют из себя белковые наномашины, сопрягающие трансмембранный ионный транспорт и
гидролиз АТФ с помощью ротационного механизма. Эти ферменты состоят из двух мультисубъединичных
субкомплексов, вращающихся друг относительно друга в процессе катализа. При этом фосфорилирова
ние/дефосфорилирование нуклеотида происходит напрямую, без интермедиата в виде фосфорилированно
го белка. АТФазы F типа обнаружены в хлоропластах, митохондриях, большинстве эубактерий, и в нес
кольких видах архей. Ферменты V типа присутствуют в эукариотических клетках в вакуолях, поздних эндо
сомах, транс*цистернах аппарата Гольджи, а также в плазматической мембране. АТФазы A типа характер
ны для архебактерий и некоторых эубактерий. У ферментов F и A типа есть две основные функции: син
тез АТФ за счет транспорта через мембрану протонов (или ионов натрия у некоторых прокариот) под
действием протонного (или натриевого) электрохимического потенциала или же, наоборот, поддержание
этого потенциала за счет гидролиза АТФ. У прокариот преобладание той или иной функции зависит от ус
ловий внешней среды и наличия у организма других ферментов, способных создавать этот потенциал. У эу
кариот преобладающей функцией F АТФаз является синтез АТФ. V АТФазы эукариот работают исключи
тельно как АТФ зависимые протонные насосы, основными функциями которых является генерация про
тонного электрохимического потенциала, необходимого для трансмембранного транспорта ионов и низко
молекулярных метаболитов, и регуляция рН. Данный обзор посвящен описанию разнообразия роторных
ион транслоцирующих АТФаз из разных организмов и сравнительному анализу структурных и функцио
нальных особенностей этих ферментов.
КЛЮЧЕВЫЕ СЛОВА: АТФ синтаза, F АТФаза, A АТФаза, V АТФаза, внутриклеточный АТФ, протон
транслоцирующая АТФаза, регуляция.
DOI: 10.31857/S0320972520120131
ВВЕДЕНИЕ
других нуклеотидов: нуклеозид дифосфат кина
за катализирует реакцию переноса γ фосфата от
АТФ является главным интермедиатом био
АТФ на ГДФ, ЦДФ, ТДФ и УДФ с образовани
энергетики клетки. Многие ферменты сопряга
ем соответствующих нуклеозид трифосфатов,
ют экзергоническую реакцию гидролиза АТФ с
которые затем участвуют в синтезе белка, нукле
необходимыми для жизни химическими реак
иновых кислот, липидов и в ряде других анабо
циями, требующими энергии. Кроме того, энер
лических реакций.
гия гидролиза АТФ используется клеткой для
Группа роторных ион транслоцирующих
трансмембранного транспорта ионов и низко
АТФаз/АТФ синтаз объединяет как ферменты,
молекулярных органических веществ и для со
являющиеся основными «поставщиками» АТФ
вершения механической работы (мышечное
в клетке, так и его потребителей; в некоторых
сокращение, биение ресничек, расхождение
случаях один и тот же фермент может выпол
хромосом во время деления и т.п.). Отношение
нять обе функции в зависимости от физиологи
АТФ/АДФ в клетке влияет на концентрации
ческих условий. Более того, в искусственных ус
ловиях эксперимента синтез АТФ можно полу
* Адресат для корреспонденции.
чить даже на ферменте, не проявляющем этой
1898
РОТОРНЫЕ ИОН ТРАНСЛОЦИРУЮЩИЕ АТФазы
1899
активности in vivo. В этой связи в данном обзоре
ОБЩИЕ ПРИНЦИПЫ СТРОЕНИЯ
термины АТФаза и АТФ синтаза используются
И ФУНКЦИИ РОТОРНЫХ АТФаз
как синонимы, но последний применяется
И ИХ СУБЪЕДИНИЧНЫЙ СОСТАВ
только к ферментам, синтезирующим АТФ
in vivo.
Все роторные АТФазы имеют общий основ
Роторные ион транслоцирующие АТФазы
ной принцип строения и субъединичной орга
подразделяют на три «семейства»: ферменты F
низации. Они состоят из двух частей: гидро
, V и A типа. Исторически первыми в середине
фильного субкомплекса F1/V1/A1, который свя
ХХ в. были открыты F АТФазы, и в настоящее
зывает нуклеотиды и фосфат и катализирует
время они являются наиболее подробно изу
синтез и/или гидролиз АТФ, и гидрофобного
ченными. Они обнаружены в большинстве эу
мембранного субкомплекса FO/VO/AO, отвечаю
бактерий и некоторых архебактериях (вместе с
щего за ионный транспорт. Эти две части соеди
A АТФазами), а также у эукариот в митохонд
нены между собой центральным стержнем, а
риях и хлоропластах. Буква F является сокра
также одним или несколькими периферически
щением от английского «фактор» и появилась в
ми стеблями в единую структуру [9].
ходе исследований окислительного фосфори
От общего предка все роторные АТФазы
лирования в митохондриях для обозначения
унаследовали набор субъединиц, непосред
факторов, необходимых для синтеза АТФ при
ственно участвующих в синтезе/гидролизе АТФ
дыхании.
и трансмембранном переносе ионов. Этот набор
V АТФазы были открыты заметно позже, в
субъединиц удобно рассмотреть на примере наи
1980 х гг., в вакуолях эукариотических клеток
более просто устроенной F АТФазы эубактерий.
(отсюда и буква V); история этого открытия
Основными функциональными компонентами
описана в обзоре [1]. Примерно в то же время
бактериального F1 являются кольцевой α3β3 гек
было обнаружено, что в архебактериях и неко
самер, содержащий сайты связывания нуклеоти
торых эубактериях ион транслоцирующие АТ
дов, и субъединица γ, которая имеет вытянутую
Фазы отличаются от ферментов F типа и гораз
форму и занимает центральную полость гекса
до больше похожи на эукариотические V АТФа
мера. Субъединица γ вместе с небольшой субъе
зы. Из за этого во многих работах эти ферменты
диницей ε составляют центральный стержень
также называются V АТФазами, особенно в слу
фермента и присоединяются к кольцевому оли
чае эубактерий (например, Enterococcus hirae или
гомеру с субъединиц. Ионный транспорт проис
Thermus thermophilus). Однако между V АТФаза
ходит в области контакта с кольца с погружен
ми эукариот и прокариотическими ферментами
ной в мембрану субъединицей a и сопровождает
есть ряд существенных отличий, описанных ни
ся вращением комплекса сnγε («ротор») относи
же, поэтому некоторые исследователи еще в на
тельно остальной части фермента («статор»).
чале 1990 х гг. предложили выделить роторные
Вращение γ внутри α3β3 гексамера сопряжено с
ион транслоцирующие АТФазы архей в отдель
конформационными изменениями в каталити
ную группу A АТФаз [2]. Классификация, сог
ческих сайтах и синтезом/гидролизом АТФ.
ласно которой все прокариотические ферменты
Гомологи вышеописанных субъединиц
этого типа объединяются в группу A АТФаз,
представлены во всех известных F АТФазах
достаточно широко принята [3-6], представля
(рис. 1). Фермент хлоропластов по своему субъ
ется разумной и позволяет избежать ненужной
единичному составу практически не отличается
путаницы, поэтому в данном обзоре мы упот
от бактериального [14]. Митохондриальные
ребляем термин «V АТФазы» только для эукари
АТФ синтазы содержат одну дополнительную
отических ферментов.
субъединицу в составе центрального стержня,
Роторные ион транслоцирующие АТФазы
называемую ε, но не являющуюся гомологом ε
имеют общее эволюционное происхождение
субъединицы эубактерий и хлоропластов. Кро
[7], сходную структуру и каталитический меха
ме того, фермент митохондрий отличается более
низм. Это позволяет предположить, что фер
сложным устройством периферического стебля:
менты этого типа уже были у общего предка
его составляют субъединицы девяти или более
про и эукариот [8]. Все они осуществляют вза
типов, различающихся у организмов разных
имопревращение двух основных «энергетичес
таксономических групп (см. таблицу)
ких валют» клетки - АТФ и трансмембранной
[11, 15, 16]. Некоторые из субъединиц перифе
разности электрохимического потенциала про
рического стебля участвуют в димеризации ми
~
H+) или, в случае некоторых прокариот,
тохондриального FOF1. Способность к димери
~
Na+), играют ключевую роль в регуля
зации, по всей видимости, является отличитель
ции концентраций нуклеотидов и энергизации
ной особенностью всех митохондриальных
мембран.
F АТФаз: она описана для ферментов дрожжей
БИОХИМИЯ том 85 вып. 12 2020
1900
ЗУБАРЕВА и др.
Субъединичный состав роторных АТФаз
FOF1
VOV1 S.
VOV1 млеко
AOA1
Комментарии
cerevisiae
питающих
E. coli
S. cere*
B. taurus
E. gracilis
Chloro
visiae
phyceae
Гексамер
А
A
А
β
β
β
β
β
несет каталитический сайт
В
B
В
α
α
α
α
α
несет некаталитический сайт
-
-
-
-
-
-
p18
-
участвует в сборке
Центральный стебель
D1
D1
D1
γ
γ
γ
γ
γ
вращается внутри каталитического
гексамера, передает вращательный
момент между мембранным и гид
рофильным субкомплексами. В F
АТФазе хлоропластов имеет регуля
торную функцию
F1,3
F1,3
F1,3
-
-
-
-
-
сопряжение
-
-
-
ε
δ
δ
δ
δ
сопряжение; в хлоропластах и у не
которых бактерий - регуляция
-
-
-
-
ε
ε
ε
ε
структурный компонент ротора
D
d
d (C)
-
-
-
-
-
структурный компонент ротора
Voa1p
ATP6AP2
-
-
-
-
-
-
участвует в процессах сигналинга
(PRR)
Big1
ATP6AP1
-
-
-
-
-
-
участвует в процессах сигналинга
(Ac45)
Мембранный комплекс FO/AO/VO и субъединицы периферического стебля
c/c’/c’’
c/c’’
c (K, L)
c
c
c
c
c
перенос ионов через мембрану
(Vma16p)
A
a
I
a
a
a
a
a
образует ионные полуканалы в
мембране; у A и V АТФаз также
образует «воротник» для прикреп
ления периферических стеблей
-
-
-
-
8
A6L
A6L
-
мембранная субъединица, стабили
зирует FO субкомплекс
-
-
-
-
e
e
-
-
мембранные субъединицы, участву
(Tim11)
ют в димеризации
-
-
-
-
g
g
-
-
-
-
-
-
l
k
k5
-
-
-
-
-
k
DAPIT
-
-
-
-
-
-
i (j)
6.8PL
i (j)
-
мембранная субъединица, участвует
в сборке FO
-
-
-
-
-
-
-
Asa3
частично или полностью погруже
ны в мембрану
-
-
-
-
-
-
-
Asa5
-
-
-
-
-
-
-
Asa6
−
-
-
−
-
-
−
Asa8
БИОХИМИЯ том 85 вып. 12 2020
РОТОРНЫЕ ИОН ТРАНСЛОЦИРУЮЩИЕ АТФазы
1901
Окончание таблицы
FOF1
VOV1 S.
VOV1 млеко
AOA1
Комментарии
cerevisiae
питающих
E. coli
S. cere*
B. taurus
E. gracilis
Chloro
visiae
phyceae
-
-
-
-
-
-
-
Asa9
-
-
-
-
-
-
-
Asa10
мембранная субъединица, участвует
в димеризации
-
-
-
-
-
-
ATPTB6
-
мембранные субъединицы
-
-
-
-
-
-
ATPTB12
-
-
-
-
-
-
-
ATPEG3
-
-
-
-
-
-
-
ATPEG4
-
-
-
-
-
-
-
ATPEG5
-
-
-
-
-
-
-
ATPEG6
-
-
-
-
-
-
-
ATPEG7
-
-
-
-
-
-
-
ATPEG8
-
-
-
-
-
-
-
ATPEG1
-
мембранные, участвуют в димеризации
-
-
-
-
-
-
ATPEG2
-
E
e
-
-
-
-
-
-
мембранные субъединицы
F
f
-
-
-
-
-
-
G1
G1
G1
b
b
b
b
-
протяженная субъединица перифе
рического стебля, связывает мемб
E1,2
E1,2
E1,2
ранный и гидрофильный комплексы
-
-
-
δ
OSCP
OSCP
OSCP
OSCP
присоединяет периферический сте
бель к с каталитическому гексамеру
C
C
-
-
-
-
-
-
образуют «воротник» для прикреп
ления периферических стеблей
H
H
-
-
-
-
-
-
-
-
-
-
f6
f6
-
-
субъединицы периферического стебля
-
-
-
-
d
d
d4
-
-
-
-
-
f
f
f4
-
-
-
-
-
-
-
-
Asa1
субъединица периферического
стебля, участвует в димеризации
-
-
-
-
-
-
-
Asa2
субъединицы периферического стебля
-
-
-
-
-
-
-
Asa4
-
-
-
-
-
-
-
Asa7
-
-
-
-
-
-
ATPTB1
-
субъединицы периферического стебля
-
-
-
-
-
-
ATPTB3
-
−
-
-
−
-
-
ATPTB4
-
Примечание. В одной и той же строке указаны субъединицы, имеющие общего предка. В скобках приводятся альтерна
тивные названия субъединиц; (1) Эволюционное родство однозначно не показано различными исследователями, гомоло
гия как и утверждается, так и опровергается; (2) некоторые исследователи предполагают гомологю и с субъединицей δ;
(3) часть исследователей предполагает гомологию с субъединицей ε; (4) предполагается участие в димеризации; (5) не пред
полагается участие в димеризации.
БИОХИМИЯ том 85 вып. 12 2020
1902
ЗУБАРЕВА и др.
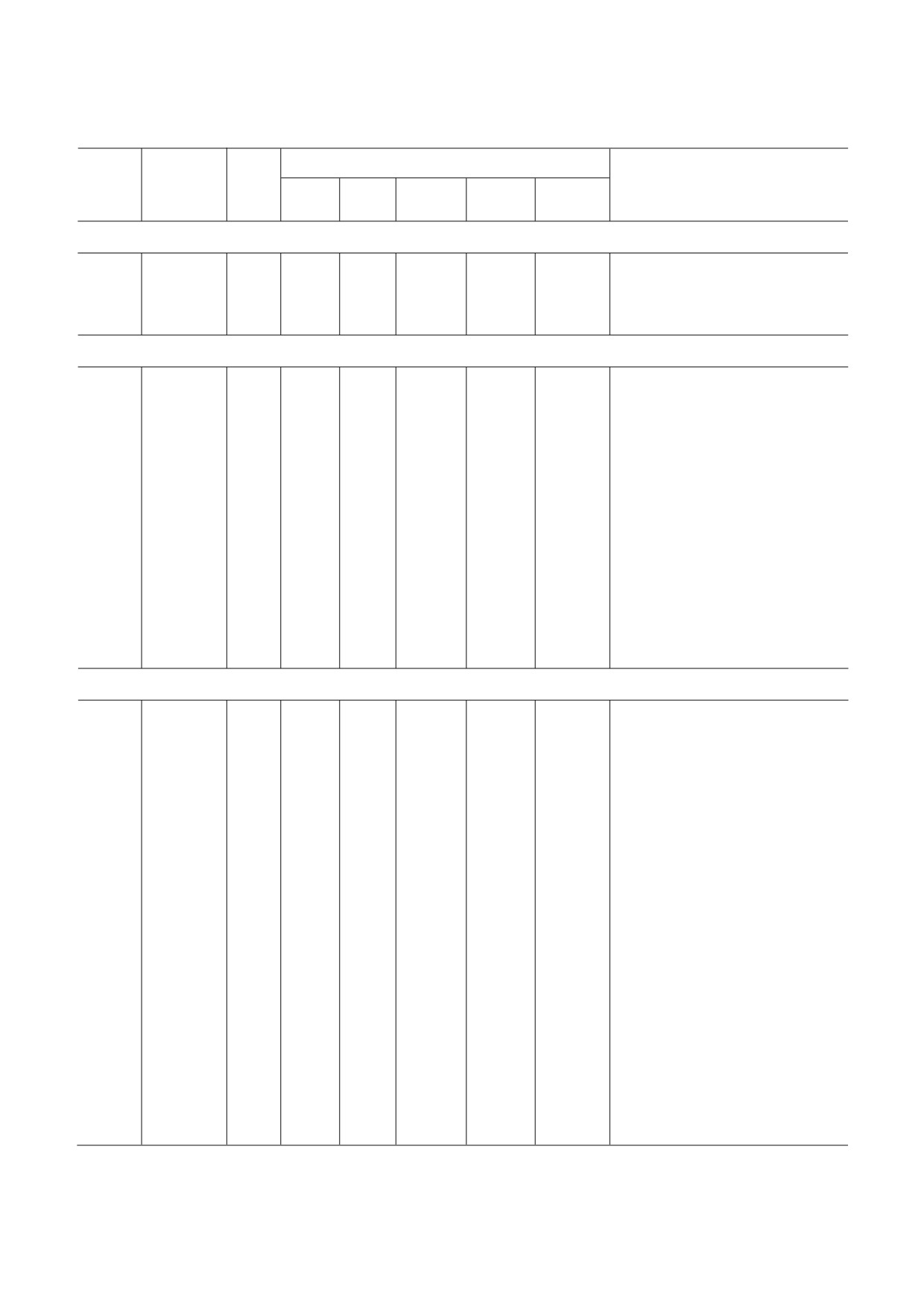
Рис. 1. Сравнение структур роторных АТФаз. Показаны: F АТФаза эубактерии Bacillus sp. PS3 (PDB ID 6N2Y [10]), F АТ
Фаза митохондрий свиньи Sus scrofa (PDB ID 6J5I [11]), A АТФаза эубактерии Thermus thermophilus (PDB ID 6R0W [12]),
V АТФаза крысы Rattus norvegicus (PDB ID: 6VQ9, 6VQC, 6VQI [13]). Одним и тем же цветом окрашены субъединицы, для
которых показана или предполагается гомология последовательностей и/или функций. Субъединицы ротора выделены
жирным контуром; пунктиром показана скрытая часть ротора; бежевой полосой обозначена мембрана. (С цветными ва
biokhsm/)
[17, 18], водорослей [15, 16], высших растений
АТФазы А и V типов структурно отличают
[19] и, наконец, позвоночных [20]. Две молеку
ся от F АТФаз наличием не одного, а несколь
лы фермента в составе димера соединяются
ких периферических стеблей. Так, прокариоти
между собой мембранными частями со стороны
ческие А АТФазы содержат два периферических
периферических стеблей; сам димер имеет V
стебля [12], а V АТФазы эукариот - три [13].
образную форму и приводит к возникновению
Каждый стебель состоит из двух субъединиц: E и
изгиба мембраны. Кроме того, димеры собира
G. Некоторые исследователи предполагают, что
ются в протяженные ряды [21] и обеспечивают
эти субъединицы являются гомологами субъе
формирование крист, располагаясь вдоль скла
диниц δ и b периферического стебля F АТФаз
док внутренней митохондриальной мембраны
эубактерий [7, 24]. Центральный стержень A и
(таблица) [22]. Подробное сравнение структур
V АТФаз содержит специфические дополни
F АТФаз из разных организмов и органелл мож
тельные субъединицы, участвующие в присое
но найти в недавнем обзоре [5].
динении субъединицы D - функционального
БИОХИМИЯ том 85 вып. 12 2020
РОТОРНЫЕ ИОН ТРАНСЛОЦИРУЮЩИЕ АТФазы
1903
аналога субъединицы γ F АТФаз - к с кольцу. У
вать АТФ и другие пуриновые нуклеотиды, и,
V АТФаз с кольцо представляет собой гетеро
вероятно, участвуют в регуляции активности
олигомер, который, помимо нескольких копий
фермента (см. обзоры [34, 35]). Для АТФаз А и
субъединицы с, содержит гомологичную пос
V типа сам факт существования некаталитичес
ледней субъединицу c’’, а у дрожжей ещё и с’
ких сайтов является предметом дискуссии. В
[13, 25]. Субъединица a у V АТФаз (и ее гомолог
имеющихся структурах ферментов субъединица
I у A АТФаз) имеет гидрофильный домен, напо
B не содержит связанного нуклеотида [12, 13,
минающий по форме воротник и выдающийся
36]. Вместе с тем, в литературе имеются данные
из мембраны; он служит для присоединения
о связывании фотоаффинных аналогов АТФ и
двух периферических стеблей. Третий перифе
АДФ субъединицей В некоторых А АТФаз как в
рический стебель у V АТФаз присоединяется к
изолированном виде, так и в составе A1 субко
субъединице a посредством отдельной субъеди
мплекса, поэтому некоторые исследователи
ницы С, отсутствующей у ферментов А типа
предполагают, что эта субъединица все же может
[13]. Считается, что V АТФазы эукариот прои
играть роль в регуляции катализа [4, 37]. Появ
зошли от А АТФаз плазматической мембраны
ление каталитической и некаталитической
архей: на это указывает сходство субъединично
субъединицы в гексамере, по всей вероятности,
го состава и аминокислотных последователь
является результатом дупликации гена у общего
ностей этих ферментов. Подробная характерис
предка пробактерий еще до их разделения на ар
тика структур A и V АТФаз дается в ряде обзо
хе и эубактерий [38].
ров, см. например [26-28]; полный список субъ
При синтезе/гидролизе АТФ три каталити
единиц отдельных представителей роторных
ческих сайта кооперативно взаимодействуют
АТФаз с учетом гомологии функций и последо
между собой. В отдельно взятый момент време
вательностей приведен в таблице. Стоит еще раз
ни сайты имеют неодинаковое сродство к
отметить, что, несмотря на перечисленные раз
субстратам и продуктам реакции, а каталитичес
личия, связанные по большей части со струк
кие события в одном сайте влияют на конфор
турной «обвязкой» ферментов, набор субъеди
мацию двух остальных. Эта идея впервые была
ниц, непосредственно вовлеченных в связыва
предложена для F АТФазы Полом Бойером и
ние субстратов и транспортируемых ионов, оди
позднее легла в основу общепринятой сейчас
наков у всех роторных АТФаз, что указывает на
модели катализа, получившей название «меха
общее эволюционное происхождение и высо
низм чередования изменяющегося сродства»
кую консервативность их каталитического ме
(alternating binding change mechanism) [39]. Эф
ханизма.
фективность кооперации между сайтами обес
печивает асимметричная субъединица цент
рального стержня (γ у F АТФаз и D у A и V АТ
КАТАЛИТИЧЕСКИЙ МЕХАНИЗМ F1/A1/V1
Фаз), которая вращается внутри каталитическо
го гексамера, по очереди взаимодействуя с его
В составе гексамера субъединицы α и β (В и
субъединицами и вызывая конформационные
А) чередуются между собой, а нуклеотид связы
изменения в них. Полный оборот этой субъеди
вающие сайты располагаются на поверхностях
ницы сопровождается синтезом или гидролизом
их взаимодействия. У всех роторных АТФаз есть
трех молекул АТФ. Вращение γ субъединицы в
три каталитических сайта; они образованы по
процессе катализа было предсказано на основа
большей части остатками субъединиц β у F АТ
нии структуры F1 субкомплекса из митохонд
Фаз [29] и субъединиц А у V и A АТФаз [13, 30]
рий быка [29] и впоследствии показано напря
и имеют чрезвычайно консервативную структу
мую на единичных молекулах бактериального F1
ру [31]. В катализе участвует также консерватив
[40]. В дальнейшем методы исследования гидро
ный остаток аргинина («аргининовый палец»),
лиза АТФ комплексом F1 на единичных молеку
который принадлежит субъединице α у F АТ
лах были значительно усовершенствованы и
Фаз и B у A и V АТФаз и стабилизирует γ фос
позволили получить огромный массив экспери
фатную группу АТФ [32, 33]. Субстратами ро
ментальных данных, детально прояснивших мо
торных АТФаз являются магниевые комплексы
лекулярный механизм гидролиза АТФ для F
нуклеотидов; без магния нуклеотиды связыва
АТФаз прокариот и эукариот (см., например,
ются с ферментом, однако гидролиза/синтеза не
обзоры [41-43]). Ротационный механизм А1
происходит.
субкомплекса изучен в основном на ферментах
У F АТФаз α3β3 гексамер содержит еще три
эубактерий Enterococcus hirae [44] и Thermus ther*
нуклеотид связывающих сайта, которые распо
mophilus [45, 46] и имеет свои особенности, од
ложены в основном на субъединицах α и назы
нако подчиняется описанному выше принципу.
ваются некаталитическими; они могут связы
Для эукариотической V АТФазы также было по
БИОХИМИЯ том 85 вып. 12 2020
1904
ЗУБАРЕВА и др.
казано АТФ зависимое вращение центрального
случае V АТФаз, ее мембранный С концевой
стержня [47]. Таким образом, фундаментальное
домен). Говоря о ферментах А типа, гомолог
сходство F , A и V АТФаз просматривается не
субъединицы с в литературе называют субъеди
только на уровне структуры, но и в механизме
ницей K или L, а гомолог субъединицы a - субъ
ротационного катализа.
единицей I.
Субстратная специфичность роторных АТ
На внешней поверхности с кольца (K или L
Фаз широка и исследовалась как на изолирован
кольца у А АТФаз) находятся сайты связывания
ных ферментах [48-50] или их субкомплексах
ионов, погруженные в глубину липидного бис
[51-54], так и на мембранах митохондрий [55],
лоя. Ключевую роль в связывании иона играет
хлоропластов [56], вакуолей [57] и плазматичес
карбоксильная группа остатка аспартата или
ких мембранах эукариотических [58] и прокари
глутамата, расположенного в середине одной из
отических клеток [59, 60]. По всей видимости,
трансмембранных α спиралей субъединицы
для всех роторных АТФаз характерны ГТФазная
c/K/L. Субъединица a (I у А АТФаз), взаимодей
и ИТФазная активности, которые по своей ве
ствуя с c/K/L кольцом, образует два полукана
личине сопоставимы с АТФазной (от 30 до 90%
ла, которые открываются на разные стороны
для разных ферментов или их субкомплексов) и
мембраны. Между полуканалами в области кон
способны поддерживать ионный транспорт. Для
такта с c/K/L кольцом у субъединицы a/I рас
F АТФазы из Escherichia coli показан также син
положен консервативный остаток аргинина, без
тез ГТФ и ИТФ [59], а для фермента из термо
которого ионный транспорт не происходит [64].
фильной бактерии Bacillus sp. PS3 - синтез ГТФ
Принцип работы подобного ион транслоци
и, хотя и с очень низкой эффективностью, син
рующего роторного комплекса был предложен
тез УТФ и ЦТФ [60]. Таким образом, следует от
В.П. Скулачевым и А.Н. Глаголевым в 1978 г. для
метить, что ион транслоцирующие роторные
объяснения механизма вращения бактериаль
АТФазы, видимо, способны напрямую регули
ного жгутика [65]. Согласно этой гипотезе, пе
ровать в клетке не только отношение
ренос иона между полуканалами происходит
АТФ/АДФ, но и ГТФ/ГДФ.
благодаря вращению кольцевого олигомерного
Некоторые ферменты, в особенности A АТ
белкового комплекса, несущего ион связываю
Фазы архей, могут также катализировать гидро
щие сайты, в плоскости мембраны. Модели,
лиз пиримидиновых нуклеозидтрифосфатов
описывающие сходный механизм ротационного
(УТФ и/или ЦТФ), однако эта реакция проис
транспорта ионов, были предложены для F АТ
ходит гораздо медленнее [49, 50, 53, 54, 61, 62] и
Фаз еще до того, как была получена структура
плохо сопрягается с протонным транспортом
комплекса FO [66, 67] (рис. 2). Структуры, полу
[57]. Лишь для некоторых AОA1 показана УТ
ченные позже с помощью криоэлектронной
Фазная или ЦТФазная активность, сопостави
микроскопии , хорошо согласуются с этой мо
мая с АТФазной [63]. УТФазная активность V
делью, в том числе, и для V и A АТФаз
АТФазы быка не ингибируется бафиломици
[10, 11, 13, 14, 68, 69].
ном - ингибитором ион транспортирующего
Большинство прокариотических ферментов
комплекса VO, - что указывает на нарушение
A и F типа, а также все известные на сегодня F
сопряженности между VO и V1 при гидролизе
и V АТФазы эукариот осуществляют трансме
УТФ [58]. Исследование единичных молекул F1
мбранный транспорт ионов водорода, и до нача
субкомплекса термофильной эубактерии
ла 1980 х гг. предполагалось, что биоэнергетика
Bacillus sp. PS3 показало, что вращение γ субъе
синтеза/гидролиза АТФ связана исключительно
диницы происходит при гидролизе только пури
с протонным транспортом. Однако затем
новых нуклеотидов [48]. Таким образом, ротор
В.П. Скулачев предположил возможность суще
ные АТФазы вряд ли могут напрямую оказывать
ствования натриевой биоэнергетики и синтеза
~
заметное влияние на соотношение пиримиди
Na+ [70, 71]. Дальнейшие
новых нуклеотидов в клетке.
эксперименты подтвердили эту гипотезу. Были
обнаружены F и A АТФазы, сопрягающие син
тез/гидролиз АТФ и трансмембранный транс
МЕХАНИЗМ ИОННОГО ТРАНСПОРТА
порт ионов натрия (см., например, обзоры
ЧЕРЕЗ FO/AO/VO. ИОННАЯ СПЕЦИФИЧНОСТЬ
[72, 73]). Они были найдены у некоторых эубак
И СООТНОШЕНИЕ ИОН/АТФ
терий и архей и могут выполнять роль как АТФ
синтаз, так и АТФ зависимых Na+ насосов,
Ключевыми участниками трансмембранно
контролирующих концентрацию натрия в ци
го ионного транспорта, осуществляемого ротор
топлазме. Весьма вероятно, что эволюционно
ными АТФазами, являются кольцевой с олиго
натрий транслоцирующие роторные АТФазы
мер и прилежащая к нему субъединица a (или, в
предшествовали протонным [74], и что в древ
БИОХИМИЯ том 85 вып. 12 2020
РОТОРНЫЕ ИОН ТРАНСЛОЦИРУЮЩИЕ АТФазы
1905
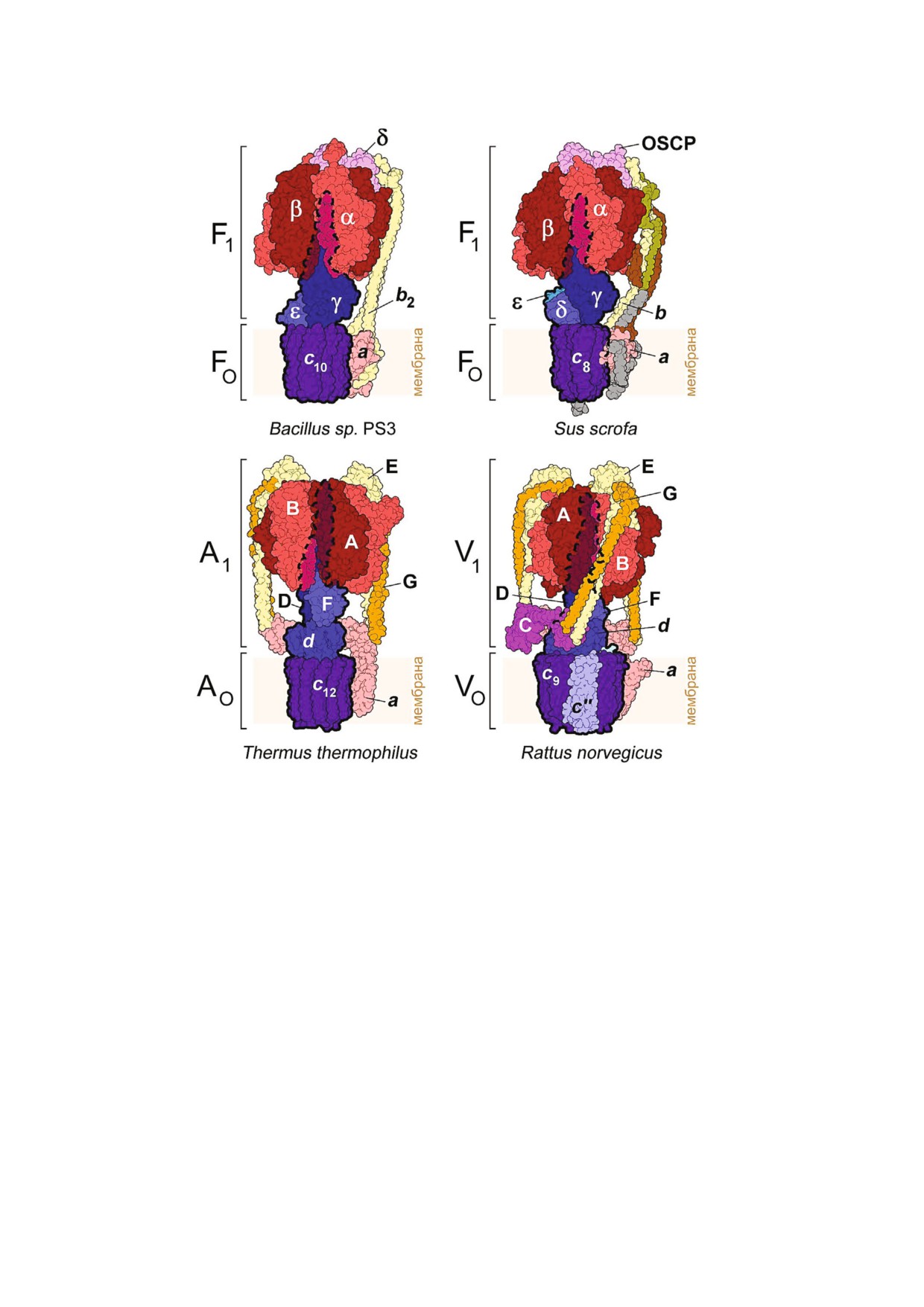
Рис. 2. Схема трансмембранного протонного транспорта, осуществляемого роторной АТФазой при гидролизе АТФ. Про
тоны могут достигнуть ион связывающих групп на субъединицах c только через полуканалы, образованные субъедини
цей a (I у А АТФаз). Гидролиз АТФ приводит во вращение субъединицы ротора, в том числе и c кольца (K или L кольца
у А АТФаз). Высококонсервативный остаток аргинина субъединицы a/I, несущий положительный заряд, препятствует
переносу протонов между полуканалами в области ее контакта с c/K/L кольцом
них пробактериях присутствовали Na+ трансло
Ионная специфичность роторных АТФаз
цирующие АТФ синтазы, работавшие за счет
определяется первичной структурой субъеди
~
ниц c/K/L и α/L. Следует отметить, что все ро
Na+, генерируемого в ходе синтеза ацетата из
углекислого газа и молекулярного водорода [75].
торные АТФазы теоретически способны к
Na+ транслоцирующие АТФазы обнаруже
транспорту протонов; для некоторых натрий за
ны у многих морских и у патогенных прокариот,
висимых АТФаз он показан экспериментально в
где они, вероятно, играют важную роль в под
условиях недостатка натрия [78-80]. В физиоло
держании низкой внутриклеточной концентра
гических условиях, однако, концентрация ио
ции натрия, а также у некоторых анаэробных эу
нов натрия превосходит концентрацию прото
и архебактерий, в которых они синтезируют
нов примерно на шесть порядков. Таким обра
~
зом, протон зависимые АТФазы в ходе эволю
Na+ [73]. У прокариот, для которых
главной предполагаемой функцией фермента
ции выработали чрезвычайно высокую селек
является откачка натрия из клетки, Na+ транс
тивность H+/Na+. По всей видимости, такую се
лоцирующая F АТФаза имеет ряд особеннос
лективность обеспечивает гидрофобное окруже
тей: у нее отсутствует субъединица δ, а субъеди
ние ион переносящей карбоксильной группы. В
ница b имеет дополнительный домен, вероятно,
свою очередь, натрий зависимые ферменты об
выполняющий функцию субъединицы δ. Такие
ладают более низкой протонной селектив
F АТФазы были выделены в отдельную подг
ностью благодаря наличию в ион связывающем
руппу и названы N АТФазами; было также от
сайте полярных групп. Эти группы принадлежат
мечено, что у организмов, в которых они прису
остову белка или боковым цепям аминокислот
тствуют, обнаруживается еще одна, протонная
(глутамин, серин, треонин, тирозин) и коорди
роторная АТФаза [76].
нируют ион натрия вместе с ионизируемым кар
Следует также отметить, что N АТФазы, ве
боксилом; в некоторых случаях в координации
роятно, могут быть и + транслоцирующими
иона участвует также молекула воды [81, 82].
ферментами: эксперименты на N АТФазе пато
Именно соотношение полярных и гидрофобных
генной бактерии Burkholderia pseudomallei позво
групп в ион связывающем сайте, а также их рас
ляют предположить, что сопрягающим ионом
положение в пространстве определяют ионную
является протон, а не натрий [77].
селективность фермента, что подтверждается
12 БИОХИМИЯ том 85 вып. 12 2020
1906
ЗУБАРЕВА и др.
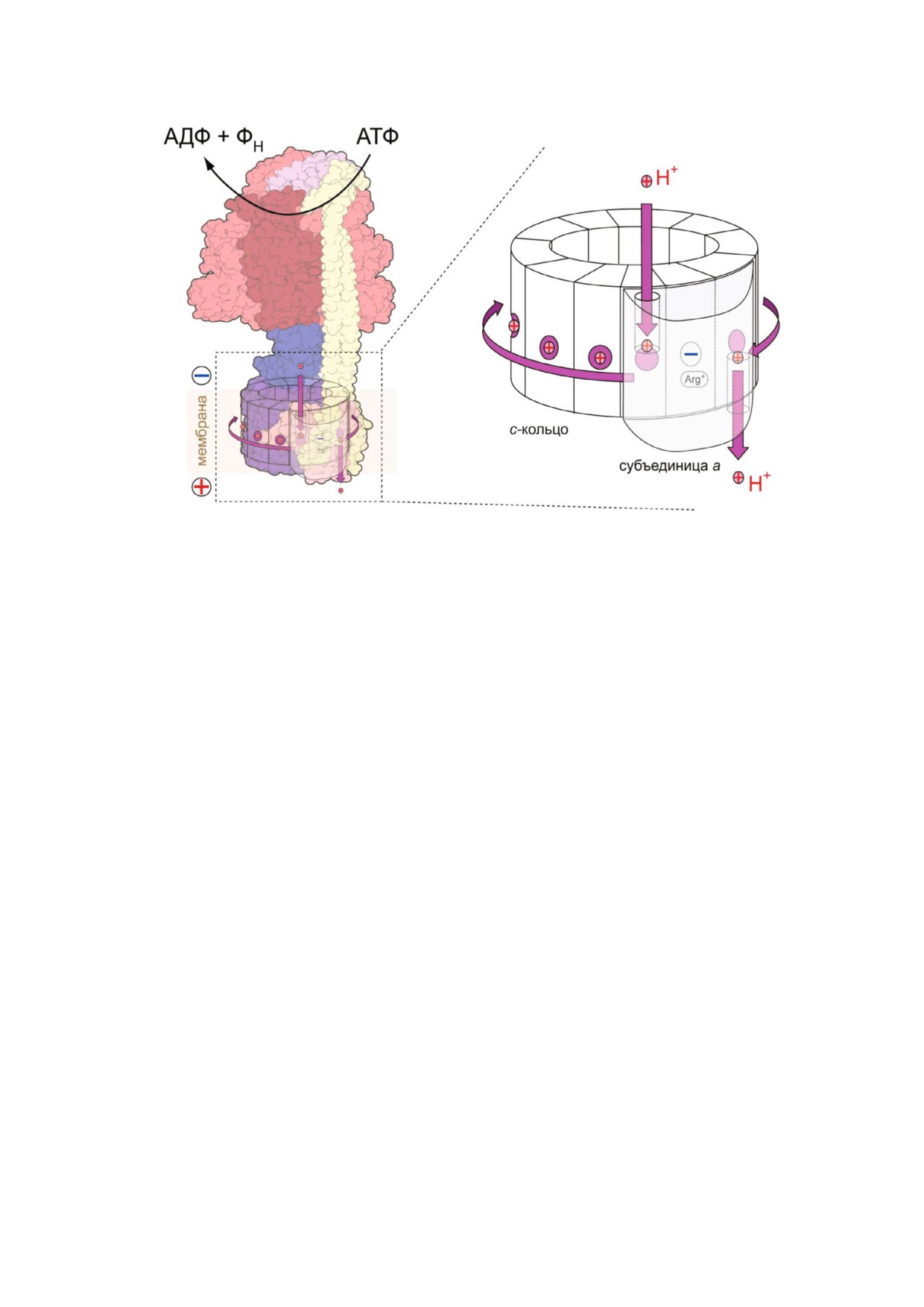
Рис. 3. Варианты строения с/K/L субъединиц роторных АТФаз с указанием примера организма, обладающего соответ
ствующим ферментом. Буквы E/D обозначают остатки глутамата/аспартата, необходимые для связывания и транслока
ции ионов. В скобках указано количество субъединиц, входящих в с/K/L кольцо у фермента из разных организмов. Прос
той вариант субъединицы c, как у E. coli, является преобладающим среди ферментов F типа
молекулярно динамическими симуляциями и
Эукариотические V АТФазы с известной стехи
мутагенезом [83, 84]. Существуют ферменты,
ометрией с кольца (ферменты дрожжей и мле
которые в физиологических условиях могут од
копитающих) содержат по 10 ион транслоциру
новременно транспортировать и H+, и Na+, нап
ющих групп [13, 25]. В простейшем случае (нап
ример, A АТФаза метаногенной археи
ример, в F АТФазе E. coli или митохондрий) с
Methanosarcina acetivorans [85].
субъединица представляет собой шпильку из
Ключевым параметром биоэнергетики клет
двух трансмембранных α спиралей и содержит
ки является количество ионов, транслоцируе
единственный ион переносящий остаток, кото
мых роторной АТФазой на одну молекулу АТФ
рый расположен в средней части С концевой α
(отношение H+/АТФ или Na+/АТФ; корреляция
спирали. Две спирали соединяются петлей, ко
этого параметра с функцией фермента обсужда
торая образована полярными аминокислотны
ется ниже в соответствующем разделе). Число
ми остатками и взаимодействует с другими
молекул АТФ, синтезируемых или гидролизуе
субъединицами ротора. Такое строение имеют с
мых за один полный оборот ротора, одинаково
субъединицы большинства изученных F АТ
для всех роторных АТФаз и равняется трем по
Фаз, а также c/K/L субъединицы ряда фермен
числу каталитических сайтов. В свою очередь,
тов А типа [88, 89]. Вместе с тем, во всех группах
число ионов, переносимых через мембрану,
роторных АТФаз независимо происходили дуп
напрямую зависит от количества карбоксиль
ликации генов субъединицы с/K/L, что приво
ных групп консервативных остатков глутама
дило к появлению субъединиц, содержащих две
та/аспартата, необходимых для связывания ио
и более α спиральные шпильки [90]. В некото
нов на кольце с субъединиц. Эта величина ви
рых случаях дупликация сопровождалась поте
доспецифична и зависит от стехиометрии
рей ион связывающей группы на одной из шпи
с/K/L кольца, от количества вышеупомянутых
лек. Наиболее разнообразны субъединицы
карбоксильных групп на одну с/K/L субъеди
c/K/L у А АТФаз. Типичным вариантом являет
ницу (рис. 3), и от эффективности сопряжения
ся субъединица с одной шпилькой [88, 91]. Так
(т.е. от вероятности «проскальзывания» фер
же часто встречается субъединица c с двумя
мента и не сопряженного с синтезом/гидроли
шпильками, причем на них могут сохраняться
зом АТФ переноса ионов).
как два сайта связывания иона (характерно для
В литературе описаны ферменты, содержа
метаногенов), так и один (у Pyrococcus и
щие от 8 (F АТФаза митохондрий быка [86], A
Thermococcus) [92, 93]. Субъединица c/K/L фер
АТФаза Methanococcus jannaschii [87]) до 17 (N
мента M. jannaschii состоит из трех шпилек и не
АТФаза патогенной бактерии B. pseudomallei
сет два сайта связывания ионов [87]. Наконец, у
[77]) ион транслоцирующих групп в с кольце.
метаногена Methanopyrus kandleri по геномной
БИОХИМИЯ том 85 вып. 12 2020
РОТОРНЫЕ ИОН ТРАНСЛОЦИРУЮЩИЕ АТФазы
1907
последовательности предсказано существова
значений pH между матриксом и межмембран
ние с субъединицы, которая состоит из 13 шпи
ным пространством) составляет ~ 18-22 кДж/моль
лек, содержит 13 сайтов связывания ионов и, ве
(p ≈ 180-220 мВ) [100]. Увеличение количества
роятно, образует мономерное кольцо [94].
ион связывающих сайтов на кольце c субъеди
У V АТФаз каждая из субъединиц гетеромер
ниц, по всей видимости, повышает отношение
ного с кольца (с, с′′, а также c′ дрожжей) содер
H+/АТФ и позволяет синтезировать АТФ при
~
жит две α спиральные шпильки, однако сохра
H+.
нила только один ион переносящий остаток
Направление реакции, катализируемой ро
[90]. Гетеромерное с кольцо известно и среди F
торными АТФазами, зависит от наличия и ак
АТФаз: в Na+ транслоцирующей АТФазе Aceto*
тивности других ферментов, генерирующих
~
bacterium woodii оно состоит из 9 копий «обыч
H+. В митохондриях АТФ синтаза начинает
ной» с субъединицы, образованной двумя α
гидролизовать АТФ в условиях ишемии, когда
спиралями, и одной дуплицированной с субъе
активность ферментов дыхательной цепи пада
диницы из четырех спиралей, несущей лишь
ет. В хлоропластах то же самое происходит при
один ион связывающий сайт [95, 96].
снижении интенсивности освещения. У прока
~
Стехиометрия с кольца постоянна у каждого
H+ могут генерировать ферменты дыха
организма и определяется первичной структу
тельной или фотосинтетических цепей переноса
рой с субъединицы, в частности - аминокис
электронов, бактериородопсины, а также неко
лотными остатками в области контакта сосед
торые белки переносчики метаболитов. При
них субъединиц. Мутации в этой области у F
снижении активности этих ферментов АТФаза
АТФаз приводили к образованию с колец с из
начинает гидролизовать АТФ и выкачивать про
~
мененной стехиометрией [97, 98].
H+. У
прокариот этот процесс имеет особо важное
~
H+ необходима для ряда
ФУНКЦИИ F и A АТФаз
важных функций: вращения жгутика, трансме
мбранного транспорта ионов и низкомолеку
Все роторные АТФазы устанавливают опре
лярных веществ и др. Однако в отсутствие иных
деленный баланс между величиной трансмемб
источников АТФ такая активность может быст
ранной разности электрохимического потенци
ро истощить его внутриклеточные запасы. Поэ
~
~
Na+; ниже
тому неудивительно, что для F АТФаз обнару
для краткости мы будем говорить о протонах, но
жен целый ряд регуляторных механизмов, по
для ионов натрия логика сохраняется та же са
давляющих АТФазную активность фермента в
мая) и соотношением концентраций АТФ,
условиях падения отношения АТФ/АДФ и сни
~
АДФ, ГТФ, ГДФ, неорганического фосфата, ио
H+ [14, 35, 101]. Некоторые из этих ме
нов магния и величины pH. Количественно этот
ханизмов, судя по всему, встречаются также у A
баланс будет определяться специфичным для
АТФаз (см. ниже).
каждого конкретного фермента отношением
В вышеперечисленных примерах важной,
H+/АТФ, которое, как было сказано выше, зави
если не основной, функцией роторной АТФазы
сит от количества ион связывающих карбок
является синтез АТФ, который она осуществля
~
сильных групп на кольце c субъединиц.
H+. У
Величина энергии Гиббса синтеза АТФ в
прокариот, в которых такие генераторы отсут
клетке в физиологических условиях составляет
ствуют, роторная АТФаза работает исключи
~ 55 кДж/моль [99]. Величина энергии, высво
тельно как протонный насос, генерирующий
~
бождаемой при транспорте протонов «вниз» по
H+ и повышающий pH цитоплазмы. Для аци
электрохимическому градиенту зависит от вели
дофильных прокариот последняя функция бы
~
H+ и для сопрягающих мембран прока
вает жизненно важной.
риот, митохондрий и хлоропластов обычно сос
Как было отмечено выше, для архебактерий
тавляет ~ 10-22 кДж/моль (что примерно соот
характерны A АТФазы, в то время как у эубакте
ветствует протон движущей силе p от 100 до 220
рий преобладают ферменты F типа. Примеча
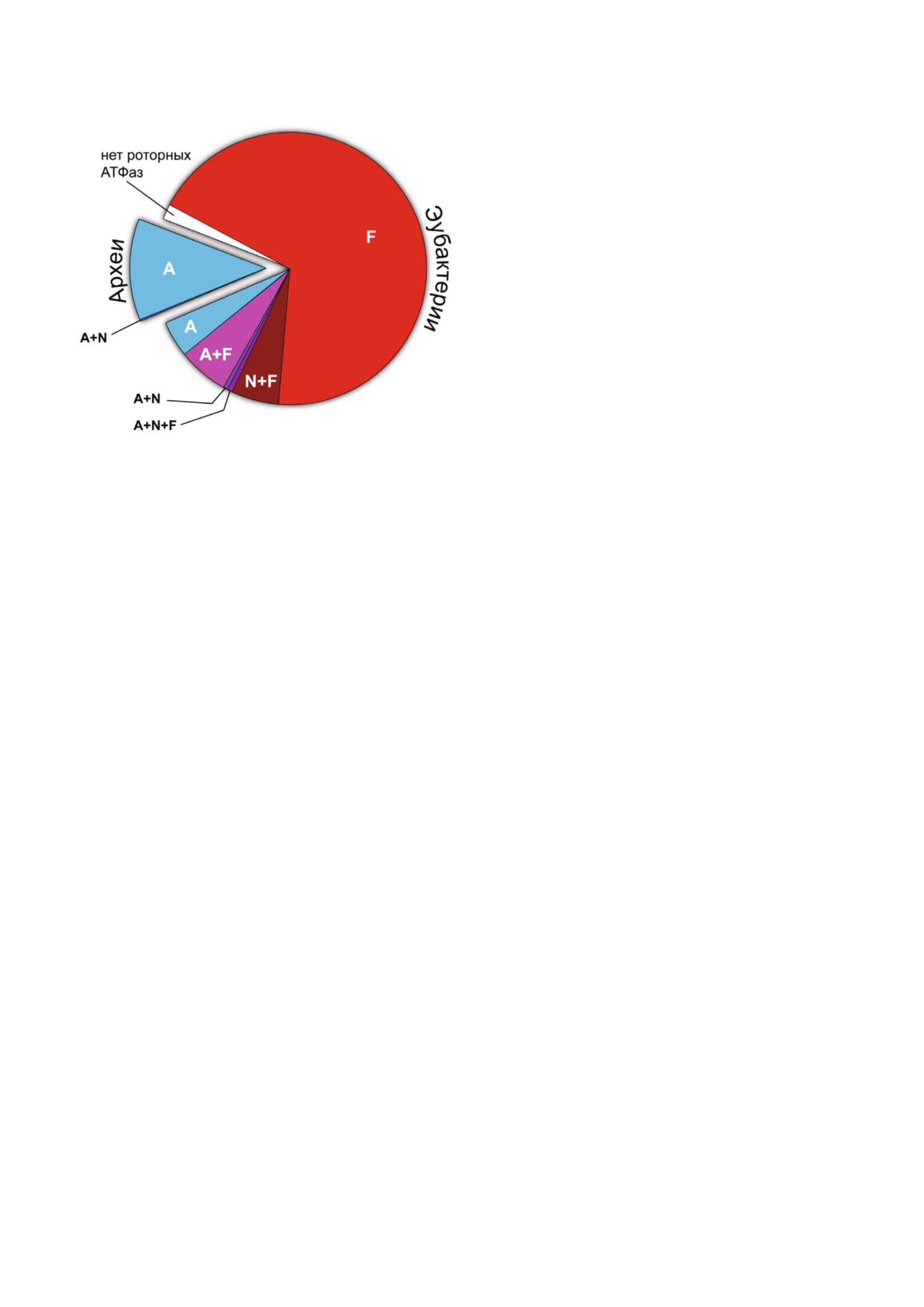
мВ). Это означает, что для синтеза одной моле
тельно, что в ходе эволюции многие эубактерии
~
H+, не
приобрели опероны A АТФаз, а в некоторых
обходим транспорт от 2,5 до 5,5 протонов. В
случаях потеряли затем опероны F АТФаз. Про
полном соответствии с этим расчетом, у F АТ
веденный нами анализ набора полностью секве
Фазы в митохондриях млекопитающих отноше
нированных 711 геномов прокариот (83 архей и
ние H+/АТФ, исходя из структуры фермента,
628 эубактерий), взятый за основу последней
~
H+, на внутренней ми
версии базы Clusters of Orthologous Groups of
тохондриальной мембране (с учетом различия
proteins (COG) [102], показал, что приобретения
БИОХИМИЯ том 85 вып. 12 2020
12*
1908
ЗУБАРЕВА и др.
«митохондриальной поры» (mPTP, mitochondrial
permeability transition pore) - белкового комплек
са, который образует в митохондриальной мемб
ране канал, пропускающий молекулы массой до
1,5 кДа. Образование mPTP в условиях стресса (в
частности, при повышении концентрации каль
ция или активных форм кислорода) в митохонд
риях млекопитающих приводит к диссипации
~
H+, набуханию митохондрий, выходу в цитоп
лазму митохондриальных белков и запуску кас
када программируемой клеточной гибели [103].
Ряд исследователей предполагает, что митохонд
риальная АТФ синтаза играет важную роль в об
разовании mPTP [104]. Однако прямые экспери
менты, в которых исследовалось влияние деле
ции генов АТФ синтазы на формирование
mPTP, противоречат этой гипотезе [105].
Рис. 4. Распределение оперонов различных типов ротор
ных АТФаз в геномах прокариот из базы данных COG. Эта
ФУНКЦИИ V АТФаз
база данных содержит геномы 83 архей и 628 эубактерий, и
достаточно равномерно покрывает все филогенетическое
Если направление катализируемой реакции
разнообразие известных прокариот. Количественные дан
ные приведены в тексте
для F и A АТФаз зависит от внешних условий и
от вида организма, то для V АТФаз единствен
ным режимом работы in vivo является трансме
эубактериями А АТФазы через горизонтальный
мбранный транспорт протонов за счет энергии
перенос генов происходили многократно и не
гидролиза АТФ. В искусственных условиях, од
зависимо в разных группах. В целом, распреде
нако, исследователям удалось «заставить» V АТ
~
ление оперонов роторных АТФаз в организмах
H+,
базы COG оказалось следующим (рис. 4): 1) все
создаваемого пирофосфатазой [106]. Это позво
83 представителя архебактерий содержат гены
ляет предположить, что, как и АТФазы F и A
A АТФазы, а один вид (Methanosarcina acetivo*
типа, фермент способен катализировать и син
rans) содержит еще и оперон F АТФазы N типа;
тез, и гидролиз АТФ. Но функция синтеза оста
2) из 628 эубактерий у 488 есть только един
ется «невостребованной» in vivo, так как в боль
ственный оперон F АТФазы, у 19 - только один
шинстве мембран, где обнаружены V АТФазы,
~
оперон A АТФазы, у 47 присутствуют одновре
H+, а на плазма
менно опероны типа A и F (4 случая из них - A
тической мембране эукариотической клетки ве
~
и N), а также встречаются эубактерии с несколь
H+ недостаточна для синтеза АТФ.
кими оперонами ферментов одного типа; 3) у 12
Физиологическое значение V АТФазы весь
из 628 эубактерий вообще отсутствуют роторные
ма многообразно, и в литературе есть много об
ион транслоцирующие АТФазы (эти организмы
зоров, где подробно описаны ее различные
являются эндосимбионтами растений и насеко
функции, например, [1,107,108]. Ниже мы огра
мых).
ничимся лишь наиболее общей информацией
Эти данные указывают, что F и A АТФазы
на эту тему.
функционально «взаимозаменяемы» у эубакте
Чаще всего V АТФаза работает в паре с дру
рий. Кроме того, в некоторых случаях наличие
гими мембранными белками транспортерами и
более чем одной роторной АТФазы (предполо
выполняет функцию универсального мотора,
~
жительно, с разными регуляторными особен
H+, которая затем конвертируется
ностями), вероятно, дает эволюционное преи
в различные виды работы, необходимой для
мущество.
жизнедеятельности клетки и организма. В боль
В заключение следует отметить, что у эукари
шинстве случаев эта работа заключается в
от F АТФазы, помимо синтеза АТФ, выполняют
трансмембранном транспорте ионов и низкомо
еще ряд функций. Выше было отмечено, что ди
лекулярных соединений (рис. 5).
меризация митохондриальных АТФ синтаз не
Одной из важнейших функций этого фер
обходима для образования крист. Еще одной
мента является закисление содержимого компа
важной, хотя и спорной, функцией этого фер
ртментов эукариотической клетки, а в некото
мента является его участие в образовании т.н.
рых тканях - внеклеточной среды. В этом слу
БИОХИМИЯ том 85 вып. 12 2020
РОТОРНЫЕ ИОН ТРАНСЛОЦИРУЮЩИЕ АТФазы
1909
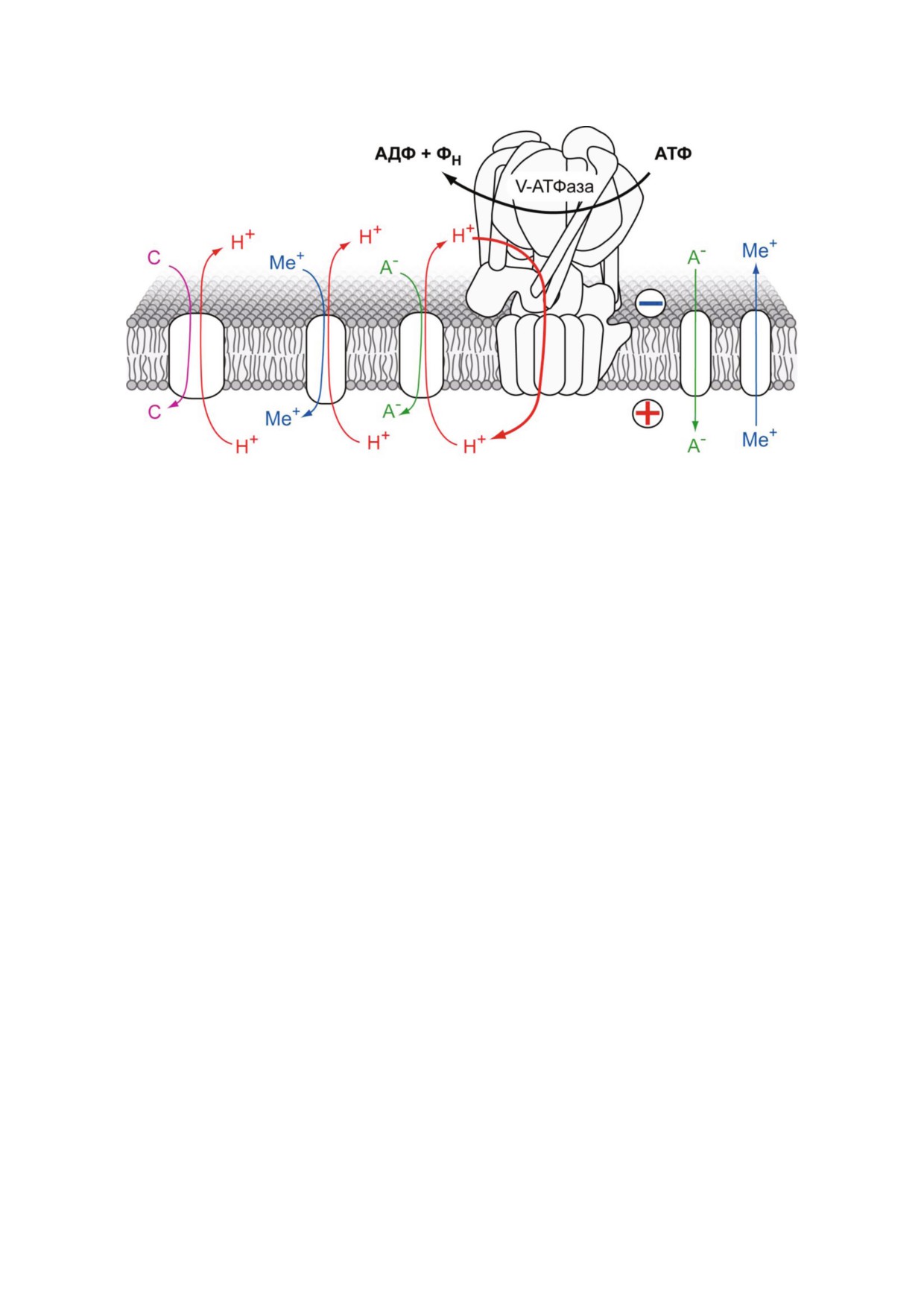
Рис. 5. V АТФаза как поставщик энергии для трансмембранного транспорта. Перенос протонов за счет энергии гидроли
~
H
+, которая складывается из электрического потенциала и градиента концентрации. Раз
нообразные мембранные белки переносчики (симпортеры, антипортеры, переносчики и каналы) используют энергию
~
H
+ для транспорта ионов (Ме+ - катионы металлов, А- - анионы органических кислот, Cl- и др.) и низкомолекуляр
ных соединений (С - нейромедиаторы, пептиды и др.)
чае электрическая компонента генерируемой
нений через мембраны. Так, активность V АТ
~
H+ компенсируется транспортом других ионов
Фазы поддерживает нормальное функциониро
(симпортом анионов Cl-, например), что позво
вание Na+/H+ обменников, которые участвуют
ляет создать ΔpH большей величины и сильнее
в ответе на гиперосмотический и окислитель
закислить содержимое компартмента. V АТФа
ный стрессы, что было показано на клетках
за участвует в закислении содержимого транс
дрожжей S. сerevisiae [113]. В растительных клет
цистерн аппарата Гольджи и последующем бел
ках фермент играет важнейшую роль в ответе на
ковом сортинге [109], дает энергию для процес
солевой стресс, в накоплении в вакуоли ионов
са ретроградного транспорта белков [28], а так
металлов (в том числе, токсичных), а также ми
же необходима для снижения pH лизосом и эн
неральных и органических кислот [114]. В си
досом [107] и играет важную роль в процессах
наптических везикулах специальные мембран
эндоцитоза, в том числе клатрин зависимого,
ные белки осуществляют обмен H+ и нейротра
осуществляя необходимое для этого закисление
нсмиттеров, что позволяет более чем в 1000 раз
содержимого везикул [110]. Протонный транс
увеличить концентрацию последних внутри ве
порт из клетки в межклеточную среду, осущес
зикул по сравнению с цитоплазмой [1].
твляемый V АТФазой в плазматической мемб
V АТФаза также является важным элемен
ране остеокластов, необходим для нормальной
том ряда клеточных сигнальных путей. Показа
ресорбции костной ткани и поддержания балан
но, что подавление ее активности приводит к
са между ее формированием и разрушением.
нарушению ассоциации комплекса mTORC1
Повышенная активность фермента может при
- одного из важнейших регуляторов метаболиз
водить к остеопетрозу, а пониженная - к остео
ма аминокислот - с лизосомами. Закисление их
порозу [111]. В клетках эпителия почечных ка
содержимого в результате работы V АТФазы
нальцев V АТФаза осуществляет закисление
оказалось необходимым этапом для нормальной
мочи; нарушения ее работы приводят к неспо
активации mTORC1 в ответ на повышение кон
собности дистальных канальцев поддерживать
центрации аминокислот [115]. Также фермент
градиент рН, что приводит к потере ионов калия
играет важную роль в регуляции метаболизма
и натрия с мочой и возникновению дистального
глюкозы. В ответ на снижение внутриклеточной
почечного тубулярного ацидоза [112].
концентрации глюкозы происходит диссоциа
Кроме поддержания pH гомеостаза, V АТ
ция комплексов V1 и VO (см. также раздел «Регу
Фаза также необходима для осуществления
ляция активности роторных АТФаз» ниже), в
транспорта ионов и низкомолекулярных соеди
результате которой фермент инактивируется.
БИОХИМИЯ том 85 вып. 12 2020
1910
ЗУБАРЕВА и др.
РЕГУЛЯЦИЯ АКТИВНОСТИ
Регуляция A АТФаз изучена менее подроб
РОТОРНЫХ АТФаз
но, однако, как минимум один из вышеперечис
ленных регуляторных механизмов встречается и
Активность роторных АТФаз регулируется
у них - это АДФ ингибирование. В этой связи
на уровне экспрессии кодирующих их генов.
не исключено, что оно представляет собой один
Кроме того, у эукариот существуют изоформы
из древнейших механизмов регуляции АТФаз
субъединиц роторных АТФаз, что позволяет мо
ной активности роторных АТФаз. F АТФазы
дифицировать фермент под нужды разных тка
некоторых организмов, в которых преобладаю
ней и клеточных органелл. Наконец, активность
щее значение имеет синтетазная активность
роторных АТФаз может регулироваться с по
(например, в ферментах Paracoccus denitrificans,
мощью пост трансляционных модификаций
некоторых видов бацилл, хлоропластов), под
белка, в первую очередь - фосфорилирования.
вержены АДФ ингибированию настолько силь
Каждый из этих уровней представляет собой
но, что практически не гидролизуют АТФ без
большую и сложную тему. Ниже мы подробнее
дополнительной активации, приводящей к выб
остановимся лишь на наиболее общих регуля
росу ингибиторного АДФ. В качестве такой ак
торных механизмах, заложенных в аминокис
тивации может выступать энергизация мембра
лотной последовательности фермента и не свя
ны или добавление некоторых химических ве
занных с отдельными его изоформами.
ществ (детергенты, спирты, сульфит и другие
Как было сказано выше, специфика регуля
анионы). С другой стороны, F АТФаза E. coli,
ции роторных АТФаз в значительной степени за
которая в случае обитания бактерии в анаэроб
висит от того, должен ли фермент оперативно
ных условиях в кишечнике человека работает
~
переключаться между АТФ синтазной и гидро
H+, гидролизу
лазной активностью, или же работает исключи
ет АТФ с высокой скоростью даже в случае де
тельно как АТФ зависимый протонный (или
энергизованной мембраны, и в отсутствие пере
натриевый) насос. Для F АТФаз, относящихся к
численных выше стимуляторов. Добавка этих
первой группе (ферментов митохондрий, хло
стимуляторов увеличивает АТФазную актив
ропластов, фотосинтетических и аэробных эу
ность фермента E. coli не так сильно, как у F
бактерий) характерно ингибирование АТФазной
АТФаз хлоропластов и бацилл [35], что, на наш
активности в условиях снижения отношения
взгляд, указывает на относительно менее выра
~
H+ ниже уровня, не
женное АДФ ингибирование. Разная степень
обходимого для синтеза АТФ. Ре активация фер
АДФ ингибирования показана и для А АТФаз.
мента из ингибированного состояния происхо
Так, у АТФ синтаз архей Th. thermophilus и
~
H+ выше этого уровня.
Methanosarcina mazei Gö1 АДФ ингибирование
Описано несколько механизмов такой регуляции
выражено сильно [120-122], а на А АТФазе
(см. обзор [116]). У всех изученных F АТФаз об
E. hirae - ферменте, осуществляющем АТФ за
наружено неконкурентное ингибирование фер
висимую откачку ионов натрия из клетки, АДФ
мента комплексом MgАДФ (АДФ ингибирова
ингибирование обнаружить не удалось [123].
ние), которое отличается от обычного ингибиро
Мутагенез ферментов F и A типа позволил оп
вания реакции ее продуктом и происходит при
ределить аминокислотные остатки, модулирую
связывании MgАДФ в каталитическом сайте в
щие силу АДФ ингибирования [122, 124, 125].
отсутствие фосфата [35]. У многих прокариоти
ческих и у хлоропластных ферментов обнаруже
АДФ оказывает ингибиторное действие и на
но ингибирование АТФазной активности при
V АТФазы эукариот. Очевидно, АДФ может
изменении конформации субъединицы ε [117].
выступать как конкурентный ингибитор, препя
Для АТФ синтазы хлоропластов характерна ре
тствуя связыванию АТФ в каталитическом сайте
докс регуляция, связанная с образованием в
V АТФазы [126]. Однако ряд данных указывает
темноте дисульфидного мостика между специ
на наличие у V АТФаз также аллостерического
альной парой остатков цистеина в субъединице
или неконкурентного АДФ ингибирования
γ, приводящему к подавлению активности в от
[127-129], которое может быть обусловлено ме
сутствии освещения [101]. В митохондриях, а
ханизмом, схожим с таковым у F и A АТФаз. У
также у некоторых α протеобактерий есть инги
А АТФаз предполагают ещё один механизм ре
биторные белки (IF1 и ζ, соответственно), по
гуляции активности, связанный с функциони
давляющие гидролитическую активность F АТ
рованием субъединицы F. Эта небольшая субъе
Фазы в условиях де энергизации мембраны
диница вместе с субъединицей D входит в состав
[118, 119]. У прокариотических F АТФаз обнару
ротора фермента и имеет гибкий вытянутый до
жено еще несколько регуляторных механизмов,
мен, который может взаимодействовать с субъе
препятствующих гидролизу АТФ (см. обзор [35]).
диницами каталитического гексамера. Показа
БИОХИМИЯ том 85 вып. 12 2020
РОТОРНЫЕ ИОН ТРАНСЛОЦИРУЮЩИЕ АТФазы
1911
но, что это взаимодействие приводит к актива
тивности V АТФазы [144, 145]. Координация
ции гидролиза АТФ А1 субкомплексами
работы V АТФазы и гликолиза позволяет клетке
Th. thermophilus и M. masei Gö1 [130, 131], причем
экономить АТФ в условиях голодания, а при ин
предполагается, что движение регуляторного
тенсивном анаэробном гликолизе не допустить
домена субъединицы F является нуклеотид за
избыточного закисления цитоплазмы [143].
висимым [132]. Для A1 E. hirae активация также
Следует отметить, что у АТФаз F и A типов
была показана, но она оказалась заметно слабее
нуклеотид связывающий гидрофильный субко
[133]. Исследователи часто сравнивают субъеди
мплекс связан с ион транслоцирующей мемб
ницу F А АТФаз с субъединицей ε бактериаль
ранной частью настолько прочно, что для их
ных ферментов F типа: последняя также явля
разделения требуется достаточно жесткая обра
ется частью ротора и имеет подвижный регуля
ботка хаотропными агентами в отсутствие ио
торный домен, который в развернутой конфор
нов магния. В этой связи диссоциация F и A
мации взаимодействует с каталитическим гекса
АТФаз in vivo представляется крайне маловеро
мером, влияя на гидролиз АТФ. В большинстве
ятной.
случаев, однако, субъединица ε ингибирует АТ
У АТФаз V типа встречается также редокс
Фазную активность F АТФаз ([117], но см. так
зависимая инактивация гидролиза АТФ за счет
же [134]). Гомология последовательностей субъ
образования дисульфидного мостика между дву
единицы ε F АТФаз и субъединицы F А АТФаз
мя консервативными остатками цистеина в
не очевидна; некоторые авторы предполагают
субъединице А, один из которых принадлежит
эволюционное родство субъединицы F c глобу
каталитическому сайту. Этот способ регуляции
лярным доменом субъединицы γ F АТФаз [135].
был неоднократно продемонстрирован in vitro на
У V АТФаз регуляторная роль субъединицы F не
V АТФазах млекопитающих и грибов [146-150],
исследовалась. В имеющихся структурных мо
а его физиологическая роль была косвенно пока
делях эта субъединица находится в компактной
зана на клетках дрожжей [151]. У V АТФаз расте
конформации и, вероятно, не взаимодействует с
ний in vitro также обнаружено ингибирование
каталитическим гексамером [13, 136].
активности при окислении сульфгидрильных
Основным способом регуляции активности
групп в каталитическом сайте [152]. Тем не менее
V АТФаз является обратимая диссоциация суб
эксперименты на Arabidopsis thaliana показали,
комплексов V1 и VO. Она характерна только для
что in vivo этот механизм не играет значительной
этого типа АТФаз и показана для ферментов на
роли [153]. В случае некоторых А АТФаз воздей
секомых, млекопитающих и пекарских дрожжей
ствие окислителей приводит к снижению актив
[137]. Ключевую роль в этом процессе играет
ности и образованию кросс сшивок между субъ
субъединица С, которая в целом ферменте обес
единицами каталитического гексамера [63], од
печивает присоединение периферических стеб
нако никаких свидетельств редокс зависимой
лей к VO. Диссоциация этой субъединицы при
регуляции активности А АТФаз in vivo в литера
водит к дестабилизации VOV1 [138]. После дис
туре нам найти не удалось.
социации комплекс V1 утрачивает АТФазную
активность; инактивация сопровождается кон
В заключение следует отметить, что ротор
формационной перестройкой субъединицы H
ные ион транслоцирующие АТФазы играют
[139, 140]. В свою очередь, свободный комплекс
ключевую роль в биоэнергетике большинства
VO также теряет способность транспортировать
живых организмов. Эти ферменты имеют общее
протоны. Это происходит благодаря изменению
эволюционное происхождение и каталитичес
конформации цитоплазматического домена
кий механизм, однако их регуляторные меха
субъединицы а, который взаимодействует с
низмы отличаются большим разнообразием и
субъединицей d и тем самым останавливает
зависят от тех физиологических функций, кото
транспорт [141, 142]. Одним из основных факто
рые АТФазы выполняют в клетке. Дисбаланс в
ров, вызывающих диссоциацию VOV1 в живых
регуляции активности этих ферментов является
клетках, является снижение концентрации глю
причиной многочисленных патологий, и поэто
козы [113]. Метаболизм глюкозы тесно связан с
му исследования в данной области имеют не
диссоциацией/ассоциацией V АТФазы за счет
только фундаментально научное, но и приклад
нескольких сигнальных путей, которые подроб
ное значение для разработки новых способов те
но рассматриваются в обзоре [143]. Кроме того,
рапии. Кроме того, выявление отличительных
V АТФаза может напрямую взаимодействовать
особенностей роторных АТФаз вредных микро
с двумя ферментами гликолиза: альдолазой и
организмов может помочь в поиске новых спе
фосфофруктокиназой. В условиях высокой кон
цифических ингибиторов этих ферментов, на
центрации глюкозы эти взаимодействия приво
основе которых возможно будет разработать ан
дят к ассоциации V1 и VO и восстановлению ак
тимикробные средства, не оказывающих токси
БИОХИМИЯ том 85 вып. 12 2020
1912
ЗУБАРЕВА и др.
ческого влияния на клетки человека, но препят
дание факультета биоинженерии и биоинфор
ствующих росту этих микроорганизмов [154].
матики МГУ, не будь которого, эта работа ни
когда не была бы написана.
Благодарности. Авторы выражают благодар
Финансирование. Работа выполнена при фи
ность В.П. Скулачеву за создание и поддержку
нансовой поддержке Российского научного
уникальной и удивительной атмосферы в Инс
фонда (грант 20 14 00268).
титуте физико химической биологии им.
Конфликт интересов. Авторы заявляют об от
А.Н. Белозерского МГУ, благодаря которой ис
сутствии конфликта интересов.
следования в области биоэнергетики бурно и
Соблюдение этических норм. В данной работе
плодотворно развиваются в течение уже нес
нет исследований, в которых были использова
кольких десятилетий, а также за его вклад в соз
ны в качестве объектов люди или животные.
СПИСОК ЛИТЕРАТУРЫ
1.
Beyenbach, K. W. (2006) The V type H+ ATPase: molecu
drial ATP synthase reveal the basis of flexible F1 F0 cou
lar structure and function, physiological roles and regula
pling, Science, 364, doi: 10.1126/science.aaw9128.
tion, J. Exp. Biol., 209, 577 589, doi: 10.1242/jeb.02014.
16.
Mühleip, A., McComas, S. E., and Amunts, A. (2019)
2.
Ihara, K., Abe, T., Sugimura, K. I., and Mukohata, Y.
Structure of a mitochondrial ATP synthase with bound
(1992) Halobacterial A ATP synthase in relation to V
native cardiolipin, eLife, 8, doi: 10.7554/eLife.51179.
ATPase, J. Exp. Biol., 172, 475 485.
17.
Arnold, I., Pfeiffer, K., Neupert, W., Stuart, R. A, and
3.
Müller, V., and Grüber, G. (2003) ATP synthases: struc
Schägger, H. (1998) Yeast mitochondrial F1F0 ATP syn
ture, function and evolution of unique energy converters,
thase exists as a dimer: identification of three dimer specif
Cell. Mol. Life Sci.,
60,
474494, doi:
10.1007/
ic subunits, EMBO J., 17, 7170 7178, doi: 10.1093/emboj/
s000180300040.
17.24.7170.
4.
Grüber, G., and Marshansky, V. (2008) New insights into
18.
Guo, H., Bueler, S. A., and Rubinstein, J. L. (2017)
structure function relationships between archeal ATP syn
Atomic model for the dimeric FO region of mitochondrial
thase (A1A0) and vacuolar type ATPase (V1V0), BioEssays,
ATP synthase, Science, 358, 936 940, doi: 10.1126/sci
30, 1096 1099, doi: 10.1002/bies.20827.
ence.aao4815.
5.
Kühlbrandt, W. (2019) Structure and mechanisms of F
19.
Eubel, H., Jänsch, L., and Braun, H. P. (2003) New
type ATP synthases, Ann. Rev. Biochem., 88, 515 549,
insights into the respiratory chain of plant mitochondria.
doi: 10.1146/annurev biochem 013118 110903.
Supercomplexes and a unique composition of complex II,
6.
Hilario, E., and Gogarten, J. P. (1998) The prokaryote to
Plant Physiol., 133, 274 286, doi: 10.1104/pp.103.024620.
eukaryote transition reflected in the evolution of the
20.
Strauss, M., Hofhaus, G., Schröder, R. R., and
V/F/A ATPase catalytic and proteolipid subunits, J. Mol.
Kühlbrandt, W. (2008) Dimer ribbons of ATP synthase
Evol., 46, 703 715, doi: 10.1007/pl00006351.
shape the inner mitochondrial membrane, EMBO J., 27,
7.
Mulkidjanian, A. Y., Makarova, K. S., Galperin, M. Y.,
1154 1160, doi: 10.1038/emboj.2008.35.
and Koonin, E. V. (2007) Inventing the dynamo machine:
21.
Blum, T. B., Hahn, A., Meier, T., Davies, K. M., and
the evolution of the F type and V type ATPases, Nat. Rev.
Kühlbrandt, W. (2019) Dimers of mitochondrial ATP syn
Microbiol., 5, 892 899, doi: 10.1038/nrmicro1767.
thase induce membrane curvature and self assemble into
8.
Gogarten, J. P., and Taiz, L. (1992) Evolution of proton
rows, Proc. Natl. Acad. Sci. USA, doi: 10.1073/pnas.
pumping ATPases: rooting the tree of life, Photosynth. Res.,
1816556116.
33, 137 146, doi: 10.1007/BF00039176.
22.
Paumard, P., Vaillier, J., Coulary, B., Schaeffer, J.,
9.
Kühlbrandt, W., and Davies, K. M. (2016) Rotary
Soubannier, V., Mueller, D. M., et al. (2002) The ATP syn
ATPases: a new twist to an ancient machine, Trends
thase is involved in generating mitochondrial cristae mor
Biochem. Sci., 41, 106116, doi: 10.1016/j.tibs.2015.
phology, EMBO J., 21, 221 230, doi: 10.1093/emboj/
10.006.
21.3.221.
10.
Guo, H., Suzuki, T., and Rubinstein, J. L. (2019) Structure
23.
Davies, K.M., Anselmi, C., Wittig, I., Faraldo Gómez,
of a bacterial ATP synthase, eLife, 8, doi: 10.7554/
J.D., and Kühlbrandt, W. (2012) Structure of the yeast
eLife.43128.
F1F0 ATP synthase dimer and its role in shaping the mito
11.
Gu, J., Zhang, L., Zong, S., Guo, R., Liu, T., Yi, J., et al.
chondrial cristae, Proc. Natl. Acad. Sci. USA, 109, 13602
(2019) Cryo EM structure of the mammalian ATP syn
13607, doi: 10.1073/pnas.1204593109.
thase tetramer bound with inhibitory protein IF1, Science,
24.
Muench, S. P., Trinick, J., and Harrison, M. A. (2011)
364, 1068 1075, doi: 10.1126/science.aaw4852.
Structural divergence of the rotary ATPases, Quart. Rev.
12.
Zhou, L., and Sazanov, L. A. (2019) Structure and confor
Bioph., 44, 311 356, doi: 10.1017/S0033583510000338.
mational plasticity of the intact Thermus thermophilus V/A
25.
Mazhab Jafari, M. T., Rohou, A., Schmidt, C., Bueler,
type ATPase, Science, 365, doi: 10.1126/science.aaw9144.
S. A., Benlekbir, S., Robinson, C. V., et al. (2016) Atomic
13.
Abbas, Y. M., Wu, D., Bueler, S. A., Robinson, C. V., and
model for the membrane embedded VO motor of a eukary
Rubinstein, J. L. (2020) Structure of V ATPase from the
otic V ATPase, Nature, 539, 118122, doi: 10.1038/
mammalian brain, Science, 367, 1240 1246, doi: 10.1126/
nature19828.
science.aaz2924.
26.
Grüber, G., Manimekalai, M. S. S., Mayer, F., and Müller, V.
14.
Hahn, A., Vonck, J., Mills, D. J., Meier, T., and
(2014) ATP synthases from archaea: the beauty of a mole
Kühlbrandt, W. (2018) Structure, mechanism, and regula
cular motor, Biochim. Biophys. Acta, 1837, 940952,
tion of the chloroplast ATP synthase, Science, 360,
doi: 10.1016/j.bbabio.2014.03.004.
doi: 10.1126/science.aat4318.
27.
Harrison, M. A., and Muench, S. P. (2018) The Vacuolar
15.
Murphy, B. J., Klusch, N., Langer, J., Mills, D. J., Yildiz, Ö.,
ATPase - a nano scale motor that drives cell biology, in
and Kühlbrandt, W. (2019) Rotary substates of mitochon
Membrane Protein Complexes: Structure and Function
БИОХИМИЯ том 85 вып. 12 2020
РОТОРНЫЕ ИОН ТРАНСЛОЦИРУЮЩИЕ АТФазы
1913
(Harris, J. R., and Boekema, E. J., eds.) Springer
45.
Furuike, S., Nakano, M., Adachi, K., Noji, H., Kinosita, K.,
Singapore, Singapore, p. 409 459, doi: 10.1007/978 981
and Yokoyama, K. (2011) Resolving stepping rotation in
10 7757 9_14.
Thermus thermophilus H(+) ATPase/synthase with an
28.
Vasanthakumar, T., and Rubinstein, J. L. (2020) Structure
essentially drag free probe, Nat. Commun., 2, 233, doi:
and roles of V type ATPases, Trends Biochem. Sci., 45,
10.1038/ncomms1215.
295 307, doi: 10.1016/j.tibs.2019.12.007.
46.
Imamura, H., Takeda, M., Funamoto, S., Shimabukuro, K.,
29.
Abrahams, J. P., Leslie, A. G. W., Lutter, R., and Walker,
Yoshida, M., and Yokoyama, K. (2005) Rotation scheme of
J. E. (1994) Structure at 2.8 A resolution of F1 ATPase
V1 motor is different from that of F1 motor, Proc. Natl.
from bovine heart mitochondria, Nature, 370, 621 628.
Acad. Sci. USA, 102, 17929 17933.
30.
Arai, S., Saijo, S., Suzuki, K., Mizutani, K., Kakinuma, Y.,
47.
Hirata, T., Iwamoto Kihara, A., Sun Wada, G. H.,
Ishizuka Katsura, Y., et al. (2013) Rotation mechanism of
Okajima, T., Wada, Y., and Futai, M. (2003) Subunit rota
Enterococcus hirae V1 ATPase based on asymmetric crystal
tion of vacuolar type proton pumping ATPase: relative
structures, Nature,
493,
703707, doi:
10.1038/
rotation of the G and C subunits, J. Biol. Chem., 278,
nature11778.
23714 23719, doi: 10.1074/jbc.M302756200.
31.
Schäfer, G., Engelhard, M., and Müller, V.
(1999)
48.
Noji, H., Bald, D., Yasuda, R., Itoh, H., Yoshida, M., and
Bioenergetics of the Archaea, Microbiol. Mol. Biol. Rev.,
Kinosita, K. (2001) Purine but not pyrimidine nucleotides
570 620, doi: 10.1128/mmbr.63.3.570 620.1999.
support rotation of F(1) ATPase, J. Biol. Chem., 276,
32.
Kumar, A., Manimekalai, M. S. S., Balakrishna, A. M.,
25480 25486, doi: 10.1074/jbc.M102200200.
Jeyakanthan, J., and Grüber, G. (2010) Nucleotide bind
49.
Pisa, K. Y., Huber, H., Thomm, M., and Müller, V. (2007)
ing states of subunit A of the A ATP synthase and the
A sodium ion dependent A1AO ATP synthase from the
implication of P loop switch in evolution, J. Mol. Biol.
hyperthermophilic archaeon Pyrococcus furiosus: A1AO
396, 301 320, doi: 10.1016/j.jmb.2009.11.046.
ATPase of Pyrococcus furiosus, FEBS J., 274, 3928 3938,
33.
Komoriya, Y., Ariga, T., Iino, R., Imamura, H., Okuno,
doi: 10.1111/j.1742 4658.2007.05925.x.
D., and Noji, H. (2012) Principal role of the arginine fin
50.
Yokoyama, K., Akabane, Y., Ishii, N., and Yoshida, M.
ger in rotary catalysis of F1 ATPase, J. Biol. Chem., 287,
(1994) Isolation of prokaryotic V0V1 ATPase from a ther
15134 15142, doi: 10.1074/jbc.M111.328153.
mophilic eubacterium Thermus thermophilus, J. Biol.
34.
Malyan, A. N. (2013) Noncatalytic nucleotide binding
Chem., 269, 12248 12253.
sites: properties and mechanism of involvement in ATP
51.
Yoshida, M., Sone, N., Hirata, H., and Kagawa, Y. (1975)
synthase activity regulation, Biochemistry (Moscow), 78,
A highly stable adenosine triphosphatase from a ther
1512 1523, doi: 10.1134/S0006297913130099.
mophillie bacterium. Purification, properties, and recon
35.
Lapashina, A. S., and Feniouk, B. A. (2018) ADP inhibi
stitution, J. Biol. Chem., 250, 7910 7916.
tion of H+ F0F1 ATP synthase, Biochemistry (Moscow), 83,
52.
Senior, A. E., Lee, R. S., al Shawi, M. K., and Weber, J.
1141 1160, doi: 10.1134/S0006297918100012.
(1992) Catalytic properties of Escherichia coli F1 ATPase
36.
Suzuki, K., Mizutani, K., Maruyama, S., Shimono, K.,
depleted of endogenous nucleotides, Arch. Biochem.
Imai, F. L., Muneyuki, E., et al. (2016) Crystal structures
Biophys., 297, 340 344.
of the ATP binding and ADP release dwells of the V1
53.
Iida, T., Hoaki, T., Kamino, K., Inatomi, K., Kamagata, Y.,
rotary motor, Nat. Commun., 7, 13235, doi: 10.1038/
and Maruyama, T. (1996) Vacuolar type ATPase in a
ncomms13235.
hyperthermophilic archaeum, Thermococcus sp., Biochem.
37.
Schäfer, I. B., Bailer, S. M., Düser, M. G., Börsch, M.,
Biophys. Res. Commun., 229, 559 564, doi: 10.1006/bbrc.
Bernal, R. A., et al. (2006) Crystal structure of the archaeal
1996.1843.
A1A0 ATP synthase subunit B from Methanosarcina mazei
54.
Konishi, J., Wakagi, T., Oshima, T., and Yoshida, M.
Gö1: implications of nucleotide binding differences in the
(1987) Purification and properties of the ATPase solubi
major A1Ao subunits A and B, J. Mol. Biol., 358, 725 740,
lized from membranes of an acidothermophilic archaebac
doi: 10.1016/j.jmb.2006.02.057.
terium, Sulfolobus acidocaldarius, J. Biochem., 102, 1379
38.
Gogarten, J. P., Kibak, H., Dittrich, P., Taiz, L., Bowman,
1387, doi: 10.1093/oxfordjournals.jbchem.a122184.
E. J., Bowman, B. J., et al. (1989) Evolution of the vacuo
55.
Pedersen, P. L. (1976) ATP dependent reactions catalyzed
lar H+ ATPase: implications for the origin of eukaryotes,
by inner membrane vesicles of rat liver mitochondria.
Proc. Natl. Acad. Sci. USA, 86, 6661 6665, doi: 10.1073/
Kinetics, substrate specificity, and bicarbonate sensitivity,
pnas.86.17.6661.
J. Biol. Chem., 251, 934 940.
39.
Boyer, P. D. (1997) The ATP synthase - a splendid molec
56.
Vambutas, V. K., and Racker, E. (1965) Partial resolution
ular machine, Ann. Rev. Biochem., 66, 717 749.
of the enzymes catalyzing photophosphorylation. I.
40.
Noji, H., Yasuda, R., Yoshida, M., and Kinosita, K. (1997)
Stimulation of photophosphorylation by a preparation of a
Direct observation of the rotation of F1 ATPase, Nature,
latent, Ca++ dependent adenosine triphosphatase from
299 302, doi: 10.1038/386299a0.
chloroplasts, J. Biol. Chem., 240, 2660 2667.
41.
Okuno, D., Iino, R., and Noji, H. (2011) Rotation and
57.
Struve, I., and Lüttge, U. (1987) Characteristics of
structure of FoF1 ATP synthase, J. Biochem., 149, 655
MgATP2—dependent electrogenic proton transport in
664, doi: 10.1093/jb/mvr049.
tonoplast vesicles of the facultative crassulacean acid
42.
Junge, W., and Nelson, N. (2015) ATP synthase, Ann. Rev.
metabolism plant Mesembryanthemum crystallinum L.
Biochem., 84, 631 657, doi: 10.1146/annurev biochem
Planta, 170, 111 120, doi: 10.1007/BF00392387.
060614 034124.
58.
Pacheco, G., Lippo de Bécemberg, I., Gonzalez de
43.
Noji, H., Ueno, H., and McMillan, D. G. G. (2017)
Alfonzo, R., and Alfonzo, M. J. (1996) Biochemical char
Catalytic robustness and torque generation of the F1
acterization of a V ATPase of tracheal smooth muscle plas
ATPase, Biophys. Rev., 9, 103 118, doi: 10.1007/s12551
ma membrane fraction, Biochim. Biophys. Acta, 1282, 182
017 0262 x.
192, doi: 10.1016/0005 2736(96)00038 7.
44.
Iida, T., Minagawa, Y., Ueno, H., Kawai, F., Murata, T.,
59.
Perlin, D. S., Latchney, L. R., Wise, J. G., and Senior,
and Iino, R. (2019) Single molecule analysis reveals rota
A. E. (1984) Specificity of the proton adenosine triphos
tional substeps and chemo mechanical coupling scheme of
phatase of Escherichia coli for adenine, guanine, and ino
V ATPase, J. Biol. Chem., 294, 17017 17030, doi: 10.1074/
sine nucleotides in catalysts and binding, Biochem. (Am.
jbc.RA119.008947.
Chem. Soc.), 23, 4998 5003, doi: 10.1021/bi00316a026.
БИОХИМИЯ том 85 вып. 12 2020
1914
ЗУБАРЕВА и др.
60.
Suzuki, T., Wakabayashi, C., Tanaka, K., Feniouk, B. A.,
77.
Schulz, S., WiIkes, M., Mills, D. J., Kuhlbrandt, W., and
and Yoshida, M. (2011) Modulation of nucleotide speci
Meier, T. (2017) Molecular archifecture of the N type
ficity of thermophilic FOF1 ATP synthase by epsilon sub
ATPase rotor ring from Barkholderia pseudomallei, EMBO
unit, J. Biol. Chem., 286, 16807 16813, doi: 10.1074/jbc.
Rep., 18, 526 535, doi: 10.15252/embr.201643374.
M110.209965.
78.
Laubinger, W., and Dimroth, P. (1989) The sodium ion
61.
D’Auzac, J. (1977) ATPase membranaire de vacuoles lyso
translocating adenosine triphosphatase of Propionigenium
somales: les lutoides du latex d’Hevea brasiliensis,
modestum pumps protons at low sodium ion concentra
Phytochemistry,
16,
18811885, doi:
10.1016/0031
tions, Biochem. (Amer. Chem. Soc.), 28, 71947198,
9422(77)80088 5.
doi: 10.1021/bi00444a010.
62.
Gräf, R., Harvey, W. R., and Wieczorek, H.
(1996)
79.
Neumann, S., Matthey, U., and Kaim, G.
(1998)
Purification and properties of a Cytosolic V1 ATPase,
Purification and properties of the F1Fo ATPase of
J. Biol. Chem., 271, 20908 20913, doi: 10.1074/jbc.271.
Ilyobacter tartaricus, a sodium ion pump, J. Bacteriol., 180,
34.20908.
3312 3316, doi: 10.1128/JB.180.13.3312 3316.1998.
63.
Mayer, F., Lim, J. K., Langer, J. D., Kang, S. G., and
80.
McMillan, D. G. G., Ferguson, S. A., Dey, D., Schröder,
Mueller, V. (2015) Na+ transport by the A(1)A(O) ATP
K., Aung, H. L., Carbone, V., et al. (2011) A1Ao ATP syn
synthase purified from Thermococcus onnurineus and
thase of Methanobrevibacter ruminantium couples sodium
reconstituted into liposomes, J. Biol. Chem., 290, 6994
ions for ATP synthesis under physiological conditions,
7002, doi: 10.1074/jbc.M114.616862.
J. Biol. Chem., 286, 3988239892, doi: 10.1074/jbc.
64.
Valiyaveetil, F. I., and Fillingame, R. H. (1997) On the role
M111.281675.
of Arg 210 and Glu 219 of subunit a in proton transloca
81.
Murata, T., Yamato, I., Kakinuma, Y., Shirouzu, M.,
tion by the Escherichia coli F0F1 ATP synthase, J. Biol.
Walker, J.E., Yokoyama, S., et al. (2008) Ion binding and
Chem., 272, 32635 32641, doi: 10.1074/jbc.272.51.32635.
selectivity of the rotor ring of the Na+ transporting V
65.
Glagolev, A. N., and Skulachev, V. P. (1978) The proton
ATPase, Proc. Natl. Acad. Sci. USA, 105, 8607 8611,
pump is a molecular engine of motile bacteria, Nature,
doi: 10.1073/pnas.0800992105.
272, 280 282, doi: 10.1038/272280a0.
82.
Meier, T., Krah, A., Bond, P. J., Pogoryelov, D.,
66.
Junge, W., Lill, H., and Engelbrecht, S. (1997) ATP syn
Diederichs, K., and Faraldo Gómez, J. D.
(2009)
thase: an electrochemical transducer with rotatory
Complete ion coordination structure in the rotor ring of
mechanics, Trends Biochem. Sci.,
22,
420423,
Na+ dependent F ATP synthases, J. Mol. Biol., 391, 498
doi: 10.1016/s0968 0004(97)01129 8.
507, doi: 10.1016/j.jmb.2009.05.082.
67.
Vik, S. B., and Antonio, B. J. (1994) A mechanism of proton
83.
Krah, A., Pogoryelov, D., Langer, J. D., Bond, P. J., Meier,
translocation by F1F0 ATP synthases suggested by double
T., and Faraldo Gómez, J. D. (2010) Structural and ener
mutants of the a subunit, J. Biol. Chem., 269, 30364 30369.
getic basis for H+ versus Na+ binding selectivity in ATP
68.
Srivastava, A. P., Luo, M., Zhou, W., Symersky, J., Bai, D.,
synthase FO rotors, Biochim. Biophys. Acta, 1797, 763 772,
Chambers, M. G., et al. (2018) High resolution cryo EM
doi: 10.1016/j.bbabio.2010.04.014.
analysis of the yeast ATP synthase in a lipid membrane,
84.
Leone, V., Pogoryelov, D., Meier, T., and Faraldo Gómez,
Science, 360, doi: 10.1126/science.aas9699.
J. D. (2015) On the principle of ion selectivity in Na+/H+
69.
Murata, T., Yamato, I., Kakinuma, Y., Leslie, A. G. W.,
coupled membrane proteins: experimental and theoretical
and Walker, J. E. (2005) Structure of the rotor of the V
studies of an ATP synthase rotor, Proc. Natl. Acad. Sci.
Type Na+ ATPase from Enterococcus hirae, Science, 308,
USA, 112, 1057 1066, doi: 10.1073/pnas.1421202112.
654 659, doi: 10.1126/science.1110064.
85.
Schlegel, K., Leone, V., Faraldo Gómez, J.D., and Müller,
70.
Skulachev, V. P. (1984) Membrane bioenergetics — should
V. (2012) Promiscuous archaeal ATP synthase concurrent
we build the bridge across the river or alongside of it?
ly coupled to Na+ and H+ translocation, Proc. Natl. Acad.
Trends Biochem. Sci., 9, 182 185, doi: 10.1016/0968
Sci. USA, 109, 947 952, doi: 10.1073/pnas.1115796109.
0004(84)90134 8.
86.
Watt, I. N., Montgomery, M. G., Runswick, M. J., Leslie,
71.
Skulachev, V. P. (1985) Membrane linked energy transduc
A. G. W., and Walker, J. E. (2010) Bioenergetic cost of
tions. Bioenergetic functions of sodium: H+ is not unique
making an adenosine triphosphate molecule in animal
as a coupling ion, Eur. J. Biochem., 151, 199208,
mitochondria. Proc. Natl. Acad. Sci. USA, 107, 16823
doi: 10.1111/j.1432 1033.1985.tb09088.x.
16827, doi: 10.1073/pnas.1011099107.
72.
Dimroth, P., and Cook, G. M. (2004) Bacterial Na+ or
87.
Ruppert, C., Kavermann, H., Wimmers, S., Schmid, R.,
H+ coupled ATP synthases operating at low electrochemi
Kellermann, J., Lottspeich, F., et al. (1999) The prote
cal potential, Adv. Microb. Physiol., 49, 175 218.
olipid of the A1A0 ATP synthase from Methanococcus jan*
73.
Mulkidjanian, A. Y., Dibrov, P., and Galperin, M. Y. (2008)
naschii has six predicted transmembrane helices but only
The past and present of sodium energetics: may the sodi
two proton translocating carboxyl groups, J. Biol. Chem.,
um motive force be with you, Biochim. Biophys. Acta,
274, 25281 25284, doi: 10.1074/jbc.274.36.25281.
1777, 985 992, doi: 10.1016/j.bbabio.2008.04.028.
88.
Wilms, R., Freiberg, C., Wegerle, E., Meier, I., Mayer, F.,
74.
Mulkidjanian, A. Y., Galperin, M. Y., Makarova, K. S.,
and Müller, V. (1996) Subunit structure and organization of
Wolf, Y. I., and Koonin, E. V. (2008) Evolutionary prima
the genes of the A1A0 ATPase from the Archaeon
cy of sodium bioenergetics, Biol. Direct.,
3,
13,
Methanosarcina mazei Gö1, J. Biol. Chem., 271, 18843
doi: 10.1186/1745 6150 3 13.
18852, doi: 10.1074/jbc.271.31.18843.
75.
Poehlein, A., Schmidt, S., Kaster, A. K., Goenrich, M.,
89.
Steinert, K., Wagner, V., Kroth Pancic, P. G., and Bickel
Vollmers, J., et al. (2012) An ancient pathway combining
Sandkötter, S. (1997) Characterization and subunit struc
carbon dioxide fixation with the generation and utilization
ture of the ATP synthase of the halophilic archaeon
of a sodium ion gradient for ATP synthesis, PLoS One, 7,
Haloferax volcanii and organization of the ATP synthase
e33439, doi: 10.1371/journal.pone.0033439.
genes, J. Biol. Chem., 272, 6261 6269, doi: 10.1074/jbc.
76.
Dibrova, D. V., Galperin, M. Y., and Mulkidjanian, A. Y.
272.10.6261.
(2010) Characterization of the N ATPase, a distinct, later
90.
Kibak, H., Taiz, L., Starke, T., Bernasconi, P., and
ally transferred Na+ translocating form of the bacterial F
Gogarten, J. P. (1992) Evolution of structure and function
type membrane ATPase, Bioinformatics, 26, 1473 1476,
of V ATPases, J. Bioenerg. Biomembr., 24, 415424,
doi: 10.1093/bioinformatics/btq234.
doi: 10.1007/BF00762534.
БИОХИМИЯ том 85 вып. 12 2020
РОТОРНЫЕ ИОН ТРАНСЛОЦИРУЮЩИЕ АТФазы
1915
91. Ihara, K., Watanabe, S., Sugimura, K. I., Katagiri, I., and
drial ATP synthase form the permeability transition pore,
Mukohata, Y. (1997) Identification of proteolipid from an
Proc. Natl. Acad. Sci. USA, 110, 5887 5892, doi: 10.1073/
extremely halophilic archaeon Halobacterium salinarumas
pnas.1217823110.
an N, N′ dicyclohexyl carbodiimide binding subunit of
105. Carroll, J., He, J., Ding, S., Fearnley, I. M., and Walker,
ATP synthase, Arch. Biochem. Biophys., 341, 267 272,
J. E. (2019) Persistence of the permeability transition pore
doi: 10.1006/abbi.1997.9972.
in human mitochondria devoid of an assembled ATP syn
92. Vonck, J., Pisa, K. Y., Morgner, N., Brutschy, B., and
thase, Proc. Natl. Acad. Sci. USA, 116, 12816 12821,
Müller, V. (2009) Three dimensional structure of A1A0
doi: 10.1073/pnas.1904005116.
ATP synthase from the hyperthermophilic archaeon
106. Hirata, T., Nakamura, N., Omote, H., Wada, Y., and
Pyrococcus furiosus by electron microscopy, J. Biol. Chem.,
Futai, M. (2000) Regulation and reversibility of vacuolar
284, 10110 10119, doi: 10.1074/jbc.M808498200.
H+ ATPase, J. Biol. Chem.,
275,
386389,
93. Mayer, F., Leone, V., Langer, J. D., Faraldo Gómez, J. D.,
doi: 10.1074/jbc.275.1.386.
and Müller, V. (2012) A c subunit with four transmembrane
107. Forgac, M. (2007) Vacuolar ATPases: rotary proton pumps
helices and one ion Na+ binding site in an archaeal ATP
in physiology and pathophysiology, Nat. Rev. Mol. Cell
synthase: implications for c ring function and structure,
Biol., 8, 917 929, doi: 10.1038/nrm2272.
J. Biol. Chem., 287, 39327 39337, doi: 10.1074/jbc.M112.
108. McGuire, C., Stransky, L., Cotter, K., and Forgac, M.
411223.
(2017) Regulation of V ATPase activity, Front. Biosci., 22,
94. Slesarev, A. I., Mezhevaya, K. V., Makarova, K. S.,
609 622, doi: 10.2741/4506.
Polushin, N. N., Shcherbinina, O. V., et al. (2002) The
109. Huang, C., and Chang, A. (2011) pH dependent cargo
complete genome of hyperthermophile Methanopyrus kan*
sorting from the Golgi, J. Biol. Chem., 286, 10058 10065,
dleri AV19 and monophyly of archaeal methanogens, Proc.
doi: 10.1074/jbc.M110.197889.
Natl. Acad. Sci. USA, 99, 46444649, doi: 10.1073/
110. Kozik, P., Hodson, N. A., Sahlender, D. A., Simecek, N.,
pnas.032671499.
Soromani, C., Wu, J., et al. (2013) A human genome wide
95. Müller, V., Aufurth, S., and Rahlfs, S. (2001) The Na+
screen for regulators of clathrin coated vesicle formation
cycle in Acetobacterium woodii: identification and charac
reveals an unexpected role for the V ATPase, Nat. Cell
terization of a Na+ translocating F1F0 ATPase with a
Biol., 15, 50 60, doi: 10.1038/ncb2652.
mixed oligomer of 8 and 16 kDa proteolipids, Biochim.
111.
Futai, M., Sun Wada, G. H., Wada, Y., Matsumoto, N.,
Biophys. Acta Bioenergetics, 1505, 108 120, doi: 10.1016/
and Nakanishi Matsui, M. (2019) Vacuolar type ATPase:
S0005 2728(00)00281 4.
A proton pump to lysosomal trafficking, Proc. Japan Acad.
96. Matthies, D., Zhou, W., Klyszejko, A. L., Anselmi, C.,
Series B Physic. Biol. Sci., 95, 261 277, doi: 10.2183/
Yildiz, Ö., Brandt, K., et al. (2014) High resolution struc
pjab.95.018.
ture and mechanism of an F/V hybrid rotor ring in a Na+
112. Finberg, K. E., Wagner, C. A., Bailey, M. A., Paunescu, T.
coupled ATP synthase, Nat. Commun.,
5,
5286,
G., Breton, S., Brown, D., et al. (2005) The B1 subunit of
doi: 10.1038/ncomms6286.
the H+ ATPase is required for maximal urinary acidifica
97. Pogoryelov, D., Klyszejko, A. L., Krasnoselska, G. O.,
tion, Proc. Natl. Acad. Sci. USA, 102, 1361613621,
Heller, E. M., Leone, V., et al. (2012) Engineering rotor
doi: 10.1073/pnas.0506769102.
ring stoichiometries in the ATP synthase, Proc. Natl. Acad.
113. Cotter, K., Stransky, L., McGuire, C., and Forgac, M.
Sci. USA, 109, 1599 1608, doi: 10.1073/pnas.1120027109.
(2015) Recent insights into the structure, regulation, and
98. Preiss, L., Klyszejko, A. L., Hicks, D. B., Liu, J.,
function of the V ATPases, Trends Biochem. Sci., 40, 611
Fackelmayer, O. J., et al. (2013) The c ring stoichiometry
622, doi: 10.1016/j.tibs.2015.08.005.
of ATP synthase is adapted to cell physiological require
114. Almeida, D. M., Oliveira, M. M., and Saibo, N. J. M.
ments of alkaliphilic Bacillus pseudofirmus OF4, Proc. Natl.
(2017) Regulation of Na+ and K+ homeostasis in plants:
Acad. Sci. USA, 110, 78747879, doi: 10.1073/pnas.
towards improved salt stress tolerance in crop plants, Genet.
1303333110.
Mol. Biol., 40, 326 345, doi: 10.1590/1678 4685 GMB
99. Veech, R. L., King, M. T., Pawlosky, R., Bradshaw, P. C.,
2016 0106.
and Curtis, W. (2019) Relationship between inorganic ion
115. Zoncu, R., Bar Peled, L., Efeyan, A., Wang, S., Sancak, Y.,
distribution, resting membrane potential, and the ΔG’ of
and Sabatini, D. M. (2011) mTORC1 senses lysosomal
ATP hydrolysis: a new paradigm, FASEB J., 33, 13126
amino acids through an inside out mechanism that
13130, doi: 10.1096/fj.201901942R.
requires the vacuolar H+ ATPase, Science, 334, 678 683,
100. Hüttemann, M., Lee, I., Pecinova, A., Pecina, P.,
doi: 10.1126/science.1207056.
Przyklenk, K., and Doan, J. W. (2008) Regulation of
116. Feniouk, B. A., and Yoshida, M. (2008) Regulatory mech
oxidative phosphorylation, the mitochondrial membrane
anisms of proton translocating F0F1 ATP synthase, Results
potential, and their role in human disease, J. Bioener.
Problems Cell Differ.,
45,
279308, doi:
10.1007/
Biomembr., 40, 445 456, doi: 10.1007/s10863 008 9169 3.
400_2007_043.
101. Hisabori, T., Konno, H., Ichimura, H., Strotmann, H.,
117. Feniouk, B. A., Suzuki, T., and Yoshida, M. (2006) The
and Bald, D. (2002) Molecular devices of chloroplast F1
role of subunit epsilon in the catalysis and regulation of
ATP synthase for the regulation, Biochim. Biophys. Acta
F0F1 ATP synthase, Biochim. Biophys. Acta, 1757, 326
Bioenergetics,
1555,
140146, doi:
10.1016/S0005
338, doi: 10.1016/j.bbabio.2006.03.022.
2728(02)00269 4.
118. Gledhill, J. R., Montgomery, M. G., Leslie, A. G. W., and
102. Galperin, M. Y., Makarova, K. S., Wolf, Y. I., and Koonin,
Walker, J. E. (2007) How the regulatory protein, IF1,
E. V. (2015) Expanded microbial genome coverage and
inhibits F1 ATPase from bovine mitochondria, Proc. Natl.
improved protein family annotation in the COG database,
Acad. Sci. USA, 104, 15671 15676, doi: 10.1073/pnas.
Nucleic Acids Res., 43, 261 269, doi: 10.1093/nar/gku1223.
0707326104.
103. Zorov, D. B., Juhaszova, M., and Sollott, S. J. (2014)
119. Morales R os, E., de la Rosa Morales, F., Mendoza
Mitochondrial reactive oxygen species (ROS) and ROS
Hernández, G., Rodr guez Zavala, J.S., Celis, H., et al.
induced ROS release, Physiol. Rev.,
94,
909950,
(2010) A novel 11 kDa inhibitory subunit in the F1FO ATP
doi: 10.1152/physrev.00026.2013.
synthase of Paracoccus denitrificans and related alpha pro
104. Giorgio, V., von Stockum, S., Antoniel, M., Fabbro, A.,
teobacteria, FASEB J., 24, 599 608, doi: 10.1096/fj.09
Fogolari, F., Forte, M., et al. (2013) Dimers of mitochon
137356.
БИОХИМИЯ том 85 вып. 12 2020
1916
ЗУБАРЕВА и др.
120. Yokoyama, K., Muneyuki, E., Amano, T., Mizutani, S.,
maintenance of cellular membrane potential in Bacillus
Yoshida, M., Ishida, M., et al. (1998) V ATPase of
subtilis, Microbiol. Open, 8, e00815, doi: 10.1002/mbo3.815.
Thermus thermophilus is inactivated during ATP hydrolysis
135. Kishikawa, J. I., Ibuki, T., Nakamura, S., Nakanishi, A.,
but can synthesize ATP, J. Biol. Chem., 273, 20504 20510,
Minamino, T., Miyata, T., et al. (2013) Common evolu
doi: 10.1074/jbc.273.32.20504.
tionary origin for the rotor domain of rotary ATPases and
121. Nakano, M., Imamura, H., Toei, M., Tamakoshi, M.,
flagellar protein export apparatus, PLoS One, 8, e64695,
Yoshida, M., and Yokoyama, K. (2008) ATP hydrolysis and
doi: 10.1371/journal.pone.0064695.
synthesis of a rotary motor V ATPase from Thermus ther*
136. Balakrishna, A. M., Basak, S., Manimekalai, M. S. S., and
mophilus, J. Biol. Chem., 283, 20789 20796, doi: 10.1074/
Grüber, G. (2015) Crystal structure of subunits D and F in
jbc.M801276200.
complex gives insight into energy transmission of the eukary
122. Singh, D., and Grüber, G. (2018) Crystallographic and
otic V ATPase from Saccharomyces cerevisiae, J. Biol.
enzymatic insights into the mechanisms of Mg ADP inhi
Chem., 290, 3183 3186, doi: 10.1074/jbc.M114.622688.
bition in the A1 complex of the A1AO ATP synthase,
137. Kane, P. M. (2012) Targeting reversible disassembly as a
J. Struct. Biol., 201, 26 35, doi: 10.1016/j.jsb.2017.10.008.
mechanism of controlling V ATPase activity, Curr. Protein
123. Kishikawa, J. I., Nakanishi, A., Furuike, S., Tamakoshi,
Peptide Sci., 13, 117 123, doi: 10.2174/138920312800493142.
M., and Yokoyama, K. (2014) Molecular basis of ADP
138. Tabke, K., Albertmelcher, A., Vitavska, O., Huss, M.,
inhibition of vacuolar (V) type ATPase/synthase, J. Biol.
Schmitz, H. P., and Wieczorek, H. (2014) Reversible dis
Chem., 289, 403 412, doi: 10.1074/jbc.M113.523498.
assembly of the yeast V ATPase revisited under in vivo con
124. Lapashina, A. S., Prikhodko, A. S., Shugaeva, T. E., and
ditions, Biochem. J.,
462,
185197, doi:
10.1042/
Feniouk, B. A. (2019) Residue 249 in subunit beta regulates
BJ20131293.
ADP inhibition and its phosphate modulation in
139. Beltrán, C., and Nelson, N. (1992) The membrane sector
Escherichia coli ATP synthase, Biochim. Biophys. Acta
of vacuolar H(+) ATPase by itself is impermeable to pro
Bioenerg., 1860, 181188, doi: 10.1016/j.bbabio.2018.
tons, Acta Physiol. Scandinavica Suppl., 607, 41 47.
12.003.
140. Zhang, J., Myers, M., and Forgac, M. (1992) Character
125. Lapashina, A. S., and Feniouk, B. A. (2019) Mutation
ization of the V0 domain of the coated vesicle (H+)
Q259L in subunit beta in Bacillus subtilis ATP synthase
ATPase, J. Biol. Chem., 267, 9773 9778.
attenuates ADP inhibition and decreases fitness in mixed
141. Qi, J., and Forgac, M. (2008) Function and subunit inter
cultures, Biochem. Biophys. Res. Commun., 509, 102 107,
actions of the N terminal domain of subunit a (Vph1p) of
doi: 10.1016/j.bbrc.2018.12.075.
the yeast V ATPase, J. Biol. Chem., 283, 19274 19282,
126. David, P., and Baron, R. (1994) The catalytic cycle of the
doi: 10.1074/jbc.M802442200.
vacuolar H+ ATPase. Comparison of proton transport in
142. Couoh Cardel, S., Milgrom, E., and Wilkens, S. (2015)
kidney and osteoclast derived vesicles, J. Biol. Chem.,
Affinity purification and structural features of the yeast
269, 30158 30163.
vacuolar ATPase V0 membrane sector, J. Biol. Chem., 290,
127. Moriyama, Y., and Nelson, N. (1987) Nucleotide binding
27959 27971, doi: 10.1074/jbc.M115.662494.
sites and chemical modification of the chromaffin granule
143. Hayek, S. R., Rane, H. S., and Parra, K. J.
(2019)
proton ATPase, J. Biol. Chem., 262, 14723 14729.
Reciprocal regulation of V ATPase and glycolytic pathway
128. Webster, L. C., Pérez Castiсeira, J. R., Atkins, G. L., and
elements in health and disease, Front. Physiol., 10, 127,
Apps, D. K. (1995) Allosteric regulation of proton translo
doi: 10.3389/fphys.2019.00127.
cation by a vacuolar adenosinetriphosphatase, Eur. J.
144. Lu, M., Ammar, D., Ives, H., Albrecht, F., and Gluck,
Biochem., 232, 586 595, doi: 10.1111/j.1432 1033.1995.
S. L. (2007) Physical interaction between aldolase and vac
586zz.x.
uolar H+ ATPase is essential for the assembly and activity
129. Vasilyeva, E., and Forgac, M. (1998) Interaction of the
of the proton pump, J. Biol. Chem., 282, 24495 24503,
clathrin coated vesicle V ATPase with ADP and sodium
doi: 10.1074/jbc.M702598200.
azide, J. Biol. Chem., 273, 23823 23829, doi: 10.1074/
145. Chan, C. Y., and Parra, K. J. (2014) Yeast phosphofruc
jbc.273.37.23823.
tokinase 1 subunit Pfk2p is necessary for pH homeostasis
130. Kishikawa, J. I., Seino, A., Nakanishi, A., Tirtom, N. E.,
and glucose dependent vacuolar ATPase reassembly,
Noji, H., Yokoyama, K., et al. (2014) F subunit reinforces
J. Biol. Chem., 289, 1944819457, doi: 10.1074/jbc.
torque generation in V ATPase, Eur. Biophys. J., 43, 415
M114.569855.
422, doi: 10.1007/s00249 014 0973 x.
146. Feng, Y., and Forgac, M. (1992) A novel mechanism for
131. Singh, D., Sielaff, H., Sundararaman, L., Bhushan, S.,
regulation of vacuolar acidification, J. Biol. Chem., 267,
and Grüber, G. (2016) The stimulating role of subunit F in
19769 19772.
ATPase activity inside the A1 complex of the
147. Feng, Y., and Forgac, M. (1994) Inhibition of vacuolar H+
Methanosarcina mazei Gö1 A1AO ATP synthase, Biochim.
ATPase by disulfide bond formation between cysteine 254
Biophys. Acta, 1857, 177 187, doi: 10.1016/j.bbabio.2015.
and cysteine 532 in subunit A, J. Biol.Chem., 269, 13224
12.003.
13230.
132. Singh, D., Sielaff, H., Börsch, M., and Grüber, G. (2017)
148. Forgac, M. (1999) The vacuolar H+ ATPase of clathrin
Conformational dynamics of the rotary subunit F in the
coated vesicles is reversibly inhibited by S nitrosoglu
A3B3DF complex of Methanosarcina mazei Gö1 A ATP
tathione, J. Biol. Chem., 274, 1301 1305, doi: 10.1074/jbc.
synthase monitored by single molecule FRET, FEBS Lett.,
274.3.1301.
591, 854 862, doi: 10.1002/1873 3468.12605.
149. Dschida, W. J., and Bowman, B. J. (1995) The vacuolar
133. Saijo, S., Arai, S., Hossain, K. M. M., Yamato, I., Suzuki,
ATPase: sulfite stabilization and the mechanism of nitrate
K., Kakinuma, Y., et al. (2011) Crystal structure of the cen
inactivation, J. Biol. Chem., 270, 1557 1563, doi: 10.1074/
tral axis DF complex of the prokaryotic V ATPase, Proc.
jbc.270.4.1557.
Natl. Acad. Sci. USA, 108, 19955 19960, doi: 10.1073/
150. Liu, Q., Leng, X. H., Newman, P. R., Vasilyeva, E., Kane,
pnas.1108810108.
P. M., and Forgac, M. (1997) Site directed mutagenesis of
134. Akanuma, G., Tagana, T., Sawada, M., Suzuki, S.,
the yeast V ATPase A subunit, J. Biol. Chem., 272, 11750
Shimada, T., Tanaka, K., et al. (2019) C terminal regulato
11756, doi: 10.1074/jbc.272.18.11750.
ry domain of the ε subunit of FOF1 ATP synthase enhances
151. Oluwatosin, Y. E., and Kane, P. M. (1997) Mutations in the
the ATP dependent H+ pumping that is involved in the
CYS4 gene provide evidence for regulation of the yeast vac
БИОХИМИЯ том 85 вып. 12 2020
РОТОРНЫЕ ИОН ТРАНСЛОЦИРУЮЩИЕ АТФазы
1917
uolar H+ ATPase by oxidation and reduction in vivo,
153. Seidel, T., Scholl, S., Krebs, M., Rienmüller, F., Marten, I.,
J. Biol. Chem., 272, 2814928157, doi: 10.1074/jbc.
Hedrich, R., et al. (2012) Regulation of the V type ATPase
272.44.28149.
by redox modulation, Biochem. J.,
448,
243251,
152. Hager, A., and Lanz, C. (1989) Essential sulfhydryl groups
doi: 10.1042/BJ20120976.
in the catalytic center of the tonoplast H+ ATPase from
154. Hards, K., and Cook, G. M. (2018) Targeting bacterial
coleoptiles of Zea mays L. as demonstrated by the biotin
energetics to produce new antimicrobials, Drug Resist.
streptavidin peroxidase system, Planta, 180, 116212,
Updates: Rev.Comm. Antimicrob. Anticancer Chemother., 36,
doi: 10.1007/BF02411417.
1 12, doi: 10.1016/j.drup.2017.11.001.
ROTARY ION TRANSLOCATING ATPases/ATP SYNTHASES:
DIVERSITY, SIMILARITIES, AND DIFFERENCES
Review
V. M. Zubareva1, A. S. Lapashina1,2, T. E. Shugaeva1, A. V. Litvin1, and B. A. Feniouk1,2*
1 Lomonosov Moscow State University, Faculty of Bioengineering and Bioinformatics,
119991 Moscow, Russia; E*mail: feniouk@fbb.msu.ru
2 Belozersky Institute of Physico*Chemical Biology, Lomonosov Moscow State University, 119991 Moscow, Russia
Received July 22, 2020
Revised September 22, 2020
Accepted October 9, 2020
Ion translocating ATPases and ATP synthases (F , V , A type ATPases, and several P type ATPases and ABC trans
porters) catalyze ATP hydrolysis or ATP synthesis coupled with the ion transport across the membrane. F , V , and
A ATPases are protein nanomachines that combine transmembrane transport of protons or sodium ions with ATP
synthesis/hydrolysis by means of a rotary mechanism. These enzymes are composed of two multisubunit subcom
plexes that rotate relative to each other during catalysis. Rotary ATPases phosphorylate/dephosphorylate nucleotides
directly, without the generation of phosphorylated protein intermediates. F type ATPases are found in chloroplasts,
mitochondria, most eubacteria, and in few archaea. V type ATPases are eukaryotic enzymes present in a variety of
cellular membranes, including the plasma membrane, vacuoles, late endosomes, and trans Golgi cisternae. A type
ATPases are found in archaea and some eubacteria. F and A ATPases have two main functions: ATP synthesis pow
ered by the proton motive force (pmf) or, in some prokaryotes, sodium motive force (smf) and generation of the pmf
or smf at the expense of ATP hydrolysis. In prokaryotes, both functions may be vitally important, depending on the
environment and the presence of other enzymes capable of pmf or smf generation. In eukaryotes, the primary and the
most crucial function of F ATPases is ATP synthesis. Eukaryotic V ATPases function exclusively as ATP dependent
proton pumps that generate pmf necessary for the transmembrane transport of ions and metabolites and are vitally
important for pH regulation. This review describes the diversity of rotary ion translocating ATPases from different
organisms and compares the structural, functional, and regulatory features of these enzymes.
Keywords: ATP synthase, F ATPase, A ATPase, V ATPase, intracellular ATP, proton translocating ATPase, regulation
БИОХИМИЯ том 85 вып. 12 2020