БИОХИМИЯ, 2020, том 85, вып. 12, с. 1918 - 1927
УДК 577.152.1
ИДЕНТИФИКАЦИЯ Na+ ПЕРЕКАЧИВАЮЩЕЙ
ЦИТОХРОМОКСИДАЗЫ В МЕМБРАНАХ ЭКСТРЕМАЛЬНО
АЛКАЛИФИЛЬНОЙ БАКТЕРИИ Thioalkalivibrio
© 2020
М.С. Мунтян1*, Д.А. Морозов1, Ю.Ф. Леонова2, Т.В. Овчинникова2
1 НИИ физико химической биологии имени А.Н. Белозерского, Московский государственный университет
имени М.В. Ломоносова, 119991 Москва, Россия; электронная почта: muntyan@genebee.msu.ru
2 ФГБУН Институт биоорганической химии имени академиков М.М. Шемякина
и Ю.А. Овчинникова РАН, 117997 Москва, Россия
Поступила в редакцию 26.07.2020
После доработки 01.09.2020
Принята к публикации 01.09.2020
Впервые доказательство функционирования кислород редуктазного Na+ насоса (Na+ перекачивающей ци
тохром с оксидазы cbb3 типа) было получено при изучении дыхательной цепи экстремально алкалифиль
ной бактерии Thioalkalivibrio versutus [Muntyan, M. S., et al. (2015) Cytochrome cbb3 of Thioalkalivibrio is a Na+
pumping cytochrome oxidase, Proc. Natl. Acad. Sci. USA, 112, 7695 7700]. В настоящей работе проведена имму
нодетекция и идентификация этой Na+ перекачивающей цитохром с оксидазы, являющейся продуктом
оперона ccoNOQP. С помощью кроличьих поликлональных антител, полученных на предсказанную С кон
цевую аминокислотную последовательность каталитической субъединицы, показано, что оксидаза cbb3 ти
па синтезируется в клетках бактерии и локализуется в её мембранах; субъединица оксидазы с мол. массой
48 кДа является каталитической, СcoN; субъединицы с мол. массами 29 и 34 кДа, СcoO и СcoP, соответ
ственно являются цитохромами с. Определены теоретические значения pI субъединиц СcoN, СcoO и СcoP.
Показано, что части субъединиц CcoO и CcoP, экспонированные в водную фазу на P стороне цитоплазма
тической мембраны клеток, обогащены отрицательно заряженными аминокислотными остатками, в отли
чие от граничащих с водной фазой частей интегральной субъединицы CcoN. Таким образом, Na+ перека
чивающая цитохром с оксидаза T. versutus как по функции, так и по структуре демонстрирует приспособ
ленность к экстремально щелочным условиям.
КЛЮЧЕВЫЕ СЛОВА: Na+ насос, цитохром с оксидаза, экстремофилия, алкалифилия, оксидаза cbb3 типа.
DOI: 10.31857/S0320972520120143
ВВЕДЕНИЕ
жен принципиально новый тип преобразовате
лей энергии, активный при щелочных рН, -
У аэробных организмов биологически дос
Na+ перекачивающий фермент на уровне комп
тупная энергия, высвобождающаяся в процессе
лекса I, а именно, Na+ НАДН хинон оксидоре
дыхания, первично запасается в виде трансмем
дуктаза (NQR) [1]. Появление и использование
бранного градиента ионов Н+ на внутренней
Na+ насосов у алкалифилов, по гипотезе акаде
мембране митохондрий (у эукариот) или на ци
мика В.П. Скулачева, связаны с преимущества
топлазматической мембране (у прокариот).
ми энергетики, базирующейся на градиенте ио
Важнейшими механизмами, которые перекачи
нов Na+ [2]. Предложенная гипотеза позволяет
вают ионы Н+ и генерируют трансмембранный
объяснить, как алкалифилы с Na+ типом энер
градиент ионов Н+, являются кислородредук
гетики преодолевают проблему низкой величи
тазные электронтранспортные цепи (КР ЭТЦ).
ны протон движущей силы, создающейся всле
В общем случае работа КР ЭТЦ по перекачке
дствие обращенного градиента концентрации
ионов Н+ обеспечивается комплексами I, III и
ионов Н+ на их мембранах. В.П. Скулачев пред
IV. Более 35 лет тому назад в КР ЭТЦ морских
положил, что в КР ЭТЦ аэробных алкалифиль
алкалифильных бактерий впервые был обнару
ных бактерий также может существовать и Na+
перекачивающий комплекс IV [3]. Однако более
Принятые сокращения: ТМФД - N,N,N′,N′ тетра
трех с половиной десятков лет NQR оставался
метил p фенилендиамин; СА
- сульфат аммония;
единственным компонентом аэробных дыха
ЦО - цитохром с оксидаза; КР ЭТЦ - кислородредуктаз
ные электронтранспортные цепи; NQR - Na+ НАДН хи
тельных цепей, для которого была доказана спо
нон оксидоредуктаза; ТМБЗ - тетраметилбензидин.
собность запасать энергию в форме трансмемб
* Адресат для корреспонденции.
ранного градиента ионов Na+. В 2015 г. впервые
1918
СВОЙСТВА Na+ ПЕРЕКАЧИВАЮЩЕЙ ЦИТОХРОМОКСИДАЗЫ
1919
получено доказательство функционирования в
ных как инструмент для идентификации и ис
аэробной дыхательной цепи Na+ перекачиваю
следования фермента. Подход может использо
щего комплекса IV, представленного цитохром
ваться в будущих работах и быть полезен другим
с оксидазой (ЦО) cbb3 типа у экстремально ал
исследователям. Исследование дает ключ к по
калифильной бактерии Thioalkalivibrio versutus
ниманию механизмов адаптации бактерии к ус
[4]. До этого времени среди всех исследованных
ловиям обитания, характеризующимся одно
ЦО были известны только Н+ перекачивающие
временно двумя экстремальными показателя
ферменты. ЦО являются представителями су
ми - крайне щелочными рН и близкими к на
персемейства оксидаз с гем медным биядерным
сыщающим концентрациями солей натрия.
каталитическим центром и подразделяются на
три подсемейства: A, B и C. ЦО С типа (оксида
зы cbb3 типа) считаются наиболее древними
МЕТОДЫ ИССЛЕДОВАНИЙ
среди них [5, 6]. Несмотря на то, что ЦО С типа
широко распространены как среди патогенных,
Культивирование бактерии T. versutus (штамм
так и у ряда полезных в сельском хозяйстве бак
T. versutus AL2) проводили в аэробных условиях,
терий, они изучены в наименьшей степени. В
как описано Сорокиным и соавт. [13].
частности, несмотря на успех в получении рент
Определение нуклеотидной последователь
геновской структуры оксидазы cbb3 типа [7], к
ности 3′ концевого фрагмента гена каталитичес
настоящему времени механизм перекачки про
кой субъединицы Na+ перекачивающей оксидазы
тонов ферментами данного типа малоизучен.
T. versutus. Полинуклеотиды, содержащие 3′
Объект наших исследований, экстремально
концевой фрагмент гена каталитической субъе
гало и алкалифильная серуокисляющая бакте
диницы CcoN, получали путем ПЦР амплифи
рия T. versutus из класса Gammaproteobacteria,
кации с использованием геномной ДНК T. ver
населяет уникальную экологическую нишу
-
sutus в качестве матрицы и пары вырожденных
высокощелочные содовые озера Тувы (Сибирь)
праймеров, сконструированных на основе мно
с рН 9,2-11,0 и соленостью до 4 М по натрию
жественного выравнивания последовательнос
[8]. Исследования на многих экстремофильных
тей того же оперона из девяти других видов про
видах зачастую сопряжены с трудностями куль
теобактерий: Fw, 5′-TTCGA(A,G)GG(C,T,G)CC
тивирования, вследствие чего ряд первичных
GATGATGTCG-3′ и Rv, 5′-TT(C,G)GA(A,T,C,G)C
Na+ насосов из таких объектов никогда не изу
CCCA(T,C)TG(A,G)AA(G,C,A)G-3′. ПЦР про
чали на уровне организма хозяина, и вся ин
водили в амплификаторе «Терцик» («ДНК тех
формация об этих ферментах была получена
нология», Россия) в реакционной смеси объе
исключительно на трансгенных штаммах, не яв
мом 20 мкл, содержащей 10-20 нг исследуемой
ляющихся экстремофилами. Так, были изучены
ДНК, 2 пМ каждого праймера и 2 ед Taq ДНК
относительно просто устроенные Na+ перека
полимеразы («Сибэнзим», Россия) по следую
чивающие ферменты, состоящие только из по
щей температурной схеме: стартовая денатура
липептидов одного вида. Среди них Na+ пиро
ция - 94 °С, 3 мин, затем 30 циклов амплифика
фосфатазы из Methanosarcina mazei, Moorella
ции следующего температурного профиля: де
thermoacetica, Thermotoga maritima [9] и Na+ про
натурация - 94 °С, 30 с, отжиг - 50 °С, 30 с и уд
теородопсин из Indibacter alkaliphilus [10]. В от
линение - 72 °С, 30 с. ДНК секвенировали в
личие от указанных работ, в представленной ра
обоих направлениях с использованием автома
боте, как и в наших более ранних исследовани
тического четырехкапиллярного секвенатора
ях Na+ насосов экстремофилов [4, 11, 12], экс
ДНК «ABI Prism 3100 Avant» («Applied Biosys
периментальная часть выполнена с использова
tems», США) и набора реагентов «ABI Prism
нием клеток и клеточных препаратов организ
BigDye Terminator v. 3.1» в центре «Геном» Инс
ма хозяина. Na+ перекачивающая cbb3 оксида
титута молекулярной биологии им. Энгельгард
за T. versutus - это уникальный новый фермент,
та (РАН). Полученные нуклеотидные последо
для которого только недавно доказана функция
вательности анализировали с использованием
транспорта ионов Na+, новая для всего класса
сервера BLASTA и выравнивали с использова
оксидоредуктаз. Физико химические свойства
нием программы ClustalW [14]. Нуклеотидная
фермента ранее не были известны. В задачу нас
последовательность фрагмента гена ccoN T. ver
тоящей работы входило изучение свойств фер
sutus депонирована в базе данных GenBank (но
мента, что могло бы пролить свет на структур
мер доступа: AM850129).
ные факторы, повлиявшие на приобретение
Выделение цитоплазматических мембран и
комплексом столь новой функции. В статье
экстракция мембранных цитохромов. Заморожен
описан способ получения к комплексу cbb3 ок
ные клетки T. versutus оттаивали и к полученной
сидазы специфических антител, использован
биомассе добавляли 2 мМ MgCl2, 1 мМ фенил
БИОХИМИЯ том 85 вып. 12 2020
1920
МУНТЯН и др.
метилсульфонилфторид и 5 мкг/мл ДНКазы
зованием Tris Tricine электродного буфера, со
(конечные концентрации). Клетки разрушали
держащего 0,25% ный Triton Х 100 [17]. После
двумя проходами через ячейку Френч пресса
завершения электрофореза в ПААГ выявляли:
(«Aminco», США) при давлении 16 000 фунт/кв.
а) цитохромы по методу Thomas et al. [18], ис
дюйм. Из полученного гомогената цитоплазма
пользуя пероксидазную реакцию с тетраметил
тические мембраны выделяли как описано ра
бензидином; б) белки, обладающие оксидазной
нее, но исключали обработку клеток лизоцимом
активностью в растворе 2 мМ ТМФД при 37 °С,
[15]. Мембранные белки экстрагировали путем
как описано ранее [19]. Для проведения имму
перемешивания суспензии цитоплазматических
нодетекции белки после электрофореза перено
мембран в течение 15 мин при 4 °С в растворе,
сили на PVDF мембраны Hybond P («Amersham
содержащем 30 мМ Mops HCl, pH 7,5, 0,5 мМ
Phar macia Biotech», Швеция) путем электроб
ЭДТА, 5 мМ NaCl, 0,7 М KCl, 8-15% октил β
лоттинга при силе тока 200 мА в течение 1,5 ч по
D глюкопиранозид (при соотношении 2,5 г на
методу Towbin et al. [20]. Белки и полипептиды,
1 г общего белка). После экстракции мембраны
перекрестно реагирующие с АТ, выявляли ECL
осаждали при 15 000 g в течение 15 мин при 4 °С.
методом после обработки козьими анти
Супернатант, содержащий экстракт белков,
кроличьими вторичными антителами, конъ
фракционировали СА. Фракцию белков, обра
югированными с пероксидазой хрена, в соот
зующую преципитат красного цвета при насы
ветствии с инструкциями производителя
щающей концентрации СА 50-70% и обладаю
(«Amersham Pharmacia Biotech»).
щую полной дыхательной активностью, прису
Определение N концевой аминокислотной
щей мембранам, далее обозначали, как экстра
последовательности проводили, как описано ра
гированные мембранные цитохромы «фракция
нее [21], путем отщепления аминокислотных
50-70%».
остатков по методу Edman и хроматографии фе
Иммунизация кролика и получение поликло
нилтиогидантоиновых производных аминокис
нальных антител. Для выработки у кролика по
лот с использованием секвенатора «Applied
ликлональных антител против каталитической
Biosystems 477A» (США) по стандартным прог
субъединицы CcoN комплекса cbb3 оксидазы
раммам.
использовали пептидо белковый конъюгат, ко
Моделирование субъединиц cbb3 оксидазы
торый получали путем инкубации 0,2 мкмоль
проводили в среде «SWISS MODEL Server» с ис
синтетического олигопептида: KAEAREAQAA
пользованием пакета программ для гомологично
STEARTA и 1 мг БСА с глутаровым альдегидом.
го моделирования «SWISS MODEL Workspace/
После солюбилизации в PBS буфере пептидо
GMQE» [22]. Теоретическое значение pI белко
белковый конъюгат в концентрации 1 мг/мл в
вых молекул определяли с помощью програм
суспензии с полным адъювантом Фрейнда в со
много средства «Compute pI/Mw tool» на серве
отношении 1 : 1 использовали для иммунизации
ре Expasy [23].
кролика линии «Серый великан» путем подкож
ных инъекций по 1 мл в каждый бок через каж
дые 30 дней в течение 3 х мес. По окончании пе
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
риода иммунизации у кролика отбирали 10 мл
крови для проверки титра антител и выделения
Ранее нами установлено, что Na+ перекачи
из сыворотки фракции, обогащенной IgG, по
вающий комплекс IV у экстремально алкали
стандартной методике путем высаливания СА.
фильной бактерии T. versutus представлен ЦО
Полученную фракцию иммуноглобулинов хра
cbb3 типа [4]. В настоящей работе для подготов
нили при 4 °С с добавлением нескольких крис
ки идентификации Na+ перекачивающей ЦО
таллов азида натрия и в дальнейшем использо
методом иммуноферментного анализа была по
вали в качестве реагента, содержащего поликло
лучена 3′ концевая нуклеотидная последова
нальные антитела на синтезированный олиго
тельность гена каталитической субъединицы
пептид.
CcoN (номер доступа в GenBank: AM850129).
Электрофорез и Вестерн блоттинг. Денату
Схема иллюстрирует положение полученной
рирующий электрофорез проводили в 12% ном
последовательности на карте оперона ccoNOQP.
ДСН ПААГ с использованием Tris Tricine бу
Эти данные были использованы нами при
ферной системы [16]. Перед электрофорезом
конструировании полипептида, который мог бы
образцы суспендировали в буфере для образцов,
послужить антигеном для выработки антител на
содержащем 3% ный ДСН, и затем оставляли на
субъединицу CcoN при иммунизации кроликов.
1 ч при 25 °С без кипячения. Неденатурирую
Варианты последовательностей пептидов, полу
щий электрофорез проводили в 6% ном ПААГ,
чаемые при конструировании, контролировали
содержащем 0,25% ный Triton Х 100, с исполь
на уникальность и отсутствие совпадений со
БИОХИМИЯ том 85 вып. 12 2020
СВОЙСТВА Na+ ПЕРЕКАЧИВАЮЩЕЙ ЦИТОХРОМОКСИДАЗЫ
1921
Оперон ccoNOQP и расшифрованные фрагменты генов T. versutus. Предполагаемые сайты связывания простетических
групп оксидазы cbb3 типа показаны треугольниками, согласно данным для оперона ccoNOQP Rhodobacter sphaeroides [24]
структурой известных токсичных белков. С уче
шей специфичностью и предпочтительно свя
том этих условий был синтезирован 17 членный
зываются лишь с одной белковой полосой. Мол.
пептид, соответствующий предполагаемой C кон
масса субъединицы CcoN T. versutus, определен
цевой области субъединицы CcoN. Синтезирован
ная с помощью белков маркеров, составляет
ный пептид в составе конъюгата с БСА, имею
48 кДа (рис. 3, дорожки 2, 5).
щего структуру (KAEAREAQAASTEARTA)8БСА,
Поскольку в денатурирующих условиях бел
был использован для иммунизации кролика. В
ки теряют нековалентно связанные гемы, по ок
течение всего периода иммунизации поведение и
раске ДСН ПААГ на гемы можно заключить,
состояние кролика не отличались от обычного, а
что полипептиды с мол. массами 34 и 29 кДа со
аппетит животного был в норме. Эти наблюдения
держат ковалентно связанные гемы с, так же как
позволили сделать вывод, что сконструирован
субъединицы CcoO и CcoP известных оксидаз
ный пептид не обладает токсическим действием.
cbb3 типа. На рис. 3 (дорожка 3) видно, что субъ
По окончании иммунизации из крови, забран
ной у кролика, проводили выделение фракции
антител, обогащенной IgG. По титру полученных
фракций IgG можно видеть, что в результате им
мунизации кролика на пептидо белковый конъ
югат выработались антитела (рис. 1).
После электрофоретического разделения
экстрагированных мембранных белков T. versu
tus (фракция 50-70%) в 6% ном ПААГ в отсут
ствие денатурирующих агентов была проведена
иммунодетекция с использованием полученно
го препарата антител к С концевому фрагменту
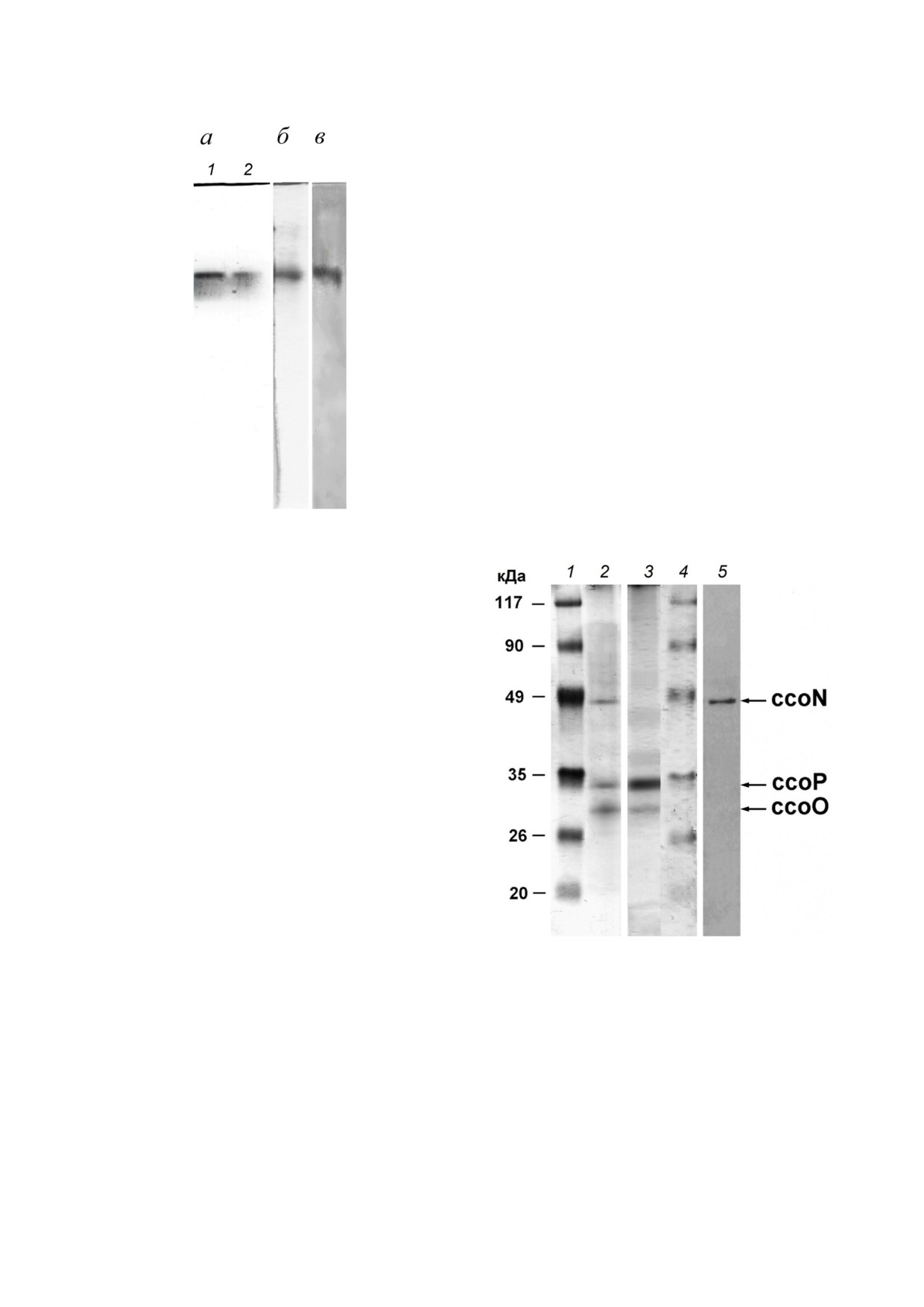
субъединицы CcoN (рис. 2). Поликлональные
антитела, выработавшиеся на пептидо белко
вый конъюгат, давали перекрестную реакцию
только с одним гем содержащим белковым
комплексом в экстракте мембранных белков
(рис. 2, в). Этот белковый комплекс обнаружи
вал оксидазную (рис. 2, а) и пероксидазную ак
тивность, характерную для гемов (рис. 2, б). По
сумме перечисленных признаков можно было
предположить, что белковый комплекс является
cbb3 оксидазой. Для определения субъединич
ного состава оксидазы cbb3 типа белковый
комплекс, перекрестно реагирующий с анти
CcoN антителами, элюировали из соответству
Рис. 1. Определение титра препарата антител с помощью
ющих зон в 6% ном ПААГ и подвергали разде
двойной радиальной иммунодиффузии по Ухтерлони в
лению во втором направлении с помощью
1% ном агарозном геле. В центральной лунке: анти
ДСН ПААГ электрофореза. На рис. 3 (дорож
ген - препарат синтезированного пептида в виде пептид
но белкового конъюгата; в 6 ти периферических лунках:
ки 2 и 3) показан результат разделения элюиро
последовательные разведения препарата антител, предс
ванных белков и последующей иммунодетекции
тавленных фракцией иммуноглобулинов IgG из сыворот
анти CcoN антителами (дорожка 5). Можно ви
ки иммунизированного кролика; стрелкой показано нап
деть, что анти CcoN антитела обладают хоро
равление уменьшения степени разведения
13 БИОХИМИЯ том 85 вып. 12 2020
1922
МУНТЯН и др.
компоненты комплекса cbb3 у известных предс
тавителей [5]. Таким образом, в настоящей ра
боте удалось получить препарат IgG, специфич
ный к субъединице CcoN из комплекса оксида
зы cbb3 типа T. versutus, и установить, что Na+
перекачивающая ЦО cbb3 типа из экстремально
алкалифильной бактерии T. versutus обладает
общей структурой с представителями ЦО С
кластера [25]. Аминокислотная последователь
ность субъединиц комплекса, предсказанная по
нуклеотидной последовательности оперона,
имеет высокую гомологию с субъединицами
комплекса cbb3 из бактерии P. stutzeri. Высокая
степень гомологии позволила провести гомоло
гичное моделирование на основе данных о
кристаллической структуре комплекса cbb3 из
бактерии P. stutzeri [7]. Результаты моделирова
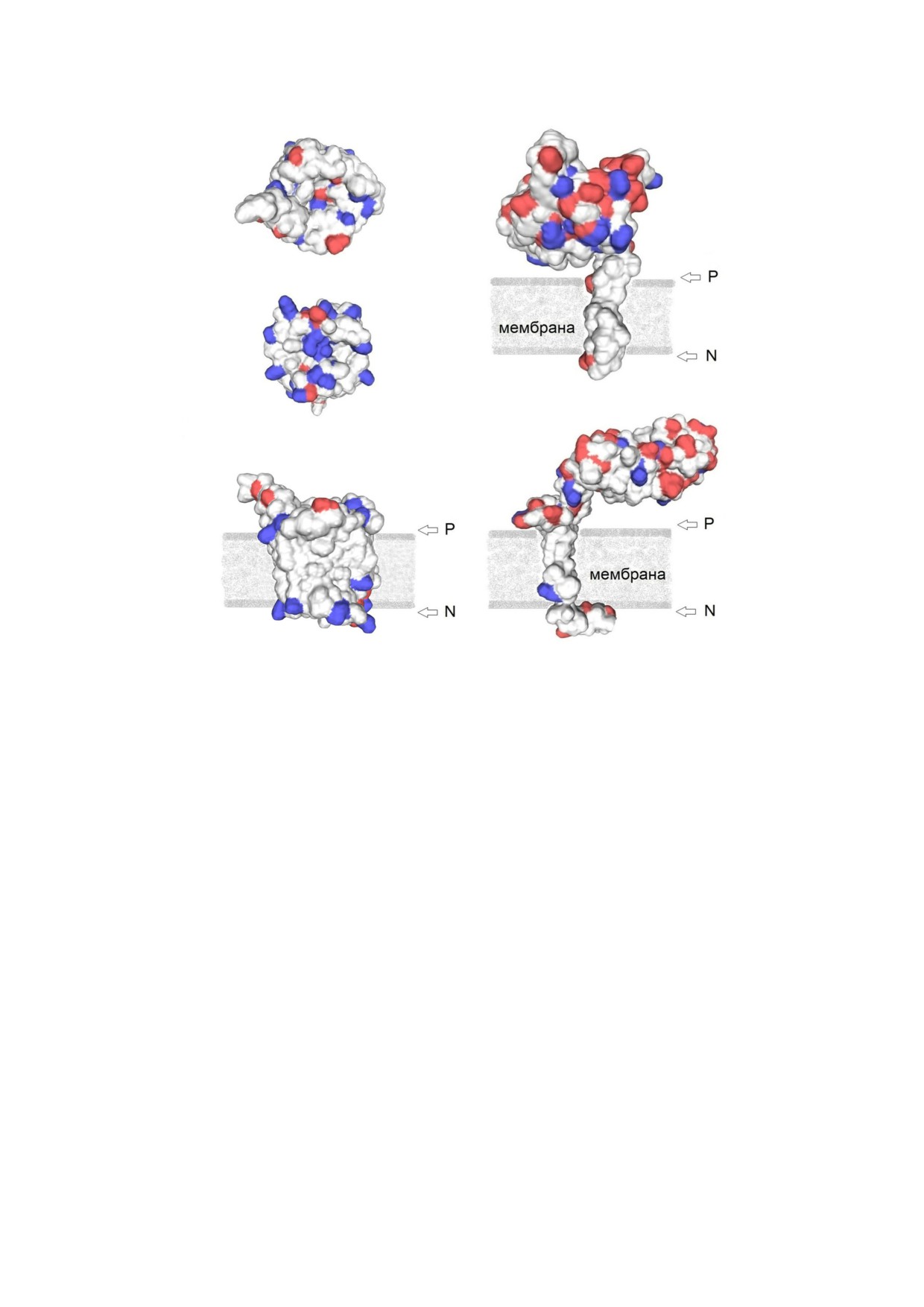
ния показывают, что части субъединиц CcoO и
CcoP из T. versutus, экспонированные в водную
фазу на стороне P цитоплазматической мембра
ны, обогащены отрицательно заряженными
аминокислотными остатками (рис. 4, г, д). В
Рис. 2. Иммунодетекция комплекса cbb3 оксидазы T. versu
tus. Электрофореграмма экстракта мембранных цитохро
мов (фракция 50-70%) T. versutus в 6% ном ПААГ в отсут
ствие денатурирующих агентов (а, б); окраска на ТМФД
оксидазную активность (а) и на гем (б); фотореплика
PVDF мембраны на рентгеновской пленке после обработ
ки первичными антителами кролика к субъединице CcoN
T. versutus и флуоресцентной детекции по ECL методу (в)
единица с мол. массой 34 кДа дает гораздо более
интенсивную окраску на гем, чем субъединица с
мол. массой 29 кДа. Подобное соотношение по
окраске на гем описано для субъединиц CcoP и
CcoO других известных ЦО cbb3 типа, что объ
ясняется присутствием двух гемов С в субъеди
нице CcoP против одного в субъединице CcoO.
Это дало основание предположить, что в препа
ратах из T. versutus субъединица с мол. массой
34 кДа является субъединицей CcoP, а субъеди
ница с мол. массой 29 кДа - CcoO. Предположе
ние подтвердилось после определения N конце
вой аминокислотной последовательности поли
пептида с мол. массой 29 кДа. Эта последова
тельность состава - KHESVETN - оказалась
идентичной N концевому фрагменту субъеди
Рис. 3. Определение субъединичного состава и молекуляр
ницы CcoO в комплексе cbb3 из T. versutus,
ной массы субъединиц cbb3 оксидазы T. versutus после
электрофореза в 12% ДСН ПААГ. В дорожках слева нап
предсказанному по нуклеотидной последова
раво: 1, 4 - предокрашенные белки маркеры; 2, 3 - фрак
тельности соответствующего гена в полной
ция белков с оксидазной активностью, элюированная из
нуклеотидной последовательности оперона
6% ного ПААГ после неденатурирующего электрофореза
ccoNOQP cbb3 оксидазы T. versutus AL2 (код дос
мембранных белков T. versutus (рис. 2, а); 5 - фотореплика
тупа в GenBank: HE575403.1), которая была на
PVDF мембраны на рентгеновской пленке. Окраска: на
белок - дорожки 1, 2 (Кумасси R 250); на гемы - дорож
ми определена позднее после определения
ки 3, 4 (ТМБЗ); засветка рентгеновской пленки после флуо
3′ концевой нуклеотидной последовательности
ресцентного окрашивания PVDF мембраны (ECL метод),
гена каталитической субъединицы CcoN. Субъ
исходно обработанной первичными анителами кролика к
единицы CcoN, CcoO и CcoP - обязательные
субъединице CcoN T. versutus
БИОХИМИЯ том 85 вып. 12 2020
СВОЙСТВА Na+ ПЕРЕКАЧИВАЮЩЕЙ ЦИТОХРОМОКСИДАЗЫ
1923
а
г
б
д
в
Рис. 4. Модели коровых субъединиц комплекса cbb3 у экстремально алкалифильной бактерии T. versutus. Субъединица
CcoN (а, б), вид в плоскости мембраны со стороны P (а) и стороны N (б). Субъединицы CcoN (в), CcoO (г) и CcoP (д),
вид сбоку перпендикулярно плоскости мембраны. Стороны мембраны обозначены стрелками и буквами P и N. Отрица
тельно и положительно заряженные аминокислотные остатки на поверхности субъединиц окрашены соответственно в
красный и синий цвета. При моделировании за эталон принимали трехмерную структуру гомологичных субъединиц
комплекса cbb3 P. stutzeri (номер доступа в PDB: 3MK7) [7]
субъединице CcoN, представленной полностью
субъединиц [26, 27]. По данным, полученным в
интегральным белком, напротив, суммарно
настоящем исследовании, cbb3 оксидаза T. ver
превалируют положительно заряженные амино
sutus состоит из трех субъединиц с мол. массами
кислотные остатки (рис. 4, а, б, в). В соответ
48, 34 и 29 кДа, из которых медленно мигрирую
ствии с этими данными интегральная субъеди
щая субъединица является каталитической, а
ница CcoN характеризуется pI с рассчитанным
две более подвижные - цитохромами с. По
значением 9,2, а поверхность субъединицы, об
строению фермент сходен с известными гомо
ращенная в цитоплазматический отсек, при
логами из R. sphaeroides [26, 28], Rhodobacter cap
pH < 9,2 заряжена положительно. У мембран
sulatus [29, 30], Bradyrhizobium japonicum [31, 32],
ных субъединиц CcoO и CcoP, имеющих боль
Thioalcalomicrobium aerophilum AL3 [33], H. pylori
шие периферические домены в периплазмати
[34], P. stutzeri [35], Rhizobium etli [36]. Сходство
ческом отсеке, напротив, рассчитанные значе
наблюдается не только на уровне субъединич
ния pI составили 4,51 и 4,44 соответственно, и
ного состава, но и на уровне аминокислотных
при pH > 4,5 эти части молекул несут отрица
последовательностей, степень гомологии кото
тельный заряд.
рых у каталитических субъединиц комплекса из
T. versutus и P. stutzeri достигает 69%. Однако те
комплексы cbb3 оксидаз из Paracoccus denitrifi
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
cans [37, 38], R. sphaeroides [24], H. pylori [34] и
B. japonicum [39], у которых были исследованы
Известные ЦО cbb3 типа после выделения
свойства молекулярных насосов, обнаруживают
из мембран и очистки состоят из трех четырех H+ транспортную активность, в отличие от cbb3
БИОХИМИЯ том 85 вып. 12 202
13*
1924
МУНТЯН и др.
оксидазы T. versutus. Последняя, в противопо
этого заключается в выборе объектов исследо
ложность гомологам в вышеперечисленных ви
ваний. Объекты наших исследований долгое
дах бактерий, не только не производит закисле
время оставались недоступными для культиви
ния внешней среды в ответ на добавки кислоро
рования и функционального биохимического
да к анаэробным суспензиям, но в присутствии
исследования из за неразработанности биохи
ионов Na+ и разобщителя протонофора создает
мических подходов, а также малой изученности
обратимое защелачивание, эквивалентное чис
характеристик экологической ниши, содовых
лу входящих протонов во внутреннее простран
озер, в которых эти организмы обитают. Уни
ство клеток со стехиометрией 2H+/e- [11]. Эти
кальность содовых озер по сравнению с солевы
результаты позволили нам предположить, что
ми озерами состоит в том, что они характеризу
протоны входят внутрь клеток как противоионы
ются более щелочными показателями рН
в ответ на откачку ионов Na+ из клеток T. versu
(9,2-11,0) при близких к насыщающим конце
tus cbb3 оксидазой. Функционирование на кон
нтрациям ионов натрия (до 4 М) с преоблада
це дыхательной цепи T. versutus первичного
нием карбонатных солей натрия [8]. Столь спе
Na+ насоса, предсказанного в обсуждаемой ра
цифические условия, по видимому, стали дви
боте по данным косвенного метода [11], позднее
жущей силой приобретения обитателями таких
было экспериментально доказано прямым ме
водоемов ряда особых признаков [51], таких как
тодом с радиоактивным изотопом 22Na [4]. Такое
функционирование Na+ насоса с оптимумом
различие в ионной специфичности, как у высо
при рН 9,5 на конце аэробной дыхательной це
когомологичных ЦО cbb3 типа, известно и у
пи [4] и крайне высокое абсолютное значение
других энергопреобразующих комплексов. По
электрического потенциала на мембранах, сос
казано, что достаточно замены 1-3 аминокис
тавляющее более -230 мВ [52] и превосходящее
лотных остатков для изменения функции с Na+
значение -180 мВ у алкалифильных видов
на H+ перекачивающую или с H+ на Na+ пере
Bacillus [53, 54]. И так же, как и у алкалифилов
качивающую в таких первичных ионных насо
из других щелочных ниш, у T. versutus можно
сах, как ATPазы F0F1 типа [40-42], протеоро
отметить повышенное содержание цитохромов
допсины [43, 44], и с Na+/H+ перекачивающей
группы b и c [55, 56] и преобладание отрица
на Na+ перекачивающую в пирофосфатазах
тельно заряженных остатков в полипептидных
[45, 46]. Отдельного обсуждения заслуживают
цепях ЦО, описанное у экстремально алкали
данные, полученные группой Webster et al., о
фильных видов Bacillus [53, 54]. Из данных, по
транспорте ионов Na+ с участием хинолоксида
лученных в настоящей работе, следует, что в ус
зы bo типа из бактерии Vitreoscilla [47, 48]. Про
ловиях высокощелочной среды обитания
веденный нами подробный анализ этих данных
(рН 9,5-11,0), когда физиологические значе
показал, что отсутствие теста с протонофором
ния pH внутри клеток алкалифилов находятся в
разобщителем на системе, в которой была
пределах 7,5-9,0 [57], поверхность комплекса
экспрессирована оксидаза bo типа [49], не поз
cbb3 оксидазы в клетках T. versutus со стороны
воляет однозначно сделать вывод о ионной спе
цитоплазмы заряжена положительно (представ
цифичности этого насоса и не исключает вто
лена в основном поверхностью субъединицы
ричный характер транспорта ионов Na+. Опи
CcoN), а со стороны периплазмы - отрицатель
санное в этих работах явление можно было бы
но (представлена в основном гидрофильными
объяснить активностью Na+/H+ антипортера,
доменами субъединиц CcoO и CcoP). Таким об
работающего в паре с первичным H+ насо
разом, по сравнению с ферментами гомолога
сом - оксидазой bo типа, а не самой оксидазой
ми из организмов, обитающих в нейтральных и
bo типа [4]. Позднее экспериментальные иссле
умеренно щелочных ареалах, у комплекса cbb3
дования Graf et al. показали, что оксидаза bo ти
оксидазы T. versutus должен создаваться более
па из Vitreoscilla действительно является строгим
низкий редокс потенциал кофакторов, предс
H+ насосом и не перекачивает ионы Na+ [50].
тавленных гемами С в гидрофильных доменах
Таким образом, описанная нами ЦО cbb3 типа у
субъединиц CcoO и CcoP на P стороне мемб
представителей рода Thioalkalivibrio является
ран. Можно предполагать, что такая особен
первым доказанным первичным Na+ насосом,
ность, которая наблюдается и у алкалифильных
функционирующим на конце аэробной дыха
бактерий рода Bacillus [53, 58], должна повы
тельной цепи.
шать эффективность передачи электронов от
Нужно отметить, что в течение долгого вре
гемов С субъединиц CcoP и CcoO в активный
мени, до появления публикации в 2015 г. [4],
центр фермента и приводить к созданию эконо
убедительные доказательства наличия Na+ пе
мичной модели преобразователя энергии. Та
рекачивающей активности в комплексе IV в ли
ким образом, Na+ перекачивающая ЦО T. ver
тературе отсутствовали. Вероятно, причина
sutus как по функции, так и по строению демон
БИОХИМИЯ том 85 вып. 12 2020
СВОЙСТВА Na+ ПЕРЕКАЧИВАЮЩЕЙ ЦИТОХРОМОКСИДАЗЫ
1925
стрирует приспособленность к экстремально
дования (проекты 02 04 49107 а, 05 04 49504 а),
щелочным условиям.
исследование белков (проект 20 04 01105 а).
Наши исследования подтвердили гипотезу
Благодарности. Авторы выражают благодар
академика В.П. Скулачева о функционирова
ность В.П. Скулачеву за постоянное внимание к
нии Na+ перекачивающего преобразователя
работе и плодотворное обсуждение результатов,
энергии на концевом отрезке КР ЭТЦ у экстре
Н.В. Поздняковой за помощь в работе с живот
мально алкалифильных организмов. В настоя
ными.
щей работе впервые показано, что такой Na+
Конфликт интересов. Авторы не имеют
насос имеет особые свойства, позволяющие ор
конфликта интересов в финансовой или каких
ганизмам хозяевам эффективно запасать энер
либо иных сферах деятельности.
гию в условиях экстремально высоких значений
Соблюдение этических норм. Уход за кроли
рН и концентрации солей, когда протон дви
ками и их использование в экспериментах осу
жущая сила на мембранах этих организмов
ществляли в соответствии с протоколами, раз
низка.
работанными и утвержденными Комитетом по
этике работы с животными в Институте физи
ко химической биологии им. А.Н. Белозерско
Финансирование. Исследования выполнены
го. Все процедуры выполняли в соответствии с
при финансовой поддержке Российского фонда
принципами Федерации сообществ по научным
фундаментальных исследований в течение нес
исследованиям с лабораторными животны
кольких проектных периодов: геномные иссле
ми (FELASA).
СПИСОК ЛИТЕРАТУРЫ
1.
Tokuda, H., and Unemoto, T. (1984) Na+ is translocated at
11. Грищук Ю. В., Мунтян М. С., Попова И. В., Соро
NADH: quinone oxidoreductase segment in the respirato
кин Д. Ю. (2003) Транспорт ионов, сопряженный с ра
ry chain of Vibrio alginolyticus, J. Biol. Chem., 259, 7785
ботой терминальной оксидазы экстремально щелоче
7790.
любивой солеустойчивой бактерии рода Thioalkalivibrio,
2.
Skulachev, V. P. (1992) The laws of cell energetics, Eur. J.
Биохимия, 68, 477 483.
Biochem.,
208,
203209, doi:
10.1111/j.1432 1033.
12. Sorokin, D. Y., Muntyan, M. S., Toshchakov, S. V.,
1992.tb17175.x.
Korzhenkov, A., and Kublanov, I. V. (2018) Phenotypic
3.
Skulachev, V. P. (1984) Sodium bioenergetics, Trends
and genomic properties of a novel deep lineage haloalka
Biochem. Sci.,
9,
483485, doi:
10.1016/0968
liphilic member of the phylum Balneolaeota from soda
0004(84)90317 7.
lakes possessing Na+ translocating proteorhodopsin,
4.
Muntyan, M. S., Cherepanov, D. A., Malinen, A. M.,
Front. Microbiol., 9, 2672, doi: 10.3389/fmicb.2018.02672.
Bloch, D. A., Sorokin, D. Y., et al. (2015) Cytochrome
13. Sorokin, D. Y., Lysenko, A. M., Mityushina, L. L.,
cbb3 of Thioalkalivibrio is a Na+ pumping cytochrome oxi
Tourova, T. P., Jones, B. E., et al. (2001) Thioalkalimicro
dase, Proc. Natl. Acad. Sci. USA, 112, 76957700,
bium aerophilum gen. nov., sp. nov. and Thioalkalimicro
doi: 10.1073/pnas.1417071112.
bium sibericum sp. nov., and Thioalkalivibrio versutus gen.
5.
Gribaldo, S., Talla, E., and Brochier Armanet, C. (2009)
nov., sp. nov., Thioalkalivibrio nitratis sp. nov., novel and
Evolution of the haem copper oxidases superfamily: a root
Thioalkalivibrio denitrificancs sp. nov., novel obligately
ing tale, Trends Biochem. Sci., 34, 375 381, doi: 10.1016/
alkaliphilic and obligately chemolithoautotrophic sulfur
j.tibs.2009.04.002.
oxidizing bacteria from soda lakes, Int. J. Syst. Evol.
6.
Saraste, M., and Castresana, J. (1994) Cytochrome oxidase
Microbiol., 51, 565 580, doi: 10.1099/00207713 51 2 565.
evolved by tinkering with denitrification enzymes, FEBS
14. Thompson, J. D., Higgins, D. G., and Gibson, T. J. (1994)
Lett., 341, 1 4, doi: 10.1016/0014 5793(94)80228 9.
CLUSTAL W: Improving the sensitivity of progressive mul
7.
Buschmann, S., Warkentin, E., Xie, H., Langer, J. D.,
tiple sequence alignment through sequence weighting, posi
Ermler, U., and Michel, H. (2010) The structure of cbb3
tionspecific gap penalties and weight matrix choice, Nucleic
cytochrome oxidase provides insights into proton pump
Acids Res., 22, 4673 4680, doi: 10.1093/nar/22.22.4673.
ing, Science, 329, 327 330, doi: 10.1126/science.1187303.
15. Muntyan, M. S., and Skripnikova, E. V. (1993) Two types
8.
Sorokin, D. Y., Banciu, H., Robertson, L. A., Kuenen,
of terminal oxidase in alkalotolerant Bacillus FTU,
J. G., Muntyan, M. S., and Muyzer, G. (2013) Halophilic
Biochim. Biophys. Acta, 1143, 142 146, doi: 10.1016/0005
and haloalkaliphilic sulfur oxidizing bacteria, in The
2728(93)90136 4.
Prokaryotes: Prokaryotic Physiology and Biochemistry,
16. Schägger, H., and von Jagow, G. (1987) Tricine sodium
(Rosenberg, E., DeLong, E., Lory, S., Stackebrandt, E.,
dodecyl sulfate polyacrylamide gel electrophoresis for the
and Thompson, F., eds) Springer, Berlin, Heidelberg,
separation of proteins in the range from 1 to 100 kDa, Anal.
pp. 529 554, doi: 10.1007/978 3 642 30141 4_77.
Biochem., 166, 368 379, doi: 10.1016/0003 2697(87)90587 2.
9.
Malinen, A. M., Belogurov, G. A., Baykov, A. A., and
17. Davis, B. J. (1964) Disk electrophoresis - II. Method and
Lahti, R. (2007) Na+ pyrophosphatase: a novel primary
application to human serum proteins, Ann. N. Y. Acad.
sodium pump, Biochemistry, 46, 8872 8878, doi: 10.1021/
Sci., 121, 404 427.
bi700564b.
18. Thomas, P.E., Ryan, D., and Levin, W. (1976) An
10.
Li, H., Sineshchekov, O. A., da Silva, G. F., and Spudich,
improved staining procedure for the detection of the perox
J. L. (2015) In vitro demonstration of dual light driven
idase activity of cytochrome P 450 on sodium dodecyl sul
Na+/H+ pumping by a microbial rhodopsin, Biophys. J.,
fate polyacrylamide gels, Anal. Biochem., 75, 168 176,
109, 1446 1453, doi: 10.1016/j.bpj.2015.08.018.
doi: 10.1016/0003 2697(76)90067 1.
БИОХИМИЯ том 85 вып. 12 2020
1926
МУНТЯН и др.
19.
Muntyan, M. S., Bloch, D. A., Ustiyan, V. S., and
33.
Sorokin, D. Y., Cherepanov, A., de Vries, S., and Kuenen,
Drachev, L. A. (1993) Kinetics of CO binding to H+
G. J. (1999) Identification of cytochrome c oxidase in the
motive oxidases of the caa3 type from Bacillus FTU and of
alkaliphilic, obligately chemolithoautotrophic, sulfur oxi
the o type from Escherichia coli, FEBS Lett., 327, 351 354,
dizing bacterium ‘Thioalcalomicrobium aerophilum’strain
doi: 10.1016/0014 5793(93)81019 V.
AL 3, FEMS Microbiol. Lett., 179, 91 99, doi: 10.1016/
20.
Towbin, H., Staehelin, T., and Gordon, J.
(1979)
S0378 1097(99)00398 5.
Electrophoretic transfer of proteins from polyacrylamide
34.
Tsukita, S., Koyanagi, S., Nagata, K., Koizuka, H.,
gels to nitrocellulose sheets: procedure and some applica
Akashi, H., Shimoyama, T., Tamura, T., and Sone, N.
tions, Proc. Natl. Acad. Sci. USA,
76,
43504354,
(1999) Characterization of a cb type cytochrome c oxidase
doi: 10.1073/pnas.76.9.4350.
from Helicobacter pylori, J. Biochem., 125, 194201,
21.
Гринкевич В. А., Лысенко А. М., Мунтян М. С.,
doi: 10.1093/oxfordjournals.jbchem.a022259.
Скрипникова Е. В., Африкян Э. К. (1997) Идентифи
35.
Urbani, A., Gemeinhardt, S., Warne, A., and Saraste, M.
кация штамма Bacillus sp. FTU и изучение гомологии
(2001) Properties of the detergent solubilised cytochrome c
оксидаз сaa3 типа, Биохимия, 62, 842 849.
oxidase (cytochrome cbb3) purified from Pseudomonas
22.
Waterhouse, A., Bertoni, M., Bienert, S., Studer, G.,
stutzeri, FEBS Lett., 508, 29 35, doi: 10.1016/S0014
Tauriello, G., et al. (2018) SWISS MODEL: homology
5793(01)03006 X.
modelling of protein structures and complexes, Nucleic
36.
Granados Baeza, M. J., Gómez Hernández, N., Mora, Y.,
Acids Res., 46, W296 W303, doi: 10.1093/nar/gky427.
Delgado, M. J., Romero, D., and Girard, L. (2007) Novel
23.
Gasteiger, E., Hoogland, C., Gattiker, A., Duvaud, S.,
reiterated Fnr type proteins control the production of the
Wilkins, M. R., Appel, R. D., Bairoch, A. (2005) Protein
symbiotic terminal oxidase cbb3 in Rhizobium etli CFN42,
identification and analysis tools on the ExPASy server, in
Mol. Plant Microbe Interact., 20, 1241 1249, doi: 10.1094/
The Proteomics Protocols Handbook (Walker, J. M., ed.)
MPMI 20 10 1241.
Humana Press, Totowa, New Jersey, pp.
571607,
37.
De Gier, J. W. L., Lübben, M., Reijnders, W. N., Tipker,
doi: 10.1385/1 59259 890 0:571.
C. A., Slotboom, D. J., van Spanning, R. J.,
24.
Toledo Cuevas, M., Barquera, B., Gennis, R. B.,
Stouthamer, A. H., and van der Oost, J. (1994) The termi
Wikström, M., and Garc a Horsman, J. A. (1998) The
nal oxidases of Paracoccus denitrificans, Mol. Microbiol.,
cbb3 type cytochrome c oxidase from Rhodobacter
13, 183 196, doi: 10.1111/j.1365 2958.1994.tb00414.x.
sphaeroides, a proton pumping heme copper oxidase,
38.
Raitio, M., and Wikström, M. (1994) An alternative
Biochim. Biophys. Acta, 1365, 421 434, doi: 10.1016/
cytochrome oxidase of Paracoccus denitrificans functions as
S0005 2728(98)00095 4.
a proton pump, Biochim. Biophys. Acta, 1186, 100 106,
25.
Myllykallio, H., and Liebl, U. (2000) Dual role for
doi: 10.1016/0005 2728(94)90140 6.
cytochrome oxidase in clinically relevant proteobacteria,
39.
Arslan, E., Kannt, A., Thöny Meyer, L., and
Trends Microbiol., 8, 542543, doi: 10.1016/S0966
Hennecke, H. (2000) The symbiotically essential cbb3 type
842X(00)91831 6.
oxidase of Bradyrhizobium japonicum is a proton pump,
26.
Garcia Horsman, J. A., Berry, E., Shapleigh, J. P., Alben,
FEBS Lett., 470, 7 10, doi: 10.1016/S0014 5793(00)01277 1.
J. O., and Gennis, R. B. (1994) A novel cytochrome c oxi
40.
Kaim, G., and Dimroth, P. (1995) A double mutation in
dase from Rhodobacter sphaeroides that lacks CuA,
subunit c of the Na+ specific F1F0 ATPase of Propioni
Biochemistry, 33, 3113 3119, doi: 10.1021/bi00176a046.
genium modestum results in a switch from Na+ to H+ cou
27.
Gray, K.A., Grooms, M., Myllykallio, H., Moomaw, C.,
pled ATP synthesis in the Escherichia coli host cells, J. Mol.
Slaughter, C., and Daldal, F. (1994) Rhodobacter capsula
Biol., 253, 726 738, doi: 10.1006/jmbi.1995.0586.
tus contains a novel cb type cytochrome c oxidase without
41.
Kaim, G., Wehrle, F., Gerike, U., and Dimroth, P. (1997)
a CuA center, Biochemistry, 33, 3120 3127, doi: 10.1021/
Molecular basis for the coupling ion selectivity of F1F0 ATP
bi00176a047.
synthases: probing the liganding groups for Na+ and Li+ in
28.
Rauhamäki, V., Bloch, D. A., and Wikström, M. (2012)
the c subunit of the ATP synthase from Propionigenium
Mechanistic stoichiometry of proton translocation by
modestum, Biochemistry, 36, 9185 9194, doi: 10.1021/
cytochrome cbb3, Proc. Natl. Acad. Sci. USA, 109, 7286
bi970831q.
7291, doi: 10.1073/pnas.1202151109.
42.
Dimroth, P. (2000) Operation of the F0 motor of the ATP
29.
Thöny Meyer, L., Beck, C., Preisig, O., and Hennecke, H.
synthase, Biochim. Biophys. Acta,
1458,
374386,
(1994) The ccoNOQP gene cluster codes for a cb type
doi: 10.1016/s0005 2728(00)00088 8.
cytochrome oxidase that functions in aerobic respiration of
43.
Inoue, K., Ono, H., Abe Yoshizumi, R., Yoshizawa, S.,
Rhodobacter capsulatus, Mol. Microbiol., 14, 705 716,
Ito, H., Kogure, K., and Kandori, H. (2013) A light driven
doi: 10.1111/j.1365 2958.1994.tb01308.x.
sodium ion pump in marine bacteria, Nat. Commun., 4, 1
30.
Zeilstra Ryalls, J.H., Gabbert, K., Mouncey, N. J.,
10, doi: 10.1038/ncomms2689.
Kaplan, S., and Kranz, R. G. (1997) Analysis of the fnrL
44.
Mamedov, M.D., Mamedov, A.M., Bertsova, Y.V., and
gene and its function in Rhodobacter capsulatus,
Bogachev, A.V. (2016) A single mutation converts bacterial
J. Bacteriol., 179, 7264 7273, doi: 10.1128/jb.179.23.7264
Na+ transporting rhodopsin into an H+ transporter, FEBS
7273.1997.
Lett., 590, 2827 2835. doi: 10.1002/1873 3468.12324.
31.
Preisig, O., Zufferey, R., Thöny Meyer, L., Appleby, C. A.,
45.
Luoto, H. H., Baykov, A. A., Lahti, R., Malinen, A. M.
and Hennecke, H. (1996) A high affinity cbb3 type
(2013) Membrane integral pyrophosphatase subfamily
cytochrome oxidase terminates the symbiosis specific
capable of translocating both Na+ and H+, Proc. Natl.
respiratory chain of Bradyrhizobium japonicum,
Acad. Sci. USA, 110, 12551260, doi: 10.1073/pnas.
J. Bacteriol., 178, 1532 1538, doi: 10.1128/jb.178.6.1532
1217816110.
1538.1996.
46.
Luoto, H. H., Nordbo, E., Baykov, A. A., Lahti, R., and
32.
Zufferey, R., Arslan, E., Thöny Meyer, L., and
Malinen, A. M. (2013) Membrane Na+ pyrophosphatases
Hennecke, H. (1998) How replacements of the 12 con
can transport protons at low sodium concentrations, J. Biol.
served histidines of subunit I affect assembly, cofactor bind
Chem., 288, 35489 35499, doi: 10.1074/jbc.M113.510909.
ing, and enzymatic activity of the Bradyrhizobium japon
47.
Efiok, B. J., Webster, D. A. (1990) A cytochrome that can
icum cbb3 type oxidase, J. Biol. Chem., 273, 6452 6459,
pump sodium ion, Biochem. Biophys. Res. Commun., 173,
doi: 10.1074/jbc.273.11.6452.
370 375, doi: 10.1016/s0006 291x(05)81067 8.
БИОХИМИЯ том 85 вып. 12 2020
СВОЙСТВА Na+ ПЕРЕКАЧИВАЮЩЕЙ ЦИТОХРОМОКСИДАЗЫ
1927
48.
Chung, Y. T., Stark, B. C., and Webster, D. A. (2006) Role
54. Krulwich, T. A., and Ito, M. (2013) Alkaliphilic prokary
of Asp544 in subunit I for Na+ pumping by Vitreoscilla
otes, in The prokaryotes - Prokaryotic Communities and
cytochrome bo, Biochem. Biophys. Res. Commun., 348,
Ecophysiology (Rosenberg, E., DeLong, E. F., Lory,
1209 1214, doi: 10.1016/j.bbrc.2006.07.184.
S., Stackebrandt, E., and Thompson, F., eds) Springer,
49.
Efiok, B. J., and Webster, D. A. (1990) Respiratory driven
Berlin, Heidelberg, pp. 441 469, doi: 10.1007/978 3 642
Na+ electrical potential in the bacterium Vitreoscilla,
30123 0_58.
Biochemistry, 29, 4734 4739, doi: 10.1021/bi00471a030.
55. Lewis, R. J., Belkina, S., and Krulwich, T. A. (1980)
50.
Graf, S., Brzezinski, P., and von Ballmoos, C. (2019) The
Alkalophiles have much higher cytochrome contents than
proton pumping bo oxidase from Vitreoscilla, Sci. Rep., 9,
conventional bacteria and than their own non alkalophilic
4766, doi: 10.1038/s41598 019 40723 2.
mutant derivatives, Biochem. Biophys. Res. Commun., 95,
51.
Banciu, H. L., and Muntyan, M. S. (2015) Adaptive strate
857 863, doi: 10.1016/0006 291x(80)90866 9.
gies in the double extremophilic prokaryotes inhabiting
56. Мунтян М. С., Попова И. В., Блох Д. А., Скрипнико
soda lakes, Curr. Opin. Microbiol., 25, 73 79, doi: 10.1016/
ва Е. В., Устиян B. C. (2005). Энергетика щелочелюби
j.mib.2015.05.003.
вых представителей рода Bacillus, Биохимия, 70, 171
52.
Мунтян М. С., Морозов Д. А., Клишин С. С., Хитрин Н.В.,
176.
Коломийцева Г. Я. (2012) Измерение электрического по
57. Krulwich, T. A., Ito, M., and Guffanti, A. A. (2001) The
тенциала на мембранах экстремально щелочелюбивых
Na+ dependence of alkaliphily in Bacillus, Biochim.
бактерий рода Thioalkalivibrio, Биохимия, 77, 1113 1121.
Biophys. Acta,
1505,
158168, doi:
10.1016/s0005
53.
Krulwich, T. A., Liu, J., Morino, M., Fujisawa, M.,
2728(00)00285 1.
Ito, M., and Hicks, D. B. (2011) Adaptive mechanisms of
58. Мунтян М. С., Блох Д. А. (2008) Измерение среднето
extreme alkaliphiles, in Extremophiles handbook
чечного окислительно восстановительного потенциа
(Horikoshi, K., Antranikian, G., Bull, A. T., Robb, F. T.,
ла ковалентно связанного цитохрома с в терминаль
and Stetter, K. O., eds) Springer, Tokyo, pp. 119 139,
ной оксидазе алкалофильной бактерии Bacillus рseud
doi: 10.1007/978 4 431 53898 1_2.6.
ofirmus FTU, Биохимия, 73, 131 136.
IDENTIFICATION OF THE Na+ PUMPING CYTOCHROME OXIDASE
IN MEMBRANES OF EXTREMELY ALKALIPHILIC BACTERIA Thioalkalivibrio
M. S. Muntyan1*, D. A. Morozov1, Y. F. Leonova2, and T. V. Ovchinnikova2
1 Belozersky Institute of Physico Chemical Biology, Lomonosov Moscow State University,
119991 Moscow, Russia; E mail: muntyan@genebee.msu.ru
2 Shemyakin-Ovchinnikov Institute of Bioorganic Chemistry, Russian Academy of Sciences, 117997 Moscow, Russia
Received July 26, 2020
Revised September 1, 2020
Accepted September 1, 2020
For the first time, the functioning of the oxygen reductase Na+ pump (Na+ pumping cytochrome c oxidase of the
cbb3 type) was demonstrated by examining the respiratory chain of the extreme alkaliphilic bacterium Thioalkalivibrio
versutus [Muntyan, M. S., et al. (2015) Cytochrome cbb3 of Thioalkalivibrio is a Na+ pumping cytochrome oxidase,
Proc. Natl. Acad. Sci. USA, 112, 7695 7700], a product of the ccoNOQP operon. In this study, we detected and iden
tified this enzyme using rabbit polyclonal antibody against the predicted C terminal amino acid sequence of its cat
alytic subunit. We found that the this cbb3 type oxidase is synthesized in bacterial cells, where it is located in the mem
branes. The 48 kDa oxidase subunit (CcoN) is catalytic, while subunits CcoO and CcoP with molecular masses of 29
and 34 kDa, respectively, are cytochromes c. The theoretical pI values of the CcoN, CcoO, and CcoP subunits were
determined. It was shown that parts of the CcoO and CcoP subunits exposed to the aqueous phase on the cytoplas
mic membrane P side are enriched with negatively charged amino acid residues, in contrast to the parts of the inte
gral subunit CcoN adjacent to the aqueous phase. Thus, the Na+ pumping cytochrome c oxidase of T. versutus, both
in function and in structure, demonstrates adaptation to extremely alkaline conditions.
Keywords: Na+ pump, cytochrome c oxidase, extremophily, alkaliphily, cbb3 type oxidase
БИОХИМИЯ том 85 вып. 12 2020