БИОХИМИЯ, 2020, том 85, вып. 3, с. 307 - 323
УДК 577.1
МЕТАБОЛИЧЕСКАЯ РЕГУЛЯЦИЯ ДИФФЕРЕНЦИРОВКИ
СТВОЛОВЫХ КЛЕТОК МЛЕКОПИТАЮЩИХ
Обзор
© 2020
П.А. Тюрин#Кузьмин1*, А.Ю. Молчанов2,
В.И. Чечехин1, А.М. Иванова1, К.Ю. Кулебякин1
1 Московский государственный университет им. М.В. Ломоносова, факультет фундаментальной медицины,
119991 Москва, Россия; электронная почта: tyurinkuzmin.p@gmail.com
2 Московский государственный университет им. М.В. Ломоносова,
биологический факультет, 119234 Москва, Россия
Поступила в редакцию 28.10.2019
После доработки 19.01.2020
Принята к публикации 19.01.2020
Формирование нормальной структуры ткани, поддержание ее гомеостаза и восстановление после повреж
дений требуют пролиферации и дифференцировки стволовых клеток. Отличительной особенностью дан
ных клеток является уникальная организация метаболических путей, при которой вклад различных путей
получения энергии в общий клеточный метаболизм кардинальным образом отличается от такового у диф
ференцированных клеток. При этом изменение организации метаболизма при дифференцировке как эм
бриональных, так и постнатальных стволовых клеток обладает целым рядом закономерностей. Более того,
изменение метаболизма стволовых клеток является не просто следствием дифференцировки, но и актив
ным регулятором этого процесса. Метаболические ферменты и интермедиаты регулируют и направляют
процессы поддержания клеток в стволовом состоянии, их самообновления и дифференцировки. В данном
обзоре рассмотрены закономерности и молекулярные механизмы переключения метаболизма стволовых
клеток по мере их перехода из плюрипотентного состояния в дифференцированные клетки. Особый упор
сделан на то, как протекающие в клетках метаболические процессы регулируют их функции, способность к
дифференцировке и выбор конкретного направления развития стволовых клеток.
КЛЮЧЕВЫЕ СЛОВА: метаболизм, плюрипотентные стволовые клетки, мезенхимные стволовые клетки,
гликолиз, окислительное фосфорилирование.
DOI: 10.31857/S0320972520030021
Процесс дифференцировки стволовых кле
ность развиться в полноценный организм. Да
ток является основой индивидуального разви
лее в процессе эмбрионального развития проис
тия, а также процессов поддержания гомеостаза
ходит деление, рост и специализация клеточных
и обновления тканей взрослого организма.
популяций. Смена стадий в ходе эмбрионально
Клетками, обладающими всей полнотой прог
го развития подразумевает увеличение числа
раммы развития, т.е. наиболее универсальными
клеток организма и появление у них новых ка
стволовыми клетками (СК), можно считать зи
честв, необходимых для выполнения задач и
готу и бластомеры после первого деления зиго
функций формирующихся органов. По мере
ты. Однако уже после нескольких делений блас
роста эмбриона, наряду с формированием раз
томеры морулы млекопитающих теряют способ
нообразных структур, не существовавших на
предыдущих этапах, происходит ограничение
возможностей дифференцировки клеток. Диф
Принятые сокращения: АФК - активные формы
кислорода, АцКоА - ацетил кофермент А, СК - стволо
ференцировка СК сопровождается существен
вые клетки, ГСК - гематопоэтические стволовые клетки,
ным изменением особенностей протекания ме
МСК - мезенхимные стволовые клетки или мультипотент
таболических процессов, причем эти изменения
ные мезенхимные стромальные клетки, ПСК - плюрипо
носят закономерный характер. В то же время
тентные стволовые клетки, ПДК - пируватдегидрогеназ
ный комплекс, ЦТК - цикл трикарбоновых кислот,
метаболические ферменты и ключевые участни
ЭпиСК - праймированные мышиные ПСК, ЭСК - эм
ки метаболических путей, такие как NADH или
бриональные стволовые клетки.
ацетил кофермент А (АцКоА), играют ключе
* Адресат для корреспонденции.
вую роль в регуляции процессов поддержания
307
308
ТЮРИН КУЗЬМИН и др.
клеток в стволовом состоянии (стволовости),
ши, о которых будет сказано ниже, мы во всех
самообновления и дифференцировки стволо
случаях конкретизируем, какой тип клеток име
вых клеток. Это позволяет рассматривать мета
ется в виду - человеческие (чЭСК) или мыши
болические процессы, как отдельную регуля
ные (мЭСК). После разделения на зародышевые
торную систему, определяющую участие СК в
листки стволовые клетки становятся мультипо
формировании ткани и поддержании ее гомеос
тентными, поскольку способны дифференциро
таза.
ваться только в границах одного зародышевого
В данном обзоре мы сфокусировались на
листка. Плюрипотентные стволовые клетки
описании закономерностей изменения ключе
(ПСК), выделенные из эмбрионов мышей, су
вых метаболических путей получения клетками
ществуют в двух функционально различных со
энергии - путей катаболизма глюкозы, углерод
стояниях. ПСК, полученные из внутренней кле
ных скелетов аминокислот и жирных кислот - в
точной массы эмбрионов до имплантации,
процессе перехода клетки из состояния плюри
представляют собой наивные ПСК (naive PSC,
потентности в дифференцированное состояние.
mESC, или мЭСК). Клетки, полученные из
На каждом этапе мы рассматривали метаболизм
эпибласта мыши после имплантации эмбриона,
одного конкретного типа стволовых клеток. Из
получили название праймированные (primed
множества СК взрослого организма мы взяли в
PSC, EpiSC или ЭпиСК). Между ними сущест
качестве примера по одному наиболее хорошо
вует особое функциональное состояние ПСК,
изученному примеру тканеспецифичных ство
именуемое формативные ПСК (formative PSC,
ловых клеток (гематопоэтические стволовые
Epi like cells, EpiLC) [3]. И наивные, и форма
клетки (ГСК)) и мультипотентных стромальных
тивные, и праймированные ПСК способны к
клеток (МСК) соответственно.
неограниченному росту, дифференцировке в
клетки всех трех зародышевых листков in vitro и
in vivo на иммунодефицитных животных, но от
ОБЩИЕ ЗАКОНОМЕРНОСТИ ИЗМЕНЕНИЯ
личаются в функциональном плане. Если наив
МЕТАБОЛИЗМА СТВОЛОВЫХ КЛЕТОК
ные ПСК мыши при подсадке в эмбрион, т.е. в
ПРИ ИХ ДИФФЕРЕНЦИРОВКЕ
условиях in vivo, дают полноценный химерный
организм с образованием всех типов клеток, в
Формирующиеся из зиготы клетки ранней
том числе половых, то у праймированных есть
морулы представляют собой тотипотентные
ограничения. Праймированные ПСК не коло
клетки - это клетки, которые могут дать начало
низируют эмбрион с образованием химерного
всем типам клеток зародыша и внезародыше
организма. Наивные и формативные ПСК, в от
вым органам (рис. 1). Сам зародыш преимуще
личие от праймированных, способны диффе
ственно развивается из клеток, которые нахо
ренцироваться в половые клетки. Метилирова
дятся внутри морулы (в случае мышиного эм
ние генома наивных ПСК существенно ниже
бриона - после 4 го деления, на 16 клеточной
праймированных, кроме того, различается уро
стадии) [1]. В процессе формирования бласто
вень экспрессии транскрипционных факторов
цисты, на стадии 64 клеток, единая популяция
регуляторов плюрипотентности Nanog, Klf4 и
разделяется на клетки внутренней клеточной
Oct4 (подробнее см. в обзоре Morgani et al. [3]).
массы и клетки трофобласта, после чего переход
Различается также и энергетический метабо
между этими клеточными типами невозможен
лизм наивных и праймированных ПСК, что бу
[2]. В процессе имплантации бластоцисты в
дет подробно разобрано ниже [4, 5].
матку из клеток трофобласта развивается хори
В организме взрослого человека постнаталь
он, а из клеток внутренней клеточной массы -
ные СК являются мультипотентными или уни
три зародышевых листка и связанные с ними
потентными. В последнем случае стволовая
внезародышевые органы (желточной мешок, ал
клетка способна к самообновлению и диффе
лантоис и амнион). На стадии бластоцисты и
ренцировке только в один определенный вид
имплантации эмбриональные клетки характе
клеток. Несколько упрощая, постнатальные СК
ризуют как плюрипотентные, поскольку они
можно разделить на два типа - тканеспецифич
могут дифференцироваться как в клетки всех
ные стволовые клетки и мультипотентные стро
трех зародышевых листков, так и в половые
мальные клетки (МСК, также альтернативно
клетки. Выделенные в культуру клетки внутрен
называемые мезенхимными стволовыми клет
ней клеточной массы бластоцисты обозначают
ками или мультипотентными мезенхимными
как эмбриональные стволовые клетки (ЭСК). В
стромальными клетками). Тканеспецифичные
связи с различием функциональных и метабо
СК способны к самообновлению и дифферен
лических свойств ЭСК, полученных из внутрен
цируются в один или несколько типов клеток
ней клеточной массы эмбрионов человека и мы
определенной ткани. Например, гематопоэти
БИОХИМИЯ том 85 вып. 3 2020
МЕТАБОЛИЧЕСКАЯ РЕГУЛЯЦИЯ СТВОЛОВЫХ КЛЕТОК
309
ческие СК дают начало всем клеткам крови, а
эпидермальные СК в течение всей жизни орга
низма дифференцируются в клетки эпидермиса.
МСК выявляются в большинстве тканей орга
низма и ключевыми их функциями является
формирование стромы органов и тканей, регу
ляция тканеспецифичных стволовых клеток и
дифференцировка в клетки мезенхимального
ряда, такие как кость, жир и хрящ. Что интерес
но, если ПСК являются очень быстро пролифе
рирующими клетками, то постнатальные СК по
большей части находятся в покоящемся состоя
нии, лишь изредка выходя из него для обновле
ния клеток ткани или в случае необходимости
репарации и/или регенерации повреждения [5].
Изначально особенности метаболизма СК
воспринимались исследователями просто как
побочный продукт условий их существования.
Действительно, зигота, морула и ранняя бласто
циста до имплантации в эндометрий синтезиру
ют ATP в основном за счет потребления лактата,
пирувата, аминокислот и жирных кислот, кото
рые они получают из окружающей среды (жид
кости полости матки). При этом тотипотентные
клетки, входящие на начальных этапах развития
в эмбрион, имеют достаточный доступ к кисло
роду, а ключевым катаболическим путем, служа
щим для синтеза ATP, для них является окисли
тельное фосфорилирование [5, 6]. Высокий уро
вень окислительного фосфорилирования харак
терен также и для наивных мЭСК, получаемых
из мышиных эмбрионов до их имплантации.
После имплантации и до развития плаценты
доступ кислорода к эмбриону снижен. Клетки
эмбриона переходят на анаэробный метабо
лизм, так же как и праймированные ПСК, выде
ляемые из эмбриона на этих стадиях [7]. Что ин
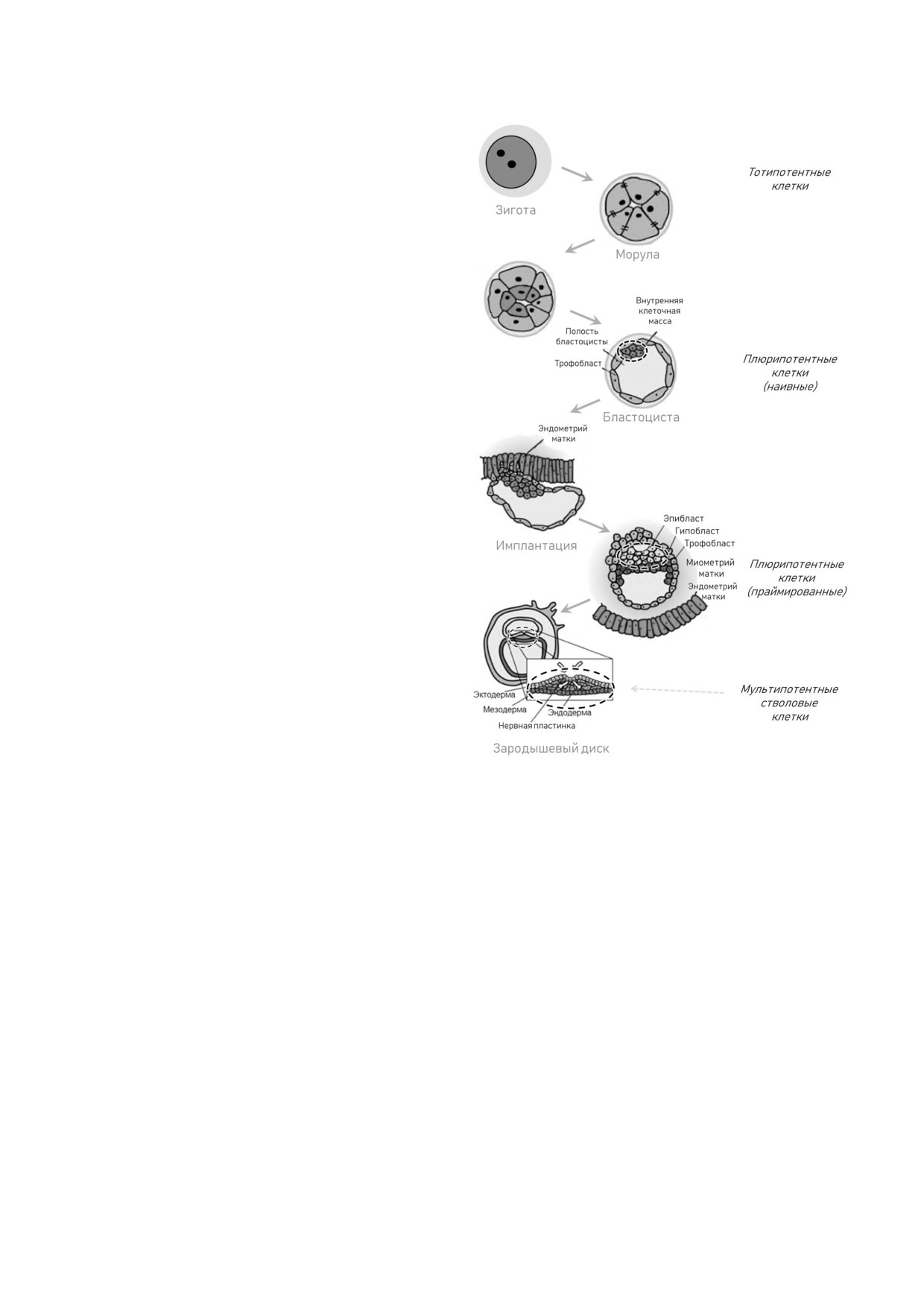
Рис. 1. Схематическое изображение начальных этапов
эмбрионального развития мыши. Пунктирными линиями
тересно, несмотря на то, что уровень окисли
отмечены области эмбриона, из которых выделяют стволо
тельного фосфорилирования в наивных ПСК
вые клетки, характеризующиеся различным потенциалом
выше, чем в праймированных, эти клетки, как и
дифференцировки
ПСК в целом, полагаются в основном на глико
литический путь получения ATP, а митохондрий
у них мало, они развиты слабо, и митохондри
питательных веществ ограничен [9, 10]. Общей
альный потенциал снижен по сравнению с диф
чертой постнатальных СК является высокая
ференцированными клетками [8]. Далее, по ме
роль гликолитического пути получения энер
ре развития плаценты, доступ кислорода к раз
гии.
вивающимся тканям и органам становится дос
таточным для аэробного дыхания. Клетки орга
низма по мере их дифференцировки все в боль
ПУТИ ВЛИЯНИЯ МЕТАБОЛИЗМА
шей степени переходят к окислительному фос
НА ФУНКЦИИ КЛЕТОК
форилированию как основному источнику ATP.
Во взрослом организме постнатальные СК рас
Общей закономерностью изменения метабо
полагаются в особом микроокружении в тканях,
лизма в процессе дифференцировки клеток яв
называемых нишами, в которых доступность
ляется переход от гликолиза, как основного ис
кислорода и питательных веществ может варьи
точника ATP, к окислительному фосфорилиро
ровать в широких пределах. Однако в целом в
ванию. В ходе окислительного фосфорилирова
большинстве типов ниш СК доступ кислорода и
ния пируват, получившийся в процессе глико
БИОХИМИЯ том 85 вып. 3 2020
310
ТЮРИН КУЗЬМИН и др.
Рис. 2. Участники метаболического пути получения энергии из глюкозы регулируют активность генов на эпигенетичес
ком и транскрипционном уровнях. Сокращения: αКГ - альфа кетоглутарат, АцКоА - ацетил кофермент А, ГАФД - D
глицеральдегид 3 фосфат дегидрогеназа, АФК - активные формы кислорода, ΔμH+ - трансмембранный электрохими
ческий потенциал митохондрий
лиза, входит в митохондрии и превращается там
тенциала - трансмембранного электрохимичес
в АцКоА благодаря работе пируватдегидроге
кого градиента протонов на внутренней мемб
назного комплекса (ПДК) с участием кофер
ране митохондрий. Конечным акцептором
мента NAD+, который восстанавливается до
электронов в дыхательной цепи является кисло
NADН. АцКоА входит в цикл трикарбоновых
род (рис. 2).
кислот (ЦТК, цикл Кребса, он же цикл лимон
Путь катаболизма глюкозы в клетках долгое
ной кислоты), где полностью окисляется до двух
время рассматривался в основном в призме ге
молекул СО2. При этом образуется дополни
нерации энергии ATP. В настоящее время пока
тельно три восстановленных молекулы NADН,
зан ряд других функций веществ-участников
одна FADН2 и одна молекула ATP или ГТФ. По
метаболических процессов. Они влияют на
лучившийся во всех этих реакциях NADН отда
функционирование СК и необходимы в процес
ет свои электроны в дыхательную цепь, где они,
се дифференцировки для синтеза строительных
проходя по цепи переноса электронов, дают
блоков. Кроме того, метаболические процессы
энергию для создания митохондриального по
эпигенетически регулируют экспрессию генов,
БИОХИМИЯ том 85 вып. 3 2020
МЕТАБОЛИЧЕСКАЯ РЕГУЛЯЦИЯ СТВОЛОВЫХ КЛЕТОК
311
влияя на выбор направления дифференцировки
ческие субстраты, такие как АцКоА, ATP,
СК. Внутриклеточный баланс метаболитов на
NADH и др. Таким образом, эти соединения
прямую влияет на эпигеном посредством пост
выступают в роли своеобразных метаболиче
трансляционных модификаций гистонов, ДНК
ских мессенджеров, способных обеспечивать
и транскрипционных факторов [5, 11] (рис. 2).
сопряжение транскрипционной клеточной
Например показано, что в некоторых случа
программы с уровнем активности основных ме
ях искусственное изменение баланса метаболи
таболических каскадов.
ческих путей может приводить к приобретению
Наиболее хорошо изученным на сегодняш
клетками фенотипа стволовых. К примеру, при
ний день механизмом воздействия на диффе
ангиогенезе капилляров эндотелий формирует 2
ренцировку клеток при участии метаболитов яв
типа клеток: верхушечную клетку, определяю
ляется регуляция эпигенетических модифика
щую процесс прорастания капилляра в ткани, и
ций гистонов и ДНК. Ацетилирование гистонов
клетки «ствола», формирующие стенки прорас
коррелирует с интенсивностью гликолиза. Пи
тающего капилляра. При этом поддержание
ровиноградная кислота превращается в АцКоА,
каждого из данных фенотипов определяется
который в виде цитрата выходит из митохон
тем, какие метаболические пути преобладают в
дрий, и в ядре разделяется на АцКоА и оксало
конкретной клетке. Верхушечная клетка капил
ацетат. АцКоА выступает донором ацетильной
ляра использует гликолиз как основной источ
группы для гистоновых ацетилаз [5]. Что инте
ник энергии, а клетки «ствола» используют
ресно, в отсутствие поступления глюкозы в
окислительное фосфорилирование. При этом в
клетку, когда основным донором АцКоА для
случае экспериментальной активации гликоли
ЦТК являются жирные кислоты, ацетилирова
за в клетках «ствола» достаточно быстро проис
ние гистонов не повышается [16]. Это может по
ходила их трансдифференцировка в новые вер
казаться странным, поскольку в митохондриях
хушечные клетки и формирование новых точек
точно так же образуется цитрат, а молекулы Ац
ветвления капилляров [12]. Таким образом, в
КоА не различаются в зависимости от источни
организме постоянно идут процессы клеточной
ка их синтеза. Этот феномен может быть объяс
дифференцировки и трансдифференцировки, в
нен тем, что оксалоацетат из ядра после высво
которых доступность субстратов, скорость про
бождения АцКоА не возвращается в митохон
дукции ATP и метаболитов обладает определяю
дрии, соответственно, ЦТК истощается на свои
щим действием на фенотип клеток.
интермедиаты. В случае поступления глюкозы в
Регуляция дифференцировки и дедиффе
клетку недостаток оксалоацетата может ком
ренцировки клеток при участии метаболитов
пенсироваться путем анаплеротических реак
может осуществляться через несколько специ
ций, связанных с активностью пируваткарбок
фических механизмов.
силазы, которая синтезирует оксалоацетат пу
1) Активация специфических транскрипци
тем карбоксилирования пирувата. В том же слу
онных факторов при изменении концентрации
чае, если источником АцКоА являются жирные
метаболитов. Например, уровень активности
кислоты, данный тип анаплеротических реак
транскрипционного фактора SREBP снижается
ций не работает, и цитрат не выходит из митохон
при накоплении в клетке жирных кислот [13],
дрий.
что может происходить при переходе клеток с
Деацетилирование гистонов осуществляется
окислительного фосфорилирования на глико
большой группой ферментов, называемых гис
лиз. В свою очередь, SREBP является важным
тон деацетилазы. Представители III класса гис
регулятором адипогенной дифференцировки
тон деацетилаз, также известные как белки сир
МСК [14].
туины, используют NAD+ для деацетилирова
2) Некоторые метаболические ферменты са
ния гистонов. В связи с этим их ферментативная
ми могут выступать в роли транскрипционных
активность зависит от уровня NAD+ в ядре, ко
факторов. Например, показано прямое участие
торый, по видимому, коррелирует с его уровнем
фермента гликолиза глицеральдегид 3 фосфат
в цитоплазме, а сами сиртуины рассматривают в
дегидрогеназы (ГАФД) в сборке транскрипци
качестве эндогенных сенсоров, регистрирую
онного комплекса, который регулирует тран
щих потенциал NAD+/NADН в клетке. Измене
скрипцию гена гистона Н2В во время S фазы
ния в метаболизме между преимущественно
клеточного цикла. Формирование этого ком
гликолитическим путем и окислительным фос
плекса ингибируется NADН и стимулируется
форилированием неизбежно приводят к изме
при повышении уровня NAD+ [15].
нению потенциала NAD+/NADН. Чем выше
3) Большинство ферментов, осуществляю
интенсивность гликолиза, тем большая доля
щих транскрипцию и ремоделирование хрома
NAD находится в восстановленном состоянии.
тина, требуют для своей активности метаболи
Повышение доли NAD+ в цитоплазме при пере
БИОХИМИЯ том 85 вып. 3 2020
312
ТЮРИН КУЗЬМИН и др.
ходе клетки к окислительному фосфорилирова
рования. Введение в кровоток мышей повышен
нию может регистрироваться сиртуинами и
ных концентраций глюкозы, глутамина или глу
конвертироваться ими в эпигенетические моди
тамата приводит к существенному увеличению
фикации гистонов и негистоновых белков, под
активности деметилазы TET в ряде органов [23].
вергающихся деацетилированию [5, 17, 18].
С другой стороны, если стволовая клетка пре
Деметилирование гистонов и ДНК осущест
бывает в условиях недостаточной доступности
вляется ферментами деметилазами. Лизин спе
глюкозы, активность деметилаз JmjC и TET мо
цифичная деметилаза (lysine specific demethylase
жет быть подавлена. Аналогично ситуации с
1, LSD1) осуществляет деметилирование гисто
ацетилированием гистонов при участии цитра
нов [19] с использованием FAD, который в про
та, если один из участников ЦТК выходит из не
цессе деметилирования восстанавливается до
го, эта утрата должна компенсироваться за счет
FADН2. Предполагается, что окислительно вос
анаплеротических реакций, которые в значи
становительный потенциал FAD/ FADН2 деме
тельной степени зависят от гликолиза. Таким
тилаз, который зависит от метаболического ста
образом, суммируя вышесказанное, метаболи
туса клетки, может влиять на эффективность де
ческие процессы, протекающие в конкретной
метилазной активности LSD1 [20]. Однако клю
стволовой клетке, а также доступность глюкозы
чевые метаболические реакции, в ходе которых
и кислорода для дыхания могут влиять на эпиге
происходит восстановление FADН2, а именно,
нетические процессы регуляции активности ге
окисление жирных кислот и реакции II комп
нов, как поддерживающих клетку в состоянии
лекса дыхательной цепи, происходят в митохо
стволовости, так и направляющих ее в диффе
ндриях. При этом гистон деметилаза работает в
ренцировку.
ядре. Учитывая, что FAD - это простетическая
группа фермента, которая не выходит из него
после совершения реакции, встает вопрос: ка
ПЛЮРИПОТЕНТНЫЕ
ким образом потенциал FAD/FADН2 из митохо
СТВОЛОВЫЕ КЛЕТКИ
ндрий транслируется в ядро. Вероятнее всего,
окислительно восстановительный потенциал
Плюрипотентность - это способность клет
FAD/FADН2 деметилаз отражает цитоплазмати
ки к формированию всех трех зародышевых
ческое соотношение NAD+/NADН. Таким обра
листков в процессе эмбрионального развития
зом, можно предположить участие метаболичес
организма или при дифференцировке в культу
ких ферментов в регуляции активности LSD1
ре. В более широком смысле, плюрипотентны
[5]. Этот фермент привлекает особое внимание
ми называются клетки, которые способны к са
исследователей, поскольку показано, что он вы
мообновлению и могут дифференцироваться в
зывает деметилирование гистонов и, как след
ткани, предшественники которых в эмбрио
ствие, ингибирование энхансерных регионов
нальном развитии происходят из разных заро
генов, критически важных для поддержания
дышевых листков. Как было сказано выше, если
стволовости ПСК. Это является одним из важ
ПСК из эмбрионов мыши могут выделяться на
ных шагов для успешного направления ПСК в
двух различных стадиях и, соответственно, на
дифференцировку [21]. Таким образом, окисли
ходиться в двух функциональных состояниях, в
тельно восстановительный потенциал FAD,
виде наивных и праймированных клеток, то
располагающегося в ферментах деметилазах,
чЭСК, выделенные из бластоцисты человека,
напрямую влияет на регуляцию направления
соответствуют праймированным мышиным
ПСК в дифференцировку. В то же время вопрос
ПСК, т.е. ЭпиСК. Как ЭпиСК, так и чЭСК об
о том, как он соотносится с соответствующим
ладают особенностями метаболизма, которые
потенциалом митохондрий и цитоплазмы, т.е. с
обусловлены этапами развития эмбриона на
метаболическим статусом клетки, требует даль
стадии плюрипотентности после его импланта
нейших исследований.
ции (рис. 3).
Ряд других деметилаз гистонов (JmjC) и
Первая отличительная черта праймирован
ДНК (TET) в качестве акцептора электронов в
ных ПСК - это преобладание гликолитического
оксилительно восстановительной реакции де
пути получения энергии над окислительным
метилирования используют альфа кетоглутарат
фосфорилированием [7, 24]. В ПСК гликолиз
(α КГ) [22, 23]. α КГ образуется в процессе про
занимает ключевую роль в общем энергетичес
хождения ЦТК, а также при дезаминировании
ком метаболизме. ПСК активно делятся и, в
аминокислот глутамата и глутамина. α КГ по
среднем, нуждаются в большем количестве
средством селективного переносчика может вы
энергии для своих синтетических процессов,
ходить из митохондрий и участвовать в окисли
чем дифференцированные клетки. При этом
тельно восстановительных реакциях деметили
гликолиз - намного менее энергетически эф
БИОХИМИЯ том 85 вып. 3 2020
МЕТАБОЛИЧЕСКАЯ РЕГУЛЯЦИЯ СТВОЛОВЫХ КЛЕТОК
313
Рис. 3. Схематическое изображение закономерностей изменения уровня гликолиза и окислительного фосфорилирования
при дифференцировке клеток из плюрипотентного состояния в дифференцированные клетки
фективный путь катаболизма глюкозы по срав
пролиферация. Это вторая причина, по которой
нению с окислительным фосфорилированием.
в ПСК наблюдается крайне высокая активность
При полном окислении глюкозы с участием
гликолиза, который играет ключевую роль не
окислительного фосфорилирования образуется
только в производстве энергии, но и в прохож
32-34 молекулы ATP на одну молекулу глюко
дении ускоренных биосинтетических процессов
зы, в гликолизе же - только 2 молекулы. Снача
в активно пролиферирующих клетках. Для ак
ла в раковых клетках, а потом в плюрипотент
тивной пролиферации требуется синтез боль
ных и некоторых постнатальных стволовых
шого количества нуклеотидов, фосфолипидов и
клетках (например, гематопоэтических) был об
аминокислот; некоторые клетки крайне актив
наружен эффект перехода метаболизма преиму
но синтезируют белки внеклеточного матрикса
щественно на гликолитический путь даже при
или сигнальные молекулы. Метаболические
высокой концентрации кислорода. При этом
процессы играют ключевую роль в образовании
подавляется окислительное фосфорилирование
строительных блоков для синтезов новых ве
и усиливается продукция лактата. Этот способ
ществ, требуемых для деления и дифференци
получения энергии получил название аэробного
ровки. Существенная часть субстратов для син
гликолиза или эффекта Варбурга по фамилии
теза всех этих молекул происходит из гликолиза
его первооткрывателя (рис. 4) [25, 26]. Предпо
и ЦТК (рис. 4). 3 Фосфоглицерат выводится из
лагается, что необходимость перехода на глико
гликолиза; АцКоА - после ПДК; оксалоацетат,
литический путь производства ATP связана со
цитрат, альфа кетоглутарат и сукцинил КоА
скоростью процесса: гликолиз, хотя и является
выводятся из ЦТК, и все это используется для
существенно более затратным путем, проходит
синтезов [28]. Для компенсации недостающих
намного быстрее, чем окислительное фосфори
компонентов цикла Кребса используются анап
лирование. Вследствие этого суммарный выход
леротические реакции, ключевой из которых
ATP в единицу времени оказывается выше [26].
является реакция пируваткарбоксилазы, кото
При дифференцировке ПСК идет переключе
рая из пирувата делает оксалоацетат. При этом
ние метаболических путей, происходит переход
цикл Кребса оказывается как бы разомкнутым.
от гликолиза к окислительному фосфорилиро
Крайне высокий уровень пролиферации в
ванию в качестве основного и более эффектив
ПСК характеризуется укороченным клеточным
ного пути образования энергии [27].
циклом. При этом по сравнению с дифференци
Клетки, переходящие на аэробный глико
рованными клетками существенно большая
лиз, отличаются крайне высокой скоростью
часть ПСК находится в S фазе [29]. В то же вре
пролиферации. Соответственно, второй отли
мя высокая пролиферативная активность ПСК
чительной чертой ПСК является их быстрая
не приводит к их выходу из состояния плюрипо
2 БИОХИМИЯ том 85 вып. 3 2020
314
ТЮРИН КУЗЬМИН и др.
Рис. 4. Изменение ключевых метаболических путей катаболизма глюкозы при активной пролиферации ПСК. В активно
пролиферирующих и синтезирующих клетках интермедиаты ЦТК выводятся из цикла и выступают в качестве предшест
венников синтезируемых веществ - аминокислот, гема, нуклеотидов и др. Недостаток участников ЦТК компенсируется
за счет анаплеротических реакций - превращения пирувата в оксалоацетат пируваткарбоксилазой и синтеза αКГ из глу
тамата и глутамина. Образующиеся при этом молекулы NADH утилизируются частично за счет окислительного фосфо
рилирования, частично - за счет работы разобщающего белка дыхательной цепи - uncoupling protein 2 (UCP2)
тентности благодаря способности к самообнов
акций и анаплеротическими реакциями
лению. Самообновление поддерживается уни
[31-33].
кальными эпигенетическими модификациями
В третьих, в ПСК митохондрии фрагменти
хроматина и транскрипционными факторами -
рованные и разрозненные, а уровень окисли
регуляторами плюрипотентности Oct4, Nanog и
тельного фосфорилирования крайне низок. При
Sox2 [30]. Таким образом, быстрый приток стро
этом направление ПСК в дифференцировку ха
ительных блоков для активно пролиферирую
рактеризуется структурированием митохондрий
щих и синтезирующих ПСК обеспечивается вы
и их выстраиванием в длинные филаментные
ведением интермедиатов из метаболических ре
структуры [24]. Ультраструктура крист тоже раз
БИОХИМИЯ том 85 вып. 3 2020
МЕТАБОЛИЧЕСКАЯ РЕГУЛЯЦИЯ СТВОЛОВЫХ КЛЕТОК
315
личается - если в дифференцированных клет
Величина электрохимического потенциала
ках в активно работающих митохондриях ли
митохондрий в ПСК регулируется при помощи
нейные ровные кристы расположены упорядо
разобщающего белка дыхательной цепи UCP2.
ченными стопками, то в ПСК кристы - разроз
UCP2 является гомологом белка UCP1 (термо
ненные и слабоупорядоченные. При этом нор
генина), который разобщает дыхательную цепь
мализованное на общий белок количество ми
митохондрий в клетках бурой жировой ткани
тохондрий, а также нормализованная актив
для производства тепла. Уровень экспрессии
ность цитрат синтазы существенно не изменя
UCP2 существенно повышен в ПСК по сравне
ются [24]. Ряд данных свидетельствует о том, что
нию с дифференцированными клетками [24].
в плюрипотентных клетках меньшие плотность
Например, по сравнению с фибробластами уро
и количество митохондрий по сравнению с диф
вень UCP2 в плюрипотентных клетках повышен
ференцированными клетками. Однако, скорее
в 5-10 раз. Другие изоформы разобщителей ми
всего, это ошибочное заключение связано с тем,
тохондриального мембранного потенциала
что ПСК имеют меньший объем цитоплазмы
UCP1 и UCP3 в ПСК экспрессируются на суще
при приблизительно равном размере ядра, то
ственно более низких уровнях. UCP2, в отличие
есть имеют более высокий показатель ядерно
от UCP1, не сбрасывает потенциал до низких
цитоплазматического индекса, и при равной
значений, а обеспечивает «подтекание» прото
плотности расположения митохондрий имеют
нов через внутреннюю мембрану митохондрий.
меньшее их число.
Одной из ключевых его функций, как считается,
Четвертой характерной чертой ПСК являет
является регулирование уровня электрохими
ся крайне высокая чувствительность к про
ческого потенциала митохондрий для защиты от
апоптическим стимулам и, одновременно с
чрезмерно высоких его значений. Эта функция
этим, мощная защита от этих стимулов: высо
осуществляется за счет того, что активность
кая концентрация антиоксидантов и наличие
UCP2 зависит от уровня активных форм кисло
системы стабилизации митохондриального
рода (АФК). При повышении трансмембранно
мембранного потенциала [31-33]. Несмотря на
го потенциала митохондрий дыхательная цепь
слабое развитие системы митохондрий, клетки
замедляется, что приводит к образованию повы
поддерживают высокие значения митохондри
шенного уровня АФК. АФК активируют UCP2,
ального потенциала. Это объясняется тем, что
который сбрасывает излишки протонного гра
ATP синтаза в ПСК работает в значительной
диента. Дыхательная цепь ускоряется, продук
степени в направлении гидролиза ATP для про
ция АФК снижается, UCP2 инактивируется. Та
дукции протонного градиента. Это также под
ким образом, UCP2 выполняет роль своеобраз
тверждается низким уровнем экспрессии инги
ного клапана электрохимического потенциала
биторного фактора 1 (IF1), который в диффе
митохондрий, который служит для предотвра
ренцированных клетках препятствует гидролаз
щения электрического пробоя «биологического
ной активности ATP синтазы [24, 34]. Этим же
конденсатора» - внутренней мембраны митохон
свойством АТФ синтазы митохондрий можно
дрий [35, 36]. Механизм действия UCP основан
объяснить тот факт, что в ПСК уровень дыха
на его способности переносить анионы органи
ния является максимально возможным даже
ческих кислот из матрикса митохондрий в меж
при крайне слабом окислительном фосфорили
мембранное пространство, в результате чего
ровании. Это продемонстрировали с использо
происходит компенсация электрохимического
ванием разобщителя дыхательной цепи FCCP.
потенциала. В том случае, если переносятся
При его появлении электрохимический мито
жирные кислоты, они протонируются в меж
хондриальный потенциал падает, и клетка, пы
мембранном пространстве и, в результате флип
таясь компенсировать его, разгоняет дыхание
флоп перехода, могут возвращаться на матрикс
на максимально возможный для конкретных
ную сторону мембраны, где дополнительно от
клеток уровень. Если в дифференцированных
дают протон [37].
фибробластах уровень дыхания после добавле
UCP2 играет важную роль в регуляции мета
ния FCCP вырастает более чем вдвое, то ПСК -
болического статуса плюрипотентных стволо
вообще не показывает прироста. Таким обра
вых клеток. При дифференцировке ПСК проис
зом, низкий уровень дыхания, который наблю
ходит снижение экспрессии UCP2, и, вероятно,
дается в ПСК, является максимально возмож
связанные с этим повышение общего содержа
ным для слабоорганизованной митохондриаль
ния АФК и увеличение мембранного потенциа
ной системы этих клеток, а АТФ синтаза за счет
ла митохондрий. Эктопическая экспрессия
гидролазной активности поддерживает высо
UCP2 приводит к поддержанию стволовости
кий уровень электрохимического потенциала
клеток, приводя к снижению экспрессии генов,
митохондрий [24].
активируемых при дифференцировке [24]. Роль
БИОХИМИЯ том 85 вып. 3 2020
2*
316
ТЮРИН КУЗЬМИН и др.
UCP2 в поддержании метаболического статуса
щих в цитохромы, и антиоксидантного агента
плюрипотентных клеток не ограничивается
глутатиона [28]. Глутатион необходим ПСК для
только редокс зависимым сбросом мембранно
поддержания мощной антиоксидантной систе
го потенциала для защиты от окислительного
мы и новых синтезов для быстрой пролифера
стресса. Сброс излишков протонного градиента
ции клеток. Ингибирование треонин дегидро
необходим при существенном повышении син
геназы тормозит процесс самообновления
тетической активности клеток, когда ЦТК рабо
ПСК, а избыточная экспрессия способствует
тает в основном на синтез предшественников
индуцированной плюрипотентности [41].
синтезируемых веществ. Анаплеротические ре
Таким образом, метаболизм ПСК характери
акции в этом случае пополняют выводимые из
зуется ключевой ролью гликолиза в выработке
ЦТК интермедиаты, а NADН, как побочный
энергии, а ЦТК в основном работает на продук
продукт,
«сжигается» в дыхательной цепи.
цию строительных блоков для синтезов. Это
Третья возможная роль UCP2 в поддержании
связано с крайне высокой скоростью пролифе
гликолитического метаболизма ПСК связана с
рации этих клеток и их синтетической актив
их способностью переносить из митохондрий
ностью, а также слабым развитием митохондри
анионы органических кислот, в том числе, пиру
альной системы.
ват. В результате этой активности UCP2 выводит
пируват из матрикса митохондрий, лишая ПДК
субстрата. В дифференцированных клетках это
ПОСТНАТАЛЬНЫЕ МУЛЬТИПОТЕНТНЫЕ
приводит к переключению метаболизма на ка
СТВОЛОВЫЕ КЛЕТКИ
таболизм жирных кислот, а в ПСК, в комплексе
с другими факторами - к переключению мета
Дифференцировка ПСК в направлении од
болизма на аэробный гликолиз [38].
ного из зародышевых листков, мезодермы, эк
Лимитирующей скорость стадией в метабо
тодермы или энтодермы приводит к превраще
лизме глюкозы в ПСК является не вход глюкозы
нию плюрипотентных клеток в мультипотент
в клетку, а именно способность клетки ее усво
ные. В эмбриональном развитии на этой стадии
ить [24]. В ПСК достаточное количество глю
уже начинает образовываться плацента, в ре
козных транспортеров и высокий уровень гек
зультате чего доступ кислорода к эмбриону, ко
сокиназы II, благодаря которой входящая в
торый был затруднен после имплантации, во
клетку глюкоза фосфорилируется и задержива
зобновляется. В целом, как в процессе эмбрио
ется в цитоплазме. С другой стороны, в этих
нального развития, так и в культуре, по мере
клетках сниженная активность пируватдегидро
дифференцировки ПСК, все больший вклад в
геназного комплекса, который вводит пируват в
энергетический метаболизм начинает вносить
ЦТК. Кроме того, в ПСК активна киназа пиру
окислительное фосфорилирование. Митохон
ватдегидрогеназы, фосфорилирование которой
дрии из разрозненных точечных образований
дополнительно снижает активность ПДК [39].
превращаются в длинные разветвленные струк
Функции ПСК регулируются также продук
туры с упорядоченными кристами [24, 42]. Од
тами обмена аминокислот. Важную роль в этом
нако в процессе дифференцировки ПСК пере
процессе играет катаболизм треонина. С одной
ход от гликолиза к окислительному фосфорили
стороны, он ведет к образованию S аденозилме
рованию осуществляется не во всех случаях.
тионина (SAM), который является основным
Например, эктодермальное направление диффе
донором метильных групп при метилировании
ренцировки ПСК значительно в меньшей степе
ДНК и гистонов. При этом изменения в уровне
ни приводит к переходу на окислительное фос
SAM могут приводить к значительному измене
форилирование, в отличие от мезодермального и
нию уровня метилирования гистонов [40], что
энтодермального направлений [43]. Таким обра
определяет эпигенетическое регулирование
зом, за некоторыми исключениями, переход
клеток при изменении метаболизма и скорости
клеток к мультипотентности сопровождается
катаболизма аминокислот. С другой стороны,
усилением функций митохондрий и окислитель
треонин является важным регулятором самооб
ного фосфорилирования в синтезе ATP.
новления эмбриональных стволовых клеток.
Постнатальные СК, являющиеся либо муль
Катаболизм треонина, осуществляемый трео
типотентными, либо унипотентными, проявля
нин дегидрогеназой, приводит к образованию
ют достаточно большую гетерогенность по от
АцКоА и глицина в митохондриях, служащих
носительному вкладу окислительного фосфори
для синтезов и получения энергии. АцКоА вхо
лирования и аэробного гликолиза в продукцию
дит в ЦТК и используется для получения клет
ATP. Однако, в среднем, эти клетки занимают
кой энергии. Глицин является ключевым проме
промежуточное положение между ПСК и боль
жуточным соединением синтеза гемов, входя
шинством дифференцированных клеток, а за
БИОХИМИЯ том 85 вып. 3 2020
МЕТАБОЛИЧЕСКАЯ РЕГУЛЯЦИЯ СТВОЛОВЫХ КЛЕТОК
317
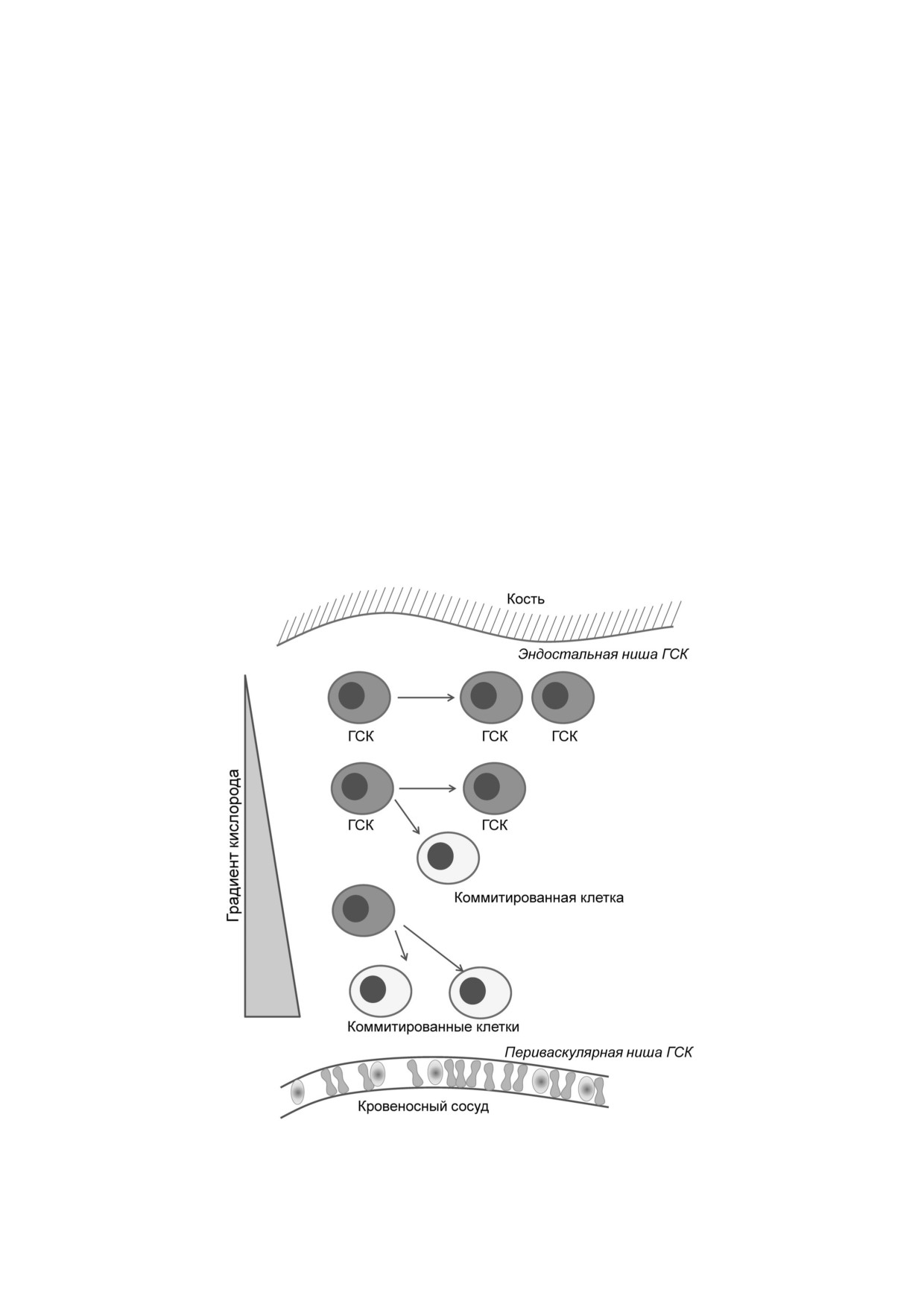
кономерности связи стволового потенциала
тохондриальным потенциалом, продукцией
клеток и их метаболического статуса справедли
большого количества лактата и низким уровнем
вы и для постнатальных СК. Так, локальное
ATP и NADH [45]. Доступность кислорода и
микроокружение играет существенную роль в
связанные с этим доминирующие пути синтеза
регуляции их функций. Компоненты ниши мо
ATP играют критическую роль в регуляции
гут ограничивать доступ кислорода и/или пита
функциональной активности ГСК. В костном
тельных веществ к СК, поддерживая ее в покоя
мозге выявляют два типа ниш ГСК: эндосталь
щемся состоянии [10, 44]. На примере двух
ную и периваскулярную (рис. 5). Периваскуляр
представителей постнатальных СК рассмотрим
ная ниша располагается рядом с сосудами и, как
особенности энергетического метаболизма
следствие, уровень кислорода в ней достаточно
стволовых клеток взрослого организма и свя
высокий. Эндостальная ниша располагается по
занные с этим функции.
периферии от периваскулярной, ближе к кост
Гематопоэтические стволовые клетки нарав
ной ткани, в ней доступность кислорода сущест
не с базальными клетками эпителия и эпидер
венно ниже. В этих двух нишах располагаются
миса являются наиболее активными тканеспе
разные по пролиферативному потенциалу и
цифичными постнатальными СК. ГСК дают на
дифференцировочным свойствам ГСК. В эн
чало всем клетками крови и локализуются в
достальной нише находятся покоящиеся ГСК,
костном мозге. Вследствие ограниченной дос
которые медленно делятся, характеризуются
тупности кислорода в нише костного мозга ГСК
высоким уровнем HIF 1α и повышенным анаэ
постоянно находятся в гипоксических условиях.
робным гликолизом. При переходе ГСК в пери
Гипоксия активирует экспрессию HIF 1α, что
васкулярную нишу уровень HIF 1α снижается,
приводит к усилению анаэробного гликолиза.
клетки начинают быстрее пролиферировать и
Преимущественно гликолитический метаболи
направляются в дифференцировку. Выделяют 3
ческий статус ГСК подтверждается низким ми
варианта деления ГСК. Покоящиеся ГСК в эн
Рис. 5. Дифференцировочная судьба ГСК зависит от доступности кислорода
БИОХИМИЯ том 85 вып. 3 2020
318
ТЮРИН КУЗЬМИН и др.
лизм является одним из ключевых регуляторов
направления дифференцировки ГСК.
Мультипотентные стромальные клетки пред
ставляют собой постнатальные СК, встречаю
щиеся в большинстве тканей организма, кото
рые могут дифференцироваться в ряд типов кле
ток мезенхимного направления, таких как ади
поциты, остеобласты и хондробласты, но, по
видимому, in vivo делают это крайне редко [48,
49]. Более важной их функцией является орга
низация комплекса компонентов микроокруже
ния и регуляции тканеспецифичных стволовых
и дифференцированных клеток, что можно на
звать понятием «строма» в широком смысле
этого слова. Например, МСК костного мозга яв
ляются ключевыми и необходимыми посредни
ками между симпатической регуляцией кровет
ворения и ГСК [50]. МСК преимущественно
располагаются периваскулярно, регистрируют
гормональный фон организма и получают сиг
налы от симпатической нервной системы [51,
52]. МСК конвертируют эти сигналы в спектр
паракринных факторов и регуляторных микро
везикул, благодаря чему выступают ключевыми
Рис. 6. МСК проявляют метаболическую пластичность,
факторами поддержания гомеостаза ткани и ре
переключаясь на анаэробный гликолиз в условиях
гуляторами процессов репарации и регенерации
гипоксии и возвращаясь к исходному состоянию при нор
[53, 54], а также регулируют функционирование
мализации доступа кислорода. При направлении в диффе
иммунных клеток в ткани [55].
ренцировку характер изменения метаболизма клеток зави
сит от направления дифференцировки
МСК проявляют очень высокую пластич
ность в способности переключаться между
окислительным фосфорилированием и глико
достальной нише делятся редко и живут за счет
лизом для выбора наиболее оптимального пути
анаэробного гликолиза. При этом деление сим
получения энергии (рис. 6). При этом в МСК в
метричное, на выходе образуются две стволовые
условиях нормоксии активны как окислитель
клетки. ГСК, попадающие в периваскулярную
ное фосфорилирование, так и гликолитический
нишу, делятся одним из двух вариантов. Либо
путь получения энергии. По некоторым оцен
асимметрично, в результате чего образуется од
кам, в культуре МСК вклад окислительного
на стволовая клетка и одна клетка, коммитиро
фосфорилирования в продукцию ATP составля
ванная в дифференцировку. Либо симметрично,
ет ~30%, а остальное - аэробный гликолиз [56].
но на выходе из деления образуются две комми
МСК можно перевести в 3D культуру путем их
тированные в дифференцировку клетки. Выбор
культивирования при низкой плотности посад
между двумя последними типами деления ГСК
ки и определенном составе среды. При этом
зависит от энергетического метаболизма деля
МСК самоорганизуются в клональные мезен
щихся клеток [46]. Если в ГСК активен путь β
сферы, внутри которых популяция СК поддер
окисления жирных кислот, то СК подвергаются
живается существенно дольше, чем в расплас
асимметричному делению с поддержанием са
танной культуре клеток [50]. После перехода
мообновления. Если же этот путь либо подавлен
МСК в 3D культуру в них существенно снижа
физиологическими стимулами, либо подавлен
ется общий уровень метаболизма. Уменьшается
фармакологически, то стволовая клетка делится
как продукция лактата, так и уровень потребле
на две коммитированные гематопоэтические
ния кислорода, нормированные на количество
клетки [47]. Дифференцирующиеся ГСК ис
клеток [56]. Проявляя метаболическую пластич
пользуют для получения энергии окислительное
ность, МСК оказываются устойчивы к гипоксии,
фосфорилирование и делятся с образованием
переходя на анаэробный гликолиз. При этом
только более дифференцированных клеток. Лю
МСК не теряют своих способностей к диффе
бые воздействия, активирующие окислительное
ренцировке, а сам переход носит обратимый ха
фосфорилирование, в ГСК приводят к диффе
рактер [57]. Считается, что метаболическая
ренцировке клеток [46]. Таким образом, метабо
пластичность необходима МСК для успешного
БИОХИМИЯ том 85 вып. 3 2020
МЕТАБОЛИЧЕСКАЯ РЕГУЛЯЦИЯ СТВОЛОВЫХ КЛЕТОК
319
функционирования в условиях ишемии после
окислительного фосфорилирования [63]. Дру
повреждения ткани, когда МСК должны произ
гие же показали, что дифференцирующиеся
водить репарацию повреждения.
МСК сохраняют высокий уровень гликолиза и
Преимущественно гликолитический мета
его значительное участие в продукции ATP [64].
болизм, даже в условиях достаточного поступле
Эти противоречия могут быть вызваны тем, что
ния кислорода, играет существенную роль в
в процессе остеогенной дифференцировки кле
поддержании пролиферации, секреторной
точный энергетический метаболизм изменяется
функции и выбора направления дифференци
нелинейно. Так, на первом этапе дифференци
ровки МСК [58]. При гипоксии происходит ак
ровки МСК активно пролиферируют, при этом
тивация HIF 1a, что приводит к повышению
в них доминирует гликолитический путь полу
экспрессии ферментов анаэробного гликолиза и
чения энергии, а ЦТК используется как источ
снижению уровня окислительного фосфорили
ник метаболитов для синтеза структур в деля
рования за счет ингибирования ПДК [59]. Одна
щихся клетках. Далее, когда клетки переходят
ко и в условиях нормоксии МСК продолжают
непосредственно к остеогенной дифференци
поддерживать высокий уровень гликолиза за
ровке, для синтеза энергии используется преи
счет сохранения экспрессии HIF 1a. Это необ
мущественно окислительное фосфорилирова
ходимо для поддержания высокой синтетичес
ние [65]. Таким образом, МСК, в отличие от
кой активности клеток, а также продукции ан
тканеспецифичных мультипотентных клеток,
тиоксидантов для предотвращения окислитель
проявляют существенную метаболическую
ного стресса. Кроме того, невысокая активность
пластичность, которая позволяет им эффектив
митохондрий дополнительно снижает вероят
но выполнять свои функции как в условиях нор
ность образования АФК [58, 60]. Совместно
мального снабжения ткани кислородом, так и в
мощная антиоксидантная защита и низкий уро
условиях гипоксии.
вень продукции АФК приводят к тому, что МСК
проявляют крайне высокую устойчивость к
апоптозу [61]. Направление МСК в дифферен
МЕТАБОЛИЗМ И ДИФФЕРЕНЦИРОВКА
цировку, так же, как и в случае ПСК, изменяет
СТВОЛОВЫХ КЛЕТОК
метаболический статус клеток. При этом харак
тер изменения метаболизма зависит от того, в
Как было показано выше, в процессе диффе
какой тип клеток дифференцируются МСК.
ренцировки СК происходят существенные из
При адипогенной дифференцировке происхо
менения метаболических путей получения
дит переключение МСК с преимущественно
энергии клетками. Более того, интермедиаты
гликолитической продукции ATP на окисли
метаболических процессов сами влияют на эф
тельное фосфорилирование. При этом сущест
фективность дифференцировки. Таким обра
венно снижается продукция лактата, повышает
зом, метаболический статус клеток и их стволо
ся потребление кислорода. В то же время значи
вый потенциал являются взаимосвязанными и
тельно повышается экспрессия белков разоб
обоюдно зависимыми признаками. С практи
щителей митохондрий (UCP1, UCP2 и UCP3)
ческой точки зрения было бы полезно научить
[62]. Это может свидетельствовать о том, что
ся управлять дифференцировочными свойства
ЦТК работает не только на обеспечение энерге
ми СК для их контролируемого применения в
тических нужд, но и для снабжения дифферен
регенеративной медицине. Например, для боль
цирующихся клеток необходимыми для синте
шинства стволовых клеток актуально стоит воп
зов интермедиатами аналогично тому, как ПСК
рос о как можно более однородной дифферен
используют интермедиаты ЦТК (рис. 2). Блоки
цировке в нужном направлении без побочных
рование дыхательной цепи или помещение кле
продуктов. А для использования индуцирован
ток в условия гипоксии приводит к подавлению
ных ПСК в медицине на первых же этапах вста
адипогенной дифференцировки [62]. При хонд
ет еще более серьезный вопрос о вероятном об
рогенной дифференцировке МСК сохраняется
разовании тератом в том случае, если в популя
преимущественно гликолитический путь полу
ции останутся хотя бы небольшие группы плю
чения ATP. Это может быть связано с особен
рипотентных клеток. Ниже будут рассмотрены
ностями хрящевой ткани, которая не снабжает
некоторые примеры того, как, воздействуя на
ся кровью, в связи с чем хондробласты функци
метаболизм СК, можно влиять на их способ
онируют в условиях гипоксии [56]. Данные по
ность к дифференцировке.
поводу изменения метаболизма МСК в процес
Величина митохондриального мембранного
се остеогенной дифференцировки разнятся. Ряд
потенциала является фактором, регулирующим
авторов утверждает, что клетки при этом перехо
стволовый и дифференцировочный потенциал
дят на аэробный метаболизм с преобладанием
ПСК. Для демонстрации этого мышиные ЭСК
БИОХИМИЯ том 85 вып. 3 2020
320
ТЮРИН КУЗЬМИН и др.
культивировали в метастабильном состоянии в
щественно вырастала по сравнению с необрабо
среде, содержащей LIF, но без ингибиторов сиг
танными клетками [67].
нальных путей МАРК и Gsk3, которые промо
В линиях ПСК, а также на начальных этапах
тируют переход наивных мышиных ЭСК в
направления их в дифференцировку, одним из
праймированное состояние. В этом состоянии
основных питательных веществ является глута
ПСК демонстрируют гетерогенность по мито
мин. Он обеспечивает анаплеротические реак
хондриальному мембранному потенциалу.
ции ЦТК в активно пролиферирующих клетках,
Клетки разделили при помощи клеточного сор
превращаясь в глутамат и метаболиты ЦТК.
тера на клетки с высоким и низким митохон
Кроме того, глутамин активирует UCP2, кото
дриальным потенциалом. Такие клетки не раз
рый, как было сказано выше, является важным
личаются внешне и по экспрессии маркеров и
регулятором метаболизма ПСК. Депривация
факторов плюрипотентности, но отличаются
клеток в питательной среде без глутамина при
функционально. Клетки с высоким мембран
водит к значительному снижению количества
ным потенциалом имеют существенно повы
метаболитов ЦТК, при этом пируват не компен
шенный уровень метаболизма, поскольку у них
сирует этот недостаток [43]. Таким образом, ре
повышен как уровень потребления кислорода,
гулируя доступность глутамина для ПСК, мож
так и продукции лактата, что свидетельствует о
но пробовать останавливать процесс самопод
том, что у них усилен и гликолиз, и дыхание.
держания плюрипотентных клеток при направ
Эти клетки крайне плохо направляются в мезо
лении их в дифференцировку.
дермальную дифференцировку, но при подсад
Использование стволовых плюрипотентных
ке in vivo образуют тератомы с формированием
и мультипотентных клеток в регенеративной
клеток всех трех зародышевых листков. Клетки
медицине открывает крайне широкие возмож
с пониженным мембранным потенциалом эф
ности для восстановления тканей и целых орга
фективно направляются в мезодермальную
нов человека. Однако до того, как эти клетки
дифференцировку [66]. Можно предположить,
смогут использоваться в широкой практике,
что клетки с высоким потенциалом митохон
требуется существенно расширить наши знания
дрий находятся в состоянии наивных мЭСК, у
о механизмах функционирования и регуляции
которых повышен уровень окислительного
этих клеток. Причем, метаболизм СК является
фосфорилирования, а клетки с низким митохон
не только маркером их стволового статуса, но и
дриальным потенциалом схожи с праймирован
активным действующим лицом, воздействуя на
ными ЭпиСК.
которое потенциально можно управлять про
Искусственное воздействие на митохондри
цессом дифференцировки стволовых клеток.
альный потенциал также изменяет дифферен
цировочные характеристики ПСК. Так, если
культивировать мЭСК или чЭСК в среде, содер
Финансирование. Работа поддержана Рос
жащей митохондриальный разобщитель CCCP,
сийским фондом фундаментальных исследова
уровень пролиферации падает, а экспрессия
ний (грант № 18 015 00421), (П.А.Т. К.) в части
транскрипционных факторов плюрипотентнос
регуляции метаболизма плюрипотентных ство
ти Oct4, Nanog и Sox2 растет. Это сопровождает
ловых клеток, а также Российским научным
ся снижением уровня дыхания и повышением
фондом (грант № 19 75 30007) в части регуля
активности анаэробного гликолиза, сопровож
ции метаболизма постнатальных стволовых кле
дающегося продукцией лактата [67]. Если на
ток (К.Ю.К.). П.А.Т. К. поддержан стипендией
править мЭСК в дифференцировку в присут
Президента России для молодых ученых СП
ствии СССР, то, несмотря на то что экспрессия
2903.2019.4.
транскрипционных факторов плюрипотентнос
Конфликт интересов. Авторы заявляют об от
ти снижается так же, как и в необработанных
сутствии конфликта интересов.
клетках, в популяции сохраняются клетки, спо
Соблюдение этических норм. Настоящая
собные образовывать тератомы. При подсадке
статья не содержит каких либо исследований с
мыши дифференцированных мЭСК, обрабо
участием людей или использованием животных
танных СССР, частота образования тератом су
в качестве объектов исследований.
СПИСОК ЛИТЕРАТУРЫ
1.
Pedersen, R.A., Wu, K., and Balakier, H. (1986) Origin of
2.
Гилберт С.Ф. (2010) Биология развития, Политехника,
the inner cell mass in mouse embryos: cell lineage analysis
Санкт Петербург.
by microinjection, Dev. Biol.,
117,
581-595,
3.
Morgani, S., Nichols, J., and Hadjantonakis, A.K. (2017)
doi: 10.1016/0012 1606(86)90327 1.
The many faces of Pluripotency: in vitro adaptations of a
БИОХИМИЯ том 85 вып. 3 2020
МЕТАБОЛИЧЕСКАЯ РЕГУЛЯЦИЯ СТВОЛОВЫХ КЛЕТОК
321
continuum of in vivo states, BMC Dev. Biol., 17, 7,
cells by facilitating nuclear localization of LSD1, FEBS
doi: 10.1186/s12861 017 0150 4.
Open Bio, 7, 1932-1942, doi: 10.1002/2211 5463.12331.
4.
Weinberger, L., Ayyash, M., Novershtern, N., and Hanna, J.H.
21.
Whyte, W.A., Bilodeau, S., Orlando, D.A., Hoke, H.A.,
(2016) Dynamic stem cell states: naive to primed pluripo
Frampton, G.M., Foster, C.T., Cowley, S.M., and
tency in rodents and humans, Nat. Rev. Mol. Cell Biol., 17,
Young, R.A. (2012) Enhancer decommissioning by LSD1
155.
during embryonic stem cell differentiation, Nature, 482,
5.
Ryall, J.G., Cliff, T., Dalton, S., and Sartorelli, V. (2015)
221-225, doi: 10.1038/nature10805.
Metabolic reprogramming of stem cell epigenetics, Cell
22.
Tsukada, Y., Fang, J., Erdjument Bromage, H., Warren, M.E.,
Stem Cell, 17, 651-662, doi: 10.1016/j.stem.2015.11.012.
Borchers, C.H., Tempst, P., and Zhang, Y. (2006) Histone
6.
Martin, K.L., and Leese, H.J. (1995) Role of glucose in
demethylation by a family of JmjC domain containing pro
mouse preimplantation embryo development, Mol. Reprod.
teins, Nature, 439, 811-816, doi: 10.1038/nature04433.
Dev., 40, 436-443, doi: 10.1002/mrd.1080400407.
23.
Yang, H., Lin, H., Xu, H., Zhang, L., Cheng, L., Wen, B.,
7.
Houghton, F.D., Thompson, J.G., Kennedy, C.J., and
Shou, J. Guan, K., Xiong, Y., and Ye, D. (2014) TET cat
Leese, H.J. (1996) Oxygen consumption and energy
alyzed 5 methylcytosine hydroxylation is dynamically reg
metabolism of the early mouse embryo, Mol. Reprod. Dev.,
ulated by metabolites, Cell Res.,
24,
1017-1020,
44, 476-485, doi: 10.1002/(SICI)1098 2795(199608)44:
doi: 10.1038/cr.2014.81.
4<476::AID MRD7>3.0.CO;2 I.
24.
Zhang, J., Khvorostov, I., Hong, J.S., Oktay, Y., Vergnes, L.,
8.
Prigione, A., and Adjaye, J. (2010) Modulation of mito
Nuebel, E., Wahjudi, P.N., Setoguchi, K., Wang, G., Do, A.,
chondrial biogenesis and bioenergetic metabolism upon in
Jung, H.J., McCaffery, J.M., Kurland, I.J., Reue, K.,
vitro and in vivo differentiation of human ES and iPS cells,
Lee, W.N., Koehler, C.M., and Teitell, M.A. (2011) UCP2
Int. J. Dev. Biol.,
54,
1729-1741, doi:
10.1387/
regulates energy metabolism and differentiation potential
ijdb.103198ap.
of human pluripotent stem cells, EMBO J., 30, 4860-4873,
9.
Morrison, S.J., and Spradling, A.C. (2008) Stem cells and
doi: 10.1038/emboj.2011.401.
niches: mechanisms that promote stem cell maintenance
25.
Warburg, O., Wind, F., and Negelein, E. (1927) The
throughout life, Cell, 132, 598-611, doi: 10.1016/j.cell.
metabolism of tumors in the body, J. Gen. Physiol., 8,
2008.01.038.
519-530, doi: 10.1085/jgp.8.6.519.
10.
Нимирицкий П., Сагарадзе Г., Ефименко А., Макаре
26.
Vander Heiden, M.G., Cantley, L.C., and Thompson, C.B.
вич П., Ткачук В. (2018) Ниша стволовой клетки, Ци*
(2009) Understanding the Warburg effect: the metabolic
тология, 60.
requirements of cell proliferation, Science,
324,
11.
Moussaieff, A., Kogan, N.M., and Aberdam, D. (2015)
1029-1033, doi: 10.1126/science.1160809.
Concise review: energy metabolites: key mediators of the
27.
Rodimova, S.A., Meleshina, A.V., Kalabusheva, E.P.,
epigenetic state of pluripotency, Stem Cells,
33,
Dashinimaev, E.B., Reunov, D.G., Torgomyan, H.G.,
2374-2380, doi: 10.1002/stem.2041.
Vorotelyak, E.A., and Zagaynova, E.V. (2019) Metabolic
12.
Rivera, L.B., and Bergers, G. (2014) Angiogenesis.
activity and intracellular pH in induced pluripotent stem
Targeting vascular sprouts, Science, 344, 1449-1450,
cells differentiating in dermal and epidermal directions,
doi: 10.1126/science.1257071.
Methods Appl. Fluoresc., 7, 044002, doi: 10.1088/2050
13.
Kim, H.J., Miyazaki, M., Man, W.C., and Ntambi, J.M.
6120/ab3b3d.
(2002) Sterol regulatory element binding proteins
28.
Nelson, D.L., and Cox, M.M. (2005) Lehninger principles
(SREBPs) as regulators of lipid metabolism: polyunsatu
of biochemistry, WH Freeman and Company, New York,
rated fatty acids oppose cholesterol mediated induction of
pp. 1216.
SREBP 1 maturation, Ann. N. Y. Acad. Sci., 967, 34-42,
29.
Becker, K.A., Ghule, P.N., Therrien, J.A., Lian, J.B.,
doi: 10.1111/j.1749 6632.2002.tb04261.x.
Stein, J.L., van Wijnen, A.J., and Stein, G.S. (2006) Self
14.
Inoue, J., Kumagai, H., Terada, T., Maeda, M., Shimizu, M.,
renewal of human embryonic stem cells is supported by a
and Sato, R. (2001) Proteolytic activation of SREBPs dur
shortened G1 cell cycle phase, J. Cell. Physiol., 209,
ing adipocyte differentiation, Biochem. Biophys. Res.
883-893, doi: 10.1002/jcp.20776.
Commun., 283, 1157-1161, doi: 10.1006/bbrc.2001.4915.
30.
Boyer ,L.A., Lee, T.I., Cole, M.F., Johnstone, S.E.,
15.
Zheng, L., Roeder, R.G., and Luo, Y. (2003) S phase acti
Levine, S.S., Zucker, J.P., Guenther, M.G., Kumar, R.M.,
vation of the histone H2B promoter by OCA S, a coactiva
Murray, H.L., Jenner, R.G., Gifford, D.K., Melton, D.A.,
tor complex that contains GAPDH as a key component,
Jaenisch, R., and Young, R.A. (2005) Core transcriptional
Cell, 114, 255-266, doi: 10.1016/s0092 8674(03)00552 x.
regulatory circuitry in human embryonic stem cells, Cell,
16.
Wellen, K.E., Hatzivassiliou, G., Sachdeva, U.M.,
122, 947-956, doi: 10.1016/j.cell.2005.08.020.
Bui, T.V., Cross, J.R., and Thompson, C.B. (2009) ATP
31.
Madden, D.T., Davila Kruger, D., Melov, S., and
citrate lyase links cellular metabolism to histone acetyla
Bredesen, D.E. (2011) Human embryonic stem cells
tion, Science, 324, 1076-1080, doi: 10.1126/science.
express elevated levels of multiple pro apoptotic BCL 2
1164097.
family members, PLoS One, 6, e28530, doi: 10.1371/journal.
17.
Ryall, J.G. (2012) The role of sirtuins in the regulation of
pone.0028530.
metabolic homeostasis in skeletal muscle, Curr. Opin. Clin.
32.
Setoguchi, K., TeSlaa, T., Koehler, C.M., and Teitell, M.A.
Nutr. Metab. Care., 15, 561-566, doi: 10.1097/MCO.
(2016) P53 Regulates rapid apoptosis in human pluripotent
0b013e3283590914.
stem cells, J. Mol. Biol., 428, 1465-1475, doi: 10.1016/
18.
Canto, C., Menzies, K.J., and Auwerx, J. (2015) NAD(+)
j.jmb.2015.07.019.
Metabolism and the control of energy homeostasis: a bal
33.
Saretzki, G., Armstrong, L., Leake, A., Lako, M., and von
ancing act between mitochondria and the nucleus, Cell
Zglinicki, T. (2004) Stress defense in murine embryonic
Metab., 22, 31-53, doi: 10.1016/j.cmet.2015.05.023.
stem cells is superior to that of various differentiated
19.
Shi, Y.J., Matson, C., Lan, F., Iwase, S., Baba, T., and Shi, Y.
murine cells, Stem Cells, 22, 962-971, doi: 10.1634/
(2005) Regulation of LSD1 histone demethylase activity by
stemcells.22 6 962.
its associated factors, Mol. Cell,
19,
857-864,
34.
Dahan, P., Lu, V., Nguyen, R.M.T., Kennedy, S.A.L., and
doi: 10.1016/j.molcel.2005.08.027.
Teitell, M.A. (2019) Metabolism in pluripotency: both dri
20.
Hirano, K., and Namihira, M. (2017) FAD influx
ver and passenger? J. Biol. Chem., 294, 5420-5429,
enhances neuronal differentiation of human neural stem
doi: 10.1074/jbc.TM117.000832.
БИОХИМИЯ том 85 вып. 3 2020
322
ТЮРИН КУЗЬМИН и др.
35.
Krauss, S., Zhang, C.Y., and Lowell, B.B. (2005) The
50.
Mendez Ferrer, S., Michurina, T.V., Ferraro, F.,
mitochondrial uncoupling protein homologues, Nat. Rev.
Mazloom, A.R., Macarthur, B.D., Lira, S.A., Scadden, D.T.,
Mol. Cell Biol., 6, 248-261, doi: 10.1038/nrm1572.
Ma’ayan, A., Enikolopov, G.N., and Frenette, P.S. (2010)
36.
Diano, S., and Horvath, T.L. (2012) Mitochondrial uncou
Mesenchymal and haematopoietic stem cells form a
pling protein 2 (UCP2) in glucose and lipid metabolism,
unique bone marrow niche, Nature, 466, 829-834,
Trends Mol. Med., 18, 52-58, doi: 10.1016/j.molmed.
doi: 10.1038/nature09262.
2011.08.003.
51.
Kotova, P.D., Sysoeva, V.Y., Rogachevskaja, O.A.,
37.
Berardi, M.J., and Chou, J.J. (2014) Fatty acid flippase
Bystrova, M.F., Kolesnikova, A.S., Tyurin Kuzmin, P.A.,
activity of UCP2 is essential for its proton transport in
Fadeeva, J.I., Tkachuk, V.A., and Kolesnikov, S.S. (2014)
mitochondria,
Cell
Metab.,
20,
541-552,
Functional expression of adrenoreceptors in mesenchymal
doi: 10.1016/j.cmet.2014.07.004.
stromal cells derived from the human adipose tissue,
38.
Bouillaud, F. (2009) UCP2, not a physiologically relevant
Biochim. Biophys. Acta, 1843, 1899-1908, doi: 10.1016/
uncoupler but a glucose sparing switch impacting ROS
j.bbamcr.2014.05.002.
production and glucose sensing, Biochim. Biophys. Acta,
52.
Tyurin Kuzmin, P.A., Fadeeva, J.I., Kanareikina, M.A.,
1787, 377-383, doi: 10.1016/j.bbabio.2009.01.003.
Kalinina, N.I., Sysoeva, V.Y., Dyikanov, D.T.,
39.
Varum, S., Rodrigues, A.S., Moura, M.B., Momcilovic, O.,
Stambolsky, D.V., and Tkachuk, V.A. (2016) Activation of
Easley, C.A. 4th, Ramalho Santos, J. Van Houten, B., and
beta adrenergic receptors is required for elevated alpha1A
Schatten, G. (2011) Energy metabolism in human pluripo
adrenoreceptors expression and signaling in mesenchymal
tent stem cells and their differentiated counterparts, PLoS
stromal cells, Sci. Rep., 6, 32835, doi: 10.1038/srep32835.
One, 6, e20914.
53.
Sysoeva, V.Y., Ageeva, L.V., Tyurin Kuzmin, P.A.,
40.
Zee, B.M., Levin, R.S., Xu, B., LeRoy, G., Wingreen, N.S.,
Sharonov, G.V., Dyikanov, D.T., Kalinina, N.I., and
and Garcia, B.A. (2010) In vivo residue specific histone
Tkachuk, V.A. (2017) Local angiotensin II promotes adi
methylation dynamics, J. Biol. Chem., 285, 3341-3350,
pogenic differentiation of human adipose tissue mesenchy
doi: 10.1074/jbc.M109.063784.
mal stem cells through type 2 angiotensin receptor, Stem
41.
Chen, G., and Wang, J. (2019) A regulatory circuitry lock
Cell Res., 25, 115-122, doi: 10.1016/j.scr.2017.10.022.
ing pluripotent stemness to embryonic stem cell: interac
54.
Lopatina, T., Bruno, S., Tetta, C., Kalinina, N., Porta, M.,
tion between threonine catabolism and histone methyla
and Camussi, G. (2014) Platelet derived growth factor reg
tion, Semin. Cancer Biol., 57, 72-78, doi: 10.1016/j.
ulates the secretion of extracellular vesicles by adipose mes
semcancer.2019.01.005.
enchymal stem cells and enhances their angiogenic poten
42.
Cho, Y.M., Kwon, S., Pak, Y.K., Seol, H.W., Choi, Y.M.,
tial, Cell Commun. Signal., 12, 26, doi: 10.1186/1478
Park, D.J., Park, K.S., and Lee, H.K. (2006) Dynamic
811X 12 26.
changes in mitochondrial biogenesis and antioxidant
55.
Rubtsov, Y.P., Suzdaltseva, Y.G., Goryunov, K.V.,
enzymes during the spontaneous differentiation of human
Kalinina, N.I., Sysoeva, V.Y., and Tkachuk, V.A. (2012)
embryonic stem cells, Biochem. Biophys. Res. Commun.,
Regulation of immunity via multipotent mesenchymal
348, 1472-1478, doi: 10.1016/j.bbrc.2006.08.020.
stromal cells, Acta Naturae, 4, 23-31.
43.
Lu, V., Dahan, P., Ahsan, F.M., Patananan, A.N.,
56.
Pattappa, G., Heywood, H.K., de Bruijn, J.D., and
Roy, I.J., Torres, A. Jr., Nguyen, R.M.T., Huang,D.,
Lee, D.A. (2011) The metabolism of human mesenchymal
Braas, D., and Teitell, M.A. (2019) Mitochondrial metab
stem cells during proliferation and differentiation, J. Cell.
olism and glutamine are essential for mesoderm differenti
Physiol., 226, 2562-2570, doi: 10.1002/jcp.22605.
ation of human pluripotent stem cells, Cell Res., 29,
57.
Mylotte, L.A., Duffy, A.M., Murphy, M., O’Brien, T.,
596-598, doi: 10.1038/s41422 019 0191 2.
Samali, A., Barry, F., and Szegezdi, E. (2008) Metabolic
44.
Novoseletskaya, E.S., Grigorieva, O.A., Efimenko, A.Y.,
flexibility permits mesenchymal stem cell survival in an
and Kalinina, N.I. (2019). Extracellular matrix in the reg
ischemic environment, Stem Cells,
26,
1325-1336,
ulation of stem cell differentiation, Biochemistry (Moscow),
doi: 10.1634/stemcells.2007 1072.
84, 232-240.
58.
Liu, Y., and Ma, T. (2015) Metabolic regulation of mes
45.
Simsek, T., Kocabas, F., Zheng, J., Deberardinis, R.J.,
enchymal stem cell in expansion and therapeutic applica
Mahmoud, A.I., Olson, E.N., Schneider, J.W.,
tion, Biotechnol. Prog., 31, 468-481, doi: 10.1002/
Zhang, C.C., and Sadek, H.A. (2010) The distinct meta
btpr.2034.
bolic profile of hematopoietic stem cells reflects their loca
59.
Hsu, Y.C., Wu, Y.T., Yu, T.H., and Wei, Y.H. (2016)
tion in a hypoxic niche, Cell Stem Cell, 7, 380-390,
Mitochondria in mesenchymal stem cell biology and cell
doi: 10.1016/j.stem.2010.07.011.
therapy: from cellular differentiation to mitochondrial
46.
Oburoglu, L., Romano, M., Taylor, N., and Kinet, S. (2016)
transfer, Semin. Cell Dev. Biol.,
52,
119-131,
Metabolic regulation of hematopoietic stem cell commit
doi: 10.1016/j.semcdb.2016.02.011.
ment and erythroid differentiation, Curr. Opin. Hematol., 23,
60.
Palomaki, S., Pietila, M., Laitinen, S., Pesala, J.,
198-205, doi: 10.1097/MOH.0000000000000234.
Sormunen, R., Lehenkari, P., and Koivunen, P. (2013)
47.
Ito, K., Carracedo, A., Weiss, D., Arai, F., Ala, U.,
HIF 1alpha is upregulated in human mesenchymal stem
Avigan, D.E., Schafer, Z.T., Evans, R.M., Suda, T.,
cells, Stem Cells, 31, 1902-1909, doi: 10.1002/stem.1435.
Lee, C.H., and Pandolfi, P.P. (2012) A PML PPAR delta
61.
Рылова Ю., Андреева Е., Гогвадзе В., Животовский Б.,
pathway for fatty acid oxidation regulates hematopoietic
Буравкова Л. (2012) Этопозид и гипоксия не активи
stem cell maintenance, Nat. Med., 18, 1350-1358,
руют апоптоз мультипотентных мезенхимальных
doi: 10.1038/nm.2882.
стромальных клеток in vitro, Клеточные технологии в
48.
Kalinina, N.I., Sysoeva, V.Y., Rubina, K.A., and Tkachuk, V.A.
биологии и медицине, 3, 148-151.
(2011) Mesenchymal stem cells in tissue growth and repair,
62.
Zhang, Y., Marsboom, G., Toth, P.T., and Rehman, J.
Acta Naturae, 3, 32-39.
(2013) Mitochondrial respiration regulates adipogenic dif
49.
Murray, I.R., West,C.C., Hardy,W.R., James, A.W.,
ferentiation of human mesenchymal stem cells, PLoS One,
Park, T.S., Nguyen, A., Tawonsawatruk, T., Lazzari, L.
8, e77077, doi: 10.1371/journal.pone.0077077.
Soo, C., and Peault, B. (2014) Natural history of mesenchy
63.
Chen, C.T., Shih, Y.R.V., Kuo, T.K., Lee, O.K., and Wei, Y.H.
mal stem cells, from vessel walls to culture vessels, Cell. Mol.
(2008) Coordinated changes of mitochondrial biogenesis
Life Sci., 71, 1353-1374, doi: 10.1007/s00018 013 1462 6.
and antioxidant enzymes during osteogenic differentiation
БИОХИМИЯ том 85 вып. 3 2020
МЕТАБОЛИЧЕСКАЯ РЕГУЛЯЦИЯ СТВОЛОВЫХ КЛЕТОК
323
of human mesenchymal stem cells, Stem Cells, 26,
66. Schieke, S.M., Ma, M., Cao, L., McCoy, J.P. Jr., Liu, C.,
960-968.
Hensel, N.F., Barrett, A.J., Boehm, M., and Finkel, T.
64. Esen, E., Chen, J., Karner, C.M., Okunade, A.L.,
(2008) Mitochondrial metabolism modulates differentia
Patterson, B.W., and Long, F. (2013) WNT LRP5 signal
tion and teratoma formation capacity in mouse embryonic
ing induces Warburg effect through mTORC2 activation
stem cells, J. Biol. Chem., 283, 28506-28512, doi: 10.1074/
during osteoblast differentiation, Cell Metab., 17, 745-755,
jbc.M802763200.
doi: 10.1016/j.cmet.2013.03.017.
67. Mandal, S., Lindgren, A.G., Srivastava, A.S., Clark, A.T.,
65. Shum, L.C., White, N.S., Mills, B.N., Bentley, K.L., and
and Banerjee, U. (2011) Mitochondrial function controls
Eliseev, R.A. (2016) Energy metabolism in mesenchymal
proliferation and early differentiation potential of embry
stem cells during osteogenic differentiation, Stem Cells
onic stem cells, Stem Cells, 29, 486-495.
Dev., 25, 114-122, doi: 10.1089/scd.2015.0193.
METABOLIC REGULATION OF MAMMALIAN
STEM CELLS DIFFERENTIATION
Review
P. A. Tyurin#Kuzmin1*, A. Yu. Molchanov2, V. I. Chechekhin1,
A. M. Ivanova1, and K. Yu. Kulebyakin1
1 Lomonosov Moscow State University, Faculty of Fundamental Medicine,
Department of Biochemistry and Molecular Medicine, 119991 Moscow, Russia; E*mail: tyurinkuzmin.p@gmail.com
2 Lomonosov Moscow State University, Faculty of Biology, Department of Embryology, 119234 Moscow, Russia
Received October 28, 2019
Revised January 19, 2020
Accepted January 19, 2020
Proliferation and differentiation of stem cells are required for the formation of a normal tissue structure, for the main
tenance of its homeostasis, and for the repair from damage. A distinctive feature of these cells is the unique organiza
tion of metabolic pathways, in which the contribution of various energy production pathways to the general cellular
metabolism is radically different from that of differentiated cells. Changes in metabolism during the differentiation of
both embryonic and postnatal stem cells have several specific features. Moreover, changes in stem cell metabolism are
not just a consequence of differentiation, but also an active regulator of this process. Metabolic enzymes and inter
mediates regulate and direct the processes of maintaining stemness, self renewal and differentiation of stem cells.
Here we discuss the patterns and molecular mechanisms of switching of stem cells’ metabolism on their transition
from a pluripotent to differentiated state with particular emphasis on how metabolic processes in cells regulate their
functions, their ability to differentiate, and the choice of a specific direction of stem cell development.
Keywords: metabolism, pluripotent stem cells, mesenchymal stem cells, glycolysis, oxidative phosphorylation
БИОХИМИЯ том 85 вып. 3 2020