БИОХИМИЯ, 2020, том 85, вып. 3, с. 335 - 347
УДК 577.29
ВЛИЯНИЕ ОКИСЛЕНИЯ БЕЛКА XRCC1 ЧЕЛОВЕКА
НА ФУНКЦИОНАЛЬНУЮ АКТИВНОСТЬ ЕГО КОМПЛЕКСОВ
С КЛЮЧЕВЫМИ ФЕРМЕНТАМИ ЭКСЦИЗИОННОЙ
РЕПАРАЦИИ ОСНОВАНИЙ ДНК*,**
© 2020
И.А. Васильева1#, Н.А. Моор1#, О.И. Лаврик1,2***
1 Институт химической биологии и фундаментальной медицины СО РАН, 630090 Новосибирск, Россия;
электронная почта: lavrik@niboch.nsc.ru
2 Новосибирский государственный университет, 630090 Новосибирск, Россия
Поступила в редакцию 29.11.2019
После доработки 20.01.2020
Принята к публикации 27.01.2020
Эксцизионная репарация оснований (Base Excision Repair, BER) обеспечивает исправление самых много
численных повреждений ДНК у млекопитающих. Эффективность репарации с помощью этого многосту
пенчатого процесса, протекающего по разным маршрутам, зависит от координированного действия фер
ментов, катализирующих отдельные стадии. Важную роль в координации процессов репарации поврежден
ных оснований и апуриновых/апиримидиновых (АР) сайтов по «короткозаплаточному» маршруту и репа
рации одноцепочечных разрывов играет архитектурный белок XRCC1. В работе впервые с использованием
метода флуоресцентного титрования показано образование in vitro тройного комплекса белка XRCC1 с клю
чевыми ферментами «короткозаплаточной» репарации - ДНК полимеразой β (Polβ) и ДНК лигазой IIIα
(LigIIIα). Зарегистрировано прямое взаимодействие Polβ с LigIIIα, но их комплекс уступает по стабильнос
ти комплексам XRCC1-Polβ и XRCC1-LigIIIα. Исследовано влияние окисления белка XRCC1 и состава
мультибелкового комплекса на эффективность репаративного синтеза и лигирования ДНК. Образование
дисульфидной связи между остатками Cys12 и Cys20 в результате окисления XRCC1, модулирующее срод
ство белка к Polβ (как показано ранее), оказывает влияние на выход как конечного продукта «короткозап
латочной» репарации, так и нелигируемых ДНК интермедиатов (субстратов «длиннозаплаточной» репара
ции). Эффект окисления XRCC1 на выход конечного продукта зависит от присутствия АР эндонуклеазы 1.
Результаты работы и ранее проведенного нами исследования указывают на важную роль окисления XRCC1
в тонкой регуляции процессов формирования и функциональной активности репаративных комплексов.
КЛЮЧЕВЫЕ СЛОВА: эксцизионная репарация оснований ДНК, белок белковые взаимодействия, белок
XRCC1 человека, ДНК полимераза β, ДНК лигаза IIIα.
DOI: 10.31857/S0320972520030045
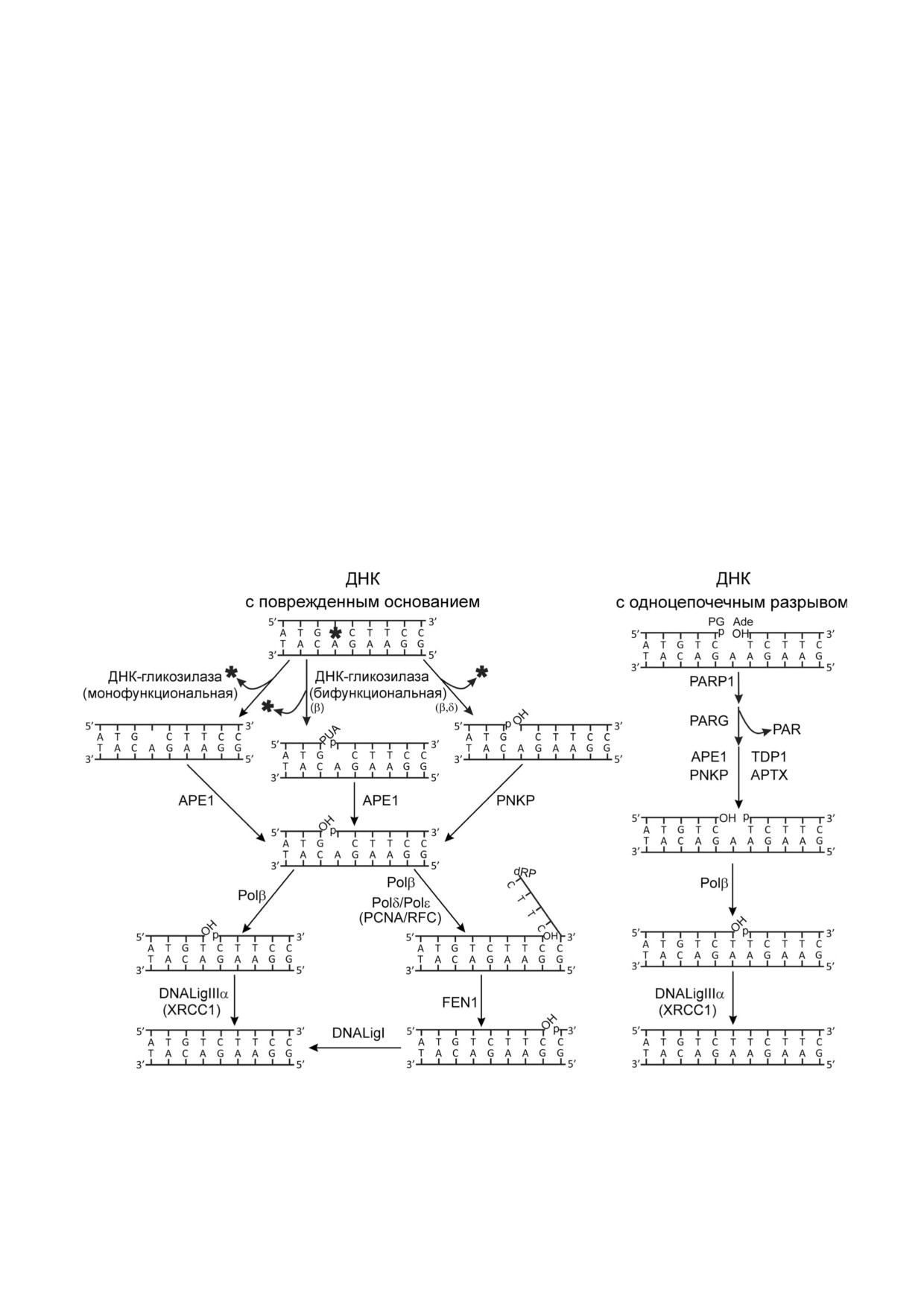
Эксцизионная репарация оснований (Base
Многостадийные процессы коррекции повреж
Excision Repair, BER) обеспечивает исправление
дений ДНК по различным маршрутам BER
самых многочисленных повреждений ДНК у
представлены на рис. 1. Удаление поврежденных
млекопитающих - модифицированных основа
оснований инициируется ДНК гликозилазами,
ний, апуриновых/апиримидиновых (АР) сайтов
специфичными к определенному типу повреж
и одноцепочечных разрывов [1, 2], и является
дения. Моно или бифункциональные ДНК
важнейшей системой для сохранения генома.
гликозилазы катализируют образование интакт
Принятые сокращения: АР сайт - апуриновый/апиримидиновый сайт; APE1 - АР эндонуклеаза 1; dRp - дезок
сирибозофосфат; DTT - дитиотреитол; FAM - 5(6) карбоксифлуоресцеин; FEN1 - флэп эндонуклеаза 1; gap ДНК -
ДНК дуплекс с однонуклеотидной брешью; LigI/LigIIIα - ДНК лигаза I/IIIα; LP BER - «длиннозаплаточная» эксцизи
онная репарация оснований; nick ДНК - ДНК дуплекс с одноцепочечным разрывом; PARP1/PARP2 - поли(АDP рибо
за) полимераза 1/2; Polβ/Polδ/Polε - ДНК полимераза β/δ/ε; SP BER - «короткозаплаточная» эксцизионная репарация
оснований; XRCC1ox - окисленная форма белка XRCC1.
biokhimiya, в рубрике «Papers in Press», BM19 338, 02.03.2020.
** Приложение к статье на английском языке опубликовано на сайте журнала «Biochemistry» (Moscow) и на сайте изда
*** Адресат для корреспонденции.
# Авторы внесли равный вклад в работу.
335
336
ВАСИЛЬЕВА и др.
ного или расщепленного (по механизму β или
участием репликативных ДНК полимераз δ и ε
β/δ элиминации) АР сайта. Интактный АР сайт
(Polδ, Polε), свисающая структура (флэп) удаля
гидролизуется АР эндонуклеазой 1 (APE1); за
ется флэп эндонуклеазой 1 (FEN1), и конечное
тем ДНК полимераза β (Polβ) удаляет остаток
лигирование разрыва завершает ДНК лигаза I
дезоксирибозофосфата (dRp) на 5′ конце разры
(LigI). Репарация одноцепочечных разрывов в
ва с помощью ее dRp лиазной активности. Про
ДНК, возникающих под действием повреждаю
дукты действия бифункциональных ДНК гли
щих факторов или в процессе репарации моди
козилаз содержат 3′ или 5′ концевые блокирую
фицированных оснований и АР сайтов, включа
щие группы, которые удаляются с помощью
ет детекцию разрыва, удаление блокирующих
фосфатазной активности полинуклеотидкина
групп, заполнение бреши и лигирование разры
зы/фосфатазы (PNKP) или 3′ фосфатазной и 3′
ва. Основным детектором разрывов в ДНК явля
фосфодиэстеразной активностей APE1. Основ
ется поли(АDP рибоза) полимераза 1 (PARP1);
ной путь репарации оснований по «короткозап
в деблокировании 3′ и 5′ концов участвуют
латочному» пути (short patch, SP BER) включает
APE1, PNKP, апратаксин (APTX) и тирозил
заполнение однонуклеотидной бреши с по
ДНК фосфодиэстераза 1 (TDP1); Polβ и LigIIIα
мощью ДНК полимеразной активности Polβ и
катализируют заполнение бреши и лигирование.
восстановление целостности цепи с помощью
Взаимодействуя с поврежденной ДНК, PARP1
ДНК лигазы IIIα (LigIIIα). Другой путь, извест
активируется и катализирует синтез поли(АDP
ный как «длиннозаплаточная» репарация (long
рибозы) (PAR) и ее присоединение к себе и дру
patch, LP BER), реализуется в случае модифика
гим белкам участникам репарации. Основной
ции 5′ dRp остатка (не удаляемого с помощью
мишенью этой модификации (PARилирования)
лиазной активности Polβ). Синтез с вытеснени
в процессе BER является белок XRCC1 (X ray
ем цепи инициируется Polβ и продолжается с
repair cross complementing protein 1), в привлече
Рис. 1. Схематическое представление путей репарации поврежденных оснований и одноцепочечных разрывов в ДНК.
Обозначения белков описаны в тексте. Обозначения концевых блокирующих групп в разрывах ДНК следующие: PUA -
3′ фосфо α,β ненасыщенный альдегид, p - 3′ /5′ фосфат, OH - 3′ /5′ ОН группа, dRP - 5′ дезоксирибозофосфат, PG -
3′ фосфогликолят, Ade - 5′ альдегидная группа. Рисунок воспроизводится из обзора [5] с разрешения издателя
БИОХИМИЯ том 85 вып. 3 2020
ВЛИЯНИЕ ОКИСЛЕНИЯ XRCC1 НА АКТИВНОСТЬ КОМПЛЕКСОВ BER
337
нии которого к одноцепочечным разрывам хро
дисульфидной связи между остатками Cys12 и
мосомной ДНК PARP1 играет главную роль [1,
Cys20 в результате окисления XRCC1 индуциру
3]. XRCC1 не имеет ферментативной активности
ет структурную реорганизацию NTD и его
и выполняет функцию «платформы» в организа
комплекса с Polβ, как показано с помощью
ции комплекса BER [3-5]. Практически для всех
рентгеноструктурного анализа комплекса соот
белков участников BER локализованы сайты
ветствующих доменов белков, и усиливает срод
связывания в XRCC1, в формирование которых
ство белков друг к другу [4]. Блокирование обра
вовлечены все его структурные фрагменты: N
зования окисленной формы XRCC1 (XRCC1ox)
концевой (NTD), центральный (BRCTa) и С
в клетках млекопитающих заменой белка
концевой домены (BRCTb) и неупорядоченные
XRCC1 дикого типа на Cys12Ala мутант снижает
линкеры XL1 и XL2 [4, 5].
выживаемость клеток в условиях окислительно
Эффективность репарации с помощью мно
го стресса [14, 15]. Авторы этих исследований
гоступенчатого процесса BER зависит от коор
предполагают, что образование более прочного
динированного действия ферментов, катализи
комплекса XRCC1ox с Polβ необходимо для эф
рующих отдельные стадии. Один из механизмов
фективной репарации окислительных повреж
координации предполагает формирование
дений ДНК in vivo. Однако влияние окисления
мультибелковых комплексов, «репарасом», с
XRCC1 на собственно процесс репаративного
участием ферментов и архитектурных белков,
синтеза ДНК до сих пор не изучено.
каким является XRCC1 [1, 6]. Ранее было пока
зано, что комплекс XRCC1 с LigIIIα критически
важен для стабилизации этого фермента и репа
МЕТОДЫ ИССЛЕДОВАНИЯ
рации in vivo [7, 8]. Этот комплекс был зарегист
рирован в клеточном экстракте неравновесным
Материалы. В работе использованы [γ32Р]АТР
методом гель фильтрации и рассматривался как
(с удельной радиоактивностью 5 Ки/мкмоль)
самый устойчивый среди белковых комплексов
производства лаборатории биотехнологии Инс
с участием XRCC1 [9]. С использованием равно
титута химической биологии и фундаменталь
весного и неравновесного методов нами зареги
ной медицины СО РАН; N оксисукцинимид
стрирован комплекс XRCC1 с Polβ, и впервые
ный эфир 5(6) карбоксифлуоресцеина (FAM
оценена его стабильность в сравнении с ком
SE) и трис(2 карбоксиэтил)фосфин (TCEP)
плексами других белков [10]. Необходимость
(«Sigma», США); глутатион окисленный
этого комплекса для эффективной репарации
(GSSG) («ICN Biomedicals», США); реактивы
in vitro и in vivo и взаимной защиты белков от про
для электрофореза и реактивы, входящие в сос
теасомной деградации была установлена в дру
тав буферных растворов, производства фирмы
гих работах [11-13]. Учитывая, что сайты связы
«Sigma» (США) или отечественного производ
вания Polβ и LigIIIα сформированы разными
ства (квалификации о.с.ч.). В работе использо
доменами XRCC1 (NTD и BRCTb соответствен
ваны рекомбинантные белки эксцизионной ре
но) и не перекрываются с сайтами связывания
парации оснований ДНК млекопитающих.
других участников BER, мы предположили су
Плазмидные векторы для экспрессии в клетках
ществование тройного комплекса этих белков,
Escherichia coli белков АРЕ1 человека и Polβ
как устойчивой «платформы» для формирова
крысы любезно предоставлены доктором Виль
ния более динамичных мультибелковых ансамб
соном (National Institute of Health, North
лей [10]. Для подтверждения этой гипотезы в
Carolina, США), XRCC1 человека - доктором
настоящей работе исследовано взаимодействие
Радицеллой (UMR217 CNRS/CEA, Франция) и
LigIIIα с XRCC1 и Polβ методом флуоресцент
LigIIIα человека - доктором Диановым (Oxford
ного титрования, использованным нами ранее
University, Великобритания). Polβ, XRCC1 и
для характеризации комплекса XRCC1 с Polβ
АРЕ1 получали как описано ранее [16-18].
[10], чтобы сравнить сродство разных белков
LigIIIα получали по оригинальному методу,
друг к другу в одинаковых условиях. Этот равно
описанному ниже. Конечные препараты белков
весный метод позволил зарегистрировать комп
диализовали против буфера хранения, содержа
лексы разных белков участников BER, не де
щего 50 мM Tris HCl (pH 8,0), 200 мM NaCl,
тектируемые часто используемыми неравновес
0,5 мM ЭДТА, 5 мM дитиотреитол (DTT) и 40%
ными методами аффинного соосаждения и
ный (v/v) глицерин, и хранили при -30 °C.
гель фильтрации [5, 10]. Кроме этого, мы иссле
ДНК олигонуклеотиды
(5′ GGAAGACCCT
довали роль тройного комплекса в регуляции
GACGTTACCCAACTTAATCGCC 3′ -матрица,
эффективности SP BER in vitro в зависимости от
5′ GGCGATTAAGTTGGG 3′ - праймер 1, 5′
существования XRCC1 в обычной (восстанов
GGCGATTAAGTTGGGT 3′ - праймер 2 и 5′
ленной) или окисленной форме. Образование
pAACGTCAGGGTCTTCC 3′ - запирающий
БИОХИМИЯ том 85 вып. 3 2020
338
ВАСИЛЬЕВА и др.
праймер) были синтезированы в лаборатории
ровали градиентом
5-600 мМ имидазола
Медицинской химии Института химической био
(pH 8,0) в буфере А. Целевой белок отделяли от
логии и фундаментальной медицины СО РАН.
примесей с помощью последовательных хрома
32P Мечение олигонуклеотидов по 5′ концу бы
тографий на колонках с гепарин сефарозой
ло выполнено с использованием [γ32Р]АТР и T4
(Heparin Sepharose 6 Fast Flow, «GE Healthcare»,
полинуклеотидкиназы («Биосан», Россия) по
Швейцария) и ss ДНК целлюлозой («USB»,
протоколу, рекомендованному производителем.
США), уравновешенных буфером Б (50 мМ Tris
32 звенные ДНК дуплексы с одноцепочечным
HCl (pH 8,0), 100 мМ NaCl, 10 мM β МЕ, 0,5 мМ
разрывом (nick ДНК) или однонуклеотидной
ЭДТА, 5% ный (v/v) глицерин), используя гра
брешью (gap ДНК) в середине цепи были подго
диент 0,1-1,0 М NaCl в буфере Б. Анализ фрак
товлены как описано нами ранее [10].
ций проводили с помощью электрофореза в
Получение окисленной формы белка XRCC1.
10% ном (m/v) Ds Na ПААГ. Фракции, содер
Для получения XRCC1ox использован метод
жащие очищенный белок, концентрировали и
мягкого окисления SH групп в белках [19].
диализовали против буфера хранения в микро
XRCC1 (100 мкМ) инкубировали с GSSG
диализных ячейках 10 кДа («Sartorius», Герма
(10 мМ) в 50 мМ Na фосфатном буфере (pH 7,8),
ния). Функциональную активность LigIIIα тес
содержащем 100 мМ NaCl, в течение 18 ч в тем
тировали в реакции лигирования синтетическо
ноте при 4 °C. Белок диализовали против буфе
го 32 звенного дуплекса, содержащего одноце
ра хранения, не содержащего DTT. Для получе
почечный разрыв (nick ДНК). Реакционную
ния обычной полностью восстановленной фор
смесь (10 мкл), содержащую 50 мМ Tris HCl
мы XRCC1 исходный препарат белка инкубиро
(pH 8,0), 50 мМ NaCl, 10 мМ MgCl2, 7 мМ DTT,
вали с 10 мМ TCEP в течение 18 ч при 4 °C и ди
1 мМ АТР, 50 нМ 5′ [32P] меченный ДНК
ализовали против буфера хранения. Содержа
субстрат и 100-400 нМ LigIIIα, инкубировали
ние SH групп в препаратах XRCC1 и XRCC1ox
30 мин при 37 °С. Реакцию инициировали добав
анализировали колориметрическим методом с
лением фермента и останавливали добавлением
использованием реактива Эллмана [20].
равного объема буфера для нанесения образцов
Экспрессия и очистка ДНК;лигазы IIIα. Пол
на денатурирующий ПААГ (90% ный (v/v) фор
норазмерный ядерный белок LigIIIα человека с
мамид, 20 мM ЭДТА, 0,05% ный (m/v) бромфе
полигистидиновой последовательностью на N
ноловый синий и 0,05% ный (m/v) ксиленциа
конце экспрессировали в клетках E. coli BL21
нол). Образцы инкубировали 2 мин при 90 °С, и
(DE3) Rosetta 2. После трансформации плазми
продукты реакции разделяли электрофорезом в
дой клетки подращивали при 30 °C в среде LB до
20% ном (m/v) ПААГ с мочевиной. Для визуали
A600 0,6 и после индукции 1 мМ изопропил β D
зации гелей и количественного анализа продук
1 тиогалактопиранозидом инкубировали 4 ч при
тов реакции использовали сканер Typhoon FLA
18 °C; клетки осаждали центрифугированием
9500 («GE Healthcare», Швейцария) и программу
(7000 об./мин при 4 °С) («Beckman Coulter Inc»,
Quantity One («Bio Rad», США).
США) и хранили при -40 °C. Биомассу оттаива
Флуоресцентное мечение ДНК;лигазы IIIα и
ли на льду и ресуспендировали в предварительно
исследование образования белковых комплексов
охлажденном буфере для лизиса, содержащем
методом флуоресцентного титрования. Мечение
50 мМ Tris HCl (pH 8,0), 300 мМ NaCl, 1% ный
LigIIIα N оксисукцинимидным эфиром 5(6)
(v/v) детергент NP 40, 1 мМ β меркаптоэтанол
карбоксифлуоресцеина (FAM SE) по N конце
(β МЕ), 10% ный (v/v) глицерин, 1 мМ фенил
вой аминогруппе белка проводили по методу,
метилсульфонил фторид (PMSF), 1 мМ бенза
разработанному нами ранее [10]. Белок диализо
мидин (Bz) и таблетку ингибиторного коктейля
вали 4 раза против буфера, содержащего 100 мМ
(«Roche», Швейцария). После инкубации с лизо
Mes (pH 7,0) и 200 мМ NaCl, используя микроди
цимом (1,5 мг/мл; «Boehringer Mannheim», Герма
ализную ячейку 10 кДа. Реакцию с FAM SE про
ния) в течение 20 мин во льду клетки разрушали
водили в этом же буфере, инкубируя 20-50 мкМ
ультразвуком («Bandelin», Германия) до получе
LigIIIα с 40-200 мкМ реагентом в течение 18 ч
ния гомогенной суспензии, и клеточный дебрис
при 4 °С в темноте. Реакцию останавливали до
отделяли центрифугированием (18000 об./мин
бавлением к реакционной смеси (30-50 мкл) бу
при 4 °С) («Beckman Coulter Inc», США). К су
фера, содержащего 100 мМ Hepes (pH 8,0),
пернатанту добавляли имидазол (pH 8,0) до
200 мМ NaCl и 10 мМ DTT, до конечного объема
5 мМ, и сорбировали белки на Ni сефарозе (Ni
500 мкл. Белок отделяли от избытка реагента
Sepharose 6 Fast Flow, «GE Healthcare», Швейца
гель фильтрацией на микроколонке Spin Trap G
рия), уравновешенной буфером А (50 мМ Tris
25 («GE Healthcare», Швейцария). После концен
HCl (pH 8,0), 300 мМ NaCl, 3 мМ β МЕ, 1 мМ
трирования к белку добавляли глицерин до 40%
PMSF, 1 мМ Bz и 5 мМ имидазол). Белки элюи
для хранения при -30 °С и цетиловый эфир по
БИОХИМИЯ том 85 вып. 3 2020
ВЛИЯНИЕ ОКИСЛЕНИЯ XRCC1 НА АКТИВНОСТЬ КОМПЛЕКСОВ BER
339
лиоксиэтилена Brij 58 («Sigma», США) до 0,001%
10 мкл) содержала 50 мМ Tris HCl (pH 8,0),
для предотвращения агрегации белка. Концент
50 мМ NaCl, 6 мМ MgCl2, 50 нМ 32Р меченную
рацию белка и степень его мечения определяли
gap ДНК, 10-50 нМ Polβ. Реакцию иницииро
спектрофотометрически на приборе CLARIOstar
вали добавлением смеси нуклеотидов dATP,
(«GMB Labtech GmbH», Германия), используя
dGTP, dTTP и ddCTP до конечной концентра
коэффициенты экстинкции для FAM ε494
ции каждого нуклеотида 10 мкМ. Смеси инку
80445 M-1⋅см-1 и для LigIIIα ε280 79300 M-1⋅см-1.
бировали при 37 °C в течение 30 мин. При изу
Специфическую активность меченого фермента
чении влияния белков на выход продуктов стан
тестировали в реакции лигирования 32Р мечен
дартная смесь содержала 50 нМ Polβ, 50-200 нМ
ной nick ДНК как описано выше.
XRCC1 или XRCC1ох,
10-50 нМ APE1,
Эксперименты по связыванию FAM LigIIIα
10-50 нМ LigIIIα (в присутствии 1 мМ АТР),
другими белками выполняли титрованием мече
как указано в подписях к рисункам. Реакцию
ного белка (при фиксированной концентрации
останавливали добавлением равного объема бу
40 нМ) отдельными белками Polβ и XRCC1 (в
фера для нанесения образцов на денатурирую
отсутствие или в присутствии второго партнера
щий ПААГ. Образцы инкубировали 2 мин при
в концентрации 200 нМ) или эквимолярной
90 °С, и продукты реакции разделяли электро
смесью XRCC1 и Polβ. Буфер связывания содер
форезом в денатурирующем 20% ном (m/v) ПААГ
жал 50 мМ Hepes (рН 8,0), 100 мМ NaCl и 5 мМ
с мочевиной. Гели визуализировали с помощью
DTT. Измерения интенсивности флуоресцен
сканера Typhoon FLA 9500 и анализировали вы
ции образцов (объемом 12 мкл) проводили в
ход продуктов реакции с помощью программы
непрозрачных полипропиленовых планшетах
Quantity One.
(«Corning», США) с использованием микро
планшетного флуориметра CLARIOstar («GMB
Labtech GmbH», Германия). Длина волны воз
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
буждения флуоресценции составляла 485 нм,
изменение интенсивности флуоресценции де
Исследование взаимодействия ДНК;лигазы
тектировали на длине волны эмиссии 530 нм. В
IIIα с белком XRCC1 и ДНК;полимеразой β. Вза
каждом независимом эксперименте измерения
имодействие LigIIIα с архитектурным белком
интенсивности флуоресценции при каждой
XRCC1 и ферментом Polβ, катализирующим в
концентрации белка партнера проводились для
процессе
«короткозаплаточной» репарации
трех одинаковых образцов. Количественную об
синтез субстрата LigIIIα, было исследовано ме
работку экспериментальных данных выполняли
тодом флуоресцентного титрования путем изме
в программе MARS Data analysis («GMB Labtech
рения интенсивности флуоресценции FAM ме
GmbH», Германия). Кривые связывания описы
ченой LigIIIα в отсутствие и в присутствии не
ваются уравнением:
меченых белков (XRCC1, Polβ). Для мечения
LigIIIα
N оксисукцинимидным эфиром
F = F0 + (F∞ - F0)/[1 + (EC50/C)n],
5(6)карбоксифлуоресцеина (FAM SE) преиму
щественно по N концевой аминогруппе белка
где F0, F и F∞ - интенсивность флуоресценции
реакцию модификации проводили при рН 7,0
раствора FAM LigIIIα в отсутствие других бел
[21]. Условия реакции были оптимизированы
ков, в присутствии белка партнера в данной (С)
варьированием концентрации белка и реагента
и насыщающей концентрации соответственно,
для получения полностью активного белка, со
EC50 - концентрация белка партнера, при кото
держащего не более одного остатка флуоресцеи
рой F - F0 = (F∞ - F0)/2, n - коэффициент Хил
на на молекулу белка. Такой препарат со стехио
ла. Все независимые эксперименты были вы
метрией мечения ~0,5 моль FAM на 1 моль бел
полнены не менее трех раз. Кривые связывания
ка был получен при инкубации 50 мкМ белка с
по усредненным экспериментальным данным
200 мкМ реагента.
построены в программе OriginPro 8.6; степень
Типичные кривые титрования FAM LigIIIα
связывания, соответствующая максимальному
немечеными белками (LigIIIα, Polβ и XRCC1) и
сигналу при насыщающей концентрации белка
соответствующие кривые связывания белков
партнера (F∞ - F0), принята за единицу, а сте
представлены на рис. 2. Максимальное увеличе
пень связывания при данной концентрации оп
ние интенсивности флуоресценции меченого
ределена как отношение (F - F0)/(F∞ - F0).
белка в присутствии насыщающих концентра
Регистрация продуктов репарации ДНК, со;
ций белков партнеров не превышало 20%, в от
держащей однонуклеотидную брешь, в присут;
личие от зарегистрированных нами ранее для
ствии ферментов и белков;участников SP BER.
других FAM меченых белков изменений в 1,5-2
Стандартная реакционная смесь (объемом
раза [10]. Такое различие может быть обусловле
БИОХИМИЯ том 85 вып. 3 2020
340
ВАСИЛЬЕВА и др.
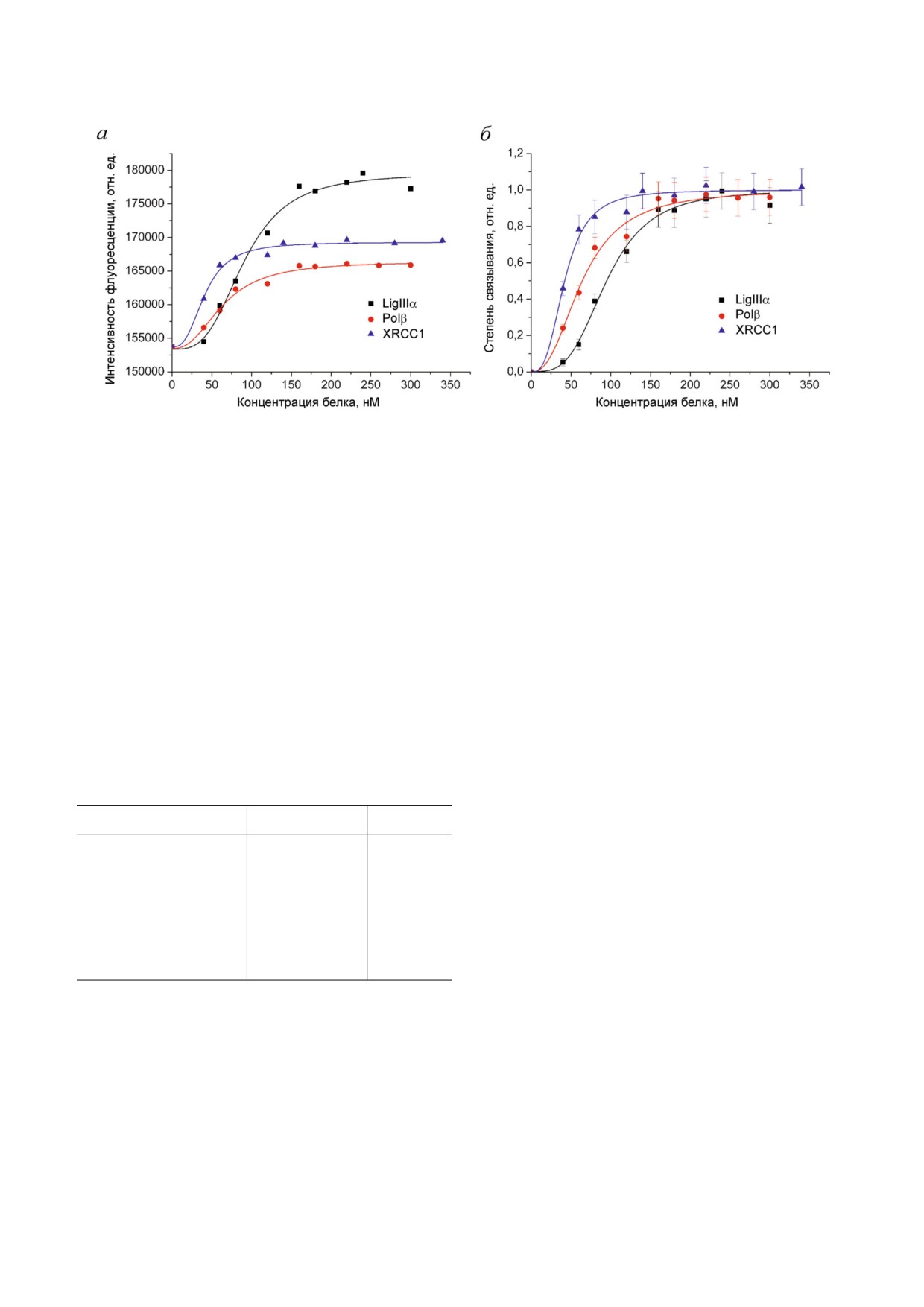
Рис. 2. Исследование гомо и гетеро ассоциации LigIIIα с белками участниками BER методом флуоресцентного титрова
ния. На панели а представлены типичные экспериментальные кривые титрования FAM меченой LigIIIα (40 нМ) немече
ными белками (LigIIIα, Polβ и XRCC1), на панели б - кривые связывания, рассчитанные из данных 3-5 независимых экс
периментов (на графиках приведены средние значения ± стандартные отклонения).
biokhsm/
но удаленностью флуорофора в FAM LigIIIα от
щуюся равновесную константу диссоциации
С концевого BRCT домена, на котором локали
комплекса. Сравнение этих характеристик для
зованы сайты как гомо ассоциации LigIIIα, так
разных белков (таблица) указывает на образова
и ее гетеро ассоциации с белком XRCC1 [5].
ние более прочных комплексов при гетеро ассо
Эффективная концентрация белка партнера
циации, чем при гомо ассоциации LigIIIα.
(ЕС50), при которой увеличение интенсивности
Сродство LigIIIα к XRCC1 (ЕС50 = 42 нМ) в 1,5
флуоресценции по сравнению с начальным
раза выше, чем к Polβ (ЕС50 = 64 нМ). В то же
уровнем (F - F0) составляет половину от макси
время XRCC1 обладает более высоким срод
мального увеличения при насыщающей концен
ством к Polβ (ЕС50 = 23 нМ [10]), чем к LigIIIα. В
трации [(F∞ - F0)/2], представляет собой кажу
целом, комплексы белка XRCC1 с Polβ и LigIIIα
являются самыми прочными среди всех ком
плексов белков участников BER, охарактеризо
Количественные характеристики взаимодействия LigIIIα с
ванных нами одним и тем же равновесным ме
белками BER
тодом [10].
Чтобы зарегистрировать формирование
Меченый белока
Белок партнерб
EC50в, нМ
тройного комплекса XRCC1 с LigIIIα и Polβ к
FAM LigIIIα
LigIIIα
91 ± 16
смеси FAM LigIIIα с одним из партнеров (Polβ
FAM LigIIIα
Polβ
64 ± 11
или XRCC1), присутствующим в высокой (прак
тически насыщающей) концентрации, добавля
FAM LigIIIα
XRCC1
42 ± 8
ли в возрастающей концентрации третий белок
FAM LigIIIα
Polβ + XRCC1
46 ± 8
(XRCC1 или Polβ). В каждом эксперименте из
FAM LigIIIα + Polβ
XRCC1
70 ± 13
меряли параллельно интенсивность флуорес
FAM LigIIIα + XRCC1
Polβ
н.о.г
ценции FAM LigIIIα при титровании соответ
ствующим белком. Более высокий нулевой сиг
а Титрование FAM LigIIIα (40 нМ) белком партнером про
нал флуоресценции (F0) для смеси FAM LigIIIα
водилось в отсутствие или в присутствии предварительно
с Polβ или XRCC1 в сравнении с FAM LigIIIα
добавленного белка (Polβ или XRCC1) в избыточной кон
(рис. 3, а и б) обусловлен образованием двойно
центрации (200 нМ).
б Титрование FAM LigIIIα отдельными белками или экви
го комплекса. Увеличение этого сигнала при до
молярной смесью Polβ и XRCC1.
бавлении XRCC1 к смеси FAM LigIIIα с Polβ
в Кажущиеся равновесные константы диссоциации ком
(рис. 3, а) свидетельствует о взаимодействии
плексов белков. Приведены средние значения ± стандарт
XRCC1 с FAM LigIIIα, несмотря на присутствие
ные отклонения 3-5 независимых экспериментов.
г Не определена из за отсутствия изменения интенсивнос
в смеси более предпочтительного для XRCC1
ти флуоресценции.
партнера в избыточной концентрации. Величи
БИОХИМИЯ том 85 вып. 3 2020
ВЛИЯНИЕ ОКИСЛЕНИЯ XRCC1 НА АКТИВНОСТЬ КОМПЛЕКСОВ BER
341
на ЕС50 для связывания FAM LigIIIα с XRCC1 в
различное окружение флуорофора при образо
тройной смеси (70 нМ) ниже суммарной концен
вании двойного комплекса FAM LigIIIα с Polβ
трации XRCC1, необходимой для независимого
или тройного комплекса с Polβ и XRCC1. Вели
связывания половины FAM LigIIIα (42 нМ) и
чина ЕС50 для связывания FAM LigIIIα в трой
половины Polβ (не менее 100 нМ), что указыва
ной смеси (46 нМ) сопоставима с величиной
ет на формирование тройного комплекса бел
ЕС50 для ее двойного комплекса с XRCC1
ков. Отсутствие изменения нулевого сигнала
(42 нМ). Совокупность этих фактов свидетель
флуоресценции смеси FAM LigIIIα с XRCC1
ствует о преимущественном взаимодействии
при добавлении Polβ (рис. 3, б) свидетельствует
LigIIIα с белком XRCC1 в их тройном комплек
о том, что связывание Polβ с XRCC1 при образо
се с Polβ. Таким образом, впервые показано пря
вании тройного комплекса не оказывает суще
мое взаимодействие между ферментами Polβ и
ственного влияния на взаимодействие между
LigIIIα, катализирующими последовательные
XRCC1 и FAM LigIIIα. Титрование FAM
стадии SP BER, а также образование их тройно
LigIIIα эквимолярной смесью Polβ и XRCC1 по
го комплекса с координирующим белком
казало увеличение интенсивности флуоресцен
XRCC1 (Polβ•XRCC1•LigIIIα). Ранее было по
ции до более высокого уровня, чем при титрова
казано прямое взаимодействие Polβ с фермен
нии белком Polβ (рис. 3, в), что указывает на
том LigI, завершающим LP BER [22].
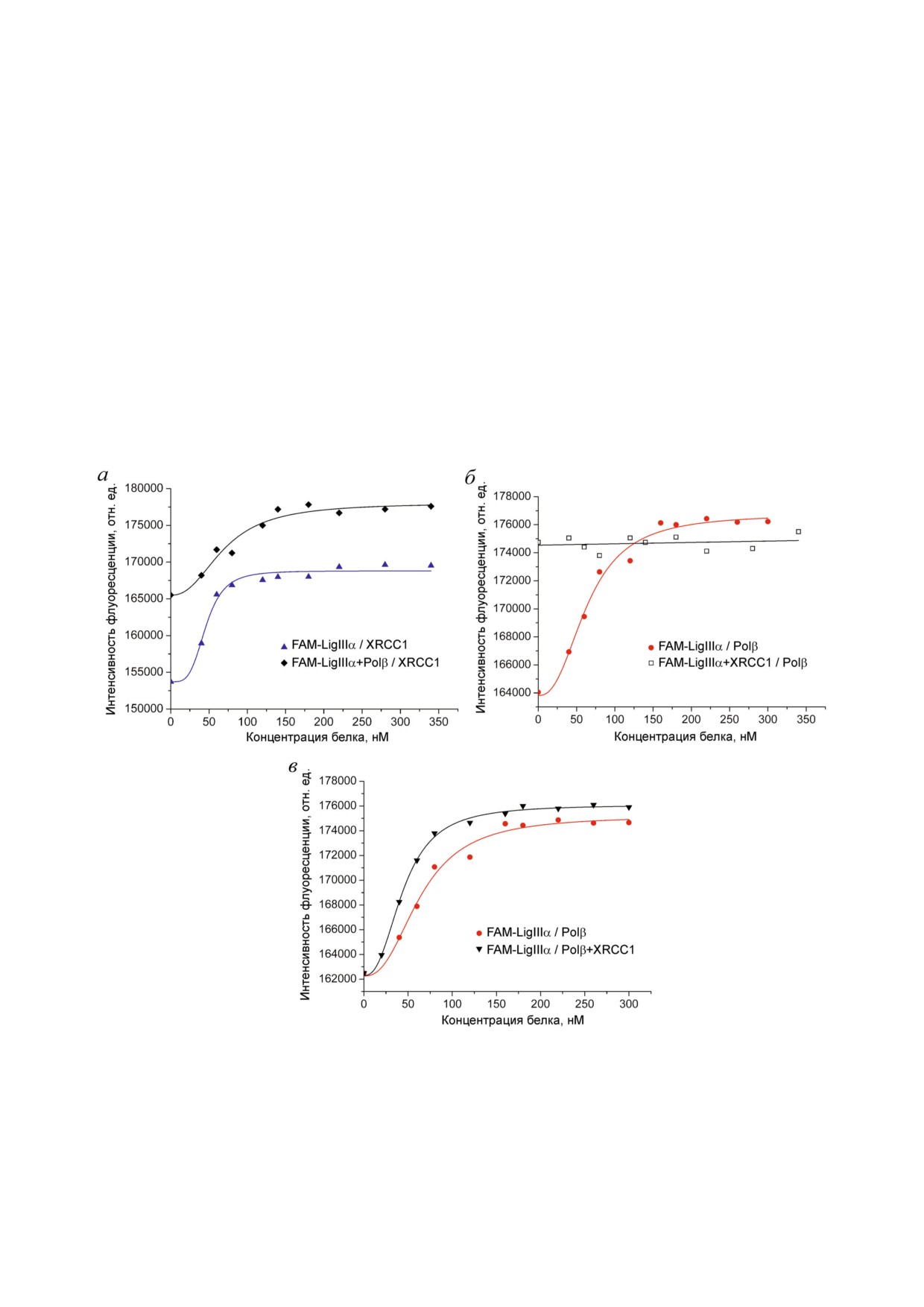
Рис. 3. Исследование формирования тройного комплекса LigIIIα с Polβ и XRCC1. Типичные кривые флуоресцентного
титрования (а) FAM LigIIIα (40 нМ) в отсутствие и в присутствии Polβ (200 нМ) белком XRCC1; (б) FAM LigIIIα (40 нМ)
в отсутствие и в присутствии XRCC1 (200 нМ) белком Polβ; (в) FAM LigIIIα (40 нМ) белком Polβ или эквимолярной
смесью белков Polβ и XRCC1. Кривые связывания, рассчитанные из усредненных данных независимых экспериментов,
приведены на рис. S1 в Приложении к статье.
biokhsm/
БИОХИМИЯ том 85 вып. 3 2020
342
ВАСИЛЬЕВА и др.
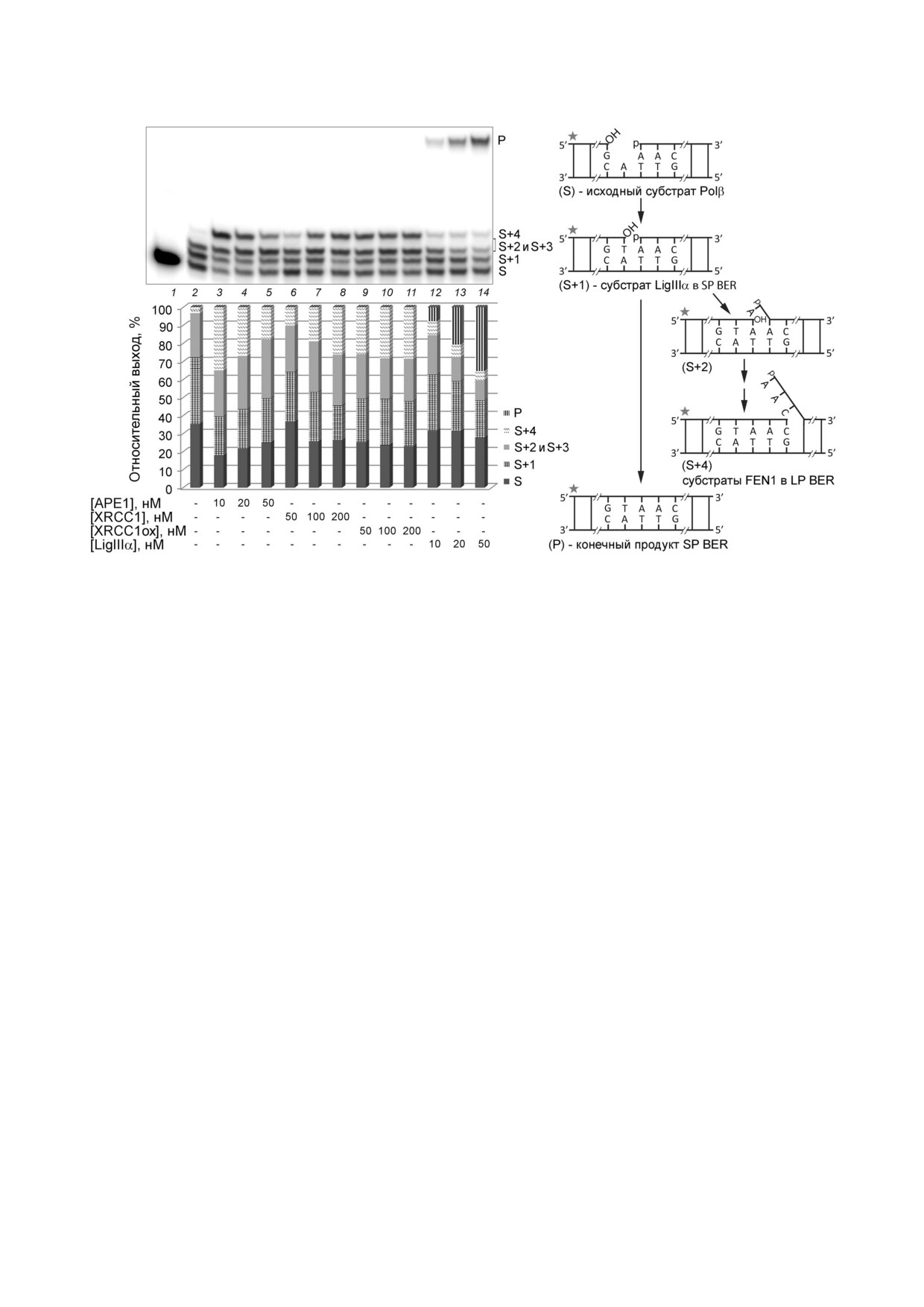
Рис. 4. Влияние на активность Polβ в репаративном синтезе ДНК белков участников BER при их различных концентра
циях. Представлены радиоавтограф геля после разделения продуктов репаративного синтеза ДНК, катализируемого Polβ
в отсутствие и в присутствии других белков, и гистограмма относительных выходов продуктов удлинения и лигирования
цепи ДНК в соответствующих образцах. 32P меченную gap ДНК (50 нМ) инкубировали с Polβ (50 нМ) и смесью dATP,
dGTP, dTTP и ddCTP (10 мкМ каждого) в течение 30 мин при 37 °С (дорожки 2-14) в отсутствие или в присутствии АРЕ1
(10-50 нМ), XRCC1 или XRCC1ox (50-200 нМ) или LigIIIα (10-50 нМ). Остальные условия реакции описаны в Методах
исследования. Обозначения: S - 32P меченный праймер (15 мер) в исходной ДНК, S+1 - S+4 - продукты удлинения
праймера, Р - конечный продукт репарации цепи после лигирования (32 мер); соответствующие структуры дуплексов
(интермедиатов разных стадий SP/LP BER) приведены на схеме справа, где звездочкой показано положение 32P метки.
Для продуктов включения одного/двух остатков dAМP (S+2 и S+3), не разрешенных в геле, приведен их суммарный вы
ход. Представлены данные одного из трех независимых экспериментов; отклонения значений относительных выходов от
средних значений составляли 2-10%
Исследование влияния на репаративный син;
трации белка от 50 до 200 нМ: доля продукта, со
тез ДНК, катализируемый ДНК;полимеразой β,
ответствующего включению одного нуклеотида
других белков. Для исследования влияния бел
в репарируемую цепь (S+1) уменьшалась, а доля
ковых комплексов различного состава на актив
продукта, соответствующего включению
ность Polβ в репаративном синтезе предвари
4 х нуклеотидов (S+4) увеличивалась (рис. 4,
тельно были найдены концентрации отдельных
дорожки 6-8). В случае окисленной формы
белков, при которых наблюдали активацию Polβ
XRCC1 (XRCC1ox) не обнаружено зависимости
(рис. 4). Условия реакции были оптимизирова
эффектов от концентрации белка, варьируемой
ны по концентрации Polβ и времени инкубации,
в том же диапазоне (рис. 4, дорожки 9-11). Для
чтобы тестировать продукты
«коротко » и
сравнения XRCC1 и в последующих экспери
«длиннозаплаточного» синтеза ДНК (заполне
ментах (в присутствии других участников) была
ния бреши в gap ДНК и синтеза с вытеснением
выбрана концентрация 100 нМ, при которой
цепи соответственно) при неполном превраще
наблюдали влияние обычной формы на общую
нии субстрата. Для ограничения длины продук
эффективность превращения исходного
тов синтеза с вытеснением цепи включением
субстрата и различия двух форм в оказываемых
четырех нуклеотидов, реакцию проводили в
эффектах. LigIIIα наряду с каталитическим
присутствии соответствующего дидезоксинук
превращением продукта заполнения бреши
леотида (ddCTP). Стимулирующее влияние
(S+1) в конечный продукт «короткозаплаточ
обычной формы XRCC1 на синтез ДНК с вытес
ной» репарации (Р) стимулировала синтез с вы
нением цепи возрастало с увеличением концен
теснением цепи; этот эффект уменьшался с уве
БИОХИМИЯ том 85 вып. 3 2020
ВЛИЯНИЕ ОКИСЛЕНИЯ XRCC1 НА АКТИВНОСТЬ КОМПЛЕКСОВ BER
343
Рис. 5. Влияние белков участников BER на репаративный синтез ДНК, катализируемый Polβ. Представлены радиоавто
граф геля после разделения продуктов репаративного синтеза ДНК, катализируемого Polβ в отсутствие и в присутствии
других белков (APE1, XRCC1, XRCC1ox и LigIIIα), и гистограмма относительных выходов продуктов удлинения и лиги
рования цепи ДНК в соответствующих образцах. 32P меченную gap ДНК (50 нМ) инкубировали с Polβ (50 нМ) и смесью
dATP, dGTP, dTTP и ddCTP (10 мкМ каждого) в течение 30 мин при 37°С (дорожки 2-13), в отсутствие или в присутствии
(+) APE1 (50 нМ), разных форм XRCC1 (100 нМ) или LigIIIα (50 нМ). Остальные условия реакции описаны в «Методах
исследования». Для продуктов включения одного/двух остатков dAМP (S+2 и S+3), не разрешенных в геле, приведен их
суммарный выход. Обозначения регистрируемых в геле ДНК расшифрованы в подписи к рис. 4. Представлены данные
одного из трех независимых экспериментов; отклонения значений относительных выходов от средних значений состав
ляли 2-10%
личением концентрации фермента из за более
действию на синтез с вытеснением цепи (увели
эффективного лигирования (рис. 4, дорожки
чению выхода S+4) белки можно расположить в
12-14). В качестве оптимальной была выбрана
следующий ряд: XRCC1ox > XRCC1 > АРЕ1 >
концентрация 50 нМ, при которой заметно
LigIIIα. Окисленная форма XRCC1 значительно
уменьшалась доля исходного субстрата. Стиму
превосходит обычную форму в этом действии:
лирующее влияние АРЕ1 на синтез ДНК с вы
доля S+4 в присутствии XRCC1ox больше в 2 ра
теснением цепи и общую эффективность прев
за, чем в присутствии XRCC1. Такое различие
ращения исходного субстрата уменьшалось с
может быть объяснено более высоким срод
увеличением концентрации белка от 10 до
ством XRCC1ox к Polβ [4].
50 нМ из за 3′ 5′ экзонуклеазной активности
АРЕ1 усиливает стимулирующий эффект
фермента (рис. 4, дорожки 3-5), но еще наблю
XRCC1 на синтез с вытеснением цепи в боль
далось при концентрации 50 нМ, используемой
шей степени, чем стимулирующий эффект
в последующих экспериментах.
XRCC1ox: доля S+4 увеличивается в 2,7 раза в
Как видно из данных, представленных на
первом случае и в 1,3 раза во втором (рис. 5, до
рис.
5, отдельные белки АРЕ1, XRCC1,
рожки 6 и 7 по сравнению с дорожками 4 и 5). В
XRCC1ox и LigIIIα оказывают сравнимые эф
результате этого в присутствии АРЕ1 нивелиру
фекты на общую эффективность превращения
ются различия между разными формами
исходного субстрата: его доля в их присутствии
XRCC1. Формирование тройного комплекса
уменьшается на ~10% (дорожки 3, 4, 5 и 8 по
XRCC1 с Polβ и АРЕ1 показано нами ранее [10].
сравнению с дорожкой 2). По стимулирующему
Сайт связывания АРЕ1 локализован в линкер
БИОХИМИЯ том 85 вып. 3 2020
344
ВАСИЛЬЕВА и др.
ной области (XL1), примыкающей к N концево
Наличие в реакционной смеси всех белков
му домену XRCC1 (NTD), где локализован сайт
участников SP BER показывает наиболее эф
связывания Polβ [4]. Не исключено, что окисле
фективную репарацию в комплексе с обычной
ние XRCC1 индуцирует перестройку не только
формой XRCC1: в ее присутствии выход конеч
NTD, где образуется (-S-S-) связь между ос
ного продукта на 10% выше, чем в присутствии
татками Cys12 и Cys20, но и в трехмерной струк
XRCC1ox (рис. 5, дорожка 12 по сравнению с
туре белка в целом. Более прочное связывание
дорожкой 13). Кроме этого, эффективность ре
XRCC1ox с Polβ может оказывать негативное
парации в присутствии АРЕ1, LigIIIα и XRCC1
влияние на формирование их тройного ком
выше, чем в присутствии АРЕ1 и LigIIIα (на 9%)
плекса с АРЕ1.
или LigIIIα и XRCC1 (на 15%) (дорожка 12 по
Совместное действие LigIIIα и XRCC1ox на
сравнению с дорожками 11 и 9). Такой результат
общую эффективность превращения субстрата
может быть обусловлен комбинацией более
несколько превосходит действие LigIIIα и
сильного действия АРЕ1 по сравнению с XRCC1
XRCC1 (рис. 5, дорожка 10 по сравнению с до
или XRCC1ox на активность LigIIIα и понижен
рожкой 9). LigIIIα подавляет стимулирующий
ным стимулирующим действием XRCC1 по
эффект обеих форм XRCC1 на синтез с вытесне
сравнению с XRCC1ox на синтез нелигируемых
нием цепи, но превосходство XRCC1ox над
ДНК интермедиатов, что в целом может указы
XRCC1 в стимуляции этого синтеза сохраняется
вать на формирование в случае XRCC1 более ус
и в присутствии LigIIIα (дорожки 9 и 10 по срав
тойчивого мультибелкового ансамбля с участи
нению с дорожками 4 и 5 и по сравнению друг с
ем всех белков. Действительно, распределение
другом). В свою очередь, обе формы XRCC1 уси
продуктов в присутствии LigIIIα и XRCC1ox ме
ливают активность LigIIIα: выход конечного
няется незначительно при добавлении АРЕ1
продукта репарации увеличивается на 6% и 9% в
(дорожка 10 по сравнению с дорожкой 13). Та
присутствии XRCC1 и XRCC1ox соответственно
ким образом, влияние окисления белка XRCC1
(дорожки 9 и 10 по сравнению с дорожкой 8).
на эффективность репарации ДНК субстрата,
Интересно отметить, что суммарные выходы ли
катализируемой Polβ по «короткозаплаточному»
гируемого интермедиата (S+1) и конечного про
маршруту, зависит от состава «репарасомы».
дукта «короткозаплаточной» репарации (Р) очень
близки в присутствии LigIIIα и XRCC1 (61%)
С использованием равновесного метода
или LigIIIα и XRCC1ox (59%), но степень прев
флуоресцентного титрования нами впервые по
ращения S+1 в конечный продукт выше во вто
казано образование in vitro тройного комплекса
ром случае (72% и 80% соответственно). Можно
ключевых участников SP BER - архитектурного
предположить, что формирование тройного
белка XRCC1 с ферментами Polβ и LigIIIα. Polβ
комплекса белков и стабилизация взаимодей
и LigIIIα, прямое взаимодействие которых в от
ствия Polβ с XRCC1ox (по сравнению с комплек
сутствие XRCC1 зарегистрировано впервые, об
сом Polβ с XRCC1) способствуют передаче ДНК
разуют менее прочный комплекс по сравнению
интермедиата от одного фермента другому.
с комплексами Polβ XRCC1 и LigIIIα XRCC1.
Общая эффективность превращения суб
Эти результаты объясняют, почему образование
страта при совместном присутствии АРЕ1 и
тройного комплекса может обеспечить более
LigIIIα несколько превышает соответствующие
эффективную координацию заключительных
уровни в присутствии отдельных белков (рис. 5,
стадий процесса BER. Тройной комплекс бел
дорожка 11 по сравнению с дорожками 3 и 8).
ков не был зарегистрирован в цельноклеточном
АРЕ1 стимулирует активность LigIIIα более эф
экстракте [9], что может быть обусловлено его
фективно, чем XRCC1 и XRCC1ox: выход ко
нестабильностью в неравновесных условиях
нечного продукта увеличивается на 12% (дорож
гель фильтрации и/или дестабилизирующим
ка 11 по сравнению с дорожками 9 и 10). В свою
действием других белков экстракта. В то же вре
очередь, LigIIIα подавляет стимулирующий эф
мя, в другой работе показано совместное присут
фект АРЕ1 на синтез нелигируемых интермеди
ствие XRCC1, Polβ и LigIIIα в целом ряде муль
атов (S+2, S+3 и S+4): их выход в присутствии
тибелковых комплексов BER, выделенных из
АРЕ1 и LigIIIα в 2,5 раза ниже, чем в присут
ядерных экстрактов [24]. В пользу существова
ствии АРЕ1 и почти такой же, как в присутствии
ния тройного комплекса in vivo указывает син
LigIIIα (дорожка 11 по сравнению с дорожками
хронная локализация XRCC1, Polβ и LigIIIα на
3 и 8). Активирующее действие АРЕ1 на лигиро
повреждениях ДНК [25].
вание ДНК известно для LigI и указывает на ак
Стабильность комплекса XRCC1 с Polβ регу
тивную роль фермента, ответственного за де
лируется окислением архитектурного белка с
блокирование 3′ концов в разрывах, в коорди
образованием дисульфидной связи между остат
нации всего процесса репарации [23].
ками Cys12 и Cys20 в N концевом домене, где
БИОХИМИЯ том 85 вып. 3 2020
ВЛИЯНИЕ ОКИСЛЕНИЯ XRCC1 НА АКТИВНОСТЬ КОМПЛЕКСОВ BER
345
локализован сайт связывания Polβ [4]. XRCC1ox
мами XRCC1 в их способности регулировать
присутствует в клетках млекопитающих, и от от
уровень автомодификации PARP1 усиливается в
носительного содержания этой формы XRCC1
присутствии Polβ [28], что указывает на возмож
зависит цитотоксичность окислительных аген
ную кооперацию XRCC1 и Polβ в этом процессе.
тов, обусловленная дефицитом BER [14, 15].
Таким образом, соотношение уровней XRCC1 и
Значительное различие клеток, экспрессирую
XRCC1ox может регулировать время жизни
щих XRCC1 дикого типа или его Cys12Ala му
комплекса PAR-PARP1 с поврежденной ДНК.
тант (не образующий окисленной формы), в их
В настоящем исследовании мы обнаружили, что
выживаемости обнаружено лишь в экстремаль
присутствие в большинстве исследованных
ных условиях окисления - при подавлении ак
комплексов XRCC1ox вместо XRCC1 увеличи
тивности системы, синтезирующей глутатион
вает долю нелигируемых ДНК интермедиатов,
[15]. Показано, что наличие окисленной формы
что требует их более эффективной репарации в
XRCC1 ускоряет аккумуляцию Polβ на повреж
повторном цикле. Их репарация может проис
дениях ДНК [14, 15], но до сих пор не установ
ходить по «длиннозаплаточному» маршруту с
лено как окислительная модификация XRCC1
участием Polβ и FEN1. В свою очередь, актив
может влиять на формирование репаративных
ность Polβ в LP BER регулируется PARP1 и его
комплексов и собственно процесс репарации. С
PARилированием: PARP1 подавляет синтез
использованием реконструированной системы
ДНК и FEN1 зависимую стимуляцию репара
мы показали, что от образования тройного
ции, но его ингибирующее действие снижается
комплекса и окисления белка XRCC1 зависит
при автомодификации PARP1 [29]. В то же вре
эффективность репарации ДНК по «коротко
мя взаимодействие PARP1 с ДНК интермедиа
заплаточному» маршруту BER. XRCC1ox пре
тами SP BER не влияет на эффективность репа
восходит обычную форму XRCC1 в стимулиру
рации по этому маршруту из за отсутствия ин
ющем действии на каталитическую активность
гибирующего действия PARP1 на dRp лиазную
Polβ и LigIIIα. Однако в присутствии АРЕ1
активность Polβ и лигирующую активность
окисление XRCC1 снижает выход конечного
LigIIIα [29-31]. Таким образом, обеспечивая
продукта репарации. Таким образом, стимуля
тонкую регуляцию уровня автомодификации
ция репаративного синтеза ДНК окислением
PARP1, окисление XRCC1 может способство
XRCC1 может иметь значение для эффективно
вать более эффективной репарации нелигируе
го восстановления некоторых повреждений
мых ДНК интермедиатов в повторном цикле с
ДНК. Так, репарация поврежденных основа
участием PARP1. Совокупность результатов ра
ний, удаляемых бифункциональными ДНК
нее проведенного [28] и настоящего исследова
гликозилазами по механизму β/δ элиминации, и
ния позволяет заключить, что окислительно
ряда одноцепочечных разрывов не требует учас
восстановительный статус XRCC1 может влиять
тия АРЕ1 (рис. 1).
на эффективность BER как на стадии формиро
Состав белковых комплексов BER зависит
вания репаративных комплексов регуляцией
от типа и уровня повреждений ДНК, и репара
уровня автомодификации PARP1, так и на ста
ция при высоких уровнях любых повреждений
дии репаративного синтеза.
требует участия PARP1 для более эффективной
сборки репаративных комплексов [24]. Уровень
автомодификации PARP1 синтезируемым поли
Финансирование. Наработка рекомбинант
мером ADP рибозы (PAR) влияет на сродство
ных белков для исследования выполнена при
PARP1 к ДНК интермедиатам BER и рассмат
поддержке Программы фундаментальных науч
ривается как фактор регуляции процесса репа
ных исследований государственных академий
рации ДНК [1, 3]. XRCC1 обладает высоким
наук на
2013-2020 гг.
(№ АААА А17
сродством к PAR и играет первостепенную роль
117020210022 4); исследование белок белковых
в сборке комплексов репарации с участием
взаимодействий поддержано грантом Россий
PARP1 [26]. Кроме этого, XRCC1 является эф
ского Научного Фонда (проект № 19 14 00107).
фективной мишенью ADP рибозилирования и
Благодарности. Авторы благодарны доктору
регулирует уровень автомодификации PARP1,
С. Вильсону (Dr. S.H. Wilson, National Institute of
подавляя элонгацию PAR [27]. Как нами недав
Health, North Carolina, США), доктору Х.П. Ра
но установлено, окисление XRCC1 оказывает
дицелле (Dr. J.P. Radicella, UMR217 CNRS/CEA,
негативное влияние на взаимодействие этого
Франция) и доктору Г. Дианову (Dr. G. Dianov,
белка с PAR и акцепторную активность в реак
Oxford University, UK) за предоставленные плаз
ции ADP рибозилирования, что подавляет ин
мидные векторы для экспрессии белков. Авторы
гибирующее действие белка на автомодифика
выражают глубокую благодарность студенту Но
цию PARP1 [28]. Различие между разными фор
восибирского государственного университета
4 БИОХИМИЯ том 85 вып. 3 2020
346
ВАСИЛЬЕВА и др.
Чжао Минсин за участие в экспериментах по
или использованием животных в качестве объ
флуоресцентному титрованию.
ектов.
Конфликт интересов. Авторы заявляют об от
Приложение к статье. Дополнительные ма
сутствии конфликта интересов.
териалы размещены в электронной версии
Соблюдение этических норм. Данная статья
не
СПИСОК ЛИТЕРАТУРЫ
1.
Abbotts, R., and Wilson, D.M. 3rd (2017) Coordination of
Hou, E.W., London, R.E., and Wilson, S.H. (2013)
DNA single strand break repair, Free Radic. Biol. Med.,
Preventing oxidation of cellular XRCC1 affects PARP
107, 228-244, doi: 10.1016/j.freeradbiomed.2016.11.039.
mediated DNA damage responses, DNA Repair (Amst.),
2.
Whitaker, A.M., Schaich, M.A., Smith, M.R., Flynn, T.S.,
12, 774-785, doi: 10.1016/j.dnarep.2013.06.004.
and Freudenthal, B.D. (2017) Base excision repair of
15.
Horton, J.K., Seddon, H.J., Zhao, M.L., Gassman, N.R.,
oxidative DNA damage: from mechanism to disease, Front.
Janoshazi, A.K., Stefanick, D.F., and Wilson, S.H. (2017)
Biosci. (Landmark Ed.), 22, 1493-1522, doi: 10.2741/
Role of the oxidized form of XRCC1 in protection against
4555.
extreme oxidative stress, Free Radic. Biol. Med., 107,
3.
Caldecott, K.W. (2014) DNA single strand break repair,
292-300, doi: 10.1016/j.freeradbiomed.2017.02.005.
Exp. Cell. Res., 329, 2-8, doi: 10.1016/j.yexcr.2014.08.027.
16.
Kumar, A., Widen, S.G., Williams, K.R., Kedar, P.,
4.
London, R.E. (2015) The structural basis of XRCC1
Karpel, R.L., and Wilson, S.H. (1990) Studies of the
mediated DNA repair, DNA Repair (Amst.), 30, 90-103,
domain structure of mammalian DNA polymerase beta.
doi: 10.1016/j.dnarep.2015.02.005.
Identification of a discrete template binding domain, J.
5.
Moor, N.A., and Lavrik, O.I. (2018) Protein-protein inter
Biol. Chem., 265, 2124-2131.
actions in DNA base excision repair, Biochemistry
17.
Belousova, E.A., Vasil’eva, I.A., Moor, N.A., Zatsepin, T.S.,
(Moscow), 83, 411-422, doi: 10.1134/S0006297918040120.
Oretskaya, T.S., and Lavrik, O.I. (2013) Clustered DNA
6.
Dutta, A., Yang, C., Sengupta, S., Mitra, S., and Hegde, M.L.
lesions containing 5 formyluracil and AP site: repair via
(2015) New paradigms in the repair of oxidative damage in
the BER system, PLoS One, 8, e68576, doi: 10.1371/journal.
human genome: mechanisms ensuring repair of mutagenic
pone.0068576.
base lesions during replication and involvement of accesso
18.
Strauss, P.R., Beard, W.A., Patterson, T.A., and Wilson, S.H.
ry proteins, Cell. Mol. Life Sci.,
72,
1679-1698,
(1997) Substrate binding by human apurinic/apyrimidinic
doi: 10.1007/s00018 014 1820 z.
endonuclease indicates a Briggs Haldane mechanism,
7.
Caldecott, K.W., McKeown, C.K., Tucker, J.D.,
J. Biol. Chem., 272, 1302-1307, doi: 10.1074/jbc.272.2.1302.
Ljungquist, S., and Thompson, L.H. (1994) An interaction
19.
Chim, N., Harmston, C.A., Guzman, D.J., and Goulding, C.W.
between the mammalian DNA repair protein XRCC1 and
(2013) Structural and biochemical characterization of the
DNA ligase III, Mol. Cell. Biol., 14, 68-76, doi: 10.1128/
essential DsbA like disulfide bond forming protein from
mcb.14.1.68.
Mycobacterium tuberculosis, BMC Struct. Biol., 13, 23,
8.
Kubota, Y., and Horiuchi, S. (2003) Independent roles of
doi: 10.1186/1472 6807 13 23.
XRCC1’s two BRCT motifs in recovery from methylation
20.
Wunderlich, M., and Glockshuber, R. (1993) Redox prop
damage, DNA Repair (Amst.), 2, 407-415, doi: 10.1016/
erties of protein disulfide isomerase (DsbA) from
s1568 7864(02)00242 2.
Escherichia coli, Protein Sci., 2, 717-726, doi: 10.1002/
9.
Parsons, J.L., Dianova, I.I., Allinson, S.L., and Dianov, G.L.
pro.5560020503.
(2005) DNA polymerase beta promotes recruitment of
21.
Haugland, R.P. (2005) The Handbook - a Guide to
DNA ligase III alpha XRCC1 to sites of base excision
Fluorescent Probes and Labeling Technologies, 10th edn.,
repair, Biochemistry, 44, 10613-10619, doi: 10.1021/
Invitrogen Corp., USA.
bi050085m.
22.
Dimitriadis, E.K., Prasad, R., Vaske, M.K., Chen, L.,
10.
Moor, N.A., Vasil’eva, I.A., Anarbaev, R.O., Antson, A.A.,
Tomkinson, A.E., Lewis, M.S., and Wilson, S.H. (1998)
and Lavrik, O.I. (2015) Quantitative characterization of
Thermodynamics of human DNA ligase I trimerization
protein protein complexes involved in base excision DNA
and association with DNA polymerase beta, J. Biol. Chem.,
repair, Nucleic Acids Res., 43, 6009-6022, doi: 10.1093/
273, 20540-20550, doi: 10.1074/jbc.273.32.20540.
nar/gkv569.
23.
Ranalli, T.A., Tom, S., and Bambara, R.A. (2002) AP
11.
Kubota, Y., Nash, R.A., Klungland, A., Schär, P., Barnes, D.E.,
endonuclease 1 coordinates flap endonuclease 1 and DNA
and Lindahl, T. (1996) Reconstitution of DNA base excision
ligase I activity in long patch base excision repair, J. Biol.
repair with purified human proteins: interaction between
Chem., 277, 41715-41724, doi: 10.1074/jbc.M207207200.
DNA polymerase β and the XRCC1 protein, EMBO J., 15,
24.
Hanssen Bauer, A., Solvang Garten, K., Sundheim, O.,
6662-6670, doi: 10.1002/j.1460 2075.1996.tb01056.x.
Peña Diaz, J., Andersen, S., Slupphaug, G., Krokan, H.E.,
12.
Wong, H.K., and Wilson, D.M. 3rd (2005) XRCC1 and
Wilson, D.M. 3rd, Akbari, M., and Otterlei, M. (2011)
DNA polymerase beta interaction contributes to cellular
XRCC1 coordinates disparate responses and multiprotein
alkylating agent resistance and single strand break repair,
repair complexes depending on the nature and context of
J. Cell. Biochem., 95, 794-804, doi: 10.1002/jcb.20448.
the DNA damage, Environ. Mol. Mutagen., 52, 623-635,
13.
Fang, Q., Inanc, B., Schamus, S., Wang, X.H., Wei, L.,
doi: 10.1002/em.20663.
Brown, A.R., Svilar, D., Sugrue, K.F., Goellner, E.M.,
25.
Lan, L., Nakajima, S., Oohata, Y., Takao, M., Okano, S.,
Zeng, X., Yates, N.A., Lan, L., Vens, C., and Sobol, R.W.
Masutani, M., Wilson, S.H., and Yasui, A. (2004) In situ
(2014) HSP90 regulates DNA repair via the interaction
analysis of repair processes for oxidative DNA damage in
between XRCC1 and DNA polymerase β, Nat. Commun.,
mammalian cells, Proc. Natl Acad. Sci. USA, 101,
5, 5513, doi: 10.1038/ncomms6513.
13738-13743, doi: 10.1073/pnas.0406048101.
14.
Horton, J.K., Stefanick, D.F., Gassman, N.R., Williams, J.G.,
26.
Polo, L.M., Xu, Y., Hornyak, P., Garces, F., Zeng, Z.,
Gabel, S.A., Cuneo, M.J., Prasad, R., Kedar, P.S., Derose, E.F.,
Hailstone, R., Matthews, S.J., Caldecott, K.W., Oliver, A.W.,
БИОХИМИЯ том 85 вып. 3 2020
ВЛИЯНИЕ ОКИСЛЕНИЯ XRCC1 НА АКТИВНОСТЬ КОМПЛЕКСОВ BER
347
and Pearl, L.H. (2019) Efficient single strand break repair
DNA polymerase beta in long patch base excision repair,
requires binding to both poly(ADP ribose) and DNA by
Mutat. Res., 685, 80-89, doi: 10.1016/j.mrfmmm.2009.
the central BRCT domain of XRCC1, Cell Rep., 26,
08.009.
573-581, doi: 10.1016/j.celrep.2018.12.082.
30. Prasad, R., Lavrik, O.I., Kim, S.J., Kedar, P., Yang, X.P.,
27. Masson, M., Niedergang, C., Schreiber, V., Muller S.,
Vande Berg, B.J., and Wilson, S.H. (2001) DNA poly
Menissier de Murcia, J. and de Murcia, G. (1998) XRCC1 is
merase beta mediated long patch base excision repair.
specifically associated with poly(ADP ribose) polymerase
Poly(ADP ribose)polymerase 1 stimulates strand dis
and negatively regulates its activity following DNA damage,
placement DNA synthesis, J. Biol. Chem.,
276,
Mol. Cell. Biol., 18, 3563-3571, doi: 10.1128/mcb.18.6.3563.
32411-32414, doi: 10.1074/jbc.C100292200.
28. Vasil’eva, I.A., Moor, N.A., and Lavrik, O.I. (2019) Role of
31. Leppard, J.B., Dong, Z., Mackey, Z.B., and Tomkinson, A.E.
oxidation of XRCC1 protein in regulation of mammalian
(2003) Physical and functional interaction between
DNA repair process, Doklady Biochem. Biophys., 489,
DNA ligase IIIalpha and poly(ADP ribose) polymer
doi: 10.1134/S1607672919060012.
ase 1 in DNA single strand break repair, Mol. Cell. Biol.,
29. Sukhanova, M., Khodyreva, S., and Lavrik, O. (2010)
23, 5919-5927, doi: 10.1128/mcb.23.16.5919 5927.
Poly(ADP ribose) polymerase 1 regulates activity of
2003.
INFLUENCE OF HUMAN XRCC1 PROTEIN OXIDATION
ON FUNCTIONAL ACTIVITY OF ITS COMPLEXES
WITH KEY ENZYMES OF DNA BASE EXCISION REPAIR*,**
I. A. Vasil’eva1#, N. A. Moor1#, and O. I. Lavrik1,2***
1 Institute of Chemical Biology and Fundamental Medicine, Siberian Branch of the Russian Academy of Sciences,
630090 Novosibirsk, Russia; E<mail: lavrik@niboch.nsc.ru
2 Novosibirsk State University, 630090 Novosibirsk, Russia
Received November 29, 2019
Revised January 20, 2020
Accepted January 27, 2020
Base Excision Repair (BER) ensures correction of the most abundant DNA lesions in mammals. The efficiency of
this multistep repair process occurring via various sub pathways depends on the coordinated action of enzymes cat
alyzing individual steps. Scaffold XRCC1 protein plays an important coordinating role in the repair of base damages
and apurinic/apyrimidinic (AP) sites via short patch sub pathway and in the repair of single strand breaks. In this
study we showed for the first time the in vitro formation of a ternary complex of XRCC1 protein with the key enzymes
of short patch BER, DNA polymerase β (Polβ) and DNA ligase IIIα (LigIIIα), using fluorescence titration tech
nique. Polβ interacts directly with LigIIIα, but this complex is less stable than XRCC1-Polβ and XRCC1-LigIIIα
complexes. The influence of both XRCC1 oxidation and composition of the multiprotein complex on the efficiency
of DNA repair synthesis and DNA ligation has been explored. The oxidation induced formation of disulfide bond
between Cys12 and Cys20 of XRCC1, modulating, as shown previously, the protein affinity for Polβ, affects the yield
of both the final product of short patch BER and the non ligated DNA intermediates (substrates of long patch BER).
The effect of XRCC1 oxidation on the yield of the final product depends on the presence of AP endonuclease 1. Our
cumulative (previous and present) results indicate the important role of XRCC1 oxidation in fine regulation of the
formation and functional activity of BER complexes.
Keywords: DNA base excision repair, protein-protein interactions, human XRCC1 protein, DNA polymerase β,
DNA ligase IIIα
БИОХИМИЯ том 85 вып. 3 2020
4*