БИОХИМИЯ, 2020, том 85, вып. 3, с. 360 - 368
УДК 578.32; 578.865; 539.26
ХАРАКТЕРИСТИКА ВИРИОНОВ И РЕПОЛИМЕРОВ БЕЛКА
ОБОЛОЧКИ ВИРУСА ТАБАЧНОЙ МОЗАИКИ В РАСТВОРЕ
МЕТОДОМ МАЛОУГЛОВОГО РЕНТГЕНОВСКОГО РАССЕЯНИЯ*
© 2020
А.Л. Ксенофонтов1**, М.В. Петухов2,3,
А.Н. Прусов1, Н.В. Федорова1, Э.В. Штыкова2
1 НИИ физико химической биологии им. А.Н. Белозерского,
Московский государственный университет им. М.В. Ломоносова,
119991 Москва, Россия; электронная почта: ksenofon@belozersky.msu.ru
2 Институт кристаллографии им. А.В. Шубникова, ФНИЦ «Кристаллография и фотоника» РАН,
119333 Москва, Россия; электронная почта: shtykova@ns.crys.ras.ru
3 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН,
119071 Москва, Россия; электронная почта: maxim@embl hamburg.de
Поступила в редакцию 07.11.2019
После доработки 20.12.2019
Принята к публикации 22.12.2019
Структурный анализ вирионов и реполимеров белка оболочки вируса табачной мозаики (ВТМ) в водно со
левом растворе был проведен по данным синхротронного малоуглового рентгеновского рассеяния (МУРР)
и с помощью просвечивающей электронной микроскопии (ПЭМ) с негативным контрастом. Частицы ре
полимеров белка оболочки обладают уникальной стабильностью и не имеют спиральной симметрии. По
данным ПЭМ, такие частицы содержат гетерогенные по длине поперечно исчерченные палочковидные
«стопки дисков» длиной 300-800 Å. Структурное моделирование этих частиц было выполнено с использо
ванием элемента кристаллографической модели четырехслойного агрегата (PDB: 1EI7). Получившиеся мо
дели «стопок дисков» представляли собой полые цилиндры, и мы сравнили их расчетное рассеяние с экс
периментальным на всем измеряемом диапазоне. Показана лучшая корреляция данных МУРР с моделью из
повторяющейся центральной пары дисков. Кривые МУРР практически совпадали для образцов «стопок
дисков» ВТМ независимо от метода выделения белка. Положения максимумов интенсивности на кривых
рассеяния могут быть использованы в качестве специфической характеристики образцов, некоторые из них
соотнесены с реальными элементами четвертичной структуры частиц (периодичность структуры реполиме
ра, шаг спирали вириона). Впервые структурные данные низкого разрешения реполимеров ВТМ были по
лучены в растворе в условиях, близких к естественным. Анализ подобных наноразмерных объектов важен
для их возможного биомедицинского и биотехнологического применения.
КЛЮЧЕВЫЕ СЛОВА: ВТМ, белок оболочки, реполимеры, вирионы, малоугловое рентгеновское рассеяние.
DOI: 10.31857/S0320972520030069
Вирус табачной мозаики (ВТМ) является хо
длины используется его диаметр, а также длина
рошо охарактеризованным растительным виру
шага спирали 22,92 Å, которые измерены очень
сом, состоящим из 2130 идентичных субъеди
точно методом рентгеновской дифракции ори
ниц белка оболочки, расположенных спираль
ентированных волокон [2]. Субъединицы белка
но вокруг одноцепочечной РНК [1]. ВТМ ши
оболочки образуют полый цилиндр длиной
роко изучался с использованием методов кри
3000 Å и диаметром 180 Å. Особенностью выде
сталлографии и электронной микроскопии.
ленного белка оболочки ВТМ является его спо
Из за стабильности и доступности ВТМ в
собность образовывать в растворе большое чис
электронной микроскопии в качестве эталона
ло упорядоченных агрегатов с различной струк
турой. В зависимости от рН, ионной силы, тем
Принятые сокращения: ВТМ - вирус табачной мо
пературы и концентрации белок ВТМ находит
заики, МУРР - малоугловое рентгеновское рассеяние,
ся в двух основных состояниях: дисковом и
ПЭМ - просвечивающая электронная микроскопия.
спиральном [3]. К числу агрегатов дискового
* Первоначально английский вариант рукописи опублико
типа относятся двухслойные 20S диски с коэф
msu.ru/biokhimiya, в рубрике «Papers in Press», BM19 321,
фициентом седиментации 20S и агрегаты дис
03.02.2020.
ков, уложенных попарно в «стопки дисков», ко
** Адресат для корреспонденции.
торые образуются при выдерживании препара
360
СТРУКТУРА РЕПОЛИМЕРОВ ВТМ
361
та в растворе с рН 7-9. К спиральному типу от
добной степени стабильности: после того как
носятся прежде всего сами вирионы ВТМ и
молекулы белка собраны в такую структуру, для
идентичный им спиральный реполимеризован
ее разборки требуются денатурирующие условия
ный белок при рН ≤ 6,0, а также двухвитковые
[13, 14]. Подобные наноразмерные объекты -
фрагменты спирали [3]. Двухслойная структура
нановолокна и наностержни - могут найти ши
20S диска определена кристаллографическим
рокое применение в наноэлектронике и различ
анализом с разрешением 2,8 Å [4]. 20S Диски
ных биомедицинских приложениях. Ранее нами
состоят из 34 белковых субъединиц (17 субъеди
с помощью МУРР были охарактеризованы дру
ниц на слой). Два слоя диска соединены на его
гие вирусоподобные частицы - ассоциаты белка
периферии на больших радиусах и не соприка
оболочки спирального потивируса А вируса кар
саются на малых [4], образуя щель около сайта
тофеля - и изучена их диссоциация [15, 16].
связывания РНК. Именно эти данные рентге
ноструктурного анализа послужили основани
ем для построения модели самосборки ВТМ in
МЕТОДЫ ИССЛЕДОВАНИЯ
vitro «изнутри» [5, 6], в соответствии с которой
сборка инициируется связыванием диска 20S со
Получение белка оболочки и реполимеров
специфическим участком РНК со стороны
ВТМ. Препарат ВТМ (штамм U1) был любезно
центрального канала, при этом происходит
предоставлен В.В. Макаровым. Образцы репо
трансформация цилиндрического диска до спи
лимеров ВТМ получали двумя методами: 1) бе
ральной структуры [6].
лок ВТМ, выделенный литиевым методом [17],
Необычные рентгенограммы, полученные
диализовали в 10 мМ Tris HCl буфер (рН 8,0) c
Франклин в 1955 г. [7] для полимеризованного
0,1 М NaCl; 2) белок ВТМ, полученный ацетат
белка оболочки ВТМ, выделенного из инфици
ным методом [18], диализовали в 10 мМ фос
рованных растений, дали первое указание на об
фатный буфер (рН 8,0) c 0,1 М NaCl. В обоих
разование полимера из дисков, уложенных по
случаях диализ проводили в течение суток при
парно в «стопки дисков» («stacked discs»). Дол
+8 °С, далее препараты белка (1,5-5 мг/мл) вы
гое время предполагалось наличие равновесия и
держивали 5-7 суток при +8 °С для формирова
возможность трансформации между «стопками
ния
«стопок дисков» и центрифугировали
дисков» и спиральными агрегатами, и это под
10 мин при 14 000 об/мин (Benchtop Microfuge
разумевало, что «стопки дисков», подобно спи
22R; «Beckman Coulter», США). Выход белка
рали вируса, должны быть полярной структу
ВТМ составлял 50-70% от расчетного.
рой, в которой все субъединицы ориентированы
Определение концентрации препаратов репо;
в одном направлении [8]. Доказательство бипо
лимеров и вируса ВТМ. Концентрацию препара
лярности «стопок дисков» было получено с по
тов определяли с помощью спектрофотометра
мощью моноклональных антител, которые свя
UV 2600 («Hitachi», Япония), используя спект
зывались лишь с одним концом вириона ВТМ,
ры поглощения в УФ диапазоне 240-340 нм. В
однако эти антитела реагировали с обоими кон
связи с большим вкладом рассеяния в поглоще
цами реполимера [9]. Дальнейшее изучение их
ние реполимера (40-50%) вычисляли истинные
структуры методом криоэлектронной микро
спектры поглощения (E) суспензий частиц ме
скопии с разрешением 9-12 Å [10, 11] показало,
тодом экстраполяции
[19], применяя для
что бóльшая часть двухслойных дисков имеет
экстраполяции область 320-338 нм. Коэффици
четвертичную структуру, аналогичную цент
енты поглощения препаратов белка и вируса
ральной паре колец закристаллизованного че
принимали равными E0
1% = 1,3 и Е01% = 2,3 со
тырехслойного дискового агрегата [12].
ответственно. Контроль чистоты образцов осу
В настоящей работе с помощью синхротрон
ществляли с помощью электрофореза по методу
ного малоуглового рентгеновского рассеяния
Лэммли [20], используя 15% ный ПААГ, в каме
(МУРР) впервые охарактеризована структура в
ре Мini PROTEAN 3 Cell («Bio Rad», США). Ге
растворе и выполнено моделирование вирионов
ли окрашивали
0,22% ным Кумасси G 250
и реполимеров белка оболочки ВТМ, сформи
(«Serva», Германия).
рованных в «стопки дисков». Мы представили
Просвечивающая электронная микроскопия
набор моделей, которые были построены с ис
(ПЭМ). Препараты помещали на сетки с угле
пользованием атомарных координат четырех
родным покрытием. Образцы инкубировали
слойного агрегата [12], и сравнили их расчетное
1 мин при 20 °С, промывали дистиллированной
рассеяние с экспериментальным, полученным с
водой в течение 30 с, контрастировали 2% ным
помощью метода МУРР.
уранилацетатом в течение 10-30 с, снова про
Реполимеры «стопки дисков» ВТМ являются
мывали дистиллированной водой и высушива
интригующим объектом из за их амилоидопо
ли. Образцы исследовали в просвечивающем
5 БИОХИМИЯ том 85 вып. 3 2020
362
КСЕНОФОНТОВ и др.
электронном микроскопе JEM 1400 («JEOL»,
максимумов интенсивности вектора рассеяния sim
Япония) при увеличении в 60 000 раз.
модели от экспериментальных величин siexp:
Эксперимент и анализ данных МУРР. Иссле
Ō = 1/n × Σ(⏐sim - siexp⏐/siexp).
дование структуры образцов ВТМ и их реполи
меров с помощью малоуглового рассеяния
синхротронного излучения проводили на син
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
хротроне PetraIII (DESY, Гамбург) на линии P12.
Линия P12 оснащена оборудованием для авто
Электронно;микроскопический анализ препа;
матической смены образцов и двумерным де
ратов. Белок оболочки, выделенный из ВТМ,
тектором Pilatus 2M («DECTRIS», Швейцария).
способен легко самоассоциироваться в опреде
Интенсивность рассеяния I(s) измеряли в об
ленных условиях в 20S диски, которые при даль
ласти значений волновых векторов 0,003 < s <
нейшей инкубации трансформируются в ста
< 0,5 Å-1, где s = (4πsinθ)/λ ≤ 2π/d - модуль век
бильные реполимеры, так называемые «стопки
тора рассеяния; 2θ - угол рассеяния; λ = 1,24 Å -
дисков» [13, 14, 25]. На первом этапе мы изучили
длина волны [21]; d - размер рассеивающих не
структуру и длину образованных частиц с по
однородностей, период структуры. Измерения
мощью просвечивающей электронной микро
проводили при температуре 10 °C, за 1 с регист
скопии (ПЭМ). Результаты ПЭМ с негативным
рировали 20 отдельных кривых рассеяния для
контрастом показали, что полученные разными
каждого образца с целью отслеживания возмож
методами препараты реполимеров содержали ге
ного радиационного повреждения. Первичную
терогенные по длине поперечно исчерченные
обработку данных проводили с помощью прог
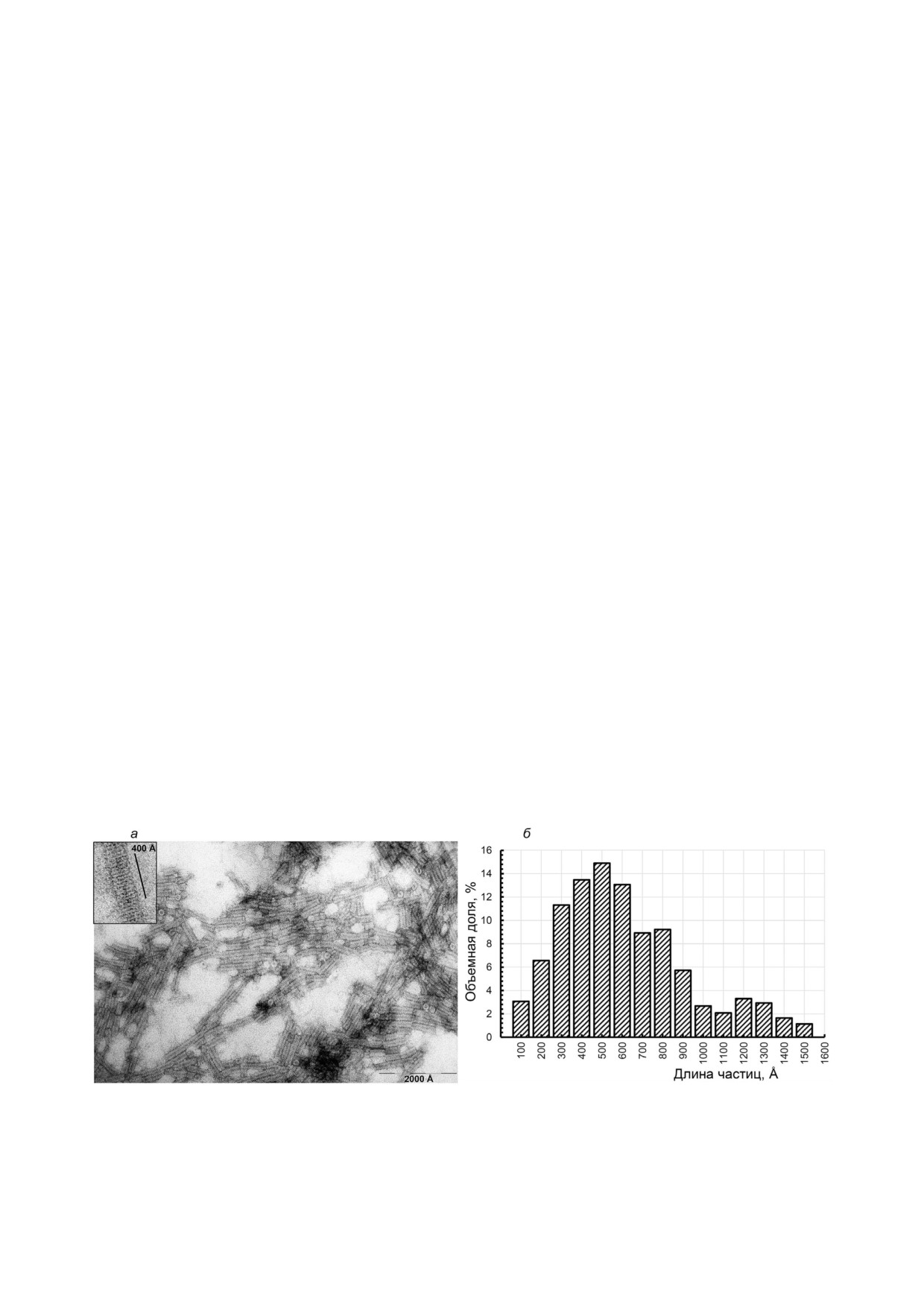
палочковидные частицы (рис. 1, а, б). Распреде
раммы РRIMUS [22]. Чтобы учесть концентра
ление частиц по размерам (рис. 1, б) показывает,
ционную зависимость, анализировали препарат
что основная объемная доля в препарате прихо
вируса и белка при нескольких различных кон
дится на частицы длиной 300-800 Å (~70% от
центрациях в диапазоне 2,0-7,0 мг/мл. Про
всех частиц). На рис. 1 видно, что фрагмент дли
грамму MASSHA [23] использовали для модели
ной 400 Å содержит ~15-16 колец «стопки»
рования структур вириона и реполимера, прог
(15,5 ± 0,5), что соответствует ранее полученным
рамму CRYSOL [24] - для расчета кривых рассе
данным ПЭМ [8, 9, 14] (рис. 1, врезка), и осевая
яния моделей атомного разрешения и определе
периодичность структуры реполимера составля
ния их радиусов инерции (Rg).
ет (26,0 ± 0,9) Å. Таким образом, сформирован
Размеры в кристаллографической модели
ные «стопки дисков» содержали 6-16 20S дис
(PDB: 1EI7) четырехслойного дискового агрега
ков. Кроме того, в образце можно видеть также
та измеряли с помощью инструментов програм
кластеры латерально связанных реполимеров.
В следующей части работы с помощью син
ния модельных структур реполимера с реальной
хротронного МУРР мы охарактеризовали струк
структурой в растворе использовали усреднен
туру в растворе и выполнили моделирование ви
ную величину относительных отклонений (Ō)
рионов и реполимеров белка оболочки ВТМ.
Рис. 1. Электронно микроскопический анализ препаратов реполимеров ВТМ (а) и распределение по размерам частиц (б). Из
мерена длина ~250 частиц. Препараты получали из белка ВТМ, выделенного литиевым методом [17]. ПЭМ (JEM 1011,
«JEOL», Япония), контрастирование 2% ным уранилацетатом. Увеличение ×60 000 (а) и ×150 000 (врезка)
БИОХИМИЯ том 85 вып. 3 2020
СТРУКТУРА РЕПОЛИМЕРОВ ВТМ
363
измеренной методом рентгеновской дифракции
ориентированных волокон [2].
Структурное моделирование реполимеров бел;
ка ВТМ в растворе. По данным ПЭМ, препара
ты реполимеров белка ВТМ содержали смесь ге
терогенных по длине частиц с повторяющимися
элементами структуры. Профили рассеяния от
препаратов «стопок дисков» из белка ВТМ, вы
деленного разными методами [17, 18], практи
чески совпадали (отклонение < 0,2% максиму
мов векторов рассеяния s1-s6) на всем интерва
ле измерения (рис. 3, врезка), и в дальнейшем
мы приводим данные МУРР для реполимеров
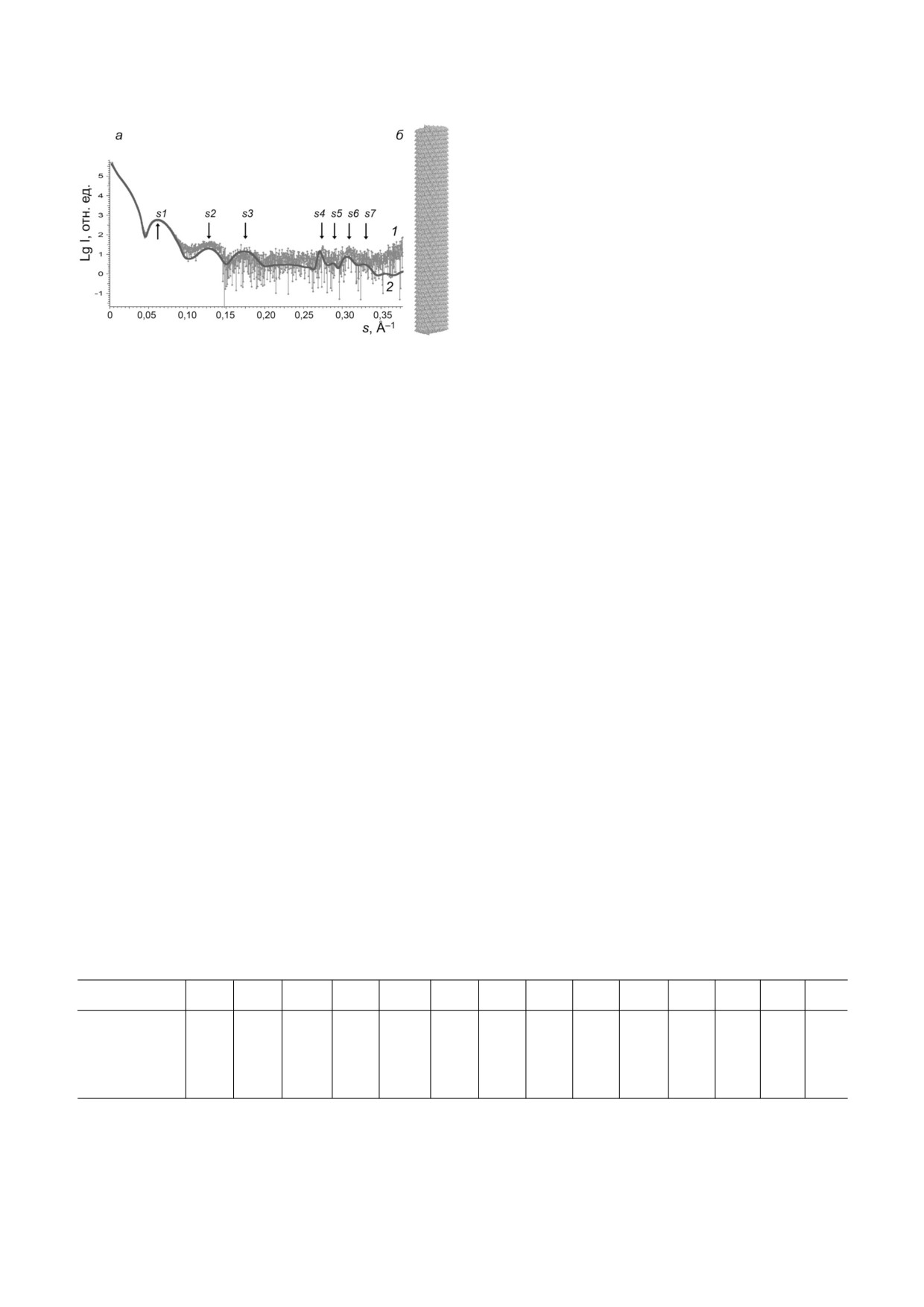
Рис. 2. Экспериментальные и модельные кривые МУРР
белка, полученного литиевым методом.
(а), модельная структура вириона ВТМ (б); 1 - экспери
ментальные данные, приведенные к нулевой концентра
В качестве структурного элемента для по
ции; 2 - рассеяние, рассчитанное с помощью програм
строения модели вначале была выбрана кристал
мы CRYSOL, модельной структуры вириона, смоделиро
лографическая структура PDB: 1EI7, состоящая
ванной с помощью программы MASSHA
из двух сложенных парных колец БA по 17 субъ
единиц белка в каждом [12]. Нижнее и верхнее
Структурное моделирование вирионов ВТМ в
кольцо обозначали символом Б, а центральные
растворе. Были получены профили рассеяния от
кольца - символом А. Структурный элемент
образцов вирионов ВТМ c концентрацией
БAAБ был размножен посредством простран
3-6 мг/мл. В качестве структурного элемента
ственной трансформации. Профиль интенсив
для моделирования вириона была выбрана
ности рассеяния структуры (БAАБ)8 значитель
структура PDB: 2OM3 с разрешением 4,4 Å, по
но отличался от профиля, полученного в экспе
лученная методом криоэлектронной микроско
рименте (рис. 3, а, б; табл. 2).
пии и содержащая фрагмент со спиральной сим
В дальнейшем для моделирования реполи
метрией из трех витков [26]. Затем этот фрагмент
меров ВТМ использовали две другие модели на
был воспроизведен 16 раз вдоль винтовой оси
основе пары колец кристаллографической мо
для построения модели вириона (длина ~1200 Å,
дели (PDB: 1EI7): 1) нижняя пара колец (БА;
784 субъединицы). Рассчитанная кривая рассея
рис. 3, г) или 2) центральная пара (AA; рис. 3, е).
ния модели вириона с использованием програм
Эти элементы были размножены посредством
мы CRYSOL [24] (рис. 2, кривая 2) коррелирует с
пространственной трансформации с поворотом
экспериментальными данными по всем пикам и
каждого элемента на 6,35° в соответствии с дан
минимумам кривой рассеяния на интервале век
ными структуры PDB: 1EI7. В результате были
тора рассеяния 0,03 < s < 0,35 (рис. 2, кривая 1).
получены модели структур «стопок дисков» в
Для более точного сравнения в табл. 1 сопо
виде полых цилиндров, содержащих по
16
ставили величины вектора рассеяния s и разме
двухслойных дисков. Данные модели содержали
ра рассеивающих неоднородностей d для всех
544 субъединицы и имели размер длинной оси
семи пиков (s1-s7) экспериментальной и мо
~820 Å. Обе модели - (БA)16 и (АA)16 - имели
дельной кривых. Анализ табл. 1 показывает, что
неплохую корреляцию между эксперименталь
некоторые максимумы интенсивности вектора
ными данными Iexp(s) и теоретическими кривы
рассеяния s хорошо соответствуют известным
ми рассеяния, рассчитанными для этих моде
размерам в вирионе, например, d4 (линейный
лей. Положения максимумов интенсивности на
размер 22,9 Å) равен длине шага спирали 22,9 Å,
кривых рассеяния (s1-s6) могут быть использо
Таблица 1. Сравнение характеристик рассеяния вирионов ВТМ в растворе с рассеянием от модели вириона
Вирион ВТМ*
s1
d1
s2
d2
s3
d3
s4
d4
s5
d5
s6
d6
s7
d7
Эксперимент
0,062
101
0,129
48,7
0,175
36,0
0,274
22,9
0,290
21,6
0,309
20,4
0,330
19,0
Модель
0,062
101
0,129
48,7
0,175
36,0
0,271
23,2
0,288
21,9
0,306
20,6
0,330
19,0
Costa, 2016**
0,062
101
0,130
48,7
0,175
35,9
0,275
23,2
0,294
21,8
0,311
20,5
0,336
19,0
* Использовали модель PDB: 2OM3; s (Å-1) - модуль вектора рассеяния; d = 2π/s (Å) - период структуры, размер рассеи
вающих неоднородностей.
** Экспериментальные данные, приведенные в статье Costa et al. [29].
БИОХИМИЯ том 85 вып. 3 2020
5*
364
КСЕНОФОНТОВ и др.
полностью не совпала с экспериментальной
кривой.
Влияние длины модельных реполимеров на
расчетные кривые МУРР. Чтобы оценить влия
ние длины реполимера на кривые рассеяния,
мы рассчитали с помощью программы CRYSOL
[24] характеристики ряда смоделированных
структур: А, (АА)1, (АА)2, (АА)4, (АА)8, (АА)16
кристаллической модели PDB: 1EI7 [12], где А -
одно кольцо из 17 субъединиц белка (рис. 4).
На кривых рассеяния моделей кольца А и дис
ка (АА)1 полностью отсутствуют брэгговские мак
симумы (рис. 4, кривые 1 и 2), тогда как в моделях
реполимера (АА)2 и (АА)4 интенсивность рассея
ния возрастает в положениях угловых векторов
s1, s4 и s5 (кривые 3, 4). В моделях реполимера
(АА)8 и (АА)16 интенсивность рассеяния значи
тельно увеличивается в положениях угловых век
торов s2, s4 и s6 (кривые 5, 6), которые соответ
ствуют рассеивающим размерам в препарате ре
полимера: d2 = 51 Å, d4 = 26,9 Å и d6 = 13,4 Å
(табл. 2). Размер d4 близок к определенной нами
методом ПЭМ величине осевой периодичности
колец реполимера (26,0 ± 0,9 Å). Удвоенная вели
чина (52 Å) соответствует периодичности дисков
в реполимерах и близка к рассеивающему разме
ру d2. Определенная методом рентгеновской
дифракции ориентированных волокон Франк
лин и Коммонером [7], эта величина составляла
53 Å. В табл. 3 приведены расчетные инварианты
(молекулярные массы Mr и радиусы инерции Rg)
для этих моделей и препарата реполимера. Вели
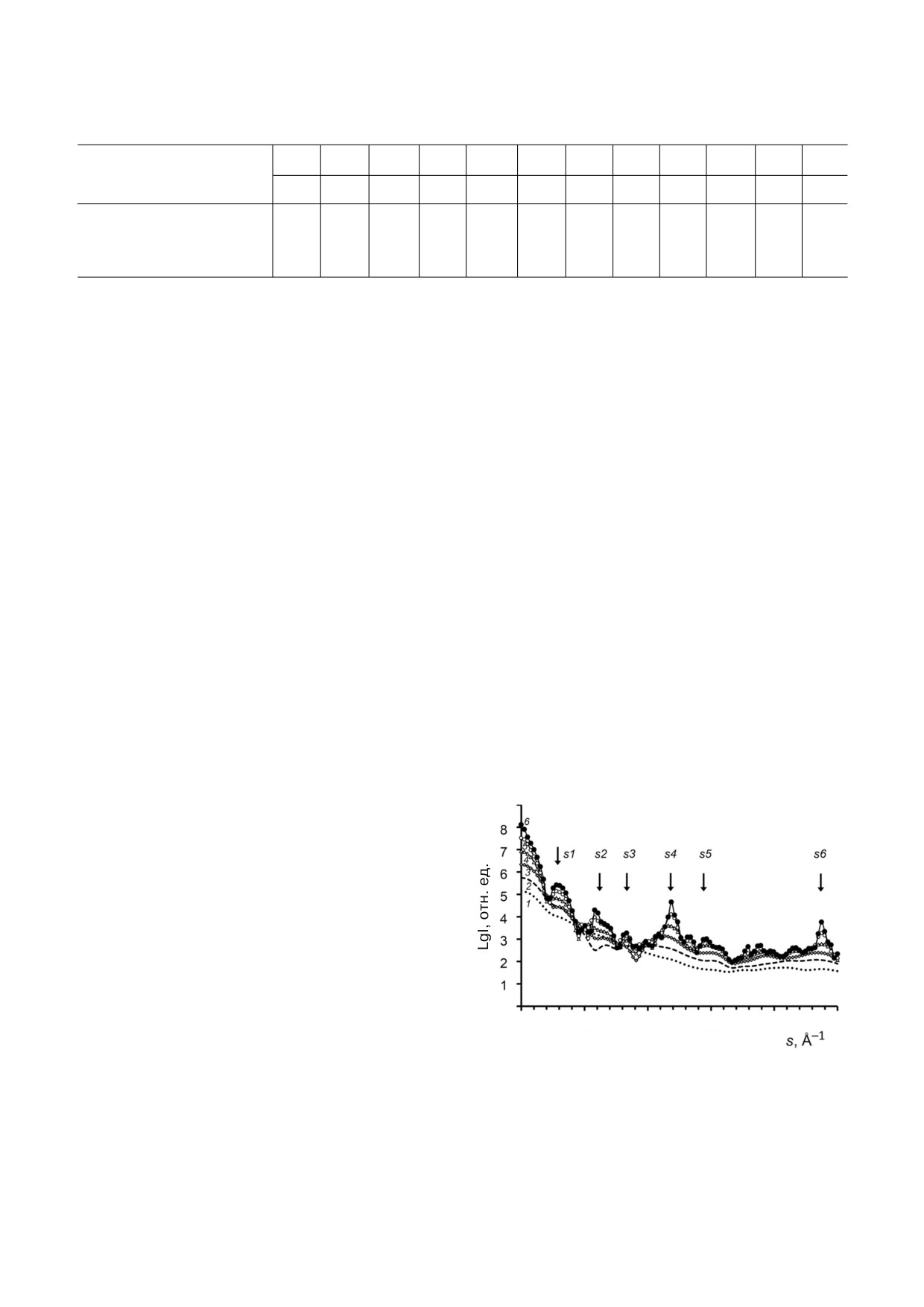
Рис. 3. Малоугловое рентгеновское рассеяние реполиме
чины Rg для моделей от 1 до 32 колец в реполиме
ров ВТМ в виде «стопок дисков»; а, в, д - эксперименталь
ре находились в диапазоне 64,2-253,4 Å. Инвари
ные и рассчитанные данные МУРР от модельных структур
анты для модели (АA)16 оказались близки к значе
(б, г, е). Рассеяние рассчитывали с помощью программы
ниям препарата реполимера в растворе.
16
CRYSOL. Модели структур - (БAАБ)8 (б), (БA)16 (г) и (АA)
(е) - были получены в программе MASSHA. Эксперимен
тальные данные показаны точками, рассеяние моделей -
сплошными линиями. Стрелки указывают на максимумы
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
интенсивности векторов рассеяния. Врезка - кривые
МУРР для препаратов реполимера из белка оболочки, по
Современные методы интерпретации данных
лученного литиевым (кривая 1) или ацетатным (кривая 2)
методом
синхротронного МУРР вместе с комплементар
ным методом электронной микроскопии позво
лили нам в данной работе провести детальный
ваны в качестве специфической характеристики
структурный анализ образцов реполимеров бел
образцов. Для количественной оценки сходства
ка оболочки ВТМ в форме «стопок дисков». По
моделей реполимеров с реальной структурой в
данным МУРР можно определять в многоком
растворе использовали усредненную величину
понентном растворе молекулярную архитектуру
относительных отклонений максимумов интен
белков [27] и белков с гибкими неструктуриро
сивности вектора рассеяния sim модели от экспе
ванными фрагментами [28]. Новые подходы к
риментальных величин: Ō = 1/n × Σ (⏐sim -
анализу данных МУРР позволяют получать ин
- siexp⏐/siexp). Наименьшая величина Ō оказалась у
формацию о четвертичной структуре биологи
модели (АA)16 (Ō = 0,02 ± 0,01), что указывало на
ческих объектов. Метод способен визуализиро
наилучшее сходство с реальной структурой в
вать структуру исследуемых объектов в широ
растворе в сравнении с другими моделями -
ком диапазоне размеров в зависимости от энер
(БA)16 (Ō = 0,03 ± 0,01) или (БAАБ)8 (Ō = 0,04 ±
гии рентгеновского излучения и анализируемо
± 0,01). Однако ни одна из модельных кривых
го углового диапазона, который соответствует
БИОХИМИЯ том 85 вып. 3 2020
СТРУКТУРА РЕПОЛИМЕРОВ ВТМ
365
Таблица 2. Сравнение характеристик рассеяния реполимеров ВТМ в растворе с рассеянием от моделей
s1
d1
s2
d2
s3
d3
s4
d4
s5
d5
s6
d6
Препарат
0,054
114
0,124
51,0
0,168
37,4
0,234
26,9
0,287
21,90
0,47
13,4
Модель (БAAБ)8*
0,057
110
0,119
53,0
0,168
37,4
0,221
28,5
0,278
22,60
-
-
Модель (БA)16
0,058
108
0,130
48,0
0,177
35,6
0,236
26,7
0,290
21,60
0,47
13,4
Модель (AA)16
0,058
109
0,119
52,7
0,168
37,4
0,237
26,5
0,290
21,60
0,48
13,2
* Использовали кристаллографическую структуру PDB: 1EI7; величины s (Å-1) и d (Å) - как в табл. 1. Препарат реполи
мера был получен литиевым методом.
определяемому размеру частиц ~10-2100 Å.
В последующей работе данной лаборатории с
Поскольку длинная ось вириона ВТМ составля
помощью МУРР сравнивали кинетику рекон
ет ~3000 Å, его длина не может быть измерена
струкции из белка и РНК вирионов ВТМ и ви
непосредственно при данном угловом диапазо
руса зеленой крапчатой мозаики огурца по из
не (0,003 < s < 0,5 Å-1). Экспериментальные и
менению величины Rg и показали, что для ВТМ
рассчитанные кривые после s = 0,35 Å-1 расхо
скорость сборки значительно выше [32]. Кине
дятся (рис. 2), что может быть связано с низкой
тику образования спиральных «завитков», воз
точностью определения МУРР размеров менее
можных интермедиатов сборки ВТМ, и длин
15 Å или некоторым различием структур трех
ных спиральных реполимеров в кислой среде
виткового фрагмента (PDB: 2OM3) и аналогич
изучали в работе Potschka et al. [33] на линии
ного элемента вириона в растворе. Недавно в
DORIS I (DESY, Гамбург; λ = 1,50 Å).
работе Costa et al. [29] методом МУРР был изме
В настоящей работе с помощью МУРР впер
рен препарат вирионов ВТМ на малоугловой
вые охарактеризована структура в растворе и вы
линии BM29 (ESRF, Гренобль, λ = 0,99 Å) и по
полнено моделирование кривой МУРР во всем
лучена кривая рассеяния вириона при концент
измеряемом диапазоне для вирионов и реполи
рации вируса в 4 раза выше используемой нами
меров ВТМ. По данным ПЭМ, препарат реполи
(26 мг/мл). Из табл. 1 видно, что величины s и d
меров содержал набор длинных и гетерогенных
хорошо совпадают с данными нашей работы
по длине частиц в виде «стопок дисков» (рис. 1).
(относительное отклонение не превышает
Основная часть частиц препарата включала 6-16
1,5%). Приближение геометрических моделей
20S дисков. Измеренные величины усредненно
было выполнено авторами с использованием
го радиуса инерции Rg = 244,1 Å и молекулярно
программы Genfit [30]. С помощью трехцилинд
го веса Mr = 8308 кДа оказались близкими к мо
ровой модели вириона им удалось воспроизвес
дели (АA)16: Rg = 253,4 Å и Mr = 9505 кДа (табл. 3).
ти лишь первые два максимума пиков s1 и s2 из
семи на экспериментальной кривой рассеяния.
Ранее в работе Hiragi et al. [31] методом
МУРР изучали препарат агрегатов белка ВТМ,
сформированных в растворе с рН 7,2, ионной
силе 0,1-0,2 М при температуре 15-25 °С на ма
лоугловой линии («Photon Factory», Япония; λ =
1,49 Å). Приближение было выполнено автора
ми с использованием цилиндрической модели
20S диска с наружным и внутренним диаметра
ми 180 и 40 Å соответственно, с двумя слоями
толщиной 23 Å, с радиусом инерции Rg, равным
66,5 Å. Препарат оказался в значительной сте
пени полидисперсным, содержащим в основ
0
0,1
0,2
0,3
0,4
0,5
ном двух , четырехслойные агрегаты и неболь
шое количество более длинных агрегатов. Ради
ус инерции образца увеличивался с ростом ион
Рис. 4. Модельные кривые МУРР. Расчет модельных ин
тенсивностей проводили с помощью программы
ной силы, температуры и концентрации и до
CRYSOL [24] для ряда моделей: А, (АА)1, (АА)2, (АА)4,
стигал 85,6 Å в 100 мМ фосфатном буфере при
(АА)8, (АА)16, кривые 1-6 соответственно. Стрелки указы
25 °С и 12 мг/мл, что близко к нашей модели ре
вают на максимумы интенсивности векторов рассеяния
полимера (АA)4 с Rg, равным 88,7 Å (табл. 3).
(см. рис. 3, кривая 1)
БИОХИМИЯ том 85 вып. 3 2020
366
КСЕНОФОНТОВ и др.
Таблица 3. Сравнение инвариант модельных структур и препарата реполимера ВТМ
Модели «стопок дисков»*
Образец
Инварианты
A
(АА)1
(АА)2
(АА)4
(АА)8
(АА)16
реполимер
Mr aa, кДа
297,5
595
1190
2380
4760
9520
-
Mr Crys, кДа
297,0
594
1188
2376
4752
9505
8308
Rg, Å
64,2
65,5
70,8
88,7
138,4
253,4
244,1
* Величины молекулярных масс (Mr Crys) и радиусов инерции (Rg) для ряда смоделированных структур: А, (АА)1, (АА)2,
(АА)4, (АА)8, (АА)16 - рассчитывали с помощью программы CRYSOL [24], используя кристаллографическую структуру
PDB: 1EI7; величины Mraa - из данных аминокислотной последовательности.
Ранее с помощью криоэлектронной микроско
ре при условиях, близких к физиологическим,
пии «стопок дисков» белка ВТМ было показано,
тогда как более трудоемкий метод рентгено
что их структура подобна ассоциату двух цент
структурного анализа позволяет определять
ральных колец закристаллизованного четырех
структуру в кристалле, а с помощью криоэлек
слойного агрегата, определен размер толщины
тронной микроскопии можно проанализиро
одного кольца 26,8 Å [10, 11], что близко к опре
вать выборку замороженных частиц. Нами
деленной нами величине периода структуры
впервые были охарактеризованы структуры в
d4 = 26,9 Å реполимера (табл. 2).
растворе и выполнено структурное моделирова
Причиной низкой корреляции модельных и
ние по данным МУРР во всем измеряемом диа
экспериментальных кривых МУРР может быть
пазоне для вирионов и реполимеров белка обо
различие в длинах используемой модели (АA)16
лочки ВТМ. Ряд максимумов интенсивности на
(~820 Å) и частиц в препарате реполимера
кривых рассеяния соотнесен с реальными эле
(300-800 Å). На рис. 4 хорошо видно, что увели
ментами четвертичной структуры (периодич
чение длины частиц приводит к возрастанию
ность структуры, шаг спирали в вирионе), и наи
интенсивности пиков s2, s4 и s6, соответствую
лучшее совпадение с экспериментальными дан
щих упаковке дисков в структуре реполимера.
ными оказалось у модели реполимера из повто
Различная гидратация 20S дисков в кристалле и
ряющихся 20S дисков центральной пары колец
растворе реполимера также может быть одной
кристаллической модели PDB: 1EI7.
из причин несовпадения данных. Франклин и
Коммонер [7] обнаружили значительную гидра
тацию дисков в растворе и уменьшение размера
Финансирование. Работа выполнена при под
осевой периодичности в «стопках дисков» с 53
держке Российского фонда фундаментальных
до 43 Å при удалении воды в препаратах. Можно
исследований (18 04 00525а) и Министерства
предположить также, что атомарные структуры
науки и высшего образования Российской Фе
белка в кристаллической модели PDB: 1EI7 не
дерации в рамках выполнения работ по Государ
сколько отличаются от их структуры реполиме
ственному заданию ФНИЦ «Кристаллография
ра в растворе. Это различие в структуре может
и фотоника» РАН в части проведения экспери
быть причиной необычной стабильности репо
ментов МУРР.
лимера ВТМ в растворе и объяснять связывание
Конфликт интересов. Авторы заявляют об от
некоторых красителей, характерное для амило
сутствии конфликта интересов.
идов [13, 14].
Соблюдение этических норм. Настоящая
статья не содержит описания каких либо иссле
Одним из преимуществ МУРР является воз
дований с участием людей или использованием
можность характеристики всех частиц в раство
животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Caspar, D.L., and Namba, K. (1990) Switching in the self
3.
Butler, P.J. (1999) Self assembly of tobacco mosaic virus:
assembly of tobacco mosaic virus, Adv. Biophys., 26,
the role of an intermediate aggregate in generating both
157-185, doi: 10.1016/0065 227x(90)90011 h.
specificity and speed, Philos. Trans. R. Soc. Lond. B Biol.
2.
Kendall, A., McDonald, M., and Stubbs, G. (2007) Precise
Sci., 354, 537-550, doi: 10.1098/rstb.1999.0405.
determination of the helical repeat of tobacco mosaic virus,
4.
Bloomer, A.C., Champness, J.N., Bricogne, G., Staden, R.,
Virology, 369, 226-227, doi: 10.1016/j.virol.2007.08.013.
and Klug, A. (1978) Protein disk of tobacco mosaic virus at
БИОХИМИЯ том 85 вып. 3 2020
СТРУКТУРА РЕПОЛИМЕРОВ ВТМ
367
2.8 Å resolution showing the interactions within and
20.
Laemmli, U.K. (1970) Cleavage of structural proteins dur
between subunits, Nature, 276, 362-368, doi: 10.1038/
ing the assembly of the head of bacteriophage T4, Nature,
276362a0.
227, 680-685, doi: 10.1038/227680a0.
5.
Klug, A. (1999) The tobacco mosaic virus particle: structure
21.
Blanchet, C.E., Spilotros, A., Schwemmer, F., Graewert, M.A.,
and assembly, Philos. Trans. R. Soc. Lond. B Biol. Sci., 354,
Kikhney, A., Jeffries, C.M., Franke, D., Mark, D.,
531-535, doi: 10.1098/rstb.1999.0404.
Zengerle, R., Cipriani, F., Fiedler, S., Roessle, M., and
6.
Butler, P.J. (1984) The current picture of the structure and
Svergun, D.I. (2015) Versatile sample environments and
assembly of tobacco mosaic virus, J. Gen. Virol., 65 (Pt 2),
automation for biological solution X ray scattering experi
253-279, doi: 10.1099/0022 1317 65 2 253.
ments at the P12 beamline (PETRA III, DESY), J. Appl.
7.
Franklin, R.E., and Commoner, B. (1955) Abnormal pro
Crystallogr., 48, 431-443, doi: 10.1107/S160057671500254X.
tein associated with tobacco mosaic virus; X ray diffraction
22.
Konarev, P.V., Volkov, V.V., Sokolova, A.V., Koch, M.H.J.,
by an abnormal protein (B8) associated with tobacco
and Svergun, D.I. (2003) PRIMUS: a Windows PC based sys
mosaic virus, Nature, 175, 1076-1077, doi: 10.1038/
tem for small angle scattering data analysis, J. Appl. Crystallogr.,
1751076a0.
36, 1277-1282, doi: 10.1107/S0021889803012779.
8.
Unwin, P.N., and Klug, A. (1974) Electron microscopy of
23.
Konarev, P.V., Petoukhov, M.V., and Svergun, D.I. (2001)
the stacked disk aggregate of tobacco mosaic virus protein.
MASSHA - a graphics system for rigid body modelling of
I. Three dimensional image reconstruction, J. Mol. Biol.,
macromolecular complexes against solution scattering data,
87, 641-656, doi: 10.1016/0022 2836(74)90075 8.
J. Appl. Crystallogr.,
34,
527-532, doi:
10.1107/
9.
Dore, I., Ruhlmann, C., Oudet, P., Cahoon, M., Caspar, D.L.,
S0021889801006100.
and Van Regenmortel, M.H. (1990) Polarity of binding of
24.
Svergun, D., Barberato, C., and Koch, M.H.
(1995)
monoclonal antibodies to tobacco mosaic virus rods and
CRYSOL - a program to evaluate X ray solution scattering of
stacked disks, Virology, 176, 25-29, doi: 10.1016/0042
biological macromolecules from atomic coordinates, J. Appl.
6822(90)90226 h.
Crystallogr., 28, 768-773, doi: 10.1107/S0021889895007047.
10.
Diaz Avalos, R., and Caspar, D.L. (1998) Structure of the
25.
Durham, A.C., Finch, J.T., and Klug, A. (1971) States of
stacked disk aggregate of tobacco mosaic virus protein,
aggregation of tobacco mosaic virus protein, Nat. New Biol.,
Biophys. J.,
74,
595-603, doi:
10.1016/S0006
229, 37-42, doi: 10.1038/newbio229037a0.
3495(98)77818 X.
26.
Sachse, C., Chen, J.Z., Coureux, P.D., Stroupe, M.E.,
11.
Diaz Avalos, R., and Caspar, D.L. (2000) Hyperstable
Fandrich, M., and Grigorieff, N. (2007) High resolution
stacked disk structure of tobacco mosaic virus protein: elec
electron microscopy of helical specimens: a fresh look at
tron cryomicroscopy image reconstruction related to atom
tobacco mosaic virus, J. Mol. Biol., 371, 812-835,
ic models, J. Mol. Biol., 297, 67-72, doi: 10.1006/jmbi.
doi: 10.1016/j.jmb.2007.05.088.
1999.3481.
27.
Blanchet, C.E., and Svergun, D.I. (2013) Small angle X
12.
Bhyravbhatla, B., Watowich, S.J., and Caspar, D.L. (1998)
ray scattering on biological macromolecules and nanocom
Refined atomic model of the four layer aggregate of the
posites in solution, Annu. Rev. Phys. Chem., 64, 37-54,
tobacco mosaic virus coat protein at 2.4 A resolution,
doi: 10.1146/annurev physchem 040412 110132.
Biophys. J.,
74,
604-615, doi:
10.1016/S0006
28.
Shtykova, E.V., Baratova, L.A., Fedorova, N.V.,
3495(98)77819 1.
Radyukhin, V.A., Ksenofontov, A.L., Volkov, V.V.,
13.
Raghavendra, K., Adams, M.L., and Schuster, T.M. (1985)
Shishkov, A.V., Dolgov, A.A., Shilova, L.A., Batishchev, O.V.,
Tobacco mosaic virus protein aggregates in solution: struc
Jeffries, C.M., and Svergun, D.I. (2013) Structural analysis
tural comparison of 20S aggregates with those near condi
of influenza A virus matrix protein M1 and its self assem
tions for disk crystallization, Biochemistry, 24, 3298-3304,
blies at low pH, PLoS One, 8, e82431, doi: 10.1371/journal.
doi: 10.1021/bi00334a034.
pone.0082431.
14.
Raghavendra, K., Salunke, D.M., Caspar, D.L., and
29.
Costa, L., Andriatis, A., Brennich, M., Teulon, J.M.,
Schuster, T.M. (1986) Disk aggregates of tobacco mosaic
Chen, S.W., Pellequer, J.L., and Round, A.
(2016)
virus protein in solution: electron microscopy observations,
Combined small angle X ray solution scattering with atom
Biochemistry, 25, 6276-6279, doi: 10.1021/bi00368a066.
ic force microscopy for characterizing radiation damage on
15.
Ksenofontov, A.L., Dobrov, E.N., Fedorova, N.V.,
biological macromolecules, BMC Struct. Biol., 16, 18,
Arutyunyan, A.M., Golanikov, A.E., Jarvekulg, L., and
doi: 10.1186/s12900 016 0068 2.
Shtykova, E.V. (2018) Structure of potato virus A coat pro
30.
Spinozzi, F., Ferrero, C., Ortore, M.G., Antolinos, A.D.,
tein particles and their dissociation, Molecular Biology, 52,
and Mariani, P. (2014) GENFIT: software for the analysis of
913-921, doi: 10.1134/S0026893318060109.
small angle X ray and neutron scattering data of macro
16.
Ksenofontov, A.L., Dobrov, E.N., Fedorova, N.V.,
molecules in solution, J. Appl. Crystallogr., 47, 1132-1139,
Serebryakova, M.V., Prusov, A.N., Baratova, L.A., Paalme, V.,
doi: 10.1107/S1600576714005147.
Jarvekulg, L., and Shtykova, E V. (2018) Isolated potato
31.
Hiragi, Y., Inoue, H., Sano, Y., Kajiwara, K., Ueki, T.,
virus A coat protein possesses unusual properties and forms
Kataoka, M., Tagawa, H., Izumi, Y., Muroga, Y., and
different short virus like particles, J. Biomol. Struct. Dyn.,
Amemiya, Y. (1988) Temperature dependence of the struc
36, 1728-1738, doi: 10.1080/07391102.2017.1333457.
ture of aggregates of tobacco mosaic virus protein at pH 7.2.
17.
Goodman, R.M. (1975) Reconstitution of potato virus X in
Static synchrotron small angle X ray scattering, J. Mol.
vitro. I. Properties of the dissociated protein structural sub
Biol., 204, 129-140, doi: 10.1016/0022 2836(88)90604 3.
units, Virology,
68,
287-298, doi:
10.1016/0042
32.
Sano, Y., Inoue, H., and Hiragi, Y. (1999) Differences of
6822(75)90272 x.
reconstitution process between tobacco mosaic virus and
18.
Fraenkel Conrat, H. (1957) Degradation of tobacco mosa
cucumber green mottle mosaic virus by synchrotron small
ic virus with acetic acid, Virology, 4, 1-4, doi: 10.1016/
angle X ray scattering using low temperature quenching, J.
0042 6822(57)90038 7.
Protein Chem., 18, 801-805, doi: 10.1023/a:1020689720082.
19.
Ksenofontov, A.L., Kozlovskii, V.S., Kordiukova, L.V.,
33.
Potschka, M., Koch, M.H., Adams, M.L., and Schuster, T.M.
Radiukhin, V.A., Timofeeva, A.V., and Dobrov, E.N. (2006)
(1988) Time resolved solution X ray scattering of tobacco
Determination of concentration and aggregate size in
mosaic virus coat protein: kinetics and structure of interme
influenza virus preparations from true UV absorption spectra,
diates, Biochemistry,
27,
8481-8491, doi:
10.1021/
Molecular Biology, 40, 152-158.
bi00422a028.
БИОХИМИЯ том 85 вып. 3 2020
368
КСЕНОФОНТОВ и др.
CHARACTERIZATION OF TOBACCO MOSAIC VIRUS VIRIONS
AND REPOLYMERIZED COAT PROTEIN AGGREGATES
IN SOLUTION BY SMALL;ANGLE X;RAY SCATTERING*
A. L. Ksenofontov1**, M. V. Petukhov2,3, A. N. Prusov1, N. V. Fedorova1, and E. V. Shtykova2
1 Belozersky Institute of Physico Сhemical Biology, Lomonosov Moscow State University,
119991 Moscow, Russia; E mail: ksenofon@belozersky.msu.ru
2 Shubnikov Institute of Crystallography, Federal Scientific Research Centre «Crystallography and Photonics»,
Russian Academy of Sciences, 119333 Moscow, Russia; E mail: shtykova@ns.crys.ras.ru
3 Frumkin Institute of Physical Chemistry and Electrochemistry, Russian Academy of Sciences,
119071 Moscow, Russia; E mail: maxim@embl hamburg.de
Received November 7, 2019
Revised December 20, 2019
Accepted December 22, 2019
The structure of tobacco mosaic virus (TMV) virions and stacked disk aggregates of TMV coat protein (CP) in solu
tion was analyzed by synchrotron based small angle X ray scattering (SAXS) and negative contrast transmission elec
tron microscopy (TEM). TMV CP aggregates had a unique stability but did not have helical symmetry. According to
the TEM data, they were stacked disks associated into transversely striated rod shaped structures 300 to 800 Å long.
According to modeling based on the crystallographic model of the 4 layer TMV CP aggregate (PDB: 1EI7), the
stacked disks represented hollow cylinders. The calculated SAXS pattern for the disks was compared to the experi
mental one over the entire measured range. The best correlation with the SAXS data was found for the model with the
repeating central pair of discs; the SAXS curves for the stacked disks were virtually identical irrespectively of the pro
tein isolation method. The positions of maxima on the scatter curves could be used as characteristic features of the
studied samples; some of the peaks were assigned to the existing elements of the quaternary structure (periodicity of
aggregate structure, virion helix pitch). Low resolution structural data for the repolymerized TMV CP aggregates in
solution under conditions similar to natural were produced for the first time. Analysis of such nano size objects is
essential for their application in biomedicine and biotechnology.
Keywords: TMV, coat protein, stacked disk aggregates, virions, small angle X ray scattering
БИОХИМИЯ том 85 вып. 3 2020