БИОХИМИЯ, 2020, том 85, вып. 3, с. 369 - 377
УДК 577.112
АНТИРЕСТРИКЦИОННЫЙ БЕЛОК ArdB (R64)
ВЗАИМОДЕЙСТВУЕТ С ДНК*
© 2020
А.А. Кудрявцева1**, И.С. Охрименко1, В.С. Дидина1,
Г.Б. Завильгельский2, И.В. Манухов1,2
1 Московский физико технический институт (Национальный исследовательский университет),
141707 Долгопрудный Московской обл., Россия; электронная почта: kudryavtseva@phystech.edu
2 Государственный научно исследовательский институт генетики и селекции промышленных микроорганизмов
Национального исследовательского центра «Курчатовский институт», 117545 Москва, Россия
Поступила в редакцию 15.11.2019
После доработки 14.01.2020
Принята к публикации 17.01.2020
Антирестрикционные белки ArdB ингибируют in vivo рестрикционную (эндонуклеазную) активность фер
ментов рестрикции модификации I типа, но в настоящее время механизм ингибирования остается неизвес
тен. В данной работе показано, что при выделении и очистке белка ArdB из рекомбинантных клеток
Escherichia coli происходит совместное выделение (совыделение) ArdB с ДНК. В условиях суперпродукции
часть белка ArdB образует в клетке нерастворимые агрегаты, которые не содержат ДНК. Показано, что со
выделение ДНК как при выделении белка с использованием ионообменной и аффинной хроматографии,
так и при выделении тотальной ДНК из клеток, предварительно обработанных формальдегидом, имеет мес
то лишь с нативным ArdB, но не с его мутантным вариантом ArdBΔD141, не обладающим антирестрикци
онной активностью. Получено подтверждение гипотезы блокирования белком ArdB процесса транслока
ции ДНК через R субъединицы комплекса R2M2S фермента рестрикции модификации I типа.
КЛЮЧЕВЫЕ СЛОВА: антирестрикция, трансмиссивная плазмида, R64, ArdB.
DOI: 10.31857/S0320972520030070
Антирестрикционные белки cемейства ArdB
ного количества немодифицированной хромо
специфически ингибируют рестрикционную
сомальной ДНК. Феномен влияния немодифи
(эндонуклеазную) активность ферментов рест
цированной ДНК на антирестрикционную ак
рикции модификации I типа, таким образом
тивность ArdB позволил нам выдвинуть гипоте
позволяя конъюгативным плазмидам преодоле
зу о блокировании белком ArdB процесса транс
вать рестрикционный барьер. Впервые ген ardB,
локации немодифицированной ДНК через R
кодирующий антирестрикционный белок ArdB,
субъединицы комплекса R2M2S фермента рест
был обнаружен в трансмиссивной плазмиде
рикции модификации I типа [4].
pKM101 (группа несовместимости IncN) [1].
В настоящей работе исследована способность
Оказалось, что белок АrdB in vivo ингибирует
связывания белка ArdB, кодируемого геном ardB,
только рестрикционную (эндонуклеазную) ак
расположенным в трансмиссивной плазмиде
тивность ферментов рестрикции модификации
R64 (группа несовместимости IncI1), с ДНК in
I типа [1, 2] и не образует комплекс с фермента
vivo и, как следствие, возможность их совместно
ми рестрикции модификации I типа in vitro [2].
го выделения при различных условиях.
Была показана ключевая роль С концевого ас
партата (D141) в антирестрикционной актив
ности ArdB [3]. В работе Balabanov et al. [4] было
МАТЕРИАЛЫ ИССЛЕДОВАНИЯ
показано, что ArdB теряет способность защи
щать немодифицированный фаг λ.0 в УФ облу
Штаммы и условия культивирования. Штам
ченных клетках E. coli K12 от рестрикции EcoKI
мы Escherichia coli K 12: Е. coli AB1157; Е. coli
при условии образования в клетках значитель
TG1 (thi relA supE44 hsdR17 hsdM Δ(lac proAB)
[F′ traD36 proAB lacIqZ ΔM15]) и Е. coli
* Первоначально английский вариант рукописи опублико
BL21(DE3) - были получены из коллекции
msu.ru/biokhimiya, в рубрике «Papers in Press», BM19 326,
ВКПМ «ГосНИИгенетика».
02.03.2020.
Бактерии выращивали в колбах (150 мл) со
** Адресат для корреспонденции.
средой LB на качалке
(«New Brunswick
369
370
КУДРЯВЦЕВА и др.
Scientific», США) при 37 °С и 200 об/мин. Для
Q Sepharose® Fast Flow («GE Healthcare», США)
получения агаризованной среды использовали
или СПС био Q («Техносорбент», Россия) при
1,5% агара. Трансформированные штаммы
4 °С методом batch. Осадок диспергировали в
культивировали на средах с добавлением ампи
нетитрованном 20 мМ Tris OH буфере (pH ~
циллина в конечной концентрации 100 мкг/мл.
10,0). Полученный раствор центрифугировали в
Оптическую плотность (OD) бактериальной
течение 10 мин при 15 000 g. Переход агрегиро
суспензии измеряли при 590 нм с помощью фо
ванного ArdB из телец включения в раствори
токолориметра КФК 2МП («ПрофМТ», Рос
мую фазу контролировали методом электрофо
сия). Биосинтез ArdB в штамме Е. coli
реза в 15% ном ПААГ в денатурирующих усло
BL21(DE3) осуществляли в индукционной сре
виях (SDS PAGE) с окрашиванием Кумасси G
де с добавлением лактозы, как описано в рабо
250. У супернатанта, содержавшего солюбили
тах Pokrovsky et al. [5] и Studier [6].
зированный ArdB, доводили pH до 8,0 титрова
Экспрессию гена химерного белка GST
нием HCl. Ионообменную хроматографию на
ArdB (глутатионтрансфераза слита с ArdB) осу
тивного и солюбилизированного ArdB проводи
ществляли с плазмиды pGEX ArdB в штамме
ли на колонке, заполненной сорбентами
E. coli AB1157 в среде LB с добавлением IPTG
Q Sepharose® Fast Flow («GE Healthcare», США)
(1 мМ) при достижении OD590 0,8.
или СПС био Q («Техносорбент», Россия).
Экспрессию генов химерных белков ArdB и
Элюцию ArdB проводили при 4 °С, пропуская
ArdBΔD141, слитых с антигеном Flag, проводи
через колонку 50 мМ Tris HCl буфер (pH 8,0) со
ли с плазмид pFlag ArdB и pFlag ArdBΔD141 в
скоростью 6 мл/мин при линейном росте концен
штамме E. coli AB1157 в среде LB без добавления
трации NaCl от 0 до 1 M в 20 объемах сорбента в
индуктора.
хроматографической колонке. Результаты хро
Плазмиды. В качестве источника гена ardB
матографии анализировали методом SDS
использовали трансмиссивную плазмиду R64
PAGE.
(IncI1). Эндонуклеолитическое расщепление,
Аффинная хроматография. Химерный белок
лигирование фрагментов ДНК, электрофорез в
Flag ArdB выделяли с помощью набора Anti
агарозном геле, выделение фрагментов ДНК из
FLAG® M2 Magnetic Beads (M8823, «Sigma
агарозного геля проводили согласно общепри
Aldrich», США) согласно рекомендациям про
нятым методикам [7]. Полученные конструкции
изводителя; образцы наносили в 50 мМ Tris
представлены в таблице.
HCl буфере (pH 8,0), 150 мМ NaCl. Раствор це
В качестве отрицательного контроля при
левого химерного белка добавляли к сорбенту и
экспрессии гена ardB с промотора T7 использо
инкубировали в течение часа при комнатной
вали клетки E. coli BL21(DE3) с плазмидой
температуре при постоянном медленном пере
pET15b («Novagen», США).
мешивании на орбитальной мешалке. Магнит
Измерение антирестрикционной активности
ные частицы сорбента с адсорбированным бел
белка ArdB. Антирестрикционную активность
ком осаждали с помощью магнита, супернатант
белков ArdB, кодированных в конструкциях
удаляли, частицы сорбента промывали буфером
pGST ArdB, pFlag ArdB и pFlag ArdBΔD141, из
для нанесения в 20 объемах сорбента. Элюцию
меряли с использованием фаговой методики.
проводили, добавляя к частицам сорбента
Фаг λ.0 (содержащий немодифицированную
100 мМ глицин (pH 3,0). К раствору элюирован
ДНК) титровали, используя в качестве хозяйско
ного целевого химерного белка добавляли рав
го штамма E. coli K12 AB1157 c активной систе
ный объем 100 мМ Tris HCl буфера (pH 8,0),
мой рестрикции модификации I типа - EcoKI.
300 мМ NaCl и доводили pH до 8,0.
Эффективность посева (ЕОР - efficiency of plat
Конструкция pET His ArdB определяет син
ing) фага λ.0 определяли как соотношение титра
тез белка ArdB в слитной полипептидной цепи с
фага на штамме Е. coli AB1157 с плазмидой, со
полигистидиновым тагом 6xHis на N конце, со
держащей ген ardB, и на том же штамме без плаз
единенным с ArdB через линкер Gly Gly Ser
миды или содержащем вектор без вставки.
Gly Gly Gly Ser Gly. Целевой белок выделяли с
Ионообменная хроматография. Клетки штам
помощью сорбента TALON® Metal Affinity Resin
ма Е. coli BL21(DE3) pET YfeB лизировали с по
(«Clontech», США). Клеточные лизаты (в 20 мМ
мощью микрофлюидайзера M 100P («Microflu
фоcфатном буфере, pH 8,0; 300 мМ NaCl), со
idics International Corporation», США) в 50 мМ
державшие растворимую фракцию ArdB, нано
Tris HCl буфере (pH 8,0) при давлении 1500 бар.
сили на колонку, промывали буфером (20 мМ
Клеточные лизаты центрифугировали 10 мин
фоcфатный буфер, pH 8,0; 300 мМ NaCl) с до
при 15 000 g. Супернатант после центрифугиро
бавлением 10 мМ имидазола. Целевой белок
вания наносили на хроматографическую колон
элюировали с колонки фосфатным буфером, со
ку, заполненную ионообменными сорбентами
державшим 300 мМ NaCl и 500 мМ имидазола.
БИОХИМИЯ том 85 вып. 3 2020
БЕЛОК ArdB ВЗАИМОДЕЙСТВУЕТ С ДНК
371
Плазмиды, использованные в настоящей работе, содержащие ген ardB и его варианты
Плазмида,
Описание
Последовательности праймеров
источник
pET YfeB
ген ardB (R64), встроенный в вектор
5′ AAGGAGATATACCATGCATCATCACCATCACCACGGAG
pET15b под контроль промотора pT7
GCTCCGGCGGGGATCCGGTCAATATGCGAAACCTGT 3′
по сайтам NcoI/BamHI [8]
5′ AGCAGCCGGATCCTTAGTCCAGAGCCGCGTAAATC 3′
pET His
ген ardB (R64), содержащий
5′ AGGAGATATACCATGGGACATCATCACCATCACCACGGAG
ArdB
последовательность, кодирующую
GCTCCGGCGGCGGATCCGGTCAATATGCGAAACCTGT 3′
6xHis таг на N конце целевого белка
5′ AGCAGCCGGATCCTTAGTCCAGAGCCGCGTAAATC 3′
His ArdB; встроен в вектор pET15b
под контроль промотора pT7 по
сайтам NcoI/BamHI
pET His
то же, что и pET His ArdB, но
5′ AGGAGATATACCATGGGACATCATCACCATCACCACGGAG
ArdBΔD141
кодирует мутантный белок His
GCTCCGGCGGCGGATCCGGTCAATATGCGAAACCTGT 3′
ArdBΔD141, содержащий 6xHis таг
5′ AGCAGCCGGATCCTTACAGAGCCGCGTAAATC 3′
на N конце
pGEX ArdB
ген ardB (R64) встроен в вектор pGEX
5′ GGATCCATGCAATATGCGAAACCTGTC 3′
KG [9] по сайтам BamHI/EcoRI;
5′ GAATTCTCAGTCCAGAGCCGCGTAAAT 3′
конструкция содержит ген ardB
под контролем промотора tac
и определяет экспрессию химерного
белка GST ArdB [4]
pFlag ArdB
ген ardB (R64), содержащий
5′ GAGGAATACATCATGGACTACAAAGACGATGACGACAA
последовательность, кодирующую
GAATGTTGAAG 3′
Flag таг на N конце целевого белка
5′ GCGGATCCGTCCGTTAATCAGTCCAGAGCC 3′
Flag ArdB; встроен в коммерческий
вектор pTZ57R под промотор lac
pFlag
то же, что и pFlag ArdB, но кодирует
5′ GAGGAATACATCATGGACTACAAAGACGATGACGACAA
ArdBΔD141
мутантный белок Flag ArdBΔD141,
GAATGTTGAAG 3′
содержащий Flag таг на N конце
5′ GCGGATCCCCGTTAATCACAGAGCCGCGTA 3′
Для выделения белка GST ArdB, в котором
денситометрического анализа результатов гель
глутатион S трансфераза (GST) соединена с N
электрофореза в программе TotlLAb. Для этого
концом ArdB через гидролизуемый тромбином
определяли интенсивность окрашивания полос
линкер Leu Val Pro Arg Gly Ser Pro Gly [9], ис
ArdB на фотографии геля для каждой фракции,
пользовали набор реактивов Pierce™ GST Protein
нормированной на ее объем. Сумму интенсив
Interaction Pull Down Kit («Thermo Scientific»,
ностей окрашивания полос ArdB принимали за
США). Клетки лизировали в PBS (pH 7,5),
100%.
150 мМ NaCl. После центрифугирования освет
Получение ковалентных конъюгатов ДНК-
ленные лизаты, содержавшие растворимую
белок с использованием формальдегида. Суспен
фракцию ArdB, добавляли к GST сорбенту, мед
зию клеток E. coli BL21(DE3) без плазмиды или
ленно перемешивали в течение часа при 4 °С,
с плазмидами, содержащими гены ardB (натив
промывали PBS трижды. Целевой белок элюи
ный ArdB) или ardB ΔD141 (мутантный
ровали 50 мМ Tris HCl с 50 мМ глутатионом.
ArdBΔD141) под контролем промотора pТ7, вы
Результаты выделения белков с помощью аф
держивали 40 мин при комнатной температуре в
финной хроматографии анализировали методом
30% ном формальдегиде [10, 11]. После этого
SDS PAGE и масс спектрометрическим фингер
выделяли тотальную ДНК с помощью набора
принт анализом. Наличие ДНК в образцах конт
реактивов Wizard® Genomic DNA Purification
ролировали электрофорезом в 1% ном агароз
Kit («Promega», США). Полученные образцы
ном геле с окрашиванием этидиум бромидом с
анализировали в 1% ном агарозном и 15% ном
добавлением в электродный буфер РНКазы A.
полиакриламидном гелях.
Расчет содержания целевого белка в образце.
МассGспектрометрический анализ. Иденти
Расчет содержания целевого белка в каждой
фикацию белков ArdB проводили с помощью
фракции элюата после хроматографического
масс спектрометрии. Белки, выделенные из ге
разделения белков осуществляли с помощью
ля после SDS PAGE, идентифицировали мето
БИОХИМИЯ том 85 вып. 3 2020
372
КУДРЯВЦЕВА и др.
дом MALDI TOF (matrix assisted laser description
графической очистке на ионообменном сорбен
ionization time of flight). Образцы перед анали
те с помощью электрофореза в полиакриламид
зом обрабатывали трипсином [12-16]. Масс
ном и агарозном гелях. После хроматографичес
спектрометрический анализ проводили на при
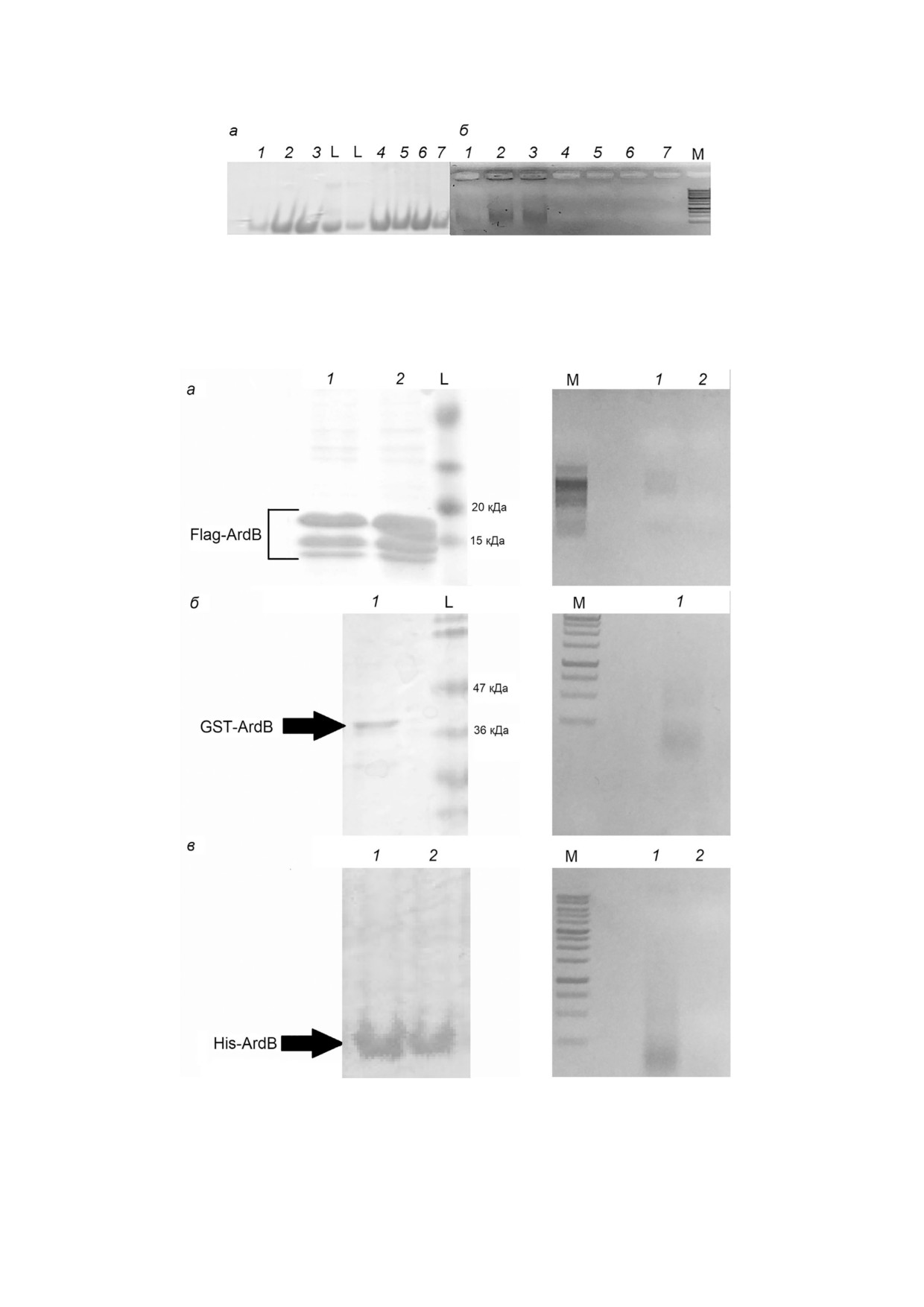
кой очистки на ионообменном сорбенте во
боре MALDI TOF Reflex III («Bruker», Герма
фракциях с ArdB содержится сравнительно ма
ния) в Центре протеомных исследований при
лое количество примесных белков штамма про
Институте биомедицинской химии РАН
дуцента. Анализ с помощью электрофореза в
им. В.Н. Ореховича. Полученные масс фингер
агарозном геле (рис. 2, б) показал присутствие
принты анализировали с помощью базы данных
ДНК во фракциях белка ArdB, полученных в
Swiss Prot [17].
процессе ионообменной хроматографии при
нанесении белка из растворимой фракции кле
точного лизата (дорожки 1-3), но не во фракци
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
ях, полученных из агрегатов (дорожки 4-7).
Для подтверждения гипотезы о связывании
Результаты выделения белка ArdB с по
ArdB с ДНК были поставлены эксперименты с
мощью ионообменной хроматографии пред
выделением ArdB и его мутантной формы
ставлены на рис. 1. Клетки E. coli BL21(DE3)
ArdBΔD141, не обладающей антирестрикцион
pET YfeB культивировали при 37 °С на индук
ной активностью, с помощью разных видов аф
ционной среде с лактозой в течение 20 ч. При
финной хроматографии.
экспрессии ardB с промотора фага T7 значи
Поскольку плазмида с активно экспрессиру
тельная часть белка агрегирует (образует неклас
ющимся геном ardB нередко теряется клетками,
сические тельца включения - нерастворимые
антирестрикционная активность химерных бел
агрегаты). Ионообменную хроматографию про
ков была предварительно подтверждена in vivo с
водили как для растворимой фракции белка
помощью посевов немодифицированного фага λ.
ArdB, так и для агрегированной формы, предва
На рис. 3 приведены результаты аффинной
рительно растворенной с помощью нетитрован
хроматографии химерных белков Flag ArdB,
ного 20 мМ Tris.
Flag ArdBΔD141, GST ArdB, His ArdB и His
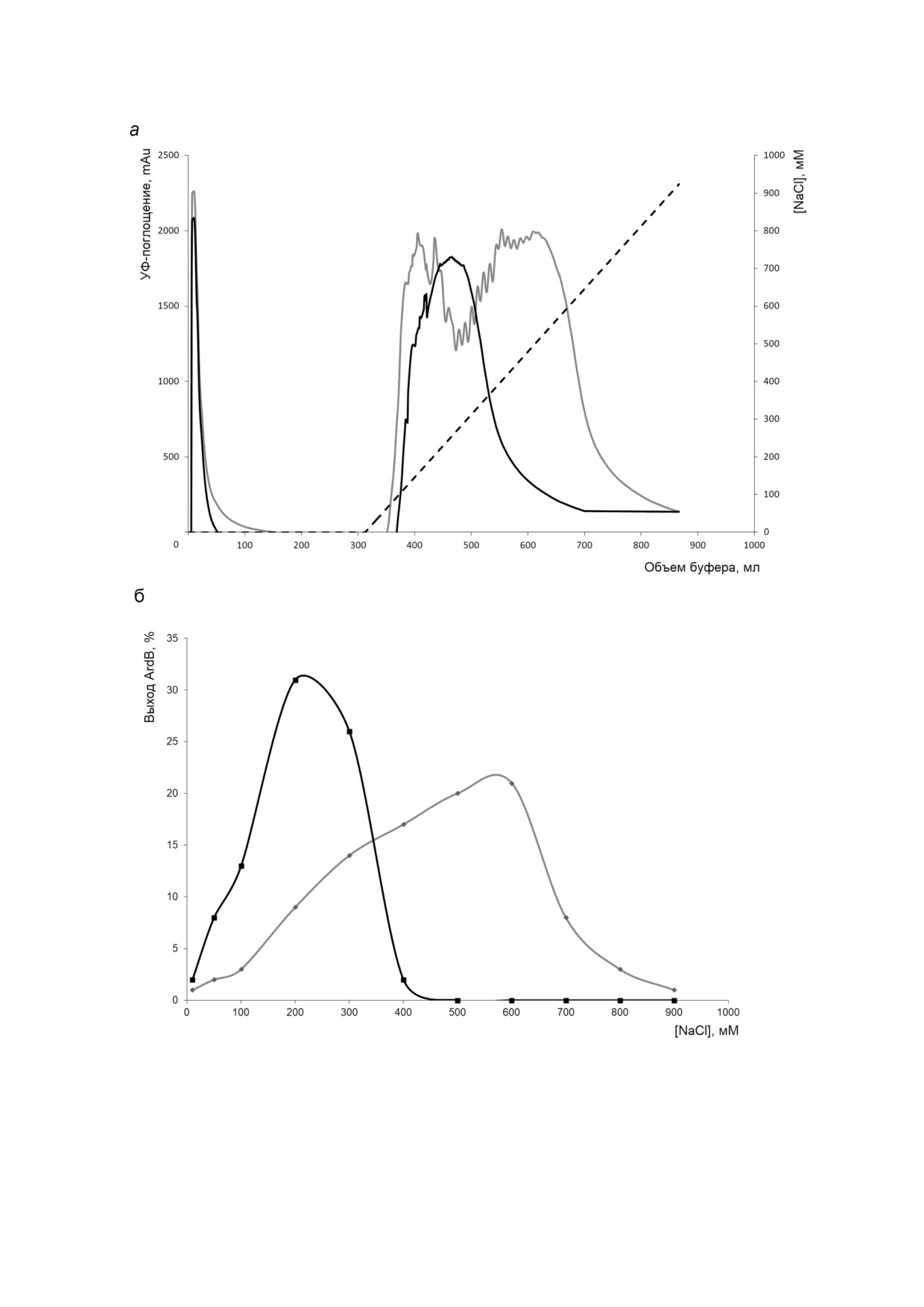
Как видно из рис. 1, белок ArdB, переведен
ArdBΔD141. Содержание ArdB и ArdBΔD141 в
ный в растворимую форму из агрегатов, элюи
полосах на ПААГ (рис. 3, левая часть) после аф
руется с сорбента при сравнительно невысокой
финной хроматографии было подтверждено
концентрации соли (максимум концентрации
масс спектрометрическим фингерпринт анали
200 мM NaCl), что вполне ожидаемо для белка с
зом. Наличие ДНК в элюатах было показано с
расчетной изоэлектрической точкой, равной
помощью электрофореза в 1% ном агарозном
4,97. Стоит отметить сравнительную компакт
геле с окрашиванием этидиум бромидом.
ность пика при элюции, что может свидетель
Как видно из рис. 3, ДНК совыделяется с
ствовать о гомогенности белка. Однако белок
ArdB при использовании разных носителей и
ArdB, выделяемый из фракции растворимых
сорбентов: магнитных частиц с антителами anti
белков клеточного лизата, т.е. находящийся в
Flag, глутатионового сорбента и кобальтовой
растворимой форме, элюируется с хроматогра
смолы. ДНК совыделяется лишь с нативными
фического ионообменного сорбента более
формами белка Flag ArdB и His ArdB (дорожки
широким пиком при концентрации NaCl
1), но не с мутантами Flag ArdBΔD141 и His
200-700 мM. Полученные профили элюции
ArdBΔD141 (дорожки 2). Отметим, что ДНК в
свидетельствуют о том, что изначально раство
образцах представлена различными фрагмента
римый белок ArdB в клетке может быть связан с
ми в пределах 1000 п.н.
ДНК, что, во первых, приводит к увеличению
Для проверки взаимодействия ArdB с ДНК
распределенного электростатического отрица
были получены ковалентные конъюгаты ArdB с
тельного заряда и к повышенной сорбции комп
ДНК, т.е. были зафиксированы взаимодействия
лекса белка ArdB с ДНК на ионообменном сор
белок-ДНК за счет образования ковалентных
бенте и, следовательно, требует большей концен
связей между первичной аминогруппой белка и
трации NaCl для элюции; во вторых, гетероген
нуклеиновой кислотой с использованием фор
ность ДНК в комплексе ArdB с ДНК может при
мальдегида [10, 11]. Клетки E. coli трех штаммов
водить к значительному уширению хроматогра
BL21(DE3) (без плазмиды), BL21(DE3) (pET
фических пиков при элюции. Следствие обоих
YfeB) с нативным геном ardB и BL21(DE3)
этих процессов мы наблюдаем при проведении
(pET YfeBΔD141) с мутантным геном ardB
ионообменной хроматографии ArdB.
ΔD141 культивировали до OD590 0,8, затем обра
На рис. 2 представлены результаты анализа
батывали формальдегидом и выделяли тоталь
фракций белка ArdB, полученных при хромато
ную ДНК. Выделение хромосомальной ДНК
БИОХИМИЯ том 85 вып. 3 2020
БЕЛОК ArdB ВЗАИМОДЕЙСТВУЕТ С ДНК
373
Рис. 1. Профиль элюции растворимой и нерастворимой форм белка ArdB с ионообменного сорбента (заряженная группа
ионообменного сорбента - четвертичный амин). а - Зависимость УФ поглощения при 280 нм элюата от объема буфера,
прошедшего через колонку; б - содержание белка ArdB во фракциях, полученных в процессе очистки на ионообменном
сорбенте, при различных концентрациях NaCl. Серая кривая - профиль элюции растворимой фракции белка ArdB, чер
ная кривая - профиль элюции белка ArdB, переведенного в растворимую форму из телец включения. Пунктирная ли
ния - линейный градиент концентрации NaCl в элюенте
БИОХИМИЯ том 85 вып. 3 2020
374
КУДРЯВЦЕВА и др.
Рис. 2. Анализ фракций белка ArdB, полученных в результате ионообменной хроматографии, с помощью электрофореза
в SDS PAGE (а) и 1% ном агарозном геле (б). Дорожки 1-3 - фракции белка ArdB, полученные при очистке ArdB, изна
чально присутствовавшего в клеточном лизате в растворимой форме, элюированные с сорбента 200, 500 и 600 мМ NaCl
соответственно; дорожки 4-7 - фракции, полученные при очистке белка ArdB из растворенных агрегатов, элюированные
с сорбента 150, 200, 300 и 350 мМ NaCl соответственно. L - маркер 14,5 кДа (РНКаза А, «Евроген», Россия), M - маркер
ДНК (1 kb, «Евроген», Россия)
Рис. 3. Результаты аффинной хроматографии химерных белков ArdB. Слева - анализ полученных фракций в SDS PAGE,
справа - в 1% ном агарозном геле. а - Flag ArdB (дорожки 1) и Flag ArdBΔD141 (дорожки 2); б - GST ArdB (дорожки 1);
в - His ArdB (дорожки 1) и His ArdBΔD141 (дорожки 2). L - Prestained Protein MW marker (а) и PageRuler Plus (б) («Thermo
Scientific», США); M - 100+ bp (а) и 1 kb (б, в) («Евроген», Россия)
БИОХИМИЯ том 85 вып. 3 2020
БЕЛОК ArdB ВЗАИМОДЕЙСТВУЕТ С ДНК
375
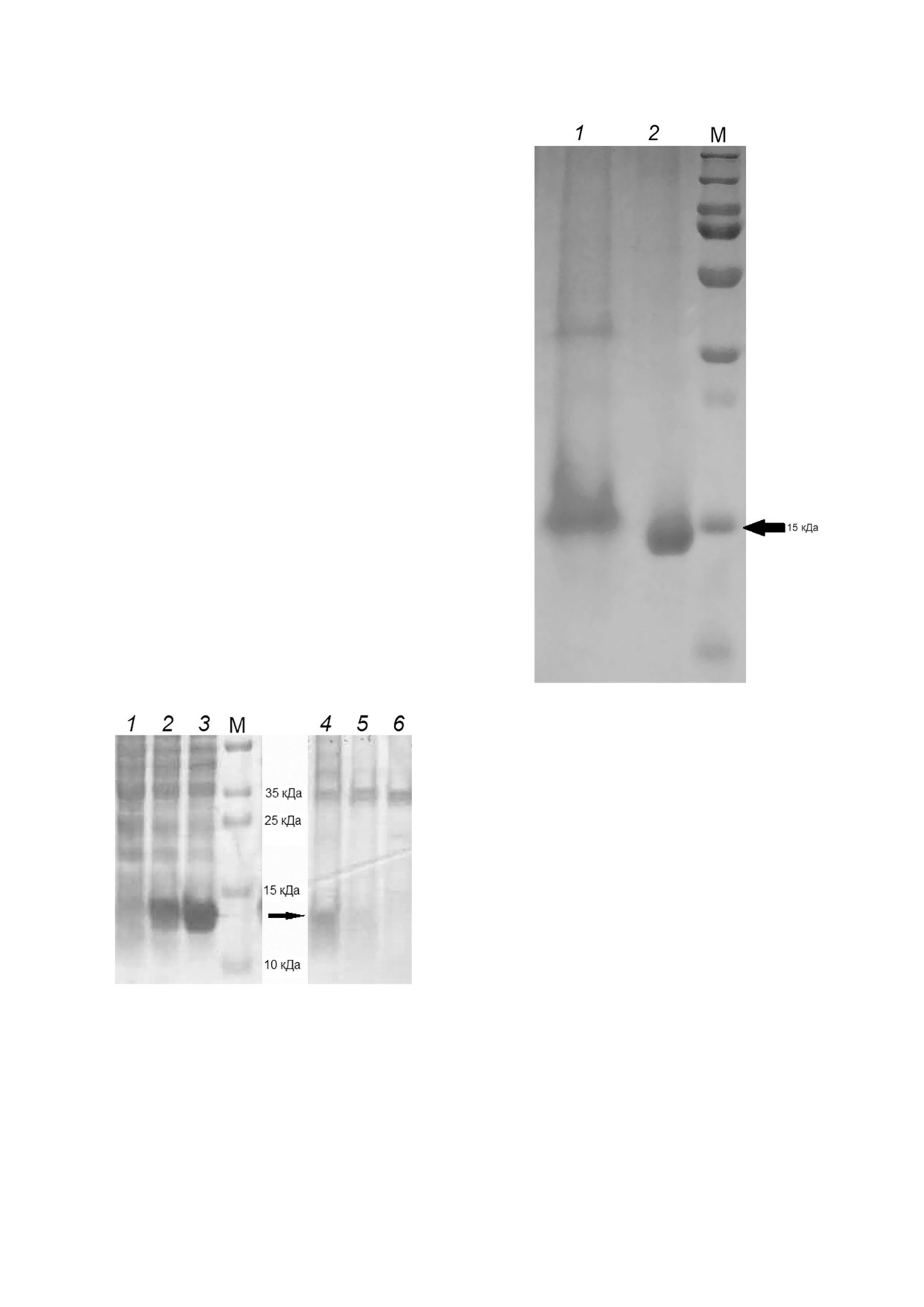
контролировали методом электрофореза в ага
розном геле. Совыделяющиеся с ДНК белки оп
ределяли с помощью SDS PAGE (рис. 4, дорожки
4-6), предварительно обработав образцы ультраз
вуком для деградации длинных фрагментов ДНК.
Полосы с массой 14 кДа вырезали из геля, обраба
тывали трипсином, элюировали полученные пеп
тиды и идентифицировали по распределению и
составу пептидных фингерпринтов и сравнению
с базой данных Swiss Prot как белок ArdB.
После обработки клеток формальдегидом сов
местно с ДНК совыделяется большое количество
разнообразных белков. Однако ArdB выделяется
вместе с тотальной ДНК только в варианте натив
ного белка (рис. 4, дорожка 4), а не мутантной
формы, не обладающей антирестрикционной
активностью (рис. 4, дорожка 5). Вместе с то
тальной ДНК, выделенной из клеток, несущих
плазмиду с мутантным геном ardB ΔD141, не
выделяется белок массой 14 кДа, соответствую
щий ArdBΔD141. Мутантный по С концевому
аспартату белок ArdBΔD141, по видимому, не
способен взаимодействовать с ДНК и поэтому
не обладает антирестрикционной активностью.
Для доказательства непосредственной связи
ArdB с ДНК был поставлен эксперимент с про
веркой торможения в геле (рис. 5). Для этого на
одном полиакриламидном геле (SDS PAGE)
были проанализированы результаты выделения
ДНК из клеток, обработанных формальдегидом
(рис. 4, дорожка 4), и результаты выделения и
Рис. 5. Электрофоретическое разделение в ПААГ белков
после выделения ДНК из клеток, обработанных формаль
дегидом (1), и после выделения и очистки белка ArdB из
агрегатов (2). М - маркер PageRuler Plus («Thermo
Scientific», США)
очистки белка ArdB из агрегатов (рис. 2, дорож
ка 5), которые не содержат в своем составе ДНК.
Как видно из рис. 5, белок ArdB, содержа
щийся в образце после выделения тотальной
ДНК, несколько отстает от белка, выделенного
с помощью ионообменной хроматографии из
белковых агрегатов. Принадлежность полос раз
мером 15 кДа к белку ArdB подтверждена масс
спектрометрическим фингерпринт анализом.
Данный результат можно считать прямым ука
занием на взаимодействие между ДНК и белком
Рис. 4. Электрофоретическое разделение в ПААГ белков
ArdB in vivo.
клеточных лизатов штаммов E. coli BL21(DE3) и выделен
ной хромосомальной ДНК. 1-3 - Лизаты из клеток, не об
работанных формальдегидом: 1 - BL21(DE3) pET15, 2 -
BL21(DE3) pET YfeB с геном ardB, 3 - BL21(DE3) pET
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
YfeBΔD141 с мутантным геном ardB ΔD141; 4-6 - хромо
сомальная ДНК, выделенная из клеток, обработанных
При выделении ArdB с использованием ионо
формальдегидом: 4 - BL21(DE3) pET YfeB, 5 - BL21(DE3)
обменной хроматографии во фракциях с белком
pET YfeBΔD141, 6 - BL21(DE3) pET15; М - маркер
PageRuler Plus («Thermo Scientific», США)
была обнаружена ДНК. Этот же результат под
БИОХИМИЯ том 85 вып. 3 2020
376
КУДРЯВЦЕВА и др.
тверждался и при выделении ArdB с помощью
ющая антирестрикционную активность белка
различных методов аффинной хроматографии:
ArdB, в ~50 раз превышает таковую белка ArdA,
выделение с помощью Flag тага, 6хHis тага и в
т.е. равна ~5 ⋅ 10-7 М. По данным Serfiotis Mitsa
химерной конструкции с GST. Во всех случаях
et al. [2], in vitro активность ArdB не обнаружива
были использованы совершенно разные носите
ется, и, следовательно, связывание белка с ДНК
ли и сорбенты, поэтому элюция ДНК вместе с
не происходит. Однако надо отметить, что в
целевым белком не может объясняться связыва
этой работе проводили сравнение ArdA и ArdB в
нием ДНК с сорбентом. В экспериментах с вы
эквимолярных концентрациях, и, возможно,
делением тотальной ДНК из клеток, обработан
требуются дополнительные эксперименты in
ных формальдегидом, было проведено сравне
vitro с бóльшими концентрациями ArdB.
ние ArdB дикого типа и мутанта по С концевому
Полученные в настоящей работе данные о
аспартату ArdBΔD141, не обладающего антире
наличии комплексов белка ArdB с хромосомаль
стрикционной активностью. Показано, что
ной ДНК подтверждают гипотезу о блокирова
ArdBΔD141 не связывается с ДНК, и, по види
нии белком ArdB процесса транслокации немо
мому, это служит причиной отсутствия у данно
дифицированной ДНК через R субъединицы
го белка антирестрикционной активности. Пос
комплекса R2M2S фермента рестрикции моди
кольку белок ArdB, содержащийся в образце,
фикации I типа, высказанную в работе Balabanov
после выделения тотальной ДНК при миграции
et al. [4]. В результате ингибируется лишь рест
в ПААГ отстает от белка, выделенного с по
рикционная (эндонуклеазная), но не модифика
мощью ионообменной хроматографии из бел
ционная (метилазная) активность фермента.
ковых агрегатов, можно считать доказанным
взаимодействие между ДНК и ArdB in vivo.
В работе Завильгельского с соавт. [18] была
Финансирование. Работа выполнена при под
определена Kd ДНК мимикрирующего белка
держке РФФИ (гранты 18 34 00753 и 19 04
ArdA. Измерения проводили по ингибированию
00495), а также за счет средств Госзадания
рестрикционной активности ферментов рест
№ 6.9899.2017/БЧ.
рикции модификации I типа in vivo. Показано,
Конфликт интересов. Авторы заявляют об от
что Kd для белка ArdA составляет ~10-8 М. В ра
сутствии конфликта интересов.
боте Балабанова с соавт. [19] было проведено
Соблюдение этических норм. Настоящая
сравнительное измерение Kd также in vivo для
статья не содержит описания каких либо иссле
белков ArdA и ArdB, гены которых расположены
дований с участием людей или животных в каче
в плазмиде R64. Показано, что Kd, характеризу стве объектов исследований.
СПИСОК ЛИТЕРАТУРЫ
1.
Belogurov, A.A., Delver, E.P., and Rodzevich, O.V. (1993)
Kotova, V.Y., and Manukhov, I.V. (2019) Methionine
Plasmid pKM101 encodes two nonhomologous antirestric
gamma lyase from Clostridium sporogenes increases the
tion proteins (ArdA and ArdB) whose expression is con
anticancer effect of doxorubicin in A549 cells and human
trolled by homologous regulatory sequences, J. Bacteriol.,
cancer xenografts, Invest New Drugs, 37, 201-209,
175, 4843-4850, doi: 10.1128/jb.175.15.4843 4850.1993.
doi: 10.1007/s10637 018 0619 4.
2.
Serfiotis Mitsa, D., Herbert, A.P., Roberts, G.A.,
6. Studier, F.W. (2005) Protein production by auto induction
Soares, D.C., White, J.H., Blakely, G.W., Uhrin, D., and
in high density shaking cultures, Protein Expr. Purif., 41,
Dryden, D.T. (2010) The structure of the KlcA and ArdB
207-234, doi: 10.1016/j.pep.2005.01.016.
proteins reveals a novel fold and antirestriction activity
7. Sambrook, J., and Russell, D.W. (2001) Molecular cloning:
against type I DNA restriction systems in vivo but not in
a laboratory manual, Cold Spring Harbor, Cold Spring
vitro, Nucl. Acids Res., 38, 1723-1737, doi: 10.1093/nar/
Harbor Laboratory Press, N.Y.
gkp1144.
8. Goryanin, I.I., Kudryavtseva, A.A., Balabanov, V.P.,
3.
Кудрявцева А.А., Осетрова М.С., Ливинюк В.Я., Ма
Biryukova, V.S., Manukhov, I.V., and Zavilgelsky, G.B.
нухов И.В., Завильгельский Г.Б. (2017) С концевой
(2018) Antirestriction activities of KlcA (RP4) and ArdB
остаток аспарагиновой кислоты (D141) необходим
(R64) proteins, FEMS Microbiol. Lett.,
365,
для антирестрикционной активности белка ArdB
doi: 10.1093/femsle/fny227.
(R64), Молекулярная биология, 51, 831-835.
9. Guan, K.L., and Dixon, J.E. (1991) Eukaryotic proteins
4.
Balabanov, V.P., Kudryavtseva, A.A., Melkina, O.E.,
expressed in Escherichia coli: an improved thrombin cleav
Pustovoit, K.S., Khrulnova, S.A., and Zavilgelsky, G.B.
age and purification procedure of fusion protein with glu
(2019) ArdB protective activity for unmodified λ phage
tathione S transferase, Anal. Biochem., 192, 262-267,
against EcoKI restriction decreases in UV treated
doi: 10.1016/0003 2697(91)90534 z.
Escherichia coli, Curr. Microbiol.,
76,
1374-1378,
10. Solomon, M.J., and Varshavsky, A. (1985) Formaldehyde
doi: 10.1007/s00284 019 01755 z.
mediated DNA protein crosslinking: a probe for in vivo
5.
Pokrovsky, V.S., Anisimova, Yu.N., Davydov, Z.D.,
chromatin structures, Proc. Natl. Acad. Sci. USA,
82,
Bazhenov, S.V., Bulushova, N.V., Zavilgelsky, G.B.,
6470-6474, doi: 10.1073/pnas.82.19.6470.
БИОХИМИЯ том 85 вып. 3 2020
БЕЛОК ArdB ВЗАИМОДЕЙСТВУЕТ С ДНК
377
11.
Hoffman, E.A., Frey, B.L., Smith, L.M., and Auble, D.T.
intestinal microflora of the fish inhabiting the Bering and
(2015) Formaldehyde crosslinking: a tool for the study of
Okhotsk seas, FEMS Microbiol. Lett., 366, pii: fnz040,
chromatin complexes, J. Biol. Chem., 290, 26404-26411,
doi: 10.1093/femsle/fnz040.
doi: 10.1074/jbc.R115.651679.
16. Manukhov, I.V., Melkina, O.E., Goryanin, I.I., Baranova, A.V.,
12.
Han, M.J., Yoon, S.S., and Lee, S.Y. (2001) Proteomic
and Zavilgelsky, G.B. (2010) The N terminal domain of the
analysis of metabolically engineered Escherichia coli pro
Aliivibrio fischeri LuxR is a target of the GroEL chaperonin,
ducing poly(3 hydroxybutyrate), J. Bacteriol.,
183,
J. Bacteriol., 192, 549-551, doi: 10.1128/JB.00754 10.
301-308, doi: 10.1128/JB.183.1.301 308.2001.
17. Bairoch, A., and Apweiler, R. (2000) The SWISS PROT
13.
Rosenfeld, J., Capdevielle, J., Guillemoi, J., and Ferrara, P.
protein sequence database and its supplement TrEMBL in
(1992) In gel digestion of proteins for internal sequence
2000, Nucl. Acids Res., 28, 45-48, doi: 10.1093/nar/28.
analysis after one or two dimensional gel electrophoresis,
1.45.
Anal. Biochem.,
203,
173-179, doi:
10.1016/0003
18. Zavilgelsky, G.B., Kotova, V.Yu., and Rastorguev, S.M.
2697(92)90061 b.
(2008) Comparative analysis of antirestriction activity of
14.
Patterson, S.D., and Aebersold, R. (1995) Mass spectro
ArdA (ColIbP9) and Ocr (T7) proteins, Biochemistry
metric approaches for the identification of gel separated
(Moscow), 73, 1124-1130.
proteins, Electrophoresis, 16, 1791-1814, doi: 10.1002/
19. Balabanov, V.P., Pustovoit, K.S., and Zavilgelsky, G.B.
elps.11501601299.
(2012) Comparative analysis of antirestriction activity of
15.
Bazhenov, S.V., Khrulnova, S.A., Konopleva, M.N., and
R64 ArdA and ArdB proteins, Mol. Biol. (Mosk.), 46,
Manukhov, I.V. (2019) Seasonal changes in luminescent
269-275.
ANTIGRESTRICTION PROTEIN ArdB (R64) BINDS TO DNA*
A. A. Kudryavtseva1**, I. S. Okhrimenko1, V. S. Didina1,
G. B. Zavilgelsky2, and I. V. Manukhov1,2
1 Moscow Institute of Physics and Technology, Laboratory of Molecular Genetics,
141707 Dolgoprudny, Moscow Region, Russia; E mail: kudryavtseva@phystech.edu
2 State Research Institute of Genetics and Selection of Industrial Microorganisms,
National Research Center “Kurchatov Institute”, Laboratory of Genetics of Bacteria, 117545 Moscow, Russia
Received November 15, 2019
Revised January 14, 2020
Accepted January 17, 2020
Аnti restriction ArdB protein inhibits restriction (endonuclease) activity of restriction modification (RM) type I
enzymes in vivo, however the mechanism of the inhibition is still unknown. In this study it was shown that isolation
and purification of ArdB from the recombinant Escherichia coli cells results in co isolation of ArdB with DNA.
Though under conditions of superproduction, part of ArdB protein forms in cells insoluble DNA free aggregates.
Only native ArdB, but not the ArdBΔD141 mutant which does not reveal anti restriction activity, could be co isolat
ed with DNA both during protein isolation by anion exchange and affinity chromatography and during the total DNA
isolation from formaldehyde treated cells. This confirms the hypothesis that ArdB blocks the DNA translocation via
the R subunits of the RM type I enzyme R2M2S complex.
Keywords: anti restriction, transmissive plasmid, R64, ArdB
6 БИОХИМИЯ том 85 вып. 3 2020