БИОХИМИЯ, 2020, том 85, вып. 3, с. 378 - 386
УДК 577.151
ВЛИЯНИЕ СТРУКТУРНЫХ ИЗМЕНЕНИЙ В ЗОНЕ КОНТАКТА
СУБЪЕДИНИЦ НА АКТИВНОСТЬ И АЛЛОСТЕРИЧЕСКУЮ
РЕГУЛЯЦИЮ ПИРОФОСФАТАЗЫ ИЗ Mycobacterium tuberculosis*
© 2020
Р.С. Романов1,2, С.А. Курилова1,2, А.А. Байков1,2, Е.В. Родина1,2**
1 Московский государственный университет им. М.В. Ломоносова,
НИИ физико"химической биологии им. А.Н. Белозерского,
119991 Москва, Россия; электронная почта: rodina@belozersky.msu.ru
2 Московский государственный университет им. М.В. Ломоносова,
химический факультет, 119991 Москва, Россия
Поступила в редакцию 26.12.2019
После доработки 14.01.2020
Принята к публикации 14.01.2020
Гексамерная неорганическая пирофосфатаза из Mycobacterium tuberculosis (Mt PPаза) имеет ряд структурных
и функциональных особенностей, выделяющих ее среди гомологов, широко распространенных в живом
мире. В частности, в ней иные контактные зоны субъединиц и отсутствует N концевой участок полипептид
ной цепи. В данной работе мы сконструировали две мутантные формы фермента (Ec Mt РРазу и R14Q Mt
PPазу), в первой из которых недостающая часть цепи достроена фрагментом РРазы Escherichia coli, а во вто
рой произведена точечная замена в зоне контакта двух тримеров внутри гексамера. Обе модификации зна
чительно улучшили каталитические свойства фермента и устранили его ингибирование избытком кофакто
ра, иона магния. Обнаружена активация Mt PPазы малыми (~10 мкМ) концентрациями ATP, фруктозо 1
фосфата, L малата и негидролизуемого аналога субстрата, метиленбисфосфоната (РСР). При концентра
ции 100 мкМ и выше три первых соединения выступали в роли ингибиторов. Активирующее действие РСР
отсутствовало у обеих мутантных форм, а ингибирующее действие фруктозо 1 фосфата отсутствовало у Ec
Mt РРазы. Эффекты остальных модуляторов изменялись только количественно. Полученные данные сви
детельствуют о наличии у Mt РРазы аллостерических центров регуляции, которые находятся в зонах кон
такта субъединиц или структурно связаны с ними.
КЛЮЧЕВЫЕ СЛОВА: пирофосфатаза, сайт направленный мутагенез, аллостерическая регуляция, фрукто
зо 1 фосфат, L малат.
DOI: 10.31857/S0320972520030082
Растворимые неорганические пирофосфата
ганизмов характерны не только сходство строе
зы семейства I (РРазы) катализируют гидролиз
ния активного центра и механизма действия, но
неорганического пирофосфата с образованием
и высокая консервативность аминокислотных
двух молекул ортофосфата. РРазы присутствуют
последовательностей и пространственных
в большинстве живых организмов, где выполня
структур субъединиц [2]. Все РРазы активны
ют важную задачу - гидролизуя пирофосфат,
только в присутствии ионов магния, которые ак
смещают множество биохимических процессов,
тивируют как фермент, так и субстрат. Всего для
протекающих с его образованием, в сторону ге
катализа необходимы три иона магния на один
нерации продуктов [1]. Для РРаз различных ор
активный центр: один из них образует с пиро
фосфатом истинный субстрат (комплекс
Принятые сокращения: РРаза - неорганическая MgPPi), а два других формируют на ферменте
пирофосфатаза; Mt PPаза - неорганическая пирофосфа
центр связывания субстрата и, кроме того, акти
таза из Mycobacterium tuberculosis; Ес РРаза - неорганичес
кая пирофосфатаза из Escherichia coli; Ec Mt РРаза - хи
вируют нуклеофильную молекулу воды [3]. Фер
мерный фермент, в котором полипептидная цепь Mt
ментативная реакция протекает без образования
РPазы продолжена на N конце остатками 1-12 Ес РРазы; ковалентного интермедиата, как прямая атака
R14Q Mt PPаза - мутантный вариант Mt РРазы с заменой
молекулы воды, активированной двумя ионами
Arg14 на Gln; РСР - метиленбисфосфонат.
магния, на атом фосфора [4].
* Первоначально английский вариант рукописи опубли
РPаза из Mycobacterium tuberculosis (Mt РРаза)
msu.ru/biokhimiya, в рубрике «Papers in Press», BM19 352,
обладает рядом структурных и функциональных
24.02.2020.
особенностей, отличающих ее от большинства
** Адресат для корреспонденции.
известных РPаз, и поэтому входит в группу пер
378
АЛЛОСТЕРИЧЕСКАЯ РЕГУЛЯЦИЯ ПИРОФОСФАТАЗЫ ИЗ Mycobacterium tuberculosis
379
В настоящей работе с целью определения пу
тей регуляции Mt РPазы и поиска структурно
функциональных соотношений в молекуле фер
мента мы сконструировали мутантные варианты
Mt РPазы с модифицированными межсубъеди
ничными контактами в областях, которые отли
чают Mt РPазу от других прокариотических
РРаз. Мы определили влияние этих модифика
ций на каталитические свойства и взаимодей
ствие Mt РPазы с аналогом субстрата и тремя
потенциальными аллостерическими регулято
рами активности фермента в клетке. Получен
ная информацию о путях регуляции Mt РРазы
может быть использована для конструирования
специфических ингибиторов этого фермента.
МЕТОДЫ ИССЛЕДОВАНИЯ
Получение генетических конструкций. Генети
ческая конструкция Mt РРаза/pUC 19 для
экспрессии Mt PPазы дикого типа без дополни
Рис. 1. Пространственные структуры гексамерных Mt
тельных вставок была получена нами ранее [11].
PPазы и Ec РРазы (коды PDB: 4Z71 и 1OBW соответствен
Мутацию Arg14Gln вводили двустадийной ПЦР
но) [8, 9]. а - Два вида на Mt PPазу - вдоль оси третьего
порядка (слева) и перпендикулярно ей (справа). Субъеди
с использованием праймеров №1 (прямого) и
ницы верхнего тримера окрашены в разные цвета, нижний
№2 (обратного) («Евроген», Россия). Последо
тример не окрашен. N концевые остатки каждой цепи ука
вательности праймеров приведены в табл. 1. По
заны соответствующим цветом. Заменяемый остаток Arg14
лученный фрагмент вырезали эндонуклеазами
приведен в виде шаростержневых моделей во всех субъеди
рестрикции («Thermo Fisher Scientific», США)
ницах окрашенного тримера. Ионы магния, локализован
ные в активном центре, показаны в виде черных сфер.
по сайтам NdeI и BglII и лигировали в линеари
б - Вид вдоль оси третьего порядка на молекулу Ec РРазы.
зованный вектор pET 42a для экспрессии
Субъединицы верхнего тримера окрашены в разные цвета,
(«Thermo Fisher Scientific», США).
нижний тример не окрашен. Остатки 1-12, отсутствующие
Для присоединения фрагмента 1-12 Ec
в Mt PPазе, показаны более насыщенным цветом в субъе
PPaзы (SLLNVPAGKDLP) к N концу Mt PPазы
диницах верхнего тримера. Рисунок создан с помощью
программы UCSF Chimera (UCSF Resource for Biocomput
использовали описанные ранее плазмиды Mt
ing, Visualization, and Informatics, США) [10].
РРаза/pET 28a и NdeI Ec РРаза/pUC 18 [11].
С цветным вариантом рисунка можно ознакомиться в элек
Вторая плазмида содержит ген пирофосфатазы
из E. coli и сайт рестрикции эндонуклеазой NdeI
journal/biokhsm/
на 5′ конце. В качестве праймеров на разных
стадиях использовали три олигонуклеотида: №3
спективных мишеней для лечения туберкулеза
(кодирует аминокислотные остатки 9-13 Ec
животных и человека [5]. Кроме того, гибрид
РРазы и 1-5 Mt РРазы), №4 (M13/pUC - «об
ные наноматериалы на основе иммобилизован
ратный» праймер) и №5 (для введения сайта
ной Mt PPазы в качестве активного агента перс
пективны для лечения пирофосфатной артропа
Таблица 1. Последовательности праймеров, использован
тии человека [6]. Фермент представляет собой
ных для оценки количества импортированных ДНК
гексамер, образованный как димер тримеров
субстратов
(рис. 1, а). К структурным особенностям этого
Название
5'-3' последовательность праймеров
фермента относится отсутствие 12 аминокислот
праймера
ных остатков на N конце полипептидной цепи
по сравнению с РРазой Escherichia coli (Ec РРа
1
CCAAGGGCCAGCAGAACAAATACGAG
зы) (рис. 1, б) и многих других представителей
2
CTCGTATTTGTTCTGCTGGCCCCTTGG
прокариотических РPаз и, как следствие, изме
3
ATGGTCACGTCGAATTGTTCCGGCAGATCTTTA
ненные межсубъединичные контакты. Кроме
того, в активном центре Mt PPазы присутствуют
4
GTTTTCCCAGTCACGAC
два остатка гистидина (в положениях 21 и 86)
5
GAGGAGAATTCGCGTTATCAG
вместо обычных остатков аланина и лизина [7].
БИОХИМИЯ том 85 вып. 3 2020
6*
380
РОМАНОВ и др.
рестрикции EcoRI на 3′ конец гена Mt РРазы).
кислота («СигмаТек», Россия), поливиниловый
Последовательности праймеров приведены в
спирт («ЛенРеактив», Россия), вода деионизо
табл. 1. Первую полимеразную цепную реакцию
ванная, через 15 с добавляли водный раствор
проводили с праймерами №3 и №4 и плазмидой
цитрата натрия («Sigma Aldrich», США) и изме
NdeI Eс РРаза/pUC 18 (получена нами ранее).
ряли светопоглощение при 590 нм с использова
Полученный фрагмент использовали с прайме
нием планшетного спектрофотометра Victor x5
рами №4 и №5 во второй полимеразной цепной
(«Perkin Elmer», США).
реакции с плазмидой Mt РРаза/pET 28a (полу
Определение зависимости стабильности Mt=
чена нами ранее). Полученный фрагмент ДНК
РРазы от рН и температуры. Раствор фермента
гидролизовали рестриктазами NdeI и EcoRI и
(0,1 мг/мл) в буфере с рН в диапазоне 2,6-11,
лигировали в плазмиду pET23a.
содержавшем 5 мМ Mg2+, инкубировали в тече
Получение и очистка белков. Вышеописанные
ние суток при 4 °C, после чего измеряли оста
генетические конструкции были экспрессирова
точную активность, как описано выше. В каче
ны в клетках E. coli BL21(DE3), и рекомбинант
стве буферов для различных диапазонов pH ис
ные белки были выделены с помощью гидро
пользовали 50 мМ лимонную кислоту/50 мМ
фобной хроматографии, как описано ранее для
цитрат натрия (pH 2,6-4,6); 50 мМ MES (pH
Mt РРазы дикого типа [11]. Выход белков соста
5,6-6,6); 50 мМ Tris HCl (pH 7,5-8,6); 50 мМ
вил 20-30 мг/литр культуры. Чистота фермен
CAPSO (pH 9,6) и CAPS 50 мМ (pH 10,6-11).
тов, определенная методом гель электрофореза
Для характеристики термостойкости PPазу
по Лэммли [12], составила 99%. Масс спектро
(0,1 мг/мл) инкубировали 10 мин при 25-75 °C в
метрическую идентификацию белков проводили
50 мМ Tris HCl, pH 7,5 (измерено при 25 °C), со
с использованием масс спектрометра типа
державшем 5 мМ Mg2+, и затем измеряли оста
MALDI TOF/TOF («Bruker Daltonics», США).
точную активность.
Полученные препараты хранили при 4 °C в
Аналитическое ультрацентрифугирование. Для
виде суспензий в растворе сульфата аммония
седиментационного анализа использовали ана
(90% насыщения). Непосредственно перед ис
литическую ультрацентрифугу Spinco E
пользованием ферменты растворяли в 50 мМ бу
(«Beckman», СШA) со сканированием при
фере Tris HCl, pH 7,5, содержавшем 5 мМ MgCl2,
280 нм при скорости вращения 48000 об./мин.
и отделяли сульфат аммония гель фильтрацией
Перед седиментацией образцы, содержавшие
на колонке с Sephadex G 50 («GE Healthcare»,
фермент, 50 мM Tris HCl, pH 7,5 и 5 мM MgCl2,
США). Концентрацию белков определяли
преинкубировали ночь при 4 °C.
спектрофотометрически, используя следующие
Математическая обработка результатов и мо=
величины А0,1%, рассчитанные из аминокислот
делирование структуры. Кривые ингибирования
ного состава с помощью программы ProtParam:
ионами фтора и кальция, а также влияние мети
для Mt PPазы дикого типа и R14Q Mt PPазы -
ленбисфосфоната (РСР) описывали простой ги
1,04; для Ec Mt PPазы - 0,98. Теоретическая мо
перболической функцией. Для описания коло
лекулярная масса субъединицы, рассчитанная с
колообразной зависимости активности Mt РРазы
помощью программы ProtParam, составила: для
от концентрации модулирующего соединения
Mt PPазы дикого типа и R14Q Mt PPазы -
использовали схему.
18,3 кДа, для Ec Mt PPазы - 19,5 кДа.
Определение скорости гидролиза пирофосфа=
та. Каталитическую активность PPазы опреде
Ka
Ki
ляли по скорости образования продукта (фос
фата) по описанной ранее методике, основан
ной на реакции фосфомолибдатного комплекса
с малахитовым зеленым и цитратом натрия [13].
К 25 мкл 50 мМ буфера Tris HCl, pH 7,5, содер
Схема. Активация и ингибирование активности РРазы
жавшего, если не указано иначе, 5 мМ Mg2+ и
при последовательном связывании ионов модулятора.
M - модулятор (ион магния, РСР или аллостерический
50 мкМ комплекс MgPPi (общая концентрация
эффектор), Ka и Ki - кажущиеся константы диссоциации
PPi - 74,5 мкМ), добавляли 0,5-1,5 мкл раство
комплекса фермента с активирующим и ингибирующим
ра PPазы (конечная концентрация белка
ионом модулятора соответственно, А0 - активность в от
0,2-0,4 мкг/мл) и инкубировали смесь при
сутствие модулятора, β и i - коэффициенты активации и
20 °C. Через фиксированные промежутки вре
ингибирования соответственно. Для модуляции ионами
магния β = ∞, i = 0, поскольку активность в отсутствие
мени в интервале 15-60 с реакцию останавлива
Mg2+ и при его бесконечной концентрации равна нулю.
ли добавлением окрашивающего раствора: ма
Параметры в скобках под формами фермента обозначают
лахитовый зеленый («Sigma Aldrich», США), мо
их активности. Максимальная активность соответствует
либдат аммония («Реахим», Россия), соляная
комплексу ЕМ
БИОХИМИЯ том 85 вып. 3 2020
АЛЛОСТЕРИЧЕСКАЯ РЕГУЛЯЦИЯ ПИРОФОСФАТАЗЫ ИЗ Mycobacterium tuberculosis
381
Определение скорости для схемы представ
РРазу, в котором полипептидная цепь Mt РPазы
лено уравнением (1), в котором А - измеряемая
продолжена на N конце остатками 1-12 Ес
активность, h — эмпирический коэффициент
РРазы. Методом гомологического моделирова
(аналог коэффициента Хилла). Величина h
ния было показано, что добавленный фрагмент
меньше или равна числу ионов модулятора, свя
может занимать то же положение, что и в Ес
зывание которых вызывает ингибирование и
РРазе (рис. 1, б), и затруднять связывание аллос
может иметь нецелые значения.
терических эффекторов в полости внутритри
мерного интерфейса.
A = A0(1 + β[M]/Ka + i[M]h+ 1/KaKih)/
Остаток Arg14 экспонирован в межтример
ную полость Mt PPазы (рис. 1, а) и входит в по
/(1 + [M]/Ka + [M]h+ 1/KaKih).
(1)
ложительно заряженный кластер Lys11 Arg14
Arg101, образованный остатками трех субъеди
Для описания колоколообразной рН зави
ниц. Сеть контактов Arg14 различной природы
симости стабильности РРазы использовали
удерживает петлю Tyr31-Met36, участвующую в
уравнение (2), которое предполагает наличие
формировании межтримерного контакта. В Ec
основных и кислотных групп с pKa1 и pKa2 в ко
PPазе расположенный в другом участке субъе
личестве m и n соответственно:
диницы аналогичный кластер остатков Lys112,
Lys115 и Lys146 представляет собой аллостери
А = Аmax/[1 + 10m(pKa1 - pH) + 10n(pH - pKa2)].
(2)
ческий центр, связывающий активатор ATP и
ингибитор фруктозо 1 фосфат [15, 16].
Для определения температуры полуинакти
Получение и характеристика мутантных форм
вации РРазы (T1/2) из зависимости активности
Mt=PPазы. Две мутантные формы Mt PPазы,
от температуры (T) преинкубации использовали
R14Q Mt PPаза и Ec Mt PPаза, были продуци
уравнение (3), где a - эмпирический коэффи
рованы в E. сoli. Идентичность белков была
циент.
подтверждена методом MALDI масс спектро
метрии по массам полноразмерных белков и на
А = Аmax/[1 + (T/T1/2)a].
(3)
борам пептидов после гидролиза белков трипси
ном (данные не приведены).
Для аппроксимации данных методом нели
Четвертичная структура трех форм Mt РРазы
нейной регрессии использовали программу
была определена методом скоростной седимен
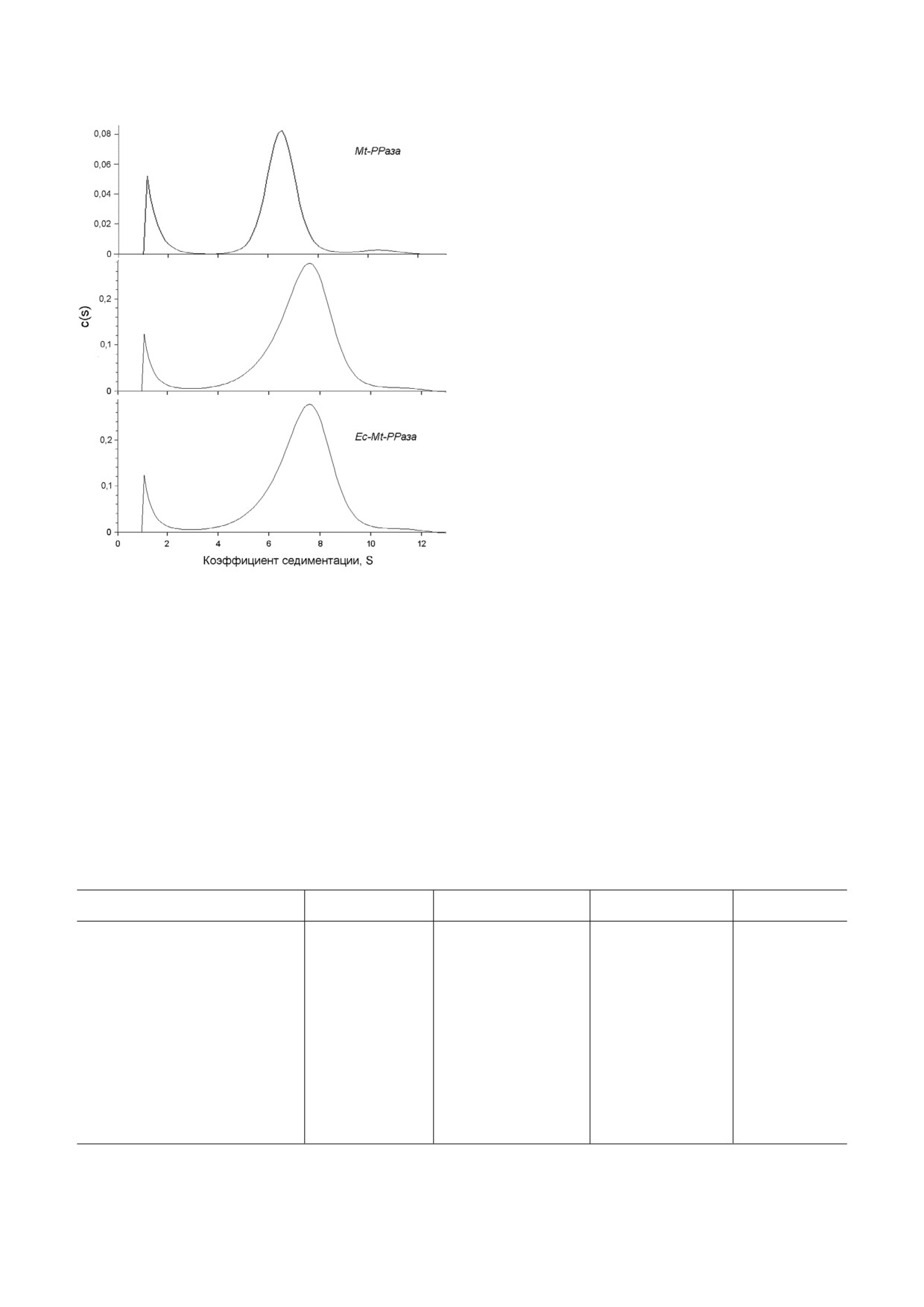
SigmaPlot («Systat Software Inc», США). Коэф
тации (рис. 2). Во всех случаях основная масса
фициент седиментации (s20,w) рассчитывали из
белка представляла собой гексамерный белок
профиля седиментации с помощью программы
(табл. 2). Во всех препаратах присутствовало
SedFit
[14]. Гомологическое моделирование
также малое количество более тяжелой формы
проводили с помощью программы SWISS
(предположительно додекамера).
MODEL со стандартными значениями парамет
Для мутантных форм Mt РРазы были опре
ров и структурой Ec PPазы (PDB ID 1OBW) в
делены каталитические параметры гидролиза
качестве шаблона.
MgPPi, максимальная активность и Km, констан
ты диссоциации комплексов с металлом кофак
тором Mg2+ и ингибиторами Ca2+ и F-, а также
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
параметры рН и термостабильности гексамера
(табл. 3). Параметр Ka (Mg2+) в табл. 3 относится
Выбор направлений мутагенеза. Mt PPаза от
к одному из двух ионов Mg2+, которые активиру
личается от Ес РРазы и большинства других
ют фермент. Второй активирующий ион Mg2+
РРаз семейства I отсутствием N концевого
связывается гораздо прочнее, и поэтому не про
фрагмента из 12 а.о. [7]. В Ес РРазе в этот фраг
мент (SLLNVPAGKDLP) входят несколько ос
Таблица 2. Коэффициенты седиментации (s20,w) и предпо
татков, формирующих водородные связи и гид
лагаемая олигомерная организация пирофосфатаз
рофобные контакты между различными субъе
Фермент
s20,w, S
Олигомерная форма
диницами внутри тримера (Ser1 Ser36, Leu2
Ala38) [11]. Вследствие отсутствия указанного
Mt РРаза
6,6
гексамер
фрагмента в Mt PPазе открыта полость во внут
ритримерном интерфейсе, в которой могут свя
R14Q Mt РРаза
7,4
гексамер
зываться низкомолекулярные лиганды - потен
Ec Mt PPаза
7,8
гексамер
циальные аллостерические эффекторы.
Для проверки этого предположения было ре
Ec РРаза [17]
6,0
гексамер
шено сконструировать химерный белок Ec Mt
БИОХИМИЯ том 85 вып. 3 2020
382
РОМАНОВ и др.
снижала термостойкость. Действие ингибиторов,
ионов фтора и кальция, в большинстве случаев
изменилось мало, кроме увеличения чувстви
тельности химерного белка к ионам кальция.
Активация и ингибирование Mt=PPазы анало=
гом субстрата. Для РРаз семейства I характерно
наличие аллостерических центров связывания
эффекторов в зонах контакта субъединиц, кото
рые структурно обособлены от активного цент
R14Q Mt РРаза
ра [3]. Некоторые аналоги пирофосфата могут
связываться как в активном центре, так и в ал
лостерических регуляторных центрах. Так, на
пример в Ес РРазе аллостерический регулятор
АТР может гидролизоваться в активном центре
[15]. Свободная форма пирофосфата, связыва
ясь в аллостерическом центре, активирует Ес
РРазу [19, 22]. Чтобы проверить наличие аллос
терических центров связывания в Mt РРазе и их
взаимосвязь с областями олигомерных контак
тов, мы исследовали влияние негидролизуемого
аналога пирофосфата, PCP, на активность Mt
PPазы и ее мутантных вариантов Ec Mt РРазы и
R14Q Mt РРазы с заменами в области контакта
субъединиц.
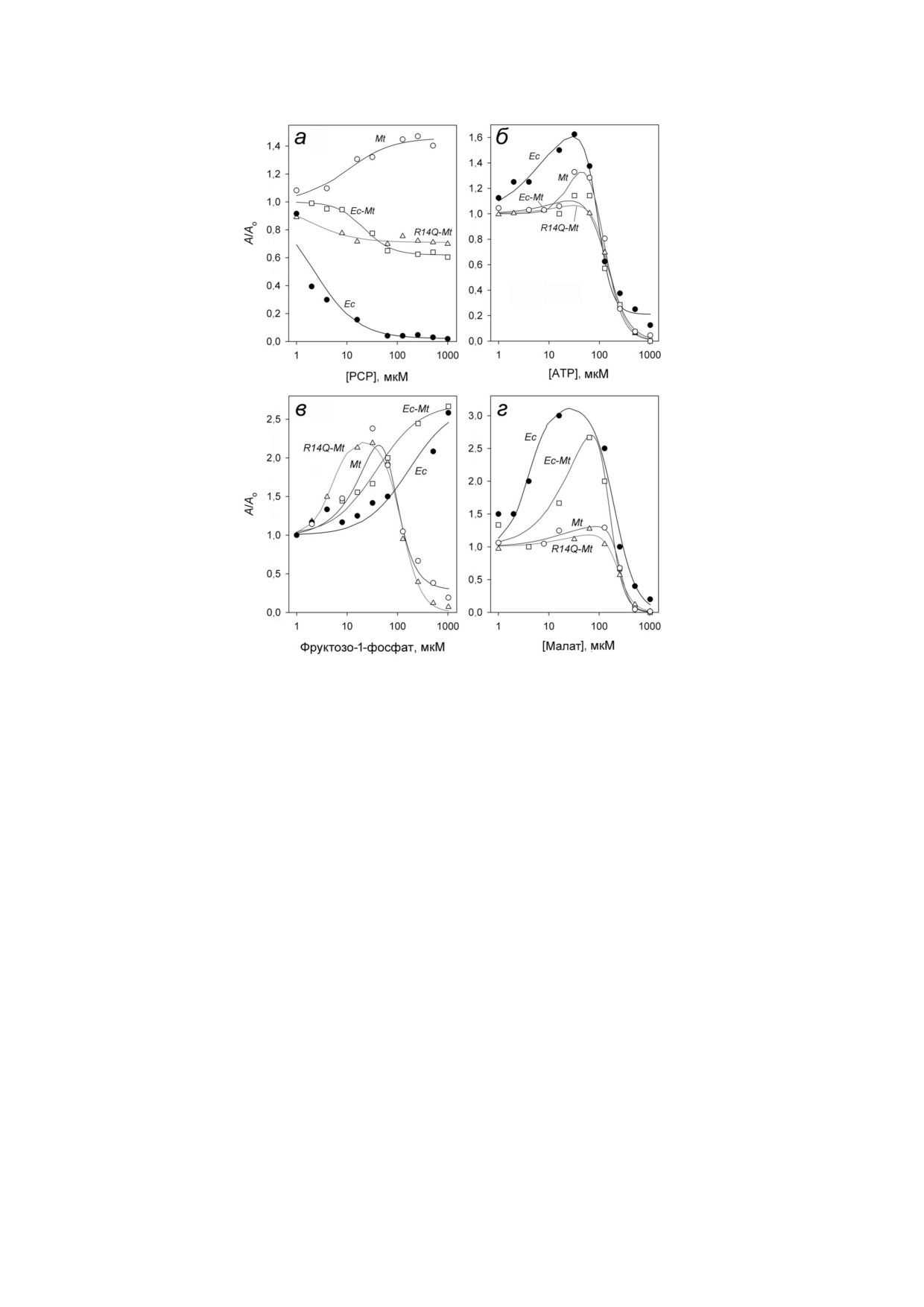
Полученные данные (рис. 3, а) показывают
Рис. 2. Распределение величин коэффициента седимента
резкое различие в поведении Mt PPaзы и Ec
ции для трех форм Mt РРазы при 20 °С. Концентрация
PPaзы. Если Ec PPаза ингибировалась под
белка во всех экспериментах - 0,6 мг/мл
действием РСР почти полностью, то Mt PPaза
активировалась этим аналогом пирофосфата.
является в использованном диапазоне концен
Мутантные формы Mt PPaзы, в отличие от на
траций Mg2+. Как следует из полученных данных,
тивного фермента, ингибировались под
мутации значительно «улучшали» каталитичес
действием РСР, но снижение активности соста
кие характеристики Mt PPазы - увеличивали
вило не более 40%.
максимальную активность (каталитическую
Полученные зависимости были описаны уп
константу) и уменьшали Km, приближая ее по
рощенной схемой, предполагающей связывание
этим параметрам к Ес РРазе. Кроме того, мута
только активирующей или ингибирующей мо
ции снимали ингибирующий эффект металла
лекул РСР. Полученные в рамках этой схемы па
кофактора (Mg2+) при его высоких концентраци
раметры (табл. 4) показывают, что сродство Mt
ях. С другой стороны, мутации снижали сродство
PPaзы дикого типа к РСР на порядок ниже, чем
к активирующему иону Mg2+, а мутация R14Q
у Ec PPaзы. У химерного белка, Ec Mt РРазы,
Таблица 3. Каталитические свойства вариантов Mt PPазы в сравнении с Ес РРазой
Параметр
Mt PPаза
R14Q Mt PPаза
Ec Mt PPаза
Ec РPаза
Максимальная активность, МЕ/мг
295 ± 7
646 ± 13
505 ± 10
754 ± 13 [7]
Km, мкM
6,0 ± 0,5
2,6 ± 0,3
2,9 ± 0,1
3,2 ± 0,3 [7]
Ka (Mg2+), мкM
140 ± 40
600 ± 30
360 ± 20
200 ± 40 [18]
Ki (Mg2+), мM
36 ± 4
16 ± 2 [19]
Ki (F-), мкM
660 ± 30
710 ± 40
500 ± 30
36 ± 0,2 [20]
Ki (Ca2+), мкM
310 ± 30
400 ± 22
160 ± 10
10 ± 1 [21]
Т1/2 инактивации, °C
60 ± 2
40 ± 1
57 ± 2
70 ± 3
pKa1 (pH стабильность)
5,4 ± 0,2
4,5 ± 0,3
5,4 ± 0,02
6 ± 0,2 [7]
m
4,3 ± 1,5
4 ± 0,5
2,5 ± 0,2
6 [7]
pKa2 (pH стабильность)
9,8 ± 0,2
8,7 ± 0,3
8,04 ± 0,06
> 8,5 [7]
n
4,3 ± 1,5
4 ± 0,5
2,5 ± 0,2
6 [7]
БИОХИМИЯ том 85 вып. 3 2020
АЛЛОСТЕРИЧЕСКАЯ РЕГУЛЯЦИЯ ПИРОФОСФАТАЗЫ ИЗ Mycobacterium tuberculosis
383
Рис. 3. Влияние РСР (а), ATP (б), фруктозо 1 фосфата (в) и L малата (г) на активности Ec PPазы и трех форм Mt PPазы.
Обозначения: Mt - Mt PPаза, R14Q Mt - Mt PPаза с заменой R14Q, Еc Mt - Mt PPаза, соединенная с фрагментом Ес
РРазы, Ec - Ес РРаза. Линиями показана наилучшая аппроксимация уравнением (1)
сродство к РСР практически не изменилось, в
(рис. 3, в). Рассчитанные в рамках схемы пара
то время как у варианта R14Q Mt РРазы оно
метры активации и ингибирования приведены в
возросло на порядок.
табл. 4. Как видно, значения Ka для разных форм
Активация и ингибирование Mt=PPазы мета=
Mt PPазы и разных модуляторов в большинстве
болитами. Влияние на активность Mt PPазы бы
случаев различаются не сильно. Резкое падение
ло измерено также для ATP, фруктозо 1 фосфа
активности при высоких концентрациях ATP и
та и L малата. Выбор этих соединений объясня
L малата указывает на то, что этот эффект об
ется тем, что ATP и фруктозо 1 фосфат влияют
условлен кооперативным связыванием несколь
на активность Ec PPазы [15, 16], а связанный
ких молекул ингибитора. Величина h равна при
L малат был обнаружен в кристаллической
мерно двум для ATP и трем - для L малата. В
структуре PPазы из Bartonella henselae (PDB ID
большинстве остальных случаев она не отлича
3SW5). Все три соединения в малых концентра
ется достоверно от единицы.
циях активировали, а в больших - ингибирова
ли Mt PPазу (рис. 3, б-г). Влияние ATP и L ма
лата было качественно похожим для всех иссле
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
дованных белков, тогда как для фруктозо 1
фосфата отсутствовал эффект ингибирования в
Использованные в данной работе мутации
случае Ec PPазы и Ec Mt РРазы. По профилю
так или иначе затрагивают олигомерные кон
изменения активности под действием фрукто
такты в гексамерной Mt РPазе, что позволяет
зо 1 фосфата и L малата химерная Ec Mt РРаза
объяснить большинство наблюдаемых эффек
больше походит на Ес РРазу, чем на Mt РРазу, в
тов. Повышенная активность мутантных форм
то время как вариант R14Q Mt РРазы практи
может означать, что образование олигомерных
чески не отличается от Mt РРазы дикого типа
контактов в гексамере природной Mt РРазы по
БИОХИМИЯ том 85 вып. 3 2020
384
РОМАНОВ и др.
Таблица 4. Параметры схемы для взаимодействия Ec PPазы и трех форм Mt PPазы с PCP, ATP, фруктозо 1 фосфатом и
L малатом, полученные из рис. 3
Активация
Ингибирование
Фермент
h
β
Ka, мкМ
i
Ki, мкМ
Метиленбисфосфонат (РСР)
Mt PPаза
1,46 ± 0,05
11 ± 3
R14Q Mt PPаза
0,71 ± 0,01
1,9 ± 0,2
~1
Ec Mt PPаза
0,58 ± 0,02
22 ± 7
~1
Ec PPаза
<0,03
2,2 ± 0,6
~1
ATP
Mt PPаза
1,60 ± 0,2
30 ± 10
<0,03
120 ± 20
2,3 ± 0,3
R14Q Mt PPаза
1,19 ± 0,03
40 ± 10
<0,03
140 ± 40
2,2 ± 0,1
Ec Mt PPаза
1,25 ± 0,25
24 ± 3
<0,03
130 ± 10
1,9 ± 0,3
Ec PPаза
1,8 ± 0,1
7 ± 3
0,21 ± 0,05
90 ± 10
3 ± 1
Фруктозо"1"фосфат
Mt PPаза
≥4
≥60
0,3 ± 0,2
≤60
1,9 ± 0,7
R14Q Mt PPаза
3,3 ± 0,4
14 ± 6
<0,03
84 ± 14
1,9 ± 0,2
Ec Mt PPаза
2,5 ± 0,2
50 ± 10
Ec PPаза
2,5 ± 0,3
280 ± 180
L"Малат
Mt PPаза
1,4 ± 0,1
20 ± 10
<0,03
250 ± 10
4 ± 1
R14Q Mt PPаза
1,30 ± 0,05
30 ± 10
<0,03
240 ± 10
2,8 ± 0,1
Ec Mt PPаза
4 ± 1
40 ± 10
<0,03
141 ± 12
3 ± 0,7
Ec PPаза
3,2 ± 0,3
4 ± 1
<0,03
230 ± 10
2 ± 0,5
давляет ее потенциальную активность, т.е. вы
Активация Mt РPазы негидролизуемым ана
зывает своего рода «внутреннее ингибирование»
логом субстрата, РСР, может означать, что он свя
(«самоингибирование»). Поэтому нарушение
зывается не в активном центре. Положительная
олигомерных контактов произведенными
гетеротропная кооперативность действия актив
структурными изменениями снимает внутрен
ных центров представляется менее вероятным
нее ингибирование и в определенном смысле
объяснением, поскольку субстрат взаимодей
восстанавливает каталитическую активность
ствует с активными центрами не кооперативно
белка, увеличивая каталитическую константу и
[7, 11]. Наши данные позволяют предположить,
уменьшая Km. При этом модификации зон кон
что сайт связывания активирующей молекулы
такта субъединиц не изменили олигомерное
РСР расположен в межсубъединичных интер
строение Mt РРазы, а лишь сделали структуру
фейсах либо связан через них с активным цент
молекулы белка менее компактной, о чем свиде
ром, поскольку обе мутации устраняют актива
тельствуют данные седиментационного анализа.
цию Mt РРазы под действием РСР. Наблюдаемое
Так, величины s20,w для мутантных форм в табл. 2
в мутантных формах частичное ингибирование
значимо выше, чем для фермента дикого типа,
также трудно объяснить, если считать, что РСР
даже при учете увеличенной на 8% массы Ec
связывается в активном центре. Более вероятно,
Mt РРазы. Кроме влияния на активность мута
что ингибирование возникает по мере заполне
ции уменьшили сродство фермента к ионам ме
ния аллостерических центров связывания.
талла кофактора и устранили ингибирование
В целом действие РСР на Mt РPазу имеет
его избытком. Следовательно, и действие ко
принципиально иной характер, чем его
фактора, который тоже связывается в активном
действие на Ec РPазу, которую он конкурентно
центре, может зависеть от контактов субъеди
ингибирует с Ki приблизительно равной Km [22].
ниц и компактности молекулы в целом.
Отсюда следует важный практический вывод о
БИОХИМИЯ том 85 вып. 3 2020
АЛЛОСТЕРИЧЕСКАЯ РЕГУЛЯЦИЯ ПИРОФОСФАТАЗЫ ИЗ Mycobacterium tuberculosis
385
неперспективности конструирования селектив
щие, и ингибирующие лиганды связываются в
ных ингибиторов Mt РPазы с помощью рацио
одном и том же аллостерическом центре, распо
нального дизайна на основе аналогов субстрата.
ложенном в межсубъединичном интерфейсе
ATP, фруктозо 1 фосфат и L малат являются
каждой субъединицы. Заполнение этого центра
важными для всех организмов метаболитами, по
в одной субъединице вызывает активацию фер
этому их влияние на активность Mt РРазы, на
мента, а его заполнение в других субъединицах
блюдаемое in vitro, может отражать их участие в
вызывает ингибирование, что предполагает взаи
регуляции PPаз in vivo. Константы диссоциации
мозависимость субъединиц.
комплексов фермента с этими эффекторами ле
Альтернативное объяснение предполагает
жат в диапазоне 10-300 мкМ, что позволяет ис
связывание эффекторов в двух или даже трех ал
пользовать их в качестве лидерных соединений
лостерических центрах на субъединицу, один из
для создания высокоаффинных ингибиторов.
которых активирующий, а другие - ингибирую
Действие ATP и L малата на Mt РPазу и Ec
щие. Если ингибирующий центр один на субъе
РPазу качественно похоже в том, что их низкие
диницу, то для объяснения кооперативности ин
концентрации вызывают активацию, которая пе
гибирования следует допустить взаимовлияние
реходит в ингибирование при высоких концен
ингибирующих центров разных субъединиц.
трациях (рис. 3, б, г). Это свидетельствует о нали
Поскольку полость в межтримерном интерфей
чии нескольких центров их связывания в белке.
се, вероятно, является активирующим центром,
Разнонаправленное действие на Mt РPазу ока
роль ингибирующего центра может выполнять
зывает и фруктозо 1 фосфат, тогда как Ec РPазу
полость, открытая в Mt РРазе из за отсутствия
он только активирует. Ингибирующее действие
N концевого фрагмента. В пользу этого говорит
фруктозо 1 фосфата на Mt РPазу устраняется
отсутствие ингибирования фруктозо 1 фосфа
после присоединения к ней N концевого фраг
том Ec Mt PPазы, в чем она похожа на Ес РРазу.
мента Ec РPазы. Эта модификация Mt РPазы де
В случае двух ингибирующих центров они могут
лает ее похожей на Ес РPазу и по влиянию РСР.
быть независимыми. При этом один из ингиби
В совокупности полученные данные свиде
рующих центров может быть активным центром
тельствуют о наличии в Mt РPазе не менее од
фермента. Возможность связывания в нем ATP
ного, а возможно, двух или трех аллостеричес
следует из наличия ATP азной активности у Mt
ких центров связывания эффекторов. Актива
РРазы [11]. Экспериментально обоснованный
ция всеми лигандами, а также неполное ингиби
выбор между всеми этими возможностями явля
рование под действием РСР не могут быть след
ется целью наших дальнейших исследований.
ствием их связывания в активном центре. Соот
ветствующий аллостерический центр (условно
названный «активирующим») может быть рас
Благодарности. Мы благодарим П. В. Калмы
положен в зоне межтримерных контактов субъ
кова и Н. Н. Магретову за проведение скорост
единиц. Это следует из данных рентгенострук
ной седиментации, Н. Н. Воробьеву за предо
турного анализа других гексамерных РРаз, в ко
ставленные образцы Ec PPазы и М. В. Серебря
торых были обнаружены связанные L малат и
кову за проведение масс спектрометрического
фосфат только в этой зоне (PDB ID 3SW5 и
анализа белков. MALDI масс спектрометр был
3FQ3 соответственно), что означает, что соответ
доступен в рамках Программы развития МГУ.
ствующий центр имеет наибольшее сродство к
Конфликт интересов. Авторы заявляют об от
этим лигандам. Сродство «ингибирующего»
сутствии конфликта интересов.
центра к ATP, фруктозо 1 фосфату и L малату
Соблюдение этических норм. Настоящая
значительно меньше, но связывание с ним ха
статья не содержит каких либо результатов, по
рактеризуется высокой кооперативностью. На
лученных с участием людей или животных, ис
блюдаемые закономерности можно объяснить в
пользованных в качестве объектов исследова
рамках модели, согласно которой и активирую
ний.
СПИСОК ЛИТЕРАТУРЫ
1.
Baykov, A.A., Cooperman, B.S., Goldman, A., and Lahti, R.
4.
Heikinheimo, P., Tuominen, V., Ahonen, A. K.,
(1999) Cytoplasmic inorganic pyrophosphatase, in Inorganic
Teplyakov, A., Cooperman, B., Baykov, A., Lahti, R., and
Polyphosphates, Springer, pp. 127-150.
Goldman, A. (2001) Toward a quantum mechanical
2.
Cooperman, B.S., Baykov, A.A., and Lahti, R. (1992)
description of metal assisted phosphoryl transfer in
Evolutionary conservation of the active site of soluble inor
pyrophosphatase, Proc. Natl. Acad. Sci. USA,
98,
ganic pyrophosphatase, Trends Biochem. Sci., 17, 262-266.
3121-3126.
3.
Самыгина В.Р. (2016) Неорганические пирофосфата
5.
Vijayan, M. (2005) Structural biology of mycobacterial
зы: структурная вариативность на службе функции,
proteins: the Bangalore effort, Tuberculosis (Edinb), 85,
Успехи химии, 85, 464-476.
357-366.
БИОХИМИЯ том 85 вып. 3 2020
386
РОМАНОВ и др.
6.
Rodina, E.V., Valueva, A.V., Yakovlev, R.Y., Vorobyeva, N.N.,
15. Rodina, E.V., Vorobyeva, N.N., Kurilova, S.A., Sitnik, T.S.,
Kulakova, I.I., Lisichkin, G.V., and Leonidov, N.B. (2015)
and Nazarova, T.I. (2007) ATP as effector of inorganic
Immobilization of inorganic pyrophosphatase on nanodia
pyrophosphatase of Escherichia coli. The role of residue
mond particles retaining its high enzymatic activity,
Lys112 in binding effectors, Biochemistry (Moscow), 72,
Biointerphases, 10, 041005.
100-108.
7.
Tammenkoski, M., Benini, S., Magretova, N.N., Baykov, A.A.,
16. Vorobyeva, N.N., Kurilova, S.A., Anashkin, V.A., and
and Lahti, R. (2005) An unusual, His dependent family I
Rodina, E.V. (2017) Inhibition of Escherichia coli inorgan
pyrophosphatase from Mycobacterium tuberculosis, J. Biol.
ic pyrophosphatase by fructose 1 phosphate, Biochemistry
Chem., 280, 41819-41826.
(Moscow), 82, 953-956.
8.
Pratt, A.C., Dewage, S.W., Pang, A.H., Biswas, T.,
17. Вайнонен Ю.П., Курилова С.А., Аваева С.М. (2002)
Barnard Britson, S., Cisneros, G.A., and Tsodikov, O.V.
Гексамерная, тримерная, димерная и мономерная
(2015) Structural and computational dissection of the cat
формы неорганической пирофосфатазы Escherichia
alytic mechanism of the inorganic pyrophosphatase from
coli, Биоорганическая химия, 28, 426-433.
Mycobacterium tuberculosis, J. Struct. Biol., 192, 76-87.
18. Avaeva, S.M., Rodina, E.V., Kurilova, S.A., Nazarova, T.I.,
9.
Harutyunyan, E.H., Oganessyan, V.Y., Oganessyan, N.N.,
Vorobyeva, N.N., Harutyunyan, E.H., and Oganessyan, V.Y.
Avaeva, S.M., Nazarova, T.I., Vorobyeva, N.N., Kurilova, S.A.,
(1995) Mg2+ activation of Escherichia coli inorganic
Huber, R., and Mather, T. (1997) Crystal structure of holo inor
pyrophosphatase, FEBS Lett., 377, 44-46.
ganic pyrophosphatase from Escherichia coli at 1.9 Å resolution.
19. Sitnik, T., Vainonen, J., Rodina, E., Nazarova, T.,
Mechanism of hydrolysis, Biochemistry, 36, 7754-7760.
Kurilova, S., Vorobyeva, N., and Avaeva, S.
(2003)
10.
Pettersen, E.F., Goddard, T.D., Huang, C.C., Couch, G.S.,
Effectory site in Escherichia coli inorganic pyrophos
Greenblatt, D.M., Meng, E.C., and Ferrin, T.E. (2004)
phatase is revealed upon mutation at the intertrimeric
UCSF Chimera—a visualization system for exploratory
interface, IUBMB Life, 55, 37-41.
research and analysis, J. Comput. Chem., 25, 1605-1612.
20. Samygina, V.R., Moiseev, V.M., Rodina, E.V., Vorobyeva, N.N.,
11.
Rodina, E.V., Vainonen, L.P., Vorobyeva, N.N., Kurilova, S.A.,
Popov, A.N., Kurilova, S.A., Nazarova, T.I., Avaeva, S.M.,
Sitnik, T.S., and Nazarova, T.I. (2008) Metal cofactors play
and Bartunik, H.D. (2007) Reversible inhibition of
a dual role in Mycobacterium tuberculosis inorganic
Escherichia coli inorganic pyrophosphatase by fluoride:
pyrophosphatase, Biochemistry (Moscow), 73, 897-905.
trapped catalytic intermediates in cryo crystallographic
12.
Laemmli, U.K. (1970) Cleavage of structural proteins during
studies, J. Mol. Biol., 366, 1305-1317.
the assembly of the head of bacteriophage T4, Nature, 227, 680.
21. Avaeva, S.M., Vorobyeva, N.N., Kurilova, S.A., Nazarova, T.I.,
13.
Rowlands, M.G., Newbatt, Y.M., Prodromou, C., Pearl, L.H.,
Polyakov, K.M., Rodina, E.V., and Samygina, V.R. (2000)
Workman, P., and Aherne, W. (2004) High throughput
Mechanism of Ca2+ induced inhibition of Escherichia coli
screening assay for inhibitors of heat shock protein 90
inorganic pyrophosphatase, Biochemistry (Moscow), 65,
ATPase activity, Anal. Biochem., 327, 176-183.
373-387.
14.
Schuck, P., Gillis, R.B., Besong, T.M., Almutairi, F.,
22. Vainonen, J.P., Vorobyeva, N.N., Rodina, E.V., Nazarova, T.I.,
Adams, G.G., Rowe, A.J., and Harding, S.E. (2014) SEDFIT-
Kurilova, S.A., Skoblov, J.S., and Avaeva, S.M. (2005)
MSTAR: molecular weight and molecular weight distribu
Metal free PPi activates hydrolysis of MgPPi by an
tion analysis of polymers by sedimentation equilibrium in
Escherichia coli inorganic pyrophosphatase, Biochemistry
the ultracentrifuge, Analyst, 139, 79-92.
(Moscow), 70, 69-78.
INFLUENCE OF STRUCTURE VARIATIONS IN THE INTERSUBUNIT
CONTACTS ON ACTIVITY AND ALLOSTERIC REGULATION
OF INORGANIC PYROPHOSPHATASE FROM Mycobacterium tuberculosis*
R. S. Romanov1,2, S. A. Kurilova1,2, A. A. Baykov1,2, and E. V. Rodina1,2**
1 Lomonosov Moscow State University, Belozersky Institute of Physico"Chemical Biology,
119991 Moscow, Russia; E"mail rodina@belozersky.msu.ru
2 Lomonosov Moscow State University, Faculty of Chemistry, 119991 Moscow, Russia
Received December 26, 2019
Revised January 14, 2020
Accepted January 14, 2020
Hexameric inorganic pyrophosphatase from Mycobacterium tuberculosis (Mt PPase) has a number of structural and
functional features that distinguish it from homologues, widely distributed in all lifeforms. In particular, it has unusu
al zones of intersubunit contacts, and the N terminal region of its polypeptide chain is absent. In this work, we con
structed two mutant forms of the enzyme (Ec Mt PPase and R14Q Mt PPase). In the first mutant, the missing part
of the polypeptide chain is compensated by a fragment of PPase from Escherichia coli (Ec PPase). In the second
mutant, a single amino acid residue substitution was made in the contact interface of two trimers inside the hexamer.
Both modifications significantly improved the catalytic properties of the enzyme and eliminated its inhibition by
excess of the cofactor (Mg2+). Activation of Mt PPase by small (~10 μM) concentrations of ATP, fructose 1 phos
phate, L malate, and a nonhydrolyzable analogue of the substrate - methylene bisphosphonate (PCP) - was found.
At concentrations of 100 μM and above, the first three compounds acted as inhibitors. The activating effect of PCP
was absent in both mutant forms, and the inhibitory effect of fructose 1 phosphate was absent in Ec Mt PPase. The
effects of the other modulators varied among mutants only quantitatively. The data obtained indicate the presence of
allosteric centers in Mt PPase, which are located in the zones of intersubunit contacts or associated with them.
Keywords: pyrophosphatase, site directed mutagenesis, allosteric regulation, fructose 1 phosphate, L malate
БИОХИМИЯ том 85 вып. 3 2020