БИОХИМИЯ, 2020, том 85, вып. 3, с. 387 - 398
УДК 571.175.722
ИНТЕРЛЕЙКИН 4 ВОССТАНАВЛИВАЕТ ЧУВСТВИТЕЛЬНОСТЬ
К ИНСУЛИНУ В ИНСУЛИНОРЕЗИСТЕНТНЫХ ОСТЕОБЛАСТАХ,
ПОВЫШАЯ ЭКСПРЕССИЮ СУБСТРАТА РЕЦЕПТОРА ИНСУЛИНА 1
© 2020
Ж. Чао1, Д. Ли1, Ц. Юэ1, Ц. Хуан1, Ю. Коу1,
Ц. Чжоу1, Ю. Гао1, Т. Хасэгава2, Ц. Го1, М. Ли1*
1 Department of Bone Metabolism, School of Stomatology Shandong University,
Shandong Provincial Key Laboratory of Oral Tissue Regeneration,
Jinan 250012, China; E mail: liminqi@sdu.edu.cn
2 Department of Developmental Biology of Hard Tissue,
Graduate School of Dental Medicine, Hokkaido University,
Sapporo 060 8586, Japan
Поступила в редакцию 14.10.2019
После доработки 30.11.2019
Принята к публикации 31.12.2019
Ожирение и латентные воспалительные процессы могут привести к возникновению резистентности к ин
сулину и развитию диабета 2 го типа (T2D - type 2 diabetes). В настоящей работе для изучения механизма
восстановления чувствительности клеток к действию инсулина с помощью противовоспалительного интер
лейкина 4 (IL 4 - interleukin 4) была создана модель инсулиновой резистентности с использованием остео
бластов. Нами было показано, что IL 4 ингибирует пролиферацию клеток в зависимости от его концентра
ции и длительности воздействия. Устойчивость к действию инсулина в значительной степени понижала
уровни фосфорилирования белков, выступающих в качестве субстратов инсулинового рецептора, а именно
белков IRS1(Tyr612), Akt (Ser473) и AS160 (Ser318). Добавление IL 4 в модель инсулиновой резистентности
вызывало дозозависимую стимуляцию фосфорилирования белков IRS1, Akt и AS160. В концентрации
50 нг/мл IL 4 полностью восстанавливал процесс активации инсулинового каскада в резистентных к инсу
лину клетках. Кроме того, IL 4 способствовал повышению уровня экспрессии белка IRS1 в зависимости от
продолжительности воздействия. Мы предполагаем, что IL 4 восстанавливает чувствительность остеоблас
тов к действию инсулина путем повышения уровня экспрессии белка IRS1. Также нами было показано, что
IL 4 способствует экспрессии остеопротегерина (OPG) в зависимости от продолжительности экспонирова
ния. Этот эффект может играть важную роль в регуляции обмена энергии во всем организме.
КЛЮЧЕВЫЕ СЛОВА: ожирение, инсулиновая резистентность, интерлейкин 4, остеобласты.
DOI: 10.31857/S0320972520030094
Популярность системы быстрого питания
Эпидемиология воспалительных процессов при
(фастфуд) и продуктов быстрого приготовления
T2D, ассоциированных с ожирением, восходит
и отсутствие физической нагрузки превратили
к концу 50 х и 60 м годам прошлого столетия.
ожирение в глобальную проблему здравоохране
Еще в 1876 г. Ebstein [3] пришел к заключению,
ния. Ожирение увеличивает риск возникнове
что натриевая соль салициловой кислоты может
ния сердечно сосудистых заболеваний, скелет
привести к полной отмене симптомов диабета.
но мышечных нарушений и некоторых типов
Hotamisligil et al. [4] впервые показали, что про
рака. В частности, диабет 2 го типа (T2D - тype
воспалительный цитокин TNF α может инду
2 diabetes) тесным образом связан с ожирением
цировать устойчивость к действию инсулина.
[1]. Случаи возникновения T2D составляют
Резистентность к инсулину повышает уровень
~90-95% всех заболеваний диабетом, и для
сахара в крови, приводя к возникновению T2D,
больных диабетом 2 го типа в основном харак
при котором секреция инсулина не приводит к
терен фенотип инсулиновой резистентности [2].
компенсации инсулиновой резистентности, ас
социированной с ожирением. Несмотря на рас
Принятые сокращения: ALP - щелочная фосфатаза; тущую распространенность диабета во всем ми
IL 4 - интерлейкин 4; IR - инсулиновый рецептор; T2D -
ре механизм резистентности к инсулину в пато
диабет 2 го типа; IRS1 - субстрат инсулинового рецептора
1; OPG - остеопротегерин; OCN - остеокальцин; PA -
генезе T2D изучен плохо. Значительно позже
пальмитиновая кислота.
выхода работы Hotamisligil et al. другие исследо
* Адресат для корреспонденции.
ватели, изучающие роль воспалительных про
387
388
ЧАО и др.
цессов в патогенезе инсулиновой резистентнос
орган, регулирующий метаболизм глюкозы че
ти, Hundal et al. [5] и Shoelson et al. [6], пересмот
рез секрецию остеокальцина (OCN - osteocal
рели гипогликемическую функцию салицило
cin) и таким образом оказывающий влияние на
вой кислоты и подтвердили, что ее молекуляр
системное откладывание жира и уровень сахара
ной мишенью является каскад IkB киназа β
крови [10, 12, 13].
(IKKβ)/NF kB. Было показано, что высокие до
Поэтому в настоящей работе мы ставили
зы салициловой кислоты могут повысить
целью создать остеогенную модель инсулино
чувствительность к действию инсулина у боль
вой резистентности, изучить восстановление
ных с T2D, воздействуя на эту мишень.
чувствительности остеобластов к действию ин
Существование взаимных связей между вос
сулина с помощью IL 4 и выявить механизмы
палением и резистентностью к инсулину были
этого процесса. Нами также было изучено влия
продемонстрированы во многих клинических и
ние IL 4 на уровень экспрессии белков остео
экспериментальных исследованиях. Использо
протегерина (OPG) и OCN в остеобластах с раз
вание антагонистов рецепторов провоспали
личной степенью дифференцировки с целью
тельных цитокинов (анакинра, этанерцепт) или
разработки новых подходов для изучения влия
неспецифических противовоспалительных ле
ния IL 4 на системный обмен энергии in vivo.
карств (салициловая кислота) являются двумя
наиболее широко применяемыми терапевти
ческими противовоспалительными стратегия
МЕТОДЫ ИССЛЕДОВАНИЯ
ми. Другие способы активации противовоспа
лительных рецепторов, такие как использова
Реактивы и антитела. В работе использовали
ние природного противовоспалительного цито
следующие реактивы: IL 4, антитела против
кина интерлейкина 4 (IL 4), изучены в мень
beta актина («Proteintech», США); препарат ин
шей степени [7, 8]. Тем не менее Stafeev et al. [9]
сулина, антитела против белка Akt (ab32505),
обнаружили, что IL 4 восстанавливает чувстви
Akt с фосфорилированным остатком Ser473
тельность к действию инсулина резистентных к
(ab192623), антитела против белка AS160 с фос
инсулину адипоцитов через механизмы, кото
форилированным остатком Ser318 (ab189890),
рые не связаны с индуцированным адипогене
антитела против белка OPG (ab9986) и против
зом или образованием de novo липидных отло
белка OCN (ab93876) («Abcam», Великобрита
жений.
ния); пальмитиновая кислота (PA - рalmitic
Инсулин, секретируемый островковыми бе
acid) была приобретена у Xian Kunchuang. Набо
та клетками, в основном действует на белую
ры ALP, используемые для определения актив
жировую ткань (WAT - white adipose tissue) и
ности щелочной фосфатазы (ALP), были приоб
инсулиновые рецепторы (IR - insulin receptors)
ретены в Nanjing Jiancheng Bioengineering
мышечных клеток и способствует усвоению
Institute. Процедуру иммуноблоттинга проводи
глюкозы и, действуя в гепатоцитах, увеличивает
ли с использованием первичных антител против
синтез гликогена в печени. Инсулин играет
субстрата инсулинового рецептора 1 (IRS1) из
важную роль в поддержании гомеостаза глюко
CST (#3407); против белка IRS1 с фосфорили
зы во всем организме [10]. В то время как IR в
рованным остатком Tyr612 (GTX24868;
основном экспрессируется в клетках жировой
«GeneTex, Inc.», США); против белка AS160
ткани, миобластах и гепатоцитах, он также
(AF2317; Affinity).
экспрессируется в других клетках, таких как ос
Клетки. Клетки линии MG 63 остеосаркомы
теобласты и остеокласты. Avnet et al. [11] прове
человека были получены от Банка Клеток Ки
ли измерения уровня экспрессии IR и других
тайской Академии Наук (Шанхай, Китай).
рецепторов в образцах, полученных у больных
Клетки культивировали в культуральной среде
остеосаркомой. Полученные ими результаты
DMEM/F12 (Dulbecco’s Modified Eagle
указывали на то, что при остеосаркоме челове
Medium), дополненной 10% фетальной бычьей
ка изоформа А инсулинового рецептора
сыворотки («Gibco», США), 1% неэссенциаль
экспрессируется более интенсивно по сравне
ных аминокислот (NEAA - non essential amino
нию с рецептором инсулиноподобного фактора
acid) и 1% пенициллина стрептомицина при
роста I (IGFIR - Insulin like growth factor recep
стандартных условиях культивирования (37 °C,
tor). Свободные жирные кислоты могут вызы
95% увлажненная атмосфера и 5% CO2). Каж
вать инсулиновую резистентность остеоблас
дые 3 дня производили смену культуральной
тов, увеличивая степень убиквитинилирования
среды.
IR, тем самым приводя к возникновению мета
Дифференцировка остеогенных клеток. Клет
болических нарушений. Кроме того, костная
ки линии MG 63 рассевали при плотности
ткань может рассматриваться как эндокринный
~3000 клеток/см2 и выдерживали в инкубаторе
БИОХИМИЯ том 85 вып. 3 2020
МЕХАНИЗМ ВОЗДЕЙСТВИЯ IL 4 НА ЧУВСТВИТЕЛЬНОСТЬ К ИНСУЛИНУ
389
при 37°C в атмосфере 5% CO2. Через 48 ч стандарт
Обработка IL 4 и инсулином. IL 4 в низкой,
ную среду заменяли на среду, способствующую
стандартной и высокой концентрациях (10, 50 и
остеогенезу,
которая содержала среду
100 нг/мл соответственно) добавляли в индуци
DMEM/F12, 10% фетальной бычьей сыворотки
рованную липидом модель инсулиновой резис
(FCS), 50 мкг/мл 2P аскорбиновой кислоты,
тентности в течение 24 ч. Затем чтобы оценить
10 мМ β глицерофосфата натрия, 100 нМ декса
инсулин зависимую передачу сигнала, клетки
метазона, 1% неэссенциальных аминокислот и
обрабатывали 10 нМ инсулина (ab123768) в те
1% смеси пенициллина и стрептомицина. Каж
чение 20 мин. На основе полученных результа
дые 3 дня производили смену культуральной
тов была определена оптимальная концентра
среды.
ция IL 4 (50 нг/мл). IL 4 в концентрации
Окрашивание ализариновым красным и коли
50 нг/мл добавляли в среду дифференцировки
чественное определение активности ALP. Остео
на 0, 7 и 14 день, чтобы исследовать, восстанав
бласты линии MG 63 рассеивали в 6 луночные
ливает ли IL 4 временную зависимость чувстви
планшеты при плотности ~3000 клеток/см2. За
тельности к инсулину.
тем клетки обрабатывали реагентом, вызываю
Экстракция белков и вестерн блоттинг. Клет
щим их дифференцировку, и отбирали для про
ки четыре раза промывали в ледяном фосфат
ведения анализа через 0, 4, 7 и 14 дней. Для оп
ном буфере (PBS) и лизировали во льду в буфере
ределения минерализации остеобластов исполь
RIPA (Betotium Institute of Biotechnology, Пекин,
зовали окраску ализариновым красным. Актив
Китай), содержащем смесь ингибиторов протеаз
ность ALP измеряли с помощью набора для об
(«CoWin BioSciences», США) и смесь ингибито
наружения флуоресценции в соответствии с
ров фосфатаз («CoWin BioSciences», США) в со
протоколом производителя.
отношении 98 : 1 : 1. Полученные лизаты клеток
Анализ жизнеспособности клеток. Для опре
центрифугировали в течение
15
мин при
деления влияния различных концентраций IL 4
16 000 об./мин, и собранные супернатанты объ
на пролиферацию клеток MG 63 использовали
единяли. Концентрацию белка в белковых
метод определения выживаемости клеток. Клет
экстрактах определяли с использованием набо
ки инкубировали в 96 луночных планшетах в
ров для определения белка с BCA (Bicinchoninic
100 мкл культуральной среды в течение 24 ч при
acid, «Beyotime», Китай). Белки разделяли с по
плотности клеток 5 × 103 клеток/ячейка. Затем
мощью гель электрофореза в 6-12% м полиак
клетки обрабатывали различными концентра
риламидном геле в присутствии SDS (SDS
циями IL 4 (0; 0,1; 1; 10; 50 и 100 нг/мл, при трех
PAGE), и разделенные белки переносили из ге
повторах для каждого образца). Через 12, 24 и
ля на поливинилиденфлюоридные мембраны
48 ч определяли выживаемость клеток с исполь
(PVDF - polyvinylidene fluoride). Мембраны
зованием набора Cell Counting Kit 8 assay
подвергали фиксации в течение по крайней ме
(«MedChemExpress», Китай) и рассчитывали
ре 1 ч в 5% м обезжиренном молоке в TBS (Tris
значения для различных экспериментальных
buffered saline), содержащем 0,1% (v/v) Tween 20
групп.
(TBST). Затем мембраны инкубировали в тече
Индуцированная липидами модель инсулино
ние ночи при 4 °C с разведенными препаратами
вой резистентности. В модели богатого жирами
первых антител (1 : (500-3000)) и потом со вто
пищевого рациона в качестве классического
рыми антителами при комнатной температуре в
индуктора инсулиновой резистентности был
течение 1 ч. Наконец зону иммунной реакции
использован конъюгат пальмитиновой кислоты
измеряли, используя ECL систему детекции
и бычьего сывороточного альбумина (BSA -
(«Smart Chemi 420», Китай). Каждый экспери
bovine serum albumin). В предыдущих работах
мент повторяли не менее трех раз.
PA и клетки MG 63 уже использовали для соз
Статистическая обработка полученных ре
дания модели инсулиновой резистентности [9,
зультатов. Все полученные данные представле
14]. Зрелые остеобласты инкубировали в тече
ны в виде среднего значения ± стандартное от
ние 24 ч в не содержащей фетальную сыворотку
клонение. Статистический анализ был проведен
среде DMEM/F12 (1% неэссенциальных ами
с использованием программы Graghpad prism 7
нокислот, 1% пенициллин стрептомицин). За
software (Сан Диего, Калифорния, США). Раз
тем добавляли раствор PA до достижения низ
личия между экспериментальными и контроль
кого, стандартного и высокого значения ее
ными группами были оценены с использовани
концентрации (100, 200 и 500 мкМ PA соответ
ем t критерия Стьюдента. Различия между экс
ственно). Клетки культивировали в течение
периментальными группами были рассчитаны с
48 ч в той же среде и затем добавляли 10 нм ин
помощью метода двухфакторного дисперсион
сулина (ab123768) и инкубировали в течение
ного анализа вариаций (ANOVA). Значение p <
20 мин [13].
0,05 считали статистически достоверным.
БИОХИМИЯ том 85 вып. 3 2020
390
ЧАО и др.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
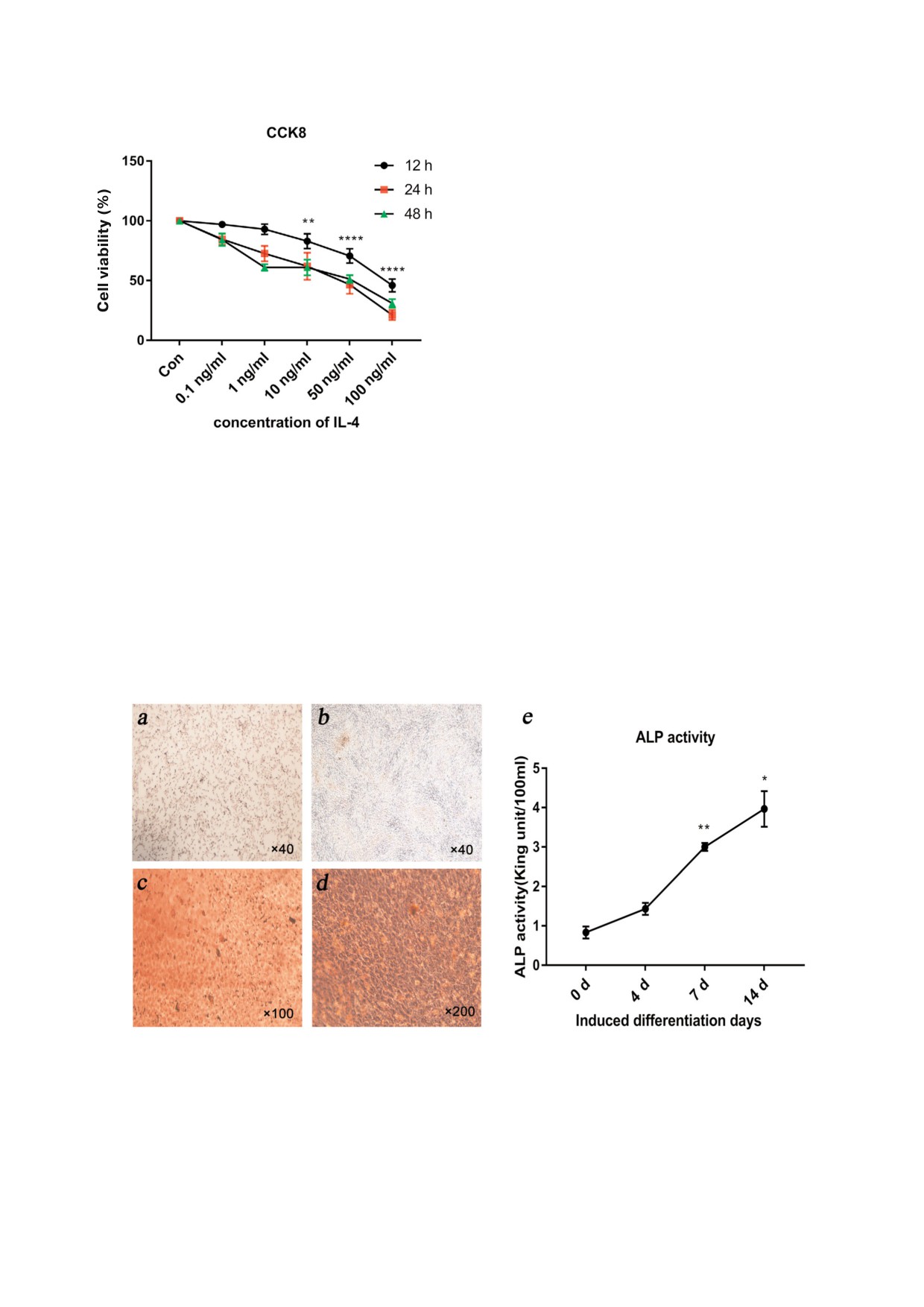
IL 4 ингибирует пролиферацию клеток MG 63
в зависимости от дозы и продолжительности
действия. Различные концентрации IL 4 оказы
вали действие на клетки MG 63 на протяжении
12, 24 и 48 ч соответственно и в различной сте
пени ингибировали пролиферацию клеток
(рис. 1). Более выраженный ингибирующий эф
фект наблюдали в случае более высоких концен
траций IL 4. Так, 100 нг/мл IL 4 в течение одно
го дня снижали выживаемость клеток на ~50%, в
то время как IL 4 в концентрации 0,1 нг/мл про
являл незначительный ингибирующий эффект.
Также было обнаружено, что ингибирование
усиливается с увеличением времени действия
цитокина. Например, ингибирующий эффект
различных концентраций IL 4, определяемый
через 24 ч и 48 ч, был значительно сильнее, чем
Рис. 1. Выживаемость клеток, определяемая с помощью
метода с использованием CCK8 (n = 3). Относительное
через 12 ч (1 нг/мл p < 0,01, p < 0,0001; 10 нг/мл
число клеток - это соотношение значений оптической
p < 0,01, p < 0,01; 50 нг/мл p < 0,001, p < 0,01;
плотности (OD), определенное при анализе эксперимен
100 нг/мл p < 0,001, недостоверный результат).
тальной и контрольной групп. Клетки MG 63 обрабатыва
При концентрации 1 нг/мл ингибирующий эф
ли указанной дозой IL 4 (0; 0,1; 1; 10; 50 и 100 нг/мл) в те
фект через 48 ч был сильнее, чем через 24 ч, хо
чение различного времени (12, 24 и 48 ч). Статистическую
обработку полученных данных проводили с использовани
тя подобное не наблюдали при концентрациях,
ем метода двухфакторного дисперсионного анализа вариа
равных 10, 50 и 100 нг/мл.
ций (ANOVA). (** p < 0,01, **** p < 0,0001, 12 часовые груп
Модель индукции остеогенеза была успешно
пы в сравнении с контрольной группой).
создана. На основании результатов окрашива
С цветным вариантом рис. 1 можно ознакомиться в элек
ния красителем ализариновым красным
journal/biokhsm/
(Alizarin Red S) было выяснено, что через 7 дней
Рис. 2. Окрашивание ализариновым красным и определение активности ALP. а - Окрашивание ализариновым красным
в самом начале индукции остеогенеза (0 дней). b - Окрашивание образцов ализариновым красным через 7 дней после на
чала остеогенной индукции. c и d - Окрашивание образцов ализариновым красным через 7 дней после начала индукции,
наблюдаемое при световой микроскопии при различном увеличении. e - Определение активности ALP в клетках после
различной продолжительности индукции. (* p < 0,05, ** p < 0,01 в сравнении с контрольной группой).
biokhsm/
БИОХИМИЯ том 85 вып. 3 2020
МЕХАНИЗМ ВОЗДЕЙСТВИЯ IL 4 НА ЧУВСТВИТЕЛЬНОСТЬ К ИНСУЛИНУ
391
после индукции процесса минерализации клет
чительно повышена на 7 й день после индукции
ки MG 63 были частично окрашены в красный
дифференцировки (p < 0,01), и это повышение
цвет и частично темный с небольшим числом
было выражено еще в большей степени на 14 й
минерализованных узелков. Через 14 дней после
день процесса дифференцировки (p < 0,05)
индукции процесса минерализации наблюдали
(рис. 2, e). С увеличением продолжительности
обширное окрашивание в красный цвет, и ло
индукции количество остеобластов, окрашен
кальные пятна были сильно окрашены. При
ных ализариновым красным, количество каль
этом плотность минерализованных узелков бы
циевых узелков и активность ALP также повы
ла значительно выше, чем у образцов, подверг
шались. Таким образом, модель индукции остео
шихся индукции в течение 7 дней (рис. 2, a-d).
генеза оказалась успешной.
Результаты определения активности щелоч
IL 4 полностью восстанавливает процесс ак
ной фосфатазы продемонстрировали ту же тен
тивации инсулинового каскада в клетках резис
денцию, что и результаты окрашивания ализа
тентных к инсулин. Инсулиновая резистент
риновым красным. При этом не было выявлено
ность характеризуется инсулин стимулируе
статистически значимого повышения активнос
мым фосфорилированием остатка серина в
ти ALP на 4 й день. Активность ALP была зна
IRS1 и нарушением инсулин зависимой пере
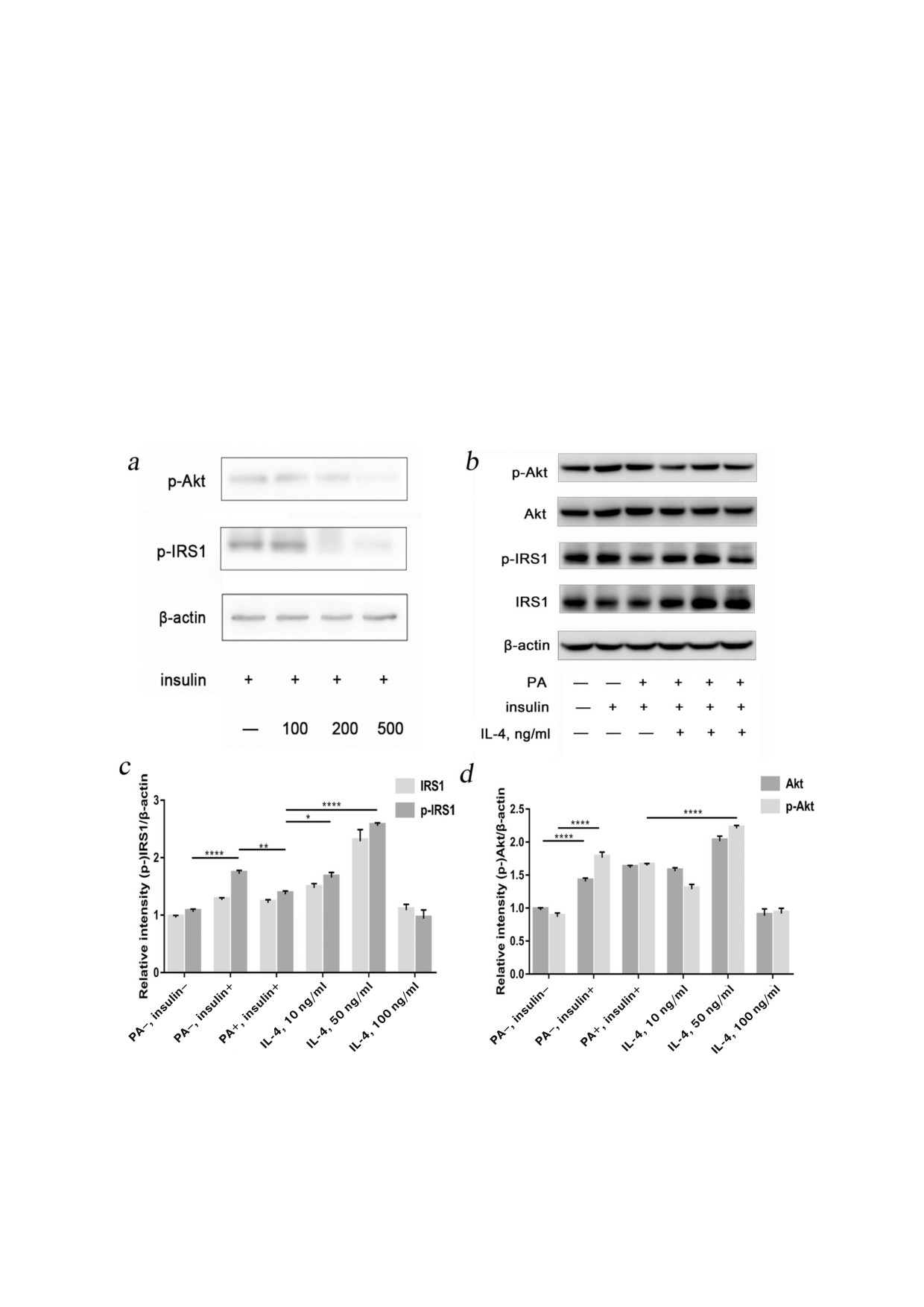
PA, μM
Рис. 3. Обработка PA снижала уровень инсулин зависимой передачи сигнала. IL 4 полностью восстанавливал процесс ак
тивации инсулинового каскада в инсулинорезистентных клетках. a - Экспрессию белков инсулин зависимого сигналь
ного пути оценивали с помощью метода вестерн блоттинга. Добавление 200 мкМ и 500 мкМ пальмитиновой кислоты эф
фективно нарушали активность инсулин зависимого сигнального пути (n = 3). b-d - С помощью метода вестерн блот
тинга показана экспрессия IRS1, p IRS1(Tyr612), Akt и p Akt (Ser473) в различных группах. (* p < 0,05; ** p < 0,01; *** p <
< 0,001; **** p < 0,0001)
БИОХИМИЯ том 85 вып. 3 2020
392
ЧАО и др.
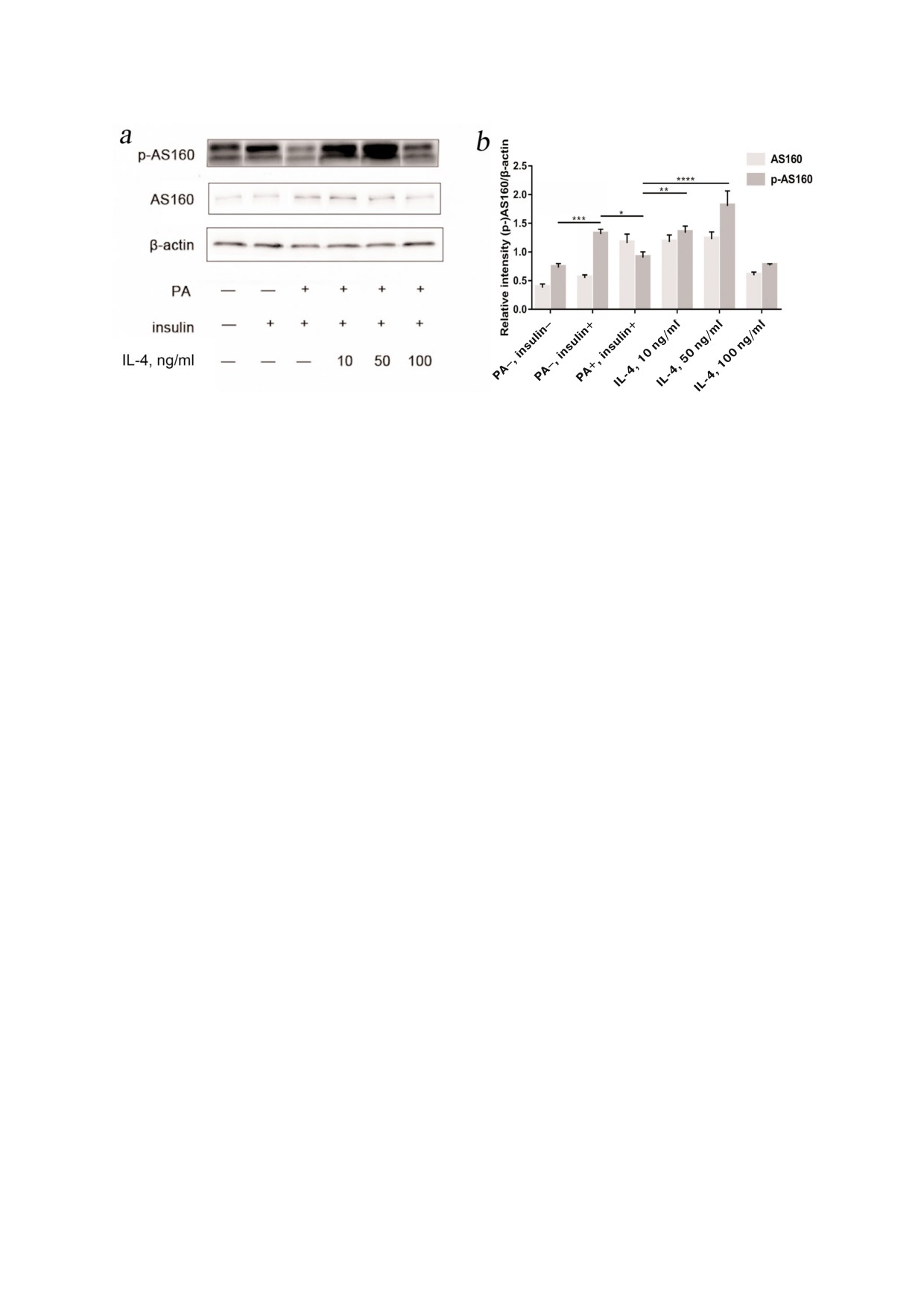
Рис. 4. а и b - Клетки были обработаны 200 мкМ PA, 10 нМ инсулина и различными концентрациями IL 4 в соответствии
с группами, описанными выше. Для определения уровня экспрессии AS160 и p AS160(Ser318) использовали метод вес
терн блоттинга. В качестве контроля использовали β актин. (* p < 0,05; ** p < 0,01; *** p < 0,001; **** p < 0,0001)
дачи сигнала. Стимуляция свободными жирны
остатка Ser473 является одним из условий для
ми кислотами может привести к возникновению
активации инсулин зависимого сигнального
инсулиновой резистентности. Так, добавляли PA
пути. Нами было показано, что инсулин усили
в различных концентрациях (0, 100, 200 и
вает фосфорилирование Akt и Akt Ser473 (p <
500 мкМ) в течение двух дней после 14 дней ин
0,0001, p < 0,0001). Напротив, не было выявлено
дукции остеогенеза и дифференцировки. Было
статистически достоверного влияния PA на
показано, что 200 мкМ и 500 мкМ PA могут эф
уровни экспрессии Akt и его фосфорилирован
фективно нарушить активность инсулин зави
ной формы. IL 4 (10 и 100 нг/мл) ингибировал в
симого сигнального пути (p < 0,01, p < 0,01)
различной степени фосфорилирование Akt
(рис. 3, a). В результате для создания модели инсу
Ser473 (p < 0,01, p < 0,001), в то время как
линовой резистентности была выбрана концент
50 нг/мл IL 4 достоверно повышали уровень
рация 200 мкМ PA, которую далее использовали.
фосфорилирования Akt Ser473 (p < 0,0001)
Сначала нами было изучено влияние IL 4 на
(рис. 3, d). В целом картина влияния различных
субстрат инсулинового рецептора в PA индуци
концентраций IL 4 на Akt была сходна с его вли
рованной модели инсулиновой резистентности.
янием на Akt Ser473, и степень фосфорилирова
Для обнаружения сайтов фосфорилирования
ния оставалась без изменений.
IRS1 и фосфорилирования остатка тирозина
Фосфорилирование белком Akt белка AS160
Tyr612 был использован метод иммуноокрашива
приводит к активации процесса транслокации
ния. На рис. 3, b показано, что в необработанных
транспортера глюкозы 4 го типа (GLUT4) к кле
клетках, инсулин повышал уровни фосфорили
точной мембране, способствуя транспорту глю
рования как IRS1, так и остатка тирозина Tyr612
козы в клетки, и этот процесс является ключе
(p < 0,05, p < 0,0001). Обработка пальмитиновой
вым фактором активации инсулин зависимого
кислотой снижала уровень фосфорилирования
сигнального пути. Как показано на рис. 3, b, в
IRS1 Tyr612 (p < 0,01). Добавление 10 нг/мл IL 4
необработанных клетках инсулин повышал уро
приводило к восстановлению уровня фосфори
вень фосфорилированного остатка Ser318 в
лирования IRS1 Tyr612 (p < 0,05), а добавление
AS160 (p < 0,001), в то время как обработка
50 нг/мл IL 4 вызывало значительное усиление
коньюгатом PA BSA приводила к снижению
фосфорилирования Tyr612 в инсулин индуциро
уровня фосфорилированного остатка Ser318 в
ванном IRS1 (p < 0,0001) (рис. 3, c). Однако повы
AS160 (p < 0,05). Как показано на рис. 4, уровень
шение концентрации IL 4 до 100 нг/мл приводи
фосфорилирования AS160 Ser318 восстанавли
ло к ослаблению стимуляции инсулин индуци
вался при добавлении 10 или 50 нг/мл IL 4, и
рованного фосфорилирования остатка Tyr612,
при этом наблюдали статистически достовер
приводя к противоположному эффекту.
ные различия (p < 0,01, p < 0,0001). Однако при
Далее нами было изучено влияние IL 4 на
добавлении 100 нг/мл IL 4 его влияние на уро
фосфорилирование Akt и его остатка Ser473.
вень фосфорилирования AS160 не было статис
Инсулин стимулируемое фосфорилирование
тически достоверным.
БИОХИМИЯ том 85 вып. 3 2020
МЕХАНИЗМ ВОЗДЕЙСТВИЯ IL 4 НА ЧУВСТВИТЕЛЬНОСТЬ К ИНСУЛИНУ
393
Полученные результаты свидетельствуют о
ла. Все эти белки представляют собой скаффол
том, что PA обладает выраженным индуцирую
ды, задействованные в дальнейшей передаче
щим влиянием на экспрессию инсулиновой ре
сигнала путем сборки и кластеризации специ
зистентности в остеобластах, и что активация
фических сигнальных комплексов через домен
воспалительного ответа представляет собой
ные взаимодействия Src гомологии (SH2) [15].
важный механизм противодействия липидной
Существует шесть изоформ белка IRS, из кото
перегрузке, который приводит к возникнове
рых IRS1 является наиболее распространенным,
нию инсулиновой резистентности. Различные
он широко экспрессируется. Чтобы изучить
концентрации IL 4 оказывали различное влия
влияние IL 4 на экспрессию IRS1 в клетках
ние на уровень фосфорилирования IRS1 Tyr612,
MG 63, была осуществлена остеогенная диффе
Akt Ser473 и AS160 Ser318. При сравнении раз
ренцировка в присутствии 50 нг/мл IL 4 или в
личных концентраций цитокина, его концен
его отсутствии. На 0 й, 7 й и 14 й дни из клеток
трация (50 нг/мл) проявляла наиболее сильный
экстрагировали белки и определяли уровень
эффект в плане восстановления активности
экспрессии IRS с помощью метода иммуно
классического инсулин зависимого сигнально
блоттинга (рис. 5, a).
го пути, в то же время 100 нг/мл IL 4 приводили
На рис. 5, b показано, что уровень экспрес
к противоположному эффекту.
сии IRS1 был повышен как в присутствии IL 4,
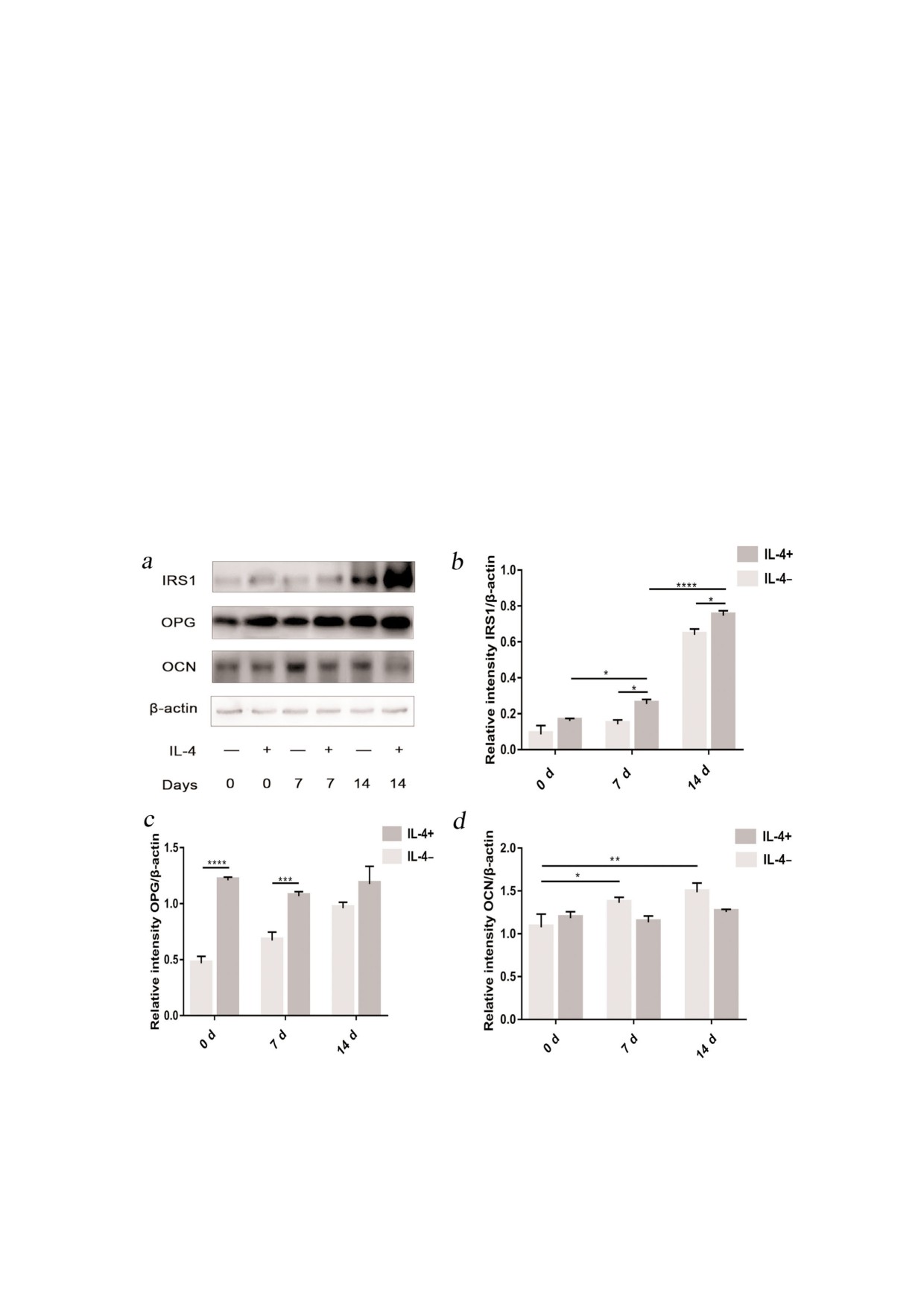
IL 4 усиливает экспрессию IRS1 с зависящим
так и без него, при этом наблюдали статистичес
от времени эффектом. Белки субстраты инсули
ки достоверные различия. IL 4 повышал
нового рецептора (IRS) являются важными ком
экспрессию IRS1 на различных стадиях процес
понентами инсулин зависимой передачи сигна
са дифференцировки клеток. Добавление IL 4
Рис. 5. Влияние 50 нг/мл IL 4 на уровни экспрессии IRS1, OPG и OCN в остеобластах после различной продолжительнос
ти остеогенной индукции (0, 7 и 14 дней). a - Для определения уровня экспрессии белков IRS1, OPG и OCN использова
ли метод вестерн блоттинга (n = 3). b - Экспрессию белка IRS1 анализировали с помощью метода вестерн блоттинга
(n = 3). c - Уровень экспрессии белка OPG определяли с помощью метода вестерн блоттинга (n = 3). d - Уровень экспрес
сии белка OCN определяли с помощью метода вестерн блоттинга (n = 3). (* p < 0,05; ** p < 0,01; *** p < 0,001; **** p < 0,0001)
7 БИОХИМИЯ том 85 вып. 3 2020
394
ЧАО и др.
на 7 й и 14 й дни индукции значительно усили
ции со временем воздействия. Таким образом,
вало экспрессию IRS1 (p < 0,05). В то же время
экспрессия белков OPG и OCN повышается по
не было выявлено статистических различий с
мере увеличения степени дифференцировки
образцами, взятыми сразу в начале экспери
клеток. IL 4 может повышать уровень экспрес
мента (0 й день). Кроме того, было обнаруже
сии OPG в остеобластах и не оказывает значи
но, что экспрессия IRS1 повышалась по мере
мого влияния на экспрессию белка OCN.
усиления дифференцировки. Было высказано
предположение, что эффект IL 4 имеет отно
шение к стадии дифференцировки клеток и что
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
восстановление чувствительности к инсулину
резистентных к нему остеобластов под влияни
Инсулин в основном действует на жировые
ем IL 4 обусловлено повышением экспрессии
клетки, клетки скелетных мышц и клетки пече
IRS1 (по крайней мере, при концентрации IL 4
ни. Были проведены исследования, посвящен
50 нг/мл).
ные изучению механизмов, с помощью которых
IL 4 влияет на зависящее от времени увеличе
воспалительные процессы, вызванные ожире
ние экспрессии OPG и не действует на экспрессию
нием, влияют на инсулиновый путь в адипоци
OCN. Остеопротегерин, индуцируемый инсу
тах, а именно на накопление триглицеридов,
лин зависимым сигнальным путем, может спо
цитопатический эффект, окислительный стресс,
собствовать дифференцировке остеокластов и
нарушения микроциркуляции, вызванные ги
затем реабсорбироваться в зазор между костями
поксией, и снижение уровня снабжения клеток
и снижать значение pH. Это приводит к декар
кислородом, приводящее к фосфорилированию
боксилированию остеокальцина, что способ
или нарушению функционирования белков
ствует секреции инсулина поджелудочной желе
IRS. Действительно, стресс активируемые ки
зой, а также приносит пользу печени, мышцам и
назы (ERK, JNK, AMPK), киназа IKK и ниже
другим органам и влияет на системный метабо
лежащие киназы Akt, aPKC и mTOR вносят
лизм глюкозы [13]. Белки OPG и OCN играют
вклад в фосфорилирование серина/треонина
основную роль в общем метаболизме глюкозы.
IRS. Ингибирование при фосфорилировании
Поэтому нами сначала было изучено влияние
остатков серина может быть достигнуто различ
IL 4 на экспрессию белков OPG и OCN в остео
ными способами, такими как отделение IRS от
бластах. Результаты этого исследования также
IR, превращение IRS в ингибитор активности
позволили сделать предположение, что IL 4 ре
тирозинкиназы, увеличение уровня деградации
гулирует системный метаболизм глюкозы, ока
IRS и содействие отделению адапторного белка
зывая влияние на костную ткань, что открывает
[16-19]. Wei et al. [13] на основе использования
новое направление для будущих исследований.
обогащенной жирами пищи создали модель ин
На рис. 5, c показано, что экспрессия белка
сулиновой резистентности у крыс и обнаружи
OPG в группе с IL 4 повышается со временем по
ли, что в результате употребления такой пищи в
мере усиления дифференцировки клеток с на
клетках костной ткани также может возникнуть
блюдаемыми статистически достоверными раз
инсулиновая резистентность. Было предполо
личиями между группами от 0 до 14 дней диф
жено, что насыщенные жирные кислоты повы
ференцировки клеток (p < 0,0001). Хотя добав
шают уровень экспрессии Smurf1 и усиливают
ление IL 4 приводило к повышению уровня
smurf1 опосредованное убиквитинилирование
экспрессии OPG, этот эффект не зависел от вре
инсулинового рецептора, внося вклад в разви
мени. Было показано, что в 0 й и 7 й день ин
тие инсулиновой резистентности остеобластов.
дукции в группе с добавленным IL 4 уровень
К настоящему моменту большинство работ бы
экспрессии был значительно повышен по срав
ло сосредоточено на изучении ингибиторов
нению с соответствующей IL 4 группой (p <
противовоспалительных цитокинов и на проти
0,0001, p < 0,001). Уровень экспрессии белка
вовоспалительных лекарствах, таких как сали
OPG повышался на 14 й день, однако этот эф
цилаты. В то же время только ограниченное
фект не был статистически значимым.
число работ было посвящено изучению проти
Экспрессия белка OCN повышалась в груп
вовоспалительных лекарств, как возможных ми
пе с IL 4 по мере увеличения количества дней
шеней для терапевтического вмешательства. В
индукции (7 дней - p < 0,05, 14 дней - p < 0,01,
частности, Stafeev et al. показали, что IL 4 вос
в сравнении с днем 0 соответственно). Получен
станавливает чувствительность к действию ин
ные результаты показывают, что добавление IL 4,
сулина в резистентных к нему индуцированных
по видимому, оказывает слабый ингибирующий
липидами адипоцитах [9]. IL 4 является проти
эффект в отношении OCN, и этот эффект не яв
вовоспалительным фактором, который непо
ляется статистически значимым и нет корреля
средственно активирует факторы транскрипции
БИОХИМИЯ том 85 вып. 3 2020
МЕХАНИЗМ ВОЗДЕЙСТВИЯ IL 4 НА ЧУВСТВИТЕЛЬНОСТЬ К ИНСУЛИНУ
395
STAT6, и было предположено, что IL 4 может
ром [25]. В наших экспериментах было показа
замедлять процессы воспаления и восстанавли
но, что IL 4 восстанавливает и даже существен
вать чувствительность к инсулину в инсулино
но активирует инсулин зависимую передачу
резистентных остеобластах.
сигнала в инсулинорезистентных клетках MG 63.
Снижение активности остеобластов и нару
Фосфорилирование ключевых компонентов ин
шение дифференцировки может привести к на
сулин зависимого сигнального пути (IRS1, Akt
рушению процесса формирования костей. Это
и AS160) в клетках, находящихся в инсулиноре
может регулироваться различными цитокинами
зистентном состоянии, максимально активиро
и факторами роста, присутствующими в кост
валось при добавлении 50 нг/мл IL 4. В некото
ной ткани. Интерлейкин 4 регулирует актив
рых работах было показано, что IL 4 может сти
ность различных лимфоцитов, гематопоетичес
мулировать IRS2/PI3K зависимый сигнальный
ких и мезенхимных клеток, однако его влияние
путь в CD4+ и CD8+ клетках через IL 4R зави
на клетки костной ткани были недостаточно
симый сигнальный путь [26]. Добавление IL 4 к
изучено. Ura et al. [20] показали, что IL 4 и IL 13
остеобластам активирует комплекс IRS1 через
дозозависимо индуцируют клеточную пролифе
IL 4R, тем самым активируя PI3K/Akt зависи
рацию. Однако в других работах было показано,
мый сигнальный путь. Мы также обнаружили,
что IL 4 ингибирует пролиферацию остеобласт
что положительное влияние IL 4 на чувстви
подобных клеток MG 63 человека [21]. Riancho
тельность клеток к инсулину может быть связа
et al. [22] сообщили, что mIL 4 не оказывает за
но со специфическим механизмом развития ин
метного влияния на пролиферацию клеток
сулиновой резистентности в результате
MC3T3 El. В наших экспериментах было пока
действия липидов. Инсулин связывается с IR и
зано, что IL 4 ингибирует активность клеток
инициирует сигнальный каскад путем актива
MG 63, и также была подтверждена зависи
ции рецепторных тирозиновых киназ, и это
мость этого эффекта от дозы и продолжитель
приводит к активации транспорта глюкозы и
ности воздействия. Расхождения между резуль
другим метаболическим эффектам. В целом, эти
татами, полученными Riancho et al., и нашими
результаты указывают на то, что IRS1 является
могут быть объяснены различиями в методоло
непосредственным физиологическим субстра
гических подходах. Также следует учесть, что
том инсулинового рецептора и может играть
были использованы различные клеточные ли
роль в инсулин зависимой передаче сигнала
нии. Полученные нами результаты способству
[27-29]. Нами также было показано, что
ют более глубокому пониманию возможной ро
экспрессия IRS1 в значительной степени воз
ли интерлейкина 4, как регулятора пролифера
растает по мере остеогенной дифференцировки,
ции остеобластов, но для полного понимания
и добавление IL 4 на 7 й и 14 й день вызывает
этой проблемы необходимы более глубокие ис
повышение IRS1 (p < 0,05). Было высказано
следования. Frost et al. [23] и Silfversward et al.
предположение, что повышение экспрессии
[24] показали, что IL 4 способствует секреции
IRS под воздействием IL 4 может быть одной из
щелочной фосфатазы, образованию коллагена и
причин восстановления чувствительности остео
минерализации остеобластов человека, поддер
бластов к действию инсулина с помощью IL 4.
живая клетки в дифференцированной продук
В работах, выполненных Wei et al. [13], было
тивной фазе. Мы обнаружили, что 50 нг/мл IL 4
показано, что инсулиновая резистентность в
эффективно усиливает экспрессию OPG в остео
костной ткани приводит к снижению уровня
бластах в зависимости от времени (0 дней -
цикла остеокальцина, гормона из костной тка
p < 0,0001, 7 дней - p < 0,001), но не оказывает
ни, разрушая остеокальцин зависимый сиг
существенного влияния на ОКН.
нальный путь и приводя к непереносимости
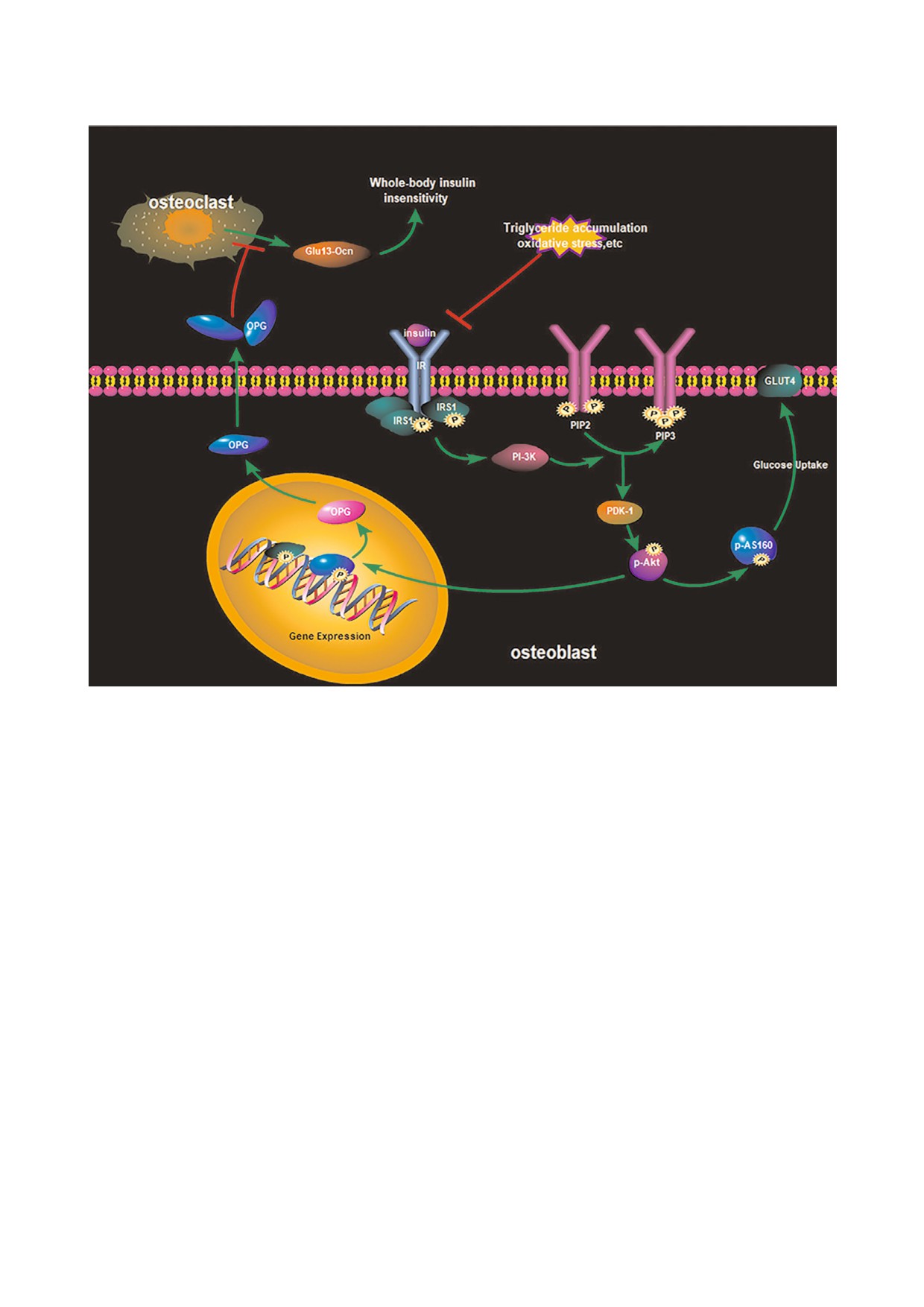
Инсулин зависимая передача сигнала осу
глюкозы. OCN необходим для повышения
ществляется высокоинтегрированной сетью,
чувствительности мышц и клеток белой жиро
контролирующей несколько процессов. В при
вой ткани к инсулину [30, 31]. Глюкоза может
сутствии инсулина инсулиновый рецептор фос
регулировать экспрессию гена остеокальцина
форилирует IRS, которые связаны с активацией
через процесс трансактивации на уровне тран
фосфатидилинозитол 3 киназа (PI3K)-AKT/
скрипции. Совсем недавно было показано, что
протеинкиназа B (PKB) зависимого сигнально
инсулиновая резистентность и высокий уровень
го пути, ответственного за большинство метабо
глюкозы понижают экспрессию OCN in vitro, и
лических действий инсулина (рис. 6). В сигналь
что инсулинорезистентные остеобласты могут
ных сетях есть несколько ключевых узлов, кото
вызвать снижение уровня OCN, образуемого в
рые играют важную роль в нормальных физио
костной ткани, и привести к возникновению
логических условиях и при патологиях, таких
системных нарушений [14]. Специфичный для
как диабет, ожирение и метаболический синд
костной ткани гормон OCN может влиять на
БИОХИМИЯ том 85 вып. 3 2020
7*
396
ЧАО и др.
Рис. 6. Инсулин зависимый сигнальный путь и общий обмен глюкозы в остеобластах и остеокластах.
biokhsm/
секрецию инсулина, чувствительность клеток к
клеток. Действительно, низкие значения pH,
инсулину, и он крайне необходим для общего
достигаемые при резорбции кости, являются
обмена энергии. Наши эксперименты показали,
важным условием для декарбоксилированного
что экспрессия OCN повышается по мере увели
остеокальцина. OPG играет важную роль в
чения продолжительности индукции. Добавле
трансформации OCN при активации и инакти
ние IL 4, по видимому, вызывало небольшое
вации [10, 12]. Нами было обнаружено, что
ингибирующее действие на экспрессию OCN,
экспрессия OPG увеличивалась со временем по
но этот эффект был незначителен, статистичес
мере повышения степени дифференцировки
ки не значим и при этом не было выявлено кор
клеток. Добавление IL 4 вызывало повышение
реляции с продолжительностью индукции. IL 4
уровня экспрессии OPG, но в этом случае не бы
не оказывал заметного влияния на уровень
ло выявлено временной зависимости. Однако в
экспрессии OCN. Карбоксилированный OCN
этой работе были изучены эффекты IL 4 на OPG
(GLA) является неактивной формой OCN, и ак
остеобластов только при нормальных условиях,
тивация белка происходит в результате его де
и полученные нами результаты не указывают на
карбоксилирования (рис. 5). Ferron et al. [10] об
процесс активации OCN в результате декарбок
наружили, что нарушение инсулин зависимой
силирования в условиях in vivo. Влияние IL 4 на
передачи сигнала стимулирует экспрессию
экспрессию OPG остеобластов и в целом на сис
OPG, снижает адсорбцию остеокластов, повы
темный метаболизм глюкозы в моделях инсули
шает уровень карбоксилирования OCN и инги
норезистентности и на животных еще предстоит
бирует активность инсулин чувствительных
исследовать в дальнейших работах.
БИОХИМИЯ том 85 вып. 3 2020
МЕХАНИЗМ ВОЗДЕЙСТВИЯ IL 4 НА ЧУВСТВИТЕЛЬНОСТЬ К ИНСУЛИНУ
397
В заключение отметим, что это исследова
диабетом и для повышения системной резистент
ние продемонстрировало, что IL 4 ингибирует
ности к инсулину через факторы, связанные с
пролиферацию клеток MG 63 в зависимости от
костью.
времени и концентрации. Также было показано,
что IL 4 восстанавливает и даже значительно
усиливает активность инсулин зависимого сиг
Финансирование. Li M. получил частичную
нального пути в остеобластах, находящихся в
поддержку от Государственного фонда естест
инсулинорезистентном состоянии. Восстанов
венных наук Китая (National Nature Science
ление чувствительности остеобластов к
Foundation of China, грант № 81470719 и
действию инсулина с помощью IL 4 может быть
№ 81611140133) и проекта Shuong Key
связано с повышением уровня экспрессии IRS1.
Research and development Project (Grant
Кроме того, было показано, что уровни белков
No. 2018GSF118114). Guo J. получил поддерж
OPG и OCN повышаются по мере возрастания
ку от Государственного фонда естественных
степени дифференцировки клеток, и 50 нг/мл
наук Китая (National Nature Science Foundation
IL 4 способствуют секреции OPG в остеоблас
of China, грант № 81771108).
тах без оказания какого либо влияния на уро
Конфликт интересов. Авторы заявляют об от
вень OCN. Из за тесной взаимосвязи между ме
сутствии конфликта интересов.
таболизмом костной ткани и глюкозы исследо
Соблюдение этических норм. Настоящая
вание положительного влияния IL 4 на чувстви
статья не содержит каких либо исследований с
тельность к инсулину в остеобластах полезно
участием людей или использованием животных
для снижения риска остеопороза у пациентов с
в качестве объектов исследований.
СПИСОК ЛИТЕРАТУРЫ
1. Bluher, M. (2016) Adipose tissue inflammation: a cause or
and energy metabolism, Cell, 142, 296-308, doi: 10.1016/
consequence of obesity related insulin resistance? Clin.
j.cell.2010.06.003.
Sci. (Lond.), 130, 1603-1614, doi: 10.1042/cs20160005.
11. Avnet, S., Sciacca, L., Salerno, M., Gancitano, G.,
2. Karalliedde, J., and Gnudi, L. (2016) Diabetes mellitus, a
Cassarino, M.F., Longhi, A., Zakikhani, M., Carboni, J.M.,
complex and heterogeneous disease, and the role of insulin
Gottardis, M., Giunti, A., Pollak, M., Vigneri, R., and
resistance as a determinant of diabetic kidney disease, Nephrol.
Baldini, N. (2009) Insulin receptor isoform A and insulin
Dial. Transplant., 31, 206-213, doi: 10.1093/ndt/gfu405.
like growth factor II as additional treatment targets in
3. Ebstein, W. (2002) Invited comment on W. Ebstein: On the
human osteosarcoma, Cancer Res., 69, 2443-2452,
therapy of diabetes mellitus, in particular on the applica
doi: 10.1158/0008 5472.can 08 2645.
tion of sodium salicylate, J. Mol. Med. (Berl.), 80, 618.
12. Clemens, T.L., and Karsenty, G. (2011) The osteoblast: an
4. Hotamisligil, G.S., Shargill, N.S., and Spiegelman, B.M.
insulin target cell controlling glucose homeostasis, J. Bone
(1993) Adipose expression of tumor necrosis factor alpha:
Miner. Res., 26, 677-680, doi: 10.1002/jbmr.321.
direct role in obesity linked insulin resistance, Science,
13. Wei, J., Ferron, M., Clarke, C.J., Hannun, Y.A., Jiang, H.,
259, 87-91, doi: 10.1126/science.7678183.
Blaner, W.S., and Karsenty, G. (2014) Bone specific
5. Hundal, R.S., Petersen, K.F., Mayerson, A.B., Randhawa, P.S.,
insulin resistance disrupts whole body glucose homeostasis
Inzucchi, S., Shoelson, S.E., and Shulman, G.I. (2002)
via decreased osteocalcin activation, J. Clin. Invest., 124,
Mechanism by which high dose aspirin improves glucose
1-13, doi: 10.1172/jci72323.
metabolism in type 2 diabetes, J. Clin. Invest., 109,
14. Bilotta, F.L., Arcidiacono, B., Messineo, S., Greco, M.,
1321-1326, doi: 10.1172/jci14955.
Chiefari, E., Britti, D., Nakanishi, T., Foti, D.P., and
6. Shoelson, S.E., Lee, J., and Goldfine, A.B.
(2006)
Brunetti, A. (2018) Insulin and osteocalcin: further evi
Inflammation and insulin resistance, J. Clin. Invest., 116,
dence for a mutual cross talk, Endocrine, 59, 622-632,
1793-1801, doi: 10.1172/jci29069.
doi: 10.1007/s12020 017 1396 0.
7. Ricardo Gonzalez, R.R., Red Eagle, A., Odegaard, J.I.,
15. Shaw, L.M. (2011) The insulin receptor substrate (IRS)
Jouihan, H., Morel, C.R., Heredia, J.E., Mukundan, L.,
proteins: at the intersection of metabolism and cancer, Cell
Wu, D., Locksley, R.M., and Chawla, A. (2010) IL
Cycle, 10, 1750-1756, doi: 10.4161/cc.10.11.15824.
4/STAT6 immune axis regulates peripheral nutrient
16. Stafeev, I.S., Vorotnikov, A.V., Ratner, E.I., Menshikov, M.Y.,
metabolism and insulin sensitivity, Proc. Natl. Acad. Sci.
and Parfyonova, Y.V. (2017) Latent inflammation and
USA, 107, 22617-22622, doi: 10.1073/pnas.1009152108.
insulin resistance in adipose tissue, Int. J. Endocrinol.,
8. Darkhal, P., Gao, M., Ma, Y., and Liu, D. (2015) Blocking
2017, 5076732, doi: 10.1155/2017/5076732.
high fat diet induced obesity, insulin resistance and fatty
17. Boura Halfon, S., and Zick, Y. (2009) Serine kinases of
liver by overexpression of Il 13 gene in mice, Int. J. Obes.
insulin receptor substrate proteins, Vitam. Horm., 80,
(Lond.), 39, 1292-1299, doi: 10.1038/ijo.2015.52.
313-349, doi: 10.1016/s0083 6729(08)00612 2.
9. Stafeev, I.S., Michurina, S.S., Podkuychenko, N.V.,
18. Boura Halfon, S., and Zick, Y. (2009) Phosphorylation of
Vorotnikov, A.V., Menshikov, M.Y., and Parfyonova, Y.V.
IRS proteins, insulin action, and insulin resistance, Am. J.
(2018) Interleukin 4 restores insulin sensitivity in lipid
Physiol. Endocrinol. Metab.,
296, E581-E591,
induced insulinresistant adipocytes, Biochemistry
doi: 10.1152/ajpendo.90437.2008.
(Moscow), 83, 498-506, doi: 10.1134/s0006297918050036.
19. Zick, Y.
(2004) Uncoupling insulin signalling by
10. Ferron, M., Wei, J., Yoshizawa, T., Del Fattore, A.,
serine/threonine phosphorylation: a molecular basis for
DePinho, R.A., Teti, A., Ducy, P., and Karsenty, G. (2010)
insulin resistance, Biochem. Soc. Trans., 32, 812-816,
Insulin signaling in osteoblasts integrates bone remodeling
doi: 10.1042/bst0320812.
БИОХИМИЯ том 85 вып. 3 2020
398
ЧАО и др.
20.
Ura, K., Morimoto, I., Watanabe, K., Saito, K.,
2 mediated phosphatidylinositol 3 kinase activity in pri
Yanagihara, N., and Eto, S. (2000) Interleukin (IL) 4 and
mary macrophages to induce a state of cytokine resistance
IL 13 inhibit the differentiation of murine osteoblastic
to IL 4 in association with overexpression of suppressor of
MC3T3 E1 cells, Endocr. J., 47, 293-302, doi: 10.1507/
cytokine signaling 3, J. Immunol., 178, 6886-6893, doi:
endocrj.47.293.
10.4049/jimmunol.178.11.6886.
21.
Riancho, J.A., Zarrabeitia, M.T., Olmos, J.M., Amado, J.A.,
27. Myers, M.G., Jr., and White, M.F. (1996) Insulin signal
and Gonzalez Macias, J. (1993) Effects of interleukin 4 on
transduction and the IRS proteins, Annu. Rev. Pharmacol.
human osteoblast like cells, Bone Miner., 21, 53-61,
Toxicol., 36, 615-658, doi: 10.1146/annurev.pa.36.040196.
doi: 10.1016/s0169 6009(08)80120 1.
003151.
22.
Riancho, J.A., González Marc as, J., Amado, J.M.,
28. Paz, K., Voliovitch, H., Hadari, Y.R., Roberts, C.T., Jr.,
Olmos, J.M., and Fernández Luna, J.L.
(1995)
LeRoith, D., and Zick, Y. (1996) Interaction between the
Interleukin 4 as a bone regulatory factor: effects on murine
insulin receptor and its downstream effectors. Use of indi
osteoblast like cells, J. Endocrinol. Invest., 18, 174-179.
vidually expressed receptor domains for structure/function
23.
Frost, A., Jonsson, K.B., Brandstrom, H., Ljunghall, S.,
analysis, J. Biol. Chem., 271, 6998-7003, doi: 10.1074/jbc.
Nilsson, O., and Ljunggren, O. (2001) Interleukin (IL) 13
271.12.6998.
and IL 4 inhibit proliferation and stimulate IL 6 formation
29. Sun, X.J., Miralpeix, M., Myers, M.G., Jr., Glasheen, E.M.,
in human osteoblasts: evidence for involvement of receptor
Backer, J.M., Kahn, C.R., and White, M.F.
(1992)
subunits IL 13R, IL 13Ralpha, and IL 4Ralpha, Bone, 28,
Expression and function of IRS 1 in insulin signal trans
268-274.
mission, J. Biol. Chem., 267, 22662-22672.
24.
Silfversward, C.J., Penno, H., Frost, A., Nilsson, O., and
30. Ferron, M., Hinoi, E., Karsenty, G., and Ducy, P. (2008)
Ljunggren, O. (2010) Expression of markers of activity in
Osteocalcin differentially regulates beta cell and adipocyte
cultured human osteoblasts: effects of interleukin 4 and
gene expression and affects the development of metabolic
interleukin 13, Scand. J. Clin. Lab. Invest., 70, 338-342,
diseases in wild type mice, Proc. Natl. Acad. Sci. USA, 105,
doi: 10.3109/00365513.2010.488698.
5266-5270, doi: 10.1073/pnas.0711119105.
25.
Taniguchi, C.M., Emanuelli, B., and Kahn, C.R. (2006)
31. Lee, N.K., Sowa, H., Hinoi, E., Ferron, M., Ahn, J.D.,
Critical nodes in signalling pathways: insights into insulin
Confavreux, C., Dacquin, R., Mee, P.J., McKee, M.D.,
action, Nat. Rev. Mol. Cell Biol., 7, 85-96, doi: 10.1038/
Jung, D.Y., Zhang, Z., Kim, J.K., Mauvais Jarvis, F.,
nrm1837.
Ducy, P., and Karsenty, G. (2007) Endocrine regulation of
26.
O’Connor, J.C., Sherry, C.L., Guest, C.B., and Freund, G.G.
energy metabolism by the skeleton, Cell, 130, 456-469,
(2007) Type 2 diabetes impairs insulin receptor substrate
doi: 10.1016/j.cell.2007.05.047.
INTERLEUKIN 4 RESTORES INSULIN SENSITIVITY
IN INSULIN RESISTANT OSTEOBLASTS BY INCREASING
THE EXPRESSION OF INSULIN RECEPTOR SUBSTRATE 1
R. Chao1, D. Li1, Z. Yue1, C. Huang1, Y. Kou1, Q. Zhou1,
Y. Gao1, T. Hasegawa2, J. Guo1, and M. Li1*
1 Department of Bone Metabolism, School and Hospital of Stomatology, Shandong University;
Shandong Key Laboratory of Oral Tissue Regeneration; Shandong Engineering Laboratory for Dental Materials
and Oral Tissue Regeneration, Jinan, 250012 China; E mail: liminqi@sdu.edu.cn
2 Department of Developmental Biology of Hard Tissue, Graduate School of Dental Medicine,
Hokkaido University, Sapporo, 060 8586 Japan
Received October 14, 2019
Revised November 30, 2019
Accepted December 31, 2019
Obesity and latent inflammation can give rise to insulin resistance and type 2 diabetes. Here we established an insulin
resistance model of osteoblasts to explore the restoration effect of anti inflammatory interleukin 4 (IL 4) on insulin
sensitivity and its mechanism. We found that IL 4 inhibited cell proliferation in a concentration and time dependent
manner. Insulation resistance significantly reduced the phosphorylation levels of the insulin receptor substrate 1
(IRS1; Tyr612), Akt (Ser473), and AS160 (Ser318) proteins. The addition of IL 4 to the insulin resistance model led
to a dose dependent stimulation of the phosphorylation of IRS1, Akt, and AS160. IL 4 fully restored the activation
of the insulin cascade in insulin resistant cells at the concentration of 50 ng/ml. Additionally, IL 4 promoted the
expression of IRS1 in a time dependent manner. We conjecture that IL 4 restores insulin sensitivity in osteoblasts by
upregulating the expression of IRS1. It was also found that IL 4 promoted the expression of osteoprotegerin depend
ing on the time of exposure. This effect may play an important role in the regulation of the energy metabolism in the
whole body.
Keywords: obesity, insulin resistance, interleukin 4, osteoblast
БИОХИМИЯ том 85 вып. 3 2020