БИОХИМИЯ, 2020, том 85, вып. 3, с. 412 - 427
УДК 579.242;579.222.2
АЛЬТЕРНАТИВНЫЙ ПУТЬ МЕТАБОЛИЗМА НАФТАЛИНА
У ШТАММА Rhodococcus opacus 3D, ВКЛЮЧАЮЩИЙ ОБРАЗОВАНИЕ
орто ФТАЛЕВОЙ И ПРОИЗВОДНЫХ КОРИЧНОЙ КИСЛОТЫ
© 2020
Т.О. Анохина, Т.З. Есикова, А.Б. Гафаров,
В.Н. Поливцева, Б.П. Баскунов, И.П. Соляникова*
Федеральный исследовательский центр «Пущинский научный центр биологических исследований РАН»,
Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН,
142290 Пущино Московской обл., Россия; электронная почта: innas@IBPM.Pushchino.ru
Поступила в редакцию 01.11.2019
После доработки 06.12.2019
Принята к публикации 06.12.2019
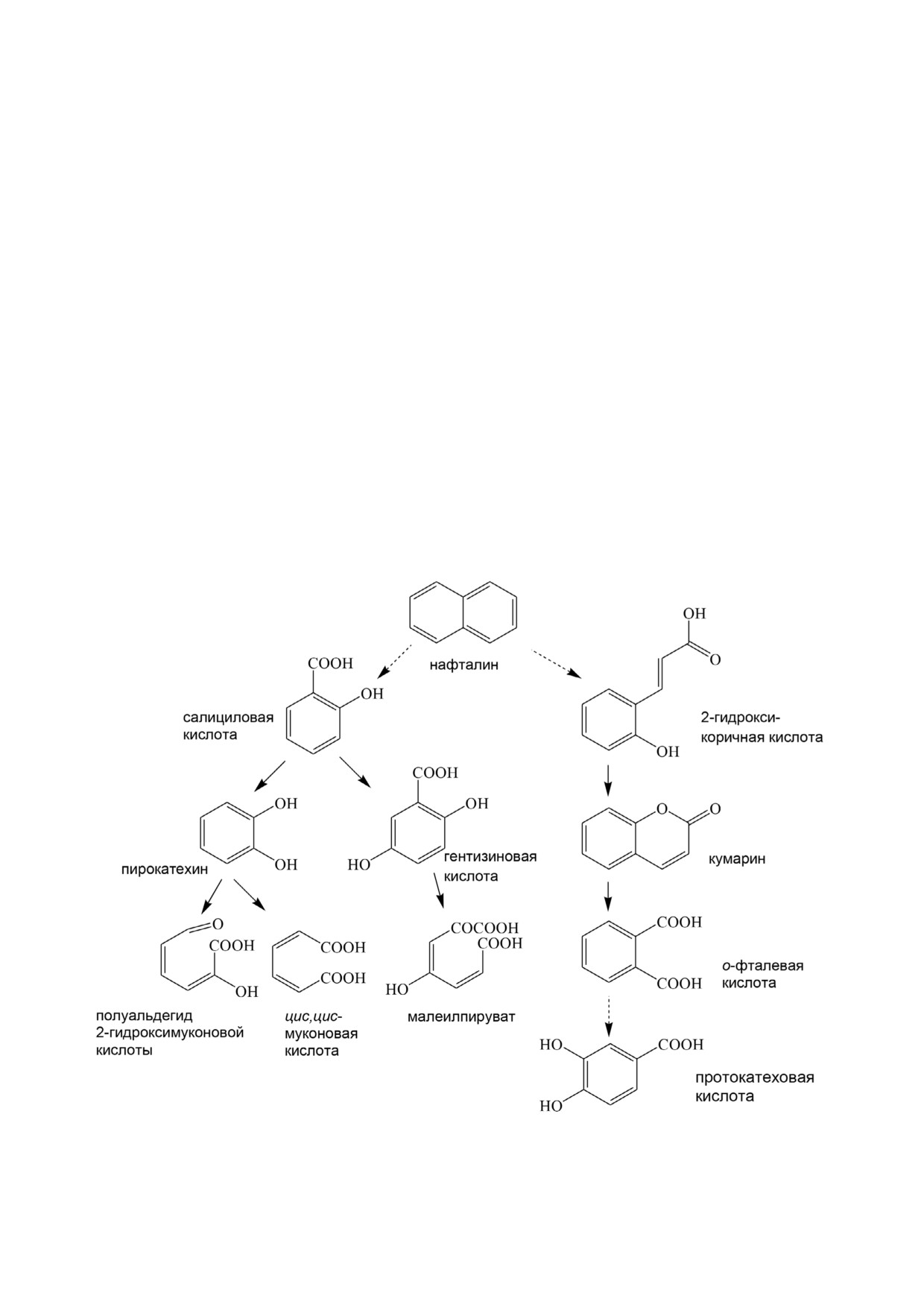
Нафталин, как один из компонентов нефти, относится к широко распространенным в окружающей среде
поллютантам. Биохимические и генетические аспекты деградации нафталина наиболее полно изучены у
бактерий рода Pseudomonas. Известно, что салицилат является ключевым интермедиатом деградации этого
соединения у псевдомонад. В данной работе исследована способность штамма Rhodococcus opacus 3D ис'
пользовать нафталин в качестве единственного источника углерода и энергии. Особенностью этого штам'
ма является отсутствие роста в минеральной среде с салицилатом, типичным интермедиатом биодеградации
нафталина у грамотрицательных бактерий. Отсутствие активности фермента салицилатгидроксилазы и ди'
намика накопления салицилата при культивировании штамма R. opacus 3D в минеральной среде с нафтали'
ном свидетельствуют об альтернативном пути окисления нафталина данной культурой. Показана способ'
ность исследуемого штамма использовать в качестве ростовых субстратов моноароматические соедине'
ния - соли гентизиновой, протокатеховой, орто'фталевой, 2'гидроксикоричной кислот и кумарин. На ос'
новании определения активности ферментов, идентификации интермедиатов, анализа генетических детер'
минант и определения спектра ростовых субстратов было сделано заключение, что штамм R. opacus 3D осу'
ществляет деструкцию нафталина по альтернативному, не характерному для псевдомонад, пути, включаю'
щему образование орто'фталевой кислоты. В данной работе методом масс'спектрометрии впервые показа'
но, что образующийся в следовых количествах и неметаболизируемый далее ассоциат салициловой кисло'
ты накапливался в ростовой среде в виде димера.
КЛЮЧЕВЫЕ СЛОВА: Rhodococcus opacus, нафталин, салициловая кислота, орто'фталевая кислота, 2'гид'
роксикоричная кислота, гены биодеградации, ферментативная активность.
DOI: 10.31857/S0320972520030112
В ряду полициклических ароматических уг'
цессов, разлива и переработки нефти, уничто'
леводородов (ПАУ) нафталин представляет со'
жения бытовых отходов и использования фуми'
бой самое простое соединение. Учитывая его
гантов и дезодораторов [1, 2].
высокую токсичность и присутствие в отходах
Биохимические пути и генетические системы
химической и нефтеперерабатывающей про'
биодеградации нафталина наиболее полно изуче'
мышленности, нафталин следует рассматривать
ны у бактерий рода Pseudomonas и родственных
как поллютант приоритетного значения. Нафта'
видов [3-8]. Гены деградации ПАУ у них имеют,
лин, как и другие ПАУ, попадает в окружающую
как правило, плазмидную локализацию [9-11],
среду также в результате неполного сгорания ор'
но могут располагаться и на бактериальной хро'
ганических соединений, пиролитических про'
мосоме [12]. Для генов катаболизма нафталина
характерна оперонная организация. «Верхний»
Принятые сокращения: ГДО - гентизатдиоксигена'
оперон (nah1<оперон) кодирует белки, окисляю'
за; КОЕ - колониеобразующие единицы; МЦИ - муко'
щие нафталин до салицилата; «нижний» оперон
натциклоизомераза; НДО - нафталин'1,2'диоксигеназа; (nah2< или sal'оперон) включает в себя гены, от'
ПАУ - полициклические ароматические углеводороды; ветственные за окисление салицилата до пирока'
ПК'1,2'ДО - пирокатехин'1,2'диоксигеназа; ПК'2,3'
техина с последующим расщеплением последне'
ДО - пирокатехин'2,3'диоксигеназа; ПКК - протокате'
ховая кислота; 1СГ - салицилат'1'гидроксилаза; ТСХ -
го по мета<пути до метаболитов цикла Кребса
тонкослойная хроматография.
[9]. Эти опероны генетически тесно связаны друг
* Адресат для корреспонденции.
с другом и их общим регуляторным геном nahR.
412
МЕТАБОЛИЗМ НАФТАЛИНА ШТАММОМ R. opacus 3D
413
Большинство грамотрицательных бактерий
очередь, расщепляется гентизат'1,2'диоксиге'
характеризуются сходными путями метаболиз'
назой (ГДО; КФ 1.13.11.4) [22-24] (рис. 1). Про'
ма нафталина. Молекулярные основы этого
дукты окисления пирокатехина и гентизиновой
процесса детально исследованы ранее [13, 14].
кислоты в конечном итоге поступают в цикл
На первом этапе происходит окисление
трикарбоновых кислот [9, 20, 25, 26].
субстрата молекулярным кислородом с участи'
Хотя изначально считалось, что гентизино'
ем фермента нафталин'1,2'диоксигеназы
вый путь менее распространен, чем пирокатехи'
(НДО; КФ 1.14.12.12), что приводит к образова'
новый, впоследствии ГДО в составе метаболи'
нию цис'нафталиндигидродиола [15, 16]. Далее
ческого пути деградации нафталина была обна'
цис'нафталиндигидродиол трансформируется
ружена не только у бактерий рода Pseudomonas
до 1,2'дигидроксинафталина, который в ходе
[27-30]. Исследование деструкции нафталина
последовательных реакций превращается в са'
псевдомонадами положило начало изучению
лицилат. Салицилат'1'гидроксилаза
(1СГ;
метаболизма ПАУ в целом и стимулировало ра'
КФ 1.14.13.1) окисляет салицилат с образовани'
боты по характеристике биохимических путей
ем пирокатехина [7, 17, 18], салицилат'5'гид'
деградации нафталина у бактерий разных таксо'
роксилаза (5СГ; КФ 1.14.13.172) тот же субстрат
номических групп [31].
трансформирует в гентизиновую кислоту [19,
Процесс деструкции нафталина у грамполо'
20]. Пирокатехин далее конвертируется по пу'
жительных бактерий, в частности у представи'
тям орто' или мета'расщепления, ключевыми
телей рода Rhodococcus, изучен в значительно
ферментами которых являются, соответствен'
меньшей степени [31, 32]. Информация в основ'
но, пирокатехин'1,2'диоксигеназа (ПК'1,2'ДО;
ном касается организации генов, кодирующих
КФ 1.13.11.1) и пирокатехин'2,3'диоксигеназа
нафталин'1,2'диоксигеназу (narAa и narAb) и
(ПК'2,3'ДО; КФ 1.13.11.2) [21]. Гентизат, в свою
дигидродиолдегидрогеназу (narB) [33]. Отличи'
Рис. 1. Начальные этапы деструкции нафталина бактериями различных таксономических групп
БИОХИМИЯ том 85 вып. 3 2020
414
АНОХИНА и др.
тельной особенностью родококков является то,
водителей
«Реахим» (СССР),
«AppliChem»
что гены, ответственные за первые этапы де'
(США) и «Panreac» (США). Биохимические ре'
струкции нафталина, не организованы в единый
активы были получены от фирм «Sigma'Aldrich»
кластер, как у псевдомонад. У разных штаммов
(США) и «Serva» (Германия), реактивы для мо'
Rhodococcus в геноме присутствует несколько го'
лекулярно'биологических работ - от фирм
мологичных участков, разделенных негомоло'
«Thermo Fischer Scientific» (США),
«Zymo
гичными последовательностями, включая пря'
Research» (США) и «Биоком» (Россия).
мые и инвертированные повторы [34, 35]. Раз'
Бактериальные штаммы. В данной работе бы'
личия также касаются участия предполагаемого
ли использованы бактериальные штаммы'де'
регулятора транскрипции GntR (narR1 и narR2),
структоры рода Rhodococcus, выделенные ранее
характерного для ряда родококков [35].
из различных загрязненных источников. Куль'
Информация о путях деструкции нафталина
туры, использованные в работе, указаны в
родококками ограничена и противоречива. По'
табл. 1. Из'за отсутствия в коллекции штамма
казано, что утилизация нафталина у штаммов
родококка, обладающего фенотипом Nah+Sal+,
Rhodococcus sp. B4 и Rhodococcus sp. NCIMB 12038
в качестве контроля был выбран штамм
проходит по пути, характерному для псевдомо'
Pseudomonas chlororaphis OV17(pOV17), утилизи'
над, с салицилатом в качестве центрального ин'
рующий нафталин или салицилат как един'
термедиата [36, 37]. В ряде случаев у родококков
ственный источник углерода и энергии.
салициловая кислота, образующаяся в результате
Условия культивирования. Штаммы выращи'
трансформации нафталина, превращается в ген'
вали в минеральной среде следующего состава
тизиновую [36, 38]. Штамм R. wratislaviensis IFP
(г/л): Na2HPO4 - 0,73; KH2PO4 - 0,35; MgSO4 ×
2016 способен разлагать 11 ароматических соеди'
× 7H2O - 0,1; NaHCO3 - 0,25; MnSO4 × 5H2O -
нений, включая нафталин, однако путь деграда'
0,002; NH4NO3 - 0,75; FeSO4 × 7H2O - 0,02
ции нафталина у него детально не изучен [32].
(«Реахим», СССР). Для получения агаризован'
Особый интерес представляет штамм R. opacus
ной среды добавляли 1,5% агара («Difco», США).
M213, у которого разложение нафталина проис'
Ростовые субстраты использовали в следую'
ходит с образованием не салицилата, а производ'
щих концентрациях: сукцинат, глутамат, нафта'
ных коричной кислоты [31].
лин - 0,5-1,0 г/л; гентизат, протокатехоат, пи'
Таким образом, анализ имеющихся литера'
рокатехин, орто'фталат, 2'гидроксикоричная и
турных данных показывает, что у микроорга'
2'карбоксикоричная кислоты - 0,2-0,5 г/л; са'
низмов наиболее полно исследованы пути раз'
лицилат - 0,1-1,0 г/л (все реактивы производ'
ложения нафталина, в которых центральным
ства «Sigma'Aldrich», США и «Thermo Fischer»,
метаболитом является салицилат. Тем не менее
Германия). Нерастворимые в воде ароматичес'
ряд работ указывает на то, что у грамположи'
кие кислоты вносили в ростовую среду в виде
тельных бактерий, скорее как исключение, раз'
солей натрия. При выращивании штамма на
ложение нафталина происходит по альтерна'
агаризованной среде летучие ароматические со'
тивным путям.
единения (нафталин, кумарин) наносили на
Исследуя способность родококков'деструк'
крышку перевернутой чашки Петри. Бактерии
торов ПАУ разлагать нафталин, мы обнаружи'
культивировали при 30 °C на чашках или в жид'
ли, что эти культуры росли в минеральной среде
кой среде на качалке (150 об/мин) в 750'мл кол'
с нафталином в качестве ростового субстрата,
бах Эрленмейера, содержавших 100 мл среды.
но не были способны к росту в минеральной
Интенсивность роста микроорганизмов оце'
среде с салицилатом. Целью данной работы яв'
нивали спектрофотометрически (UV'1800,
лялось изучение метаболизма нафталина у
«Shimadzu», Япония) по поглощению света при
штамма R. opacus 3D, выделенного из активного
длине волны 560 нм и/или подсчетом колониеоб'
ила очистных сооружений. Особое внимание
разующих единиц (КОЕ) в культуральной жид'
было уделено идентификации интермедиатов
кости. Количество клеток определяли методом
деградации нафталина, выявлению биохими'
10'кратных серийных разведений с последую'
ческих особенностей этого процесса и обнару'
щим высевом на агаризованную среду LB. Пробы
жению генов, потенциально вовлеченных в про'
отбирали в течение 3-5 сут через каждые 24 ч.
цесс разложения нафталина у данного штамма.
Начальная концентрация клеток для штамма
R. opacus 3D составляла 6,3 × 107 - 8,0 × 107 КОЕ/мл
(А560
0,28
±
0,02), а для P. chlororaphis
МЕТОДЫ ИССЛЕДОВАНИЯ
OV17(pOV17) - 2,2 × 108 - 2,6 × 108 КОЕ/мл
(А560 0,16 ± 0,02).
Реактивы. Для приготовления минеральных
Биомассу для определения в ней фермента'
сред были использованы реактивы фирм'произ'
тивных активностей выращивали на агаризо'
БИОХИМИЯ том 85 вып. 3 2020
МЕТАБОЛИЗМ НАФТАЛИНА ШТАММОМ R. opacus 3D
415
Таблица 1. Штаммы, использованные в данной работе, и их фенотипическая характеристика
Штамм
Источник выделения
Фенотип (окисляемые субстраты)
R. opacus 3D
активный ил очистных сооружений, г. Пущино, Москов'
Наф+Сал-Гент+о'Фт+ПКК+2ГКор+Кум+
ская обл., 2016
R. opacus 1СР
накопительная культура, поддерживаемая в течение
Наф+/-Сал-Гент+о'Фт+ПКК+2ГКор+Кум+
нескольких месяцев с 2,4'дихлорфенолом [39]
R. pyridinivorans
почва, загрязненная нефтепродуктами, Ливия [40]
Наф+Сал-Гент-о'Фт-ПКК+2ГКор+Кум+
5Ap (L5A'BSU)
R. wratislaviensis
штамм R. wratislaviensis G10 выделен из почвы, загрязнен'
Наф+Сал-Гент-о'Фт+ПКК-2ГКор+Кум+
G10'Ph
ной галогенсодержащими ароматическими соединениями
(ОАО «Галоген», Пермь) [41]; использованный в данной
работе вариант штамма не утилизировал салицилат
Rhodococcus sp.
донные отложения Балтийского моря, Финский залив,
Наф+Сал-Гент+о'Фт+ПКК+2ГКор+Кум+
K NAH1
д. Кандикюля [42]
Rhodococcus sp.
почва, загрязненная отходами нефтехимического произ'
Наф-Сал-Гент-о'Фт-ПКК+2ГКор-Кум-
Dop2*
водства, г. Стерлитамак, Башкортостан, 2000 г.
Pseudomonas
ризосфера растений, почва, загрязненная нефтью, Запад'
Наф+Сал+Гент-о'Фт-ПКК+2ГКор-Кум-
chlororaphis
ная Сибирь [43]
OV17(pOV17)
Примечание. Интермедиаты деградации нафталина добавляли в среду до конечной концентрации 0,2 г/л. Наф - нафта'
лин, Сал - салицилат, Гент - гентизат, о'Фт - о'фталат, ПКК - протокатеховая кислота, 2ГКор - 2'гидроксикоричная
кислота, Кум - кумарин.
* Штамм Rhodococcus sp. Dop2, обладающий фенотипом Наф-Сал-, был использован в работе в качестве отрицательного
контроля при проведении ПЦР.
ванной минеральной среде в парах нафталина в
ли с использованием OligoAnalyzer
3.1
течение трех суток. Штамм P. chlororaphis
OV17(pOV17) выращивали в жидкой минераль'
специфичности праймеров осуществляли в
ной среде в присутствии салицилата (0,5 г/л) в
течение 14 ч. Для определения активности фер'
primer'blast).
ментов в неиндуцированных клетках бактерии
Амплификацию генов проводили на прибо'
культивировали в жидкой минеральной среде,
ре GeneAmp PCR System
9700
(«Applied
содержавшей 0,5 г/л сукцината или глутамата.
Biosystems», США) при следующих условиях:
Клетки отмывали 0,05 М калий'фосфатным бу'
первичная денатурация - 95 °С, 5 мин; далее
фером (рН 7,0), ресуспендировали в 4-5 мл это'
30 циклов: 95 °С - 30 с, отжиг праймеров - 30 с
го буфера, добавляли дитиотрейтол до конечной
(температура отжига указана для каждой пары
концентрации 5 мМ, MnSO4 до конечной кон'
праймеров в табл. 2), 72 °С - 40 с; конечная
центрации 2 мМ, замораживали и хранили до
элонгация - 72 °С - 5 мин. Продукты реакции
использования при -20 °C.
разделяли методом электрофореза в агарозном
ПЦР анализ целевых генов. Выделение ДНК
геле (1,0%) при напряжении 10 В/см. Гель окра'
проводили с использованием набора реактивов
шивали раствором бромистого этидия
«DiatomtmDNAprep» («Биоком», Россия) со'
(5 мкг/мл) и фотографировали в УФ'свете с ис'
гласно рекомендациям фирмы'изготовителя.
пользованием системы гель'документирования
Олигонуклеотидные праймеры, использован'
Gel DocTM XR («Bio'Rad», США). Taq ДНК'по'
ные в работе, представлены в табл. 2.
лимераза, компоненты для ПЦР, концентриро'
Конструирование праймеров для амплифи'
ванный буфер для электрофореза и маркер
кации генов фталат'3,4'диоксигеназы (pht3,4DO)
GeneRuler 1 kb DNA Ladder (SM0311) были про'
и салицилат'1'гидроксилазы (sal1) осуществляли
изводства «Fermentas» (Литва).
с использованием программы PrimerQuest Tool
Секвенирование гена
16S рРНК штамма
R. opacus 3D и филогенетический анализ. Выделе'
Предсказание термодинамических параметров,
ние и очистку ПЦР'продукта гена, кодирующе'
третичных структур олигонуклеотидов проводи'
го 16S рРНК, осуществляли с использованием
БИОХИМИЯ том 85 вып. 3 2020
416
АНОХИНА и др.
Таблица 2. Праймеры, использованные в данной работе
Название
Нуклеотидная последовательность
Температура
Размер ПЦР'
Белок (целевой ген)
праймера
праймера (5′-3′)
отжига
продукта, п.н.
Ссылка
праймера, °C
Малая субъединица
27F
AGAGTTTGATCMTGGCTCAG
55
1465
[44]
рРНК (rrs)
1492R
TACGGHTACCTTGTTACGACTT
Нафталиндиокси'
Forward
GCATGAGAGTGAGATCCCC
55
211
[45]
геназа (ndo)
Reverse
ACTTCCCGTGTTGCTGTAG
Салицилат'1'
Forward
AGTGGGGCATCTTCGAYGMNATYGC
63
642
данная
гидроксилаза (sal)
Reverse
GTCGACCGGGTCGATRTCRTAVAC
работа
Фталат'3,4'
Forward
CGACAACCTGGTSYTCGCCA
54
688
данная
диоксигеназа
Reverse
TCTTCCAGTCGTAGTCGTACT
работа
(pht3,4DO)
Фталат'3,4'
Forward
ATGGAAGACATTCGCCGC
55
2056
[46]
диоксигеназа
Reverse
TCATAGGAACACCGCGAG
(ophA1A2)
Пирокатехин'2,3'
LK16
GAGGACCCGAGCGGAATCA
64
663
[47]
диоксигеназа (edoA)
LK14
GACCGCAGCGGCTACGGGT
Пирокатехин'2,3'
LK33
CGCATCGAGGCCACCGAC
61
306
[47]
диоксигеназа (edoB)
LK38
CGACGGGTCCTCGAACGTGA
Пирокатехин'2,3'
VD11
GGTTACATGGGCTTCGAG
58
1096
[47]
диоксигеназа (edoC)
VD14
CTCCGCCGACTTCTCCAG
Пирокатехин'2,3'
VD6
CTTCTACAAGCTCATGCC
64
403
[47]
диоксигеназа (edoD)
VD3
CCGGTCGCTGCCTCGAGC
Протокатехоат'3,4'
2F
TGCCCNTACCACGGCTG
59
300
[48]
диоксигеназа (pcaG<
2R
GCDCCGAKCTTCCAGTT
pcaH)
Протокатехоат'3,4'
pcaH_260f
CAACGCCGACATCGCCAA
54
489
[49]
диоксигеназа (pcaH)
pcaH_749r
GAATCCGACGGCCCAGTTGT
Пирокатехин'1,2'
cat4f
AAATTCAAGGGCGCAAG
52
720
[49]
диоксигеназа (catA2,
cat4r
GAGTTCGGGTTTCGTTG
GenBank FM877593.1)
Пирокатехин'1,2'
cat6f
CGACAAGTTCAAGGCCGAG
52
780
[49]
диоксигеназа (catA,
cat6r
CACGAAGTTGTAGGTGACGTAG
GenBank X99622.2)
набора ZymoClean Gel DNA Recovery Kit («Zymo
соответствующими последовательностями бли'
Research», США) согласно инструкциям фир'
жайших видов бактерий с помощью программы
мы'производителя. Секвенирование проводили
CLUSTAL W [50].
на автоматическом секвенаторе ABI Prism 373
Нуклеотидная последовательность фрагмен'
3130XL («Applied Biosystems», США).
та гена 16S рРНК штамма R. opacus 3D длиной
Предварительный филогенетический скри'
1374 п.н. помещена в GenBank под номером
нинг сходства нуклеотидных последовательнос'
MH553083.
тей генов 16S рРНК осуществляли в базе данных
Определение активностей ферментов в бескле
GenBank (NCBI) с помощью пакета программ
точных экстрактах. Клетки разрушали экструзи'
онной дезинтеграцией на прессе типа Хьюза
точного определения филогенетического поло'
(«ИБФМ'пресс», Россия) с рабочим давлением
жения исследуемого штамма полученную по'
3200 кг/см2. После дезинтеграции клеточный
следовательность гена 16S рРНК выравнивали с
дебрис удаляли центрифугированием (10 000 g,
БИОХИМИЯ том 85 вып. 3 2020
МЕТАБОЛИЗМ НАФТАЛИНА ШТАММОМ R. opacus 3D
417
4 °С, 30 мин) в присутствии следовых количеств
минеральной среде с нафталином, проводили с
ДНКазы. Супернатант использовали в качестве
помощью тонкослойной хроматографии (ТСХ)
бесклеточного экстракта для определения ак'
и масс'спектрометрии. Бактериальную культу'
тивностей ферментов. В реакционную смесь с
ру выращивали в жидкой минеральной среде с
конечным объемом 1,0 мл вносили 5-50 мкл
нафталином (1,0 г/л) или салицилатом (0,2 г/л)
экстракта. Определение активностей проводили
в качестве единственных источников углерода и
при 25 °С, начиная реакцию внесением бескле'
энергии. При культивировании штамма в мине'
точного экстракта, на спектрофотометре UV'1800
ральной среде с нафталином пробы (100 мл) от'
(«Shimadzu», Япония).
бирали при засеве и после одних, двух и трех су'
Активность нафталиндиоксигеназы опреде'
ток культивирования. В опыте, в котором в ка'
ляли спектрофотометрически по убыли NADH
честве ростового субстрата был использован са'
(«Sigma'Aldrich», Германия) (A340, ε 6220 М-1 см-1)
лицилат, пробы отбирали в момент засева и че'
в реакционной смеси, содержавшей 0,1 мМ
рез трое суток. Абиотическим контролем слу'
NADH и 0,1 мМ нафталин (спиртовой раствор),
жили образцы, содержавшие 0,2 г/л салици'
бесклеточный экстракт и 50 мМ фосфатный бу'
лата.
фер (рН 7,5), учитывая эндогенное потребление
Отобранные пробы экстрагировали 30 мл
NADH бесклеточным экстрактом [51].
этилацетата при интенсивном встряхивании,
Активность салицилат'1'гидроксилазы оп'
далее культуральную жидкость подкисляли HCl
ределяли спектрофотометрически по убыли
до pH 2,0 и повторно экстрагировали этилацета'
NADH (A340, ε 6220 М-1 см-1) в реакционной
том. Этилацетатную фракцию отбирали, обезво'
смеси, содержавшей 0,1 мМ NADH и 0,1 мМ са'
живали сульфатом натрия, упаривали и раство'
лицилат, бесклеточный экстракт и 50 мМ фос'
ряли в 200 мкл ацетона.
фатный буфер (рН 7,5), учитывая эндогенное
Для ТСХ применяли силикагелевые пласти'
потребление NADH бесклеточным экстрак'
ны с флуоресцентным индикатором («Fluka»,
том [52].
Германия) и систему растворителей бензол : ди'
Активность пирокатехин'2,3'диоксигеназы
оксан : уксусная кислота (90 : 10 : 2). Rf опреде'
определяли по скорости образования 2'гидрокси'
ляли как отношение подвижности метаболита к
муконового полуальдегида (A375, ε 33 400 М-1 см -1)
подвижности фронта. В качестве стандартов ис'
в реакционной смеси, содержавшей 0,25 мМ пи'
пользовали следующие соединения: нафталин,
рокатехин, бесклеточный экстракт и 50 мМ Tris'
салициловую кислоту, пирокатехин, протокате'
НСl'буфер (рН 7,5) [53].
ховую, гентизиновую и о'фталевую кислоты,
Активность пирокатехин'1,2'диоксигеназы
кумарин.
определяли по скорости образования цис,цис'
Суммарные экстракты анализировали мето'
муконата (A260, ε 16 900 М-1 см-1) в реакционной
дом масс'спектрометрии на приборе низкого
смеси, содержавшей 5 мМ ЭДТА, 0,25 мМ пиро'
разрешения LCQ Advantage MAX («Thermo'
катехин, бесклеточный экстракт и 50 мМ фос'
Finnigan», Германия) с использованием однока'
фатный буфер (рН 7,0) [53].
нального шприцевого насоса для прямой инфу'
Активность гентизат'1,2'диоксигеназы оп'
зии метанольного раствора образца в область хи'
ределяли по скорости образования малеилпиру'
мической ионизации при атмосферном давле'
вата (A330, ε 10 800 М-1 см-1) в реакционной сме'
нии (APCI). В ходе анализа применяли различ'
си, содержавшей 0,1 мМ гентизат, бесклеточный
ные условия работы источника ионов: нормали'
экстракт и 100 мМ калий'фосфатный буфер (рН
зованная энергия столкновений 10-40% при
7,4) [54].
скорости высушивающего газа 50 мл/мин и тем'
Активность протокатехоат'3,4'диоксигена'
пературе капилляра 240 °C. Масс'спектрометри'
зы определяли по убыли протокатехоата (A290,
ческие данные собирали и обрабатывали с по'
ε 2870 М-1 см-1) в реакционной смеси, содер'
мощью программного обеспечения XcaliburТМ.
жавшей 0,25 мМ протокатехоат и бесклеточный
Детекцию проводили как в положительных, так
экстракт в Tris'ацетатном буфере (рН 7,5) [55].
и в отрицательных ионах. MC/МС'спектры по'
Удельную активность ферментов выражали в
лучали, используя в качестве предшественников
микромолях потребленного субстрата или обра'
как протонированные [M+H]+, так и депрото'
зующегося продукта в минуту на 1 мг общего
нированные молекулы [M-H]-. Идентифика'
бактериального белка. Концентрацию белка оп'
цию метаболитов осуществляли с использова'
ределяли спектрофотометрически по модифи'
нием стандартных образцов исследуемых соеди'
цированному методу Бредфорда [56].
нений.
Определение интермедиатов деградации наф
Определение концентрации салициловой кис
талина. Анализ метаболитов, накапливающихся
лоты. Метод основан на способности салицила'
в культуральной жидкости при росте клеток в
та реагировать с нитратом железа (III) с образо'
БИОХИМИЯ том 85 вып. 3 2020
418
АНОХИНА и др.
ванием комплекса фиолетового цвета, интен'
вой, 2'карбоксикоричной, 2'гидроксикоричной
сивность окрашивания которого зависит от кон'
кислот и кумарина. Три из пяти проверенных
центрации салицилата [57]. Концентрацию са'
штаммов использовали в качестве источника уг'
лициловой кислоты определяли спектрофото'
лерода и энергии каждый из протестированных
метрически по калибровочной кривой с по'
субстратов, кроме салицилата (табл. 1). Один из
мощью спектрофотометра UV'1800 («Shimadzu»,
этих штаммов, R. opacus 3D, был отобран для
Япония). Для этого супернатант, полученный
дальнейших исследований.
после осаждения клеток (0,5 мл), разводили
Штамм R. opacus 3D (ВКМ Ac'2848) был вы'
дистиллированной водой до 3 мл. Затем добав'
делен ранее из активного ила сточных вод
ляли 0,5 мл 5%'ного раствора Fe(NO3)3 и 0,5 мл
очистных сооружений (г. Пущино, Московская
1%'ной HNO3. Пробирки инкубировали 10 мин
обл.) методом прямого высева на агаризованной
при комнатной температуре и измеряли опти'
минеральной среде с нафталином в качестве
ческую плотность раствора при 540 нм.
единственного ростового источника. Для опре'
Статистическая обработка данных. Средние
деления таксономического положения изолята
значения и стандартные ошибки среднего ариф'
была определена нуклеотидная последователь'
метического были получены по данным трех не'
ность гена 16S рРНК длиной 1374 п.н. Анализ
зависимых экспериментов с использованием
последовательности показал, что штамм отно'
программы Microsoft Excel 2007.
сится к классу Actinobacteria, роду Rhodococcus и
имеет высокий уровень сходства гена 16S рРНК
(99,93%) с типовым штаммом R. opacus DSM
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
43205 (LN827919). На основании полученных
данных штамм был отнесен нами к виду R. opa<
Рост бактерий рода Rhodococcus на минераль
cus. Последовательность гена 16S рРНК была
ной среде с нафталином и ароматическими
помещена в GenBank под номером MH553083.
субстратами - потенциальными интермедиатами
Культивирование R. opacus 3D в жидкой мине
его деградации. На первом этапе работы прове'
ральной среде с нафталином и салицилатом. Ди'
ряли способность бактерий'деструкторов наф'
намику роста штамма R. opacus 3D исследовали
талина, принадлежащих к роду Rhodococcus и
в жидкой минеральной среде с нафталином
выделенных ранее из различных загрязненных
(1,0 г/л) и салицилатом (0,2 г/л) в течение 72 ч
источников, к росту в минеральной среде с са'
(рис. 2). Через каждые 24 ч отбирали пробы для
лицилатом в качестве единственного источника
измерения поглощения света, количества КОЕ
углерода и энергии. Из пяти штаммов, утилизи'
и веса сухой биомассы.
рующих нафталин, ни один не рос в присут'
При культивировании штамма R. opacus 3D в
ствии салицилата. Факт, что ни один из родо'
минеральной среде с нафталином в качестве
кокков, утилизирующих нафталин, не разлагал
ростового субстрата количество КОЕ в начале
салицилат, позволил предположить, что у бакте'
эксперимента составляло 6,3 × 107 КОЕ/мл. Фа'
рий рода Rhodococcus имеется альтернативный
за активного роста культуры продолжалась в те'
путь деградации нафталина.
чение 24 ч культивирования (рис. 2, а, кривая 1).
Эти штаммы были проверены на способ'
За это время концентрация клеток достигала
ность расти в минеральной среде в присутствии
максимума и составляла 2,4 × 108 КОЕ/мл, что
других потенциальных, согласно литературным
соответствовало значению поглощения 1,3 о.е.
данным, интермедиатах разложения нафталина:
Результаты измерения прироста биомассы кле'
солей гентизиновой, о'фталевой, протокатехо'
ток приведены в табл. 3. Как видно из представ'
ленных данных, вес сухой биомассы к концу
эксперимента увеличился примерно на порядок
Таблица 3. Вес сухой биомассы штамма R. opacus 3D при
и составил (730 ± 40) мг/л.
культивировании в минеральной среде с нафталином и са'
Рост штамма R. opacus 3D отсутствовал в
лицилатом
жидкой минеральной среде, содержавшей сали'
цилат в диапазоне концентраций 0,1-1,0 г/л,
Вес сухой биомассы (мг/л)
Ростовой
при этом количество салицилата не снижалось в
субстрат
0 ч
24 ч
72 ч
процессе культивирования в течение 3-7 суток.
На рис. 2, а (кривая 2) приведены данные куль'
тивирования штамма при концентрации сали'
Нафталин (1 г/л)
80 ± 10
590 ± 30
730 ± 40
цилата 0,2 г/л. Показано, что в течение 72 ч экс'
Салицилат (0,2 г/л)
80 ± 10
н.о.
80 ± 10
перимента численность клеток незначительно
уменьшалась: 0 ч - 8,0 × 107 КОЕ/мл, 72 ч - 5,1 ×
Примечание. н.о. - не определяли.
× 107 КОЕ/мл.
БИОХИМИЯ том 85 вып. 3 2020
МЕТАБОЛИЗМ НАФТАЛИНА ШТАММОМ R. opacus 3D
419
Отсутствие роста R. opacus 3D в минеральной
среде с салицилатом может указывать на нали'
чие неполного пути окисления нафталина. В
этом случае следует ожидать накопления сали'
цилата в культуральной жидкости при выращи'
вании клеток в среде с нафталином. Однако ко'
личество салицилата при росте штамма R. opacus
3D в минеральной среде с нафталином, добав'
ленным в качестве единственного ростового
субстрата, было незначительным (3-10 мг/л) и
сохранялось на этом уровне в течение всего экс'
перимента (рис. 2, б). Следует отметить, что ко'
личество салицилата, внесенного в минераль'
ную среду в качестве единственного ростового
субстрата, также не уменьшалось. Исходя из по'
лученных данных, можно предположить, что
Рис. 3. Рост штамма P. chlororaphis OV17(pOV17) в мине'
ральной среде с нафталином и салицилатом (а) и содержа'
ние салицилата в среде (б); 1 - культивирование в присут'
ствии нафталина (1,0 г/л), 2 - культивирование в присут'
ствии салицилата (0,5 г/л)
утилизация нафталина у штамма R. opacus 3D не
включает образования салицилата в качестве
ключевого интермедиата и происходит по аль'
тернативному биохимическому пути.
Из'за отсутствия в коллекции штамма родо'
кокка, обладающего фенотипом Nah+Sal+, в ка'
честве контроля был использован штамм
P. chlororaphis OV17(pOV17), растущий в мине'
ральной среде с нафталином или салицилатом и
разлагающий нафталин по классическому для
грамотрицательных бактерий пути (рис. 1). При
культивировании штамма максимальный титр
клеток наблюдался к концу вторых суток и сос'
тавлял 8,5 × 109 КОЕ/мл при использовании
нафталина и 1,2 × 1010 КОЕ/мл при использова'
Рис. 2. Рост штамма R. opacus 3D в минеральной среде с нии салицилата (рис. 3). При этом концентра'
нафталином и салицилатом (а) и содержание салицилата в ция салицилата, образующегося в качестве ин'
среде (б); 1 - культивирование в присутствии нафталина
термедиата при утилизации нафталина псевдо'
(1,0 г/л), 2 - культивирование в присутствии салицилата
(0,2 г/л)
монадой, не превышала в среде 16 мг/л. При ис'
БИОХИМИЯ том 85 вып. 3 2020
420
АНОХИНА и др.
пользовании в качестве ростового субстрата в
но, что в экстрактах культуральной жидкости
концентрации 500 мг/л салицилат разлагался
штамма R. opacus 3D, выращенного в минераль'
полностью за 24 ч. Далее в культуральной жид'
ной среде с нафталином, накапливается целый
кости наблюдалось только остаточное количест'
ряд соединений (до 10 пятен в зависимости от
во субстрата (не более 8 мг/л).
времени культивирования). Эти соединения
Активность ферментов при росте культур в
различались по окрашиванию в видимом свете,
присутствии нафталина. Для изучения пути
УФ'флуоресценции и по значениям Rf. К треть'
окисления нафталина у R. opacus 3D были ис'
им суткам культивирования интенсивность не'
следованы активности ферментов, потенциаль'
которых пятен уменьшалась. Пятна с Rf 0,69
но вовлеченных в метаболизм этого соединения
(слабая интенсивность) и 0,75 были сходны по
(табл. 4). Было установлено, что активность ди'
значениям Rf и характеру флуоресценции с са'
оксигеназ: гентизат'1,2'диоксигеназы, пирока'
лицилатом и кумарином, которые использова'
техин'1,2' и 2,3'диоксигеназ, протокатехоат'
лись в качестве стандартов. При культивирова'
3,4'диоксигеназы - была незначительной. Пол'
нии штамма в присутствии салицилата в культу'
ностью отсутствовала активность салицилат'1'
ральной жидкости детектировалось только дан'
гидроксилазы и муконатциклоизомеразы. Та'
ное соединение.
ким образом, полученные данные свидетель'
Перечень метаболитов, идентифицирован'
ствовали об отсутствии индукции основных
ных методом масс'спектрометрии в экстрактах
ферментов деструкции нафталина. Для опреде'
культуральной жидкости, приведен в табл. 5.
ления уровня активности пула диоксигеназ в не'
Анализ экстрактов, полученных при выращива'
индуцированных клетках штамм R. opacus 3D
нии штамма R. opacus 3D в присутствии нафта'
выращивали в минеральной среде, содержав'
лина, показал, что после первых суток роста в
шей сукцинат (табл. 4). Величины удельной ак'
культуральной жидкости детектируются кума'
тивности сравниваемых ферментов в клетках,
рин, салициловая, о'фталевая и 2'карбоксико'
выращенных в минеральной среде с нафтали'
ричная кислоты. Максимальное содержание ку'
ном или сукцинатом в качестве ростовых
марина и о'фталевой кислоты наблюдалось на
субстратов, отличались незначительно, что ука'
вторые сутки, на третьи сутки эти соединения
зывает на то, что синтез этих ферментов носит
не обнаруживались. Салициловая кислота при'
конститутивный характер, и нафталин не явля'
сутствовала в течение всего периода культиви'
ется для них индуктором. У P. chlororaphis
рования (1-3 сутки), тогда как 2'гидроксико'
OV17(pOV17) при росте в минеральной среде с
ричная кислота была обнаружена только на
нафталином или салицилатом были ожидаемо
третьи сутки культивирования. В это же время в
определены активности 1СГ и обеих ПК'ДО
экстракте был выявлен ассоциат салициловой
(табл. 4). При этом активность ПК'2,3'ДО была
кислоты, накапливающийся в ростовой среде в
в 3-8 раз выше активности ПК'1,2'ДО.
виде димера (следовые количества). Протокате'
Идентификация интермедиатов разложения
ховая кислота, один из потенциальных метабо'
нафталина. При проведении ТСХ было показа'
литов пути деградации нафталина и о'фталевой
Таблица 4. Удельная активность ферментов биодеградации нафталина у штаммов R. opacus 3D и P. chlororaphis
OV17(pOV17)
Удельная активность, мкмоль/мин на 1 мг белка
Фермент
R. opacus 3D
P. chlororaphis OV17(pOV17)
нафталин
сукцинат
нафталин
салицилат
глутамат
СГ
< 0,001
< 0,001
0,011 ± 0,001
0,31 ± 0,06
0,011 ± 0,001
ПК'1,2'ДО
0,009 ± 0,003
0,006 ± 0,003
0,054 ± 0,009
0,043 ± 0,006
0,018 ± 0,001
ПК'2,3'ДО
0,007 ± 0,002
0,002 ± 0,000
0,456 ± 0,003
0,11 ± 0,01
0,28 ± 0,01
Г'1,2'ДО
0,002 ± 0,001
0,002 ± 0,001
н.о.
< 0,001
н.о.
ПКК'3,4'ДО
0,012 ± 0,009
0,021 ± 0,003
н.о
< 0,001
н.о.
МЦИ
< 0,001
< 0,001
н.о
н.о.
н.о.
Примечание. СГ - салицилатгидроксилаза; ПК'1,2'ДО - пирокатехин'1,2'диоксигеназа; ПК'2,3'ДО - пирокатехин'
2,3'диоксигеназа; Г'1,2'ДО - гентизат'1,2'диоксигеназа; ПКК'3,4'ДО - протокатехоат'3,4'диоксигеназа; МЦИ - муко'
натциклоизомераза; н.о. - не определяли.
БИОХИМИЯ том 85 вып. 3 2020
МЕТАБОЛИЗМ НАФТАЛИНА ШТАММОМ R. opacus 3D
421
Таблица 5. Масс'спектрометрическая характеристика интермедиатов, образующихся при культивировании штамма
R. opacus 3D в присутствии нафталина и салицилата
Визуальная оценка по
Энергия коллизии/молекулярный ион
интенсивности пиков
и характеристические пики в МС/МС'спектрах
Ростовой
Метаболит
(интенсивность, %)
субстрат
1'е сут
2'е сут
3'и сут
[M-H]-
[M+H]+
Нафталин
кумарин
+
++
-
-
28/147(100), 103(32)
(1,0 г/л)
салициловая кислота
+
+
+
28/137(100), 93(95)
21/139(90), 138(16), 121(100)
о'фталевая кислота
+
++
-
26/165(28), 121(100)
16/167(48), 149(100)
2'карбоксикоричная кислота
+
+
+
21/191(100), 147(85)
30/193(100), 175(32), 133(91)
2'гидроксикоричная кислота
-
следы
+
24/163(80), 119(100)
19/165(95), 147(100), 123(65)
ассоциат салициловой
-
-
следы
16/275(91), 137(100)
-
кислоты
Салицилат
салициловая кислота
н.о.
н.о.
+
28/137(100), 93(95)
21/139(90), 138(16), 121(100)
(0,2 г/л)
ассоциат салициловой
н.о.
н.о.
++
16/275(91), 137(100)
-
кислоты
Примечание. (++) - интенсивность 100%; (+) - интенсивность 30% по сравнению со 100%; (-) - метаболит не детекти'
ровался; н.о. - не определяли.
кислоты, не определялась в течение всего экспе'
ветствующего размера. У штамма Rhodococcus sp.
римента.
Dор2 с фенотипом Nah-Sal-, который служил
В экстрактах, полученных после трех суток
отрицательным контролем, продукты амплифи'
культивирования R. opacus 3D в присутствии
кации получены не были.
салицилата, указанные выше интермедиаты
Поскольку деградация нафталина осущест'
деградации нафталина не детектировались, за
вляется по двум основным путям - с салицило'
исключением салициловой кислоты и ее диме'
вой или о'фталевой кислотами в качестве цент'
ра. Количество димера было на 2 порядка боль'
ральных интермедиатов - проводили поиск ге'
ше, чем при культивировании штамма в присут'
нов, кодирующих потенциально вовлеченные в
ствии нафталина. В контроле (минеральная
эти пути ферменты. Использованные праймеры
среда с добавлением салицилата без бактерий)
не позволили выявить гены, ответственные за
димер салициловой кислоты не обнаруживал'
синтез 1СГ и фталат'3,4'диоксигеназы.
ся.
Дальнейшее расщепление интермедиатов
Гены деградации ароматических соединений
деградации салициловой или о'фталевой кислот
штамма R. opacus 3D. Для идентификации генов
может осуществляться с участием ферментов
деградации ароматических соединений у штам'
ПК'1,2'ДО и ПК'2,3'ДО (для салициловой
ма R. opacus 3D нами были использованы прай'
кислоты) и ПКК'3,4'ДО (для о'фталевой кис'
меры как описанные ранее, так и сконструиро'
лоты). У штамма R. opacus 3D были обнаружены
ванные в ходе настоящей работы (табл. 2). Ре'
гены, кодирующие ПК'1,2'ДО. Положитель'
зультаты определения генов, кодирующих наф'
ный ответ также был получен для генов се'
талин'1,2'диоксигеназу, салицилат'1'гидрокси'
мейств edoB и edoC, кодирующих ПК'2,3'ДО.
лазу, а также пирокатехин', фталат' и протока'
Кроме того, продукт амплификации был полу'
техоат'диоксигеназы родококков, приведены в
чен на матрице ДНК из штамма R. opacus 3D с
табл. 6.
праймерами, специфичными к гену pcaH, коди'
В биодеградации нафталина у бактерий клю'
рующему β'субъединицу протокатехоат'3,4'ди'
чевым ферментом является нафталиндиоксиге'
оксигеназы штамма R. opacus 1CP. Для других
наза. Для всех штаммов родококков, способных
штаммов родококков в ряде случаев также были
использовать нафталин в качестве ростового
получены соответствующие продукты, но в раз'
субстрата, были получены ПЦР'продукты соот'
личной комбинации.
БИОХИМИЯ том 85 вып. 3 2020
422
АНОХИНА и др.
Таблица 6. Гены, обнаруженные в штаммах родококков на основании ПЦР'анализа
Штамм
Ген
R. opacus 3D
R. pyridinivorans 5Ap
Rhodococcus sp. K NAH1
Rhodococcus sp. Dор2
ndo
+
+
+
-
sal1
-
-
-
-
pht3,4DO
-
-
-
-
ophA1A2
-
-
-
-
edoA
-
-
-
-
edoB
+
-
+
-
edoC
+
-
-
-
edoD
-
-
-
-
pcaG<pcaH
-
+
+
-
pcaH
+
-
+
-
catA2
+
-
+
-
catA
+
-
+
-
Примечание. Представленные гены кодируют следующие ферменты: ndo - нафталиндиоксигеназу; sal1 - салицилатгид'
роксилазу; pht3,4DO и ophA1A2 - фталатдиоксигеназу; edoA, edoB, edoC, edoD - пирокатехин'2,3'диоксигеназу; pcaG<pcaH
и pcaH - протокатехоат'3,4'диоксигеназу; catA2 и catA - пирокатехин'1,2'диоксигеназу.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Отсутствие деградативной активности по отно'
шению к салицилату также является общей чер'
Особенности метаболизма позволяют акти'
той этих штаммов.
нобактериям заселять экологические ниши, от'
Из литературных данных известно о не'
личные от мест обитания псевдомонад, или раз'
скольких штаммах бактерий рода Rhodococcus,
виваться в условиях, вынуждающих псевдомо'
не способных расти в присутствии салицилата.
над прекратить свой рост и перейти в состояние
Так, штаммы P200 и P400 бактерий R. rhodo<
покоя или переживания неблагоприятных усло'
chrous NCIMB 13064, утилизирующие нафта'
вий [58]. Кроме того, для родококков характер'
лин, практически не были способны расти в ми'
но большое количество путей периферического
неральной среде с салицилатом в концентрации
метаболизма [59]. Ферменты этих метаболичес'
1,0-10,0 мМ, и данное соединение не детекти'
ких путей трансформируют изначально разно'
ровалось в культуральной жидкости [61].
образные по строению соединения в относи'
Салицилат в концентрациях 0,01; 0,1 и 0,5%
тельно небольшое количество ключевых проме'
не поддерживал рост штамма R. opacus M213,
жуточных субстратов центрального метаболиз'
деструктора нафталина [58]. Рост на нафталине
ма ароматических соединений, превращение
также не сопровождался индукцией салицилат'
которых приводит к формированию интермеди'
гидроксилазы у данного штамма [31]. Авторы
атов цикла трикарбоновых кислот. Так, у штам'
предположили, что путь деградации нафталина
ма R. jostii RHA1 в геноме размером 9,7 МБ вы'
не включает салицилат в качестве интермедиата.
явлено 26 путей периферического метаболизма
Другие потенциальные метаболиты пути дегра'
и 8 путей центрального катаболизма аромати'
дации нафталина, такие как гентизат, карбокси'
ческих соединений [60]. Штаммы бактерий рода
бензальдегид, о'фталат, гидроксифталат и про'
Rhodococcus, использованные в данной работе,
токатехоат, являлись ростовыми субстратами
были выделены из удаленных друг от друга тер'
для штамма M213 [58]. В качестве интермедиа'
риторий, значительно отличающихся экологи'
тов деградации нафталина у этого штамма авто'
ческими условиями. Общей характеристикой
рами были обнаружены салициловый альдегид
этих штаммов является их способность исполь'
и салицилат (кроме пробы в нулевой момент), а
зовать большое количество ароматических сое'
также метаболиты о'фталатного пути: коричная
динений в качестве источников углерода и энер'
кислота, 2'карбокси' и 2'гидроксикоричные
гии, в т.ч. нафталин, что позволяет предполо'
кислоты, кумарин, гидрокумарин и фталевый
жить наличие в их геномах гомологичных генов.
альдегид. Исследуемый штамм R. opacus 3D так'
БИОХИМИЯ том 85 вып. 3 2020
МЕТАБОЛИЗМ НАФТАЛИНА ШТАММОМ R. opacus 3D
423
же рос в минеральной среде с кумарином, ген'
минеральной среде с нафталином, присутство'
тизатом, о'фталатом, 2'гидроксикоричной кис'
вали активности протокатехоат'3,4'диоксиге'
лотой и протокатехоатом (табл. 1), что свиде'
назы, гентизат'1,2'диоксигеназы и ПК'1,2'ДО.
тельствует о наличии гомологичных ферментов
Активность ПК'2,3'ДО отсутствовала. На ос'
и путей деструкции ароматических соединений
новании полученных результатов авторы сдела'
у штаммов R. opacus 3D и M213. Из литератур'
ли вывод, что важную роль в разложении наф'
ных и полученных нами данных по идентифика'
талина R. ruber OA1 играет путь превращения
ции метаболитов методом масс'спектрометрии
протокатехоата [48]. Авторы провели гетероло'
можно заключить, что у штаммов R. opacus 3D и
гичную экспрессию генов катаболизма прото'
M213 путь деградации нафталина включает об'
катехоата. Однако в статье не представлено од'
разование в качестве интермедиатов 2'карбокси',
нозначных доказательств того, что путь дегра'
2'гидроксикоричных, о'фталевой кислот и ку'
дации нафталина данным штаммом включает
марина (табл. 5).
образование протокатехоата как одного из ин'
Низкая активность ферментов 1СГ, ПК'1,2'
термедиатов, т.к. ПКК, в отличие от о'фталевой
ДО, ПК'2,3'ДО и ГДО, отвечающих за деструк'
и салициловой кислот, не была идентифициро'
цию нафталина, в бесклеточном экстракте
вана. Несмотря на то что активность ПКК'3,4'
штамма R. opacus 3D также дает основание пред'
ДО в клетках, выращенных в минеральной сре'
положить, что деградация нафталина у исследу'
де с нафталином, была относительно велика
емого штамма не включает образование салици'
(0,127 мкмоль/мин на 1 мг белка), данные по
лата.
уровню активности этого фермента в неиндуци'
В противоположность родококку у P. chloro<
рованных клетках отсутствуют, что не дает воз'
raphis OV17(pOV17) активности 1СГ, ПК'1,2'ДО
можности сравнить уровень активности фер'
и ПК'2,3'ДО в клетках, выращенных в присут'
мента в индуцированных и неиндуцированных
ствии нафталина и салицилата, превосходили
клетках [48].
активности этих ферментах в клетках, выращен'
Таким образом, анализ литературы позволя'
ных в присутствии глутамата, что указывает на
ет сделать заключение, что на данный момент
их индуцибельный синтез при деструкции наф'
описано только три штамма бактерий рода
талина (табл. 4).
Rhodococcus, не способных разлагать салицилат
Анализ литературных данных показал, что в
при наличии фенотипа Nah+. Это два производ'
бесклеточном экстракте штаммов P200 и P400
ных штамма R. rhodochrous NCIMB 13064 [61] и
бактерий R. rhodochrous NCIMB 13064, выра'
штамм R. opacus M213 [58]. Описанный в данной
щенных в минеральной среде с нафталином, оп'
работе штамм R. opacus 3D близок к сравнивае'
ределялась активность нафталиндиоксигеназы
мым штаммам по фенотипическим характерис'
и нафталин'цис'диолдегидрогеназы, а также
тикам. Особенностью штамма R. opacus 3D, от'
низкая активность пирокатехин'1,2' и '2,3'ди'
личающей его от всех описанных ранее штам'
оксигеназ [61]. Причем в одном из штаммов,
мов, является его реакция на салицилат при
P400, активность ПК'1,2'ДО была сравнима с
культивировании как с нафталином, так и с
активностью этого фермента в клетках, выра'
этим субстратом. Штамм R. opacus 3D способен
щенных в минеральной среде с пируватом. Ак'
к образованию салицилата из нафталина. Одна'
тивности 1СГ и ГДО обнаружены не были. Ав'
ко клетки трансформируют его в ассоциат, сос'
торы предположили, что ПК'1,2'ДО, в отличие
тоящий из двух молекул салициловой кислоты,
от ПК'2,3'ДО, может не участвовать в деграда'
вероятно, для предотвращения аккумуляции
ции нафталина у штамма R. rhodochrous [61].
этого соединения в среде. Данная реакция в
В отличие от штаммов R. opacus 3D, R. opacus
абиотических условиях не происходит. Этот
M213 и R. rhodochrous P200 и P400, штамм
факт говорит в пользу микробной трансформа'
R. ruber OA1, выделенный из очистных сооруже'
ции мономера салицилата в димер. Возможное
ний фармакологического предприятия, спосо'
объяснение этого процесса - перевод салицила'
бен утилизировать не только нафталин, но и са'
та в форму, которая не позволяет данному сое'
лицилат в качестве единственных ростовых ис'
динению конкурировать за активный центр
точников [48]. Проведенные исследования по'
ферментов, участвующих в превращении нафта'
казали, что о'фталевая и салициловая кислоты
лина по пути образования о'фталевой кислоты,
были интермедиатами разложения нафталина.
с их целевыми субстратами. Однако это предпо'
Эти вещества обнаруживались на 6'й день куль'
ложение требует проверки.
тивирования клеток с нафталином, далее их ко'
На сходство метаболических активностей у
личество снижалось к 16'м суткам. Определение
родококков указывают и данные ПЦР'анализа.
активности ферментов в бесклеточном экстрак'
Разрыв кольца является важной стадией в аэ'
те показало, что у R. ruber OA1, выращенного в
робной деградации ароматических соединений,
БИОХИМИЯ том 85 вып. 3 2020
424
АНОХИНА и др.
в т.ч. пирокатехинов и их производных. Разрыв
дококками. Для штамма R. ruber OA1, утилизи'
кольца катализируется ферментами, которые
рующего и нафталин, и салицилат, было пред'
делятся на два класса: интрадиольные диоксиге'
положено, что путь превращения нафталина
назы (типичный представитель - пирокатехин'
включает образование фталата и протокатехоата
1,2'диоксигеназа) и экстрадиольные диоксиге'
[48]. о'Фталат был идентифицирован в культу'
назы (типичный представитель - пирокатехин'
ральной жидкости, протокатехоат обнаружен не
2,3'диоксигеназа). В литературе они рассматри'
был. Потенциально образование протокатехоа'
ваются как ключевые ферменты деградации
та подтверждается высоким уровнем активнос'
нафталина. Согласно классификации, основан'
ти ПКК'3,4'ДО. Штаммы R. rhodochrous
ной на анализе нуклеотидных последователь'
NCIMB 13064 [61] и R. opacus M213 [58] не спо'
ностей, гены экстрадиольных диоксигеназ мож'
собны утилизировать салицилат, но разлагают
но разделить на два типа: тип I (семейства edoA,
нафталин. Путь деградации нафталина штам'
edoB, edoC) и тип II (edoD) [47]. Для многих
мом R. opacus M213 включает образование
штаммов родоккоков описаны случаи наличия
о'фталата. Но и в этом случае ПКК не была оп'
генов семейства edo в разных сочетаниях. Извест'
ределена в культуральной жидкости. Путь де'
ны штаммы, у которых присутствуют все четыре
градации нафталина, включающий формирова'
типа ПК'2,3'ДО. У изучаемого штамма R. opacus
ние o'фталата и протокатехоата, а не пар «сали'
3D обнаружены ПК'2,3'ДО только двух типов.
цилат-гентизат» или «салицилат-пирокате'
ПЦР'продукт для гена фталат'3,4'диоксиге'
хин», был показан для двух грамположительных
назы не был обнаружен ни у одного из исследу'
бактерий Bacillus thermoleovorans Hamburg 2 и
емых в данной работе штаммов'деструкторов
Geobacillus sp. G27 [63, 64]. о'Фталат и ПКК бы'
нафталина. Одна из возможных причин этого
ли определены как интермедиаты нового пути
состоит в высокой специфичности праймеров,
разложения антрацена штаммом Mycobacterium
использованных в работе. Первоначально нами
sp. LB501T [65]. Отсутствие продукта амплифи'
были использованы праймеры, разработанные
кации гена фталат'3,4'диоксигеназы и протока'
для штамма Rhodococcus sp. DK17, которые не
техоата в культуральной жидкости наряду с низ'
позволили получить ПЦР'продукт ожидаемого
кой активностью ПКК'3,4'ДО в выращенной в
размера. Использование новой пары прайме'
присутствии нафталина биомассе штамма
ров, специально синтезированных в ходе вы'
R. opacus 3D указывают на то, что путь деграда'
полнения данной работы, для гена фталат'3,4'
ции нафталина у данного штамма на этапе
диоксигеназы также не позволило получить
трансформации фталата отличается от описан'
ожидаемого ампликона. Эта пара праймеров
ных в литературе вариантов. Определение ин'
была разработана на основе ограниченного чис'
термедиатов этого пути является целью даль'
ла последовательностей, извлеченных из базы
нейших исследований.
данных для представителей разных видов рода
Полученные в настоящей работе данные
Rhodococcus. Предполагается, что для детекции
указывают на то, что для бактерий рода
этого гена необходимы праймеры, обладающие
Rhodococcus разложение нафталина через сали'
высокой видовой специфичностью. Как показа'
цилат является менее характерным, чем по пути
но в работе Anastasi et al. [62], родококки можно
образования о'фталата, кумарина и коричных
разделить на пять филогенетически отдельных
кислот. Однако чрезвычайно ограниченная ин'
групп на основании полногеномного секвени'
формация о путях деструкции нафталина родо'
рования. Штаммы, принадлежащие к виду
кокками не является основанием для вывода о
R. opacus, образуют отдельную группу. Отсут'
том, какой путь преобладает, и данный вопрос
ствие в базе данных достаточного количества
также требует дальнейшего детального изуче'
последовательностей гена фталат'3,4'диоксиге'
ния.
назы для штаммов этой группы не позволило
корректно подобрать праймеры. Тем не менее
способность использовать соль о'фталевой кис'
Финансирование. Работа выполнена при час'
лоты в качестве единственного ростового
тичной финансовой поддержке Российского
субстрата и динамика метаболитов указывают
фонда фундаментальных исследований (грант
на то, что путь деструкции нафталина штаммом
№ 18'34'00964).
R. opacus 3D включает образование этого соеди'
Благодарности. Авторы искренне благодарят
нения, и гены для его трансформации должны
к.б.н. М.И. Чернявскую (Белорусский государ'
присутствовать в геноме.
ственный университет, г. Минск, Республика
Полученные данные позволяют выдвинуть
Беларусь) за предоставление штамма R. pyri<
еще одно предположение, касающееся особен'
dinivorans 5Ap (L5A'BSU) и д.б.н. Е.Г. Плотни'
ностей метаболизма о'фталата и нафталина ро'
кову (Институт экологии и генетики микроор'
БИОХИМИЯ том 85 вып. 3 2020
МЕТАБОЛИЗМ НАФТАЛИНА ШТАММОМ R. opacus 3D
425
ганизмов УрО РАН, г. Пермь, Россия) за предос'
Соблюдение этических норм. Настоящая
тавление штамма R. wratislaviensis G10.
статья не содержит описания выполненных ав'
Конфликт интересов. Авторы заявляют об от'
торами исследований с участием людей или ис'
сутствии конфликта интересов.
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Juhasz, A.L., and Naidu, R. (2000) Bioremediation of high
teria, Appl. Microbiol. Biotechnol.,
55,
609-618,
molecular weight PAHs: a review of the microbial degrada'
doi: 10.1007/s002530000489.
tion of benzo[a]pyrene, Int. Biodeterior. Biodegrad., 45,
15.
Kauppi, B., Lee, K., Carredano, E., Parales, R.E., and
57-88, doi: 10.1016/S0964'8305(00)00052'4.
Gibson, D.T. (1998) Structure of an aromatic ring'
2.
Fonger, G.C., Hakkinen, P., Jordan, S., and Publicker, S.
hydroxylating dioxygenase naphthalene 1,2'dioxygenase,
(2014) The National Library of Medicine’s (NLM)
Structure, 6, 571-586, doi: 10.1016/s0969'2126(98)00059'8.
Hazardous Substances Data Bank (HSDB): background,
16.
Parales, R.E., Parales, J.V., and Gibson, D.T.
(1999)
recent enhancements and future plans, Toxicology, 325,
Aspartate 205 in the catalytic domain of naphthalene
209-216, doi: 10.1016/j.tox.2014.09.003.
dioxygenase is essential for activity, J. Bacteriol., 181,
3.
Davies, J.I., and Evans, W.C. (1964) Oxidative metabolism
1831-1837.
of naphthalene nucleus by soil pseudomonads - ring fis'
17.
Bosch, R., Moore, E.R., Garcia'Valdes, E., and Pieper, D.H.
sion mechanism, Biochem. J., 91, 251-261, doi: 10.1042/
(1999) NahW, a novel, inducible salicylate hydroxylase
bj0910251.
involved in mineralization of naphthalene by Pseudomonas
4.
Jeffrey, A.M., Yeh, H.J., Jerina, D.M., Patel, T.R., Davey, J.F.,
stutzeri AN10, J. Bacteriol., 181, 2315-2322.
and Gibson, D.T. (1975) Initial reactions in the oxidation
18.
Eaton, R.W., and Chapman, P.J. (1992) Bacterial metabo'
of naphthalene by Pseudomonas putida, Biochemistry, 14,
lism of naphthalene: construction and use of recombinant
575-584, doi: 10.1021/bi00674a018.
bacteria to study ring cleavage of 1,2'dihydroxynaphtha'
5.
Patel, T.R., and Barnsley, E.A. (1980) Naphthalene metab'
lene and subsequent reactions, J. Bacteriol.,
174,
olism by pseudomonads: purification and properties of 1,2'
7542-7554, doi: 10.1128/jb.174.23.7542'7554.1992.
dihydroxynaphthalene dioxygenase, J. Bacteriol., 143,
19.
Fuenmayor, S.L., Wild, M., Boyes, A.L., and Williams, P.A.
668-673.
(1998) A gene cluster encoding steps in conversion of
6.
Assinder, S.J., and Williams, P.A. (1988) Comparison of
naphthalene to gentisate in Pseudomonas sp. strain U2, J.
the meta pathway operons on NAH plasmid pWW60'22
Bacteriol., 180, 2522-2530.
and TOL plasmid pWW53'4 and its evolutionary signifi'
20.
Hickey, W.J., Sabat, G., Yuroff, A.S., Arment, A.R., and
cance, J. Gen. Microbiol., 134, 2769-2778, doi: 10.1099/
Perez'Lesher, J. (2001) Cloning, nucleotide sequencing,
00221287'134'10'2769.
and functional analysis of a novel, mobile cluster of
7.
Rossello'Mora, R.A., Lalucat, J., and Garcia'Valdes, E.
biodegradation genes from Pseudomonas aeruginosa strain
(1994) Comparative biochemical and genetic analysis of
JB2, Appl. Environ. Microbiol.,
67,
4603-4609,
naphthalene degradation among Pseudomonas stutzeri
doi: 10.1128/aem.67.10.4603'4609.2001.
strains, Appl. Environ. Microbiol., 60, 966-972.
21.
Lee, J., Min, K.R., Kim, Y.C., Kim, C.K., Lim, J.Y.,
8.
Tay, M., Roizman, D., Cohen, Y., Tolker'Nielsen, T.,
Yoon, H., Min, K.H., Lee, K.S., and Kim, Y. (1995)
Givskov, M., and Yang, L. (2014) Draft genome sequence
Cloning of salicylate hydroxylase gene and catechol 2,3'
of the model naphthalene'utilizing organism Pseudomonas
dioxygenase gene and sequencing of an intergenic
putida OUS82, Genome Announc.,
2, e01161'13,
sequence between the two genes of Pseudomonas putida
doi: 10.1128/genomeA.01161'13.
KF715, Biochem. Biophys. Res. Commun., 211, 382-388,
9.
Yen, K.M., and Serdar, C.M. (1988) Genetics of naphtha'
doi: 10.1006/bbrc.1995.1825.
lene catabolism in pseudomonads, Crit. Rev. Microbiol., 15,
22.
Feng, Y., Khoo, H.E., and Poh, C.L. (1999) Purification
247-268.
and characterization of gentisate 1,2'dioxygenases from
10.
Кочетков В.В., Балакшина В.В., Мордухова Е.А., Бо'
Pseudomonas alcaligenes NCIB 9867 and Pseudomonas
ронин А.М. (1997) Плазмиды биодеградации нафта'
putida NCIB
9869, Appl. Environ. Microbiol.,
65,
лина в ризосферных бактериях рода Pseudomonas,
946-950.
Микробиология, 66, 211-216.
23.
Chua, C.H., Feng, Y., Yeo, C.C., Khoo, H.E., and Poh, C.L.
11.
Sevastsyanovich, Y.R., Krasowiak, R., Bingle, L.E.H.,
(2001) Identification of amino acid residues essential for
Haines, A.S., Sokolov, S.L., Kosheleva, I.A., Leuchuk, A.A.,
catalytic activity of gentisate
1,2'dioxygenase from
Titok, M.A., Smalla, K., and Thomas, C.M. (2008)
Pseudomonas alcaligenes NCIB 9867, FEMS Microbiol.
Diversity of IncP'9 plasmids of Pseudomonas, Microbiology,
Lett., 204, 141-146, doi: 10.1007/s10529'007'9421'7.
154, 2929-2941, doi: 10.1099/mic.0.2008/017939'0.
24.
Zhou, N.Y., Fuenmayor, S.L., and Williams, P.A. (2001)
12.
Kiyohara, H., Torigoe, S., Kaida, N., Asaki, T., Iida, T.,
nag genes of Ralstonia (formerly Pseudomonas) sp. strain U2
Hayashi, H., and Takizawa, N. (1994) Cloning and charac'
encoding enzymes for gentisate catabolism, J. Bacteriol.,
terization of a chromosomal gene cluster, pah, that encodes
183, 700-708, doi: 10.1128/JB.183.2.700'708.2001.
the upper pathway for phenanthrene and naphthalene uti'
25.
Goetz, F.E., and Harmuth, L.J. (1992) Gentisate pathway
lization by Pseudomonas putida OUS82, J. Bacteriol., 176,
in Salmonella typhimurium: metabolism of m'hydroxyben'
2439-2443, doi: 10.1128/jb.176.8.2439'2443.1994.
zoate and gentisate, FEMS Microbiol. Lett., 76, 45-49,
13.
Meyer, S., Moser, R., Neef, A., Stahl, U., and Kampfer, P.
doi: 10.1016/0378'1097(92)90361'q.
(1999) Differential detection of key enzymes of polyaro'
26.
Civilini, M., de Bertoldi, M., and Tell, G.
(1999)
matic'hydrocarbon'degrading bacteria using PCR and
Molecular characterization of Pseudomonas aeruginosa
gene probes, Microbiology, 145, 1731-1741, doi: 10.1099/
2NR degrading naphthalene, Lett. Appl. Microbiol., 29,
13500872'145'7'1731.
181-186, doi: 10.1046/j.1365'2672.1999.00613.x.
14.
Moser, R., and Stahl, U. (2001) Insights into the genetic
27.
Старовойтов И.И., Нефедова М.Ю., Яковлев Г.И., Зя'
diversity of initial dioxygenases from PAH'degrading bac'
кун А.М., Аданин В.М. (1975) Гентизиновая кислота -
9 БИОХИМИЯ том 85 вып. 3 2020
426
АНОХИНА и др.
продукт микробного окисления нафталина, Известия
43.
Anokhina, T.O., Volkova, O.V., Puntus, I.F., Filonov, A.E.,
АН СССР Сер. хим., 9, 2091-2092.
Kochetkov, V.V., and Boronin, A.M. (2006) Plant growth'
28.
Monticello, D.J., Bakker, D., Schell, M., and Finnerty, W.R.
promoting Pseudomonas bearing catabolic plasmids: naph'
(1985) Plasmid'borne TnS insertion mutations resulting in
thalene degradation and effect on plants, Process
accumulation of gentisate from salicylate, Appl. Environ.
Biochemistry, 41, 2417-2423, doi: 10.1016/j.procbio.2006.
Microbiol., 49, 761-764.
06.026.
29.
Fu, W., and Oriel, P. (1998) Gentisate 1,2'dioxygenase
44.
Lane, D.J. (1991) 16S/23S rRNA sequencing, in: Nucleic
from Haloferax sp. D1227, Extremophiles, 2, 439-446,
acid techniques in bacterial systematic (Stackebrandt, E.,
doi: 10.1007/s007920050090.
and Goodfellow, M., eds), John Wiley and Sons, New
30.
Werwath, J., Arfmann, H.A., Pieper, D.H., Timmis, K.N.,
York, NY, pp. 115-175.
and Wittich, R.M. (1998) Biochemical and genetic charac'
45.
Subashchandrabose, S.R., Venkateswarlu, K., Naidu, R.,
terization of a gentisate
1,2'dioxygenase from
and Megharaj, M. (2019) Biodegradation of high'molecu'
Sphingomonas sp. strain RW5, J. Bacteriol.,
180,
lar weight PAHs by Rhodococcus wratislaviensis strain 9:
4171-4176.
overexpression of amidohydrolase induced by pyrene and
31.
Uz, I., Duan, Y.P., and Ogram, A. (2000) Characterization
BaP, Sci. Total Environ., 651, 813-821, doi: 10.1007/978'
of the naphthalene'degrading bacterium, Rhodococcus
3'030'24035'6_3.
opacus M213, FEMS Microbiol. Lett., 185, 231-238,
46.
Choi, K.Y., Kim, D., Sul, W.J., Chae, J.C., Zylstra, G.J.,
doi: 10.1111/j.1574'6968.2000.tb09067.x.
Kim, Y.M., and Kim, E. (2005) Molecular and biochemi'
32.
Auffret, M., Labbe, D., Thouand, G., Greer, C.W., and
cal analysis of phthalate and terephthalate degradation by
Fayolle'Guichard, F. (2009) Degradation of a mixture of
Rhodococcus sp. strain DK17, FEMS Microbiol. Lett., 252,
hydrocarbons, gasoline, and diesel oil additives by
207-213, doi: 10.1016/j.femsle.2005.08.045.
Rhodococcus aetherivorans and Rhodococcus wratislaviensis,
47.
Kulakov, L.A., Delcroix, V.A., Larkin, M.J., Ksenzenko, V.N.,
Appl. Environ. Microbiol., 75, 7774-7782, doi: 10.1128/
and Kulakova, A.N. (1998) Cloning of new Rhodococcus
AEM.01117'09.
extradiol dioxygenase genes and study of their distribution
33.
Larkin, M.J., Kulakov, L.A., and Allen, C.C.
(2005)
in different Rhodococcus strains, Microbiology,
144,
Biodegradation and Rhodococcus - masters of catabolic
955-963, doi: 10.1099/00221287'144'4'955.
versatility, Curr. Opin. Biotechnol.,
16,
282-290,
48.
Li, C., Zhang, C., Song, G., Liu, H., Sheng, G., Ding, Z.,
doi: 10.1016/j.copbio.2005.04.007.
Wang, Z., Sun, Y., Xu, Y., and Chen, J.
(2016)
34.
Dong, L., Nakashima, N., Tamura, N., and Tamura, T.
Characterization of a protocatechuate catabolic gene clus'
(2004) Isolation and characterization of the Rhodococcus
ter in Rhodococcus ruber OA1 involved in naphthalene
opacus thiostrepton'inducible genes tipAL and tipAS: appli'
degradation,
Ann.
Microbiol.,
66,
469-478,
cation for recombinant protein expression in Rhodococcus,
doi: 10.1007/s13213'015'1132'z.
FEMS Microbiol. Lett., 237, 35-40, doi: 10.1016/j.fem'
49.
Соляникова И.П., Борзова О.В., Емельянова Е.В.,
sle.2004.06.012.
Шумкова Е.С., Присяжная Н.В., Плотникова Е.Г., Го'
35.
Kulakov, L.A., Chen, S., Allen, C.C., and Larkin, M.J.
ловлева Л.А. (2016) Диоксигеназы, индуцирующиеся
(2005) Web'type evolution of Rhodococcus gene clusters
при разложении бензоата деструкторами хлорбифе'
associated with utilization of naphthalene, Appl. Environ.
нилов Rhodococcus wratislaviensis G10 и хлорфенолов
Microbiol., 71, 1754-1764, doi: 10.1007/978'3'642'
Rhodococcus opacus 1CP, и гены, потенциально вовле'
12937'7_3.
ченные в этот процесс, Биохимия, 81, 1239-1253.
36.
Grund, E., Denecke, B., and Eichenlaub, R. (1992)
50.
Thompson, J.D., Higgins, D.G., and Gibson, T.J. (1994)
Naphthalene degradation via salicylate and gentisate by
CLUSTAL W: improving the sensitivity of progressive mul'
Rhodococcus sp. strain B4, Appl. Environ. Microbiol., 58,
tiple sequence alignment through sequence weighting,
1874-1877.
position'specific gap penalties and weight matrix choice,
37.
Allen, C., Boyd, D., and Larkin, M. (1997) Metabolism of
Nucleic Acids Res.,
22,
4673-4680, doi:
10.1093/
naphthalene,
1'naphthol, indene, and indole by
nar/22.22.4673.
Rhodococcus sp. strain NCIMB 12038, Appl. Environ.
51.
Dua, R.D., and Meera, S. (1981) Purification and charac'
Microbiol., 63, 151-155.
terisation of naphthalene oxygenase from Corynebacterium
38.
Larkin, M.J., and Day, M.J. (1986) The metabolism of car'
renale, Eur. J. Biochem., 120, 461-465, doi: 10.1111/
baryl by three bacterial isolates, Pseudomonas spp.
j.1432'1033.1981.tb05724.x.
(NCBI12042 and
12043) and Rhodococcus sp.
52.
Shamsuzzaman, K.M., and Barnsley, E.A. (1974) The reg'
(NCIB12038) from garden soil, J. Appl. Bacteriol., 60,
ulation of naphthalene oxygenase in pseudomonads, J. Gen.
233-242, doi: 10.1111/j.1365'2672.1986.tb01078.x.
Microbiol., 83, 165-170, doi: 10.1099/00221287'83'1'165.
39.
Горлатов С.Н., Мальцева О.В., Шевченко В.Л., Голов'
53.
Hegeman, G.D. (1966) Synthesis of the enzymes of the
лева Л.А. (1989) Разложение хлорфенолов культурой
mandelate pathway by Pseudomonas putida. I. Synthesis of
Rhodococcus erythropolis, Микробиология, 58, 802-806.
enzymes by the wild type, J. Bacteriol., 91, 1140-1154.
40.
Чернявская М.И. (2016) Характеристика штаммов
54.
Crawford, R.L., Hutton, S.W., and Chapman, P.J. (1975)
нафталинутилизирующих бактерий рода Rhodococcus,
Purification and properties of gentisate 1,2'dioxygenase
Труды БГУ. Физиологические, биохимические и молеку<
from Moraxella osloensis, J. Bacteriol., 121, 794-799.
лярные основы функционирования биосистем,
11,
55.
Fujisawa, H., and Hayaishi, O. (1968) Protocatechuate
190-197.
3,4'dioxygenase. I. Crystallization and characterization, J.
41.
Плотникова Е.Г., Рыбкина Д.О., Ананьина Л.Н., Яст'
Biol. Chem., 243, 2673-2681.
ребова О.В., Демаков В.А. (2006) Характеристика
56.
Schlomann, M., Schmidt, E., and Knackmuss, H.J. (1990)
микроорганизмов, выделенных из техногенных почв
Different types of dienelactone hydrolase in 4'fluoroben'
Прикамья, Экология, 4, 261-268.
zoate'utilizing bacteria, J. Bacteriol., 172, 5112-5118,
42.
Измалкова Т.Ю., Гафаров А.Б., Сазонова О.И., Соко'
doi: 10.1128/jb.172.9.5112'5118.1990.
лов С.Л., Кошелева И.А., Боронин А.М. (2018) Разно'
57.
Кулакова А.Н. (1988) Природа генетического контроля
образие микроорганизмов'нефтедеструкторов Финс'
катаболизма нафталина и салициловой кислоты у
кого залива Балтийского моря в зимний и летний пе'
штамма Pseudomonas putida BSA202. Дис. канд. биол.
риоды, Микробиология, 87, 204-214.
наук, ИБФМ, Пущино.
БИОХИМИЯ том 85 вып. 3 2020
МЕТАБОЛИЗМ НАФТАЛИНА ШТАММОМ R. opacus 3D
427
58.
Pathak, A., Chauhan, A., Blom, J., Indest, K.J., Jung, C.M.,
biodegradative abilities, FEMS Microbiol. Lett., 145,
Stothard, P., Bera, G., Green, S.J., and Ogram, A. (2016)
227-231, doi: 10.1111/j.1574'6968.1996.tb08582.x.
Comparative genomics and metabolic analysis reveals
62. Anastasi, E., MacArthur, I., Scortti, M., Alvarez, S.,
peculiar characteristics of Rhodococcus opacus strain M213
Giguere, S., and Vazquez'Boland, J.A. (2016) Pangenome
particularly for naphthalene degradation, PLoS One, 11,
and phylogenomic analysis of the pathogenic actinobac'
e0161032, doi: 10.1371/journal.pone.0161032.
terium Rhodococcus equi, Genome Biol. Evol.,
8,
59.
Martinkova, L., Uhnakova, B., Patek, M., Nesvera, J., and
3140-3148, doi: 10.1007/s00203'019'01695'z.
Kren, V. (2009) Biodegradation potential of the genus
63. Annweiler, E., Richnow, H.H., Antranikian, G.,
Rhodococcus, Environ. Int., 35, 162-177, doi: 10.1016/
Hebenbrock, S., Garms, C., Franke, S., Francke, W., and
j.envint.2008.07.018.
Michaelis, W. (2000) Naphthalene degradation and incorpora'
60.
McLeod, M.P., Warren, R.L., Hsiao, W.W., Araki, N.,
tion of naphthalene'derived carbon into biomass by the ther'
Myhre, M., Fernandes, C., Miyazawa, D., Wong, W.,
mophile Bacillus thermoleovorans, Appl. Environ. Microbiol.,
Lillquist, A.L., Wang, D., Dosanjh, M., Hara, H.,
66, 518-523, doi: 10.1128/aem.66.2.518'523.2000.
Petrescu, A., Morin, R.D., Yang, G., Stott, J.M., Schein, J.E.,
64. Bubinas, A., Giedraityte, G., Kalediene, L., Nivinskiene, O.,
Shin, H., Smailus, D., Siddiqui, A.S., Marra, M.A.,
and Butkiene, R. (2008) Degradation of naphthalene by
Jones, S.J., Holt, R., Brinkman, F.S., Miyauchi, K.,
thermophilic bacteria via a pathway through protocate'
Fukuda, M., Davies, J.E., Mohn, W.W., and Eltis, L.D.
chuic acid, Cent. Eur. J. Biol., 3, 61-68, doi: 10.2478/
(2006) The complete genome of Rhodococcus sp. RHA1
s11535'007'0042'x.
provides insights into a catabolic powerhouse, Proc. Natl.
65. Van Herwijnen, R., Springael, D., Slot, P., Govers, H.A.,
Acad. Sci. USA, 103, 15582-15587, doi: 10.1073/pnas.
and Parsons, J.A. (2003) Degradation of anthracene by
0607048103.
Mycobacterium sp. strain LB501T proceeds via a novel
61.
Kulakova, A.N., Reid, K.A., Larkin, M.J., Allen, C.C.,
pathway, through o'phthalic acid, Appl. Environ.
and Kulakov, L.A. (1996) Isolation of Rhodococcus
Microbiol., 69, 186-190, doi: 10.1128/aem.69.1.186'
rhodochrous NCIMB
13064 derivatives with new
190.2003.
ALTERNATIVE NAPHTHALENE METABOLIC PATHWAY INCLUDES
FORMATION OF ortho PHTHALIC ACID AND CINNAMIC ACID
DERIVATIVES IN THE Rhodococcus opacus STRAIN 3D
T. O. Anokhina, T. Z. Esikova, A. B. Gafarov,
V. N. Polivtseva, B. P. Baskunov, and I. P. Solyanikova*
Federal Research Center “Pushchino Scientific Center for Biological Research” of the Russian Academy of Sciences,
Skryabin Institute of Biochemistry and Physiology of Microorganisms, 142290 Pushchino, Moscow Region, Russia;
E<mail: innas@IBPM.Pushchino.ru
Received November 1, 2019
Revised December 6, 2019
Accepted December 6, 2019
Naphthalene, as a component of crude oil, is a common environmental pollutant. Biochemical and genetic aspects
of naphthalene catabolism have been examined in most detail in the bacteria of Pseudomonas genus. In pseudomonads,
the key intermediate in naphthalene degradation is salicylate. In this study, we investigated the ability of Rhodococcus
opacus strain 3D to utilize naphthalene as a sole carbon and energy source. The characteristic feature of this strain is
the inability to grow in the mineral medium supplemented with salicylate (typical intermediate of naphthalene degra'
dation in Gram'negative bacteria). The absence of salicylate hydroxylase activity and salicylate accumulation in the
mineral medium in the course of R. opacus 3D cultivation indicated existence of an alternative pathway of naphtha'
lene oxidation. At the same time, R. opacus 3D was able to use monoaromatic compounds (salts of gentisic, ortho'
phthalic, and 2'hydroxycinnamic acids and coumarin) as growth substrates. Based on the analysis of enzymatic activ'
ities, identification of the reaction intermediates, genetic determinants, and growth substrates, we concluded that R.
opacus 3D carries out naphthalene degradation through an alternative pathway via formation of ortho'phthalic acid,
which is untypical for pseudomonads. Using mass spectrometry, we showed for the first time that salicylic acid asso'
ciate formed in trace amounts in the process of naphthalene degradation is not further metabolized and accumulated
in the growth medium in a form of dimer.
Keywords: Rhodococcus opacus, naphthalene, salicylic acid, ortho'phthalic acid, 2'hydroxycinnamic acid, biodegra'
dation genes, enzymatic activity
БИОХИМИЯ том 85 вып. 3 2020
9*