БИОХИМИЯ, 2020, том 85, вып. 3, с. 428 - 437
УДК 577.124
РАМНОМАННАНЫ И ТЕЙХУРОНОВАЯ КИСЛОТА
ИЗ КЛЕТОЧНОЙ СТЕНКИ Rathayibacter tritici ВКМ Ac 1603Т*
© 2020
А.С. Шашков1, Е.М. Тульская2**, Г.М. Стрешинская2,
А.С. Дмитренок1, Н.В. Потехина2, С.Н. Сенченкова1,
Н.Ф. Пискункова2, Л.В. Дорофеева3, Л.И. Евтушенко3
1 Институт органической химии им. Н.Д. Зелинского РАН, 119991 Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова, биологический факультет,
119991 Москва, Россия; электронная почта: em_tulskaya@mail.ru
3 Всероссийская коллекция микроорганизмов, Институт биохимии и физиологии
микроорганизмов им. Г.К. Скрябина РАН, 142290 Пущино Московская обл., Россия
Поступила в редакцию 28.11.2019
После доработки 18.12.2019
Принята к публикации 18.12.2019
Химическими и ЯМР спектроскопическими методами установлены структуры трех гликополимеров кле
точной стенки фитопатогена Rathayibacter tritici ВКМ Ас 1603T (семейство Microbacteriaceae, порядок
Micrococcales, класс Actinobacteria). Полимер 1 - разветвленный рамноманнан с повторяющейся единицей
→3) α [β D Xylp (1→2)] D Manp (1→2) α D Rhap (1→3) α D Manp (1→2) α D Rhap (1→; полимер 2 -
линейный рамноманнан →2) α D Manp (1→2) α D Rhap (1→3) α D Manp (1→2) α D Rhap (1→; поли
мер 3 - тейхуроновая кислота с боковыми заместителями, содержащая остатки моносахаридов GlcA, Gal,
Man и Glc в соотношении 1/1/1/5. Структуры полимеров описаны впервые для прокариотных микроорга
низмов. Обсуждается индивидуальный набор бесфосфатных гликополимеров в клеточных стенках предста
вителей 4 х видов рода Rathayibacter (R. tritici ВКМ Ас 1603T, R. iranicus ВКМ Ас 1602T, R. toxicus ВКМ
Ас 1600 и «Rathayibacter tanaceti» ВКМ Ас 2596), изученных к настоящему времени. Штаммы характеризу
ются общим свойством - присутствием в клеточных стенках линейных или разветвленных рамноманнанов
с D рамнозой, с различной локализацией гликозидных связей в цепи и различными боковыми заместите
лями, что является важным хемотаксономическим признаком рода Rathayibacter.
КЛЮЧЕВЫЕ СЛОВА: Rathayibacter, клеточная стенка, рамноманнан, тейхуроновая кислота, D рамноза,
ЯМР спектроскопия.
DOI: 10.31857/S0320972520030124
Актинобактерии рода Rathayibacter (семей
типа и преобладающим менахиноном дыхатель
ство Microbacteriaceae, класс Actinobacteria) -
ной цепи МК 10 [1]. Ряд видов рода, в их числе
аэробные, грамположительные, неподвижные,
R. tritici, известны как фитопатогены, вызываю
неправильные палочки с пептидогликаном B2γ
щие гуммоз и задержку роста пшеницы и неко
торых других злаковых растений [1, 2]. R. toxicus,
кроме того, образует высокотоксичный глико
Принятые сокращения: ВКМ - Всероссийская кол
лекция микроорганизмов; HMBC - гетероядерная корре
липид (коринетоксин), который является при
ляция 1H,13C через несколько связей; HSQC - протон де
чиной гибели травоядных животных [1, 2]. Счи
тектированная HOHO квантовая корреляция; J (КССВ) - тается, что в природных условиях фитопатогены
константа спин спинового взаимодействия; ROESY - дву
рода Rathayibacter переносятся на хозяйские
мерная спектроскопия ядерного эффекта Оверхаузера во
растения галлообразующими нематодами рода
вращающейся системе координат; COSY - корелляцион
ная спектроскопия; TOCSY - тотальная корреляционная
Anguina [1, 2].
спектроскопия; TSP - натриевая соль 3 (триметилсилил)
Наши предыдущие исследования показали,
- значе
3,3,2,2 тетрадейтеропропионовой кислоты; δC, δH
что клеточные стенки R. toxicus ВКМ Ас 1600,
ния химических сдвигов атомов 13C1H соответственно,
«Rathayibacter tanaceti» ВКМ Ас 2596 и R. iranicus
тейхуроновая кислота - (ТУК).
ВКМ Ас 1602Т содержат полимеры уникальной
* Приложение к статье на английском языке опубликова
структуры [3, 4]. Другие представители рода ра
но на сайте журнала «Biochemistry» (Moscow) и на сайте из
нее не исследованы в этом отношении.
том 85, вып. 3, 2020.
Изучение состава и строения гликополиме
** Адресат для корреспонденции.
ров клеточных стенок ковалентно связанных с
428
РАМНОМАННАНЫ И ТЕЙХУРОНОВАЯ КИСЛОТА Rathayibacter tritici
429
пептидогликаном у ранее не исследованных ви
обессоливали на колонке (90 × 1,5 см) с TSK
дов (групп) бактерий представляет интерес для
HW 40S гелем («Toyopearl», Япония). Элюцию
ряда областей фундаментальной и прикладной
проводили 1% ным AcOH, используя диффе
науки, в том числе микробиологии и экологии
ренциальный рефрактометр («Knauer», Герма
микроорганизмов. Сведения о строении глико
ния). Фракции гликополимеров объединяли,
полимеров клеточных стенок имеют также важ
диализовали против дистиллированной воды,
ное значение для развития системы классифика
замораживали и высушивали лиофильно.
ции бактерий, в частности для обоснования опи
Абсолютная D конфигурация рамнозы и
сания новых видов (доказательство их отличий
маннозы (полимеры 1 и 2) была установлена ме
от известных видов на уровне фенотипа) [5, 6].
тодом ГЖХ ацетилированных гликозидов с
В настоящей работе приведены структуры
(+) октан 2 олом согласно опубликованным
углеводсодержащих полимеров клеточной стен
процедурам [8]. Абсолютную конфигурацию
ки типового штамма Rathayibacter tritici в сравне
моносахаридных остатков в полимере 3 опреде
нии с таковыми, изученными ранее у других ви
ляли по эффектам гликозилирования в остатках
дов рода.
моносахаридов в спектрах ЯМР 13С согласно за
кономерностям, изложенным в работе Shashkov
et al. [9], предполагая, что глюкоза относится к
МЕТОДЫ ИССЛЕДОВАНИЯ
D ряду. D Конфигурацию глюкозы подтвер
ждали ферментативно, как описано ранее [4].
В работе использовали штамм Rathayibacter
Спектры ЯМР снимали на приборе Bruker
tritici ВКМ Ac 1603T (= DSM 7486T = ICMP
AV600 («Bruker», Германия) для растворов в
2626T) из Всероссийской коллекции микроор
99,96% D2O при температурах, обеспечивающих
ганизмов (ВКМ) Института биохимии и физио
минимальное перекрывание остаточного сигна
логии микроорганизмов им. Г.К. Скрябина
ла дейтерированной воды с сигналами полиме
ров. В качестве внутреннего эталона использо
Культуру выращивали аэробно при 28 °С в
вали натриевую соль 3 (триметилсилил) 3,3,2,2
колбах на качалке до середины логарифмической
тетрадейтеропропионовой кислоты (TSP, δН
фазы роста на пептонно дрожжевой среде [7].
0,0 м.д., δС -1,6 м.д.). Двумерные спектры сни
Получение клеточных стенок и выделение из
мали и записывали при использовании стандарт
них гликополимеров проводили как описано в
ных методик фирмы Bruker. Время спин лока в
работе Shashkov et al. [3]. Выход препаратов гли
экспериментах тотальной корреляционной
кополимеров, полученных при холодной и горя
спектроскопии (TOCSY) составляло 100 мс.
чей ТХУ экстракциях (10% ТХУ, 4 °С, 24 ч и
Время смешивания в эксперименте двумерной
последующая - 5% ТХУ, 90 °С, 20 мин), соста
спектроскопии ядерного эффекта Оверхаузера
вил 1,3% и 4,6% соответственно. В дальнейшем
во вращающейся системе координат (ROESY)
препараты гликополимеров, полностью иден
составляло 150 мс. Эксперименты по гетеро
тичные по предварительным химическим и
ядерной корреляции 1H,13C (HMBC) были опти
ЯМР спектроскопическим исследованиям, бы
мизированы для констант спин спинового взаи
ли объединены и обозначены как препарат Ас
модействия JH,C 8 Гц.
1603.
Кислотный гидролиз клеточной стенки и
препаратов гликополимеров проводили 2 M HCl,
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
3 ч, 100 °С, как описано в работе Potekhina et al. [7].
Нисходящую хроматографию (БХ) и элек
В кислотных гидролизатах клеточной стенки
трофорез проводили на бумаге Filtrak FN 3
и препарата Ас 1603 (2 М HCl, 100 °С, 3 ч) фос
(«Filtrak», Германия), используя различные сис
фат содержащие соединения не выявлены
темы растворителей [7]. Фосфат содержащие
(электрофорез), однако были обнаружены мо
соединения выявляли реактивом Ишервуда; по
носахариды - галактоза, глюкоза, манноза, рам
лиолы и моносахариды - 5% ным аммиачным
ноза и ксилоза (БХ), которые могли входить в
раствором AgNO3, восстанавливающие моноса
состав гликополимеров клеточной стенки ис
хариды - анилинфталатом [7].
следуемого штамма.
Гликополимеры препарата Ас 1603 разделя
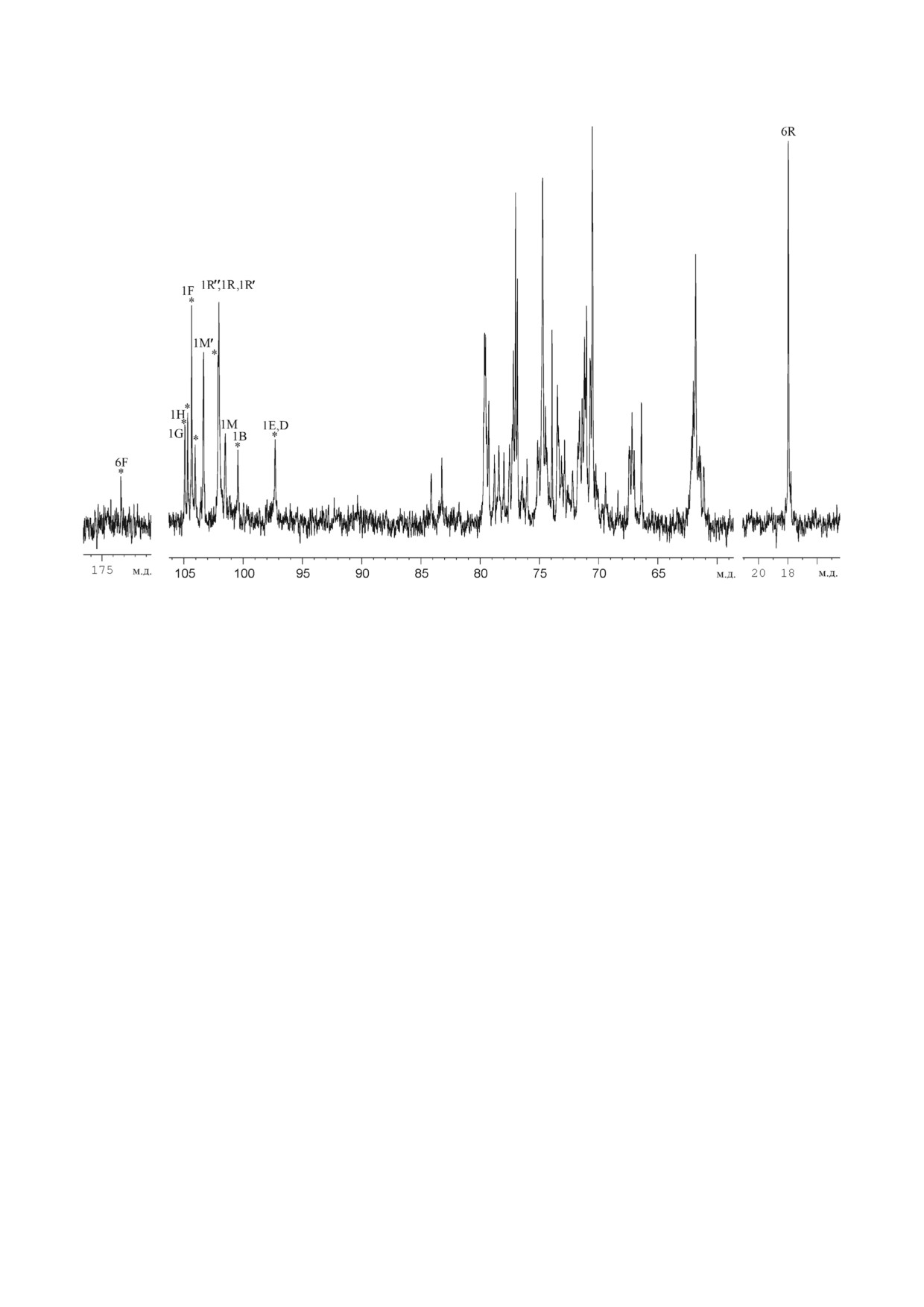
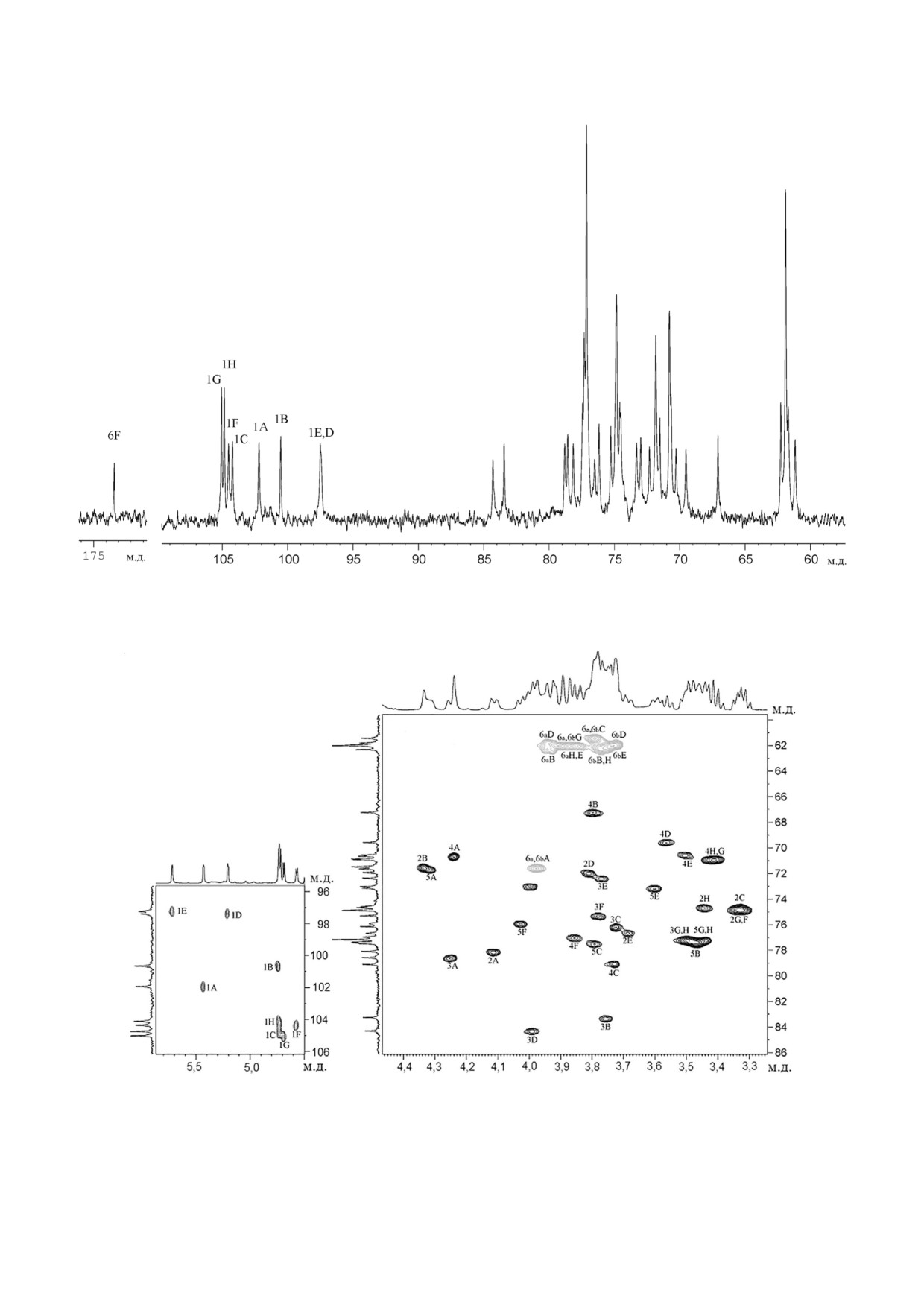
13C ЯМР спектр препарата Ас 1603 (рис. 1)
ли методом анионообменной хроматографии на
был типичным для нерегулярного полимера или
колонке (80 × 1,5 см) с DEAE целлюлозой
смеси полимеров. Спектр содержал, по крайней
(«Toyopearl», Япония). Нейтральную фракцию
мере, 12 сигналов различной интенсивности в
элюировали 0,005 M, а кислую - 0,5 M фосфат
аномерной области атомов углерода δC 97,5-
ным буфером (pH 6,3). Полученные фракции
105,1 м.д., а также один сигнал от 6 дезокси са
БИОХИМИЯ том 85 вып. 3 2020
430
ШАШКОВ и др.
Рис. 1. Спектр 13С ЯМР гликополимеров препарата Ас 1603 из клеточной стенки R. tritici ВKM Ac 1603T. Арабские циф
ры относятся к номерам атомов углерода в остатках, обозначенных заглавными латинскими буквами в соответствии с
табл. 1. Звездочками помечены сигналы, относящиеся к полимеру 3
хара при δC 18,0 м.д. Спектр также содержал сиг
ки α маннопиранозы (α Manp), α рамнопира
нал в области резонанса карбонильных групп
нозы (α Rhap) и β ксилопиранозы (β Xylp).
при δC 173,2 (pH 3,0) или 174,0 (pH 7,0), принад
Анализ 1H,13C HSQC спектра (табл. 1, рис. 3)
лежащий, судя по зависимости положения от
показал различное замещение остатков Manp: в
рН, COOH группе. Разделение препарата
положение 2 и 3 (химический сдвиг С 2 при
Ас 1603 на колонке с DEAE (см. раздел «Мето
79,2 м.д. и химический сдвиг С 3 при 77,6 м.д.,
ды исследования») привело к получению нейт
остаток M); только в положение 3 (химический
ральной и кислой фракций.
сдвиг C 3 при 79,6 м.д., остаток M′); только в
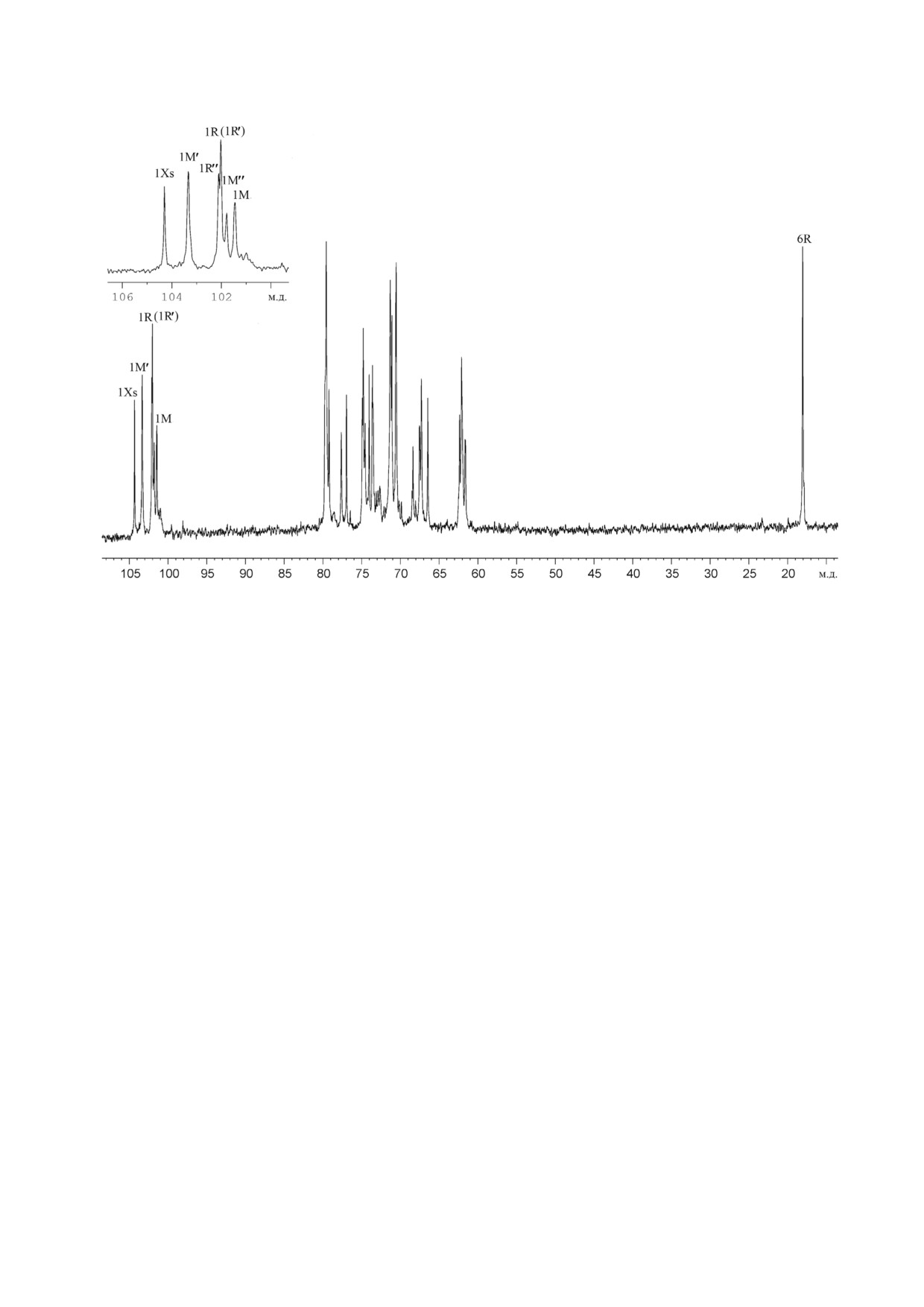
13C ЯМР спектр нейтральной фракции
положение
2 (химический сдвиг С 2 при
(табл. 1, рис. 2) в аномерной области атомов уг
79,8 м.д., остаток M′′); замещение α Rhap в по
лерода (δC 101,4-104,3 м.д.) содержал большое
ложение 2 (химический сдвиг C 2 при 79,5 м.д.,
количество сигналов различной интенсивности,
остаток R; при 79,6 м.д., остаток R′ и при
а в сильнопольной области спектра были сигна
79,7 м.д., остаток R′′). Остатки β Xylp выявлены
лы при δC 17,9 и 18,0 м.д.
как концевые (Xs).
1H ЯМР спектр нейтральной фракции
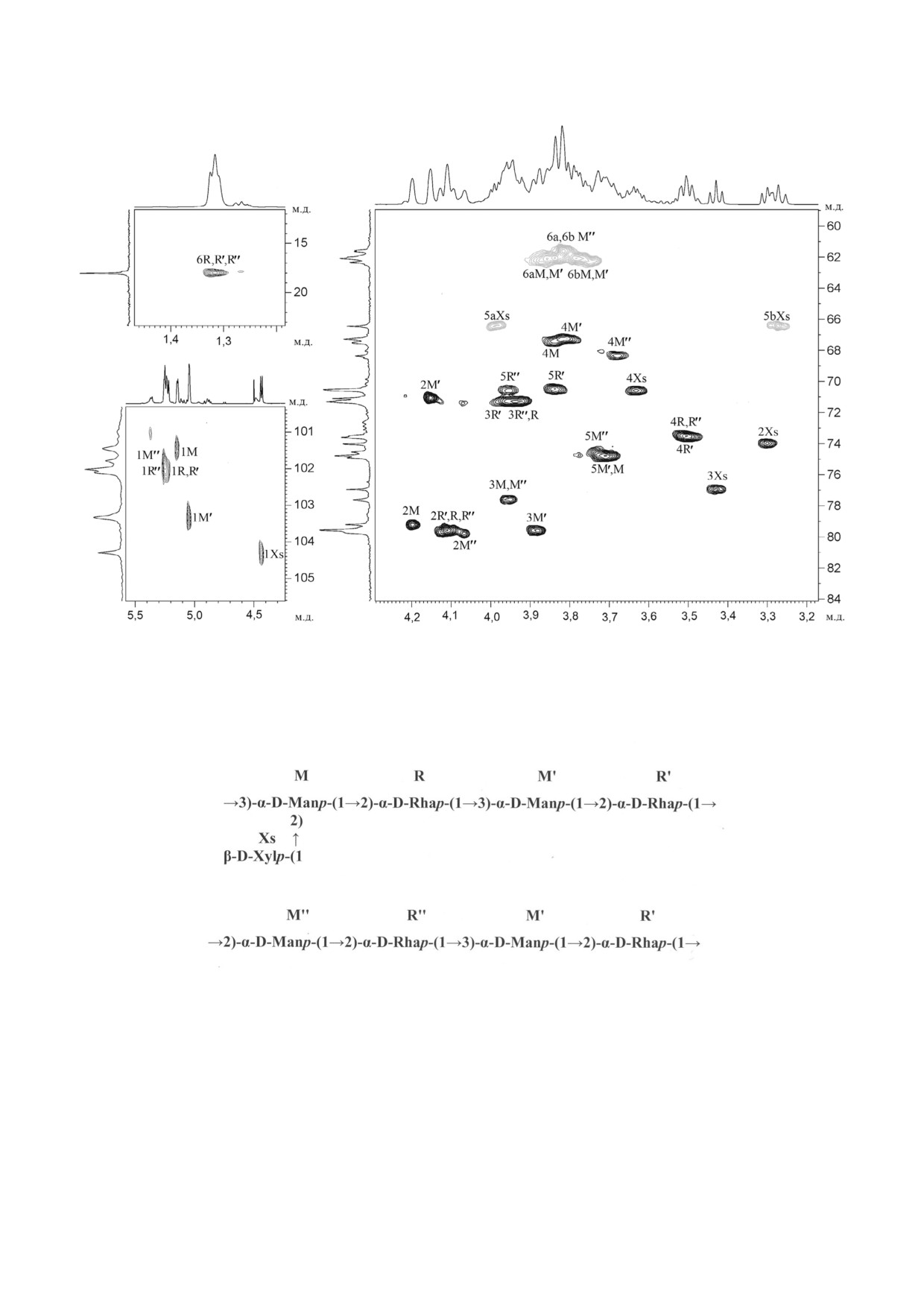
Последовательность остатков определена
(табл. 1, рис. 3, вверху) содержал шесть хорошо
путем анализа 1H,1H ROESY (табл. 1, рис. S1 в
разрешенных сигналов в аномерной области
Приложении) и 1H,13C HMBC (табл. 1, рис. S2 в
протонов. Два сигнала наблюдали в области
Приложении) спектров. Корреляционные пики
сильного поля при δH 1,30 и 1,32 м.д.
между остатками H 1(M)/H 2(R) (5,15/4,11);
Как 1H, так и 13C спектры полимеров ней
H 1(M′′)/H 2(R′′) (5,22/4,11); H 1(R, R′′)/H 3(M′)
трального препарата были расшифрованы с по
(5,25, 5,22/3,88); H 1(M′)/H 2(R′) (5,05/4,10);
мощью двумерных гомоядерных 1H,1H COSY,
H 1(R′)/ H 3(M) (5,24/3,95); H 1(R′)/H 2(M′′)
TOCSY, ROESY и гетероядерных 1H,13C спек
(5,24/4,07) и H 1(R′)/H 3(M′) (5,24/3,88) на
тров HSQC и HMBC.
блюдали в 1H,1H ROESY спектре (табл. 1, рис.
Двумерные 1H,1H COSY, TOCSY и ROESY
S1 в Приложении). Они указывали на присут
(рис. S1 в Приложении) спектры выявили остат ствие двух типов повторяющихся звеньев, что,
БИОХИМИЯ том 85 вып. 3 2020
РАМНОМАННАНЫ И ТЕЙХУРОНОВАЯ КИСЛОТА Rathayibacter tritici
431
Рис. 2. Спектр 13С ЯМР полимеров 1 и 2 нейтральной фракции из клеточной стенки R. tritici ВKM Ac 1603T. Арабские
цифры относятся к номерам атомов углерода в остатках, обозначенных заглавными латинскими буквами в соответствии
с табл. 1. Вверху слева приведена область аномерных атомов углерода, увеличенная в масштабе
скорее всего, связано с наличием в нейтральной
Структуры повторяющихся звеньев рамно
фракции либо одного полимера с гетерогенной
маннанов (полимеры 1 и 2) представлены на
цепью, либо двух. Структуры были установлены
рис. 4.
при анализе дальних H/C корреляций в спек
13C ЯМР спектр полимера 3 из кислой фрак
трах 1H, 13C HMBC (табл. 1, рис. S2 в Приложе
ции (табл. 1, рис. 5) был типичным для регуляр
нии), где обнаружены следующие корреляцион
ного полимера. Аномерная область атомов угле
ные пики между остатками: H 1(M)/C 2(R)
рода содержала шесть сигналов равной интен
(5,15/79,5); H 1(R, R′′)/C 3(M′) (5,25, 5,22/79,6);
сивности и один сигнал двойной интегральной
H 1(Xs)/C 2(M) (4,43/79,2); H 1(M′)/C 2(R′)
интенсивности. В области сильного поля сигна
(5,05/79,6);
H 1(R′)/C 2(M′′)
(5,24/76,8);
лов не наблюдали, а сигнал при δC 173,5 (pH 5)
H 2(M)/C 1(R) (4,22/102,0); H 3(R′)/C 1(M)
был виден в резонансной области карбоксиль
(3,96/101,4); H 3(M)/C 1(Xs)
(3,95/104,3);
ных групп.
H 2(M′)/C 1(R′) (4,15/102,0) и H 3(R′)/C 1(M′)
1H ЯМР спектр полимера 3 из кислой фрак
(3,96/103,3).
ции (рис. 6, вверху) содержал шесть хорошо раз
Абсолютная D конфигурация остатков
решенных сигналов и один сигнал двойной ин
α Rhap и α Manp определена согласно процеду
тенсивности в аномерной области протонов.
ре, описанной в работе Gerwig et al. [8], и подт
Как 1H, так и 13C спектры полимера 3 были
верждена совпадением химических сдвигов
расшифрованы с помощью двумерных спек
C 1 - C 3 α Rhap и α Manp в спектрах 13C ЯМР
тров, упомянутых выше. Спектры 2D 1H,1H
с таковыми для полимера I из R. toxicus ВКМ Ac
COSY, TOCSY и ROESY (рис. S3 в Приложении)
1600, имеющего идентичную основную повто
выявили остатки α Galp, β Manp, β Glcp, два
ряющуюся единицу [3]. Присутствие в 1Н, 1Н
остатка α Glcp, β GlcpA и два терминальных ос
ROESY спектре (табл. 1, рис. S1 в Приложении)
татка β Glcp. Анализ 1H,13C HSQC спектра
H 1(M)/H 1(Xs) (5,15/4,43) указывает на одина
(табл. 1, рис. 6, слева) показал слабопольный хи
ковые D конфигурации маннопиранозы и кси
мический сдвиг атомов углерода при С 2
лопиранозы.
(78,2 м.д.) и С 3 (78,6 м.д.) (A); C 3 (83,4 м.д.)
БИОХИМИЯ том 85 вып. 3 2020
432
ШАШКОВ и др.
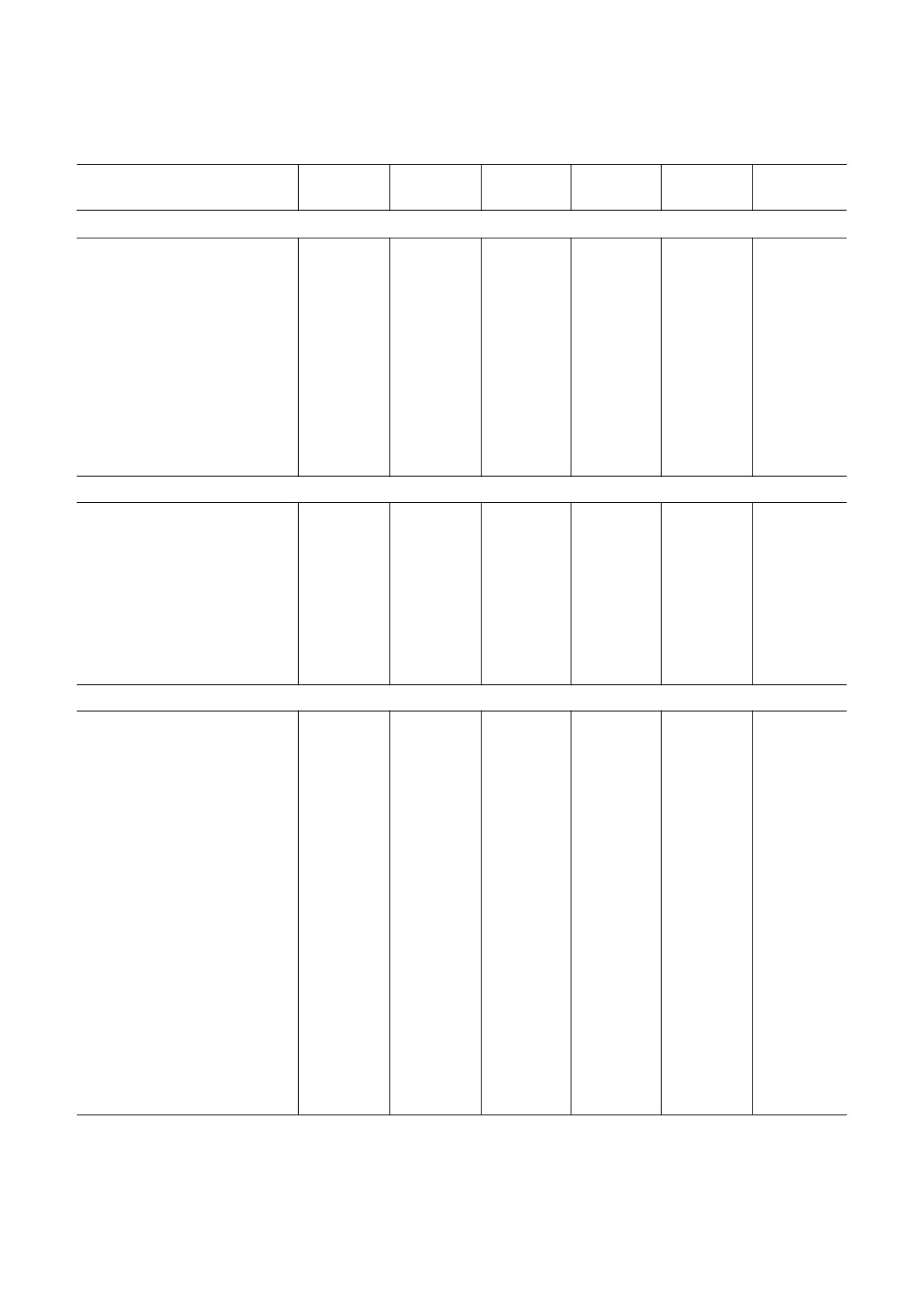
Таблица 1. Химические сдвиги в спектрах ЯМР 13С и 1H для гликополимеров клеточной стенки R. tritici ВKM Ac 1603Т
(TSP δC - 1,6 м.д. и δH 0.00 м.д.)
Остаток
C 1
C 2
C 3
C 4
C 5
C 6
H>1
H>2
H>3
H>4
H>5
H>6 (H>6a,6b)
Нейтральный полимер 1
→3) α D Manp (1→
M
101,4
79,2
77,6
67,5
74,9
62,3b
2)
5,15
4,22
3,95
3,84
3,69
3,88, 3,77
↑
α D Xylp (1
Xs
104,3
74,0
76,9
70,6
66,4
4,43
3,30
3,43
3,63
3,98, 3,27
→2) α D Rhap (1→
R
102,0
79,5
71,3
73,5
70,6a
18,0
5,25
4,11
3,92
3,51
3,95
1,32
→3) α D Manp (1→
M′
103,3
71,1
79,6
67,3
74,8
62,0b
5,05
4,15
3,88
3,81
3,71
3,86, 3,76
→2) α D Rhap (1→
R′
102,0
79,6
71,3
73,5
70,6a
17,9
5,24
4,10
3,96
3,52
3,95
1,28
Нейтральный полимер 2
→2) α D Manp (1→
M′′
101,8
79,8
71,3
68,4
74,5
61,6
5,22
4,07
3,91
3,68
3,73
3,82, 3,80
→2) α D Rhap (1→
R′′
102,1
79,7
71,3
73,6
70,5a
17,9
5,22
4,11
3,98
3,49
3,83
1,28
→3) α D Manp (1→
M′
103,3
71,1
79,6
67,3
74,8
62,3b
5,05
4,15
3,88
3,81
3,71
3,84, 3,79
→2) α D Rhap (1→
R′
102,0
79,6
71,3
73,5
70,6a
17,9
5,25
4,10
3,96
3,52
3,95
1,28
Кислый полимер 3
β D Glcp (1
G
105,1
74,6
77,1
71,0
77,1
62,0
4,69
3,31
3,49
3,41
3,48
3,91, 3,87
↓
2)
→6) α D Galp (1→
A
102,2
78,2
78,6
70,7
71,8
71,5
3)
5,43
4,11
4,25
4,23
4,32
3,98, 3,98
↑
β D Glcp (1
H
104,8
74,7
77,3
70,8
76,2
62,0
4,72
3,34
3,44
3,41
3,73
3,87, 3,77
→3) β D Manp (1→
B
100,7
71,5
83,4
67,1
77,6
62,3
4,74
4,34
3,75
3,79
3,47
3,94, 3,76
→4) β D Glcp (1→
C
104,2
74,9
76,2
79,1
77,5
61,4
4,72
3,44
3,72
3,72
3,79
3,78, 3,78
→3) α D Glcp (1→
D
97,5
71,8
84,3
69,5
73,0
61,8
5,21
3,81
3,98
3,56
4,00
3,94, 3,72
→2) α D Glcp (1→
E
97,5
76,6
72,3
70,3
73,1
62,0
5,72
3,69
3,78
3,52
3,61
3,84, 3,72
→4) β D GlcpA (1→
F
104,4
74,6
75,3
77,0
75,0
173,5
4,58
3,33
3,76
3,86
4,13
a,b Предполагаемое отнесение в колонке.
БИОХИМИЯ том 85 вып. 3 2020
РАМНОМАННАНЫ И ТЕЙХУРОНОВАЯ КИСЛОТА Rathayibacter tritici
433
Рис. 3. Части двумерного 1H,13C HSQC спектра полимеров 1 и 2 нейтральной фракции из клеточной стенки R. tritici ВKM
Ac 1603T. Соответствующие части 1H и 13C ЯМР спектров приведены вверху и слева от двумерного спектра соответствен
но. Арабские цифры относятся к номерам атомов углерода в остатках, обозначенных заглавными латинскими буквами в
соответствии с табл. 1
а
б
Рис. 4. Структуры повторяющихся звеньев нейтральных полимеров из клеточной стенки R. tritici ВКМ Ac 1603T: а - рам
номаннан 1 (полимер 1); б - рамноманнан 2 (полимер 2). Заглавными латинскими буквами обозначены остатки в соответ
ствии с табл. 1
(B); C 4 (79,1 м.д.) (C); C 3 (84,3 м.д.) (D); C 2
вым в β Glcp OMe, что указывает на концевое
(76,6 м.д.) (E) и C 4 (77,0 м.д.) (F) в сравнении с
положение остатков в повторяющемся звене.
таковыми в спектрах соответствующих незаме
Последовательность остатков в полимере 3
щенных остатков. Химические сдвиги 13C в под
стала понятной после анализа 2D 1H,1H ROESY
спектрах остатков (G) и (H) были близки к тако
спектра (табл. 1, рис. S3 в Приложении). Спектр
БИОХИМИЯ том 85 вып. 3 2020
434
ШАШКОВ и др.
Рис. 5. Спектр 13С ЯМР полимера 3 кислой фракции из клеточной стенки R. tritici ВKM Ac 1603T. Арабские цифры отно
сятся к номерам атомов углерода в остатках, обозначенных заглавными латинскими буквами в соответствии с табл. 1
Рис. 6. Части двумерного 1H,13C HSQC спектра полимера 3 кислой фракции из клеточной стенки R. tritici ВKM Ac 1603T.
Соответствующие части 1H и 13C ЯМР спектров приведены вверху и слева от двумерного спектра соответственно. Араб
ские цифры относятся к номерам атомов углерода в остатках, обозначенных заглавными латинскими буквами в соответ
ствии с табл. 1
БИОХИМИЯ том 85 вып. 3 2020
РАМНОМАННАНЫ И ТЕЙХУРОНОВАЯ КИСЛОТА Rathayibacter tritici
435
Рис. 7. Структура повторяющегося звена кислого полисахарида из клеточной стенки R. tritici ВКМ Ac 1603T - тейхуроно
вой кислоты (полимер 3). Заглавными латинскими буквами обозначены остатки в соответствии с табл. 1
1H,1H ROESY содержал следующие пики между
Полимер 1 - разветвленный рамноманнан, в
остатками: H 1(A)/H 3(B) (5,43/3,75); H 1(B)/
цепи которого остатки D маннозы частично за
H 4(C) (4,74/3,72); H 1(C)/H 3(D) (4,72/3,98);
мещены остатками D ксилопиранозы (Manp,
H 1(D)/H 2(E) (5,21/3,69); H 1(E)/H 4(F) (5,72/
Xylp, 2/1). Отметим, что рамноманнан (с D рам
3,86); H 1(F)/H 6(A) (4,58/3,98); H 1(G)/H 2(A)
нозой) с другой локализацией гликозидных свя
(4,69/4,11) и H 1(H)/H 3(A) (4,72/4,25). Такая
зей в цепи, а также с D ксилофуранозой на остат
последовательность была подтверждена при
ках маннозы был выявлен в О полисахариде грам
анализе 1H,13C HMBC спектра кислого полиме
отрицательных бактерий рода Citrobacter [10].
ра 3 (табл. 1, рис. S4 в Приложении), где присут
Полимер 2 - линейный рамноманнан - не
ствовали следующие пики между остатками: H
содержит ксилозы и с иной локализацией гли
6(A)/C 1(F)
(3,98/104,4);
H 3(B)/C 1(A)
козидной связи между остатками маннозы и
(3,75/ 102,2); H 4(C)/C 1(B) (3,72/100,7); H 3(D)/
рамнозы в цепи. Возможно, что представленные
C 1(C) (3,98/104,2); H 2(E)/C 1(D) (3,69/97,5);
повторяющиеся единицы (рис. 4) входят в сос
H 4(F)/C 1(E)
(3,86/97,5); H 2(A)/C 1(G)
тав одного полимера.
(4,11/105,1) и H 3(A)/C 1(H) (4,25/104,8).
Полимер 3, ТУК, состоит из остатков моно
Абсолютную конфигурацию моносахарид
сахаридов - GlcA, Gal, Man и Glc в соотноше
ных остатков в полимере 3 определяли по гли
нии 1/1/1/5, при этом два остатка β D Glcp яв
козилирующим эффектам в 13С ЯМР спектре
ляются терминальными на остатке α D Galp.
согласно закономерностям, описанным ранее,
Представленная ТУК (рис. 7) содержит 8 остат
принимая во внимание D конфигурацию глю
ков моносахаридов в повторяющемся звене.
ко остатков (Glcp и GlcpA) [9]. Аналогичный
Большинство описанных ТУК состоят из диса
подход был использован при определении абсо
харидных звеньев, однако встречаются полиме
лютных конфигураций моносахаридных остат
ры, содержащие 4 и более моносахаридных ос
ков гликополимеров [3, 4]. Отрицательный
татков в повторяющемся звене [11].
(-0,7 м.д.) γ эффект гликозилирования β Glcp
В табл. 2 представлены структуры гликопо
по C 6 (остаток C) характерен для D абсолют
лимеров клеточных стенок R. tritici в сравнении
ной конфигурации гликозилирующей β пира
с изученными ранее у R. toxicus, «Rathayibacter
нозы, то есть β Manp (остаток B). Гликозилирую
tanaceti» и R. iranicus [3, 4]. Эти данные свиде
щие эффекты, как большой положительный
тельствуют, что каждый упомянутый вид имеет
(+9,1 м.д.) α эффект Manp по C 3, так и малый
индивидуальный набор различных по структуре
по модулю отрицательный β эффект (-0,1 м.д.)
гликополимеров. Штаммы содержат линейные
Manp по C 2 (остаток B), типичны для одинако
или разветвленные рамноманнаны с разной ло
вой абсолютной конфигурации остатков B и C.
кализацией гликозидных связей и разным со
Таким образом, абсолютная D конфигурация
ставом боковых гликозильных заместителей.
Galp (остаток А) следует из D конфигурации
Характерной особенностью описанных рамно
β Manp (остаток B).
маннанов является наличие рамнозы в D кон
Структура повторяющегося звена полимера 3,
фигурации.
ТУК, представлена на рис. 7.
В результате проведенного исследования ус
У представителей двух наиболее близких ви
тановлены структуры трех гликополимеров кле
дов R. iranicus и R. tritici (уровень сходства 16S
точной стенки типового штамма R. tritici. Струк
рРНК генов - 99,3%) помимо рамноманнанов в
туры полимеров (рамноманнаны и тейхуроно
клеточных стенках присутствуют гликополиме
вая кислота) описаны впервые у прокариотных
ры другой природы - тейхуроновые кислоты
микроорганизмов.
различной структуры. К особенностям пред
БИОХИМИЯ том 85 вып. 3 2020
436
ШАШКОВ и др.
Таблица 2. Гликополимеры клеточных стенок некоторых штаммов рода Rathayibacter
Штаммы рода Rathayibacter
Гликополимеры клеточных стенок
R. tritici
R. toxicus
«Rathayibacter tanaceti»
R. iranicus
ВKM Ac 1603T
ВKM Ac 1600 [3]
ВKM Ac 2596 [3]
ВKM Ac 1602T [4]
[настоящая работа]
Рамноманнан 1 (РM1)
•
Рамноманнан 2 (РM2)
•
Рамноманнан 3 (РM3)
•
Рамноманнан 4 (РM4)
•
Рамноманнан 5 (РM5)
•
Полисахарид (ПС)
Δ
♦
Тейхуроновая кислота 1 (ТУК1)
Тейхуроновая кислота 2 (ТУК2)
♦
Примечание: (•) - рамноманнан; (Δ) - нейтральный полисахарид; (♦) - ТУК;
(РM1) →3) α [β D Xylp (1→2)] D Manp (1→2) α D Rhap (1→3) α D Manp (1→2) α D Rhap (1→;
(РM2) →2) α D Manp (1→2) α D Rhap (1→3) α D Manp (1→2) α D Rhap (1→;
(РM3) →2) α D Rhap (1→3) α D Manp (1→;
(РM4) →3) α D Rhap (1→2) α D Manp (1→;
(РM5) →2) α D Rhap (1→3) α [α D Manp (1→6)] D Manp (1→;
(ПС) →2) β [α L Rhap (1→3)] β D Manp (1→4) α D Manp (1→3) β D Glcp (1→3) α D Glcp (1→2) α D Glcp (1→4)
β D Glcp (1→;
(ТУК1) →6) [β D Glcp (1→2) и β D Glcp (1→3)] α D Galp (1→3) β D Manp (1→4) β D Glcp (1→3) α D Glcp
(1→2) α D Glcp (1→4) β D GlcpA (1→;
(ТУК2) →3) α [α D Glcp (1→2)] L Rhap (1→4) β D GlcpA (1→2) α D Manp (1→3) α D Galp (1→3) β D Glcp (1→.
ставленных ТУК можно отнести отсутствие в
ством - в их клеточной стенке присутствуют
цепи N ацетилированных производных моно
рамноманнаны c D Rhap, что, возможно, явля
сахаридов, которые присутствуют в структурах
ется характерным признаком для актинобакте
большинства полимеров этого класса [11]. У ге
рий данного рода.
нетически более удаленного от них вида R. toxi>
cus (98,3 и 97,8% сходства 16S рРНК генов соот
ветственно [12]) найден второй нейтральный
Финансирование. Работа выполнялась в рам
полисахарид, в то время как ТУК отсутствует.
ках программы исследований
№ ЦИТИС:
Штамм «Rathayibacter tanaceti» [13] отличает
АААА А16 116021660068 1, запланированной в
ся от трех, описанных выше, наличием в клеточ
МГУ им. М.В. Ломоносова, кафедра микробио
ной стенке только одного гликополимера -
логии 2016-2022 гг.
рамноманнана.
Конфликт интересов. Авторы заявляют об от
Таким образом, представители изученных к
сутствии конфликта интересов в финансовой
настоящему времени видов рода Rathayibacter
или какой либо иной сфере.
содержат индивидуальные наборы уникальных
Соблюдение этических норм. Настоящая
гликополимеров, что дифференцирует их на
статья не содержит описания выполненных ав
уровне фенотипа. При этом все вышеупомяну
торами исследований с участием людей или ис
тые штаммы характеризуются общим свой пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Evtushenko, L.I., and Dorofeeva, L.V. (2012) Genus XXII.
bacterial head blight of grasses, and the potential for live
Rathayibacter, in Bergey’s Manual of Systematic Bacteriology
stock poisonings, Phytopathology, 107, 804-815.
(Whitman, W., Goodfellow, M., Kämpfer, P., Busse, H.J.,
3.
Shashkov, A.S., Tul’skaya, E.M., Dmitrenok, A.S.,
Trujillo, M., Ludwig, W., Suzuki, K., and Parte, A., eds),
Streshinskaya, G.M., Potekhina, N.V., Senchenkova, S.N.,
vol. 5, Springer New York, NY, USA, pp. 953-964.
Piskunkova, N.F., Dorofeeva, L.V., and Evtushenko, L.I.
2.
Murray, T.D., Schroeder, B.K., Schneider, W.L., Luster, D.G.,
(2018) Rhamnose containing cell wall glycopolymers from
Sechler, A., Rogers, E.E., and Subbotin, S.A.
(2017)
Rathayibacter toxicus VKM Ac 1600 and “Rathayibacter
Rathayibacter toxicus, other Rathayibacter species inducing
tanaceti” VKM Ac 2596, Biochemistry (Moscow), 83, 717-726.
БИОХИМИЯ том 85 вып. 3 2020
РАМНОМАННАНЫ И ТЕЙХУРОНОВАЯ КИСЛОТА Rathayibacter tritici
437
4.
Dmitrenok, A.S., Shashkov, A.S., Streshinskaya, G.M.,
monosaccharides in complex carbohydrates by capillary
Tul’skaya, E.M., Potekhina, N.V., Senchenkova, S.N.,
G.L.C., Carbohydr. Res., 77, 1-7.
Dorofeeva, L.V., and Evtushenko, L.I. (2019) New rham
9. Shashkov, A.S., Lipkind, G.M., Knirel, Y.A., and
nose contaning glycopolymers from Rathayibacter iranicus
Kochetkov, N.K. (1988) Stereometrical factors determining
VKM Ac 1602Т cell wall, Carbohydr. Res., 482, 107728.
the effects of glycosylation on the 13C chemical shifts in car
5.
Stackebrandt, E., Frederiksen, W., Garrity, G.M.,
bohydrates, Magn. Reson. Chem., 26, 735-747.
Grimont, P.A.D., Kämpfer, P., Maiden, M.C.J., Nesme, X.,
10. Knirel, Y.A. (2011) Structure of O antigens, in Bacterial
Rossello Mora, R., Swings, J., Trüper, H.G., Vauterin, L.,
lipopolysaccharides (Knirel, Y.A., and Valvano, M.A., eds),
Ward, A.C., and Whitman, W.B. (2002) Report of Ad Hoc
Springer Verlag/Wien, pp. 41-115, doi: 10.1007/978 3
committee fir the re evaluation of the species definition in
7091 0733 1_3.
bacteriology, Int. J. Syst. Evol. Microbiol., 52, 1043-1047.
11. Tul’skaya, E.M., Shashkov, A.S., Streshinskaya, G.M.,
6.
Schumann, P., Kämpfer, P., Busse, H.J., and Evtushenko, L.I.
Senchenkova, S.N., Potekhina, N.V., Kozlova, Yu.I., and
(2009) Proposed minimal standards for describing new gen
Evtushenko, L.I. (2011) Teichuronic and teichulosonic acids
era and species of the suborder Micrococcineae, Int. J. Syst.
of actinomycetes, Biochemistry (Moscow), 76, 904-913.
Evol. Microbiol., 59, 1823-1829.
12. Стародумова И.П. (2018) Развитие системы классифи
7.
Potekhina, N.V., Streshinskaya, G.M., Tul’skaya, E.M.,
кации актинобактерий рода Rathayibacter, Дисс. канд.
and Shashkov, A.S. (2011) Cell wall teichoic acids in the
биол. наук, Москва, с. 77.
taxonomy and characterization of gram positive bacteria, in
13. Vasilenko, O.V., Starodumova, I.P., Tarlachkov, S.V.,
Methods in Microbiology (F.A. Rainey, F.A., A. Oren, A.,
Dorofeeva, L.V., Avtukh, A.N., and Evtushenko, L.I.
eds.), Vol.
38, Chapt.
6, Academic Press/Elsevier,
(2016) Draft genome sequence of “Rathayibacter tanaceti”
Amsterdam, pp. 131-164.
strain VKM Ac 2596 isolated from Tanacetum vulgare
8.
Gerwig, G.J., Kamerling, I.P., and Viegenthart, J.F.G.
infested by a foliar nematode, Genome Announc., 4, e00512-
(1979) Determination of the absolute configuration of
e00516.
RHAMNOMANNANS AND TEICHURONIC ACID
FROM THE CELL WALL OF Rathayibacter tritici VKM Ac 1603Т*
A. S. Shashkov1, E. M. Tul’skaya2**, G. M. Streshinskaya2,
A. S. Dmitrenok1, N. V. Potekhina2, S. N. Senchenkova1,
N. F. Piskunova2, L. V. Dorofeeva3, and L. I. Evtushenko3
1 Zelinsky Institute of Organic Chemistry, Russian Academy of Sciences, 119991 Moscow, Russia
2 Lomonosov Moscow State University, Faculty of Biology, 119991 Moscow, Russia; E>mail: em_tulskaya@mail.ru
3 All>Russian Collection of Microorganisms (VKM), Skryabin Institute of Biochemistry and Physiology
of Microorganisms, Russian Academy of Sciences, 142290 Pushchino, Moscow Region, Russia
Received November 28, 2019
Revised December 18, 2019
Accepted December 18, 2019
The structures of three cell wall glycopolymers of the phytopathogen Rathayibacter tritici VKM Ac 1603T (family
Microbacteriaceae, order Micrococcales, class Actinobacteria) were established by chemical methods and NMR
spectroscopy. Polymer 1 is a branched rhamnomannan with the repeating unit →3) α [β D Xylp (1→2)] D Manp
(1→2) α D Rhap (1→3) α D Manp (1→2) α D Rhap (1→; polymer 2 is a linear rhamnomannan with the
repeating unit →2) α D Manp (1→2) α D Rhap (1→3) α D Manp (1→2) α D Rhap (1→; polymer 3 is a
branched teichuronic acid containing monosaccharides residues GlcA, Gal, Man, and Glc at the a 1 : 1 : 1 : 5 ratio
(see the text for the structures). Glycopolymers with these structures were identified in prokaryotic microorganisms
for the first time. Species specific sets of cell wall phosphate free glycopolymers of four species from the Rathayibacter
genus (R. tritici VKM Ac 1603T, R. iranicus VKM Ac 1602T, R. toxicus VKM Ac 1600, and “Rathayibacter tanaceti”
VKM Ac 2596) are discussed. All studied strains have a common property - the presence of linear or branched rham
nomannans with D rhamnose, but the positions of glycosidic bonds and side substituents in their molecules are dif
ferent and may serve as usefull chemotaxonomic marker of the genus Rathayibacter.
Keywords: Rathayibacter, cell wall, rhamnomannan, teichuronic acid, D rhamnose, NMR spectroscopy
БИОХИМИЯ том 85 вып. 3 2020