БИОХИМИЯ, 2020, том 85, вып. 3, с. 438 - 448
УДК 577.1
ФОСФАТАЗЫ МОНО И ДИФОСФАТА ТИАМИНА
В СИНАПТОСОМАХ МОЗГА БЫКА
© 2020
В.А. Алешин1,2*, О.А. Меженская3, Ю.М. Пархоменко3,
Т. Кэне4, В.И. Буник1,2,5*
1 Московский государственный университет им. М.В. Ломоносова,
факультет биоинженерии и биоинформатики, 119991 Москва, Россия;
электронная почта: aleshinvasily@gmail.com; bunik@belozersky.msu.ru
2 Московский государственный университет им. М.В. Ломоносова,
НИИ физико*химической биологии им. А.Н. Белозерского, 119991 Москва, Россия
3 Институт биохимии им. А.В. Палладина НАНУ, 01601 Киев, Украина
4 Институт экспериментальной медицины университета имени Отто фон Гюрике, 39120 Магдебург, Германия
5 Первый Московский государственный медицинский университет имени И. М. Сеченова
Министерства здравоохранения Российской Федерации, 119992 Москва, Россия
Поступила в редакцию 31.12.2019
После доработки 08.01.2020
Принята к публикации 09.01.2020
Активности фосфатаз моно и дифосфатов тиамина меняются при нейродегенеративных заболеваниях, од
нако молекулярная природа этих ферментов у млекопитающих не определена в полной мере. В данной ра
боте фракция синаптосом мозга быка, обогащенная фосфатазными активностями в отношении производ
ных тиамина, была подвергнута аффинной хроматографии на модифицированной тиамином сефарозе (ти
амин сефарозе). В последовательных элюатах белков, связавшихся с носителем, растворами тиамина
(рН 7,4 или 5,6), хлорида натрия и мочевины характеризовали фосфатазные активности в отношении тиа
минмонофосфата (ТМФ), тиаминдифосфата (ТДФ) и структурно сходных с тиамином пуриновых нуклео
тидов. Элюируемые на каждой стадии белки идентифицировали методом масс спектрометрии, используя
базу данных SwissProt по всем организмам, ввиду недостаточной аннотации генома быка. В элюате кислым
раствором тиамина идентифицировали пептиды, найденные в двух бактериальных фосфатазах: щелочной
фосфатазе L из семейства DING белков и экзополифосфатазе. Представленность пептидов фосфатазы L во
фракциях элюируемых белков коррелировала с элюцией ТМФ азной активности, а экзополифосфатазы -
с элюцией ТДФ азной активности. Профили элюции данных белков и активностей в отношении фосфатов
тиамина отличались от профилей элюции фосфатаз нуклеотидов, свидетельствуя о специфичности фермен
тов к производным тиамина. Направленный поиск DING фосфатаз млекопитающих в элюатах с тиамин
сефарозы выявил преимущественную элюцию X DING CD4 тиамином (рН 5,6). Для экзополифосфатазы
выявлено структурное сходство с обладающими ТДФ азной активностью апиразами. Полученные результа
ты свидетельствуют в пользу фосфатазных активностей DING белков и апираз млекопитающих в отноше
нии ТМФ и ТДФ соответственно.
КЛЮЧЕВЫЕ СЛОВА: апираза, тиамин, тиаминмонофосфатаза, тиаминдифосфатаза, DING фосфатаза,
HPBP, X DING CD4.
DOI: 10.31857/S0320972520030136
Тиамин (витамин В1) является незамени
лизма - давно известна. Однако помимо этого
мым водорастворимым витамином. Его функ
накоплено большое количество данных о роли
ция как предшественника тиаминдифосфата
тиамина и его производных в качестве регуля
(ТДФ) - кофермента энергетического метабо
торов синаптической нейропередачи и тран
скрипции [1, 2]. В клетках млекопитающих, по
Принятые сокращения: ТМФ - тиаминмонофос
мимо тиамина и ТДФ, который является основ
фат; ТДФ - тиаминдифосфат; тиамин сефароза - моди
ным представителем тиаминового пула, содер
фицированная тиамином сефароза (тиамин N 4 азобен
жится также достаточно много тиаминмоно
зоил ε гидразидсефароза 4В); DING белки - семейство фосфата (ТМФ) [2]. При этом из ферментов,
белков DING (названо по началу N концевой последова
осуществляющих превращения между тиами
тельности); HPBP - фосфат связывающий DING белок
человека; X DING CD4 - секретируемый белок DING из
ном, ТМФ и ТДФ, на молекулярном уровне
CD4(+) Т клеток.
охарактеризованы лишь тиаминдифосфокиназа
* Адресат для корреспонденции.
(EC 2.7.6.2) и кислая фосфатаза простаты
438
СИНАПТОСОМАЛЬНЫЕ ФОСФАТАЗЫ ТМФ И ТДФ
439
(ЕС 3.1.3.5) [3]. Гены многих тканеспецифич
рия); малахитовый зеленый
(«PanReac
ных фосфатаз, обладающих активностями в от
AppliChem», Испания); глицерин («Biomedicals,
ношении фосфатов тиамина, до сих пор не
LLC», США). Растворы готовили на деионизи
идентифицированы [2]. В частности, это отно
рованной воде стандарта Milli Q, использован
сится к синаптосомальным тиамин связываю
ные в работе соли были наивысшей степени
щим белкам мозга млекопитающих, обладаю
чистоты.
щим высокой фосфатазной активностью по от
Тиамин N 4 азобензоил ε гидразидсефаро
ношению к фосфорилированным производным
зу 4В (тиамин сефароза) синтезировали анало
тиамина [4, 5]. В этой связи целью данной рабо
гично ранее опубликованному протоколу [11].
ты было провести масс спектрометрическую
Приготовление образцов для аффинной хро
идентификацию фосфатаз в белковых фракци
матографии. Мозг быков возрастом 1,5-3 года
ях, получаемых очисткой фосфатазных актив
был получен на бойне (г. Киев). Ацетоновый по
ностей синаптосом мозга быка путем аффин
рошок из частично очищенной фракции синап
ной хроматографии, используя модифициро
тосом мозга, обогащенной фосфатазными ак
ванную тиамином сефарозу (тиамин сефарозу).
тивностями по отношению к производным тиа
Актуальность данного исследования для меди
мина [4, 5], получали согласно ранее описанной
цины определяется корреляцией между разви
методике [5] и хранили сухим при -70 °C.
тием болезни Альцгеймера и изменением ак
Экстракцию белков ацетонового порошка про
тивностей ТДФ аз и ТМФ аз в крови пациен
водили согласно ранее описанному протоколу
тов, сопровождающихся снижением уровней
[12].
ТДФ и ТМФ [6]. Поскольку уровень ТДФ, в от
Аффинная хроматография. Хроматографию с
личие от уровня амилоидных агрегатов, корре
использованием тиамин сефарозы проводили
лирует со скоростью метаболизма глюкозы в
аналогично опубликованному протоколу [13].
мозге [7] данные ферменты метаболизма фос
Вкратце, экстракт ацетонового порошка мозга
фатов тиамина могут быть потенциальными
наносили на колонку с тиамин сефарозой,
мишенями для разработки эффективных ком
предварительно уравновешенную буфером элю
бинированных терапий нейродегенеративных
ции (буфер Кребса-Рингера: 24,9 мМ NaHCO3;
заболеваний. Отсутствие же молекулярной
118 мМ NaCl; 2,34 мМ KH2PO4; 4,6 мМ KCl;
идентификации таких фосфатаз не позволяет
1,19 мМ MgSO4; 2,42 мМ CaCl2 и 10 мМ глюко
использовать эти ферменты для таких подходов
зы, pH 7,4). Удаление не связавшихся белков
к лечению заболеваний.
контролировали по оптической плотности элю
Проведенное нами исследование показало,
ата при 280 нм до базовой линии. Связавшиеся с
что плохая молекулярная идентификация фос
тиамин сефарозой белки элюировали буфером
фатаз, участвующих в метаболизме тиамина,
Кребса-Рингера, содержащим 5 мМ раствор тиа
может отчасти быть связана с проблемой анно
мина, рН 7,4 или 10 мМ раствор тиамина,
тации генов эукариот, имеющих, в отличие от
рН 5,6. Для дальнейшей ступенчатой элюции
бактериальных генов, сложную интрон экзон
использовали 10 мМ Tris HCl, рН 7,4, содержа
ную структуру. Например, представители се
щий 1 М NaCl или 2 M мочевину, как описано
мейства белков DING хорошо идентифициро
ранее [12, 13].
ваны у бактерий, но у млекопитающих (в ос
Измерение активности фосфатаз. Активность
новном у человека) обнаружены лишь на уров
фосфатаз измеряли по продукции неорганичес
не мРНК и белка [8-10]. В представленной ра
кого фосфата с использованием одного из сле
боте получены данные в пользу участия плохо
дующих субстратов: ТМФ, ТДФ, AMP, ADP,
идентифицируемых в геномах млекопитающих
ATP, IMP, GDP и GTP. Уровень фосфата опреде
фосфатаз семейства DING в дефосфорилирова
ляли, как описано ранее [12, 14].
нии ТМФ, а апираз - в дефосфорилировании
Измерение концентрации белка в образцах.
ТДФ.
Концентрацию белка определяли по методу
Lowry et al. [15].
Характеристика тиамин зависимых протеомов
МЕТОДЫ ИССЛЕДОВАНИЯ
исследуемых образцов. Элюированные с тиа
мин сефарозы белки разделяли с помощью
Материалы. В исследованиях использованы
электрофореза в денатурирующих условиях с
следующие реактивы: ТДФ, AMP, ADP, ATP,
последующей идентификацией методом масс
GDP, GTP, UMP, Tris HCl, ингибиторы протеаз
спектрометрии (LC MS/MS) после трипсино
AEBSF, апротинин, бестатин, E 64, лейпептин,
лиза, как описано ранее [12]. Ввиду плохой ан
пепстатин А («Sigma», США); тиамин, глюкоза
нотации белков быка в базе UniProtKB/
(«Serva», Германия); ТМФ («Fluca», Швейца
TrEMBL идентификацию пептидов проводили
БИОХИМИЯ том 85 вып. 3 2020
440
АЛЕШИН и др.
по курируемой базе данных UniProtKB/
ков, обладающих высокой подвижностью
SwissProt, используя для поиска программное
структуры.
обеспечение
«Biotools Software for Protein
Analysis» («Bruker», Германия). В связи с отсут
ствием многих белков быка в этой базе поиск
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
пептидов и белков проводили по всем организ
мам. Результаты такого скрининга проверяли и
Аффинная хроматография синаптосомальной
уточняли вручную, осуществляя направленный
фракции мозга быка на тиамин сефарозе. На
поиск гомологичных идентифицированным
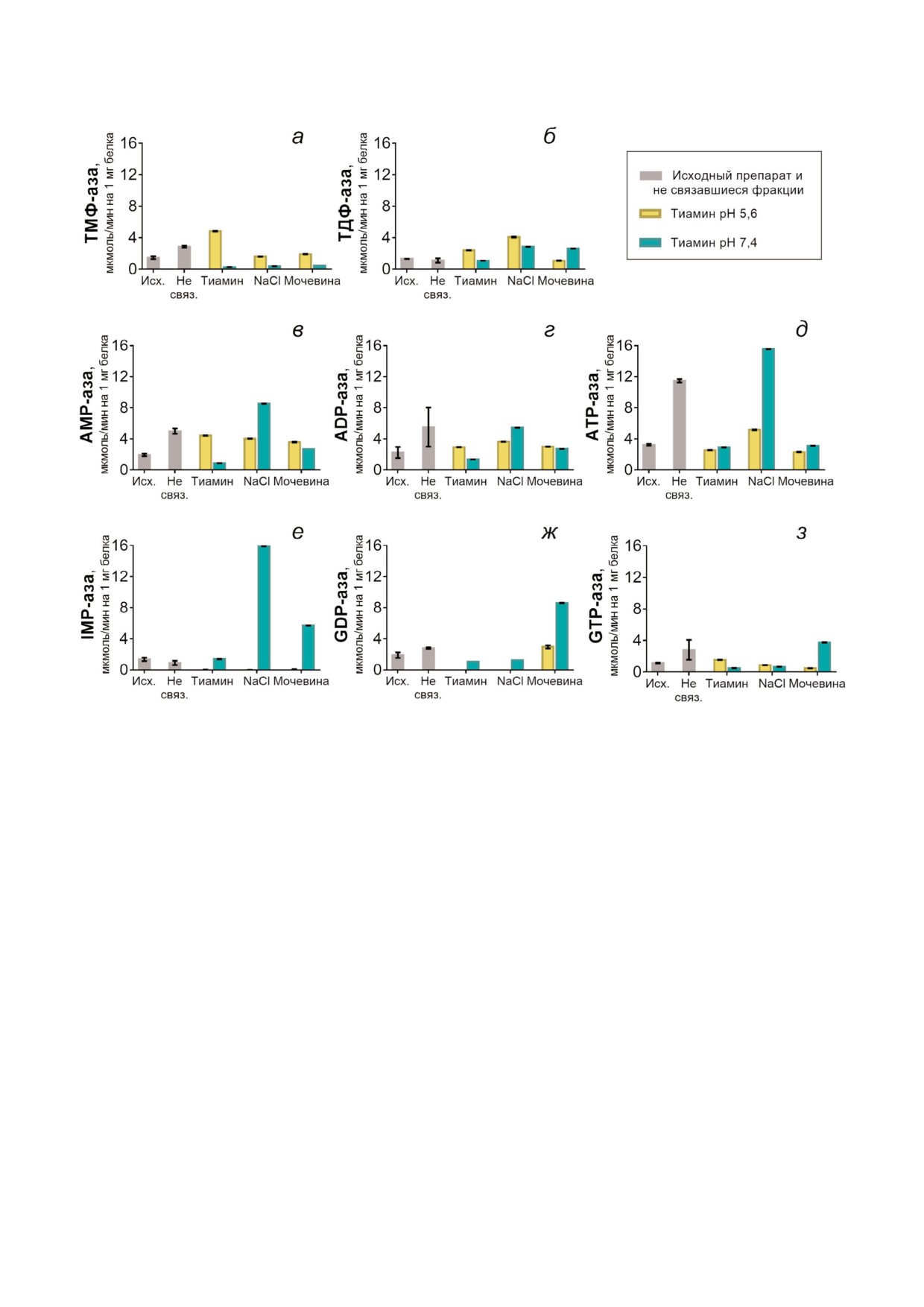
рис. 1 представлены активности фосфатаз из си
фосфатазам белков быка или млекопитающих
наптосомальной фракции мозга быка на разных
по другим базам данных.
стадиях аффинной хроматографии в зависимос
Определение относительного содержания бел
ти от значения pH раствора тиамина (5,6 или
ков в образцах. Содержание исследуемых белков
7,4) на первой, аффинной, стадии элюции. По
в частично очищенных препаратах оценивали с
скольку проведенный ранее анализ показал
помощью полуколичественного метода, осно
структурное сходство белковых комплексов с
вывающегося на пропорциональности между
производными тиамина и пуриновыми нуклео
количеством белка в препарате и долей покры
тидами [1], активности ТМФ аз и ТДФ аз во
тия последовательности белка пептидами, иден
фракциях (рис. 1, а, б) исследовали в сравнении
тифицированными при масс спектрометрии
с активностями в отношении фосфорилирован
[13, 16]. При сравнении разных образцов кон
ных производных пуриновых нуклеотидов -
тролировали параметры общего потока ионов в
AMP, ADP, ATP, IMP, GDP и GTP (рис. 1, в-з).
ходе масс спектрометрической детекции, про
На рис. 1 видно, что активности фосфатаз по от
порционального количеству белка в анализиру
ношению к двум наиболее представленным
емой пробе. Данный параметр мало отличался
фосфорилированным производным тиаминово
между образцами, варьируя в диапазоне
го пула млекопитающих - ТМФ и ТДФ (рис. 1,
1,4·1010-1,7·1010 условных единиц.
а, б) - более специфично элюируются при про
Биоинформатический анализ. Для поиска
ведении аффинной элюции тиамином в кислой
последовательностей DING белков млекопита
среде (рН 5,6). Так, ТМФ аза синаптосом мозга
ющих в базе данных UniProtKB/TrEMBL ис
быка элюируется в основном лишь при кислом
значении рН аффинной элюции (рис. 1, а). Пик
nih.gov/Blast.cgi) - в варианте tblastn с парамет
ТДФ азной активности наблюдали при элюции
рами по умолчанию. Поскольку TrEMBL явля
NaCl (рис. 1, б), однако наиболее высокая и спе
ется не курируемой базой данных, информацию
цифичная в отношении ТДФ активность на
о находках проверяли, используя сервис Uniprot
этой стадии требовала проведения аффинной
элюции при рН 5,6. Если же аффинную элюцию
Множественные выравнивания последова
проводили при рН 7,4, то при последующей
тельностей белков получали, используя алго
элюции NaCl и мочевиной во фракциях обнару
ритм Clustal Omega в сервисе Uniprot, и обраба
живали также значительную активность в отно
шении пуриновых нуклеотидов (рис. 1, в-з). Та
embnet.org/software/BOX_form.html).
ким образом, оптимальная процедура очистки
Поиск гомологов фосфат связывающего
ТМФ азы и ТДФ азы состоит в проведении аф
DING белка человека (HPBP) по его структуре
финной элюции при рН 5,6. Удельная актив
(PDB ID: 2v3q) осуществляли с помощью сер
ность ТМФ азы в данном элюате увеличивается
в 5 раз по сравнению с ТМФ азной активностью
srv/ssm/) с порогом сходства 40%. Аналогично
исходного препарата (рис. 1, а). Увеличение ак
осуществляли поиск гомологов экзополифос
тивности ТДФ аз по сравнению с исходным
фатазы Q9ZN70, используя структуру 1u6z с на
препаратом на стадии кислой (рН 5,6) аффин
ибольшей (40%) идентичностью последова
ной элюции - в 2 раза, а в максимуме, т.е. на
тельности. Выравнивания структур получали с
стадии элюции NaCl после кислой аффинной
элюции - в 3 раза (рис. 1, б).
проверяли с помощью алгоритма гибкого
Идентификация тиамин зависимых фосфатаз,
элюируемых при аффинной хроматографии на ти
sanfordburnham.org/). Согласно этому алгорит
амин сефарозе. Для идентификации синаптосо
му, для выравнивания структур 2v3q и 2qry, а
мальных фосфатаз ТМФ и ТДФ использовали
также 1u6z и 4brh не требуется введения допол
масс спектрометрический анализ белковых
нительных изгибов белковых цепей, которые
элюатов, полученных при аффинной хромато
могут быть необходимы для выравнивания бел
графии на тиамин сефарозе (см. «Материалы и
БИОХИМИЯ том 85 вып. 3 2020
СИНАПТОСОМАЛЬНЫЕ ФОСФАТАЗЫ ТМФ И ТДФ
441
Рис. 1. Активности фосфатаз при хроматографии белков синаптосомальной фракции мозга быка на тиамин сефарозе.
Показаны активности ТМФ азы (а), ТДФ азы (б), AMP азы (в), ADP азы (г), ATP азы (д), IMP азы (е), GDP азы (ж) и
GTP азы (з) в исходных препаратах (Исх.) и не связавшихся с тиамин сефарозой (Не связ.) фракциях белков, а также в
элюатах растворами тиамина (рН 5,6 или 7,4), NaCl и мочевиной. Хотя вариации рН элюента были лишь при аффинной
элюции раствором тиамина, результаты последующей элюции NaCl и мочевиной зависели от первой стадии. Поэтому два
цвета для активностей фосфатаз в элюатах даны для всех стадий элюции. Цветовой код указан в представленной на ри
сунке легенде. Данные получены по трем независимым хроматографическим экспериментам и представлены в виде сред
них значений ± SEM.
biokhsm/
методы»). Определяемые в результате такого
ата. Вместо этого для характеристики степени
анализа наборы белков составляют так называе
очистки мы использовали увеличение удельной
мые тиаминовые протеомы [12, 13]. В элюируе
активности целевых ферментов (рис. 1) и полу
мой тиамином фракции масс спектрометричес
количественную оценку представленности бел
ки определили ~100 белков, наиболее представ
ка по покрытию его аминокислотной последо
ленными из которых были высоко экспрессиру
вательности идентифицированными масс
емые глутаматдегидрогеназа и малатдегидроге
спектрометрически пептидами аннотированных
назы, взаимодействующие с тиамином и его
фосфатаз (таблица).
производными [13]. Поэтому аффинную очист
Поиск тиамин зависимых фосфатаз в элюи
ку тиамин зависимых фосфатаз, экспрессируе
руемых протеомах проводили с использованием
мых в значительно меньшей степени, чем фер
следующих критериев: идентифицированные
менты центрального метаболизма, нельзя оха
пептиды должны принадлежать белкам, анноти
рактеризовать с помощью электрофоретическо
рованным как фосфатазы, их содержание в не
го анализа исходного препарата и фракций элю
связавшихся с тиамин сефарозой фракциях
10 БИОХИМИЯ том 85 вып. 3 2020
442
АЛЕШИН и др.
Представленность фосфатаз, их гомологов и белковых партнеров в элюатах белков синаптосомальной фракции мозга бы
ка с тиамин сефарозы, по данным масс спектрометрии
Покрытие пептидами, %, в элюатах с тиамин сефарозы
Белок (ID)
Не св.
Тиамин (рН 5,6)
NaCl
Мочевина
Фосфатазы
Фосфатаза L (P35482)
-
11
-
6
Экзополифосфатаза (Q9ZN70)
-
2
7
-
Белки семейства DING человека
X DING CD4 (R4H484)
4
9
-
4
HPBP (P85173)
12
2
6
7
Партнер фосфат связывающего белка человека HPBP
Параоксоназа 1 (P27169)
-
-
-
6
Примечание. Суммированы результаты определения фосфатаз во фракции не связавшихся с тиамин сефарозой белков
(Не св.), при кислой (рН 5,6) элюции тиамином и последующих элюциях NaCl и мочевиной. При слабощелочной (рН 7,4)
элюции тиамином и последующих элюциях NaCl и мочевиной данные белки не определялись. Покрытие идентифициро
ванными масс спектрометрически пептидами указанных в таблице белков представлено в % общей длины пептидов от
длины последовательности данного белка.
должно быть мало по сравнению с содержани
мг белка (рис. 1, а), было определено меньше
ем в элюатах с тиамин сефарозы, а элюция
пептидов фосфатазы L, покрытие последова
должна определяться аффинной стадией. Из
тельности 6% (таблица). Активности ТМФ аз в
определенных в элюатах с аффинной колонки
других образцах были ниже и могли соответ
пептидов аннотированных фосфатаз данным
ствовать фосфатазам, не имеющим высокой
критериям удовлетворяли лишь пептиды двух
специфичности к ТМФ (рис. 1).
фосфатаз Pseudomonas aeruginosa: щелочной
Активность ТДФ аз была наибольшей
фосфатазы L (P35482) и экзополифосфатазы
(4,1 ± 0,1 мкмоль/мин на мг белка) при элюции
(Q9ZN70). Профили элюции пептидов этих
NaCl после кислой (рН 5,6) элюции раствором
двух фосфатаз отличались (таблица) аналогич
тиамина. В этих же условиях наблюдали наи
но профилям элюции ТМФ азы и ТДФ азы со
больший уровень определения пептидов экзо
ответственно (рис. 1). При этом элюция обеих
полифосфатазы (7% покрытия последователь
фосфатаз была чувствительна к аффинной ста
ности). На предшествующей стадии элюции
дии, т.к. ферменты были идентифицированы
тиамином (рН
5,6) и активность ТДФ аз
лишь после аффинной элюции при рН 5,6, но
(2,4 ± 0,1 мкмоль/мин на мг белка), и количест
не 7,4 (таблица).
во пептидов экзополифосфатазы (2% покрытия)
Относительная представленность пептидов
были меньше по сравнению с их максимальным
данных фосфатаз во фракциях, элюируемых
значением в элюате NaCl (рис. 1, таблица).
тиамином с тиамин сефарозы (таблица), кор
Поиск гомологов фосфатазы L из семейства
релировала с уровнями фосфатазных активнос
DING, аннотированных у млекопитающих. Иден
тей в элюатах после аффинной хроматографии
тификация пептидов рассмотренных выше бак
(рис. 1, а, б). Для пептидов фосфатазы L на
териальных ферментов при аффинной хрома
блюдали корреляцию с уровнем активности
тографии белков быка указывала на присутствие
ТМФ аз, а для пептидов экзополифосфатазы -
в элюатах ортологичных бактериальным фосфа
с уровнем активности ТДФ аз (рис. 1, таблица).
тазам ферментов быка, последовательности ко
Так, наибольшую активность ТМФ аз
торых отсутствуют в курируемой базе данных
(4,8 ± 0,1 мкмоль/мин на мг белка) детектиро
SwissProt. Поэтому для идентификации фосфа
вали при кислой (рН 5,6) элюции раствором тиа
таз быка мы проводили направленный поиск
мина. В элюате были определены пептиды фос
идентифицированных пептидов аннотирован
фатазы L, покрывающие 11% ее последователь
ных фосфатаз бактерий в последовательностях
ности. В элюате мочевиной, где активность
млекопитающих, используя базу UniProtKB/
ТМФ азы составляла 1,9 ± 0,1 мкмоль/мин на
TrEMBL (см. «Материалы и методы»). В резуль
БИОХИМИЯ том 85 вып. 3 2020
СИНАПТОСОМАЛЬНЫЕ ФОСФАТАЗЫ ТМФ И ТДФ
443
тате поиска мы столкнулись с проблемой иден
совпадал с таковым для пептидов щелочной
тификации DING белков, представителем ко
фосфатазы L (таблица), что указывает на при
торых была бактериальная фосфатаза L, в гено
надлежность пептидов одному и тому же орто
мах млекопитающих [17-20]. Из семейства дан
логичному белку DING из генома быка. Корре
ных белков лишь последовательности белков
ляция же представленности пептидов данных
человека HPBP [8, 21] и X DING CD4 [22, 23]
белков (таблица) с уровнями ТМФ азной актив
(таблица) определены достоверно. Гомология
ности в элюатах (рис. 1, а) указывает на то, что
данных белков человека с бактериальной фос
ортолог бактериальной фосфатазы L у живот
фатазой L (таблица) следует из принадлежности
ных, такой как белок X DING CD4 или его го
к общему семейству белков DING и 54-66%
молог, является ТМФ азой. При выравнивании
сходства между последовательностями (рис. 2).
последовательностей один из идентифициро
Проведенный нами направленный поиск пеп
ванных пептидов, соответствующий консерва
тидов Х DING CD4 показал, что данная фос
тивному для этих последовательностей участку,
фатаза была представлена в не связавшихся с
определен как общий для бактериальной фос
тиамин сефарозой белках меньше (4% покры
фатазы L и X DING CD4 человека (рис. 2). От
тия), чем при специфической элюции тиамином
сутствие совпадения других выявленных пепти
(11% покрытия, таблица). При этом профиль
дов бактериальной фосфатазы L и X DING
элюции пептидов фосфатазы X DING CD4
CD4 белка человека, очевидно, определено
Рис. 2. Множественное выравнивание (Clustal Omega) последовательностей белков семейства DING, пептиды которых
идентифицированы при аффинной хроматографии на тиамин сефарозе. X DING CD4 - R4H484, HPBP - P85173, ще
лочная фосфатаза L (APh L) - P35482. Найденные уникальные пептиды отмечены зелеными рамками.
biokhsm/
БИОХИМИЯ том 85 вып. 3 2020
10*
444
АЛЕШИН и др.
структурными отличиями данных фосфатаз у
вать о прочном связывании с тиамин сефарозой
человека и быка.
комплекса HPBP с параоксаназой. Частичное
Определенные в элюатах пептиды другого
разрушение данного комплекса идет под
представителя семейства DING белков млеко
действием NaCl, приводя к элюции НРВР.
питающих
- фосфат связывающего белка
Связь же параоксаназы с тиамин сефарозой
HPBP - не совпадают с пептидами X DING
разрушается лишь при элюции мочевиной, при
CD4 и фосфатазы L при выравнивании их по
водя к идентификации обоих белков комплекса
следовательностей (рис. 2). Наблюдаются и су
в данном элюате (таблица).
щественные отличия профилей элюции пепти
Таким образом, поиск бычьих ортологов из
дов HPBP и фосфатазы L или X DING CD4
вестных DING белков человека показал нали
(таблица). Эти результаты свидетельствовали о
чие двух представителей семейства DING во
присутствии как минимум двух DING белков в
фракции синаптосом мозга быка. Бычий орто
элюатах с тиамин сефарозы.
лог фосфатазы X DING CD4 человека эффек
При элюции тиамином (рН 5,6) фосфат свя
тивно элюируется кислым раствором тиамина
зывающий белок HPBP практически не детек
одновременно с ТМФ азной активностью. Бы
тировался (2% покрытия), но был наиболее вы
чий ортолог фосфат связывающего белка HPBP,
соко представлен (12% покрытия) во фракции
по видимому, связывается с тиамин сефарозой
белков, не связавшихся с тиамин сефарозой
через параоксоназу 1, а в изолированном виде
(таблица). При элюции белков с тиамин сефа
находится среди не связавшихся с аффинным
розы неспецифическими агентами (NaCl и мо
носителем белков. Хотя наши результаты не по
чевиной) HPBP детектировали на промежуточ
казали высокого уровня ТМФ азной или ТДФ
ном уровне (6-7% покрытия). Такой профиль
азной активностей в элюируемой мочевиной
элюции не соответствует ни одной из детекти
фракции белков (рис. 1), это могло быть связано
рованных нами фосфатазных активностей
с инактивацией фермента в условиях элюции.
(рис. 1), хотя для HPBP показано наличие ак
Не исключено, что активность HPBP в отноше
тивности щелочной фосфатазы в стандартном
нии фосфатов тиамина требует комплекса с па
анализе с пара нитрофенилфосфатом [24]. Раз
раоксаназой. В связи с известными данными об
личие профилей элюции пептидов, соответству
активности щелочной фосфатазы в отношении
ющих последовательностям щелочной фосфата
ТДФ [26] и наличием активности щелочной
зы L и белка HPBP, отсутствие корреляции
фосфатазы у НРВР [24] представляется пер
уровня HPBP и активности ТМФ аз или ТДФ
спективным дальнейшее исследование участия
аз (рис. 1, а, б) и наличие значительной части
НРВР в метаболизме фосфатов тиамина.
этого белка во фракции белков, не связавшихся
Гомология DING белка человека и бактери
с тиамин сефарозой (таблица), дает основания
ального тиамин связывающего белка. Наличие
считать, что определенные в элюатах синапто
структурного и/или функционального сходства
сом мозга быка пептиды соответствуют таковым
может указывать на гомологию белков с низкой
бычьего ортолога HPBP, а не другому представи
консервативностью аминокислотных последо
телю DING белков - X DING CD4.
вательностей. Используя сервис PDBeFold и
Следует отметить, что представленность
структуру DING белка человека HPBP (PDB
пептидов HPBP во фракциях элюата с аффин
ID: 2v3q) - единственного DING белка млеко
ной колонки была наиболее высока (7% покры
питающих с известной пространственной
тия) в элюате мочевиной, где также детектиро
структурой, - был проведен поиск его структур
вали параоксоназу 1 (таблица). Гидролизующая
ных гомологов (см. «Методы исследования»).
лактоны, эфиры и фосфорорганические соеди
Помимо бактериальных представителей семей
нения параоксоназа 1 (ген PON1) прочно связы
ства DING белков данный поиск определил
вает HPBP и соочищается с ним при выделении
структурное сходство DING белка человека
из плазмы крови человека [9]. Взаимодействие
HPBP с бактериальными субъединицами АВС
этих белков функционально значимо для под
транспортеров. Хотя наибольшим структурным
держания стабильности параоксоназы 1 [25]. В
сходством с фосфат связывающим DING бел
связи с этим возможно, что с тиамин сефарозой
ком человека HPBP обладали фосфат связыва
связывается не сам HPBP, а прочно взаимодей
ющие белки PstS, в качестве гомолога был иден
ствующая с ним параоксоназа 1. В этом случае
тифицирован также белок ThiB Escherichia coli
детекция значительной части НРВР во фракции
(PDB ID: 2qry), связывающий тиамин, ТМФ и
не связавшихся с тиамин сефарозой белков
ТДФ. Гомологичные белки DING и PstS пока
(таблица) может объясняться его свободным от
зывают до 30% идентичности по аминокислот
параоксаназы состоянием. Наблюдаемый же
ной последовательности [17]. Сходство после
профиль элюции НРВР может свидетельство
довательностей HPBP и ThiB E. coli незначи
БИОХИМИЯ том 85 вып. 3 2020
СИНАПТОСОМАЛЬНЫЕ ФОСФАТАЗЫ ТМФ И ТДФ
445
правленном поиске идентифицированных пеп
тидов экзополифосфатазы в базе данных
UniProtKB/TrEMBL не были обнаружены зна
чимые совпадения с имеющимися на данный
момент последовательностями млекопитающих.
Анализ доменной структуры экзополифосфата
зы P. aeruginosa показал, что на N конце ее по
следовательности аннотирован экзополифосфа
тазный/гуанозинпентафосфатфосфогидролаз
ный домен Ppx GppA (PF02541). Из недавно по
лученной трехмерной структуры гомолога этого
фермента из E. сoli следует, что оставшаяся часть
последовательности экзополифосфатазы фор
мирует второй не охарактеризованный C конце
вой домен [28]. Используя разрешенную струк
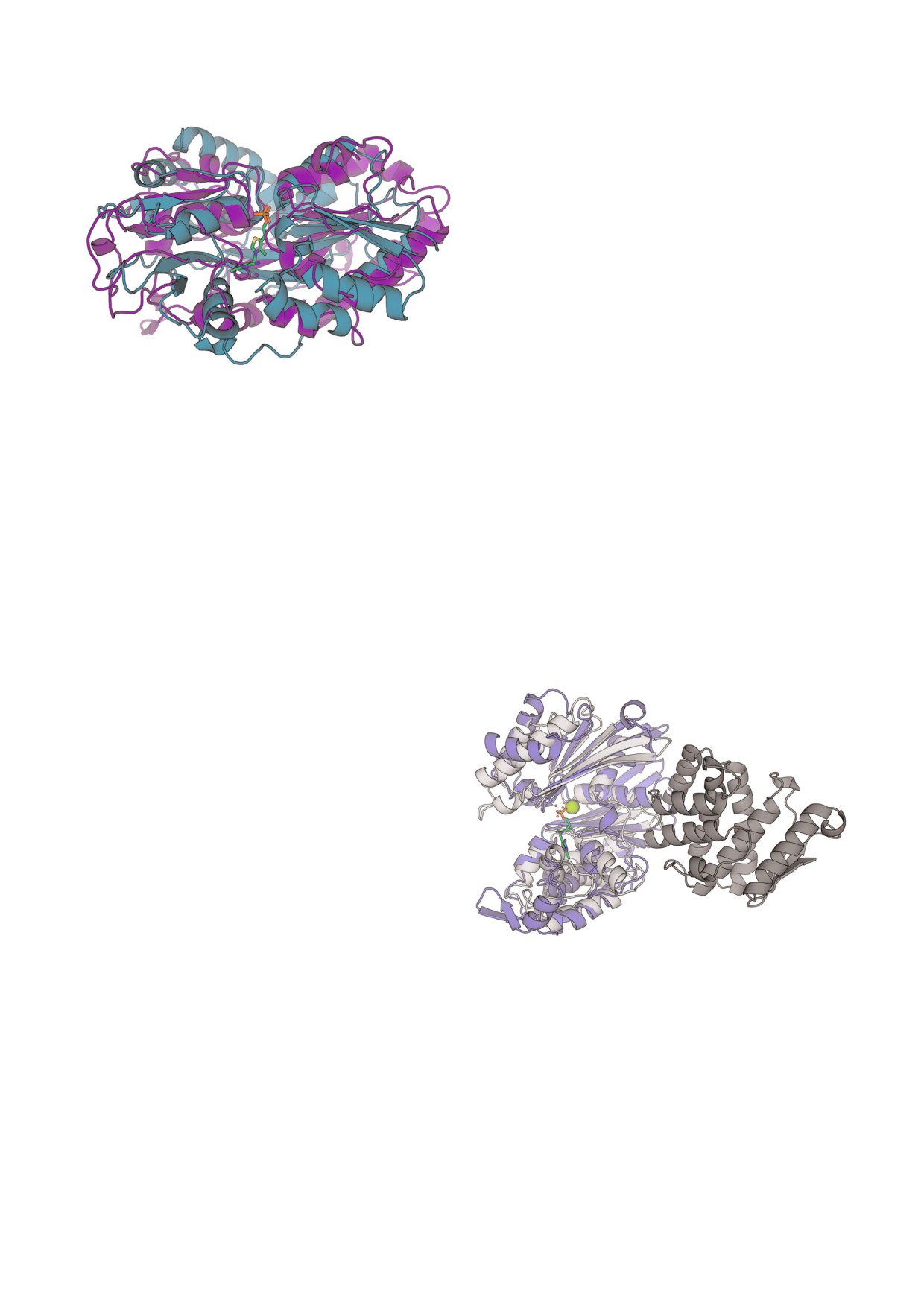
Рис. 3. Структурное выравнивание фосфат связывающего
белка человека HPBP из семейства DING (PDB ID: 2v3q,
туру ближайшего гомолога определенной нами
белок показан фиолетовым) и бактериального тиамин
экзополифосфатазы (PDB ID: 1u6z, идентич
связывающего белка ThiB (PDB ID: 2qry, белок показан
ность 40%), мы провели поиск гомологичных
бирюзовым) с фосфатом (оранжевые связи с красными
атомами кислорода) и ТМФ (зеленые атомы углерода) со
белков млекопитающих с помощью PDBeFold.
ответственно.
Помимо бактериальных белков такой поиск об
С цветным вариантом рис. 3 можно ознакомиться в элек
наружил гомологию с эктонуклеозидтрифосфат
дифосфогидролазами (апиразами) крысы (на
journal/biokhsm/
примере одного из паралогов, кодируемого ге
ном ENTPD2) [29]. Анализ найденного сходства
тельное - всего 15% идентичных остатков. Од
показал, что апиразный домен (GDA1_CD39,
нако выравнивание структур белков НРВР и
PF01150) относится к тому же структурному се
ThiB (рис. 3) показывает не только общее строе
мейству SCOP (Ppx/GppA phosphatase), что и N
ние, проявляющееся в соответствии элементов
концевой домен экзополифосфатаз/гуанозинпен
вторичной структуры, но и совпадение центров
тафосфатфосфогидролаз (Ppx GppA, PF02541).
белков, связывающих фосфат и фосфатную
группу ТМФ (рис. 3). Таким образом, обнаруже
но функциональное и структурное сходство бел
ков HPBP и ThiB.
Идентификация экзополифосфатазы как по
тенциальной ТДФ азы. Профиль элюции пепти
дов экзополифосфатазы P. aeruginosa, иденти
фицированных при аффинной хроматографии
на тиамин сефарозе при кислой элюции тиами
ном (пептид YAQAYTAAR) и NaCl (пептиды
VQLAAGLDEER, YAQAYTAAR и HGAYLIEHS
DLAGFSR), соответствует профилю элюции
ТДФ азной активности (таблица, рис. 1). Экзо
полифосфатаза относится к семейству экзопо
лифосфатаз/гуанозинпентафосфатфосфогидро
лаз и является многофункциональным фермен
том, гидролизующим полифосфаты до ортофос
фатов при возможном сопряжении данной реак
Рис. 4. Структурное выравнивание экзополифосфатазы и
ции с ADP киназной [27]. Таким образом, сведе
апиразы. В структуре экзополифосфатазы из E. coli (PDB
ID: 1u6z) N концевой домен показан светло серым, а С
ния о данном ферменте не исключают связыва
концевой домен - темно серым. В структуре апиразы из
ния и гидролиза ТДФ, обладающего структур
Legionella pneumophila (PDB ID: 4brh) апиразный домен по
ным сходством с АДФ, в его активном центре.
казан голубым. Апираза включает ион магния (показан в
Аминокислотная последовательность экзо
виде зеленой сферы) и ванадийсодержащий аналог ТДФ.
полифосфатазы P. aeruginosa не гомологична та
Атомы ванадата показаны маленькими шариками, атомы
углерода аналога ТДФ показаны зеленым, цвета других ато
ковой экзополифосфатазы млекопитающих (ген
мов даны в соответствии со стандартной цветовой схемой.
PRUNE1). Определить гомологи бактериальной
С цветным вариантом рис. 4 можно ознакомиться в элек
экзополифосфатазы у млекопитающих не уда
лось и с использованием поиска blast. При на
journal/biokhsm/
БИОХИМИЯ том 85 вып. 3 2020
446
АЛЕШИН и др.
Хотя в базе Pfam эти домены имеют разные
в элюатах тиамином и NaCl соответственно.
идентификаторы, ввиду отсутствия достаточно
Профили элюции данных активностей коррели
го сходства их аминокислотных последователь
руют с масс спектрометрической идентифика
ностей, пространственная структура N концево
цией пептидов фосфатаз, элюируемых с тиа
го домена экзополифосфатазы хорошо выравни
мин сефарозы в зависимости от рН аффинной
вается со структурой апиразы (рис. 4). Более то
элюции. Структурный анализ аннотированных
го, известно связывание и гидролиз ТДФ апира
фосфатаз, включающих идентифицированные в
зами [29]. Таким образом, экзополифосфатаза,
элюатах с тиамин сефарозы пептиды, показал,
идентифицированная по элюируемым с тиа
что ТМФ аза мозга быка может быть ортологом
мин сефарозы пептидам, не гомологична экзо
белка человека X DING CD4, тогда как ТДФ аза
полифосфатазе млекопитающих, но имеет
мозга быка может быть апиразой. Обнаружено
структурное сходство с апиразами.
опосредованное параоксоназой 1 связывание
Каталитической особенностью апираз явля
на тиамин сефарозе DING белка, ортологично
ется их способность гидролизовать как три , так
го белку человека HPBP, обладающему актив
и дифосфатные производные при отсутствии
ностью щелочной фосфатазы.
способности расщеплять монофосфаты [29]. В
этой связи следует отметить, что фосфатазная
активность синаптосомальных фракций по от
Финансирование. Работа выполнена при фи
ношению к тиаминтрифосфату соочищается с
нансовой поддержке Российского фонда фунда
фосфатазной активностью к ТДФ [4]. Такая осо
ментальных исследований в рамках научного
бенность может указывать на принадлежность
проекта № 18 34 00235.
синаптосомальной фосфатазы ТДФ и/или тиа
Конфликт интересов. Авторы заявляют об от
минтрифосфата к группе апираз. Кроме того,
сутствии конфликта интересов.
свойства ранее выделенной, но не охарактери
Соблюдение этических норм. Все примени
зованной на молекулярном уровне мембранной
мые международные, национальные и/или ин
ТДФ азы мозга крысы [30], во многом совпада
ституциональные принципы ухода и использо
ют с известными свойствами апираз млекопита
вания животных были соблюдены. В частности,
ющих.
все эксперименты с животными проводили с
соблюдением этических норм согласно «Прави
Аффинная хроматография экстракта синап
лам проведения работ с использованием экспе
тосом мозга быка на тиамин сефарозе при кис
риментальных животных», утвержденным ди
лой (рН 5,6) элюции тиамином приводит к 4
рективой Евросоюза 2010/63/EU. Эксперимен
кратной очистке ТМФ азы и ТДФ азы по мак
ты были одобрены Комиссией по биоэтике МГУ
симальной удельной активности, определяемой им. М.В. Ломоносова.
СПИСОК ЛИТЕРАТУРЫ
1.
Bunik, V.I., and Aleshin, V.A. (2017) Analysis of the protein
5.
Постоенко В.А., Пархоменко Ю.М., Вовк А.И., Хал
binding sites for thiamin and its derivatives to elucidate the
мурадов А.Г., Донченко Г.В. (1987) Выделение и неко
molecular mechanisms of the noncoenzyme action of thi
торые свойства тиаминсвязывающего белка синапто
amin (vitamin B1), in Studies in natural products chemistry,
сом головного мозга крыс, Биохимия, 52, 1792-1797.
Vol. 53, pp. 375-429, Elsevier, Amsterdam, doi: 10.1016/
6.
Pan, X., Sang, S., Fei, G., Jin, L., Liu, H., Wang, Z., Wang, H.,
b978 0 444 63930 1.00011 9.
and Zhong, C. (2017) Enhanced activities of blood thi
2.
Aleshin, V.A., Mkrtchyan, G.V., and Bunik, V.I. (2019)
amine diphosphatase and monophosphatase in Alzheimer’s
Mechanisms of the non coenzyme action of thiamin: pro
disease, PLoS one, 12, e0167273, doi: 10.1371/journal.
tein targets and medical significance, Biochemistry
pone.0167273.
(Moscow), 84, 829-850, doi: 10.1134/S0006297919080017.
7.
Sang, S., Pan, X., Chen, Z., Zeng, F., Pan, S., Liu, H., Jin, L.,
3.
Hurt, J.K., Coleman, J.L., Fitzpatrick, B.J., Taylor Blake, B.,
Fei, G., Wang, C., Ren, S., Jiao, F., Bao, W., Zhou, W.,
Bridges, A.S., Vihko, P., and Zylka, M.J. (2012) Prostatic
Guan, Y., Zhang, Y., Shi, H., Wang, Y., Yu, X., Wang, Y.,
acid phosphatase is required for the antinociceptive effects
and Zhong, C. (2018) Thiamine diphosphate reduction
of thiamine and benfotiamine, PLoS one, 7, e48562,
strongly correlates with brain glucose hypometabolism in
doi: 10.1371/journal.pone.0048562.
Alzheimer’s disease, whereas amyloid deposition does not,
4.
Parkhomenko, Y.M., Protasova, Z.S., Yanchiy, O.R.,
Alzheimers Res. Ther., 10, 26, doi: 10.1186/s13195 018
Khosla, K., and Donchenko, G.V. (2001) Localization of
0354 2.
thiamine binding protein in synaptosomes from the rat
8.
Diemer, H., Elias, M., Renault, F., Rochu, D., Contreras
brain, Neurophysiology,
33,
135-139, doi:
10.1023/
Martel, C., Schaeffer, C., Van Dorsselaer, A., and
a:1012840417285.
Chabriere, E. (2008) Tandem use of X ray crystallography
БИОХИМИЯ том 85 вып. 3 2020
СИНАПТОСОМАЛЬНЫЕ ФОСФАТАЗЫ ТМФ И ТДФ
447
and mass spectrometry to obtain ab initio the complete and
20.
Sachdeva, R., Li, Y., Shilpi, R.Y., and Simm, M. (2015)
exact amino acids sequence of HPBP, a human 38 kDa
Human X DING CD4 mediates resistance to HIV 1 infec
apolipoprotein, Proteins, 71, 1708-1720, doi: 10.1002/
tion through novel paracrine like signaling, FEBS J., 282,
prot.21866.
937-950, doi: 10.1111/febs.13192.
9.
Renault, F., Chabriere, E., Andrieu, J.P., Dublet, B.,
21.
Morales, R., Berna, A., Carpentier, P., Contreras Martel, C.,
Masson, P., and Rochu, D. (2006) Tandem purification of
Renault, F., Nicodeme, M., Chesne Seck, M. L., Bernier, F.,
two HDL associated partner proteins in human plasma,
Dupuy, J., Schaeffer, C., Diemer, H., Van Dorsselaer, A.,
paraoxonase (PON1) and phosphate binding protein
Fontecilla Camps, J. C., Masson, P., Rochu, D., and
(HPBP) using hydroxyapatite chromatography,
Chabriere, E. (2006) Serendipitous discovery and X ray
J. Chromatogr. B Analyt. Technol. Biomed. Life Sci., 836,
structure of a human phosphate binding apolipoprotein,
15-21, doi: 10.1016/j.jchromb.2006.03.029.
Structure, 14, 601-609, doi: 10.1016/j.str.2005.12.012.
10.
Gonzalez, D., Elias, M., and Chabriere, E. (2014) The
22.
Lesner, A., Shilpi, R., Ivanova, A., Gawinowicz, M.A.,
DING family of phosphate binding proteins in inflammato
Lesniak, J., Nikolov, D., and Simm, M.
(2009)
ry diseases, Adv. Exp. Med. Biol.,
824,
27-32,
Identification of X DING CD4, a new member of human
doi: 10.1007/978 3 319 07320 0_4.
DING protein family that is secreted by HIV 1 resistant
11.
Клящицкий Б.А., Позднев В.Ф., Митина В.Х., Воско
CD4(+) T cells and has anti viral activity, Biochem.
боев А.И., Черникевич И.П. (1980) Выделение и
Biophys. Res. Commun., 389, 284-289, doi: 10.1016/j.bbrc.
очистка биополимеров методом аффинной хромато
2009.08.140.
графии. Аффинная хроматография пируватдекарбок
23.
Ivanova, A., Shilpi, R.Y., Sachdeva, R., Li, G., and Simm, M.
силазы из пивных дрожжей, Биоорганическая химия, 6,
(2012) Native X DING CD4 protein secreted by HIV 1
1572-1579.
resistant CD4+ T cells blocks activity of IL 8 promoter in
12.
Mkrtchyan, G., Aleshin, V., Parkhomenko, Y., Kaehne, T.,
human endothelial cells infected with enteric bacteria,
Di Salvo, M.L., Parroni, A., Contestabile, R., Vovk, A.,
Innate Immun.,
18,
571-579, doi:
10.1177/
Bettendorff, L., and Bunik, V. (2015) Molecular mecha
1753425911427065.
nisms of the non coenzyme action of thiamin in brain: bio
24.
Porzio, E., De Maio, A., Ricciardi, T., Mistretta, C.,
chemical, structural and pathway analysis, Sci. Rep., 5,
Manco, G., and Faraone Mennella, M.R.
(2018)
12583, doi: 10.1038/srep12583.
Comparison of the DING protein from the archaeon
13.
Mezhenska, O.A., Aleshin, V.A., Kaehne, T., Artiukhov, A.V.,
Sulfolobus solfataricus with human phosphate binding pro
and Bunik, V.I. (2020) Regulation of malate dehydrogenas
tein and Pseudomonas fluorescence DING counterparts,
es and glutamate dehydrogenase in animal brain with thi
Extremophiles, 22, 177-188, doi: 10.1007/s00792 017
amine in vitro and in vivo, Biochemistry (Moscow), 85,
0985 4.
27-39, doi: 10.1134/S0006297920010034.
25.
Rochu, D., Renault, F., Clery Barraud, C., Chabriere, E.,
14.
Chan, K.M., Delfert, D., and Junger, K.D. (1986) A direct
and Masson, P. (2007) Stability of highly purified human
colorimetric assay for Ca2+ stimulated ATPase activity,
paraoxonase (PON1): association with human phosphate
Anal. Biochem.,
157,
375-380, doi:
10.1016/0003
binding protein (HPBP) is essential for preserving its active
2697(86)90640 8.
conformation(s), Biochim. Biophys. Acta, 1774, 874-883,
15.
Lowry, O.H., Rosebrough, N.J., Farr, A.L., and Randall, R.J.
doi: 10.1016/j.bbapap.2007.05.001.
(1951) Protein measurement with the Folin phenol reagent,
26.
Вовк А.И., Бабий Л.В., Муравьева И.В. (2002) Относи
J. Biol. Chem., 193, 265-275.
тельная реактивность тиаминмонофосфата и тиамин
16.
Bunik, V., Kaehne, T., Degtyarev, D., Shcherbakova, T.,
дифосфата при взаимодействии со щелочной фосфа
and Reiser, G. (2008) Novel isoenzyme of 2 oxoglutarate
тазой, Укр. биохим. журн., 74, 93-96.
dehydrogenase is identified in brain, but not in heart,
27.
Beassoni, P.R., Gallarato, L.A., Boetsch, C., Garrido, M.N.,
FEBS J., 275, 4990-5006, doi: 10.1111/j.1742 4658.
and Lisa, A.T.
(2015) Pseudomonas aeruginosa
2008.06632.x.
exopolyphosphatase is also a polyphosphate: ADP phos
17.
Berna, A., Bernier, F., Chabriere, E., Perera, T., and Scott, K.
photransferase, Enzyme Res., 2015, 404607, doi: 10.1155/
(2008) DING proteins; novel members of a prokaryotic
2015/404607.
phosphate binding protein superfamily which extends into
28.
Song, H., Dharmasena, M. N., Wang, C., Shaw, G. X.,
the eukaryotic kingdom, Int. J. Biochem. Cell Biol., 40,
Cherry, S., Tropea, J. E., Jin, D. J., and Ji, X. (2019)
170-175, doi: 10.1016/j.biocel.2007.02.004.
Structure and activity of PPX/GppA homologs from
18.
Collombet, J.M., Elias, M., Gotthard, G., Four, E.,
Escherichia coli and Helicobacter pylori, FEBS J.,
Renault, F., Joffre, A., Baubichon, D., Rochu, D., and
doi: 10.1111/febs.15120.
Chabriere, E. (2010) Eukaryotic DING proteins are
29.
Zebisch, M., Krauss, M., Schafer, P., Lauble, P., and
endogenous: an immunohistological study in mouse tissues,
Strater, N. (2013) Crystallographic snapshots along the
PLoS One, 5, e9099, doi: 10.1371/journal.pone.0009099.
reaction pathway of nucleoside triphosphate diphosphohy
19.
Cherrier, T., Elias, M., Jeudy, A., Gotthard, G., Le Douce,
drolases, Structure, 21, 1460-1475, doi: 10.1016/j.str.
V., Hallay, H., Masson, P., Janossy, A., Candolfi, E., Rohr,
2013.05.016.
O., Chabriere, E., and Schwartz, C. (2011) Human
30.
Sano, S., Matsuda, Y., Miyamoto, S., and Nakagawa, H.
Phosphate Binding Protein inhibits HIV 1 gene transcrip
(1984) Thiamine pyrophosphatase and nucleoside diphos
tion and replication, Virol. J., 8, 352, doi: 10.1186/1743
phatase in rat brain, Biochem. Biophys. Res. Commun., 118,
422X 8 352.
292-298, doi: 10.1016/0006 291x(84)91099 4.
БИОХИМИЯ том 85 вып. 3 2020
448
АЛЕШИН и др.
PHOSPHATASES OF THIAMINE MONO AND DIPHOSPHATES
IN BOVINE BRAIN SYNAPTOSOMES
V. A. Aleshin1,2*, O. A. Mezhenska3, Y. M. Parkhomenko3, T. Kaehne4, and V. I. Bunik1,2,5*
1 Lomonosov Moscow State University, Faculty of Bioengineering and Bioinformatics,
119991 Moscow, Russia; E*mail: aleshinvasily@gmail.com; bunik@belozersky.msu.ru
2 Belozersky Institute of Physico*Chemical Biology, Lomonosov Moscow State University, 119991 Moscow, Russia
3 Palladin Institute of Biochemistry, National Academy of Sciences of Ukraine, 01601 Kyiv, Ukraine
4 Institute of Experimental Internal Medicine, Otto von Guericke University, 39120 Magdeburg, Germany
5 Sechenov First Moscow State Medical University Ministry of Health of the Russian Federation, 119992 Moscow, Russia
Received December 31, 2019
Revised January 8, 2020
Accepted January 9, 2020
Activities of the thiamine mono and diphosphate phosphatases change in neurodegenerative diseases, but molecular
identification of these enzymes in mammals is incomplete. In this work, bovine brain synaptosomes fraction, enriched
with phosphatase activities toward the thiamine derivatives, was subjected to affinity chromatography using thiamine
Sepharose. Proteins bound to the affinity sorbent were sequentially eluted with solutions of thiamine (pH 7.4 or 5.6),
sodium chloride and urea, and the eluates were assayed for phosphatase activities toward thiamine monophosphate
(ThMP), thiamine diphosphate (ThDP) and structurally similar purine nucleotides. Protein sets in each eluted frac
tion were identified by mass spectrometry; the SwissProt database for all organisms was used due to insufficient anno
tation of the bovine genome. In the acidic thiamine eluates, we identified peptides of two bacterial phosphatases -
alkaline phosphatase L from the family of DING proteins and exopolyphosphatase. The representation of the pep
tides of phosphatase L and exopolyphosphatase in the eluates correlated with the elution of the ThMPase and
ThDPase activities, respectively. The elution profiles of these phosphatase activities differed from those of nucleotide
phosphatases, pointing to the phosphatase specificities toward the thiamine derivatives. Targeted search for mam
malian DING phosphatases in eluates from thiamine Sepharose revealed predominant elution of X DING CD4
protein with acidic (pH 5.6) thiamine solution. Structural similarity of the exopolyphosphatase (identified by pep
tides) with apyrases possessing ThDPase activity was revealed. The results obtained support the correspondence of
ThMPase and ThDPase activities to mammalian DING proteins and apyrases, respectively.
Keywords: apyrase, thiamine, thiamine monophosphatase, thiamine diphosphatase, DING phosphatase, HPBP,
X DING CD4
БИОХИМИЯ том 85 вып. 3 2020