БИОХИМИЯ, 2020, том 85, вып. 4, с. 459 - 475
УДК 577.3
АМИНОКИСЛОТЫ КАК РЕГУЛЯТОРЫ МЕТАБОЛИЗМА КЛЕТКИ
Обзор
© 2020
С.В. Нестеров1,2, Л.С. Ягужинский1,3*, Г.И. Подопригора1, Я.Р. Нарциссов1
1 НИИ цитохимии и молекулярной фармакологии,
115404 Москва, Россия; электронная почта: yag@genebee.msu.ru
2 Московский физико&технический институт, 141701 Долгопрудный, Московская обл., Россия
3 НИИ физико&химической биологии им. А.Н. Белозерского,
Московский государственный университет им. М.В. Ломоносова, 119991 Москва, Россия
Поступила в редакцию 03.10.2019
После доработки 10.02.2020
Принята к публикации 11.02.2020
Обзор посвящён исследованию принципов регуляции и синхронизации процессов метаболизма в клетках
млекопитающих. В работе использовали модель двухкомпонентного устройства метаболизма клетки, вклю
чающую управляющую сигнальную систему, которая регулирует основные ферментные системы, и испол
нительную метаболическую систему, непосредственно осуществляющую биосинтез. Такое рассмотрение
позволило выделить два переходных состояния метаболизма (от катаболизма к анаболизму и обратно), в ко
торых происходят основные перестройки в сигнальной системе. Сигнальная система природных аминокис
лот (АК) выбрана для обзора как наиболее удобный фрагмент общего метаболизма клетки, поскольку АК
участвуют и в сигнальной, и исполнительной подсистемах метаболизма. В работе разработан графический
способ представления событий, позволивший продемонстрировать последовательность процессов, проте
кающих в обеих подсистемах метаболизма в ходе прохождения полного метаболического цикла неделящей
ся клеткой. Выявлена важная особенность сигнальной системы АК: их сигнальные свойства определяются
не только структурой молекулы, но и местом локализации в клетке. Выделены четыре основные сигналь
ные группы АК, локализованные в лизосомах, митохондриях, цитозоле и внеклеточном пространстве, при
легающем к плазматической мембране. Эти группы АК схожи по составу, но имеют при этом различные ре
цепторы. Построенная в работе схема системы регуляции метаболизма сигналами АК способна служить ба
зой для разработки более полной пространственно временной схемы регуляции метаболизма, включающей
широкое множество внутриклеточных сигнальных каскадов.
КЛЮЧЕВЫЕ СЛОВА: аминокислоты, внутриклеточная сигнализация, mTORC1, AMPK, лизосома,
катаболизм, анаболизм.
DOI: 10.31857/S0320972520040016
Настоящая работа посвящена исследованию
катаболизм. При анаболизме активны системы
системы синхронизации (в пространстве и вре
синтеза сложных соединений, а при катаболиз
мени) биохимических процессов в системе об
ме преобладают процессы распада.
щего метаболизма клетки. Этой проблемой мы
В данном обзоре метаболизм клетки рас
начали заниматься ещё на этапе формирования
смотрен на основе двухкомпонентной модели,
современных представлений о молекулярном
включающей исполнительную метаболическую
устройстве сигнальных систем клетки [1, 2],
систему клетки, выполняющую процессы био
опираясь, в том числе, на работы Вебера [3-5].
синтеза (основа описания этой системы заложе
Веберу удалось выделить две антагонистичные
на Вебером), и сигнально управляющую систе
группы ферментов, показать синхронную акти
му, регулирующую работу исполнительной сис
вацию ферментов каждой группы и синхронное
темы. В настоящее время выделение двух основ
переключение между этими двумя группами.
ных состояний метаболизма на уровне исполни
Фактически на уровне ферментативных процес
тельных систем уже стало общепринятым. Акту
сов Вебер эмпирически выделил анаболизм и
альной научной задачей является расшифровка
механизмов функционирования сигнальных
систем, которые обеспечивают синхронизацию
Принятые сокращения: АК
- аминокислоты;
GAP - белок активатор ГТФазной активности; GEF -
работы внутри анаболического и катаболиче
фактор обмена гуаниловых нуклеотидов.
ского ферментативных кластеров и переключе
* Адресат для корреспонденции.
ние между ними.
459
460
НЕСТЕРОВ и др.
Переходы между метаболическими режима
АК и наличия других необходимых для роста
ми в клетке индуцируются внешними и внут
факторов активирует анаболизм. Существенное
ренними сигналами, такими как гормоны (адре
влияние оказывают сигналы АК также на АМФ
налин, глюкагон, инсулин), стрессовые факто
зависимую киназу (AMPK) и NAD+ зависимую
ры, сигналы внесения и удаления субстратов
деацетилазу Sirt1. Два последних фермента яв
(сигналы «сытости» и «голода»). Сигнальная
ляются активаторами кластера катаболических
система природных АК выбрана для обзора как
процессов. Все вышеперечисленные белковые
наиболее удобный фрагмент общего метаболиз
регуляторные системы (или их аналоги) присут
ма клетки, на основе которого можно получить
ствуют во всех эукариотических клетках, неза
достаточно полную картину, адекватно отража
висимо от тканевой специфичности в многокле
ющую устройство и принципы функционирова
точных организмах. Таким образом, именно эти
ния системы клеточного метаболизма. Такой
ключевые метаболические регуляторы служат
выбор был сделан потому, что АК органично
центральной частью системы управления мета
включены в обе подсистемы метаболизма клет
болизмом. Необходимо отметить, что для пол
ки - и сигнальную, и исполнительную. В соот
ного представления о метаболизме отдельных
ветствии с этим сигналы АК должны прямо или
типов клеток нужно учитывать также видо и
косвенно контролировать очень широкое мно
ткане специфичные сигнальные каскады, как
жество метаболических процессов. В рамках
связанные с аминокислотами (например, сигна
настоящей работы были рассмотрены именно
лы от глутаматного и глицинового рецепторов
сигналы АК в качестве индукторов перехода от
на плазматических мембранах некоторых кле
катаболизма к анаболизму и обратно (при дефи
ток), так и иной природы (сигналы от рецепто
ците АК). Таким образом, в работе на уровне
ров гормонов, цитокинов и иных сигнальных
сигнальной системы показан полный метаболи
молекул).
ческий цикл неделящихся клеток и проведено
В обзоре разработана схема графического
соответствие между работой сигнальной и ис
представления последовательности событий в
полнительной систем.
сигнальной и исполнительной системах неделя
Переключение между метаболическими ре
щихся эукариотических клеток в процессе пол
жимами осуществляется как путём быстрого
ного метаболического цикла.
включения и выключения уже существующих
Список и минимальное описание функций
ферментов, так и путём регуляции процессов
основных белков, которые были использованы
трансляции и транскрипции, необходимых для
при построении схем сигнально метаболичес
синтеза новых ферментов. Центральную роль в
кой системы, связанной с аминокислотами, да
переносе сигналов играет система пост транс
но в табл. 1. Более подробное описание интере
ляционной модификации белков. На одном
сующих белков и их сигналов можно найти в со
белке под влиянием внешних и внутренних сиг
ответствующих ссылках. Таблица может исполь
налов могут индуцироваться десятки химичес
зоваться вместо списка сокращений, а также для
ких модификаций (фосфорилирование, мети
лучшего понимания представленных далее схем.
лирование и др.), которые влияют на конформа
цию, каталитическую активность и локализа
цию белка [6]. Взаимосвязанная сеть регулятор
ЦЕНТР УПРАВЛЕНИЯ МЕТАБОЛИЗМОМ
ных белков, способных к изменению конфор
НА ПОВЕРХНОСТИ ЛИЗОСОМ
мации, представляет собой кратковременную
(«оперативную») память клетки. Именно эта
Данные последних лет показывают, что глав
система, в первую очередь, перестраивается в
ный сигнальный центр метаболического конт
ответ на внешние раздражители, обеспечивает
роля расположен на внешней поверхности
быстрые стрессовые ответы, а также регулирует
мембраны лизосом [39-41]. При этом ключе
активность генома за счёт модификации факто
вым звеном в сигнальных каскадах АК является
ров транскрипции.
димер малых ГТФаз Rag, который расположен
У эукариот существуют две основные сиг
на белковом комплексе Ragulator, заякоренном
нальные системы пост трансляционной моди
на внешней поверхности лизосомы посредством
фикации белков, управляющие метаболизмом
ковалентной сшивки с жирной кислотой [18], а
непосредственно по сигналу АК: «SOS система»
также за счёт взаимодействия с вакуолярной АТ
интегрального стрессового ответа, переводящая
Фазой (vATPase)
[21]. Комплекс vATPase
клетку в катаболический режим при дефиците
Ragulator Rag является структурной платфор
хотя бы одной АК (активируется киназой
мой, на которую в разных метаболических ре
GCN2), и система регуляции, связанная с
жимах происходит посадка ключевых регуля
mTORC1, которая при условии полноты набора
торных белков: протеинкиназы AMPK при ка
БИОХИМИЯ том 85 вып. 4 2020
АМИНОКИСЛОТЫ - РЕГУЛЯТОРЫ МЕТАБОЛИЗМА КЛЕТКИ
461
таболизме
[19]; протеинкиназы PERK при
зации метаболизма. Наша схема хорошо согла
стрессовом ответе [42]; митоген активируемой
суется с другими подобными реконструкциями,
протеинкиназы ERK [18] по сигналу факторов
вышедшими в период рецензирования нашего
роста; протеинкиназы mTORC1 и некоторых её
обзора [59, 60], но в отличие от них отображает
мишеней по сигналу АК [43]. Белковый комп
приблизительное расположение также vATPase
лекс vATPase Ragulator Rag, контролирующий
и транспортёра SLC38A9, являющегося сенсо
посадку и активацию этих протеинкиназ, полу
ром лизосомального аргинина.
чил в некоторых работах название «нутрисома»
[44-46].
Малые ГТФазы, в том числе Rag и Rheb, яв
ЧЕТЫРЕ СИГНАЛЬНЫХ ПУЛА АК,
ляются ГТФ удерживающими белками и сами
РАЗЛИЧНЫХ ПО ЛОКАЛИЗАЦИИ В КЛЕТКЕ
по себе обладают слабо выраженной гидролити
ческой активностью. Эти ГТФазы осуществля
В настоящей работе показано, что сигналь
ют гидролиз ГТФ только при воздействии спе
ная система АК, в первую очередь, связана со
циальных белков GAP. Для RagA и RagB ГТФаз
структурно функциональными компартмента
таким активирующим белком является белко
ми клетки, такими как плазматическая мембра
вый комплекс GATOR1, для RagC - комплекс
на (внешняя среда), цитозоль, лизосомы и ми
FLCN/FNIP, для RagD - LRS, для Rheb - бел
тохондрии. Возможно, регуляторное значение
ковый комплекс TSC-TBC (см. табл. 1). Прямое
могут иметь сигналы АК и из других органелл,
взаимодействие c этими белками фактически
например, из аппарата Гольджи [61]. Различная
ингибирует передачу сигнала соответствующи
локализация АК в клеточных компартментах
ми ГТФазами, переводя их в неактивную ГДФ
приводит к их взаимодействию с разными ре
связанную форму. Последующее возобновление
цепторными белками. Благодаря этому АК, на
сигнальной активности ГТФаз происходит с по
ходящиеся в разных компартментах, обладают
мощью других белков (GEF), стимулирующих
различными сигнальными свойствами. Тот
обмен ГДФ на ГТФ. Для Rag - это Ragulator, для
факт, что специфика сигналов АК определяется
Rheb - регуляторный белок пока не установлен.
не только их структурой, но и локализацией в
В последние несколько лет появилось боль
клетке является важнейшей особенностью этой
шое число работ по рентгеноструктурному ана
системы. Как показано в предыдущем разделе,
лизу и криоэлектронной микроскопии, в кото
все эти сигналы, так или иначе, сходятся в еди
рых исследуется структура белковых компонент
ном сигнальном центре управления метаболиз
АК регуляции, связанных с mTORC1 (подроб
мом на внешней поверхности мембраны лизо
нее см. обзор [47]). Были установлены структу
сом.
ры АК связывающих белков Sestrin2 [26] и CAS
АК с разной локализацией имеют и различ
TOR
[28],
АК транспортёра-рецептора
ное функциональное значение. Внеклеточные
SLC38A9 [48]. Недавно была расшифрована
АК являются внешним управляющим факто
структура пентамерного комплекса Ragulator
ром, под который подстраивается метаболизм
вместе с закреплёнными фрагментами Rag
клетки. Пул АК в цитозоле используется для
ГТФаз [49-52], показаны также структуры клю
синтеза белка и, следовательно, необходим для
чевых посредников в каскадах передачи сигна
адаптации клетки к постоянно изменяющимся
лов АК - комплекса GATOR1, присоединённо
внешним условиям. АК в матриксе митохонд
го к Rag ГТФазам [22], ГТФазы Rheb [53], ваку
рий активно вовлечены в метаболизм: в зависи
олярной АТФазы [54, 55]. В нескольких работах
мости от условий в митохондриях происходит
расшифрована структура самого комплекса
распад или синтез АК (заменимых), а также ре
mTORC1 [14, 56, 57], которая показала его
ализуются начальные звенья биосинтеза многих
функционирование в составе димера и позволи
сложных органических соединений. Лизосо
ла установить место связывания активирующей
мальный пул АК прямо не вовлечён в процессы
его ГТФазы Rheb. Используя вышеприведённые
биосинтеза и является внутренним резервом
новейшие структурные данные работы [21] о
клетки, который посредством транспортёров
контактах Ragulator c vATPase, а также того, что
может быть транспортирован в цитозоль и ми
комплекс Ragulator и ГТФаза Rheb заякорены в
тохондрии. АК в лизосомах появляются в основ
лизосомальной мембране [58], мы составили
ном за счёт эндоцитоза и протеолиза белков в
приближённую структуру белкового суперкомп
процессе аутофагии.
лекса на лизосомальной мембране, на котором
Необходимо указать, что в каждом компарт
закреплён mTORC1 (рис. 1). Эта реконструкция
менте основные сигналы индуцируются приб
является наглядной иллюстрацией структурного
лизительно одним и тем же набором АК: лейци
устройства ключевого звена системы синхрони
ном, глутамином, аргинином и метионином.
БИОХИМИЯ том 85 вып. 4 2020
462
НЕСТЕРОВ и др.
Таблица 1. Список основных белков, связанных с системой АК сигнализации
Белок
Краткое описание роли в системе сигнализации
mTORC1
активирует систему трансляции и несколько факторов транскрипции, стимулирующих
комплекс 1 киназы mTOR
синтез ферментов биосинтеза, инактивирует факторы аутофагии и транскрипции лизосо
(механистической мишени
мальных белков [7]
рапамицина)
AMPK
активирует факторы аутофагии и факторы транскрипции, отвечающие за экспрессию лизо
АМФ активируемая киназа
сомальных и митохондриальных белков; активирует АМФ и Ca2+ при дефиците незамени
мых АК [8]
Sirt1
активирует AMPK и ряд других клеточных систем антистрессовой защиты, препятствует
NAD+ зависимая деацети
воспалению [9, 10]; связывание лейцина с Sirt1 усиливает его сродство к NAD+ [11]
лаза
GCN2
активируется в цитозоле при связывании со свободными тРНК, а также иными путями
киназа общего контроля с
[12]; фосфорилирует фактор инициации трансляции eIF 2, что препятствует посадке рибо
постоянной репрессией 2
сом на мРНК и индуцирует интегральный стрессовый ответ [13]
Rheb
в ГТФ связанной форме при присоединении к mTORC1 включает его фосфорилирующую
малая ГТФаза
активность [14]; помимо mTORC1 регулирует и другие сигнальных каскады, причём в раз
ных органеллах [15]
TSC5TBC
является GAP для Rheb [16]; активируется многими стрессовыми сигналами, в том числе
комплекс из белков TSC1,
киназой AMPK; теряет активность при фосфорилировании протеинкиназой Akt (PKB), ко
TSC2, TBC1D7
торая активируется по сигналу инсулина
Rag A, B, C, D
существуют в форме димеров: A или B связана с C или D [17]; димеры удерживаются на по
малые ГТФазы
верхности лизосом с помощью комплекса Ragulator и обладают способностью связывать
mTORC1, если RagA или Rag B связаны с ГТФ
Ragulator
адапторный белковый пентамерный комплекс на поздних эндосомах или лизосомах, на ко
(образовано от слов Rag
тором происходит активация митоген активируемой киназы ERK [18], mTORC1 и AMPK
regulator), он же LAMTOR
[19]; при взаимодействии с некоторыми транспортёрами АК и vATPase выполняет роль
GEF для RagA и B ГТФаз [20]
vATPase
протонный насос: закисляет полость лизосом за счёт энергии гидролиза АТФ; взаимодей
вакуолярная АТФаза
ствует с комплексом Ragulator и транспортёрами АК в мембране лизосом [21]; точный ме
ханизм участия в активации mTORC1 не установлен, однако без способной к вращению
vATPase mTORC1 не может быть активирован
GATOR1
устойчивый комплекс из трёх белков (Depdc5, Nprl2, Nprl3), являющийся GAP для RagA и
B [22]; по сигналу АК его активность регулируется связыванием с ним белков SAMTOR и
GATOR2
SAMTOR
при недостатке метионина (в несвязанной с SAM форме) связан с GATOR1 (с Depdc5 субъ
сенсор SAM (S аденозил
единицей), что усиливает GAP активность GATOR1 по отношению к RagA и B; при связы
метионина)
вании с SAM отсоединяется от GATOR1, что ослабляет его связь с RagA и B [23]
GATOR2
пентамерный белковый комплекс; ингибирует GATOR1, связываясь с его Depdc5 субъеди
ницей [22]
Sestrin2
при недостатке АК в цитоплазме образует комплекс с GATOR2 [24], тем самым его ингиби
стресс индуцируемый бе
руя; присоединение лейцина (а также Ile, Val, Met) [25] разрушает комплекс Sestrin с
лок, цитоплазматический
GATOR2, что позволяет последнему блокировать GATOR1, то есть предотвращать гидролиз
сенсор лейцина
ГТФ на RagA и B; кроме этого, Sestrin2 регулирует аутофагию, снижает уровень АФК [26]
CASTOR
стресс индуцируемый белок; в каскаде mTORC1 действует аналогично Sestrin2: комплекс
цитоплазматический сен
CASTOR с GATOR2 распадается при связывании CASTOR с аргинином [27, 28]
сор аргинина
FLCN
в каскаде активации mTORC1 функционирует в комплексе с белком FNIP и является GAP
фолликулин
для RagC [29]; связывается с Rag при отсоединении GATOR1 [30]; является регулятором
активности AMPK [31], также регулирует транспорт лизосом в клетке [32]
БИОХИМИЯ том 85 вып. 4 2020
АМИНОКИСЛОТЫ - РЕГУЛЯТОРЫ МЕТАБОЛИЗМА КЛЕТКИ
463
Окончание таблицы 1
Белок
Краткое описание роли в системе сигнализации
LRS
содержит в структуре специальный домен, который при связывании LRS с лейцином, но в
лейцил тРНК синтетаза
отсутствие связанной тРНК, проявляет GAP активность по отношению к Rag D [33]
Vps34
регулирует широкий спектр мембранно связанных процессов, включая везикулярный
киназа фосфатидилинози
транспорт, эндоцитоз и аутофагию; по сигналу АК стимулирует активность фосфолипазы D
тола класса 3
и способствует деактивации TSC-TBC [34]
PLD1
образует фосфатидную кислоту (PA) из глицерофосфолипидов; PA связывается с mTORC1
фосфолипаза D1
и вызывает отсоединение от него ингибиторных белков [35, 36]
PIKfyve
образует фосфотидил инозитол бифосфат PI(3,5)P2 из монофосфата PI(3)P [37]
фосфоинозитид киназа
TRPML1
активируется PI(3,5)P2, обеспечивает выход кальция из полости лизосом и активацию
кальциевый канал в лизо
кальций зависимых процессов в окрестности лизосомальной мембраны [37]
сомальной мембране
GDH
при связывании лейцина ускоряет расщепление глутамата митохондриями; в результате
глутаматдегидрогеназа
повышается концентрация α кетоглутарата, необходимого для функционирования про
лил гидроксилаз, без работы которых невозможна активация mTORC1 [38]
Тот факт, что именно эти АК используется клет
менимых АК из внеклеточной среды [63] и лизо
ками в качестве сигнальных, по видимому, оп
сом [64] в цитозоль. Таким образом, эти две за
ределяется эволюционным развитием рецеп
менимые АК помимо важной роли в структуре
торно сигнальной системы, которая реагирует
белков являются показателями катаболизма АК
лишь на самые важные для клетки сигналы.
и возможности транспорта незаменимых АК.
Лейцин является существенно гидрофобной
При этом клетка, благодаря наличию системы
АК, формирующей основу для альфа спиралей
интегрального стрессового ответа, всё же
белков, что делает его ключевой частью интег
чувствительна к падению концентрации и лю
ральных белков и одной из самых распростра
бой другой протеиногенной АК, что позволяет
нённых АК. Лейцин является неглюкогенной
оперативно остановить процесс трансляции при
АК, не задерживается печенью, в связи с чем его
их дефиците [65]. Этого механизма, по видимо
концентрация в крови после приёма пищи ме
му, достаточно, чтобы обеспечить функциони
няется в большей степени, чем большинства АК
рование клетки, а развитие сенсорной системы,
[62], что делает лейцин индикатором поступле
специфически реагирующей на каждую АК,
ния с пищей белка (незаменимых АК). Метио
привело бы лишь к необоснованному усложне
нин является незаменимой серосодержащей АК
нию сигнальной системы, что невыгодно для
и служит как донором серы для синтеза другой
организма в условиях естественного отбора.
серосодержащей АК - цистеина (ключевой АК
при фолдинге белков), так и является основным
донором метильных групп (в форме s аденозил
ЦИКЛЫ ПЕРЕКЛЮЧЕНИЯ
метионина). Реакция метилирования является
КАТАБОЛИЗМ-АНАБОЛИЗМ
второй по интенсивности (после фосфорилиро
вания) в клетках, что делает контроль уровня
Анализ процессов сигнализации АК и транс
метионина критически важным. Кроме того,
порта АК позволяет определить чёткую хроно
значительная часть биологических эффектов
логическую последовательность действия АК на
метионина вызвана непосредственным влияни
ключевые метаболические регуляторы mTORC1
ем на скорость реакций метилирования и не
и AMPK в процессе перехода между режимами
требует дополнительных сигнальных белков.
катаболизма и анаболизма (рис. 2). Rag ГТФазы
Глутамин и аргинин, хотя и являются замени
при недостатке АК, складывающемся, в част
мыми АК, не менее важны для клетки. Глутамин
ности, при голодании, находятся в «катаболи
является временным депо азота в митохондри
ческой» форме: Rag B(A) ГДФ, Rag D(C) ГТФ
ях, а аргинин вовлечён в цикл мочевины. Эти
[33] (рис. 3, а в момент начала отсчёта; рис. 4
АК также влияют на процессы транспорта неза
блок I). Появление внешних АК и их транспор
БИОХИМИЯ том 85 вып. 4 2020
464
НЕСТЕРОВ и др.
Rag A
Рис. 1. Реконструкция предположительной структуры места посадки mTORC1 на лизосому (платформы «нутрисома»).
а - Вид на поверхность лизосомы со стороны цитозоля; б - вид на плоскость, перпендикулярную лизосомальной мемб
ране. Пунктиром обозначен возможный контур мембраны лизосом, позволяющий мембранной субъединице vATPase,
транспортёру SLC38A9 и жирным кислотам, ковалентно связанным с белками Rheb и Ragulator, находиться в липидном
окружении. Первичную визуализацию структуры белков проводили с помощью программы PyMol с использованием
структур белкового банка данных 3j9t, 5tj5, 6bcu, 6ehr, 6ces, 6c08, 6U62. Приблизительный докинг проводили по принци
пу плотной упаковки с использованием установленных методом электронной микроскопии мест связывания отдельных
белков, а также описанных в литературе белок белковых и белок липидных взаимодействий комплексообразующих бел
ков. Обозначения: mLST8, Raptor, mTOR - субъединицы mTORC1, SLC38A9 - лизосомальный транспортёр незаменимых
АК, регулируемый аргинином. Описание остальных белков дано в табл. 1
тировка в цитоплазму индуцирует переход Rag
тивируют ГТФаз активирующие белки (GAP)
ГТФаз в промежуточное разблокированное сос
для RagC и D. Только в этом разблокированном
тояние (рис. 3, а, минуты 1-8; рис. 4, блок II).
состоянии димера Rag возможна посадка ГТФ
Эта разблокировка происходит по сигналу цито
на RagB(A), которая происходит по сигналу от
зольных и митохондриальных АК, которые ак
пула лизосомальных АК (посредством актива
БИОХИМИЯ том 85 вып. 4 2020
АМИНОКИСЛОТЫ - РЕГУЛЯТОРЫ МЕТАБОЛИЗМА КЛЕТКИ
465
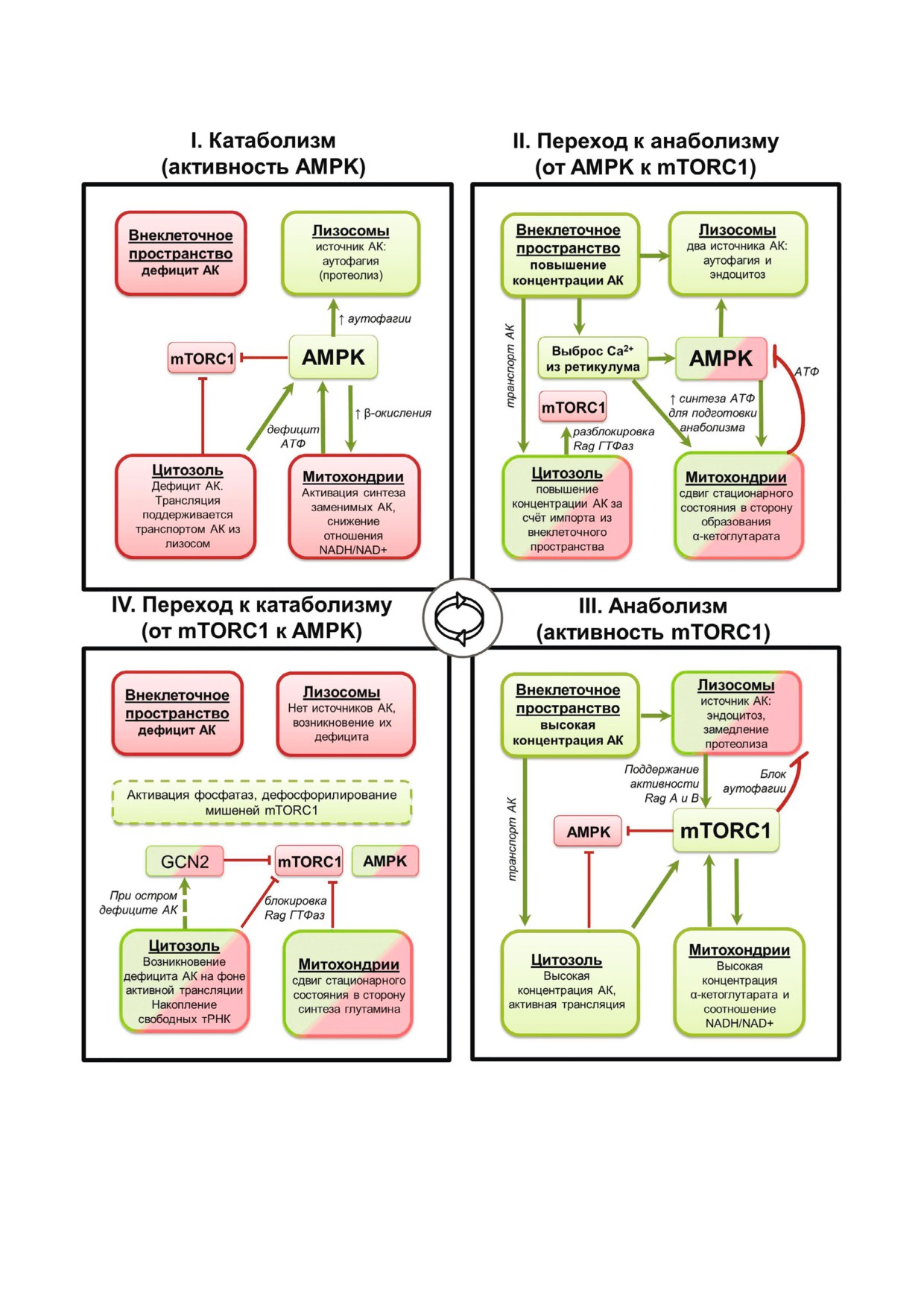
Рис. 2. Схема функционирования сигнальных пулов АК в процессе метаболического цикла. На схеме отображено как из
менение в наполненности четырёх основных пулов АК управляет активностью ключевых регуляторов метаболизма
(mTORC1 и AMPK) и, тем самым, индуцирует циклический переход от катаболизма к анаболизму и обратно
БИОХИМИЯ том 85 вып. 4 2020
466
НЕСТЕРОВ и др.
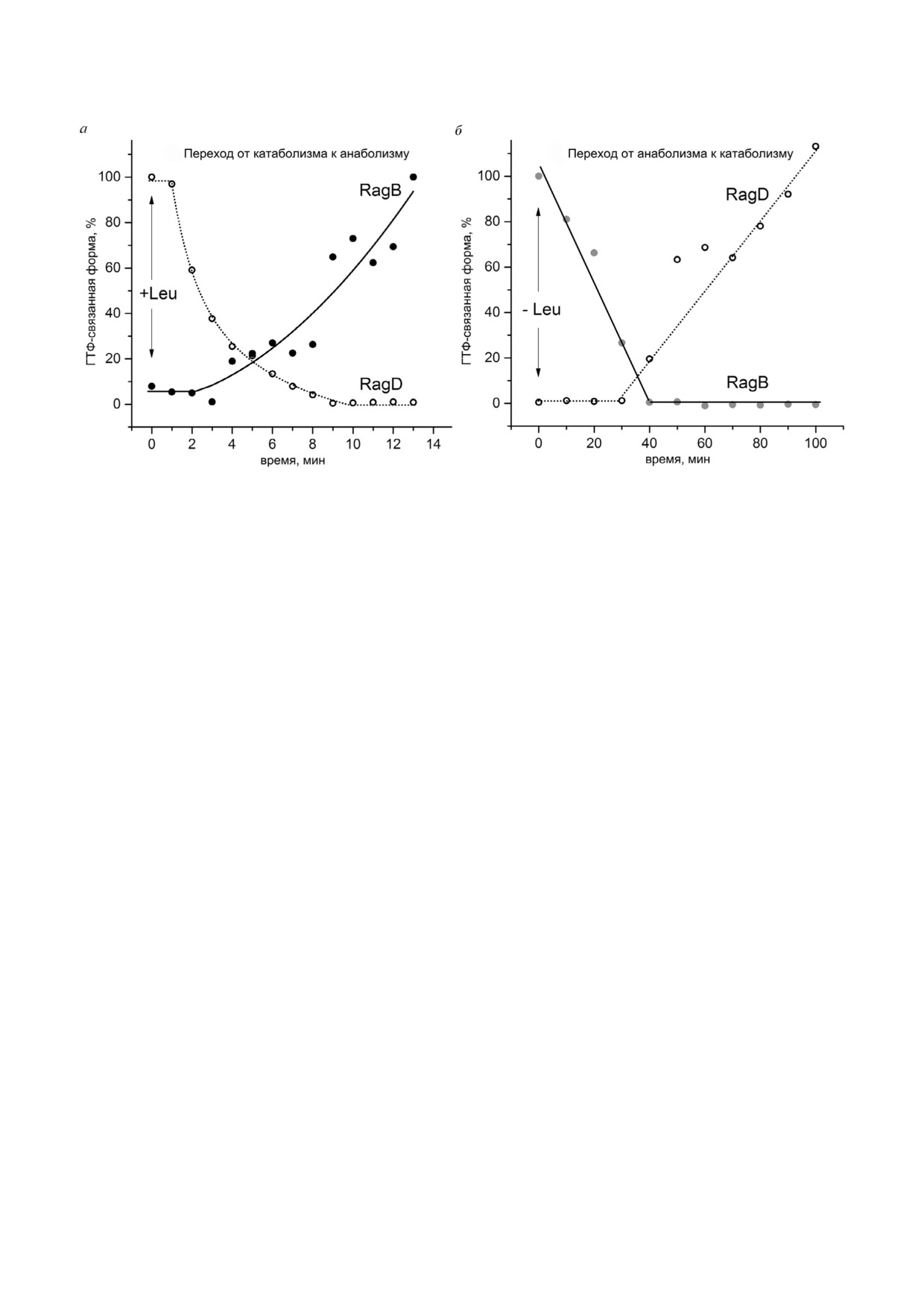
Рис. 3. Изменение ГТФ связывания Rag ГТФаз (на примере димера RagB с RagD) при переходах катаболизм-анаболизм
и анаболизм-катаболизм. Гомологичный димер RagA с RagC претерпевает такие же изменения ГТФ связывания с запаз
дыванием в несколько минут. Процесс перехода от катаболизма к анаболизму (а) индуцировали добавлением лейцина к
клеткам (+Leu), инкубируемым перед этим 90 мин без этой АК. Процесс перехода от анаболизма к катаболизму (б) инду
цировали пересадкой клеток в среду, не содержащую лейцин ( Leu). Графики построены по оцифрованным данным рабо
ты [33], полученным в экспериментах на клетках рака кишечника человека SW620. Линии на графиках соответствуют
сплайн интерполяции оцифрованных данных
ции комплекса Ragulator, являющегося факто
катаболизме димер Rag вновь переходит в «ката
ром обмена гуаниновых нуклеотидов (GEF) для
болическую» форму (рис. 3, б, минуты 40-100;
Rag) (рис. 3, а, минуты 8-13). Переход димера
рис. 4, блок I). Особенность Rag ГТФаз состоит
Rag в «анаболическую» форму (RagB(A) ГТФ,
в том, что обе ГТФазы в составе димера однов
RagD(C) ГДФ) является сигналом для посадки
ременно не могут быть связаны с ГТФ, посколь
mTORC1 на лизосому [17]. Согласно данным
ку связывание ГТФ с одной ГТФазой блокирует
динамической внутриклеточной визуализации
посадку ГТФ на другую. Данное обстоятельство
[66], активированный димер Rag имеет меньшее
делает необходимым прохождение через пере
сродство к комплексу Ragulator, в результате че
ходное состояние. Это свойство димера Rag
го приобретает способность отсоединяться от
подтверждается как структурными данными
лизосомы и начинает циркулировать между
[68], так и экспериментами по измерению кине
мембраной лизосомы и цитозолем. В цитозоле
тики ГТФ ГДФ связывания Rag ГТФаз [33]
димер Rag связывается с неактивным mTORC1,
(данные представлены на рис. 3). Необходимо
после чего вместе с ним садится на поверхность
отметить, что приведённые на рис. 3 данные от
лизосомы, где mTORC1 связывается с ГТФазой
носятся к конкретной культуре клеток, время
Rheb и фосфатидной кислотой, переходит в ка
активации Rag может значительно отличаться в
талитически активную форму и включает клас
других типах клеток, однако данные литературы
тер анаболических процессов (рис. 4, блок III).
позволяют утверждать, что общие принципы
При исчерпании лизосомального и/или цито
сигнализации и качественная картина кинетики
зольного пула АК, например, в результате огра
активации схожи во всех клетках.
ничения поступления внешних АК, Rag ГТФазы
На рис. 2, в основном, отображены измене
переходят в промежуточное состояние (рис. 3, б,
ния в наполненности и сигнальной активности
минуты 1-40; рис. 4, блок IV). В этом состоянии
различных пулов АК в процессе циклических
должна также происходить активация фосфатаз,
переходов клетки между катаболизмом и анабо
вызывающих дефосфорилирование мишеней
лизмом. На этой схеме, в том числе, упрощённо,
mTORC1 (например, фосфатазы PP2A [67]).
отображены основные транспортные и метабо
После стирания «анаболических меток» с сиг
лические процессы в клетке в ходе метаболичес
нальных белков становится возможным переход
кого цикла. Обнаруженные пространственно
в катаболический режим. При установившемся
временные изменения активности сигнальных
БИОХИМИЯ том 85 вып. 4 2020
АМИНОКИСЛОТЫ - РЕГУЛЯТОРЫ МЕТАБОЛИЗМА КЛЕТКИ
467
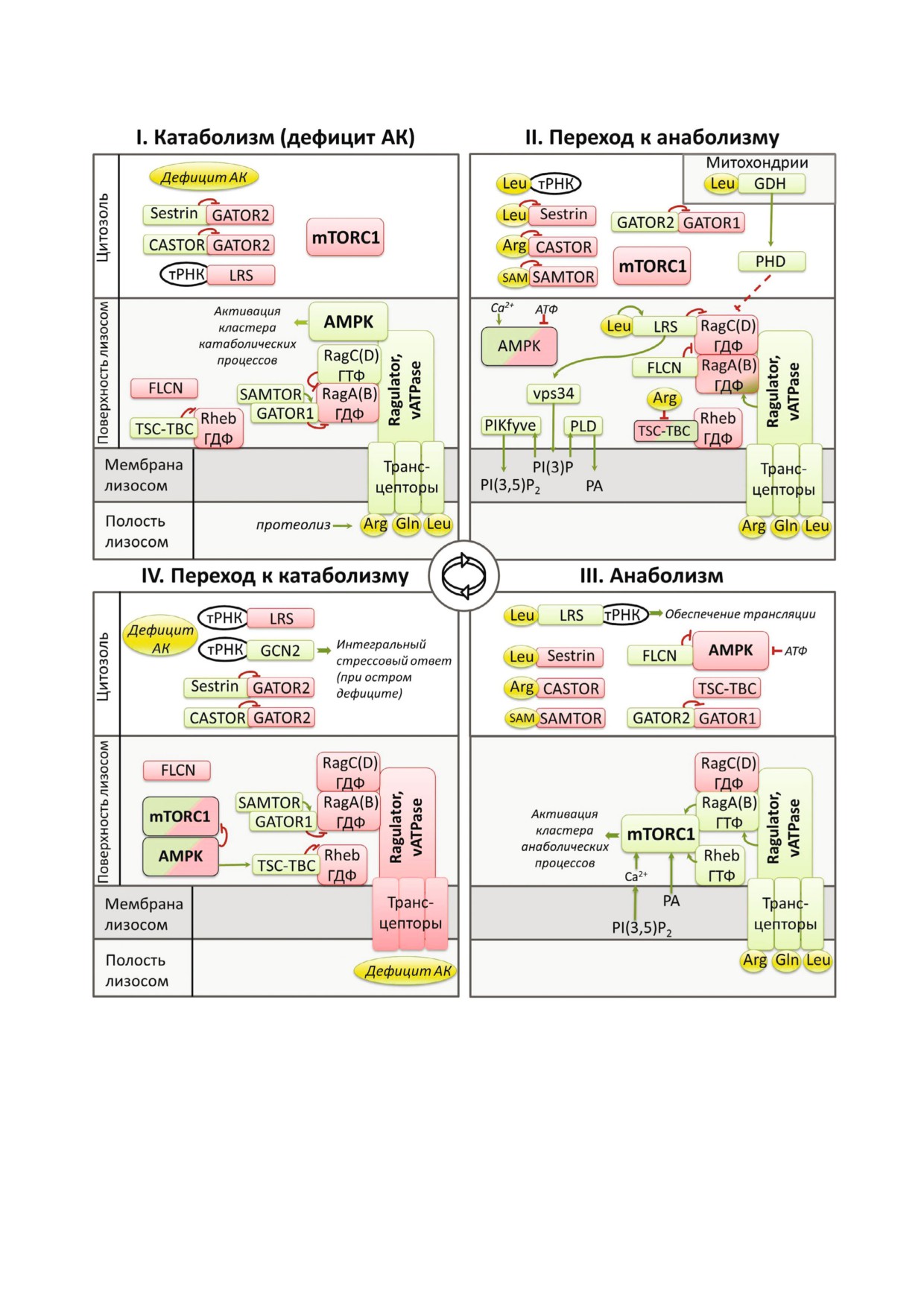
Рис. 4. Молекулярная основа синхронных перестроек метаболизма клетки. Изменения активности белков системы АК
сигнализации на основных (I и III) и переходных (II и IV) стадиях метаболического цикла. Зелёным цветом обозначены
активные (т.е. передающие сигнал последующим звеньям), а красным - неактивные компоненты сигнальной системы.
Двойным цветом обозначены белки, активность которых не однозначна или может претерпевать изменения во времен
ном интервале одной стадии цикла. Физически взаимодействующие белки на схеме также соприкасаются, при этом ак
тивирующее воздействие обозначено стрелкой, а подавляющее воздействие обозначено T образной линией. Активация
для ГТФаз понимается в смысле наличия их сигнальной активности, т.е. активация - это переход в ГТФ связанную фор
му, а блокирование - в ГДФ связанную форму. Краткое описание используемых на схеме белков дано в табл. 1, а после
довательность активации описана в табл. 2
БИОХИМИЯ том 85 вып. 4 2020
468
НЕСТЕРОВ и др.
Таблица 2. Последовательность активации сигналов различных групп АК в процессе циклического переключения между
состояниями катаболизма и анаболизма
Первичный сигнал
Краткое описание механизма
Влияние на метаболизм/
(взаимодействие АК
сигнального каскада
ключевые регуляторы
с рецептором)
I. Катаболизм
В этом состоянии низкая концентрация АК вне клетки; основной источник АК - аутофагия и протеолиз в лизосомах; из
лизосом АК переносятся в цитозоль и митохондрии, где используются для поддержания трансляции или расщепляются
Белки Sestrin, CASTOR,
Sestrin [24-26, 71, 72] и CASTOR [27, 28]
RagA(B) ГДФ не позволяет mTORC1 сесть
SAMTOR в цитозоле не свя
связаны с GATOR2. SAMTOR [23] связан
на лизосому; в цитозоле каталитический
заны с лейцином, аргини
с GATOR1, стимулируя его GAP актив
центр mTORC1 блокирован
ном, и s аденозилметиони
ность по отношению к RagA(B) [22]
ном соответственно
Связывание АК (подробнее
в этом состоянии RagA и B не могут свя
перевод димера ГТФаз в «заблокированное»
описано ниже) из полости
зывать ГТФ (из за активности GAP
состояние предотвращает спонтанную акти
лизосом с лизосомальными
GATOR1), поэтому происходит медлен
вацию mTORC1; фиксируется состояние ка
транспортёрами рецепто
ная посадка ГТФ на RagC и D; возможно,
таболизма (преобладает активность AMPK и
рами (трансцепторами)
этот процесс катализируется Ragulator,
Sirt1)
который является единственным извест
ным GEF белком для Rag [20]
II. Переходное состояние катаболизм-анаболизм
Индуцируется повышением концентрации внеклеточных АК, попадающих в цитоплазму в результате работы АК транс
портёров и эндоцитоза
Связывание любой АК из
T1R активирует фосфолипазу С, образу
кальций стимулирует синтез АТФ митохонд
внеклеточной среды с вкусо
ющую инозитол 3 фосфат, вызывающий
риями, при этом поддерживая или даже вре
вым рецептором (T1R) на
выброс кальция из ЭПС [73]; кальций
менно усиливая активность AMPK [74]. Ак
плазматической мембране
стимулирует работу митохондриальных
тивация биоэнергетики и катаболизма даёт
дегидрогеназ, а также AMPK
клетке ресурс для импорта внешних
субстратов и включения анаболизма
Связывание незаменимых
обмен цитозольного глутамина [63] и ас
сформированный митохондриями в катабо
АК из внеклеточной среды с
парагина [75] на внешние незаменимые
лическом состоянии пул глутамина поддер
транспортёрами плазмати
АК может лимитировать скорость вклю
живает быстрый транспорт незаменимых АК
ческой мембраны
чения анаболизма [76]
Лейцин в цитозоле связыва
связывание лейцина увеличивает срод
Sirt1 на первом этапе перехода активирует
ется с деацетилазой Sirt1
ство Sirt1 к NAD+ [11], что позволяет
катаболизм (совместно с AMPK) [9, 77].
Sirt1 сохранять активность в условиях по
Sirt1 также необходим для восстановления
вышения соотношения NADH/NAD+
трансляции после интегрального стрессово
го ответа [10]
Лейцин связывается с лей
связанная с лейцином LRS является GAP
гидролиз ГТФ на RagD ГТФазе снимает зап
цил тРНК синтетазой
для RagD [33, 78]
рет на посадку ГТФ на связанную с ней
(LRS) в условиях дефицита
RagB
свободных тРНК в цитозоле
(на фоне медленного темпа
LRS связывается с фосфатидилинозитол
1. фосфатидная кислота связывается с
трансляции)
киназой vps34 [79]. Фосфатидилинозитол
mTORC1, вызывая диссоциацию его инги
фосфат (PI(3)P) активирует синтез фос
биторных белков [35,36] (разблокировка
фатидной кислоты (PA) фосфолипазой D.
mTORC1);
Накопление PA и PI(3)P в мембране пре
2. Rheb ГТФ активирует mTORC1;
пятствует посадке TSC-TBC комплекса
3. кальций кальмодулин непосредственно
на лизосому и тем самым способствует
связывается с mTORC1 и активирует его;
удержанию ГТФазы Rheb в ГТФ форме [34].
4. также кальций кальмодулин активирует
PI(3)P подвергается также повторному
фосфатазу кальциневрин (PP2B), которая
фосфорилированию с образованием би
дефосфорилирует мишени AMPK
фосфата PI(3,5)P, который активирует
кальциевый канал TRPML1, вызываю
щий выход кальция из полости лизосом
[37]
БИОХИМИЯ том 85 вып. 4 2020
АМИНОКИСЛОТЫ - РЕГУЛЯТОРЫ МЕТАБОЛИЗМА КЛЕТКИ
469
Окончание таблицы 2
Первичный сигнал
Краткое описание механизма
Влияние на метаболизм/
(взаимодействие АК
сигнального каскада
ключевые регуляторы
с рецептором)
В цитозоле:
связывание АК с Sestrin и CASTOR разру
переход ведущего димера Rag (RagB с
1. Лейцин (также изолейцин и
шает их комплекс с GATOR2. GATOR2
RagD) в промежуточную «разблокиро
валин) связывается с белком
связывается с GATOR1 и вытесняет его с
ванную» форму, из которой возможен
Sestrin
RagA(B) [80]. Связывание SAMTOR с s
переход в «анаболическую» форму, свя
2. Аргинин связывается с белком
аденозил метионином также вытесняет
зывающуюся с mTORC1
CASTOR
GATOR1 с RagA(B) [23]
3. S аденозил метионин связы
вается с белком SAMTOR
после отсоединения GATOR1 с RagA свя
переход запаздывающего димера Rag
зывается комплекс FLCN/FNIP, являю
(RagA с RagC) в промежуточную «раз
щийся GAP для RagC [30]; гидролиз ГТФ
блокированную» форму, из которой
на RagС снимает запрет на посадку ГТФ
возможен переход в «анаболическую»
на парную ГТФазу - RagA
форму, связывающуюся с mTORC1
III. Анаболизм
В ходе переходного состояния сформировались лизосомальный, митохондриальный и цитозольный пулы АК, которые
подают терминальные сигналы на mTORC1
Лейцин связывается с глутамат
аллостерическая стимуляция лейцином
1. повышение соотношения
дегидрогеназой (GDH) в митохон5
GDH [81] ускоряет образование альфа ке
NADH/NAD+ и скорости синтеза АТФ
дриях
тоглутарата (aKG) из глутамата и глутамина.
блокируют ключевые катаболические
aKG стимулирует синтез АТФ и работу про
регуляторы (Sirt1 и AMPK);
лил гидроксилаз, влияющих на Rag [82]
2. пролил гидроксилазы способствуют
посадке mTORC1 на лизосому
Лизосомальные АК связываются с
связыванные с соответствующими АК
сигнал лизосомальных АК индуцирует
транспортёрами (трансцептора
трансцепторы образуют комплексы с v
переход RagA(B) в ГТФ связанную
ми): аргинин связывается с
ATPase и Ragulator, что индуцирует посад
форму и является окончательным сиг
SLC38A9 [64]; лейцин с LAT 1
ку ГТФ на RagA и B [86] (предварительно
налом для посадки mTORC1 на лизосо
[83]; глутамин (и, возможно, се
разблокированных при переходном состо
му, где эта протеинкиназа взаимодей
рин) с PAT 4 [84] (PAT 4 функци
янии); присоединение Arg к SLC38A9 так
ствует с Rheb ГТФ и фосфатидной кис
онирует также в аппарате Гольджи
же ускоряет опосредованный им транс
лотой, активирующими каталитичес
[61]); цистин (димер цистеина) c
порт незаменимых АК из лизосомы в ци
кую активность mTORC1
транспортёром сystinosin [85]
тозоль [64]
Лейцил тРНК синтетаза (LRS) в
LRS переходит из режима сигнального
обеспечение высокого темпа трансля
цитозоле связана и с лейцином, и
белка в режим функционирования в каче
ции
с тРНК
стве фермента, катализирующего образо
вание лейцил тРНК [87]
Заменимые АК (включая арги
стабилизация активной ГТФазы Rheb на
активный Rheb связывается с mTORC1,
нин, глутамин) в цитозоле пере
лизосоме [88], препятствие её взаимодей
включая его каталитическую актив
дают сигналы через не иденти
ствию с GAP комплексом TSC-TBC [89];
ность [14]
фицированные рецепторы
есть сообщения о Rag независимой транс
локации mTORC1 на лизосому по сигналу
глутамина [90]
IV. Переходное состояние анаболизм-катаболизм
Падение уровня АК во внеклеточной среде индуцирует падение уровня АК в цитозоле, лизосомах и митохондриях
Цитозольные белки Sestrin, CAS
происходит активация GATOR1, который
уход mTORC1 с лизосомы, начало про
TOR, SAMTOR высвобождаются
переводит RagA(B) в ГДФ связанную
цессов дефосфорилирования мишеней
от связывания с АК и их произ
форму [33], вызывая диссоциацию
mTORC1
водными
mTORC1 с лизосомы
Дефицит метионина в цитозоле
недостаток метионина замедляет метилиро
PP2A дефосфорилирует мишени
вание и разблокирует фосфатазу PP2A [91, 92]
mTORC1, стимулирует синтез лизосо
мальных белков [67, 93]
При остром дефиците АК проис
GCN2 блокирует фактор инициации
запуск интегрального стрессового отве
ходит накопление свободных
трансляции eIF 2, что приводит к транс
та, активация защитных и транспорт
тРНК в цитозоле, которые свя
ляции с вышестоящих рамок считывания;
ных систем клетки на уровне тран
зываются с киназой GCN2
также блокирует mTORC1 [94, 95]
скрипции [65], аутофагии
БИОХИМИЯ том 85 вып. 4 2020
470
НЕСТЕРОВ и др.
белков, передающих сигналы от АК на mTORC1
и анаболизма. Анализ новейших литературных
в ходе метаболического цикла, более детально
данных позволил дополнить метаболический
представлены на рис. 4. Обозначенные на рис. 4
цикл Вебера (базировавшегося только на актив
промежуточные белковые посредники опреде
ности исполнительных систем) двумя промежу
ляют состояние ГТФаз Rag, обеспечивающих
точными стадиями, при которых происходит
связывание mTORC1 с лизосомой, необходимое
перестройка сигнальной системы и стирание
для активации этой протеинкиназы. Следует
информации, записанной на белках во время
подчеркнуть, что разные сигнальные белки, во
основных метаболических стадий.
первых, находятся в разных компартментах и,
Построенная нами схема метаболического
следовательно, связаны с разными метаболи
цикла выполнена на основе сигнальной систе
ческими пулами АК, а с другой стороны, имен
мы аминокислот. В первую очередь, было про
но через посредничество этих «промежуточных»
ведено сопоставление сигналов АК с актив
сигнальных белков осуществляется взаимосвязь
ностью ключевых сигнально метаболических
системы АК сигнализации со всем остальным
регуляторов, таких как mTORC1 и AMPK (рис. 2
множеством сигнальных каскадов клетки. Крат
и рис. 4). Для этих протеинкиназ уже известны
кое описание перестройки белковых взаимодей
молекулярные механизмы регуляции, что поз
ствий (схемы на рис. 4) в зависимости от изме
воляет по их активности с достаточной точ
нения концентрации АК в разных компартмен
ностью прогнозировать состояние исполни
тах дано в табл. 2.
тельной системы метаболизма. Во вторых, было
Особый интерес представляет роль митохон
показано, что сигнальные свойства АК опреде
дрий в метаболическом цикле. При катаболизме
ляются не только их молекулярной структурой,
происходит активация AMPK, которая активи
но и локализацией (рис. 2). Основными компарт
рует протеолиз в лизосоме, синтез митохондри
ментами, сигналы АК из которых реализуются
альных белков и бета окисление жирных кислот
на разных стадиях метаболического цикла, яв
в митохондриях. В условиях катаболизма высо
ляются: внеклеточное примембранное простра
коэффективный синтез АТФ в митохондриях
нство, цитозоль, лизосомы и митохондрии. При
является основным источником энергии в клет
этом переход в анаболический режим невозмо
ке. Последние данные показывают, что без ак
жен без подачи сигналов от всех указанных пу
тивно функционирующих митохондрий клетки
лов АК на специальную липидно белковую
не способны даже поддерживать ключевой ката
платформу на поверхности лизосомы.
болический процесс - аутофагию [69]. Важно
Как показал анализ литературы и составлен
подчеркнуть, что необходимым фактором для
ные нами детальные схемы, система аминокис
перехода от катаболизма к анаболизму является
лотной регуляции метаболизма оказалась не
перестройка метаболизма глутамата в митохо
только необходимой, но и достаточной для
ндриях под действием аллостерического сигна
обеспечения движения клетки по метаболичес
ла лейцина. Присоединение лейцина к GDH об
кому циклу (рис. 4). Таким образом, система АК
ращает процесс синтеза глутамата (преобладаю
сигнализации может рассматриваться как ство
щий при катаболизме) в процесс синтеза α ке
ловая система регуляции метаболизма, а другие
тоглутарата. Без этого обращения работы фер
типы внешних сигналов (стрессы, гормоны) яв
мента, которое экспериментально наблюдается
ляются модулирующими, вспомогательными
при поступлении внешних АК в митохондрии,
сигналами. Такое рассмотрение логично и с эво
невозможен переход Rag ГТФаз в mTORC1 свя
люционной точки зрения, так как система АК
зывающую форму и включение анаболизма [38].
сигнализации, близкая по своей структуре к
Необходимо отметить, что, наоборот, смещение
сигнальной системе АК млекопитающих, при
стационарного состояния в сторону синтеза глу
сутствует и в одноклеточных эукариотах, кото
тамата является достаточным, чтобы индуциро
рые лишены гормональной регуляции.
вать катаболизм посредством сигнала из мито
Сигналы АК не только определяют возмож
хондрий [70].
ность роста и деления отдельных клеток, но так
В работе метаболизм клеток млекопитаю
же выполняют адаптогенную роль, являясь необ
щих рассмотрен как двухкомпонентная система,
ходимыми факторами для быстрого протекания
состоящая из сигнально командной и исполни
любых стресс реакций. Наличие согласованной
тельной ферментативной подсистем. Такое рас
регуляции гомеостаза АК в крови млекопитаю
смотрение позволило достаточно полно описать
щих делает АК также неотъемлемой частью меха
и графически отобразить последовательность
низма синхронизации процессов анаболизма и
событий, происходящих в ключевых звеньях
катаболизма на уровне всего организма за счёт
сигнальной и исполнительной систем клетки
регуляции работы эндокринных клеток [96] и
при переходах между состояниями катаболизма
клеток гипоталамуса
[97-99]. Активность
БИОХИМИЯ том 85 вып. 4 2020
АМИНОКИСЛОТЫ - РЕГУЛЯТОРЫ МЕТАБОЛИЗМА КЛЕТКИ
471
mTORC1 также необходима для работы иммун
Таким образом, построенная в работе схема
ной системы, как на этапе созревания новых им
системы регуляции метаболизма, присутствую
мунных клеток [100], так и на этапе секреции
щая практически во всех клетках млекопитаю
воспалительных цитокинов [101]. Более того,
щих, способна служить начальным звеном и
последние данные показывают, что патологичес
точкой роста для более полной пространствен
кая активность mTORC1 за счёт воздействия на
ной схемы, включающей, помимо сигналов
эндотелиальную NO синтазу ведёт к нарушению
АК, широкое множество других сигнальных
микроциркуляции [102], что является одной из
каскадов клетки, в том числе, и тканеспецифи
ключевых причин развития автокаталитических
ческих.
воспалительных процессов [103]. Учёт этих важ
нейших сигнальных путей АК позволяет допол
нить ранее продемонстрированные эффекты АК
Финансирование. Работа выполнена при фи
на микроциркуляцию [104-106] и найти новые
нансовой поддержке НИИ цитохимии и моле
пути коррекции метаболических нарушений,
кулярной фармакологии и РФФИ (грант 19 04
тесно связанных с воспалением. Благодаря тес
00835/19).
ной взаимосвязи метаболизма и функциональ
Конфликт интересов. Авторы заявляют об от
ной активности клеток, построенная в работе
сутствии конфликта интересов.
схема пространственно временной динамики
Соблюдение этических норм. Настоящая ра
АК сигнализации открывает путь для поиска но
бота не содержит описания выполненных авто
вых схем терапии и профилактики заболеваний
рами исследований с участием людей или ис
человека с использованием аминокислот.
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Смирнова Е. Г., Нижний С. В., Ягужинский Л. С.
SIRT1 AMPK signaling in C2C12 myotubes, J. Nutr.
(1980) Метод определения специфических изменений
Metab., 2014, 239750, doi: 10.1155/2014/239750.
метаболизма в быстро пролиферирующих тканях,
12. Masson, G. R. (2019) Towards a model of GCN2 activa
Изв. АН СССР, 636 653.
tion, Biochem. Soc. Trans., 47, 1481 1488, doi: 10.1042/
2. Смирнова Е. Г., Нижний С. В., Ягужинский Л. С.
BST20190331.
(1982) Соотношение скоростей метаболических про
13. Pakos Zebrucka, K., Koryga, I., Mnich, K., Ljujic, M.,
цессов в опухолевых клетках, Изв. АН СССР, 499 507.
Samali, A., and Gorman, A. M. (2016) The integrated
3. Weber, G. (1964) Enzyme regulation in mammalian tis
stress response, EMBO Rep., 17, 1374 1395, doi: 10.15252/
sues, Science, 146, 14891492, doi: 10.1126/science.
embr.201642195.
146.3650.1489.
14. Yang, H., Jiang, X., Li, B., Yang, H. J., Miller, M., Yang, A.,
4. Weber, G., and Singhal, R. L. (1965) Insulin: inducer of
Dhar, A., and Pavletich, N. P. (2017) Mechanisms of
phosphofructokinase. The integrative action of insulin at
mTORC1 activation by RHEB and inhibition by PRAS40,
the enzyme biosynthetic level, Life Sci., 4, 1993 2002.
Nature, 552, 368 373, doi: 10.1038/nature25023.
5. Weber, G., Singhal, R. L., and Srivastava, S. K. (1965)
15. Heard, J. J., Fong, V., Bathaie, S. Z., and Tamanoi, F.
Effect of nutritional state on hormonal regulation of liver
(2014) Recent progress in the study of the Rheb family
enzymes, Can. J. Biochem., 43, 1549 1563.
GTPases, Cell. Signal., 26, 1950 1957, doi: 10.1016/j.cellsig.
6. Pearce, L. R., Komander, D., and Alessi, D. R. (2010) The
2014.05.011.
nuts and bolts of AGC protein kinases, Nat. Rev. Mol. Cell
16. Dibble, C. C., Elis, W., Menon, S., Qin, W., Klekota, J.,
Biol., 11, 9 22, doi: 10.1038/nrm2822.
Asara, J. M., Finan, P. M., Kwiatkowski, D. J., Murphy, L.
7. Sabatini, D. M. (2017) Twenty five years of mTOR: uncov
O., and Manning, B. D. (2012) TBC1D7 is a third subunit
ering the link from nutrients to growth, Proc. Natl. Acad. Sci.
of the TSC1 TSC2 complex upstream of mTORC1, Mol.
USA, 114, 11818 11825, doi: 10.1073/pnas.1716173114.
Cell, 47, 535 546, doi: 10.1016/j.molcel.2012.06.009.
8. Herzig, S., and Shaw, R. J. (2018) AMPK: guardian of
17. Sancak, Y., Peterson, T. R., Shaul, Y. D., Lindquist, R. A.,
metabolism and mitochondrial homeostasis, Nat. Rev. Mol.
Thoreen, C. C., Bar Peled, L., and Sabatini, D. M. (2008)
Cell Biol., 19, 121 135, doi: 10.1038/nrm.2017.95.
The Rag GTPases bind raptor and mediate amino acid sig
9. Price, N. L., Gomes, A. P., Ling, A. J. Y., Duarte, F. V.,
naling to mTORC1, Science,
320,
14961501,
Martin Montalvo, A., North, B. J., Agarwal, B., Ye, L.,
doi: 10.1126/science.1157535.
Ramadori, G., Teodoro, J. S., Hubbard, B. P., Varela, A. T.,
18. Nada, S., Hondo, A., Kasai, A., Koike, M., Saito, K.,
Davis, J. G., Varamini, B., Hafner, A., Moaddel, R.,
Uchiyama, Y., and Okada, M. (2009) The novel lipid raft
Rolo, A. P., Coppari, R., Palmeira, C. M., de Cabo, R.,
adaptor p18 controls endosome dynamics by anchoring the
Baur, J. A., and Sinclair, D. A. (2012) SIRT1 is required for
MEK ERK pathway to late endosomes, EMBO J., 28, 477
AMPK activation and the beneficial effects of resveratrol
489, doi: 10.1038/emboj.2008.308.
on mitochondrial function, Cell Metab., 15, 675 690,
19. Zhang, C. S., Jiang, B., Li, M., Zhu, M., Peng, Y., Zhang, Y. L.,
doi: 10.1016/j.cmet.2012.04.003.
Wu, Y. Q., Li, T. Y., Liang, Y., Lu, Z., Lian, G., Liu, Q.,
10. Ghosh, H. S., Reizis, B., and Robbins, P. D. (2011) SIRT1
Guo, H., Yin, Z., Ye, Z., Han, J., Wu, J. W., Yin, H., Lin, S. Y.,
associates with eIF2 alpha and regulates the cellular stress
and Lin, S. C. (2014) The lysosomal v ATPase ragulator
response, Sci. Rep., 1, 150, doi: 10.1038/srep00150.
complex is a common activator for AMPK and mTORC1,
11. Liang, C., Curry, B. J., Brown, P. L., and Zemel, M. B.
acting as a switch between catabolism and anabolism, Cell
(2014) Leucine modulates mitochondrial biogenesis and
Metab., 20, 526 540, doi: 10.1016/j.cmet.2014.06.014.
БИОХИМИЯ том 85 вып. 4 2020
472
НЕСТЕРОВ и др.
20.
Bar Peled, L., Schweitzer, L. D., Zoncu, R., and Sabatini, D. M.
Kim, S., and Han, J. M. (2018) Coordination of the
(2012) Ragulator is a GEF for the Rag GTPases that signal
leucine sensing Rag GTPase cycle by leucyl tRNA syn
amino acid levels to mTORC1 Cell, 150, 1196 1208,
thetase in the mTORC1 signaling pathway, Proc. Natl.
doi: 10.1016/j.cell.2012.07.032.
Acad. Sci. USA, 115, 52795288, doi: 10.1073/pnas.
21.
Zoncu, R., Bar Peled, L., Efeyan, A., Wang, S., Sancak, Y.,
1801287115.
and Sabatini, D. M. (2011) mTORC1 senses lysosomal
34.
Mohan, N., Shen, Y., Dokmanovic, M., Endo, Y., Hirsch, D. S.,
amino acids through an inside out mechanism that
and Wu, W. J. (2016) VPS34 regulates TSC1/TSC2 het
requires the vacuolar H(+) ATPase, Science, 334, 678
erodimer to mediate RheB and mTORC1/S6K1 activation
683, doi: 10.1126/science.1207056.
and cellular transformation, Oncotarget 7, 52239 52254,
22.
Shen, K., Huang, R. K., Brignole, E. J., Condon, K. J.,
doi: 10.18632/oncotarget.10469.
Valenstein, M. L., Chantranupong, L., Bomaliyamu, A.,
35.
Yoon, M. S., Rosenberger, C. L., Wu, C., Truong, N.,
Choe, A., Hong, C., Yu, Z., and Sabatini, D. M. (2018)
Sweedler, J. V., and Chen, J. (2015) Rapid mitogenic regu
Architecture of the human GATOR1 and GATOR1 Rag
lation of the mTORC1 inhibitor, DEPTOR, by phospha
GTPases complexes, Nature, 556, 64 69, doi: 10.1038/
tidic acid. Mol. Cell, 58, 549 556, doi: 10.1016/j.mol
nature26158.
cel.2015.03.028.
23.
Gu, X., Orozco, J. M., Saxton, R. A., Condon, K. J.,
36.
Yoon, M. S., Sun, Y., Arauz, E., Jiang, Y., and Chen, J.
Liu, G. Y., Krawczyk, P. A., Scaria, S. M., Harper, J. W.,
(2011) Phosphatidic acid activates mammalian target of
Gygi, S. P., and Sabatini, D. M. (2017) SAMTOR is an
rapamycin complex 1 (mTORC1) kinase by displacing
S adenosylmethionine sensor for the mTORC1 pathway,
FK506 binding protein 38 (FKBP38) and exerting an
Science, 358, 813 818, doi: 10.1126/science.aao3265.
allosteric effect, J. Biol. Chem., 286, 2956829574,
24.
Chantranupong, L., Wolfson, R. L., Orozco, J. M.,
doi: 10.1074/jbc.M111.262816.
Saxton, R. A., Scaria, S. M., Bar Peled, L., Spooner, E.,
37.
Dayam, R. M., Saric, A., Shilliday, R. E., and Botelho, R. J.
Isasa, M., Gygi, S. P., and Sabatini, D. M. (2014) The ses
(2015) The phosphoinositide gated lysosomal Ca2+ chan
trins interact with GATOR2 to negatively regulate the
nel, TRPML1, is required for phagosome maturation,
amino acid sensing pathway upstream of mTORC1, Cell
Traffic Cph. Den., 16, 1010 1026, doi: 10.1111/tra.12303.
Rep., 9, 1 8, doi: 10.1016/j.celrep.2014.09.014.
38.
Durán, R. V., Oppliger, W., Robitaille, A. M., Heiserich,
25.
Wolfson, R. L., Chantranupong, L., Saxton, R. A., Shen, K.,
L., Skendaj, R., Gottlieb, E., and Hall, M. N. (2012)
Scaria, S. M., Cantor, J. R., and Sabatini, D. M. (2016)
Glutaminolysis activates Rag mTORC1 signaling, Mol.
Sestrin2 is a leucine sensor for the mTORC1 pathway,
Cell, 47, 349 358, doi: 10.1016/j.molcel.2012.05.043.
Science, 351, 43 48, doi: 10.1126/science.aab2674.
39.
Mony, V. K., Benjamin, S., and O’Rourke, E. J. (2016) A
26.
Kim, H., An, S., Ro, S. H., Teixeira, F., Park, G. J., Kim, C.,
lysosome centered view of nutrient homeostasis,
Cho, C. S., Kim, J. S., Jakob, U., Lee, J. H., and
Autophagy, 12, 619631, doi: 10.1080/15548627.2016.
Cho, U. S. (2015) Janus faced sestrin2 controls ROS and
1147671.
mTOR signalling through two separate functional domains,
40.
Lim, C. Y., and Zoncu, R. (2016) The lysosome as a com
Nat. Commun., 6, 10025, doi: 10.1038/ncomms10025.
mand and control center for cellular metabolism lyso
27.
Chantranupong, L., Scaria, S. M., Saxton, R. A., Gygi, M. P.,
somes as orchestrators of cellular metabolism, J. Cell Biol.,
Shen, K., Wyant, G. A., Wang, T., Harper, J. W., Gygi, S. P.,
214, 653 664, doi: 10.1083/jcb.201607005.
and Sabatini, D. M. (2016) The CASTOR proteins are
41.
Lamming, D. W., and Bar Peled, L. (2019) Lysosome: the
arginine sensors for the mTORC1 pathway, Cell, 165, 153
metabolic signaling hub, Traffic, 20, 27 38, doi: 10.1111/
164, doi: 10.1016/j.cell.2016.02.035.
tra.12617.
28.
Gai, Z., Wang, Q., Yang, C., Wang, L., Deng, W., and Wu, G.
42.
Tyagi, R., Shahani, N., Gorgen, L., Ferretti, M., Pryor, W.,
(2016) Structural mechanism for the arginine sensing and
Chen, P. Y., Swarnkar, S., Worley, P. F., Karbstein, K.,
regulation of CASTOR1 in the mTORC1 signaling path
Snyder, S. H., and Subramaniam, S. (2015) Rheb inhibits
way, Cell Discov. 2, 16051, doi: 10.1038/celldisc.2016.51.
protein synthesis by activating the PERK eIF2α signaling
29.
Shen, K., Rogala, K. B., Chou, H. T., Huang, R. K., Yu, Z.,
cascade, Cell Rep., 10, 684 693, doi: 10.1016/j.celrep.
and Sabatini, D. M. (2019) Cryo-EM structure of the
2015.01.014.
human FLCN-FNIP2-Rag-Ragulator complex, Cell,
43.
Martina, J. A., and Puertollano, R. (2013) Rag GTPases
179, 1319—1329, doi: 10.1016/j.cell.2019.10.036.
mediate amino acid dependent recruitment of TFEB and
30.
Meng, J., and Ferguson, S. M. (2018) GATOR1 depen
MITF to lysosomes, J. Cell Biol.,
200,
475491,
dent recruitment of FLCN-FNIP to lysosomes coordi
doi: 10.1083/jcb.201209135.
nates Rag GTPase heterodimer nucleotide status in
44.
Goberdhan, D. C. (2010) Intracellular amino acid sensing
response to amino acids, J. Cell Biol., 217, 2765 2776,
and mTORC1 regulated growth: new ways to block an old
doi: 10.1083/jcb.201712177.
target? Curr. Opin. Investig. Drugs Lond. Engl., 11, 1360
31.
Baba, M., Hong, S. B., Sharma, N., Warren, M. B.,
1367.
Nickerson, M. L., Iwamatsu, A., Esposito, D., Gillette, W. K.,
45.
Ögmundsdóttir, M. H., Heublein, S., Kazi, S., Reynolds, B.,
Hopkins, R. F., Hartley, J. L., Furihata, M., Oishi, S.,
Visvalingam, S. M., Shaw, M. K., and Goberdhan, D. C. I.
Zhen, W., Burke, T. R., Linehan, W. M., Schmidt, L. S.,
(2012) Proton assisted amino acid transporter PAT1 com
and Zbar, B. (2006) Folliculin encoded by the BHD gene
plexes with Rag GTPases and activates TORC1 on late
interacts with a binding protein, FNIP1, and AMPK, and
endosomal and lysosomal membranes, PLoS One 7,
is involved in AMPK and mTOR signaling, Proc. Natl.
e36616, doi: 10.1371/journal.pone.0036616.
Acad. Sci. USA, 103, 15552 15557, doi: 10.1073/pnas.
46.
Zoncu, R., Sabatini, D. M., and Efeyan, A. (2011) mTOR:
0603781103.
from growth signal integration to cancer, diabetes and age
32.
Starling, G. P., Yip, Y. Y., Sanger, A., Morton, P. E., Eden, E. R.,
ing., Nat. Rev. Mol. Cell Biol., 12, 21 35, doi: 10.1038/
and Dodding, M. P. (2016) Folliculin directs the formation
nrm3025.
of a Rab34 RILP complex to control the nutrient depen
47.
Kailash, R., and Aylett, C. H. S. (2018) Signal integration
dent dynamic distribution of lysosomes, EMBO Rep., 17,
in the (m)TORC1 growth pathway, Front. Biol., 13, 237
823 841, doi: 10.15252/embr.201541382.
262, doi: 10.1007/s11515 018 1501 7.
33.
Lee, M., Kim, J. H., Yoon, I., Lee, C., Sichani, M. F.,
48.
Lei, H. T., Ma, J., Sanchez Martinez, S., and Gonen, T.
Kang, J. S., Kang, J., Guo, M., Lee, K. Y., Han, G.,
(2018) Crystal structure of arginine bound lysosomal
БИОХИМИЯ том 85 вып. 4 2020
АМИНОКИСЛОТЫ - РЕГУЛЯТОРЫ МЕТАБОЛИЗМА КЛЕТКИ
473
transporter SLC38A9 in the cytosol open state, Nat. Struct.
63.
Nicklin, P., Bergman, P., Zhang, B., Triantafellow, E.,
Mol. Biol., 25, 522 527, doi: 10.1038/s41594 018 0072 2.
Wang, H., Nyfeler, B., Yang, H., Hild, M., Kung, C.,
49.
Cherfils, J. (2017) Encoding allostery in mTOR signaling:
Wilson, C., Myer, V. E., MacKeigan, J. P., Porter, J. A.,
the structure of the Rag GTPase/ragulator complex, Mol.
Wang, Y. K., Cantley, L. C., Finan, P. M., and Murphy, L. O.
Cell, 68, 823 824, doi: 10.1016/j.molcel.2017.11.027.
(2009) Bidirectional transport of amino acids regulates
50.
Mu, Z., Wang, L., Deng, W., Wang, J., and Wu, G. (2017)
mTOR and autophagy, Cell, 136, 521 534, doi: 10.1016/
Structural insight into the Ragulator complex which
j.cell.2008.11.044.
anchors mTORC1 to the lysosomal membrane, Cell
64.
Wyant, G. A., Abu Remaileh, M., Wolfson, R. L., Chen, W. W.,
Discov., 3, 17049, doi: 10.1038/celldisc.2017.49.
Freinkman, E., Danai, L. V., Vander Heiden, M. G., and
51.
Yonehara, R., Nada, S., Nakai, T., Nakai, M., Kitamura, A.,
Sabatini, D. M. (2017) mTORC1 activator SLC38A9 is
Ogawa, A., Nakatsumi, H., Nakayama, K. I., Li, S.,
required to efflux essential amino acids from lysosomes and
Standley, D. M., Yamashita, E., Nakagawa, A., and Okada, M.
use protein as a nutrient, Cell, 171, 642 654, doi: 10.1016/
(2017) Structural basis for the assembly of the Ragulator
j.cell.2017.09.046.
Rag GTPase complex, Nat. Commun.,
8,
1625,
65.
Kilberg, M. S., Shan, J., and Su, N. (2009) ATF4 depen
doi: 10.1038/s41467 017 01762 3.
dent transcription mediates signaling of amino acid limita
52.
Zhang, T., Wang, R., Wang, Z., Wang, X., Wang, F., and
tion, Trends Endocrinol. Metab., 20, 436 443, doi: 10.1016/
Ding, J. (2017) Structural basis for Ragulator functioning
j.tem.2009.05.008.
as a scaffold in membrane anchoring of Rag GTPases and
66.
Lawrence, R. E., Cho, K. F., Rappold, R., Thrun, A.,
mTORC1, Nat. Commun., 8, 1394, doi: 10.1038/s41467
Tofaute, M., Kim, D. J., Moldavski, O., Hurley, J. H., and
017 01567 4.
Zoncu, R. (2018) A nutrient induced affinity switch con
53.
Yu, Y., Li, S., Xu, X., Li, Y., Guan, K., Arnold, E., and
trols mTORC1 activation by its Rag GTPase ragulator
Ding, J. (2005) Structural basis for the unique biological
lysosomal scaffold, Nat. Cell Biol.,
20,
10521063,
function of small GTPase RHEB, J. Biol. Chem., 280,
doi: 10.1038/s41556 018 0148 6.
17093 17100, doi: 10.1074/jbc.M501253200.
67.
Wong, P. M., Feng, Y., Wang, J., Shi, R., and Jiang, X.
54.
Mazhab Jafari, M. T., Rohou, A., Schmidt, C., Bueler, S. A.,
(2015) Regulation of autophagy by coordinated action of
Benlekbir, S., Robinson, C. V., and Rubinstein, J. L.
mTORC1 and protein phosphatase 2A, Nat. Commun., 6,
(2016) Atomic model for the membrane embedded VO
8048, doi: 10.1038/ncomms9048.
motor of a eukaryotic v ATPase, Nature, 539, 118 122,
68.
Shen, K., Choe, A., and Sabatini, D. M.
(2017)
doi: 10.2210/pdb5tj5/pdb.
Intersubunit crosstalk in the Rag GTPase heterodimer
55.
Zhao, J., Benlekbir, S., and Rubinstein, J. L.
(2015)
enables mTORC1 to respond rapidly to amino acid avail
Electron cryomicroscopy observation of rotational states in
ability, Mol. Cell, 68, 552—565, doi: 10.1016/j.molcel.
a eukaryotic v ATPase, Nature, 521, 241245, doi:
2017.09.026.
10.1038/nature14365.
69.
Thomas, H. E., Zhang, Y., Stefely, J. A., Veiga, S. R.,
56.
Aylett, C. H. S., Sauer, E., Imseng, S., Boehringer, D.,
Thomas, G., Kozma, S. C., and Mercer, C. A. (2018)
Hall, M. N., Ban, N., and Maier, T. (2016) Architecture of
Mitochondrial complex I activity is required for maximal
human mTOR complex
1, Science,
351,
4852,
autophagy, Cell Rep., 24, 2417, doi: 10.1016/j.celrep.
doi: 10.1126/science.aaa3870.
2018.07.101.
57.
Yang, H., Wang, J., Liu, M., Chen, X., Huang, M., Tan, D.,
70.
Adachi, Y., De Sousa Coelho, A. L., Harata, I., Aoun, C.,
Dong, M. Q., Wong, C. C. L., Wang, J., Xu, Y., and
Weimer, S., Shi, X., Gonzalez Herrera, K. N., Takahashi, H.,
Wang, H. W. (2016) 4.4 Å Resolution Cryo-EM structure
Doherty, C., Noguchi, Y., Goodyear, L. J., Haigis, M. C.,
of human mTOR complex 1, Protein Cell, 7, 878 887,
Gerszten, R. E., and Patti, M. E. (2018) l alanine activates
doi: 10.1007/s13238 016 0346 6.
hepatic AMP activated protein kinase and modulates sys
58.
Basso, A. D., Mirza, A., Liu, G., Long, B. J., Bishop, W. R.
temic glucose metabolism, Mol. Metab., 17, 6170,
and Kirschmeier, P. (2005) The farnesyl transferase
doi: 10.1016/j.molmet.2018.08.002.
inhibitor (FTI) SCH66336 (lonafarnib) inhibits Rheb far
71.
Kimball, S. R., Gordon, B. S., Moyer, J. E., Dennis, M. D.,
nesylation and mTOR signaling. Role in FTI enhancement
and Jefferson, L. S. (2016) Leucine induced dephosphory
of taxane and tamoxifen anti tumor activity, J. Biol. Chem.,
lation of sestrin2 promotes mTORC1 activation, Cell.
280, 31101 31108, doi: 10.1074/jbc.M503763200.
Signal., 28, 896 906, doi: 10.1016/j.cellsig.2016.03.008.
59.
Rogala, K. B., Gu, X., Kedir, J. F., Abu Remaileh, M.,
72.
Parmigiani, A., Nourbakhsh, A., Ding, B., Wang, W.,
Bianchi, L. F., Bottino, A. M. S., Dueholm, R., Niehaus, A.,
Kim, Y. C., Akopiants, K., Guan, K. L., Karin, M., and
Overwijn, D., Fils, A. C. P., Zhou, S. X., Leary, D.,
Budanov, A. V. (2014) Sestrins inhibit mTORC1 kinase
Laqtom, N. N., Brignole, E. J., and Sabatini, D. M. (2019)
activation through the GATOR complex, Cell Rep., 9,
Structural basis for the docking of mTORC1 on the lysoso
1281 1291, doi: 10.1016/j.celrep.2014.10.019.
mal surface, Science, 366, 468 475, doi: 10.1126/science.
73.
Wauson, E. M., Zaganjor, E., Lee, A. Y., Guerra, M. L.,
aay0166.
Ghosh, A. B., Bookout, A. L., Chambers, C. P., Jivan, A.,
60.
Peng, W., and Jewell, J. L. (2020) Amino acid sensing:
McGlynn, K., Hutchison, M. R., Deberardinis, R. J., and
architecture of mTORC1 on the lysosome surface, Curr.
Cobb, M. H. (2012) The G protein coupled taste receptor
Biol., 30, 89 91, doi: 10.1016/j.cub.2019.11.087.
T1R1/T1R3 regulates mTORC1 and autophagy, Mol. Cell,
61.
Fan, S. J., Snell, C., Turley, H., Li, J. L., McCormick, R.,
47, 851 862, doi: 10.1016/j.molcel.2012.08.001.
Perera, S. M. W., Heublein, S., Kazi, S., Azad, A., Wilson, C.,
74.
Pezze, P. D., Ruf, S., Sonntag, A. G., Langelaar
Harris, A. L., and Goberdhan, D. C. I. (2016) PAT4 levels
Makkinje, M., Hall, P., Heberle, A. M., Navas, P. R., van
control amino acid sensitivity of rapamycin resistant
Eunen, K., Tölle, R. C., Schwarz, J. J., Wiese, H.,
mTORC1 from the Golgi and affect clinical outcome in
Warscheid, B., Deitersen, J., Stork, B., Fäßler, E.,
colorectal cancer, Oncogene, 35, 3004 3015, doi: 10.1038/
Schäuble, S., Hahn, U., Horvatovich, P., Shanley, D. P.,
onc.2015.363.
and Thedieck, K. (2016) A systems study reveals concur
62.
Pedroso, J. A. B., Zampieri, T. T., and Donato, J. (2015)
rent activation of AMPK and mTOR by amino acids, Nat.
Reviewing the effects of L leucine supplementation in the
Commun., 7, doi: 10.1038/ncomms13254.
regulation of food intake, energy balance, and glucose homeo
75.
Krall, A. S., Xu, S., Graeber, T. G., Braas, D., and
stasis, Nutrients, 7, 3914 3937, doi: 10.3390/nu7053914.
Christofk, H. R. (2016) Asparagine promotes cancer cell
2 БИОХИМИЯ том 85 вып. 4 2020
474
НЕСТЕРОВ и др.
proliferation through use as an amino acid exchange factor,
89. Carroll, B., Maetzel, D., Maddocks, O. D., Otten, G.,
Nat. Commun., 7, 11457, doi: 10.1038/ncomms11457.
Ratcliff, M., Smith, G. R., Dunlop, E. A., Passos, J. F.,
76.
Dyachok, J., Earnest, S., Iturraran, E. N., Cobb, M. H.,
Davies, O. R., Jaenisch, R., Tee, A. R., Sarkar, S., and
and Ross, E. M. (2016) Amino acids regulate mTORC1 by
Korolchuk, V. I. (2016) Control of TSC2 Rheb signaling
an obligate two step mechanism, J. Biol. Chem., 291,
axis by arginine regulates mTORC1 activity, eLife, 5,
22414 22426, doi: 10.1074/jbc.M116.732511.
e11058, doi: 10.7554/eLife.11058.
77.
Ruderman, N. B., Xu, X. J., Nelson, L., Cacicedo, J. M.,
90. Jewell, J. L., Kim, Y. C., Russell, R. C., Yu, F. X., Park, H. W.,
Saha, A. K., Lan, F., and Ido, Y. (2010) AMPK and
Plouffe, S. W., Tagliabracci, V. S., and Guan, K. L. (2015)
SIRT1: a long standing partnership? Am. J. Physiol.
Differential regulation of mTORC1 by leucine and gluta
Endocrinol. Metab., 298, 751 760, doi: 10.1152/ajpen
mine, Science,
347,
194198, doi:
10.1126/science.
do.00745.2009.
1259472.
78.
Kim, J. H., Lee, C., Lee, M., Wang, H., Kim, K., Park, S. J.,
91. Laxman, S., Sutter, B. M., and Tu, B. P.
(2014)
Yoon, I., Jang, J., Zhao, H., Kim, H. K., Kwon, N. H.,
Methionine is a signal of amino acid sufficiency that
Jeong, S. J., Yoo, H. C., Kim, J. H., Yang, J. S., Lee, M. Y.,
inhibits autophagy through the methylation of PP2A,
Lee, C. W., Yun, J., Oh, S. J., Kang, J. S., Martinis, S. A.,
Autophagy, 10, 386 387, doi: 10.4161/auto.27485.
Hwang, K. Y., Guo, M., Han, G., Han, J. M., and Kim, S.
92. Sutter, B. M., Wu, X., Laxman, S., and Tu, B. P. (2013)
(2017) Control of leucine dependent mTORC1 pathway
Methionine inhibits autophagy and promotes growth by
through chemical intervention of leucyl tRNA synthetase
inducing the SAM responsive methylation of PP2A, Cell,
and Rag D interaction, Nat. Commun.,
8,
732,
154, 403 415, doi: 10.1016/j.cell.2013.06.041.
doi: 10.1038/s41467 017 00785 0.
93. Chen, L., Wang, K., Long, A., Jia, L., Zhang, Y., Deng, H.,
79.
Yoon, M. S., Son, K., Arauz, E., Han, J. M., Kim, S., and
Li, Y., Han, J., and Wang, Y. (2017) Fasting induced hor
Chen, J. (2016) Leucyl tRNA synthetase activates Vps34
monal regulation of lysosomal function, Cell Res., 27, 748
in amino acid sensing mTORC1 signaling, Cell Rep., 16,
763, doi: 10.1038/cr.2017.45.
1510 1517, doi: 10.1016/j.celrep.2016.07.008.
94. Yuan, W., Guo, S., Gao, J., Zhong, M., Yan, G., Wu, W.,
80.
Wolfson, R. L., Chantranupong, L., Wyant, G. A., Gu, X.,
Chao, Y., and Jiang, Y. (2017) General control nondere
Orozco, J. M., Shen, K., Condon, K. J., Petri, S., Kedir, J.,
pressible 2 (GCN2) kinase inhibits target of rapamycin
Scaria, S. M., Abu Remaileh, M., Frankel, W. N., and
complex 1 in response to amino acid starvation in
Sabatini, D. M. (2017) KICSTOR recruits GATOR1 to the
Saccharomyces cerevisiae, J. Biol. Chem., 292, 2660 2669,
lysosome and is necessary for nutrients to regulate
doi: 10.1074/jbc.M116.772194.
mTORC1, Nature, 543, 438 442, doi: 10.1038/nature21423.
95. Averous, J., Lambert Langlais, S., Mesclon, F., Carraro, V.,
81.
Tomita, T., Kuzuyama, T., and Nishiyama, M. (2011)
Parry, L., Jousse, C., Bruhat, A., Maurin, A. C., Pierre, P.,
Structural basis for leucine induced allosteric activation of
Proud, C. G., and Fafournoux, P. (2016) GCN2 con
glutamate dehydrogenase, J. Biol. Chem., 286,
37406
tributes to mTORC1 inhibition by leucine deprivation
37413, doi: 10.1074/jbc.M111.260265.
through an ATF4 independent mechanism, Sci. Rep. 6,
82.
Durán, R. V., MacKenzie, E. D., Boulahbel, H., Frezza, C.,
27698, doi: 10.1038/srep27698.
Heiserich, L., Tardito, S., Bussolati, O., Rocha, S., Hall, M.
96. Floyd, J. C., Fajans, S. S., Pek, S., Thiffault, C. A.,
N., and Gottlieb, E. (2013) HIF independent role of prolyl
Knopf, R. F., and Conn, J. W. (1970) Synergistic effect of
hydroxylases in the cellular response to amino acids,
certain amino acid pairs upon insulin secretion in man,
Oncogene, 32, 4549 4556, doi: 10.1038/onc.2012.465.
Diabetes, 19, 102 108, doi: 10.2337/diab.19.2.102.
83.
Milkereit, R., Persaud, A., Vanoaica, L., Guetg, A., Verrey, F.,
97. Choi, Y. H., Fletcher, P. J., and Anderson, G. H. (2001)
and Rotin, D. (2015) LAPTM4b recruits the LAT1 4F2hc
Extracellular amino acid profiles in the paraventricular
Leu transporter to lysosomes and promotes mTORC1 acti
nucleus of the rat hypothalamus are influenced by diet
vation, Nat. Commun., 6, 7250, doi: 10.1038/ncomms8250.
composition, Brain Res., 892, 320 328, doi: 10.1016/
84.
Shang, P., Valapala, M., Grebe, R., Hose, S., Ghosh, S.,
s0006 8993(00)03267 4.
Bhutto, I. A., Handa, J. T., Lutty, G. A., Lu, L., Wan, J.,
98. Su, Y., Lam, T. K. T., He, W., Pocai, A., Bryan, J., Aguilar
Qian, J., Sergeev, Y., Puertollano, R., Zigler, J. S., Xu, G. T.,
Bryan, L., and Gutiérrez Juárez, R. (2012) Hypothalamic
and Sinha, D.
(2017) The amino acid transporter
leucine metabolism regulates liver glucose production,
SLC36A4 regulates the amino acid pool in retinal pig
Diabetes, 61, 85 93, doi: 10.2337/db11 0857.
mented epithelial cells and mediates the mechanistic target
99. Xiao, Y., Deng, Y., Yuan, F., Xia, T., Liu, H., Li, Z., Liu, Z.,
of rapamycin, complex 1 signaling, Aging Cell, 16, 349 359,
Ying, H., Liu, Y., Zhai, Q., Chen, S., and Guo, F. (2017)
doi: 10.1111/acel.12561.
ATF4/ATG5 signaling in hypothalamic proopiome
85.
Andrzejewska, Z., Nevo, N., Thomas, L., Chhuon, C.,
lanocortin neurons regulates fat mass via affecting energy
Bailleux, A., Chauvet, V., Courtoy, P. J., Chol, M.,
expenditure, Diabetes, 66, 1146 1158, doi: 10.2337/db16
Guerrera, I. C., and Antignac, C. (2016) Cystinosin is a
1546.
component of the vacuolar H+ ATPase Ragulator-Rag
100. Delgoffe, G. M., Pollizzi, K. N., Waickman, A. T.,
complex controlling mammalian target of rapamycin com
Heikamp, E., Meyers, D. J., Horton, M. R., Xiao, B.,
plex 1 signaling, J. Am. Soc. Nephrol., 27, 1678 1688,
Worley, P. F., and Powell, J. D. (2011) The kinase mTOR
doi: 10.1681/ASN.2014090937.
regulates the differentiation of helper T cells through the
86.
Shen, K., and Sabatini, D. M. (2018) Ragulator and
selective activation of signaling by mTORC1 and
SLC38A9 activate the Rag GTPases through noncanonical
mTORC2, Nat. Immunol., 12, 295 303, doi: 10.1038/
GEF mechanisms, Proc. Natl. Acad. Sci. USA, 115, 9545
ni.2005.
9550, doi: 10.1073/pnas.1811727115.
101. Bao, W., Wang, Y., Fu, Y., Jia, X., Li, J., Vangan, N., Bao, L.,
87.
Lee, S. W., Cho, B. H., Park, S. G., and Kim, S. (2004)
Hao, H., and Wang, Z. (2015) mTORC1 regulates fla
Aminoacyl-tRNA synthetase complexes: beyond transla
gellin induced inflammatory response in macrophages,
tion, J. Cell Sci., 117, 3725 3734, doi: 10.1242/jcs.01342.
PLoS One, 10, e0125910, doi: 10.1371/journal.pone.
88.
Fawal, M. A., Brandt, M., and Djouder, N. (2015)
0125910.
MCRS1 binds and couples Rheb to amino acid dependent
102. Decker, B., and Pumiglia, K. (2018) mTORc1 activity is
mTORC1 activation, Dev. Cell, 33, 67 81, doi: 10.1016/
necessary and sufficient for phosphorylation of eNOS
j.devcel.2015.02.010.
S1177, Physiol. Rep., 6, е13733, doi: 10.14814/phy2.13733.
БИОХИМИЯ том 85 вып. 4 2020
АМИНОКИСЛОТЫ - РЕГУЛЯТОРЫ МЕТАБОЛИЗМА КЛЕТКИ
475
103. Nesterov, S. V., Yaguzhinsky, L. S., Podoprigora, G. I., and
105. Podoprigora, G. I., Nartsissov, Y. R., and Aleksandrov, P. N.
Nartsissov, Y. R. (2018) Autocatalytic cycle in the patho
(2005) Effect of glycine on microcirculation in pial vessels
genesis of diabetes mellitus: biochemical and pathophysio
of rat brain, Bull. Exp. Biol. Med., 139, 675677,
logical aspects of metabolic therapy with natural amino
doi: 10.1007/s10517 005 0375 2.
acids on the example of glycine, Diabetes Mellit., 21, 283
106. Podoprigora, G. I., Blagosklonov, O., Angoué, O.,
292, doi: 10.14341/DM9529.
Boulahdour, H., and Nartsissov, Y. R. (2012) Assessment of
104. Podoprigora, G. I., and Nartsissov, Y. R. (2009) Effect of glycine
microcirculatory effects of glycine by intravital microscopy
on the microcirculation in rat mesenteric vessels, Bull. Exp.
in rats, Conf. Proc. IEEE Eng. Med. Biol. Soc., 2012, 2651
Biol. Med., 147, 308 311, doi: 10.1007/s10517 009 0498 y.
2654, doi: 10.1109/EMBC.2012.6346509.
AMINO ACIDS AS METABOLIC REGULATORS
Review
S. V. Nesterov1,2, L. S. Yaguzhinsky1,3*, G. I. Podoprigora1, and Ya. R. Nartsissov1
1 Institute of Cytochemistry and Molecular Pharmacology, 115404 Moscow, Russia; E&mail: yag@genebee.msu.ru
2 Moscow Institute of Physics and Techonology, 141701 Dolgoprudny, Moscow Region, Russia
3 Belozersky Research Institute for Physico&Chemical Biology, Lomonosov Moscow State University, 119991 Moscow, Russia
Received October 3, 2019
Revised February 10, 2020
Accepted February 11, 2020
In this analytical review the regulation and synchronization principles of metabolic processes in mammalian cells
were studied. It was used a model of cell metabolism as a two componential system, which includes a controlling sig
naling system (that regulates the main enzymatic systems), and an executive metabolic system (that directly performs
biosynthesis). This consideration allowed us to distinguish two transitional metabolic states (transition from catabo
lism to anabolism and vice versa), in which the main changes in the signaling system occur. The signaling system of
natural amino acids (AAs) was selected for review as the most convenient fragment of the cell metabolism, since AAs
are involved in both signaling and executive metabolic subsystems. A graphical method for representation of signaling
events was developed in the work. It made possible to demonstrate the processes sequence occurring in both meta
bolic subsystems during the passage of a complete metabolic cycle by a non dividing cell. An important feature of the
AA signaling system was revealed: their signal properties are determined not only by molecular structure, but also by
their location in the cell. Four main signaling groups of AAs were determined: localized in lysosomes, mitochondria,
cytosol, and extracellular space near the plasma membrane. These AA groups are similar in composition, but have dif
ferent receptors. The scheme of metabolism regulation by AAs was constructed in this work and can serve as basis for
the development of a more complete spatio temporal scheme of metabolic regulation, which includes a wide variety
of other intracellular signaling cascades.
Keywords: amino acids, intracellular signaling, mTORC1, AMPK, lysosome, catabolism, anabolism
БИОХИМИЯ том 85 вып. 4 2020
2*