БИОХИМИЯ, 2020, том 85, вып. 4, с. 476 - 493
УДК 577.151.36
КАТАЛИТИЧЕСКАЯ СУБЪЕДИНИЦА PKA КАК ПРОТОТИП
СЕМЕЙСТВА ЭУКАРИОТИЧЕСКИХ ПРОТЕИНКИНАЗ
Обзор
© 2020
Б.А. Рейхардт*, П.Д. Шабанов
Институт экспериментальной медицины, 197376 Санкт!Петербург, Россия;
электронная почта: reichardt@mail.ru
Поступила в редакцию 21.10.2019
После доработки 25.02.2020
Принята к публикации 26.02.2020
Каталитическая субъединица PKА (PKAc) представляет собой практически изолированный киназный до
мен, консервативный у всех эукариотических протеинкиназ. PKAc состоит из двух долей, образующих ка
талитическую щель, в которой располагаются: ATP связывающий участок, пептид связывающий участок и
каталитический сайт. В процессе фолдинга вторичные структуры РКАс укладываются так, что неполярные
участки собираются в глобулярное ядро, а подвижные петли и хвосты экспонируются наружу, образуя регу
ляторные элементы. Синтезированная de novo PKАс подвергается процессингу путем фосфорилирования T
петли. При этом формируется полноценный активный центр, способный высокоаффинно связывать косуб
страты. Молекула АТР «склеивает» две доли вместе, а связывание пептидного субстрата завершает сборку
активного центра. В результате «каталитическая триада» (γ фосфат ATP, гидроксил Ser/Thr белка субстрата
и карбоксил Asp166) занимает положение, оптимальное для эффективного катализа. Динамическая реорга
низация полярных и гидрофобных взаимодействий в ходе каталитического цикла обеспечивает переход
PKАс из открытой конформации в закрытую и обратно. Изучение структурных основ работы ePK необхо
димо для успешного создания модуляторов ePK.
КЛЮЧЕВЫЕ СЛОВА: каталитическая субъединица PKA, АТР связывающий сайт PKА, пептид связываю
щий сайт PKА, Thr197 PKA, гидрофобные спины.
DOI: 10.31857/S0320972520040028
cAMP Зависимая протеинкиназа (cAPK),
ные субстраты. Выделяют серин/треониновые
получившая известность как PKA (протеинки
PK, осуществляющие перенос фосфата на ами
наза А), была открыта в 1968 г. [1]. Уже первые
нокислотный осадок (а.о.) серина или треонина
кристаллические структуры PKAc [2, 3], полу
(протеин Ser/Thr киназы); PK, переносящие
ченные к 1991-1993 гг., легли в основу класси
фосфат на остаток тирозина (протеин Tyr кина
фикации консервативных доменов (ePK,
зы); PK двойной специфичности (Ser/Thr и
eukaryotic protein kinases) [4]. Будучи наиболее
Tyr киназы); а также аргинин , гистидин кина
просто организованной и хорошо изученной,
зы прокариот и другие [18].
PKAc прочно вошла в научную литературу, как
Ser/Thr киназы, вместе с Tyr киназами
прототип обширного и разнообразного семей
(ТК), составляют наиболее важную группу ePK
ства ePK [5-11].
[19]. У человека относительные доли фосфори
лирования белков по Ser, Thr, и Tyr составляют ∼
86, 12 и 2% [20]. Несмотря на небольшой вклад
СЕМЕЙСТВО ЭУКАРИОТИЧЕСКИХ
в общее фосфорилирование, ТК занимают осо
ПРОТЕИНКИНАЗ
бое место, благодаря высокому онкогенному
потенциалу. Многие цитоплазматические онко
С момента открытия фосфорилирования,
гены обладают Tyr киназной активностью, а
как важнейшего механизма регуляции функций
мембранные рецепторы факторов роста пред
белков, стало очевидно, что протеинкиназы
ставляют собой рецепторные ТК [21].
(PK) играют ключевую роль во всех аспектах
В протеоме человека выявлено 518 PK, из
клеточной жизни [12-16]. PK относятся к клас
которых 478 содержат характерный для всех ePK
су фосфотрансфераз [17], катализирующих пе
консервативный каталитический домен; а 40 -
ренос фосфосфосодержащей группы на различ
представляют собой атипичные PK, обладаю
щие киназной активностью, но не проявляю
* Адресат для корреспонденции.
щие структурного сходства с ePK. Эволюцион
476
КАТАЛИТИЧЕСКАЯ СУБЪЕДИНИЦА PKA
477
ное дерево ePK делится на восемь основных
Ser/Thr киназы и Tyr киназы имеют регулятор
групп. К семейству AGC относятся PKA, PKG и
ные (R) домены [22-26]. Обычно R домен бло
PKC; в семейство CaMK входят Ca/кальмоду
кирует киназную активность (PKC, PKG,
лин зависимые PK; семейство CK1 представля
CaMKII), выступая в роли псевдосубстрата. Ак
ет казеинкиназа 1; семейство CMGC образуют
тивацию таких PK осуществляют низкомолеку
циклин зависимые PK (CDK), митоген активи
лярные аллостерические эффекторы (Са2+,
руемые PK (MAPK), киназа гликогенсинтазы
cAMP/cGMP, фосфолипиды), которые, связы
(GSK) и CDK подобные PK; семейство STE
ваясь с R доменом, устраняют автоингибирую
составляют PK верхних эшелонов каскада
щий эффект. PK семейства CaMK, не способ
МАРK, аналоги дрожжевой PK STE; семейства
ные самостоятельно связывать Са2+, используют
ТК и TKL включают Tyr киназы и ТК подоб
Са связывающий белок кальмодулин в качестве
ные киназы; и наконец, членами семейства
сенсора Са2+ сигнала [27]. К регуляторным эле
RGC являются рецепторные гуанилатциклазы,
ментам относятся также сайты фосфорилирова
обладающие ТК доменом [19].
ния/автофосфорилирования, присутствующие
в структуре многих ePK.
Субклеточная локализация PK регулируется
МОДУЛЬНАЯ СТРУКТУРА ePK
путем ассоциации с мембранными липидами,
скаффолдами, шаперонами и адаптерными бел
Являясь ключевыми ферментами внутри
ками. Для этого в составе ePK имеются домены
клеточной сигнализации, PK должны выпол
(PH, C1, C2, PX, FERM), связывающие опреде
нять свои функции в строго определенное время
ленные фракции мембранных фосфолипидов;
и строго определенном месте. Эти принципы
домены (SH3, SH2, 14 3 3), распознающие ами
воплощает модульная структура ePK (рис. 1).
нокислотные мотивы (Pro xx Pro) или ковале
Наряду с каталитическим доменом, многие
нтно модифицированные аминокислоты
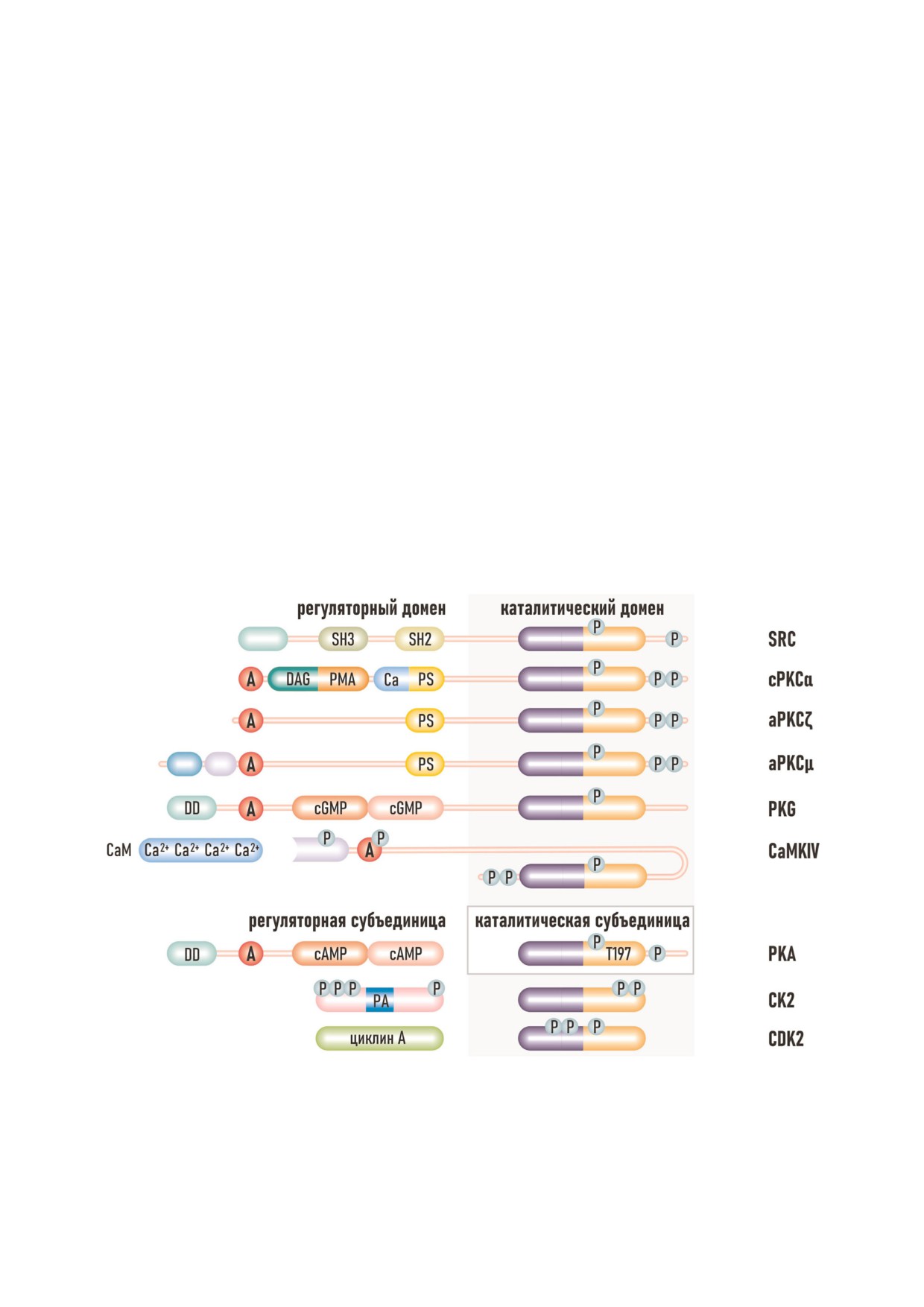
Рис. 1. Модульная структура ePK. А - автоингибирующий домен, Р - сайты фосфорилирования, DD - домен димериза
ции, NLS - сигнал ядерной локализации. Сайты, связывающие эффекторные молекулы: DAG - диацилглицерол, PMA -
форболовый эфир, PS - фосфатидилсерин, Ca - Ca2+, CaM - кальмодулин, PA - полиамины.
journal/biokhsm/
БИОХИМИЯ том 85 вып. 4 2020
478
РЕЙХАРДТ, ШАБАНОВ
(pTyr/pSer); а также домены, способные к диме
образующие участок связывания пептида. Три
ризации (DD DD, PZD PZD, SAM SAM) с ана
последние петли образуют сегмент активации,
логичными доменами других белков [28]. В ряде
выполняющий каталитические и регуляторные
случаев функции R доменов выполняют само
функции [7, 34].
стоятельные белки - регуляторные субъедини
Как и многие ePK, PKAc синтезируется de
цы. Так, холоферменты CDK1 [29] и CK2 [30]
novo в неактивной конформации и требует фос
представляют собой гетерокомплексы RC и
форилирования для активации [35]. В результа
R2C2, где R - регуляторные, а C - каталитичес
те фосфорилирования формируется полноцен
кие субъединицы.
ный активный центр (способный высокоаф
Холофермент PKA (R2C2) состоит из двух ре
финно связывать ATP и пептидный субстрат) и
гуляторных и двух каталитических субъединиц
PKAc переходит в активную конформацию
[31]. Связывание cAMP с PKAr в составе холо
[36-38]. В отсутствие ATP, благодаря гибкому
фермента стимулирует высвобождение двух ак
линкерному региону N и C доли могут переме
тивных PKAc мономеров и последующее фос
щаться относительно друг друга. Такая конфор
форилирование белков мишеней [32]. Таким
мация называется открытой. Молекула ATP,
образом, PKАс представляет собой практически
связываясь одновременно с обеими долями,
изолированный киназный домен ePK, лишен
«склеивает» их вместе и переводит энзим в зак
ный дополнительных модулей (таких как авто
рытую конформацию. По завершении катали
ингибирующий домен, сайты связывания ал
тического цикла PKAc освобождается от про
лостерических эффекторов). В отличие от чрез
дуктов реакции и снова переходит в открытую
вычайно разнообразных R доменов, каталити
конформацию [33, 39, 40].
ческий домен ePK обладает высокой степенью
гомологии и включает 12 консервативных суб
доменов, характерных для всех членов семей
ДОМЕННАЯ СТРУКТУРА КАТАЛИТИЧЕСКОЙ
ства. Три важнейшие функции [4]: 1) связыва
СУБЪЕДИНИЦЫ PKA
ние и ориентация ATP; 2) связывание и ориен
тация белка субстрата; и 3) перенос γ фосфата
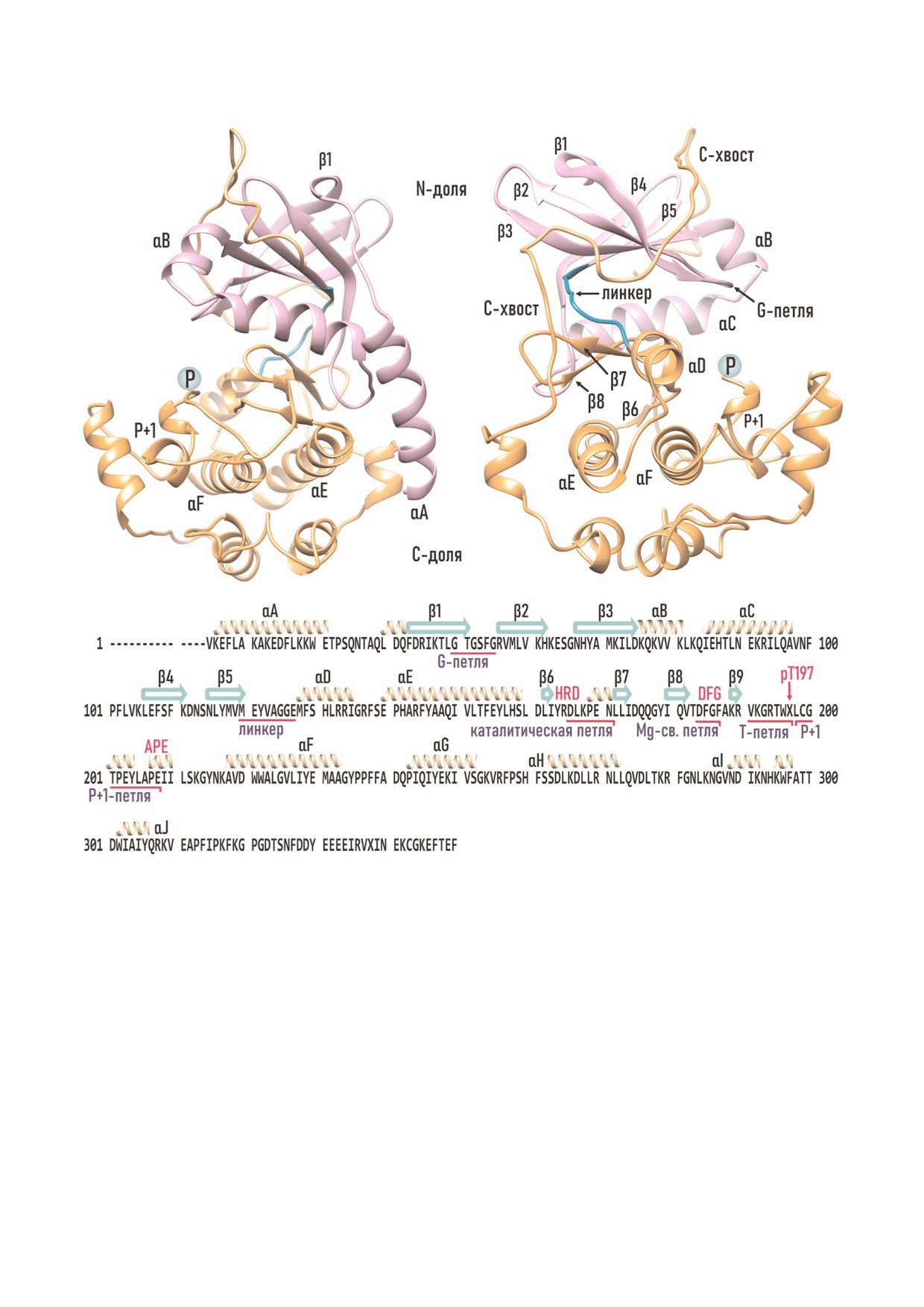
N4доля. N доля PKAc (40-119 а.о.) представ
ATP на Ser/Thr или Tyr белка субстрата - наш
лена пятью антипараллельными β структурами
ли отражение в структуре PKAc.
(1-5) и небольшим α спиральным доменом
(A C) (рис. 2). Спиральный домен включает две
вариабельные α спирали (αA и αВ) и длинную
КАТАЛИТИЧЕСКАЯ СУБЪЕДИНИЦА PKA.
αC спираль, обязательную для структуры лю
ОБЩИЕ СВЕДЕНИЯ
бой ePK [3]. N доля PKAc млекопитающих на
чинается с сайта миристоилирования (Gly1), N
PKAc состоит из двух долей - N концевой
концевая аминогруппа которого способна кова
(малой) и C концевой (большой), соединяю
лентно связывать остаток жирной (миристино
щихся между собой подвижным линкерным
вой) кислоты. У немиристоилированных форм
участком. Две доли формируют каталитическую
PKAc подвижный N хвост (1-10 а.о.) распола
щель, в которой размещаются молекула ATP в
гается произвольно [36]. Миристоилирование
комплексе с двумя дивалентными катионами
обычно повышает сродство белков к мембра
(Mg или Mn) и фосфо акцепторный участок
нам, однако у свободных PKAc углеводородная
пептидного субстрата.
цепь миристиновой кислоты укладывается в
За связывание ATP преимущественно отве
гидрофобный карман на поверхности C доли.
чает N доля, тогда как C доля содержит участки
Присоединение R субъединиц освобождает
для связывания пептида, катализа, и регуляции
жирнокислотный хвост, и холофермент PKA
[3, 6, 33]. Обе доли образуют несколько фарма
прекрасно связывается с липидными везикула
кофорных площадок для связывания различ
ми [41].
ных частей аденозинтрифосфата: «фосфатный
Следующие 11-31 а.о. N!доли образуют ам
якорь», «рибозный якорь», «гидрофобную щель»
фипатическую αA спираль. N конец αA спира
и аденин связывающий карман. На поверхности
ли прочно фиксируется на поверхности боль
C доли располагаются: 1) каталитическая петля,
шой доли благодаря гидрофобным силам притя
участвующая в процессе катализа; 2) Mg связы
жения, а C конец располагается между долями,
вающая петля, координирующая положение
ограничивая их подвижность, наподобие суста
комплекса Mg2/ATP; 3) активирующая петля,
ва. Гидрофобный «сустав» образуют боковые це
которая содержит консервативный Thr197, не
пи ароматических а.о. Phe26 и Trp30 αA спира
обходимый для активации PKAc путем фосфо
ли, которые проникают в обширную гидрофоб
рилирования; и 4) Р+1 петля и ее окружение,
ную щель между долями (Ile94, Ala97, Val98,
БИОХИМИЯ том 85 вып. 4 2020
КАТАЛИТИЧЕСКАЯ СУБЪЕДИНИЦА PKA
479
а
б
в
Рис. 2. Структура PKАс мыши по Zheng at al. (1993). а - 15-350 а.о.; б - 40-350 а.о.; в - первичная аминокислотная по
следовательность. PDB:1ATP.
journal/biokhsm/
Tyr156, Leu160, Leu162). Положение Phe26 и
нов по «анатомической» классификации Хэнкса
Trp30 фиксируют с двух сторон полярные Arg93
[4]. Первые два субдомена образуют фосфатный
αC спирали и Arg190 β9 структуры. В этом
якорь, удерживающий фосфаты ATP, в положе
участке C концы αC спирали и αA спирали
нии оптимальном для катализа.
тесно контактируют и стабилизируют друг друга
G4петля (Glycine rich loop, G loop), соединя
путем взаимодействий Lys92-Ser34, Arg93-
ющая β1 и β2 структуры, получила свое назва
Trp30, Gln96-Lys29, и Gln96-Ser34 [42]. Важ
ние по глициновому кластеру (Gly50, Gly52,
нейшими консервативными мотивами N доли
Gly55), консервативному у всех ePK. Обычно к
являются: G петля, β3 структура, и αC спи
G петле относят короткие фрагменты β1 и β2,
раль, входящие в состав I, II, и III го субдоме
на которые она опирается. G петля стабилизи
БИОХИМИЯ том 85 вып. 4 2020
480
РЕЙХАРДТ, ШАБАНОВ
руется несколькими внутримолекулярными
Важную роль в связывании ATP играют рас
связями между антипараллельными β структу
положенный в глубине каталитической щели
рами и образует «козырек» над входом в катали
линкерный регион (120-127 а.о.), вместе с
тическую щель. В закрытой конформации G
αD спиралью, входящий в состав субдомена V.
петля покрывает молекулу ATP, изолируя ее от
У PKA этот фрагмент содержат один а.о.
растворителя. При проникновении молекулы
(Glu127), образующий рибозный якорь, и два
ATP в каталитическую щель амиды основной
а.о. (Glu121 и Val123), отвечающие за распозна
цепи G петли захватывают фосфаты ATP и ко
вание фармакофорных атомов N аденинового
ординируют их положение внутри активного
гетероцикла ATP.
центра [43]. Ser53 образует водородную связь с
C4доля. C доля (128-300 а.о.) включает семь
ключевым γ фосфатом, а Phe54 и Gly55 фикси
α спиралей (D I) и четыре коротких β структу
руют β фосфат. По данным мутационного ана
ры (6-9), соединенные между собой петлями.
лиза [44], из трех глицинов наиболее важную
Спиральные домены образуют глобулярное яд
роль в связывании ATP играет Gly52, регулиру
ро, а экспонированные наружу петли участвуют
ющий положение Ser53 на вершине G петли
в связывании косубстратов и регуляции катали
[45]. G петля заканчивается на Val57 β2 струк
тической активности [3] (рис. 2). C доля начи
туры, который вместе с Ala70 образует верхнюю
нается с короткой αD спирали, за которой сле
часть гидрофобной щели, вмещающей в себя
дует длинная гидрофобная αE спираль (субдо
адениновый гетероцикл ATP.
мен VIA). Важнейшим участком C доли являет
Вторую часть фосфатного якоря составляет
ся продолжительный фрагмент, состоящий из
последовательность АхК, относящаяся к β3
β структур, соединяющихся между собой под
структуре (субдомен II). Находящийся внутри
вижными петлями (рис. 3). Первой в этом фраг
каталитической щели Lys72 этого мотива обра
менте располагается каталитическая петля
зует связи с двумя (α и β) фосфатами ATP. В
(166-171 а.о.), занимающая место между β6 и
свою очередь, положение Lys72 стабилизирует
β7 структурами (субдомен VIB). Консерватив
Glu91, расположенный в начале αC спирали, с
ный HRD мотив (His Arg Asp) этой петли со
которым Lys72 образует ионную пару [46].
держит ключевую пару: Arg165-Asp166, в кото
Возможность взаимодействия Lys72-Glu91
рой аргинин запускает сборку активного центра
критически зависит от конформации подвижной
в ответ на фосфорилирование петли активации
αC спирали (субдомен III). Располагаясь между
[36], а аспартат непосредственно участвует в
двумя долями, своим N концом αC спираль тес
процессе катализа. «Каталитический» Asp166
но контактирует с сегментом активации C доли,
выполняет две функции: выступает в роли про
и ее статус зависит от таких факторов, как состо
тонной ловушки и координирует гидроксиль
яние сайта фосфорилирования, связывание ATP
ную группу Ser/Thr белка субстрата относи
и сборка гидрофобного R спина [37, 47-49]. В
тельно γ фосфата ATP [51-54], положение ко
закрытой конформации положение обеих долей
торого контролирует еще один консервативный
фиксирует «застежка», которую образуют His87
остаток (Lys168) каталитической петли. Ката
αC спирали и pThr197 петли активации [50].
литическая петля содержит также Asp171, хела
а
б
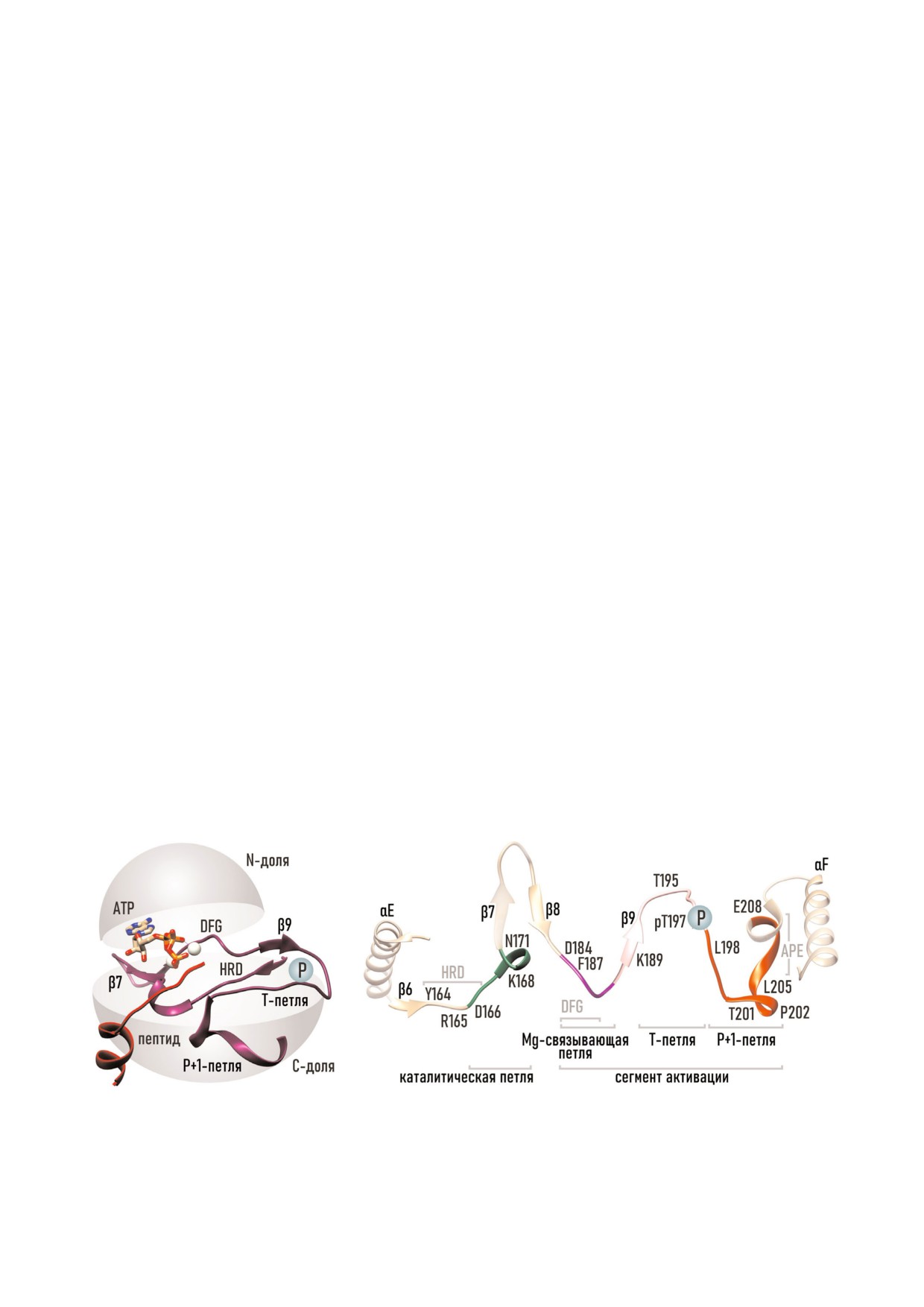
Рис. 3. Каталитическая петля и сегмент активации. а - Положение в структуре активной PKАc; б - схема.
journal/biokhsm/
БИОХИМИЯ том 85 вып. 4 2020
КАТАЛИТИЧЕСКАЯ СУБЪЕДИНИЦА PKA
481
тирующий Mg 1. За каталитической петлей сле
кинг сайт для Trp222 αF спирали, следующей за
дует сегмент активации (рис. 3), с одной сторо
VIII субдоменом (194-213 а.о.).
ны, опирающийся на β7/β8 структуры, а с дру
Субдомен IX представлен большой неполяр
гой - на APE мотив αF спирали глобулярного
ной αF спиралью (218-233 а.о.), выполняющей
ядра. Сегмент активации включает Mg связы
опорные функции при сборке гидрофобных
вающую петлю, β9, активирующую петлю, и
спинов, составляющих внутреннюю архитекту
P+1 петлю.
ру PKAc [47, 49, 59]. Субдомен X содержит ко
Короткая Mg связывающая петля/Mg пози
роткую αG спираль, а субдомен XI образует
ционирующая петля (Asp184 Phe Gly Phe187)
подвижный C хвост большой доли. Некоторые
располагается между 8 й и 9 й β структурами и
фрагменты C хвоста, расположенные в непосре
относится к субдомену VII (176-193 а.о.). Эта
дственной близости к каталитической щели,
петля играет ключевую роль в позиционирова
участвуют в механизмах связывания косубстра
нии ионов металлов, ассоциированных с ATP.
тов. Так, остатки 315-327 C хвоста (рис. 2, б) ре
Окружение ATP составляют два иона магния
гулируют доступ к аденин связывающему кар
(Mg 1 и Mg 2), необходимые для нейтрализа
ману; а кислый кластер (328-334 а.о.) помогает
ции высокого отрицательного заряда фосфатов
притягивать положительно заряженные пепти
и координации трифосфатной группы внутри
ды к активному центру [33, 37, 58].
активного центра. В активной конформации
PKAc Asp184 консервативного DFG мотива
(Asp Phe Gly) Mg связывающей петли контро
ATP4СВЯЗЫВАЮЩИЙ УЧАСТОК
лирует положение Mg 1 и Mg 2. Положение
Mg 1 дополнительно стабилизирует Asn171 ка
Поскольку большинство PK используют мо
талитической петли.
лекулу ATP в качестве донора фосфата, ATP
Между VII и VIII субдоменами Хэнкса рас
связывающий участок (рис. 4) отличается наи
полагается вариабельная активирующая петля
большей консервативностью среди ePK. Моле
(188-197 а.о.), так же известная как T петля,
кула ATP, глубоко проникая в каталитическую
поскольку содержит консервативные остатки
щель, образует множественные контакты с обе
Ser/Thr или Tyr, которые могут быть модифици
ими долями. В составе ATP связывающего
рованы путем фосфорилирования. Иногда в ли
участка выделяют несколько фармакофорных
тературе встречается название А петля (аctiva
площадок для связывания различных частей мо
tion loop). У PKAc сайтом фосфорилирования
лекулы ATP [33, 37].
является Thr197. Фосфорилирование T петли
Фосфатный якорь. Основной функцией это
представляет собой широко распространенный
го участка является правильная ориентация γ
механизм активации ePK [35, 36, 55]. У некото
фосфата относительно каталитического сайта. В
рых ePK (CDK2, InRK) в нефосфорилирован
тройном комплексе отрицательно заряженные
ной форме T петля препятствует связыванию
фосфаты ATP образуют связи с амидами пеп
ATP и пептидного субстрата, и наоборот, фос
тидного скелета G петли и аминогруппами бо
форилирование T петли стабилизирует PK в ак
ковых цепей Lys72 и Lys168. Как видно из рис. 4,
тивной конформации [56-58].
положение γ и β фосфатов стабилизирует пеп
Последней в сегменте активации располага
тидная цепь Ser53 Phe54 Gly55, α и β фосфаты
ется P+1 петля (198-208 а.о.). В случае PKAc эта
связывает Lys72 β3 структуры, а Lys168 катали
петля образует гидрофобное ложе для неполяр
тической петли образует связь с γ фосфатом. В
ного Р+1 остатка, характерного для субстратов
свою очередь, позицию Lys72 поддерживает
PK семейства AGC, и ориентирует фосфоакцеп
Glu91 αC спирали, конформация которой зави
торный P сайт относительно активного центра.
сит от взаимодействия pThr197-His87; а коор
Р+1 петля и ее окружение формируют пептид
динаты Lys168 определяет цепочка связей
связывающий участок на поверхности C доли,
pThr197-Arg165-Asp166-Thr201-Lys168. Таким
поэтому в литературе иногда встречается назва
образом, ключевой γ фосфат ATP занимает оп
ние пептид позиционирующая петля [37].
тимальное для катализа положение благодаря
Консервативный мотив APE (Ala206 Pro
взаимодействиям с Ser53 и Lys168 и координа
Glu208), расположенный в конце Р+1 петли,
ционным связям с двумя ионами Mg.
обеспечивает интеграцию между структурами C
Ионы металлов. В состав комплекса с ATP
доли [46]. Glu208 формирует солевой мост с
входят два Mg2+, определяющие конформацию
Arg280 αH-αI петли, стабилизирующий поло
трифосфатной группы. Один из ионов Mg (Mg
жение сегмента активации относительно C кон
1) координирует положение α и γ фосфатов
цевых αG , αH и αI спиралей; а Ala206 и
ATP, а второй (Mg 2) - β и γ фосфатов. Поло
Pro207 APE мотива образуют гидрофобный до
жение ионов Mg контролирует аминокислотное
БИОХИМИЯ том 85 вып. 4 2020
482
РЕЙХАРДТ, ШАБАНОВ
а
б
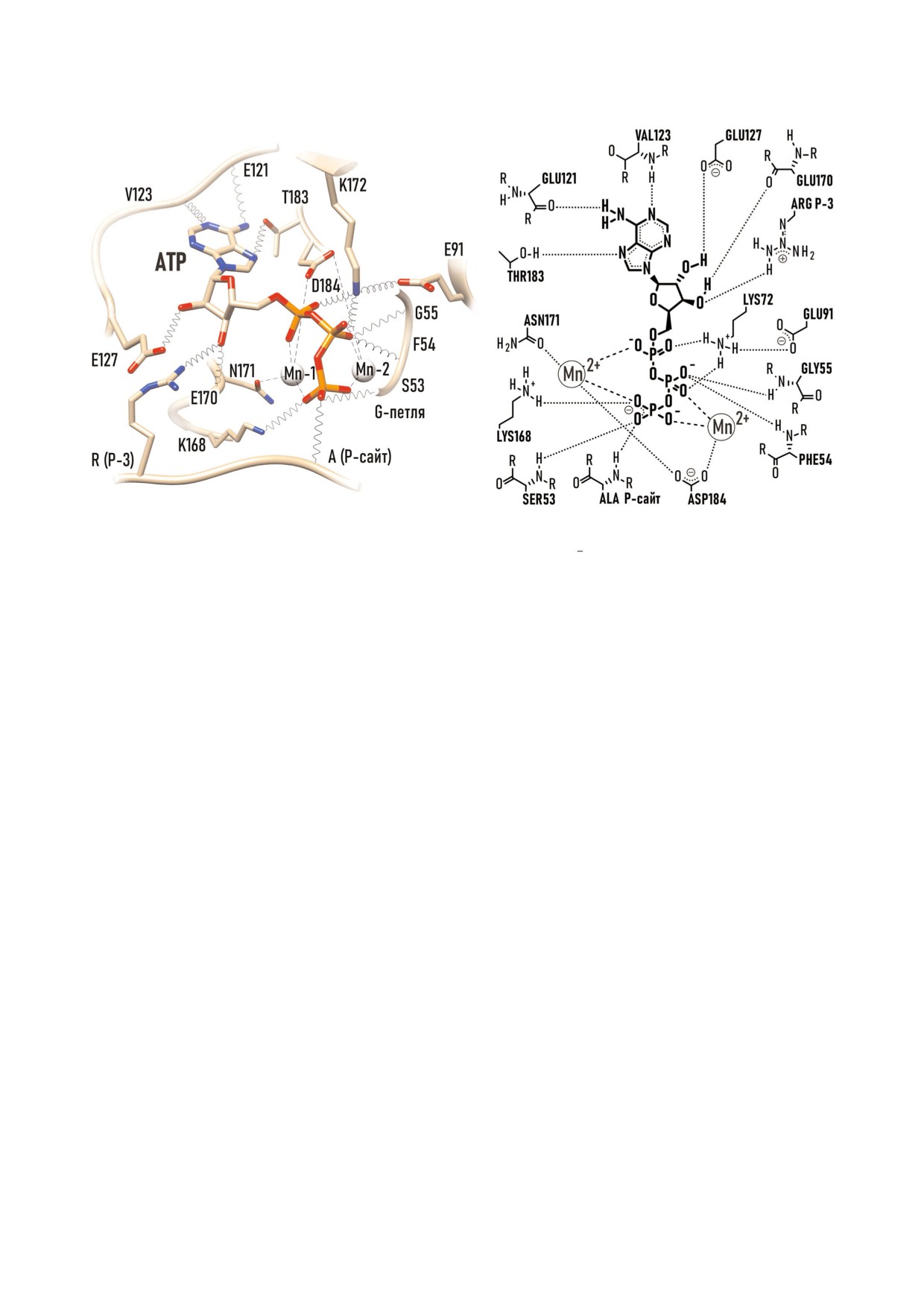
Рис. 4. а - ATP связывающий участок в тройном комплексе PKAc/Mn ATP/PKI524; б - схема. PKI524 (protein kinase
inhibitor) пептид, содержащий субстратоподобную последовательность (RRNAI), где фосфоакцепторный Ser замещен на
Ala. PDB:1ATP.
journal/biokhsm/
окружение каталитического сайта. Asn171 ката
спирали, располагается в глубине каталитичес
литической петли образует связь с Mg 1, а
кой щели. Его основной функцией является
Asp184 Mg связывающей петли образует связи с
распознавание фармакофорных атомов азота
обоими Mg2+ (Mg 1 и Mg 2).
пуринового гетероцикла. Взаимодействуя с
Рибозный якорь образуют два Glu (Glu127
PKAc, азотистое основание ATP образует две
линкерного региона и Glu170 каталитической
донорно акцепторные пары с пептидной цепью
петли), связывающие 1'OH и 2'OH группы ри
линкерного региона. Водородная связь между
бозы. При присоединении белка субстрата фор
NH2 группой аденина и карбонилом пептидно
мируется третья водородная связь между Arg в
го скелета Glu121, вместе с водородной связью
положении Р 3 и 2'OH группой рибозы.
между N1 аденина и амидом пептидного скелета
Гидрофобную щель, в которой размещается
Val123, связывают пурин с линкерным регио
плоский скелет аденинового основания ATP об
ном. Еще одна водородная связь возникает меж
разуют неполярные а.о. обеих долей (Val57 и
ду N7 аденина и ОH группой Thr183 Mg связы
Ala70 N доли, и Leu173 C доли). Плоская струк
вающей петли [33]. Связывание ATP критичес
тура пуринового гетероцикла предполагает два
ки зависит от взаимодействия с этим участком.
типа взаимодействий с аминокислотным окру
PKAc не может использовать в качестве донора
жением: 1) гидрофобные силы притяжения
фосфата молекулу GTP, несмотря на сходство
между неполярным поверхностями, и 2) водо
трифосфатных групп, рибозы и пуринового ге
родные связи с полярными фрагментами пеп
тероцикла.
тидной цепи, лежащими в плоскости колец. Ес
В то же время конформационная пластич
ли гидрофобные взаимодействия с поверх
ность нуклеотид связывающего участка обеспе
ностью гидрофобной щели регулируют простран
чивает двойную специфичность каталитической
ственное положение и подвижность адениново
субъединицы CK2 в отношении ATP/GTP [60].
го гетероцикла, то водородные связи играют
У PKA отрицательно заряженный Glu127 лин
ключевую роль в процессе распознавания азо
керного региона находится на расстоянии
тистого основания и определяют специфич
действия водородных связей с гидроксилами
ность ePK в отношении ATP/GTP.
рибозы, тогда как эквивалентный ему Asp120
Аденин4связывающий участок, включающий
CK2α располагается на значительном удалении
фрагмент линкерного региона и начало αD и не образует рибозного якоря. В результате ри
БИОХИМИЯ том 85 вып. 4 2020
КАТАЛИТИЧЕСКАЯ СУБЪЕДИНИЦА PKA
483
боза приобретает способность перемещаться в
деленные белки. Селективность в отношении
пределах свободного пространства у входа в
белков субстратов обеспечивают вариабельные
нуклеотид связывающий карман [61]. Вместе с
а.о. большой доли, вместе с консервативной
иной (чем у PKA) ориентацией гидрофобной
Р+1 петлей, образующие участок связывания
щели это повышает подвижность ароматическо
пептида.
го гетероцикла относительно просторного лин
Минимальный консенсусный мотив, характер
керного региона, и при замене ATP на GTP поз
ный для субстратов PKA (RR x S/T), включает
воляет фармакофорным группам аденина/гуа
два положительно заряженных остатка (обычно
нина находить на этом участке индивидуальный
Arg) в положениях Р 2 и Р 3 относительно сайта
набор партнеров по водородным связям. Такая
фосфорилирования [64] (рис. 5, а). В протони
возможность исключена для PKA, поскольку
рованной форме боковая цепь аргинина несет
Glu127 жестко фиксирует положение рибозы и
сильный положительный заряд. В распознава
ограничивает подвижность гетероцикла, а
нии положительно заряженных детерминант
Phe327 C хвоста PKA ограничивает простран
субстратов PKA ключевую роль играют кислые
ство внутри нуклеотид связывающего кармана
аминокислоты (преимущественно Glu), образу
[62, 63].
ющие катион связывающие сайты на поверх
ности N доли.
Одним из таких участков является кислый
ПЕПТИД4СВЯЗЫВАЮЩИЙ УЧАСТОК
кластер (Asp328, Asp329, Glu331, Glu332,
Glu333, Glu334), входящий в состав C хвоста
В отличие от универсального для всех проте
большой доли. Предполагается, что остатки Asp
инкиназ ATP связывающего участка, пептид
и Glu образуют ловушку, притягивающую ще
связывающий участок должен обладать высокой
лочные субстанции [37]. Если пептид обладает
специфичностью, поскольку каждая PK должна
свойствами субстрата PKA, его ключевые а.о.
распознавать и фосфорилировать строго опре
вступают во взаимодействие с анионными сай
а
в
б
г
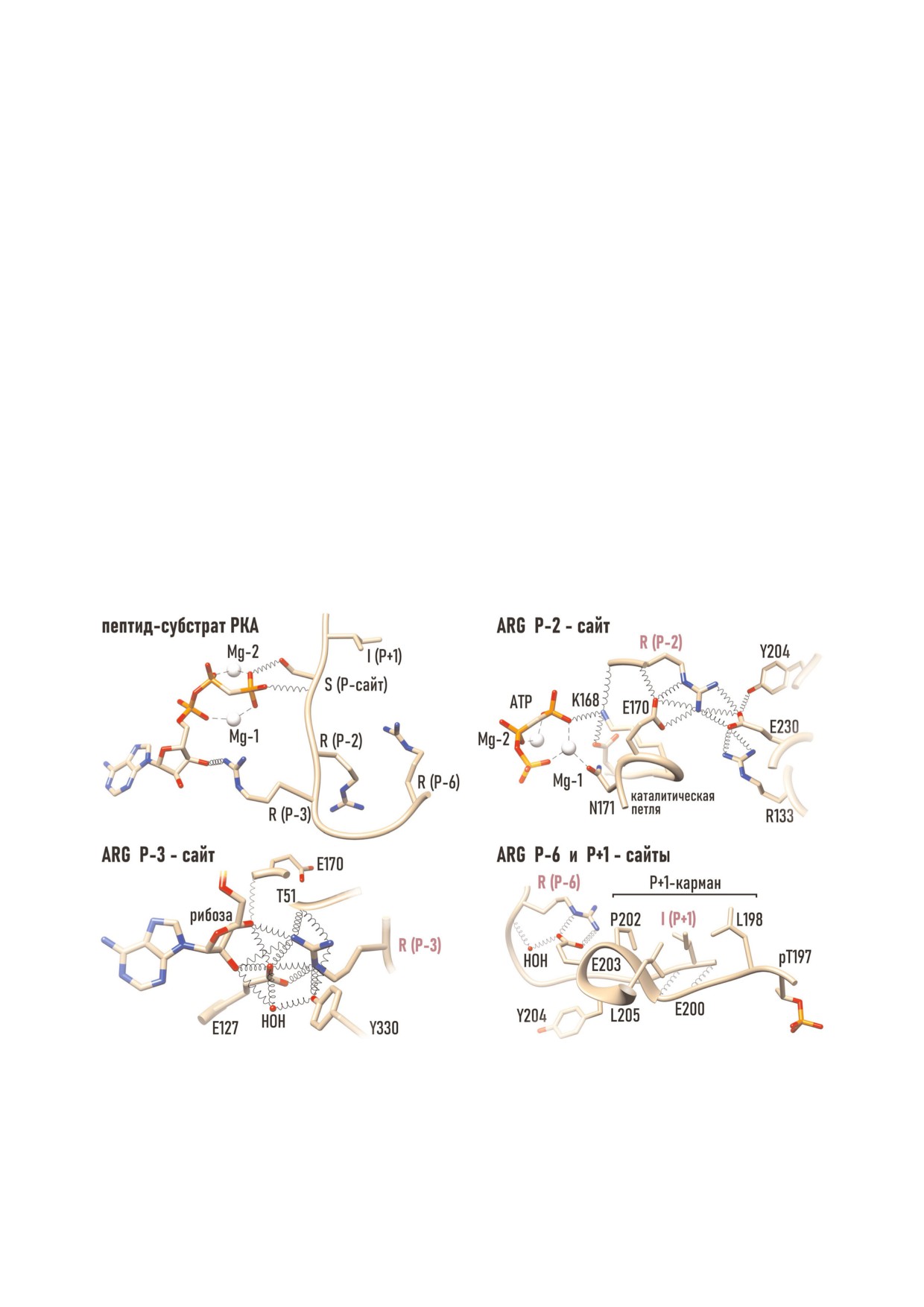
Рис. 5. Взаимодействие пептида с PKAc. а - Специфическими детерминантами субстратов PKА служат положительно за
ряженные боковые цепи аргинина в положениях Р 2, Р 3, и Р 6. В их распознавании ключевую роль играют кислые ами
нокислоты (Glu127, Glu170, Glu203, Glu230), образующие катион связывающие сайты для (б) Arg P 2, (в) Arg P 3 и
(г) Arg P 6, которые вместе с Р+1 петлей образуют пептид связывающий участок PKАс. PDB:4IAC.
journal/biokhsm/
БИОХИМИЯ том 85 вып. 4 2020
484
РЕЙХАРДТ, ШАБАНОВ
тами и Р+1 петлей и ориентируются в строго
Ser/Thr пептидного субстрата с γ фосфатом ATP.
определенном порядке относительно активного
В конечном итоге, Р сайт ориентируется внутри
центра. Локализованный посредине кислого
активного центра так, что ОH группа Ser/Thr
кластера, Tyr330 вместе с консервативной моле
оказывается в радиусе действия водородных свя
кулой воды образует сеть связей, соединяющих
зей с γР ATP и карбоксилом Asp166.
вместе: Arg Р 3 пептидного субстрата, 2′OH
группу рибозы ATP и Glu127 линкерного регио
на [37, 65, 66]. В результате этих взаимодействий
РОЛЬ ФОСФОРИЛИРОВАНИЯ
Glu127 формирует ионную пару с Arg Р 3, а Arg
В РЕГУЛЯЦИИ ePK
Р 3 образует связь с 2′OH группой рибозы. Еще
две связи Arg Р 3 образует с карбонилом пептид
Как ключевые компоненты внутриклеточ
ного скелета Thr51 G петли [43], координирую
ной сигнализации, PK находятся под строгим
щей положение β и γ фосфатов. Таким обра
контролем со стороны клеточного окружения,
зом, молекула ATP и пептидный субстрат ока
наиболее изученным механизмом которого яв
зываются прочно привязанными друг к другу
ляется фосфорилирование [14, 16]. Из 112 PK,
внутри активного центра (рис. 5, б).
экспрессируемых S. сerevisiae, фосфорилирова
Интеграцию между отдельными участками
нию подвержено 56, из которых 27 активируют
молекулы PKAc и косубстратами можно рас
ся посредством фосфорилирования Т петли вы
смотреть на примере P 2 связывающего сайта
шестоящей PK. Альтернативным механизмом
(рис. 5, в). С Arg P 2 пептидного субстрата не
является цис/транс автофосфорилирование Т
посредственно взаимодействует Glu230 αF спи
петли (внутримолекулярное фосфорилирование
рали; в свою очередь, положение Glu230 стаби
или фосфорилирование соседней аналогичной
лизируют Tyr204 Р+1 петли и Arg133 αD спира
PK). Так, активируются 10 PK, тогда как 19 PK
ли, в начале которой располагается Р 3 связы
имеют регуляторные P сайты за пределами Т
вающий Glu127. Вторую связь с Arg P 2 образу
петли. И, наконец, дефосфорилирование слу
ет Glu170 каталитической петли. Одновременно
жит механизмом активации/инактивации для 11
Glu170 взаимодействует с 2′OH группой рибо
PK [67].
зы, а следующий за ним консервативный Asn171
Иерархически организованные PK образуют
подтягивает к активному центру ATP связан
сигнальные каскады, в которых одна PK фосфо
ный ион Mg 1 и Asp166 каталитической петли.
рилирует и активирует другую, как в каскаде
Еще одну связь с амидом пептидного скелета
МАРK/Erk [68]. На роль киназы PKA у млеко
Arg Р 2 образует Lys168 каталитической петли,
питающих претендует PDK1 (3 phosphoinosi
который вместе с Asn171 обеспечивает сопряже
tide dependent protein kinase) [69, 70]. Связыва
ние пептида с γ P и Mg 1 [33, 37, 64, 66].
ние PDK1 с определенными фракциями фосфо
Наряду с минимальным консенсусным мо
липидов (плазматической, ядерной мембран)
тивом, некоторые субстраты PKA содержат Arg в
стимулирует кластеризацию и транс автофос
позиции Р 6 (рис. 5, г). Распознавание Arg Р 6
форилирование PDK1 [71]. Благодаря этому
осуществляет Glu203 (вместе с консервативной
свойству, PDK1 часто занимает место в верхних
молекулой воды), входящий в состав Р+1 петли
эшелонах AGC киназ (PKA, PKB/Akt, PKC,
[37, 65].
SGK, и p70 S6R) и может быть upstream киназой
К консервативным элементам пептид связы
PKA. Не исключено также существование аль
вающего участка ePK относится P+1 петля
тернативных механизмов активации PKA. Так, в
(198-208 а.о.), кэпирующая а.о. субстратного
бактериальных клетках, дефицитных по PDK,
белка в положении Р+1 относительно сайта фос
процессинг PKA осуществляется путем авто
форилирования (рис. 5, г). У пептидных субстра
фосфорилирования [72].
тов PKA, таких как кемптид (LRRASLG) или
Клеточными антагонистами PK являются
PKI524 (TTYADFIASGRTGRRNAIHN), непос
протеинфосфатазы (PP), осуществляющие де
редственно после сайта фосфорилирования
фосфорилирование белков. Этот антагонизм
обычно размещается неполярный лейцин/изо
проявляется не только в отношении нижестоя
лейцин. Этот остаток укладывается в гидрофоб
щих белков мишеней, но и в отношении самих
ный карман, который образуют боковые цепи
PK. В отличие от PKAc, у которой Thr197 не
неполярных аминокислот Leu198, Pro202 и
чувствителен к действию PP, многие ePK
Leu205 [37, 65]. Одновременно с этим основную
(PKB/Akt, IκB kinase, PKC, CaMK, Erk, CDK)
цепь Ile P+1 фиксирует Gly200, а следующий за
могут быть инактивированы путем дефосфори
ним Thr201 (рис. 5, г) привязывает к Р+1 петле
лирования Ser/Thr фосфатазой РР2А (во вся
Asp166 и Lys168 каталитической петли, обеспе
ком случае in vitro) или образуют комплекс с
чивая тесный контакт фосфоакцепторных
РР2А [73].
БИОХИМИЯ том 85 вып. 4 2020
КАТАЛИТИЧЕСКАЯ СУБЪЕДИНИЦА PKA
485
Обратимое фосфорилирование представляет
му времени структуры тройного комплекса, где
собой мощный механизм регуляции киназной
молекулы ATP и пептида уже занимают свои
активности, поэтому многие ePK имеют один
места [3, 66] позволяют предложить сценарий
или несколько P сайтов, расположенных в сег
сборки активного центра PKAc, в котором клю
менте активации и подвижных N и C хвостах
чевые роли последовательно исполняют
(рис. 1). У PKAc млекопитающих известно три
pThr197, Arg165, и Asp166 HRD мотива.
таких сайта (Ser10, Thr197, Ser338). Ser10 входит
В фосфорилированной форме Thr197 обра
в состав сегмента (Ser10 Glu Gln Glu13), кэпи
зует четыре полярных контакта, с Arg165 HRD
рующего αA спираль, которая препятствует
мотива, Lys189 β9 структуры, Thr195 Т петли, и
расхождению N и C долей. Автофосфорилиро
His87 αC спирали, отчетливо прослеживаю
вание Ser10 наблюдается только у E. сoli; оно
щихся в структурах всех активных PKAc
дестабилизирует N хвост и приводит к инакти
(рис. 6, а). Роль «эффектора» в сборке активно
вации PKA [72]. Ser338 PKA образует вершину
го центра выполняет HRD мотив. HRD мотив
(turn motif) петли между двумя консервативны
ePK содержит уникальную последовательность,
ми участками (FDDY и FxxF) подвижного С
обладающую крайне высоким потенциалом для
хвоста и в фосфорилированной форме стабили
полярных взаимодействий - два положительно
зирует C хвост, регулирующий доступ ATP к ка
заряженных остатка (His164 и Arg165), и отри
талитическому центру и положение N конца
цательно заряженный Asp166. У PKAc положе
αC спирали
[31]. Автофосфорилирование
ние гистидина занимает неполярный Tyr164, ко
Ser338 PKA происходит в ходе трансляции. За
торый опосредует гидрофобный механизм сбор
исключением PKA и PKG все AGC киназы име
ки активного центра [49].
ют еще один сайт автофосфорилирования, сле
Формирование ионной пары pThr197-
дующий за FDDY. В фосфорилированной фор
Arg165 имеет два важных последствия: наруша
ме С хвосты AGC киназ приобретают способ
ется распределение зарядов вокруг HRD моти
ность к взаимодействию с PIF pocket (PDK1
ва, и изменяются координаты Tyr164, Arg165, и
interacting fragment) PDK1 [58, 74]. В результате
Asp166. Это стимулирует дальнейшую реоргани
происходит аллостерическая активация PDK1 и
зацию сегмента активации, в которой «ключе
PDK1 зависимое фосфорилирование Т петли
вым игроком» становится Asp166. Иными сло
AGC киназ (Thr197 PKA).
вами, мобилизация HRD мотива создает усло
вия для новых полярных взаимодействий с учас
тием Asp166, в результате которых к активному
СБОРКА АКТИВНОГО ЦЕНТРА PKAc
центру подтягиваются Р+1 петля и каталити
ческая петля.
Само название сегмент активации указывает
Гидрофобный карман Р+14петли, в котором
на важную роль этого фрагмента в регуляции
размещается боковая цепь Ile пептидного
ePK. Центральное место в сегменте активации
субстрата, образуют три неполярные аминокис
занимает T петля, содержащая фосфоакцептор
лоты (Leu198, Pro202, и Leu205). Как видно из
ный сайт (рис. 3). Фосфорилирование консерва
рис. 6, б, в тройном комплексе координаты Р+1
тивных Ser/Thr или Tyr является ключевым со
петли, с одной стороны, контролирует поляр
бытием в процессе активации многих ePK
ный pThr197, непосредственно контактирую
(CDK2/4, Raf1, Mek1, Erk2, PKC, CaMKI/IV,
щий с Leu198; а с другой - Asp166, образующий
ISPK1, GSK3, InRK, PDGF, TK семейства Src)
связь с гидроксилом Thr201. Конформация
[35, 75]. У конституционно активной PKСδ сайт
Р+1 петли во многом зависит и от гидрофобных
фосфорилирования (Thr505) соседствует с «фос
взаимодействий. Неполярные контакты Tyr204
фомиметиком» Glu500, поэтому PKСδ не требу
(с Pro169 каталитической петли, Val226 и Leu227
ет фосфорилирования для активации [76].
αF спирали и αE спиралью) прочно привязы
У PKAc сайт фосфорилирования T петли
вают Р+1 петлю к гидрофобному ядру большой
представлен консервативным Thr197. Присое
доли, создавая платформу для пептид связыва
динение отрицательно заряженного фосфата к
ющего участка [37, 64, 77].
Thr197 запускает цепь ионных, водородных и
Растущая интеграция между различными
неполярных взаимодействий, которые ориенти
частями молекулы приводит к формированию
руют каталитическую петлю, Mg связывающую
еще одной связи, которую образует Thr201 с
петлю и Р+1 петлю в положениях, оптимальных
Lys168. Наряду с цепочкой Asp166-Thr201-
для эффективного связывания косубстратов и
Lys168, положение каталитической петли стаби
катализа [62, 66]. В результате PK переходит в
лизируют еще две связи: связь pThr197 с Asp166,
активную (каталитически компетентную) кон
лежащим в основании каталитической петли; и
формацию (рис. 6). Существующие к настояще
связь Asp166 с Asn171, хелатирующим Mg 1.
БИОХИМИЯ том 85 вып. 4 2020
486
РЕЙХАРДТ, ШАБАНОВ
а
в
б
г
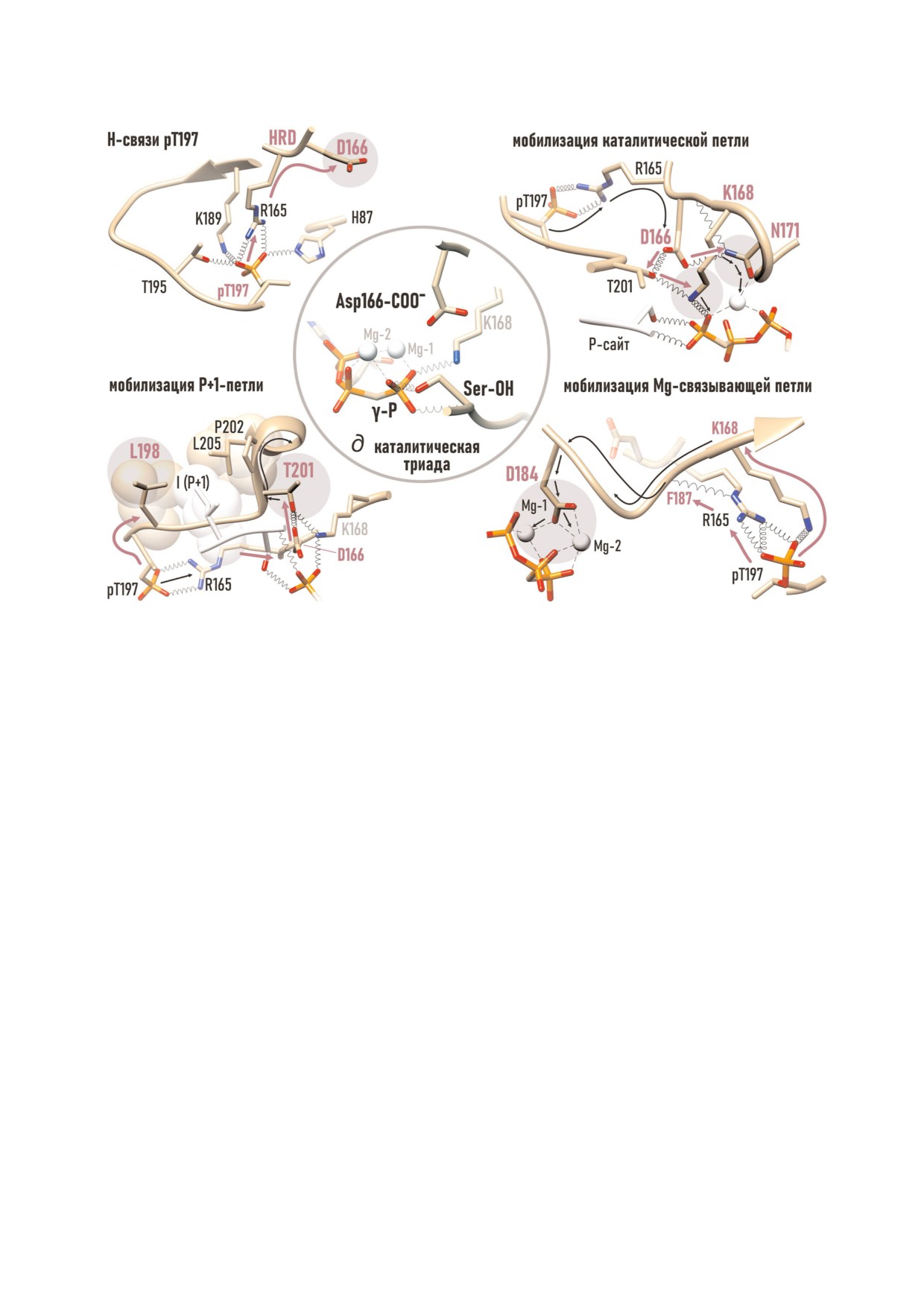
Рис. 6. Сборка активного центра PKАс. а - В фосфорилированной форме Thr197 образует четыре связи, стимулирующие
мобилизацию; б) Р+1 петли; в) каталитической петли; г) Mg связывающей петли. В результате формируется (д) катали
тическая триада: γ фосфат ATP, гидроксил Ser/Thr белка субстрата и карбоксил Asp166. Стрелочками (один цвет) обозна
чены цепочки связей, ведущие от pThr197 к ключевым а.о. активного центра и далее.
journal/biokhsm/
В результате этих взаимодействий Asp166 и
схождение. При этом пептид связывающий
Lys168 каталитической петли занимают положе
участок, расположенный у основания каталити
ния в непосредственной близости к будущему
ческой щели на поверхности большой доли, ос
каталитическому сайту (рис. 6, в).
тается доступным; а ATP связанная закрытая
Мобилизацию Mg4связывающей петли осу
конформация PKA стабилизируется солевым
ществляет pThr197 совместными усилиями с
мостом pThr197-His87.
Arg165 HRD мотива. pThr197 формирует ион
Дополнительные механизмы стабилизации
ную пару с аминогруппой Lys189 β9 структуры,
активного центра включают правильную ориен
на которую опирается Mg связывающая петля,
тацию подвижных элементов, таких как β9
а боковая цепь Arg165 образует связь с карбони
структура, αC спираль и αA спираль. Так, две
лом скелета Phe187 (рис. 6, г). В результате к ак
связи: pThr197-Thr195 и pThr197-Lys189 при
тивному центру подтягивается Asp184, хелати
вязывают к активному центру T петлю и β9
рующий два иона Mg (Mg 1 и Mg 2) в составе
структуру. В свою очередь, мобилизация β9
комплекса с ATP.
структуры и реорганизация αC спирали (Arg93,
И, наконец, сборка активного центра закан
Gln96 и Arg190 которых образуют полярные гра
чивается, и активированная PKAc приобретает
ницы «гидрофобного сустава») - упорядочива
способность к высокоаффинному связыванию
ют положение αA спирали, соединяющей две
ATP и пептидного субстрата. Учитывая высокую
доли наподобие пружины [42, 50].
концентрацию ATP в клетке (5 мМ), предпола
Таким образом, фосфорилирование T петли
гается, что первой с PKAc связывается молекула
PKAc приводит в конечном итоге к формирова
ATP [62]. Образуя множественные контакты с
нию активного центра. Активный центр PKAc
двумя долями, молекула ATP стимулирует их
включает: ATP связывающий участок, пептид
БИОХИМИЯ том 85 вып. 4 2020
КАТАЛИТИЧЕСКАЯ СУБЪЕДИНИЦА PKA
487
связывающий участок, и собственно, каталити
три компонента: богатый электронами нуклео
ческий сайт, содержащий химические группы,
фил, электронодефицитный электрофил и «ухо
непосредственно участвующие в процессе ката
дящая» (отщепляемая) группа, в данном случае
лиза. В тройном комплексе основу каталитичес
ADP.
кого сайта составляет каталитическая триада:
Кислород гидроксила является сильным
γ фосфат ATP, гидроксил Ser/Thr белка субстра
нуклеофилом, он «атакует», т.е. притягивается к
та, и карбоксил Asp166, (рис. 6, д). Непосред
положительно заряженному центру γ Р, и стре
ственное окружение каталитического сайта об
мится образовать новую ковалентную связь,
разуют два иона Mg, Lys168, Lys72 и амиды G
предоставляя в общее пользование свободную
петли, которые компенсирует локальный отри
пару электронов. В результате нуклеофильной
цательный заряд, возникающий в ходе реакции.
атаки кислородный мостик между β и γ фосфа
тами разрывается, O принимает два электрона
этой связи и «уходит» в депротонизированной
КАТАЛИТИЧЕСКИЙ МЕХАНИЗМ
форме в составе молекулы ADP. Его место зани
ФОСФОРИЛТРАНСФЕРАЗНОЙ РЕАКЦИИ.
мает кислород ОH группы Ser белка субстрата,
РОЛЬ Asp166
замещая молекулу ADP, и инверсируя стереохи
мическую конфигурацию фосфатной группы
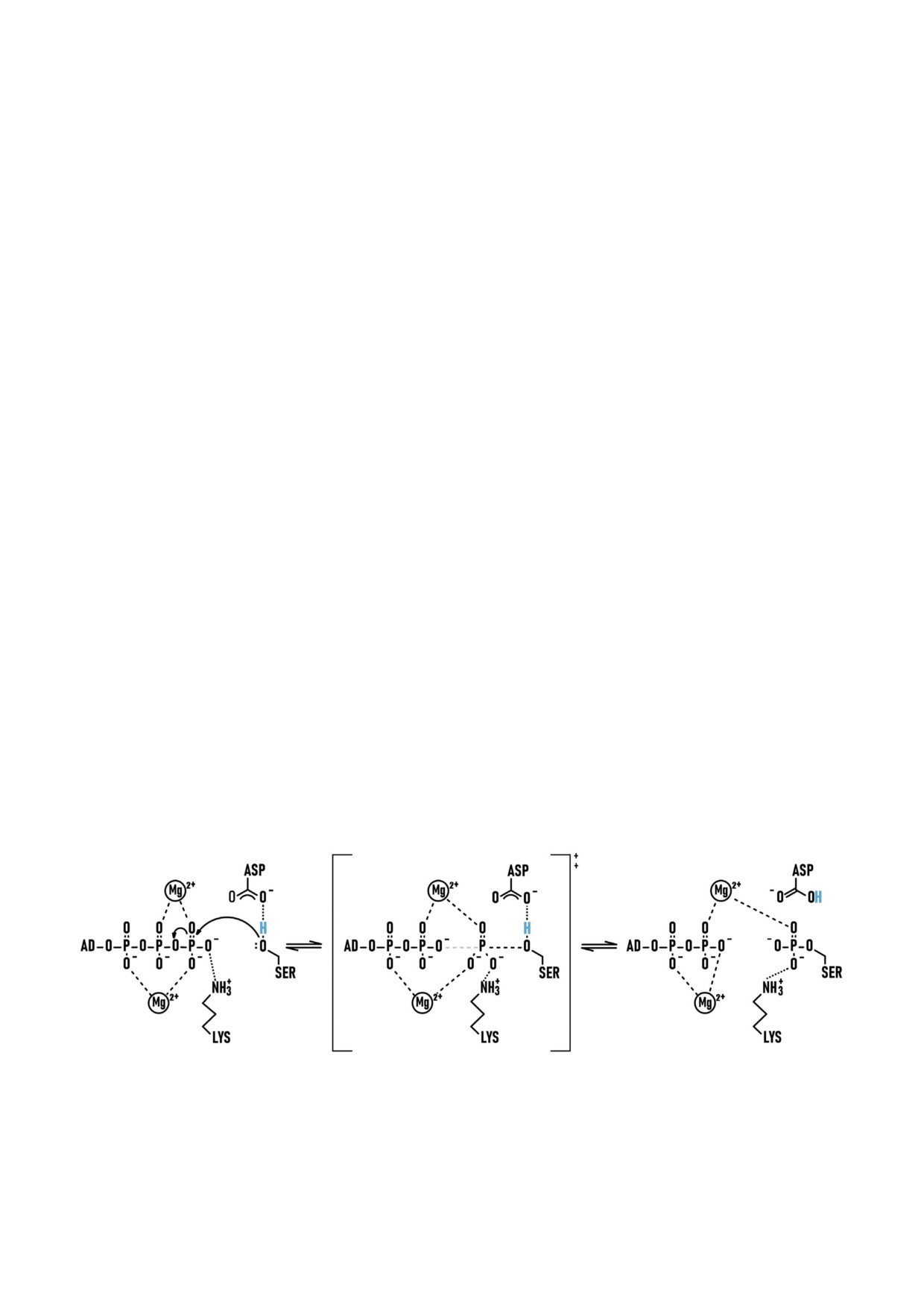
Реакция переноса фосфата (перенос фосфо
[83, 54];
рильной группы) происходит через образование
3) кислотно щелочной катализ с участием
промежуточного интермедиата (рис. 7), преиму
Asp166. Ферменты являются уникальными био
щественно по диссоциативному механизму [54,
логическими катализаторами благодаря тому,
78-82], и включает три этапа:
что а.о. в окружении активного центра могут
1) ориентация терминальных фосфатов и
проявлять как кислотные, так и щелочные свой
ОH группы Ser. В этом процессе участвуют
ства. У PKA таким а.о. является Asp166, несу
Asp166, два иона магния и Lys168 каталитиче
щий карбоксильную группу. Для карбоксила ха
ской петли. Важным аспектом каталитической
рактерно смещение электронной плотности в
реакции переноса фосфата является то, что
сторону карбонильного кислорода и поляриза
электрофильность γ Р усиливается в результате
ция связи О-Н. Благодаря этому, атом водорода
взаимодействия с двумя ионами Mg. Положи
легко диссоциирует в виде H+. В результате об
тельно заряженные ионы металлов стабилизи
разуется высокореактивный карбоксилат ион
руют отрицательный заряд атомов кислорода,
(R COO-), в котором отрицательный заряд рав
что приводит к увеличению дипольного момен
номерно распределяется между двумя атомами
та фосфорно кислородной связи. Поэтому P
кислорода.
получает больший положительный заряд и ста
С самого начала Asp166 рассматривали в ка
новится лучшим электрофилом;
честве кандидата на роль акцептора протона,
2) нуклеофильная атака атома фосфора гид
повышающего нуклеофильные свойства ОH
роксилом Ser очень похожа на реакцию нуклео
группы Ser [3, 51, 52]. Однако последующие ис
фильного замещения. В этой реакции участвуют
следования показали, что Asp166 не обладает
Рис. 7. Предполагаемый «in line» механизм фосфорилтрансферазной реакции с образованием пентакоординированного
промежуточного комплекса. Переходное состояние (в центре) имеет преимущественно диссоциативный характер; связь
между β и γ Р слабеет, а новая связь между γ Р и О Ser начинает формироваться. AD - аденозин.
journal/biokhsm/
БИОХИМИЯ том 85 вып. 4 2020
488
РЕЙХАРДТ, ШАБАНОВ
достаточной щелочностью, чтобы катализиро
тельный заряд, возникающий в ходе реакции
вать отрыв протона, и его вклад на начальных
[54, 84]. Описанный механизм во многом явля
стадиях реакции сводится к образованию водо
ется дискуссионным и может включать множе
родной связи с гидроксилом Ser. Ограничивая
ственные формы переходных состояний [79].
вращения гидроксильной группы, она стабили
зирует положение нуклеофила в непосредствен
ной близости к электрофильному γ фосфату,
СПИНОВАЯ КОНЦЕПЦИЯ ePK
повышая продуктивность нуклеофильной атаки
[53, 54, 78, 81].
В последние годы получила распростране
Иная картина наблюдается в переходном
ние «спиновая концепция» строения ePK. Сог
состоянии (рис. 7), когда начинает формиро
ласно этой модели, для полной активации ePK
ваться нуклеофильная связь между γ фосфатом
необходима сборка двух гидрофобных осей, наз
и гидроксильным кислородом. В процессе фор
ванных регуляторным (R) и каталитическим (С)
мирования этой связи гидроксил теряет прото
«спинами». Каждый спин состоит из несколь
ны, которые накапливаются в окружении Ser.
ких неполярных остатков, расположенных в
Эти протоны захватывают Asp166, смещая хи
различных регионах, которые на уровне прост
мическую реакцию в сторону образования pSer.
ранственной структуры формируют единый
В дальнейшем, по всей вероятности, этот про
гидрофобный хребет [11, 49, 59]. Оба спина про
тон переходит к ADP, а Asp166 снова превраща
ходят через каталитическое ядро и соединяются
ется в карбоксилат анион [54, 84, 85]. Таким об
между собой посредством αF спирали, состав
разом, «каталитический» Asp166 удерживает
ляя внутренний гидрофобный скелет киназного
гидроксил Ser на ранних стадиях реакции, вы
домена (рис. 8).
полняет функции «протонной ловушки» на
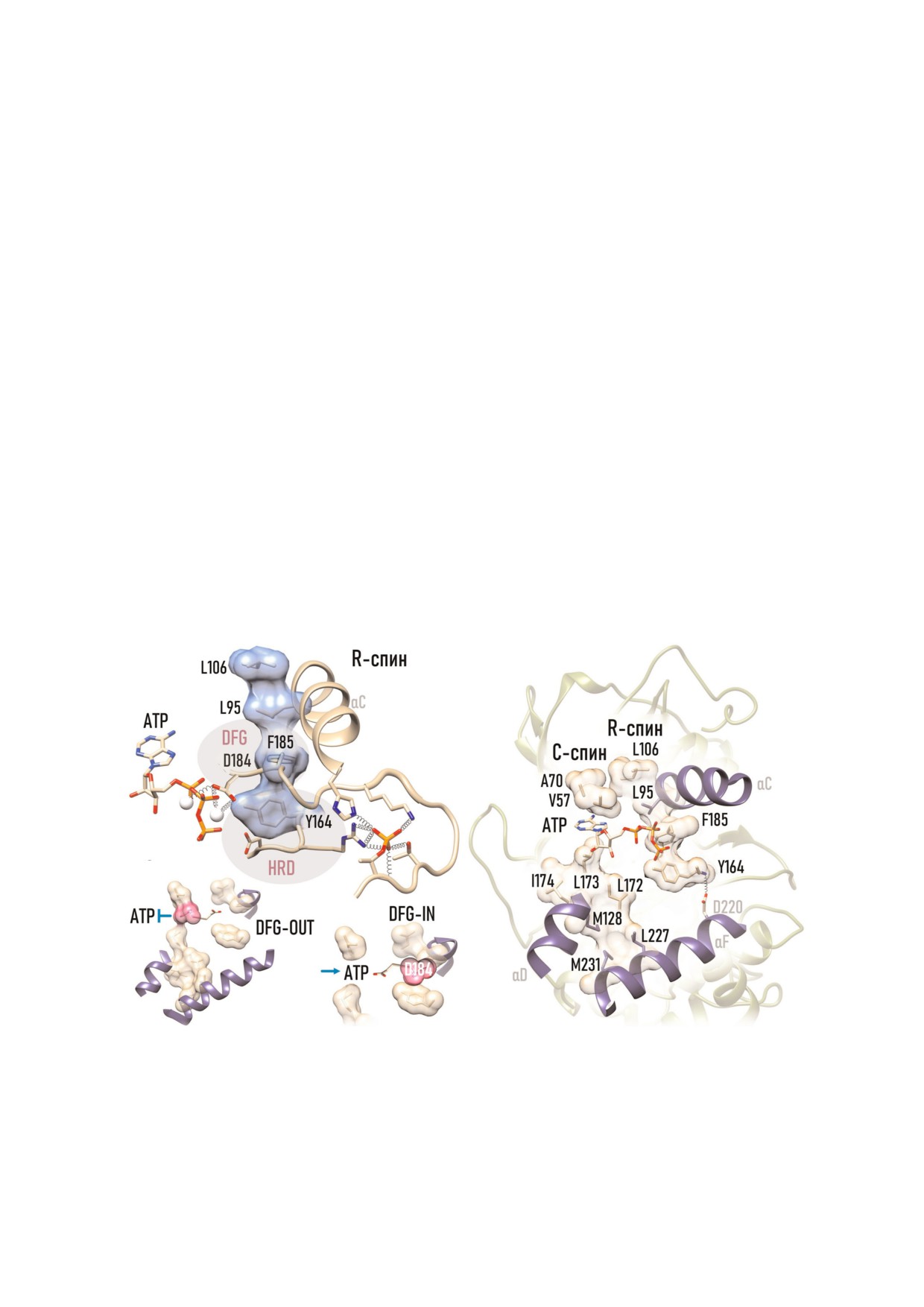
R4спин PKAc (рис. 8, а) включает два гидро
поздних стадиях и служит донором протона по
фобных остатка малой доли (Leu106 β4 структу
ее завершении. Важную роль в стабилизации пе
ры и Leu95 αC спирали) и два гидрофобных ос
реходного состояния играют два иона Mg и
татка большой доли (Phe185 DFG мотива Mg
Lys168, компенсирующие локальный отрица
связывающей петли, и Tyr164 HRD мотива ка
а
в
б
Рис. 8. Внутренний скелет PKAc образуют два гидрофобных спина. а - R спин объединяет и координирует αC спираль,
DFG мотив и HRD мотив. В собранном R спине Asp184 образует связи с двумя Mg2+, а Phe185 находится в конформации
DFG In; б - у некоторых неактивных киназ Phe185 занимает положение DFG Out, препятствуя связыванию ATP. Фос
форилирование Т петли стимулирует сборку R спина; в - молекула ATP занимает свое место, склеивая вместе верхний и
нижний сегменты С спина. PDB:1ATP.
journal/biokhsm/
БИОХИМИЯ том 85 вып. 4 2020
КАТАЛИТИЧЕСКАЯ СУБЪЕДИНИЦА PKA
489
талитической петли). R спин формируется в ре
Спиновая модель помогает идентифициро
зультате фосфорилирования T петли [58] и от
вать а.о., занимающие ключевые простран
ражает готовность активного центра к связыва
ственные позиции. К таким относится, напри
нию косубстратов. Индикатором сборки/раз
мер, Met120 линкерного региона PKAc. Распо
борки R спина является положение Phe185
лагаясь между спинами, Met120 контролирует
DFG мотива. В собранном спине ароматиче
доступ к аденин связывающему карману, вы
ская боковая цепь Phe185 укладывается в гидро
полняя функции «привратника» [46]. Приврат
фобный карман, который образуют Leu106 и
ник может иметь громоздкую боковую цепь
Leu95 малой доли, и Tyr164 большой доли. По
(как Phe у CDK2 или СК2α) и затруднять про
ложение Phe185 DFG мотива в составе R спина
никновение лиганда, и наоборот, легкая цепь
обозначается как «DFG In». В этой конформа
(как Thr у EGFR) повышает доступность аде
ции Asp184 DFG мотива образует координаци
нин связывающего участка. Мутации Met120
онные связи с двумя ионами Mg, необходимые
не влияют на киназную активность, но размеры
для правильной ориентации молекулы ATP. У
привратника имеют значение при создании
синтезированных de novo нефосфорилирован
конкурентных ингибиторов ATP связывающе
ных киназ R спин обычно состоит из трех от
го участка [80].
дельных сегментов. Положение Phe185 вне R
Таким образом, гидрофобная природа спи
спина обозначается как «DFG Out» и служит
нов обеспечивает жесткое и очень динамичное
маркером неактивных форм ePK [47].
сочленение между долями. Нуклеофильная ата
У некоторых PK (Akt, InRK, p38 MAP, MSK)
ка и переходное состояние требуют стабильнос
Phe185 в конформации DFG out располагается
ти киназного ядра и точной взаимоориентации
так, что стерически блокирует связывание ATP
ATP и пептида; тогда как освобождение от про
[86] (рис. 8, б). На стабилизацию неактивной
дуктов реакции и захват новых косубстратов -
конформации DFG Out направленно действие
предполагают координированные движения N
Gleevec - ингибитора тирозинкиназ Abl/Src.
и C долей и их отдельных компонентов. В этом
Однако инактивация ePK не всегда требует кон
плане спиновая модель прекрасно демонстри
фигурации DFG Out [46]. У ряда протеинкиназ
рует динамическую природу киназного цикла.
R спин разрушается другим путем, например,
ротацией αC спирали. Примерами служат неак
тивные формы Src и CDK2, у которых DFG мо
CТРУКТУРНО4ОРИЕНТИРОВАННЫЙ
тив находится в конформации DFG In, а αC
ДРАГ4ДИЗАЙН ИНГИБИТОРОВ еРК
спираль занимает положение «αC Out» [87, 88].
C4спин PKAc (рис. 8, в) образуют гидрофоб
С начала XXI в. PKA и другие ePK стали рас
ные остатки обеих долей, но для его сборки не
сматриваться как вторые по важности (после
обходимо связывание молекулы ATP. В связан
GPCR) фармакологические мишени [89, 90]. К
ной форме плоский ароматический гетероцикл
2017 г. в США только для терапии рака приме
ATP располагается внутри гидрофобной щели.
няли 37 ингибиторов PK, список которых пос
Возникающие при этом силы притяжения скле
тоянно растет [91, 92]. Наряду с онкологически
ивают вместе верхний и нижний сегменты C
ми заболеваниями целый ряд других патологий
спина. Верхний сегмент образуют два небольших
(кардиологические, иммунологические, невро
остатка малой доли (Val57 β2 структуры и Ala70
логические, метаболические, и инфекционные
β3 структуры). Нижний сегмент включает
заболевания) прямо или опосредованно связа
Leu173 β7 структуры и окружающие его Leu172 и
ны с дисрегуляцией еРК [93-97]. Это вызывает
Ile174, которые кэпируют гидрофобный Met128
неуклонный интерес к еРК и желание управлять
αD спирали. В основании C спина располага
их функциями.
ются массивные Leu227 и Met231, входящие в
Одним из новых подходов к созданию инги
состав αF спирали. На протяжении каталити
биторов еРК является SBDD (structure based
ческого цикла происходят динамические изме
drug design), на начальных этапах которого ши
нения C спина [47]. C спин разобщается при
роко применяются методы in silico, а экспери
высвобождении молекулы ADP и вновь собира
ментально тестируются только потенциально
ется при связывании новой молекулы ATP. В це
активные соединения [98]. Центральное место в
лом открытая конформация адаптирует киназу к
структурно ориентированных исследованиях
эффективному захвату ATP. Этому способствуют:
занимает определение 3D структуры белка ми
раскрытие каталитической щели, «взведенное»
шени (с помощью рентгеновской кристаллогра
положение G петли, разблокировка аденин свя
фии, ЯМР и т.п.). Возможности SBDD значи
зывающего кармана и преформированные регу
тельно расширяют моделирование 3D структу
ляторные спины и активный центр.
ры на основе гомологии с белками, чья структу
3 БИОХИМИЯ том 85 вып. 4 2020
490
РЕЙХАРДТ, ШАБАНОВ
ра уже известна, и моделирование различных
зывающих участков и обеспечивают наиболее
конформаций белка мишени. Следующим ша
высокую селективность в действии ингибито
гом является поиск участков на поверхности
ров, но выявляются случайно. Поэтому скри
мишени, обладающих выгодной энергией взаи
нинг уникальных структур (полостей, карманов,
модействия с функциональными группами на
расщелин) на основе 3D моделей мог бы стиму
молекулах зондах, подобных лекарственным
лировать создание эффективных ингибиторов
средствам. И наконец, проводят молекулярный
еРК аллостерического действия.
докинг целевого сайта с уже известными соеди
Помимо медицинского применения, инги
нениями из библиотек лигандов (виртуальный
биторы РК (как исследовательские инструмен
скрининг) или осуществляют дизайн de novo.
ты) необходимы для изучения клеточных функ
Последний предполагает разработку соедине
ций еРК в работе мозга, сердца и других орга
ния с нуля на основе сайта связывания. Наряду
нов, а также механизмов РК опосредованной
с интуицией химика для этого используют прог
сигнализации при клеточном стрессе, адапта
раммы, позволяющие совмещать фрагменты из
ции, пролиферации и апоптозе. Так, атипичная
вестных ингибиторов или наращивать замести
PKC (PKMζ) получила известность как «киназа
тели на структуре скаффолде.
памяти» благодаря работам с использованием
Однако низкая селективность ингибиторов
высоко избирательного ингибиторного пептида
ATP сайта (консервативного у всех еРК) и слабая
[103]. Очевидно, что изучение структурных ос
биодоступность ингибиторов пептидной приро
нов работы ePK является предпосылкой для ус
ды - затрудняют продвижение таких соединений
пешного создания таких соединений.
[99]. В этой связи все большую актуальность при
обретает таргетинг сайтов аллостерической регу
ляции еРК [100, 101], какими являются PIF
Конфликт интересов. Авторы заявляют об от
pocket PDK1 (PDB:4AW0), каталитическая петля
сутствии конфликта интересов.
и DFG out pocket FAK (PDB:4EBV)б контактные
Соблюдение этических норм. Настоящая ра
сайты PH домена Akt (PDB:4EJN), myristate
бота не содержит каких либо исследований, в
pocket ABL2 (PDB:3GVU) и др. [102]. Эти сайты
которых были использованы в качестве объек
располагаются за пределами ATP/пептид свя тов люди или животные.
СПИСОК ЛИТЕРАТУРЫ
1.
Walsh, D. A., Perkins, J. P., and Krebs, E. G. (1968) An
8. Taylor, S. S., Knighton, D. R., Zheng, J., Sowadski, J. M.,
adenosine 3′,5′ monophosphate dependent protein kinase
Gibbs, C. S., and Zoller, M. J. (1993) A template for the
from rabbit skeletal muscle, J. Biol. Chem., 243, 3763 3765.
protein kinase family, Trends Biochem. Sci., 18, 84 89,
2.
Knighton, D. R., Zheng, J. H., Ten Eyck, L. F., Xuong, N. H.,
doi: 10.1016/0968 0004(93)80001 r.
Taylor, S. S., and Sowadski, J. M. (1991) Crystal structure
9. Taylor, S. S., and Kornev, A. P. (2012) in: Quantitative
of the catalytic subunit of cyclic adenosine monophos
Biology: From Molecular to Cellular Systems (Wall, M. E.,
phate dependent protein kinase, Science, 253, 407 414,
ed.), CRC Press, pp. 267 298.
doi: 10.1126/science.1862342.
10. Taylor, S. S., Zhang, P., Steichen, J. M., Keshwani, M. M.,
3.
Zheng, J., Trafny, E. A., Knighton, D. R., Xuong, N. H.,
and Kornev, A. P. (2013) PKA: lessons learned after twenty
Taylor, S. S., Ten Eyck, L. F., and Sowadski, J. M. (1993)
years, Biochim. Biophys. Acta,
1834,
12711278,
2.2 A refined crystal structure of the catalytic subunit of
doi: 10.1016/j.bbapap.2013.03.007.
cAMP dependent protein kinase complexed with MnATP
11. Taylor, S. S., Meharena, H. S., and Kornev, A. P. (2019)
and a peptide inhibitor, Acta Crystallogr. D Biol. Crystallogr.,
Evolution of a dynamic molecular switch, IUBMB Life, 71,
49, 362 365, doi: 10.1107/S0907444993000423.
672 684, doi: 10.1002/iub.2059.
4.
Hanks, S. K., and Hunter, T. (1995) Protein kinases 6. The
12. Fischer, E. H., and Krebs, E. G. (1955) Conversion of
eukaryotic protein kinase superfamily: kinase (catalytic)
phosphorylase b to phosphorylase a in muscle extracts, J.
domain structure and classification, FASEB J., 9, 576 596.
Biol. Chem., 216, 121 132.
5.
Taylor, S. S., Knighton, D. R., Zheng, J., Ten Eyck, L. F.,
13. Северин Е. С., Кочеткова М. Н. (1985) Роль фосфори
and Sowadski, J. M. (1992) cAMP dependent protein
лирования в регуляции клеточной активности, Наука,
kinase and the protein kinase family, Faraday Discuss., 93,
Москва.
143 152, doi: 10.1039/fd9929300143.
14. Graves, J. D., and Krebs, E. G. (1999) Protein phosphory
6.
Taylor, S. S., Radzio Andzelm, E., Knighton, D. R., Ten
lation and signal transduction, Pharmacol. Ther., 82, 111
Eyck, L. F., Sowadski, J. M., Herberg, F. W., Yonemoto, W.,
121, doi: 10.1016/s0163 7258(98)00056 4.
and Zheng, J. (1993) Crystal structures of the catalytic sub
15. Cohen, P. (2000) The regulation of protein function by
unit of cAMP dependent protein kinase reveal general fea
multisite phosphorylation - a 25 year update, Trends
tures of the protein kinase family, Receptor., 3, 165 172.
Biochem. Sci.,
25,
596601, doi:
10.1016/s0968
7.
Taylor, S. S., Zheng, J., Radzio Andzelm, E., Knighton, D. R.,
0004(00)01712 6.
Ten Eyck, L. F., Sowadski, J. M., Herberg, F. W., and
16. Hunter, T. (2000) Signaling 2000 and beyond, Cell, 100,
Yonemoto, W. M. (1993) cAMP dependent protein kinase
113 127, doi: 10.1016/s0092 8674(00)81688 8.
defines a family of enzymes, Philos. Trans. R. Soc. Lond. B
17. Jeske, L., Placzek, S., Schomburg, I., Chang, A., and
Biol. Sci., 340, 315 324, doi: 10.1098/rstb.1993.0073.
Schomburg, D. (2019) BRENDA in 2019: a european
БИОХИМИЯ том 85 вып. 4 2020
КАТАЛИТИЧЕСКАЯ СУБЪЕДИНИЦА PKA
491
ELIXIR core data resource, Nucleic Acids Res., 47, 542
35.
Johnson, L. N., Noble, M. E., and Owen, D. J. (1996)
549, doi: 10.1093/nar/gky1048.
Active and inactive protein kinases: structural basis for reg
18.
Гусев Н. Б. (2000) Протеинкиназы: строение, класси
ulation, Cell,
85,
149158, doi:
10.1016/s0092
фикация, свойства и биологическая роль, СОЖ, 6, 4
8674(00)81092 2.
12.
36.
Johnson, L. N., Lowe, E. D., Noble, M. E., and Owen, D. J.
19.
Manning, G., Whyte, D. B., Martinez, R., Hunter, T., and
(1998) The eleventh datta lecture. The structural basis for
Sudarsanam, S. (2002) The protein kinase complement of
substrate recognition and control by protein kinases, FEBS.
the human genome, Science,
298,
19121934,
Lett., 430, 1 11, doi: 10.1016/s0014 5793(98)00606 1.
doi: 10.1126/science.1075762.
37.
Johnson, D. A., Akamine, P., Radzio Andzelm, E.,
20.
Olsen, J. V., Blagoev, B., Gnad, F., Macek, B., Kumar, C.,
Madhusudan, M., and Taylor, S. S. (2001) Dynamics of
Mortensen, P., and Mann, M. (2006) Global, in vivo, and
cAMP dependent protein kinase, Chem. Rev., 101, 2243
site specific phosphorylation dynamics in signaling net
2270.
works, Cell, 127, 635 648, doi: 10.1016/j.cell.2006.09.026.
38.
Kornev, A. P., Haste, N. M., Taylor, S. S., and Eyck, L. F.
21.
Gschwind, A., Fischer, O. M., and Ullrich, A. (2004) The
(2006) Surface comparison of active and inactive protein
discovery of receptor tyrosine kinases: targets for cancer
kinases identifies a conserved activation mechanism, Proc.
therapy, Nat. Rev. Cancer, 4, 361 370, doi: 10.1038/
Natl. Acad. Sci. USA, 103, 17783 17788, doi: 10.1073/
nrc1360.
pnas.0607656103.
22.
Bradshaw, J. M. (2010) The Src, Syk, and Tec family kinas
39.
Kornev, A. P., and Taylor, S. S. (2015) Dynamics driven
es: distinct types of molecular switches, Cell Signal., 22,
allostery in protein kinases, Trends Biochem. Sci., 40, 628
1175 1184, doi: 10.1016/j.cellsig.2010.03.001.
647, doi: 10.1016/j.tibs.2015.09.002.
23.
Gaestel, M. (2016) MAPK activated protein kinases
40.
McClendon, C. L., Kornev, A. P., Gilson, M. K., and
(MKs): novel insights and challenges, Front. Cell Dev. Biol.,
Taylor, S. S. (2014) Dynamic architecture of a protein
3, 88, doi: 10.3389/fcell.2015.00088.
kinase, Proc. Natl. Acad. Sci. USA, 111, E4623 E4631, doi:
24.
Waters, M. J. (2016) The growth hormone receptor, Growth
10.1073/pnas.1418402111.
Horm. IGF Res., 28, 6 10, doi: 10.1016/j.ghir.2015.06.001.
41.
Gangal, M., Clifford, T., Deich, J., Cheng, X., Taylor, S. S.,
25.
Kim, J. J., Lorenz, R., Arold, S. T., Reger, A. S., Sankaran, B.,
and Johnson, D. A. (1999) Mobilization of the A kinase N
Casteel, D. E., Herberg, F. W., and Kim, C. (2016) Crystal
myristate through an isoform specific intermolecular
structure of PKG I:cGMP complex reveals a cGMP mediat
switch, Proc. Natl. Acad. Sci. USA, 96, 12394 12399,
ed dimeric Interface that facilitates cGMP induced activa
doi: 10.1073/pnas.96.22.12394.
tion, Structure, 24, 710 720, doi: 10.1016/j.str.2016.03.009.
42.
Herberg, F. W., Zimmermann, B., McGlone, M., and
26.
Isakov, N. (2018) Protein kinase C (PKC) isoforms in can
Taylor, S. S. (1997) Importance of the A helix of the cat
cer, tumor promotion and tumor suppression, Semin.
alytic subunit of cAMP dependent protein kinase for sta
Cancer Biol.,
48,
3652, doi:
10.1016/j.semcancer.
bility and for orienting subdomains at the cleft interface,
2017.04.012.
Protein Sci., 6, 569 579, doi: 10.1002/pro.5560060306.
27.
Brzozowski, J. S., and Skelding, K. A. (2019) The multi
43.
Bossemeyer, D. (1994) The glycine rich sequence of pro
functional calcium/calmodulin stimulated protein kinase
tein kinases: a multifunctional element, Trends Biochem.
(CaMK) family: emerging targets for anti cancer thera
Sci., 19, 201 205, doi: 10.1016/0968 0004(94)90022 1.
peutic intervention, Pharmaceuticals (Basel), 12, pii: E8,
44.
Grant, B. D., Hemmer, W., Tsigelny, I., Adams, J. A., and
doi: 10.3390/ph12010008.
Taylor, S. S. (1998) Kinetic analyses of mutations in the
28.
Pawson, T., and Nash, P. (2003) Assembly of cell regulato
glycine rich loop of cAMP dependent protein kinase,
ry systems through protein interaction domains, Science,
Biochemistry, 37, 7708 7715, doi: 10.1021/bi972987w.
300, 445 452, doi: 10.1126/science.1083653.
45.
Aimes, R. T., Hemmer, W., and Taylor, S. S. (2000) Serine
29.
Brown, N. R., Korolchuk, S., Martin, M. P., Stanley, W. A.,
53 at the tip of the glycine rich loop of cAMP dependent
Moukhametzianov, R., Noble, M. E. M., and Endicott, J. A.
protein kinase: role in catalysis, P site specificity, and
(2015) CDK1 structures reveal conserved and unique fea
interaction with inhibitors, Biochemistry, 39, 8325 8332,
tures of the essential cell cycle CDK, Nat. Commun., 6,
doi: 10.1021/bi992800w.
6769, doi: 10.1038/ncomms7769.
46.
Taylor, S. S., and Kornev, A. P. (2011) Protein kinases: evo
30.
Bibby, A. C., and Litchfield, D. W. (2005) The multiple
lution of dynamic regulatory proteins, Trends Biochem.
personalities of the regulatory subunit of protein kinase
Sci., 36, 65 77, doi: 10.1016/j.tibs.2010.09.006.
CK2: CK2 dependent and CK2 independent roles reveal a
47.
Kornev, A. P., and Taylor, S. S. (2010) Defining the con
secret identity for CK2 beta, Int. J. Biol. Sci., 1, 67 79,
served internal architecture of a protein kinase, Biochim.
doi: 10.7150/ijbs.1.67.
Biophys. Acta,
1804,
440444, doi:
10.1016/j.bba
31.
Taylor, S. S., Ilouz, R., Zhang, P., and Kornev, A. P. (2012)
pap.2009.10.017.
Assembly of allosteric macromolecular switches: lessons
48.
Steichen, J. M., Kuchinskas, M., Keshwani, M. M., Yang, J.,
from PKA, Nat. Rev. Mol. Cell Biol., 13, 646658,
Adams, J. A., and Taylor, S. S. (2012) Structural basis for
doi: 10.1038/nrm3432.
the regulation of protein kinase A by activation loop phos
32.
Shabb, J. B. (2001) Physiological substrates of cAMP
phorylation, J. Biol. Chem., 287, 14672 14680, doi: 10.1074/
dependent protein kinase, Chem. Rev., 101, 2381 2411.
jbc.M111.335091.
33.
Bossemeyer, D., Engh, R. A., Kinzel, V., Ponstingl, H.,
49.
Kim, J., Ahuja, L. G., Chao, F. A., Xia, Y., McClendon, C. L.,
and Huber, R. (1993) Phosphotransferase and substrate
Kornev, A. P., Taylor, S. S., and Veglia, G. (2017) A dynam
binding mechanism of the cAMP dependent protein
ic hydrophobic core orchestrates allostery in protein kinas
kinase catalytic subunit from porcine heart as deduced
es, Sci. Adv., 3, e1600663, doi: 10.1126/sciadv.1600663.
from the 2.0 A structure of the complex with Mn2+ adeny
50.
Taylor, S. S., Shaw, A. S., Kannan, N., and Kornev, A. P.
lyl imidodiphosphate and inhibitor peptide PKI(5 24),
(2015) Integration of signaling in the kinome: architecture
EMBO J., 12, 849 859.
and regulation of the αC Helix, Biochim. Biophy. Acta,
34.
Taylor, S. S., Yang, J., Wu, J., Haste, N. M., Radzio
1854, 1567 1574, doi: 10.1016/j.bbapap.2015.04.007.
Andzelm, E., and Anand, G. (2004) PKA: a portrait of
51.
Madhusudan, Trafny, E. A., Xuong, N. H., Adams, J. A.,
protein kinase dynamics, Biochim. Biophys. Acta, 1697,
Ten Eyck, L. F., Taylor, S. S., and Sowadski, J. M. (1994)
259 269, doi: 10.1016/j.bbapap.2003.11.029.
cAMP dependent protein kinase: crystallographic insights
БИОХИМИЯ том 85 вып. 4 2020
3*
492
РЕЙХАРДТ, ШАБАНОВ
into substrate recognition and phosphotransfer, Protein
68.
Kyriakis, J. M., and Avruch, J. (2012) Mammalian MAPK
Sci., 3, 176 187, doi: 10.1002/pro.5560030203.
signal transduction pathways activated by stress and
52.
Zhou, J., and Adams, J. A. (1997) Is there a catalytic base
inflammation: a 10 year update, Physiol. Rev., 92, 689
in the active site of cAMP dependent protein kinase?
737, doi: 10.1152/physrev.00028.2011.
Biochemistry, 36, 2977 2984, doi: 10.1021/bi9619132.
69.
Cheng, X., Ma, Y., Moore, M., Hemmings, B. A., and
53.
Valiev, M., Kawai, R., Adams, J. A., Weare, J. H. (2003)
Taylor, S. S. (1998) Phosphorylation and activation of
The role of the putative catalytic base in the phosphoryl
cAMP dependent protein kinase by phosphoinositide
transfer reaction in a protein kinase: first principles calcu
dependent protein kinase, Proc. Natl. Acad. Sci. USA, 95,
lations, J. Am. Chem. Soc., 125, 9926 9927, doi: 10.1021/
9849 9854, doi: 10.1073/pnas.95.17.9849.
ja029618u.
70.
Moore, M. J., Kanter, J. R., Jones, K. C., and Taylor, S. S.
54.
Endicott, J. A., Noble, M. E., and Johnson, L. N. (2012)
(2002) Phosphorylation of the catalytic subunit of protein
The structural basis for control of eukaryotic protein kinas
kinase A. Autophosphorylation versus phosphorylation by
es, Annu. Rev. Biochem., 81, 587613, doi: 10.1146/
phosphoinositide dependent kinase 1, J. Biol. Chem., 277,
annurev biochem 052410 090317.
47878 47884, doi: 10.1074/jbc.M204970200.
55.
Nolen, B., Taylor, S., and Ghosh, G. (2004) Regulation of
71.
Di Blasio, L., Gagliardi, P. A., Puliafito, A., and Primo, L.
protein kinases; controlling activity through activation seg
(2017) Serine/threonine kinase
3 phosphoinositide
ment conformation, Mol. Cell, 15, 661 675, doi: 10.1016/
dependent protein kinase 1 (PDK1) as a key regulator of
j.molcel.2004.08.024.
cell migration and cancer dissemination, Cancers (Basel),
56.
Hubbard, S. R. (1997) Crystal structure of the activated
9, 25, doi: 10.3390/cancers9030025.
insulin receptor tyrosine kinase in complex with peptide
72.
Yonemoto, W., McGlone, M. L., Grant, B., and Taylor, S. S.
substrate and ATP analog, EMBO J., 16, 5572 5581,
(1997) Autophosphorylation of the catalytic subunit of
doi: 10.1093/emboj/16.18.5572.
cAMP dependent protein kinase in Escherichia coli,
57.
Wood, D. J., and Endicott, J. A. (2018) Structural insights
Protein Eng., 10, 915 925, doi: 10.1093/protein/10.8.915.
into the functional diversity of the CDK cyclin family,
73.
Millward, T. A., Zolnierowicz, S., and Hemmings, B. A.
Open Biol., 8, pii: 180112, doi: 10.1098/rsob.180112.
(1999) Regulation of protein kinase cascades by protein
58.
Gógl, G., Kornev, A. P., Reményi, A., and Taylor, S. S.
phosphatase 2A, Trends Biochem. Sci., 24, 186191,
(2019) Disordered protein kinase regions in regulation of
doi: 10.1016/s0968 0004(99)01375 4.
kinase domain cores, Trends Biochem. Sci., 44, 300 311,
74.
Xu, X., Chen, Y., Fu, Q., Ni, D., Zhang, J., Li, X., and Lu, S.
doi: 10.1016/j.tibs.2018.12.002.
(2019) The chemical diversity and structure based discov
59.
Kornev, A. P., Taylor, S. S., and Ten Eyck, L. F. (2008) A
ery of allosteric modulators for the PIF pocket of protein
helix scaffold for the assembly of active protein kinases,
kinase PDK1, J. Enzyme Inhib. Med. Chem., 34, 361 374,
Proc. Natl. Acad. Sci. USA,
105,
1437714382,
doi: 10.1080/14756366.2018.1553167.
doi: 10.1073/pnas.0807988105.
75.
Newton, A. C. (2003) Regulation of the ABC kinases by
60.
Niefind, K., Putter, M., Guerra, B., Issinger, O. G., and
phosphorylation: protein kinase C as a paradigm, Biochem.
Schomburg, D. (1999) GTP plus water mimic ATP in the
J., 370, 361 371, doi: 10.1042/BJ20021626.
active site of protein kinase CK2, Nat. Struct. Biol., 6,
76.
Stempka, L., Schnolzer, M., Radke, S., Rincke, G.,
1100 1103, doi: 10.1038/70033.
Marks, F., and Gschwendt, M. (1999) Requirements of
61.
Niefind, K., and Issinger, O. G. (2010) Conformational
protein kinase cdelta for catalytic function. Role of glu
plasticity of the catalytic subunit of protein kinase CK2 and
tamic acid 500 and autophosphorylation on serine 643, J.
its consequences for regulation and drug design, Biochim.
Biol. Chem., 274, 8886 8892, doi: 10.1074/jbc.274.13.8886.
Biophys. Acta,
804,
484492, doi:
10.1016/j.bba
77.
Yang, J., Ten Eyck, L. F., Xuong, N. H., and Taylor, S. S.
pap.2009.09.022.
(2004) Crystal structure of a cAMP dependent protein
62.
Akamine, P., Madhusudan, Wu, J., Xuong, N. H., Ten
kinase mutant at 1.26A: new insights into the catalytic
Eyck, L. F., and Taylor, S. S. (2003) Dynamic features of
mechanism, J. Mol. Biol., 336, 473 487, doi: 10.1016/
cAMP dependent protein kinase revealed by apoenzyme
j.jmb.2003.11.044.
crystal structure, J. Mol. Biol.
327,
159171,
78.
Adams, J. A. (2001) Kinetic and catalytic mechanisms of
doi: 10.1016/s0022 2836(02)01446 8.
protein kinases, Chem. Rev., 101, 2271 2290, doi: 10.1021/
63.
Bastidas, A. C., Wu, J., and Taylor, S. S. (2015) Molecular
cr000230w.
features of product release for the PKA catalytic cycle,
79.
Lassila, J. K., Zalatan, J. G., and Herschlag, D. (2011)
Biochemistry, 54, 2 10, doi: 10.1021/bi500684c.
Biological phosphoryl transfer reactions: understanding
64.
Moore, M. J., Adams, J. A., and Taylor, S. S. (2003)
mechanism and catalysis, Annu. Rev. Biochem., 80, 669
Structural basis for peptide binding in protein kinase A.
702, doi: 10.1146/annurev biochem 060409 092741.
Role of glutamic acid 203 and tyrosine 204 in the peptide
80.
Schwartz, P. A., and Murray, B. W. (2011) Protein kinase
positioning loop, J. Biol. Chem., 278, 1061310618,
biochemistry and drug discovery, Bioorg. Chem., 39, 192
doi: 10.1074/jbc.M210807200.
210, doi: 10.1016/j.bioorg.2011.07.004.
65.
Shaltiel, S., Cox, S., and Taylor, S. S. (1998) Conserved
81.
Montenegro, M., Garcia Viloca, M., Lluch, J. M., and
water molecules contribute to the extensive network of
González Lafont, A. (2011) QM/MM study of the phos
interactions at the active site of protein kinase A, Proc.
phoryl transfer to the Kemptide substrate catalyzed by pro
Natl. Acad. Sci. USA, 95, 484 491, doi: 10.1073/pnas.
tein kinase A. The effect of the phosphorylation state of the
95.2.484.
protein on the mechanism, Phys. Chem. Chem. Phys., 13,
66.
Gerlits, O., Weiss, K. L., Blakeley, M. P., Veglia, G., Taylor,
530 539, doi: 10.1039/c0cp01062f.
S. S., and Kovalevsky, A. (2019) Zooming in on protons:
82.
Wang, Z., and Cole, P. A. (2014) Catalytic mechanisms
neutron structure of protein kinase A trapped in a product
and regulation of protein kinases, Methods Enzymol., 548,
complex, Sci. Adv., 5, eaav0482, doi: 10.1126/sciadv.
1 21, doi: 10.1016/B978 0 12 397918 6.00001 X.
aav0482.
83.
Кочетков С. Н., Габибов А. Г., Северин Е. С. (1984)
67.
Rubenstein, E. M., and Schmidt, M. C.
(2007)
Механизмы переноса фосфорильной группы в фер
Mechanisms regulating the protein kinases of
ментативных реакциях, Биоорг. химия, 10, 1301 1325.
Saccharomyces cerevisiae, Eukaryot. Cell, 6, 571583,
84.
Skamnaki, V. T., Owen, D. J., Noble, M. E., Lowe, E. D.,
doi: 10.1128/EC.00026 07.
Lowe, G., Oikonomakos, N. G., and Johnson, L. N.
БИОХИМИЯ том 85 вып. 4 2020
КАТАЛИТИЧЕСКАЯ СУБЪЕДИНИЦА PKA
493
(1999) Catalytic mechanism of phosphorylase kinase
94. Castello, J., Ragnauth, A., Friedman, E., and Rebholz, H.
probed by mutational studies, Biochemistry, 38, 14718
(2017) CK2 an emerging target for neurological and psy
14730, doi: 10.1021/bi991454f.
chiatric disorders, Pharmaceuticals (Basel),
10,
7,
85.
Madhusudan, Akamine, P., Xuong, N. H., and Taylor, S. S.
doi: 10.3390/ph10010007.
(2002) Crystal structure of a transition state mimic of the
95. Saad, N. S., Elnakish, M. T., Ahmed, A. A. E., and
catalytic subunit of cAMP dependent protein kinase, Nat.
Janssen, P. M. L. (2018) Protein kinase A as a promising
Struct. Biol., 9, 273 277, doi: 10.1038/nsb780.
target for heart failure drug development, Arch. Med. Res.,
86.
Shan, Y., Seeliger, M. A., Eastwood, M. P., Frank, F., Xu, H.,
49, 530 537, doi: 10.1016/j.arcmed.2018.12.008.
Jensen, M. Ø., Dror, R. O., Kuriyan, J., and Shaw, D. E.
96. Yan, Z., Gibson, S. A., Buckley, J. A., Qin, H., and
(2009) A conserved protonation dependent switch controls
Benveniste, E. N. (2018) Role of the JAK/STAT signaling
drug binding in the Abl kinase, Proc. Natl. Acad. Sci. USA,
pathway in regulation of innate immunity in neuroinflam
106, 139 144, doi: 10.1073/pnas.0811223106.
matory diseases, Clin. Immunol., 189, 4 13, doi: 10.1016/
87.
Xu, W., Doshi, A., Lei, M., Eck, M. J., and Harrison, S. C.
j.clim.2016.09.014.
(1999) Crystal structures of c Src reveal features of its
97. DuShane, J. K., and Maginnis, M. S. (2019) Human DNA
autoinhibitory mechanism, Mol. Cell,
3,
629638,
virus exploitation of the MAPK ERK cascade, Int. J. Mol.
doi: 10.1016/s1097 2765(00)80356 1.
Sci., 20, 3427, doi: 10.3390/ijms20143427.
88.
Huse, M., and Kuriyan, J. (2002) The conformational
98. Batool, M., Ahmad, B., and Choi, S. (2019) A structure
plasticity of protein kinases, Cell,
109,
275282,
based drug discovery paradigm, Int. J. Mol. Sci., 20,
doi: 10.1016/s0092 8674(02)00741 9.
pii: E2783, doi: 10.3390/ijms20112783.
89.
Cohen, P. (2002) Protein kinases - the major drug targets
99. Roskoski, R. Jr. (2016) Classification of small molecule
of the twenty first century? Nat. Rev. Drug Discov., 1, 309
protein kinase inhibitors based upon the structures of their
315, doi: 10.1038/nrd773.
drug enzyme complexes, Pharmacol. Res., 103, 26 48,
90.
Рейхардт Б. А., Куликова О. Г., и Сапронов Н. С.
doi: 10.1016/j.phrs.2015.10.021.
(2002) Терапевтический потенциал модуляторов про
100. Eglen, R., and Reisine, T. (2011) Drug discovery and the
теинкиназы СК2, Вестник АМН, 12, 20 24.
human kinome: recent trends, Pharmacol. Ther., 130, 144
91.
Bhullar, K. S., Lagarón, N. O., McGowan, E. M., Parmar, I.,
156, doi: 10.1016/j.pharmthera.2011.01.007.
Jha, A., Hubbard, B. P., and Rupasinghe, H. P. V. (2018)
101. Jenardhanan, P., Panneerselvam, M., and Mathur, P. P. (2019)
Kinase targeted cancer therapies: progress, challenges and
Targeting kinase interaction networks: a new paradigm in PPI
future directions, Mol. Cancer, 17, 48, doi: 10.1186/
based design of kinase inhibitors, Curr. Top. Med. Chem., 19,
s12943 018 0804 2.
467 485, doi: 10.2174/1568026619666190304155711.
92.
Kannaiyan, R., and Mahadevan, D. (2018) A comprehen
102. Fabbro, D., Cowan Jacob, S. W., and Moebitz, H. (2015)
sive review of protein kinase inhibitors for cancer therapy,
Ten things you should know about protein kinases:
Expert. Rev. Anticancer Ther., 18, 1249 1270, doi: 10.1080/
IUPHAR Review 14, Br. J. Pharmacol., 172, 2675 2700,
14737140.2018.1527688.
doi: 10.1111/bph.13096.
93.
Patterson, H., Nibbs, R., McInnes, I., and Siebert, S.
103. Бородинова А. А., Зюзина А. Б., и Балабан П. М.
(2014) Protein kinase inhibitors in the treatment of inflam
(2017) Роль атипичных протеинкиназ в поддержании
matory and autoimmune diseases, Clin. Exp. Immunol., 76,
долговременной памяти и синаптической пластич
1 10, doi: 10.1111/cei.12248.
ности, Биохимия, 82, 372 388.
CATALYTIC SUBUNIT OF PKA AS A PROTOTYPE
OF THE EUKARYOTIC PROTEIN KINASE FAMILY
Review
B. A. Reikhardt* and P. D. Shabanov
Federal State Budgetary Scientific Institution “Institute of Experimental Medicine”,
197376 St. Petersburg, Russia; E!mail: reichardt@mail.ru
Received October 21, 2019
Revised February 25, 2020
Accepted February 26, 2020
The PKA catalytic subunit (PKAc) is a practically isolated kinase domain that is conserved in all eukaryotic protein
kinases. PKAc consists of two lobes that form the catalytic gap in which ATP binding site, peptide binding site, and
catalytic site are located. During the folding, PKAc secondary structures are stacked so that the non polar chains are
assembled into a globular core, and the moving loops and tails are exposed out, to form regulatory elements. The syn
thesized de novo PKAc is processed by T loop phosphorylation, and active center, capable to high affinity binding of
co substrates is formed. The ATP molecule “sticks” two lobes together, and the binding of peptide completes the
assembly of the active center. As a result, the “catalytic triad” (gamma phosphate of ATP, hydroxyl of Ser/Thr pro
tein substrate, and carboxyl of Asp166) occupies an optimal position for catalysis. During the catalytic cycle, the
dynamic reorganization of polar and hydrophobic interactions ensures the transition of PKAc from open to closed
conformation and vice versa. An understanding of ePK structural basis is essential for successful design of ePK mod
ulators.
Keywords: PKA catalytic subunit, ATP binding site of PKA, peptide binding site of PKA, Thr197 PKA, hydrophobic
spines
БИОХИМИЯ том 85 вып. 4 2020