БИОХИМИЯ, 2020, том 85, вып. 4, с. 494 - 506
УДК 577.214
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ ДНК И КАНЦЕРОГЕНЕЗ*
Обзор
© 2020
Е.С. Шилкин1, Е.О. Болдинова1, А.Д. Столяренко1, Р.И. Гончарова2,
Р.Н. Чупров)Неточин3, Р.Ф. Хайруллин4, М.П. Смаль2**, А.В. Макарова1**
1 Институт молекулярной генетики Российской академии наук,
123182 Москва, Россия; электронная почта: amakarova"img@yandex.ru
2 Институт генетики и цитологии НАН Беларуси, 220072 Минск,
Республика Беларусь; электронная почта: m.smal@igc.by
3 Московский физико"технический институт (национальный исследовательский университет),
141701 Долгопрудный, Московская область, Россия
4 Казанский (Приволжский) федеральный университет, 420008 Казань, Россия
Поступила в редакцию 04.12.2019
После доработки 20.02.2020
Принята к публикации 20.02.2020
В клетках млекопитающих под влиянием эндогенных и экзогенных факторов постоянно образуются десят
ки тысяч повреждений ДНК. Основным механизмом защиты клеток от повреждений, избежавших удале
ния системами репарации, является транслезионный синтез ДНК. ДНК полимеразы йота (Pol ι), эта
(Pol η), каппа (Pol κ) и зета (Pol ζ) эффективно включают нуклеотиды напротив повреждений, но обладают
низкой точностью синтеза и являются источником мутаций в геномной ДНК. Нарушения в работе этих
ДНК полимераз повышают риск развития онкологических заболеваний.
КЛЮЧЕВЫЕ СЛОВА: транслезионный синтез ДНК, повреждения ДНК, мутагенез, канцерогенез.
DOI: 10.31857/S032097252004003X
Одним из основных факторов запуска кан
ную структуру молекулы, но часть повреждений
церогенного перерождения клеток являются со
избегает репарации. Такие повреждения могут
матические мутации в генах онкосупрессорах и
приводить к гибели клеток в результате блоки
онкогенах. Источниками мутагенеза являются
рования репликации и остановки клеточного
дезаминирование 5 метилцитозина и цитозина,
цикла, а также обладают мутагенными свой
ошибки репарации и репликации. Сбои в рабо
ствами (многие типы поврежденных оснований
те ферментов репарации и репликации приво
образуют водородные связи с основаниями,
дят к ускоренному накоплению соматических
некомплементарными первичной неповреж
мутаций [1].
денной последовательности) [2]. Некоторые
Источником мутаций при репликации явля
повреждения обладают одновременно высоки
ются не только ошибки копирования непов
ми мутагенными и цитотоксическими свой
режденной ДНК, но и ошибки, вызванные
ствами (например, апуриновые/апиримидино
спонтанными и индуцированными поврежде
вые сайты (АП сайты)).
ниями. ДНК постоянно подвергается повреж
Для защиты клеток от нерепарированных
дениям, возникающим под действием разнооб
повреждений может запускаться альтернатив
разных физических и химических факторов.
ный механизм - транслезионный синтез ДНК
Системы репарации эффективно удаляют пов
или «синтез через повреждение», при котором
реждения ДНК, восстанавливая первоначаль
становится возможным синтез ДНК на повреж
денных матрицах. Ключевую роль в этом про
Принятые сокращения: ДНКП - ДНК полимераза; цессе у млекопитающих играют специализиро
СГМ - соматический гипермутагенез; ЭРО - эксцизион
ванные транслезионные* ДНК полимеразы
ная репарация оснований; ММР - мисмэтч репарация.
* Приложение к статье на английском языке опубликова
* Транслезионные ДНКП - это ДНКП, основной функци
но на сайте журнала «Biochemistry» (Moscow) и на сайте из
ей которых в клетке принято считать синтез ДНК в по
врежденных участках, и демонстрирующие высокую эф
том 85, вып. 4, 2020.
фективность включения нуклеотидов напротив повреж
** Адресат для корреспонденции.
денных оснований ДНК in vitro и in vivo.
494
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ ДНК И КАНЦЕРОГЕНЕЗ
495
(ДНКП): ДНКП зета (Pol ζ) B семейства и
единичный комплекс, состоящий из ДНКП и
ДНКП iota (Pol ι), eta (Pol η), kappa (Pol κ) и
регуляторных белков.
REV1 Y семейства
[2-5]. Транслезионные
Согласно двухполимеразной модели, одна из
ДНКП обладают активным центром, нетребова
ДНКП Y семейства — йота (Pol ι), эта (Pol η) или
тельным к структуре матрицы, и эффективно
каппа (Pol κ) — включает нуклеотиды напротив
включают нуклеотиды напротив повреждений,
поврежденного участка, тогда как ДНКП зета
преодолевая блок репликации [5, 6]. Во многих
(Pol ζ) продолжает синтез после поврежденного
случаях транслезионные ДНКП включают нук
участка [4]. Pol ι, Pol η и Pol κ - это односубъеди
леотиды, преимущественно комплементарные
ничные ферменты, обладающие очень низкой
поврежденным основаниям. Такой синтез явля
точностью синтеза на неповрежденных ДНК
ется достаточно точным и вносит существенный
матрицах (10-1-10-4) и низкой процессивностью
вклад в снижение мутаций, индуцированных
[10-12]. Эти ферменты являются ДНКП «ин
факторами, повреждающими ДНК.
сертерами» (ДНКП «инсертер» - ДНКП, кото
Тем не менее вследствие «толерантности»
рая ограничивается включением только одного
активного центра, отсутствия 3′ 5′ экзонуклеаз
или нескольких нуклеотидов напротив повреж
ной корректирующей активности и использова
денного участка). Pol ι, Pol η и Pol κ характеризу
ния неканонических взаимодействий при вклю
ются разными биохимическими свойствами, от
чении нуклеотидов точность синтеза ДНК у
личаются по эффективности и спектру включе
транслезионных ДНКП является низкой [5, 6].
ния нуклеотидов напротив разных повреждений
Такая низкая точность неприемлема при синте
и точности копирования ДНК. Несмотря на то,
зе неповрежденной ДНК. Активность высоко
что разные транслезионные ДНКП специализи
ошибочных ДНКП и их доступ к репликативной
руются на разных типах повреждений, они час
вилке жестко регулируются в клетке, а наруше
тично дублируют функции друг друга [2].
ние их работы (увеличение и снижение катали
Поскольку ДНКП Y семейства не всегда мо
тической активности, а также нарушения досту
гут осуществить удлинение праймера после
па к репликативной вилке) может являться при
включения нуклеотида напротив поврежденно
чиной ускоренного накопления мутаций и раз
го основания, дальнейший синтез, в том числе
вития онкологических заболеваний. В настоя
от неспаренных, свободных концов праймеров,
щем обзоре рассмотрены основные функции
обеспечивает ДНКП «экстендер» Pol ζ (ДНКП
Pol ζ, Pol ι, Pol η, Pol κ и REV1 и их возможная
«экстендер» - ДНКП, которая продолжает син
роль в канцерогенезе и защите от развития он
тез после повреждения) [4]. Pol ζ состоит из не
кологических заболеваний.
скольких субъединиц: каталитической REV3 и
регуляторных REV7 (в форме димера), POLD2
(p50) и POLD3 (p66) (рис. 1) [13-16]. Y ДНКП
ФУНКЦИИ ДНКП В КЛЕТКЕ
REV1 обладает слабой ДНК полимеразной ак
тивностью и включает dCMP напротив некото
ДНКП человека относятся к нескольким се
рых повреждений in vitro, но основная функция
мействам и характеризуются большим разнооб
REV1 - регуляция активности и координация
разием, различаясь по биохимическим свой
работы ДНКП при сборке транслесомы [3, 4].
ствам, точности копирования ДНК и функци
REV1 участвует в белок-белковых взаимодей
ям. Репликативные ДНКП B семейства дельта
ствиях одновременно с Pol ζ, ДНКП Y семей
(Pol δ), эпсилон (Pol ε) и альфа (Pol α) осущест
ства и фактором процессивности PCNA [3, 4].
вляют синтез геномной ДНК с высокой точ
Кроме репликации в поврежденных участках
ностью, что достигается за счет высокой селек
ДНК транслезионные ДНКП могут выполнять
тивности работы активного центра и наличия
и другие функции в клетке. Pol κ осуществляет
3′ 5′ корректирующей экзонуклеазной актив
репаративный синтез ДНК в ходе эксцизионной
ности (в случае Pol δ и Pol ε) [7, 8]. Частота оши
репарации поврежденных нуклеотидов [17].
бок Pol δ и Pol ε при репликации (in vivo и in vitro)
Pol ι и REV1 обладают дополнительной дезокси
составляет всего 10-5-10-7 [8].
рибофосфатлиазной (дРФ лиазной) актив
Репликативные ДНКП наталкиваются на
ностью и, возможно, в ряде случаев Pol ι и REV1
повреждения ДНК, что часто приводит к оста
могут замещать Pol β в ходе синтеза ДНК при
новке репликации и запускает каскад событий,
эксцизионной репарации оснований (ЭРО) [18,
приводящий к моноубиквитинилированию
19]. Pol η и REV1 вовлечены в соматический ги
фактора процессивности PCNA по остатку
пермутагенез (СГМ) генов иммуноглобулинов в
Lys164 и переключению синтеза на транслези
В лимфоцитах [20-22].
онные ДНКП [5, 9]. Для эффективной работы
Нарушение работы транслезионных ДНКП
ДНКП формируют транслесому — мультисубъ
в организме является фактором повышенного
БИОХИМИЯ том 85 вып. 4 2020
496
ШИЛКИН и др.
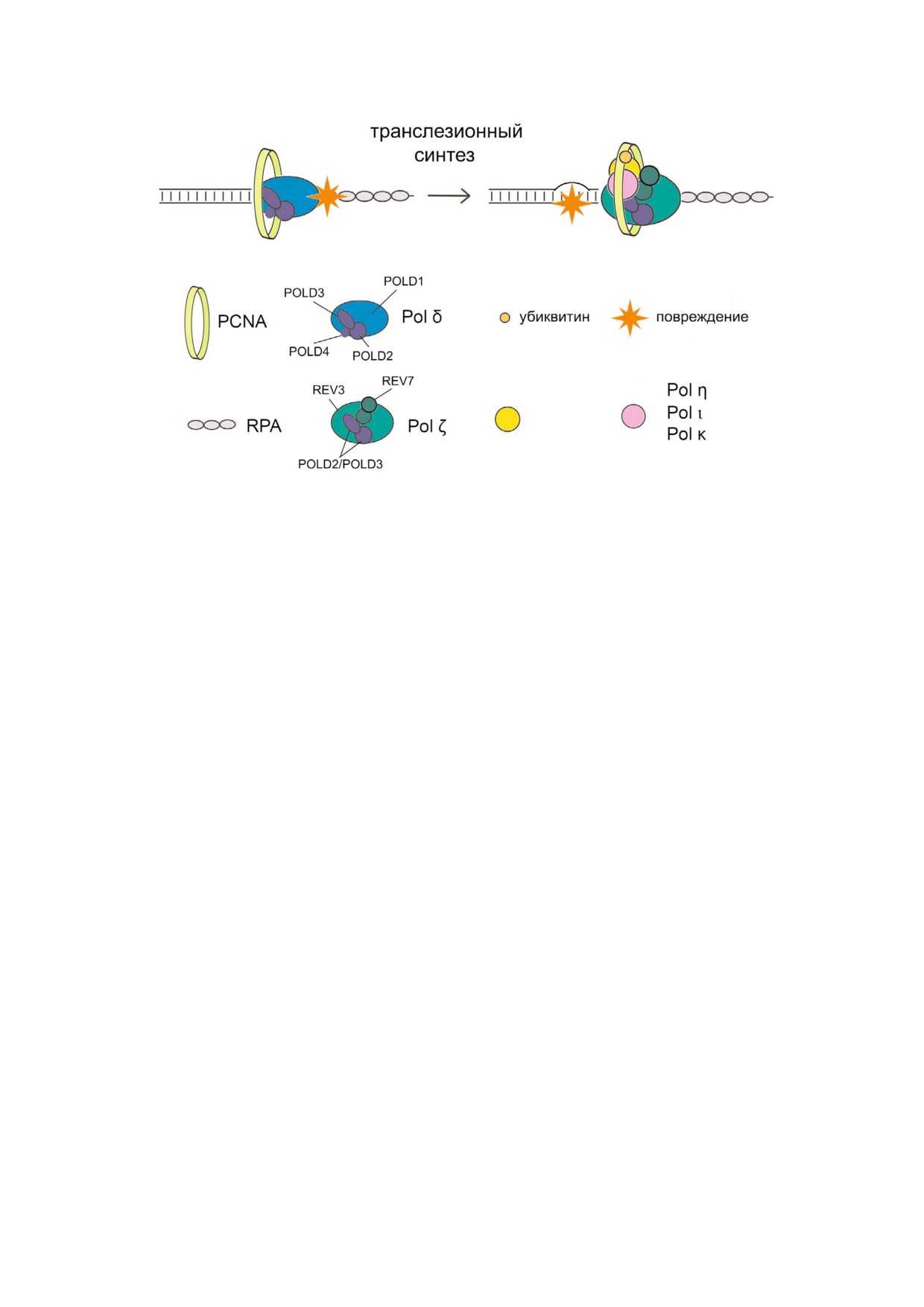
REV1
Рис. 1. Модель транслезионного синтеза ДНК. Переключение ДНКП и сборка транслесомы в участке ДНК с повреждени
ем инициируется убиквитинилированием PCNA. Показаны основные белки и белок-белковые взаимодействия трансле
сомы человека: 1) регуляторные субъединицы POLD2/POLD3 являются общими для Pol δ и Pol ζ; 2) REV1 одновременно
взаимодействует с убиквитинилированным PCNA, REV7 димером Pol ζ, а также ДНКП Y семейства или POLD3 Pol ζ (С
конец REV1 и RIR мотив в Y ДНКП и POLD3); 3) POLD3 Pol ζ взаимодействует с PCNA, REV7, а также REV1 или ДНКП
Y семейства. Альтернативное связывание REV1 RIR мотивов Y ДНКП и POLD3 может играть роль в переключении
ДНКП «инсертера» и ДНКП «экстендера». На рисунке не показаны взаимодействия ДНКП Y семейства с PCNA [3, 4].
journal/biokhsm/
риска канцерогенного перерождения клеток.
Pol η
Опухолеобразование может быть ассоциирова
но с падением уровня экспрессии и нарушением
Основная функция Pol η в клетке состоит в
функций транслезионных ДНКП, а повышен
эффективной и точной репликации через фо
ная активность транслезионных ДНКП в опухо
топродукты (тимин тиминовые (Т Т) циклобу
лях может сопровождаться хромосомной неста
тановые димеры) и защите клеток от ультрафио
бильностью и высокой смертностью пациентов
летового излучения [23]. Кроме Т Т димеров
из за повышенной устойчивости опухолевых
Pol η эффективно включает нуклеотиды напро
клеток к препаратам химиотерапии.
тив АП сайтов, 8 oxo G, тимидин гликоля [2],
Нарушение функции с развитием наследуе
внутринитевых цисплатиновых сшивок [14, 27].
мых заболеваний у человека и мыши четко
Потеря активности Pol η приводит у человека к
прослеживается для Pol η и Pol ζ [23-25]. Мута
развитию варианта пигментной ксеродермы
ции и аминокислотные полиморфизмы других
(XP V фенотип) — синдрома с аутосомально ре
транслезионных ДНКП обнаруживаются как у
цессивным наследованием, который характери
здоровых людей, так и в образцах пациентов с
зуется фотодерматозами и очень высокой часто
разными онкологическими заболеваниями
той образования опухолей кожи [23]. У мышей
(Table S1 Приложения). Для некоторых поли
потеря двух аллелей Polh вызывает плоскокле
морфизмов продемонстрирована ассоциация с
точные карциномы кожи, индуцированные УФ,
высоким риском развития онкологических за
в 100% случаев, у гетерозиготных особей опухо
болеваний и негативным прогнозом, что позво
ли развиваются ~ в 30% случаев [28].
ляет рассматривать их в качестве потенциаль
У пациентов с XP V фенотипом описаны му
ных прогностических маркеров.
тации и аминокислотные полиморфизмы, зат
Массовое секвенирование геномов позволи
рагивающие как каталитический кор (каталити
ло выявить наиболее часто встречаемые паттер
ческий кор — содержащий активный центр ка
ны мутаций (мутационные подписи) в опухолях
талитически активный фермент, лишенный С
[26]. Ряд таких паттернов мутаций был связан с
концевой регуляторной области), так и С кон
измененной активностью или нарушением
цевую область Pol η, участвующую в белок-бел
функций определенных ДНКП.
ковых взаимодействиях (Table S2 Приложения).
БИОХИМИЯ том 85 вып. 4 2020
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ ДНК И КАНЦЕРОГЕНЕЗ
497
В среднем, мутации гена POLH повышают веро
дукты гуанина) [30, 31]. Включение нуклеотидов
ятность образования опухолей кожи в 1000 раз, а
напротив повреждений, нарушающих образова
возраст появления опухолей составляет 20-30
ние уотсон-криковских взаимодействий, воз
лет. В большинстве случаев у пациентов однов
можно благодаря использованию Pol ι хугстинов
ременно образуются множественные меланомы,
ских взаимодействий [32, 33] (рис. 2).
базальноклеточные и плоскоклеточные карци
Pol ι является ДНКП с очень низкой точ
номы кожи (до нескольких десятков). Иногда
ностью синтеза на неповрежденной ДНК. Нео
заболевание сопровождается актиническим ке
бычная особенность Pol ι - преимущественное
ратозом и множественными атипичными неву
включение dGMP напротив тимина, урацила и
сами; в литературе были описаны единичные
его производных [12, 34, 35]. Включение dGMP
случаи опухолей глаз, трихобластомы, нейро
напротив тимина матричной ДНК стабилизиру
фибромы, кератоакантомы и иммунные дефек
ется уникальной водородной связью, которая
ты (Table S2 Приложения).
образуется непосредственно между N2 атомом
Предполагается, что кроме защитной функ
dGTP и Gln59 в активном центре Pol ι [33, 36].
ции Pol η может способствовать накоплению
Pol ι является также одной из немногих ДНКП,
мутационных изменений генома клеток, приво
которая включает напротив АП сайтов преиму
дящих к возникновению злокачественных опу
щественно не dAMP, а dGMP [2, 30, 35]. Эти
холей. Pol η участвует в СГМ генов иммуногло
свойства могут играть роль в снижении мутаген
булинов в А Т парах [21, 22]. Мутации, харак
ного потенциала дезаминированных остатков
терные для Pol η, были обнаружены не только в
цитозина и его окисленных производных и 5 ме
В лимфоцитах, но и во многих типах опухолей
тилцитозина (5 me C) (при AID/APOBEC ин
разной локализации и предполагается, что не
дуцированном мутагенезе и спонтанном дезами
мишенный мутагенез геномной ДНК, обуслов
нировании 5 me C CpG островков) [35]. Однов
ленный Pol η, может быть связан с канцерогене
ременно дезаминированные и окисленные ос
зом [29].
татки цитозина составляют большую часть пи
римидиновых повреждений в геномной ДНК,
поэтому можно ожидать, что включение dGМP
Pol ι
напротив неканонических пиримидинов в ходе
транслезионного синтеза будет преимуществен
Pol ι эффективно включает нуклеотиды c раз
но антимутагенным. Однако роль Pol ι в сниже
ной точностью напротив целого ряда поврежде
нии мутагенного потенциала дезаминированных
ний ДНК, вызванных эндогенными и экзоген
остатков цитозина не подтверждена in vivo, и ме
ными факторами: АП сайтов, урацила и его про
ханизмы распознавания этих остатков не ясны.
изводных, 8 oxo G, N3 me A, O6 me G, круп
Падение уровня экспрессии и/или актив
ных аддуктов пуриновых оснований, блокирую
ности Pol ι связано с развитием ряда онкологи
щих образование уотсон-криковских взаимо
ческих заболеваний. У мышей ген Polι находит
действий (например, 1,N6 этеноаденин и N2 ад
ся в локусе PAR2. Данный участок генома важен
Уотсон криковские
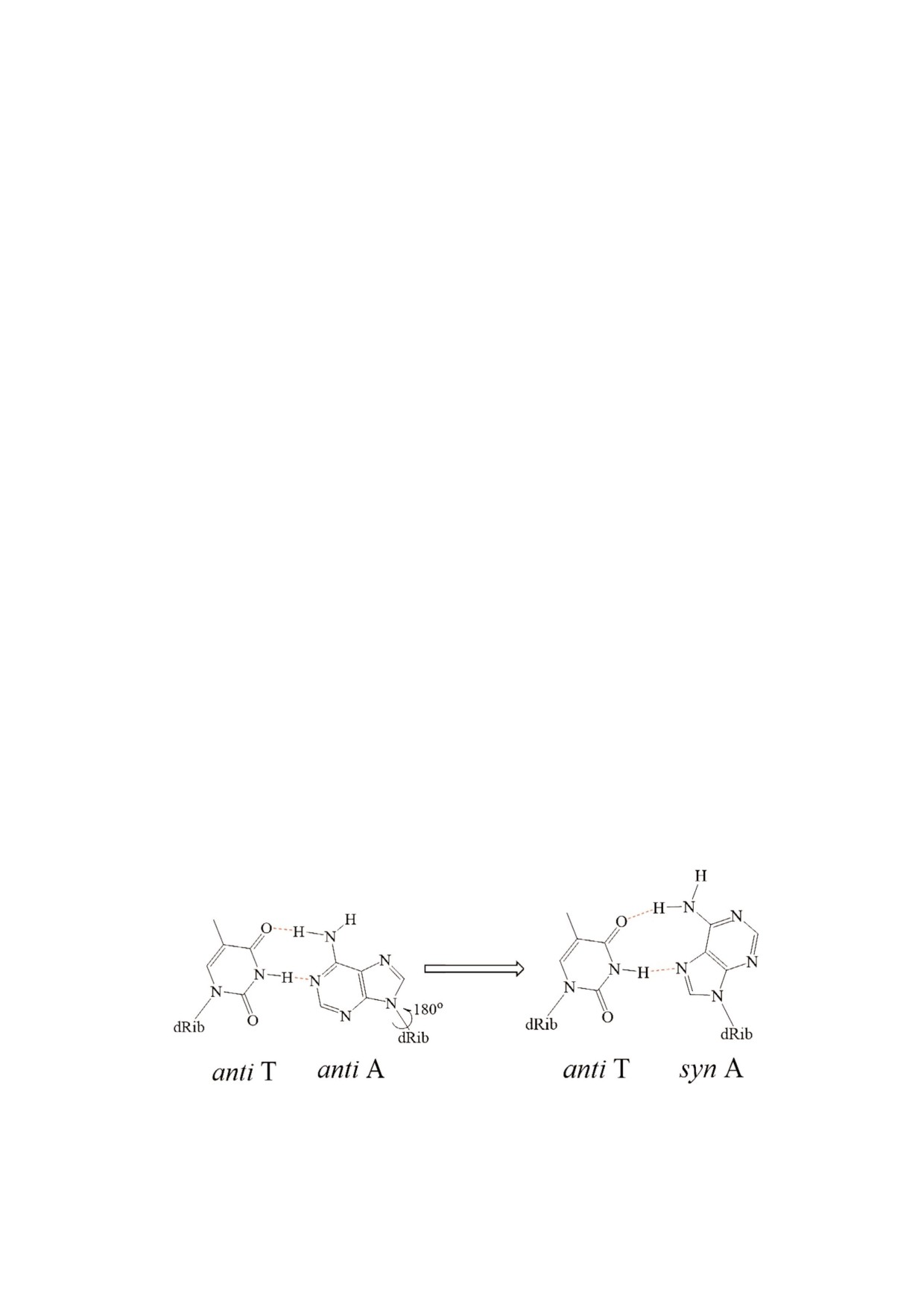
Хугстиновские
взаимодействия
взаимодействия
Рис. 2. Пример образования Хугстиновских взаимодействий в активном центре Pol ι.
journal/biokhsm/
БИОХИМИЯ том 85 вып. 4 2020
498
ШИЛКИН и др.
для защиты от химически индуцированного ра
этеноаденин), но основной «мишенью» Pol κ
ка легких [37-39]. Нокаут, а также альтернатив
считаются экспонированные в малую бороздку
ный сплайсинг, мутации и полиморфизмы гена
ДНК модификации нуклеотидов, прежде всего,
Polι, снижающие активность фермента, связаны
крупные N2 аддукты гуанина, образующиеся
с высоким риском развития аденом и аденокар
под действием химических канцерогенов
цином легких, индуцированных уретаном и ди
[55-59]. Pol κ снижает мутагенный потенциал
этилнитрозамином [37-39]. Защитное действие
распространенного канцерогена бенз[а]пирена,
Pol ι продемонстрировано и при развитии опу
который содержится в жареных и копченых
холей кожи, индуцированных ультрафиолетом
продуктах, табачном дыме, продуктах горения
(в отсутствие Pol ι образуются преимущественно
автомобильного топлива [60, 61]. Благодаря от
мезенхимальные опухоли кожи) [40, 41].
крытому активному центру Pol κ с очень высо
Повышенный риск развития рака легких у
кой эффективностью и точностью включает
человека ассоциирован с гетерозиготным и го
напротив BPDE N2 dG аддуктов, образующих
мозиготным носительством варианта гена POLI,
ся под влиянием бенз[а]пирена, dCMP, тогда
кодирующего фермент с аминокислотной заме
как большинство ДНКП включает напротив
ной T706A (rs8305) (Table S1 Приложения). По
BPDE N2 dG, преимущественно dAMP, что вы
вышенный риск появления опухолей простаты
зывает G>T трансверсии [57]. Нокаут гена Polκ
связан с заменами T706A и F507S (rs3218786)
повышает частоту мутаций, индуцированных
Pol ι (Table S1 Приложения). Сильная ассоциа
BPDE N2 dG, в культуре клеток [62, 63].
ция образования химерного гена TMPRSS2"ERG
Важно отметить, что защитная роль Pol κ от
с аминокислотной заменой F507S была проде
повреждений ДНК может быть связана и с еще
монстрирована у пациентов с раком простаты
неизвестной некаталитической функцией поли
(Table S1 Приложения). Cлияние промоторного
меразы. Клетки человека с геном, кодирующим
элемента андроген регулируемого гена протеа
каталитически неактивную Pol κ, и нокаутом ге
зы TMPRSS2 с протоонкогеном фактора тран
на POLK одинаково чувствительны к ряду по
скрипции ERG может быть вызвано хромосом
вреждающих агентов, в том числе, бенз[а]пире
ными перестройками и является одним из мар
ну [64]. Кроме того, и нокаут Polκ, и каталити
керов рака простаты [42]. С концевые амино
чески неактивная Pol κ у мышей, ассоцииро
кислотные остатки Phe507 и Thr706 находятся в
ваны с повышенным риском рака кишечника,
сайтах связывания убиквитинилированного
индуцированного бенз[а]пиреном в присут
PCNA (UBM1 и UBM2 соответственно) [43, 44]
ствии DSS (агента, вызывающего воспаление).
и могут нарушать взаимодействие Pol ι с транс
При такой обработке у мышей c геном Polκ ди
лесомой. Вариант I236M Pol ι может быть связан
кого типа обнаружили аддукты ДНК с окислен
с развитием меланомы (Table S1 Приложения).
ными липидами (маркер воспаления), но про
Увеличение экспрессии и/или активности
дуктов бенз[а]пирена обнаружено не было [65].
Pol ι у человека было отмечено в глиомах голов
Pol κ также осуществляет синтез напротив
ного мозга [45], карциномах пищевода [46-48],
внутри и межцепочечных сшивок ДНК, инду
опухолях молочной железы [49] и мочевого пу
цированных цисплатином и митомицином С
зыря [50]. Высокий уровень экспрессии Pol ι
[66-68], участвует в репарации межнитевых сши
при раке пищевода, легких и груди может быть
вок ДНК [69, 70] и репаративном синтезе ДНК
связан с высоким риском метастазирования и
при эксцизионной репарации нуклеотидов [17].
негативным прогнозом [46, 48, 51-53]. Индук
Низкий уровень экспрессии Pol κ был обна
ция экспрессии POLI регулируется HIF 1
ружен в опухолях прямой кишки, груди, легких и
(hypoxia inducible factor 1), стимулирующим
желудка [71, 72]. Повышенная экспрессия POLK
сверхэкспрессию POLI в опухолевых клетках в
вызывает повышение частоты мутагенеза в куль
условиях гипоксии [54]. Уровень экспрессии
турах клеток млекопитающих [73, 74]. Эктопи
POLI в опухолях мочевого пузыря регулируется
ческая сверхэкспрессия Polκ у мышей вызывает
фактором транскрипции c Jun и c Jun N тер
двухцепочечные разрывы ДНК, анеуплоидию и
минальной киназой, а также коррелирует со ста
стимулирует канцерогенез у мышей с иммуноде
дией заболевания [50].
фицитом [75]. Высокая экспрессия POLK харак
терна для клеток пациентов с мелкоклеточным
раком легких [76, 77] и коррелирует с инактива
Pol κ
цией Р53 [77]. Повышенная экспрессия Pol κ
наблюдается также в глиомах и ассоциирована с
Pol κ с различной эффективностью и точ
поздними стадиями заболевания [45].
ностью «проходит» широкий спектр поврежде
Для полиморфизмов POLK показана ассоци
ний ДНК (АП сайты, тимидин гликоль, 1, N6
ация с повышенным риском рака груди, а также
БИОХИМИЯ том 85 вып. 4 2020
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ ДНК И КАНЦЕРОГЕНЕЗ
499
продемонстрировано их влияние на частоту ра
повреждающим ДНК [87-89]. Предполагается,
ка легких (Table S1 Приложения). Соматические
что примерно 50% всех спонтанных мутаций за
мутации гена POLK были обнаружены у 28% па
висит от Pol ζ [90].
циентов с раком простаты (Table S1 Приложе
Нарушение функций Pol ζ в организме свя
ния). Многие полиморфизмы были охарактери
зано с канцерогенезом [24, 25]. Тканеспецифич
зованы биохимически. Подробнее о полимор
ный кондиционный нокаут гена Rev3l у мышей в
физмах POLK написано в обзоре [55].
клетках эпидермиса приводит к хромосомной
нестабильности, высокой частоте развития рака
кожи и нарушению способности тканей к реге
Pol ζ
нерации [25]. Снижение уровня экспрессии ге
на REV3L у человека, вероятно, связано с повы
Pol ζ является единственной ДНКП челове
шенным риском развития карциномы прямой
ка, полноразмерный комплекс которой не выде
кишки [91]. Полиморфизмы REV3L влияют на
лен. Многосубъединичный комплекс Pol ζ чело
риск развития рака легких, груди, толстой и
века, содержащий протяженную делецию ката
прямой кишки, а также связаны с негативным
литической субъединицы REV3, был выделен и
прогнозом заболеваний (Table S1 Приложения).
охарактеризован в работе [14]. Показано, что
Pol ζ в кооперации с Pol η очень эффективно
осуществляют синтез напротив внутринитевых
REV1
цисплатиновых сшивок [14]. Намного больше
известно о свойствах Pol ζ Saccharomyces cerevisiae.
REV1 играет важную структурную и регуля
С использованием дрожжевого фермента пока
торную роли при сборке транслесомы. REV1 од
зано, что in vitro Pol ζ осуществляет эффектив
новременно содержит сайты связывания с
ный транслезионный синтез в кооперации с
ДНКП Y семейства Pol ι, Pol η, Pol κ (через RIR
Pol ι, Pol η и Pol κ человека для эффективной
мотив) и несколькими субъединицами Pol ζ
репликации напротив разных типов поврежде
[91-95]. REV1 также взаимодействует с неубик
ний ДНК [3]. Кроме того, Pol ζ может включать
витинированным и моноубиквитинированным
нуклеотиды напротив ряда повреждений в каче
фактором процессивности PCNA [96, 97]. Нали
стве «ДНК инсертера». Например, Pol ζ являет
чие множества сайтов связывания с ДНКП и
ся основной ДНКП, осуществляющей высоко
факторами репликации позволяет координиро
мутагенный транслезионный синтез напротив
вать работу ферментов репликации и своевре
аддуктов, образующихся под влиянием канце
менно обеспечивать переключение синтеза с
рогенов афлатоксина B1 [78, 79] и аристолохие
высокоточных ДНКП на транслезионные
вой кислоты [80], которые могут попадать в ор
ДНКП и с ДНКП «инсертера» Y семейства на
ганизм с зараженными продуктами питания или
процессивную Pol ζ. Таким образом, REV1 явля
травяными сборами, используемыми в народ
ется ключевым регулятором репликации по
ной медицине [81]. Мутагенез, вызванный эти
врежденной ДНК.
ми агентами, является причиной развития опу
REV1 обладает также слабой ДНК полиме
холей печени и мочевого пузыря соответственно
разной активностью и преимущеcтвенно вклю
[82, 83]. Особенностью Pol ζ является генерация
чает dCМP напротив неповрежденных матрич
тандемных мутаций и мисмэтчей при синтезе на
ных нуклеотидов, АП сайтов и N2 аддуктов гуа
неповрежденной ДНК, а наиболее часто встре
нина [98-100]. REV1 осуществляет C>G/G>C
чающимися заменами Pol ζ in vivo являются
трансверсии в ходе СГМ при созревании имму
трансверсии G>C, G>T, G>A и T>A [3, 84].
ноглобулинов в В лимфоцитах [20], но, возмож
Pol ζ занимает исключительно важную роль
но, также вовлечен в немишенный мутагенез и в
в репликации поврежденной ДНК. В отличие от
других клетках и органах (роль REV1 в СГМ
ДНКП Y семейства, функции которых взаимо
подробнее будет рассмотрена в следующем раз
заменяемы, потеря каталитической активности
деле). Повышенный уровень экспрессии Rev1 у
Pol ζ у мышей приводит к эмбриональной гибе
мышей, подвергшихся воздействию N метил N
ли, что указывает на роль Pol ζ в репликации
нитрозомочевины, вызывает REV1 зависимый
большого числа эндогенных повреждений ДНК
мутагенез и индуцирует аденомы кишечника
[85, 86]. Потеря функции REV3 у эмбрионов
[101].
мыши сопровождается накоплением разрывов
Подавление экспрессии REV1 с помощью
ДНК, хромосомной нестабильностью (трансло
рибозима резко снижает частоту мутаций, инду
кации и анеуплоидии), генерализованным p53
цированных УФ и бенз[а]пиреном в культуре
зависимым апоптозом, а клетки с мутациями
клеток [102, 103], а подавление Rev1 экспрессии
Rev3l чрезвычайно чувствительны к агентам,
у мышей (доставка плазмиды для экспрессии ри
БИОХИМИЯ том 85 вып. 4 2020
500
ШИЛКИН и др.
бозима с помощью небулайзера) снижает часто
АП эндонуклеазой APE1 (MSH2/MSH6 неза
ту химически индуцированных опухолей легких
висимый синтез) [109].
[104]. Однако делеция С концевого BRCA1 по
Гипермутагенез происходит не только в
добного домена REV1 (делеция не нарушает ка
В лимфоцитах. Дезаминирование цитозинов в
талитическую активность, но приводит к потере
нелимфоидных тканях осуществляют AID и
ключевых белок-белковых взаимодействий в
цитидин дезаминазы APOBEC (APOBEC1,
реплисоме) приводит к снижению мутагенеза,
APOBEC3A, APOBEC3B, APOBEC3G). APOBEC
но более раннему появлению плоскоклеточных
опосредованное дезаминирование защищает
карцином кожи, индуцированных УФ [105].
клетки от вирусной инфекции, ингибируя реп
Полиморфизмы REV1 связаны с высоким
ликацию ретровирусов и обратную транскрип
риском развития ряда онкологических заболе
цию ретротранспозонов, а также дезаминирует
ваний. Аминокислотная замена N373S REV1 ас
остатки цитозинов в геномной ДНК, что может
социирована с высоким риском рака шейки
играть роль в мутагенезе и канцерогенезе (в том
матки, тогда как полиморфизм F257S
числе при хронической вирусной инфекции)
(rs3087386) связан со сниженным риском разви
[110-112]. Спектр мутаций, осуществляемый
тия рака шейки матки, но высоким риском раз
REV1 и Pol η при СГМ генов иммуноглобули
вития рака легких и простаты (Table S1 Прило
нов, совпадает со спектром мутаций во многих
жения). Биохимический анализ полиморфных
типах опухолей человека, что указывает на роль
вариантов REV1 показал, что вариант N373S об
немишенного мутагенеза, индуцированного ци
ладает повышенной каталитической актив
тидин дезаминазами AID/APOBEC и REV1/Pol
ностью при включении dCМP напротив непов
η, в канцерогенезе [26, 29, 112]. Например, с
режденного G и АП сайтов (Table S1 Приложе
действием цитидин дезаминаз и REV1 связыва
ния). Для полиморфизмов rs6761390 и rs3792142
ют обнаруженные в опухолях паттерны мутаций
REV1, которые находятся в промоторной облас
#2 и #13, для которых характерны замены C>T и
ти и интроне 5 соответственно, показана связь с
C>G [26, 112]. Предполагается, что C>T транзи
размером опухоли и стадией заболевания при
ции образуются в результате включения dАMP
раке груди (Table S1 Приложения).
напротив урацила (любыми ДНКП), тогда как
C>G трансверсии образуются при включении
REV1 dCMP напротив АП сайта после удаления
ДНК)ПОЛИМЕРАЗЫ И ГИПЕРМУТАГЕНЕЗ
урацила UNG2 [112]. AID преимущественно де
заминирует цитозин в мотиве WRC (W = A/T,
Дезаминирование цитозина цитидин деза
R = A/G), APOBEC3G - в мотиве CCC, а
миназой AID и последующее удаление урацила с
APOBEC1, APOBEC3A и APOBEC3B - в мотиве
образованием АП сайтов играют ключевую
TC [112]. Предположительно, Pol η осуществля
роль в мутагенезе вариабельных областей генов
ет А>G/T>C мутации в мотивах WA (W = A/T) в
иммуноглобулинов в В лимфоцитах млекопита
ходе неканонической MMP в активно транскри
ющих [106]. Мутации образуются преимущест
бируемых генах [29].
венно в мотивах WRCY и WA (W = A/T, R =
A/G, Y = C/T) несколькими способами: при
включении dAMP напротив урацила, высоко
РЕПЛИКАЦИЯ ПОВРЕЖДЕННОЙ ДНК
ошибочном транслезионном синтезе напротив
ПРАЙМАЗОЙ-ПОЛИМЕРАЗОЙ PRIMPOL
АП сайтов после удаления урацила урацил
ДНК гликозилазой UNG2, в ходе ЭРО и нека
Кроме транслезионного синтеза в клетках су
нонической мисмэтч репарации (ММР) [106].
ществуют и другие механизмы, обеспечивающие
REV1 осуществляет G>C/C>G трансверсии
толерантность клеток к повреждениям ДНК. В
при СГМ в ходе транслезионного синтеза,
2013 г. была впервые описана праймаза полиме
включая dCМP напротив АП сайтов, образо
раза человека PrimPol [113, 114]. PrimPol обнару
ванных UNG2 [20]. Pol η осуществляет СГМ в
жена в ядре и митохондриях и обладает одновре
А Т парах. Pol η преимущественно ведет высоко
менно ДНК праймазной и ДНК полимеразной
ошибочный синтез в ходе неканонической
активностями [113]. PrimPol играет роль в защи
ММР репарации, индуцируя А>G/T>C мутации
те клеток от многих повреждений ДНК. Предпо
при застраивании бреши, которую образует эк
лагается, что PrimPol осуществляет реинициа
зонуклеаза EXO1 после распознавания мисмэт
цию репликации после повреждений c помощью
ча U G комплексом MSH2/MSH6 [107, 108].
ДНК праймазной активности [115-117]. В этом
Кроме того, Pol η вносит мутации в А Т парах в
случае одноцепочечный участок с повреждением
ходе длиннозаплаточного пути ЭРО после уда
должен быть в дальнейшем репарирован. Кроме
ления урацила UNG2 и расщепления АП сайта
способности синтезировать ДНК de novo PrimPol
БИОХИМИЯ том 85 вып. 4 2020
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ ДНК И КАНЦЕРОГЕНЕЗ
501
обладает также транслезионной активностью in
Транслезионные ДНКП играют важную роль
vitro и эффективно «проходит» ряд распростра
в обеспечении генетической стабильности, од
ненных повреждений ДНК, таких как 8 oxo G,
нако, защищая клетки от повреждений ДНК,
формилурацил, АП сайт [113, 118].
они сами являются источником мутаций в орга
Было высказано предположение о том, что
низме. Накапливается все больше данных о вов
PrimPol проявляет антимутагенную роль в СГМ
леченности высоко ошибочных транслезионных
генов иммуноглобулинов и может нейтрализо
ДНКП не только в процессы канцерогенеза, но
вать мутагенную активность цитидин дезами
и в развитие резистентности опухолей к препа
наз, снижая частоту C>G трансверсий в лиди
ратам химиотерапии. Конкретные механизмы
рующей цепи [116]. Антимутагенная актив
индукции мутагенеза и канцерогенеза, связан
ность PrimPol предполагает защитную роль в
ные с нарушением функций транслезионных
развитии онкологических заболеваний. Деле
ДНКП или их неконтролируемой активности,
ции PRIMPOL часто встречаются у пациентов с
недостаточно ясны. Исследования клеток и жи
инвазивным раком груди, а количество точеч
вотных с нокаутом генов ДНКП и сопоставление
ных мутаций в опухолях с делецией PRIMPOL
паттернов мутаций у онкологических пациентов
почти в два раза больше, чем опухолях без деле
и модельных объектов (с использованием пос
ций
[116].
PrimPol снижает частоту
ледних достижений в области секвенирования
APOBEC3B индуцированных мутаций, выз
генома и биоинформатики) являются важными
ванных дезаминированием цитозина в TpC
направлениями дальнейших исследований.
сайтах, в инвазивных опухолях груди [116].
Предполагается, что ре инициация синтеза
ДНК после АП сайтов с помощью PrimPol ог
Финансирование. Работа поддержана гранта
раничивает высоко ошибочный транслезион
ми: 1) разделы по ДНКП Y семейства: РФФИ
ный синтез напротив АП сайтов и стимулирует
комфи 17 00 00264 (АВМ), РФФИ Бел а 18 54
переключение на более точный механизм толе
00024 (АВМ) и БРФФИ Б18Р 094 (МПС),
рантности к повреждениям с участием гомоло
2) раздел по PrimPol: РНФ 18 14 00354 (АВМ).
гичной рекомбинации [116]. Схожий механизм
Конфликт интересов. Авторы заявляют об от
с участием PrimPol может играть роль в сниже
сутствии у них конфликта интересов.
нии мутагенного потенциала крупных аддук
Соблюдение этических норм. Статья не содер
тов. Показано, что PrimPol необходима для го
жит исследований, в которых участвовали люди,
мологичной рекомбинации фотопродуктов и
и экспериментов, выполненных с использова
аддуктов бенз[а]пирена [119].
нием животных.
СПИСОК ЛИТЕРАТУРЫ
1.
Loeb, L. A., Loeb, K. R., and Anderson, J. P. (2003)
8. Kunkel, T. A. (2009) Evolving views of DNA replication
Multiple mutations and cancer, Proc. Natl. Acad. Sci. USA,
(in)fidelity, Cold Spring Harb. Symp. Quant. Biol., 74, 91
100, 776 781, doi: 10.1073/pnas.0334858100.
101, doi: 10.1101/sqb.2009.74.027.
2.
Игнатов А. В., Бондаренко К. А., Макарова А. В.
9. Yang, K., Weinacht, C. P., and Zhuang, Z.
(2013)
(2017) Пути образования, репарации и репликации
Regulatory role of ubiquitin in eukaryotic DNA translesion
необъемных повреждений у человека, Acta Naturae, 9,
synthesis, Biochemistry, 52, 32173228, doi: 10.1021/
45 60.
bi400194r.
3.
Makarova, A. V., and Burgers, P. M. (2015) Eukaryotic
10. Matsuda, T., Bebenek, K., Masutani, C., Hanaoka, F., and
DNA polymerase ζ, DNA Repair (Amst), 29, 47 55,
Kunkel, T. A. (2000) Low fidelity DNA synthesis by human
doi: 10.1016/j.dnarep.2015.02.012.
DNA polymerase eta, Nature,
404,
10111013,
4.
Rizzo, A. A., and Korzhnev, D. M. (2019) The Rev1 Pol ζ
doi: 10.1038/35010014.
translesion synthesis mutasome: Structure, interactions
11. Ohashi, E., Bebenek, K., Matsuda, T., Feaver, W. J.,
and inhibition, Enzymes, 45, 139 181, doi: 10.1016/bs.enz.
Gerlach, V. L., Friedberg, E. C., Ohmori, H., and
2019.07.001.
Kunkel, T. A. (2000) Fidelity and processivity of DNA syn
5.
Sale, J. E., Lehmann, A. R., and Woodgate, R. (2012) Y
thesis by DNA polymerase kappa, the product of the
family DNA polymerases and their role in tolerance of cel
human DINB1 gene, J. Biol. Chem., 275, 39678 39684,
lular DNA damage, Nat. Rev. Mol. Cell. Biol., 13, 141 152,
doi: 10.1074/jbc. M005309200.
doi: 10.1038/nrm3289.
12. Tissier, A., McDonald, J. P., Frank, E. G., and Woodgate,
6.
Yang, W., and Woodgate, R. (2007) What a difference a
R. (2000) Poliota, a remarkably error prone human DNA
decade makes: insights into translesion DNA synthesis,
polymerase, Genes Dev., 14, 1642 1650.
Proc. Natl. Acad. Sci. USA,
104,
1559115598,
13. Baranovskiy, A. G., Lada, A. G., Siebler, H. M., Zhang, Y.,
doi: 10.1073/pnas.0704219104.
Pavlov, Y. I., and Tahirov, T. H. (2012) DNA polymerase δ
7.
Burgers, P. M. J., and Kunkel, T. A. (2017) Eukaryotic
and ζ switch by sharing accessory subunits of DNA poly
DNA replication fork, Annu. Rev. Biochem., 86, 417 438,
merase δ, J. Biol. Chem., 287, 17281 17287, doi: 10.1074/
doi: 10.1146/annurev biochem 061516 044709.
jbc.M112.351122.
БИОХИМИЯ том 85 вып. 4 2020
502
ШИЛКИН и др.
14.
Lee, Y. S., Gregory, M. T., and Yang, W. (2014) Human Pol
human DNA polymerase η mediated chemoresistance to
ζ purified with accessory subunits is active in translesion
cisplatin, Proc. Natl. Acad. Sci. USA, 109, 7269 7274,
DNA synthesis and complements Pol η in cisplatin bypass,
doi: 10.1073/pnas.1202681109.
Proc. Natl. Acad. Sci. USA, 111, 2954 2959, doi: 10.1073/
28.
Lin, Q., Clark, A. B., McCulloch, S. D., Yuan, T.,
pnas.1324001111.
Bronson, R. T., Kunkel, T. A., and Kucherlapati, R. (2006)
15.
Makarova, A. V., Stodola, J. L., and Burgers, P. M. (2012)
Increased susceptibility to UV induced skin carcinogenesis
A four subunit DNA polymerase ζ complex containing Pol
in polymerase eta deficient mice, Cancer Res., 66, 87 94,
δ accessory subunits is essential for PCNA mediated muta
doi: 10.1158/0008 5472.CAN 05 1862.
genesis, Nucleic Acids Res., 40, 11618 11626, doi: 10.1093/
29.
Supek, F., and Lehner, B. (2017) Clustered mutation sig
nar/gks948.
natures reveal that error prone DNA repair targets muta
16.
Rizzo, A. A., Vassel, F. M., Chatterjee, N., D’Souza, S.,
tions to active genes, Cell, 170, 534 547, doi: 10.1016/
Li, Y., Hao, B., Hemann, M. T., Walker, G. C., and
j.cell.2017.07.003.
Korzhnev, D. M. (2018) Rev7 dimerization is important
30.
Макарова А. В., Кульбачинский А. В. (2012) Структу
for assembly and function of the Rev1/Polζ translesion
ра ДНК полимеразы йота человека и механизм синте
synthesis complex, Proc. Natl. Acad. Sci. USA, 115, 8191
за ДНК, Биохимия,
22,
669685, doi:
10.1134/
8200, doi: 10.1073/pnas.1801149115.
S0006297912060016.
17.
Ogi, T., Limsirichaikul, S., Overmeer, R. M., Volker, M.,
31.
McIntyre, J. (2019) Polymerase iota - an odd sibling
Takenaka, K., Cloney, R., Nakazawa, Y., Niimi, A.,
among Y family polymerases, DNA Repair (Amst.), 86,
Miki, Y., Jaspers, N. G., Mullenders, L. H., Yamashita, S.,
102753, doi: 10.1016/j.dnarep.2019.102753.
Fousteri, M. I., and Lehmann, A. R. (2010) Three DNA
32.
Johnson, R.E., Prakash, L., and Prakash, S.
(2005)
polymerases, recruited by different mechanisms, carry out
Biochemical evidence for the requirement of Hoogsteen
NER repair synthesis in human cells, Mol. Cell, 37, 714
base pairing for replication by human DNA polymerase
727, doi: 10.1016/j.molcel.2010.02.009.
iota, Proc. Natl. Acad. Sci. USA, 102, 10466 10471, doi:
18.
Bebenek, K., Tissier, A., Frank, E. G., McDonald, J. P.,
10.1073/pnas.0503859102.
Prasad, R., Wilson, S. H., Woodgate, R., and Kunkel, T. A.
33.
Makarova, A. V., Ignatov, A., Miropolskaya, N., and
(2001) 5′ Deoxyribose phosphate lyase activity of human
Kulbachinskiy, A. (2014) Roles of the active site residues
DNA polymerase iota in vitro, Science, 291, 2156 2159,
and metal cofactors in noncanonical base pairing during
doi: 10.1126/science.1058386.
catalysis by human DNA polymerase iota, DNA Repair
19.
Prasad, R., Poltoratsky, V., Hou, E. W., and Wilson, S. H.
(Amst.), 22, 67 76, doi: 10.1016/j.dnarep.2014.07.006.
(2016) Rev1 is a base excision repair enzyme with 5′
34.
Makarova, A. V., Grabow, C., Gening, L. V., Tarantul, V. Z.,
deoxyribose phosphate lyase activity, Nucleic Acids Res.,
Tahirov, T. H., Bessho, T., and Pavlov, Y. I.
(2011)
44, 10824 10833, doi: 10.1093/nar/gkw869.
Inaccurate DNA synthesis in cell extracts of yeast produc
20.
Jansen, J. G., Langerak, P., Tsaalbi Shtylik, A., van den
ing active human DNA polymerase iota, PLoS One, 6,
Berk, P., Jacobs, H., and de Wind, N. (2006) Strand biased
16612, doi: 10.1371/journal.pone.0016612.
defect in C/G transversions in hypermutating
35.
Vaisman, A., and Woodgate, R. (2001) Unique misinser
immunoglobulin genes in Rev1 deficient mice, J. Exp.
tion specificity of poliota may decrease the mutagenic
Med., 203, 319 323, doi: 10.1084/jem.20052227.
potential of deaminated cytosines, EMBO J., 20, 6520
21.
Zeng, X., Winter, D. B., Kasmer, C., Kraemer, K. H.,
6529, doi: 10.1093/emboj/20.22.6520.
Lehmann, A. R., and Gearhart, P. J. (2001) DNA poly
36.
Kirouac, K. N., and Ling, H. (2009) Structural basis of
merase eta is an A T mutator in somatic hypermutation of
error prone replication and stalling at a thymine base by
immunoglobulin variable genes, Nat. Immunol., 2, 537
human DNA polymerase iota, EMBO J., 28, 1644 1654,
541, doi: 10.1038/88740.
doi: 10.1038/emboj.2009.122.
22.
Rogozin, I. B., Pavlov, Y. I., Bebenek, K., Matsuda, T., and
37.
Iguchi, M., Osanai, M., Hayashi, Y., Koentgen, F., and
Kunkel, T. A. (2001) Somatic mutation hotspots correlate
Lee, G.H. (2014) The error prone DNA polymerase ι pro
with DNA polymerase eta error spectrum, Nat. Immunol.,
vides quantitative resistance to lung tumorigenesis and
2, 530 536.
mutagenesis in mice, Oncogene,
33,
36123617,
23.
Masutani, C., Kusumoto, R., Yamada, A., Dohmae, N.,
doi: 10.1038/onc.2013.331.
Yokoi, M., Yuasa, M., Araki, M., Iwai, S., Takio, K., and
38.
Lee, G. H., and Matsushita, H. (2005) Genetic linkage
Hanaoka, F. (1999) The XPV (xeroderma pigmentosum
between Pol iota deficiency and increased susceptibility to
variant) gene encodes human DNA polymerase eta,
lung tumors in mice, Cancer Sci.,
96,
256259,
Nature, 399, 700 704, doi: 10.1038/21447.
doi: 10.1111/j.1349 7006.2005.00042.x.
24.
Wittschieben, J. P., Patil, V., Glushets, V., Robinson, L. J.,
39.
Wang, M., Devereux, T. R., Vikis, H. G., McCulloch, S. D.,
Kusewitt, D. F., and Wood, R. D. (2010) Loss of DNA
Holliday, W., Anna, C., Wang, Y., Bebenek, K., Kunkel, T. A.,
polymerase zeta enhances spontaneous tumorigenesis,
Guan, K., and You, M. (2004) Pol iota is a candidate for
Cancer Res.,
70,
27702778, doi:
10.1158/0008
the mouse pulmonary adenoma resistance 2 locus, a major
5472.CAN 09 4267.
modifier of chemically induced lung neoplasia, Cancer
25.
Lange, S. S., Bedford, E., Reh, S., Wittschieben, J. P.,
Res., 64, 1924 1931, doi: 10.1158/0008 5472.can 03 3080.
Carbajal, S., Kusewitt, D. F., DiGiovanni, J., and Wood, R. D.
40.
Dumstorf, C. A., Clark, A. B., Lin, Q., Kissling, G. E.,
(2013) Dual role for mammalian DNA polymerase ζ in
Yuan, T., Kucherlapati, R., McGregor, W. G., and
maintaining genome stability and proliferative responses,
Kunkel, T. A. (2006) Participation of mouse DNA poly
Proc. Natl. Acad. Sci. USA, 110, 687 696, doi: 10.1073/
merase iota in strand biased mutagenic bypass of UV pho
pnas.1217425110.
toproducts and suppression of skin cancer, Proc. Natl.
26.
Alexandrov, L. B., Nik Zainai, S., Wedge, D. C.,
Acad. Sci. USA, 103, 18083 18088, doi: 10.1073/pnas.
Campbell, P. J., and Stratton, M. R. (2013) Signatures of
0605247103.
mutational processes in human cancer, Nature, 500, 415
41.
Ohkumo, T., Kondo, Y., Yokoi, M., Tsukamoto, T.,
421, doi: 10.1038/nature12477.
Yamada, A., Sugimoto, T., Kanao, R., Higashi, Y.,
27.
Zhao, Y., Biertümpfel, C., Gregory, M. T., Hua, Y. J.,
Kondoh, H., Tatematsu, M., Masutani, C., and Hanaoka, F.
Hanaoka, F., and Yang, W. (2012) Structural basis of
(2006) UV B radiation induces epithelial tumors in mice
БИОХИМИЯ том 85 вып. 4 2020
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ ДНК И КАНЦЕРОГЕНЕЗ
503
lacking DNA polymerase eta and mesenchymal tumors in
the expression of DNA polymerase iota in human tumor
mice deficient for DNA polymerase iota, Mol. Cell. Biol.,
cells, Biochem. Biophys. Res. Commun., 351, 306 311,
26, 7696 7706, doi: 10.1128/MCB.01076 06.
doi: 10.1016/j.bbrc.2006.10.048.
42.
Tomlins, S. A., Rhodes, D. R., Perner, S., Dhanasekaran, S.M.
55.
Stern, H. R., Sefcikova, J., Chaparro, V. E., and Beuning, P. J.
et al. (2005) Recurrent fusion of TMPRSS2 and ETS tran
(2019) Mammalian DNA polymerase kappa activity
scription factor genes in prostate cancer, Science, 310, 644
and specificity, Molecules,
24,
2805, doi:
10.3390/
648, doi: 10.1126/science.1117679.
molecules24152805.
43.
Bienko, M., Green, C. M., Crosetto, N., Rudolf, F.,
56.
Choi, J.Y., Angel, K.C., and Guengerich, F.P.
(2006)
Zapart, G., Coull, B., Kannouche, P., Wider, G., Peter, M.,
Translesion synthesis across bulky N2 alkyl guanine DNA
Lehmann, A. R., Hofmann, K., and Dikic, I. (2005)
adducts by human DNA polymerase kappa, J. Biol. Chem.,
Ubiquitin binding domains in Y family polymerases regu
281, 21062 21072, doi: 10.1074/jbc.M602246200.
late translesion synthesis, Science,
310,
18211824,
57.
Jha, V., Bian, C., Xing, G., and Ling, H. (2016) Structure
doi: 10.1126/science.1120615.
and mechanism of error free replication past the major
44.
Bomar, M. G., D’Souza, S., Bienko, M., Dikic, I.,
benzo[a]pyrene adduct by human DNA polymerase κ,
Walker, G. C., and Zhou, P. (2010) Unconventional ubiq
Nucleic Acids Res.,
44,
49574967, doi:
10.1093/
uitin recognition by the ubiquitin binding motif within the
nar/gkw204.
Y family DNA polymerases iota and Rev1, Mol. Cell, 37,
58.
Yasui, M., Dong, H., Bonala, R. R., Suzuki, N., Ohmori, H.,
408 417, doi: 10.1016/j.molcel.2009.12.038.
Hanaoka, F., Johnson, F., Grollman, A.P., and Shibutani,
45.
Wang, H., Wu, W., Wang, H.W., Wang, S., Chen, Y.,
S. (2004) Mutagenic properties of 3 (deoxyguanosin N2
Zhang, X., Yang, J., Zhao, S., Ding, H. F., and Lu, D.
yl) 2 acetylaminofluorene, a persistent acetylaminofluo
(2010) Analysis of specialized DNA polymerases expres
rene derived DNA adduct in mammalian cells,
sion in human gliomas: association with prognostic signifi
Biochemistry, 43, 15005 15013, doi: 10.1021/bi048279+.
cance, Neuro Oncol., 12, 679 686, doi: 10.1093/neuonc/
59.
Yuan, B., Cao, H., Jiang, Y., Hong, H., and Wang, Y.
nop074.
(2008) Efficient and accurate bypass of N2 (1 car
46.
Sun, H., Zou, S., Zhang, S., Liu, B., Meng, X., Li, X., Yu, J.,
boxyethyl) 2′ deoxyguanosine by DinB DNA polymerase
Wu, J., and Zhou, J. (2015) Elevated DNA polymerase iota
in vitro and in vivo, Proc. Natl. Acad. Sci. USA, 105, 8679
(poli) is involved in the acquisition of aggressive pheno
8684, doi: 10.1073/pnas.0711546105.
types of human esophageal squamous cell cancer, Int. J.
60.
Lee, B. M., and Shim, G. A. (2007) Dietary exposure esti
Clin. Exp. Pathol., 8, 3591 3601.
mation of benzo[a]pyrene and cancer risk assessment, J.
47.
Zhou, J., Zhang, S., Xie, L., Liu, P., Xie, F., Wu, J., Cao, J.,
Toxicol. Env. Heal. A, 70, 13911394, doi: 10.1080/
and Ding, W.Q. (2012) Overexpression of DNA poly
15287390701434182.
merase iota (Polι) in esophageal squamous cell carcinoma,
61.
Hecht, S. S. (1999) Tobacco smoke carcinogens and lung
Cancer Sci.,
103,
15741579, doi:
10.1111/j.1349
cancer, J. Natl. Cancer Inst., 91, 1194 1210, doi: 10.1093/
7006.2012.02309.x.
jnci/91.14.1194.
48.
Zou, S., Shang, Z. F., Liu, B., Zhang, S., Wu, J., Huang, M.,
62.
Avkin, S., Goldsmith, M., Velasco Miguel, S., Geacintov, N.,
Ding, W.Q., and Zhou, J. (2016) DNA polymerase iota
Friedberg, E. C., and Livneh, Z. (2004) Quantitative
(Pol ι) promotes invasion and metastasis of esophageal
analysis of translesion DNA synthesis across a
squamous cell carcinoma, Oncotarget, 7, 32274 32285,
benzo[a]pyrene guanine adduct in mammalian cells: the
doi: 10.18632/oncotarget.8580.
role of DNA polymerase kappa, J. Biol. Chem., 279, 53298
49.
Yang, J., Chen, Z., Liu, Y., Hickey, R. J., and Malkas, L. H.
53305, doi: 10.1074/jbc.M409155200.
(2004) Altered DNA polymerase iota expression in breast
63.
Ogi, T., Shinkai, Y., Tanaka, K., and Ohmori, H. (2002)
cancer cells leads to a reduction in DNA replication fideli
Polkappa protects mammalian cells against the lethal and
ty and a higher rate of mutagenesis, Cancer Res., 64, 5597
mutagenic effects of benzo[a]pyrene, Proc. Natl. Acad. Sci.
5507, doi: 10.1158/0008 5472.CAN 04 0603.
USA, 99, 15548 15553, doi: 10.1073/pnas.222377899.
50.
Yuan, F., Xu, Z., Yang, M., Wei, Q., Zhang, Y., Yu, J., Zhi, Y.,
64.
Kanemaru, Y., Suzuki, T., Niimi, N., Gruz, P.,
Liu, Y., Chen, Z., and Yang, J. (2013) Overexpressed DNA
Matsumoto, K., Adachi, N., Honma, M., and Nohmi, T.
polymerase iota regulated by JNK/c Jun contributes to
(2015) Catalytic and non catalytic roles of DNA poly
hypermutagenesis in bladder cancer, PLoS One, 8, 69317,
merase κ in the protection of human cells against genotox
doi: 10.1371/journal.pone.0069317.
ic stresses, Environ. Mol. Mutagen.,
56,
650662,
51.
He, C., Wu, S., Gao, A., Su, Y., Min, H., Shang, Z. F.,
doi: 10.1002/em.21961.
Wu, J., Yang, L., Ding, W.Q., and Zhou, J. (2017)
65.
Hakura, A., Sui, H., Sonoda, J., Matsuda, T., and Nohmi, T.
Phosphorylation of ETS 1 is a critical event in DNA poly
(2019) DNA polymerase kappa counteracts inflammation
merase iota induced invasion and metastasis of esophageal
induced mutagenesis in multiple organs of mice, Environ.
squamous cell carcinoma, Cancer Sci., 108, 2503 2510,
Mol. Mutagen., 60, 320 330, doi: 10.1002/em.22272.
doi: 10.1111/cas.13399.
66.
Ho, T. V., Guainazzi, A., Derkunt, S. B., Enoiu, M., and
52.
Li, L., Tian, H., Cheng, C., Li, S., Ming, L., and Qi, L.
Scharer, O. D. (2011) Structure dependent bypass of DNA
(2018) siRNA of DNA polymerase iota inhibits the migra
interstrand crosslinks by translesion synthesis polymerases,
tion and invasion in the lung cancer cell A549, Acta
Nucleic Acids Res.,
39,
74557464, doi:
10.1093/
Biochim. Biophys. Sin. (Shanghai),
50,
929933,
nar/gkr448.
doi: 10.1093/abbs/gmy089.
67.
Jha, V., and Ling, H. (2018) Structural basis for human
53.
Zou, S., Xu, Y., Chen, X., He, C., Gao, A., Zhou, J., and
DNA polymerase kappa to bypass cisplatin intrastrand
Chen, Y. (2019) DNA polymerase iota (Pol ι) promotes the
cross link (Pt GG) lesion as an efficient and accurate
migration and invasion of breast cancer cell via EGFR
extender, J. Mol. Biol., 430, 1577 1589, doi: 10.1016/j.jmb.
ERK mediated epithelial to mesenchymal transition,
2018.04.023.
Cancer Biomarkers, 24, 363370, doi: 10.3233/CBM
68.
Kanemaru, Y., Suzuki, T., Sassa, A., Matsumoto, K.,
181516.
Adachi, N., Honma, M., Numazawa, S., and Nohmi, T.
54.
Ito, A., Koshikawa, N., Mochizuki, S., Omura, K., and
(2017) DNA polymerase kappa protects human cells
Takenaga, K. (2006) Hypoxia inducible factor 1 mediates
against MMC induced genotoxicity through error free
БИОХИМИЯ том 85 вып. 4 2020
504
ШИЛКИН и др.
translesion DNA synthesis, Genes Environ.,
39,
6,
82.
Wu, H. C., and Santella, R. (2012) The role of aflatoxins in
doi: 10.1186/s41021 016 0067 3.
hepatocellular carcinoma, Hepat. Mon.,
12,
7238,
69.
Williams, H. L., Gottesman, M. E., and Gautier, J. (2012)
doi: 10.5812/hepatmon.7238.
Replication independent repair of DNA interstrand
83.
Chen, C. H., Dickman, K. G., Moriya, M., Zavadil, J.,
crosslinks, Mol. Cell, 47, 140 147, doi: 10.1016/j.molcel.
Sidorenko, V. S., Edwards, K. L., Gnatenko, D. V., Wu, L.,
2012.05.001.
Turesky, R. J., Wu, X. R., Pu, Y. S., and Grollman, A. P.
70.
Zhuo, M., Gorgun, M. F., and Englander, E. W. (2017)
(2012) Aristolochic acid associated urothelial cancer in
Translesion synthesis DNA polymerase kappa is indispens
Taiwan, Proc. Natl. Acad. Sci. USA, 109, 8241 8246,
able for DNA repair synthesis in cisplatin exposed dorsal
doi: 10.1073/pnas.1119920109.
root ganglion neurons, Mol. Neurobiol., 55, 2506 2515,
84.
Kochenova, O. V., Bezalel Buch, R., Tran, P., Makarova, A. V.,
doi: 10.1007/s12035 017 0507 5.
Chabes, A., Burgers, P. M., and Shcherbakova, P. V. (2017)
71.
Lemée, F., Bavoux, C., Pillaire, M. J., Bieth, A.,
Yeast DNA polymerase ζ maintains consistent activity and
Machado, C. R., Pena, S. D., Guimbaud, R., Selves, J.,
mutagenicity across a wide range of physiological dNTP
Hoffmann, J. S., and Cazaux, C. (2007) Characterization
concentrations, Nucleic Acids Res.,
45,
12001218,
of promoter regulatory elements involved in downexpres
doi: 10.1093/nar/gkw1149.
sion of the DNA polymerase kappa in colorectal cancer,
85.
Esposito, G., Godindagger, I., Klein, U., Yaspo, M.L.,
Oncogene, 26, 3387 3394.
Cumano, A., and Rajewsky, K. (2000) Disruption of the
72.
Pan, Q., Fang, Y., Xu, Y., Zhang, K., and Hu, X. (2005)
Rev3l encoded catalytic subunit of polymerase zeta in
Down regulation of DNA polymerases kappa, eta, iota, and
mice results in early embryonic lethality, Curr. Biol., 10,
zeta in human lung, stomach, and colorectal cancers, Cancer
1221 1224, doi: 10.1016/s0960 9822(00)00726 0.
Lett., 217, 139 147, doi: 10.1016/j.canlet.2004.07.021.
86.
Wittschieben, J., Shivji, M. K., Lalani, E., Jacobs, M. A.,
73.
Ogi, T., Kato, T. Jr., Kato, T., and Ohmori, H. (1999)
Marini, F., Gearhart, P. J., Rosewell, I., Stamp, G., and
Mutation enhancement by DINB1, a mammalian homo
Wood, R. D. (2000) Disruption of the developmentally reg
logue of the Escherichia coli mutagenesis protein din B,
ulated Rev3l gene causes embryonic lethality, Curr. Biol.,
Genes Cells,
4,
607618, doi:
10.1046/j.1365 2443.
10, 1217 1220, doi: 10.1016/s0960 9822(00)00725 9.
1999.00289.x.
87.
Van Sloun, P. P., Varlet, I., Sonneveld, E., Boei, J. J.,
74.
Bergoglio, V., Bavoux, C., Verbiest, V., Hoffmann, J. S.,
Romeijn, R. J., Eeken, J. C., and De Wind, N. (2002)
and Cazaux, C. (2002) Localisation of human DNA poly
Involvement of mouse Rev3 in tolerance of endogenous
merase kappa to replication foci, J. Cell Sci., 115, 4413
and exogenous DNA damage, Mol. Cell Biol., 22, 2159
4418, doi: 10.1242/jcs.00162.
2169, doi: 10.1128/mcb.22.7.2159 2169.2002.
75.
Bavoux, C., Leopoldino, A. M., Bergoglio, V., O Wang, J.,
88.
Zander, L., and Bemark, M. (2004) Immortalized mouse
Ogi, T., Bieth, A., Judde, J. G., Pena, S. D., Poupon, M. F.,
cell lines that lack a functional Rev3 gene are hypersensi
Helleday, T., Tagawa, M., Machado, C., Hoffmann, J. S.,
tive to UV irradiation and cisplatin treatment, DNA
and Cazaux, C. (2005) Up regulation of the error prone
Repair (Amst.), 3, 743 752, doi: 10.1016/j.dnarep.2004.
DNA polymerase {kappa} promotes pleiotropic genetic
03.031.
alterations and tumorigenesis, Cancer Res., 65, 325 330.
89.
Wittschieben, J. P., Reshmi, S. C., Gollin, S. M., and
76.
O Wang, J., Kawamura, K., Tada, Y., Ohmori, H.,
Wood, R. D. (2006) Loss of DNA polymerase zeta causes
Kimura, H., Sakiyama, S., and Tagawa, M. (2001) DNA
chromosomal instability in mammalian cells, Cancer Res.,
polymerase kappa, implicated in spontaneous and DNA
66, 134 142, doi: 10.1158/0008 5472.CAN 05 2982.
damage induced mutagenesis, is overexpressed in lung
90.
Harfe, B. D., and Robertson, S. (2000) DNA polymerase
cancer, Cancer Res., 61, 5366 5369.
zeta introduces multiple mutations when bypassing sponta
77.
Wang, Y., Seimiya, M., Kawamura, K., Yu, L., Ogi, T.,
neous DNA damage in Saccharomyces cerevisiae, Mol. Cell,
Takenaga, K., Shishikura, T., Nakagawara, A., Sakiyama, S.,
6, 1491 1499, doi: 10.1016/s1097 2765(00)00145 3.
Tagawa, M., and O Wang, J. (2004) Elevated expression of
91.
Brondello, J. M., Pillaire, M. J., Rodriguez, C., Gourraud, P. A.,
DNA polymerase kappa in human lung cancer is associat
Selves, J., Cazaux, C., and Piette, J. (2008) Novel evi
ed with p53 inactivation: negative regulation of POLK pro
dences for a tumor suppressor role of Rev3, the catalytic
moter activity by p53, Int. J. Oncol., 25, 161 165.
subunit of Pol zeta, Oncogene,
27,
60936101,
78.
Lin, Y. C., Li, L., Makarova, A. V., Burgers, P. M.,
doi: 10.1038/onc.2008.212.
Stone, M. P., and Lloyd, R. S. (2014) Molecular basis of
92.
Guo, C., Fischhaber, P. L., Luk Paszyc, M. J., Masuda, Y.,
aflatoxin induced mutagenesis role of the aflatoxin B1
Zhou, J., Kamiya, K., Kisker, C., and Friedberg, E. C.
formamidopyrimidine adduct, Carcinogenesis, 35, 1461
(2003) Mouse Rev1 protein interacts with multiple DNA
1468, doi: 10.1093/carcin/bgu003.
polymerases involved in translesion DNA synthesis, EMBO
79.
Lin, Y. C., Owen, N., Minko, I. G., Lange, S. S., Tomida, J.,
J., 22, 6621 6630, doi: 10.1093/emboj/cdg626.
Li, L., Stone, M. P., Wood, R. D., McCullough, A. K., and
93.
Ohashi, E., Hanafusa, T., Kamei, K., Song, I., Tomida, J.,
Lloyd, R. S. (2016) DNA polymerase ζ limits chromoso
Hashimoto, H., Vaziri, C., and Ohmori, H.
(2009)
mal damage and promotes cell survival following aflatoxin
Identification of a novel REV1 interacting motif necessary
exposure, Proc. Natl. Acad. Sci. USA, 113, 13774 13779,
for DNA polymerase kappa function, Genes Cells, 14, 101
doi: 10.1073/pnas.1609024113.
111, doi: 10.1111/j.1365 2443.2008.01255.x.
80.
Hashimoto, K., Bonala, R., Johnson, F., Grollman, A. P.,
94.
Pustovalova, Y., Bezsonova, I., and Korzhnev, D. M.
and Moriya, M. (2016) Y family DNA polymerase inde
(2012) The C terminal domain of human Rev1 contains
pendent gap filling translesion synthesis across aristolochic
independent binding sites for DNA polymerase η and Rev7
acid derived adenine adducts in mouse cells, DNA Repair
subunit of polymerase ζ, FEBS Lett., 586, 3051 3056,
(Amst), 46, 55 60, doi: 10.1016/j.dnarep.2016.07.003.
doi: 10.1016/j.febslet.2012.07.021.
81.
Stegelmeier, B. L., Brown, A. W., and Welch, K. D. (2015)
95.
Pustovalova, Y., Magalhães, M. T., D’Souza, S., Rizzo, A. A.,
Safety concerns of herbal products and traditional Chinese
Korza, G., Walker, G. C., and Korzhnev, D. M. (2016)
herbal medicines: dehydropyrrolizidine alkaloids and aris
Interaction between the Rev1 C terminal domain and the
tolochic acid, J. Appl. Toxicol.,
35,
14331437,
PolD3 subunit of Polζ suggests a mechanism of polymerase
doi: 10.1002/jat.3192.
exchange upon Rev1/Polζ dependent translesion synthe
БИОХИМИЯ том 85 вып. 4 2020
ТРАНСЛЕЗИОННЫЙ СИНТЕЗ ДНК И КАНЦЕРОГЕНЕЗ
505
sis, Biochemistry,
55,
20432053, doi:
10.1021/acs.
Gearhart, P. J. (2005) MSH2 MSH6 stimulates DNA
biochem.5b01282.
polymerase eta, suggesting a role for A:T mutations in anti
96. Guo, C., Sonoda, E., Tang, T. S., Parker, J. L., Bielen, A. B.,
body genes, J. Ex. Med., 201, 637 645, doi: 10.1084/
Takeda, S., Ulrich, H. D., and Friedberg, E. C. (2006)
jem.20042066.
REV1 protein interacts with PCNA: significance of the
108. Peńa Diaz, J., Bregenhorn, S., Ghodgaonkar, M.,
REV1 BRCT domain in vitro and in vivo, Mol. Cell, 23,
Follonier, C., Artola Borán, M., Castor, D., Lopes, M.,
265 271, doi: 10.1016/j.molcel.2006.05.038.
Sartori, A. A., and Jiricny, J. (2012) Noncanonical mis
97. Pustovalova, Y., Maciejewski, M. W., and Korzhnev, D. M.
match repair as a source of genomic instability in human
(2013) NMR mapping of PCNA interaction with transle
cells, Mol. Cell, 47, 669680, doi: 10.1016/j.molcel.
sion synthesis DNA polymerase Rev1 mediated by Rev1
2012.07.006.
BRCT domain, J. Mol. Biol.,
425,
30913105,
109. Delbos, F., Aoufouchi, S., Faili, A., Weill, J. C., and
doi: 10.1016/j.jmb.2013.05.029.
Reynaud, C. A. (2007) DNA Polymerase eta is the sole
98. Masuda, Y., and Kamiya, K. (2002) Biochemical proper
contributor of A/T modifications during immunoglobulin
ties of the human REV1 protein, FEBS Lett., 520, 88 92,
gene hypermutation in the mouse, J. Exp. Med., 204, 17
doi: 10.1016/s0014 5793(02)02773 4.
23, doi: 10.1084/jem.20062131.
99. Choi, J. Y., Lim, S., Kim, E. J., Jo, A., and Guengerich, F. P.
110. Burns, M. B., Temiz, N. A., and Harris, R. S. (2013)
(2010) Translesion synthesis across abasic lesions by
Evidence for APOBEC3B mutagenesis in multiple human
human B family and Y family DNA polymerases α, δ, η,
cancers, Nat. Genet., 45, 977 973, doi: 10.1038/ng.2701.
ι, κ, and REV1, J. Mol. Biol., 404, 34 44, doi: 10.1016/
111.
Koito, A., and Ikeda, T. (2013) Intrinsic immunity against
j.jmb.2010.09.015.
retrotransposons by APOBEC cytidine deaminases, Front.
100. Choi, J. Y., and Guengerich, F. P. (2008) Kinetic analysis
Microbiol., 4, 28, doi: 10.3389/fmicb.2013.00028.
of translesion synthesis opposite bulky N2 and O6 alkyl
112. Rogozin, I. B., Roche Lima, A., Lada, A. G., Belinky, F.,
guanine DNA adducts by human DNA polymerase REV1,
Sidorenko, I. A., Glazko, G. V., Babenko, V. N.,
J. Biol. Chem., 283, 2364523655, doi: 10.1074/jbc.
Cooper, D. N., and Pavlov, Y. I. (2019) Nucleotide weight
M801686200.
matrices reveal ubiquitous mutational footprints of
101. Sasatani, M., Xi, Y., Kajimura, J., Kawamura, T., Piao, J.,
AID/APOBEC deaminases in human cancer genomes,
Masuda, Y., Honda, H., Kubo, K., Mikamoto, T.,
Cancers (Basel), 11, 211, doi: 10.3390/cancers11020211.
Watanabe, H., Xu, Y., Kawai, H., Shimura, T., Noda, A.,
113. Garc a Gómez, S., Reyes, A., Mart nez Jiménez, M. I.,
Hamasaki, K., Kusunoki, Y., Zaharieva, E.K., and
Chocrón, E. S., Mourón, S., Terrados, G., Powell, C.,
Kamiya, K. (2017) Overexpression of Rev1 promotes the
Salido, E., Méndez, J., Holt, I. J., and Blanco, L. (2013)
development of carcinogen induced intestinal adenomas
PrimPol, an archaic primase/polymerase operating in
via accumulation of point mutation and suppression of
human cells, Mol. Cell, 52, 541 553, doi: 10.1016/j.mol
apoptosis proportionally to the Rev1 expression level,
cel.2013.09.025.
Carcinogenesis,
38,
570 578, doi:
10.1093/carcin/
114. Bianchi, J., Rudd, S. G., Jozwiakowski, S. K., Bailey, L. J.,
bgw208.
Soura, V., Taylor, E., Stevanovic, I., Green, A. J., Stracker,
102. Clark, D. R., Zacharias, W., Panaitescu, L., and
T. H., Lindsay, H. D., and Doherty, A. J. (2013) PrimPol
McGregor, W. G. (2003) Ribozyme mediated REV1 inhi
bypasses UV photoproducts during eukaryotic chromoso
bition reduces the frequency of UV induced mutations in
mal DNA replication, Mol. Cell,
52,
566573,
the human HPRT gene, Nucleic Acids Res., 31, 4981 4988,
doi: 10.1016/j.molcel.2013.10.035.
doi: 10.1093/nar/gkg725.
115. Mourón, S., Rodriguez Acebes, S., Mart nez Jiménez, M. I.,
103. Mukhopadhyay, S., Clark, D. R., Watson, N. B.,
Garc a Gómez, S., Chocrón, S., Blanco, L., and Méndez,
Zacharias, W., and McGregor, W. G. (2004) REV1 accu
J. (2013) Repriming of DNA synthesis at stalled replication
mulates in DNA damage induced nuclear foci in human
forks by human PrimPol, Nat. Struct. Mol. Biol., 20, 1383
cells and is implicated in mutagenesis by benzo[a]pyrene
1389, doi: 10.1038/nsmb.2719.
diolepoxide, Nucleic Acids Res.,
32,
58205826,
116. Pilzecker, B., Buoninfante, O. A., Pritchard, C.,
doi: 10.1093/nar/gkh903.
Blomberg, O. S., Huijbers, I. J., van den Berk, P. C., and
104. Dumstorf, C. A., Mukhopadhyay, S., Krishnan, E.,
Jacobs, H. (2016) PrimPol prevents APOBEC/AID family
Haribabu, B., and McGregor, W.G. (2009) REV1 is impli
mediated DNA mutagenesis, Nucleic Acids Res., 44, 4734
cated in the development of carcinogen induced lung can
4744, doi: 10.1093/nar/gkw123.
cer, Mol. Cancer Res., 7, 247 254, doi: 10.1158/1541 7786.
117. Kobayashi, K., Guilliam, T. A., Tsuda, M., Yamamoto, J.,
MCR 08 0399.
Bailey, L. J., Iwai, S., Takeda, S., Doherty, A. J., and
105. Tsaalbi Shtylik, A., Verspuy, J. W., Jansen, J. G., Rebel,
Hirota, K. (2016) Repriming by PrimPol is critical for
H., Carlée, L. M., van der Valk, M. A., Jonkers, J., de
DNA replication restart downstream of lesions and chain
Gruijl, F. R., and de Wind, N. (2009) Error prone transle
terminating nucleosides, Cell Cycle, 15, 19972008,
sion replication of damaged DNA suppresses skin carcino
doi: 10.1080/15384101.2016.1191711.
genesis by controlling inflammatory hyperplasia, Proc.
118. Makarova, A. V., Boldinova, E. O., Belousova, E. A., and
Natl. Acad. Sci. USA, 106, 21836 21841, doi: 10.1073/
Lavrik, O. I. (2018) In vitro lesion bypass by human
pnas.0909507106.
PrimPol, DNA Repair (Amst), 70, 18 24, doi: 10.1016/
106. Pilzecker, B., and Jacobs, H. (2019) Mutating for good:
j.dnarep.2018.07.009.
DNA damage responses during somatic hypermutation,
119. Piberger, A. L., Walker, A. K., Morris, J. R., Bryant, H. E.,
Front. Immunol., 10, 438, doi: 10.3389/fimmu.2019.
and Petermann, E. (2019) PrimPol dependent single
00438.
stranded gap formation mediates homologous recombi
107. Wilson, T. M., Vaisman, A., Martomo, S. A., Sullivan, P.,
nation at bulky DNA adducts, bioRxiv, doi: 10.1101/
Lan, L., Hanaoka, F., Yasui, A., Woodgate, R., and
773242.
4 БИОХИМИЯ том 85 вып. 4 2020
506
ШИЛКИН и др.
TRANSLESION DNA SYNTHESIS AND CARCINOGENESIS*
Review
Е. S. Shilkin1, Е. О. Boldinova1, A. D. Stolyarenko1, R. I. Goncharova2,
R. N. Chuprov)Netochin3, R. F. Khairullin4, М. P. Smal2**, and A. V. Makarova1**
1 Institute of Molecular Genetics of Russian Academy of Sciences,
123182 Moscow, Russia; E"mail: amakarova"img@yandex.ru
2 Institute of Genetics and Cytology of the National Academy of Sciences of Belarus,
220072 Minsk, Republic of Belarus; E"mail: m.smal@igc.by
3 Moscow Institute of Physics and Technology, 141701 Dolgoprudny, Moscow Region, Russia
4 Institute of Fundamental Medicine and Biology, Kazan (Volga Region) Federal University, 420012 Kazan, Russia
Received December 4, 2019
Revised February 20, 2020
Accepted February 20, 2020
Tens of thousands of DNA lesions are formed in mammalian cells each day. DNA translesion synthesis (TLS) is the
main mechanism of tolerance to unrepaired DNA lesions in cells. DNA polymerases iota (Pol ι), eta (Pol η), kappa
(Pol κ) and zeta (Pol ζ) possess an active site that is undemanding to the structure of DNA template and effectively
incorporate nucleotides opposite DNA lesions. However, they have low accuracy of DNA synthesis and are a source
of mutations in genomic DNA. Loss of these polymerases can lead to an increased risk of cancer.
Keywords: DNA translesion synthesis, DNA damage, mutagenesis, carcinogenesis
БИОХИМИЯ том 85 вып. 4 2020