БИОХИМИЯ, 2020, том 85, вып. 4, с. 507 - 520
УДК 577.032
ОБЗОР МЕХАНИЗМОВ ДЕЙСТВИЯ ЦИТОКИНА Tgfβ3
КАК ТЕРАПЕВТИЧЕСКОГО АГЕНТА ДЛЯ УВЕЛИЧЕНИЯ СИНТЕЗА
ВНЕКЛЕТОЧНОГО МАТРИКСА ГИАЛИНОВОГО ХРЯЩА
Обзор
© 2020
М.С. Божокин1,2*, Ю.В. Сопова3,4,5, Д.В. Качкин4,5, А.А. Рубель4,5, М.Г. Хотин2
1 Российский научно исследовательский институт травматологии и ортопедии им. Р.Р. Вредена,
195427 Санкт Петербург, Россия; электронная почта: writeback@mail.ru
2 Институт цитологии РАН, 194064 Санкт Петербург, Россия
3 Санкт Петербургский филиал Института общей генетики РАН, 199034 Санкт Петербург, Россия
4 Санкт Петербургский государственный университет,
биологический факультет, 199034 Санкт Петербург, Россия
5 Санкт Петербургский государственный университет, научная лаборатория биологии амилоидов,
199034 Санкт Петербург, Россия
Поступила в редакцию 04.01.2020
После доработки 26.02.2020
Принята к публикации 26.02.2020
Гиалиновый хрящ представляет собой аваскулярную соединительную ткань поверхности суставов, состоя
щую преимущественно из белков внеклеточного матрикса и небольшого количества высоко дифференци
рованных клеток - хондроцитов. В настоящее время исследуются различные методики восстановления
повреждённой суставной поверхности, например, с использованием модифицированной клеточной культу
ры и биодеградируемого скаффолда. Активно изучаются молекулярные процессы, связанные с пролифера
цией хрящевой ткани. Одним из важнейших белков среди цитокинов и факторов роста, влияющих на хонд
рогенез, является белок Tgfβ3, который выполняет критическую роль для нормальной пролиферации хря
щевой ткани. Взаимодействуя с лигандами на поверхности клеточной мембраны, он запускает каскад моле
кулярных механизмов с участием транскрипционного фактора Sox9. В данном обзоре рассмотрено действие
данного цитокина на активацию рецепторного комплекса и последующее внутриклеточное перемещение
связанных с этим Smad медиаторов. Также изложен анализ связи данных процессов с увеличением экспрес
сии основных генов внеклеточного матрикса, таких как col2a1 и acan.
КЛЮЧЕВЫЕ СЛОВА: Tgfβ3, механизм действия, гиалиновый хрящ, Smad белки, внеклеточный матрикс.
DOI: 10.31857/S0320972520040041
Гиалиновый хрящ - это аваскулярная соеди
щей массы) позволяет ему обратимо деформи
нительная ткань поверхности суставов, состоя
роваться и выдерживать большие механические
щая преимущественно из белков внеклеточного
нагрузки, а гладкая поверхность - осуществлять
матрикса и небольшого количества (~ 5% общей
сгибание сустава с минимальным трением [2].
массы) высокоспецифичных клеток - хондро
Однако способность хряща к регенерации весь
цитов [1].
ма ограничена, поэтому повреждения, возника
Основными белками внеклеточного матрик
ющие на его поверхности, быстро увеличивают
са являются коллаген II типа и аггрекан. Насы
ся с течением времени и ведут к дальнейшей
щенность гиалинового хряща водой (2/3 от об
деградации гиалинового слоя как в диаметре,
так и в глубину [3]. В результате дегенеративных
процессов, происходящих в нём, суставной
Принятые сокращения: КИК - клеточно инженер
ная конструкция; ММСК -мезенхимальные мультипоте
хрящ разрушается, что ведёт к нарушению
нтные стромальные клетки; GDF - факторы роста и диф
функции сустава, и, как следствие, к необходи
ференцировки; Tgfβ - трансформирующий фактор роста мости проведения процедуры эндопротезирова
β; Bmp - костный морфометрический белок; FSH - фол
ния. Наиболее часто такой процедуре подверга
ликулстимулирующий гормон; MIF - мюллеровский ин
ются самые нагружаемые суставы: коленный и
гибиторный фактор; SUM - small ubiquitin like modifier;
SARA - smad anchor for receptor activation; SBE - smad
тазобедренный [4].
binding element; Sp1 - specialprotein.
Количество оперативных вмешательств в об
* Адресат для корреспонденции.
ласти коленного сустава увеличивается из года в
507
4*
508
БОЖОКИН и др.
год из за разных факторов (травмы, заболева
КЛЕТОЧНАЯ ИНЖЕНЕРИЯ
ния, спортивные нагрузки и т.д.). В 2007 г. Kurtz
КАК ПЕРСПЕКТИВНАЯ ТЕХНОЛОГИЯ
спрогнозировал, что из за целого ряда факторов
ДЛЯ ВОССТАНОВЛЕНИЯ
(травмы, спортивные нагрузки, ожирениe, раз
ПОВРЕЖДЕННОЙ ПОВЕРХНОСТИ
личные заболевания, генетические предраспо
ГИАЛИНОВОГО ХРЯЩА
ложенности и др.) с 2007 по 2030 гг. количество
эндопротезирований только коленного сустава
Существует целый ряд причин возникнове
в США увеличится с 700 тыс. до 3,4 млн в год [5].
ния дефектов в коленных и тазобедренных сус
Несмотря на то, что современная хирургия рас
тавах: травмы, различные заболевания, избы
полагает большим количеством методик (нап
точный вес, чрезмерные нагрузки или генети
ример, хондропластика и микрофрактурирова
ческая предрасположенность [10]. Исследова
ние [4]), направленных на восстановление пов
ние проблемы восстановления повреждённой
реждённого гиалинового слоя, данная проблема
поверхности сустава началось ещё в XVIII в. В
в полном объеме до сих пор не решена.
1743 г. Вильям Хантер впервые отметил, что од
В 1987 г. Brittberg et al. [6] разработали прин
нажды повреждённый хрящ уже никогда не вос
ципиально новую методику по трансплантации
станавливался, а в 1853 г. Джеймс Рагет написал:
в область дефекта суставного хряща культуры
«Неизвестно ни единого случая, когда потерян
аутологичных хондроцитов, предварительно
ная часть хряща восстанавливалась новым, хо
культивируемой in vitro в течение некоторого
рошо сформированным хрящом» [1]. В середине
времени. В настоящее время данную техноло
XX в. исследователи предположили гипотезу,
гию существенно улучшили путем предвари
что из за аваскулярной природы хряща для его
тельной активации (модификации) клеток [7].
регенерации нужен доступ питательных веществ
На пролиферацию клеточной культуры влияют
и клеточных элементов в зону дефекта. Так, в
различными способами: добавляют факторы
1960 х гг. появилась технология субхондральной
роста, изменяют газовый состав смеси при куль
туннелизации и её модернизированная версия -
тивации, оказывают механическое воздействие,
микрофрактурирование [11]. Суть метода состо
осуществляют трансфекцию или трансдукцию
яла в том, что в зоне дефекта гиалинового хряща
клеток, направленную на изменение экспрес
создавались множественные отверстия («тунне
сии ключевых генов, влияющих на хондрогенез.
ли») в подлежащую субхондральную кость, че
Затем производят совмещение клеточной куль
рез которые мигрировали клетки костного моз
туры с биодеградируемым носителем (скаффол
га. Технология позволяла получить положитель
дом), и уже получившуюся клеточно инженер
ный результат, но лишь в краткосрочной перс
ную конструкцию (КИК) трансплантируют в
пективе, и с течением времени образовавшийся
область дефекта гиалинового хряща.
на месте первоначального повреждения регене
Для создания и успешного применения та
рат вновь деградировал. Несмотря на сущест
ких конструкций важно детальное понимание
венные недостатки, данная технология до сих
молекулярных механизмов, ответственных за
пор применяется в клинической практике во
регуляцию регенерации хрящевой ткани, чтобы
многих странах мира [1].
получившаяся КИК была устойчивой к механи
В 1994 г. группа шведских исследователей во
ческим нагрузкам. Главной задачей для получе
главе с Brittbergn M. предложила принципиаль
ния положительного эффекта от применения
но новую методику [6]. Суть данного метода
КИК в среднесрочной перспективе является
заключалась в том, что у пациента предвари
пролиферация клеточной культуры с формиро
тельно осуществляли забор аутологичных хонд
ванием гиалиноподобного регенерата в области
роцитов, далее проводили их культивирование
дефекта и отсутствие деградации транспланти
in vitro, и затем осуществляли трансплантацию
рованного объекта. В настоящее время уделяет
культуры клеток в область дефекта. Технологию
ся большое внимание анализу влияния действия
назвали ACI (autological chondrocyte implanta
различных факторов на клеточную культуру в
tion). Позже вместо культуры хондроцитов было
составе КИК, в том числе, цитокину Tgfβ3, иг
предложено использовать культуру мезенхи
рающему одну из ключевых ролей в пролифера
мальных мультипотентных стромальных клеток
ции клеток при хондрогенезе [8, 9].
(ММСК), индуцированных плюрипотентных
Данный обзор посвящён механизмам
стволовых клеток (iPSCs - induced pluripotent
действия Tgfβ3 на увеличение экспрессии генов
stem cells), а также клеток из других источников
основных белков внеклеточного матрикса (кол
[12] в сочетании с биодеградируемым носите
лагена II типа и аггрекана) и, как следствие, воз
лем. Так началась эпоха применения клеточно
можности его применения в ближайшем буду
инженерных конструкций для замещения де
щем в качестве терапевтического агента.
фектов гиалинового хряща. Применение такой
БИОХИМИЯ том 85 вып. 4 2020
ПРИНЦИПЫ ДЕЙСТВИЯ ЦИТОКИНА Tgfβ3
509
комбинации позволяло зафиксировать транс
имеющий ключевой значение при хондроген
плантируемую культуру клеток внутри области
ной пролиферации суставного хряща [21].
дефекта, и, тем самым, существенно уменьшить
Цитокин Tgfβ3 играет важнейшую роль в
миграцию клеток из зоны повреждения на на
формировании гиалинового хряща, пролифера
чальном этапе, а применение биодеградируемо
ции, регуляции синтеза основных компонентов
го полимера защищало клетки от значительных
внеклеточного матрикса, таких, как коллаген II
механических нагрузок непосредственно после
типа и аггрекан, а также способствует ингибиро
трансплантации. Уже в среднесрочной перспек
ванию ферментов, ответственных за деградацию
тиве были получены положительные результа
матрикса, например, коллагеназы 3, кодируе
ты, однако вскоре стало понятно, что на боль
мой геном MMP13 [22].
ших сроках регенерат снова подвергался дегра
История изучения белка Tgfβ3 насчитывает
дации [7]. Был сделан вывод, что, скорее всего,
более 40 лет, и в настоящее время данному белку
используемая клеточная культура (хондроцитов,
посвящено порядка 70 тыс. статей, согласно ба
ММСК или других клеток) не позволяла за ко
зе PubMed [23]. Многие белки, принимающие
роткое время создать регенерат, способный вы
участие в регуляции пролиферации клеток, из
полнять функции неповрежденного гиалиново
начально были названы «факторами роста», так
го хряща в полной мере [1].
как именно изменение пролиферации клеточ
Тогда возникло предложение предваритель
ной культуры было проще всего анализировать
но искусственно модифицировать используе
[24]. Именно на это обратили внимание в 1978 г.
мую культуру клеток с целью придания или уси
итальянские учёные Todaro и de Larko, которые
ления тех свойств, которые у неё первоначально
обнаружили, что клетки вирусно трансформи
отсутствовали для достижения лучшего терапев
рованной мышечной саркомы 3T3 продуциро
тического эффекта [1].
вали специальный «фактор», под влиянием ко
Потенциал для модификации клеточной
торого неопухолевые клетки почки крысы
культуры в настоящее время огромен. Однако
(NRK) приобретали неопластический фенотип
принципиальных групп методов модификации
[25]. Данный фактор назвали «sarcoma growth
клеточной культуры всего три:
factor» (SGF) и связали его активность со спо
1) физическое (механическое) воздействие -
собностью клеток расти на мягком агаре [26].
осуществляется с помощью электромагнитного
Было показано, что SGF на самом деле состоит
излучения, механического давления, изменения
из двух белков. Первый белок получил название
газовой среды и т.д. [13-16]. Данная процедура
«трансформирующий ростовой фактор альфа»
относительно проста в исполнении и экономи
(transforming growth factor α, TGF α). Этот бе
чески доступна, однако недостаточно эффек
лок стимулировал рост только маленьких коло
тивна. Её возможности по модификации кле
ний неопластических крысиных фибробластов.
точной культуры ограничены;
Второй белок, стимулировавший рост большего
2) химическое воздействие представляет со
количества крупных колоний, назвали «транс
бой добавление к культуре клеток различных
формирующий ростовой фактор бета» (trans
агентов: химических соединений, цитокинов,
forming growth factor β) [27]. Впервые этот белок
гормонов, факторов роста, рекомбинантных
был выделен и подробно описан в 1983 г. амери
белков и т.д. [17, 18];
канскими учёными во главе с R. Assoian [28].
3) генетическое воздействие состоит в изме
Группа похожих по строению белков рассмотре
нении генетического материала отдельных кле
на далее в данном обзоре.
ток или всей популяции [19, 20]. Следствием
В настоящее время у человека открыто 33
этого является изменение уровня экспрессии
белка, cходных по строению своей димерной
отдельных генов и/или увеличение (или прекра
структуры и входящих в т.н. «cуперсемейство
щение) синтеза различных белков. Такие изме
трансформирующего ростового фактора β» [24].
нения генотипа клеток являются методически
Белки данной группы выполняют важнейшую
непростой задачей, так как эволюционно при
роль в клеточной дифференцировке, миграции
рода создала множество барьеров для проник
и адгезии [21]. Нарушения в синтезе и механиз
новения чужеродной генетической информации
ме регуляции активности белков этого семей
в клетки.
ства приводят к большому количеству заболева
Для генетической модификации культуры
ний человека, включая тканевые фиброзы [29] и
клеток и восстановления повреждённой сустав
онкологические заболевания [30-32].
ной поверхности исследователи обратили свой
«Суперсемейство Tgfβ» у человека имеет
взгляд на белки, участвующие в регуляции хонд
сложную иерархию, однако, несмотря на разно
рогенеза и образовании гиалинового хряща. Од
образие данных белков, все члены и подгруппы
ним из таких белков является цитокин Tgfβ3,
этого семейства имеют сходную димерную
БИОХИМИЯ том 85 вып. 4 2020
510
БОЖОКИН и др.
структуру, похожую на «крылья бабочки». Боль
нако, похожи по строению мономерных частей
шинство членов семейства дополнительно ста
[33, 34].
билизируются дисульфидными связями между
Их функции разнообразны. Например, MIF
цепями, которые связывают мономеры вместе
является важным регулятором дифференциров
собой [33, 34].
ки репродуктивных органов в процессе эмбрио
«Суперсемейство Tgfβ» можно принципи
нального развития [46]. Lefty играет важную роль
ально разделить на пять подгрупп:
в ингибировании различных сигнальных путей,
1) изоформы белков непосредственно подсе
влияющих на направление дифференцировки
мейства Tgfβ (Tgfβ1,Tgfβ2,Tgfβ3). Tgfβ1 имеет
[47]. Nodal - белок, играющий одну из ключевых
фундаментальное значение для развития, физи
ролей в раннем эмбриональном развитии и фор
ологии и патологии сосудистой системы [35].
мировании мезодермы у позвоночных [48]. Но
Tgfβ2 связывают с развитием дегенеративных
менклатура названий белков суперсемейства
процессов органов зрения [36, 37]. Tgfβ3 прини
Tgfβ довольно сложна, и многие из них истори
мает участие в процессах, связанных с формиро
чески получили несколько названий, которые не
ванием структур дермы (или эпидермиса), а так
всегда верно отражают их функции [49].
же пролиферацией и образованием гиалинового
Несмотря на всё многообразие функций, ко
хряща [37-39];
торые выполняют белки суперсемейства Tgfβ,
2) костные морфометричекие белки BMP
наиболее заметное влияние они оказывают на
(bone morfometric proteins) - участвуют в фор
клеточную дифференцировку в целом, и синтез
мировании и пролиферации костной ткани,
внеклеточного матрикса, в частности [49].
стимулируют экспрессию генa Runx2 [40], коди
В связи со значительной ролью, которую иг
рующего белок runt related transcription factor2,
рает непосредственно белок Tgfβ3 в пролифера
также известный под названием CBF alpha 1
ции и хондрогенной дифференцировке, в дан
(core binding factor subunit alpha 1), являющийся
ной работе мы подробно рассмотрим цепочку
ключевым транскрипционным фактором для
молекулярных процессов, начиная от взаимо
остеобластической дифференцировкии проли
действия белка с рецепторами на поверхности
ферации клеток;
клеточной мембраны и заканчивая увеличением
3) факторы роста и дифференцировки GDF
экспрессии генов внеклеточного матрикса.
имеют гомологию с костными морфометричес
Изоформы белка Tgfβ представляют собой
кими белками, поэтому в некоторых классифи
небольшие секретируемые во внеклеточное
кациях данные две группы объединены. Белки
пространство гомодимерные сигнальные белки
GDF играют ключевую роль при дифференци
[45], у млекопитающих выявлено только три из
ровке во время эмбриогенеза, а также при про
них: Tgfβ1, Tgfβ2 и Tgfβ3. Белки семейства Tgfβ
лиферации клеток в сформированных тканях,
являются высоко консервативными, степень
таких как селезёнка, тимус, яичник и другие
идентичности между данными изоформами у
[33];
человека и некоторых млекопитающих может
4) активины/ингибины. Данные белки пер
достигать почти 100%, поэтому в эксперимен
воначально описаны в работе D. Yu et al. в каче
тальных работах на животных часто используют
стве регуляторов фолликул стимулирующего
белок человеческого происхождения.
гормона (FSH) [41]. Название эти белки полу
чили в 1987 г., когда N. Ling et al. обнаружили
свойство активинов стимулировать высвобож
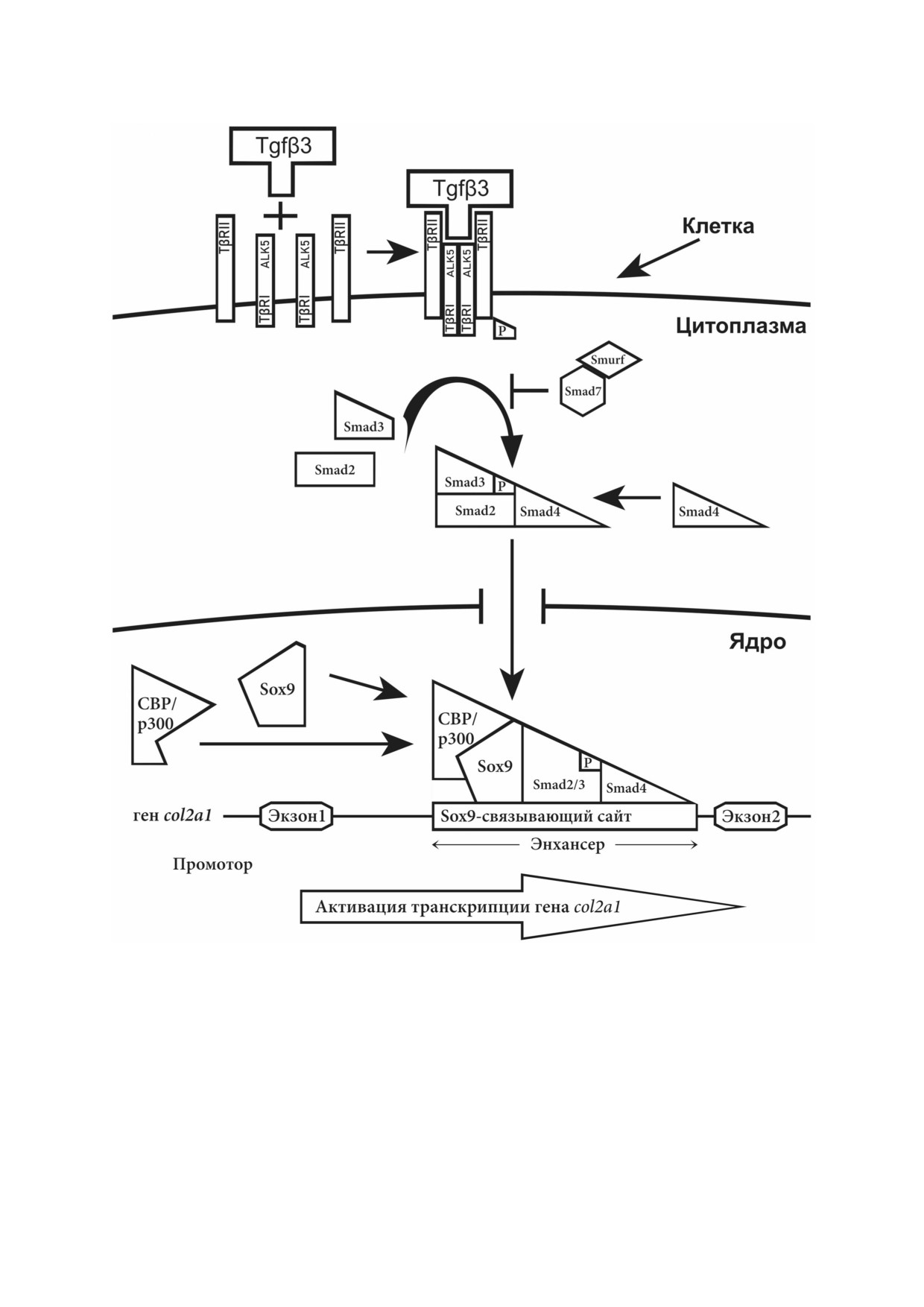
МЕХАНИЗМ ДЕЙСТВИЯ БЕЛКА Tgfβ3
дение FSH из гипофиза, в отличие от ингибина,
который мог избирательно блокировать синтез
Клеточный сигналинг, опосредованный бел
и секрецию гормона FSH [42, 43].
ками подсемейства изоформ Tgfβ, начинается с
В настоящее время известно, что данные
взаимодействия белка Tgfβ с его рецепторами
представители суперсемейства Tgfβ принимают
TβR, находящимися на плазматической мем
участие во многих процессах, начиная от ранних
бране. Три изоформы Tgfβ1, Tgfβ2 и Tgfβ3 связы
стадий эмбрионального развития и стимулиро
ваются с рецепторами TβRI, TβRII и TβRIII.
вания секреции гормонов у позвоночных и за
При этом один и тот же белок может присоеди
канчивая специализированными функциями в
няться ко всем вышеуказанным рецепторам, но
дифференцированных тканях и клетках [44];
с различной аффиностью [24, 50]. На поверх
5) остальные белки: в эту группу входят бел
ности большинства клеток организма находятся
ки Lefty, Nodal, мюллеровский ингибиторный
рецепторы TβRI и TβRII, количество которых
фактор (MIF) и другие белки [45]. Они демон
варьируется от 5 до 10 тыс. на клетку, количест
стрируют слабое сходство с димерной структу
во рецепторов TβRIII может составлять до 200
рой остальных членов суперсемейства Tgfβ, од
тыс. на одну клетку [24, 51]. Рецепторы являют
БИОХИМИЯ том 85 вып. 4 2020
ПРИНЦИПЫ ДЕЙСТВИЯ ЦИТОКИНА Tgfβ3
511
ся двух специфическими киназами (способны
Несмотря на то, что большинство исследова
фосфорилировать как серин и треонин, так и
телей считает, что для передачи сигналов необ
тирозин [52], передающими сигнал из внекле
ходимо образование именно тетрамерного
точного пространства к внутриклеточным меди
комплекса, в одной работе Huang et al. показали,
аторам - Smad белкам, которые постоянно цир
что также и димер, состоящий из рецепторов
кулируют между цитоплазмой и ядром. Рецеп
TβRI и TβRII, способен эффективно передать
тор TβRII фосфорилирует TβRI, что иницииру
во внутриклеточное пространство соответству
ют Smad опосредованный сигналинг [21, 53]. В
ющий сигнал [60]. После образования тетрамер
ядре Smad белки выполняют роль транскрипци
ного гетерокомплекса происходит трансфосфо
онных факторов и взаимодействуют с опреде
рилирование TβRI под действием TβRII и за
лёнными последовательностями ДНК в промо
пускается дальнейшая цепочка передачи сигна
торной области, таким образом регулируя
лов во внутриклеточное пространство.
экспрессию различных генов. Белок Tgfβ3 мо
Активность рецепторов также может регули
жет активировать не только сигнальный путь
роваться другими пострансляционными моди
Smad (канонический путь - сanonical pathway),
фикациями, например, убиквитинованием
но и другие сигнальные пути (неканонический
[61-64]. Так как оба рецептора являются поли
путь), например, путь митоген активируемой
убиквитированными, то при удалении убикви
протеинкиназы MAPK (ERK, JNK и p38), сиг
тина с рецептора TβRI происходит стабилиза
нальный путь фосфоинозитид 3 киназы (PI3K),
ция рецепторного комплекса и увеличивается
протеинкиназы В (AKT) и протеинкиназы
эффективность передачи сигнала [65]. Таким
(mTOR - мишень рапомицина у млекопитаю
образом, ингибирование убиквитинлигазы при
щих) - (PI3K/AKT/mTOR). Эти пути напрямую
водит к дополнительной активации всего ком
не связаны с увеличением синтеза внеклеточно
плекса передачи сигналов. Аналогично убикви
го матрикса, и поэтому в данной работе подроб
тированию на рецепторы влияет и сумоилиро
но рассмотрены не будут.
вание (присоединение белка SUMO) (small ubiq
uitin like modifier), приводя к их стабилизации и
повышению эффективности передачи сигналов.
РЕЦЕПТОРЫ
Сумоилирование также регулирует клеточную
локализацию рецепторов [66], влияя, таким об
На поверхности клетки могут находиться три
разом, на их совместную активацию. Другим ме
вида рецепторов: TβRI, TβRII и TβRIII.
ханизмом активации является действие шаперо
К TβRI относятся активин рецепторные ки
на Hsp90, который стабилизирует оба рецептора
назы 1-7 (ALK1 7). При этом в сигналинге,
на поверхности клеточной мембраны и блоки
опосредованном Tgfβ, принимает участие кина
рует их взаимодействие с E3 протеин убиквити
за ALK5.
новой лигазой (убиквитинлигазой), кодируемой
К TβRII относятся непосредственно TβRII
геном Smurf2. Данная лигаза взаимодействует с
(TGF β type II или TβRII, который является се
белком Smad7, образует стабильный комплекс с
рин треониновой киназой), рецептор для кост
фосфорилированными белками Smad2 и Smad3
ного морфометрического белка 2 (BMPRII), ак
и инактивирует их.
тивиновый рецептор II (ACTRII, ACTRIIB), а
Для рецепторного комплекса TβRI/TβRII
также рецептор антимюллерового гормона II
было исследовано большое количество белков,
(AMHRII).
которые либо ингибируют передачу сигналов
К TβRIII относятся белки бетаглюкан и эн
(BAMBI, STRAP, Tollip, SIK, FKBP12) [21], ли
доглин, которые по большей части действуют в
бо, наоборот, её усиливают (TSC 22). Протеоли
виде корецепторов для увеличения эффектив
тическое расщепление рецепторов под действи
ности передачи сигнала Tgfβ [50].
ем белков TACE или ADAM17 ингибирует даль
На поверхности клетки рецепторы сущест
нейший механизм передачи сигналов с по
вуют в виде мономеров, димеров и гетеромеров,
мощью Tgfβ [67].
что позволяет транслировать сигнал в клетку
только в случае образования упорядоченного
рецепторного комплекса при его взаимодей
Smad БЕЛКИ
ствии с лигандом [24].
При присоединении лиганда к соответству
Белок Tgfβ3 регулирует экспрессию генов
ющему рецептору происходит образование тет
путем взаимодействия с рецепторами
рамерного гетерокомплекса, состоящего из двух
TβRI/TβRII, что индуцирует опосредованную
рецепторов I типа и двух рецепторов II типа
активацию внутриклеточных Smad белков. Эти
[54-59].
белки, которые были первоначально открыты у
БИОХИМИЯ том 85 вып. 4 2020
512
БОЖОКИН и др.
дрозофилы, своё название получили от сокра
мен MH2 содержит петлю L3, способствующую
щения от Caenorhabditis elegans SMAll («малень
взаимодействию R Smads с внутриклеточной
кий» червь) и от Drosophila MAD («mothers
частью рецептора TβRI. При образовании гете
against decapentaplegic»). Smad белки передают
ротетрамерного комплекса из двух рецепторов
сигнал с внутренней части клеточной мембраны
TβRI и двух TβRII белок TβRI фосфорилирует
в ядро для активации экспрессии различных ге
два остатка серина на С конце R Smad в мотиве
нов (в том числе генов внеклеточного матрик
SSXS (Ser Ser X Ser) [21]. В результате данного
са). Семейство Smad белков является важней
действия два белка R Smad отсоединяются от
шим медиатором регуляции сигналинга Tgfβ3,
внутриклеточной части гетерорецепторного
на сегодняшний день описано большое количе
комплекса, называемой «SARA» (smad anchor for
ство механизмов регулирования действия дан
receptor activation), после чего два белка R Smad
ных белков [68].
(Smad2 + Smad3) и один co Smad (Smad4) в сос
Известно три разновидности белков Smad,
таве одного комплекса направляются к ядру.
включающих 8 членов данного семейства, кото
Они транспортируются в ядро через ядерные
рые можно разделить на три принципиальные
поры и с помощью MH1 домена связываются с
подгруппы:
ДНК [73]. В ядре домен MH2 взаимодействует с
1) рецептор регулируемые R Smad (Smad1,
различными ядерными факторами и контроли
Smad2, Smad3, Smad5, Smad9 (иногда в литера
рует транскрипцию большого количества генов.
туре встречается обозначение Smad8 или
Ингибирование данного сигнального пути про
Smad8/9 - так как у белка, кодируемого геном
исходит за счет различных действий Smad7: взаи
Smad9, есть две изоформы - Smad8 и Smad8b
модействия с R Smad, дефосфорилирования ге
[69];
теро рецепторного комплекса, индукции дегра
2) партнеры Сo Smad (в литературе встре
дации активированного рецепторного комплек
чаются обозначения Co Smad или CSmad, или
са, взаимодействия с убиквитинлигазой, а также
Smad4 (Smad4 «COmmon partner»));
препятствования присоединения к ДНК комп
3) ингибиторы I Smad (Smad6, Smad7).
лекса R Smads и co Smad. При этом ингибиро
Представители Smad белков - Smad1, Smad5
вание сигналинга Tgfβ3 белком Smad7 не явля
и Smad8/9, - относящиеся к группе R Smad, а
ется однозначным процессом. В общем виде
также представитель I Smad - белок Smad6,
Smad7 выполняет непростую роль, обеспечивая
участвуют в передаче сигналов, опосредованных
отрицательную обратную связь Tgfβ3 сигналин
белками BMPs и GDF [40, 70] но не белками
га и поддерживая его в определённых границах
Tgfβ1 3. Действие белков Smad 1,5,8/9 важно,
[50, 54, 74, 75].
так как они регулируют процессы, связанные с
В дополнение к трем основным событиям,
остеогенезом. R Smad могут активировать
которые приводят к активации белков Smad
и/или блокировать транскрипцию фактора
(фосфорилирование SSXS мотива белками R
Runx2 - главного регулятора развития костной
Smads, отщепление комплекса двух R Smad и
ткани. Хондрогенная и остеогеннная диффе
одного co Smad от тетрамерногорецепторного
ренцировка являются взаимно исключающими
комплекса, а также нуклеоплазматического дви
одновременными процессами по отношению к
жения Smad белков из цитоплазмы в ядро и об
одной клетке. Поэтому активация одного пути
ратно), Smad белки являются субъектами разно
неминуемо ведет к ингибированию другого.
го рода посттрансляционных модификаций, та
Например, было показано, что белки Smad2 и
ких как убиквитирование, сумоилирование,
Smad3 ингибируют экспрессию гена Runx2 [71].
ацетилирование и AДФ рибозилирование, а так
Smad3, проникая в ядро в составе комплекса
же фосфорилирование линкерной последова
Smad2/3 + Smad4, рекрутирует гистон деацети
тельности, что может влиять на их активность, а
лазу II (HDAC), которая действует как ко реп
также на передачу сигналов Tgfβ3.
рессор в Smad3 опосредованой транскрипцион
ной репрессии фактора Runx2, что подтвержда
ет негативное влияние воздействия Tgfβ на остео
ВНУТРИКЛЕТОЧНОЕ ПЕРЕМЕЩЕНИЕ
генез [71, 72].
БЕЛКОВ Smad И ИХ РОЛЬ В РЕГУЛЯЦИИ
Белки R Smad содержат два домена MH1 и
РЕЦЕПТОРНОГО КОМПЛЕКСА TβRI/TβRII
MH2, соединенные линкерной последователь
ностью. Домен MH1 имеет шпилечную структу
Независимо от наличия или отсутствия ли
ру, содержит сигнал ядерной локализации и от
гандов, Smad белки постоянно циркулируют
ветственен за связывание с ДНК и миРНК, раз
между цитоплазмой и ядром, но комплекс бел
личными ДНК связывающими ко факторами,
ков Smad2,3/Smad4 обнаруживается только в
ко активаторами и ко репрессорами [73]. До
ядре [70]. Однако было показано, что данный
БИОХИМИЯ том 85 вып. 4 2020
ПРИНЦИПЫ ДЕЙСТВИЯ ЦИТОКИНА Tgfβ3
513
комплекс белков взаимодействуя с белками
транскрипционными факторами и ко регулято
Importin7,8 может активно транспортироваться
рами, таргетного гена, физиологического состо
в ядро и накапливаться там, так как эффектив
яния клетки и строения Smad комплекса [80,
ность импорта этого комплекса в 4 раза больше
81]. Было показано, что данный комплекс свя
эффективности экспорта [76, 77]. В результате
зывается с низкой аффинностью с GC богатой
рецептор опосредованного фосфорилирования
последовательностью «Smad binding element»
и ассоциации двух белков R Smad c одним
(SBE) (например, GTCT или AGAC). Белки R
co Smad, комплекс из трёх белков проникает в
Smad в активированном комплексе (два R Smad
ядро [21, 70]. Нуклеоплазматический транспорт
и один co Smad) с помощью домена MH2 свя
макромолекул в/из ядра происходит через
зываются с транскрипционными факторами для
комплекс ядерных пор, пронизывающих ядер
идентификации генов мишеней и регуляции их
ную оболочку. В отсутствие активации рецепто
экспрессии, что повышает специфичность и аф
ров (воздействия белка Tgfβ) Smad7, являющий
финность связывания с ДНК [73]. Многие тран
ся репрессором данного сигнального пути, на
скрипционные факторы, связывающиеся с
капливается в ядре, а после активации рецепто
комплексом Smad белков, являются тканеспе
ров переносится в цитоплазму. Экспорт отдель
цифичными и, таким образом, играют важную
ных белков Smad из ядра может происходить
роль в регуляции экспрессии генов.
при помощи белков экспортинов [78]. При по
В работе Qiao et al. [82] было показано увели
падании в ядро белок Smad 7 блокирует образо
чение синтеза коллагена II типа - основного
вание комплекса ДНК + Smad (2,3,4) путем свя
белка внеклеточного матрикса гиалинового хря
зывания домена MH2 белка Smad7 с ДНК [74].
ща, в ответ на воздействие белком Tgfβ, однако,
Проведённые исследования подтверждают, что
данный результат был получен независимо от
перемещения белков Smad между ядром и ци
увеличения экспрессии гена коллагена II типа, а
топлазмой являются активными и направлен
также Smad опосредованного сигналинга. Такие
ными процессами, а не пассивной диффузией
данные свидетельствуют о наличии другого пути
[78, 79]. По всей видимости, именно концентра
активации синтеза коллагена II типа. В работе R.
ция белков Smad в ядре является показателем
Bhogal et al. [83] был показан альтернативный
интенсивности взаимодействия белка Tgfβ3 с
путь увеличения экспрессии коллагена II, кото
клеточными рецепторами [70]. Постоянное пе
рый связан с увеличением экспрессии гена, ко
ремещение белков семейства Smad между ядром
дирующего один из рецепторов TβR. В работе
и цитоплазмой позволяет обеспечить контроль
этих же авторов на культуре фибробластов in vitro
внутриклеточных медиаторов для регуляции ак
было показано, что уровень экспрессии гена
тивности рецепторного комплекса, выполняя,
коллагена I типа (вида коллагена, не характерно
таким образом, роль обратной связи, что явля
го для гиалинового хряща) снижался в результате
ется необходимым условием передачи сигнала у
воздействия на культуру клеток белком Tgfβ [83].
всех многоклеточных организмов. Распределе
Белок Smad 2/3, проникая в ядро, связывает
ние Smad белков внутри клетки и регуляция их
ся там с транскрипционными ко активаторами
перемещения между ядром и цитоплазмой до
(например, p300/CBP). Эти белки, в свою оче
конца не изучена, но очевидно, что этот процесс
редь, взаимодействуют с транскрипционным
вовлечен в активацию или репрессию экспрес
фактором Sox9 [40], который является одним из
сии генов [24].
ключевых транскрипционных факторов при ак
тивации хондрогенеза. Таким образом, белки
Smad2 и Smad3 активируют экспрессию и син
ФУНКЦИИ БЕЛКОВ
тез коллагена II типа [84]. Взаимодействие Smad
CЕМЕЙСТВА Smad В ЯДРЕ
с активатором p300/CBP associated factor
(PCAF) критически необходимо для формиро
При попадании в ядро комплекс белков
вания хряща [85]. Взаимодействие данных бел
Smad может связываться с ДНК и регулировать
ков с факторами транскрипции FoxO (forkhead
транскрипцию. Активирующая или репрессиру
transcription factors (FoxO1,3,4)) приводит к про
ющая активность комплекса белков Smad требу
лиферации и росту хрящевой ткани, что было
ет обязательной ассоциации его с факторами и
показано на экспериментах на рыбах Danio rerio
кофакторами транскрипции, которые связыва
[86]. Кроме того, взаимодействие между путями
ют специфические последовательности ДНК в
регуляции, включающими Smad белки и тран
проксимальных промоторных областях или эн
скрипционные факторы FoxO, обеспечивает
хансеры с большой аффинностью [24]. Способ
интеграцию сигнальных путей, активируемых
ность регуляции экспрессии генов Smad белка
Tgfβ и PI3K/AKT/mTOR [87, 88]. Такое перекрёст
ми зависит от многих причин: ассоциации с
ное взаимодействие может быть также достиг
БИОХИМИЯ том 85 вып. 4 2020
514
БОЖОКИН и др.
нуто за счет совместного использования генов
как транскрипционно - через ДНК связываю
мишеней Smad [89, 90].
щую активность комплексов Smad, так и пост
Ранее была показана возможность взаимо
транскрипционно - через РНК связывающую
действия белков Smad2 и Smad3, которые явля
активность R Smad [21].
ются медиаторами Tgfβ сигналинга, с тран
На сегодняшний момент открыто и описано
скрипционным фактором Sp1 - Special protein1
большое количество миРНК, влияющих на ре
[50, 91]. Одновременно было показано, что уве
гуляцию Tgfβ сигналинга [21]. Некоторые из них
личение экспрессии гена Sp1 влияет на увеличе
принимают участие в процессах, связанных с
ние экспрессии гена Sox9, и, соответственно,
хондрогенезом. Например, миРНК410 взаимо
увеличивает синтез коллагена II типа [92]. Ана
действует с регуляторным путём Wnt, который
логичные данные были получены и для тран
перекрёстно связан с механизмом передачи сиг
скрипционных факторов сJun/c Fos (другое
налов, инициируемым Tgfβ белком [97]. Было
название, встречающееся в литературе - Ap1) и
показано, что микроРНК присоединяется к
Sertadt1 [50].
3′ нетранслируемой области гена wnt3a, кото
При активации рецептора TβRI происходит
рый регулирует сигнальный путь Wnt. Культура
увеличение продукции аггрекана [93] - другого
клеток, у которых искусственно активирована
важнейшего белка внеклеточного матрикса.
миРНК410, увеличивает синтез основных бел
При активации регуляции по пути Smad 1,5,8
ков внеклеточного матрикса гиалинового хря
увеличивается синтез металлопротеиназы 13
ща, таких как коллаген II типа, аггрекан, а так
(MMP 13) [93], ответственной за деградацию
же синтез транскрипционного фактора Sox9,
внеклеточного матрикса, что, по видимому,
важного при хондрогенезе [97]. МиРНК495 яв
обусловлено связью белков Smad1,5,8 с Runx2 -
ляется важным регулятором хондрогенной диф
ключевым транскрипционным фактором при
ференцировки [98], так как в 3′ нетранслируе
остеогенезе.
мой области гена sox9 есть область связывания с
Общая схема регулирования экспрессии ге
данной миРНК. Сверхэкспрессиями РНК495
на коллагена II типа (col2a1) через Smad медиа
репрессирует экспрессию генов, кодирующих
торы и Tgfβ передачу сигналов представлена на
белки внеклеточного матрикса (коллаген II типа
рисунке.
и аггрекан), а ингибирование ее экспрессии
приводит к обратному эффекту.
РЕГУЛИРОВАНИЕ ЭКСПРЕССИИ ГЕНОВ
МАТРИКСА С ПОМОЩЬЮ микро РНК
ИСПОЛЬЗОВАНИЕ Tgfβ3 ДЛЯ ЗАМЕЩЕНИЯ
ДЕФЕКТОВ ГИАЛИНОВОГО ХРЯЩА
Другим механизмом передачи сигналов под
действием белка Tgfβ3, влияющим на регуляцию
Использование различных белков, стимули
экспрессии генов внеклеточного матрикса гиа
рующих процессы регенерации хряща и диффе
линового хряща, является взаимодействие с
ренцировки мезенхимальных стволовых клеток,
микроРНК. Данные молекулы являются не
как по отдельности, так и в комбинации между
большими (18-25, в среднем, 22 нуклеотида)
собой, в настоящее время является перспектив
некодирующими последовательностями РНК.
ным направлением в терапии целого ряда забо
Они комплементарны определённому фрагмен
леваний опорно двигательного аппарата, что
ту мРНК (у животных это обычно 3′ некодирую
было показано, в том числе, и в наших пилот
щая область), и их взаимодействие с мРНК вы
ных экспериментах [17]. Белок Tgfβ3 активно
зывает ингибирование трансляции [94, 95]. Био
используется для восстановления гиалинового
синтез микроРНК начинается с транскрипции
слоя, при этом он не только стимулирует хонд
генов миРНК с помощью РНК полимеразы II и
рогенез [99-101, 100], но и подавляет актив
синтеза длинных фрагментов, известных как
ность медиаторов воспаления и матриксных ме
пре миРНК. В результате ядерного процессинга
таллопротеиназ, таких как IL 1, MMPs и TNF α
у позвоночных пре миРНК идентифицируется
[101, 102]. Трансплантация биодеградируемых
белком Di (george syndrome critical region8)
носителей (на основе фиброина или внеклеточ
(DGCR8), который при взаимодействии с комп
ного матрикса хондроцитов), содержащих Tgfβ3,
лексом Drosha разрезает пре миРНК. Получив
приводила к регенерации повреждений хряща in
шиеся фрагменты экспортируются из ядра бел
vivo, при этом комбинация Tgfβ3 c механозави
ком Exportin 5 и в результате цитоплазматичес
симым фактором роста MGF давала синерги
кого процессинга данные фрагменты разреза
ческий эффект [103-105].
ются рибонуклеазой Dicer [96]. Связывание Tgfβ
Следующим шагом на пути разработки тран
с рецепторами модулирует экспрессию миРНК
сплантатов, способных эффективно замещать
БИОХИМИЯ том 85 вып. 4 2020
ПРИНЦИПЫ ДЕЙСТВИЯ ЦИТОКИНА Tgfβ3
515
Активация транскрипции гена col2aI под действием белка Tgfβ
дефекты хряща, стало использование матрикса,
и Bmp2 [106], а в работе Sun et al. была показана
содержащего не только белок Tgfβ3, но и раз
эффективность инъекций стволовых клеток жи
личные варианты стволовых или частично диф
ровой ткани в комплексе с Tgfβ3 [107]. В насто
ференцированных клеток. Так, Wang et al. ус
ящее время активно ведется разработка 3D мо
пешно использовали деминерализованную
делей скаффолда, способных обеспечить равно
костную ткань в сочетании с мезенхимальными
мерное распределение стволовых клеток по все
стволовыми клетками, продуцирующими Tgfβ3
му объему матрикса и пролонгированное высво
БИОХИМИЯ том 85 вып. 4 2020
516
БОЖОКИН и др.
бождение активаторов хондрогенеза [108]. Удач
нового хряща, что было показано Sun et al. [107],
ным примером таких моделей является сочета
а также в наших собственных работах [17]. При
ние клеток стромальной васкулярной фракции с
менение данного цитокина для модификации
гидрогелем метакрилат желатина, содержащим
клеточной культуры (как с помощью рекомбинан
Tgfβ3, использованное для терапии поврежде
тных белков, так и с помощью созданных плаз
ний мениска [109].
мид, несущих ген данного белка), на наш взгляд,
является перспективным направлением при соз
Почти три десятилетия прошли с открытия
дании КИК для замещения поверхностных де
рецепторов и сигнальных медиаторов белка
фектов гиалинового хряща. Однако такие рабо
Tgfβ3. В настоящее время механизм воздействия
ты требуют от исследователей детального пони
данных белков на рецепторы клеточной поверх
мания всех молекулярных механизмов и дозо за
ности и активацию внутриклеточного сигналин
висимости действия белка Tgfβ3 на культуру кле
га посредством белков семейства Smad, в целом,
ток и тщательного контроля её пролиферации.
понятен. Взаимодействие Smad белков с тран
скрипционными факторами влияет на увеличе
ние экспрессии генов коллагена II типа и аггре
Финансирование. Работа выполнена в рамках
кана, что приводит к увеличению синтеза вне
темы Государственного задания Института ци
клеточного матрикса гиалинового хряща. После
тологии РАН при финансовой поддержке Мин
открытия этого явления исследователи задума
образования и науки России и при финансовой
лись об использовании белка Tgfβ3 в терапевти
поддержке гранта СПбГУ ID 51140332.
ческих целях для восстановления гиалинового
Благодарности. Авторы благодарны за сот
слоя хрящевой поверхности. Появились работы
рудничество ресурсным центрам «ЦКП ХРО
по модификации клеточной культуры ММСК
МАС», «Биобанк» и «РМиКТ» научного парка
рекомбинантным белком Tgfβ3 для последую
СПбГУ.
щей дифференцировки и хондрогенной проли
Конфликт интересов. Авторы статьи заявляют
ферации как в экспериментах in vitro [105]. Сле
об отсутствии конфликта интересов.
дующим этапом стало применение в экспери
Соблюдение этических норм. Настоящая
ментах на животных клеточно инженерных
статья не содержит описания выполненных ав
конструкций с модифицированными ММСК
торами исследований с участием людей или ис
для восстановления повреждённого слоя гиали пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Божокин М. С., Божкова С. А., Нетылько Г. И. (2016)
6. Brittberg, M., Lindahl, A., Nilsson, A., Ohlsson, C.,
Возможности современных клеточных технологий
Isaksson, O., and Peterson, L. (1994) Treatment of deep
для восстановления повреждённого суставного хряща
cartilage defects in the knee with autologous chondrocyte
(аналитический обзор литературы), Травматология и
transplantation, N. Engl. J. Med., 6, 889 895, doi: 10.1056/
ортопедия России, 22,122 134, doi: 10.21823/2311 2905
NEJM199410063311401.
2016 22 3 122 134.
7. Xiang, Y., Bunpetch, V., Zhou, W., and Ouyang, H. (2019)
2.
Sophia Fox, A. J., Bedi, A., and Rodeo, S. A. (2009) The
Optimization strategies for ACI: a step chronicle review,
basic science of articular cartilage: structure, composition,
J. Orthopaedic Transl., 17, 3 14, doi:
10.1016/j.jot.2018.
and function, Sports Health, 1, 461 468, doi: 10.1177/
12.005.
1941738109350438.
8. Elmallah, R., Cherian, J., Jauregui, J., Pierce, T., Beaver,
3.
Божокин М. С., Божкова С. А., Нетылько Г. И., Рума
W., and Mont, M. (2015) Genetically modified chondro
кин В. П., Наконечный Д. Г., Чепурненко М. Н. (2017)
cytes expressing TGF β1: a revolutionary treatment for
Морфофункциональная характеристика хондрореге
articular cartilage damage? Expert Opin. Biol. Therapy, 15,
нераторного процесса в экспериментальном локаль
455 464, doi: 10.1517/14712598.2015.1009886.
ном дефекте поверхности суставного хряща, Между
9. Finnson, K., Chi, Y., Bou Gharios, G., Leask, A., and
народный журнал прикладных и фундаментальных ис
Philip, A. (2012) TGF beta signaling in cartilage home
следований, 8, 302 306.
ostasis and osteoarthritis, Front. Biosci. Sch., 1, 251 268,
4.
Maglio, M., Brogini, S., Pagani, S., Giavaresi, G., and
doi: 10.2741/s266.
Tschon, M. (2019) Current trends in the evaluation of
10. Jeuken, R., Roth, A., Peters, R., Van Donkelaar, C., Thies, J.,
osteochondral lesion treatments: histology, histomor
Van Rhijn, L., and Emans, P. J. (2016) Polymers in carti
phometry, and biomechanics in preclinical models, Bio.
lage defect repair of the knee: current status and future
Med. Research Intern., 2019, 4040236, doi: 10.1155/2019/
prospects, Polymers, 4, 8, doi: 10.3390/polym8060219.
4040236.
11. Plánka, L., Starý, D., Srnec, R., Necas, A., and Gál, P.
5.
Kurtz, S., Ong, K., Lau, E., Mowat, F., and Halpern, M.
(2008) New options for management of posttraumatic
(2007) Projections of primary and revision hip and knee
articular cartilage defects, Rozhledy v Chirurgii: Měs čn k
arthroplasty in the United States from 2005 to 2030, J.
Československé Chirurgické Společnosti, 87, 1, 42 45.
Bone Jt. Surg. - Ser. A., 89, 780 785, doi: 10.2106/JBJS.F.
12. Diederichs, S., Gabler, J., Autenrieth, J., Kynast, K.,
00222.
Merle, C., Walles, H., Utikal, J., and Richter, W. (2016)
БИОХИМИЯ том 85 вып. 4 2020
ПРИНЦИПЫ ДЕЙСТВИЯ ЦИТОКИНА Tgfβ3
517
Differential regulation of SOX9 protein during chondroge
(2000) Transforming growth factor beta superfamily mem
nesis of induced pluripotent stem cells versus mesenchymal
bers: role in cartilage modeling, Plast. Reconstr. Surg., 105,
stromal cells: a shortcoming for cartilage formation, Stem
980 990, doi: 10.1097/00006534 200003000 00022.
Cells Dev., 25, 598 609, doi: 10.1089/scd.2015.0312.
30.
Reddi, A., and Cunningham, N. (1990) Bone induction by
13.
Skuse, G., and Lamkin Kennard, K. (2013) Reverse engi
osteogenin and bone morphogenetic proteins, Biomaterials,
neering life: physical and chemical mimetics for controlled
11, 33 34
stem cell differentiation into cardiomyocytes, Methods
31.
Glick, A., Weinberg, W., Wu, I., Quan, W., and Yuspa, S.
Mol. Biol., 1001, 99 114, doi: 10.1007/978 1 62703 363
(1996) Transforming growth factor beta 1 suppresses
3_9.
genomic instability independent of a G1 arrest, p53, and
14.
Tokuda, S., and Yu, A. (2019) Regulation of epithelial cell
Rb, Cancer Res., 56, 3645 3650.
functions by the osmolality and hydrostatic pressure gradi
32.
Massagué, J. (1999) Wounding, Smad, Nat. Cell. Biol., 1,
ents: a possible role of the tight junction as a sensor, Intern.
117 119, doi: 10.1038/12944.
J. Mol. Sci., 20, doi: 10.3390/ijms20143513.
33.
Herpin, A., Lelong, C., and Favrel, P. (2004) Transforming
15.
Vieira, H., Alves, P., and Vercelli, A. (2011) Modulation of
growth factor β related proteins: an ancestral and wide
neuronal stem cell differentiation by hypoxia and reactive
spread superfamily of cytokines in metazoans, Dev. Comp.
oxygen species, Prog. Neurobiol.,
93,
444455,
Immunol., 28, 461 485, doi: 10.1016/j.dci.2003.09.007.
doi: 10.1016/j.pneurobio.2011.01.007.
34.
Kwiatkowski, W., Gray, P., and Choe, S.
(2014)
16.
Khamo, J., Krishnamurthy, V., Sharum, S., Mondal, P.,
Engineering TGF β superfamily ligands for clinical appli
and Zhang, K. (2017) Applications of optobiology in intact
cations, Trends Pharmacol. Sci.,
35,
648657, doi:
cells and multicellular organisms, J. Mol. Biol., 429, 2999
10.1016/j.tips.2014.10.006.
3017, doi: 10.1016/j.jmb.2017.08.015.
35.
Lu, Y., Boer, J., Barsova, R., Favorova, O., Goel, A.,
17.
Божокин М. С., Божкова С. А., Нетылько Г. И., Нако
Müller, M., and Feskens, E. (2012) TGFB1 genetic poly
нечный Д. Г., Блинова М. И., Нащекина Ю. А. (2018)
morphisms and coronary heart disease risk: a meta analy
Результаты замещения поверхностного дефекта гиа
sis, BMC Med. Genet., 13, 39, doi: 10.1186/1471 2350 13 39.
линового хряща крысы клеточно инженерной
36.
Rao, K., Nagireddy, S., and Chakrabarti, S.
(2011)
конструкцией в эксперименте, Труды Карельского НЦ
Complex genetic mechanisms in glaucoma: an overview,
РАН, 4, 13 22, doi: 10.17076/them815.
Ind. J. Ophthalm., 59, 31 42, doi: 10.4103/0301 4738.
18.
Kuroda, Y., Kawai, T., Goto, K., and Matsuda, S. (2019)
73685.
Clinical application of injectable growth factor for bone
37.
Leutermann, R., Sheikhzadeh, S., Brockstädt, L.,
regeneration: a systematic review, Inflamm. Regen., 39, 1
Rybczynski, M., van Rahden, V., Kutsche, K., von
10, doi: 10.1186/s41232 019 0109 x.
Kodolitsch, Y., and Rosenberger, G. (2014) A 1 bp dupli
19.
Hamann, A., Nguyen, A., and Pannier, A. (2019) Nucleic
cation in TGFB2 in three family members with a syn
acid delivery to mesenchymal stem cells: a review of nonvi
dromic form of thoracic aortic aneurysm, Eur. J. Hum.
ral methods and applications, J. Biol. Engin., 13,7,
Genet., 22, 944 948, doi: 10.1038/ejhg.2013.252.
doi: 10.1186/s13036 019 0140 0.
38.
Occleston, N., Laverty, H., O’Kane, S., and Ferguson, M.
20.
Oggu, G., Sasikumar, S., Reddy, N., Ella, K., Rao, C., and
(2008) Prevention and reduction of scarring in the skin by
Bokara, K. (2017) Gene delivery approaches for mes
transforming growth factor beta 3 (TGFβ3): from laborato
enchymal stem cell therapy: strategies to increase efficien
ry discovery to clinical pharmaceutical, J. Biomater. Sci.,
cy and specificity, Stem Cell Rev.,
13,
725740,
Polymer Edition,
19,
10471063, doi:
10.1163/
doi: 10.1007/s12015 017 9760 2.
156856208784909345.
21.
Hata, A., and Chen, Y. (2016) TGF β signaling from
39.
Gilbert, R., Vickaryous, M., and Viloria Petit, A. (2016)
receptors to smads, Cold Spring Harb. Perspect. Biol., 8,
Signalling by transforming growth factor beta isoforms in
doi: 10.1101/cshperspect.a022061.
wound healing and tissue regeneration, J. Dev. Biol., 22, 4,
22.
Yang, X., Chen, L., Xu, X., Li, C., Huang, C., and Deng, C.
doi: 10.3390/jdb4020021.
(2001) TGF β/Smad3 signals repress chondrocyte hyper
40.
Furumatsu, T., Tsuda, M., Taniguchi, N., Tajima, Y., and
trophic differentiation and are required for maintaining
Asahara, H.
(2005) Smad3 induces chondrogenesis
articular cartilage, J. Cell Biol., 153, 35 46.
through the activation of SOX9 via CREB binding pro
23.
Moses, H., Roberts, A., and Derynck, R. (2016) The dis
tein/p300 recruitment, J. Biol. Chem., 280, 8343 8350
covery and early days of TGF b: a historical perspective,
doi: 10.1074/jbc.M413913200.
Cold Spring Harb. Perspect. Biol., 8, doi: 10.1101/cshper
41.
Yu, J., Shao, L., Lemas, V., Yu, A., Vaughan, J., Rivier, J.,
spect.a021865.
and Vale, W. (1987) Importance of FSH releasing protein
24.
Derynck, R., and Budi, E. (2019) Specificity, versatility,
and inhibin in erythrodifferentiation, Nature, 330, 765
and control of TGF b family signaling, Sci. Signal., 12,
767, doi: 10.1038/330765a0.
570, doi: 10.1126/scisignal.aav5183.
42.
Bloise, E., Ciarmela, P., Cruz, C., Luisi, S., Petraglia, F.,
25.
De Larco, J., and Todaro, G. (1978) Growth factors from
and Reis, F. (2019) Activin A in mammalian physiology,
murine sarcoma virus transformed cells, Proc. Natl. Acad.
Physiol. Rev., 99, 739 780, doi: 10.1152/physrev.00002.
Sci. USA, 75, 4001 4005.
2018.
26.
Todaro, G., De Larco, J., and Fryling, C. (1982) Sarcoma
43.
Ling, N., Ying, S., Ueno, N., Shimasaki, S., Esch, F.,
growth factor and other transforming peptides produced by
Hotta, M., and Guillemin, R. (1986) Pituitary FSH is
human cells: interactions with membrane receptors, Fed.
released by a heterodimer of the β subunits from the two
Proc., 41, 2996 3003.
forms of inhibin, Nature, 321, 779 782, doi: 10.1038/
27.
Kastin, A. (2013) Handbook of Biologically Active Peptides,
321779a0.
Chapter 225, doi: 10.1016/C2010 0 66490 X.
44.
Namwanje, M., and Brown, C. (2016) Activins and inhib
28.
Assoian, R., Komoriya, A., Meyers, C., Miller, D., and
ins: roles in development, physiology, and disease, Cold
Sporn, M. (1983) Transforming growth factor β in human
Spring Harb. Perspect. Biol., 8, doi: 10.1101/cshperspect.
platelets. Identification of a major storage site, purifica
a021881.
tion, and characterization, J. Biol. Chem., 258, 7155 7160.
45.
Chin, D., Boyl, G., Parsons, P., and Coman, W. (2004)
29.
Frenkel, S., Saadeh, P., Mehrara, B., Chin, G.,
What is transforming growth factor beta (TGF β)? Brit. J.
Steinbrech, D., Brent, B., Gittes, G., and Longaker, M.
Plastic Surg., 57, 215 221, doi: 10.1016/j.bjps.2003.12.012.
БИОХИМИЯ том 85 вып. 4 2020
518
БОЖОКИН и др.
46.
Kushnir, V., Seifer, D., Barad, D., Sen, A., and Gleicher, N.
63.
Imamura, T., Oshima, Y., and Hikita, A..(2013)
(2017) Potential therapeutic applications of human anti
Regulation of TGF β family signalling by ubiquitination
Müllerian hormone (AMH) analogues in reproductive
and deubiquitination, J. Biochem.,
154,
481489,
medicine, J. Assist. Reprod. Genet., 34, 11051113,
doi: 10.1093/jb/mvt097.
doi: 10.1007/s10815 017 0977 4.
64.
Zuo, W., Huang, F., Chiang, Y., Li, M., Du, J., Ding, Y.,
47.
Tabibzadeh, S., and Hemmati Brivanlou, A. (2006) Lefty
Zhang, T., Lee, H., Jeong, L., Chen, Y., Deng, H., Feng, X.,
at the crossroads of “stemness” and differentiative events,
Luo, S., Gao, C., and Chen, Y. (2013) C Cbl mediated
Stem Cells, 24, 1998 2006, doi: 10.1634/stemcells.2006
neddylation antagonizes ubiquitination and degradation of
0075.
the TGF β type II receptor, Mol. Cell, 49, 499 510,
48.
Jones, C., Kuehn, M., Hogan, B., Smith, J., and Wright, C.
doi: 10.1016/j.molcel.2012.12.002.
(1995) Nodal related signals induce axial mesoderm and
65.
Zhang, L., Zhou, F., Drabsch, Y., Gao, R., Snaar
dorsalize mesoderm during gastrulation, Development, 121,
Jagalska, B., Mickanin, C., Huang, H., Sheppard, K.,
3651 3662.
Porter, J., Lu, C., and Dijke, P. (2012) USP4 is regulated by
49.
Morikawa, M., Derynck, R., and Miyazono, K. (2016)
AKT phosphorylation and directly deubiquitylates TGF β
TGF β and the TGF β family: context dependent roles in
type i receptor, Nat. Cell Biol., 14, 717 726, doi: 10.1038/
cell and tissue physiology, Cold Spring Harb. Perspect. Biol.,
ncb2522.
2, 8, doi: 10.1101/cshperspect.a021873.
66.
Flotho, A., and Melchior, F. (2013) Sumoylation: a regula
50.
Papageorgis, P., and Stylianopoulos, T. (2015) Role of
tory protein modification in health and disease, Annu. Rev.
TGFβ in regulation of the tumor microenvironment and
Biochem., 82, 357 385, doi: 10.1146/annurev biochem
drug delivery (review), Int. J. Oncol., 46, 933943,
061909 093311.
doi: 10.3892/ijo.2015.2816.
67.
Mu, Y., Sundar, R., Thakur, N., Ekman, M., Gudey, S.,
51.
Gatza, C., Oh, S., and Blobe, G. (2010) Roles for the type
Yakymovych, M., Hermansson, A., Dimitriou, H.,
III TGF β receptor in human cancer, Cell. Signal., 22,
Bengoechea Alonso, M., Ericsson, J., Heldin, C., and
1163 1174, doi: 10.1016/j.cellsig.2010.01.016.
Landström, M. (2011) TRAF6 ubiquitinates TGFβ type i
52.
Lawler, S., Feng, X., Chen, R., Maruoka, E., Turck, C.,
receptor to promote its cleavage and nuclear translocation
Griswold Prenner, I., and Derynck, R. (1997) The type II
in cancer, Nat. Commun.,
2,
330, doi:
10.1038/
transforming growth factor β receptor autophosphorylates
ncomms1332.
not only on serine and threonine but also on tyrosine
68.
Li, S. B., and Jia Fa Wu, J. F. (2020) TGF β/SMAD
residues, J. Biol. Chem., 272, 14850 14859, doi: 10.1074/
Signaling regulation of mesenchymal stem cells in
jbc.272.23.14850.
adipocyte commitment, Rev. Stem Cell Res. Therl., 11, 41,
53.
Heldin, C., and Moustakas, A. (2016) Signaling receptors
doi: 10.1186/s13287 020 1552 y.
for TGF β family members, Cold Spring Harb. Perspect.
69.
Nishita, M., Ueno, N., and Shibuya, H. (1999) Smad8B, a
Biol., 8, 8, doi: 10.1101/cshperspect.a022053.
Smad8 splice variant lacking the SSXS site that inhibits
54.
Ahmadi, A., Najafi, M., Farhood, B., and Mortezaee, K.
Smad8 mediated signaling, Genes Cells, 4, 583591,
(2019) Transforming growth factor β signaling: tumorigen
doi: 10.1046/j.1365 2443.1999.00285.x.
esis and targeting for cancer therapy, J. Cell. Physiol., 234,
70.
Hill, C. (2009) Nucleocytoplasmic shuttling of Smad pro
12173 12187, doi: 10.1002/jcp.27955.
teins, Cell Res., 19, 36 46, doi: 10.1038/cr.2008.325.
55.
Wrana, J., Attisano, L., Cárcamo, J., Zentella, A., Doody,
71.
Wu, M., Chen, G., and Li, Y. (2016) TGF β and BMP sig
J., Laiho, M., Wang, X., and Massagué, J. (1992) TGFβ
naling in osteoblast, skeletal development, and bone for
signals through a heteromeric protein kinase receptor com
mation, homeostasis and disease, Bone Res., 4, 16009,
plex, Cell,
71,
10031014, doi:
10.1016/0092
doi: 10.1038/boneres.2016.9.
8674(92)90395 S.
72.
Kang, J., Alliston, T., Delston, R., and Derynck, R. (2014)
56.
Yamashita, H., ten Dijke, P., Franzén, P., Miyazono, K.,
Repression of Runx2 function by TGF beta through
and Heldin, C. (1994) Formation of hetero oligomeric
recruitment of class II histone deacetylases by Smad3,
complexes of type I and type II receptors for transforming
EMBO J., 24, 2543 2555.
growth factor β, J. Biol. Chem., 269, 20172 20178.
73.
Massagué, J. (2014) TGFbeta signalling in context, Nat.
57.
Massagué, J. (1998) TGF beta signal transduction, Annu.
Rev. Mol. Cell Biol., 13, 616 630, doi: 10.1038/nrm3434.
Rev. Biochem.,
67,
753791, doi:
10.1146/annurev.
74.
Zhang, S., Fei, T., Zhang, L., Zhang, R., Chen, F., Ning, Y.,
biochem.67.1.753.
Han, Y., Feng, X., Meng, A., and Chen, Y. (2007) Smad7
58.
Massagué, J., and Chen, Y. (2000) Controlling TGF beta
antagonizes transforming growth factor signaling in the
signaling, Genes Dev., 14, 627 644.
nucleus by interfering with functional Smad DNA com
59.
Feng, X., and Derynck, R. (2005) Specificity and versatili
plex formation, Mol. Cell. Biol.,
27,
44884499,
ty in tgf beta signaling through smads, Annu. Rev. Cell Dev.
doi: 10.1128/mcb.01636 06.
Biol.,
21,
659693, doi:
10.1146/annurev.cellbio.21.
75.
Gu, W., Monteiro, R., Zuo, J., Simões, F., Martella, A.,
022404.142018.
Andrieu Soler, C., Grosveld, F., Sauka Spengler, T., and
60.
Huang, T., David, L., Mendoza, V., Yang, Y., Villarreal, M.,
Patient, R. (2015) A novel TGFβ modulator that uncouples
De, K., Sun, L., Fang, X., López Casillas, F., Wrana, J.,
R Smad/I Smad mediated negative feedback from R
and Hinck, A. (2011) TGF β signalling is mediated by two
Smad/ligand driven positive feedback, PLoS Biol., 13,
autonomously functioning TβRI:TβRII pairs, EMBO J.,
doi: 10.1371/journal.pbio.1002051.
30, 1263 1276, doi: 10.1038/emboj.2011.54.
76.
Thielen, N., van der Kraan, P., and van Caam, A. (2019)
61.
Atfi, A., Dumont, E., Colland, F., Bonnier, D.,
TGFβ/BMP signaling pathway in cartilage homeostasis, 8,
L’helgoualc’h, A., Prunier, C., Ferrand, N., Clément, B.,
9, doi: 10.3390/cells8090969.
Wewer, U., and Théret, N. (2007) The disintegrin and met
77.
Li, Y., Luo, W., and Yang, W. (2018) Nuclear transport and
alloproteinase ADAM12 contributes to TGF β signaling
accumulation of Smad proteins studied by single molecule
through interaction with the type II receptor, J. Cell Biol.,
microscopy, Biophys. J., 114, 2243 2251 doi: 10.1016/j.bpj.
16, 201 208, doi: 10.1083/jcb.200612046.
2018.03.018.
62.
Kang, J., Liu, C., and Derynck, R. (2009) New regulatory
78.
Jin, Q., Gao, G., and Mulder, K. (2009) Requirement of a
mechanisms of TGF β receptor function, Trends Cell Biol.,
dynein light chain in TGFβ/Smad3 signaling, J. Cell.
19, 385 394, doi: 10.1016/j.tcb.2009.05.008.
Physiol., 221, 707 715, doi: 10.1002/jcp.21910.
БИОХИМИЯ том 85 вып. 4 2020
ПРИНЦИПЫ ДЕЙСТВИЯ ЦИТОКИНА Tgfβ3
519
79.
Batut, J., Howell, M., and Hill, C. (2007) Kinesin mediat
93. Blaney Davidson, E., Remst, D., Vitters, E., van
ed transport of Smad2 is required for signaling in response
Beuningen, H., Blom, A., Goumans, M., van den Berg, W.,
to TGF β ligands, Dev. Cell., 12, 261 274, doi: 10.1016/
and van der Kraan, P. (2009) Increase in ALK1/ALK5
j.devcel.2007.01.010.
ratio as a cause for elevated MMP 13 expression in
80.
Massagué, J., Seoane, J., and Wotton, D. (2005) Smad
osteoarthritis in humans and mice, J. Immunol., 182, 7937
transcription factors, Genes Dev.,
19,
27832810,
7945, doi: 10.4049/jimmunol.0803991.
doi: 10.1101/gad.1350705.
94. Siomi, H., and Siomi, M. (2010) Posttranscriptional regu
81.
Hill, C. (2016) Transcriptional control by the SMADs,
lation of microRNA biogenesis in animals, Mol. Cell, 38,
Cold Spring Harbor Persp. Biol.,
8, doi:
10.1101/
323 332, doi: 10.1016/j.molcel.2010.03.013.
cshperspect.a022079.
95. Ha, M., and Kim, V. (2014) Regulation of microRNA bio
82.
Qiao, B., Padilla, S., and Benya, P. (2005) Transforming
genesis, Nat. Rev. Mol. Cell Biol.,
15,
509524,
growth factor (TGF) β activated kinase 1 mimics and
doi: 10.1038/nrm3838.
mediates TGF β induced stimulation of type II collagen
96. Blahna, M., and Hata, A. (2012) Smad mediated regula
synthesis in chondrocytes independent of Col2a1 tran
tion of microRNA biosynthesis, FEBS Lett., 586, 1906
scription and Smad3 signaling, J. Biol. Chem., 280, 17562
1912, doi: 10.1016/j.febslet.2012.01.041.
17571, doi: 10.1074/jbc.M500646200.
97. Zhang, Y., Huang, X., and Yuan, Y. (2017) MicroRNA
83.
Bhogal, R., Stoica, C., McGaha, T., and Bona, C. (2005)
410 promotes chondrogenic differentiation of human bone
Molecular aspects of regulation of collagen gene expression
marrow mesenchymal stem cells through down regulating
in fibrosis, J. Clin. Immun., 25, 592 603, doi: 10.1007/
Wnt3a, Am. J. Transl. Res., 9, 136 145.
s10875 005 7827 3.
98. Lee, S., Yoon, D., Paik, S., Lee, K., Jang, Y., and Lee, J.
84.
Bell, D., Leung, K., Wheatley, S., Ng, L., Zhou, S., Ling, K.,
(2014) MicroRNA 495 Inhibits chondrogenic differentia
Sham, M., Koopman, P., Tam, P., and Cheah, K. (1997)
tion in human mesenchymal stem cells by targeting Sox9,
SOX9 directly regulates the type II collagen gene, Nat.
Stem Cells Dev.,
23,
17981808, doi:
10.1089/scd.
Genet., 16,174 178, doi: 10.1038/ng0697 174.
2013.0609.
85.
Sen, R., Pezoa, S., Carpio, Shull, L., Hernandez Lagunas, L.,
99. Crecente Campo, J., Borrajo, E., Vidal, A., and Garcia
Niswander, L., and Artinger, K. (2018) Kat2a and Kat2b
Fuentes, M., (2017) New scaffolds encapsulating TGF
acetyltransferase activity regulates craniofacial cartilage
β3/BMP 7 combinations driving strong chondrogenic dif
and bone differentiation in Zebrafish and mice, J. Dev.
ferentiation, Eur. J. Pharm. Biopharm., 114, 69 78, doi:
Biol., 12, doi: 10.3390/jdb6040027.
10.1016/j.ejpb.2016.12.021.
86.
Chen, X., Huang, H., Wang, H., Guo, F., Du, X., Ma, L.,
100. Wang, J., Sun, B., Tian, L., He, X., Gao, Q., Wu, T.,
Zhao, L., Pan, Z., Gui, H., Yuan, T., Liu, X., Song, L.,
Ramakrishna, S., Zheng, J., and Mo, X. (2017) Evaluation
Wang, Y., He, J., Lei, H., and Gao, R.
(2014)
of the potential of rhTGF β3 encapsulated P(LLA
Characterization of zebrafish pax1b and pax9 in fin bud
CL)/collagen nanofibers for tracheal cartilage regeneration
development, Biomed Res. Int.,
2014,
309385,
using mesenchymal stems cells derived from Wharton’s
doi: 10.1155/2014/309385.
jelly of human umbilical cord, Mater. Sci. Eng., 70, 637
87.
Seoane, J., Le, H., Shen, L., Anderson, S., and Massagué, J.
645, doi: 10.1016/j.msec.2016.09.044.
(2004) Integration of smad and forkhead pathways in the
101. Yanagawa, Y., Hiraide, S., and Iizuka, K. (2016) Isoform
control of neuroepithelial and glioblastoma cell prolifera
specific regulation of transforming growth factor β mRNA
tion, Cell,
117,
211223, doi:
10.1016/S0092
expression in macrophages in response to adrenoceptor
8674(04)00298 3.
stimulation, Microbiol. Immunol., 60, 56 63. doi: 10.1111/
88.
Naka, K., Hoshii, T., Muraguchi, T., Tadokoro, Y.,
1348 0421.12344.
Ooshio, T., Kondo, Y., Nakao, S., Motoyama, N., and
102. Frangogiannis, N. G. (2017) The role of transforming
Hirao, A. (2010) TGF β FOXO signalling maintains
growth factor (TGF) β in the infarcted myocardium, J.
leukaemia initiating cells in chronic myeloid leukaemia,
Thor. Dis., 9, 52 63, doi: 10.21037/jtd.2016.11.19.
Nature, 463, 676 680, doi: 10.1038/nature08734.
103. Luo, Z., Jiang, L., Xu, Y., Li, H., Xu, W., Wu, S., Wang, Y.,
89.
Kang, Y., Chen, C., and Massagué, J. (2003) A self
Tang, Z., Lv, Y., and Yang, L. (2015) Mechano growth fac
enabling TGFβ response coupled to stress signaling: Smad
tor (MGF) and transforming growth factor (TGF) β3
engages stress response factor ATF3 for Id1 repression in
functionalized silk scaffolds enhance articular hyaline car
epithelial cells, Mol. Cell, 11, 915 926, doi: 10.1016/
tilage regeneration in rabbit model, Biomaterials, 52, 463
S1097 2765(03)00109 6.
475, doi: 10.1016/j.biomaterials.2015.01.001.
90.
Vincent, T., Neve, E., Johnson, J., Kukalev, A., Rojo, F.,
104. Yang, S. S., Jin, L. H., Park, S. H., Kim, M. S., Kim, Y. J.,
Albanell, J., Pietras, K., Virtanen, I., Philipson, L.,
Choi, B. H., Lee, C. T., Park, S. R., and Min, B. H. (2016)
Leopold, P., Crystal, R., de Herreros, A., Moustakas, A.,
Extracellular matrix (ECM) multilayer membrane as a sus
Pettersson, R., and Fuxe, J. (2009) A SNAIL1 SMAD3/4
tained releasing growth factor delivery system for rhTGF
transcriptional repressor complex promotes TGF β medi
β3 in articular cartilage repair, PLoS One, 11, e0156292,
ated epithelial mesenchymal transition, Nat. Cell Biol., 11,
doi: 10.1371/journal.pone.0156292.
943 950, doi: 10.1038/ncb1905.
105. Yang, Q., Teng, B. H., Wang, L. N., Li, K., Xu, C., Ma, X. L.,
91.
Pardali, K., Kurisaki, A., Morén, A., ten Dijke, P.,
Zhang, Y., Kong, D.L., Wang, L. Y., and Zhao, Y. H.
Kardassis, D., and Moustakas, A. (2000) Role of Smad
(2017) Silk fibroin/cartilage extracellular matrix scaffolds
proteins and transcription factor Sp1 in p21Waf1/Cip1 reg
with sequential delivery of TGF β3 for chondrogenic dif
ulation by transforming growth factor β, J. Biol. Chem.,
ferentiation of adipose derived stem cells, Int. J.
275, 29244 29256, doi: 10.1074/jbc.M909467199.
Nanomed., 12, 6721 6733, doi: 10.2147/IJN.S141888.
92.
Baugé, C., Cauvard, O., Leclercq, S., Galéra, P., and
106. Wang, X., Li, Y., Han, R., He, C., Wang, G., Wang, J.,
Boumédiene, K. (2011) Modulation of transforming
Zheng, J., Pei, M., and Wei, L. (2014) Demineralized
growth factor beta signalling pathway genes by transform
bone matrix combined bone marrow mesenchymal stem
ing growth factor beta in human osteoarthritic chondro
cells, bone morphogenetic protein 2 and transforming
cytes: Involvement of Sp1 in both early and late response
growth factor β3 gene promoted pig cartilage defect
cells to transforming growth factor beta, Arthritis Res.
repair, PLoS One, 9, e116061, doi: 10.1371/journal.pone.
Ther., 13, 23, doi: 10.1186/ar3247.
0116061.
БИОХИМИЯ том 85 вып. 4 2020
520
БОЖОКИН и др.
107. Sun, Q., Zhang, L., Xu, T., Ying, J., Xia, B., Jing, H., and
enchymal stem cells in 3D hydrogels, Acta Biomater., 96,
Tong, P. (2018) Combined use of adipose derived stem cells
271 280, doi: 10.1016/j.actbio.2019.07.027.
and TGF β3 microspheres promotes articular cartilage
109. Rothrauff, B., Sasaki, H., Kihara, S., Overholt, K.,
regeneration in vivo, Biotech. Histochem., 93, 168 176, doi:
Gottardi, R., Lin, H., Fu, F., Tuan, R., and Alexander, P.
10.1080/10520295.2017.1401663.
(2019) Point of care procedure for enhancement of
108. Zhou, M., Lozano, N., Wychowaniec, J. K., Hodgkinson, T.,
meniscal healing in a goat model utilizing infrapatellar fat
Richardson, S. M., Kostarelos, K., and Hoyland, J. A.
pad derived stromal vascular fraction cells seeded in pho
(2019) Graphene oxide: a growth factor delivery carrier to
tocrosslinkable hydrogel, Am. J. Sports Med., 47, 3396
enhance chondrogenic differentiation of human mes
3405, doi: 10.1177/0363546519880468.
EVALUATION Of Tgfβ3 CYTOKINE MECHANISM OF ACTION
AS A THERAPEUTIC AGENT FOR INCREASING SYNTHESIS
OF EXTRACELLULAR MATRIX PROTEINS IN HYALINE CARTILAGE
Review
M. S. Bozhokin1,2*, Y. V. Sopova3,4,5, D. V. Kachkin4,5, A. A. Rubel4,5, and M. G. Khotin2
1 Russian Scientific Research Institute of Traumatology and Orthopedics named after R. R. Vreden,
195427 St. Petersburg, Russia; E mail: writeback@mail.ru
2 Institute of Cytology of the Russian Academy of Science, 194064 St. Petersburg, Russia
3 St. Petersburg subsidiary of Vavilov Institute of General Genetics Russian Academy of Science,
199034 St. Petersburg, Russia
4 St. Petersburg State University, Faculty of Biology, 199034 St. Petersburg, Russia
5 St. Petersburg State University, Faculty of Biology, Laboratory of Amyloid Biology, 199034 St.Peterburg, Russia
Received January 4, 2020
Revised February 26, 2020
Accepted February 26, 2020
Hyaline cartilage is forming a nonvascular connective tissue of the joints surface, consisting mostly from extracellular
matrix proteins and a small number of highly differentiated chondrocytes cells. Nowadays are investigated a various
techniques for repairing a joint surfaces damages, for example, the using of modified cell culture and biodegradable
scaffolds. Molecular mechanisms of cartilage tissue proliferation are being actively studied during recent years. One
of the most important proteins among cytokines and growth factors affecting the chondrogenesis is Tgfβ3, which plays
a critical role in normal cartilage tissue proliferation. Via direct interaction with ligands on the surface of cell mem
brane, Tgfβ3 triggers a cascade of molecular interactions involving transcription factor Sox9. In this review we study
the effect of Tgfβ3 on the receptor complex activation and subsequent intracellular movement of the associated Smad
mediators. An analysis and the relation of these processes and a major extracellular matrix genes, such as col2a1 and
acan expression increase is also presented.
Keywords: Tgfβ3, mechanism of action, hyaline cartilage, Smad proteins, extracellular matrix
БИОХИМИЯ том 85 вып. 4 2020