БИОХИМИЯ, 2020, том 85, вып. 4, с. 556 - 566
УДК 577.151.42/45
ОПРЕДЕЛЕНИЕ СРАВНИТЕЛЬНОЙ АКТИВНОСТИ
КЛЮЧЕВЫХ ФЕРМЕНТОВ ЭКСЦИЗИОННОЙ РЕПАРАЦИИ
ОСНОВАНИЙ В КЛЕТОЧНЫХ ЭКСТРАКТАХ*
© 2020
О.А. Кладова1, Д.А. Яковлев1, Р. Гроисман2,3, А.А. Ищенко2,3,
М.К. Сапарбаев2,3, О.С. Федорова1,4**, Н.А. Кузнецов1,4**
1 Институт химической биологии и фундаментальной медицины СО РАН, 630090 Новосибирск, Россия;
электронная почта: fedorova@niboch.nsc.ru, nikita.kuznetsov@niboch.nsc.ru
2 Groupe “Réparation de l’AND”, Equipe Labellisée par la Ligue Nationale contre le Cancer,
CNRS UMR 8200, Univ. Paris Sud, Université Paris Saclay, F 94805 Villejuif, France
3 Gustave Roussy, Université Paris Saclay, F 94805 Villejuif, France
4 Новосибирский государственный университет, 630090 Новосибирск, Россия
Поступила в редакцию 21.01.2020
После доработки 13.02.2020
Принята к публикации 17.02.2020
Поврежденные азотистые основания ДНК удаляются в процессе эксцизионной репарации оснований. Этот
ферментативный процесс начинается с действия одной из ДНК"гликозилаз, которые находят и удаляют
поврежденные гетероциклические основания путем гидролиза N"гликозидных связей с образованием апу"
ринового/апиримидинового сайта (AP"сайта). Затем апуриновая/апиримидиновая эндонуклеаза APE1 гид"
ролизует фосфодиэфирную связь с 5′"стороны от АР"сайта с образованием одноцепочечного разрыва в
ДНК. Снижение функциональной активности отдельных ферментов BER связано с повышенным риском
развития сердечно"сосудистых, нейродегенеративных и онкологических заболеваний. В данной работе про"
ведена разработка и апробация метода флуоресцентного анализа для измерения активности ключевых
ДНК"гликозилаз и AP"эндонуклеазы человека в клеточных экстрактах. Эффективность флуоресцентных
ДНК"зондов проверяли с помощью очищенных ферментов. Перспективные конструкции зондов были ис"
пытаны для определения активности ферментов в экстрактах клеточных линий A549, MCF7, HeLa, WT"7,
HEK293T и HKC8. Показано, что общий уровень активности ферментов, отвечающих за репарацию АР"
сайтов, удаление урацила и 5,6"дигидроурацила, был выше в линиях раковых клеток по сравнению с нор"
мальной линией клеток почек человека HKC8.
КЛЮЧЕВЫЕ СЛОВА: ферментативная активность, флуоресценция, ДНК"зонд, ДНК"гликозилаза, АР"эн"
донуклеаза.
DOI: 10.31857/S0320972520040089
Окисление, алкилирование, дезаминирова"
процесс опухолевой трансформации клеток. С
ние, апуринизация/апиримидинизация, обра"
другой стороны, этот же спектр повреждений
зование разрывов цепей ДНК - это неполный
возникает при химио" и лучевой терапии опухо"
спектр процессов, которые приводят к повреж"
левых заболеваний [8-10]. Поэтому система за"
дению структуры ДНК [1-7]. С одной стороны,
щиты клетки от повреждений - ферментатив"
такие повреждения ДНК могут инициировать
ная система репарации ДНК выполняет важную
роль в протекании процессов образования и
Принятые сокращения: OGG1 - 8"оксогуанин"
деградации новообразований. Многочисленные
ДНК"гликозилаза; AAG - алкиладенин"ДНК"гликозила"
исследования показали, что активность некото"
за; APE1 - АР"эндонуклеаза человека; MBD4 - метилци" рых ферментов репарации ДНК влияет на ток"
тозин"связывающий домен 4 человека; TDG - тимин"
сичность генотоксинов и/или повреждающих
ДНК"гликозилаза; NEIL1 - эндонуклеаза VIII; NTHL1 -
эндонуклеаза II; АР"сайт - апуриновый/апиримидиновый
факторов, в том числе, используемых в ходе хи"
сайт; F"сайт - остаток (2R,3S)"2"(гидроксиметил)"3"гид"
мио" и лучевой терапии онкологических заболе"
рокситетрагидрофурана; εА
-
1,N6"этеноаденозин; ваний [11, 12]. Также известно, что нарушения
oxoG - 8"оксогуанозин; DHU - 5,6"дигидроуридин.
работы ферментов репарации ДНК вызывают
* Первоначально английский вариант рукописи опубли" тяжелые последствия в организме человека и
часто ведут к возникновению рака и преждевре"
msu.ru/biokhimiya, в рубрике «Papers in Press», BM20"017,
16.03.2020.
менному старению [13, 14]. Считается, что глав"
** Адресат для корреспонденции.
ную роль в одном из путей репарации ДНК, экс"
556
АКТИВНОСТЬ ФЕРМЕНТОВ ЭКСЦИЗИОННОЙ РЕПАРАЦИИ ОСНОВАНИЙ
557
цизионной репарации оснований (BER), игра"
Реакционную смесь выдерживали 1,5 ч, а затем
ют ДНК"гликозилазы, которые узнают различ"
по значению флуоресцентного сигнала, возникаю"
ные модифицированные и неправильно спарен"
щего за счет образования продуктов реакции,
ные основания и катализируют их удаление [15,
определяли специфическую активность. Недав"
16]. Затем апуриновая/апиримидиновая эндо"
но для определения низких концентраций ура"
нуклеаза (АР"эндонуклеаза) удаляет оставший"
цил"ДНК"гликозилазы был предложен метод,
ся фрагмент 2′"дезоксирибозы. Основная задача
основанный на использовании терминальной
этих ферментов состоит в том, чтобы быстро и
дезоксинуклеотидилтрансферазы, с помощью
точно определить местоположение модифици"
которой в образце происходило образование
рованного основания или апуринового/апири"
флуоресцентных кластеров меди [34]. Были раз"
мидинового сайта среди огромного количества
работаны также другие способы усиления сигна"
неповрежденных азотистых оснований и ини"
ла для определения активности урацил"ДНК"
циировать процесс репарации.
гликозилазы [35-37]. Однако, несмотря на оби"
Показано, что клетки и нокаутные живот"
лие различных вариантов регистрации фермен"
ные, лишенные различных ДНК"гликозилаз,
тативной активности в клеточных экстрактах,
становятся более чувствительными к воздей"
некоторые упомянутые способы включают в се"
ствию факторов, приводящих к повреждению
бя выполнение большого количества подготови"
ДНК [17-19]. Генно"инженерное удаление из
тельных этапов, специализированного оборудо"
клеток АР"эндонуклеазы приводит к их гибели,
вания или требуют использования других фер"
что свидетельствует о критической роли этого
ментов, таких как ДНК"полимераза, ДНК"ника"
фермента в процессе восстановления неповреж"
за, рибонуклеаза и даже AP"эндонуклеаза.
денной структуры ДНК [20-22].
Кроме того, необходимо отметить, что коли"
Необходимо отметить, что в последнее время
чественное определение активности ферментов,
интенсивно развиваются методы определения
как правило, основано на сравнении уровня флу"
активности ферментов репарации в клеточных
оресцентного сигнала в реакционной смеси через
экстрактах [23-29]. Для определения фермента"
определенное время с уровнем сигнала, который
тивной активности ДНК"гликозилаз было пред"
получен для очищенного препарата этого же фер"
ложено несколько различных подходов. Эти
мента. Однако множественные литературные
подходы обычно связаны с регистрацией флуо"
данные [38-43] свидетельствуют о том, что актив"
ресцентного сигнала, генерируемого ДНК"зон"
ность ферментов репарации значительно изменя"
дами, содержащими поврежденный нуклеотид,
ется при взаимодействии с другими белками и
который является субстратом для фермента"ми"
ферментами, которые могут присутствовать в
шени [30-32]. Как правило, в качестве источни"
клеточном экстракте и отсутствуют в «калибро"
ков сигнала используются разнообразные флуо"
вочных кривых». Таким образом, одно и то же ко"
ресцентные красители, например, взаимодей"
личество фермента будет приводить к разному из"
ствующие по принципу резонансной передачи
менению флуоресцентного сигнала в контроль"
энергии флуоресценции (FRET) или изменяю"
ной реакционной смеси и клеточном экстракте.
щие интенсивность флуоресценции аналоги азо"
В настоящей работе проведена апробация ме"
тистых оснований, расположенные в одноцепо"
тода определения активности основных фермен"
чечных или двухцепочечных ДНК"зондах [33].
тов эксцизионной репарации оснований (ДНК"
Например, в работе [23] используются ДНК"зон"
гликозилазы и AP"эндонуклеазы человека) в
ды, дополнительно модифицированные биоти"
экстрактах различных клеточных линий челове"
ном для иммобилизации на магнитных наночас"
ка. Основная цель этой работы - это разработка
тицах. Реакционную смесь, содержащую ДНК"
простого в использовании метода измерения ак"
зонд и разное количество фермента (AAG и/или
тивности ферментов BER в клеточных экстрак"
APE1), выдерживали 1 ч, после чего регистриро"
тах. Преимущество представленного FRET"ана"
вали интенсивность флуоресценции раствора.
лиза перед другими заключается в простоте, ос"
Авторы [23] подтверждают, что данные наночас"
нованной на использовании небольшого коли"
тицы деградируют со скоростью 2% в сутки. Та"
чества клеток и синтетического FRET"меченого
ким образом, использование таких конструкций
ДНК"дуплекса, содержащего специфический
осложняется контролем качества данных нано"
поврежденный нуклеотид. Новизна данной ра"
частиц и контролем концентрации флуоресцент"
боты заключается в анализе не только амплитуды
ного ДНК"зонда на поверхности этих наночас"
изменения сигнала через определенное время,
тиц. В другой работе [30] для анализа активности
но и скорости расщепления ДНК"зонда.
ферментов OGG1 и AAG использовали специа"
В ходе работы был синтезирован ряд флуо"
лизированное оборудование, позволяющее реги"
ресцентных ДНК"зондов, содержащих в качест"
стрировать сигнал на уровне одной молекулы.
ве повреждения такие нуклеотиды, как F"сайт,
БИОХИМИЯ том 85 вып. 4 2020
558
КЛАДОВА и др.
Таблица 1. Последовательность ДНК"зондов, использованных в работе, содержащих специфическое повреждение для
различных ДНК"гликозилаз и AP"эндонуклеазы
Целевой фермент
Поврежденный нуклеотид
Последовательность ДНК"зонда
APE1
5′"FAM" GCTCA(F)GTACAGAGCTG"3′
F
3′"BHQ1"CGAGT(G)CATGTCTCGAC"5′
OGG1
5′"FAM"GCTCA(oxoG)GTACAGAGCTG"3′
oxoG
3′"BHQ1"CGAGT (C) CATGTCTCGAC"5′
UNG2, SMUG1, MBD4, TDG
U
Тип I
5′"FAM"GCTCA(U)GTACAGAGCTG"3′
3′"CGAGT(G)CATGTCTCGAC"BHQ1"5′
Тип II
5′"FAM"GCTCA(U)GTACAGAGCTG"3′
3′"BHQ1"CGAGT(G)CATGTCTCGAC"5′
NEIL1, NTHL1
5′"FAM"GCTCA(DHU)GTACAGAGCTG"3′
DHU
3′"BHQ1"CGAGT (G) CATGTCTCGAC"5′
AAG
εA
5′"FAM"GCTCA(εA)GTACAGAGCTG"3′
3′"BHQ1"CGAGT (T)CATGTCTCGAC"5′
Неспецифическое расщепление
C
5′"FAM"GCTCA(С)GTACAGAGCTG"3′
3′"BHQ1"CGAGT(G)CATGTCTCGAC"5′
Примечание. FAM - остаток 6"карбоксифлуоресцеина, BHQ1 - тушитель флуоресценции «black hole quencher».
5,6"дигидроуридин (DHU), 1,N6"этеноаденозин
фичность к определенному ферменту или груп"
(εA), 8"оксогуанозин (oxoG) и уридин (табл. 1).
пе ферментов (табл. 1). При удалении повреж"
Эффективность данных зондов определена с по"
денного азотистого основания, входящего в сос"
мощью очищенных препаратов нескольких
тав ДНК"зонда, происходит либо образование
ДНК"гликозилаз и АР"эндонуклеазы человека.
AP"сайта (в случае действия монофункциональ"
Перспективные конструкции были использова"
ных ДНК"гликозилаз, таких как UNG2,
ны для определения активности ферментов в
SMUG1, MBD4, TDG и AAG), либо образова"
экстрактах клеточных линий A549, MCF7, HeLa,
ние разрыва в цепи, содержащей повреждение
WT"7, HEK293T и HKC8. В качестве контроля
(в случае действия бифункциональных ДНК"
неспецифического расщепления ДНК"зондов
гликозилаз, таких как OGG1, NEIL1 и NTHL1).
использовали дуплекс, не содержащий повреж"
Фермент APE1 также образует одноцепочечный
денных нуклеотидов, что позволило оценить ус"
разрыв в цепи, содержащей F"сайт. После обра"
тойчивость используемых зондов к неспецифи"
зования разрыва происходит плавление корот"
ческим эндо" и экзонуклеазам в клеточных
ких участков ДНК"продукта и пространствен"
экстрактах. Было показано, что флуоресцентные
ное отдаление FRET"красителей FAM и BHQ1
ДНК"зонды можно использовать для измерения
друг от друга, что приводит к значительному
активности нескольких ДНК"гликозилаз и АР"
росту флуоресцентного сигнала FAM.
эндонуклеазы APE1 человека. Чувствительность
Клеточные линии. Для анализа активности
анализа позволяет измерить активность некото"
ферментов репарации ДНК с помощью ДНК"
рых ферментов в экстракте, содержащем
зондов использовали клетки человека различ"
106 клеток. Анализ различных раковых и нерако"
ных линий: A549, HeLa, MCF7, WT"7, HEK293T
вых клеточных линий выявил различия в актив"
и HKC8 (табл. 2). Клетки линий HEK293T, A549,
ности ключевых ферментов BER.
WT"7, HeLa, HKC8 культивировали в среде
DMEM («Gibco»,
«ThermoFisher Scienific»,
США), клетки линии MCF7 культивировали в
МАТЕРИАЛЫ И МЕТОДЫ
среде RPMI"1640
(«Gibco»,
«ThermoFisher
Scienific») с 10%"ной фетальной сывороткой те"
Структура ДНК8зондов. ДНК"зонды содер"
лят («Gibco», «Thermo FS»), 100 мкг/мл стрепто"
жали FRET"пару красителей FAM/BHQ1 и пов"
мицина и 100 ед./мл пенициллина в атмосфере
режденный нуклеотид, обеспечивающий специ"
5%"ного CO2 при 37 °C.
БИОХИМИЯ том 85 вып. 4 2020
АКТИВНОСТЬ ФЕРМЕНТОВ ЭКСЦИЗИОННОЙ РЕПАРАЦИИ ОСНОВАНИЙ
559
Клетки механически снимали с поверхности
Таблица 2. Клеточные линии человека, использованные в
работе
культурального флакона, осаждали центрифуги"
рованием (1000 об/мин, 2 мин), ресуспендиро"
Название
Происхождение клеточной линии
вали в растворе PBS и также осаждали центри"
фугированием (1000 об/мин, 2 мин). Данную
A549
карцинома легкого
процедуру повторяли два раза.
HeLa
карцинома шейки матки
Подсчет клеток проводили, используя авто"
MCF7
карцинома молочной железы
матический счетчик клеток Countess II
Automated Cell Counter («Thermo FS»). Для это"
WT"7
карцинома почки
го 10 мкл клеточной суспензии смешивали с
HEK293T
эмбриональные клетки почки
10 мкл трипанового синего, 10 мкл смеси поме"
HKC8
клетки почки
щали в кассету для подсчета клеток (Bio"Rad,
США).
Подготовка клеточного экстракта. Для анали"
за активности ферментов репарации ДНК ис"
светофильтра OG"515 («Schott», Германия). Все
пользовали 1×106 клеток. Лизис клеток прово"
эксперименты проводили при 25 °С в буфере,
дили в CHAPS буфере (10 мМ Tris"HCl, pH 7,5,
состоящем из 50 мМ Тris"HCl, рН 7,5, 50 мМ
1 мМ MgCl2, 1 мМ EDTA, 0,5%"ный CHAPS,
KCl, 1,0 мМ ЭДТА, 1,0 мМ DTT, 5,0 мМ MgCl2 и
10%"ный глицерин, 0,1 мМ PMSF, 0,5 мМ β"
7%"ного глицерина.
меркаптоэтанол). Общую концентрацию белка
Раствор, содержащий ДНК"гликозилазы
измеряли по методу Бредфорда (концентрация
или смесь ДНК"гликозилазы и AP"эндонуклеа"
белков, как правило, составляла 1-2 мкг/мкл).
зы в буфере, быстро смешивали в реакционной
Клеточный экстракт хранили при -80 °C и раз"
камере с раствором ДНК"зонда. Мертвое время
мораживали непосредственно перед работой.
прибора - 1,4 мс. Концентрация ферментов и
Определение активности ферментов в клеточ8
ДНК"зонда составляла 1,0 мкМ во всех экспе"
ном экстракте. Пробы готовили в 100 мкл буфер"
риментах. Указанные концентрации реагентов
ного раствора (50 мМ Tris"HCl, pH 7,5, 50 мМ
соответствуют концентрациям в реакционной
KCl, 1 мМ ЭДТА, 1 мМ ДТТ, 7%"ный глицерин),
кювете после смешивания. Как правило, каж"
содержащего 70 мкл экстракта клеток. ДНК"
дую кинетическую кривую, представленную на
зонд, содержащий определенный тип повреж"
рисунках, воспроизводили несколько раз. Из"
денного нуклеотида (табл. 1), добавляли к кле"
мерение FRET"сигнала характеризует измене"
точному экстракту до конечной концентрации
ние расстояния между красителем FAM и туши"
1 мкМ. После быстрого перемешивания ДНК"
телем BHQ1 как в процессе конформационных
зонда и клеточного экстракта проводили реги"
изменений ДНК"зонда при образовании ката"
страцию FRET"сигнала, используя прибор
литического комплекса фермент-ДНК, так и
FLUOstar Omega («BMG Labtech», Германия).
при последующем расщеплении ДНК и диссо"
Длина волны возбуждения флуоресценции сос"
циации комплекса фермент-продукт.
тавляла λex = 485 нм, регистрацию эмиссии про"
водили на длине волны λem = 520 нм. Макси"
мальное время реакции составляло 2000 с, тем"
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
пература 37 °С. Каждый эксперимент проводили
трижды. Амплитуду FRET"сигнала после инку"
Для регистрации каталитической активнос"
бирования реакционной смеси в течение 2000 с
ти ДНК"гликозилаз и АР"эндонуклеазы были
использовали для определения относительной
разработаны ДНК"субстраты, несущие повреж"
активности ферментов в разных клеточных ли"
денный нуклеотид, обеспечивающий специ"
ниях.
фичность к данному ферменту и FRET"пару
Кинетический анализ рекомбинантных фер8
красителей на концах дуплекса. Для оценки
ментов методом «остановленного потока». Кине"
чувствительности использовали два типа ДНК"
тические кривые, характеризующие взаимодей"
субстратов (рис. 1): тип I ДНК"субстратов
ствие рекомбинантных ферментов с ДНК"зон"
(рис. 1, а) содержал красители FAM и BHQ1 на
дом, были получены на спектрометре останов"
5′"концах олигонуклеотидов, а тип II ДНК"
ленного потока SX.18MV («Applied Photophysics
субстратов (рис. 1, б) содержал FAM на 5′"конце
Ltd.», Великобритания) с регистрацией FRET"
и BHQ1 на 3′"конце олигонуклеотидов, форми"
сигнала, как описано ранее [44-47]. Длина вол"
рующих дуплекс.
ны возбуждения флуоресценции FAM составля"
Необходимо отметить, что анализ активнос"
ла λex= 494 нм, и регистрацию FRET"сигнала
ти монофункциональных ДНК"гликозилаз, об"
проводили при λem > 515 нм с использованием
разующих в ДНК"дуплексе АР"сайт, представ"
БИОХИМИЯ том 85 вып. 4 2020
560
КЛАДОВА и др.
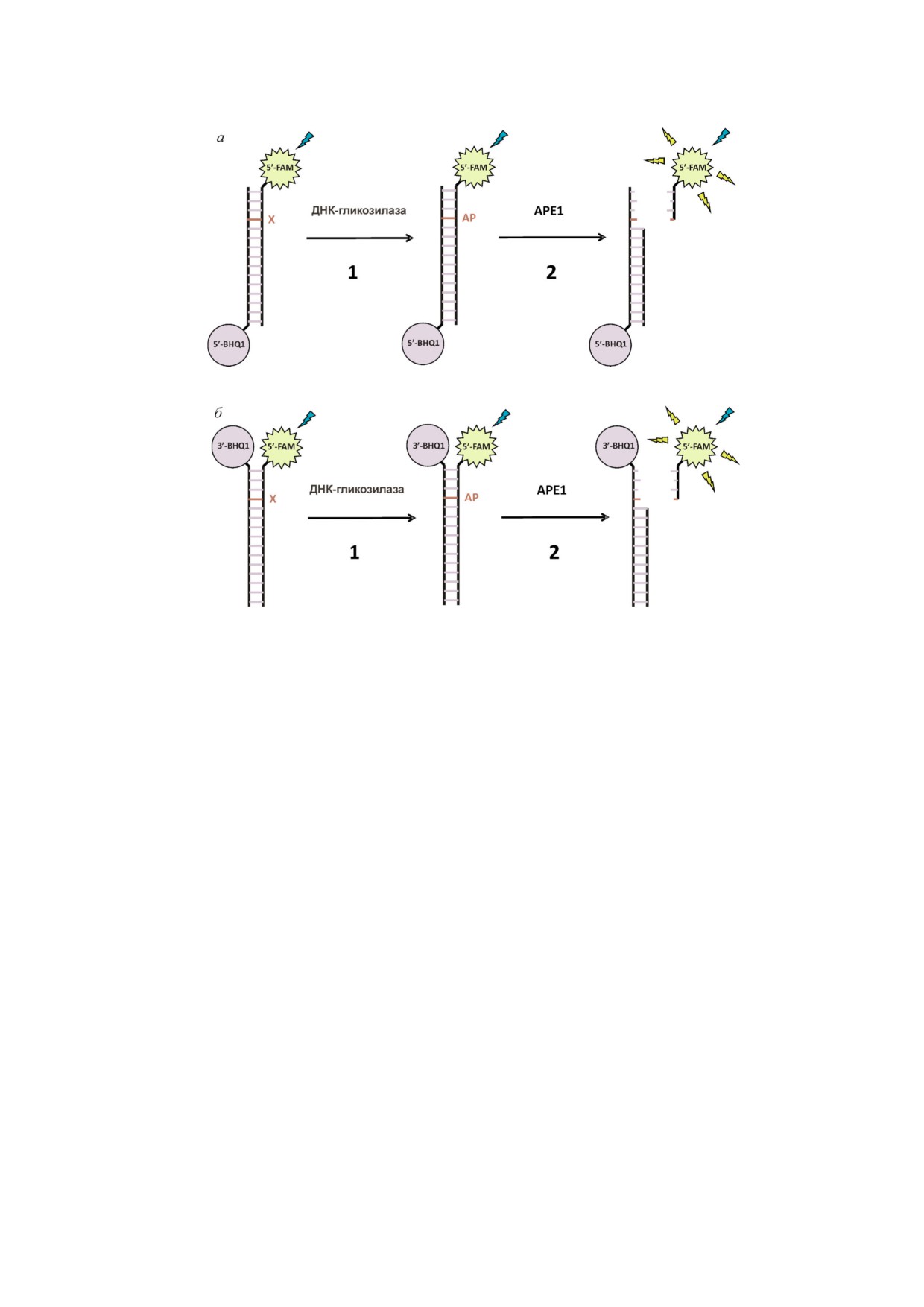
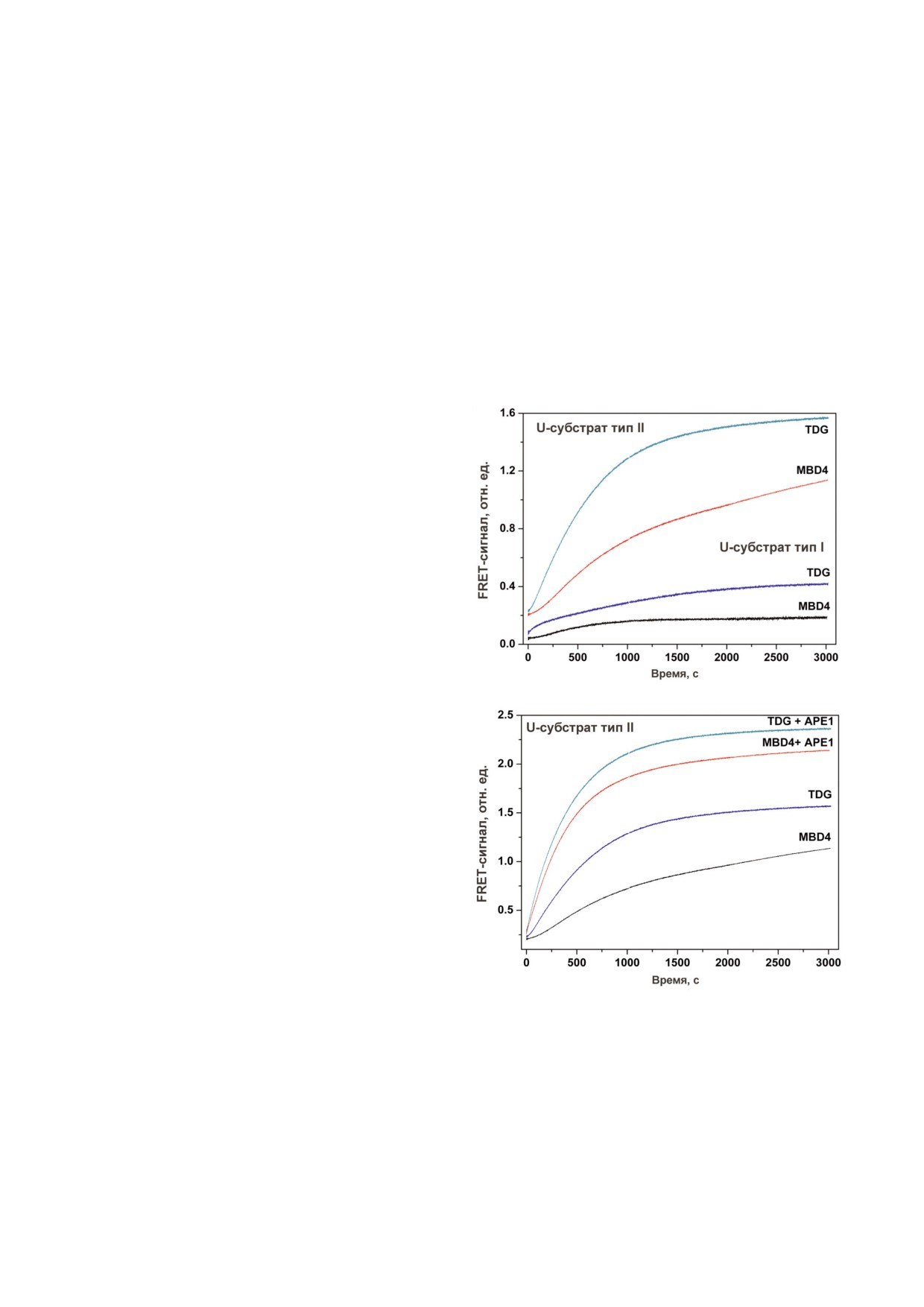
Рис. 1. Принципиальная схема анализа процессов взаимодействия монофункциональных ДНК"гликозилаз с модельны"
ми FRET"субстратами: (а) тип I, (б) тип II. Стадия 1 - удаление поврежденного основания X и образование АР"сайта.
Стадия 2 - расщепление АР"сайта АР"эндонуклеазой APE1, которое ведет к пространственному отдалению флуорофора
FAM и тушителя BHQ1 и значительному росту FRET"сигнала.
journal/biokhsm/
ляет нетривиальную задачу по сравнению с би"
Второй тип ДНК"субстрата (рис. 1, б), содер"
функциональными ДНК"гликозилазами и АР"
жащий красители на одном конце ДНК"дуплек"
эндонуклеазой, которые формируют одноцепо"
са, обладал большей амплитудой изменения
чечный разрыв в модельном ДНК"субстрате.
FRET"сигнала и, соответственно чувствитель"
Поэтому чувствительность обоих типов ДНК"
ностью, при взаимодействии с MBD4 и TDG.
субстратов была проанализирована при исполь"
Поэтому в последующих экспериментах с учас"
зовании монофункциональных ДНК"гликози"
тием АР"эндонуклеазы APE1 использовали этот
лаз MBD4 и TDG (рис. 2). Взаимодействие
модельный субстрат. Взаимодействие MBD4 и
MBD4 и TDG с модельными дуплексами, содер"
TDG с данным субстратом в присутствии APE1
жащими в качестве повреждения уридин, при"
приводило к значительному ускорению и при"
водило к удалению урацила и образованию АР"
мерно двукратному увеличению амплитуды фа"
сайта (рис. 1, стадия 1), этот процесс сопровож"
зы роста FRET"сигнала (рис. 2, б), что свиде"
дается медленным ростом FRET"сигнала
тельствует об образовании одноцепочечного
(рис. 2, a). Сравнение кинетических кривых с
разрыва по АР"сайту, катализируемого АР"эндо"
ранее полученными данными для MBD4 пока"
нуклеазой. Кроме того, ранее было показано,
зывает, что медленный рост FRET"сигнала в ин"
что АР"эндонуклеаза APE1 стимулирует актив"
тервале времени 100-3000 с совпадает с медлен"
ность ДНК"гликозилаз в условиях множествен"
ным накоплением продуктов реакции и, по"ви"
ного оборота фермента [38-43]. Таким образом,
димому, характеризует скорость"лимитирую"
присутствие АР"эндонуклеазы в реакционной
щую стадию диссоциации комплекса фермента
смеси позволяет увеличить амплитуду измене"
с продуктом реакции, содержащим АР"сайт
ний FRET"сигнала при взаимодействии с моно"
[48].
функциональными ДНК"гликозилазами и по"
БИОХИМИЯ том 85 вып. 4 2020
АКТИВНОСТЬ ФЕРМЕНТОВ ЭКСЦИЗИОННОЙ РЕПАРАЦИИ ОСНОВАНИЙ
561
высить чувствительность модельного суб"страта
клеточных экстрактах содержатся экзо" и эндо"
к данным ферментам. На основании получен"
нуклеазы, которые могут неспецифически гид"
ных данных далее в работе с клеточными
ролизовать ДНК"зонд, для контроля такого
экстрактами использовали ДНК"субстраты ти"
расщепления использовали ДНК"дуплекс, не
па II.
содержащий поврежденных нуклеотидов в сво"
Полученные данные показывают, что в слу"
ей структуре (С"зонд) (табл. 1).
чае ДНК"зонда типа I чувствительность к рас"
Для анализа активности ферментов репара"
щеплению ДНК невысока, но все же достаточ"
ции ДНК с помощью ДНК"зондов были выбра"
на для обнаружения этого процесса in vitro. Од"
ны клетки опухолевых линий человека различ"
нако даже такая низкая чувствительность поз"
ного гистологического происхождения (табл.
воляет регистрировать процесс образования
2). Все подготовленные образцы содержали
AP"сайта, который сопровождается увеличени"
клеточный экстракт и ДНК"зонд с определен"
ем гибкости дуплекса ДНК после удаления ура"
ным поврежденным нуклеотидом. На рис. 3
цила монофункциональными ДНК"гликозила"
приведены кинетические кривые изменения
зами и уменьшением расстояния между краси"
телями. ДНК"зонд типа II обладает более высо"
а
кой чувствительностью к расщеплению ДНК
из"за более короткого расстояния между флуо"
рофором и тушителем. Кроме того, в случае од"
новременного действия ДНК"гликозилазы и
AP"эндонуклеазы, который реализуется в кле"
точном экстракте, амплитуда изменения
FRET"сигнала дополнительно увеличивается
~ в 2 раза (рис. 2, б). Поэтому для оценки фер"
ментативной активности в клеточных экстрак"
тах, в которых присутствуют оба фермента, бы"
ли выбраны более чувствительные ДНК"
субстраты типа II.
Для определения активности определенных
ферментов репарации были использованы
ДНК"субстраты типа II, содержащие опреде"
ленный поврежденный нуклеотид (табл. 1). В
качестве поврежденных нуклеотидов были выб"
б
раны модификации, возникающие при окисли"
тельном стрессе (8"оксогуанозин и 5,6"дигид"
роуридин), дезаминировании (уридин), алки"
лировании (1, N6"этеноаденозин) и апуриниза"
ции/апиримидинизации (АР"сайт). Набор
ДНК"зондов, содержащих эти повреждения,
позволил охарактеризовать активность всех
ключевых ферментов репарации человека. Для
определения активности 8"оксогуанин"ДНК"
гликозилазы OGG1 использовали ДНК"зонд,
содержащий остаток 8"оксогуанозина (oxoG"
зонд). Для исследования ДНК"гликозилаз
UNG2, SMUG1, MBD4 и TDG, специфически
узнающих урацил в ДНК, в составе ДНК"зон"
дов присутствовал уридин (U"зонд), для ДНК"
гликозилаз NEIL1 и NTHL1 ДНК"зонд содер"
Рис. 2. Кинетические кривые изменения FRET"сигнала
жал остаток 5,6"дигидроуридина (DHU"зонд), а
при взаимодействии MBD4 и TDG с модельными ДНК"
для алкиладенин"ДНК"гликозилазы AAG в
субстратами типа I и типа II, содержащими в качестве пов"
составе ДНК"дуплексов был остаток 1, N6"эте"
реждения уридин. а - Сравнение чувствительности ДНК"
ноаденозина (εA"зонд). ДНК"зонд, содержа"
субстратов типа I и типа II при взаимодействии с MBD4 и
TDG; б - влияние АР"эндонуклеазы APE1 на взаимодей"
щий в составе аналог AP"сайта - остаток
ствие MBD4 и TDG с U"субстратом типа II.
(2R,3S)"2"(гидроксиметил)"3"гидрокситетра"
С цветным вариантом рисунка можно ознакомиться в
гидрофурана (F"зонд), являлся субстратом для
AP"эндонуклеазы APE1. Поскольку в общих
journal/biokhsm/
БИОХИМИЯ том 85 вып. 4 2020
562
КЛАДОВА и др.
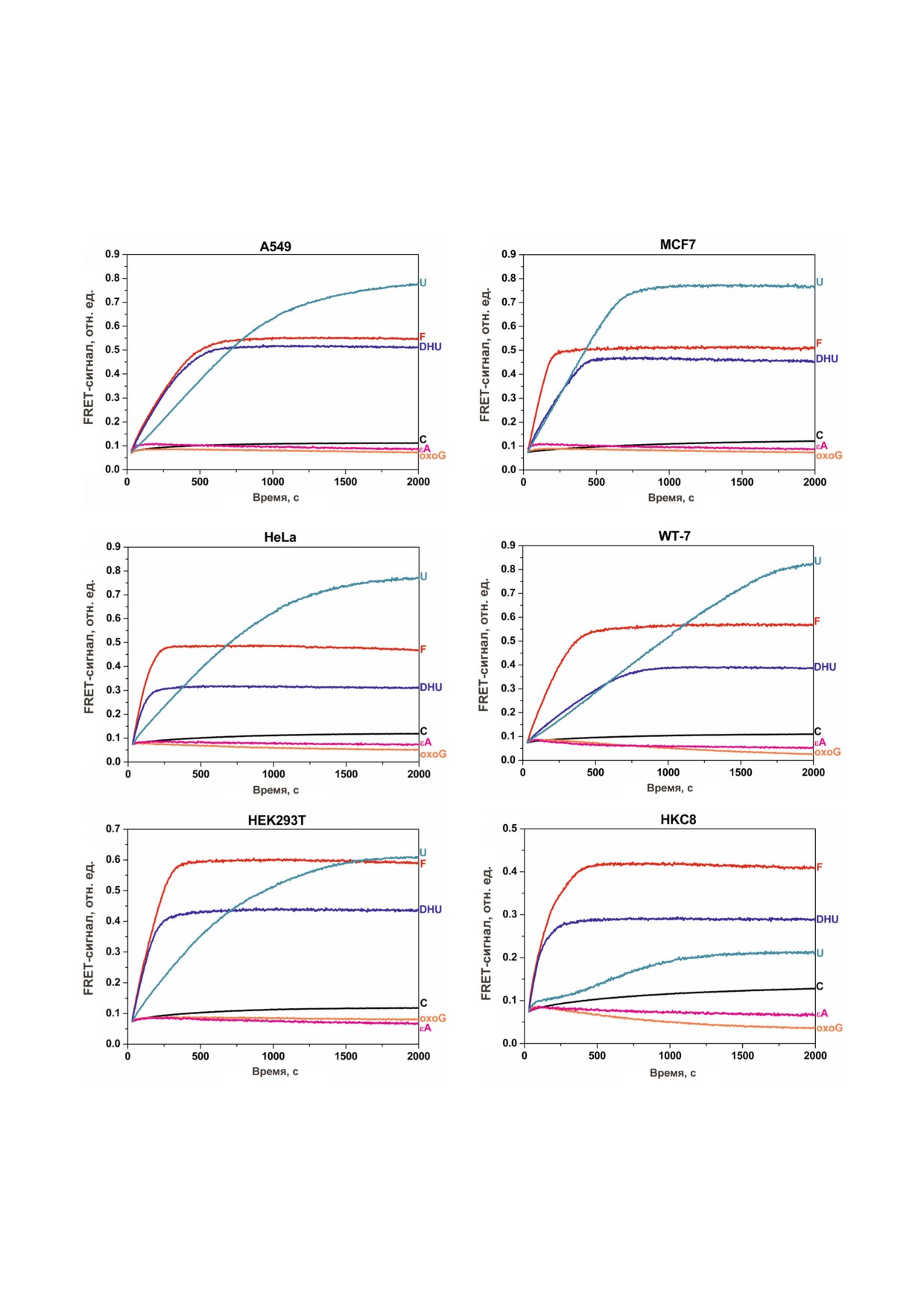
FRET"сигнала, соответствующие расщеплению
гидроуридин, проходило до 2000 с и сопровож"
ДНК"зондов в клеточном экстракте каждой ли"
далось значительным ростом амплитуды FRET"
нии. Для всех линий клеток расщепление ДНК"
сигнала, характеризующим активность соответ"
зондов, содержащих F"сайт, уридин и 5,6"ди"
ствующих ферментов (табл. 1). Необходимо от"
а
б
в
г
д
е
Рис. 3. Изменения FRET"сигнала, характеризующие активность ферментов в клеточных экстрактах линий A549 (а),
MCF7 (б), HeLa (в), WT"7 (г), HEK293T (д), HKC8 (е). Буквенное обозначение ДНК"зондов соответствует табл. 1.
journal/biokhsm/
БИОХИМИЯ том 85 вып. 4 2020
АКТИВНОСТЬ ФЕРМЕНТОВ ЭКСЦИЗИОННОЙ РЕПАРАЦИИ ОСНОВАНИЙ
563
а
б
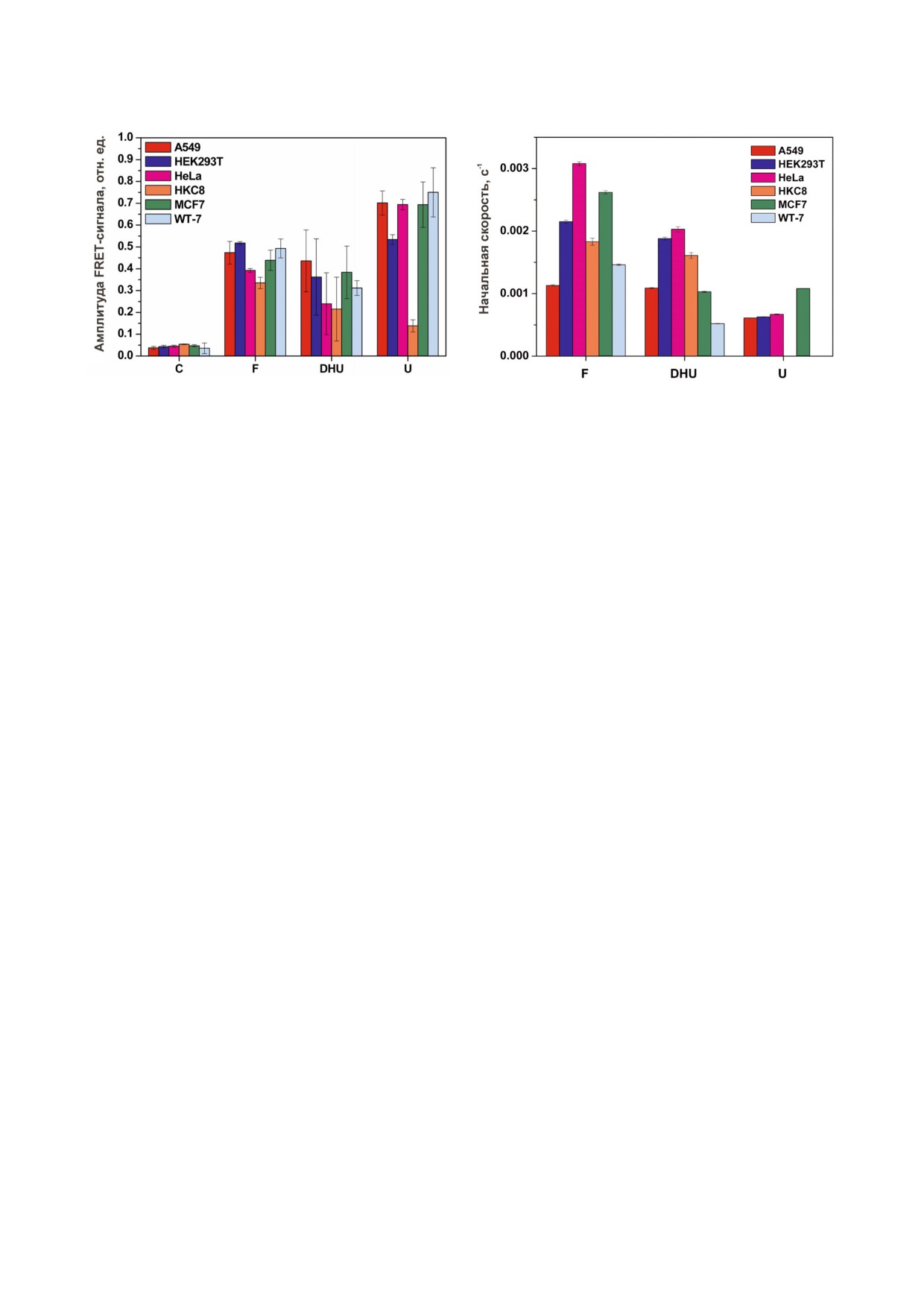
Рис. 4. Относительная активность ферментов репарации в экстрактах клеточных линий A549, MCF7, HeLa, WT"7,
HEK293T и HKC8. а - Амплитуда изменения FRET"сигнала; б - начальная скорость роста FRET"сигнала на кинетичес"
ких кривых.
journal/biokhsm/
метить, что расщепление неповрежденного
сложных взаимодействиях данных зондов с фер"
дуплекса (С"зонд) сопровождалось небольшим
ментами, находящимися в клеточном экстракте,
ростом FRET"сигнала, что свидетельствует о
так и о том, что концентрация OGG1 и AAG в
значительно более медленном неспецифичес"
клеточном экстракте слишком мала для измере"
ком расщеплении ДНК. Для защиты от экзо"
ния активности этих ферментов в клеточном
нуклеазного расщепления используют различ"
экстракте, полученном из 106 клеток. Таким об"
ные подходы: шпилечные структуры, модифи"
разом, можно предположить, что в полученных
цированные концевые нуклеотиды или фос"
клеточных экстрактах концентрация OGG1,
фатные группы. Однако полученные данные
единственной ДНК"гликозилазы, которая отве"
свидетельствуют о том, что использование не"
чает за удаление 8"оксогуанина, и AAG, един"
большого количества клеток позволяет пренеб"
ственной ДНК"гликозилазы, которая отвечает
речь вкладом неспецифического расщепления
за удаление метилированных нуклеотидов, зна"
ДНК"зондов за время проведения анализа. Та"
чительно ниже, чем концентрация урацил"
ким образом, предлагаемый метод определения
ДНК"гликозилаз UNG2, SMUG1, MBD4 и
активности позволил сопоставить специфичес"
TDG, а также ДНК"гликозилаз NEIL1 и
кое и неспецифическое расщепление и заклю"
NTHL1, отвечающих за удаление поврежденных
чить, что в случае F", U" и DHU"зондов можно
пиримидиновых нуклеотидов.
пренебречь деградацией ДНК"зонда клеточны"
Для сравнения относительной активности
ми нуклеазами и, соответственно, использовать
ферментов в клеточных экстрактах разных ли"
стандартные олигонуклеотиды без введения до"
ний использовали амплитуду изменения FRET"
полнительных защитных конструкций в струк"
сигнала через 2000 с после начала регистрации.
туру ДНК"зонда.
Как видно на рис. 4, а, неспецифическое рас"
При этом для всех клеточных линий при ис"
щепление С"зонда происходит с близкой эф"
пользовании oxoG" и εА"зондов, расщепляемых
фективностью во всех линиях клеток. Более зна"
ферментами OGG1 и AAG, соответственно,
чительный рост FRET"сигнала наблюдался для
после незначительного роста FRET"сигнала на
F", U" и DHU"зондов. Сравнение амплитуд
начальном участке кинетических кривых проис"
FRET"сигнала в случае F"зонда выявило не"
ходило его уменьшение в диапазоне времени до
большие различия между клеточными линиями,
2000 с. Такое изменение FRET"сигнала не соот"
не превышающими коэффициент 1,5 (между
ветствует модели прямого расщепления ДНК"
клеточными линиями HKC8 и HEK293T). Сле"
зонда ни за счет специфического расщепления
довательно, этот результат показывает, что уро"
ферментами OGG1 и AAG, ни за счет неспеци"
вень активности AP"эндонуклеазы незначи"
фической деградации, так как в обоих случаях
тельно варьирует среди использованных клеточ"
такое расщепление должно сопровождаться
ных линий.
ростом FRET"сигнала (рис. 1, б). Полученные
В случае анализа активности NEIL1 и
данные могут свидетельствовать как о более
NTHL1 с использованием DHU"зонда разли"
БИОХИМИЯ том 85 вып. 4 2020
564
КЛАДОВА и др.
чия в амплитудах FRET"сигнала были более
В данной работе был апробирован флуорес"
значительными и достигли коэффициента 2
центный метод определения активности ключе"
при сравнении клеток HKC8 и A549. Анализ
вых ферментов репарации человека в экстрактах
суммарной урацил"ДНК"гликозилазной актив"
клеточных линий HKC8, WT"7, A549, MCF7,
ности, характеризующей концентрацию фер"
HEK293T и HeLa. Для этого создан ряд флуо"
ментов UNG2, SMUG1, MBD4 и TDG, выявил
ресцентных ДНК"зондов, содержащих различ"
пятикратное увеличение амплитуд FRET"сиг"
ные типы поврежденных нуклеотидов ДНК, в
нала во всех линиях раковых клеток по сравне"
том числе повреждения ДНК, возникающие при
нию с клетками почки человека HKC8. Напро"
химио" и лучевой терапии онкологических забо"
тив, уровень урацил"ДНК"гликозилазной ак"
леваний. Использование ДНК"зондов позволи"
тивности в эмбриональных клетках почки
ло оценить относительную активность ряда
HEK293T был выше, чем в клеточной линии
ДНК"гликозилаз и АР"эндонуклеазы человека в
HKC8, только в 3,8 раза. Интересно отметить,
здоровых клетках и клетках опухолевых линий.
что, в целом, уровень репарационной активнос"
Показано, что неспецифическая деградация
ти для всех ДНК"зондов оказался ниже в клет"
ДНК"зондов в общем клеточном экстракте про"
ках линии HKC8.
исходит значительно медленнее, чем специфи"
Для сравнения активности ферментов в раз"
ческое расщепление ДНК, содержащей повреж"
личных экстрактах также использовали началь"
денный нуклеотид. При этом уровень активнос"
ную скорость расщепления ДНК"зондов, кото"
ти ферментов репарации, процессирующих F",
рую оценивали как наклон начального участка
DHU" и U"зонды, был выше в раковых линиях
кинетических кривых (рис. 4, б). Анализ началь"
по сравнению с нормальными клетками почки
ного участка кинетических кривых может быть
человека HKC8.
выполнен в условиях стационарного протека"
Полученные результаты могут стать основой
ния процесса расщепления ДНК"зонда. Однако
для создания статистической библиотеки дан"
в случае анализа экстракта клеточной линии
ных об относительной активности ферментов
HKC8 при взаимодействии с ДНК"субстратами,
репарации ДНК в индивидуальных линиях ра"
содержащими урацил, изменения FRET"сигна"
ковых клеток, а также клеток опухолевых тка"
ла имели двухфазный характер (рис. 3, е), что не
ней человека. В перспективе такая молекуляр"
позволило определить начальную скорость рас"
ная характеристика клеток может помочь выяс"
щепления U"зонда. Такое отклонение от стацио"
нить механизмы, лежащие в основе онкогенеза
нарного протекания процесса может быть обус"
и развития опухолевых заболеваний, а также
ловлено сложными белок"белковыми взаимо"
проводить коррекцию методов терапии с целью
действиями ферментов, участвующих на на"
повышения ее эффективности.
чальных этапах пути BER, взаимным влиянием
этих ферментов на активность друг друга, а так"
же присутствием в клеточном экстракте нес"
Финансирование. Работа выполнена при час"
кольких ферментов с одинаковой субстратной
тичной финансовой поддержке проекта ПФНИ
специфичностью. Сравнение начальных ско"
ГАН (АААА"А17"117020210022"4). Часть рабо"
ростей расщепления ДНК"зондов во всех ос"
ты, включающая апробацию ДНК"субстратов
тальных случаях показало, что скорость расщеп"
типа I и II на монофункциональных ДНК"гли"
ления F"сайта отличается между клеточными
козилазах MBD4 и TDG, поддержана грантом
линиями не более чем в три раза для клеток A549
РНФ (16"14"10038). Часть работы, включающая
и HeLa соответственно. В случае DHU"зонда
дизайн ДНК"зондов и определение активности
четырехкратная разница была отмечена между
ферментов репарации в линиях клеток, поддер"
клетками WT"7 и HeLa. Следует отметить, что
жана грантом РНФ (18"14"00135). Работа также
активность ферментов, катализирующих рас"
частично поддержана Ligue National Contre le
щепление F"сайта и DHU в клетках почки чело"
Cancer «Equipe Labellisee», Electricité de France
века HKC8, имела среднее значение, по сравне"
#RB 2017 (M.S.) и French National Research
нию с опухолевыми линиями. Из"за нестацио"
Agency #ANR"18"CE44"0008, и Fondation ARC
нарной кинетики в случае клеточного экстракта
#PJA"20181208015 (A.A.I.).
HKC8 с ДНК"зондом, содержащим урацил, наб"
Конфликт интересов. Авторы заявляют об от"
людаемая константа скорости расщепления U"
сутствии конфликта интересов.
зонда не была рассчитана. Тем не менее, разли"
Соблюдение этических норм. Настоящая ра"
чие в активности урацил"ДНК"гликозилаз сре"
бота не содержит каких"либо исследований, в
ди других клеточных линий не превышало ко"
которых в качестве объектов были использова"
эффициент 2.
ны люди или животные.
БИОХИМИЯ том 85 вып. 4 2020
АКТИВНОСТЬ ФЕРМЕНТОВ ЭКСЦИЗИОННОЙ РЕПАРАЦИИ ОСНОВАНИЙ
565
СПИСОК ЛИТЕРАТУРЫ
1.
Wallace, S. S. (2002) Biological consequences of free radi"
in human cells, Mol. Cell, 17, 463"470, doi: 10.1016/j.molcel.
cal"damaged DNA bases, Free Radic. Biol. Med., 33, 1"14,
2004.12.029.
doi: 10.1016/s0891"5849(02)00827"4.
21.
Xanthoudakis, S., Smeyne, R. J., Wallace, J. D., and
2.
Boiteux, S., and Guillet, M. (2004) Abasic sites in DNA,
Curran, T. (1996) The redox/DNA repair protein, Ref"1, is
repair and biological consequences in Saccharomyces cere*
essential for early embryonic development in mice, Proc.
visiae, DNA Repair, 3, 1"12, doi: 10.1016/j.dnarep.2003.
Natl. Acad. Sci. USA, 93, 8919"8923, doi: 10.1073/Pnas.93.
10.002.
17.8919.
3.
Van Loon, B., Markkanen, E., and Hubscher, U. (2010)
22.
Unnikrishnan, A., Raffoul, J. J., Patel, H. V., Prychitko, T. M.,
Oxygen as a friend and enemy. How to combat the muta"
Anyangwe, N., Meira, L. B., Friedberg, E. C., Cabelof, D.
tional potential of 8"oxo"guanine, DNA Repair (Amst.), 9,
C., and Heydari, A. R. (2009) Oxidative stress alters base
604"616, doi: 10.1016/j.dnarep.2010.03.004.
excision repair pathway and increases apoptotic response in
4.
Kuznetsova, A. A., Knorre, D. G., and Fedorova, O. S.
apurinic/apyrimidinic endonuclease 1/redox factor"1 hap"
(2009) Oxidation of DNA and its components with reactive
loinsufficient mice, Free Radic. Biol. Med., 46, 1488"1499,
oxygen species, Russ. Chem. Rev.,
78,
659"678,
doi: 10.1016/j.freeradbiomed.2009.02.021.
doi: 10.1070/Rc2009v078n07abeh004038.
23.
Gines, G., Saint"Pierre, C., and Gasparutto, D. (2014)
5.
Nakamura, J., Walker, V. E., Upton, P. B., Chiang, S. Y.,
On"bead fluorescent DNA nanoprobes to analyze base
Kow, Y. W., and Swenberg, J. A. (1998) Highly sensitive
excision repair activities, Anal. Chim. Acta, 812, 168"175,
apurinic/apyrimidinic site assay can detect spontaneous
doi: 10.1016/j.aca.2013.12.038.
and chemically induced depurination under physiological
24.
Chaim, I. A., Nagel, Z. D., Jordan, J. J., Mazzucato, P.,
conditions, Cancer Res., 58, 222"225.
Ngo, L. P., and Samson, L. D. (2017) In vivo measure"
6.
Frederico, L. A., Kunkel, T. A., and Shaw, B. R. (1990) A
ments of interindividual differences in DNA glycosylases
sensitive genetic assay for the detection of cytosine deami"
and APE1 activities, Proc. Natl. Acad. Sci. USA, 114,
nation, determination of rate constants and the activation
10379"10388, doi: 10.1073/pnas.1712032114.
energy, Biochemistry (Moscow), 29, 2532"2537.
25.
Maksimenko, A., Ishchenko, A. A., Sanz, G., Laval, J.,
7.
Burcham, P. C. (1999) Internal hazards, baseline DNA
Elder, R. H., and Saparbaev, M. K. (2004) A molecular
damage by endogenous products of normal metabolism,
beacon assay for measuring base excision repair activities,
Mutat. Res., 443, 11"36.
Biochem. Biophys. Res. Commun.,
319,
240"246,
8.
Evans, M. D., Dizdaroglu, M., and Cooke, M. S. (2004)
doi: 10.1016/j.bbrc.2004.04.179.
Oxidative DNA damage and disease, induction, repair and
26.
Lebedeva, N. A., Anarbaev, R. O., Kupryushkin, M. S.,
significance, Mutat. Res., 567, 1"61.
Rechkunova, N. I., Pyshnyi, D. V., Stetsenko, D. A., and
9.
Leandro, G. S., Sykora, P., and Bohr, V. A. (2015) The
Lavrik, O. I. (2015) Design of a new fluorescent oligonu"
impact of base excision DNA repair in age"related neu"
cleotide"based assay for a highly specific real"time detec"
rodegenerative diseases, Mutat. Res.,
776,
31"39,
tion of apurinic/apyrimidinic site cleavage by tyrosyl"DNA
doi: 10.1016/j.mrfmmm.2014.12.011.
phosphodiesterase 1, Bioconjug. Chem., 26, 2046"2053,
10.
Coppede, F., and Migliore, L. (2015) DNA damage in
doi: 10.1021/acs.bioconjchem.5b00451.
neurodegenerative diseases, Mutat. Res., 776, 84"97,
27.
Thomson, G. J., Hamilton, N. S., Hopkins, G. V.,
doi: 10.1016/j.mrfmmm.2014.11.010.
Waddell, I. D., Watson, A. J., and Ogilvie, D. J. (2013) A
11.
Helleday, T., Petermann, E., Lundin, C., Hodgson, B., and
fluorescence"based assay for the apurinic/apyrimidinic"
Sharma, R. A. (2008) DNA repair pathways as targets for
site cleavage activity of human tyrosyl"DNA phosphodi"
cancer therapy, Nat. Rev. Cancer,
8,
193"204,
esterase 1, Anal. Biochem., 440, 1"5, doi: 10.1016/j.ab.
doi: 10.1038/nrc2342.
2013.05.003.
12.
Dietlein, F., Thelen, L., and Reinhardt, H. C. (2014)
28.
Li, J., Svilar, D., McClellan, S., Kim, J."H., Ahn, E."Y. E.,
Cancer"specific defects in DNA repair pathways as targets
Vens, C., Wilson, D. M., and Sobol, R. W. (2018) DNA
for personalized therapeutic approaches, Trends Genet., 30,
repair molecular beacon assay, a platform for real"time
326"339, doi: 10.1016/j.tig.2014.06.003.
functional analysis of cellular DNA repair capacity,
13.
Trushina, E., and McMurray, C. T. (2007) Oxidative stress
Oncotarget, 9, 31719"31743, doi: 10.18632/oncotarget.
and mitochondrial dysfunction in neurodegenerative dis"
25859.
eases, Neuroscience, 145, 1233"1248, doi: 10.1016/j.neuro"
29.
Wilson, D. L., and Kool, E. T. (2018) Fluorescent probes of
science.2006.10.056.
DNA repair, ACS Chem. Biol.,
13,
1721"1733,
14.
Cooke, M. S., Evans, M. D., Dizdaroglu, M., and Lunec, J.
doi: 10.1021/acschembio.7b00919.
(2003) Oxidative DNA damage, mechanisms, mutation,
30.
Hu J., Liu, M."H., Li, Y., Tang, B., and Zhang, C."Y.
and disease, FASEB J., 17, 1195"1214.
(2018) Simultaneous sensitive detection of multiple DNA
15.
Gros, L., Saparbaev, M. K., and Laval, J.
(2002)
glycosylases from lung cancer cells at the single"molecule
Enzymology of the repair of free radicals"induced DNA
level, Chem. Sci., 9, 712"720, doi: 10.1039/c7sc04296e.
damage, Oncogene, 21, 8905"8925.
31.
Svilar, D., Vens, C., and Sobol, R. W. (2012) Quantitative,
16.
Zharkov, D. O. (2008) Base excision DNA repair, Cell. Mol.
real"time analysis of base excision repair activity in cell
Life Sci., 65, 1544"1565, doi: 10.1007/s00018"008"7543"2.
lysates utilizing lesion"specific molecular beacons, J. Vis.
17.
Klungland, A., Rosewell, I., Hollenbach, S., Larsen, E.,
Exp., 66, 4168, doi: 10.3791/4168.
Daly, G., Epe, B., Seeberg, E., Lindahl, T., and Barnes, D. E.
32.
Healing, E., Charlier, C. F., Meira, L. B., and Elliott, R. M.
(1999) Accumulation of premutagenic DNA lesions in
(2019) A panel of colorimetric assays to measure enzymat"
mice defective in removal of oxidative base damage, Proc.
ic activity in the base excision DNA repair pathway, Nucleic
Natl. Acad. Sci. USA, 96, 13300"13305.
Acids Res., 47, 61, doi: 10.1093/nar/gkz171.
18.
Parsons, J. L., and Elder, R. H. (2003) DNA N"glycosylase
33.
Zhang, Y., Li, C., Tang, B., and Zhang, C. (2017) Homo"
deficient mice, a tale of redundancy, Mutat. Res., 531, 165"175.
geneously sensitive detection of multiple dna glycosylases
19.
Nilsen, H., Rosewell, I., Robins, P., Skjelbred, C. F.,
with intrinsically fluorescent nucleotides, Anal. Chem., 89,
Andersen, S., Slupphaug, G., Daly, G., Krokan, H. E.,
7684"7692, doi: 10.1021/acs.analchem.7b01655.
Lindahl, T., and Barnes, D. E. (2000) Uracil"DNA glyco"
34.
Liu, G., He, W., and Liu, C. (2019) Sensitive detection of
sylase (UNG)"deficient mice reveal a primary role of the
uracil"DNA glycosylase (UDG) activity based on terminal
enzyme during DNA replication, Mol. Cell, 5, 1059"1065.
deoxynucleotidyl transferase"assisted formation of fluores"
20.
Fung, H., and Demple, B. (2005) A vital role for
cent copper nanoclusters (CuNCs), Talanta, 195, 320"326,
Ape1/Ref1 protein in repairing spontaneous DNA damage
doi: 10.1016/j.talanta.2018.11.083.
БИОХИМИЯ том 85 вып. 4 2020
566
КЛАДОВА и др.
35.
Du, Y."C., Jiang, H."X., Huo, Y."F., Han, G."M., and
excision, association with PCNA, and stimulation by AP
Kong, D."M. (2016) Optimization of strand displacement
endonuclease, J. Mol. Biol., 346, 1259"1274, doi: 10.1016/
amplification"sensitized G"quadruplex DNAzyme"based
j.jmb.2005.01.014.
sensing system and its application in activity detection of
42. Esadze, A., Rodriguez, G., Cravens, S. L., and Stivers, J. T.
uracil"DNA glycosylase, Biosens. Bioelectron., 77, 971"
(2017) AP"endonuclease 1 accelerates turnover of human
977, doi: 10.1016/j.bios.2015.10.080.
8"oxoguanine DNA glycosylase by preventing retrograde
36.
Zhang, L., Zhao, J., Jiang, J., and Yu, R. (2012) A target"
binding to the abasic"site product, Biochemistry (Moscow),
activated autocatalytic DNAzyme amplification strategy
56, 1974"1986, doi: 10.1021/acs.biochem.7b00017.
for the assay of base excision repair enzyme activity, Chem.
43. Baldwin, M. R., and O’Brien, P. J. (2009) Human AP
Commun., 48, 8820"8822, doi: 10.1039/c2cc34531e.
endonuclease 1 stimulates multiple"turnover base excision
37.
Wang, L., Ren, M., Zhang, Q., Tang, B., and Zhang, C.
by alkyladenine DNA glycosylase, Biochemistry, 48, 6022"
(2017) Excision repair"initiated enzyme"assisted bicyclic
6033, doi: 10.1021/bi900517y.
cascade signal amplification for ultrasensitive detection of
44. Miroshnikova, A. D., Kuznetsova, A. A., Vorobjev, Y. N.,
uracil"DNA glycosylase, Anal. Chem., 89, 4488"4494,
Kuznetsov, N. A., and Fedorova, O. S. (2016) Effects of
doi: 10.1021/acs.analchem.6b04673.
mono" and divalent metal ions on DNA binding and catal"
38.
Kladova, O. A., Bazlekowa"Karaban, M., Baconnais, S.,
ysis of human apurinic/apyrimidinic endonuclease 1, Mol.
Piétrement, O., Ishchenko, A. A., Matkarimov, B. T.,
BioSyst., 12, 1527"1539, doi: 10.1039/c6mb00128a.
Iakovlev, D. A., Vasenko, A., Fedorova, O. S., Le Cam, E.,
45. Kuznetsov, N. A., Koval, V. V., and Fedorova, O. S. (2011)
Tudek, B., Kuznetsov, N. A., and Saparbaev, M. (2018)
Mechanism of recognition and repair of damaged DNA by
The role of the N"terminal domain of human
human
8"oxoguanine DNA glycosylase hOGG1,
apurinic/apyrimidinic endonuclease 1, APE1, in DNA
Biochemistry (Moscow),
76,
118"130, doi:
10.1134/
glycosylase stimulation, DNA Repair (Amst.), 64, 10"25,
S0006297911010123.
doi: 10.1016/j.dnarep.2018.02.001.
46. Kladova, O. A., Kuznetsova, A. A., Fedorova, O. S., and
39.
Kuznetsova, A. A., Kuznetsov, N. A., Ishchenko, A. A.,
Kuznetsov, N. A. (2017) Mutational and kinetic analysis of
Saparbaev, M. K., and Fedorova, O. S. (2014) Pre"steady"
lesion recognition by Escherichia coli endonuclease VIII,
state fluorescence analysis of damaged DNA transfer from
Genes, 8, 1"13, doi: 10.3390/genes8050140.
human DNA glycosylases to AP endonuclease APE1,
47. Kuznetsova, A. A., Iakovlev, D. A., Misovets, I. V.,
Biochim. Biophys. Acta, 1840, 3042"3051, doi: 10.1016/
Ishchenko, A. A., Saparbaev, M. K., Kuznetsov, N. A., and
j.bbagen.2014.07.016.
Fedorova, O. S. (2017) Pre"steady"state kinetic analysis of
40.
Waters, T. R., Gallinari, P., Jiricny, J., and Swann, P. F.
damage recognition by human single"strand selective
(1999) Human thymine DNA glycosylase binds to apurinic
monofunctional uracil"DNA glycosylase SMUG1, Mol.
sites in DNA but is displaced by human apurinic endonu"
BioSyst., 13, 2638"2649, doi: 10.1039/c7mb00457e.
clease 1, J. Biol. Chem., 274, 67"74.
48. Yakovlev, D. A., Kuznetsova, A. A., Fedorova, O. S., and
41.
Xia, L., Zheng, L., Lee, H. W., Bates, S. E., Federico, L.,
Kuznetsov, N. A. (2017) Search for modified DNA sites
Shen, B., and O’Connor, T. R. (2005) Human 3"methy"
with the human methyl"CpG"binding enzyme MBD4,
ladenine"DNA glycosylase, effect of sequence context on
Acta Naturae, 9, 88"98.
MEASURING THE ACTIVITY OF BASE EXCISION REPAIR ENZYMES
IN CELLULAR EXTRACTS USING FLUORESCENT DNA PROBES*
O. A. Kladova1, D. A. Iakovlev1, R. Groisman2,3, A. A. Ishchenko2,3,
M. K. Saparbaev2,3, O. S. Fedorova1,4**, and N. A. Kuznetsov1,4**
1 Institute of Chemical Biology and Fundamental Medicine, 630090 Novosibirsk, Russia;
E*mail: fedorova@niboch.nsc.ru, nikita.kuznetsov@niboch.nsc.ru
2 Groupe “Réparation de l’AND”, Equipe Labellisée par la Ligue Nationale contre le Cancer,
CNRS UMR 8200, Univ. Paris Sud, Université Paris Saclay, F 94805 Villejuif, France
3 Gustave Roussy, Université Paris Saclay, F 94805 Villejuif, France
4 Novosibirsk State University, 630090 Novosibirsk, Russia
Received January 21, 2020
Revised February 13, 2020
Accepted February 17, 2020
DNA glycosylases remove modified, damaged, or mismatched bases from DNA by hydrolyzing the N"glycosidic
bonds and generating an apurinic/apyrimidinic site (AP"site) in DNA. In most cases, the incision reaction of the AP"
site is catalyzed by special enzymes called AP"endonucleases. The decrease in the functional activity of individual
BER enzymes has been associated with an increased risk of cardiovascular, neurodegenerative, and oncological dis"
eases. Here, we report the fluorescence"based assay for measuring the activity of key human DNA glycosylases and
AP endonuclease. The efficacy of fluorescent DNA probes was tested by means of purified enzymes. Promising con"
structs were chosen to determine the activity of enzymes in the extracts of cell lines A549, MCF7, HeLa, WT"7,
HEK293T, and HKC8. It was shown that the level of activity of repair enzymes was higher in cancer cell lines com"
pared to a normal human kidney cell line.
Keywords: enzymatic activity, fluorescence, DNA probe, DNA glycosylase, AP endonuclease
БИОХИМИЯ том 85 вып. 4 2020