БИОХИМИЯ, 2020, том 85, вып. 4, с. 567 - 577
УДК 577.114.4, 577.151.45, 544.165
АНАЛИЗ ТРАЕКТОРИИ ОБРАЗОВАНИЯ ПРОМЕЖУТОЧНОГО
ГЛИКОЗИЛФЕРМЕНТА В МЕХАНИЗМЕ ДЕЙСТВИЯ
НЕЙРАМИНИДАЗЫ ВИРУСА ГРИППА А МЕТОДАМИ
МОЛЕКУЛЯРНОГО МОДЕЛИРОВАНИЯ*
© 2020
Е.М. Кирилин1**, В.К. Швядас1,2**
1 Московский государственный университет им. М.В. Ломоносова,
НИИ физико"химической биологии им. А.Н. Белозерского, 119991 Москва, Россия;
электронная почта: kirilin@belozersky.msu.ru; vytas@belozersky.msu.ru
2 Московский государственный университет им. М.В. Ломоносова,
факультет биоинженерии и биоинформатики, 119991 Москва, Россия
Поступила в редакцию 03.02.2020
После доработки 02.03.2020
Принята к публикации 02.03.2020
Комплексное использование методов классической молекулярной динамики, симуляции титрования
ионизируемых остатков, метадинамики, а также комбинированного метода квантовой механики/молеку
лярной механики позволило выявить альтернативный путь образования промежуточного гликозилфермен
та в механизме действия нейраминидазы вируса гриппа А H5N1. Ключевую роль в механизме обеспечивает
остаток Asp151, расположенный на подвижной петле и позволяющий реализовать каталитическую функ
цию фермента в широком интервале pH окружающей среды благодаря формированию сети взаимодействий
с молекулами воды. Так как размножение гриппа у птиц проходит в условиях пищеварительной системы
при низких значениях pH, а у человека - в дыхательных путях в условиях близких к нейтральным, сущест
вование альтернативных путей протекания реакции при разной кислотности среды может опосредовать
двойной тропизм вируса и циркуляцию специфических штаммов вируса H5N1, склонных к передаче от
птиц к человеку.
КЛЮЧЕВЫЕ СЛОВА: грипп, нейраминидаза, гликозилфермент.
DOI: 10.31857/S0320972520040090
Высокопатогенные штаммы вируса гриппа
чевых инструментов в жизнедеятельности виру
H5N1 («птичий грипп») представляют серьезную
са, обеспечивает гидролиз сиалированных гли
проблему не только для популяций диких и одо
канов для последующего высвобождения со
машненных птиц, но и способны вызывать
зревших новых вирионов гриппа. Совместно с
вспышки заболевания среди людей (смертность
другим белком - гемагглютинином, ответствен
~60%). Несмотря на то что по данным Всемир
ным за первичное распознавание гликанов, а,
ной организации здравоохранения пик инфек
соответственно, и клетки хозяина, нейрамини
ции наблюдали с 1998 по 2015 гг. [1], до сих пор
даза формирует базовый механизм вирулентнос
выясняют детали адаптации вируса к человеку
ти гриппа [3]. В зависимости от антигенных
[2], т.к. проявление двойного тропизма вируса
свойств различают девять типов нейраминидаз,
(птица/человек) представляет чрезвычайно
разделенных на две группы: группа 1 содержит
опасный путь вирусной эволюции. Заражение,
нейраминидазы N1, N4, N5 и N8 и группа 2 -
как правило, происходит путем взаимодействия
N2, N3, N6, N7 и N9 [4]. Одной из особенностей
вируса с клеткой хозяина через гликановые ре
нейраминидаз штамма H5N1, обнаруженного у
цепторы клеточной мембраны - олигосахарид
людей и птиц, является их низкая активность
ные фрагменты с концевой сиаловой кислотой.
при сильнокислых значениях pH [5], тогда как
Фермент нейраминидаза, являясь одним из клю
нейраминидазы остальных штаммов гриппа
птиц сохраняют высокую активность в сильно
Принятые сокращения: комбинированный метод
кислых средах, т.к. распространение вируса у
квантовой механики/молекулярной механики - КМ/ММ.
птиц происходит в пищеварительном тракте.
* Первоначально английский вариант рукописи опубли
Большинство сезонных человеческих штаммов
msu.ru/biokhimiya, в рубрике «Papers in Press», BM20 030,
также малоактивны при низких значениях pH
01.04.2020.
[6, 7], поскольку размножение вируса у человека
** Адресат для корреспонденции.
адаптировано к условиям дыхательных путей,
567
568
КИРИЛИН, ШВЯДАС
где в норме поддерживается уровень pH близкий
МАТЕРИАЛЫ И МЕТОДЫ
к нейтральным (pH 6,5-7,0) или слабокислым
значениям (pH 5,7-6,0) [8]. Таким образом,
Получение структуры субстрата. В качестве
адаптация нейраминидаз H5N1 штаммов у птиц,
субстрата использовали трисахарид - α Neu5Ac
по всей видимости, приблизила их по своим
2,3 β Gal 1,4 β Glc O Me - характерный тер
свойствам к нейраминидазам сезонных штаммов
минальный структурный фрагмент гликановых
гриппа человека, что может обуславливать высо
рецепторов птиц. Структура этого соединения
кую вероятность прямой передачи вируса от
была получена с помощью сервера Glycam
птиц к людям. Установлено, что для семейства
Biomolecule Builder [12] при использовании си
гликозидаз GH34, к которому относится и ней
лового поля Amber.
раминидаза вируса гриппа, характерен каталити
Двугранные углы гликозидных связей. Дву
ческий гидролиз углеводов по механизму двой
гранные углы гликозидных связей определяли
ного замещения [9, 10]. На этапе образования
следующим образом, начиная с терминального
промежуточного ковалентного гликозилфермен
остатка сиаловой кислоты: φ1 и ψ1, φ2 и ψ2. φ1 и ψ1
та один из каталитических остатков (Tyr406, ак
определяли по атомам O С2 O3 C3 и С2 С3
тивируемый Glu277) выступает в роли нуклеофи
O3 C2, φi и ψi остальных гликозидных связей
ла, а второй - Asp151, в качестве донора протона
были определены как O C1 O4′ C4′ и C1 O4′
для стабилизации уходящей группы. Данный ме
C4′ С3 для 1→4 связей и O C1 O3′ C3′ и C1
ханизм накладывает специфические требования
O3′ C3′ С2′ для 1→3 связей, апострофом обоз
к функционированию остатка Asp151 в ней
начен невосстанавливающий конец гликозид
тральных условиях кислотности среды. Микро
ной связи.
среда активного центра фермента, характер ок
Молекулярная динамика. Для подготовки
ружающих остатков и изолированность от внеш
субстратов была использована программа leap
него раствора может изменить кислотно основ
пакета AmberTools [13]. Для фермента и фер
ные свойства карбоксильной группы. Подобный
мент субстратных комплексов была создана
механизм был показан для некоторых гликози
система, включающая растворитель TIP3Р [14],
даз, когда при связывании олигосахаридного
с расстоянием от стенок куба до молекулы
субстрата активный центр фермента закрывается
субстрата не менее 15 Å. Для создания условий,
с вытеснением молекул растворителя, и остаток
приближенных к физиологическим, в систему
Asp151 в протонированной форме может непо
помещали ионы Cl- и Na+ (до достижения 0,1 M
средственно взаимодействовать с уходящей
концентраций). Суммарный заряд системы сво
группой [11]. Однако, по данным рентгенострук
дили к нулю при добавлении дополнительных
турного анализа, остаток Asp151 в нейраминида
ионов. Для каждой системы проводили мини
зе штамма H5N1 располагается на так называе
мизацию энергии (2500 шагов), последующий
мой подвижной петле 150 (а.о. 147-152) [4] в об
нагрев до 300 К в течение 60 пс, снятие ограни
ласти сайта связывания субстрата, напрямую
чений с тяжелых атомов в течение 290 пс и ре
доступен растворителю и, казалось бы, не может
лаксацию в течение 5 нс в NPT ансамбле (посто
выполнять необходимую функциональную роль
янное число частиц, давление и температура) с
при значениях pH окружающей среды 5,7-6,5.
постепенным доведением плотности до посто
Каким образом обеспечивается выполнение
янного значения 1,04 г/см3. Стандартные симу
функции остатка Asp151 в каталитическом
ляции в растворе осуществляли в пакете
действии нейраминидазы штамма H5N1 вируса
Amber14 при температуре 300 К, шаге интегри
гриппа в нейтральной среде? Как связывание
рования 2 фс в условиях NVT ансамбля (посто
олигосахаридного субстрата в активном центре
янное число частиц, температура и объем). Тем
фермента влияет на значение pKa остатка
пературу системы регулировали с использовани
Asp151? Каково конформационное состояние
ем термостата Ланжевена [15]. Продолжитель
субстрата в активном центре, соответствующее
ность каждой траектории составляла 1 микросе
наиболее эффективному протеканию фермента
кунду, кадры динамики сохраняли каждые 10 пс.
тивной реакции и формированию промежуточ
Метод ускоренной молекулярной динамики
ного гликозилфермента? В настоящей работе
был проведен посредством встроенных функ
мы попытались ответить на эти вопросы, ис
ций пакета Amber14 с использованием парамет
пользуя комплексный подход, объединяющий
ров, идентичных вышеуказанным, а также зада
возможности методов классической молекуляр
нием специфических методу значений
ной динамики, метадинамики, а также комби
(EthreshD 13,42; alphaD 3,2; EthreshP -20 203,56;
нированного метода квантовой механики/моле
alphaP 602,24).
кулярной механики (КМ/ММ) и симуляции
Метадинамика. Расчет метадинамики вы
титрования ионизируемых остатков.
полняли на базе пакета Amber14, модифициро
БИОХИМИЯ том 85 вып. 4 2020
МЕХАНИЗМ НЕЙРАМИНИДАЗЫ ГРИППА
569
ванном PLUMED (версия 2.5) [16]. Высота до
Продуктом отображения является тор Te -
бавочных Гауссовских потенциалов была опре
L мерная поверхность на единичной сфере S2L1.
делена начальным значением 0,6 ккал/моль,
Отображение является локальной изометрией с
ширина - 0,01 или 0,0075 для переноса протона.
сохранением меры расстояний [21].
Новые потенциалы добавляли через каждые 100
Преобразованные переменные использова
шагов динамики при шаге интегрирования
ли для кластеризации с помощью Байесовского
0,25 фс. Температура симуляции составляла
непараметрического метода, имплементирован
300 K. Коллективные переменные с двух сторон
ного в программе dpMMlowVar [22]. Оптимиза
ограничивали квадратичным потенциалом. Мо
цию углового параметра для данного метода
лекулы воды, входящие в квантовую область,
проводили в пределах [-0,6; -0,3] с шагом 0,01
также ограничивали квадратичным потенциа
на основании оценочной функции силуэта. При
лом на значение координационного числа вок
визуализации результатов кластеризации ис
руг атома кислорода уходящей группы на рас
пользовали метод главных компонент для
стоянии 7 Å. Для ускорения расчета использова
трансформированных значений углов с выделе
ли технологию из 10 параллельных вычислений,
нием первых трех главных компонент.
объединенных общим добавленным потенциа
лом метадинамики [17].
Комбинированный метод квантовой механи;
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ки/молекулярной механики. Вычисления КМ/
ММ проводили на базе пакета AmberTools. Для
Расчет pKa Asp151. Определение сдвига pKa
описания квантового региона использовали ме
остатка Asp151 в активном центре нейрамини
тод SCC DFTB, который хорошо себя зареко
дазы N1 при связывании субстрата проводили с
мендовал при КМ/ММ моделировании реак
использованием КМ/ММ в явном растворителе
ций, катализируемых другими ферментами се
и расчетов электростатического поля Пуассо
мейства сиалидаз [18, 19]. В квантовый регион
на-Больцмана по дискретной модели протони
включали остатки Tyr406, Glu277, Arg292,
рования, которая учитывает состояние иониза
Asp151, мономеры сиаловой кислоты и следую
ции исследуемого остатка в зависимости от его
щей за ней галактозы, а также 14 молекул воды в
текущей ориентации, доступности растворите
радиусе 7 Å от атома кислорода уходящей груп
лю и кислотности окружающей среды. Метод
пы при образовании ковалентного гликозил
позволяет проводить ряд параллельных симуля
фермента.
ций в широком интервале значений pH. В ходе
Симуляция титрования ионизируемых остат;
эксперимента проводится семплирование сис
ков в явном растворителе. Метод pH REMD,
темы, в которой предусмотрены динамические
имплементированный в Amber14, использовали
переходы между конформациями с протониро
для расчета значений pKa Asp151, симуляцию 12
ванной и непротонированной формой карбок
реплик проводили в интервале pH от 2 до 7,5.
сильной группы остатка Asp151. Так как нейра
Обмен репликами осуществлялся каждые 5000
минидаза функционирует в виде тетрамера, рас
шагов, попытка перепротонирования - каждые
чет pKa аспартата проводили независимо для че
200 шагов и релаксация - в течение 300 шагов.
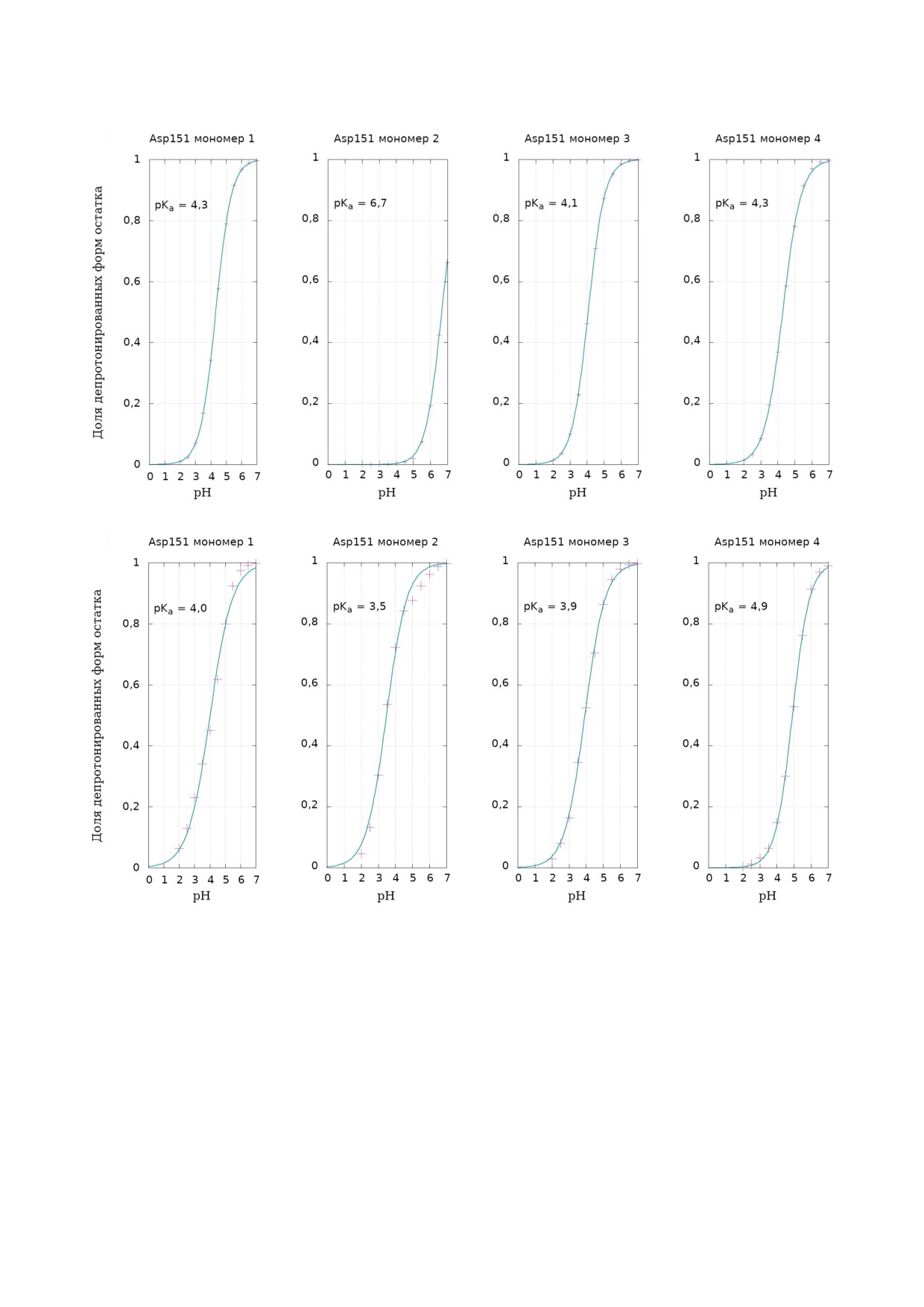
тырех остатков (рис. 1). Проведенные вычисле
Значения pKa остатка рассчитывали по адапти
ния показывают, что три остатка Asp151 в сво
рованному уравнению Хендерсона-Хассельба
бодном ферменте депротонированы при ней
ха, учитывая рассчитанную вероятность образо
тральных условиях среды - значения pKa лежат в
вания депротонированной и протонированной
диапазоне 4,1-4,3, в то время как один остаток
форм остатка [20].
(обозначенный Asp2 на рис. 1) имеет более вы
Методы кластеризации. Кластеризацию
сокое значение pKa - 6,7. Анализ положения
структуры субстрата проводили на базе значе
петли 150 в субъединице с аномально высоким
ний двугранных углов между углеводными мо
(6,7) значением pKa Asp151 показал, что при мо
номерами с использованием следующей моди
делировании в сильнокислой среде (рН 2) в этой
фикации:
субъединице, в отличие от остатков Asp151 в
отображение фазового пространства углов ui - в
трех других субъединицах, происходит образо
общем случае L мерного бокса Pc:
вание не наблюдаемой в кристаллографических
структурах фермента карбоксил карбоксилат
ной пары между Asp151 и Glu119. Можно пред
положить, что в этом случае имеет место пере
посредством преобразования:
ход к денатурированному состоянию, которое
нельзя отнести к каталитически активной фор
ме.
8 БИОХИМИЯ том 85 вып. 4 2020
570
КИРИЛИН, ШВЯДАС
а
б
Рис. 1. Кривые титрования аминокислотных остатков Asp151 в четырех субъединицах гомотетрамера нейраминидазы ви
руса гриппа H5N1 c приведенными расчетными значениями pKa (см. «Материалы и методы»): а - для свободной формы
фермента; б - для комплекса фермента с олигосахаридным субстратом, связанном в активном центре.
journal/biokhsm/
Нейраминидазы из разных источников от
субстрата на pKa остатка в разных ферментах
личаются строением активных центров и окру
этого семейства. При расчетах протонирова
жением ионизируемых остатков, различия об
ния/депротонирования аспартата в фермент
наружены также в динамическом поведении
субстратном комплексе, образованном нейра
петли 150, содержащей Asp151 [23], что может
минидазой N1, было обнаружено, что значение
быть причиной различного влияния связывания
pKa Asp151 находится в пределах 3,5-4,9. Обна
БИОХИМИЯ том 85 вып. 4 2020
МЕХАНИЗМ НЕЙРАМИНИДАЗЫ ГРИППА
571
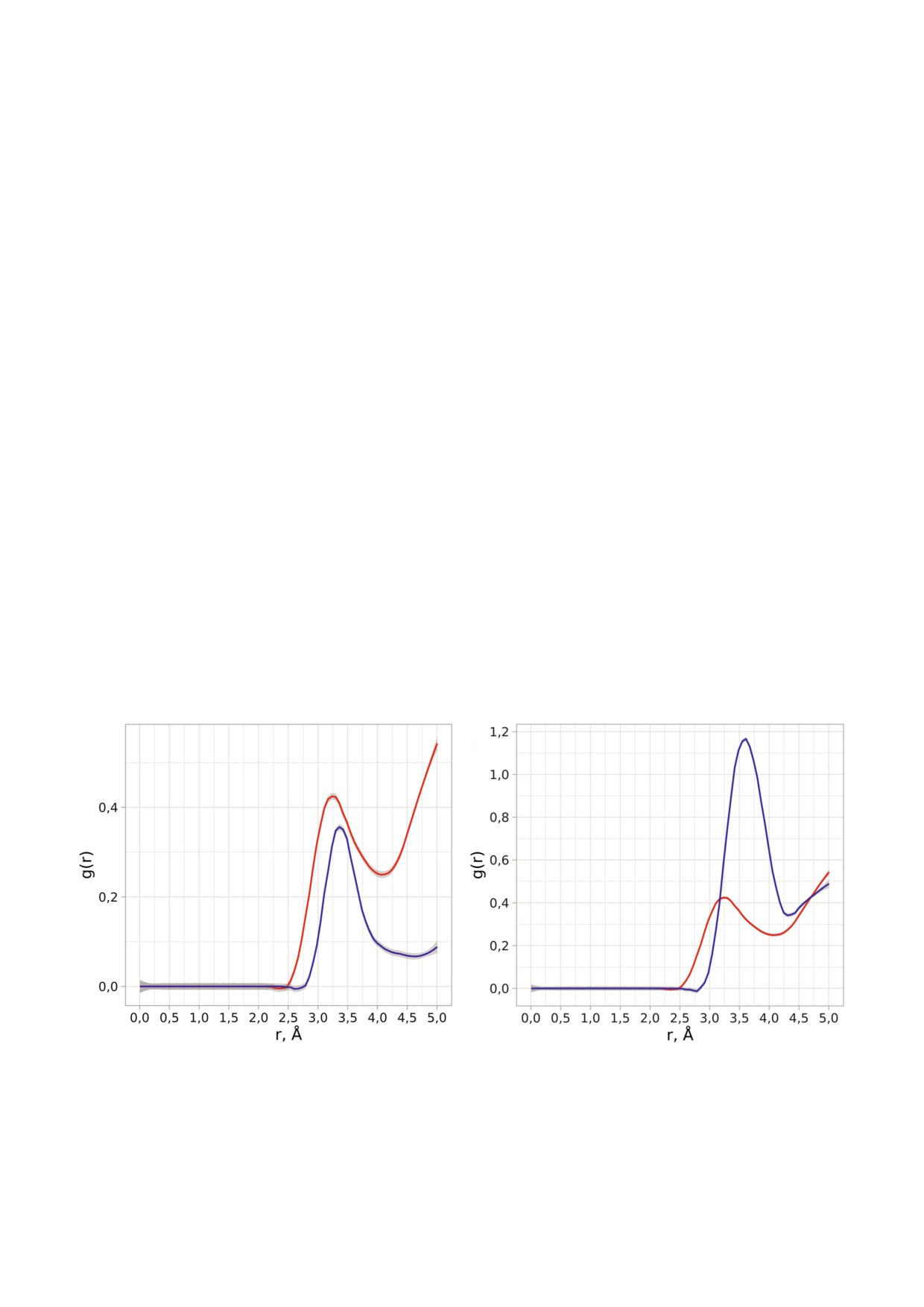
руженный интервал значений свидетельствует о
в форме гидроксония вблизи кислорода уходя
наличии различных стабилизированных струк
щей группы и таким образом обеспечить необ
турных топологий олигосахаридного субстрата в
ходимый перенос протона. Анализ функции
активном центре (см. подраздел «Конформаци
распределения молекул воды вокруг атомов
онное состояние олигосахаридного субстрата
кислорода уходящей группы и карбоксильного
при связывании с ферментом»). Наиболее рас
углерода Asp151 в свободном ферменте и в фер
пространенной конформации субстрата соотве
мент субстратном комплексе (рис. 2, а, б), опре
тствует значение pKa 4,9. В то же время можно
деленной на основе молекулярно динамиче
заключить, что в случае изучаемой нами нейра
ских траекторий при значениях pH 5,5; 6,0; 6,5 и
минидазы N1 при связывании субстрата не наб
7,0, позволяет оценить возможность реализации
людается столь существенного сдвига pKa, как
такого механизма.
это было обнаружено для нейраминидазы N9
При анализе распределения расстояний от
(до значений 8,0-9,0) [11]. Полученные при мо
атомов кислорода карбоксильной группы до
делировании расчетные значения pKa остатка
атома кислорода уходящей группы становится
аспартата в нейраминидазе N1, на первый
понятно, что молекулы воды имеют прямой дос
взгляд, противоречат возможности осуществле
туп к разрываемой связи и могут быть не только
ния эффективного катализа в нейтральных сре
звеном мостикового соединения между остат
дах с участием этой группы для прямой переда
ком Asp151 и уходящей группой, но и выступать
чи протона на уходящую группу субстрата. Од
в качестве донора протона. Включение иона
нако подобное заключение не представляется
гидроксония в такую цепочку передачи протона
столь категоричным, если рассмотреть другие
может быть обусловлено окружающими остат
возможные пути стабилизации уходящей груп
ками фермента, а также возможностью опти
пы в каталитическом механизме действия фер
мальной ориентации и стабилизации всей сис
мента. Так, при постоянном доступе молекул
темы [26]. Чтобы оценить энергетические барь
растворителя к карбоксильной группе остатка
еры образования промежуточного гликозилфер
Asp151 возможен механизм переноса протонов
мента по альтернативному механизму, необхо
Гротгуса, который уже наблюдали в фермента
дим конформационный анализ положений уг
тивных системах [24, 25]. Кроме того, депрото
леводного субстрата в активном центре нейра
нированная форма аспартата может стабилизи
минидазы для получения стартовой структуры
ровать молекулу воды в нейтральной форме или
фермент субстратного комплекса.
а
б
Рис. 2. а - Радиальная функция распределения молекул воды (красная линия) вокруг атома кислорода уходящей группы
и функция распределения расстояний от атома кислорода уходящей группы до атомов кислорода карбоксильной группы
Asp151 (синяя линия); б - радиальная функция распределения молекул воды вокруг карбоксильного углерода Asp151 в
свободной (красная линия) и в связанной с олигосахаридным субстратом (синия линия) формах фермента.
journal/biokhsm/
БИОХИМИЯ том 85 вып. 4 2020
8*
572
КИРИЛИН, ШВЯДАС
тельствует о существовании альтернативной по
лости связывания. Следует отметить, что сход
ную с топологией 1 структуру трисахарида на
блюдали при связывании с нейраминидазой N2
штамма H3N2 (рентгенографическая структура
4GZW [27]).
Формирование промежуточного гликозилфер;
мента. Моделирование процесса образования
гликозилфермента проводили с использовани
ем метадинамики. Начальная структура фер
мент субстратного комплекса была взята с ха
рактерными для топологии 1, преобладающей
при связывании олигосахаридного субстрата в
активном центре фермента (см. предыдущий
раздел), двугранными углами и конформацией
кольца остатка нейраминовой кислоты 5S1 [28].
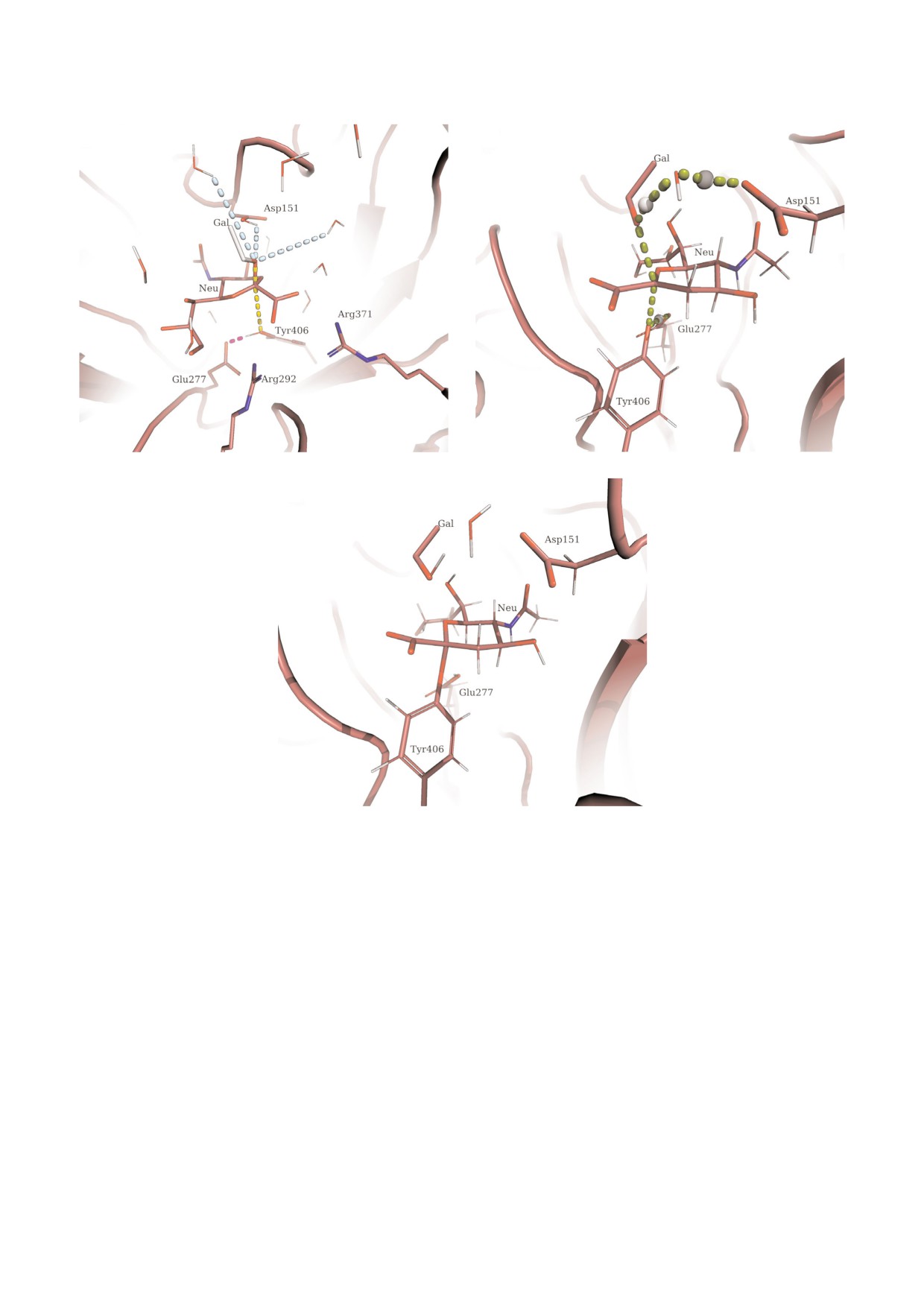
В качестве коллективных переменных, в фазо
вом пространстве которых происходит гидролиз
Рис. 3. Сэмплирование конформационного пространства
олигосахаридного субстрата в активном центре нейрами
субстрата и образование промежуточного про
нидазы N1 с последующей кластеризацией. Для нагляд
дукта реакции гликозилфермента, были исполь
ности данные визуализированы относительно первых трех
зованы: 1) параметр CV1, характеризующий раз
главных компонент при анализе восьми переменных дву
рыв гликозидной связи субстрата по остатку си
гранных углов, характеризующих конформацию олигоса
аловой кислоты и образование новой связи с
харида; принадлежность к одному кластеру обозначена
цветом.
Tyr406, а также представляющий разницу рас
С цветным вариантом рисунка можно ознакомиться в
стояний между C1SIA OTyr406 и C1SIA O3LB; 2) па
раметр CV2, отражающий активацию нуклео
journal/biokhsm/
фильного остатка Tyr406 переносом протона на
Glu277; 3) параметр CV3, характеризующий пе
Конформационное состояние олигосахаридно;
реход протона на уходящую группу от одной из
го субстрата при связывании с ферментом. Кон
молекул воды или остатка Asp151 (рис. 4, а) и
формационное пространство олигосахаридного
определяемый как минимальное расстояние
субстрата, связанного в активном центре нейра
между одним из протонов, принадлежащих мо
минидазы N1, было определено при анализе
лекулам воды, входящим в квантовую область
траекторий молекулярной динамики, получен
(8 молекул), или протоном, принадлежащим ос
ных в результате симуляций титрования Asp151
татку Asp151 - тем самым учитывается возмож
при различных значениях pH в интервале 5-7.
ность наиболее быстрого и энергетически вы
Значения двугранных углов гликозидных связей
годного пути переноса протона как от молекул
в ходе симуляций были извлечены, преобразо
воды, так и от остатка Asp151.
ваны (как описано в экспериментальной части)
Следует отметить, что в стартовой структуре
и использованы для поиска кластеров стабили
предусматривали возможность протонирования
зированных структур - топологий (рис. 3).
остатка Asp151, что позволило при моделирова
Обнаруженные топологии олигосахарида, а
нии учитывать не только механизм передачи
также соответствующие характеристические
протона от иона гидроксония, координирован
значения двугранных углов приведены в табли
ного карбоксилатным анионом Asp151, но и те
це. Аналогичным образом проведенный поиск
оретический вариант передачи протона уходя
дополнительных структурных кластеров мето
дом ускоренной молекулярной динамики новых
Характерные значения двугранных углов олигосахаридно
топологий не выявил. Для субстрата, связанного
го субстрата в активном центре нейраминидазы N1
в активном центре фермента, характерно суще
ствование трех возможных топологий (таблица).
Двугранный
угол
Преобладающая топология 1 характеризуется
φ1
ψ1
φ2
ψ2
Соотно
значениями двугранных углов φ1 - 84,29; ψ1 -
Кластер
шение
98,90; φ2 - 95,70 и ψ2 - 105,71. Популяции топо
логии 2 и 3 представлены в активном центре на
1
78,29
-110,90
-100,70
105,02
78%
8 и 14% соответственно, при этом топология 2
2
74,89
-112,41
-86,49
-57,60
8%
ориентирована вдоль активного центра иден
3
-171,95
-129,39
-76,27
136,43
14%
тично топологии 1, тогда как топология 3 свиде
БИОХИМИЯ том 85 вып. 4 2020
МЕХАНИЗМ НЕЙРАМИНИДАЗЫ ГРИППА
573
а
б
в
Рис. 4. Структуры основных стационарных состояний при образовании ковалентного промежуточного соединения - гли
козилфермента в реакции, катализируемой нейраминидазой вируса гриппа H5N1. Gal обозначена уходящая группа,
Neu - углеводный остаток сиаловой кислоты. а - Структура фермент субстратного комплекса с обозначением цветным
пунктиром основных составляющих коллективных переменных, включая путь переноса протона на Glu277 и активацию
нуклеофильного остатка Tyr406 (розовый), для указания разрываемой и образуемой связей (желтый), и любой процесс пе
реноса протона с окружающих молекул воды или Asp151 (голубой); б - структура переходного состояния системы; в - об
разование гликозилфермента.
journal/biokhsm/
щей группе напрямую. Таким образом, выбран
тативного гидролиза олигосахаридного субстра
ная квантовая область представляла одинако
та и определена энергетическая поверхность
вую стартовую точку для двух возможных путей
этого процесса (рис. 5). По критериям порядка
передачи протона на уходящую группу гидроли
связи по Полингу процесс соответствовал дис
зуемого субстрата.
социативному ANDN механизму с барьером по
При помощи КМ/ММ с использованием
рядка 14 ккал/моль (рис. 5, а, б). Остаток сиало
трех выбранных коллективных переменных бы
вой кислоты претерпевал структурное измене
ло проведено моделирование реакции фермен
ние от 5S1 конформации кольца в фермент
БИОХИМИЯ том 85 вып. 4 2020
574
КИРИЛИН, ШВЯДАС
а
б
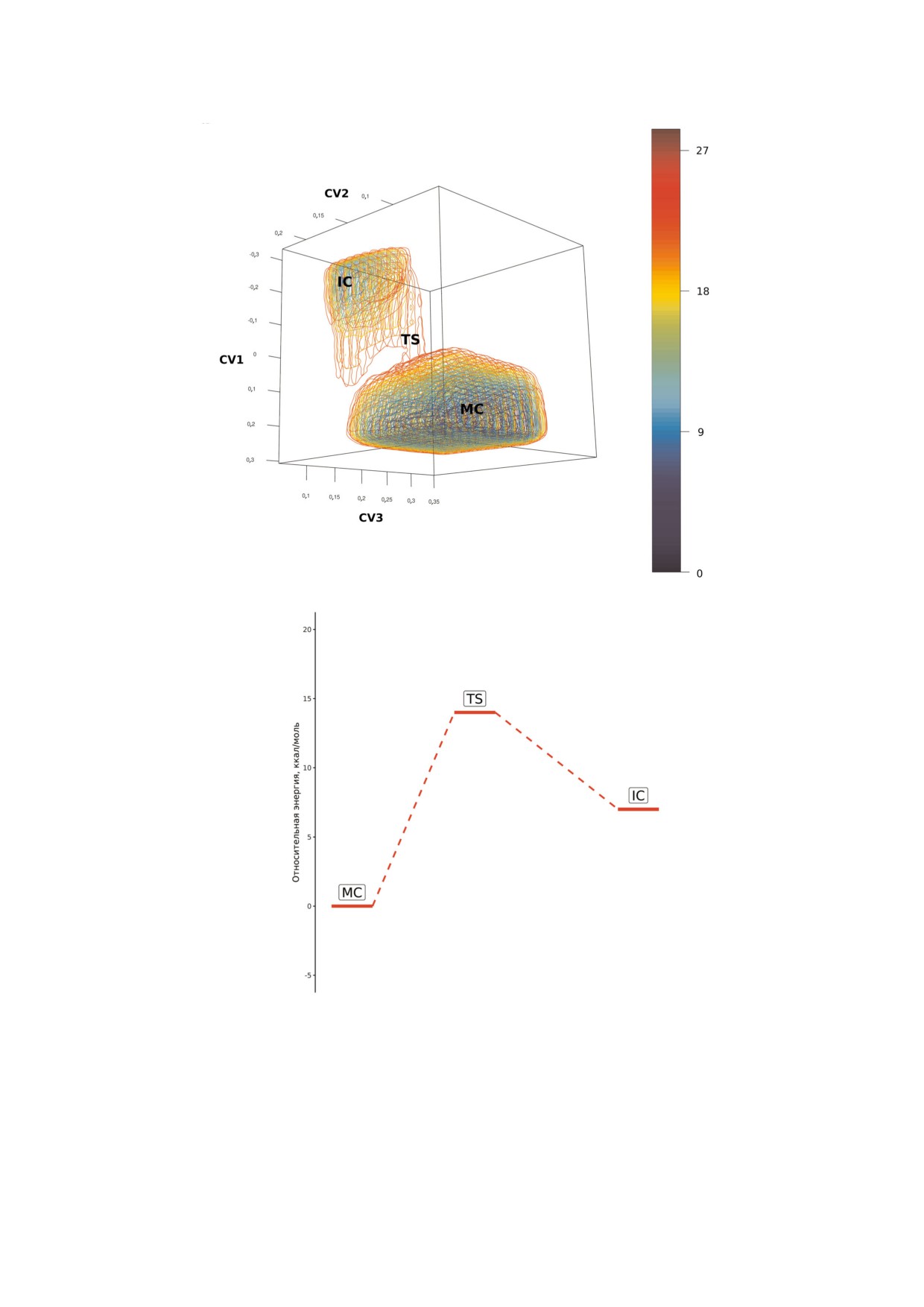
Рис. 5. а) Поверхность свободной энергии стадии образования промежуточного ковалентного соединения - гликозил
фермента в реакции гидролиза олигосахаридного субстрата, катализируемого нейраминидазой вируса гриппа H5N1,
построенная на основе коллективных переменных разрыва гликозидной связи субстрата по остатку сиаловой кислоты и
образования новой с Tyr406 (CV1), активации нуклеофильного остатка Tyr406 (CV2) и передачи протона от одной из мо
лекул воды или остатка Asp151 на уходящую группу субстрата (CV3). МС - комплекс фермента с субстратом, ТS - пере
ходное состояние перед образованием гликозилфермента, IC - промежуточный гликозилфермент. б) Упрощенная энер
гетическая диаграмма стадии образования промежуточного ковалентного соединения - гликозилфермента.
journal/biokhsm/
БИОХИМИЯ том 85 вып. 4 2020
МЕХАНИЗМ НЕЙРАМИНИДАЗЫ ГРИППА
575
субстратном комплексе (MC, рис. 4, а) до кон
также способность ферментов функциониро
формации E43H4 в переходном состоянии (TS,
вать в различных средах, представляют не толь
рис. 4, б) и 1С4 (IC, рис. 4, в) в промежуточном
ко фундаментальный, но и существенный прак
гликозилферменте, положение которого на
тический интерес. Важную роль в превращении
энергетической диаграмме было выше исходно
гликанов, катализируемом нейраминидазами,
го состояния на 7 ккал/моль (рис. 5, а, б). В ходе
имеет конформационное состояние олигосаха
ферментативной реакции протон для нейтрали
ридного субстрата, а также стадии образования
зации уходящей группы переносился от ближай
и последующего гидролиза промежуточного
шей молекулы воды, образующей связующий
гликозилфермента. Проведенное молекулярное
мостик между гликозидной связью субстрата и
моделирование механизма действия нейрами
остатком Asp151. Следует отметить, что остаток
нидазы N1 позволило выявить сродство актив
Asp151, как и молекула воды, может выполнять
ного центра фермента к определенному кон
двоякую роль. Когда карбоксильная группа
формеру субстрата и установить, какие последу
Asp151 протонирована, молекула воды может
ющие конформационные изменения имеют
выступать в качестве челнока и при передаче
место в ходе ферментативного превращения.
протона на уходящую группу субстрата одновре
Был проведен анализ возможных путей образо
менно забирать протон от Asp151. В случае, ког
вания промежуточного гликозилфермента в ре
да карбоксильная группа Asp151 депротонирова
акциях под действием нейраминидазы вируса
на, она может координировать ион гидроксония,
гриппа H5N1 в средах разной кислотности, что
который служит донором протона для уходящей
имеет непосредственное отношение к адапта
группы субстрата. Вероятность реализации того
ции и размножению вируса в дыхательных путях
или иного пути зависит от целого ряда условий:
человека, а также передаче штаммов вируса
кроме кислотности среды, важное значение име
гриппа от птиц человеку. Понимание особен
ет подвижность петли 150 и особенности струк
ностей функционирования нейраминидаз раз
турной организации активного центра в мутант
личных штаммов вируса гриппа в различных ус
ных формах фермента. Участие остатка Asp151 с
ловиях, как одного из ключевых факторов виру
протонированной карбоксильной группой в ка
лентности вируса, является важным этапом как
талитическом механизме, по видимому, менее
при разработке методов профилактики, так и
выгодно, т.к. петля 150 ограничивает движение
средств борьбы с гриппом, а также другими ин
остатка и затрудняет формирование цепи прямо
фекциями, отличающимися подобным меха
го переноса протона: подобные состояния не
низмом.
были обнаружены при независимых запусках
траекторий молекулярной динамики. Тем не ме
нее такой механизм нельзя исключить при функ
Финансирование. Исследование выполнено
ционировании фермента в более кислых средах.
при финансовой поддержке Российского фонда
В то же время установленный нами путь переда
фундаментальных исследований (грант № 18
чи протона от иона гидроксония, координиро
34 00953).
ванного отрицательно заряженной карбоксилат
Благодарности. Исследование выполнено с
ной группой Asp151, может быть более универ
использованием оборудования Центра коллек
сальным и функционировать в широком интер
тивного пользования сверхвысокопроизводи
вале рН, обуславливая двойной тропизм вируса и
тельными вычислительными ресурсами МГУ
циркуляцию специфических штаммов H5N1,
имени М.В. Ломоносова [29].
способных к прямой передаче от птиц к челове
Конфликт интересов. Авторы заявляют об от
ку, наблюдаемой в ходе последних вспышек за
сутствии конфликта интересов.
болеваний 1998-2015 годов.
Соблюдение этических норм. Настоящая
статья не содержит каких либо исследований с
Каталитический механизм действия нейра
участием людей или использованием животных
минидаз различных штаммов вируса гриппа, а
в качестве объектов исследований.
СПИСОК ЛИТЕРАТУРЫ
1.
tion of avian H5N1 influenza viruses during human infec
interface/H5N1_cumulative_table_archives/en/
tion, Emerg. Microbes Infect., 8, 262 271, doi: 10.1080/
2.
Welkers, M. R. A., Pawestri, H. A., Fonville, J. M.,
22221751.2019.1575700.
Sampurno, O. D., Pater, M., Holwerda, M., Han, A. X.,
3.
Mitnaul, L. J., Matrosovich, M. N., Castrucci, M. R.,
Russell, C. A., Jeeninga, R. E., Setiawaty, V., de Jong, M. D.,
Tuzikov, A. B., Bovin, N. V., Kobasa, D., and Kawaoka, Y.
and Eggink, D. (2019) Genetic diversity and host adapta
(2000) Balanced hemagglutinin and neuraminidase activi
БИОХИМИЯ том 85 вып. 4 2020
576
КИРИЛИН, ШВЯДАС
ties are critical for efficient replication of influenza A virus,
free energy landscapes by multiple walkers metadynamics,
J. Virol., 74, 6015 6020, doi: 10.1128/JVI.74.13.6015
J. Phys. Chem. B,
110,
35333539, doi:
10.1021/
6020.2000.
jp054359r.
4.
Russell, R. J., Haire, L. F., Stevens, D. J., Collins, P. J.,
18.
Pierdominici Sottile, G., Horenstein, N. A., and
Lin, Y. P., Blackburn, G. M., Hay, A. J., Gamblin, S. J.,
Roitberg, A. E. (2011) Free energy study of the cata
and Skehel, J. J. (2006) The structure of H5N1 avian
lytic mechanism of Trypanosoma cruzi trans sialidase.
influenza neuraminidase suggests new opportunities for
From the michaelis complex to the covalent intermedi
drug design, Nature,
443,
4549, doi:
10.1038/
ate, Biochemistry,
50,
10150 10158, doi:
10.1021/
nature05114.
bi2009618.
5.
Takahashi, T., Nidom, C. A., Quynh Le, M. T., Suzuki, T.,
19.
Bueren Calabuig, J. A., Pierdominici Sottile, G., and
and Kawaoka, Y. (2012) Amino acid determinants confer
Roitberg, A. E. (2014) Unraveling the differences of the
ring stable sialidase activity at low pH for H5N1 influenza
hydrolytic activity of Trypanosoma cruzi trans sialidase and
A virus neuraminidase, FEBS Open Bio, 2, 261 266,
Trypanosoma rangeli sialidase: a quantum mechanics-
doi: 10.1016/j.fob.2012.08.007.
molecular mechanics modeling study, J. Phys. Chem. B,
6.
Suzuki, T., Takahashi, T., Saito, T., Guo, C. T.,
118, 5807 5816, doi: 10.1021/jp412294r.
Hidari, K. I. P. J., Miyamoto, D., and Suzuki, Y. (2004)
20.
Harris, R. C., and Shen, J. (2019) GPU accelerated
Evolutional analysis of human influenza A virus N2 neu
implementation of continuous constant pH molecular
raminidase genes based on the transition of the low pH sta
dynamics in Amber: pKa predictions with single pH simu
bility of sialidase activity1, FEBS Lett., 557, 228 232,
lations, J. Chem. Inf. Model., 59, 4821 4832, doi: 10.1021/
doi: 10.1016/S0014 5793(03)01503 5.
acs.jcim.9b00754.
7.
Takahashi, T., Kurebayashi, Y., Ikeya, K., Mizuno, T.,
21.
Costa, S. I. R., Torezzan, C., Campello, A., and
Fukushima, K., Kawamoto, H., Kawaoka, Y., Suzuki, Y.,
Vaishampayan, V. A. (2013) Flat tori, lattices and spherical
and Suzuki, T. (2010) The low pH stability discovered in
codes, 1 8 in 2013 Information Theory and Applications
neuraminidase of 1918 pandemic influenza A virus
Workshop (ITA), doi: 10.1109/ITA.2013.6503002.
enhances virus replication, PLoS One, 5, doi: 10.1371/
22.
Straub, J., Campbell, T., How, J. P., and Fisher, J. W.
journal.pone.0015556.
(2015) Small"variance nonparametric clustering on the
8.
Fischer, H., and Widdicombe, J. H. (2006) Mechanisms of
hypersphere, The IEEE Conference on Computer Vision
acid and base secretion by the airway epithelium, J. Membr.
and Pattern Recognition (CVPR), 334 342.
Biol, 211, 139 150, doi: 10.1007/s00232 006 0861 0.
23.
Amaro, R. E., Minh, D. D. L., Cheng, L. S., Lindstrom, W. M.,
9.
Koshland, D. E. (1953) Stereochemistry and the mecha
Olson, A. J., Lin, J. H., Li, W. W., and McCammon, J. A.
nism of enzymatic reactions, Biological Reviews, 28, 416
(2007) Remarkable loop flexibility in avian influenza N1
436.
and its implications for antiviral drug design, J. Am. Chem.
10.
Guce, A. I., Clark, N. E., Salgado, E. N., Ivanen, D. R.,
Soc., 129, 7764 7765, doi: 10.1021/ ja0723535.
Kulminskaya, A. A., Brumer, H., and Garman, S. C.
24.
Riccardi, D., König, P., Prat Resina, X., Yu, H., Elstner, M.,
(2010) Catalytic mechanism of human α galactosidase, J.
Frauenheim, T., and Cui, Q. (2006) “Proton Holes” in
Biol. Chem., 285, 36253632, doi: 10.1074/jbc.M109.
long range proton transfer reactions in solution and
060145.
enzymes: a theoretical analysis, J. Am. Chem. Soc., 128,
11.
Yu, H., and Griffiths, T. M. (2014) p K a cycling of the gen
16302 16311, doi: 10.1021/ja065451j.
eral acid/base in glycoside hydrolase families 33 and 34,
25.
Parke, C. L., Wojcik, E. J., Kim, S., and Worthylake, D. K.
Phys. Chem. Chem. Phys., 16, 5785 5792, doi: 10.1039/
(2010) ATP Hydrolysis in Eg5 Kinesin Involves a Catalytic
C4CP00351A.
Two water Mechanism, J. Biol. Chem., 285, 5859 5867,
12.
Woods, R. J. (2008) Biomolecule Builder, GLYCAM Web,
doi: 10.1074/jbc.M109.071233.
Complex Carbohydrate Research Center, University of
26.
Mohammed, O. F., Pines, D., Dreyer, J., Pines, E., and
Georgia.
Nibbering, E. T. (2005). Sequential proton transfer
13.
Case, D. A., Babin, V., Berryman, J., Betz, R. M., Cai, Q.,
through water bridges in acid base reactions, Science, 310,
et al. (2014) Amber 14, University of California, San
83 86.
Francisco.
27.
Zhu, X., McBride, R., Nycholat, C. M., Yu, W.,
14.
Mahoney, M. W., and Jorgensen, W. L. (2000) A five site
Paulson, J. C., and Wilson, I. A. (2012) Influenza virus
model for liquid water and the reproduction of the density
neuraminidases with reduced enzymatic activity that avid
anomaly by rigid, nonpolarizable potential functions, J.
ly bind sialic acid receptors, J. Virol., 86, 13371 13383,
Chem. Phys., 112, 8910 8922, doi: 10.1063/1.481505.
doi: 10.1128/JVI.01426 12.
15.
Paterlini, M. G., and Ferguson, D. M. (1998) Constant
28.
Kirilin, E. M., and Švedas, V. K. (2018) Study of the con
temperature simulations using the Langevin equation with
formational variety of the oligosaccharide substrates of
velocity Verlet integration, Chem. Phys., 236, 243 252,
neuraminidases from pathogens using molecular modeling,
doi: 10.1016/S0301 0104(98)00214 6.
Moscow Univ. Chem. Bull., 73, 3945, doi: 10.3103/
16.
Tribello, G. A., Bonomi, M., Branduardi, D., Camilloni, C.,
S0027131418020050.
and Bussi, G. (2014) PLUMED 2: new feathers for an old
29.
Sadovnichy, V., Tikhonravov, A., Voevodin, V., and
bird, Comp. Phys. Commun., 185, 604 613, doi: 10.1016/
Opanasenko, V. (2017) “Lomonosov”: supercomputing
j.cpc.2013.09.018.
at Moscow State University, Contemporary High Per
17.
Raiteri, P., Laio, A., Gervasio, F. L., Micheletti, C., and
formance Computing, doi: 10.1201/9781351104005
Parrinello, M. (2006) Efficient reconstruction of complex
11.
БИОХИМИЯ том 85 вып. 4 2020
МЕХАНИЗМ НЕЙРАМИНИДАЗЫ ГРИППА
577
THE PATHWAY ANALYSIS AT THE FORMATION
OF GLYCOSYL;ENZYME INTERMEDIATE IN THE CATALYTIC
MECHANISM OF THE INFLUENZA A VIRUS NEURAMINIDASE
USING METHODS OF MOLECULAR MODELING*
E. M. Kirilin1** and V. K. Švedas1,2**
1 Lomonosov Moscow State University, Belozersky Institute of Physicochemical Biology,
119991 Moscow, Russia; E"mail: kirilin@belozersky.msu.ru; vytas@belozersky.msu.ru
2 Lomonosov Moscow State University, Faculty of Bioengineering and Bioinformatics, 119991 Moscow, Russia
Received February 3, 2020
Revised March 2, 2020
Accepted March 2, 2020
Comprehensive usage of classical molecular dynamics, constant pH molecular dynamics simulations, metadynamics
as well as combined quantum mechanical and molecular mechanical approach has revealed an alternative pathway at
the formation of glycosyl enzyme intermediate in the conversion of oligosaccharide substrates catalyzed by the H5N1
influenza neuraminidase. The Asp151 residue, located on a mobile loop, plays a key role in the mechanism of the pro
ton transfer from the water molecule to the leaving group of the substrate during the formation of the covalent inter
mediate glycosyl enzyme compound. Since the growth and replication of influenza virus in birds takes place under
the conditions of the digestive system at low pH values, and in humans under conditions close to neutral, the imple
mentation of alternative pathways for the reaction at different acidities of the medium can mediate the double tropism
of the virus and the circulation of specific strains of the H5N1 virus, prone to transmission from birds to humans.
Keywords: influenza, neuraminidase, glycosyl enzyme
БИОХИМИЯ том 85 вып. 4 2020